ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к частицам носителя в форме гранул для применения в сухой порошковой композиции для ингаляции и способам их получения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Лекарственную терапию посредством ингаляции сухого порошка (DPI) используют в течение многих лет для лечения заболеваний дыхательной системы, таких как астма, хронические обструктивные болезни легких (ХОБЛ), и также системных заболеваний.
При сравнении с пероральным приемом лекарственного средства только относительно небольшие дозы необходимы для эффективной терапии, поскольку пресистемный метаболизм пропускается и/или существенно уменьшается.
Такие небольшие дозы уменьшают воздействие на организм лекарственного средства и минимизируют побочные эффекты. Системные побочные эффекты также уменьшаются, поскольку местная доставка в легкое доставляет лекарственное средство непосредственно в место действия. Более низкие дозировки также могут обеспечивать существенную экономию затрат, особенно когда рассматриваются дорогие терапевтические средства.
Для эффективной доставки в легкие требуется, чтобы частицы лекарственного средства имели размер частиц в диапазоне нескольких микрометров, обычно 1–5 микрон.
Сухие порошковые композиции обычно рецептируют посредством смешивания лекарственного средства с пустыми частицами носителя, давая упорядоченную смесь, где микронизированные активные частицы прилипают к поверхности частиц носителя, находясь в ингаляционном устройстве.
Носитель делает микронизированный порошок менее липким и улучшает его текучесть, облегчая обработку порошка во время процесса производства (внесение, заполнение и др.). Более того, носитель действует как наполнитель, когда терапевтическая доза лекарственного средства находится в диапазоне микрограмм.
Во время ингаляции частицы лекарственного средства отделяются от поверхности частиц носителя и проникают в нижние отделы легкого, тогда как более крупные частицы носителя главным образом остаются в ротоглотке.
Открепление частиц лекарственного средства от поверхности носителя расценивается как наиболее критический фактор, который управляет доступностью лекарственного препарата для легких. Оно зависит от механической стабильности порошковой смеси и пути, посредством которого на это влияют характеристики адгезии между лекарственным средством и носителем, и внешних сил, требуемых для разрушения нековалентных связей, образующихся между прилипшими частицами. Слишком сильные связи между прилипшими частицами могут действительно предотвращать разделение микронизированных частиц лекарственного средства и поверхности частиц носителя.
Различные подходы, направленные на модуляцию адгезии, были предложены в области техники для обеспечения высвобождения частиц лекарственного средства и, следовательно, увеличения вдыхаемой фракции. В области техники для удовлетворения указанной цели добавление мелких частиц вспомогательного средства и/или мелких добавок со смазывающим средством или антисклеивающими свойствами (далее вместе мелкие частицы) были предложены как решение технической проблемы. Обычно указанные мелкие частицы имеют размер менее чем 50 микрон.
С другой стороны, так как мелкие частицы имеют плохие свойства текучести, текучесть важных порошковых композиций имеет тенденцию ухудшаться при увеличении содержания мелких частиц.
В предшествующей области техники в качестве решения указанной технической проблемы было предложено использовать крупнодисперсные частицы носителя, имеющие поверхность с трещинами, способную удерживать относительно большое количество мелких частиц. Например, в EP 1276472 описаны частицы носителя, имеющие щели, по меньшей мере, 5 микрон шириной и по меньшей мере 5 микрон глубиной, предпочтительно по меньшей мере 20 микрон шириной и по меньшей мере 20 микрон глубиной. Хотя согласно последним сообщениям, предлагая специальные преимущества активных агентов для введения в относительно больших дозах, указанная технология становится применимой для активных ингредиентов для введения в разовых дозах до 400 микрограмм на выдох ингалятора.
Гранулированные частицы носителя для композиций DPI также описаны в области техники, например, в WO 03/086358, Du Ping et al., AAPS PharmSciTech 2014, 15(6), 1417–1428, и Kawashima Y et al.. Int J Pharm 1998, 172, 179–188.
С другой стороны ингаляционный путь является все более и более используемым для активных ингредиентов, таких как антибиотики, для введения в более высоких разовых дозах, например, равных или выше чем 1 мг на вдох.
Это становится сложной проблемой, так как известно, что чем выше доза и, следовательно, концентрация активного ингредиента, тем выше риск образования нежелательных агломератов (т.е. микронизированные частицы лекарственного средства держатся вместе посредством сильных когезивных сил), которые препятствуют возможности достижения хорошей однородности распределения лекарственного средства в порошковой смеси и, следовательно, удовлетворительной точности дозы, а также подходящей дезагрегации при ингаляции пациентом. Более того, чем выше доза и, следовательно, концентрация активного ингредиента, тем выше количество мелких частиц, требуемое для получения удовлетворительной вдыхаемой фракции.
Массивное присутствие микронизированных и мелких частиц оказывает неблагоприятный эффект на текучесть важной композиции, которая в свою очередь влияет на способность устройства доставлять точную дозу при активации ингалятора.
Следовательно, будет предпочтительно обеспечивать частицы носителя, способные содержать более высокие количества микронизированных лекарственных средств и/или мелких частиц, чем частиц носителя в предшествующей области техники, не влияя на свойства текучести важных порошковых композиций.
Проблема решается частицами носителя по настоящему изобретению и способом их получения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к гранулам, состоящим из физиологически приемлемого вспомогательного вещества для использования в качестве носителя для композиций сухого порошка для ингаляции, указанные гранулы имеют массовый диаметр в диапазоне от 200 до 800 микрон и характеризуются порами на поверхности с периметром от 70 до 300 микрон и диаметром от 30 до 100 микрон.
Во втором аспекте изобретение относится к способу получения вышеуказанных гранул, указанный способ включает следующие стадии:
i) выбор частиц физиологически приемлемого вспомогательного вещества, имеющих начальный средний объемный диаметр по меньшей мере 100 микрон;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i), где его концентрация в воде составляет от 30 до 50% масс/об;
iii) увлажнение оставшихся частиц стадии i) 10–25% масс/масс водного раствора стадии ii);
iv) перемешивание для получения суспензии;
v) пропускание указанной суспензии через соответствующее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
В третьем аспекте изобретение относится к вышеуказанным гранулам, полученным способом, включающим стадии:
i) выбор частиц физиологически приемлемого вспомогательного вещества, имеющего начальный средний объемный диаметр менее чем 100 микрон;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i), где его концентрация в воде составляет от 30 и 50% масс/об;
iii) увлажнение оставшихся частиц стадии i) 10–25% масс/масс водного раствора стадии ii);
iv) перемешивание для получения суспензии;
v) пропускание указанной суспензии через соответствующее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
В четвертом аспекте, изобретение относится к вышеуказанным гранулам, полученным способом, включающим стадии:
i) выбор частиц физиологически приемлемого вспомогательного вещества, имеющего начальный средний объемный диаметр менее чем 100 микрон;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i), где его концентрация в воде составляет от 30 и 50% масс/об;
iii) увлажнение оставшихся частиц стадии i) 10–25% масс/масс водного раствора стадии ii);
iv) перемешивание для получения суспензии;
v) пропускание указанной суспензии через соответствующее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
В пятом аспекте изобретение относится к фармацевтической композиции в форме сухого порошка для ингаляции, включающего гранулы по изобретению и один или более активных ингредиентов.
В шестом аспекте изобретение относится к ингалятору сухого порошка, заполненному вышеупомянутым сухим порошком фармацевтической композиции.
В седьмом аспекте изобретение относится к способу получения вышеупомянутой фармацевтической композиции, включающему стадию смешивания частиц носителя по изобретению с одним или более активными ингредиентами.
В дополнительном аспекте изобретение также относится к упаковке, включающей сухую порошковую фармацевтическую композицию по изобретению и ингалятор сухого порошка.
Настоящее изобретение относится к гранулам, состоящим из физиологически приемлемого вспомогательного вещества, для использования в качестве носителя для сухой порошковой композиции для ингаляции, указанные гранулы имеют массовый диаметр в диапазоне от 200 до 800 микрон и характеризуются в ирм числе средним коэффициентом шероховатости 0,6–1,0, общим объемом введения 0,7–1,0 см3/г, и коэффициентом вместимости, равным или выше чем 35%.
ОПРЕДЕЛЕНИЯ
Если не указано иначе, термины “активное лекарственное средство”, ‘активный ингредиент’, ‘активный’ и ‘активное вещество’, ‘активное соединение’ и ‘терапевтическое средство’ используются как синонимы.
Термин “микрон” используется как синоним “микрометр”.
В общих терминах размер частиц оценивают количественно посредством измерения характерного эквивалентного сферического диаметра, известного как объемный диаметр, посредством лазерной дифракции.
Размер частиц также может быть количественно оценен посредством измерения массового диаметра при помощи подходящих инструментов и методик, известных специалисту в области техники, таких как просеивание.
Объемный диаметр (VD) связан с массовым диаметром (MD) по плотности частиц (предполагая, что размер не зависит от плотности частиц).
В настоящей заявке интервал размера частиц носителя по изобретению выражается в отношении массового диаметра. В частности, распределение размера частиц выражают в отношении: i) массового среднего диаметра (MMD), который соответствует диаметру 50 процентов по массе частиц, например, d(0,5), и ii) массовому диаметру (MD) в микронах 10% и 90% частиц, соответственно, например, d(0,1) и d(0,9).
Альтернативно, размер частиц может быть выражен в отношении объемного диаметра. В частности, распределение размера частиц выражают в отношении: i) объемного среднего диаметра (VMD) который соответствует диаметру 50 процентов по массе частиц, например, d(v0,5), и ii) объемного диаметра (VD) в микрон 10% и 90% частиц, соответственно, например, d(v0,1) и d(v0,9).
Под термином “мелкие частицы” обозначают частицы, имеющие средний объемный диаметр менее чем 45 микрон, предпочтительно менее чем 15 микрон, состоящие из физиологически приемлемого вспомогательного вещества и/или состоящие из добавки со смазывающим веществом или антиадгезивными свойствами или их смеси.
Термин ‘коэффициент вместимости’ относится к способности крупнодисперсного носителя нести в порах на поверхности определенное количество мелких частиц.
Термин ‘хорошие свойства текучести’ относится к композиции, которую легко обрабатывать во время процесса производства и которая способна обеспечивать точную и воспроизводимую доставку терапевтически эффективной дозы.
Характеристики текучести могут быть оценены посредством измерения индекса Карра; индекс Карра менее чем 25 обычно принимают как характеризующий хорошую текучесть.
Указанные свойства текучести также могут быть оценены в соответствии с методикой, указанной в примере 6.
Термином ‘хрупкость’ обозначают индекс прочности гранул во время процесса смешивания с частицами лекарственного средства. Его определяют в соответствии с методиками, известными специалисту в области техники. Для легкой обработки гранулы должны иметь хрупкость менее чем 3%, предпочтительно 0%.
Термин "индекс шероховатости", используемый в настоящем описании, относится к теоретическому объему оболочек частиц, который рассчитывается из оболочки частиц, к точному объему частиц, таким образом, исключая трещины в оболочке.
Термин “коэффициент шероховатости” используют для обозначения соотношения периметра очертания частиц к периметру «выпуклой оболочки». Такое измерение используют для выражения отсутствия гладкости в очертании частиц. 'Выпуклую оболочку' определяют как минимальную окружающую границу на оболочке частиц, которая нигде не имеет впадин. (See Hawkins, A. E., Wiley, Taunton, Somerset, "The Shape of Powder–Particle Outlines", England: Research Studies Press, 1993).
Выражение ‘хорошая гомогенность’ относится к композиции, где при перемешивании однородность содержимого активного ингредиента, выражаемая как относительное стандартное отклонение (RSD), меньше чем 5%.
Выражение ‘физически стабильная в устройстве до применения’ относится к композиции, где активные частицы по существу не отщепляются и/или открепляются от поверхности частиц носителя и во время производства сухого порошка и в устройства доставки до применения.
Тенденция к отщеплению может быть оценена в соответствии с Staniforth et al. J. Pharm. Pharmacol. 34,700–706, 1982, и расценивается приемлемой, если распределение активного ингредиента в порошковой композиции после теста, выражаемое как относительное стандартное отклонение (RSD), достоверно не изменяется в отношении такового композиции до теста.
Выражение ‘вдыхаемая фракция’ относится к индексу процента частиц активного ингредиента, которые достигают глубоких отделов легкого пациента. Вдыхаемую фракцию, также называемую как фракция мелких частиц (FPF), обычно оценивают с использованием подходящего прибора in vitro, обычно Multistage Cascade Impactor или Multi Stage Liquid Impinger (MLSI), Fast Screening Impactor (FSI), в соответствии с методиками, указанными в обычной Фармакопее. Ее рассчитывают по соотношению между вдыхаемой дозой и доставляемой (испускаемой) дозой.
Доставляемую дозу рассчитывают из кумулятивного отложения лекарственного средства в деталях прибора, тогда как вдыхаемую дозу (дозу мелких частиц) рассчитывают из отложения на стадиях, соответствующих частицам, имеющим диаметр <5,0 микрон. Специалист в области техники должен регулировать другие параметры, такие как сила вдоха, в соответствии с руководствами, указанными в обычной Фармакопее.
Вдыхаемая фракция выше, чем 30% представляет собой индекс хороших ингаляционных свойств.
Термин ‘терапевтическое количество’ обозначает количество активного ингредиента, которое при доставке в легкие посредством композиции сухого порошка, как описано в настоящем описании, обеспечивает желаемый биологический эффект.
‘Разовая доза’ обозначает количество активного ингредиента, вводимое за один раз посредством ингаляции при активации ингалятора.
Под активацией обозначают высвобождение активного ингредиента из устройства посредством разовой активации (например, механической или дыхательной).
‘Высокая разовая доза’ обозначает дозу, равную или большую чем 1 мг.
Термином ‘перенасыщенный раствор’ обозначают раствор, где физиологически приемлемое вспомогательное вещество растворяют при температуре выше, чем комнатная температура, получая концентрацию более высокую, чем насыщенная концентрация при комнатной температуре.
Например, насыщенная концентрация моногидрата альфа–лактозы при комнатной температуре в воде составляет около 18–19% масс/об, тогда как насыщенная концентрация маннита при комнатной температуре в воде составляет около 18–21% масс/об. Когда оба раствора нагревают при 50°C, достигают концентрации около 40–43% масс/об.
ЧЕРТЕЖИ
Фиг. 1 – SEM изображения гранул лактозы, начиная с Lactohale100 при 200X (верх) и 5000X (низ), полученные с 15% почти насыщенным водным раствором лактозы, просеянным через 425 мкм.
Фиг. 2 – SEM изображения гранул лактозы, начиная с 200X (слева) и 5000X (справа), полученных с 15% почти насыщенного водного раствора, просеянного через 425 мкм.
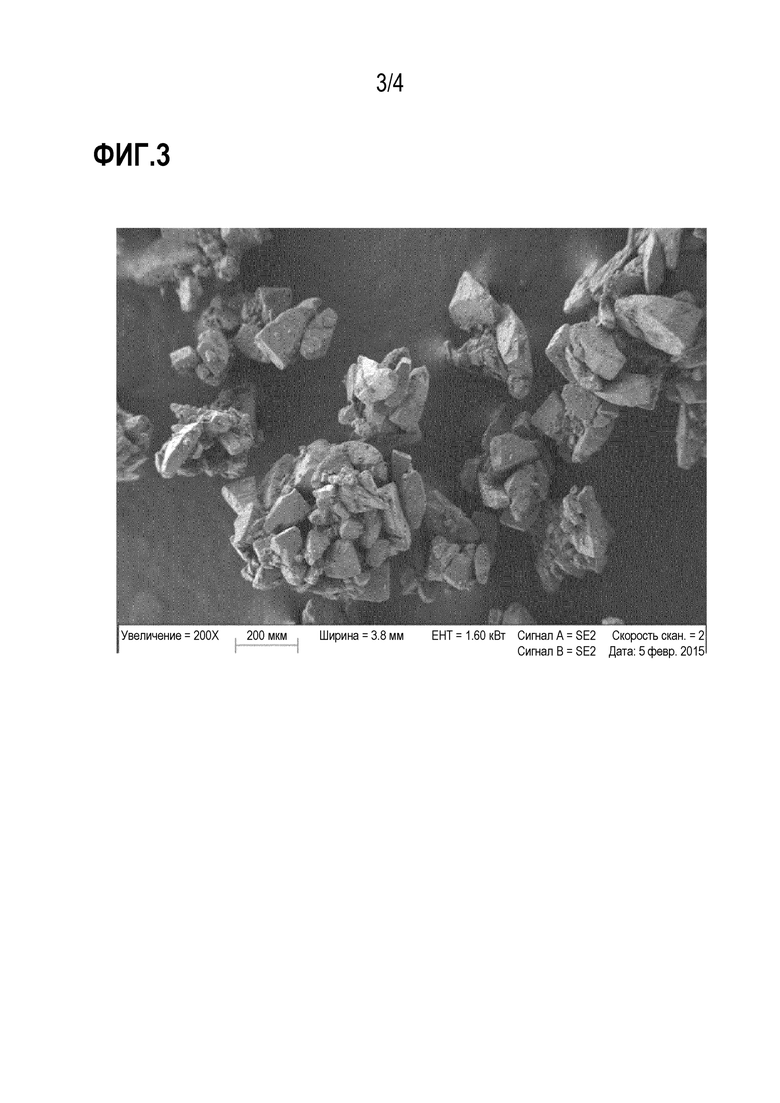
Фиг. 3 – SEM изображения гранул Lactohale LH100 425 мкм; увеличения для определения пор 200, 400, и 500 X.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к гранулам, состоящим из физиологически приемлемого вспомогательного вещества для использования в качестве носителя для сухой порошковой композиции для ингаляции, характеризуемой как имеющая на поверхности поры с периметром от 70 до 300 микрон, предпочтительно от 100 до 200 микрон, и диаметром от 30 до 100 микрон.
Преимущественно поры могут быть 40–80 микрон глубиной. Предпочтительно периметр пор составляет около 100–220 микрон и их диаметр составляет от 40 до 80 микрон.
Периметр, диаметр и глубина пор могут быть определены в соответствии с методикой, описанной в примере 2.
Физиологически приемлемое вспомогательное вещество может быть выбрано из группы, состоящей из лактозы, маннита, трегалозы, декстрана и глюкозы.
Преимущественно, гранулы могут состоять из альфалактозы или ее сольвата или бета–лактозы.
В другом варианте осуществления изобретения гранулы могут состоять из маннита.
Предпочтительно, гранулы состоят из моногидрата альфалактозы.
Все гранулы имеют размер частиц, выражаемый как массовый диаметр, в диапазоне от 200 до 800 микрон, предпочтительно от 300–600 микрон, более предпочтительно 400–500 микрон.
Когда выражают в виде объемного диаметра, распределение размера частиц должно удовлетворять следующим параметрам: d(v,0,1) состоящим от 210 до 250 микрон, d(v,0,5) составляет от 400 до 600 микрон и d(v,0,9) составляет от 700 и 750 микрон.
Ряд других методов также может быть использован для определения характеристик гранул по изобретению, например, насыпная плотность, пористость, коэффициент трещин, коэффициент шероховатости и специфическая площадь поверхности.
Насыпная плотность гранул по изобретению может быть измерена в соответствии с Европейской Фармакопеей Ed. 7.0, 2.9.34. Обычно, когда они состоят из моногидрата альфа–лактозы, она составляет не более чем 0,6 г/мл, предпочтительно не более чем 0,55 г/мл, более предпочтительно составляет от 0,4 до 0,55 г/мл.
Иным образом она может быть измерена, как указано далее: измерительный цилиндр взвешивают на лабораторных весах (2 места). Приблизительно 50 г порошка вносят в измерительный цилиндр, и массу записывают. Измерительный цилиндр, содержащий порошок, прикрепляют к встряхивающему объемометру (Jel Stampfvolumeter). Встряхивающий объемометр устанавливают для встряхивания 200 раз. Во время каждого встряхивания измерительный цилиндр поднимают и позволяют падать на установленное расстояние. После 200 встряхиваний объем порошка измеряют. Встряхивание повторяют и новый объем измеряют. Встряхивание продолжают до того, как порошок перестанет усаживаться. Насыпную плотность рассчитывают как массу порошка, поделенную на конечный насыпной объем. Процедуру проводят три раза (каждый раз с новым порошком) для каждого измеренного порошка, и среднюю насыпную плотность рассчитывают из каждого из трех окончательных значений насыпного объема.
Пористость обычно измеряют оценкой пористости путем внедрения ртути.
Обычно параметрами, используемыми для измерения, являются следующие: размер ячейки составляет 1,0 x 3,0 см, диапазон давления составляет 0,5–33000 фунтов на кв дюйм, диапазон размера пор составляет от 0,0064 до 950 мкм, угол контакта ртути составляет 140 градусов, и поверхностное натяжение ртути составляет 0,48 Н/м (480 дин/см). Например, с использованием системы PoreMaster 33 (Quantchrome Instruments, FL, USA). Образцы должны быть вакуумированы до ниже 5 Па до анализа для удаления воздуха и свободного связывания поверхности воды.
Преимущественно, гранулы по изобретению характеризуются общим объемом внедрения, измеренным посредством оценки пористости путем внесения ртути от 0,7 до 1,0 см3/г, предпочтительно от 0,8 до 0,95 см3/г.
Индекс трещин обычно рассчитывают из соотношения теоретического огибающего объема частиц, который рассчитывается из оболочки частиц, к актуальному объему частиц, то есть за исключением щелей в оболочке. Теоретический объем оболочки может быть определен оптически, например, посредством исследования небольшого образца частиц с использованием электронного микроскопа. Теоретический объем оболочки частиц может быть оценен посредством следующего метода. Электронная микрофотография образца может быть поделена на ряд квадратов сетки приблизительно равных популяций, каждый содержащий характерный образец частиц. Популяции одной или более ячеек могут затем быть исследованы, и оболочку, включающую каждую из частиц, определяют визуально, как указано далее. Диаметр Фере для частиц в ячейке измеряют относительно фиксированной оси изображения. Обычно по меньшей мере десять частиц измеряют по их диаметру Фере. Диаметр Фере определяют как длину проекции частиц вдоль заданной контрольной линии, как расстояние между крайними левой и правой касательными, которые перпендикулярны референсной линии. Получают средний диаметр Фере. Теоретический средний объем оболочки затем может быть рассчитан из среднего диаметра для получения характерного объема для всех квадратов сетки и, следовательно, всего образца. Деление этого значения на количество частиц дает среднее значение на частицу. Точный объем частиц затем может быть рассчитан как указано далее. Сначала, рассчитывают среднюю массу частиц. Получают образец приблизительно 50 мг и его точную массу записывают до 0,1 мг. Затем посредством оптической микроскопии определяют точное количество частиц в образце. Средняя масса одной частицы затем может быть определена. Методику затем повторяют пять раз для получения среднего значения. Во–вторых, фиксированную массу частиц (обычно 50 г) точно взвешивают и количество частиц в этой массе рассчитывают с использованием вышеуказанного среднего массового значения одной частицы. Наконец, образец частиц погружают в жидкость, в которой частицы являются нерастворимыми и, после перемешивания для удаления воздушных пузырьков, количество замещенной жидкости измеряют. Из этого может быть рассчитан средний точный объем одной частицы.
Средний коэффициент шероховатости может быть рассчитан оптически, как указано далее. Образец частиц может быть идентифицирован по электронной микрофотографии или по оптической микрофотографии, как определено выше. Для каждой частицы периметр оболочки частицы и ассоциированный периметр 'выпуклой оболочки' измеряют для получения коэффициента шероховатости. Это может быть повторено для по меньшей мере десяти частиц для получения среднего значения.
Преимущественно средний коэффициент шероховатости гранул по изобретению составляет от 0,6 до 1,0, предпочтительно от 0,7 до 0,9.
Из вышеуказанного определения коэффициент удлинения также может быть определен в соответствии с Mikli et al. (V. Mikli, H. Kaerdi, P. Kulu, M. Besterci Proc. Estonian Acad. Sci. Eng. 7 (2001) 22–24) or Hryciw et al. (R.D. Hryciw, M. Asce, J. Zheng, S.M. Asce, K. Shetler, S.M. Asce Journal of Geotechnical and Geoenvironmental Engineering 142 (2016) 04016038).
Преимущественно, индекс удлинения гранул по изобретению составляет от 0,3 до 1,0, предпочтительно от 0,35 до 0,9.
Специфическая площадь поверхности может быть определена посредством метода абсорбции азота Brunauer–Emmett–Teller (BET) в соответствии с известной методикой.
Специфическая площадь поверхности гранул по изобретению, состоящих из моногидрата лактозы, составляет от 0,13 до 0,20 м2/г, предпочтительно от 0,14 до 0,16 м2/г.
Каждая гранула имеет характерную форму розы или розетки и представлена в форме агломерата, состоящего из множества кристаллов, сшитых друг с другом, в которой кристаллы в агломерате сшиты друг твердыми мостиками.
Вышеуказанные гранулы по существу не имеют тенденции к разложению при обработке и/или хранении порошка в ингаляционном устройстве. Их хрупкость действительно меньше 3%, предпочтительно меньше 2%, более предпочтительно меньше 0%, как определяют.
Хрупкость гранул может быть определена с использованием теста модифицированной хрупкости для таблеток (Ph. Eur. 8.0 2.9.7). Тест на хрупкость может быть проведен посредством замены стандартного барабана измерителя хрупкости, описанного в Фармакопее, цилиндрическим баком, имеющим объем 100 мл, вращающимся вокруг его основных осей. Около 20 грамм аккуратно взвешивают и загружают в бак; затем прибор работает при 100 об/мин в течение 4 минут. После этого сито с номинальными отверстиями 180 микрон взвешивают (исходная масса) и гранулы просеивают через него; массу сита после этой процедуры записывают (конечный объем). Количество порошка, остающегося на сите, выраженное в граммах, определяют как разницу между конечной и исходной массой.
Ломкость % рассчитывают как:
Однако, в противоположность тому, что сообщалось для частиц носителя, описанных в EP 1276472, при определенном давлении тока воздуха гранулы по изобретению имели тенденцию к разрушению при выталкивании из ингалятора. Без связи с теорией это расценивается как преимущество, так как частицы активного ингредиента могут высвобождаться из носителя быстрее и, следовательно, способны проявлять терапевтический эффект более эффективно.
Указанные оптимальные характеристики прочности являются результатом процесса, используемого для получения гранул.
Следовательно, в соответствии с другим аспектом изобретение относится к способу, включающему следующие стадии:
i) выбор частиц физиологически приемлемого вспомогательного вещества, имеющих подходящий исходный средний объемный диаметр;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i) где его концентрация в воде составляет от 30 до 50% масс/об;
iii) увлажнение оставшихся частиц стадии i) с помощью 10–25% масс/масс водного раствора стадии ii);
iv) перемешивание для получения суспензии;
v) пропускание указанной суспензии через соответствующее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
Преимущественно, частицы исходного материала стадии i) имеют средний объемный диаметр по меньшей мере 100 микрон, предпочтительно он составляет от 120 микрон до 300 микрон, более предпочтительно от 150 до 250 микрон.
В предпочтительном варианте осуществления изобретения все частицы имеют объемный диаметр, составляющий от 30 до 400 микрон, более предпочтительно с d(v,10) 45–65 микрон и d(v,90) 300–350 микрон.
В определенном варианте осуществления изобретения указанный начальный порошок может необязательно включать подходящее количество мелких частиц того же физиологически приемлемого вспомогательного вещества.
В альтернативном варианте осуществления изобретения подходящее количество мелких частиц того же физиологически приемлемого вспомогательного вещества может быть добавлено к полученным гранулам стадии vi).
На стадии ii) получают перенасыщенный водный раствор того же физиологически приемлемого вспомогательного вещества, используемого в качестве носителя, предпочтительно моногидрата альфа–лактозы или маннита, более предпочтительно моногидрата альфа–лактозы.
Например, посредством нагревания до 50°C, может быть достигнута концентрация моногидрата лактозы в воде 35% масс/об.
Водный раствор стадии ii) должен быть добавлен в количестве 10–25% масс/масс в отношении количества вышеуказанных частиц, предпочтительно варьируясь от 13 до 22% масс/масс.
Было обнаружено, что, если гранулирование проводят с использованием перенасыщенного раствора физиологически приемлемого вспомогательного вещества, как определено в настоящем описании, полученные гранулы проявляют улучшенные свойства в отношении хрупкости, позволяя облегчить обработку при смешивании в обычных смесителях.
На стадии iv) исходные частицы и водный раствор стадии iii) перемешивают до получения суспензии, влажной массы, с позиции гомогенности.
Обычно перемешивание проводят в подходящем приборе, таком как мельница, в течение 10–15 минут.
Однако специалист в области техники может выбрать другой прибор и условия обработки в соответствии с его знаниями.
Преимущественно, влажную массу, полученную на стадии iv), на стадии v) пропускают через сито, имеющее размер ячеек 212–600 микрон, предпочтительно 425 микрон.
На стадии vi) влажные гранулы затем сушат в соответствии с методиками, известными специалисту в области техники. Предпочтительно гранулы сушат или в микроволновой печи или в печи под вакуумом. Если используется микроволновая печь, обычно влажные гранулы сушат при 200–650 Вт, предпочтительно при 600 Вт в течение 2–10 минут, предпочтительно в течение 3–8 минут, предпочтительно в течение 4–6 минут.
Альтернативно, если используются печи с вакуумом, обычно влажные гранулы сушат при 40–80°C, предпочтительно при 50–70°C, более предпочтительно при 60°C, при давлении от 300 до 100 мбар, предпочтительно при 200 мбар в течение 15–60 минут, предпочтительно в течение 25–45 минут.
Гранулы по изобретению демонстрируют свойства хорошей текучести, так как они имеют индекс Карра менее чем значение 25, который обычно принимают как определяющее значение для свободно текучих порошков.
В определенном варианте осуществления изобретения, подходящее количество мелких частиц того же или отличного физиологически приемлемого вспомогательного вещества может быть добавлено.
Действительно было обнаружено, что гранулы по изобретению из–за их поверхностных характеристик способны удерживать относительно большое количество мелких частиц, по существу без расщепления и таким образом поддерживая свойства хорошей текучести даже в присутствии количества мелких частиц, равного или выше чем 35%, и количества микронизированного активного ингредиента, равного или более чем 10%.
Гранулы по изобретению действительно продемонстрировали нагрузочную способность существенно более высокую, чем носители предшествующей области техники, и преимущественно равную или более чем 35% массы мелких частиц к массе носителя. Нагрузочная способность для заданного носителя может быть оценена в соответствии со способом, описанном в примере 10. Специалист в области техники может заменить используемые материалы другими подходящими.
Следовательно, соответствующие фармацевтические композиции в форме сухих порошков являются физически стабильными.
Фармацевтические композиции, включающие гранулы по изобретению, необязательно в присутствии мелких частиц, также демонстрируют хорошую гомогенность активных ингредиентов для доставки в высоких дозах, например, в 1 мг на вдох из ингалятора, а также хороших аэрозольных свойствах.
Следовательно, изобретение относится к фармацевтической композиции в форме сухого порошка для ингаляции, включающей гранулы носители по изобретению и один или более активных ингредиентов.
Активным ингредиентом может быть практически любое фармацевтически активное соединение, которое можно вводить посредством ингаляций в сухом порошке.
Чтобы активные вещества были ингалируемыми, т.е. они могли проходить в глубокие отделы легких, такие как терминальные и респираторные бронхиолы и альвеолярные протоки и мешочки, они должны находиться в форме частиц, имеющих средний диаметр (измеренный как средний массовый диаметр) по меньшей мере около 10 микрон, например, от 1 до 10 микрон, и предпочтительно от 1 до 6 микрон. Такие микронизированные частицы могут быть получены способом, известным как таковой, например, посредством микронизации, контролируемого осаждения из выбранных растворителей, распылительной сушкой, из суперкритических жидкостей, или в соответствии со способом, описанным в WO 2004/073827, WO 2008/155570, WO 2008/114052 и WO 2010/007447.
Терапевтическое количество активного вещества может варьироваться в широких пределах, в зависимости от природы активного вещества, типа и тяжести состояния, которое лечат, и состояния пациента, нуждающегося в лечении.
Обычно, частицы активного вещества добавляют к частицам носителя по изобретению посредством смешивания. Частицы могут быть смешаны с использованием кантующего смесителя, например, смесителя TurbulaTM, в соответствии с известными методиками.
В частности, скорость вращения смесителя и время перемешивания могут регулироваться специалистом для получения хорошей однородности распределения активного ингредиента в композиции.
Превосходную однородность распределения активного ингредиента достигают, когда указанный активный ингредиент имеет распределение размера частиц, где не более чем 10% частиц имеют объемный диаметр [d(v,0,1)] меньше чем 0,6 микрон, предпочтительно меньше чем 0,8 микрон, и не более чем 50% частиц имеют объемный диаметр [d(v,0,5)], составляющий от 1,6 и 2,5 микрон.
В качестве примера, они могут быть выбраны из короткодействующих и длительнодействующих бета2–агонистов, таких как тербуталин, репротерол, сальбутамол, сальметерол, формотерол, кармотерол, милветерол, индакатерол, олодатерол, фенотерол, кленбутерол, бамбутерол, броксатерол, эпинефрин, изопреналин или гексопреналин или их соли и/или сольваты; короткодействующих и длительнодействующих антихолинергических средств, таких как тиотропий, ипратропий, окситропий, оксибутинин, аклидинин, троспий, гликопиррон, или соединений, известные под кодами GSK 573719 и GSK 1160274, в форме их солей и/или сольватов; бифункциональных мускариновых антагонистов – бета2 агонистов (MABA) соединения для ингаляции, такие как GSK 961081; короткодействующих и длительнодействующих кортикостероидов, таких как бутиксокарт, рофлепонид, флунезолид, будесонид, циклезонид, мометазон и их эфиры, т.е. фуроат, флутиказон и его эфиры, например, пропионат и фуроат, беклометазон и его эфиры, например, пропионат, лотепреднол или триамцинолона ацетонид и их сольваты; антагонистов лейкотриена, таких как андоласт, иралукаст, пранлукаст, имиродаст, сератродаст, зилейтон, зафирлукаст или монтелукаст; ингибиторов фосфодиэстеразы, таких как филаминаст, пикламинаст или рофлумиласт; PAF–ингибиторов, таких как апафант, рорапафант или израпафант; обезболивающих, таких как морфин, фентанил, пентазоцин, бупренорфин, петидин, тилидин или метадон; средств для потенции, таких как силденафил, алпростадил или фентоламин; или фармацевтически приемлемых производных или соли любого из вышеуказанных соединений или классов соединений. Поскольку многие из этих соединений содержат хиральные центры, соединения могут быть использованы в оптически чистой форме, или могут быть представлены в виде диастереомерных смесей или рацемических смесей.
Композиции сухих порошков также могут включать белки, пептиды, олигопептиды, полипептиды, полиаминокислоты, нуклеиновые кислоты, полинуклеотиды, олигонуклеотиды и высокомолекулярные полисахариды.
В определенном варианте осуществления изобретения композиции сухого порошка, включающие гранулы по изобретению, являются применимыми для введения активных ингредиентов для доставки в разовой дозе на активацию ингалятора 1 мг или больше, т.е. 2 мг, 5 мг или более.
Примерами являются антибиотики, такие как ципрофлоксацин, левофлоксацин и колистин, тобрамицин, амикацин и гентамицин; белки, такие как инсулин и α1–антитрипсин; противовирусные лекарственные средства, такие как занамивир и рибавирин; противогрибковые средства, такие как итраконазол, и ингибиторы фосфодиэстеразы (PDE)–5 такие как силденафил и тадалафил.
Концентрации активного ингредиента в порошковой композиции будут зависеть от массы выдоха композиции, доставляемого при нажатии на ингалятор.
Например, предполагая ожидаемую разовую дозу 1 мг, если масса выхода композиции, доставляемой при нажатии на ингалятор, составляет 10 мг, это соответствует концентрации активного ингредиента 10% масс/масс. Аналогично, для массы выдоха 5 мг концентрация активного ингредиента составит 20% масс/об., тогда как для выдоха массой 20 мг, концентрация активного ингредиента составит 5%.
В предпочтительном варианте осуществления изобретения композиции сухого порошка, включающие гранулы по изобретению, являются особенно применимыми для введения активных ингредиентов для доставки в разовых дозах на нажатие ингалятора от 1 мг до 40 мг.
В определенном варианте осуществления изобретения, порошковая композиция дополнительно включает фракцию мелких частиц, имеющих средний объемный диаметр меньше чем 15 микрон, предпочтительно меньше, чем 10 микрон, в количестве, большем чем 10%, предпочтительно выше чем 30%, более предпочтительно выше, чем 50% на основании массы композиции.
Указанные мелкие частицы могут состоять из физиологически приемлемого вспомогательного вещества, как определено выше, и/или могут быть сделаны из дополнительного материала, выбираемого из класса противоклейких веществ, таких как аминокислоты, например, лейцин и изолейцин, или из класса смазывающих веществ, таких как стеарат магния; стеарилфумарат натрия, стеариловый спирт, стеариновая кислота и монопальмитат сахарозы.
В определенном варианте осуществления изобретения мелкие частицы состоят из физиологически приемлемого вспомогательного вещества и частиц добавки в любом соотношении, и их получают в соответствии с указаниями WO 01/78695.
В еще более предпочтительном варианте осуществления изобретения мелкие частицы состоят из смеси от 90 до 99,5 процентов по массе частиц моногидрата альфа–лактозы и от 0,5 дo 10 процентов по массе стеарата магния, где по меньшей мере 90% указанных частиц имеют объемный диаметр менее чем 12 микрон, и средний объемный диаметр указанных частиц составляет от 4 до 6 микрон.
Указанные мелкие частицы могут быть добавлены к композиции и смешаны в соответствии с известными способами.
Композиции сухого порошка для ингаляции, включающие гранулы носителя по изобретению, могут быть использованы с любым ингалятором сухого порошка.
Ингаляторы сухого порошка могут главным образом поделены на: i) однодозовые (стандартной дозы) ингаляторы, для введения отдельных поделенных доз активного соединения; ii) предварительно отмеренные многодозовые ингаляторы или резервуарные ингаляторы, предварительно загруженные количеством активного вещества, достаточным для более длинных циклов лечения.
Композиции сухого порошка могут быть представлены в стандартной лекарственной форме. Композиции сухого порошка для местного введения в легкие посредством ингаляции могут, например, быть представлены в капсулах или картриджах из, например, желатина, или блистерах из, например, ламинированной алюминиевой фольги, для применения в ингаляторе или инсуффляторе.
Композиция сухого порошка для ингаляции по изобретению является особенно подходящей для многодозовых ингаляторов сухого порошка, включающих резервуар, из которого индивидуальные терапевтические дозы могут быть получены по запросу активации устройства.
Предпочтительным многодозовым устройством является ингалятор, описанный в WO 2004/012801, в частности со страницы 1 первая строчка до страницы 39, последняя строчка.
Другие многодозовые устройства, которые могут быть использованы, представляют собой, например, ELLIPTATM или DISKUSTM от GlaxoSmithKline, TURBOHALERTM от AstraZeneca, TWISTHALERTM от Schering и CLICKHALERTM от Innovata.
В качестве имеющихся на рынке однодозовых устройств могут быть упомянуты ROTOHALERTM от GlaxoSmithKline и HANDIHALERTM от Boehringer Ingelheim.
Следующие примеры иллюстрируют изобретение подробно.
ПРИМЕРЫ
Пример 1 – Материалы
Лактозные порошки моногидрата альфа–лактозы использовали в качестве исходных материалов: Lactohale–LH100 и Respitose ML006 получали от DFE Pharma GmbH (Germany) тогда как Capsulac 60 получали от Meggle Group Wasserburg GmbH (Germany), затем просеивали для получения фракции с массовым диаметром 212–355 микрон.
В таблице 1 представлено распределение размеров частиц указанных материалов в соответствии с производителем.
Таблица 1
Дипропионат беклометазона (BDP) поставляли Farmabios SpA (Italy).
Стеарат магния (MgSt) поставляли Peter Greven GmbH (Germany).
В качестве мелких частиц моногидрат альфа–лактозы Lactohale LH300 (dv50 <5 мкм) покупали у DFE Pharma (Germany).
Смесь, состоящую из 98% масс/масс мелких частиц моногидрата лактозы и 2% масс/масс MgSt, получали в соответствии со способом, описанным в WO 01/78693 (далее Предварительная смесь).
Пример 2 – Микроволновое получение гранул лактозы с использованием почти насыщенного раствора лактозы в качестве вяжущего вещества
Поскольку хрупкость образцов, полученных с водным раствором в качестве вяжущего вещества, была во всех случаях слишком высокой, воду заменяли раствором лактозы в качестве вяжущего вещества.
Получение лактозы осуществляли посредством смешивания порошка лактозы с 15% (масс/масс) почти насыщенного раствора лактозы в качестве вяжущего вещества вместо воды. Почти насыщенный раствор лактозы получали посредством растворения при перемешивании при 50°C, 3,5 г лактозы в 10 мл ультрачистой воды (резистивность=1–10 MΏcm, проводимость=1–0,1 мкS/см). После этого получали суспензию и гранулировали посредством пропускания влажной массы через или 212 мкм или 425 мкм сито. Полученные гранулы сушили в микроволновой печи при 600 Вт в течение 5 минут.
Указанную процедуру проводили с двумя типами лактозы в качестве исходного материала для получения гранул: Respitose ML006 имеющая размер частиц меньше, чем 125 мкм (dv50 17,0 мкм), и Lactohale LH100 (dv50 125–145 мкм).
Испытание на хрупкость проводили на образцах, пропускаемых через 425 мкм и 212 мкм, которые имели хрупкость 0% и 33% соответственно. Исход испытания на хрупкость показал, что почти насыщенный раствор лактозы, используемый в качестве вяжущего вещества, увеличивал прочность гранул. Указанное поведение было обусловлено тем фактом, что лактоза в растворе создает мостики между частицами лактозы во время сушки, таким образом увеличивая твердость гранул.
Морфологию носителя лактозы также исследовали посредством сканирующей электронной микроскопии (SEM).
Ее оценивали посредством использования SEM SUPRA 40 (Carl Zeiss, Germany). Каждый образец порошка (10 мг) помещали на проводящий держатель образца, предварительно покрытый двухсторонней проводящей углеродной лентой так, чтобы позволить распределение заряда. Избыток частиц удаляли посредством мягкого тока азота.
Образцы анализировали в условиях высокого вакуума 10–6 мбар и изображения получали с тем же увеличением 200x увеличения с использованием ускоряющего напряжения 1,0 кВ.
На фиг. 1 и 2 показаны SEM изображения гранул, пропускаемых через 425 мкм, начиная с Lactohale LH100 и Respitose ML006, соответственно.
Может быть отмечено, что агрегаты лактозы Lactohale LH100 демонстрировали большие промежутки между частицами из–за большего размера частиц исходного материала (dv50=125 мкм) по сравнению с гранулами Respitose, которые демонстрировали более компактную структуру с более узкими и менее глубокими пространствами между частицами.
Морфологический анализ также проводили с целью оценки пористости материала, т.е. размера пор, которые образовывались между частицами лактозы в процессе производства. Целостность гранул также проверяли. Сообщают, что одним из факторов, который определяет адгезию лекарственного средства к носителю, является наличие “пор” и полости на поверхности лактозы. В частности, “активные сайты” могут быть расценены как области на поверхности лактозы, которые имеют высокий адгезивный потенциал; частицы лекарственного средства, прилипшие к таким областям, следовательно, труднее удаляются во время стадии аэролизации. Более того, сила адгезии увеличивается в присутствии неправильной поверхности носителя (наличие углублений и трещин) или из–за большей площади поверхности, которая увеличивает точки контакта с частицами лекарственного средства.
Периметр и диаметр Фере отверстий рассчитывали из SEM изображений с использованием открытого программного обеспечения для обработки и анализа исходного изображения IMAGE–J® (National Institute of Health, USA, загруженного на https://imagej.nih.gov/ij/).
Шкалу измерений устанавливали посредством трансформации количества пикселей, составляющих линию известной длины в мкм с использованием команд меню analyse, set scale; более того команду global в set scale выбирали так, чтобы определяемая шкала использовалась для всех рисунков, анализируемых в той же рабочей сессии. С целью получения надежного результата, анализировали 110 изображений и три углубления для каждого изображения оценивали с использованием инструмента freehand selection, которое позволяет выбирать периметр отверстий. Затем периметр и диаметр Фере (определяемый посредством руководства для пользователя Image–J как “Самое длинное расстояние между любыми двумя точками по выбранной границе, также известный как максимальный калибр”) получали посредством анализа команд меню analyse, measurement. Периметр и диаметр Фере предварительно устанавливали с использованием команды меню analyse, set measurement.
Средние значения периметра и диаметра Фере пор составили 146,6 ± 66,4 мкм и 52,0 ± 23,8 мкм, соответственно.
Более углубленный статистический анализ морфологии частиц проводили с использованием оптической микроскопии (Nikon AZ 100M) в комбинации со средствами анализа изображения (NIS–Elements AR оборудование от Nikon) большой популяции тысяч частиц носителя. Отклонение формы частиц от идеального круга описано посредством “коэффициента элонгации”, его рассчитывали как отношение минимального к максимальному диаметру Фере. Для оценки минимального и максимального диаметра Фере программное обеспечение вращает ось проекции от 0 до 180 градусов с шагом 10 градусов. Распределение “коэффициента элонгации” центрировано на диапазонах около 0,55 с 0,35 до 0,9. Размер частиц характеризовали посредством эквивалентного диаметра, т.е. диаметра круга, имеющего ту же площадь каждой частицы носителя. Такое значение центрировано на около 650 мкм и распространялось на интервал 270–900 мкм.
Пример 3 – Получение в вакуумной печи гранул лактозы с использованием почти насыщенного раствора лактозы в качестве вяжущего средства
Сырой материал моногидрата альфа–лактозы увлажняли 15% масс/масс почти насыщенного раствора лактозы. Взвесь гранулировали, пропуская через 425 мкм сито, и затем гранулы сушили в печи (Gallenkamp, Fistreem International LTD, UK) в течение 30 минут при 60°C с вакуумом остаточного давления 200 мбар. Затем образцы взвешивали с целью оценки потери массы, следовательно, сушку повторяли в течение 5 минут, чтобы оценить отсутствие дальнейшей потери массы.
Пример 4 – Микроволновое получение гранул лактозы по изобретению+мелкие частицы лактозы
Добавление части мелких частиц лактозы к гранулам носителя по изобретению исследовали с целью улучшения вдыхаемости лекарственного средства.
Часть мелкой лактозы <45 мкм добавляли при 10% масс/масс, 30% масс/масс и 50/% масс/масс непосредственно к высушенным гранулам LH100 (размер 425 мкм) после чего получали суспензию, как описано в примере 2.
Альтернативно, добавляли часть 10% масс/масс предварительной смеси, как определено выше.
Пример 5 – Смеси с высокими дозами лекарственного средства
И двойные и тройные смеси BDP (объем партии 5 г), содержащие 10% лекарственного средства, получали в соответствии с 4 стадийной методикой:
– просеивание 0,5 г BDP c половиной носителя; BDP/носитель аккуратно пропускали через сито 600 мкм. После этого добавляли оставшуюся часть носителя;
– перемешивание в смесителе Turbula® в течение 30 мин при 32 об/мин;
– повторное просеивание через 600 мкм;
– смешивание с Turbula® в течение еще 15 мин.
В случае третичной смеси носитель составляли из смеси крупнодисперсной и мелкой лактозы, полученной посредством предварительного смешивания их в Turbula® в течение 2 часов при 32 об/мин.
Гомогенность полученных смесей проверяли в конце процедуры смешивания. Для каждой композиции пять образцов (20 мг каждый) собирали из различных точек зарядной камеры. Каждый образец растворяли в 50 мл соответствующего растворителя (воды в случае сульфата сальбутамола, этанол/вода 60:40 об/об раствор в случае BDP) и проводили количественную оценку лекарственного средства. Гомогенность принимали как коэффициент вариации (рассчитанный как процент соотношения стандартного отклонения и среднего значения пяти измерений) менее чем 5%.
Во всех двойных и тройных смесях количество лекарственного средства было достаточно гомогенным и относительное стандартное отклонение было ниже чем 5%.
Пример 6 – Текучесть порошка и специфическая площадь поверхности гранул по изобретению
Текучесть порошка оценивали с использованием порошкового реометра FT4 (Freeman Technology, UK). В этом исследовании текучесть порошка оценивали с использованием порошкового реометра в динамическом режиме. В динамическом режиме, лопасть с диаметром 23,5 мм пропускали через 25 мл образцы в сосуде из боросиликатного стекла диаметром 25 мм со скоростью концов лопастей 100 мм/с и углом наклона –5°. Энергию (мДж), требуемую для движения лопастей через порошок во время перехода вниз, а именно от верха к дну сосуда, определяли как базовую энергию текучести (BFE). Более того, измеряли специфическую энергию (SE), которая является энергией (мДж) на грамм, установленной при движении вверх,; в таком случае порошок не ограничивали (порошок может подниматься) и так измеренная энергия была более зависимой от когезивных и механических взаимоблокирующих сил между частицами и меньше подвергалась влиянию других факторов, таких как прессуемость, которые могут быть очень значимыми в тесте BFE.
Все образцы до измерения предварительно кондиционировали с использованием процесса ‘кондиционирования’ прибора. ‘Кондиционирующее’ действие лопастей аккуратно нарушает ложе порошка и создает однородный и немного прессованный тестовый образец с целью удаления любого предварительного прессования и избытка воздуха из образца.
Реологические свойства полученных гранул исследовали с помощью прибора FT4. Текучесть сырого материала Lactohale LH100 определяли с целью сравнения.
В таблице 2 указаны основная энергия текучести (мДж) и специфическая энергия (мДж) образцов порошка. Интересно, можно наблюдать заметную разницу между сырым материалом и обработанным материалом. BFE обработанных образцов была существенно ниже, чем таковая сырого материала, демонстрируя лучшие свойства текучести по сравнению с сырым материалом. Причина такого поведения может быть легко объяснена большим размером частиц носителя, предполагая, что частицы с меньшим размером являются более липкими и, следовательно, требуют больше энергии для текучести. Хорошие результаты были получены и с гранулами LH100 425 мкм и с гранулами LH 100 425 мкм+30% “мелких” частиц, добавленных к исходному материалу перед стадией гранулирования. Даже более низкие значения BFE получали с последними гранулами.
Полученные данные согласуются и подтверждают данные, значимые для прочности гранул, определяемой с помощью теста на диспергируемость: в таком случае носитель оставался интактным после воздействия, осуществляемого лопастью порошкового реометра, показывая, что он не подвергался феномену сегрегации, который оказывает вредоносный эффект на BFE.
Специфическая энергия главным образом связана со сцеплением частиц, так в общем SE меньше, чем 5 демонстрирует низкое сцепление частиц, SE от 5 до 10 демонстрирует умеренное сцепление и SE выше, чем 10 указывает на более высокое сцепление частиц. Полученные значения SE представлены в таблице 2. Может быть отмечено, что все гранулы демонстрировали SE меньше чем 5, тогда как значение, относящееся к сырому материалу, было немного выше, чем 5. Указанные данные демонстрируют более низкое сцепление частиц обработанных материалов, также в таком случае обусловленные размером частиц указанных носителей, и дополнительно подтверждают ранее описанные результаты BFE.
Таблица 2
Специфическую площадь поверхности (SSA) оценивали с целью понимания, может ли добавление “мелких частиц” заполнять пространства, присутствующие в гранулах лактозы.
Специфическую площадь поверхности носителей оценивали с использованием Micromeritics Tristar II 3020 (Norcross, USA). Все образцы сушили в вакууме в течение двух дней при 25°C с использованием дегазирующего отдела Micromeritics VacPrep 061 (Norcross, USA). Измерения проводили с использованием изотерм адсорбции и десорбции азота при температуре жидкого N2 (–196°C); Brunauer, Emmett, and Teller (BET) (Emmett, 1936), теорию адсорбции использовали для расчета специфической площади поверхности с использованием диапазона давления 0,05–0,30, нормализованного до насыщенного давления адсорбата.
1,5 г порошка использовали, получая факторы корреляции BET выше 0,999, показывая применимость метода. Каждое измерение проводили в трех экземплярах.
Анализ специфической площади под кривой (SSA) проводили для гранул LH100 425 мкм, гранулах LH100 425 мкм+10% 45 мкм “мелких” частиц, и LH100 425 мкм гранул+30% 45 мкм “мелких” частиц.
Результаты представлены в таблице 3.
Как ожидали, увеличение процента “мелких частиц” увеличивало специфическую площадь под кривой носителя.
Таблица 3
<45 мкм (м2/г)
<45 мкм (м2/г)
Пример 7 – Аэродинамическая оценка in Vitro
Аэродинамическую оценку in vitro проводили с использованием Fast Screening Impactor (FSI, Copley Scientific, UK). В этом оборудовании используются две стадии сегрегации: Coarse Particle Mass (CFC) собирает частицы с аэродинамическим диаметром более, чем 5 мкм, и Fine Particle Mass (FPM) собирает частицы с аэродинамическим диаметром менее чем 5 мкм. FSI состоит из индукционного порта (IP), коллектора крупнодисперсной фракции (CFC), заполненного 10 мл метанол–вода 60:40 об/об, который действует как сепаратор для неингалируемых частиц, и посредством коллектора мелкой фракции (FFC), снабженного фильтром из стеклянного волокна (Type A/E, Pall Corporation, USA).
После завершения сборки FSI соединяли с вакуумным насосом VP 1000 (Erweka, Germany) и скорость тока через импактор измеряли масс–флуорометром (модель 3063, TSI, USA).
Средней резистентности однодозовый DPI, RS01® (Plastiape S.P.A., Italy) выбирали в качестве аэрозольного устройства. Для каждой смеси три капсулы Quali–V–I® размера 3 (Qualicaps®, Spain) заполняли 10,0±0,1 мг порошка, вносили в ингаляционное устройство и, наконец, пробивали. При соединении устройства с импактором через герметичный резиновый загубник, вакуумный насос активировали со скоростью 60 л/мин в течение 4 секунд, так что 4 л воздуха проходило через прибор в соответствии с Ph. Eur. 8.0, 2.9.18.
Три последовательных распыления проводили для каждой композиции. В конце эксперимента отложения FSI разбирали и две различные методики адаптировали в зависимости от API при исследовании.
BDP, отложившиеся на каждом этапе импактора, восстанавливали аликвотами воды, которые в конечном счете переносили в волюметрические колбы адекватного объема и доводили до объема водой. Полученные растворы перед анализом фильтровали через шприцевой фильтр из ацетата целлюлозы (пористость 0,45 мкм и диаметр 2,5 см, GVS Filter Technology, USA). Волюметрическую колбу использовали для сбора сульфата сальбутамола, оставшегося в устройстве RS01® и в капсулах, которые растворяли в воде в конце эксперимента с целью обеспечения полного восстановления активного ингредиента. Следовательно, в таком случае, исходно записанную адсорбцию корректировали посредством вычитания вклада поглощения капсулами Quali– V–I®. BDP получали с каждого этапа импактора с помощью соответствующих объемов раствора метанола/воды 6:4 об./об. До переноса во флаконы растворы фильтровали через регенерированный целлюлозный шприцевой фильтр (пористость мкм, диаметр 2,5 см, Analytical Technology, Italy).
Оценивали ВЭЖХ.
Все смеси тестировали в трех экземплярах непосредственно после получения. Их вид оценивали посредством расчета:
– отгруженной дозы (ED), полученной как сумма частей лекарственного средства, восстановленных из индукционного порта, CFC столика и FFC столика, выраженная в мкг, и его процент в отношении номинальной дозы;
– массы мелких частиц (FPM), а именно количества лекарственного средства с критическим диаметром менее чем 5 мкм, рассчитанного посредством интерполяции в соответствии с European Pharmacopoeia (Ph. Eur. 8.0, 2.9.18.) и выраженного в мкг;
– фракции мелких частиц (FPF), рассчитанной как соотношение FPM к ED, выраженное как процент.
Результаты видов аэрозолей представлены в таблице 4.
Таблица 4
Как может быть понятно, хорошие свойства аэрозоля получали для всех препаратов с FPF достоверно выше чем 35%.
Пример 8 – Сравнительный пример – Микроволновое получение лактозных гранул с использованием воды в качестве вяжущего раствора
Lactohale LH100 увлажняли различным количеством воды с целью получения суспензии.
Образцы взвеси получали посредством смешивания следующего количества лактозы и воды с помощью мельницы:
2 г ди LH100+5% масс/масс H2O;
2 г ди LH100+10% масс/масс H2O;
2 г ди LH100+15% масс/масс H2O;
2 г ди LH100+20% масс/масс H2O.
Все взвеси помещали в кристаллизатор 50 мл емкости и затем сушили в микроволновой печи (MicroFAST–Microwave–Vacuum Moisture Analyzer, Milestone, USA) при 250 Ватт в течение 5 минут.
При первом подходе лактозу Lactohale LH100 увлажняли увеличивающимся количеством воды, используемой в качестве вяжущего вещества. Целью было оценить количество воды для получения суспензии, не растворяя лактозу, во избежание образования аморфного материала в процессе сушки. После получения образцов размерный анализ с помощью сит проводили для оценки размера частиц носителя с целью вычисления наиболее подходящего количества воды для применения в процессе.
Однако, порошок лактозы, полученный с 5% воды, дал то же распределение размеров частиц сырого материала, тогда как добавление воды более чем 5% масс/масс приводило к образованию крепких и больших агрегатов.
Пример 9 – Сравнительный пример – Дизайн эксперимента (DoE) – подход для получения гранул лактозы
Дизайн экспериментального метода (DoE) использовали для ускорения плана исследования с целью определения значимых факторов, влияющих на процесс и свойства продукта. Оптимизация основана на трех факторах обработки, а именно проценте воды, микроволновой энергии (W) и времени сушки (мин). С условием, что три входящих переменных на двух уровнях рассматривали для выбранного материала, фракционированный факториальный 2–уровневый DoE адаптировали с использованием программного обеспечения UNSCREMBLER® X 10.3 (Camo software, Norway) для исследования. 2–уровневый дизайн, включающий 3 параметра плюс две центральных точки, потребовал 23+2=10 экспериментов для каждого исследуемого материала. Для изучения, как процесс влияет на вид материала, указанные экспериментальные исследования фокусировали на трех исходах:
1) процент потери воды во время сушки в микроволновой печи;
2) выход способа (% порошка с размером >180 мкм, что определяли просеиванием, и
3) хрупкость, определяемая с использованием модифицированного теста на хрупкость для таблеток, указанного в Ph. Eur. 8.0 2.9.7. Здесь тест на хрупкость проводили посредством замены стандартного цилиндра измерителя хрупкости пластиковым контейнером, имеющим объем 100 мл, вращающимся при 100 об/мин в течение 4 минут после загрузки в аппарат общего количества порошка, полученного в результате просеивания через сито 180 мкм.
В таблицах 5 и 6 проиллюстрированы результаты фракционированного факториального дизайна с центральной точкой, проводимой на Respitose ML006 и Lactohale LH100, соответственно.
Таблица 5
2 Порошок был слишком влажным для пропускания через сито 180 мкм.
Таблица 6
<180мкм
Конечные результаты для Respitose ML006 и Lactohale LH100 показали очень высокую хрупкость за исключением образца#3 для Lactohale LH100, который показал значение около 7%.
Пример 10 – Определение нагрузочной емкости
Нагрузочная емкость для гранул по изобретению может быть оценена посредством смешивания их с увеличивающимися концентрациями мелких частиц лактозы (Lacto–Sphere MM3 от Micro–Sphere Sa, Switzerland) с диаметром менее чем 10 микрон, просеивания смесей и измерения их углов откоса. С целью сравнения использовали крупнодисперсный носитель, имеющий диаметр 212–355 микрон, как указано в WO 01/78693.
Смешивающие операции проводили в барабанным смесителе с низким усилием сдвига (Turbula T2F, WAB, Switzerland) в 250 мл резервуаре, содержащим 50 г смеси порошка. Процесс смешивания намеренно делали длительным и аккуратным, давая мелким частицам достаточно времени, чтобы встретиться с участками свободной поверхности носителя и расположиться на них, скорость смешивания устанавливали на 23 оборотах в минуту в течение времени 6 часов. Когда, при увеличении концентрации мелких частиц лактозы, нагрузочная способность носителя насыщалась, в смеси появлялись агрегаты. Просеиванием смеси после смешивания через соответствующие размеры сит, агрегаты мелкой лактозы и свободных частиц могут быть отделены от смеси: агрегаты остаются на более крупном сите, свободные частицы проходят через второе сито, тогда как смесь остается на втором сите.
Из–за различий размера частиц сита, используемые для разделения несвязанных частиц, для носителя предшествующей области техники имеют ячейки от 180 до 400 мкм, тогда как для гранул по настоящему изобретению использовали от 180 до 710 мкм. Так как несвязанные частицы составляют до 20–25% масс/масс для носителя предшествующей области техники и до 35–40% масс/масс для гранул по изобретению, авторы могут заключить, что последние имеют большую нагрузочную способность, рассчитанную как равную или выше чем 15% w/w.



Настоящее изобретение относится к частицам носителя в форме гранул, подходящих для применения в композициях сухого порошка для ингаляции, и предпочтительно включающих высокую дозу активных ингредиентов. Изобретение также относится к способам для их получения. Описаны гранулы, состоящие из моногидрата альфа–лактозы, для использования в качестве носителя для композиций сухого порошка для ингаляций, при этом указанные гранулы имеют массовый диаметр от 200 до 800 микрометров и характеризуются как имеющие на поверхности поры с периметром от 70 до 300 микрометров, диаметром от 30 до 100 микрометров, глубиной 40-80 микрометров, с удельной площадью поверхности от 0,13 до 0,20 м2/г, при этом указанные гранулы имеют хрупкость менее 3%. Технический результат - обеспечить частицы носителя, способные содержать более высокие количества микронизированных лекарственных средств и/или мелких частиц, не влияя на свойства текучести важных порошковых композиций. 5 н. и 8 з.п. ф-лы, 6 табл., 10 пр., 3 ил.
1. Гранулы, состоящие из моногидрата альфа–лактозы, для использования в качестве носителя для композиций сухого порошка для ингаляций, при этом указанные гранулы имеют массовый диаметр от 200 до 800 микрометров и характеризуются как имеющие на поверхности поры с периметром от 70 до 300 микрометров, диаметром от 30 до 100 микрометров, глубиной 40-80 микрометров, с удельной площадью поверхности от 0,13 до 0,20 м2/г, при этом указанные гранулы имеют хрупкость менее 3%.
2. Гранулы по п. 1, которые находятся в форме агломерата, состоящего из множества кристаллов, сшитых друг с другом.
3. Гранулы по п. 1 или 2, где массовый диаметр составляет от 300 до 600 микрометров.
4. Гранулы по любому из пп. 1–3, где массовый диаметр составляет от 400 до 500 микрометров.
5. Гранулы по любому из предшествующих пунктов, где периметр пор составляет 100–220 микрометров, и их диаметр составляет от 30 до 80 микрометров.
6. Гранулы по любому из пп. 1–5, получаемые способом, включающим стадии:
i) выбор частиц моногидрата альфа–лактозы в качестве физиологически приемлемого вспомогательного вещества, имеющих начальный средний объемный диаметр по меньшей мере 100 микрометров;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i), где его концентрация в воде составляет от 30 до 50% масс/об;
iii) увлажнение оставшейся части физиологически приемлемого вспомогательного вещества стадии i) с помощью 13–22% масс/масс водного раствора стадии ii) для получения смеси;
iv) перемешивание указанной смеси для получения суспензии;
v) пропускание указанной суспензии через подходящее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
7. Гранулы по п. 1, характеризующиеся в том числе средним коэффициентом шероховатости 0,6–1,0 и общим объемом введения 0,7–1,0 см3/г.
8. Способ получения гранул по любому из пп. 1–5, включающий следующие стадии:
i) выбор частиц моногидрата альфа–лактозы в качестве физиологически приемлемого вспомогательного вещества, имеющих начальный средний объемный диаметр по меньшей мере 100 микрометров;
ii) получение перенасыщенного водного раствора, включающего часть физиологически приемлемого вспомогательного вещества стадии i), где его концентрация в воде составляет от 30 до 50% масс/об;
iii) увлажнение оставшейся части физиологически приемлемого вспомогательного вещества стадии i) с помощью 13–22% масс/масс водного раствора стадии ii) для получения смеси;
iv) перемешивание указанной смеси для получения суспензии;
v) пропускание указанной суспензии через подходящее сито для получения влажной массы; и
vi) сушка влажной массы для получения гранул.
9. Способ по п. 8, где стадию vi) проводят в микроволновой печи или в печи в вакууме.
10. Фармацевтическая композиция для лечения заболеваний дыхательной системы в форме сухого порошка для ингаляций, включающая гранулы по любому из пп. 1–5 в качестве носителя и один или более активных ингредиентов, подходящих для ингаляций и для лечения заболеваний дыхательной системы.
11. Фармацевтическая композиция по п. 10, где активные ингредиенты доставляются в дозе при активации ингалятора, равной или выше 1 мг.
12. Ингалятор сухого порошка, заполненный порошком фармацевтической композиции по п. 10 или 11.
13. Упаковка, включающая фармацевтическую композицию по п. 10 или 11 и ингалятор сухого порошка.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Ping Du, Ju Du, Hugh D.C | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| СИСТЕМА ПОДАЧИ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ИНГАЛЯТОРА ДЛЯ СУХОГО ПОРОШКА | 1996 |
|
RU2162717C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЦ С ПОНИЖЕННЫМ ЭЛЕКТРОСТАТИЧЕСКИМ ЗАРЯДОМ | 2011 |
|
RU2580312C2 |
| Плавкий предохранитель | 1930 |
|
SU24922A1 |
| Ping Du, Ju Du, Hugh D.C | |||
| Smyth Evaluation of Granulated Lactose as a Carrier | |||
Авторы
Даты
2021-03-18—Публикация
2018-05-16—Подача