Изобретение относится к биотехнологии, а именно генной инженерии. Предложен способ получения рекомбинантного капсидного белка вируса гепатита Е. Капсидный белок получают методом автоиндуцируемой экспрессии в клетках E. coli для получения белка, сохраняющего свои антигенные свойства и способность к самосборке в вирусоподобные частицы. Для получения бактериальных штаммов-продуцентов модифицированного капсидного белка ВГЕ использована стратегия создания искусственного гена этого белка, оптимизированного для экспрессии и сворачивания (фолдинга) в клетках E. coli. Способ позволяет получить иммуногенный антиген вируса гепатита Е, обладающий свойствами природного белка.
Вирус гепатита Е относится к семейству Hepeviridae рода Hepevirus. Частицы вируса представляют собой сферические образования диаметром 27-34 нм, построенные из идентичных структурных элементов, и лишенные наружной оболочки. Вирусные частицы реагируют с антителами сыворотки инфицированных индивидуумов из географически различных регионов, что говорит о повсеместной распространенности HEV. Серологически и молекулярно-генетически HEV отличается от других вирусов гепатита. Последовательность генома HEV впервые была определена в 1991 г. (Tam A.W. et al., 1991 Virology, 185, 120-131). Геном вируса гепатита Е представлен одноцепочечной РНК позитивной полярности. Анализ последовательности генома показал, что его размер 7.2 kb, и он содержит 3 открытые рамки считывания (ORF), каждая из которых кодирует синтез определенного белка или группы белков. ORF1 кодирует неструктурные белки вируса, ответственные за репликацию вируса, ORF2 кодирует структурный белок капсида вируса (ORF2-белок), ORF3 кодирует вспомогательный белок, функция которого еще не определена. С помощью картирования установлено, что линейные антигенные эпитопы локализованы в полипептидах, кодируемых ORF2 и ORF3 (Khydyakov Y.E. et al., Virology 1993, 194, 89-96). Рекомбинантный белок ORF2 способен к самосборке в вирусоподобные частицы (VLP), подобные по антигенным свойствам капсидному белку инфекционного вируса.
Филогенетический анализ, базирующийся на полной длине последовательности генома некоторых изолятов HEV, указывает на существование 4 различных генотипов, каждый из которых доминирует в определенной географической области. Генотип 1 включает штаммы из Азии и Африки, генотип 2 - мексиканский штамм и несколько вариантов из Африки, генотипы 3 и 4 включают HEV штаммы человека и свиньи из индустриальных стран и Азии. Генотипы 1 и 2 обнаружены только у человека, тогда как генотипы 3 и 4 у человека, а также свиней и других животных. Генотип 3 распространен повсеместно, генотип 4 чаще встречается в Китае и Японии. Открытие вирусов, подобных HEV, у свиней (свиной HEV) и кур (птичий HEV) предполагает, что вирус относится к зоонозу. Несмотря на существование различных генотипов, идентифицирован один серотип HEV. Все субтипы вируса имеют основные перекрестно реагирующие эпитопы, позволяющие создать рекомбинантную вакцину, основанную на капсидном белке, эффективную против многих штаммов HEV.
При проведении патентно-информационного поиска были выявлены следующие источники патентной информации:
Международная заявка WO 2001/46696, приоритет 21.12.1999, заявитель ABBOTT LABORATORIES, США. Документ описывает способы и композиции для обнаружения присутствия в образце US-типа или US-подтипа вируса гепатита Е, включая встречающиеся в природе варианты. В частности, настоящее изобретение относится к последовательности нуклеиновой кислоты, соответствующие геному US-типа или US-подтипа вируса гепатита Е, аминокислотных последовательностей, в том числе эпитопа последовательностей, кодируемого геном таких вирусов, и антител, которые специфически связываются с такими аминокислотными последовательности. Недостатком для данного технического решения является специфичность белковой последовательности, характерная только для США, и небольшая растворимость полученного белка в водной среде.
В научной и патентной литературе представлены примеры использования для получения рекомбинантных белков HEV бактериальной системы экспрессии на основе E. coli. Так, известно получение рекомбинантного химерного белка trpE-С2, содержащего 439 С-концевых аминокислот ORF2-белка HEV генотипа 1, слитого с N-концевой областью триптофансинтетазы, в бактериальной системе экспрессии в E. coli (Kamili S., Virus Research 2011, 161(1): 93-100). Экспрессируемый в E. coli белок обладает высокой иммунореактивностью и содержит перекрестно реактивные эпитопы, узнаваемые антителами к HEV.
Описано получение иммунореактивного полипептида рЕ2, происходящего из карбокситерминального района белка, кодируемого ORF2 генома китайского штамма D11092. Этот полипептид, благодаря присутствию конформационной антигенной детерминанты, способен из мономеров образовывать активные гомодимеры (US 7,204,989, 17.04.2007). Полипептид рЕ2 экспрессировали в клетках E. coli с использованием вектора pGEX. При клонировании в этом векторе последовательность, кодирующая рЕ2, была соединена в рамке с геном глютатион-S-трансферазы (GST). В результате был получен гибридный ген, кодирующий полипептид, на N-концевой части которого находилась GST, а на С-концевой - рЕ2. Такой составной белок, полученный в результате экспрессии гибридного гена в клетках E. coli, был растворим и мог быть выделен из лизата клеток путем связывания с глютатион-агарозой. Полипептид рЕ2 отделяли от GST при помощи специфической протеазы.
Патент РФ №2501568, приоритет 27.04.2012, правообладатель Закрытое акционерное общество научно-производственная компания "Комбиотех", Россия. Документ описывает рекомбинантную вакцину для профилактики вирусного гепатита Е у животных. Изобретение относится к биотехнологии, а именно генной инженерии. Предложена рекомбинантная вакцина для профилактики вирусного гепатита Е у животных. Вакцина включает капсидный белок (rtHEV-ORF2), полученный путем культивирования рекомбинантного штамма дрожжей Hansenula polymorpha КБТ-11/pHEV-001, содержащего интегрированную в геном клетки дрожжей последовательность ДНК, кодирующую фрагмент аминокислотной последовательности с 86 по 607 позицию капсидного белка вируса гепатита Е генотипа 3 (rtHEV-ORF2) под контролем промотора гена МОХ. Вакцина содержит эффективное количество rtHEV-ORF2 белка, масляный адъювант и физиологически приемлемый разбавитель.
Недостатком для данного технического решения является низкая растворимость белка в водных средах и необходимость культивирования клеток дрожжей.
Aye, Т.Т., Uchida, Т., Ma, X.Z., Iida, F., Shikata, Т., Zhuang, Н., & Win, K.М. (1992). Complete nucleotide sequence of a hepatitis E virus isolated from the Xinjiang epidemic (1986-1988) of China. Nucleic Acids Research, Volume 20, N 13, P. 3512.
Данная статья описывает полную нуклеотидную последовательность генома вируса гепатита Е, циркулирующего на территории Китая. Геном содержит 7194 пар нуклеотидов. Степень идентичности с известным ранее описанным штаммом составляет от 97,5% до 100%.
Fry KE, Tam AW, Smith MM, Kim JP, Luk KC, Young LM, Piatak M, Feldman RA, Yun KY, Purdy MA, et al. Hepatitis E virus (HEV): strain variation in the nonstructural gene region encoding consensus motifs for an RNA-dependent RNA polymerase and an ATP/GTP binding site. Virus Genes. 1992 Apr; 6(2): 173-85. PubMed PMID: 1589964.
Статья описывает исследование молекулярного клона полной последовательности cDNA вируса гепатита Е путем перевода основных открытых рамок считывания (ORF-1) из этих клонов. Молекулярные клоны, полученные из двух других географически различных изолятов ВГЕ, продемонстрировали неоднородность неструктурных генов в этой области. Схожесть известной аминокислотной последовательности и предмета поиска составляет 95%. Растворимость известного белка в водных средах незначительна.
Перспективным направлением развития технологии является конструирование аминокислотной последовательности, обладающей высокой растворимостью в водных средах, и которая может быть использована для формирования вакцины против вируса гепатита Е.
Прямая экспрессия эукариотической последовательности ORF2 ВГЕ приводит к образованию нерастворимых агрегатов, что требует денатурации и последующей частичной ренатурации белка в ходе выделения и очистки, а значит неизбежного снижения выхода конечного продукта и возможности неполной ренатурации белка. Для оптимизации гетерологичной экспрессии капсидного белка ОРС2 был использован уникальный подход к реконструкции генов. Этот алгоритм оптимизации принимает во внимание важность редких кодонов и их включения в соответствующие места оптимизированного гена для обеспечения правильного ритма трансляции, а, следовательно, правильного сворачивания образующегося полипептида. Использование подобного подхода приводит к высокому выходу правильно свернутых растворимых белков, экспрессируемых в гетерологичной системе.
Задачей изобретения является осуществление способа получения капсидного белка вируса гепатита Е повсеместно распространенных на территории РФ генотипов, обладающего иммуногенными свойствами природного белка.
Последовательность эукариотического гена ORF2, полученная секвенированием распространенного в регионе Российской Федерации штамма ВГЕ: вместо начальных 110 кодонов гена в последовательности была закодирована олигогистидиновая метка для выделения и очистки белка (His-10). Синтетический ген длиной 1719 пар нуклеотидов кодирует белок с молекулярным весом 60.9 кД. Ген собирался из 47 олигонуклеотидов длиной от 38 до 42 нуклеотидов каждый (Invitrogen Inc), после ПЦР клонировался в плазмидный вектор pUC57 по сайту BamHI.
Пять микрограмм плазмидной ДНК содержащей синтетический ген правильной последовательности затем использовалось для перенесения NdeI-BamHI фрагмента в экспрессионный вектор рЕТ3а под контроль гибридного промотора и регуляторных последовательностей Т7 РНК полимеразы, клонировались в штамме Е. coli DH5a. Полученная экспрессионная плазмида снова анализировалась рестрикционным анализом и трансформировалась в экспрессионный штамм BL21 (DE3). Этот штамм позволяет получить высокий уровень экспрессии гетерологичных белков после индукции РНК полимеразы Т7.
Поставленная задача решается благодаря тому, что в способе получения капсидного белка вируса гепатита Е клонированный фрагмент длиной 1719 bp включает ген ORF2, представляющий вторую рамку считывания генома HEV. Вместо начальных 110 кодонов гена в последовательности была закодирована олигогистидиновая метка для выделения и очистки белка (His-10).
Сущность предложенного способа заключается в следующем:
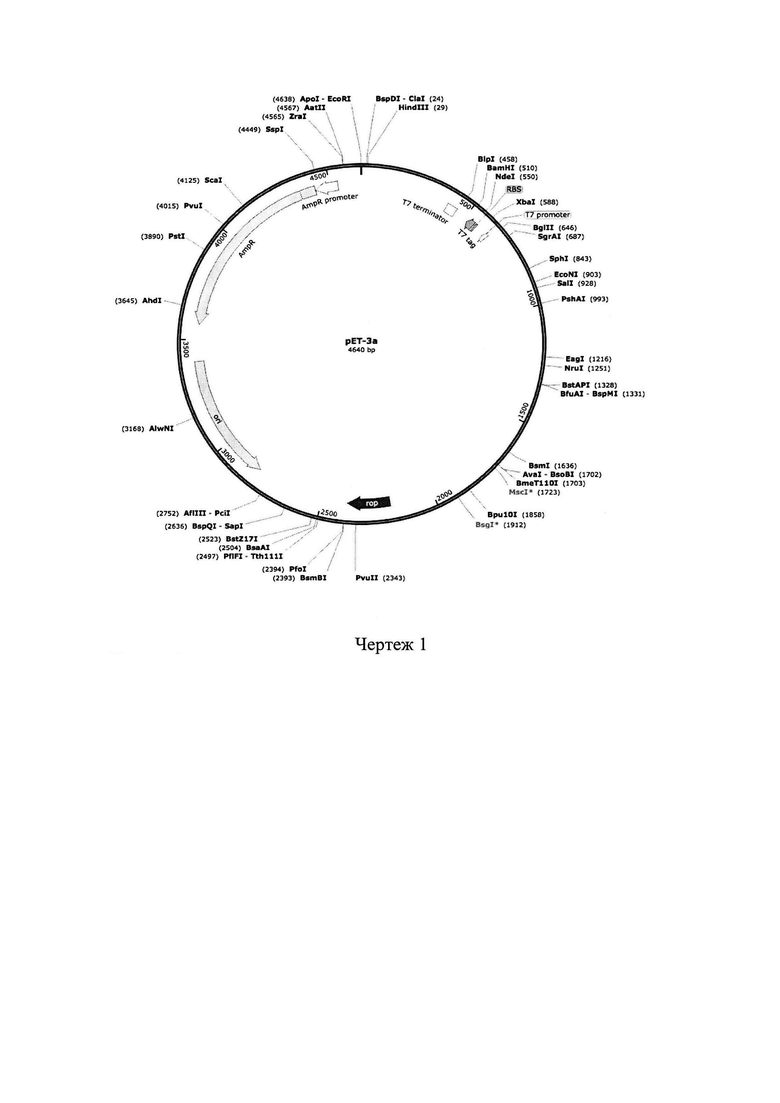
Для получения рекомбинантного капсидного белка вируса гепатита Е получена консенсусная последовательность гена, кодирующего данный белок, отражающая характерные для территории Российской федерации штаммы. На основе данной консенсусной последовательности получен синтетический ген: вместо начальных 110 кодонов гена в последовательности была закодирована олигогистидиновая метка для выделения и очистки белка (His-10). Вся остальная последовательность, кодирующая капсидный белок вируса гепатита Е, была систематически оптимизирована для экспрессии в E. coli. Синтетический ген длиной 1719 пар нуклеотидов кодирует белок с молекулярным весом 60.9 кДа. Затем полученный фрагмент перенесен в экспрессионный вектор рЕТ3а под контроль гибридного промотора и регуляторных последовательностей Т7 РНК полимеразы. Сведения о векторе рЕТ3а, на основе которого сконструирована плазмида: размер, генетическая и физическая карта вектора (с указанием литературных ссылок): 4640 bp (чертеж 1).
Трансформацией штамма реципиента BL21(DE3) плазмидой pET-ORF2 получен штамм-продуцент PORF2. Штамм-продуцент задепонирован во Всероссийской коллекции промышленных микроорганизмов. Для выделения и очистки рекомбинантного капсидного белка ВГЕ разработаны методики автоиндукции, метод лизиса и первичной очистки растворимого рекомбинантного белка, определены характеристики и параметры выделения белка на аффинной среде для IMAC. Разработаны варианты элюции рекомбинантного белка с аффинной среды и методики вторичной очистки белка гель-фильтрацией.
Плазмида выделена из клеток Е. Coli, есть ген устойчивости к ампициллину; наличие элементов, определяющих трансмиссивность плазмид - нет; круг хозяев аннотация выявленных рамок считывания (если вектор имеет происхождение из патогенных микроорганизмов) - отсутствует. Видовая принадлежность донорного организма: Hepatitis Е Virus, Род Hepavirus, семейство Hepaviridae.
Изобретение может быть проиллюстрировано следующими примерами.
В приводимых примерах все генно-инженерные операции производили согласно стандартным методикам и инструкциям компаний производителей ферментов и наборов для манипуляций с ДНК in vitro.
Пример 1. Способ получения штамма.
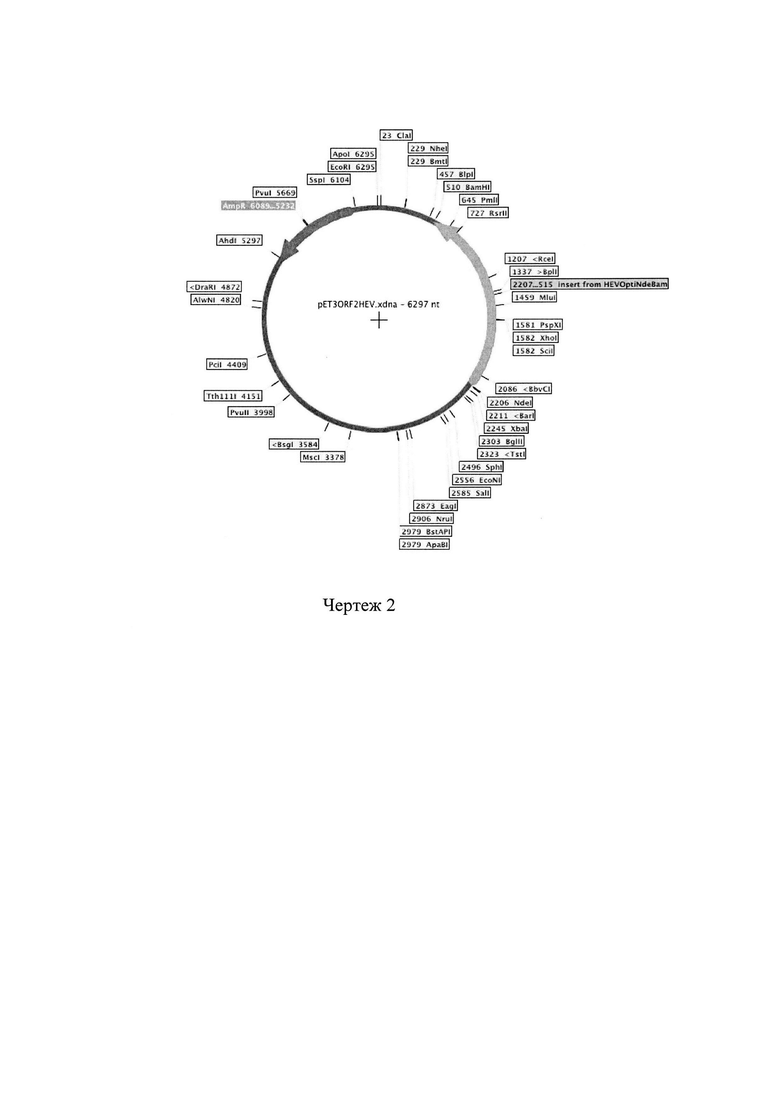
Штамм PORF2 получен трансформацией штамма реципиента BL21(DE3) плазмидой pET-ORF2. На плотной питательной среде образует круглые выпуклые колонии средней величины, влажные, с гладкой блестящей поверхностью с ровным краем. Колонии прозрачные с серовато-голубым отливом, легко сливающиеся между собой. В жидких средах (LB) растет в виде интенсивного равномерного помутнения среды, образуя осадок. Штамм продуцирует 1 мг рекомбинантного белка с 1 л культуры. Культура хранится на -70°С (неограниченное время) в 15% глицерине, 7% DMSO. Способ, условия и состав сред для размножения штамма: выращивание в среде LB (1% триптон, 0.5% дрожжевой экстракт, 0.5% NaCl; рН 7.0) при 37°С, 150-170 об/мин. Генетические особенности штамма: генотип штамма хозяина (мутации, делеции, инверсии, наличие плазмид или профагов, устойчивость (чувствительность) к антибиотикам, фагам и т.д., прочие генетические особенности): F- ompT gal dcm lon hsdSB(rB- mB-) λ(DE3 [lacI lacUV5-T7 gene 1 ind1 sam7 nin5]). Описание рекомбинантной плазмиды pET-ORF2: размер, генетическая и физическая карта плазмиды 6297 bp (чертеж 2). Плазмида выделена из клеток Е. Coli, есть ген устойчивости к ампициллину; наличие элементов, определяющих трансмиссивность плазмид - нет; круг хозяев аннотация выявленных рамок считывания (если вектор имеет происхождение из патогенных микроорганизмов) - отсутствует. Видовая принадлежность донорного организма: Hepatitis Е Virus, Род Hepavirus, семейство Hepaviridae.
Пример 2. Метод выращивания и индукции рекомбинантного растворимого капсидного белка ВГЕ на основе методики самоиндукции альфа-лактозой.
Для индукции готовят стандартную богатую среду для выращивания E. coli (среда Лурии-Бертани, LB) и следующие стерильные концентрированные растворы: 1) 20-кратный раствор NPS содержащий: 0.5М сульфата аммония (NH4)2SO4, 1М фосфата калия KH2PO4, 1М фосфата натрия Na2HPO4. 2) 50-кратный раствор 5052, содержащий: 25% глицерина, 2.5% глюкозы, 10% альфа-лактозы. 3) 1000-кратный раствор, содержащий 1М сульфат магния MgSO4.
Клетки штамма продуцента PORF2 предварительно рассевают методом исчезающего штриха на чашках Петри со средой LB и 1.8% агара и 75 μg/ml ампициллина. Жидкую среду LB с добавлением 75-100 мкг/мл ампициллина инокулируют единичной бактериальной колонией с чашки (предпочтительный метод) или из замороженного в 50% глицерине стока бактериальной культуры. Данную стартовую культуру выращивают в орбитальной качалке при 37°С и 300 об/мин до достижения поздней логарифмической фазы роста, измеряемой по поглощению в оптической области спектра 600 нм OD600=0.6-0.9. Для самоиндукции в конечном объеме 1 л используют 5 мл стартовой культуры в 50 мл одноразовых полипропиленовых пробирках с приоткрытой крышкой. Искомая плотность культуры достигается в таких условиях примерно за 3-4 часа. К моменту начала культивирования основной культуры готовят 1 л стерильной среды LB с добавлением 75-100 мкг/мл ампициллина и концентрированных растворов 1, 2 и 3 (соответственно, 1/20, 1/50 и 1/1000 объема среды). Среду подогревают в водяной бане до 37°С и разделяют на пять конических колб объемом 2 л, по 200 мл среды в каждой. Стартовую культуру инокулируют в приготовленную среду для самоиндукции из расчета 1/500-1/1000 и выращивается до насыщения (OD600~4) в орбитальной качалке при 37°С и 300 об/мин. Время выращивания в таких условиях составляет более 12 часов, обычно 16-18 часов. Для измерения OD600 после 12 часов культивации требуется разведение проб культуры в 10 раз в свежей среде LB, культивирование считается законченным тогда, когда плотность культуры перестает расти. Из выращенной культуры отбирают 2-3 пробы по 0.5 мл для анализа суммарной бактериальной массы и контроля экспрессии антигена, пробы центрифугируют при 12000 об/мин в настольной центрифуге, среду удаляют аспирацией, осадок бактериальной массы замораживают при -80°С до последующего анализа. Основную культуру объединяют в одной колбе и охлаждают в течение 20 минут при +4°С в мокром льду. Полученные 1000 мл культуры центрифугируют при 3500-4000 g в центрифуге с охлаждением при +4°С в четырех флаконах для центрифугирования объемом 250 мл. Жидкую среду удаляют аспирацией, бактериальную массу замораживают при -80°С до последующего выделения и очистки рекомбинантного белка.
Пример 3. Метод лизиса и первичной очистки растворимого рекомбинантного капсидного белка ВГЕ.
Осадок бактериальной массы после выращивания и автоиндукции в объеме 1 л культуры суспендируют при +4°С в 20 мл лизирующего буфера следующего состава: 50 mM Tris-HCL, рН 7.9, 0.1 mM EDTA, 5% glycerol, 0.1 mM DTT, 0.1М NaCl. В приготовленный лизисный раствор непосредственно перед применением добавляют ингибитор протеаз фенилметилсульфонил фторид (PMSF) до конечной концентрации 1 mM.
Бактериальную суспензию разделяют на 4 пробирки для ультразвукового лизирования. Условия ультразвукового лизирования зависят от мощности аппарата и параметров используемой насадки для лизирования. Критичным для сохранности выделяемого белка является возможность поддержания низкой (+4°С) температуры в ходе лизирования, что достигается уменьшением объема лизата. Бактериальную суспензию лизируют ультразвуком при +4°С и 60% мощности при помощи 8-10 пульсов по 30 секунд. После каждого пульса пробу выдерживают 1-2 минуты в мокром льду для охлаждения лизата. Отдельные фракции лизата объединяют в пробирке для центрифугирования. К лизату добавляют 10% стоковый раствор Triton Х-100 до 1% концентрации. Лизат инкубируют во льду при +4°С в течение 20 минут. Из лизата отбирают контрольную пробу объемом 0.2 мл для последующего анализа растворимости белка. Лизат центрифугируют в охлаждаемой центрифуге при 15000 об/мин в течение 30 минут для отделения нерастворимой фракции. Полученная растворимая фракция бактериального лизата готова для выделения растворимого рекомбинантного белка на аффинном носителе.
Пример 4. Метод выделения и очистки рекомбинантного капсидного белка ВГЕ методом аффинной хроматографии на иммобилизированных ионах металлов (IMAC).
К растворимой фракции клеточного лизата (20 мл лизата из 1 л культуры) после центрифугирования добавляют хлорид имидазола до концентрации 20 мМ, лизат фильтруют через 0.22 μМ фильтр и наносят на колонку с 2 мл носителя Profinity IMAC Ni2+ (производства BioRad). Для эффективного связывания лизат пропускают через носитель 3 раза со скоростью 2-5 мл/мин при +4°С. Аффинную колонку промывают 50 объемами (100 мл) фосфатного буфера PBS (137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4 с добавлением 0.1 mM DTT, 1 mM PMSF и 20 mM хлорида имидазола) при +4°С. Поглощение OD280 после промывки должно быть на уровне фона (<0.01). После промывки колонку освобождают от буферного раствора. Элюцию рекомбинантного белка проводят при помощи буфера для элюции (250 mM раствора хлорида имидазола в буфере для промывки на основе PBS). Для этого к осушенной колонке добавляют равный объем (2 мл) буфера для элюции. Колонку инкубируют в течение 10 минут при +4°С, после чего добавляют еще 2 мл буфера для элюции и собирают элюат. Колонку носителя Profinity IMAC Ni2+ регенерируют в соответствии с протоколом фирмы изготовителя (BioRad). Выделенный на аффинной среде рекомбинантный капсидный белок ВГЕ анализируют электрофорезом в денатурирующем ДСН-ПААГ.
Пример 5. Окончательная очистка полноразмерного белка от низкомолекулярных примесей и выделение вирусоподобных частиц методом гель-фильтрационной хроматографии с использованием носителя Sephacryl S-400 и Sephacryl S-200.
Оба носителя (Sephacryl S-400 и Sephacryl S-200) дают хорошие результаты для отделения фракций полноразмерного капсидного белка ВГЕ и фракции вирусоподобных частиц от низкомолекулярных компонентов. Для гель-фильтрации используют колонки емкостью 100 мл носителя длиной 50 см и систему для хроматографии среднего давления BioLogic DuoFlow™. Для стимулирования образования вирусоподобных частиц в элюат после аффинной хроматографии на носителе IMAC добавляют хлорид кальция (CaCl2) до концентрации 5 mM, затем белковый раствор инкубируют в течении 3-6 часов при +4°С. Для выделения вирусоподобных частиц и полноразмерных субъединиц капсидного белка ВГЕ очищенный на аффинном носителе элюат наносят на колонку с носителем Sephacryl S-200 и промываются стандартным фосфатным буфером PBS при +4°С. С помощью коллектора фракций собирают фракции объемом 0,5 мл, которые затем анализируют электрофорезом в денатурирующем ДСН-ПААГ с последующей окраской Кумасси или иммуноблотом со специфическими антителами к ORF2 ВГЕ по стандартной методике для подтверждения чистоты и специфичности очистки.
Краткое описание чертежей
Чертеж 1. Сведения о векторе рЕТ3а, на основе которого сконструирована плазмида: размер, генетическая и физическая карта вектора (с указанием литературных ссылок): 4640 bp.
Чертеж 2. Описание рекомбинантной плазмиды pET-ORF2: размер, генетическая и физическая карта плазмиды 6297 bp.
--->
Последовательность
SEQ ID #1: 71): 17
(Met-10HIS-HEVORF2(121-619 bp) 562 аа:
<PleI
HinfI
>BspD6I
NdeI <MlyI
| |
ggaaatatacatATGCACCATCATCATCACCACCATCATCACCACCTCACGGCAGTATCACCGGCACCGGACACCGCACCGGTTCCGGACGTGGACTCTC < 100
M H H H H H H H H H H L T A V S P A P D T A P V P D V D S R
cctttatatgtaTACGTGGTAGTAGTAGTGGTGGTAGTAGTGGTGGAGTGCCGTCATCGTGGCCGTGGCCTGTGGCGTGGCCAAGGCCTGCACCTGAGAG
10 20 30 40 50 60 70 80 90
>BseMII
>BspCNI
>Bpu10I
>BbvCI <AquIV
<EciI >PspPRI BfaI <BtgZI ScaI <BcgI
| || | | | | |
GCGGCGCCATACTCCGCCGCCAGTACAACCTCAGCACTTCCCCGTTAACTAGCAGCGTCGCAAGCGGTACCAACTTAGTACTATACGCAGCACCCTTAAA < 200
G A I L R R Q Y N L S T S P L T S S V A S G T N L V L Y A A P L N
CGCCGCGGTATGAGGCGGCGGTCATGTTGGAGTCGTGAAGGGGCAATTGATCGTGGTAGCGTTGGCCATGGTTGAATCATGATATGCGTCGTGGGAATAG
110 120 130 140 150 160 170 180 190
PflMI
|
CCCGCTCCTCCCGCTCCAGGACGGAACCAACACCCATATAATGGCAACCGAAGCAAGCAACTACGCACAGTACCGTGTTGTTCGTGCAACCATACGCTAC < 300
P L L P L Q D G T N T H I M A T E A S N Y A Q Y R V V R A T I R Y
CGGCGAGGAGGGCGAGGTCCTGCCTTGGTTGTGGGTATATTACCGTTGGCTTCGTTCGTTGATGCGTGTCATGGCACAACAAGCACGTTGGTATGCGATG
210 220 230 240 250 260 270 280 290
HaeIII
EaeI
<GdiII
||
CGCCCGCTCGTGCCGAACGCTGTTGGTGGGTACGCAATAAGCATAAGCTTTTGGCCGCAGACTACGACCACCCCGACCAGCGTTGACATGAACAGCATAA < 400
R P L V P N A V G G Y A I S I S F W P Q T T T T P T S V D M N S I T
GCGGGCGAGCACGGCTTGCGACAACCACCCATGCGTTATTCGTATTCGAAAACCGGCGTCTGATGCTGGTGGGGCTGGTCGCAACTGTACTTGTCGTATT
310 320 330 340 350 360 370 380 390
ZraI
AatII AclI
| |
CCAGCACCGACGTCCGCATATTAGTTCAGCCGGGTATAGCAAGCGAGTTAGTGATACCGTCGGAACGTTTACATTACCGTAACCAGGGTTGGCGTTCCGT < 500
S T D V R I L V Q P G I A S E L V I P S E R L H Y R N Q G W R S V
GGTCGTGGCTGCAGGCGTATAATCAAGTCGGCCCATATCGTTCGCTCAATCACTATGGCAGCCTTGCAAATGTAATGGCATTGGTCCCAACCGCAAGGCA
410 420 430 440 450 460 470 480 490
BstZ17I
>AcuI MspA1I AccI SgrAI
| | | |
TGAAACCTCTGGCGTCGCTGAAGAAGAAGCAACCAGCGGTCTCGTCATGCTCTGTATACATGGGAGCCCGGTGAACAGCTACACCAACACGCCGTACACC < 600
E T S G V A E E E A T S G L V M L C I H G S P V N S Y T N T P Y T
ACTTTGGAGACCGCAGCGACTTCTTCTTCGTTGGTCGCCAGAGCAGTACGAGACATATGTACCCTCGGGCCACTTGTCGATGTGGTTGTGCGGCATGTGG
510 520 530 540 550 560 570 580 590
SmlI
SciI
XhoI
<TaqII PspXI
| ||
GGCGCCCTCGGTCTCCTCGACTTCGCTCTCGAACTCGAGTTTCGTAACCTCACGCCGGGTAACACTAACACTCGTGTTAGCCGTTACACCTCGACGGCTC < 700
G A L G L L D F A L E L E F R N L T P G N T N T R V S R Y T S T A R
CCGCGGGAGCCAGAGGAGCTGAAGCGAGAGCTTGAGCTCAAAGCATTGGAGTGCGGCCCATTGTGATTGTGAGCACAATCGGCAATGTCGAGCAGCCGAG
610 620 630 640 650 660 670 680 690
MluI BspHI
| |
GTCACGTGCTACGTCGAGGACCGGACGGTACCGCAGAACTTACCACTACCGCAGCAACGCGTTTCATGAAGGACTTACATTTTACCGGAACCAACGGTGT < 800
H R L R R G P D G T A E L T T T A A T R F M K D L H F T G T N G V
CAGTGTTCGATGCAGCTCCTGGCCTGCCATGGCGTCTTGAATGGTGATGGCGTCGTTGCGCAAAGTACTTCCTGAATGTAAAATGGCCTTGGTTGCCACA
710 720 730 740 750 760 770 780 790
>BplI >SapI
| |
TGGTGAAGTTGGTCGTGGTATCGCTCTCACCTTATTCAACTTAGCAGACACTTTATTAGGTGGATTACCGACGGAGCTTATCTCCTCCGCAGGGGGTCAG < 900
G E V G R G I A L T L F N L A D T L L G G L P T E L I S S A G G Q
ACCACTTCAACCAGCACCATAGCGAGAGTGGAATAAGTTGAATCGTCTGTGAAATAATCCACCTAATGGCTGCCTCGAATAGAGGAGGCGTCCCCCAGTC
810 820 830 840 850 860 870 880 890
>EarI >BsmBI
| |
CTCTTCTACTCCCGCCCGGTCGTCTCCGCAAACGGTGAACCGACGGTGAAGTTATACACCTCCGTAGAAAACGCACAGCAGGACAAGGGTATAGCAATCC < 1000
L F Y S R P V V S A N G E P T V K L Y T S V E N A Q Q D K G I A I P
GAGAAGATGAGGGCGGGCCAGCAGAGGCGTTTGCCACTTGGCTGCCACTTCAATATGTGGAGGCATCTTTTGCGTGTCGTCCTGTTCCCATATCGTTAGG
910 920 930 940 950 960 970 980 990
>SdeOSI
>ApyPI
>RceI >NmeAIII <BsmFI
|| | | |
CCCATGACATCGACTTAGGTGAAAGCCGAGTTGTGATCCAGGACTACGACAACCAACATGAACAAGACCGTCCGACCCCGAGCCCGGCACCGTCCCGCCC < 1100
H D I D L G E S R V V I Q D Y D N Q H E Q D R P T P S P A P S R P
GGGTACTGTAGCTGAATCCACTTTCGGCTCAACACTAGGTCCTGATGCTGTTGGTTGTACTTGTTCTGGCAGGCTGGGGCTCGGGCCGTGGCAGGGCGGG
1010 1020 1030 1040 1050 1060 1070 1080 1090
PstI
>Bsp24I SfcI
| |
GTTCTCCGTTTTACGTGCAAACGACGTGTTATGGTTATCCCTTACTGCAGCAGAGTACGACCAAACCACCTACGGTAGCAGCACCAACCCGATGTACGTT < 1200
F S V L R A N D V L W L S L T A A E Y D Q T T Y G S S T N P M Y V
CAAGAGGCAAAATGCACGTTTGCTGCACAATACCAATAGGGAATGACGTCGTCTCATGCTGGTTTGGTGGATGCCATCGTCGTGGTTGGGCTACATGCAA
1110 1120 1130 1140 1150 1160 1170 1180 1190
AGCGACACCGTGACGTTTGTTAACGTAGCTACCGGTGCACAGGCAGTTGCACGCAGCTTAGACTGGAGCAAGGTTACCCTCGACGGTCGCCCGCTCACTA < 1300
S D T V T F V N V A T G A Q A V A R S L D W S K V T L D G R P L T T
TCGCTGTGGCACTGCAAACAATTGCATCGATGGCCACGTGTCCCTCAATCGGCGTCGAATCTGACCTCGTTCCAATGGGAGCTGCCAGCGGGCGAGTGAT
1210 1220 1230 1240 1250 1260 1270 1280 1290
<FokI
<StsI
<BtsCI StyI
| |
CCATCCAGCAGTACAGCAAGACCTTCTACGTTTTACCCTTACGTGGTAAGTTAAGCTTCTGGGAAGCAGGTACCACCAAGGCAGGTTACCCGTACAACTA < 1400
I Q Q Y S K T F Y V L P L R G K L S F W E A G T T K A G Y P Y N Y
GGTAGGTCGTCATGTCGTTCTGGAAGAAGCAAAATGGGAATGCACCATTCAATTCGAAGACCCTTCGTCCATGGTGGTTCCGTCCAATGGGCATGTTGAT
1310 1320 1330 1340 1350 1360 1370 1380 1390
>SfaNI
>BscAI BsaBI RsrII
| | |
CAACACCACCGCATCGGACCAGATCCTAATCGAAAACGCTGCAGGTCACCGTGTTGCAATCAGCACCTACACCACCAGCTTAGGTAGCGGTCCGGTTGCC < 1500
N T T A S D Q I L I E N A A G H R V A I S T Y T T S L G S G P V A
GTTGTGGTGGCGTAGCCTGGTCTAGGATTAGCTTTTGCGAGGCCCAGTGGCACAAACATAGTCGTGGATGTGGTGGTTGAATCCATCGCCAGGCCAATCG
1410 1420 1430 1440 1450 1460 1470 1480 1490
>BbsI
>Bbr7I PmlI PshAI
| | |
GTTAGCGCCGTCGGCGTCCTCGCTCCGCACTCTGCTCTCGCCCTCCTCGAAGACACCGTTGACTACCCGGCACGTGCACATACCTTTGACGACTTCTGTC < 1600
V S A V G V L A P H S A L A L L E D T V D Y P A R A H T F D D F C P
TATTCGCGGCAGCCGCAGGAGCGAGGCGTGAGACGAGAGCGGCGGGAGCTTCTGTGGCAACTGATGGGCCGTGCACGTGTATGGAAACTGCTGAAGACAG
1510 1520 1530 1540 1550 1560 1570 1580 1590
<BsmI DraI
| |
CGGAATGTCGTAACTTAGGTTTACAGGGTTGTGCATTCCAATCCACCATCGCAGAACTCCAGCGTTTAAAGATGAAGGTGGGTAAGACCCGCGAATCCTA < 1700
E C R N L G L Q G C A F Q S T I A E L Q R L K M K V G K T R E S *
GCCTTACAGCACGAAATCCAAATGTCCCAACACGTAAGGTTAGGTGGCAACGTCTTGAGGTCGCAAATTTCTACTTCCACCCATTCTGGGCGCTTATGAT
1610 1620 1630 1640 1650 1660 1670 1680 1690
BamHI
|
ATGAcggatccggctgcaa < 1719
* R I R L Q
TACTgcctaggccgacgtt
1710
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантный белок, содержащий антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е (варианты) | 2017 |
|
RU2711907C2 |
| Мозаичный рекомбинантный полипептид, содержащий фрагменты белков вируса гепатита Е 1 и 3 генотипов в одной полипептидной цепи, предназначенный для использования в тест-системах, применяемых в серодиагностике гепатита Е | 2020 |
|
RU2754791C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО КАПСИДНОГО БЕЛКА ВИРУСА ГЕПАТИТА Е И РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА Е | 2012 |
|
RU2501809C1 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА Е У ЖИВОТНЫХ | 2012 |
|
RU2501568C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ HANSENULA POLYMORPHA - ПРОДУЦЕНТ КАПСИДНОГО БЕЛКА ВИРУСА ГЕПАТИТА Е | 2012 |
|
RU2493249C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО АНТИГЕННОЙ АКТИВНОСТЬЮ ВИРУСА ГЕПАТИТА Е, И НАБОР ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВОЗБУДИТЕЛЮ ГЕПАТИТА Е | 1998 |
|
RU2172346C2 |
| РЕКОМБИНАНТНАЯ ВИРУСОПОДОБНАЯ ЧАСТИЦА КАПСИДА ЦИРКОВИРУСА (VLP): КОМПОЗИЦИИ, СПОСОБЫ И ПРИМЕНЕНИЯ | 2020 |
|
RU2817679C2 |
| ВАКЦИНЫ НА ОСНОВЕ СВИНОГО ВИРУСА Torque teNO И СПОСОБЫ ДИАГНОСТИКИ ИНФЕКЦИЙ, ВЫЗВАННЫХ ЭТИМ ВИРУСОМ | 2010 |
|
RU2553223C2 |
| ФРАГМЕНТ ДНК НС365, ПОЛИПЕПТИД, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА, ОБЛАДАЮЩЕГО СПОСОБНОСТЬЮ СВЯЗЫВАТЬ АНТИТЕЛА К ВИРУСУ ГЕПАТИТА C | 1993 |
|
RU2041949C1 |
| ВАКЦИНА ПРОТИВ HEV | 2017 |
|
RU2725952C1 |



Изобретение относится к биотехнологии, а именно генной инженерии. Предложены способ получения рекомбинантного капсидного белка вируса гепатита Е (PORF2) и рекомбинантная вакцина для профилактики вирусного гепатита Е. Капсидный белок получают путем культивирования рекомбинантного штамма Escherichia coli BL21(DE3)/PORF2, содержащего интегрированную в экспрессионный вектор синтетическую последовательность ДНК, оптимизированную для экспрессии в бактериальных системах и кодирующую фрагмент аминокислотной последовательности с 121 по 671 позицию капсидного белка вируса гепатита Е генотипа 3 (PORF2), несущую замены в аминокислотной последовательности, характерные для штаммов ВГЕ, циркулирующих на территории РФ (L284P, S324T, Y354H, S357G, I364V, G490N, V492M, S497T, T517S, S527T, F537Y, V571I) под контролем гибридного промотора и регуляторных последовательностей Т7 РНК полимеразы в условиях самоиндукции альфа-лактозой. Способ позволяет получить иммуногенный антиген вируса гепатита Е, обладающий свойствами природного белка. На основе полученного антигена создана рекомбинантная вакцина для профилактики вирусного гепатита Е. Вакцина содержит эффективное количество белка PORF2, адъювант и физиологически приемлемый разбавитель. 2 н.п. ф-лы, 5 пр., 2 ил.
1. Способ получения рекомбинантного капсидного белка вируса гепатита Е генотипа 3 (PORF2), включающий:
1) создание синтетического гена, кодирующего PORF2, несущего замены в аминокислотной последовательности, характерные для штаммов ВГЕ, циркулирующих на территории РФ (L284P, S324T, Y354H, S357G, I364V, G490N, V492M, S497T, T517S, S527T, F537Y, V571I), нуклеотидная последовательность которого оптимизирована для экспрессии в E. coli;
2) культивирование штамма-продуцента, содержащего последовательность ДНК, кодирующую белок ORF2, в подходящих для экспрессии указанного белка условиях, выделение и очистку целевого белка,
отличающийся тем, что культивируют рекомбинантный штамм Escherichia coli BL21(DE3)/PORF2, содержащий интегрированную в экспрессионный вектор последовательность ДНК, включающую рекомбинантный ген, кодирующий полипептид PORF2 с аминокислотной последовательностью SEQ ID #1, под контролем гибридного промотора и регуляторных последовательностей Т7 РНК полимеразы в условиях самоиндукции альфа-лактозой, а после выделения и очистки получают белок PORF2 в виде VLP, состоящей из мономеров с молекулярной массой мономера 60.9 кДа.
2. Рекомбинантная вакцина для профилактики вирусного гепатита Е, содержащая эффективное количество капсидного белка вируса гепатита Е, адъювант и физиологически приемлемый разбавитель, отличающаяся тем, что в качестве антигена вируса гепатита Е вакцина содержит белок PORF2 с аминокислотной последовательностью SEQ ID #1, полученный способом по п. 1.
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО КАПСИДНОГО БЕЛКА ВИРУСА ГЕПАТИТА Е И РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ВИРУСНОГО ГЕПАТИТА Е | 2012 |
|
RU2501809C1 |
| Li T | |||
| C | |||
| et al., Essential elements of the capsid protein for self-assembly into empty virus-like particles of hepatitis E virus, Journal of virology, 2005 | |||
| Т | |||
| Цилиндрический сушильный шкаф с двойными стенками | 0 |
|
SU79A1 |
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Способ приготовления из ягодного сока сухого консерва для варки киселя | 1925 |
|
SU12999A1 |
| Sehgal D., Malik P | |||
| S., Jameel S, Purification and diagnostic utility of a recombinant hepatitis E virus capsid protein expressed in insect | |||
Авторы
Даты
2021-03-29—Публикация
2016-12-27—Подача