ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПОДАННЫЙ В КАЧЕСТВЕ ТЕКСТОВОГО ФАЙЛА ЧЕРЕЗ EFS WEB
[0001] Список последовательностей, записанный в файле 497023SEQLIST.txt, составляет 38,3 килобайта, был создан 18 мая 2017 года и включен в данный документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Иммунизация отличных от человека животных (например, грызунов, таких как мыши или крысы), «не своим» белком является широко используемым способом для получения специфических антигенсвязывающих белков, таких как моноклональные антитела. Этот подход, однако, зависит от расхождения в последовательности между нативными белками у отличного от человека животного и иммунизированного белка, чтобы иммунная система отличного от человека животного могла распознавать иммуноген как не свой (то есть, чужеродный). Получение антител против антигенов, имеющих высокую степень гомологии с аутоантигенами, может быть сложной задачей из-за иммунологической толерантности. Поскольку функционально важные участки белков, как правило, практически идентичны у разных видов, иммунологическая толерантность к аутоантигенам часто создает проблему для получения антител к этим ключевым эпитопам.
[0003] Хотя был достигнут прогресс в нацеливании на различные геномные локусы, все еще остается много геномных локусов, на которые нельзя эффективно нацелить, или геномные модификации, которые не могут быть эффективно достигнуты с помощью обычных стратегий нацеливания. Система CRISPR/Cas предоставила новый инструмент для редактирования генома, но трудности все еще остаются. Например, трудности могут возникать в некоторых контекстах при попытке создания больших нацеленных геномных делеций или других больших нацеленных генетических модификаций, особенно в эукариотических клетках и организмах.
[0004] Кроме того, может быть трудно эффективно продуцировать клетки или животных, которые являются гомозиготными по нацеленной генетической модификации без последующих стадий скрещивания, и некоторые локусы могут быть более трудными для нацеливания, чем другие, для получения гомозиготных нацеленных модификаций. Например, хотя мыши F0-поколения, гетерозиготные для большой нацеленной геномной делеций, иногда могут быть получены с помощью обычных стратегий нацеливания, последующее скрещивание этих гетерозиготных мышей необходимо для получения F1 поколения мышей, которые гомозиготны по делеций. Эти дополнительные стадии скрещивания являются дорогостоящими и трудоемкими.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Способы и композиции предназначены для получения отличных от человека животных с уменьшенной толерантностью к чужеродному антигену, представляющему интерес, и для использования таких животных для получения антигенсвязывающих белков, которые связывают интересующий чужеродный антиген. В одном аспекте, изобретение относится к способу получения отличного от человека животного с уменьшенной толерантностью к представляющему интерес чужеродному антигену, включающему: (а) приведение в контакт генома плюрипотентной клетки отличного от человека животного, которая не является эмбрионом на одноклеточной стадии с: (i) белком Cas9: (ii) первой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой первой направляющей РНК в первом геномном локусе-мишени, причем первый геномный локус-мишень влияет на экспрессию первого аутоантигена гомологичного к или обладающего общим представляющим интерес эпитопом с представляющим интерес чужеродным антигеном; и (iii) второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в первом геномном локусе-мишени; причем первый геномный локус-мишень модифицирован в паре первой и второй хромосом с получением модифицированной плюрипотентной клетки отличного от человека животного с биаллельной модификацией, при этом экспрессия первого аутоантигена уменьшается; (b) введение модифицированной плюрипотентной клетки отличного от человека животного в эмбрион-хозяин; и (с) имплантацию эмбриона-хозяина суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного в котором первый геномный локус-мишень модифицирован в паре первой и второй хромосом, так что экспрессия первого аутоантигена уменьшилось. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. Необязательно, приведение в контакт включает введение белка Cas9, первой направляющей РНК и второй направляющей РНК в плюрипотентную клетку отличного от человека животного посредством нуклеофекции. Необязательно, белок Cas9 вводится в плюрипотентную клетку отличного от человека животного в форме ДНК, кодирующей белок Cas9, первая направляющая РНК вводится в плюрипотентную клетку отличного от человека животного в форме ДНК, кодирующей первую направляющую РНК, а вторая направляющая РНК вводится в плюрипотентную клетку отличного от человека животного в форме ДНК, кодирующей вторую направляющую РНК.
[0006] В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с: (iv) третьей направляющей РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК в первом геномном локусе-мишени; и/или (v) четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК в первом геномном локусе-мишени. В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с: (iv) третьей направляющей РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК во втором геномном локусе-мишени, причем второй геномный локус-мишень влияет на экспрессию первого аутоантигена или второго аутоантигена, гомологичного или разделяющего представляющий интерес эпитоп с представляющим интерес чужеродным антигеном; и/или (v) четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК во втором геномном локусе-мишени.
[0007] В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени. Необязательно, экзогенная матрица для репарации дополнительно содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии. В некоторых таких способах, вставка нуклеиновой кислоты гомологична или ортологична первому геномному локусу-мишени. В некоторых таких способах, экзогенная матрица для репарации составляет от около 50 нуклеотидов до около 1 т.п.о. в длину. В некоторых таких способах, экзогенная матрица для репарации составляет от около 80 нуклеотидов до около 200 нуклеотидов в длину. В некоторых таких способах, экзогенная матрица для репарации представляет собой одноцепочечный олигодезоксинуклеотид. В некоторых таких способах, экзогенная матрица для репараци представляет собой большой нацеливающий вектор (LTVEC), который имеет длину по меньшей мере 10 т.п.о., и/или экзогенная матрица для репараци представляет собой LTVEC, причем общая сумма 5'- и 3'-плечей гомологии LTVEC имеет длину по меньшей мере 10 т.п.о.
[0008] Некоторые из таких способов дополнительно включают: (d) иммунизацию генетически модифицированного F0-поколения отличного от человека животного, полученного на стадии (с), с интересующим чужеродным антигеном; (е) поддержание генетически модифицированного F0-поколения отличного от человека животного в условиях, достаточных для инициирования иммунного ответа на интересующий чужеродный антиген; и (f) получение первой последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина человека, и/или второй последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи иммуноглобулина человека, из генетически модифицированного F0-поколения отличного от человека животного.
[0009] В некоторых таких способах, антигенсвязывающие белки против чужеродного антигена, представляющего интерес, полученные после иммунизации генетически модифицированного F0-поколения отличного от человека животного с интересующим чужеродным антигеном, имеют более высокий титр, чем антигенсвязывающие белки, полученные после иммунизации контрольного отличного от человека животного, которые являются диким типом в первом геномном локусе-мишени. В некоторых таких способах, более разнообразный репертуар антигенсвязывающих белков против чужеродного антигена, представляющего интерес, полученные после иммунизации генетически модифицированного F0-поколения отличного от человека животного с интересующим чужеродным антигеном, по сравнению с антигенсвязывающими белками, полученными после иммунизации контрольного отличного от человека животного, которое являются диким типом в первом геномном локусе-мишени.
[00010] В некоторых таких способах, исключается экспрессия первого аутоантигена.
[00011] В некоторых таких способах, интересующий чужеродный антиген представляет собой ортолог первого аутоантигена. В некоторых таких способах, интересующий чужеродный антиген содержит, состоит по существу, или состоит из всего или части человеческого белка.
[00012] В некоторых таких способах, первый геномный локус-мишень модифицируется так, чтобы содержать вставку одного или более нуклеотидов, делецию одного или более нуклеотидов, или замену одного или более нуклеотидов. В некоторых таких способах, первый геномный локус-мишень модифицируется так, чтобы содержать делецию одного или более нуклеотидов. В некоторых таких способах, стадия приведения в контакт (а) включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени при условии, что если геном находится в эмбрионе на одноклеточной стадии, экзогенная матрица для репарации составляет не более 5 т.п.о. в длину, причем экзогенная матрица для репарации содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии, причем вставка нуклеиновой кислоты гомологична или ортологична удаленной последовательности нуклеиновой кислоты, и где вставка нуклеиновой кислоты замещает последовательность удаленной нуклеиновой кислоты. В некоторых таких способах, делеция является точной делецией без случайных вставок и делеций (инделей). В некоторых таких способах, стадия приведения в контакт (а) включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени при условии, что если геном находится в эмбрионе на одноклеточной стадии, экзогенная матрица для репарации составляет не более 5 т.п.о. в длину, причем последовательность удаленной нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты между 5'- и 3' последовательностями-мишенями.
[00013] В некоторых таких способах, первый геномный локус-мишень содержит, состоит по существу из, или состоит из всего или части гена, кодирующего первый аутоантиген. В некоторых таких способах, модификация содержит, по существу состоит из, или состоит из гомозиготной делеций всего или части гена, кодирующего первый аутоантиген. В некоторых таких способах, модификация содержит, по существу состоит из, состоит из гомозиготного разрушения стартового кодона гена, кодирующего первый аутоантиген.
[00014] В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона. Необязательно, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон. В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит первый сайт расщепления Cas9, а последовательность, распознаваемая второй направляющей РНК содержит второй сайт расщепления Cas9, причем первый геномный локус-мишень модифицирован, чтобы содержать делецию между первым и вторым сайтом расщепления Cas9. Необязательно, делеция представляет собой точную делецию, причем последовательность удаленной нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты между первым и вторым сайтами расщепления Cas9.
[00015] В некоторых таких способах, последовательность, распознаваемая первой и второй направляющими РНК, различна, и каждая из последовательности, распознаваемой первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона. Необязательно, каждая из последовательности, распознаваемой первой и второй направляющими РНК, содержит старт-кодон.
[00016] В некоторых таких способах, последовательность первой нуклеиновой кислоты и/или последовательность второй нуклеиновой кислоты получают из лимфоцита генетически модифицированного отличного от человека животного или из гибридомы, полученной из лимфоцитов.
[00017] В некоторых таких способах, отличное от человека животное содержит гуманизированный локус иммуноглобулина. В некоторых таких способах, отличное от человека животное представляет собой грызуна. В некоторых таких способах, грызун представляет собой мышь. Необязательно, линия мыши содержит линию BALB/c. Необязательно, указанная линия мышей содержит линии BALB/c, C57BL/6 и 129. Необязательно, линия мыши составляет 50% BALB/c, 25% C57BL/6 и 25% 129. Необязательно, гаплотип МНС мыши представляет собой MHCb/d.
[00018] В некоторых таких способах, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, вставленные в эндогенный локус иммуноглобулина мыши. Необязательно, неперестроенные генные сегменты вариабельного участка человека являются генными сегментами тяжелой цепи, а локус иммуноглобулина мыши является локусом тяжелой цепи. Необязательно, неперестроенные генные сегменты вариабельного участка человека являются генными сегментами легкой цепи, а локус иммуноглобулина мыши является локусом легкой цепи. Необязательно, генные сегменты легкой цепи представляют собой генные сегменты легкой цепи каппа или лямбда человека. В некоторых таких способах, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, функционально связанные с геном константного участка мыши, причем мышь не имеет гена константного участка человека, и причем ген константного участка мыши находится в эндогенном локусе иммуноглобулина мыши. В некоторых таких способах, мышь содержит: (а) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (b) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (а) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (b) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. В некоторых таких способах мышь, содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, и причем мышь содержит последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в месте, отличном от локуса вариабельного участка тяжелой цепи человека.
[00019] В некоторых таких способах, мышь содержит в своей зародышевой линии гуманизированный вариабельный локус легкой цепи иммуноглобулина, содержащий не более одной или не более двух перестроенных последовательностей V/J легкой цепи человека, функционально связанных с константным участком легкой цепи. Необязательно, ген константного участка легкой цепи представляет собой ген мыши. В некоторых таких способах, мышь дополнительно содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина, содержащий по меньшей мере один неперестроенный V человека, по меньшей мере один неперестроенный D человека, и по меньшей мере один неперестроенный J сегмент человека, функционально связанный с геном константного участка тяжелой цепи. Необязательно, ген константного участка тяжелой цепи представляет собой ген мыши. В некоторых таких способах, мышь содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует одну легкую цепь. В некоторых таких способах, мышь содержит: (а) один перестроенный вариабельный участок легкой цепи иммуноглобулина человека (VL/JL), которая кодирует VL домен легкой цепи иммуноглобулина человека, причем один перестроенный участок VL/JL человека выбирается из генного сегмент Vκ1-39/J человека или генного сегмента Vκ3-20/J человека; и (b) замещение генных сегментов эндогенной тяжелой цепи (VH) одним или более генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном константного участка эндогенной тяжелой цепи (CH), а генные сегменты VH человека способны перестраивать и формировать ген химерной тяжелой цепи человека/мыши. В некоторых таких способах, мышь экспрессирует популяцию антител, а зародышевая линия мыши содержит только один ген вариабельного участка легкой цепи каппа иммуноглобулина, который представляет собой перестроенный ген вариабельного участка легкой цепи каппа зародышевой линии человека, причем мышь является либо гетерозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина при этом он содержит только одну копию, или гомозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина, при этом он содержит две копии, причем мышь характеризуется активным созреванием аффинности, так что: (i) каждый легкая цепь каппа иммуноглобулина популяции содержит вариабельный домен легкой цепи, который кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, или его соматически мутированным вариантом; (ii) популяция содержит антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, и антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется их соматически мутированным варианты; и (iii) мышь образует разнообразный набор соматически мутированных высокоаффинных тяжелых цепей, которые успешно соединяются с легкими цепями каппа иммуноглобулина с образованием антител к популяции. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к мыши перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (b) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши. В некоторых таких способах мышь, содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, и причем мышь содержит последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в месте, отличном от локуса вариабельного участка тяжелой цепи человека.
[00020] В некоторых таких способах, мышь имеет геном, содержащий модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет функцию эндогенного ADAM6, и мышь дополнительно содержит последовательность нуклеиновой кислоты, кодирующую белок ADAM6 отличного от человека животного, или ортолог, или его гомолог, или функциональный фрагмент соответствующего белка ADAM6. Необязательно, геном мыши содержит: (а) эктопическое размещение гена ADAM6; и (b) локус вариабельного участка тяжелой цепи иммуноглобулина человека, содержащий вставку одного или более генных сегментов VH человека, одного или более генных сегментов DH человека, и одного или более генных сегментов JH человека в эндогенный локус тяжелой цепи отличного от человека животного, причем генные сегменты VH, DH и JH человека функционально связаны с геном константного участка тяжелой цепи; так что мышь характеризуется тем, что: (i) она фертильна; и (ii) когда она иммунизирована антигеном, то продуцирует антитела, содержащие вариабельные домены тяжелой цепи, кодируемые одним или более генными сегментами VH человека, одним или более DH человека, и одним или более JH человека, функционально связанными с константными доменами тяжелой цепи, кодируемыми геном константного участка тяжелой цепи, причем антитела проявляют специфическое связывание с антигеном.
[00021] В некоторых таких способах, отличное от человека животное представляет собой мышь, которая по меньшей мере частично является производным от линии BALB/c, причем мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является полностью или частично белком человека, который является ортологичным первому аутоантигену, и первый геномный локус-мишень содержит весь или часть гена, кодирующего первый аутоантиген, причем первый сайт узнавания направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, и второй сайт узнавания направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, и при этом модификация содержит гомозиготную делецию всего или части гена, кодирующего первый аутоантиген, причем экспрессия первого аутоантигена исключается. Необязательно, мышь содержит: (а) эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, является функциональным у самца мыши; (b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (с) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраиваются с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (с) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) эктопической последовательности нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, являются функционирующим у самца мыши; (b) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина мыши к перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (с) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00022] В некоторых таких способах, в которых отличное от человека животное представляет собой мышь, которая по меньшей мере частично является производным от линии BALB/c, причем мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является полностью или частично белком человека, который является ортологичным первому аутоантигену, и первый геномный локус-мишень содержит весь или часть гена, кодирующего первый аутоантиген, причем первый сайт узнавания направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, и второй сайт узнавания направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, и при этом где модификация содержит гомозиготное повреждение стартового кодона для гена, кодирующего первый аутоантиген, при этом экспрессия первого аутоантигена исключается. Необязательно, мышь содержит: (а) эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, является функциональным у самца мыши; (b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (с) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраиваются с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (с) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) эктопической последовательности нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, являются функционирующим у самца мыши; (b) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина мыши к перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (с) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00023] В некоторых способах, плюрипотентная клетка отличного от человека животного представляет собой гибридную клетку, и этот способ дополнительно включает: (а') сравнение последовательности соответствующих первой и второй хромосом в гомологичной паре хромосом в первом геномном локусе-мишени, и выбор участка-мишени в пределах первого геномного локуса-мишени перед стадией приведения в контакт (а) на основе участка-мишени, имеющего более высокий процент идентичности последовательности между соответствующей первой и второй хромосомами в гомологичной хромосомной паре по отношению ко всей или части остального первого геномного локуса-мишени. Необязательно, участок-мишень имеет более высокий процент идентичности последовательности между соответствующей первой и второй хромосомами в гомологичной хромосомной паре относительно остальной части первого геномного локуса-мишени. Необязательно, участок-мишень имеет по меньшей мере 99,9% идентичности последовательностей между соответствующими первой и второй хромосомами, а остальная часть первого геномного локуса-мишени имеет не более чем 99,8% идентичности последовательности между соответствующими первой и второй хромосомами. Необязательно, участок-мишень идентичен в соответствующей первой и второй хромосомах в гомологичной паре хромосом. Необязательно, участок-мишень находится в пределах максимально возможного участка непрерывной идентичности аллельной последовательности в первом геномном локусе-мишени.
[00024] В некоторых таких способах, участок-мишень содержит, по существу состоит из, состоит из последовательности, распознаваемой первой направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п. с, 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне последовательности, распознаваемой первой направляющей РНК, и последовательности, распознаваемой второй направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, на 3' стороне или на каждой стороне последовательности, распознаваемой второй направляющей РНК. Необязательно, этап (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, состоит из последовательности, распознаваемой другой направляющей РНК, не присутствующей в другом месте в геноме, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне, или на каждой стороне последовательности, распознаваемой другой направляющей РНК, и выбирается как участок-мишень двух сегментов, имеющих самый высокий процент идентичности последовательности по отношению к другим сегментам. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой последовательности, распознаваемой другой направляющей РНК в первом геномном локусе-мишени, но не присутствуют в другом месте в геноме.
[00025] В некоторых таких способах, участок-мишень содержит, по существу состоит из, или состоит из участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК, не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности по сравнению с другими сегментами. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00026] В некоторых таких способах, участок-мишень содержит, по существу состоит из, или состоит из участка между последовательностями, распознаваемыми первой и второй направляющими РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о фланкирующей последовательности на 5' стороне, 3' стороне, или каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне, или на каждой стороне геномного участка между другой парой последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности относительно других сегментов. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00027] В некоторых таких способах, в которых участок-мишень содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более несмежных сегментов первого геномного локуса-мишени, причем каждый несмежный сегмент содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне или на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени несмежного сегмента, имеющего самый высокий процент идентичности последовательности относительно других несмежных сегментов. Необязательно, один или более несмежных сегментов содержат, состоят по существу из, или состоят из несмежных сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
В некоторых таких способах, участок-мишень содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более несмежных сегментов первого геномного локуса-мишени, причем каждый несмежный сегмент содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени несмежного сегмента, имеющего самый высокий процент идентичности последовательности относительно других несмежных сегментов. Необязательно, один или более несмежных сегментов содержат, состоят по существу из, или состоят из несмежных сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00029] В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из участка, фланкированного 5'- и 3'-последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из участка, фланкированного и содержащего 5'- и 3'-последовательности-мишени. В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из 5'-последовательности-мишени и/или 3'-последовательности-мишени. Необязательно, геномный локус-мишень на стадии (а') состоит, по существу состоит из, состоит из 5'-последовательности-мишени и 3'-последовательности-мишени. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из участка между 5' и 3' последовательностями-мишенями и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из участка между 5' и 3' последовательностями-мишенями и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне участка между 5' и 3' последовательностями-мишенями.
[00030] В другом аспекте, изобретение относится к способу получения отличного от человека животного с уменьшенной толерантностью к представляющему интерес чужеродному антигену, включающему: (а) приведение в контакт генома эмбриона отличного от человека животного на одноклеточной стадии с: (i) белком Cas9; (ii) первой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой первой направляющей РНК в первом геномном локусе-мишени, причем первый геномный локус-мишень влияет на экспрессию первого аутоантигена гомологичного к или обладающего общим представляющим интерес эпитопом с интересующим чужеродным антигеном; и (iii) второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в первом геномном локусе-мишени; причем первый геномный локус-мишень модифицирован в паре первой и второй хромосом для получения биаллельной модификации, причем модифицированный эмбрион отличного от человека животного на одноклеточной стадии, в котором экспрессия первого аутоантигена снижена; и (b) имплантацию модифицированного эмбриона отличного от человека животного на одноклеточной стадии суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного в котором первый геномный локус-мишень модифицирован в паре первой и второй хромосом, так что экспрессия первого аутоантигена уменьшена. Необязательно, приведение в контакт включает введение белка Cas9, первой направляющей РНК и второй направляющей РНК в эмбрион отличного от человека животного на одноклеточной стадии посредством нуклеофекции. Необязательно, белок Cas9 вводится в эмбрион отличного от человека животного на одноклеточной стадии в форме ДНК, кодирующей белок Cas9, первая направляющая РНК вводится в эмбрион отличного от человека животного на одноклеточной стадии в форме ДНК, кодирующей первую направляющую РНК, а вторая направляющая РНК вводится в эмбрион отличного от человека животного на одноклеточной стадии в форме ДНК, кодирующей вторую направляющую РНК.
[00031] В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с: (iv) третьей направляющей РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК в первом геномном локусе-мишени; и/или (v) четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК в первом геномном локусе-мишени. В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с: (iv) третьей направляющей РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК во втором геномном локусе-мишени, причем второй геномный локус-мишень влияет на экспрессию первого аутоантигена или второго аутоантигена, гомологичного или обладающего общим представляющим интерес эпитопом с интересующим чужеродным антигеном; и/или (v) четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК во втором геномном локусе-мишени.
[00032] В некоторых таких способах, стадия приведения в контакт (а) дополнительно включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени, причем экзогенная матрица для репарации находится между около 50 нуклеотидами до около 5 т.п.о. в длину. Необязательно, экзогенная матрица для репарации дополнительно содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии. В некоторых таких способах, вставка нуклеиновой кислоты гомологична или ортологична первому геномному локусу-мишени. В некоторых таких способах, экзогенная матрица для репарации составляет от около 50 нуклеотидов до около 1 т.п.о. в длину. В некоторых таких способах, экзогенная матрица для репарации составляет от около 80 нуклеотидов до около 200 нуклеотидов в длину. В некоторых таких способах, экзогенная матрица для репарации представляет собой одноцепочечный олигодезоксинуклеотид.
[00033] Некоторые из таких способов дополнительно включают: (с) иммунизацию генетически модифицированного F0-поколения отличного от человека животного, полученного на стадии (b), с интересующим чужеродным антигеном; (d) поддержание генетически модифицированного F0-поколения отличного от человека животного в условиях, достаточных для инициирования иммунного ответа на интересующий чужеродный антиген; и (е) получение первой последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина человека, и/или второй последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи иммуноглобулина человека, из генетически модифицированного F0-поколения отличного от человека животного.
[00034] В некоторых таких способах, антигенсвязывающие белки против чужеродного антигена, представляющего интерес, полученные после иммунизации генетически модифицированного F0-поколения отличного от человека животного с интересующим чужеродным антигеном, имеют более высокий титр, чем антигенсвязывающие белки, полученные после иммунизации контрольного отличного от человека животного, которые являются диким типом в первом геномном локусе-мишени. В некоторых таких способах, более разнообразный репертуар антигенсвязывающих белков против чужеродного антигена, представляющего интерес, полученные после иммунизации генетически модифицированного F0-поколения отличного от человека животного с интересующим чужеродным антигеном, по сравнению с антигенсвязывающими белками, полученными после иммунизации контрольного отличного от человека животного, которое являются диким типом в первом геномном локусе-мишени.
[00035] В некоторых таких способах, исключается экспрессия первого аутоантигена.
[00036] В некоторых таких способах, интересующий чужеродный антиген представляет собой ортолог первого аутоантигена. В некоторых таких способах, интересующий чужеродный антиген содержит, состоит по существу, или состоит из всего или части человеческого белка.
[00037] В некоторых таких способах, первый геномный локус-мишень модифицируется так, чтобы содержать вставку одного или более нуклеотидов, делецию одного или более нуклеотидов, или замену одного или более нуклеотидов. В некоторых таких способах, первый геномный локус-мишень модифицируется так, чтобы содержать делецию одного или более нуклеотидов. В некоторых таких способах, стадия приведения в контакт (а) включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени при условии, что если геном находится в эмбрионе на одноклеточной стадии, экзогенная матрица для репарации составляет не более 5 т.п.о. в длину, причем экзогенная матрица для репарации содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии, причем вставка нуклеиновой кислоты гомологична или ортологична удаленной последовательности нуклеиновой кислоты, и где вставка нуклеиновой кислоты замещает последовательность удаленной нуклеиновой кислоты. В некоторых таких способах, делеция является точной делецией без случайных вставок и делеций (инделей). В некоторых таких способах, стадия приведения в контакт (а) включает приведение в контакт генома с экзогенной матрицей для репарации, содержащей 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени при условии, что если геном находится в эмбрионе на одноклеточной стадии, экзогенная матрица для репарации составляет не более 5 т.п.о. в длину, причем последовательность удаленной нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты между 5'- и 3' последовательностями-мишенями.
[00038] В некоторых таких способах, первый геномный локус-мишень содержит, состоит по существу из, или состоит из всего или части гена, кодирующего первый аутоантиген. В некоторых таких способах, модификация содержит, по существу состоит из, или состоит из гомозиготной делеции всего или части гена, кодирующего первый аутоантиген. В некоторых таких способах, модификация содержит, по существу состоит из, состоит из гомозиготного разрушения стартового кодона гена, кодирующего первый аутоантиген.
[00039] В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона. Необязательно, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон. В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит первый сайт расщепления Cas9, а последовательность, распознаваемая второй направляющей РНК содержит второй сайт расщепления Cas9, причем первый геномный локус-мишень модифицирован, чтобы содержать делецию между первым и вторым сайтом расщепления Cas9. Необязательно, делеция представляет собой точную делецию, причем последовательность удаленной нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты между первым и вторым сайтами расщепления Cas9.
[00040] В некоторых таких способах, последовательность, распознаваемая первой и второй направляющими РНК, различна, и каждая из последовательности, распознаваемой первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего первый аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона. Необязательно, каждая из последовательности, распознаваемой первой и второй направляющими РНК, содержит старт-кодон.
[00041] В некоторых таких способах, последовательность первой нуклеиновой кислоты и/или последовательность второй нуклеиновой кислоты получают из лимфоцита генетически модифицированного отличного от человека животного или из гибридомы, полученной из лимфоцитов.
[00042] В некоторых таких способах, отличное от человека животное содержит гуманизированный локус иммуноглобулина. В некоторых таких способах, отличное от человека животное представляет собой грызуна. В некоторых таких способах, грызун представляет собой мышь. Необязательно, линия мыши содержит линию BALB/c. Необязательно, указанная линия мышей содержит линии BALB/c, C57BL/6 и 129. Необязательно, линия мыши составляет 50% BALB/c, 25% C57BL/6 и 25% 129. Необязательно, гаплотип МНС мыши представляет собой MHCb/d.
[00043] В некоторых таких способах, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, вставленные в эндогенный локус иммуноглобулина мыши. Необязательно, неперестроенные генные сегменты вариабельного участка человека являются генными сегментами тяжелой цепи, а локус иммуноглобулина мыши является локусом тяжелой цепи. Необязательно, неперестроенные генные сегменты вариабельного участка человека являются генными сегментами легкой цепи, а локус иммуноглобулина мыши является локусом легкой цепи. Необязательно, генные сегменты легкой цепи представляют собой генные сегменты легкой цепи каппа или лямбда человека. В некоторых таких способах, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, функционально связанные с геном константного участка мыши, причем мышь не имеет гена константного участка человека, и причем ген константного участка мыши находится в эндогенном локусе иммуноглобулина мыши. В некоторых таких способах, мышь содержит: (а) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (b) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (а) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (b) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. В некоторых таких способах мышь, содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, и причем мышь содержит последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в месте, отличном от локуса вариабельного участка тяжелой цепи человека.
[00044] В некоторых таких способах, мышь содержит в своей зародышевой линии гуманизированный вариабельный локус легкой цепи иммуноглобулина, содержащий не более одной или не более двух перестроенных последовательностей V/J легкой цепи человека, функционально связанных с константным участком легкой цепи. Необязательно, ген константного участка легкой цепи представляет собой ген мыши. В некоторых таких способах, мышь дополнительно содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина, содержащий по меньшей мере один неперестроенный V человека, по меньшей мере один неперестроенный D человека, и по меньшей мере один неперестроенный J сегмент человека, функционально связанный с геном константного участка тяжелой цепи. Необязательно, ген константного участка тяжелой цепи представляет собой ген мыши. В некоторых таких способах, мышь содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует одну легкую цепь. В некоторых таких способах, мышь содержит: (а) один перестроенный вариабельный участок легкой цепи иммуноглобулина человека (VL/JL), которая кодирует VL домен легкой цепи иммуноглобулина человека, причем один перестроенный участок VL/JL человека выбирается из генного сегмент Vκ1-39/J человека или генного сегмента Vκ3-20/J человека; и (b) замещение генных сегментов эндогенной тяжелой цепи (VH) одним или более генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном константного участка эндогенной тяжелой цепи (CH), а генные сегменты VH человека способны перестраивать и формировать ген химерной тяжелой цепи человека/мыши. В некоторых таких способах, мышь экспрессирует популяцию антител, а зародышевая линия мыши содержит только один ген вариабельного участка легкой цепи каппа иммуноглобулина, который представляет собой перестроенный ген вариабельного участка легкой цепи каппа зародышевой линии человека, причем мышь является либо гетерозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина при этом он содержит только одну копию, или гомозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина, при этом он содержит две копии, причем мышь характеризуется активным созреванием аффинности, так что: (i) каждый легкая цепь каппа иммуноглобулина популяции содержит вариабельный домен легкой цепи, который кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, или его соматически мутированным вариантом; (ii) популяция содержит антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, и антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется их соматически мутированным варианты; и (iii) мышь образует разнообразный набор соматически мутированных высокоаффинных тяжелых цепей, которые успешно соединяются с легкими цепями каппа иммуноглобулина с образованием антител к популяции. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к мыши перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (b) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши. В некоторых таких способах мышь, содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, и причем мышь содержит последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека. Необязательно, эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в месте, отличном от локуса вариабельного участка тяжелой цепи человека.
[00045] В некоторых таких способах, мышь имеет геном, содержащий модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет функцию эндогенного ADAM6, и мышь дополнительно содержит последовательность нуклеиновой кислоты, кодирующую белок ADAM6 отличного от человека животного, или ортолог, или его гомолог, или функциональный фрагмент соответствующего белка ADAM6. Необязательно, геном мыши содержит: (а) эктопическое размещение гена ADAM6; и (b) локус вариабельного участка тяжелой цепи иммуноглобулина человека, содержащий вставку одного или более генных сегментов VH человека, одного или более генных сегментов DH человека, и одного или более генных сегментов JH человека в эндогенный локус тяжелой цепи отличного от человека животного, причем генные сегменты VH, DH и JH человека функционально связаны с геном константного участка тяжелой цепи; так что мышь характеризуется тем, что: (i) она фертильна; и (ii) когда она иммунизирована антигеном, то продуцирует антитела, содержащие вариабельные домены тяжелой цепи, кодируемые одним или более генными сегментами VH человека, одним или более DH человека, и одним или более JH человека, функционально связанными с константными доменами тяжелой цепи, кодируемыми геном константного участка тяжелой цепи, причем антитела проявляют специфическое связывание с антигеном.
[00046] В некоторых таких способах, отличное от человека животное представляет собой мышь, которая по меньшей мере частично является производным от линии BALB/c, причем мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является полностью или частично белком человека, который является ортологичным первому аутоантигену, и первый геномный локус-мишень содержит весь или часть гена, кодирующего первый аутоантиген, причем первый сайт узнавания направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, и второй сайт узнавания направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, и при этом модификация содержит гомозиготную делецию всего или части гена, кодирующего первый аутоантиген, причем экспрессия первого аутоантигена исключается. Необязательно, мышь содержит: (а) эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, является функциональным у самца мыши; (b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (с) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраиваются с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (с) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) эктопической последовательности нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, являются функционирующим у самца мыши; (b) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина мыши к перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (с) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00047] В некоторых таких способах, в которых отличное от человека животное представляет собой мышь, которая по меньшей мере частично является производным от линии BALB/c, причем мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является полностью или частично белком человека, который является ортологичным первому аутоантигену, и первый геномный локус-мишень содержит весь или часть гена, кодирующего первый аутоантиген, причем первый сайт узнавания направляющей РНК содержит старт-кодон для гена, кодирующего первый аутоантиген, и второй сайт узнавания направляющей РНК содержит стоп-кодон для гена, кодирующего первый аутоантиген, и при этом где модификация содержит гомозиготное повреждение стартового кодона для гена, кодирующего первый аутоантиген, при этом экспрессия первого аутоантигена исключается. Необязательно, мышь содержит: (а) эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, является функциональным у самца мыши; (b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (с) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраиваются с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (с) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) эктопической последовательности нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, являются функционирующим у самца мыши; (b) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина мыши к перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (с) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00048] В некоторых способах, эмбрион отличного от человека животного на одноклеточной стадии представляет собой гибридный эмбрион на одноклеточной стадии, и этот способ дополнительно включает: (а') сравнение последовательности соответствующих первой и второй хромосом в гомологичной паре хромосом в первом геномном локусе-мишени, и выбор участка-мишени в пределах первого геномного локуса-мишени перед стадией приведения в контакт (а) на основе участка-мишени, имеющего более высокий процент идентичности последовательности между соответствующей первой и второй хромосомами в гомологичной хромосомной паре по отношению ко всей или части остального первого геномного локуса-мишени. Необязательно, участок-мишень имеет более высокий процент идентичности последовательности между соответствующей первой и второй хромосомами в гомологичной хромосомной паре относительно остальной части первого геномного локуса-мишени. Необязательно, участок-мишень имеет по меньшей мере 99,9% идентичности последовательностей между соответствующими первой и второй хромосомами, а остальная часть первого геномного локуса-мишени имеет не более чем 99,8% идентичности последовательности между соответствующими первой и второй хромосомами. Необязательно, участок-мишень идентичен в соответствующей первой и второй хромосомах в гомологичной паре хромосом. Необязательно, участок-мишень находится в пределах максимально возможного участка непрерывной идентичности аллельной последовательности в первом геномном локусе-мишени.
[00049] В некоторых таких способах, участок-мишень содержит, по существу состоит из, состоит из последовательности, распознаваемой первой направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне последовательности, распознаваемой первой направляющей РНК, и последовательности, распознаваемой второй направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, на 3' стороне или на каждой стороне последовательности, распознаваемой второй направляющей РНК. Необязательно, этап (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, состоит из последовательности, распознаваемой другой направляющей РНК, не присутствующей в другом месте в геноме, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне, или на каждой стороне последовательности, распознаваемой другой направляющей РНК, и выбирается как участок-мишень двух сегментов, имеющих самый высокий процент идентичности последовательности по отношению к другим сегментам. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой последовательности, распознаваемой другой направляющей РНК в первом геномном локусе-мишени, но не присутствуют в другом месте в геноме.
[00050] В некоторых таких способах, участок-мишень содержит, по существу состоит из, или состоит из участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК, не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности по сравнению с другими сегментами. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00051] В некоторых таких способах, участок-мишень содержит, по существу состоит из, или состоит из участка между последовательностями, распознаваемыми первой и второй направляющими РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.с, 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о фланкирующей последовательности на 5' стороне, 3' стороне, или каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более сегментов первого геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне, или на каждой стороне геномного участка между другой парой последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности относительно других сегментов. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00052] В некоторых таких способах, в которых участок-мишень содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более несмежных сегментов первого геномного локуса-мишени, причем каждый несмежный сегмент содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне или на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени несмежного сегмента, имеющего самый высокий процент идентичности последовательности относительно других несмежных сегментов. Необязательно, один или более несмежных сегментов содержат, состоят по существу из, или состоят из несмежных сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00053] В некоторых таких способах, участка-мишень содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК. Необязательно, стадия (а') включает в себя сравнение двух или более несмежных сегментов первого геномного локуса-мишени, причем каждый несмежный сегмент содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК не присутствуют в другом месте генома, и выбираются в качестве участка-мишени несмежного сегмента, имеющего самый высокий процент идентичности последовательности относительно других несмежных сегментов. Необязательно, один или более несмежных сегментов содержат, состоят по существу из, или состоят из несмежных сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в первом геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК отсутствуют в другом месте генома.
[00054] В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из участка, фланкированного 5'- и 3'-последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из участка, фланкированного и содержащего 5'- и 3'-последовательности-мишени. В некоторых таких способах, участок-мишень на стадии (а') состоит, по существу состоит из, состоит из 5'-последовательности-мишени и/или 3'-последовательности-мишени. Необязательно, геномный локус-мишень на стадии (а') состоит, по существу состоит из, состоит из 5'-последовательности-мишени и 3'-последовательности-мишени. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из участка между 5' и 3' последовательностями-мишенями и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из участка между 5' и 3' последовательностями-мишенями и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне участка между 5' и 3' последовательностями-мишенями. В некоторых таких способах, участок-мишень на стадии (а') содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на каждой стороне участка между 5' и 3' последовательностями-мишенями.
[00055] В другом аспекте, представлен способ получения антигенсвязывающих белков против представляющего интерес чужеродного антигена, включающий: (а) создание генетически модифицированного отличного от человека животного с пониженной толерантностью к интересующему чужеродному антигену, включающему: (i) введение в эмбрион отличного от человека животного на одноклеточной стадии или плюрипотентную клетку отличного от человека животного, которая не является эмбрионом на одноклеточной стадии: (I) белка Cas9; (II) первой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой первой направляющей РНК в геномном локусе-мишени, причем геномный локус-мишень содержит весь или часть гена, кодирующего аутоантиген, гомологичный или обладающим общим представляющим интерес эпитопом с чужеродным представляющим интерес антигеном; и (III) второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени; причем геномный локус-мишень модифицируется в паре соответствующих первой и второй хромосом для получения модифицированного эмбриона отличного от человека животного на одноклеточной стадии, или модифицированной плюрипотентной клетки отличного от человека животного с биаллельной модификацией, причем экспрессия аутоантигена устраняется; и (ii) получение генетически модифицированного F0-поколения отличного от человека животного из модифицированного эмбриона на одноклеточной стадии отличного от человека или модифицированной плюрипотентной клетки отличного от человека животного, причем геномный локус-мишень модифицирован в паре соответствующих первых и вторых хромосом в генетически модифицированном F0-поколении отличного от человека животного, так что экспрессия аутоантигена устранена; (b) иммунизации генетически модифицированного F0-поколения отличного от человека животного, полученного на этапе (а) с представляющим интерес чужеродным антигеном; и (с) поддержание генетически модифицированного F0-поколения отличного от человека животного в условиях, достаточных для инициирования иммунного ответа на представляющий интерес чужеродный антиген, причем генетически модифицированное F0-поколение отличного от человека животного производит антигенсвязывающие белки против представляющего интерес чужеродного антигена.
[00056] В некоторых способах, клетка на стадии (a) (i) представляет собой плюрипотентную стволовую клетку отличного от человека животного, и продуцирование генетически модифицированного F0-поколения отличного от человека животного на стадии (а) (ii) включает: (I) введение модифицированной плюрипотентной клетки отличного от человека животного в эмбрион-хозяин; и (II) имплантацию эмбриона-хозяина суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного в котором геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом, так что экспрессия аутоантигена устранена. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. В некоторых способах, клетка на стадии (a) (i) представляет собой эмбрион отличного от человека животного на одноклеточной стадии, и продуцирование генетически модифицированного F0-поколения отличного от человека животного на стадии (а) (ii) включает имплантацию модифицированного эмбриона отличного от человека животного на одноклеточной стадии суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного, у которого геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом, так что экспрессия аутоантигена устранена.
[00057] Некоторые из таких способов дополнительно включают получение гибридомы из В-клеток, выделенных из иммунизированного генетически модифицированного F0-поколения отличного от человека животного. Некоторые из таких способов дополнительно включают получение от иммунизированного генетически модифицированного F0-поколения отличного от человека животного первой последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина одного из антигенсвязывающих белков против представляющего интерес чужеродного антигена и/или второй последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи иммуноглобулина одного из антигенсвязывающих белков против представляющего интерес чужеродного антигена. Необязательно, последовательность первой нуклеиновой кислоты и/или последовательность второй нуклеиновой кислоты получают из лимфоцита (например, В-клеток) генетически модифицированного F0-поколения отличного от человека животного или из гибридомы, полученной из лимфоцитов. Необязательно, генетически модифицированное F0-поколение отличного от человека животного, содержит гуманизированный локус иммуноглобулина, и причем первая последовательность нуклеиновой кислоты кодирует вариабельный домен тяжелой цепи иммуноглобулина человека, а вторая последовательность нуклеиновой кислоты кодирует вариабельный домен легкой цепи иммуноглобулина человека.
[00058] В некоторых таких способах, антигенсвязывающие белки, продуцируемые генетически модифицированным F0-поколением отличного от человека животного, против представляющего интерес чужеродного антигена имеют более высокий титр, чем антигенсвязывающие белки, продуцируемые контрольным отличным от человека животным, которое является диким типом в геномном локусе-мишени после иммунизации контрольного отличного от человека животного представляющего интерес чужеродным антигеном. В некоторых таких способах, более разнообразный генетический репертуар антигенсвязывающих белков против представляющего интерес чужеродного антигена продуцируется генетически модифицированным F0-поколением отличного от человека животного после иммунизации генетически модифицированного F0-поколения отличного от человека животного представляющим интерес чужеродным антигеном по сравнению с антигенсвязывающими белками, продуцируемыми контрольным отличным от человека животным, которое является диким типом в геномном локусе-мишени после иммунизации контрольного отличного от человека животного интересующим чужеродным антигеном. В некоторых таких способах, антигенсвязывающие белки, продуцируемые генетически модифицированным F0-поколением отличного от человека животного, против представляющего интерес чужеродного антигена используют большее разнообразие сегментов тяжелой цепи V гена и/или сегментов легкой цепи V гена по сравнению с антигенсвязывающими белками, продуцируемыми контрольным отличным от человеком животным, которое является диким типом в геномном локусе-мишени после иммунизации контрольного отличного от человека животного представляющего интерес чужеродным антигеном. В некоторых таких способах, некоторые из антигенсвязывающих белков, продуцируемых генетически модифицированным F0-поколением отличных от человека животных, против представляющего интерес чужеродного антигена, перекрестно реагируют с аутоантигеном.
[00059] В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК, расположена в 5' положении относительно последовательности, распознаваемой второй направляющей РНК в геномном локусе-мишени, и стадия (a) (i) дополнительно включает в себя проведение анализа удерживания для определения того, что число копий равно 2 для участка в 5' положении и в пределах около 1 т.п.о. последовательности, распознаваемой первой направляющей РНК, и/или для участка в 3' положении и в пределах около 1 т.п.о. последовательности, распознаваемой второй направляющей РНК.
[00060] В некоторых таких способах, интересующий чужеродный антиген представляет собой ортолог аутоантигена. В некоторых таких способах, интересующий чужеродный антиген содержит весь или части белка человека.
[00061] В некоторых таких способах, геномный локус-мишень модифицируется так, чтобы содержать вставку одного или более нуклеотидов, делецию одного или более нуклеотидов, или замену одного или более нуклеотидов. Необязательно, делеция является точной делецией без случайных вставок и делеций (инделей).
[00062] В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона. В некоторых таких способах, последовательности, распознаваемые первой и второй направляющими РНК, различны, и каждая из последовательностей, распознаваемых первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона.
[00063] В некоторых таких способах, геномный локус-мишень модифицируют так, чтобы он содержал биаллельную делецию размером между от около 0,1 т.п.о. до около 200 т.п.о. В некоторых таких способах, модификация содержит биаллельную делецию всего или части гена, кодирующего аутоантиген. В некоторых таких способах, модификация содержит биаллельное разрушение старт-кодона гена, кодирующего аутоантиген.
[00064] В некоторых таких способах, стадия введения (a) (i) дополнительно включает введение в плюрипотентную клетку отличного от человека животного или эмбрион отличного от человека животного на одноклеточной стадии: (iv) третьей направляющей РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК в геномном локусе-мишени; и/или (v) четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК в геномном локусе-мишени.
[00065] В некоторых таких способах, клетка на стадии (a) (i) представляет собой плюрипотентную стволовую клетку отличного от человека животного, и все из белка Cas9, первой направляющей РНК, и второй направляющей РНК вводят в плюрипотентную стволовую клетку отличного от человека животного в форме ДНК. В некоторых таких способах, клетка на стадии (a) (i) представляет собой плюрипотентную стволовую клетку отличного от человека животного, и все из белка Cas9, первой направляющей РНК, и второй направляющей РНК вводят в плюрипотентную стволовую клетку отличного от человека животного путем электропорации или нуклеофекции. В некоторых таких способах, клетка на стадии (a) (i) представляет собой эмбрион отличного от человека животного на одноклеточной стадии, и все из белка Cas9, первой направляющей РНК, и второй направляющей РНК вводят в эмбрион отличного от человека животного на одноклеточной стадии в форме РНК. В некоторых таких способах, клетка на стадии (a) (i) представляет собой эмбрион отличного от человека животного на одноклеточной стадии, и все из белка Cas9, первой направляющей РНК, и второй направляющей РНК вводят в эмбрион отличного от человека животного на одноклеточной стадии путем пронуклеарной инъекции или цитоплазматической инъекции.
[00066] В некоторых таких способах, на стадии (a) (i) не вводится экзогенная матрица для репарации. В некоторых таких способах, стадия введения (a) (i) дополнительно включает введение в плюрипотентную клетку отличного от человека животного или эмбрион отличного от человека животного на одноклеточной стадии экзогенной матрицы для репарации, содержащий 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени, при условии, что если клетка на стадии (a) (i) представляет собой эмбрион отличного от человека животного на одноклеточной стадии, экзогенная матрица для репарации составляет не более чем около 5 т.п.о. в длину. Необязательно, экзогенная матрица для репарации дополнительно содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии. Необязательно, вставка нуклеиновой кислоты гомологична или ортологична геномному локусу-мишени. Необязательно, длина экзогенной матрицы для репарации находится в промежутке от около 50 нуклеотидов до около 1 т.п.о.. Необязательно, длина экзогенной матрицы для репарации находится в промежутке от около 80 нуклеотидов до около 200 нуклеотидов. Необязательно, экзогенная матрица для репарации представляет собой одноцепочечный олигодезоксинуклеотид. Необязательно, клетка на стадии (a) (i) представляет собой плюрипотентную клетку отличного от человека животного, и (а) экзогенная матрица для репараци представляет собой большой нацеливающий вектор (LTVEC), который имеет длину по меньшей мере 10 т.п.о.; или (b) экзогенная матрица для репараци представляет собой LTVEC, причем общая сумма 5'- и 3''-плечей гомологии LTVEC имеет длину по меньшей мере 10 т.п.о. Необязательно, геномный локус-мишень модифицирован, чтобы содержать делецию одного или более нуклеотидов, а последовательность удаленной нуклеиновой кислоты состоит из последовательности нуклеиновой кислоты между 5' и 3' последовательностями-мишенями. Необязательно, экзогенная матрица для репарации содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии, вставка нуклеиновой кислоты гомологична или ортологична удаленной последовательности нуклеиновой кислоты, геномный локус-мишень модифицирован, чтобы содержать делецию одного или более нуклеотидов, а вставка нуклеиновой кислоты замещает последовательность удаленной нуклеиновой кислоты.
[00067] В некоторых таких способах, отличное от человека животное содержит гуманизированный локус иммуноглобулина. В некоторых таких способах, отличное от человека животное представляет собой грызуна. Необязательно, грызун представляет собой мышь. Необязательно, линия мыши содержит линию BALB/c. Необязательно, указанная линия мышей содержит линии BALB/c, C57BL/6 и 129. Необязательно, линия мыши составляет 50% BALB/c, 25% C57BL/6 и 25% 129. Необязательно, гаплотип МНС мыши представляет собой MHCb/d.
[00068] В некоторых таких способах, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, вставленные в эндогенный локус иммуноглобулина мыши. Необязательно, неперестроенные генные сегменты вариабельного участка человека являются генными сегментами тяжелой цепи, а локус иммуноглобулина мыши является локусом тяжелой цепи, и/или в котором неперестроенные генные сегменты вариабельного участка человека являются сегментами легкой цепи каппа или лямбда, и локус иммуноглобулина мыши является локусом легкой цепи. Необязательно, мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, функционально связанные с геном константного участка мыши, причем мыши не имеют ген константного участка человека, и причем ген константного участка мыши находится в эндогенном локусе иммуноглобулина мыши. Необязательно, мышь содержит: (а) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (b) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (а) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (b) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека.
[00069] В некоторых таких способах, мышь содержит в своей зародышевой линии гуманизированный вариабельный локус легкой цепи иммуноглобулина, содержащий не более одной или не более двух перестроенных последовательностей V/J легкой цепи человека, функционально связанных с константным участком легкой цепи мыши, и при этом мышь дополнительно содержит вариабельный локус тяжелой цепи гуманизированного иммуноглобулина, содержащий по меньшей мере один неперестроенный V человека, по меньшей мере один неперестроенный D человека, и по меньшей мере один неперестроенный J сегмент человека, функционально связанный с геном константного участка тяжелой цепи мыши. Необязательно, мышь содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует одну легкую цепь. Необязательно, мышь содержит: (а) один перестроенный вариабельный участок легкой цепи иммуноглобулина человека (VL/JL), которая кодирует VL домен легкой цепи иммуноглобулина человека, причем один перестроенный участок VL/JL человека выбирается из генного сегмента Vκ1-39/Jκ5 человека или генного сегмента Vκ3-20/Jκ1 человека; и (b) замещение генных сегментов эндогенной тяжелой цепи (VH) одним или более генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном константного участка эндогенной тяжелой цепи (CH), а генные сегменты VH человека способны перестраиваться и формировать ген химерной тяжелой цепи человека/мыши. Необязательно, мышь экспрессирует популяцию антител, а зародышевая линия мыши содержит только один ген вариабельного участка легкой цепи каппа иммуноглобулина, который представляет собой перестроенный ген вариабельного участка легкой цепи каппа зародышевой линии человека, причем мышь является либо гетерозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина при этом он содержит только одну копию, или гомозиготной для одного гена вариабельного участка легкой цепи каппа иммуноглобулина, при этом он содержит две копии, причем мышь характеризуется активным созреванием аффинности, так что: (i) каждый легкая цепь каппа иммуноглобулина популяции содержит вариабельный домен легкой цепи, который кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, или его соматически мутированным вариантом; (ii) популяция содержит антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, и антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется их соматически мутированным варианты; и (iii) мышь образует разнообразный набор соматически мутированных высокоаффинных тяжелых цепей, которые успешно соединяются с легкими цепями каппа иммуноглобулина с образованием антител к популяции. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к мыши перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (b) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00070] В некоторых таких способах мышь, содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, причем мышь содержит последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши, и при этом эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека.
[00071] В некоторых таких способах, животное отличное от человека представляет собой мышь, которая по меньшей мере частично является производным от линий BALB/c, и мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является всем или частью белка человека, который является ортологичным для аутоантигена, в котором последовательность, распознаваемая первой направляющей РНК содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона, и причем модификация содержит биаллельную делецию всего или части гена, кодирующего аутоантиген, посредством чего исключается экспрессия аутоантигена. В некоторых таких способах, животное отличное от человека представляет собой мышь, которая по меньшей мере частично является производным от линии BALB/c, и мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген является всем или частью белка человека, который является ортологичным для аутоантигена, в котором последовательность, распознаваемая первой направляющей РНК, содержит стоп-кодон для гена, кодирующего аутоантиген и последовательность, распознаваемая второй направляющей РНК, содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона, и причем модификация содержит биаллельное разрушение старт-кодона для гена, кодирующего аутоантиген, причем исключается экспрессия аутоантигена. Необязательно, мышь содержит: (а) эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, является функциональным у самца мыши; (b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека, функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и (с) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (с) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека. Необязательно, мышь гетерозиготна или гомозиготна в своей зародышевой линии для: (а) эктопической последовательности нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог, или его фрагмент, являются функционирующим у самца мыши; (b) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина мыши к перестроенной последовательности Vκ/Jκ, содержащей: (i) одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ ID NO: 148 или SEQ ID NO: 149; и (ii) одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (с) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
[00072] В некоторых таких способах, плюрипотентная клетка отличного от человека животного представляет собой гибридную клетку или эмбрион отличного от человека млекопитающего на одноклеточной стадии представляет собой гибридный эмбрион на одноклеточной стадии, и при этом способ дополнительно включает: (а') сравнение последовательности пары соответствующих первой и второй хромосом в геномном локусе-мишени, и выбор участка-мишени в геномном локусе-мишени перед стадией приведения в контакт (а) на основе участка-мишени, имеющего более высокий процент идентичности последовательности между парой соответствующих первой и второй хромосом по отношению ко всей или части остальной части геномного локуса-мишени, причем участок-мишень содержит: последовательность, распознаваемую первой направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6, т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о. или 10 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне, или каждой стороне последовательности, распознаваемой первой направляющей РНК, и/или последовательности, распознаваемой второй направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6, т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о. или 10 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или каждой стороне последовательности, распознаваемой второй направляющей РНК. Необязательно, участок-мишень имеет более высокий процент идентичности последовательности между соответствующей первой и второй относительно остальной части геномного локуса-мишени. Необязательно, участок-мишень имеет по меньшей мере 99,9% идентичности последовательностей между парой соответствующих первой и второй хромосом, а остальная часть первого геномного локуса-мишени имеет не более чем 99,8% идентичности последовательности между парой соответствующих первой и второй хромосом.
[00073] В другом аспекте, представлены способы получения генетически модифицированного отличного от человека животного с уменьшенной толерантностью представляющего интерес чужеродного антигена, включающие: (а) введение в эмбрион отличного от человека животного на одноклеточной стадии или плюрипотентную клетку отличного от человека животного, которая не является эмбрионом на одноклеточной стадии: (i) белка Cas9; (ii) первой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой первой направляющей РНК в геномном локусе-мишени, причем геномный локус-мишень содержит весь или часть гена, кодирующего аутоантиген, гомологичный или обладающим общим представляющим интерес эпитопом с чужеродным представляющим интерес антигеном; и (iii) второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени; причем геномный локус-мишень модифицируется в паре соответствующих первой и второй хромосом для получения модифицированного эмбриона отличного от человека животного на одноклеточной стадии, или модифицированной плюрипотентной клетки отличного от человека животного с биаллельной модификацией, причем экспрессия аутоантигена устраняется; и (b) получение генетически модифицированного F0-поколения отличного от человека животного из модифицированного эмбриона на одноклеточной стадии отличного от человека или модифицированной плюрипотентной клетки отличного от человека животного, причем геномный локус-мишень модифицирован в паре соответствующих первых и вторых хромосом в генетически модифицированном F0-поколении отличного от человека животного, так что исключается экспрессия аутоантигена.
[00074] Такие способы могут включать, например, любой из вариантов, описанных выше для способов получения антигенсвязывающих белков против представляющего интерес чужеродного антигена. Например, в некоторых способах, клетка на стадии (а) представляет собой плюрипотентную стволовую клетку отличного от человека животного, и продуцирование генетически модифицированного F0-поколения отличного от человека животного на стадии (b) включает: (I) введение модифицированной плюрипотентной клетки отличного от человека животного в эмбрион-хозяин; и (II) имплантацию эмбриона-хозяина суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного в котором геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом, так что экспрессия аутоантигена устранена. Необязательно, плюрипотентная клетка представляет собой эмбриональную стволовую (ЭС) клетку. В некоторых таких способах, клетка на стадии (а) представляет собой эмбрион отличного от человека животного на одноклеточной стадии, и продуцирование генетически модифицированного F0-поколения отличного от человека животного на стадии (b) включает имплантацию модифицированного эмбриона отличного от человека животного на одноклеточной стадии суррогатной матери для получения генетически модифицированного F0-поколения отличного от человека животного, у которого геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом, так что экспрессия аутоантигена устранена. В некоторых таких способах, интересующий чужеродный антиген представляет собой ортолог аутоантигена. В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, а последовательность, распознаваемая второй направляющей РНК содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона. В некоторых таких способах, последовательности, распознаваемые первой и второй направляющими РНК, различны, и каждая из последовательностей, распознаваемых первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона. В некоторых таких способах, последовательность, распознаваемая первой направляющей РНК, расположена в 5' положении относительно последовательности, распознаваемой второй направляющей РНК в геномном локусе-мишени, и стадия (a) (i) дополнительно включает в себя выполнение анализа удерживания для определения числа копии для двух участков 5' и в пределах около 1 т.п.о. последовательности, распознаваемой первой направляющей РНК, и/или для участка 3' и в пределах около 1 т.п.о. последовательности, распознаваемой второй направляющей РНК. В некоторых таких способах, модификация содержит биаллельную делецию всего или части гена, кодирующего аутоантиген. В некоторых таких способах, модификация содержит биаллельное разрушение старт-кодона гена, кодирующего аутоантиген. В некоторых таких способах, отличное от человека животное представляет собой мышь.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[00075] На фигуре 1 изображен традиционный подход к нарушению иммунологической толерантности у мышей VELOCIMMUNE® (VI-3, гомозиготный гуманизированный как у IgH, так и Igx). В традиционном подходе гетерозиготные нокаутные (нулевые) аллели гена, кодирующего аутоантиген, гомологичный чужеродному антигену-мишени, создаются в эмбриональных стволовых клетках (ЭС) F1H4. Время от проектирования векторов нацеливания до получения F0 мышей, гетерозиготных для нокаута, составляет приблизительно 5 месяцев. Мыши VI-3 затем размножаются до F0 мышей, несущих гетерозиготную нокаутную мутацию у эндогенного гена, кодирующего аутоантиген, гомологичный интересующему чужеродному антигену-мишени. Чтобы получать трижды гомозиготных мышей (гомозиготных нулевых по интересующей мишени и гомозиготных гуманизированных как IgH, так и Igκ), подходящих для иммунизации, требуются два последующих поколения разведения. Весь процесс от проектирования векторов нацеливания до получения тройных гомозиготных мышей занимает приблизительно 15-16 месяцев.
[00076] На фигуре 2 изображен ускоренный процесс нарушения иммунологической толерантности у мышей VELOCIMMUNE® (VI-3) или у мышей «универсальная легкая цепь» (ULC или общая легкая цепь). В этом процессе, ЭС-клетки, полученные от мышей VI-3 или ULC, нацелены на создание гетерозиготных нулевых аллелей эндогенного гена, кодирующего аутоантиген, гомологичный представляющему интерес чужеродному антигену-мишени. Для получения гомозиготных нулевых клонов ЭС-клеток VI-3 или ULC требуются последовательные стадии нацеливания.
[00077] На фигуре 3 изображен дополнительный ускоренный процесс нарушения толерантности у мышей VELOCIMMUNE® (VI-3) или у мышей «универсальная легкая цепь» (ULC или общая легкая цепь). В этом процессе, ЭС-клетки VI-3 или ULC нацелены на CRISPR/Cas9 и парные направляющие РНК для получения гомозиготного разрушения эндогенного гена, кодирующего аутоантиген, гомологичный чужеродному антигену-мишени, представляющему интерес в течение одной стадии. TAQMAN® скрининг может включать, например, как анализ на потерю аллеля, так и анализ удерживания.
[00078] На фигуре 4 изображена общая схема одновременной делеции гена мыши, кодирующего аутоантиген, гомологичный чужеродному антигену-мишени, и его замещение маркером для селекции с помощью неомицина с использованием большого нацеливающего вектора (LTVEC) и спаренных вверх и вниз по ходу транскрипции направляющих РНК (gU и gD). Позиции сайтов расщепления Cas9, управляемые двумя направляющими РНК, обозначены стрелками ниже последовательности гена мыши. Зонды анализа TAQMAN® обозначены горизонтальными линиями, включая зонды для анализа удерживания и зонды для анализа на потерю аллеля (LOA) вверх по ходу, по середин и вниз по ходу транскрипции. Нижняя часть фигуры указывает на ожидаемые целевые типы аллелей.
[00079] На фигуре 5 изображена общая схема одновременной делеции мышиного гена, кодирующего аутоантиген, гомологичный чужеродному антигену-мишени, и его замещение маркером для селекции с помощью флоксированного неомицина и lacZ с использованием большого нацеливающего вектора (LTVEC) и трех перекрывающихся направляющих РНК каждая из которых нацеливается на старт-кодон ATG мыши. Направляющие РНК обозначены горизонтальными стрелками, а зонды анализа TAQMAN® обозначены обведенными горизонтальными линиями. Нижняя часть фигуры указывает на ожидаемые целевые типы аллелей.
[00080] На фигуре 6 изображены данные титра антител для антигена-мишени человека (мишень 8) у мышей «универсальная легкая цепь» (ULC 1-39) дикого типа и у мышей ULC 1-39, которые являются гомозиготными нулевыми по эндогенному гену, кодирующему ортологический аутоантиген к мишени 8 (аутоантиген 8).
[00081] На фигуре 7 изображено скрещивание, предпринятое для получения гибридных VGF1 (F1H4) ЭС-клеток (C57BL6 (XB6)/129S6(Y129)).
[00082] На фигуре 8 изображена схема одновременной делеции мышиного гена или части гена мыши и замены соответствующей человеческой версии с использованием LTVEC и одного или двух 5'-участков, среднего участка и 3'-участка гРНК. LTVEC изображен в верхней части фигуры, а локус гена мыши изображен в нижней части фигуры. Позиции сайтов расщепления Cas9, управляемые восемью направляющими РНК, обозначены вертикальными стрелками ниже последовательности гена мыши.
[00083] На фигуре 9А изображена общая схема одновременной делеции мышиного гена и замены соответствующей человеческой версии с использованием LTVEC и двух направляющих РНК (направляющие РНК А и В). LTVEC изображен в верхней части фигуры 9А, а локус гена мыши изображен в нижней части фигуры 9А. Позиции сайтов расщепления Cas9, управляемые двумя направляющими РНК, обозначены стрелками ниже последовательности гена мыши.
[00084] На фигурах 9В-9Е изображены уникальные биаллельные модификации (типы аллелей), которые происходят с большей частотой, когда используются две направляющие РНК. Толстые линии с диагональным штрихованием указывают на ген мыши, пунктирные линии указывают на делеции в гене мыши, а толстые черные линии указывают на вставку гена человека. На фигуре 9В изображены гомозиготные разрушенные аллели (большая CRISPR-индуцированная делеция). На фигуре 9С изображены гомозиготные аллели-мишени. На фигуре 9D изображены гемизиготные аллели-мишени. На фигуре 9Е изображены сложные гетерозиготные аллели.
[00085] На фигуре 10А и 10В изображены ПЦР-анализы, подтверждающие генотипы выбранных клонов. На фигуре 10А изображены результаты анализов ПЦР длинных фрагментов для выбранных клонов ЭС-клеток с использованием праймеров m-lr-f и m-5'-r, которые устанавливают связь между человеческой вставкой и последовательностями вне тех, которые гомологичны 5'-плечу гомологии, тем самым подтверждая правильность нацеливания. На фигуре 10В изображены результаты ПЦР анализа 5' Del J, 5' Ins J, Del A + F и Del A + E2. 5' Del J изображает продукты ПЦР с использованием праймеров m-5'-f и m-5-r, который амплифицирует последовательность дикого типа, окружающую сайт расщепления гРНК А, для установления удержания или потери этой последовательности. 5' Ins J изображает продукты ПЦР с использованием праймеров m-5'-f и h-5'-r, которые устанавливают связь между человеческой вставкой и геномом мыши. Анализ даст положительный результат как для целевых, так и для случайных интегрированных клонов. Del А+F изображает ожидаемый размер ампликона (359 п.о.) и фактические полосы для большой делеции, опосредуемые двойным расщеплением гРНК А и F в клонах BO-F10 и AW-А8. Del А + Е2 изображает ту же идею для клона ВА-А7. NT указывает на отсутствие шаблона, +/+ указывает на родительский VGF1 гибрид ЭС-клетки контроля дикого типа, Н/+указывает на гетерозиготный гуманизированный генотип, H/Δ указывает на гемизиготный гуманизированный генотип, Н/Н указывает на гомозиготный гуманизированный генотип, и Δ/Δ указывает на гомозиготный удаленный генотип.
[00086] На фигуре 11А-11С изображен анализ флуоресценции in situ гибридизации (FISH) клонов ЭС-клетки AW-D9 мыши (фигура 11А) и BA-D5 (фигура 11С), которые были нацелены на Lrp5 гуманизацию LTVEC в сочетании с Cas9 и двумя гРНК, и клона BS-C4 (фигура 11В), который был нацелен только на LTVEC. Стрелки указывают положение сигналов гибридизации на полосе В хромосомы 19. Красный сигнал указывает на гибридизацию только с зондом мыши (пунктирная стрелка, фигура 11В). Желтый смешанный цветовой сигнал указывает на гибридизацию как с красным зондом мыши, так и с зеленым человеческим зондом. Одна полоса В хромосомы 19, имеющая красный сигнал (пунктирная стрелка) и другая полоса Б хромосомы 19, имеющая желтый сигнал (сплошная стрелка), подтвердила нацеленность на правильный локус и гетерозиготный генотип для клона BS-C4 (фигура 11В). Полосы В обеих хромосом 19, имеющие желтый сигнал (сплошные стрелки, фигуры 11А и 11С), подтвердили нацеленность на правильный локус и гомозиготные генотипы для AW-D9 и В5-С4-клонов.
[00087] На фигуре 12 изображена схема хромосомы 19 с анализами, предназначенными для изучения событий генной конверсии или митотической рекомбинации, опосредованных двумя направляющими РНК, путем анализа потери гетерозиготности (LOH) в гибридных ЭС-клетках VGF1. Примерные положения числа хромосомных копий зондов количественной ПЦР (CCN) TAQMAN® изображены стрелками. Примерные положения ПЦР-зондов с полиморфизмом структурного варианта (SV) изображены двойной скобкой с их расстояниями (в Мб) отлокуса Lrp5, приведенного выше. Примерные положения аллельных дискриминационных зондов TAQMAN® с одиночным нуклеотидным вариантом (SNV) изображены стрелками с их расстояниями (в Мб) от локуса Lrp5, приведенного ниже. Положения последовательностей узнавания гРНК для F, Е2, D, В2 и А изображены диагональными стрелками над изображением гена Lrp5.
[00088] На фигуре 13А и 13В изображен анализ флуоресценции in situ гибридизации (FISH) клонов ЭС-клеток мыши Q-E9 (фигура 13А) и О-Е3 (фигура 13В), которые были нацелены на Hc гуманизацию LTVEC в сочетании с Cas9 и двумя гРНК. Стрелки указывают положение сигналов гибридизации на полосе В хромосомы 2. Красный сигнал указывает на гибридизацию только с зондом мыши (пунктирная стрелка, фигура 13А). Желтый смешанный цветовой сигнал указывает на гибридизацию как с красным зондом мыши, так и с зеленым человеческим зондом (сплошная стрелка). Одна полоса В хромосомы 2, имеющая красный сигнал (пунктирная стрелка) и другая полоса В хромосомы 2, имеющая желтый сигнал (сплошная стрелка), подтвердила нацеленность на правильный локус и гетерозиготный генотип для клона Q-E9 (фигура 13А). Полосы В обеих хромосом 2, имеющие желтый сигнал (сплошные стрелки, фигура 13В), подтвердили нацеленность на правильный локус и гомозиготные генотипы для О-Е3 клона.
[00089] На фигуре 14 изображена схема хромосомы, содержащей ген С5 мыши, с анализами, предназначенными для изучения событий генной конверсии или митотической рекомбинации, опосредованных двумя направляющими РНК, путем анализа потери гетерозиготности (LOH) в гибридных ЭС-клетках VGF1. Примерные положения ПЦР-зондов с полиморфизмом структурного варианта (SV) изображены горизонтальными стрелками с их расстояниями (в Мб) от локуса С5, приведенного выше. Положения последовательностей узнавания гРНК для Е2 и А изображены диагональными стрелками над изображением гена С5.
[00090] На фигурах 15А-15Е изображены результаты анализа структурных вариаций (SV) клонов BR-В4, BP-G7, BO-G11, BO-F10, В0-А8 и ВС-Н9 с VGF1 (F1H4), 129 и ДНК В6 используется в качестве контроля. Анализы проводили на следующих расстояниях теломера до локуса Lrp5: 13,7 Мб (фигура 15А), 20,0 Мб (фигура 15В), 36,9 Мб (фигура 15С), 48,3 Мб (фигура 15D) и 56,7 Мб (фигура 15Е). Положения продуктов ПЦР для аллелей В6 и 129 изображены стрелками.
[00091] На фигурах 16А-16С изображены графики аллельной дискриминации для 0,32 Мб центромера Lrp5 (фигура 16А), 1,2 Мб теломера Lrp5 (фигура 16В) и 57,2 Мб теломера Lrp5 (фигура 16С). Значения на каждой оси представляют собой относительную интенсивность флуоресценции. На графиках изображены четыре репликации для каждого образца, которые изображены как закрашенные точки (аллель В6), открытые точки (129 аллелей) и точки с диагональными линиями (оба аллеля В6/129).
[00092] На фигурах 17А-17С схематично изображен возможный механизм митотической рекомбинации во время фазы G2 клеточного цикла, который может продуцировать гомозиготные события и широко распространенную генную конверсию, обнаруженную потерей гетерозиготности. На фигуре 17А изображены реплицированные гомологичные хромосомы, показывающие две хроматиды в гибридной 129/В6 ЭС-клетке, гетерозиготной для целевой гуманизации на 129 гомологе. Двусторонние стрелки указывают на потенциальные разрывы двойной цепи, генерируемые двойным гРНК-направленным расщеплением Cas9, которые способствуют взаимному обмену путем гомологичной рекомбинации между хроматидами на гомологичных хромосомах, показанных как перекрестное на центромерной стороне целевого аллеля, получающиеся в результате чего гибридные хроматиды изображены на фигуре 17В. На фигуре 17С изображено, что после митоза и деления клеток возможны четыре типа сегрегации хромосом в дочерние клетки. Два с удерживанием гетерозиготности, гетерозиготы родительского типа (Hum/+, верхний левый) и гетерозиготы равного обмена (Hum/+, верхний правый) не могут быть различимы с помощью анализа LOH. Два других показывают потерю гетерозиготности, гуманизированной гомозиготы (Hum/Hum, например, клона ВО-А8, нижний левый) с потерей теломерных В6-аллелей и гомозиготы дикого типа (+/+, нижний правый) с потерей теломерных 129 аллелей. Этот последний тип будет потерян, потому что он не сохранит кассету резистентности к лекарственным средствам гуманизированной аллели.
[00093] На фигурах 18A-18F изображены возможные механизмы, объясняющие наблюдаемые результаты, включая потерю гетерозиготности (LOH), в экспериментах по гуманизации с помощью CRISPR/Cas9 в гибридных ЭС-клетках мышей F1 с одним гаплоидным хромосомным комплементом, полученным из линии мыши 129S6/SvEvTac и одного гаплоидного хромосомного комплемента, полученного из линии мыши C57BL/6NTac (В6). На фигуре 18А изображен реципрокный хроматидный обмен с помощью митотического кроссовера, где гетерозиготная модификация происходит на хромосоме 129 до репликации генома или после репликации генома с последующей конверсией генов между сестринскими хроматидами. На фигуре 18В изображен реципрокный хроматидный обмен с помощью митотического кроссовера, где после репликации генома модифицируется одна хроматида 129. На фигуре 18С изображен реципрокный хроматидный обмен с помощью митотического кроссовера, где не было нацеливания LTVEC, но расщепление Cas9 происходило либо на хромосоме 129, либо на хромосоме В6 (изображено расщепление В6). На фигуре 18D изображено хроматидное копирование путем вызванной разрывом репликацией, где гетерозиготная модификация происходит на хромосоме 129 до репликации генома или после репликации генома с последующей конверсией генов между сестринскими хроматидами. На фигуре 18Е изображено хроматидное копирование путем вызванной разрывом репликацией, где после репликации генома модифицируется одна хроматида 129. На фигуре 18F изображено хроматидное копирование путем вызванной разрывом репликацией, где не было нацеливания LTVEC, но расщепление Cas9 происходило либо на хромосоме 129, либо на хромосоме В6 (изображено расщепление В6).
[00094] На фигуре 19 изображена схема локуса Lrp5 мыши, являющегося мишенью для делеции и замены соответствующим локусом LRP5 человека с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[00095] На фигуре 20 изображена схема локуса Нc мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[00096] На фигуре 21 изображена схема локуса Trpa1 мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[00097] На фигуре 22 изображена схема локуса Adamts5 мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[00098] На фигуре 23 изображена схема локуса Folh1 мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[00099] На фигуре 24 изображена схема локуса Dpp4 мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[000100] На фигуре 25 изображена схема локуса Ror1 мыши, являющегося мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[000101] На фигуре 26 изображена схема локуса мыши, включающую ген, кодирующий трансмембранный белок; локус мыши является мишенью для делеции и замены соответствующей человеческой версией с использованием LTVEC и одной или более гРНК в гибридных ЭС-клетках VGF1. Прямоугольники представляют разные гены в геномном участке-мишени. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с вариантом MP линии 129S6/SvEv от Taconic Biosciences, вариантом RGC линии C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Варианты MP и RGC - это разные мыши из одной и той же линии. Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[000102] На фигурах 27А-27С схематично изображен возможный механизм митотической рекомбинации во время фазы G2 клеточного цикла, который может продуцировать гомозиготные события и генную конверсию, обнаруженную с помощью локальной потери гетерозиготности. На фигуре 27А изображены реплицированные гомологичные хромосомы, показывающие две хроматиды в гибридной 129/В6 ЭС-клетке, гетерозиготной для целевой гуманизации на 129 гомологе. Гетерозиготная модификация в 129 гомологе происходит до репликации генома, или одна 129 хроматида модифицируется после репликации генома с последующей межхроматидной конверсией генов. Двусторонние стрелки указывают на потенциальные разрывы двойной цепи, генерируемые двойным гРНК-направленным расщеплением Cas9, которые способствуют двунитевому внедрению и синтез-направленной репарации, показанным диагональными пунктирными стрелками, что приводит к гибридным хроматидам, полученным с помощью события преобразования генов, которое копирует небольшую часть одной модифицированной хроматиды, как изображено на фигуре 27В. На фигуре 27С изображено, что после митоза и деления клеток возможны два типа сегрегации хромосом в дочерние клетки: один с сохранением гетерозиготности (гетерозиготы родительского типа (Hum/+, верхний) без потери гетерозиготности, и один с локальной потерей гетерозиготности, окружающей целевую модификацию (Hum/Hum, нижний, сохраняет 129 аллели).
[000103] На фигуре 28 изображена эффективность CRISPR/Cas9-опосредуемой делеции в эмбриональных стволовых клетках (ЭС) VI-3 и ULC 1-39 для различных мишеней аутоантигена разных размеров с использованием парных направляющих РНК, нацеленных на участки старт- и стоп-кодона генов, кодирующих аутоантигены, отдельно или в сочетании с большим вектором нацеливания.
[000104] На фигуре 29 изображено процентное содержание щенков мыши, полученных с разрушенными аллелями, после нацеливания эмбрионов на одноклеточной стадии VI-3 и ULC 1-39 с помощью CRISPR/Cas9 с целью нацеливания на различные аутоантигены-мишени разных размеров для делеции с использованием парных направляющих РНК, нацеленных на участки старт- и стоп-кодона генов, кодирующих аутоантигены.
[000105] На фигуре 30А и 30В изображены данные титра антител для антигена-мишени человека (Мишень 9) у мышей дикого типа VI-3-Adam6 (фигура 30 В) и у мышей VI3-Adam6, которые являются гомозиготными нулевыми по эндогенному гену, кодирующему аутоантиген ортолога к Мишени 9 (аутоантиген 9) (фигура 30А) после иммунизации с ДНК полной длины мишени 9 на родительских клетках VI-3T3 и клетках VI-3T3, сконструированных для экспрессии мишени 9.
[000106] Фигуры 31А и 31В показывают данные титра антител для антигена-мишени человека (мишень 4) и для соответствующего ортологичного аутоантигена мыши (аутоантиген 4). На фигуре 31А изображены данные титра антител для мишени 4 человека и аутоантигена 4 мыши у мышей VI3-Adam6, которые являются гомозиготными нулевыми по эндогенному гену, кодирующему аутоантиген 4. На фигуре 31В изображены данные титра антител для комбинации мишени 4 человека и аутоантигена 4 мыши у мышей ULC 1-39, которые являются гомозиготными нулевыми по эндогенному гену, кодирующему аутоантиген 4.
[000107] На фигуре 32 изображена схема для локуса тяжелой цепи иммуноглобулина вверху) и локусов легкой цепи иммуноглобулина (снизу) у мышей VI3-Adam6 и ULC 1-39, каждая из которых имеет генетический фон 50% BALB/cTac, 25% C57BL/6NTac и 25% 12956/SvEvTac. У мышей VI3-Adam6 эндогенный вариабельный участок тяжелой и легкой цепи иммуноглобулина мыши заменен соответствующей ДНК человека вместе с повторно вставленными генами Adam6 мыши (Adam6b и Adam6a, представленными с помощью трапеций). У мышей «универсальная легкая цепь» (ULC 1-39) эндогенный вариабельный участок тяжелой и легкой цепи иммуноглобулина мыши заменен соответствующей ДНК человека вместе с повторно вставленным геном Adam6 мыши, а вариабельный участок легкой цепи иммуноглобулина содержит одну перестроенную нуклеотидную последовательность легкой цепи иммуноглобулина человека (Vκ1-39/Jκ5), функционально связанную с промотором hV/κ3-15. Человеческие сегменты изображены черным цветом, а сегменты мыши обозначены диагональными линиями.
ОПРЕДЕЛЕНИЯ
[000108] Термины «белок», «полипептид» и «пептид», используемые в данном документе взаимозаменяемо, включают полимерные формы аминокислот любой длины, включая кодированные и не кодированные аминокислоты и химически или биохимически модифицированные, или дериватизированные аминокислоты. Термины также включают полимеры, которые были модифицированы, такие как полипептиды, имеющие модифицированные пептидные остовы.
[000109] Говорят, что белки имеют «N-конец» и «С-конец». Термин «N-конец» относится к началу белка или полипептида, который заканчивается аминокислотой со свободной аминогруппой (-NH2). Термин «С-конец» относится к концу аминокислотной цепи (белка или полипептида), который заканчивается свободной карбоксильной группой (-СООН).
[000110] Термины «нуклеиновая кислота» и «полинуклеотид», используемые в данном документе взаимозаменяемо, включают полимерные формы нуклеотидов любой длины, включая рибонуклеотиды, дезоксирибонуклеотиды или аналоги или их модифицированные варианты. Они включают одно-, двух- и многоцепочечную ДНК или РНК, геномную ДНК, кДНК, гибриды ДНК-РНК и полимеры, содержащие пуриновые основания, пиримидиновые основания или другие природные, химически модифицированные, биохимически модифицированные, неприродные или дериватизированные нуклеотидные основания.
[000111] Говорят, что нуклеиновые кислоты имеют «5' концы» и «3' концы», поскольку мононуклеотиды подвергают взаимодействию с образованием олигонуклеотидов таким образом, что 5'-фосфат одного мононуклеотидного пентозного кольца присоединен к 3'-кислороду его соседа в одном направлении через фосфодиэфирную связь. Конец олигонуклеотида упоминают как «5' конец», если его 5'-фосфат не связан с 3'-кислородом мононуклеотидного пентозного кольца. Конец олигонуклеотида упоминают как «3' конец», если его 3'-кислород не связан с 5'-фосфатом другого мононуклеотидного пентозного кольца. Последовательность нуклеиновой кислоты, даже если она внутренняя по отношению к более крупному олигонуклеотиду, также может быть упомянута как имеющая 5' и 3' концы. В линейной или круговой молекуле ДНК, дискретные элементы упоминаются как находящиеся «вверх по ходу транскрипции» или 5' «вниз по ходу транскрипции» или 3'-элементы.
[000112] Термин «дикий тип» включает в себя объекты, имеющие структуру и/или активность, которые находятся в нормальном (в отличие от мутантного, больного, измененного или так далее) состоянии или контексте. Ген дикого типа и полипептиды часто существуют в нескольких разных формах (например, аллелях).
[000113] Термин «изолированный» по отношению к белкам и нуклеиновой кислоте включает белки и нуклеиновые кислоты, которые относительно очищены по отношению к другим бактериальным, вирусным или клеточным компонентам, которые обычно могут присутствовать in situ, вплоть до и в том числе практически чистого препарата белка и полинуклеотида. Термин «изолированный» также включает белки и нуклеиновые кислоты, которые не имеют аналога природного происхождения, которые были химически синтезированы и, таким образом, по существу не загрязнены другими белками или нуклеиновыми кислотами, или были отделены или очищены от большинства других клеточных компонентов, которые их естественно сопровождают (например, другие клеточные белки, полинуклеотиды или клеточные компоненты).
[000114] «Экзогенные» молекулы или последовательности включают молекулы или последовательности, которые обычно не присутствуют в клетке в этой форме. Нормальное присутствие включает присутствие по отношению к конкретной стадии развития и условиям окружающей среды клетки. Экзогенная молекула или последовательность, например, может включать мутированный вариант соответствующей эндогенной последовательности в клетке, такой как гуманизированный вариант эндогенной последовательности, или может включать последовательность, соответствующую эндогенной последовательности внутри клетки, но в другой форме (т.е. не внутри хромосомы). Напротив, эндогенные молекулы или последовательности включают молекулы или последовательности, которые обычно присутствуют в этой форме в конкретной клетке на конкретной стадии развития в конкретных условиях окружающей среды.
[000115] «Оптимизация кодонов» обычно включает в себя способ модификации последовательности нуклеиновой кислоты для улучшения экспрессии в конкретных клетках-хозяевах путем замены по меньшей мере одного кодона нативной последовательности кодоном, который чаще или чаще всего используется в генах клетки хозяина, сохраняя при этом нативную аминокислотную последовательность. Например, полинуклеотид, кодирующий белок Cas9, может быть модифицирован для замены кодонов, имеющих более высокую частоту использования в данной прокариотической или эукариотической клетке, включая бактериальную клетку, дрожжевую клетку, клетку человека, не человеческую клетку, клетку млекопитающего, клетку грызуна, клетку мыши, клетку крысы, клетку хомяка или любую другую клетку-хозяина по сравнению с последовательностью нуклеиновой кислоты естественного происхождения. Таблицы использования кодонов легко доступны, например, в «Базе данных использования кодонов». Эти таблицы могут быть адаптированы несколькими способами. См. Nakamura et al. (2000) Nucleic Acids Research 28: 292, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Также доступны компьютерные алгоритмы оптимизации кодонов конкретной последовательности для экспрессии в конкретном хозяине (см., например, Gene Forge).
[000116] Термин «локус» относится к определенному местоположению гена (или значительной последовательности), последовательности ДНК, последовательности, кодирующей полипептид, или положения на хромосоме генома организма. Например, «локус Lrp5» может относиться к конкретному местоположению гена Lrp5, последовательности ДНК Lrp5, LRP5-кодирующей последовательности, или позиции Lrp5 на хромосоме генома организма, которая была идентифицирована относительно того, где такая последовательность находится. «Локус Lrp5» может содержать регуляторный элемент гена Lrp5, включая, например, энхансер, промотор, 5' и/или 3' UTR, или их комбинацию.
[000117] Термин «ген» относится к последовательности ДНК в хромосоме, которая кодирует продукт (например, РНК-продукт и/или полипептидный продукт) и включает кодирующий участок, прерванный не кодирующими интронами и последовательность, расположенную рядом с кодирующим участком на обоих концах 5' и 3', так что ген соответствует полноразмерной мРНК (включая 5' и 3' не транслируемые последовательности). Термин «ген» также включает другие не кодирующие последовательности, включая регуляторные последовательности (например, промоторы, энхансеры и сайты связывания с транскрипционным фактором), сигналы полиаденилирования, внутренние сайты входа рибосомы, сайленсеры, изоляционную последовательность и участок прикрепления матриц. Эти последовательности могут быть близки к кодирующему участку гена (например, в пределах 10 т.п.о.) или на отдаленных сайтах, и они влияют на уровень или скорость транскрипции и трансляции гена.
[000118] Термин «аллель» относится к вариантной форме гена. Некоторые гены имеют множество различных форм, которые расположены на одном и том же положении, или генетическом локусе, на хромосоме. Диплоидный организм имеет два аллеля в каждом генетическом локусе. Каждая пара аллелей представляет генотип определенного генетического локуса. Генотипы описываются как гомозиготные, если есть два идентичных аллеля в определенном локусе, и как гетерозиготные, если эти два аллеля отличаются друг от друга.
[000119] «Промотор» представляет собой регуляторный участок ДНК, обычно содержащий бокс TATA, способный направлять РНК-полимеразу II для инициации синтеза РНК на соответствующем сайте инициации транскрипции для конкретной полинуклеотидной последовательности. Промотор может дополнительно содержать другие участки, которые влияют на скорость инициации транскрипции. Описанные в данном документе промоторные последовательности модулируют транскрипцию функционально связанного полинуклеотида. Промотор может быть активным в одном или более типах клеток, описанных в данном документе (например, эукариотическая клетка, клетка млекопитающего отличного от человека, клетка человека, клетка грызуна, плюрипотентная клетка, эмбрион на одноклеточной стадии, дифференцированная клетка или их комбинация). Промотором может быть, например, конститутивно активный промотор, условный промотор, индуцируемый промотор, временно ограниченный промотор (например, промотор, регулируемый развитием), или пространственно ограниченный промотор (например, клетка специфический или тканеспецифический промотор). Примеры промоторов можно найти, например, в WO 2013/176772, включенном в данный документ в качестве ссылки во всей своей полноте.
[000120] Примеры индуцируемых промоторов включают, например, химически регулируемые промоторы и физически регулируемые промоторы. Химически регулируемые промоторы включают, например, алкоголь-регулируемые промоторы (например, промотор гена алкогольдегидрогеназы (alcA)), тетрациклин-регулируемые промоторы (например, тетрациклин-реагирующий промотор, последовательность оператора тетрациклина (tetO), tet-On промотор, или промотор tet-Off), промоторы, регулируемые стероидами (например, глюкокортикоидный рецептор крысы, промотор рецептора эстрогена или промотор рецептора экдисона) или промоторы, регулируемые металлом (например, промотор металлопротеина). Физически регулируемые промоторы включают, например, температура-регулируемые промоторы (например, промотор теплового шока) и светорегулируемые промоторы (например, светоиндуцируемый промотор или светоингибируемый промотор).
[000121] Тканеспецифическими промоторами могут быть, например, нейрон-специфические промоторы, глия-специфические промоторы, промоторы, специфичные для мышечных клеток, промоторы, специфичные для клеток сердца, промоторы, специфичные для клеток почек, промоторы, специфичные для костных клеток, промоторы, специфичные для эндотелиальных клеток, или промоторы, специфичные для иммунной клетки (например, промотор В-клеток или промотор Т-клеток).
[000122] Регулируемые в процессе развития промоторы включают, например, промоторы, активные только во время эмбриональной стадии развития или только во взрослой клетке.
[000123] «Функциональная связь» или «функционально связанный» включает в себя смежное расположение двух или более компонентов (например, промотора и другого элемента последовательности), так что оба компонента функционируют нормально и позволяют, чтобы по меньшей мере один из компонентов мог опосредовать функцию, которая влияет по меньшей мере на один из других компонентов. Например, промотор может быть функционально связан с кодирующей последовательностью, если промотор контролирует уровень транскрипции кодирующей последовательности в ответ на наличие или отсутствие одного, или более регуляторных факторов транскрипции. Функциональная связь может включать в себя такие последовательности, которые смежны друг с другом или действуют в транс (например, регуляторная последовательность может действовать на расстоянии, чтобы контролировать транскрипцию кодирующей последовательности). В качестве другого примера последовательность нуклеиновой кислоты вариабельного участка иммуноглобулина (или сегментов V(D)J) может быть функционально связана с последовательностью нуклеиновой кислоты константного участка иммуноглобулина, чтобы обеспечить надлежащую рекомбинацию между последовательностями в последовательность тяжелой или легкой цепи иммуноглобулина.
[000124] «Комплементарность» нуклеиновых кислот означает, что нуклеотидная последовательность в одной цепи нуклеиновой кислоты, обусловленная ориентацией групп ее нуклеотидных оснований, образует водородные связи с другой последовательностью на противоположной нити нуклеиновой кислоты. Комплементарные основания в ДНК, как правило, A c T и C c G. В РНК они, как правило, С с G и U с А. Комплементарность может быть идеальной или существенной/достаточной. Идеальная комплементарность между двумя нуклеиновыми кислотами означает, что две нуклеиновые кислоты могут образовывать дуплекс, в котором каждое основание дуплекса связано с комплементарным основанием путем спаривания Ватсона-Крика. «Существенная» или «достаточная» комплементарность означает, что последовательность в одной цепи не является полностью и/или идеально комплементарной последовательности в противоположной цепи, но что между связями между двумя нитями происходит достаточное связывание с образованием стабильного гибридного комплекса в наборе условий гибридизации (например, концентрации соли и температуры). Такие условия могут быть предсказаны с использованием последовательностей и стандартных математических расчетов для прогнозирования Tm (температуры плавления) гибридизованных нитей, или путем эмпирического определения Tm с использованием обычных способов. Tm включает температуру, при которой популяция комплексов гибридизации, образованных между двумя цепями нуклеиновой кислоты, на 50% денатурирована (т.е. популяция двухцепочечных молекул нуклеиновой кислоты становится наполовину диссоциированной в отдельные нити). При температуре ниже Tm предпочтительным является образование гибридизационного комплекса, тогда как при температуре выше Tm предпочтение отдается плавлению или разделению нитей в комплексе гибридизации. Tm может быть оценена для нуклеиновой кислоты, имеющей известное содержание G+C в водном 1 М растворе NaCl, используя, например, Tm=81,5+0,41 (% G+C), хотя другие известные вычисления Tm учитывают структурные характеристики нуклеиновой кислоты.
[000125] «Условие гибридизации» включает в себя кумулятивную окружающую среду, в которой одна цепь нуклеиновой кислоты связывается со второй цепью нуклеиновой кислоты с помощью комплементарных взаимодействий цепи и водородной связи для получения комплекса гибридизации. Такие условия включают химические компоненты и концентрации их (например, соли, хелатирующие агенты, формамид) водного или органического раствора, содержащего нуклеиновые кислоты, и температуру смеси. Другие факторы, такие как продолжительность инкубации или размеры реакционной камеры, могут вносить вклад в окружающую среду. См., например, Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Pp. 1.90-1.91, 9.47-9.51, 1 1.47-11.57 (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989), включенную в данный документ в качестве ссылки во всей своей полноте для всех целей.
[000126] Гибридизация требует, чтобы две нуклеиновые кислоты содержали комплементарные последовательности, хотя возможны несоответствия между основаниями. Условия, подходящие для гибридизации между двумя нуклеиновыми кислотами, зависят от длины нуклеиновых кислот и степени комплементарности, которые хорошо известны в данной области техники. Чем больше степень комплементарности между двумя нуклеотидными последовательностями, тем больше значение температуры плавления (Tm) для гибридов нуклеиновых кислот, имеющих эти последовательности. Для гибридизации между нуклеиновыми кислотами с короткими участками комплементарности (например, комплементарность более 35 или менее, 30 или менее, 25 или менее, 22 или менее, 20 или менее, или 18 или менее нуклеотидов) положения несовпадений становится важным (см. Sambrook et al., выше, 11.7-11.8). Как правило, длина гибридизуемой нуклеиновой кислоты составляет по меньшей мере около 10 нуклеотидов. Иллюстративные минимальные длины гибридизуемой нуклеиновой кислоты включают по меньшей мере около 15 нуклеотидов, по меньшей мере около 20 нуклеотидов, по меньшей мере около 22 нуклеотидов, по меньшей мере около 25 нуклеотидов и по меньшей мере около 30 нуклеотидов. Кроме того, температура и концентрация соли промывочного раствора могут быть скорректированы по мере необходимости в соответствии с такими факторами, как длина участка комплементации и степень комплементации.
[000127] Последовательность полинуклеотида не должна быть на 100% комплементарной таковой нуклеиновой кислоте-мишени, которая может быть специфически гибридизуема. Более того, полинуклеотид может гибридизоваться по одному или более сегментам таким образом, что промежуточные или смежные сегменты не участвуют в событии гибридизации (например, структура петли или структура шпильки). Полинуклеотид (например, гРНК) может содержать по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 99% или 100% комплементарности последовательности к мишени в пределах последовательности нуклеиновой кислоты-мишени, к которой они нацелены. Например, гРНК, в которой 18 из 20 нуклеотидов являются комплементарными мишени и, следовательно, специфически гибридизуются, будет представлять собой 90% комплементарность. В этом примере оставшиеся не комплементарные нуклеотиды могут быть сгруппированы или чередоваться с комплементарными нуклеотидами и не должны быть смежными друг с другом или с комплементарными нуклеотидами.
[000128] Процентную комплементарность между отдельными участками последовательностей нуклеиновых кислот в нуклеиновых кислотах можно определить с помощью программ BLAST (базовых инструментов поиска локального выравнивания) и программ PowerBLAST, известных в данной области техники (Altschul et al. (1990) J. Mol. Biol. 215:403-410; Zhang and Madden (1997) Genome Res. 7: 649-656) или с помощью программы Gap (пакет анализа последовательностей Висконсина, версия 8 для Unix, Genetics Computer Group, University Research Park, Madison Wis.), используя настройки по умолчанию, в которых используется алгоритм Smith and Waterman (Adv. Appl. Math., 1981, 2, 482-489).
[000129] Способы и композиции, представленные в данном документе, используют множество различных компонентов. В описании повсеместно признается, что некоторые компоненты могут иметь активные варианты и фрагменты. К таким компонентам относятся, например, белки Cas9, CRISPR РНК, малая некодирующая РНК и направляющие РНК. Биологическая активность для каждого из этих компонентов описана в другом месте данного документа.
[000130] «Идентификация последовательности» или «идентификация» в контексте двух полинуклеотидов или полипептидных последовательностей делает ссылку на остатки в двух последовательностях, которые являются одинаковыми, если они выровнены для максимального соответствия в определенном окне сравнения. Когда процент идентичности последовательности используется в отношении белков, признано, что положения остатков, которые не идентичны, часто отличаются консервативными аминокислотными заменами, где аминокислотные остатки замещены для других аминокислотных остатков с аналогичными химическими свойствами (например, заряд или гидрофобность) и, следовательно, не меняют функциональных свойств молекулы. Когда последовательности отличаются консервативными заменами, процентная идентичность последовательности может быть скорректирована вверх, чтобы исправить консервативный характер замещения. Говорят, что последовательности, которые отличаются такими консервативными заменами, имеют «сходство последовательностей» или «сходство». Средства для осуществления этой коррекции хорошо известны специалистам в данной области техники. Как правило, это включает в себя оценку консервативной замены как частичного, а не полного несоответствия, тем самым увеличивая идентичность последовательности в процентах. Так, например, когда идентичной аминокислоте дается оценка 1, а неконсервативной замене дается оценка ноль, консервативной замене дается оценка между нулем и 1. Оценка консервативных замен рассчитывается, например, как реализовано в программе PC/GENE (Intelligenetics, Маунтин Вью, Калифорния).
[000131] «Процент идентичности последовательностей» включает в себя значение, определяемое путем сравнения двух последовательностей с оптимальным выравниванием по сравнению с окном сравнения, причем часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. промежутки) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определения количества положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток появляется в обеих последовательностях, для получения количества совпадающих положений, деля количество совпадающих положений на общее количество положений в окне сравнения, и умножая результат на 100, чтобы получить процент идентичности последовательности.
[000132] Если не указано иное, значения идентичности/сходства последовательности включают значение, полученное с использованием GAP версия 10, используя следующие параметры: % идентичности и % сходства для нуклеотидной последовательности с использованием GAP Вес 50 и Длина Вес 3, и матрицу подсчета nwsgapdna.cmp; % идентичности и % сходства для аминокислотной последовательности с использованием GAP Вес 8 и Длина Вес 2 и матрицы подсчета BLOSUM62; или любую их эквивалентную программу. «Эквивалентная программа» включает в себя любую программу сравнения последовательностей, которая для любых двух последовательностей вопроса генерирует выравнивание, имеющее идентичные нуклеотидные или аминокислотные совпадения остатков, и идентичность последовательности идентичного процента по сравнению с соответствующим выравниванием, генерируемым GAP версия 10.
[000133] Термин «существенная идентичность», используемый в данном документе, для обозначения общих эпитопов, включает последовательности, которые содержат идентичные остатки в соответствующих положениях. Например, две последовательности можно считать практически идентичными, если по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более их соответствующих остатков идентичны по соответствующему участку остатков. Соответствующим участком может быть, например, полная последовательность или может быть по меньшей мере 5, 10, 15 или более остатков.
[000134] Термин «консервативная замена аминокислоты» относится к замене аминокислоты, которая обычно присутствует в этой последовательности с другой аминокислотой с аналогичным размером, зарядом или полярностью. Примеры консервативных замен включают замену неполярного (гидрофобного) остатка, такого как изолейцин, валин или лейцин, для другого неполярного остатка. Аналогично, примеры консервативных замен включают замены одного полярного (гидрофильного) остатка на другой, например, между аргинином и лизином, между глутамином и аспарагином или между глицином и серином. Кроме того, замена основного остатка, такого как лизин, аргинин или гистидин на другой, или замена одного кислотного остатка, такого как аспарагиновая кислота или глутаминовая кислота на другой кислотный остаток, являются дополнительными примерами консервативных замен. Примеры неконсервативных замен включают замену неполярного (гидрофобного) аминокислотного остатка, такого как изолейцин, валин, лейцин, аланин или метионин на полярный (гидрофильный) остаток, такого как цистеин, глутамин, глутаминовая кислота или лизин и/или полярный остаток на неполярный остаток. Типичные классификации аминокислот приведены ниже.

[000135] Термин «зародышевая линия» применительно к последовательности нуклеиновой кислоты иммуноглобулина включает последовательность нуклеиновой кислоты, которая может быть передана потомству.
[000136] Термин «антигенсвязывающий белок» включает любой белок, который связывается с антигеном. Примеры антигенсвязывающих белков включают антитело, антигенсвязывающий фрагмент антитела, мультиспецифическое антитело (например, биспецифическое антитело), scFV, бис-scFV, диатело, триатело, тетратело, V-NAR, VHH, VL, F(ab), F(ab)2, DVD (антигенсвязывающий белок с двойным вариабельным доменом), SVD (антигенсвязывающий белок с одним вариабельным доменом), привлекающий Т-клетки биспецифический активатор (BiTE) или Davisbody (пат. США №8586713, включенный в данный документ в качестве ссылки во всей полноте для всех целей).
[000137] Термин «антиген» относится к веществу, будь то целая молекула или домен внутри молекулы, которая способна вызывать продуцирование антител со связывающей специфичностью к этому веществу. Термин антиген также включает вещества, которые в организмах-хозяевах дикого типа не будут вызывать продуцирование антител в силу самораспознавания, но могут вызвать такой ответ у животного-хозяина с соответствующей генной инженерией для нарушения иммунологической толерантности.
[000138] Термин «эпитоп» относится к сайту на антигене, с которым связывается антигенсвязывающий белок (например, антитело). Эпитоп может быть образован из смежных аминокислот или несмежных аминокислот, сопоставленных с помощью третичного сгибания одного или более белков. Эпитопы, образованные из смежных аминокислот (также известных как линейные эпитопы), обычно сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образованные путем третичного сгибания (также называемые конформационными эпитопами), обычно теряются при обработке денатурирующими растворителями. Эпитоп обычно включает по меньшей мере 3 и более обычно по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации. Способы определения пространственной конформации эпитопов включают, например, рентгеновскую кристаллографию и двумерный ядерный магнитный резонанс. См., например, Epitope Mapping Protocols, in Methods in Molecular Biology, Vol. 66, Glenn E. Morris, Ed. (1996), включенный в данный документ в качестве ссылки во всей полноте для всех целей.
[000139] Термин «ауто» при использовании в сочетании с антигенами или эпитопами описывает антигены или эпитопы, которые не были бы распознаны или были бы слабо распознаны рецепторами В-клеток члена дикого типа из видов-хозяев в силу включения в состав веществ, которые, как правило, биосинтезируются видом-хозяином или которым обычно подвергаются виды-хозяева. Такие вещества вызывают толерантность иммунной системы хозяина. Термин «чужеродный» при использовании в сочетании с антигенами или эпитопами описывает антигены или эпитопы, которые не являются аутоантигенами или аутоэпитопами. Чужеродным антигеном является любой антиген, который обычно не продуцируется видом-хозяином.
[000140] Термин «антитело» включает молекулы иммуноглобулина, включающие четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие цепи (L), связанные между собой дисульфидными связями. Каждая тяжелая цепь содержит вариабельный домен тяжелой цепи и константный участок тяжелой цепи (CH). Константный участок тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельный домен легкой цепи и константный участок легкой цепи (CL). Вариабельные домены тяжелой цепи и легкой цепи могут быть дополнительно подразделены на участки гипервариабельности, называемые участками определения комплементарности (CDR), чередующиеся с более консервативными участками, называемыми каркасными участками (FR). Каждый вариабельный домен тяжелой и легкой цепей содержит три CDR и четыре FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (CDR тяжелой цепи могут быть сокращены как HCDR1, HCDR2 и HCDR3; CDR легкой цепи могут быть сокращены как LCDR1, LCDR2 и LCDR3). Термин «высокоаффинное» антитело относится к антителу, которое имеет KD по отношению к его эпитопу-мишени около 10-9 М или ниже (например, около 1×10-9 М, 1×10-10 М, 1×10-11 М, или около 1×10-12 М). В одном варианте осуществления изобретения, KD измеряется поверхностным плазмонным резонансом, например, BIACORE™; в другом варианте осуществления изобретения, KD измеряется с помощью ИФА.
[000141] Термин «тяжелая цепь» или «тяжелая цепь иммуноглобулина» включает последовательность тяжелой цепи иммуноглобулина, включая последовательность константного участка тяжелой цепи иммуноглобулина, из любого организма. Вариабельные домены тяжелой цепи включают в себя три CDR тяжелой цепи и четыре участка FR, если не указано иное. Фрагменты тяжелых цепей включают CDR, CDR и FR и их комбинации. Типичная тяжелая цепь имеет, следуя вариабельному домену (от N-конца до С-конца), домен CH1, шарнир, домен CH2 и домен CH3. Функциональный фрагмент тяжелой цепи включает фрагмент, который способен специфически распознавать эпитоп (например, распознавать эпитоп с KD в микромолярном, наномолярном или пикомолярном диапазоне), который способен экспрессироваться и секретироваться из клетки, и который содержит по меньшей мере один CDR. Вариабельные домены тяжелой цепи кодируются нуклеотидной последовательностью вариабельного участка, которая обычно содержит сегменты VH, DH и JH, полученные из репертуара сегментов VH, DH и JH, присутствующих в зародышевой линии. Последовательности, местоположения и номенклатуры сегментов V, D и J тяжелой цепи для различных организмов можно найти в базе данных IMGT, доступной через Интернет (www) по URL-адресу «imgt.org».
[000142] Термин «легкая цепь» включает в себя последовательность легкой цепи иммуноглобулина из любого организма, и, если не указано иное, в него входят каппа (κ) и лямбда (λ) легкие цепи человека и VpreB, а также суррогатные легкие цепи. Вариабельные домены легкой цепи обычно включают три CDR легкой цепи и четыре каркасных (FR) участка, если не указано иное. Как правило, полноразмерная легкая цепь включает от аминоконца до карбоксильного конца вариабельный домен, который включает FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, и аминокислотную последовательность константного участка легкой цепи. Вариабельные домены легкой цепи кодируются нуклеотидной последовательностью вариабельного участка легкой цепи, которая обычно содержит сегменты гена VL легкой цепи и JL легкой цепи, полученные из репертуара сегментов генов легкой цепи V и J, присутствующих в зародышевой линии. Последовательности, местоположения и номенклатуры генных сегментов V и J легкой цепи для различных организмов можно найти в базе данных IMGT, доступной через Интернет (www) по URL-адресу «imgt.org». Легкие цепи включают те, которые, например, не селективно связываются либо с первым, либо со вторым эпитопом, селективно связанным эпитоп-связывающим белком, в котором они появляются. Легкие цепи также включают те, которые связывают и распознают, или помогают тяжелой цепи связывать и распознавать один или более эпитопов, селективно связанных эпитоп-связывающим белком, в котором они появляются.
[000143] Термин «комплементарный определяющий участок» или «CDR», как используется в данном документе, включает аминокислотную последовательность, кодируемую нуклеотидной последовательностью генов иммуноглобулина организма, которая обычно (т.е. у животного дикого типа) появляется между двумя каркасными участками в вариабельном участке легкой или тяжелой цепи молекулы иммуноглобулина (например, антитела или рецептора Т-клетки). CDR может кодироваться, например, последовательностью зародышевой линии или перестроенной последовательностью и, например, наивной или зрелой В-клеткой, или Т-клеткой. CDR может быть соматически мутирована (например, варьироваться от последовательности, кодируемой в зародышевой линии животного), гуманизироваться, и/или модифицироваться аминокислотными заменами, добавлениями или делециями. В некоторых случаях (например, для CDR3), CDR могут кодироваться двумя или более последовательностями (например, последовательностями зародышевой линии), которые не являются смежными (например, в неперестроенной последовательности нуклеиновой кислоты), но являются смежными в последовательности нуклеиновой кислоты В-клеток, например, в результате сплайсинга или соединения последовательностей (например, рекомбинации V-D-J с образованием CDR3 тяжелой цепи).
[000144] Термин «неперестроенный» включает состояние локуса иммуноглобулина, в котором генные сегменты V и генные сегменты J (для тяжелых цепей, сегменты D гена) также поддерживаются отдельно, но могут быть соединены с образованием перестроенного гена V(D)J который содержит один V, (D), J репертуара V(D)J.
[000145] Термин локус вариабельного участка тяжелой цепи включает в себя местоположение на хромосоме, например, хромосоме мыши, где найдены последовательности ДНК вариабельного участка тяжелой цепи (VH), тяжелой цепи (DH) и тяжелой цепи (JH).
[000146] Термин «вариабельный участок легкой цепи каппа» включает в себя местоположение на хромосоме, например, хромосоме мыши, где найдены последовательности ДНК дикого типа к вариабельного (Vκ) и κ-соединенного (Jκ) участка.
[000147] Термин «вариабельный участок легкой цепи лямбда» включает в себя местоположение на хромосоме, например, хромосоме мыши, где найдены последовательности ДНК дикого типа λ вариабельного (Vλ) и λ-соединенного (Jλ) участка.
[000148] «Гомологичная» последовательность (например, последовательность нуклеиновой кислоты) включает последовательность, которая либо идентична, либо практически аналогична известной эталонной последовательности, так что она на, например, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентична известной эталонной последовательности. Гомологичные последовательности могут включать, например, ортологическую последовательность и паралогичные последовательности. Гомологичные гены, например, обычно происходят от общей последовательности предковых ДНК, либо через событие видообразования (ортологичные гены), либо событие генетического дублирования (паралогичные гены). «Ортологичные» гены включают гены у разных видов, которые эволюционировали из общего предкового гена с помощью видообразования. Ортологи обычно сохраняют ту же функцию в процессе эволюции. «Паралогичные» гены включают гены, связанные с дублированием в геноме. Паралоги могут развивать новые функции в процессе эволюции.
[000149] Термин «in vitro» включает искусственные окружающие среды и процессы или реакции, которые происходят в искусственной окружающей среде (например, тестовой пробирке). Термин «in vivo» включает природные окружающие среды (например, клетку или организм, или тело), а также процессы или реакции, которые происходят в естественной окружающей среде. Термин «ех vivo» включает клетки, которые были удалены из тела индивидуума, и процессы или реакции, которые происходят в таких клетках.
[000150] Термин «гибрид» включает клетки или линии, которые имеют одну или более изменений последовательности (например, имеют аллельную вариацию) в одном или более геномных локусах-мишенях между первой и второй хромосомами в гомологичной паре хромосом. Например, гибридные клетки могут быть получены из потомства спаривания между двумя генетически несхожими родителями (т.е. скрещивание между родителями, которые отличаются одним или более генами). Например, гибрид может быть сгенерирован путем скрещивания двух отдельных инбредных линий (т.е. линий, выведенных для генетической гомогенности). Все люди считаются гибридами.
[000151] Композиции или способы, «содержащие» или «включающие» один или более перечисленных элементов, могут включать в себя другие элементы, которые конкретно не перечислены. Например, композиция, которая включает «содержит» или «включает» белок, может содержать белок отдельно или в комбинации с другими ингредиентами.
[000152] Обозначение диапазона значений включает все целые числа внутри или определяющие диапазон и все поддиапазоны, определенные целыми числами в пределах диапазона.
[000153] Если иное не понимается из контекста, термин «около» охватывает значения в пределах стандартной погрешности измерения (например, SEM) указанного значения.
[000154] Единственные формы статей включают многие ссылки, если контекст явно не диктует иное. Например, термин «белок Cas9» или «по меньшей мере один белок Cas9» может включать в себя множество белков Cas9, включая их смеси.
[000155] Статистически значимые средние р≤0,05.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор
[000156] В данном документе представлены композиции и улучшенные способы получения антигенсвязывающих белков (например, антител), которые связывают эпитоп с представляющим интерес чужеродным антигеном-мишенью (например, представляющим интерес антигеном-мишенью человека), который обладает общим эпитопом с аутоантигеном или является гомологичным аутоантигеном. Такие способы включают снижение толерантности чужеродного антигена у не относящихся к человеку животных, таких как грызуны (например, мыши или крысы) (необязательно содержащие в их зародышевой линии гуманизированные локусы тяжелой и/или легкой цепи иммуноглобулина) с использованием двух или более направляющих РНК (гРНК) для создания парных двунитевых разрывов на разных сайтах в пределах одного геномного локуса-мишени. Необязательно, клетка, содержащая геномный локус-мишень, представляет собой гибридную клетку, и способы дополнительно включают в себя выбор участка-мишени в геномном локусе-мишени для претерпевания нацеленной генетической модификации, так что участок-мишень имеет более высокую степень идентичности последовательности между соответствующими первыми и вторыми хромосомами в гомологичной хромосомной паре по отношению ко всем или части остатка геномного локуса-мишени. Такие спаренные двунитевые разрывы влияют на экспрессию аутоантигена для уменьшения или устранения экспрессии аутоантигена или для уменьшения или исключения экспрессии эпитопа из аутоантигена, который является общим с чужеродным антигеном. Такие генетически модифицированные отличные от человека животные, содержащие локусы тяжелой и легкой цепи гуманизированного иммуноглобулина, а также содержащие такую мутацию в геномном локусе-мишени, могут затем быть иммунизированы чужеродным антигеном, отличное от человека животное, может поддерживаться в условиях достаточных для того, чтобы отличное от человека животное обеспечивало иммунный ответ на чужеродный антиген, и антигенсвязывающий белок, который связывает чужеродный антиген, может быть получен от отличного от человека животного или клетки от отличного от человека животного.
[000157] Мышей, используемых для получения антител против человеческих антигенов, таких как мыши, содержащие в своих зародышевых линиях локусы тяжелой и/или легкой цепи гуманизированного иммуноглобулина, обычно получают из комбинации линий, которая включает BALB/c из-за увеличения емкости линий BALB/c для производства разнообразного репертуара антител по сравнению с другими линиями мыши. Однако по сравнению с эмбриональными стволовыми клетками (ЭС), обычно используемыми для генерации направленных генетических модификаций у мышей (например, описанные в данном документе клетки F1H4 (VGF1)), ЭС-клетки, полученные из таких линий, продуцирующих антитела мышей, как правило, имеют уменьшенную способность к нацеливанию на культуру, и/или продуцирующих мышей поколения F0, имеющих нацеленную генетическую модификацию и передающих нацеленную модификацию через зародышевую линию. Следовательно, обычные способы генерации целевых нокаутных мышей для преодоления толерантности включают в себя несколько циклов размножения и/или последовательного нацеливания, при этом весь процесс доставки мышам, гомозиготным по нулевой аллели в представляющий интерес мишени, и готовым к иммунизации, занимает около 15-16 месяцев.
[000158] Описанные в данном документе способы выгодно уменьшают это время до примерно 4-5 месяцев (и щенки мышей, гомозиготных по нулевой аллели в представляющей интерес мишени, могут быть доставлены через ~3 месяца). В дополнение к более коротким временным рамкам, описанные в данном документе способы уменьшают количество раундов электропорации, необходимых для получения гомозиготных модификаций, уменьшают количество пассажей и время в культуре, уменьшают количество необходимых клеток, и упрощают процесс из-за того, что нацеливания векторов не требуется, а скринирование соответственно упрощается. Способы, описанные в данном документе, преимущественно приводят к увеличению разнообразия антител после иммунизации с представляющим интерес чужеродным антигеном, из-за увеличения использования тяжелой цепи и легкой цепи V-генных сегментов по сравнению с мышами, у которых экспрессия аутоантигена не отменяется. Кроме того, описанные в данном документе способы приводят к образованию антител против большего разнообразия эпитопов после иммунизации с представляющим интерес чужеродным антигеном, из-за образования антител, которые перекрестно реагируют с соответствующим аутоантигеном (т.е. антителами, которые связывают эпитопы, которые перекрываются между аутоантигеном и представляющим интерес чужеродным антигеном), тем самым обеспечивая получение большего количества антител против представляющего интерес чужеродного антигена.
II. Способы модификации геномного локуса-мишени для преодоления толерантности
[000159] Иммунизация отличных от человека животных (например, грызунов, таких как мыши или крысы), содержащих в их зародышевой линии локусы тяжелой и/или легкой цепи гуманизированного иммуноглобулина, «не своим» белком является широко используемым способом для получения специфических антигенсвязывающих белков, таких как моноклональные антитела. Подход к иммунизации является привлекательным, поскольку он имеет потенциал для обеспечения высокоаффинных антигенсвязывающих белков, которые созрели in vivo и могут быть экономически эффективными и эффективными во времени. Этот подход, однако, зависит от расхождения в последовательности между нативными белками у отличного от человека животного и иммунизированного белка, чтобы иммунная система отличного от человека животного могла распознавать иммуноген как не свой (то есть, чужеродный).
[000160] В-клеточные рецепторы собирают посредством серии событий рекомбинации из упорядоченного расположения генных сегментов (например, V, D и J), и эта сборка генных сегментов, как известно, является неточной и генерирует рецепторы, имеющие аффиность к различным антигенам, включая аутоантигены. Несмотря на эту способность генерировать В-клеточные рецепторы, которые связывают аутомолекулы, иммунная система оснащена несколькими механизмами аутотолерантности, чтобы избежать развития и расширения таких аутореактивных рецепторов В-клеток и отличить себя от не себя, тем самым предотвращая аутоиммунную реакцию. См., например, Shlomchik (2008) Immunity 28: 18-28 и Kumar and Mohan (2008) 40 (3): 208-23, каждый из которых включен в настоящее описание посредством ссылки во всей их полноте для всех целей. Таким образом, генерация человеческих антител у отличных от человека животных, имеющих локусы гуманизированного иммуноглобулина против человеческих антигенов, имеющих высокую степень гомологии (например, структурную гомологию или гомологию последовательностей) с аутоантигенами отличного от человека животного, может быть сложной задачей для иммунологической толерантности. Поскольку функционально важные участки белков, как правило, сохраняются у разных видов, иммунологическая толерантность к аутоантигенам часто создает проблему для получения антител к этим ключевым эпитопам. Иммунизация отличных от человека животных (например, грызунов, таких как мыши или крысы) чужеродными (например, человеческими) антигенами, которые очень похожи или «гомологичны», дает слабые или несуществующие ответы на антитела и, следовательно, затрудняет получение антигенсвязывающих белков (например, антитела) со связыванием, направленным на такие человеческие антигены. В качестве примера, количество идентичности последовательности, являющейся общей с эндогенным белком (аутоантиген) и чужеродным антигеном-мишенью, может составлять по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% 98%, 99% или 100% идентичности последовательности, так что иммунная система не распознает антиген-мишень как чужеродный. Например, общие эпитопы между чужеродным антигеном и аутоантигеном у отличного от человека животного могут сделать установку эффективного иммунного ответа против чужеродного антигена у проблемного отличного от человека животного, потому что иммунологическая толерантность истощает и/или удаляет В-клетки, которые экспрессируют нейтрализующие антитела против чужеродного антигена. Чтобы преодолеть эту толерантность и получить моноклональные антитела, которые связываются с аутоантигенами, или их гомологи (например, человеческие гомологи) у отличных от человека животных, могут быть получены специфические генетически модифицированные или нокаутные отличные от человека животные для удаления генов (или представляющих интерес общих эпитопов), кодирующих белок отличных от человека животных, который разделяет общую значительную гомологию и/или является высококонсервативным с человеческими аналогами генов, кодирующих антиген, используемый для иммунизации. См., например, патент США №7119248, включенный в данный документ в качестве ссылки во всей своей полноте для всех целей. Однако создание таких отличных от человека животных, может быть дорогостоящим и время затратным.
[000161] Обычные способы для создания целевых нокаутных мышей для преодоления толерантности включают в себя несколько раундов разведения и/или последовательного нацеливания. Мышей, используемых для получения антител против человеческих антигенов, таких как мыши, содержащие в своих зародышевых линиях локусы тяжелой и/или легкой цепи гуманизированного иммуноглобулина (например, мыши VELOCIMMUNE®, которые гомозиготными гуманизированы как в локусах IgH, так и Igκ), обычно получают из комбинации линий, которая включает BALB/c из-за увеличения емкости линий BALB/c для производства разнообразного репертуара антител по сравнению с другими линиями мыши. Однако по сравнению с эмбриональными стволовыми клетками (ЭС), обычно используемыми для генерации нацеленных генетических модификаций у мышей (например, описанные в данном документе клетки F1H4 (VGF1), которые состоят из 50% линии 129SvS6 и 50% линии C57BL/6N), ЭС-клетки, полученные из таких линий продуцирующих антитела мышей, как правило, имеют уменьшенную способность к нацеливанию на культуру, и/или продуцирующих мышей поколения F0, имеющих нацеленную генетическую модификацию и передающих целевую модификацию через зародышевую линию. Таким образом, традиционный подход к нарушению иммунологической толерантности у мышей, продуцирующих антитела, таких как мыши VELOCIMMUNE®, включает в себя сначала нацеливание на ген, кодирующий аутоантиген в линии ЭС клеток (например, F1H4), который более восприимчив к нацеливанию и передаче целевой модификации через зародышевую линию. При таком подходе создаются большие направленные векторы (LTVEC), в клетках F1H4 ЭС создаются нокаутные (нулевые) аллели, и генерируются F0-мыши, несущие гетерозиготную нокаутную мутацию в интересующей мишени (типичные временные рамки 5 месяцев). Мыши VELOCIMMUNE® затем размножаются для получения F0 мышей, несущих гетерозиготную нокаутную мутацию в представляющий интерес мишени. Чтобы получать трижды гомозиготных мышей (гомозиготных нулевых по интересующей мишени и гомозиготных гуманизированных как IgH, так и Igκ), подходящих для иммунизации, требуются еще два поколения разведения. Весь процесс занимает приблизительно от 15 до 16 месяцев (см., например, фигуру 1) и более эффективен, чем описанный ниже подход последовательного нацеливания (см., например, фигуру 2).
[000162] Альтернативно, большой нацеливающий вектор (LTVEC) может быть разработан и
сконструирован, а затем электропорирован в стволовые эмбриональные клетки (ЭС), полученные из мышей, продуцирующих антитела (например, мыши VELOCIMMUNE® или мыши VELOCIMMUNE®, содержащие функциональный эктопический ген мыши Adam6 («Мыши VI-3ʺ)), чтобы получить гетерозиготную модификацию в эндогенном гене, кодирующем аутоантиген, который является гомологичным или обладающий общим представляющим интерес эпитопом с антигеном-мишенью. Затем проводится второй раунд нацеливания для создания гомозиготной модификации. Несмотря на меньшую затрату времени, чем описанный выше подход к размножению, этот процесс все еще может потребовать много времени, занимая приблизительно от 9 до 10 месяцев для создания F0 мыши, готовой для иммунизации антигеном-мишенью (см., например, фигуру 2). Кроме того, такие способы требуют многих раундов электропорации и более длительных периодов культивирования с большим количеством пассажей, все из которых приводят к уменьшению плюрипотентности и уменьшенной способности генерировать F0 мышей для генерации антигенсвязывающих белков. См., например, Buehr et al. (2008) Cell 135:1287-1298; Li et al. (2008) Cell 135(7): 1299-1310; и Liu et al. (1997) Dev. Dyn. 209: 85-91, каждый из которых включен в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000163] Описанные в данном документе способы выгодно уменьшают это время до примерно 4-5 месяцев (см., например, фигуру 3; и щенки мышей, гомозиготных по нулевой аллели в представляющей интерес мишени, могут быть доставлены через ~3 месяца, но затем выдерживаются в течение 4-5 недель до иммунизации). В дополнение к более коротким временным рамкам, описанные в данном документе способы уменьшают количество раундов электропорации и необходимых для получения гомозиготных модификаций, уменьшают количество пассажей и время в культуре, и уменьшают количество необходимых клеток. Скрининг более прост и упрощен, потому что, например, не требуется зондов усиления аллели, и калибровки числа копий не требуется. Способы, описанные в данном документе, также приводят к увеличению разнообразия антител после иммунизации с представляющим интерес чужеродным антигеном, из-за увеличения использования тяжелой цепи и легкой цепи V-генных сегментов по сравнению с мышами, у которых экспрессия аутоантигена не отменяется. Кроме того, описанные в данном документе способы могут приводить к образованию антител против большего разнообразия эпитопов после иммунизации с представляющим интерес чужеродным антигеном, из-за образования антител, которые перекрестно реагируют с соответствующим аутоантигеном (т.е. антителами, которые связывают эпитопы, которые перекрываются между аутоантигеном и представляющим интерес чужеродным антигеном), тем самым обеспечивая получение большего количества антител против представляющего интерес чужеродного антигена.
[000164] В данном документе представлены различные способы модификации геномного локуса-мишени для преодоления толерантности. Способы могут реализовываться ex vivo или in vivo, и они могут использовать две или более направляющие РНК (например, две гРНК, три направляющие РНК или четыре направляющие РНК), которые нацелены на разные участки в пределах одного геномного локуса-мишени, который влияет на экспрессию аутоантигена, гомологичного к или обладающего общим представляющим интерес эпитопом с представляющим интерес чужеродным антигеном, и образуют два или более комплекса с белком Cas и расщепляют нуклеиновую кислоту-мишень. Две или более направляющих РНК могут использоваться как самостоятельно, так и в сочетании с экзогенной матрицей для репарации, при условии, что, если клетка представляет собой эмбрион на одноклеточной стадии, например, экзогенная матрица для репарации может быть менее чем 5 т.п.о. в длину. Такие способы способствуют созданию биаллельных генетических модификаций в локусе-мишени и могут содержать разрушение генома или другие нацеленные модификации, такие как одновременная делеция последовательности нуклеиновой кислоты в геноме и замену экзогенной последовательностью нуклеиновой кислоты. По сравнению с нацеливанием с одной гРНК, которая продуцирует биаллельные модификации с низкой частотой, нацеливание с двумя или более гРНК приводит к созданию биаллельных модификаций (например, гомозиготно нацеленные клетки, гомозиготно удаленные клетки, и соединения гетерозиготно нацеленных клеток, включая гемизиготно нацеленные клетки) при значительно увеличенной скорости.
[000165] Репарация в ответ на двухнитевые разрывы (DSB) происходит главным образом через два консервативных пути репарации ДНК: негомологичное соединение концов (NHEJ) и гомологичную рекомбинацию (HR). См. Kasparek & Humphrey (2011) Seminars in Cell & Dev. Biol. 22:886-897, включенный в данный документ в качестве ссылки во всей полноте для всех целей. NHEJ включает в себя репарацию двухнитевых разрывов в нуклеиновой кислоте путем прямого лигирования концов разрыва друг с другом или с экзогенной последовательностью без необходимости в гомологичной матрице. Лигирование несмежных последовательностей с помощью NHEJ может часто приводить к делециям, вставкам или транслокациям вблизи места двухнитевого разрыва.
[000166] Репарация нуклеиновой кислоты-мишени, опосредуемая экзогенной матрицей для репарации, может включать в себя любой процесс обмена генетической информацией между двумя полинуклеотидами. Например, NHEJ также может привести к направленной интеграции экзогенной матрицы для репарации путем прямого лигирования концов разрыва с концами экзогенной матрицы для репарации (т.е. захвата на основе NHEJ). Такая опосредованная NHEJ направленная интеграция может быть предпочтительной для вставки экзогенной матрицы для репарации, когда пути репарации, направленной гомологией (HDR), не могут быть легко использованы (например, в не делящихся клетках, первичных клетках, и клетках, которые плохо выполняют репарацию ДНК на основе гомологии). Кроме того, в отличие от репарации, основанной на гомологии, знания о больших участках идентичности последовательности, фланкирующих сайт расщепления (за пределами «липких» концов, созданных с помощью Cas-опосредованного расщепления), не нужны, что может быть полезно при попытке направленной вставки в организмы, у которых есть геномы, для которых знание о геномной последовательности ограничено. Интеграция может протекать через лигирование «тупых» концов между экзогенной матрицей для репарации и расщепленной геномной последовательностью, или путем лигирования «липких» концов (т.е. имеющих 5' или 3' «липкие» концы) с использованием экзогенной матрицы для репарации, которая фланкирована с помощью «липких» концов, которые совместимы с теми, которые генерируются с помощью белка Cas в расщепленной геномной последовательности. См., например, US 2011/020722, WO 2014/033644, WO 2014/089290, и Maresca et al. (2013) Genome Res. 23(3):539-546, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Если «тупые» концы лигированы, может потребоваться резекция цели и/или донора для генерации участков микрогомологии, необходимых для присоединения фрагментов, что может создавать нежелательные изменения в последовательности-мишени.
[000167] Репарация также может происходить посредством репарации, направляемой гомологией (HDR), или гомологичной рекомбинации (HR). HDR или HR включает в себя форму репарации нуклеиновой кислоты, которая может потребовать гомологию нуклеотидной последовательности, использует «донорскую» молекулу в качестве матрицы для репарации «целевой» молекулы (т.е. той, которая испытывала двухнитевой разрыв), и приводит к передаче генетической информации от донора к мишени. Не желая связывать себя какой-либо конкретной теорией, такая передача может включать коррекцию несовпадения гетеродуплексной ДНК, которое образуется между сломанной мишенью и донором, и/или синтез-зависимый отжиг нити, в котором донор используется для ресинтеза генетической информации, которая будет частью мишени, и/или связанных процессов. В некоторых случаях донорный полинуклеотид, часть донорного полинуклеотида, копия донорного полинуклеотида, или часть копии донорного полинуклеотида интегрируется в ДНК-мишень. См. Wang et al. (2013) Cell 153: 910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000168] Чтобы сделать отличных от человека животных с пониженной толерантностью к представляющему интерес чужеродному антигену-мишени, один или более геномных локусов-мишеней, влияющих на экспрессию аутоантигена, гомологичного или обладающего общим эпитопом с представляющим интерес чужеродным антигеном, могут быть нацелены на уменьшение экспрессии аутоантигена. Предпочтительно, устраняется экспрессия первого аутоантигена. Экспрессия аутоантигена считается устраненной, если аутоантиген больше не экспрессируется (например, если аутоантиген представляет собой белок, белок больше не экспрессируется, или если аутоантиген представляет собой определенный эпитоп на белке, белки, содержащие этот эпитоп, больше не экспрессируются).
[000169] В одном примере, геном плюрипотентной клетки отличного от человека животного, которая не является эмбрионом на одноклеточной стадии (например, эмбриональной стволовой клеткой (ЭС)), может приводиться в контакт с белком Cas, первой направляющей РНК, которая гибридизуется с первой последовательностью, распознаваемой направляющей РНК в геномном локусе-мишени, и второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени. В другом примере, геном эмбриона отличного от человека животного на одноклеточной стадии может приводиться в контакт с белком Cas, первой направляющей РНК, которая гибридизуется с первой последовательностью, распознаваемой направляющей РНК в геномном локусе-мишени, и второй направляющей РНК, которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени.
[000170] В некоторых способах, представленных в данном документе, клетка, являющаяся целью, представляет собой гибридную клетку, как определено в другом месте данного документа. Такие способы также могут включать в себя выбор участка-мишени в геномном локусе-мишени, как описано в другом месте данного документа. Участок-мишень может быть выбран так, чтобы он имел высокий процент идентичности последовательности между соответствующими первой и второй хромосомами в гомологичной паре хромосом относительно других сегментов геномного локуса-мишени или остальной части геномного локуса-мишени. В качестве примера, выбор участка-мишени может содержать сравниваемую последовательность соответствующих первой и второй хромосом в гомологичной паре хромосом в геномном локусе-мишени, и выбор участка-мишени, имеющего более высокий процент идентичности последовательности между соответствующими первой и второй хромосомами в гомологичной паре хромосом по отношению ко всему или части остатка геномного локуса-мишени. Способы выбора участка-мишени, как описано более подробно в другом месте данного документа.
[000171] Необязательно, геном может дополнительно приводиться в контакт с дополнительными направляющими РНК, которые гибридизуются с последовательностями, распознаваемыми направляющей РНК в геномном локусе-мишени (или во втором геномном локусе-мишени, который влияет на экспрессию аутоантигена или который влияет на экспрессию второго аутоантигена который является гомологичным или обладает общим представляющим интерес эпитопом с представляющим интерес чужеродным антигеном), такой как третья направляющая РНК, которая гибридизуется с последовательностью, распознаваемой третьей направляющей РНК в геномном локусе-мишени, или третьей направляющей РНК и четвертой направляющей РНК, которая гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК в геномном локусе-мишени. Приведение в контакт может включать введение белка Cas и направляющих РНК в клетку в любой форме и с помощью любых средств, как описано более подробно в другом месте данного документа. Направляющие РНК образуют комплексы с белком Cas и направляют их к последовательностям, распознаваемым направляющей РНК в геномном локусе-мишени, где белок Cas расщепляет геномный локус-мишень на сайтах расщепления белка Cas в последовательностях, распознаваемых направляющей РНК. Расщепление с помощью белка Cas может создать двухнитевой разрыв или однонитевой разрыв (например, если белок Cas представляет собой никазу). Примеры и вариации белков Cas и направляющих РНК, которые могут быть использованы в способах, описанных в другом месте данного документа. Расщепление с помощью белка Cas в геномном локусе-мишени может модифицировать геномный локус-мишень в паре первой и второй хромосом для получения биаллельной модификации, которая уменьшает экспрессию аутоантигена.
[000172] Представляющий интерес чужеродный антиген может представлять собой любой чужеродный антиген, для которого желательны антигенсвязывающие белки. Например, представляющий интерес чужеродный антиген может содержать, состоять по существу из, состоять из всего или части вирусного белка, бактериального белка, белка млекопитающих, белка обезьян, белка собачьих, белка кошачьих, белка лошадей, бычьего белка, белка грызунов (например, крысы или мыши) или белка человека. Например, представляющий интерес чужеродный антиген может содержать, состоять по существу из, состоять из белка человека с одной или более мутаций, или вариаций. Представляющий интерес чужеродный антиген и аутоантиген могут быть гомологичными. Например, представляющий интерес чужеродный антиген и аутоантиген могут быть ортологическими или паралогическими. Альтернативно или дополнительно, представляющий интерес чужеродный антиген и аутоантиген может содержать, состоять по существу из, состоять из общего эпитопа. Общие эпитопы могут существовать между гомологичными белками или могут существовать между разнородными белками, которые не являются гомологичными. Либо линейная аминокислотная последовательность и/или конформационная подгонка (например, подобные антигенные поверхности даже в отсутствие гомологии первичной последовательности) эпитопа могут быть общими. Например, общие эпитопы включают эпитопы, которые по существу идентичны. Если эпитоп являются общими между двумя антигенами, антитело против эпитопа на первом антигене будет, как правило, также связывать эпитоп со вторым антигеном.
[000173] Приведение в контакт может происходить в отсутствие экзогенной матрицы для репарации или в присутствии экзогенной матрицы для репарации, которая рекомбинируется с геномным локусом-мишенью для получения нацеленной генетической модификации. Например, клетка может быть эмбрионом на одноклеточной стадии, а экзогенная матрица для репарации может быть менее чем 5 т.п.о. в длину. Примеры экзогенной матрицы для репарации описаны в другом месте данного документа.
[000174] В некоторых таких способах, репарация нуклеиновой кислоты-мишени с помощью экзогенной матрицы для репарации происходит посредством репарации, направляемой гомологией (HDR). Репарация, направляемая гомологией может произойти, когда белок Cas расщепляет обе нити ДНК в геномном локусе-мишени для создания двухнитевого разрыва, когда белок Cas представляет собой никазу, которая расщепляет одну нить ДНК в геномном локусе-мишени для создания однонитевого разрыва, или, когда парные никизы Cas используются для создания двухнитевого разрыва, образованного двумя смещающими одноцепочечными разрывами. В таких способах, экзогенная матрица для репарации содержит 5' и 3' плечи гомологии, соответствующие 5'- и 3'-последовательностей-мишеней в геномном локусе-мишени. Последовательности, распознаваемые направляющей РНК, или сайты расщепления могут быть смежными с 5' последовательностью-мишенью, смежными с 3' последовательностью-мишенью, смежными как с 5' последовательностью-мишенью, так и 3' последовательностью-мишенью, или смежными ни с одной из 5' последовательностью-мишенью, ни с 3' последовательностью-мишенью.
Последовательности, которые находятся рядом друг с другом, включают последовательности в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов друг от друга. Необязательно, экзогенная матрица для репарации может дополнительно содержать вставку нуклеиновой кислоты, фланкированную с помощью 5'- и 3'-плечей гомологии, и вставку нуклеиновой кислоты, вставленную между 5' и 3' последовательностями-мишенями. Если вставка нуклеиновой кислоты отсутствует, экзогенная матрица для репарации может функционировать для удаления геномной последовательности между 5' и 3' последовательностями-мишенями.
[000175] Альтернативно, репарация нуклеиновой кислоты-мишени с помощью экзогенной матрицы для репарации может происходить посредством связанного с негомологичным соединением концов (NHEJ) лигирования. В таких способах, по меньшей мере один конец экзогенной матрицы для репарации содержит короткий одноцепочечный участок, который комплементарен по меньшей мере одному «липкому» концу, созданному с помощью Cas-опосредованного расщепления в геномном локусе-мишени. Комплементарный конец в экзогенной матрице для репарации может фланкировать вставку нуклеиновой кислоты. Например, каждый конец экзогенной матрицы для репарации может содержать короткий одноцепочечный участок, который комплементарен к «липкому» концу, созданному с помощью Cas-опосредованного расщепления в геномном локусе-мишени, и эти комплементарные участки в экзогенной матрице для репарации могут фланкировать вставку нуклеиновой кислоты. «Липкие» концы (т.е. ступенчатые концы) могут быть созданы путем резекции «тупых» концов двухнитевого разрыва, созданного с помощью Cas-опосредованного расщепления. Такая резекция может генерировать участки микрогомологии, необходимые для соединения фрагментов, но это может создавать нежелательные или неконтролируемые изменения в нуклеиновой кислоте-мишени. Альтернативно, такие «липкие» концы могут быть созданы с использованием парных Cas никаз. Например, если белок Cas является никазой, геномный локус-мишень может контактировать с первой и второй направляющими РНК, которые нацелены на противоположные нити ДНК, в результате чего геном модифицируют путем двойного никирования. Это может быть достигнуто путем приведения в контакт геномного локуса-мишени с двумя направляющими РНК, которые гибридизуются с другой последовательностью, распознаваемой РНК в геномном локусе-мишени. Две направляющие РНК образуют два комплекса с Cas никазой, и Cas никазой одноцепочечных разрывов первой нити геномного локуса-мишени в пределах одной из последовательностей, распознаваемых направляющей РНК, и одноцепочечных разрывов второй цепи геномного локуса-мишени в пределах другой последовательности, распознаваемой направляющей РНК. Экзогенную матрицу для репарации затем рекомбинируют с геномным локусом-мишенью для получения нацеленной генетической модификации.
[000176] В некоторых способах, вставка нуклеиновой кислоты содержит последовательность, которая является гомологичной или ортологичной для всего или части гена, кодирующего аутоантиген. Это может быть полезно, например, когда нокаут аутоантигена может привести к эмбриональной летальности. Вставка нуклеиновой кислоты может быть в экзогенной матрице для репарации в любой форме, описанной в данном документе (например, нацеливающий вектор, LTVEC, ssODN и т.д.), и вставка нуклеиновой кислоты может дополнительно содержать селекционную кассету (например, самоудаляющаяся селекционная кассета) или может отсутствовать селекционная кассета. В таких способах, например, весь или часть гена, кодирующего аутоантиген, можно удалить и заменить соответствующей гомологичной или ортологичной последовательностью. Например, весь ген, кодирующий аутоантиген, можно удалить и заменить с соответствующей гомологичной или ортологичной последовательностью, или часть гена, кодирующего конкретный мотив или участок аутоантигена, может быть удалена и заменена с соответствующей гомологичной или ортологичной последовательностью. Необязательно, соответствующая гомологичная или ортологическая последовательность может быть от другого вида. Например, если аутоантиген является мышиным антигеном, соответствующая гомологичная или ортологичная последовательность может быть, например, гомологичной или ортологичной последовательностью крысы, хомяка, кошки, собаки, черепахи, лемура или человека. Альтернативно или дополнительно гомологичная, или ортологичная последовательность может содержать одну или более точечных мутаций (например, 1, 2, 3, 4, 5 и более) по сравнению с замененной последовательностью. Такие точечные мутации могут служить, например, для устранения экспрессии одного или более эпитопов в аутоантигене. Такие эпитопы могут быть эпитопами, которые являются общими с представляющим интерес чужеродным антигеном. Необязательно, такие точечные мутации могут приводить к консервативной аминокислотной замене (например, замене аспарагиновой кислоты [Asp, D] глутаминовой кислотой [Glu, Е]) в кодированном полипептиде. Такие замены аминокислот могут приводить к экспрессии аутоантигена, который сохраняет функцию аутоантигена дикого типа, но испытывает недостаток в эпитопе, который присутствует в представляющем интерес чужеродном антигене, и является общим с аутоантигеном дикого типа. Аналогичным образом делеция всего или части гена, кодирующего аутоантиген, и замещение соответствующей гомологичной или ортологичной последовательностью, которая не содержит эпитоп, который является общим между представляющим интерес чужеродным антигеном и аутоантигеном, может приводить к экспрессии гомолога или ортолога аутоантигена, который сохраняет функцию аутоантигена дикого типа, но не содержит эпитоп, который присутствует в представляющем интерес чужеродном антигене, и является общим с аутоантигеном дикого типа. Затем могут быть получены антигенсвязывающие белки против этих эпитопов.
[000177] Модифицированную плюрипотентную клетку отличного от человека животного можно затем использовать для генерации генетически модифицированного отличного от человека животного с использованием способов, описанных в другом месте данного документа. Например, модифицированная плюрипотентная клетка отличного от человека животного может быть введена в эмбрион-хозяин, а эмбрион-хозяин может быть имплантирован суррогатной матери, чтобы произвести генетически модифицированное F0 поколение отличного от человека животного, у которого геномный локус-мишень модифицирован в паре первой и второй хромосом, чтобы иметь биаллельную модификацию, так что экспрессия аутоантигена уменьшается или устраняется. В случае эмбриона на одноклеточной стадии можно выбрать генетически модифицированный эмбрион, а затем имплантировать его суррогатной матери, чтобы произвести генетически модифицированное F0 поколение отличного от человека животного, у которого геномный локус-мишень модифицирован в паре первой и второй хромосом, чтобы иметь биаллельную модификацию, так что экспрессия аутоантигена уменьшается или устраняется. Затем F0 поколение отличного от человека животного может быть использовано для генерации антигенсвязывающих белков против представляющего интерес чужеродного антигена с использованием способов, описанных в другом месте данного документа.
А. Выбор участка-мишени
[000178] Нацеленная модификация гена путем гомологичной рекомбинации между экзогенной матрицей для репарации (например, вектором нацеливания) и геномным локусом-мишенью может быть очень неэффективной, особенно в отношении типов клеток, отличных от эмбриональных стволовых клеток грызунов. Индукция одного или более двухнитевых разрывов ДНК путем CRISPR/Cas9-направленного расщепления может способствовать нацеливанию гомологичного гена с помощью гомологичной рекомбинации (HR) между экзогенной матрицей для репарации (например, вектором нацеливания) и геномным локусом-мишенью. CRISPR/Cas9 также может способствовать гомозиготным мутациям вставки или делеции (т.е. биаллельным изменениям, которые являются идентичными) с помощью механизмов репарации негомологичного соединения концов (NHEJ). Для модификаций генов, которые включают в себя очень большие гуманизации, объединение вектора нацеливания с системой нуклеазы CRISPR/Cas9, направленной на две направляющие РНК, которые нацелены на один геномный локус-мишень, может дополнительно повысить эффективность нацеливания, превышающую эффективность, достигаемую с помощью одной направляющей РНК. По сравнению с нацеливанием с одной направляющей РНК, которая продуцирует биаллельные модификации с низкой частотой или вообще отсутствует, нацеливание с двумя направляющими РНК приводит к созданию гомозиготных клеток, гомозиготно удаленных клеток, и соединений гетерозиготно нацеленными клетками (включая гемизиготно нацеленные клетки) при значительно увеличенной скорости. Однако в некоторых геномных локусах получение гомозиготно нацеленных клеток или гомозиготно удаленных клеток может быть затруднено.
[000179] В отличие от инбредных линий мышей и крыс, обычно используемых в лабораторных условиях, которые гомозиготны практически во всех их геномных локусах, последовательность двух аллелей в геномном локусе-мишени в гибридных клетках (например, у всех людей) обычно не будет на 100% идентична. Однако, как показано в приведенных в данном документе примерах, частота гомозиготного геномного изменения, независимо от того, была ли начальная CRISPR/Cas9-индуцированная модификация продуцирована с помощью HR или NHEJ, зависит от степени сходства последовательностей между двумя аллелями геномного локуса-мишени. Это наблюдение подразумевает, что CRISPR/Cas9-индуцированная модификация гомозиготного гена, является гомологически зависимым явлением. В подтверждение этого, CRISPR/Cas9-индуцированные гомозиготные модификации, часто сопровождаются потерей гетерозиготности (LOH) аллельной последовательности и структурных вариантов (варианты с одним нуклеотидом, SNV, или структурные варианты, SV), связанные с геномным локусом-мишенью на той же хромосоме, как показано в приведенных в данном документе примерах. LOH может либо включать локальный механизм конверсии генов для вариантов с обеих сторон геномного локуса-мишени, либо конверсию генов длинного диапазона (полярного конверсия гена), включающую все варианты на теломерной стороне геномного локуса-мишени. Такие события конверсии генов должны быть результатом управляемых гомологией механизмов митотической рекомбинации.
[000180] Эти знания служат руководством для разработки экспериментов гомозиготного нацеливания с помощью CRISPR/Cas9. Выбор участков-мишеней, в которых эти два аллеля разделяют высокую степень идентичности последовательности, дает наивысшие шансы на успех. Гомозиготное нацеливание с помощью CRISPR/Cas9 в участках-мишенях с высокой степенью вариации последовательности между двумя аллелями менее вероятно будет успешным. Даже при локусах с высокой плотностью SNV и SV, показатели успеха могут быть улучшены за счет использования направляющих РНК или нуклеазных агентов, которые узнают последовательности в пределах максимально возможного длинного участка непрерывной идентичности аллельной последовательности в геномном локусе-мишени или в пределах участков геномного локуса-мишени, в котором аллельная идентичность последовательности максимизируется.
[000181] Способы, описанные в данном документе, могут включать в себя выбор участка-мишени, так что идентичность последовательности может быть максимизирована для всей или части участка-мишени между соответствующими первой и второй хромосомами в гомологичной паре хромосом. В гибридных клетках последовательность на одной копии гомологичной пары хромосом обычно будет иметь некоторые отличия по сравнению с другой копией пары хромосом (например, однонуклеотидные вариации). Таким образом, такие способы могут включать в себя сравнение последовательности соответствующих первой и второй хромосом в гомологичной паре хромосом (например, клетка человека имеет 23 гомологичных пары хромосом) в геномном локусе-мишени и затем выбор участка-мишени в геномном локусе-мишени, таком как что идентичность последовательности максимизируется для всех или части участка-мишени между соответствующей первой и второй хромосомами в гомологичной паре хромосом. Если последовательности не доступны, такие способы могут дополнительно содержать сиквенирование геномного локуса-мишени на каждой отдельной хромосоме в паре гомологичных хромосом перед сравнением последовательности.
[000182] Участок-мишень может содержать, состоять по существу из, состоять из, например, любого сегмента или участка, нацеленных с помощью одной из двух или более направляющих РНК или одной или более экзогенной матрицы для репарации в описанных в данном документе способах, или любого сегмента или участка, фланкирующих сегмент или участок, нацеленного с помощью одной из двух или более направляющих РНК или один или более экзогенной матрицы для репарации в описанных в данном документе способах. Участок-мишень может быть смежной геномной последовательностью или несмежной геномной последовательностью. Например, участок-мишень может содержать, состоять по существу из, или состоять из геномного сегмента или участка, нацеленных на делецию, геномного сегмента или участка, нацеленных на замену, или геномного сегмента или участка, нацеленных на вставку с помощью способов, описанных в данном документе, и/или могут содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей геномный сегмент или геномный участок, нацеленный на делецию, замену или вставку с помощью способов, описанных в данном документе. Предпочтительно, участок-мишень содержит, состоит по существу из, или состоит из последовательности непосредственно вверх по ходу транскрипции и/или последовательности непосредственно вниз по ходу транскрипции от участка, нацеленного на делецию, замену или вставку с помощью способов, описанных в данном документе (например, последовательность вверх по ходу транскрипции и/или вниз по ходу транскрипции от участка между двумя последовательностями, распознаваемыми направляющей РНК, или сайтами расщепления, или последовательность вверх по ходу транскрипции и/или вниз по ходу транскрипции участка между 5' и 3' последовательностями-мишенями экзогенной матрицы для репарации). В качестве примера, если используются две направляющие РНК, участок-мишень может содержать, состоять по существу из, состоять из 5' (т.е., вверх по ходу транскрипции) и 3' (т.е., вниз по ходу транскрипции) последовательности, фланкирующей участок между последовательностями, распознаваемыми направляющей РНК, или сайтами расщепления Cas. Примеры длин фланкирующих последовательностей описаны в другом месте данного документа.
[000183] В некоторых способах, например, сначала может быть создана экзогенная матрица для репарации, и затем могут быть созданы направляющей РНК в участке, фланкированном с помощью 5'- и 3'-последовательностей-мишеней экзогенной матрицы для репарации, чтобы максимизировать идентичность последовательности в участках внутри, и/или фланкирующие (5' сторона, 3' сторона, или с каждой стороны) последовательности, распознаваемые направляющей РНК (например, фланкирующие участок между двумя последовательностями, распознаваемыми направляющей РНК, наиболее удаленных друг от друга, если используются две или более направляющие РНК). Альтернативно, в некоторых способах, например, сначала могут быть созданы две или более направляющих РНК, и затем может быть создана экзогенная матрица для репарации, так что 5' и 3' последовательности-мишени фланкируют две или более последовательности, распознаваемые направляющей РНК, и так что идентичность последовательности максимизируется в участках внутри и/или фланкированных (5' сторона, 3' сторона или каждая сторона) 5'- и 3'- последовательностей-мишеней (например, фланкирующих участок между 5'- и 3'- последовательностей-мишеней).
[000184] В качестве примера, участок-мишень может содержать, состоять по существу из, или состоять из последовательности, распознаваемой направляющей РНК, для одной из двух или более направляющих РНК. Альтернативно или, кроме того, участок-мишень может содержать, состоять по существу из, состоять из 5'- и/или 3'-последовательности, фланкирующей последовательность, распознаваемую направляющей РНК. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000185] В качестве другого примера, участок-мишень может содержать, состоять по существу из, или состоять из двух или более последовательностей, распознаваемых направляющей РНК. Альтернативно или, кроме того, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'- последовательности, фланкирующей последовательности, распознаваемые направляющей РНК. В способах, в которых используются две направляющие РНК, например, участок-мишень может содержать, состоять по существу из, или состоять из геномного участка, фланкированного с помощью двух последовательностей, распознаваемых направляющей РНК, или сайтов расщепления или геномного участка, фланкированного с помощью и включающей две последовательности, распознаваемые направляющей РНК, или сайты расщепления. Альтернативно или, кроме того, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'- последовательности, фланкирующей участок между двумя последовательностями, распознаваемыми направляющей РНК, или сайтами расщепления, или фланкирующей участки между и включающей две последовательности, распознаваемые направляющей РНК, или сайты расщепления. Подобные участки-мишени могут быть выбраны способами, в которых используют более двух направляющих РНК, за исключением того, что вместо геномного участка, фланкированного с помощью двух последовательностей, распознаваемых направляющей РНК, или сайтами расщепления, как указано выше, будет геномный участок, фланкированный с помощью последовательностей, распознаваемых направляющей РНК, сайтов расщепления, наиболее удаленных друг от друга. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120,130, 140 или 150 т.п.о. фланкирующей последовательности.
[000186] В способах, в которых используется экзогенная матрица для репарации, например, участок-мишень может содержать, состоять по существу из, или состоять из участка, фланкированного с помощью 5'- и 3'-последовательностей-мишеней, или участка, фланкированного с помощью и включающей 5' и 3'-последовательности-мишени. Альтернативно или дополнительно, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей геномный участок между 5'- и 3'-последовательностями-мишенями, или 5'- и/или 3'-последовательности, фланкирующей геномный участок между 5'- и 3'-последовательностями-мишенями. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9,10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000187] Аллельная идентичность последовательности может быть максимизирована для
всего участка-мишени или части участка-мишени. В качестве примера, аллельная идентичность последовательности может быть максимизирована для геномного участка, соответствующего по меньшей мере одной или каждой последовательности, узнаваемой направляющей РНК, или для участков, содержащих по меньшей мере одну или каждую последовательность, узнаваемую направляющей РНК. Например, аллельная идентичность последовательности может быть максимизирована для по меньшей мере одной или каждой последовательности, узнаваемой направляющей РНК. Альтернативно, аллельная идентичность последовательности может быть максимизирована по меньшей мере для одной или каждой последовательности, узнаваемой направляющей РНК, и 5' и/или 3' последовательности, фланкирующей по меньшей мере одну или каждую последовательность, узнаваемую направляющей РНК. Альтернативно, аллельная идентичность последовательности может быть максимизирована для 5'- и/или 3'-последовательности, фланкирующей по меньшей мере одну или каждую последовательность, узнаваемую направляющей РНК. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000188] Альтернативно или дополнительно аллельная идентичность последовательности может быть максимизирована для геномных участков, соответствующих 5'- и/или 3'-последовательностей-мишеней, для экзогенной матрицы для репарации или для участков, содержащих по меньшей мере одну или каждую из 5'- и 3'-последовательностей-мишеней. Например, аллельная идентичность последовательности может быть максимизирована для по меньшей мере одной или каждой из 5' и 3'-последовательностей-мишеней. Альтернативно, аллельная идентичность последовательности может быть максимизирована по меньшей мере для одной или каждой из 5'- и 3'-последовательностей-мишеней и 5' и/или 3' последовательности, фланкирующей по меньшей мере одну или каждую из 5' и 3'-последовательностей-мишеней. Альтернативно, аллельная идентичность последовательности может быть максимизирована для 5' и/или 3' последовательности, фланкирующей по меньшей мере одну или каждую из 5' и 3'-последовательностей-мишеней. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90,100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000189] Альтернативно или дополнительно аллельная идентичность последовательности может быть максимизирована для последовательности, фланкирующей участок, являющийся мишенью для делеции, замены или вставки. Например, в способах, использующих две направляющие РНК, аллельная идентичность последовательности может быть максимизирована для 5'- и/или 3'-последовательности, фланкирующей участок между двумя сайтами расщепления или двумя последовательностями, распознаваемыми направляющей РНК. В способах, использующих три или более направляющие РНК, аллельная идентичность последовательности может быть максимизирована для 5' и/или 3' последовательности, фланкирующей участок между двумя сайтами расщепления или двумя последовательностями, распознаваемыми направляющей РНК, которые наиболее удалены друг от друга. В качестве другого примера, в способах, использующих экзогенную матрицу для репарации, аллельная идентичность последовательности может быть максимизирована для 5'- и/или 3'-последовательности, фланкирующей участок между 5'- и 3'-последовательностей-мишеней для экзогенной матрицы для репарации (то есть, геномный участок, являющийся мишенью для удаления с помощью экзогенной матрицы для репарации). 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50,100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности.
[000190] Выбор участка-мишени, так что идентичность последовательности максмизируется для всего или части участка-мишени между соответствующими первой и второй хромосомами в гомологичной паре хромосом, не обязательно означает поиск геномного локуса-мишени на первой и второй хромосомах в гомологичной хромосомной паре и отбор участка с наивысшей аллельной идентичностью последовательности относительно остальной части геномного локуса-мишени, но вместо этого могут приниматься во внимание другие факторы. Например, если участок-мишень содержит, состоит по существу из, или состоит из одной или более последовательностей, распознаваемых направляющей РНК, и/или последовательности, фланкирующей одну или более последовательностей, распознаваемых направляющей РНК, другие факторы, которые могут быть приняты во внимание, включают, например, такие предполагаемые последовательности, распознаваемые направляющей РНК, расположены в участке, независимо оттого, являются ли предполагаемые последовательности, распознаваемые направляющей РНК, уникальными, где внутри участка расположена предполагаемая последовательность, распознаваемая направляющей РНК, насколько успешные или конкретные предполагаемые последовательности, распознаваемые направляющей РНК в участке будут предсказаны, близость предполагаемых последовательностей, распознаваемых направляющей РНК, в пределах участка к подходящим 5'- и 3'-последовательностям мишеням для экзогенной матрицы для репарации, близость предполагаемых последовательностей, распознаваемых направляющей РНК в пределах участка к другим предполагаемым последовательностям, распознаваемым направляющей РНК, близость предполагаемых последовательностей, распознаваемых направляющей РНК, в пределах участка к мутации, являющейся мишенью для коррекции, и так далее. Например, предпочтительно последовательность, узнаваемая направляющей РНК, является уникальным сайтом-мишенью, отсутствующим в другом месте генома. См., например, US 2014/0186843, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Аналогично, специфичность направляющей РНК может относиться к и может быть оптимизирована путем изменения содержания GC и длины последовательности нацеливания, и доступны алгоритмы для создания или оценки последовательности нацеливания направляющей РНК, которая минимизирует нецелевое связывание или взаимодействие направляющей РНК. См., например, WO 2016/094872, включенную в данном документе в качестве ссылки в полном объеме для всех целей. В некоторых способах, можно рассматривать или использовать белки Cas9 из разных видов (например, 5. pyogenes Cas9 и 5. aureus Cas9) для увеличения количества потенциальных последовательностей, распознаваемых направляющей РНК, связанных с увеличением количества доступных последовательностей РАМ.
[000191] В одном примере, участок-мишень может быть выбран так, чтобы весь или часть участка-мишени обладал высоким процентом идентичности последовательности между соответствующими первой и второй хромосомами в гомологичной паре хромосом. Например, участок-мишень может быть выбран так, чтобы весь или часть участка-мишени обладал минимальным процентом идентичности последовательности между соответствующими первой и второй хромосомами в гомологичной паре хромосом, такой как по меньшей мере 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99%, 99,1%, 99,2%, 99,3%, 99,4%, 99,5%, 99,55%, 99,6%, 99,65%, 99,7%, 99,75%, 99,8%, 99,85%, 99,9%, 99,95% или 100% идентичности последовательности.
[000192] В другом примере, участок-мишень может быть выбран так, чтобы весь или часть участка-мишени имел низкое количество или низкую плотность одиночных нуклеотидных вариаций между соответствующими первой и второй хромосомами в гомологичной паре хромосом. Например, участок-мишень может быть выбран так, чтобы весь или часть участка-мишени обладал максимальной плотностью одиночных нуклеотидных вариаций между соответствующими первой и второй хромосомами в гомологичной паре хромосом, такой как не более чем 5, 4,9, 4,8, 4,7, 4,6, 4,5, 4,4, 4,3, 4,2, 4,1, 4, 3,9, 3,8, 3,7, 3,6, 3,5, 3,4, 3,3, 3,2, 3,1, 3, 2,9, 2,8, 2,7, 2,6, 2,5, 2,4, 2,3, 2,2, 2,1, 2, 1,9, 1,8, 1,7, 1,6, 1,5, 1,4, 1,3, 1,2, 1,1, 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2, 0,1 или ноль одиночных нуклеотидов на т.п.о. последовательности.
[000193] Необязательно, участок-мишень может быть идентичен в соответствующей первой и второй хромосомах в гомологичной паре хромосом. Необязательно, участок-мишень может находится в пределах максимально возможного участка непрерывной идентичности последовательности в геномном локусе-мишени.
[000194] Альтернативно или дополнительно участок-мишень в геномном локусе-мишени может быть выбран таким образом, что весь или часть участка-мишени имеет высокий процент идентичности последовательности или низкое количество, или низкую плотность одиночных нуклеотидных вариаций между соответствующими первой и второй хромосомами в гомологичной паре хромосом по отношению к другим участкам в пределах геномного локуса-мишени.
[000195] Например, участок-мишень может иметь более высокий процент идентичности последовательности или более низкую плотность одиночных нуклеотидных вариаций относительно всей или части остальной части геномного локуса-мишени. Например, участок-мишень может иметь по меньшей мере 99,9% идентичности последовательностей между соответствующими первой и второй гомологичными хромосомами, а остальная часть геномного локуса-мишени имеет не более чем 99,8% идентичности последовательности между соответствующими первой и второй хромосомами.
[000196] Например, участок-мишень может содержать, состоять по существу из, или состоять из одной или более геномных участков-мишеней, соответствующих одной или более последовательностям, распознаваемых направляющей РНК, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как геномные участки, соответствующие одной или более другим потенциальным последовательностям, распознаваемых направляющей РНК в геномном локусе-мишени. В качестве одного примера, участок-мишень может содержать, состоять по существу из, или состоять из по меньшей мере одной или каждой из одной или более последовательностей, распознаваемых направляющей РНК, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций по отношению к другим сегментам геномного локуса-мишени, таким как одна или более других потенциальных последовательностей, распознаваемых направляющей РНК в геномном локусе-мишени. В качестве еще одного примера, участок-мишень может содержать, состоять по существу из, или состоять из по меньшей мере одной или каждой из одной или более последовательности, распознаваемой направляющей РНК, и 5' и/или 3' последовательности, фланкирующей по меньшей мере одну или каждую из одной или более последовательностей, распознаваемых направляющей РНК, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, такую как одна или более других потенциальных последовательностей, распознаваемых направляющей РНК, и их 5' и/или 3' фланкирующей последовательности в геномном локусе-мишени. В еще одном примере участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей по меньшей мере одну или каждую из одной или более последовательностей, распознаваемых направляющей РНК, и участок-мишень может иметь высокий процент идентичности последовательностей или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как 5' и/или 3' фланкирующей последовательности одной или более других потенциальных последовательностей, распознаваемых направляющей РНК в геномном локусе-мишени. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000197] В способах, в которых используются две направляющие РНК, участок-мишень может содержать, состоять по существу из, или состоять из первого геномного участка-мишени, соответствующего последовательности, распознаваемой первой направляющей РНК, и/или второго геномного участка-мишени, соответствующего последовательности, распознаваемой второй направляющей РНК, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как геномные участки, соответствующие одной или более другим потенциальным последовательностям, распознаваемым направляющей РНК, в пределах геномного локуса-мишени. Например, участок-мишень может содержать, состоять по существу из, или состоять из последовательности, распознаваемой первой направляющей РНК, и/или последовательности, распознаваемой второй направляющей РНК, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций по отношению к другим сегментам геномного локуса-мишени, таким как одна или более других потенциальных последовательностей, распознаваемых направляющей РНК в геномном локусе-мишени. В качестве другого примера участок-мишень может содержать, состоять по существу из, или состоять из большого процента последовательности, распознаваемой первой направляющей РНК, и 5' и/или 3' последовательности, фланкирующей последовательность, распознаваемую первой направляющей РНК, и/или последовательность, распознаваемую второй направляющей РНК, и 5' и/или 3' последовательности, фланкирующей последовательность, распознаваемую второй направляющей РНК, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как геномные участки, соответствующие одной или более другим потенциальным последовательностям, распознаваемым направляющей РНК, и их 5' и/или 3' фланкирующей последовательности в геномном локусе-мишени. В еще одном примере, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей последовательность, распознаваемую первой направляющей РНК, и/или 5'- и/или 3'-последовательности, фланкирующей последовательность, распознаваемую второй направляющей РНК, а участок-мишень может иметь высокий процент идентичности последовательностей или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как 5' и/или 3'-последовательности, фланкирующей одну или более других потенциальных последовательностей, распознаваемых направляющей РНК в геномном локусе-мишени. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000198] Таким образом, в способах, в которых рассматривается одна направляющая РНК при выборе участка-мишени, например, выбор участка-мишени может включать в себя сравнение двух или более сегментов геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, состоит из последовательности узнавания другой направляющей РНК, не присутствующей в другом месте в геноме, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или на каждой стороне последовательности узнавания другой направляющей РНК, и выбирается как участок-мишень сегмента, имеющего самый высокий процент идентичности последовательности по отношению к другим сегментам. Если используются две или более направляющих РНК, способ может включать в себя выбор в качестве участка-мишени двух или более сегментов, имеющих самый высокий процент идентичности последовательности по сравнению с другими сегментами. Необязательно, один или более сегментов могут содержать, состоят по существу из, или состоят из сегментов, соответствующих каждой последовательности, узнаваемой направляющей РНК, в геномном локусе-мишени, но не присутствуют в другом месте в геноме.
[000199] Альтернативно или дополнительно, в способах, в которых используются две направляющие РНК, участок-мишень может содержать, состоять по существу из, или состоять из участка между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, а участок-мишень может иметь высокий процент идентичности последовательностей или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как участок между одной или более другими потенциальными последовательностями, распознаваемыми направляющей РНК, или сайтами расщепления в геномном локусе-мишени. Если используются три или более направляющие РНК, то соответствующий участок будет участком между двумя последовательностями, распознаваемыми направляющей РНК, или двумя сайтами расщепления, которые наиболее удалены друг от друга.
[000200] Таким образом, в способах, в которых используются две направляющие РНК, например, выбор участка-мишени может включать в себя сравнение двух или более сегментов геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК, не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности по сравнению с другими сегментами. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК, в геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК, отсутствуют в другом месте генома.
[000201] Альтернативно или дополнительно, в способах, в которых используются две направляющие РНК, участок-мишень может содержать, состоять по существу из, или состоять из участка между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, и 5' и/или 3'-последовательности, фланкирующей геномный участок между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как участок между одной или более парами разных потенциальных последовательностей, распознаваемых направляющей РНК, или сайтами расщепления в пределах геномного локуса-мишени, и 5'-и/или 3'-последовательности, фланкирующей геномный участок между одной или более парами разных потенциальных последовательностей, распознаваемых направляющей РНК, или сайтами расщепления. Предпочтительно участок-мишень может содержать, состоять по существу из, или состоять из геномного участка между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, и 5'- и 3'-последовательности, фланкирующей геномный участок между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, и участок-мишень может иметь высокий процент идентичности последовательностей или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как участок между одной или более парами разных потенциальных последовательностей, распознаваемых направляющей РНК, или сайтами расщепления в пределах геномного локуса-мишени, и 5'- и 3'-последовательности, фланкирующей геномные участки между одной или более парами разных потенциальных последовательностей, распознаваемых направляющей РНК, или сайтами расщепления. Если используются три или более направляющие РНК, то соответствующим участком будет 5' и/или 3' последовательность, фланкирующая геномный участок между двумя последовательностями, распознаваемыми направляющей РНК, или двумя сайтами расщепления, которые наиболее удалены друг от друга. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000202] Таким образом, в способах, в которых используются две направляющие РНК, например, выбирается участок-мишень которая может включать в себя сравнение двух или более сегментов геномного локуса-мишени, причем каждый сегмент содержит, по существу состоит из, или состоит из участка между парой разных последовательностей, распознаваемых направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне или на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК, не присутствуют в другом месте генома, и выбираются в качестве участка-мишени сегмента, имеющего самый высокий процент идентичности последовательности относительно других сегментов. Необязательно, один или более сегментов содержат, состоят по существу из, или состоят из сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК, в геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК, отсутствуют в другом месте генома.
[000203] Альтернативно или дополнительно, в способах, в которых используются две направляющие РНК, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей геномный участок между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как 5' и/или 3'-последовательность, фланкирующую геномные участки между одной или более других пар потенциальных последовательностей, распознаваемых направляющей РНК, или сайтов расщепления в пределах геномного локуса-мишени. Предпочтительно, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и 3'-последовательности, фланкирующей геномный участок между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления, и участок-мишень может иметь высокий процент идентичности последовательностей или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени, таких как 5'- и 3'-последовательности, фланкирующей геномный участок между одной или более парами разных потенциальных последовательностей, распознаваемых направляющей РНК, или сайтов расщепления в пределах геномного локуса-мишени. Если используются три или более направляющие РНК, то соответствующим участком будет 5' и/или 3' последовательность, фланкирующая геномный участок между двумя последовательностями, распознаваемыми направляющей РНК, или двумя сайтами расщепления, которые наиболее удалены друг от друга. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000204] Таким образом, в способах, в которых используются две направляющие РНК, например, выбирается участок-мишень который может включать в себя сравнение двух или более несмежных сегментов геномного локуса-мишени, причем каждый несмежный сегмент содержит, по существу состоит из, или состоит из по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о., 1000 п.о., 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о. или 150 т.п.о. фланкирующей последовательности на 5'-стороне, 3'-стороне или на каждой стороне геномного участка между парой разных последовательностей, распознаваемых направляющей РНК, причем последовательности, распознаваемые направляющей РНК, не присутствуют в другом месте генома, и выбираются в качестве участка-мишени несмежного сегмента, имеющего самый высокий процент идентичности последовательности относительно других несмежных сегментов. Необязательно, один или более несмежных сегментов содержат, состоят по существу из, или состоят из несмежных сегментов, соответствующих каждой паре разных последовательностей, распознаваемых направляющей РНК в геномном локусе-мишени, причем последовательности, распознаваемые направляющей РНК, отсутствуют в другом месте генома.
[000205] В способах, в которых используются экзогенные матрицы для репарации, участок-мишень может содержать, состоять по существу из, или состоять из участка между 5'- и 3'-последовательностями-мишенями, а участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. Альтернативно или дополнительно участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательностей-мишеней, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. Предпочтительно, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и 3'-последовательностей-мишеней, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. Например, участок-мишень может содержать, состоять по существу из, или состоять из участка, фланкированного и включающего 5' и 3' последовательности-мишени, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени.
[000206] Аналогично, в способах, в которых используется экзогенная матрица для репарации, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и/или 3'-последовательности, фланкирующей геномный участок между 5' и 3' последовательностями-мишенями экзогенной матрицы для репарации, или 5' и/или 3' последовательности, фланкирующей геномный участок между и включающий 5' и 3' последовательности-мишени экзогенной матрицы для репарации, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. Предпочтительно, участок-мишень может содержать, состоять по существу из, или состоять из 5'- и 3'-последовательности, фланкирующей геномный участок между 5' и 3' последовательностями-мишенями экзогенной матрицы для репарации, или в пределах 5' и 3' последовательности, фланкирующей геномный участок между и включающий 5' и 3'-последовательности-мишени экзогенной матрицы для репарации, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса мишени. Альтернативно, участок-мишень может содержать, состоять по существу из, или состоять из участка между 5'- и 3'-последовательностями-мишенями экзогенной матрицы для репарации, и 5'- и/или 3'-последовательности, фланкирующей геномный участок между 5' и 3'-последовательностями-мишенями, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. Предпочтительно, участок-мишень может содержать, состоять по существу из, или состоять из участка между 5'- и 3'-последовательностями-мишенями экзогенной матрицы для репарации, и 5'- и 3'-последовательности, фланкирующей геномный участок между 5' и 3'-последовательностями-мишенями, и участок-мишень может иметь высокий процент идентичности последовательности или низкую плотность одиночных нуклеотидных вариаций относительно других сегментов геномного локуса-мишени. 5'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности. Аналогично, 3'-фланкирующая последовательность может быть, например, по меньшей мере 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 п.о. фланкирующей последовательности или по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или 150 т.п.о. фланкирующей последовательности.
[000207] Участок-мишень, модифицированный описанными в данном документе способами, может включать в себя любой сегмент или участок (смежный или несмежный) ДНК внутри клетки. Участок-мишень может быть родным для клетки, может представлять собой гетерологичный или экзогенный сегмент ДНК, который был интегрирован в геном клетки или может быть их комбинацией. Такие гетерологичные или экзогенные сегменты ДНК могут включать трансгены, экспрессионные кассеты, полинуклеотидные кодирующие селективные маркеры, или гетерологичные или экзогенные участки геномной ДНК.
В. CRISPR/Cas системы
[000208] Способы, описанные в настоящем документе, используют короткие палиндромные
повторы, регулярно расположенные группами (CRISPR)/CRISPR (Саs)-ассоциированные системы или компоненты таких систем для модификации генома в клетке. Системы CRISPR/Cas включают транскрипты и другие элементы, участвующие в экспрессии или управлении активностью генов Cas. Система CRISPR/Cas может быть системой типа I, типа II или типа III. Альтернативно, система CRISPR/Cas может быть, например, системой типа V (например, подтипом V-A или подтипом V-B). Способы и композиции, описанные в данном документе, используют системы CRISPR/Cas, используя комплексы CRISPR (содержащие направляющую РНК (гРНК), образованную комплексом с белком Cas) для сайт-направленного расщепления нуклеиновых кислот.
[000209] Системы CRISPR/Cas, используемые в описанных в данном документе способах, являются не встречающимися в природе. Система «не встречающаяся в природе» включает в себя что-либо, указывающее на вмешательство человека, такое как один или более компонентов системы, которые изменяются или мутируют из их природного состояния, будучи по меньшей мере по существу свободными по меньшей мере от одного другого компонента с которыми они естественным образом связаны в природе, или связаны с по меньшей мере одним другим компонентом, с которым они не связаны естественным образом. Например, в некоторых системах CRISPR/Cas используются не встречающиеся в природе комплексы CRISPR, содержащие гРНК и белок Cas, которые не встречаются в природе вместе. В других системах CRISPR/Cas используется белок Cas, который не встречается в природе, а в других системах CRISPR/Cas используется гРНК, которая не возникает естественным образом.
(1) Cas Белки
[000210] Белки Cas обычно содержат по меньшей мере одну РНК узнавания или связывающий домен, который может взаимодействовать с направляющими РНК (гРНК, описанными более подробно ниже). Cas белки также могут содержать нуклеазные домены (например, домены ДНКазы или РНКазы), ДНК-связывающие домены, домены геликазы, домены белок-белок взаимодействия, домены димеризации и другие домены. Домен нуклеазы обладает каталитической активностью для расщепления нуклеиновой кислоты, которая включает разрывы ковалентных связей молекулы нуклеиновой кислоты. Расщепление может продуцировать тупые концы или ступенчатые концы, и оно может быть одноцепочечным или двухцепочечным. Например, белок типа Cas9 дикого типа, как правило, создает «тупой» продукт расщепления. Альтернативно, белок Cpf1 дикого типа (например, FnCpf1) может приводить к продукту разрыва с 5-нуклеотидным 5'-«липким» концом, причем расщепление происходит после 18-й пары оснований из последовательности РАМ на нецелевой цепочке и после 23-й пары оснований на целевой цепочке. Белок Cas может иметь полную активность расщепления для создания двухцепочечных разрывов в нуклеиновой кислоте-мишени (например, двухцепочечный разрыв с «тупыми» концами), или он может быть никазой, которая создает одноцепочечный разрыв в нуклеиновой кислоте-мишени.
[000211] Примеры Cas белков включают Cas1, Cas1B, Cas2, Cas3, Cas4, Cas5, Cas5e (CasD), Cas6, Cas6e, Cas6f, Cas7, Cas8a1, Cas8a2, Cas8b, Cas8c, Cas9 (Csn1 или Csx12), Cas10, Casl0d, CasF, CasG, CasH, Csy1, Csy2, Csy3, Cse1 (CasA), Cse2 (CasB), Cse3 (CasE), Cse4 (CasC), Csc1, Csc2, Csa5, Csn2, Csm2, Csm3, Csm4, Csm5, Csm6, Cmr1, Cmr3, Cmr4, Cmr5, Cmr6, Csb1, Csb2, Csb3, Csx17, Csx14, Csx10, Csx16, CsaX, Csx3, Csx1, Csx15, Csf1, Csf2, Csf3, Csf4, и Cu1966, и гомологи или их модифицированные варианты.
[000212] Иллюстративный белок Cas представляет собой белок Cas9 или белок, полученный из белка Cas9 из системы CRISPR/Cas типа II. Белки Cas9 относятся к системе CRISPR/Cas типа II и, как правило, имеют четыре ключевых мотива с сохраненной архитектурой. Мотивы 1, 2 и 4 являются RuvC-подобными мотивами, а мотив 3 представляет собой мотив HNH. Иллюстративные белки Cas9 взяты из Streptococcus pyogenes, Streptococcus thermophilus, Streptococcus sp., Staphylococcus aureus, Nocardiopsis dassonvillei, Streptomyces pristinaespiralis, Streptomyces viridochromogenes, Streptomyces viridochromogenes, Streptosporangium roseum, Streptosporangium roseum, Alicyclobacillus acidocaldarius, Bacillus pseudomycoides, Bacillus selenitireducens, Exiguobacterium sibiricum, Lactobacillus delbrueckii, Lactobacillus salivarius, Microscilla marina, Burkholderiales bacterium, Polaromonas naphthalenivorans, Polaromonas sp., Crocosphaera watsonii, Cyanothece sp., Microcystis aeruginosa, Synechococcus sp., Acetohalobium arabaticum, Ammonifex degensii, Caldicelulosiruptor becscii, Candidatus Desulforudis, Clostridium botulinum, Clostridium difficile, Finegoldia magna, Natranaerobius thermophilus, Pelotomaculum thermopropionicum, Acidithiobacillus caldus, Acidithiobacillus ferrooxidans, Allochromatium vinosum, Marinobacter sp., Nitrosococcus halophilus, Nitrosococcus watsoni, Pseudoalteromonas haloplanktis, Ktedonobacter racemifer, Methanohalobium evestigatum, Anabaena variabilis, Nodularia spumigena, Nostoc sp., Arthrospira maxima, Arthrospira platensis, Arthrospira sp., Lyngbya sp., Microcoleus chthonoplastes, Oscillatoria sp., Petrotoga mobilis, Thermosipho africanus, Acaryochloris marina, Neisseria meningitidis, или Campylobacter jejuni. Дополнительные примеры членов семейства Cas9 описаны в WO 2014/131833, включенном в данном документе в качестве ссылки во всей полноте для всех целей. Cas9 из S. pyogenes (SpCas9) (присвоен номер доступа SwissProt Q99ZW2) является иллюстративным белком Cas9. Cas9 от S. aureus (Sa Cas9) (присвоен номер доступа UniProt J7RUA5) является еще одним иллюстративным белком Cas9. Cas9 от Campylobacter jejuni (CjCas9) (присвоен номер доступа Q0P897) является еще одним иллюстративным белком Cas9. См., например, Kim et al. (2017) Nat. Comm. 8:14500, включенный в данный документ в качестве ссылки во всей полноте для всех целей. SaCas9 меньше, чем SpCas9, a CjCas9 меньше, чем и SaCas9, и SpCas9.
[000213] Другим примером белка Cas является белок Cpf1 (CRISPR из Prevotella и Francisella 1). Cpf1 представляет собой большой белок (около 1300 аминокислот), который содержит RuvC-подобный нуклеазный домен, гомологичный соответствующему домену Cas9 аналога с сопоставлением с характерным богатым аргинином кластера Cas9. Однако, в Cpf1 отсутствует нуклеазный домен HNH, который присутствует в белках Cas9, и RuvC-подобный домен является непрерывным в последовательности Cpf1, в отличие от Cas9, где он содержит длинные вставки, включая домен HNH. См., например, Zetsche et al. (2015) Cell 163(3):759-771, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Иллюстративные Cpf1 белки взяты от Francisella tularensis 1, Francisella tularensis subsp. novicida, Prevotella albensis, Lachnospiraceae bacterium MC2017 1, Butyrivibrio proteoclasticus, Peregrinibacteria bacterium GW2011_GWA2_33_10, Parcubacteria bacterium GW2011_GWC2_44_17, Smithella sp. SCADC, Acidaminococcus sp. BV3L6, Lachnospiraceae bacterium MA2020, Candidatus Methanoplasma termitum, Eubacterium eligens, Moraxella bovoculi 237, Leptospira inadai, Lachnospiraceae bacterium ND2006, Porphyromonas crevioricanis 3, Prevotella disiens, и Porphyromonas macacae. Cpf1 от Francisella novicida U112 (FnCpf1, присвоен номер доступа UniProt A0Q7Q2) является иллюстративным белком Cpf1.
[000214] Белки Cas могут представлять собой белки дикого типа (т.е., те, которые встречаются в природе), модифицированные белки Cas (например, варианты белка Cas) или фрагменты дикого типа или модифицированные белки Cas. Белки Cas могут также быть активными вариантами или фрагментами в отношении каталитической активности дикого типа или модифицированных белков Cas. Активные варианты или фрагменты в отношении каталитической активности могут содержать по меньшей мере 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более идентичности последовательности с диким типом или модифицированным белком Cas или его частью, причем активные варианты сохраняют способность разрезаться на желаемом сайте расщепления и, следовательно, удерживать индуцирующую одноцепочечные разрывы или индуцирующую двухцепочечные разрывы активность. Известны анализы индуцирующей одноцепочечные разрывы или индуцирующей двухцепочечные разрывы активности, и, как правило, измеряют общую активность и специфичность белка Cas на ДНК-субстратах, содержащих сайт расщепления.
[000215] Одним из примеров модифицированного белка Cas является модифицированный белок SpCas9-HF1, который представляет собой вариант высокой точности Streptococcus pyogenes Cas9, несущий изменения (N497A/R661A/Q695A/Q926A), предназначенные для уменьшения неспецифических контактов ДНК. См., например, Kleinstiver et al. (2016) Nature 529(7587):490-495, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Другим примером модифицированного белка Cas является модифицированный вариант eSpCas9 (K848A/K1003A/R1060A), предназначенный для уменьшения эффектов вне цели. См., например, Slaymaker et al. (2016) Science 351(6268):84-88, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Другие варианты SpCas9 включают K855A и K810A/K1003A/R1060A.
[000216] Белки Cas могут быть модифицированы для увеличения или уменьшения одной, или более аффинности связывания нуклеиновой кислоты, специфичности связывания нуклеиновой кислоты и ферментативной активности. Белки Cas также могут быть модифицированы для изменения любой другой активности или свойства белка, таких как стабильность. Например, один или более нуклеазных доменов белка Cas могут быть модифицированы, удалены или инактивированы, или белок Cas может быть усечен для удаления доменов, которые не являются существенными для функции белка или для оптимизации (например, усиливают или уменьшают) активность белка Cas.
[000217] Белки Cas могут содержать по меньшей мере один нуклеазный домен, такой как домен ДНКазы. Например, белок Cpf1 дикого типа обычно содержит RuvC-подобный домен, который расщепляет обе цепи ДНК-мишени, возможно, в димерной конфигурации. Белки Cas могут также содержать по меньшей мере два домена нуклеазы, такие как домены ДНКазы. Например, белок Cas9 дикого типа обычно содержит RuvC-подобный нуклеазный домен и HNH-подобный нуклеазный домен. Домены RuvC и HNH могут каждый вырезать другую нить двухцепочечной ДНК, чтобы сделать двухцепочечный разрыв в ДНК. См., например, Jinek et al. (2012) Science 337:816-821, включенный в данный документ в качестве ссылки во всей полноте для всех целей.
[000218] Один или оба домена нуклеазы могут быть удалены или мутированы, так что они перестали функционировать или имели уменьшенную активность нуклеазы. Если один из нуклеазных доменов удален или мутирован, полученный белок Cas (например, Cas9) может быть упомянут как никаза и может генерировать одноцепочечный разрыв в последовательности, узнаваемой направляющей РНК в двухцепочечной ДНК, но не двухцепочечный разрыв (т.е. он может расщеплять комплементарную нить или не комплементарную нить, но не то и другое). Если оба нуклеазных домена удалены или мутированы, полученный белок Cas (например, Cas9) будет иметь уменьшенную способность расщеплять обе нити двухцепочечной ДНК (например, нуклеаза-ноль белка Cas). Примером мутации, которая превращает Cas9 в никазу, является мутация D10A (аспартат к аланину в положении 10 из Cas9) в RuvC-домене Cas9 из S. pyogenes. Аналогично, Н939А (гистидин на аланин в положении 839 аминокислоты) или Н840А (гистидин на аланин в положении 840 аминокислоты) или N863A (аспарагин на аланин в положении N863 аминокислоты) в HNH-домене Cas9 из 5. pyogenes может преобразовывать Cas9 в никазу. Другие примеры мутаций, которые превращают Cas9 в никазу, включают соответствующие мутации в Cas9 из S. thermophilus. См., например, Sapranauskas et al. (2011) Nucleic Acids Research 39:9275-9282 и WO 2013/141680, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Такие мутации могут быть получены с использованием таких способов, как сайт-направленный мутагенез, ПЦР-опосредованный мутагенез или общий синтез генов. Примеры других мутаций, создающих никазы, можно найти, например, в WO 2013/176772 и WO 2013/142578, каждый из которых включен в настоящий документ посредством ссылки во всей их полноте для всех целей. Если все нуклеазные домены удалены или мутированы в белке Cas (например, оба нуклеазных домена удалены или мутированы в белке Cas9), полученный белок Cas (например, Cas9) будет иметь уменьшенную способность расщеплять обе цепи двухцепочечной ДНК (например, нуклеаза-ноль или нуклеаза-неактивный белок Cas). Один конкретный пример представляет собой двойной мутант D10A/H840A S. pyogenes Cas9 или соответствующий двойной мутант в Cas9 от другого вида, когда он оптимально совпадаете S. pyogenes Cas9. Другой конкретный пример представляет собой двойной мутант D10A/N863A 5. pyogenes Cas9 или соответствующий двойной мутант в Cas9 от другого вида, когда он оптимально совпадает с S. pyogenes Cas9.
[000219] Также известны примеры инактивирующих мутаций в каталитических доменах белков Cas9 Staphylococcus aureus. Например, фермент Cas9 Staphyloccocus aureus (SaCas9) может содержать замещение в положении N580 (например, замещение N580A) и замещение в положении D10 (например, замещение D10A) с образованием нуклеаза-неактивного белка Cas. См., например, WO 2016/106236, включенную в данном документе в качестве ссылки в полном объеме для всех целей.
[000220] Также известны примеры инактивирующих мутаций в каталитических доменах белков Cpf1. Что касается белков Cpf1 от Francisella novicida U112 (FnCpf1), Acidaminococcus sp. BV3L6 (AsCpf1), бактерии Lachnospiraceae ND2006 (LbCpf1) и Moraxella bovoculi 237 (MbCpf1 Cpf1), такие мутации могут включать мутации в положениях 908, 993 или 1263 AsCpf1 или соответствующие положения в ортологах Cpf1, или в положениях 832, 925, 947, или 1180 из LbCpf1 или соответствующих положениях в ортологах Cpf1. Такие мутации могут включать, например, одну или более мутаций D908A, Е993А и D1263A AsCpf1 или соответствующих мутаций в ортологах Cpf1 или D832A, Е925А, D947A и D1180A LbCpf1 или соответствующих мутаций в ортологах Cpf1. См., например, US 2016/0208243, включенную в данном документе в качестве ссылки в полном объеме для всех целей.
[000221] Белки Cas также могут быть функционально связаны с гетерологичными полипептидами в виде слитых белков. Например, белок Cas может быть слит с доменом расщепления, доменом эпигенетической модификации, доменом активации транскрипции или доменом репрессора транскрипции. См., WO 2014/089290, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Белки Cas также могут быть слиты с гетерологичным полипептидом, обеспечивая повышенную или пониженную стабильность. Слитый домен или гетерологичный полипептид может быть расположен на N-конце, С-конце или внутри в белке Cas.
[000222] Примером слитого белка Cas является белок Cas, слитый с гетерологичным полипептидом, который обеспечивает субклеточную локализацию. Такие гетерологичные полипептиды могут включать, например, один или более сигналов ядерной локализации (NLS), таких как SV40 NLS для нацеливания на ядро, сигнал локализации митохондрий для нацеливания на митохондрии, сигнал удерживания ER и тому подобное. См., например, Lange et al. (2007) J. Biol. Chem. 282:5101-5105, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Другие подходящие NLS включают альфа-импортин NLS. Такие сигналы субклеточной локализации могут быть расположены на N-конце, С-конце или в любом месте в белке Cas. NLS может содержать участок основных аминокислот и может быть однокомпонентной последовательностью или двухкомпонентной последовательностью. Необязательно, белок Cas содержит два или более NLS, включая NLS (например, альфа-импортин NLS) на N-конце и/или NLS (например, SV40 NLS) на С-конце.
[000223] Белки Cas также могут быть функционально связаны с доменом проникновения в клетку. Например, домен проникновения в клетку, может быть получен из белка ТАТ ВИЧ-1, проницаемого TLM мотивом, проникающим через клетку из вируса гепатита В человека, MPG, Рер-1, VP22, пептида, проникающего в клетку, из вируса Herpes simplex, или полиаргининовой пептидной последовательности. См., например, WO 2014/089290, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Домен проникновения в клетку может быть расположен на N-конце, С-конце или где-либо в белке Cas.
[000224] Белки Cas также могут быть функционально связаны с гетерологичным полипептидом для удобства отслеживания или очистки, такого как флуоресцентный белок, метка очистки или метка эпитопа. Примеры флуоресцентных белков включают зеленые флуоресцентные белки (например, GFP, GFP-2, tagGFP, turboGFP, eGFP, Emerald, Azami Green, Monomeric Azami Green, CopGFP, AceGFP, ZsGreenl), желтые флуоресцентные белки (например, YFP, eYFP, цитрин, Venus, YPet, PhiYFP, ZsYellowl), синие флуоресцентные белки (например, eBFP, eBFP2, Azurite, mKalamal, GFPuv, Sapphire, Т-сапфир), голубые флуоресцентные белки (например, eCFP, Cerulean, CyPet, AmCyanl, Midoriishi-Cyan), красные флуоресцентные белки (mKate, mKate2, mPlum, DsRed мономер, mCherry, mRFP1, DsRed-Express, DsRed2, DsRed-мономер, HcRed-Tandem, HcRedl, AsRed2, eqFP611, mRaspberry, mStrawberry, Jred), оранжевые флуоресцентные белки (mOrange, mKO, Kusabira-Orange, Monomeric Kusabira-Orange, mTangerine, tdTomato) и любой другой подходящий флуоресцентный белок. Примеры меток включают глутатион-S-трансферазу (GST), белок, связывающий хитин (СВР), белок, связывающий мальтозу, тиоредоксин (TRX), поли(NANP), метку тандемной аффинной очистки (ТАР), myc, AcV5, AU1, AU5, Е, ECS, Е2, FLAG, гемагглютинин (НА), nus, Softag 1, Softag 3, Strep, SBP, Glu-Glu, HSV, KT3, S, S1, T7, V5, VSV-G, гистидин (His), белок-носитель биотина-карбоксила (BCCP) и калмодулин.
[000225] Белки Cas9 также могут быть привязаны к экзогенным матрицам для репарации или меченым нуклеиновым кислотам. Такую привязку (т.е. физическое связывание) может быть достигнуто посредством ковалентных взаимодействий или нековалентных взаимодействий, и привязка может быть прямой (например, путем прямого слияния или химической конъюгации, что может быть достигнуто путем модификации цистеиновых или лизиновых остатков на белке или интеиновой модификации) или может быть достигнуто посредством одного или более промежуточных линкеров или адаптационных молекул, таких как стрептавидин или аптамеры. См., например, Pierce et al. (2005) Mini Rev. Med. Chem. 5(1): 41-55; Duckworth et al. (2007) Angew. Chem. Int. Ed. Engl. 46(46):8819-8822; Schaeffer and Dixon (2009) Australian J. Chem. 62(10):1328-1332; Goodman et al. (2009) Chembiochem. 10(9):1551-1557; и Khatwani et al. (2012) Bioorg. Med. Chem. 20(14):4532-4539, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Нековалентные стратегии для конъюгатов синтеза белково-нуклеиновых кислот включают способы биотин-стрептавидина и никель-гистидина. Ковалентные конъюгаты белок-нуклеиновая кислота могут быть синтезированы путем соединения соответствующих функционализированных нуклеиновых кислот и белков с использованием широкого спектра химических веществ. Некоторые из этих химических веществ включают прямое присоединение олигонуклеотида к аминокислотному остатку на поверхности белка (например, лизин-амин или цистеин тиол), тогда как другие более сложные схемы требуют пост-трансляционной модификации белка или участия каталитического, или реактивного белкового домена. Способы ковалентного присоединения белков к нуклеиновым кислотам могут включать, например, химическое перекрестное сшивание олигонуклеотидов с белковыми остатками лизина или цистеина, экспрессию белок-лигирования, химиоферментные способы и использование фотоаптамеров. Экзогенную матрицу для репарации или меченую нуклеиновую кислоту можно связать с С-концом, N-концом или с внутренним участком внутри белка Cas9. Предпочтительно, экзогенная матрица для репарации или меченая нуклеиновая кислота привязана к С-концу или N-концу белка Cas9. Аналогично, белок Cas9 может быть привязан к 5'-концу, 3'-концу или к внутреннему участку в экзогенной матрице для репарации или меченной нуклеиновой кислоте. То есть, экзогенная матрица для репарации или меченая нуклеиновая кислота может быть привязана в любой ориентации и полярности. Предпочтительно, белок Cas9 привязан к 3'-концу или 3'-концу экзогенной матрицы для репарации или меченой нуклеиновой кислоты.
[000226] Белки Cas могут быть представлены в любой форме. Например, белок Cas может быть представлен в форме белка, такого как белок Cas образующий комплекс с гРНК. Альтернативно, белок Cas может быть представлен в форме нуклеиновой кислоты, кодирующей белок Cas, такой как РНК (например, матричная РНК (мРНК)) или ДНК. Необязательно, нуклеиновая кислота, кодирующая белок Cas, может быть кодон оптимизирована для эффективной трансляции в белке в конкретной клетке или организме. Например, нуклеиновая кислота, кодирующая белок Cas, может быть модифицирована для замены кодонов, имеющих более высокую частоту использования в бактериальной клетке, дрожжевой клетке, клетке человека, клетке не человека, клетке млекопитающего, клетке грызунов, клетке мыши, клетке крысы или любой другой представляющей интерес клетки-хозяина по сравнению с полинуклеотидной последовательностью природного происхождения. Когда нуклеиновая кислота, кодирующая белок Cas, вводится в клетку, белок Cas может быть временно, условно или конститутивно экспрессирован в клетке.
[000227] Нуклеиновые кислоты, кодирующие белки Cas, могут быть стабильно интегрированы в геном клетки и функционально связаны с промотором, активным в клетке. Альтернативно, нуклеиновые кислоты, кодирующие белки Cas, могут быть функционально связаны с промотором в экспрессирующей конструкции. Экспрессионные конструкты включают любые конструкты нуклеиновых кислот, способные направлять экспрессию представляющего интерес гена или другой нуклеиновой кислоты (например, ген Cas), и которые могут передавать такую представляющую интерес последовательность нуклеиновой кислоты в клетку-мишень. Например, нуклеиновая кислота, кодирующая белок Cas, может находиться в векторе нацеливания, содержащем вставку нуклеиновой кислоты, и/или векторе, содержащем ДНК, кодирующую гРНК. Альтернативно, он может быть в векторе или плазмиде, который отделен от вектора нацеливания, содержащего вставку нуклеиновой кислоты и/или отдельно от вектора, содержащего ДНК, кодирующую гРНК. Промоторы, которые могут быть использованы в экспрессионном конструкте, включают промоторы, активные, например, в одной или более эукариотической клетке, клетке человека, клетке не человека, клетке млекопитающего, клетке млекопитающего отличного от человека, клетке грызунов, клетке мыши, клетке крысы, клетке хомяка, клетке кролика, плюрипотентной клетке, эмбриональной стволовой клетке (ЭС) или зиготе. Такими промоторами могут быть, например, условные промоторы, индуцируемые промоторы, конститутивные промоторы или тканеспецифические промоторы. Необязательно, промотор может быть двунаправленным промотором, стимулирующим экспрессию как белка Cas в одном направлении, так и направляющей РНК в другом направлении. Такие двунаправленные промоторы могут состоять из (1) полного, обычного, однонаправленного промотора Pol III, который содержит 3 внешних элемента управления: дистальный элемент последовательности (DSE), проксимальный элемент последовательности (PSE) и блок TATA; и (2) второй базовый промотор Pol III, который включает в себя PSE и блок TATA, слитый с 5'-концом DSE в обратной ориентации. Например, в промоторе H1 DSE смежна с PSE и блоком TATA, и промотор может быть визуализирован двунаправленным путем создания гибридного промотора, в котором транскрипция в обратном направлении контролируется добавлением PSE и блока TATA, полученного из промотора U6. См., например, US 2016/0074535, включенную в данном документе в качестве ссылок в полном объеме для всех целей. Использование двунаправленного промотора для экспрессии генов, кодирующих белок Cas и направляющую РНК, одновременно позволяет генерировать компактные экспрессионные кассеты для облегчения доставки.
(2) Направляющие РНК
[000228] «Направляющая РНК» или «гРНК» представляет собой молекулу РНК, которая связывается с белком Cas (например, белком Cas9) и нацеливает белок Cas в конкретное место в ДНК-мишени. Направляющая РНК могут содержать два сегмента: «сегмент нацеливания ДНК» и «сегмент, связывающий белок». «Сегмент» включает в себя участок или область молекулы, такую как смежный участок нуклеотидов в РНК. Некоторые гРНК, например, для Cas9, могут содержать две отдельные молекулы РНК: «активатор-РНК» (например, малая некодирующая РНК) и «нацеливатель-РНК» (например, CRISPR-РНК или крРНК). Другие гРНК представляют собой одну молекулу РНК (один РНК-полинуклеотид), который также можно назвать «одномолекулярной гРНК», «одну направляющую РНК» или «огРНК». См., например, WO 2013/176772, WO 2014/065596, WO 2014/089290, WO 2014/093622, WO 2014/099750, WO 2013/142578 и WO 2014/131833, каждый из которых включен в данный документ посредством ссылки во всей их полноте для всех целей. Например, для Cas9 одна направляющая РНК может содержать крРНК, слитую с малой некодирующей РНК (например, через линкер). Для Cpf1, например, требуется только крРНК для достижения связывания с последовательностью-мишенью или расщепления. Термины «направляющая РНК» и «гРНК» включают как двухмолекулярные гРНК (т.е. модульные гРНК), так и одномолекулярные гРНК.
[000229] Иллюстративная двухмолекулярная гРНК содержит молекулу, крРНК-подобную («CRISPR РНК» или «направленность-РНК» или «крРНК» или «крРНК повтор»), и соответствующую малую некодирующую РНК-подобную молекулу («транс-действующую CRISPR-РНК» или «активатор-РНК» или "малую некодирующую РНК"). КрРНК включает как сегмент нацеливания ДНК (одноцепочечный) гРНК, так и участок нуклеотидов, который образует одну половину дуплекса дцРНК белка, связывающего сегмент гРНК.
[000230] Соответствующая малая некодирующая РНК (активатор-РНК) содержит участок нуклеотидов, который образует другую половину дуплекса дцРНК белка, связывающего сегмент гРНК. Участок нуклеотидов крРНК комплементарен и гибридизуется с участком нуклеотидов малой некодирующей РНК дцРНК с образованием дуплекса белок-связывающего домена гРНК. Таким образом, каждая крРНК, как можно сказать, имеет соответствующую малую некодирующую РНК.
[000231] В системах, в которых необходимы как крРНК, так и малая некодирующая РНК, крРНК и соответствующая малая некодирующая РНК гибридизуются с образованием гРНК. В системах, в которых требуется только крРНК, крРНК может быть гРНК. КрРНК дополнительно обеспечивает одноцепочечный сегмент ДНК-нацеливания, который гибридизуется с последовательностью, узнаваемой направляющей РНК. Если использовать для модификации внутри клетки, точная последовательность данной молекулы крРНК или малой некодирующей РНК может быть сконструирована так, чтобы быть специфичной к видам, в которых будут использоваться молекулы РНК. См., например, Mali et al. (2013) Science 339:823-826; Jinek et al. (2012) Science 337:816-821; Hwang et al. (2013) Nat. Biotechnol. 31:227-229; Jiang et al. (2013) Nat. Biotechnol. 31:233-239; и Cong et al. (2013) Science 339:819-823, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000232] Сегмент ДНК-нацеливания (крРНК) данной гРНК содержит нуклеотидную последовательность, которая комплементарна последовательности (то есть, последовательности, узнаваемой направляющей РНК) в ДНК-мишени. Сегмент ДНК-нацеливания гРНК взаимодействует с ДНК-мишенью последовательность-специфичным образом посредством гибридизации (т.е. спаривания оснований). Таким образом, нуклеотидная последовательность сегмента ДНК-нацеливания может изменяться и определяет местоположение в пределах ДНК-мишени, с которой будут взаимодействовать гРНК и ДНК-мишень. Сегмент ДНК-нацеливания исследуемой гРНК может быть модифицирован для гибридизации с любой желаемой последовательностью в ДНК-мишени. Встречающиеся в природе крРНК различаются в зависимости от системы CRISPR/Cas и организма, но часто содержат сегмент-мишень длиной между 21 до 72 нуклеотидов, фланкированный двумя прямыми повторами (DR) длиной между 21 до 46 нуклеотидов (см., например, WO 2014/131833, включенную в данный документ в качестве ссылки в полном объеме для всех целей). В случае 5. pyogenes DR является 36 нуклеотидов длиной, а сегмент-мишень является 30 нуклеотидов длиной. 3' расположенный DR является комплементарным и гибридизуется с соответствующей малой некодирующей РНК, которая, в свою очередь, связывается с белком Cas.
[000233] Сегмент ДНК-нацеливания может иметь длину по меньшей мере около 12 нуклеотидов, по меньшей мере около 15 нуклеотидов, по меньшей мере около 17 нуклеотидов, по меньшей мере около 18 нуклеотидов, по меньшей мере около 19 нуклеотидов, по меньшей мере около 20 нуклеотидов, по меньшей мере около 25 нуклеотидов, по меньшей мере около 30 нуклеотидов, по меньшей мере около 35 нуклеотидов или по меньшей мере около 40 нуклеотидов. Такие сегменты ДНК-нацеливания могут иметь длину от около 12 нуклеотидов до около 100 нуклеотидов, от около 12 нуклеотидов до около 80 нуклеотидов, от около 12 нуклеотидов до около 50 нуклеотидов, от около 12 нуклеотидов до около 40 нуклеотидов, от около 12 нуклеотидов до около 30 нуклеотидов, от около 12 нуклеотидов до около 25 нуклеотидов или от около 12 нуклеотидов до около 20 нуклеотидов. Например, сегмент ДНК-нацеливания может составлять от около 15 нуклеотидов до около 25 нуклеотидов (например, от около 17 нуклеотидов до около 20 нуклеотидов, или около 17 нуклеотидов, около 18 нуклеотидов, около 19 нуклеотидов или около 20 нуклеотидов). См., например, US 2016/0024523, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Для Cas9 из S. pyogenes типичный сегмент ДНК-нацеливания составляет между 16 и 20 нуклеотидов в длину или между 17 и 20 нуклеотидов в длину. Для Cas9 из S. aureus типичный сегмент ДНК-нацеливания составляет между 21 и 23 нуклеотидов в длину. Для Cpf1 типичный сегмент ДНК-нацеливания составляет по меньшей мере 16 нуклеотидов в длину или по меньшей мере 18 нуклеотидов в длину.
[000234] Малые некодирующие РНК могут быть в любой форме (например, полноразмерные малые некодирующие РНК или активные частичные малые некодирующие РНК) и различной длины. Они могут включать первичные транскрипты или обработанные формы. Например, малые некодирующие РНК (как часть одной направляющей РНК или как отдельная молекула как часть двухмолекулярной гРНК) могут содержать или состоять из всех или части последовательности малой некодирующей РНК дикого типа (например, около или более чем около 20, 26, 32, 45, 48, 54, 63, 67, 85 или более нуклеотидов последовательности малой некодирующей РНК дикого типа). Примеры последовательностей малой некодирующей РНК дикого типа из S. pyogenes включают 171-нуклеотидную, 89-нуклеотидную, 75-нуклеотидную и 65-нуклеотидную версии. См., например, Deltcheva et al. (2011) Nature 471:602-607; WO 2014/093661, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примеры малых некодирующих РНК в одной направляющей РНК (огРНК) включают сегменты малой некодирующей РНК, обнаруженные в версиях огРНК +48, +54, +67 и +85, где «+n» указывает, что до +n нуклеотида малая некодирующая РНК дикого типа включен в огРНК. См. US 8697359, включенный в данный документ в качестве ссылки во всей полноте для всех целей.
[000235] Процентная комплементарность между ДНК-нацеливающей последовательностью и последовательностью, узнаваемой направляющей РНК, в ДНК-мишени может составлять по меньшей мере 60% (например, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100%). Процентная комплементарность между последовательностью ДНК-нацеливания и последовательностью, узнаваемой направляющей РНК, в ДНК-мишени может составлять по меньшей мере 60% по сравнению с около 20 смежными нуклеотидами. В качестве примера, процентная комплементарность между ДНК-нацеливающей последовательностью и последовательностью, узнаваемой направляющей РНК, в ДНК-мишени составляет 100% по сравнению с 14 смежными нуклеотидами на 5'-конце последовательности, узнаваемой направляющей РНК, в комплементарной цепи ДНК-мишени и менее чем 0% по сравнению с оставшейся частью. В этом случае, последовательность ДНК-нацеливания можно считать 14 нуклеотидов в длину. В качестве еще одного примера, процентная комплементарность между ДНК-нацеливающей последовательностью и последовательностью, узнаваемой направляющей РНК, в ДНК-мишени составляет 100% по сравнению с семью смежными нуклеотидами на 5'-конце последовательности, узнаваемой направляющей РНК, в комплементарной цепи ДНК-мишени и менее чем 0% по сравнению с оставшейся частью. В этом случае, последовательность ДНК-нацеливания можно считать 7 нуклеотидов в длину. В некоторых направляющих РНК по меньшей мере 17 нуклеотидов в последовательности ДНК-мишени являются комплементарными ДНК-мишени. Например, последовательность ДНК-нацеливания может быть длиной 20 нуклеотидов и может содержать 1, 2 или 3 несоответствия с ДНК-мишенью (последовательность, узнаваемая направляющей РНК). Предпочтительно, несоответствия не смежны с последовательностью протоспейсера с соседним мотивом (РАМ) (например, несоответствия находятся на 5'-конце последовательности ДНК-нацеливания, или несоответствия составляют по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или 19 пар оснований вдали от последовательности РАМ).
[000236] Белок-связывающий сегмент гРНК может содержать два участка нуклеотидов, которые являются комплементарными друг другу. Комплементарные нуклеотиды белок-связывающего сегмента гибридизуются с образованием двухцепочечного дуплекса РНК (дцРНК). Белок-связывающий сегмент исследуемой гРНК, взаимодействуете белком Cas, и гРНК направляет связанный белок Cas к определенной нуклеотидной последовательности в ДНК-мишени через сегмент ДНК-нацеливания.
[000237] Одиночные направляющие РНК имеют сегмент ДНК-нацеливания и «скаффолд» последовательность (т.е. белок-связывающая или Cas-связывающая последовательность направляющей РНК). Иллюстративные «скаффолд» последовательности включают:

[000238] Направляющие РНК могут включать модификации или последовательности, которые обеспечивают дополнительные желательные функции (например, модифицированную или регулируемую стабильность; субклеточное нацеливание; отслеживание с флуоресцентной меткой; сайт связывания для белка или белкового комплекса; и тому подобное). Примеры таких модификаций включают, например, 5'-кэп (например, 7-метилгуанилат кэп (m7G)); 3'-полиаденилированный хвост (т.е. 3' поли(А) хвост); последовательность рибопереключателя (например, для обеспечения регулируемой стабильности и/или регулируемой доступности с помощью белков и/или белковых комплексов); последовательность контроля стабильности; последовательность, которая образует дуплекс дцРНК (т.е. шпильку); модификацию или последовательность, которая нацелена на РНК в субклеточном местоположении (например, ядро, митохондрии, хлоропласты и тому подобное); модификацию или последовательность, которая обеспечивает отслеживание (например, прямую конъюгацию с флуоресцентной молекулой, конъюгацию с мотивом, которая облегчает флуоресцентное обнаружение, последовательность, которая допускает флуоресцентное обнаружение и т.д.); модификацию или последовательность, которая обеспечивает сайт связывания для белков (например, белки, которые действуют на ДНК, включая активаторы транскрипции, транскрипционные репрессоры, ДНК-метилтрансферазы, ДНК-деметилазы, гистон-ацетилтрансферазы, гистон дезацетилазы и тому подобное); и их комбинации. Другие примеры модификаций включают в себя сконструированные дуплексные структуры стебель-петля, сконструированные участки выпуклостей, сконструированные шпильки 3' дуплексной структуры стебель-петля или любую их комбинацию. См., например, US 2015/0376586, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Выпуклость может быть непарным участком нуклеотидов внутри дуплекса, состоящей из крРНК-подобного участка и минимальной малой некодирующей РНК-подобного участка. Выпуклость может содержать на одной стороне дуплекса, неспаренную 5'-XXXY-3', где X представляет собой любой пурин, a Y может быть нуклеотидом, который может образовывать неоднозначную пару с нуклеотидом на противоположной нити, и неспаренный нуклеотидный участок на другой стороне дуплекса.
[000239] Направляющие РНК могут предоставляться в любой форме. Например, гРНК может быть представлена в форме РНК либо в виде двух молекул (отдельная крРНК и малая некодирующая РНК), либо в виде одной молекулы (огРНК) и, необязательно, в форме комплекса с белком Cas. Например, гРНК могут быть получены путем транскрипции in vitro с использованием, например, РНК-полимеразы Т7 (см., например, WO 2014/089290 и WO 2014/065596, каждый из которых включен в настоящий документ посредством ссылки во всей их полноте для всех целей). Направляющие РНК также могут быть получены химическим синтезом.
[000240] ГРНК также может быть представлена в форме ДНК, кодирующей гРНК. ДНК, кодирующая гРНК, может кодировать одну молекулу РНК (огРНК) или отдельные молекулы РНК (например, отдельную крРНК и малая некодирующая РНК). В последнем случае ДНК, кодирующая гРНК, может быть предоставлена в виде одной молекулы ДНК или в виде отдельных молекул ДНК, кодирующих крРНК и малую некодирующую РНК, соответственно.
[000241] Когда гРНК предоставляется в форме ДНК, гРНК может быть временно, условно или конститутивно экспрессирована в клетке. ДНК, кодирующие гРНК, могут быть стабильно интегрированы в геном клетки и функционально связаны с промотором, активным в клетке. Альтернативно, ДНК, кодирующие гРНК, могут быть функционально связаны с промотором в экспрессирующей конструкции. Например, ДНК, кодирующая гРНК, может быть в векторе, содержащем экзогенную матрицу для репарации и/или вектор, содержащий нуклеиновую кислоту, кодирующую белок Cas. Альтернативно, он может быть в векторе или плазмиде, которая отделена от вектора, содержащего экзогенную матрицу для репарации и/или вектор, содержащий нуклеиновую кислоту, кодирующую белок Cas. Промоторы, которые могут быть использованы в таких экспрессионных конструктах, включают промоторы, активные, например, в одной или более эукариотической клетке, клетке человека, клетке не человека, клетке млекопитающего, клетке млекопитающего отличного от человека, клетке грызунов, клетке мыши, клетке крысы, клетке хомяка, клетке кролика, плюрипотентной клетке, эмбриональной стволовой клетке (ЭС) или зиготе. Такими промоторами могут быть, например, условные промоторы, индуцируемые промоторы, конститутивные промоторы или тканеспецифические промоторы. Такими промоторами могут также быть, например, двунаправленные промоторы. Конкретные примеры подходящих промоторов включают промотор РНК-полимеразы III, такой как промотор U6 человека, промотор III полимеразы U6 крысы или промотор III полимеразы U6 мыши.
(3) Последовательности, распознаваемые направляющей РНК
[000242] Термин «последовательность, распознаваемая направляющей РНК» включает последовательности нуклеиновых кислот, присутствующие в ДНК-мишени, с которой связывается сегмент ДНК-нацеливания гРНК, при условии наличия достаточных условий для связывания. Например, последовательности, распознаваемые направляющей РНК, включают последовательности, в которых направляющая РНК сконструирована, чтобы иметь комплементарность, где гибридизация между последовательностью, распознаваемой направляющей РНК, и последовательностью ДНК-нацеливания способствует образованию комплекса CRISPR. Полная комплементарность необязательно требуется, при условии достаточной комплементарности, чтобы вызвать гибридизацию и способствовать формированию комплекса CRISPR. Последовательности, распознаваемые направляющей РНК, также включают сайты расщепления для белков Cas, описанные более подробно ниже. Последовательность, узнаваемая направляющей РНК может содержать любой полинуклеотид, который может быть расположен, например, в ядре или цитоплазме клетки, или внутри органеллы клетки, такой как митохондрия или хлоропласт.
[000243] Последовательность, узнаваемая направляющей РНК, в ДНК-мишени может быть нацелена с помощью (то есть быть связанной с помощью, или гибридизованной с, или быть комплементарной) белка Cas или гРНК. Подходящие условия связывания ДНК/РНК включают физиологические условия, обычно присутствующие в клетке. Другие подходящие условия связывания ДНК/РНК (например, условия в бесклеточной системе) известны в данной области техники (см., например, Molecular Cloning: A Laboratory Manual, 3rd Ed. (Sambrook et al., Harbor Laboratory Press 2001), включенный в данный документ в качестве ссылки во всей полноте для всех целей. Цепь ДНК-мишени, которая комплементарна и гибридизуется с белком Cas или гРНК, может быть названа «комплементарной цепью», а цепь ДНК-мишени, которая комплементарна «комплементарной цепи» (и поэтому не является комплементарной белку Cas или гРНК) может быть названа «некомплементарной цепью» или «матричной цепью».
[000244] Белок Cas может расщеплять нуклеиновую кислоту в сайте внутри или вне последовательности нуклеиновой кислоты, присутствующей в ДНК-мишени, с которой будет связываться сегмент ДНК-нацеливания гРНК. «Сайт расщепления» включает положение нуклеиновой кислоты, в котором белок Cas производит одноцепочечный разрыв или двухцепочечный разрыв. Например, образование комплекса CRISPR (содержащего гРНК, гибридизованную с последовательностью, узнаваемую направляющей РНК и образующую комплекс с белком Cas) может привести к расщеплению одной или обеих цепей в или вблизи (например, в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 50 или более пар оснований из) последовательности нуклеиновой кислоты, присутствующей в ДНК-мишени, с которой будет связываться сегмент ДНК-нацеливания гРНК. Если сайт расщепления находится за пределами последовательности нуклеиновой кислоты, с которой будет связываться сегмент ДНК-нацеливания гРНК, сайт расщепления по-прежнему считается находящимся в «последовательности, узнаваемой направляющей РНК». Сайт расщепления может находиться только на одной цепи или на обеих цепях нуклеиновой кислоты. Сайты расщепления могут находиться в одном и том же положении на обеих цепях нуклеиновой кислоты (продуцирующие «тупые» концы) или могут находиться в разных сайтах на каждой цепи (образуя ступенчатые концы (т.е. «липкие» концы)). Ступенчатые концы могут быть получены, например, с использованием двух белков Cas, каждый из которых производит одноцепочечный разрыв в другом сайте расщепления на другой цепи, тем самым создавая двухцепочечный разрыв. Например, первая никаза может создать одноцепочечный разрыв на первой цепочке двухцепочечной ДНК (дцДНК), а вторая никаза может создать одноцепочечный разрыв на второй цепочке дцДНК, так что создаются «нависающие» последовательности. В некоторых случаях последовательность никазы, узнаваемая направляющей РНК, на первой нити отделена от последовательности никазы, узнаваемой направляющей РНК, на второй цепи по меньшей мере на 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 40, 50, 75, 100, 250, 500 или 1000 пар оснований.
[000245] Сайт-специфическое связывание и расщепление ДНК-мишени с помощью белков Cas может происходить в местах, определяемых как (i) комплементарность спаривания оснований между гРНК и ДНК-мишенью, так и (ii) коротким мотивом, называемым смежным мотивом протоспейсера (РАМ) в ДНК-мишени. РАМ может фланкировать последовательность, узнаваемую направляющей РНК. Необязательно, последовательность, узнаваемая направляющей РНК, может быть фланкирована на 3' конце с помощью РАМ. Альтернативно, последовательность, узнаваемая направляющей РНК, может быть фланкирована на 5' конце с помощью РАМ. Например, сайт расщепления белков Cas может составлять от около 1 до около 10 или от около 2 до около 5 пар оснований (например, 3 пары оснований) вверх или вниз по ходу транскрипции последовательности РАМ. В некоторых случаях (например, когда используется Cas9 из S. pyogenes или близкородственного Cas9), последовательность РАМ не комплементарной цепи может быть 5'-N1GG-3', где N1 представляет собой любой нуклеотид ДНК и сразу же 3' последовательности, узнаваемой направляющей РНК, не комплементарной цепи ДНК-мишени. Таким образом, последовательность РАМ комплементарной цепи будет представлять собой 5'-CCN2-3', где N2 представляет собой любой нуклеотид ДНК и сразу же 5' последовательности, узнаваемой направляющей РНК, комплементарной цепи ДНК-мишени. В некоторых таких случаях N1 и N2 могут быть комплементарными, a N1-N2 пара оснований может быть любой парой оснований (например, N1=C и N2=G; N1=G и N2=C; N1=A и N2=T; или N1=T, и N2=A). В случае Cas9 из S. aureus, РАМ, может быть NNGRRT (SEQ ID NO: 146) или NNGRR (SEQ ID NO: 147), где N может быть A, G, С или Т, a R может быть G или А. В случае Cas9 из С. jejuni, РАМ может быть, например, NNNNACAC или NNNNRYAC, где N может быть A, G, С или Т, a R может быть G или А. В некоторых случаях (например, для FnCpf1), последовательность РАМ может находиться вверх по ходу транскрипции 5'-конца и иметь последовательность 5'-TTN-3'.
[000246] Примеры последовательностей, распознаваемых направляющей РНК, включают в себя последовательность ДНК, комплементарную сегменту ДНК-нацеливания гРНК, или такую последовательность ДНК в дополнение к последовательности РАМ. Например, мотив-мишень может быть 20-нуклеотидной ДНК-последовательностью, непосредственно предшествующей мотиву NGG, распознаваемой белком Cas9, таким как GN19NGG (SEQ ID NO: 1) или N20NGG (SEQ ID NO: 2) (см., например, WO 2014/165825, включенную в данный документ в качестве ссылки во всей ее полноте для всех целей). Гуанин на 5'-конце может способствовать транскрипции РНК-полимеразой в клетках. Другие примеры последовательностей, распознаваемых направляющей РНК, могут включать два гуаниновых нуклеотида на 5'-конце (например, GGN20NGG, SEQ ID NO: 3) для облегчения эффективной транскрипции с помощью полимеразы Т7 in vitro. См., например, WO 2014/065596, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Другие последовательности, распознаваемые направляющей РНК, могут иметь между 4-22 нуклеотидов в длину SEQ ID NOS: 1-3, включая 5' G или GG и 3' GG или NGG. Тем не менее, другие последовательности, распознаваемые направляющей РНК, могут иметь между 14 и 20 нуклеотидов в длину SEQ ID NO: 1-3.
[000247] Последовательность, узнаваемая направляющей РНК, может быть любой последовательностью нуклеиновой кислоты, эндогенной или экзогенной к клетке. Последовательность, узнаваемая направляющей РНК, может быть последовательностью, кодирующей продукт гена (например, белок) или некодирующую последовательность (например, регуляторную последовательность) или может включать обе.
С. Экзогенные матрицы для репарации
[000248] Способы и композиции, раскрытые в данном документе, могут использовать экзогенные матрицы для репарации для модификации геномного локуса-мишени после расщепления геномного локуса-мишени с белком Cas. Например, клетка может быть эмбрионом на одноклеточной стадии, а экзогенная матрица для репарации может быть менее 5 т.п.о. в длину. В типах клеток, отличных от эмбрионов на одноклеточной стадии, экзогенная матрица для репарации (например, вектор нацеливания) может быть более длинной. Например, в типах клеток, отличных от эмбрионов на одноклеточной стадии, экзогенная матрица для репарации может быть большим направленным вектором (LTVEC), как описано в другом месте в данном документе (например, нацеливающий вектор, имеющий длину по меньшей мере 10 т.п.о. или имеющий 5' и 3' плечи гомологии, общая сумма которых составляет не менее 10 т.п.о.). Использование экзогенных матриц для репарации в сочетании с белками Cas может привести к более точной модификации геномного локуса-мишени путем содействия гомология-направленной репарации.
[000249] В таких методах белок Cas расщепляет геномный локус-мишень для создания одноцепочечного разрыва (одноцепочечный разрыв) или двухцепочечного разрыва, и его экзогенная матрица для репарации рекомбинирует нуклеиновую кислоту-мишень посредством опосредованного не гомологичным концевым соединением (NHEJ) лигирования или путем события гомология-направленной репарации. Необязательно, репарация с помощью экзогенной матрицы для репарации удаляет или нарушает последовательность, узнаваемую направляющей РНК, или сайт расщепления Cas, так что аллели, на которые были нацелены, не могут быть повторно нацелены на белок Cas.
[000250] Экзогенные матрицы для репарации могут содержать дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК), они могут быть одноцепочечными или двухцепочечными и могут быть в линейной или круговой форме. Например, экзогенная матрица для репарации может представлять собой одноцепочечный олигодезоксинуклеотид (ssODN). См., например, Yoshimi et al. (2016) Nat. Commun. 7:10431, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Иллюстративная длина экзогенной матрицы для репарации находится в промежутке от около 50 нуклеотидов до около 5 т.п.о., в промежутке от около 50 до около 3 т.п.о., или в промежутке от около 50 до около 1000 нуклеотидов. Другие примеры экзогенных матриц для репарации составляют между около 40 до около 200 нуклеотидов в длину. Например, экзогенная матрица для репарации может составлять между около 50 до около 60, от около 60 до около 70, от около 70 до около 80, от около 80 до около 90, от около 90 до около 100, от около 100 до около 110, от около 110 до около 120, от около 120 до 130, от около 130 до около 140, от около 140 до около 150, от около 150 до около 160, от около 160 до около 170, от около 170 до около 180, от около 180 до около 190, или от около 190 до около 200 нуклеотидов в длину. Альтернативно, экзогенная матрица для репарации может составлять между около 50 до около 100, от около 100 до около 200, от около 200 до около 300, от около 300 до около 400, от около 400 до около 500, от около 500 до около 600, от около 600 до около 700, от около 700 до около 800, от около 800 до около 900, или от около 900 до около 1000 нуклеотидов в длину. Альтернативно, экзогенная матрица для репарации может составлять между около 1 до около 1,5 т.п.о., от около 1,5 до около 2 т.п.о., от около 2 до около 2,5 т.п.о., от около 2,5 до около 3 т.п.о., от около 3 до около 3,5 т.п.о., от около 3,5 до около 4 т.п.о., от около 4 до около 4,5 т.п.о. или от около 4,5 до около 5 т.п.о. в длину. Альтернативно, экзогенная матрица для репарации может быть, например, не более чем 5 т.п.о., 4,5 т.п.о., 4 т.п.о., 3,5 т.п.о., 3 т.п.о., 2,5 т.п.о., 2 т.п.о., 1,5 т.п.о., 1 т.п.о., 900 нуклеотидов, 800 нуклеотидов, 700 нуклеотидов, 600 нуклеотидов, 500 нуклеотидов, 400 нуклеотидов, 300 нуклеотидов, 200 нуклеотидов, 100 нуклеотидов или 50 нуклеотидов в длину. В типах клеток, отличных от эмбрионов на одноклеточной стадии, экзогенная матрица для репарации (например, вектор нацеливания) может быть более длинной. Например, в типах клеток, отличных от эмбрионов на одноклеточной стадии, экзогенная матрица для репарации может быть большим направленным вектором (LTVEC), как описано в другом месте данного документа.
[000251] В одном примере, экзогенная матрица для репарации представляет собой ssODN, который находится между около 80 нуклеотидов и около 200 нуклеотидов в длину. В другом примере, экзогенные матрицы для репарации представляет собой ssODN, который находится между около 80 нуклеотидов и около 3 т.п.о. в длину. Такой ssODN может иметь, например, плечи гомологии, каждое из которых составляет между около 40 нуклеотидов и около 60 нуклеотидов в длину. Такой ssODN может также иметь, например, плечи гомологии, каждое из которых составляет между около 30 нуклеотидов и 100 нуклеотидов в длину. Плечи гомологии могут быть симметричными (например, каждые 40 нуклеотидов или каждые 60 нуклеотидов в длину), или они могут быть асимметричными (например, одно плечо гомологии, которое составляет 36 нуклеотидов в длину, и одно плечо гомологии, которое составляет 91 нуклеотид в длину).
[000252] Экзогенные матрицы для репарации могут включать в себя модификации или последовательности, которые обеспечивают дополнительные желательные функции (например, модифицированную или регулируемую стабильность, отслеживание или обнаружение с помощью флуоресцентной метки, сайт связывания для белка или белкового комплекса и т.д.). Экзогенные матрицы для репарации могут содержать одну или более флуоресцентных меток, меток для очистки, эпитопных меток или их комбинации. Например, экзогенная матрица для репарации может содержать одну или более флуоресцентных меток (например, флуоресцентные белки или другие флуорофоры или красители), такие как по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4 или по меньшей мере 5 флуоресцентных меток. Иллюстративные флуоресцентные метки включают флуорофоры, такие как флуоресцеин (например, 6-карбоксифлуоресцеин (6-FAM)), Texas Red, HEX, Су3, Су5, Су5.5, Pacific Blue, 5-(и-6)-карбокситетраметилродамин (TAMRA) и Су7. Широкий спектр флуоресцентных красителей доступен для коммерческого использования для маркировки олигонуклеотидов (например, от Integrated DNA Technologies). Такие флуоресцентные метки (например, внутренние флуоресцентные метки) могут использоваться, например, для обнаружения экзогенной матрицы для репарации, которая была непосредственно интегрирована в расщепленную нуклеиновую кислоту-мишень, имеющую выступающие концы, совместимые с концами экзогенной матрицы для репарации. Метка или маркировка могут быть на 5'-конце, 3'-конце или внутри в экзогенной матрице для репарации. Например, экзогенная матрица для репарации может быть конъюгирована на 5'-конце с флуорофором IR700 от Integrated DNA Technologies (5'IRDYE®700).
[000253] Экзогенные матрицы для репарации могут также содержать вставки нуклеиновых кислот, включая сегменты ДНК, которые должны быть интегрированы в геномные локусы-мишени. Интеграция вставки нуклеиновой кислоты в геномный локус-мишень может приводить к добавлению представляющей интерес последовательности нуклеиновой кислоты, для геномного локуса-мишени, делеции представляющей интерес последовательности нуклеиновой кислоты в геномном локусе-мишени, или замены представляющей интерес последовательности нуклеиновой кислоты в геномном локусе-мишени (т.е. делеция и вставка). Некоторые экзогенные матрицы для репарации предназначены для введения вставки нуклеиновой кислоты в геномный локус-мишень без какой-либо соответствующей делеции в геномном локусе-мишени. Другие экзогенные матрицы для репарации предназначены для удаления представляющей интерес последовательности нуклеиновой кислоты в геномном локусе-мишени без какого-либо соответствующего введения вставки нуклеиновой кислоты. Тем не менее, другие экзогенные матрицы для репарации предназначены для удаления представляющей интерес последовательности нуклеиновой кислоты в геномном локусе-мишени и замены ее на вставку нуклеиновой кислоты.
[000254] Вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, может быть различных длин. Иллюстративная вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, составляет между около 1 нуклеотида до около 5 т.п.о. в длину или составляет между около 1 нуклеотида до около 1000 нуклеотидов в длину. Например, вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, может составлять между около 1 до около 10, около 10 до около 20, около 20 до около 30, около 30 до около 40, около 40 до около 50, около 50 до около 60, от около 60 до около 70, от около 70 до около 80, от около 80 до около 90, от около 90 до около 100, от около 100 до около 110, от около 110 до около 120, от около 120 до 130, от около 130 до около 140, от около 140 до около 150, от около 150 до около 160, от около 160 до около 170, от около 170 до около 180, от около 180 до около 190, или от около 190 до около 200 нуклеотидов в длину. Аналогично, вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, может составлять между около 1 до около 100, около 100 до около 200, около 200 до около 300, около 300 до около 400, около 400 до около 500, около 500 до около 600, около 600 до около 700, около 700 до около 800, около 800 до около 900 или около 900 до около 1000 нуклеотидов в длину. Аналогично, вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, может составлять между около 1 до около 1,5 т.п.о., от около 1,5 до около 2 т.п.о., от около 2 до около 2,5 т.п.о., от около 2,5 до около 3 т.п.о., от около 3 до около 3,5 т.п.о., от около 3,5 до около 4 т.п.о., от около 4 до около 4,5 т.п.о. или от около 4,5 до около 5 т.п.о. в длину. Нуклеиновая кислота, удаляемая из геномного локуса-мишени, может также составлять между около 1 т.п.о. до около 5 т.п.о., около 5 т.п.о. до около 10 т.п.о., около 10 т.п.о. до около 20 т.п.о., около 20 т.п.о. до около 30 т.п.о., около 30 т.п.о. до около 40 т.п.о., около 40 т.п.о. до около 50 т.п.о., около 50 т.п.о. до около 60 т.п.о., около 60 т.п.о. до около 70 т.п.о., около 70 т.п.о. до около 80 т.п.о., около 80 т.п.о. до около 90 т.п.о., около 90 т.п.о. до около 100 т.п.о., около 100 т.п.о. до около 200 т.п.о., около 200 т.п.о. до около 300 т.п.о., около 300 т.п.о. до около 400 т.п.о., около 400 т.п.о. до около 500 т.п.о., около 500 т.п.о. до около 600 т.п.о., около 600 т.п.о. до около 700 т.п.о., около 700 т.п.о. до около 800 т.п.о., около 800 т.п.о. до около 900 т.п.о., или около 900 т.п.о. до около 1 Мб или длинее. Альтернативно, нуклеиновая кислота, удаляемая из геномного локуса-мишени, может составлять между около 1 Мб до около 1,5 Мб, около 1,5 Мб до около 2 Мб, около 2 Мб до около 2,5 Мб, около 2,5 Мб до около 3 Мб, около 3 Мб до около 4 Мб, около 4 Мб до около 5 Мб, около 5 Мб до около 10 Мб, около 10 Мб до около 20 Мб, около 20 Мб до около 30 Мб, около 30 Мб до около 40 Мб, около 40 Мб до около 50 Мб, около 50 Мб до около 60 Мб, около 60 Мб до около 70 Мб, около 70 Мб до около 80 Мб, около 80 Мб до около 90 Мб, или около 90 Мб до около 100 Мб.
[000255] Вставка нуклеиновой кислоты может содержать геномную ДНК или любой другой тип ДНК. Например, вставка нуклеиновой кислоты может быть из прокариот, эукариот, дрожжей, птицы (например, курицы), млекопитающего отличного от человека, грызуна, человека, крысы, мыши, хомяка, кролика, свиньи, крупного рогатого скота, оленя, овцы, козы, кошки, собаки, хорька, примата (например, мартышка, макака-резус), одомашненного млекопитающего, сельскохозяйственного млекопитающего, черепахи или любого другого представляющего интерес организма.
[000256] Вставка нуклеиновой кислоты может содержать последовательность, которая является гомологичной или ортологичной для всего или части гена, кодирующего аутоантиген (например, часть гена, кодирующего конкретный мотив или участок аутоантигена). Гомологическая последовательность может быть от другого вида или одного и того же вида. Например, вставка нуклеиновой кислоты может содержать последовательность, которая содержит одну или более точечных мутаций (например, 1, 2, 3, 4, 5 и более) по сравнению с последовательностью, являющейся мишенью для замещения в геномном локусе-мишени. Необязательно, такие точечные мутации могут приводить к консервативной аминокислотной замене (например, замене аспарагиновой кислоты [Asp, D] глутаминовой кислотой [Glu, Е]) в кодированном полипептиде.
[000257] Вставка нуклеиновой кислоты или соответствующая нуклеиновая кислота в геномном локусе-мишени, который удаляется и/или заменяется, может быть кодирующим участком, таким как экзон; некодирующим участком, таким как интрон, нетранслируемым участком или регуляторным участком (например, промотор, энхансер или транскрипционный репрессор-связывающий элемент); или любой их комбинацией.
[000258] Вставка нуклеиновой кислоты также может содержать условный аллель. Условный аллель может быть многофункциональным аллелем, как описано в US 2011/0104799, включенном в данный документ в качестве ссылки во всей его полноте для всех целей. Например, условный аллель может содержать: (а) исполнительную последовательность в смысловой ориентации относительно транскрипции гена-мишени; (b) кассету для отбора лекарств (DSC) в смысловой или антисмысловой ориентации; (с) представляющую интерес нуклеотидную последовательность (NSI) в антисмысловой ориентации; и (d) условный модуль инверсии (COIN, который использует экзон-расщепляющий интрон и обратимый ген-ловушка-подобный модуль) в обратной ориентации. См., например, US 2011/0104799. Условный аллель может дополнительно содержать рекомбинируемые единицы, которые рекомбинируют при воздействии первой рекомбиназы с образованием условного аллеля, который (i) не имеет исполнительной последовательности и DSC; и (ii) содержит NSI в смысловой ориентации и COIN в антисмысловой ориентации. См., например, US 2011/0104799.
[000259] Вставки нуклеиновой кислоты также могут содержать пол и нуклеотид, кодирующий маркер для селекции. Альтернативно, вставки нуклеиновых кислот могут не иметь полинуклеотида, кодирующего маркер для селекции. Маркер для селекции может содержаться в селекционной кассете. Необязательно, селекционная кассета может быть самоудаляющейся кассетой. См., например, US 8697851 и US 2013/0312129, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. В качестве примера, самоудаляющаяся кассета может содержать ген Crei (содержит два экзона, кодирующих рекомбиназу Cre, которые разделены интроном), функционально связанные с промотором Prm1 мыши, и ген устойчивости к неомицину, функционально связанный с промотором убиквитина человека. Используя промотор Prm1, самоудаляющаяся кассета может быть удалена конкретно в мужских половых клетках животных F0. Иллюстративные маркеры для селекции включают неомицин фосфотрансферазу (неоr), гигромицин В-фосфотрансферазу (гигr), пиромицин-N-ацетилтрансферазу (пироr), дезаминазу бластицидина S (bsrr), ксантин/гуанинфосфорибозилтрансферазу (gpt) или тимидинкиназу вируса простого герпеса (HSV-k) или их комбинацию. Полинуклеотид, кодирующий маркер для селекции, может быть функционально связан с промотором, активным в клетке для нацеливания. Примеры промоторов описаны в другом месте данного документа.
[000260] Вставка нуклеиновой кислоты также может содержать репортерный ген. Иллюстративные репортерные гены включают кодирующие люциферазы, β-галактозидазу, зеленый флуоресцентный белок (GFP), усиленный зеленый флуоресцентный белок (eGFP), голубой флуоресцентный белок (CFP), желтый флуоресцентный белок (YFP), усиленный желтый флуоресцентный белок (eYFP), синий флуоресцентный белок (BFP), усиленный синий флуоресцентный белок (eBFP), DsRed, ZsGreen, MmGFP, mPlum, mCherry, tdTomato, mStrawberry, J-Red, mOrange, mKO, mCitrine, Venus, YPet, Emerald, CyPet, Cerulean, T- Сапфир и щелочную фосфатазу. Такие репортерные гены могут быть функционально связаны с промотором, активным клетке-мишени. Примеры промоторов описаны в другом месте данного документа.
[000261] Вставка нуклеиновой кислоты может также содержать одну или более экспрессионных кассет или делеционных кассет. Данная кассета может содержать одну или более представляющих интерес нуклеотидных последовательностей, полинуклеотид, кодирующий маркер для селекции, и репортерный ген, а также различные регуляторные компоненты, которые влияют на экспрессию. Иллюстративные выбираемые маркеры и репортерные гены, которые могут быть включены, подробно обсуждаются в другом месте данного документа.
[000262] Вставка нуклеиновой кислоты может содержать нуклеиновую кислоту, фланкированную с помощью сайтов-специфических рекомбинаций последовательностей-мишеней. Альтернативно, вставка нуклеиновой кислоты может содержать одну или более сайт-специфических рекомбинаций последовательностей-мишеней. Хотя вся вставка нуклеиновой кислоты может быть фланкирована такими сайт-специфическими рекомбинациями последовательностей-мишеней, любой участок или отдельный представляющий интерес полинуклеотид внутри вставки нуклеиновой кислоты также могут быть фланкированы такими сайтами. Сайт-специфические рекомбинации последовательностей-мишеней, которые могут фланкировать вставку нуклеиновой кислоты или какой-либо представляющий интерес полинуклеотид во вставке нуклеиновой кислоты, могут включать, например, loxP, lox511, lox2272, lox66, lox71, loxM2, lox5171, FRT, FRT11, FRT71, attp, att, FRT, rox или их комбинацию. В одном примере сайт-специфические сайты рекомбинации фланкируют полинуклеотид, кодирующий маркер для селекции и/или репортерный ген, содержащийся внутри вставки нуклеиновой кислоты. После интеграции вставки нуклеиновой кислоты в целевой локус можно удалить последовательности между сайтами сайт-специфической рекомбинации. При желании можно использовать две экзогенные матрицы для репарации, каждая из которых содержит вставку нуклеиновой кислоты, содержащую сайт сайт-специфической рекомбинации. Экзогенные матрицы для репарации могут быть нацелены на 5'и 3' участки, фланкирующие представляющую интерес нуклеиновую кислоту. После интегрирования двух вставок нуклеиновой кислоты в геномный локус-мишень, представляющая интерес нуклеиновая кислота между двумя представляющими интерес вставленными сайтами сайт-специфической рекомбинации может быть удалена.
[000263] Вставки нуклеиновой кислоты могут также содержать один или более сайтов рестрикции для рестрикционных эндонуклеаз (т.е. рестрикционных ферментов), которые включают эндонуклеазы типа I, типа II, типа III и типа IV. Рестрикционные эндонуклеазы типа I и типа III распознают специфические сайты узнавания, но обычно расщепляются в различном положении от сайта связывания нуклеазы, который может составлять сотни пар оснований от сайта расщепления (сайт узнавания). В системах типа II рестрикционная активность не зависит от активности любой метилазы, и расщепление обычно происходит на определенных сайтах внутри или рядом с сайтом связывания. Большинство ферментов типа II вырезают палиндромные последовательности, однако ферменты типа IIa узнают не палиндромные сайты узнавания и расщепления за пределами сайта узнавания, ферменты типа IIb вырезают последовательности дважды с обоими сайтами за пределами сайта узнавания, а ферменты типа IIs узнают асимметричный сайт узнавания и расщепляют с одной стороны и на определенном расстоянии около 1-20 нуклеотидов от сайта узнавания. Рестрикционные ферменты типа IV нацелены на метилированную ДНК. Рестрикционные ферменты далее описаны и классифицированы, например, в базе данных REBASE (вебстраница на rebase.neb.com; Roberts et al., (2003) Nucleic Acids Res. 31:418-420; Roberts et al., (2003) Nucleic Acids Res. 31:1805-1812; и Belfort et al. (2002) в Mobile DNA II, pp. 761-783, Eds. Craigie et al., (ASM Press, Вашингтон, округ Колумбия)).
(1) Матрицы для репарации для вставки опосредованной негомологичным соединением концов
[000264] Некоторые экзогенные матрицы для репарации имеют короткие одноцепочечные участки на 5'-конце и/или 3'-конце, которые комплементарны одному или более «липких» концов, созданных опосредованным Cas-белком расщеплением в геномном локусе-мишени. Эти «липкие» концы также могут упоминаться как 5'и 3' плечи гомологии. Например, некоторые экзогенные матрицы для репарации имеют короткие одноцепочечные участки на 5'-конце и/или 3'-конце, которые комплементарны одному или более «липких» концов, созданных опосредованным Cas-белком расщеплением в 5' и/или 3' последовательности-мишени в геномном локусе-мишени. Некоторые такие экзогенные матрицы для репарации имеют комплементарные участки только на 5'-конце или только на 3'-конце. Например, некоторые такие экзогенные матрицы для репарации имеют комплементарный участок только на 5'-конце, комплементарный «липкому» концу, созданному на 5' последовательности-мишени в геномном локусе-мишени, или только на 3'-конце, комплементарную «липкому» концу, созданному на 3' последовательности-мишени в геномном локусе-мишени. Другие такие экзогенные матрицы для репарации имеют комплементарные участки как на 5', так и на 3' концах. Например, другие подобные экзогенные матрицы для репарации имеют комплементарные участки как на 5', так и на 3' концах, например, комплементарны первому и второму «липким» концам, соответственно, созданными Cas-опосредованным расщеплением в геномном локусе-мишени. Например, если экзогенная матрица для репарации является двухцепочечной, одноцепочечные комплементарные участки могут простираться от 5'-конца верхней цепи матрицы для репарации и 5'-конца нижней цепи матрицы для репарации, создавая 5' «липкие» концы на каждом конце. Альтернативно, одноцепочечный комплементарный участок может простираться от 3'-конца верхней цепи матрицы для репарации и от 3'-конца нижней цепи матрицы, создавая 3' «липкие» концы.
[000265] Комплементарные участки могут иметь любую длину, достаточную для обеспечения лигирования между экзогенной матрицей для репарации и нуклеиновой кислотой-мишенью. Иллюстративные комплементарные участки составляют между около 1 до около 5 нуклеотидов в длину, между около 1 до около 25 нуклеотидов в длину или между около 5 до около 150 нуклеотидов в длину. Например, комплементарный участок может быть по меньшей мере около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов в длину. Альтернативно, комплементарный участок может быть около 5 до около 10, около 10 до около 20, около 20 до около 30, около 30 до около 40, около 40 до около 50, около 50 до около 60, около 60 до около 70, около 70 до около 80, около 80 до около 90, около 90 до около 100, около 100 до около 110, около 110 до около 120, около 120 до около 130, около 130 до около 140, около 140 до около 150 нуклеотидов в длину, или длиннее.
[000266] Такие комплементарные участки могут быть комплементарными «липким» концам, созданным двумя парами никаз. Два двухцепочечных разрыва со ступенчатыми концами могут быть созданы с использованием первой и второй никаз, которые расщепляют противоположные цепи ДНК, чтобы создать первый двухцепочечный разрыв, и третей и четвертой никаз, которые расщепляют противоположные цепи ДНК, чтобы создать второй двухцепочечный разрыв. Например, белок Cas может быть использован для создания одноцепочечного разрыва последовательностей, распознаваемых первой, второй, третьей и четвертой направляющей РНК, соответствующих первой, второй, третьей и четвертой направляющей РНК. Последовательности, распознаваемые первой и второй направляющими РНК, могут быть расположены для создания первого сайта расщепления таким образом, что одноцепочечные разрывы, созданные первой и второй никазами на первой и второй цепях ДНК, создают двухцепочечный разрыв (то есть первый сайт расщепления содержит одноцепочечные разрывы в первой и второй последовательностями, распознаваемыми направляющей РНК). Аналогично, последовательности, распознаваемые третьей и четвертой направляющей РНК, могут быть расположены для создания второго сайта расщепления, так что одноцепочечные разрывы, созданные третьей и четвертой никазами на первой и второй цепях ДНК, создают двухцепочечный разрыв (то есть второй сайт расщепления содержит одноцепочечные разрывы в последовательностях, распознаваемых третьей и четвертой направляющей РНК). Предпочтительно, одноцепочечные разрывы в последовательностях, распознаваемых первой и второй направляющими РНК, и/или последовательностях, распознаваемых третьей и четвертой направляющей РНК, могут быть смещенными одноцепочечными разрывами, которые создают «липкие» концы. Окно смещения может быть, например, по меньшей мере около 5 п.о., 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 60 п.о., 70 п.о., 80 п.о., 90 п.о., 100 п.о. или более. См. Ran et al. (2013) Cell 154:1380-1389; Mali et al. (2013) Nat. Biotech. 31:833-838; и Shen et al. (2014) Nat. Methods 11:399-404, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. В таких случаях двухцепочечная экзогенная матрица для репарации может быть сконструирована с одноцепочечными комплементарными участками, которые комплементарны «липким» концам, созданным одноцепочечными разрывами в последовательностях, распознаваемых первой и второй направляющими РНК, и одноцепочечными разрывами в последовательностях, распознаваемых третьей и четвертой направляющей РНК. Такая экзогенная матрица для репарации затем может быть вставлена путем лигирования, опосредованного негомологичным соединением концов.
(2) Матрицы для репарации для вставки с помощью репарации, направляемой гомологией
[000267] Некоторые экзогенные матрицы для репарации содержат плечи гомологии. Если экзогенная матрица для репарации также содержит вставку нуклеиновой кислоты, плечи гомологии могут фланкировать вставку нуклеиновой кислоты. Для простоты ссылок, плечи гомологии упоминаются в данном документе как 5' и 3' (то есть вверх по ходу и вниз по ходу транскрипции) плечи гомологии. Эта терминология относится к относительному положению плечей гомологии к вставке нуклеиновой кислоты в экзогенной матрице для репарации. 5'- и 3'-плечи гомологии соответствуют участкам в пределах геномного локуса-мишени, которые в данном документе называются «5' последовательностью-мишенью» и «3' последовательностью-мишенью» соответственно.
[000268] Плечо гомологии последовательность-мишень «отвечают» или «соответствуют» друг другу, когда два участка разделяют достаточный уровень идентичности последовательности друг с другом, чтобы действовать как субстраты для реакции гомологичной рекомбинации. Термин «гомология» включает в себя последовательности ДНК, которые либо идентичны, либо разделяют идентичность последовательности с соответствующей последовательностью. Идентичность последовательности между данной последовательностью-мишенью и соответствующим плечом гомологии, найденным в экзогенной матрице для репарации, может быть любой степенью идентичности последовательности, которая допускается для происхождения гомологичной рекомбинации. Например, степень идентичности последовательности, разделенной плечом гомологии экзогенной матрицы для репарации (или ее фрагмента), и последовательности-мишени (или ее фрагмента), может быть по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности, так что последовательности подвергаются гомологичной рекомбинации. Более того, соответствующий участок гомологии между плечом гомологии и соответствующей последовательностью-мишенью может быть любой длины, достаточной для обеспечения гомологичной рекомбинации. Иллюстративные плечи гомологии составляют между около 25 нуклеотидов до около 2,5 т.п.о. в длину, составляет между около 25 нуклеотидов до около 1,5 т.п.о. в длину, или составляет между около 25 до около 500 нуклеотидов в длину. Например, данное плечо гомологии (или каждое из гомологических плечей) и/или соответствующая последовательность-мишень может содержать соответствующие участки гомологии, которые составляют между около 25 до около 30, около 30 до около 40, около 40 до около 50, около 50 до около 60, около 60 до около 70, около 70 до около 80, около 80 до около 90, около 90 до около 100, около 100 до около 150, около 150 до около 200, около 200 до около 250, около 250 до около 300, около 300 до около 350, около 350 до около 400, около 400 до около 450 или около 450 до около 500 нуклеотидов, так что плечи гомологии имеют достаточную гомологию для проведения гомологичной рекомбинации с соответствующими последовательностями-мишенями в нуклеиновой кислот-мишени. Альтернативно, данное плечо гомологии (или каждое плечо гомологии) и/или соответствующая последовательность-мишень могут содержать соответствующие участки гомологии, которые находятся между около 0,5 т.п.о. до около 1 т.п.о., около 1 т.п.о. до около 1,5 т.п.о., около 1,5 т.п.о. до около 2 т.п.о., или около от 2 т.п.о. до около 2,5 т.п.о. в длину. Например, плечо гомологии каждое может содержать около 750 нуклеотидов в длину. Плечо гомологии могут быть симметричными (каждое около одинакового размера в длину), или они могут быть асимметричными (одно длиннее другого).
[000269] Плечи гомологии могут соответствовать локусу, который является родным для клетки (например, целевой локус). Альтернативно, например, они могут соответствовать участку гетерологичного или экзогенного сегмента ДНК, которая была интегрирована в геном клетки, включая, например, трансгены, экспрессионные кассеты или гетерологичные или экзогенные участки ДНК. Альтернативно, плечи гомологии вектора нацеливания могут соответствовать участку искусственной хромосомы дрожжей (YAC), бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или любого другого сконструированного участка, содержащегося в соответствующей клетке-хозяине. Кроме того, плечи гомологии вектора нацеливания могут соответствовать или быть получены из участка библиотеки ВАС, библиотеки космиды или библиотеки фагов Р1 или могут быть получены из синтетической ДНК.
[000270] Когда система CRISPR/Cas используется в комбинации с экзогенной матрицей для репарации, 5'- и 3'-последовательности-мишени предпочтительно расположены в достаточной близости от сайта расщепления Cas (например, в пределах достаточной близости к последовательности, распознаваемой направляющей РНК), так что для содействия возникновению события гомологичной рекомбинации между последовательностями-мишенями и плечами гомологии при одноцепочечном разрыве (ник) или двухцепочечном разрыве на сайте расщепления Cas. Термин «сайт расщепления Cas» включает в себя последовательность ДНК, при котором одноцепочечный разрыв или двухцепочечный разрыв создают ферментом Cas (например, белок Cas9, комплекс образованный с направляющей РНК). Последовательности-мишени в целевом локусе, которые соответствуют 5'- и 3'-плечам гомологии экзогенной матрицы для репарации, «расположены в достаточной близости» к сайту расщепления Cas, если расстояние такое, чтобы способствовать возникновению события гомологичной рекомбинации между 5'- и 3'-последовательностями-мишенями и плечами гомологии при одноцепочечном разрыве или двухцепочечном разрыве на сайте расщепления Cas. Таким образом, последовательности-мишени, соответствующие 5'- и/или 3'-плечам гомологии экзогенной матрицы для репарации, могут быть, например, в пределах по меньшей мере 1 нуклеотида данного сайта расщепления Cas или в пределах по меньшей мере 10 нуклеотидов до около 1000 нуклеотидов данного сайта расщепления Cas. В качестве примера сайт расщепления Cas может быть непосредственно смежным с по меньшей мере одной или обеими последовательностями-мишенями.
[000271] Альтернативно, данный сайт расщепления может быть разной длины от 5'- последовательности-мишени, 3'-последовательности-мишени или обеих последовательностей-мишеней. Например, если используются две направляющие РНК, последовательности, распознаваемые первой и/или второй направляющей РНК, или первый и/или второй сайты расщепления могут быть расположены между 5' и 3' последовательностей-мишеней или могут быть смежными с или близкими к 3'-последовательности-мишени и/или 3'-последовательности-мишени, например, в пределах 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6 т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о., 10 т.п.о., 20 т.п.о., 30 т.п.о., 40 т.п.о., 50 т.п.о., 60 т.п.о., 70 т.п.о., 80 т.п.о., 90 т.п.о., 100 т.п.о., 110 т.п.о., 120 т.п.о., 130 т.п.о., 140 т.п.о., 150 т.п.о., 160 т.п.о., 170 т.п.о., 180 т.п.о., 190 т.п.о., 200 т.п.о., 250 т.п.о., 300 т.п.о., 350 т.п.о., 400 т.п.о., 450 т.п.о. или 500 т.п.о. 5'- и/или 3''-последовательностей-мишеней. Альтернативно, последовательности, распознаваемые первой и/или второй направляющей РНК, или первый и/или второй сайты расщепления могут быть расположены по меньшей мере 50 п.о., по меньшей мере 100 п.о., по меньшей мере 200 п.о., по меньшей мере 300 п.о., по меньшей мере 400 п.о., по меньшей мере 500 п.о., по меньшей мере, 600 п.о., по меньшей мере 700 п.о., по меньшей мере 800 п.о., по меньшей мере 900 п.о., по меньшей мере 1 т.п.о., по меньшей мере 2 т.п.о., по меньшей мере 3 т.п.о., по меньшей мере 4 т.п.о., по меньшей мере 5 т.п.о., по меньшей мере 6 т.п.о., по меньшей мере 7 т.п.о., по меньшей мере 8 т.п.о., по меньшей мере 9 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 110 т.п.о., по меньшей мере 120 т.п.о., по меньшей мере 130 т.п.о., по меньшей мере 140 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 160 т.п.о., по меньшей мере 170 т.п.о., по меньшей мере 180 т.п.о., по меньшей мере 190 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о., по меньшей мере 400 т.п.о., по меньшей мере 450 т.п.о. или по меньшей мере 500 т.п.о. от 5' и/или 3'-последовательностей-мишеней. Например, последовательность, распознаваемая первой и/или второй направляющей РНК, или первый и/или второй сайты расщепления могут быть расположены между около 50 п.о. до около 100 п.о., около 200 п.о. до около 300 п.о., около 300 п.о. до около 400 п.о., около 400 п.о. до около 500 п.о., около 500 п.о. до около 600 п.о., около 600 п.о. до около 700 п.о., около 700 п.о. до около 800 п.о., около 800 п.о. до около 900 п.о., около 900 п.о. до около 1 т.п.о., около 1 т.п.о. до около 2 т.п.о., около 2 т.п.о. до около 3 т.п.о., около 3 т.п.о. до около 4 т.п.о., около 4 т.п.о. до около 5 т.п.о., около 5 т.п.о. до около 10 т.п.о., около 10 т.п.о. до около 20 т.п.о., около 20 т.п.о. до около 30 т.п.о., около 30 т.п.о. до около 40 т.п.о., около 40 т.п.о. до около 50 т.п.о., около 50 т.п.о. до около 100 т.п.о., около 100 т.п.о. до около 150 т.п.о., около 150 т.п.о. до около 200 т.п.о., около 200 т.п.о. до около 300 т.п.о., около 300 т.п.о. до около 400 т.п.о., или около от 400 т.п.о. до около 500 т.п.о. от 5'- и/или 3'-последовательностей-мишеней. Альтернативно, последовательности, распознаваемые первой и/или второй направляющей РНК, или первый и/или второй сайты расщепления могут быть расположены более чем 50 п.о., более чем 100 п.о., более чем 200 п.о., более чем 300 п.о., более чем 400 п.о., более чем 500 п.о., более чем 600 п.о., более чем 700 п.о., более чем 800 п.о., более чем 900 п.о., более чем 1 т.п.о., более чем 2 т.п.о., более чем 3 т.п.о., более чем 4 т.п.о., более чем 5 т.п.о., более чем 6 т.п.о., более чем 7 т.п.о., более чем 8 т.п.о., более чем 9 т.п.о., более чем 10 т.п.о., более чем 20 т.п.о., более чем 30 т.п.о., более чем 40 т.п.о., более чем 50 т.п.о., более чем 60 т.п.о., больше чем 70 т.п.о., более чем 80 т.п.о., более чем 90 т.п.о. или более чем 100 т.п.о. от 5'-и/или 3'-последовательностей-мишеней. Например, последовательность, распознаваемая первой направляющей РНК, или первый сайт расщепления могут быть расположены более чем 50 п.о., более чем 100 п.о., более чем 200 п.о., более чем 300 п.о., более чем 400 п.о., более чем 500 п.о., более чем 600 п.о., более чем 700 п.о., более чем 800 п.о., более чем 900 п.о., более чем 1 т.п.о., более чем 2 т.п.о., более чем 3 т.п.о., более чем 4 т.п.о., более чем 5 т.п.о., более чем 6 т.п.о., более чем 7 т.п.о., более чем 8 т.п.о., более чем 9 т.п.о., более чем 10 т.п.о., более чем 20 т.п.о., более чем 30 т.п.о., более чем 40 т.п.о., более чем 50 т.п.о., более чем 60 т.п.о., больше чем 70 т.п.о., более чем 80 т.п.о., более чем 90 т.п.о. или более чем 100 т.п.о. от 5'-последовательности-мишени или от обеих 5'- и 3'-последовательностей-мишеней. Аналогично, последовательность, распознаваемая второй направляющей РНК, или второй сайт расщепления могут быть расположены более чем 50 п.о., более чем 100 п.о., более чем 200 п.о., более чем 300 п.о., более чем 400 п.о., более чем 500 п.о., более чем 600 п.о., более чем 700 п.о., более чем 800 п.о., более чем 900 п.о., более чем 1 т.п.о., более чем 2 т.п.о., более чем 3 т.п.о., более чем 4 т.п.о., более чем 5 т.п.о., более чем 6 т.п.о., более чем 7 т.п.о., более чем 8 т.п.о., более чем 9 т.п.о., более чем 10 т.п.о., более чем 20 т.п.о., более чем 30 т.п.о., более чем 40 т.п.о., более чем 50 т.п.о., более чем 60 т.п.о., больше чем 70 т.п.о., более чем 80 т.п.о., более чем 90 т.п.о. или более чем 100 т.п.о. от 3'-последовательности-мишени или от обеих 5'- и 3'-последовательностей-мишеней.
[000272] Пространственная взаимосвязь последовательностей-мишеней, которые соответствуют плечам гомологии экзогенной матрицы для репарации и сайта расщепления Cas, может изменяться. Например, последовательности-мишени могут быть расположены 5' по отношению к сайту расщепления Cas, последовательности-мишени могут быть расположены 3' по отношению к сайту расщепления Cas, или последовательности-мишени могут фланкировать сайт расщепления Cas.
[000273] В клетках, отличных от эмбрионов на одноклеточной стадии, экзогенная матрица для репарации может быть «большим направленным вектором» или «LTVEC», который включает в себя векторы нацеливания, которые содержат плечи гомологии, которые соответствуют и получены из последовательностей нуклеиновых кислот, превышающих те, которые обычно используются другими подходами, предназначенными для выполнения гомологичной рекомбинации в клетках. LTVEC также включают направленные векторы, содержащие вставки нуклеиновых кислот, имеющие последовательности нуклеиновых кислот, более крупные, чем те, которые обычно используются другими подходами, предназначенными для выполнения гомологичной рекомбинации в клетках. Например, LTVEC делает возможной модификацию больших локусов, которая не может быть обеспечена традиционными нацеливающими векторами на основе плазмид из-за их ограничений по размеру. Например, целевой локус может быть (т.е. 5' и 3' плечи гомологии могут соответствовать) локусом клетки, который не может стать целью с использованием обычного способа или который может стать целью только неправильно или только со значительно низкой эффективностью в отсутствие одноцепочечного разрыва или двухцепочечного разрыва, вызванного нуклеазным агентом (например, белком Cas).
[000274] Примеры LTVEC включают векторы, полученные из бактериальной искусственной хромосомы (ВАС), человеческой искусственной хромосомы или искусственной хромосомы дрожжей (YAC). Неограничивающие примеры LTVEC и способы их изготовления описаны, например, в патентах США №6586251; 6596541; и 7105348; и в WO 2002/036789, каждый из которых включен в настоящее описание посредством ссылок во всей их полноте для всех целей. LTVEC могут быть линейными или круговой формы.
[000275] LTVEC могут иметь любую длину и, как правило, не менее 10 т.п.о. в длину. Например, LTVEC может составлять от около 50 т.п.о. до около 300 т.п.о., от около 50 т.п.о. до около 75 т.п.о., от около 75 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до 125 т.п.о., от около 125 т.п.о. до около 150 т.п.о., от около 150 т.п.о. до около 175 т.п.о., от около 175 т.п.о. до около 200 т.п.о., от около 200 т.п.о. до около 225 т.п.о., от около 225 т.п.о. до около 250 т.п.о., от около 250 т.п.о. до около 275 т.п.о., или от около 275 т.п.о. до около 300 т.п.о. LTVEC может также составлять от около 50 т.п.о. до около 500 т.п.о., от около 100 т.п.о. до около 125 т.п.о., от около 300 т.п.о. до около 325 т.п.о., от около 325 т.п.о. до 350 т.п.о., от около 350 т.п.о. до около 375 т.п.о., от около 375 т.п.о. до около 400 т.п.о., от около 400 т.п.о. до около 425 т.п.о., от около 425 т.п.о. до около 450 т.п.о., от около 450 т.п.о. до около 475 т.п.о., или от около 475 т.п.о. до около 500 т.п.о. Альтернативно, LTVEC может составлять по меньшей мере 10 т.п.о., по меньшей мере 15 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере, 150 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о., по меньшей мере 400 т.п.о., по меньшей мере 450 т.п.о. или по меньшей мере 500 т.п.о. или более. Размер LTVEC может быть слишком большим, чтобы обеспечить скрининг событий нацеливания с помощью обычных анализов, например, вестерн-блоттинга и ПЦР на большие расстояния (например, от 1 т.п.о. до 5 т.п.о.)
[000276] Общая сумма плеча 5'-гомологии и плеча 3'-гомологии в LTVEC обычно составляет не менее 10 т.п.о. В качестве примера, 5'-плечо гомологии может находиться в диапазоне от около 5 т.п.о. до около 100 т.п.о., и/или 3'-плечо гомологии может находиться в диапазоне от около 5 т.п.о. до около 100 т.п.о. В качестве другого примера, 5'-плечо гомологии может находиться в диапазоне от около 5 т.п.о. до около 150 т.п.о., и/или 3'-плечо гомологии может находиться в диапазоне от около 5 т.п.о. до около 150 т.п.о. Каждое плечо гомологии может составлять, например, от около 5 т.п.о. до около 10 т.п.о., от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 30 т.п.о., от около 30 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 50 т.п.о., от около 50 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до около 70 т.п.о., от около 70 т.п.о. до около 80 т.п.о., от около 80 т.п.о. до около 90 т.п.о., от около 90 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 110 т.п.о., от около 110 т.п.о. до около 120 т.п.о., от около 120 т.п.о. до около 130 т.п.о., от около 130 т.п.о. до около 140 т.п.о., от около 140 т.п.о. до около 150 т.п.о., от около 150 т.п.о. до около 160 т.п.о., от около 160 т.п.о. до около 170 т.п.о., от около 170 т.п.о. до около 180 т.п.о., от около 180 т.п.о. до около 190 т.п.о., или от около 190 т.п.о. до около 200 т.п.о. Общая сумма 5'- и 3'-плечей гомологии может составлять, например, от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 30 т.п.о., от около 30 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 50 т.п.о., от около 50 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до около 70 т.п.о., от около 70 т.п.о. до около 80 т.п.о., от около 80 т.п.о. до около 90 т.п.о., от около 90 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 110 т.п.о., от около 110 т.п.о. до около 120 т.п.о., от около 120 т.п.о. до около 130 т.п.о., от около 130 т.п.о. до около 140 т.п.о., от около 140 т.п.о. до около 150 т.п.о., от около 150 т.п.о. до около 160 т.п.о., от около 160 т.п.о. до около 170 т.п.о., от около 170 т.п.о. до около 180 т.п.о., от около 180 т.п.о. до около 190 т.п.о., или от около 190 т.п.о. до около 200 т.п.о. Общая сумма 5'- и 3'-плечей гомологии может также составлять, например, от около 200 т.п.о. до около 250 т.п.о., от около 250 т.п.о. до около 300 т.п.о., от около 300 т.п.о. до около 350 т.п.о., или от около 350 т.п.о. до около 400 т.п.о. Альтернативно, каждое плечо гомологии может составлять по меньшей мере 5 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 15 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере, 100 т.п.о., по меньшей мере 110 т.п.о., по меньшей мере 120 т.п.о., по меньшей мере 130 т.п.о., по меньшей мере 140 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 160 т.п.о., по меньшей мере 170 т.п.о., по меньшей мере 180 т.п.о., по меньшей мере 190 т.п.о., или по меньшей мере 200 т.п.о. Альтернативно, общая сумма 5'- и 3'-плечей гомологии может составлять по меньшей мере 10 т.п.о., по меньшей мере 15 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере, 100 т.п.о., по меньшей мере 110 т.п.о., по меньшей мере 120 т.п.о., по меньшей мере 130 т.п.о., по меньшей мере 140 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 160 т.п.о., по меньшей мере 170 т.п.о., по меньшей мере 180 т.п.о., по меньшей мере 190 т.п.о., или по меньшей мере 200 т.п.о. Каждое плечо гомологии может также составлять по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о. или по меньшей мере 400 т.п.о.
[000277] LTVEC также содержать вставки нуклеиновых кислот, имеющие последовательности нуклеиновых кислот, более крупные, чем те, которые обычно используются другими подходами, предназначенными для выполнения гомологичной рекомбинации в клетках. Например, LTVEC может содержать вставку нуклеиновой кислоты в диапазоне от около 5 т.п.о. до около 10 т.п.о., от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до 80 т.п.о., от около 80 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 150 т.п.о., от около 150 т.п.о. до около 200 т.п.о., от около 200 т.п.о. до около 250 т.п.о., от около 250 т.п.о. до около 300 т.п.о., от около 300 т.п.о. до около 350 т.п.о., от около 350 т.п.о. до около 400 т.п.о., или более LTVEC может также содержать вставку нуклеиновой кислоты, например, от около 1 т.п.о. до около 5 т.п.о., от около 400 т.п.о. до около 450 т.п.о., от около 450 т.п.о. до около 500 т.п.о. или более. Альтернативно, вставка нуклеиновой кислоты может составлять по меньшей мере 1 т.п.о., по меньшей мере 5 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о., по меньшей мере 400 т.п.о., по меньшей мере 450 т.п.о. или по меньшей мере 500 т.п.о.
D. Приведение в контакте геномом клетки и введение нуклеиновых кислот или белков в клетки
[000278] Приведение в контакт с геномом клетки может включать введение одного или более белков Cas или нуклеиновых кислот, кодирующих белки Cas, одну или более направляющих РНК или нуклеиновых кислот, кодирующих направляющие РНК (то есть одну или более CRISPR РНК и одну или более малых некодирующих РНК), и одну или более экзогенных матриц для репарации в клетке, при условии, что если клетка представляет собой эмбрион на одноклеточной стадии, например, экзогенная матрица для репарации может быть менее чем 5 т.п.о. в длину. Приведение в контакт с геномом клетки (например, приведение в контакт клетки) может включать введение только одного из вышеуказанных компонентов, одного или более компонентов, или всех компонентов в клетку. «Введение» включает в себя введение в клетку нуклеиновой кислоты или белка таким образом, что последовательность получает доступ к внутренней части клетки. Введение может быть осуществлено любыми способами, и один или более компонентов (например, два компонента или все компоненты) могут быть введены в клетку одновременно или последовательно в любой комбинации. Например, экзогенная матрица для репарации может быть введена до введения белка Cas и направляющей РНК, или она может быть введена после введения белка Cas и направляющей РНК (например, экзогенную матрицу для репарации можно вводить около 1, 2, 3, 4, 8, 12, 24, 36, 48 или 72 часов до или после введения белка Cas и направляющей РНК). См., например, US 2015/0240263 и US 2015/0110762, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000279] Белок Cas может быть введен в клетку в виде белка, такого как белок Cas, образующий комплекс с гРНК, или в форме нуклеиновой кислоты, кодирующей белок Cas, такой как РНК (например, матричная РНК (мРНК)) или ДНК. При введении в форме ДНК, ДНК, кодирующая направляющую РНК, может быть функционально связана с промотором, активным в клетке. Такие ДНК могут быть в одном или более экспрессионных конструктах.
[000280] Направляющую РНК можно вводить в клетку в форме РНК или в форме ДНК, кодирующей направляющую РНК. При введении в форме ДНК, ДНК, кодирующая направляющую РНК, может быть функционально связана с промотором, активным в клетке. Такие ДНК могут быть в одном или более экспрессионных конструктах. Например, такие экспрессионные конструкты могут быть компонентами одной молекулы нуклеиновой кислоты. Альтернативно, они могут быть разделены в любой комбинации между двумя или более молекулами нуклеиновой кислоты (то есть, ДНК, кодирующие одну или более РНК CRISPR и ДНК, кодирующие одну или более малых некодирующих РНК, могут быть компонентами отдельных молекул нуклеиновой кислоты).
[000281] В некоторых способах ДНК, кодирующая нуклеазный агент (например, белок Cas и направляющая РНК), и/или ДНК, кодирующая экзогенную матрицу для репарации, может быть введена в клетку через миникольцо ДНК. См., например, WO 2014/182700, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Миникольца ДНК представляют собой молекулы суперспиральной ДНК, которые могут быть использованы для переноса генов без использования вирусов, и которые не имеют ни точки начала репликации, ни маркера для селекции с помощью антибиотиков. Таким образом, миникольцевые ДНК обычно имеют меньший размер, чем вектор плазмиды. Эти ДНК лишены бактериальной ДНК и, таким образом, лишены неметилированных мотивов CpG, обнаруженных в бактериальной ДНК.
[000282] Способы, предлагаемые в данном документе, не зависят от конкретного способа введения нуклеиновой кислоты или белка в клетку, только то, что нуклеиновая кислота или белок получает доступ к внутренней части по меньшей мере одной клетки. Способы введения нуклеиновых кислот и белков в различные типы клеток известны в данной области и включают, например, стабильные способы трансфекции, способы временной трансфекции и опосредованные вирусом способы.
[000283] Протоколы трансфекции, а также протоколы введения нуклеиновых кислот или белков в клетки могут варьироваться. Неограничивающие способы трансфекции включают химически-основанные способы трансфекции с использованием липосом; наночастиц; фосфата кальция (Graham et al. (1973) Virology 52 (2): 456-67, Bacchetti et al. (1977) Proc. Natl. Acad. Sci. USA 74 (4): 1590-4, и Kriegler, M (1991). Transfer and Expression: A Laboratory Manual. New York: W.H. Freeman и Company, pp. 96-97); дендримеров; или катионных полимеров, таких как DEAE-декстран или полиэтиленимин. Нехимические способы включают электропорацию, сонопоризацию и оптическую трансфекцию. Трансфекция на основе частиц включает использование генной пушки или трансфекции с помощью магнита (Bertram (2006) Current Pharmaceutical Biotechnology 7, 277-28). Вирусные способы также могут быть использованы для трансфекции.
[000284] Введение нуклеиновых кислот или белков в клетку также может быть опосредовано электропорацией, интрацитоплазматической инъекцией, вирусной инфекцией, аденовирусом, лентивирусом, ретровирусом, трансфекцией, липид-опосредственной трансфекцией или нуклеофекцией. Введение нуклеиновых кислот или белков в клетку также может быть опосредовано аденоассоциированным вирусом. Нуклеофекция представляет собой усовершенствованную технологию электропорации, которая позволяет доставлять субстраты нуклеиновых кислот не только в цитоплазму, но также через ядерную мембрану и в ядро. Кроме того, использование нуклеофекции в описанных в данном документе способах обычно требует гораздо меньшего количества клеток, чем регулярная электропорация (например, только около 2 миллионов по сравнению с 7 миллионами при регулярной электропорации). В одном примере нуклеофекция выполняется с использованием системы LONZA® NUCLEOFECTOR™.
[000285] Введение нуклеиновых кислот или белков в клетку (например, эмбрион на одноклеточной стадии) также может быть осуществлено путем микроинъекции. В эмбрионах на одноклеточной стадии, микроинъекция может быть в материнском и/или родительском пронуклеуме или в цитоплазме. Если микроинъекция находится только в одном пронуклеусе, родительский пронуклеус предпочтительнее из-за его большего размера. Микроинъекция мРНК предпочтительно находится в цитоплазме (например, для доставки мРНК непосредственно к механизму трансляции), тогда как микроинъекция белка Cas или нуклеиновой кислоты, кодирующей белок Cas или кодирующая РНК, является предпочтительной в ядро/пронуклеус. Альтернативно, микроинъекция может быть осуществлена путем инъекции как в ядро/пронуклеус, так и в цитоплазму: сначала можно ввести иглу в ядро/пронуклеус, и первое количество можно инъектировать, а при удалении иглы из эмбриона на одноклеточной стадии второе количество может быть инъектировано в цитоплазму. Если в цитоплазму инъектируют белок Cas, белок Cas предпочтительно содержит сигнал ядерной локализации для обеспечения доставки в ядро / пронуклеус. Способы проведения микроинъекции хорошо известны. См., например, Nagy et al. (Nagy A, Gertsenstein M, Vintersten K, Behringer R., 2003, Manipulating the Mouse Embryo. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press); Meyer et al. (2010) Proc. Natl. Acad. Sci. USA 107:15022-15026 и Meyer et al. (2012) Proc. Natl. Acad. Sci. USA 109:9354-9359. Введение в эмбрионы на одноклеточной стадии также может быть осуществлено электропорацией.
[000286] Другие способы введения нуклеиновой кислоты или белков в клетку могут включать, например, доставку вектора, доставку, опосредованную частицей, доставку, опосредованную экзосомой, доставку, опосредованную липидом и наночастицами, доставку, опосредуемую пептидом проникновения, или доставку, опосредуемую имплантируемым устройством.
[000287] Введение нуклеиновых кислот или белков в клетку может выполняться один или более раз в течение определенного периода времени. Например, введение может выполняться по меньшей мере два раза в течение периода времени, по крайней мере три раза в течение периода времени, по меньшей мере четыре раза в течение периода времени, по меньшей мере пять раз в течение периода времени, по меньшей мере шесть раз в течение периода времени, по меньшей мере семь раз в течение периода времени, по меньшей мере восемь раз в течение периода времени, по меньшей мере девять раз в течение периода времени, по меньшей мере десять раз в течение периода времени, по меньшей мере одиннадцать раз, по меньшей мере двенадцать раз в течение периода времени, по меньшей мере тринадцать раз в течение периода времени, по меньшей мере четырнадцать раз в течение периода времени, по меньшей мере пятнадцать раз в течение периода времени, по меньшей мере шестнадцать раз в течение периода времени, по меньшей мере семнадцать раз в течение периода времени, по меньшей мере восемнадцать раз в течение периода времени, по меньшей мере девятнадцать раз в течение периода времени или по меньшей мере двадцать раз в течение периода времени.
[000288] В некоторых случаях клетки, используемые в способах и композициях, имеют конструкт ДНК, стабильно включенный в их геном. В таких случаях приведение в контакт может включать в себя обеспечение клетки конструктом, который уже стабильно включен в ее геном. Например, клетка, используемая в описанных в данном документе способах, может иметь ранее существовавший Cas-кодирующий ген, стабильно включенный в его геном (т.е. Cas-готовую клетку). «Стабильно введенный» или «стабильно введенный» или «стабильно интегрированный» включает введение полинуклеотида в клетку, так что нуклеотидная последовательность интегрируется в геном клетки и может быть унаследована их потомством. Любой протокол может быть использован для стабильного включения конструктов ДНК или различных компонентов целевой системы геномной интеграции.
Е. Геномные локусы-мишени и месторасположения последовательностей, распознаваемых направляющей РНК.
[000289] Геномный локус-мишень может быть любым геномным локусом, который влияет на экспрессию аутоантигена, гомологичного или обладающего представляющим интерес эпитопом, с представляющим интерес чужеродным антигеном-мишенью. Предпочтительно, геномный локус-мишень содержит, по существу состоит из, или состоит из всего или части гена, кодирующего аутоантиген. В качестве примера геномный локус-мишень может содержать, по существу состоять из или состоять из участка, содержащего стартовый кодон гена, кодирующего аутоантиген, или может содержать, по существу состоять из или состоять из всего кодирующего участка гена. Альтернативно, геномный локус-мишень может содержать, состоять по существу из или состоять из другого геномного локуса, который влияет на экспрессию гена, кодирующего аутоантиген. Примером такого геномного локуса является весь или часть гена, кодирующего регулятор транскрипции, необходимый для экспрессии гена, кодирующего аутоантиген. В некоторых способах, можно использовать многие геномные локусы-мишени. В качестве примера, если существует несколько генов, кодирующих многие аутоантигены, гомологичных или разделяющих представляющий интерес эпитоп с представляющим интерес чужеродным антигеном, нацеливание на каждый из многих генов может быть либо последовательным, либо одновременным.
[000290] Последовательности, распознаваемые первой и второй направляющими РНК, могут находиться в любом месте в геномном локусе-мишени. Например, последовательности, распознаваемые первой и второй направляющими РНК, могут фланкировать весь или часть гена, кодирующего аутоантиген, который является гомологичным или разделяет представляющий интерес эпитоп с представляющим интерес чужеродным антигеном-мишенью. В одном примере, последовательность, распознаваемая первой направляющей РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, и последовательность, распознаваемая второй направляющей РНК, содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500, или 1000 нуклеотидов от стоп-кодона. Например, последовательность, распознаваемая первой направляющей РНК может содержать старт-кодон, а последовательность, распознаваемая второй направляющей РНК может содержать стоп-кодон. Если также используются третья и четвертая направляющие РНК, последовательности, распознаваемые третьей и четвертой направляющей РНК, могут также находиться в пределах геномного локуса-мишени. Например, две из последовательностей, распознаваемых направляющей РНК (например, первая и третья, в которых последовательности, распознаваемые первой и третей направляющей РНК, различны и необязательно перекрываются) могут содержать старт кодон для гена, кодирующего аутоантиген, или могут находиться в пределах около 10, 20, 30, 40, 50,100, 200, 300, 400, 500 или 1000 нуклеотидов от старт кодона, а также две другие последовательности, распознаваемые направляющей РНК (например, вторая и четвертая, в которых последовательности, распознаваемые второй и четвертой направляющей РНК, различны и необязательно перекрываются) может содержать стоп-кодон для гена, кодирующего аутоантиген, или может находиться в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от стоп-кодона. Нацеливание как старт, так и стоп кодонов может привести к удалению кодирующей последовательности для гена, кодирующего аутоантиген, и тем самым исключить экспрессию аутоантигена.
[000291] В другом примере, последовательности, распознаваемые первой и второй направляющими РНК, различны, и каждая содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона. Например, последовательности, распознаваемые первой и второй направляющими РНК, могут перекрываться, и каждая может содержать старт кодон. Если также используются третья и/или четвертая направляющие РНК, последовательности, распознаваемые третьей и четвертой направляющей РНК, могут находиться где угодно в пределах геномного локуса-мишени. Например, последовательности, распознаваемые третьей и четвертой направляющей РНК, могут отличаться друг от друга и отличаться от последовательностей, распознаваемых первой и второй направляющими РНК, и каждая из последовательностей, распознаваемых третьей и четвертой направляющей РНК, может также содержать старт кодон для гена, кодирующего аутоантиген или может находиться в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона. Нацеливание на старт-кодон может нарушить старт- кодон и тем самым исключить экспрессию гена, кодирующего аутоантиген.
[000292] Если используются третья и четвертая направляющие РНК (или дополнительные направляющие РНК), дополнительные геномные локусы-мишени, влияющие на экспрессию первого аутоантигена или влияющие на экспрессию других аутоантигенов (например, второго аутоантигена), гомологичных или разделяющих представляющий интерес эпитоп с представляющим интерес чужеродным антигеном, также могут быть нацелены на уменьшение экспрессии первого аутоантигена и/или других аутоантигенов. В качестве примера, в некоторых способах целью может быть ген, кодирующий первый аутоантиген, гомологичный или разделяющий представляющий интерес эпитоп с представляющим интерес чужеродным антигеном, и целью может быть второй ген, кодирующий второй аутоантиген, гомологичный или разделяющий представляющий интерес эпитоп с представляющим интерес чужеродным антигеном.
F. Механизмы рекомбинации и способы для изменения распространения негомологичного соединения концов, конверсии генов или гомологичной рекомбинации
[000293] Рекомбинация включает любой процесс обмена генетической информацией между двумя полинуклеотидами и может происходить с помощью любого механизма. Рекомбинация в ответ на двухнитевые разрывы (DSB) происходит главным образом через два консервативных пути репарации ДНК: негомологичное соединение концов (NHEJ) и гомологичную рекомбинацию (HR). См. Kasparek & Humphrey (2011) Seminars in Cell & Dev. Biol. 22:886-897, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Аналогичным образом, репарация нуклеиновой кислоты-мишени, опосредуемая экзогенной матрицей для репарации, может включать в себя любой процесс обмена генетической информацией между двумя полинуклеотидами.
[000294] NHEJ включает в себя репарацию двухнитевых разрывов в нуклеиновой кислоте путем прямого лигирования концов разрыва друг с другом или с экзогенной последовательностью без необходимости в гомологичной матрице. Лигирование несмежных последовательностей с помощью NHEJ может часто приводить к делециям, вставкам или транслокациям вблизи места двухнитевого разрыва. Например, NHEJ также может привести к направленной интеграции экзогенной матрицы для репарации путем прямого лигирования концов разрыва с концами экзогенной матрицы для репарации (т.е. захвата на основе NHEJ). Такая опосредованная NHEJ направленная интеграция может быть предпочтительной для вставки экзогенной матрицы для репарации, когда пути репарации, направленной гомологией (HDR), не могут быть легко использованы (например, в не делящихся клетках, первичных клетках, и клетках, которые плохо выполняют репарацию ДНК на основе гомологии). Кроме того, в отличие от репарации, основанной на гомологии, знания о больших участках идентичности последовательности, фланкирующих сайт расщепления (за пределами «липких» концов, созданных с помощью Cas-опосредованного расщепления), не нужны, что может быть полезно при попытке направленной вставки в организмы, у которых есть геномы, для которых знание о геномной последовательности ограничено. Интеграция может протекать через лигирование «тупых» концов между экзогенной матрицей для репарации и расщепленной геномной последовательностью, или путем лигирования «липких» концов (т.е. имеющих 5' или 3' «липкие» концы) с использованием экзогенной матрицы для репарации, которая фланкирована с помощью «липких» концов, которые совместимы с теми, которые генерируются с помощью белка Cas в расщепленной геномной последовательности. См., например, US 2011/020722, WO 2014/033644, WO 2014/089290, and Maresca et al. (2013) Genome Res. 23(3):539-546, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Если «тупые» концы лигированы, может потребоваться резекция цели и/или донора для генерации участков микрогомологии, необходимых для присоединения фрагментов, что может создавать нежелательные изменения в последовательности-мишени.
[000295] Рекомбинация также может происходить посредством репарации, направляемой гомологией (HDR), или гомологичной рекомбинации (HR). HDR или HR включает в себя форму репарации нуклеиновой кислоты, которая может потребовать гомологию нуклеотидной последовательности, использует «донорскую» молекулу в качестве матрицы для репарации «целевой» молекулы (т.е. той, которая испытывала двухнитевой разрыв), и приводит к передаче генетической информации от донора к мишени. Не желая связывать себя какой-либо конкретной теорией, такая передача может включать коррекцию несовпадения гетеродуплексной ДНК, которое образуется между сломанной мишенью и донором, и/или синтез-зависимый отжиг нити, в котором донор используется для ресинтеза генетической информации, которая будет частью мишени, и/или связанных процессов. В некоторых случаях донорный полинуклеотид, часть донорного полинуклеотида, копия донорного полинуклеотида, или часть копии донорного полинуклеотида интегрируется в ДНК-мишень. См. Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS ONE 7:e45768:1-9; и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000296] Рекомбинация может быть между первой и второй хромосомами в гомологичной паре хромосом. Такие средства могут включать, например, потерю гетерозиготности (LOH), конверсию генов, или перекрестные события, происходящие с помощью любого известного механизма рекомбинации. Не желая связывать себя теорией, LOH может происходить, например, посредством митотической рекомбинации, с или без конверсии гена, или посредством потери хромосом и дублирования. См., например, Lefebvre et al. (2001) Nat. Genet. 27:257-258, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Конверсия генов в этом контексте может включать однонаправленную передачу генетического материала от донорной последовательности к высоко гомологичному акцептору (т.е. нереципрокный обмен генетической информацией от одной молекулы к ее гомологу). Преобразование генов включает любые средства для копирования аллеля с помощью любого известного механизма рекомбинации. Например, конверсия генов может включать в себя нереципрокную передачу генетической информации из интактной последовательности в гомологичный участок, содержащий двухцепочечный разрыв, и он может происходить между сестринскими хроматидами, гомологичными хромосомами или гомологичными последовательностями на одной и той же хроматиде или на разных хромосомах. См., например, Chen et al. (2007) Nat. Rev. Genet. 8:762-775, включенный в данный документ в качестве ссылки во всей полноте для всех целей. В конкретных случаях, конверсия генов происходит непосредственно из гомологичной рекомбинации в результате копирования генетической информации из гомологичной хромосомы. Это может привести к локализованной потере гетерозиготности (LOH), когда гомологичные последовательности не идентичны.
[000297] В качестве примера, LOH может происходить посредством реципрокного обмена хроматидами путем митотического кроссовера или путем копирования хроматиды путем репликации, вызванной разрывом. В любом случае может возникнуть гетерозиготная модификация, в которой одна хромосома нацелена до репликации генома. Альтернативно, единственная хроматида может быть нацелена после репликации генома с последующей интерхроматидной конверсией генов.
[000298] В любом из способов, описанных в данном документе, клетка может быть клеткой, которая была модифицирована для увеличения или уменьшения активности NHEJ. Аналогично, клетка может быть клеткой, которая была модифицирована для увеличения конверсии генов или активности HDR. Такие модификации могут содержать модификации в экспрессии или активности генов, участвующих в регуляции NHEJ, конверсии генов и/или HDR. Например, снижение активности NHEJ и/или увеличение активности HDR может способствовать биаллельному разрушению геномных участков между последовательностями, распознаваемыми нуклеазой (например, последовательностями, распознаваемыми направляющей РНК), соответствующим двум нуклеазным агентам (например, белку Cas и двум направляющим РНК). Не желая быть связанными какую-либо конкретной теорией, один механизм, посредством которого может происходить биаллельное геномное разрушение, заключается в NHEJ-опосредованной репарации или HDR-опосредованной репарации в пределах первого аллеля и создании идентичного второго аллеля посредством механизмов HDR, таких как конверсия генов (см. Пример 1). Таким образом, промотирование HDR-опосредованных путей (например, путем уменьшения активности NHEJ или увеличения активности HDR) также может способствовать биаллельному разрушению геномных участков. Точно так же, не желая быть связанными какой-либо конкретной теорией, конверсия гетерозиготной клетки в гомозиготную клетку с использованием спаренных нуклеазных агентов (например, белка Cas и спаренных направляющих РНК), которые нацелены на один локус, может быть промотирована, если активность NHEJ снижается и активность HDR (например, активность конверсии генов) соответственно увеличивается.
[000299] Ингибиторы могут использоваться для увеличения или уменьшения активности NHEJ или для увеличения, или уменьшения активности HDR. Такими ингибиторами могут быть, например, малые молекулы или ингибирующие нуклеиновые кислоты, такие как короткие интерферирующие нуклеиновые кислоты (например, короткая интерферирующая РНК (киРНК), двухцепочечная РНК (дцРНК), микроРНК (миРНК) и короткая шпилечная РНК (кшРНК)) или антисмысловые олигонуклеотиды, специфичные для транскрипта гена. Ингибиторы могут быть направлены на ферменты, участвующие в NHEJ или HDR, или их регуляции вверх по ходу транскрипции посредством посттрансляционной модификации, например, фосфорилирования, убиквитилирования и сумоилирования.
[000300] В клетках млекопитающих, NHEJ является преобладающим механизмом репарации DSB и активен во всем клеточном цикле. У позвоночных «канонический» или «классический» путь NHEJ (C-NHEJ) требует несколько основных факторов, включая DNA-PK, Ku70-80, Artemis, лигазу IV (Lig4), XRCC4, CLF и Pol μ для восстановления DSB. См. Kasparek & Humphrey (2011) Seminars in Cell & Dev. Biol. 22:886-897, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Во время NHEJ, концы ДНК связаны с помощью очень богатого защищающего конец Ku белка, который функционирует как стыковочная станция для загрузки других компонентов NHEJ.
[000301] Таким образом, в некоторых способах, описанных в данном документе, клетка была модифицирована для уменьшения или устранения, или увеличения экспрессии или активности факторов, участвующих в C-NHEJ. Например, в некоторых способах, клетка была модифицирована для уменьшения или исключения экспрессии, или активности ДНК-PK, Ku70-80, Artemis, лигазы IV (Lig4), XRCC4, CLF и/или Pol μ. В конкретных способах, клетка была модифицирована для уменьшения или исключения экспрессии ДНК-PK или активности, или для увеличения экспрессии ДНК-PK или активности (например, экспрессии или активности ДНК-PKcs, иллюстративная последовательность UniProt, обозначенная Р97313). Примеры ингибиторов ДНК-PKcs включают, например, NU7026 и NU7441. См., например, патент США №6974867, включенный в данный документ в качестве ссылки во всей своей полноте для всех целей. В конкретных способах, клетка была модифицирована для уменьшения или исключения экспрессии лигазы IV или активности, или для увеличения экспрессии лигазы IV или активности. Примером ингибитора лигазы IV является SCR7.
[000302] Ингибиторы, нацеленные на белки контрольной точки клеточного цикла, такие как ATM (например, KU55933), CHK1/CHK2 (например, KLD1162 или CHIR-124) и ATR (например, VE 821), также могут использоваться для синергического усиления эффектов специфических ингибиторов репарации ДНК или для предотвращения непреднамеренных побочных эффектов, таких как остановка клеточного цикла и/или апоптоз (см. Ciccia et al. (2010) Mol Cell 40:179, включенный в данный документ в качестве ссылки во всей полноте для всех целей).
[000303] Нарушение C-NHEJ может увеличить уровни аномального соединения, опосредованного «альтернативными» NHEJ (A-NHEJ) путями, а также может увеличить репарацию HR. Пути A-NHEJ проявляют смещение к опосредованным микрогомологией соединениям и происходят с более медленной кинетикой, чем C-NHEJ. Для участия было предложено несколько факторов, включая комплекс MRN (MRE11, RAD50, NBS1), CtIP, XRCC1, PARP, Lig1 и Lig3. См. Kasparek & Humphrey (2011) Seminars in Cell & Dev. Biol. 22:886-897 и Claybon et al. (2010) Nucleic Acids Res. 38(21):7538-7545, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000304] Таким образом, в некоторых способах, описанных в данном документе, клетка была модифицирована для уменьшения или устранения, или увеличения экспрессии или активности факторов, участвующих в A-NHEJ. Например, в некоторых способах, клетка была модифицирована для уменьшения или исключения экспрессии, или активности MRE11, RAD50, NBS1, CtIP, XRCC1, PARP (например, PARP1), Lig1 и/или Lig3. В других способах, клетка была модифицирована для увеличения экспрессии или активности MRE11, RAD50, NBS1, CtIP, XRCC1, PARP (например, PARP1), Lig1 и/или Lig3. В конкретных способах, клетка была модифицирована для уменьшения или исключения экспрессии PARP1 или активности, или для увеличения экспрессии PARP1 или активности (иллюстративная последовательность UniProt, обозначенная Р11103). Примеры ингибиторов PARP (например, NU1025, Iniparib, Olaparib) включают никотинамиды; изохинолиноны и дигидроизохинолиноны; бензимидазолы и индолы; фталазин-1(2Н)-оны и хиназолиноны; изоиндолиноны и их аналоги и их производные; фенантридины и фенантридиноны; бензопироны и их аналоги и их производные; ненасыщенные производные гидроксимовой кислоты и их аналоги и их производные; пиридазины, включая слитые пиридазины и их аналоги и их производные; и/или другие соединения, такие как кофеин, теофиллин и тимидин, а также их аналоги и их производные. См., например, патент США №8071579, включенный в данный документ в качестве ссылки во всей своей полноте для всех целей.
[000305] C-NHEJ также демонстрирует конкурентные отношения с HR, так что нарушение С-NHEJ также может привести к усилению репарации HR. Такая конкуренция между NHEJ и HR может быть использована, поскольку нарушение NHEJ может привести к усилению генного нацеливания за счет уменьшения случайной интеграции и, возможно, увеличения интеграции целей путем гомологичной рекомбинации.
[000306] Существует несколько форм репарации гомологичной рекомбинации, включая одноцепочечный отжиг, конверсию генов, кроссоверы и репликацию, вызванную разрушением. Одноцепочечный отжиг является минорной формой репарации HR, в которой гомологичные одноцепочечные последовательности с обеих сторон резецированного отжига DSB, что приводит к восстановлению хромосом. Одноцепочечный отжиг генерирует делеции разного размера в зависимости от расстояния, разделяющего два участка гомологии последовательностей. Конверсия генов включает в себя нереципрокный обмен генетической информацией от одной молекулы к ее гомологу, в результате непосредственно от HR в результате копирования генетической информации из гомологичной хромосомы. Это может привести к локализованной LOH, когда гомологичные последовательности не идентичны. Обычно степень конверсии генов ограничена несколькими сотнями пар оснований. Тем не менее, сообщалось о конверсии генов длинного тракта в некоторых генетических фонах, включая дефицит RAD51C. См. Nagaraju et al. (2006) Mol. Cell. Biol. 26:8075-8086, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Кроссоверы могут происходить, например, между гомологичными хромосомами и иметь возможность приводить к реципрокным транслокациям, если они встречаются в G1 или нереципрокных транслокациях и LOH, простирающихся от места разрыва до дистальной теломеры, если они встречаются в G2. Репликация, индуцированная разрывом, представляет собой вариант HR, в котором после инвазии цепи, репликация ДНК продолжается до конца хромосомы. Таким образом, существует множество механизмов, с помощью которых HR может промотировать LOH.
[000307] Таким образом, в некоторых способах, описанных в данном документе, клетка была модифицирована для уменьшения или устранения, или увеличения экспрессии или активности факторов, участвующих в HR. Например, в некоторых способах, клетка была модифицирована для увеличения экспрессии или активности RAD51, RAD52, RAD54, RAD55, RAD51C, BRCA1, и/или BRCA2. В других способах, клетка была модифицирована для уменьшения или исключения экспрессии, или активности RAD51, RAD52, RAD54, RAD55, RAD51C, BRCA1, и/или BRCA2.
[000308] В некоторых способах, экспрессия или активность других белков, участвующих в регуляции NHEJ и/или HR, может быть изменена. Например, в некоторых способах клетка была модифицирована для уменьшения или исключения экспрессии, или активности Chk2, для уменьшения или исключения экспрессии, или активности Clspn, для уменьшения или исключения экспрессии, или активности Setd2, для увеличения экспрессии или активности Kat2a и/или для увеличения экспрессии или активность Rad51. В других способах клетка была модифицирована для увеличения экспрессии или активности Chk2, для увеличения экспрессии или активности Clspn, для увеличения экспрессии или активности Setd2, для уменьшения или исключения экспрессии, или активности Kat2a, и/или для уменьшения или исключения экспрессии, или активности Rad51.
[000309] Chk2 (также известный как Chek2 и Rad53; гомолог S. pombe представляет собой Cds1) представляет собой серин/треониновую протеинкиназу, необходимую для остановки клеточного цикла, опосредованного контрольной точкой, активации репарации ДНК и апоптоза в ответ на наличие двухцепочечных разрывов ДНК. См. Blaikley et al. (2014) Nucleic Acids Research 42:5644-5656, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Clspn (также известный как Claspin; гомологе S. pombe представляет собой Mrc1) является белком, необходимым для остановки клеточного цикла, опосредованного контрольной точкой, в ответ на повреждение ДНК. Сообщается, что удаление гомологов Chk2 или Clspn в S. pombe приводит к гипер-рекомбинантному фенотипу, демонстрирующему значительно повышенные уровни конверсии гена, индуцированного разрывом, по сравнению с диким типом. В частности, сообщалось, что уровни конверсии генов были значительно увеличены, тогда как сообщалось, что уровни не гомологичного соединения концов (NHEJ), конверсии сестринских хроматид (SCC) и потеря гетерозиготности (LOH) снижаются. См. Blaikley et al. (2014) Nucleic Acids Research 42:5644-5656.
[000310] Kat2a (также известный как Gcn5 и Gcn5I2) представляет собой убиквитарную гистоновую ацетилтрансферазу, которая способствует активации транскрипции и, как сообщается, связана с репарацией двухцепочечного разрыва. Kat2a-зависимое гистоновое Н3-лизин 36 (H3K36) ацетилирование увеличивает доступность хроматина, увеличивает резекцию и способствует гомологичной рекомбинации при подавлении не гомологичного соединения концов. См. Pai et al. (2014) Nat. Commun. 5:4091, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Setd2 (также известный как Kiaa1732, Kmt3a и Set2) представляет собой гистоновую метилтрансферазу, которая специфически представляет собой триметилаты лизина 36 гистона Н3 (H3K36me3) с использованием деметилированного лизина 36 (H3K36me2) в качестве субстрата. Setd2-зависимое метилирование H3K36 уменьшает доступность хроматина, уменьшает резекцию и промотирует NHEJ. См. Pai et al. (2014) Nat. Commun. 5:4091.
[000311] Rad 51 (также известный как Reca, Rad51A и ДНК репарационный белок Rad51 гомолог 1) представляет собой белок, который функционирует с Rad52 и другими белками для осуществления обмена цепей во время гомологичной рекомбинации, образуя гетеродуплексную ДНК, которая разрешается путем репарации несовпадений, чтобы получить тракт конверсии гена. Сообщалось, что в клетках млекопитающих избыточная экспрессия Rad51 и Rad52 увеличивает частоту гомологичной рекомбинации и конверсии генов. См. Yanez & Porter (1999) Gene Ther. 6:1282-1290 и Lambert & Lopez (2000) EMBO J. 19:3090-3099, включенный в данный документ в качестве ссылки во всей полноте для всех целей.
[000312] Модификации в экспрессии или активности генов, участвующих в регуляции NHEJ, конверсия генов, и/или репарация, связанная с гомологией, могут быть пространственно-или временно-специфичными, а также могут быть индуцибельными или временными и обратимыми. Например, могут быть созданы различные формы кассет, позволяющие проводить делецию в определенных клеточных или тканевых типах, на определенных стадиях развития или при индукции. Такие кассеты могут использовать рекомбинатную систему, в которой кассета фланкирована с обеих сторон сайтами распознавания рекомбиназы и может быть удалена с использованием рекомбиназы, экспрессированной в желаемом типе клеток, экспрессированной на желаемой стадии развития или экспрессированной или активированной при индукции. Такие кассеты могут быть дополнительно сконструированы так, чтобы включать в себя массив пар различных сайтов распознавания рекомбиназы, которые помещены таким образом, что могут быть сгенерированы нулевые, условные или комбинированные условные/нулевые аллели, как описано в US 2011/0104799, включенном в данный документ в качестве ссылки во всей его полноте для всех целей. Регулирование генов рекомбиназы можно контролировать различными способами, такими как функциональное связывание гена рекомбиназы с клетка-специфическим, ткане-специфическим, или регулируемым развитием промотором (или другим регуляторным элементом) или путем функционального связывания гена рекомбиназы с 3'-UTR, который содержит сайт распознавания для миРНК, который активен только в конкретных типах клеток, типах тканей или этапах развития. Рекомбиназу также можно регулировать, например, с использованием слитого белка, располагающего рекомбиназу под контролем эффектора или метаболита (например, CreERT2, активность которого положительно контролируется тамоксифеном) или путем размещения гена рекомбиназы под контролем индуцибельного промотора (например, тот, чья активность контролируется с помощью доксициклина и TetR или вариантов TetR). Примеры различных форм кассет и средств регулирования рекомбиназных генов приведены, например, в US 8518392; US 8354389; и US 8697851, каждый из которых включен в качестве ссылки во всей своей полноте.
[000313] В других способах, описанных в данном документе, клетка была модифицирована для увеличения или уменьшения активности NHEJ или для увеличения конверсии генов или активности HDR путем блокирования клетки на фазе клеточного цикла, такой как М-фаза или S-фаза клеточного цикла. См., например, WO 2016/036754, включенную в данном документе в качестве ссылок в полном объеме для всех целей. Это может быть достигнуто с помощью композиции блокировки клеточного цикла. Примеры таких композиций включают нокодазол, гидроксимочевину; колхицин; демеколцин (колцемид); ловастатин; мимозин; тимидин; афидиколин; латрункулин А; и латрункулин В. Такие модификации могут содержать модификации в экспрессии или активности генов, участвующих в регуляции NHEJ, конверсии генов и/или HDR.
G. Типы нацеленных генетических модификаций
[000314] Различные типы нацеленных генетических модификаций могут быть введены с использованием описанных в данном документе способов. Такие нацеленные генетические модификации могут включать в себя любую модификацию, которая уменьшает или устраняет экспрессию аутоантигена, который гомологичен или разделяет представляющий интерес эпитоп с представляющим интерес чужеродным антигеном-мишенью. Предпочтительно такие модификации разрушают геномный локус-мишень. Примеры разрушения включают в себя изменение регуляторного элемента (например, промотора или энхансера), миссенс-мутацию, нонсенс-мутацию, мутацию со сдвигом рамки, мутацию усечения, нулевую мутацию, или вставку или делецию небольшого количества нуклеотидов (например, вызывая мутацию сдвига рамки). Нарушение может привести к инактивации (т.е. потере функции) или к потере аллеля. Такие нацеленные генетические модификации могут включать, например, вставку одного или более нуклеотидов, делецию одного или более нуклеотидов, или замену (замещение) одного или более нуклеотидов. Такие вставки, делеции или замены могут приводить, например, к точечной мутации, нокауту представляющей интерес последовательности нуклеиновой кислоты или ее части, нокину представляющей интерес последовательности нуклеиновой кислоты или ее части, замену эндогенной последовательности нуклеиновой кислоты с гетерологичной или экзогенной последовательностью нуклеиновой кислоты, изменению регуляторного элемента (например, промотора или энхансера), миссенс-мутации, нонсенс-мутации, мутации со сдвигом рамки, мутации усечения, нулевой мутации, или их комбинации. Например, по меньшей мере 1, 2, 3, 4, 5, 7, 8, 9, 10 или более нуклеотидов могут быть изменены (например, удалены, вставлены или замещены), чтобы сформировать нацеленную генетическую модификацию. Делеции, вставки или замены могут быть любого размера, как описано в другом месте данного документа. См., например, Wang et al. (2013) Cell 153:910-918; Mandalos et al. (2012) PLOS One 7:e45768; и Wang et al. (2013) Nat Biotechnol. 31:530-532, каждая из которых включена в настоящее описание посредством ссылки. Такие мутации могут приводить к уменьшению экспрессии или устранению экспрессии (например, мРНК и/или экспрессии белка) аутоантигена (например, делеция аллеля).
[000315] Нацеленная генетическая модификация (например, вставка, делеция или замещение) может происходить в одном или более местах в геномном локусе-мишени. Например, нацеленная генетическая модификация может содержать две отдельные модификации в двух местах в геномном локусе-мишени, если используются две экзогенные матрицы для репарации.
[000316] В способах, в которых используется экзогенная матрица для репарации, например, делеция может быть между 5'- и 3'-последовательностью-мишенью. В способах, в которых используются две или более направляющие РНК, делеция может быть между последовательностями, распознаваемыми первой и второй направляющими РНК, или первым и вторым сайтами расщепления Cas. Такие делеции могут быть любой длины. Удаленная нуклеиновая кислота может быть, например, от около 1 п.о. до около 5 п.о., от около 5 п.о. до около 10 п.о., от около 10 п.о. до около 50 п.о., от около 50 п.о. до около 100 п.о., от около 100 п.о. до около 200 п.о., от около 200 п.о. до около 300 п.о., от около 300 п.о. до около 400 п.о., от около 400 п.о. до около 500 п.о., от около 500 п.о. до около 1 т.п.о., от около 1 т.п.о. до около 5 т.п.о., от около 5 т.п.о. до около 10 т.п.о., от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до около 80 т.п.о., от около 80 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 150 т.п.о., или от около 150 т.п.о. до около 200 т.п.о., от около 200 т.п.о. до около 300 т.п.о., от около 300 т.п.о. до около 400 т.п.о., от около 400 т.п.о. до около 500 т.п.о., от около 500 т.п.о. до около 1 Мб, от около 1 Мб до около 1,5 Мб, от около 1,5 Мб до около 2 Мб, от около 2 Мб до 2,5 около Мб, или от около 2,5 Мб до около 3 Мб.
[000317] Альтернативно, удаленная нуклеиновая кислота может составлять, например, по меньшей мере 1 п.о., по меньшей мере 5 п.о., по меньшей мере 10 п.о., по меньшей мере 50 п.о., по меньшей мере 100 п.о., по меньшей мере 200 п.о., по меньшей мере 300 п.о., по меньшей мере 400 п.о., по меньшей мере 500 п.о., по меньшей мере 1 т.п.о., по меньшей мере 5 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 50 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 70 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 90 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 110 т.п.о., по меньшей мере 120 т.п.о., по меньшей мере 130 т.п.о., по меньшей мере 140 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 160 т.п.о., по меньшей мере 170 т.п.о., по меньшей мере 180 т.п.о., по меньшей мере 190 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о., по меньшей мере 400 т.п.о., по меньшей мере 450 т.п.о. или по меньшей мере 500 т.п.о. или более. В некоторых случаях удаленная нуклеиновая кислота может составлять по меньшей мере 550 т.п.о., по меньшей мере 600 т.п.о., по меньшей мере 650 т.п.о., по меньшей мере 700 т.п.о., по меньшей мере 750 т.п.о., по меньшей мере 800 т.п.о., по меньшей мере 850 т.п.о., по меньшей мере 900 т.п.о., по меньшей мере 950 т.п.о., по меньшей мере 1 Мб, по меньшей мере 1,5 Мб, по меньшей мере 2 Мб, по меньшей мере 2,5 Мб, по меньшей мере 3 Мб, по меньшей мере 4 Мб, по меньшей мере 5 Мб, по меньшей мере 10 Мб, по меньшей мере 20 Мб, по меньшей мере 30 Мб, по меньшей мере 40 Мб, по меньшей мере 50 Мб, по меньшей мере 60 Мб, по меньшей мере 70 Мб, по меньшей мере 80 Мб, по меньшей мере 90 Мб или по меньшей мере 100 Мб (например, большая часть хромосомы).
[000318] В конкретном примере, размер делеции может составлять между около 0,1 т.п.о. и около 1 Мб, между около 0,1 т.п.о. и около 900 т.п.о., между около 0,1 т.п.о. и около 400 т.п.о., между около 0,1 т.п.о. и около 200 т.п.о., между около 0,1 т.п.о. и около 100 т.п.о., или до около 1 Мб, до около 900 т.п.о., до около 400 т.п.о., до около 200 т.п.о. или до около 100 т.п.о. В конкретном примере, размер делеции может быть между около 0,1-200, 0,1-190, 0,1-180, 0,1-170, 0,1-160, 0,1-150, 0,1-140, 0,1-130, 0,1-120, 0,1-110, 0,1-100, 0,1-90, 0,1-80, 0,1-70, 0,1-60, 0,1-50, 0,1-40, 0,1-30, 0,1-20 0,1-10, 0,1-9, 0,1-8, 0,1-7, 0,1-6, 0,1-5, 0,1-4, 0,1-3, 0,1-2 или 0,1-1 т.п.о. Эффективность биаллельной делеции (разрушения) в целевых клеточных клонах, таких как целевые клоны эмбриональных стволовых клеток (то есть процент скринированных клонов с биаллельной делецией), может составлять между около 1-100%, 1-90%, 1-80%, 1-70%, 1-60%, 1-50%, 1-40%, 1-30%, или 1-27%, или могут составлять по меньшей мере около 1%, 2%, 3%, 4%, 5% 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20% или 25%. Например, в одном варианте осуществления размер делеции составляет около 50 т.п.о. или менее, а эффективность биаллельной делеции составляет между около 1-30% или 1-27%, или размер делеции составляет около 50 т.п.о. или выше (например, между около 50 т.п.о. до около 200 т.п.о.), а эффективность биаллельной делеции составляет около 1-5% или 1-3%. В экспериментах, в которых нацелены эмбрионы на одноклеточной стадии, эффективность биаллельной делеции (разрушение) у живых щенков, родившихся после введения CRISPR/Cas в эмбрионы на одноклеточной стадии (т.е. процент живых щенков с биаллельными делециями), может быть между около 1-100%, 1-90% или 1-85%, или по меньшей мере около 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80% или 85%. Например, в одном варианте осуществления размер делеции составляет около 50 т.п.о. или менее, а эффективность биаллельной делеции составляет между около 1-85% или 20-85%, или размер делеции составляет около 50 т.п.о. или выше (например, между около 50 т.п.о. до около 100 т.п.о.), а эффективность биаллельной делеции составляет около 1-20% или 1-15%.
[000319] В способах, в которых используется экзогенная матрица для репарации, например, вставка может быть между 5'- и 3'-последовательностью-мишенью. Такие вставки могут иметь любую длину. Например, вставленная нуклеиновая кислота может быть, например, от около 1 п.о. до около 5 п.о., от около 5 п.о. до около 10 п.о., от около 10 п.о. до около 50 п.о., от около 50 п.о. до около 100 п.о., от около 100 п.о. до около 200 п.о., от около 200 п.о. до около 300 п.о., от около 300 п.о. до около 400 п.о., от около 400 п.о. до около 500 п.о., от около 500 п.о. до около 1 т.п.о., от около 1 т.п.о. до около 5 т.п.о., от около 5 т.п.о. до около 10 т.п.о., от около 10 т.п.о. до около 20 т.п.о., от около 20 т.п.о. до около 40 т.п.о., от около 40 т.п.о. до около 60 т.п.о., от около 60 т.п.о. до около 80 т.п.о., от около 80 т.п.о. до около 100 т.п.о., от около 100 т.п.о. до около 150 т.п.о., или от около 150 т.п.о. до около 200 т.п.о., от около 200 т.п.о. до около 250 т.п.о., от около 250 т.п.о. до около 300 т.п.о., от около 300 т.п.о. до около 350 т.п.о., от около 350 т.п.о. до около 400 т.п.о., от около 400 т.п.о. до около 450 т.п.о., от около 450 т.п.о. до около 500 т.п.о. или более. Альтернативно, ставка может составлять по меньшей мере 1 п.о., по меньшей мере 5 п.о., по меньшей мере 10 п.о., по меньшей мере 50 п.о., по меньшей мере 100 п.о., по меньшей мере 200 п.о., по меньшей мере 300 п.о., по меньшей мере 400 п.о., по меньшей мере 500 п.о., по меньшей мере 1 т.п.о., по меньшей мере 5 т.п.о., по меньшей мере 10 т.п.о., по меньшей мере 20 т.п.о., по меньшей мере 30 т.п.о., по меньшей мере 40 т.п.о., по меньшей мере 60 т.п.о., по меньшей мере 80 т.п.о., по меньшей мере 100 т.п.о., по меньшей мере 150 т.п.о., по меньшей мере 200 т.п.о., по меньшей мере 250 т.п.о., по меньшей мере 300 т.п.о., по меньшей мере 350 т.п.о., по меньшей мере 400 т.п.о., по меньшей мере 450 т.п.о. или, по меньшей мере 500 т.п.о.
[000320] Нацеленная генетическая модификация может быть точной модификацией или неточной модификацией. Например, в способах, использующих экзогенную матрицу для репарации, делеция может быть точной делецией, в которой удаленная нуклеиновая кислота состоит только из последовательности нуклеиновой кислоты между 5'- и 3'-гомологическими плечами, так что нет никаких дополнительных вставок или делеций (инделей) в модифицированном геномном локусе-мишени. Аналогично, если используются спаренные гРНК, которые фланкируют весь кодирующий участок гена, кодирующего аутоантиген, делеция между первым и вторым сайтами расщепления белка Cas может быть точной делецией, в которой удаленная нуклеиновая кислота состоит только из последовательности нуклеиновой кислоты между первым и вторым сайтами расщепления белка Cas, так что в модифицированном геномном локусе-мишени нет дополнительных вставок или делеций (инделей). В способах, в которых используются как экзогенная матрица для репарации, так и спаренные гРНК, фланкирующие представляющий интерес участок, делеция может быть либо точной делецией, упомянутой выше. Альтернативно, делеция между первым и вторым сайтами расщепления белка Cas может быть неточной делецией, выходящей за пределы первого и второго сайтов расщепления белка Cas, что согласуется с неточной репарацией путем не гомологичного соединения концов (NHEJ), что приводит к дополнительным делециям и/или вставкам в модифицированном геномном локусе. Например, делеция может распространяться около на 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 100, 200, 300, 400 или 500 п.о. или более за пределы первого и второго сайтов расщепления белка Cas. Аналогично, модифицированный геномный локус может содержать дополнительные вставки, согласующиеся с неточной репарацией с помощью NHEJ, такие как вставки около 1, 2, 3, 4, 5, 10, 20, 30, 40, 50, 100, 200, 300, 400, или 500 п.о. или более. Использование экзогенных матриц для репарации (например, одноцепочечные олигодезоксинуклеотиды (ssODN) вместе с CRISPR/Cas9 могут увеличить шансы на точные модификации с помощью промотирования гомолог-направленной репарации, а не NHEJ.
[000321] Нацеленная модификация может содержать замещение последовательности в геномном локусе-мишени (например, весь или часть гена, кодирующего аутоантиген, такую как часть гена, кодирующего конкретный участок или мотив аутоантигена) с помощью соответствующей гомологичной или ортологичной последовательности. Делеция всего или части гена, кодирующего аутоантиген, и замещение соответствующей гомологичной или ортологичной последовательностью, которая не содержит эпитоп, который является общим между представляющим интерес чужеродным антигеном и аутоантигеном, может приводить к экспрессии гомолога или ортолога аутоантигена, который сохраняет функцию аутоантигена дикого типа, но не содержит эпитоп, который присутствует в представляющем интерес чужеродном антигене, и является общим с аутоантигеном дикого типа. Альтернативно или дополнительно нацеленная модификация может содержать одну или более точечных мутаций (например, 1, 2, 3, 4, 5 и более) в геномном локусе-мишени (например, весь или часть гена, кодирующего аутоантиген). Такие точечные мутации могут служить, например, для устранения экспрессии одного или более эпитопов в аутоантигене, которые разделяются с представляющим интерес чужеродным антигеном. Необязательно, такие точечные мутации могут приводить к консервативной аминокислотной замене (например, замене аспарагиновой кислоты [Asp, D] глутаминовой кислотой [Glu, Е]) в кодированном полипептиде. Такие замены аминокислот могут приводить к экспрессии аутоантигена, который сохраняет функцию аутоантигена дикого типа, но испытывает недостаток в эпитопе, который присутствует в представляющем интерес чужеродном антигене, и является общим с аутоантигеном дикого типа.
[000322] Способы, описанные в данном документе, способствуют и увеличивают частоту биаллельных и, в частности, гомозиготных модификаций. В частности, путем приведения в контакт клетки с первой и второй первой и второй направляющими РНК, которые нацелены на последовательности, распознаваемые первой и второй направляющими РНК в геномном локусе-мишени, эффективность продуцирования биаллельных модификаций может быть увеличена по сравнению с приведением в контакт клетки с одной только направляющей РНК. Эффективность продуцирования биаллельных модификаций также может быть увеличена путем приведения в контакт клетки с первой, второй и третьей направляющими РНК, которые нацелены на последовательности, распознаваемые направляющей РНК в геномном локусе-мишени, или первой, второй, третьей и четвертой направляющими РНК, которые нацелены на последовательности, распознаваемые направляющей РНК в геномном локусе-мишени. Кроме того, или альтернативно, эффективность продуцирования биаллельных модификаций и, в частности, гомозиготных модификаций может быть увеличена путем выбора геномного локуса-мишени, так что идентичность последовательности максимизируется между соответствующими первой и второй хромосомами в гомологичной паре хромосом во всей или части геномного локуса-мишени. Способы выбора таких геномных локусов-мишеней более подробно описаны в другом месте в данном документе.
[000323] Предпочтительно, нацеленная генетическая модификация представляет собой биаллельную модификацию. Биаллельные модификации включают события, в которых одна и та же модификация производится в одном и том же локусе на соответствующих гомологичных хромосомах (например, в диплоидной клетке), или в которых различные модификации производится в одном и том же локусе на соответствующих гомологичных хромосомах. Гомологичные хромосомы (т.е. гомологичная пара хромосом) включают хромосомы, которые имеют одни и те же гены в одних и тех же локусах, но, возможно, разные аллели (например, хромосомы, которые спарены во время мейоза). Термин аллель включает любую из одной или более альтернативных форм генетической последовательности. В диплоидной клетке или организме два аллеля данной последовательности обычно занимают соответствующие локусы на паре гомологичных хромосом.
[000324] Биаллельная модификация может приводить к гомозиготности для нацеленной генетической модификации. Гомозиготность включает ситуации, в которых оба аллеля геномного локуса-мишени (т.е. соответствующие аллели на обеих гомологичных хромосомах) имеют нацеленную генетическую модификацию. Например, биаллельная модификация может содержать, состоять по существу из, или состоять из гомозиготной делеции всего или части гена, кодирующего аутоантиген, или биаллельная модификация может содержать, состоять по существу из, или состоять из гомозиготного нарушения старт-кодона гена, кодирующего аутоантиген, так что старт-кодон больше не функционирует.
[000325] Альтернативно, биаллельная модификация может приводить к сложной гетерозиготности (например, гемизиготности) для целевой модификации. Сложная гетерозиготность включает ситуации, в которых оба аллеля локуса-мишени (то есть аллели на обеих гомологичных хромосомах) были модифицированы, но они были модифицированы разными путями (например, целевая модификация в одном аллеле и инактивация или нарушение другом аллеле). Например, в аллеле без нацеленной модификации, двухцепочечный разрыв, созданный белком Cas, может быть восстановлен путем репарации ДНК, опосредованной не гомологичного соединения концов (NHEJ), которая продуцирует мутантный аллель, содержащий вставку или делецию последовательности нуклеиновой кислоты и, следовательно, вызывает нарушение этого геномного локуса. Например, биаллельная модификация может приводить к сложной гетерозиготности, если клетка имеет один аллель с целевой модификацией и другой аллель, который не может быть экспрессирован. Сложная гетерозиготность включает гемизиготность. Гемизиготность включает ситуации, в которых присутствует только один аллель (то есть аллель на одной из двух гомологичных хромосом) локуса-мишени. Например, биаллельная модификация может привести к гемизиготности для целевой модификации, если целевая модификация происходит в одном аллеле с соответствующей потерей или делецией другого аллеля.
[000326] В конкретном примере, биаллельная модификация может содержать гомозиготную делецию между последовательностями, распознаваемыми первой и второй направляющими РНК, или сайтами расщепления Cas в паре первой и второй гомологичных хромосом. Альтернативно, биаллельная модификация может содержать биаллельную делецию между последовательностями, распознаваемыми первой и второй направляющими РНК, или сайтами расщепления Cas в паре первой и второй гомологичных хромосом (т.е. делеций в обеих хромосомах, но не обязательно одинаковые делеций в каждой). Делеций могут происходить одновременно, или делеция может происходить изначально в первой гомологичной хромосоме, тогда как гомозиготность затем достигается с помощью клетки с использованием первой гомологичной хромосомы в качестве донорной последовательности для репарации одного или более двухцепочечных разрывов во второй гомологичной хромосоме через гомологичную рекомбинацию, такую как конверсия генов.
[000327] В другом конкретном примере, биаллельная модификация может содержать гомозиготное разрушение участка старт-кодона гена-мишени в паре первой и второй гомологичных хромосом. Альтернативно, биаллельное разрушение участка старт-кодона гена-мишени в паре первой и второй гомологичных хромосом (т.е. нарушения в обеих хромосомах, но не обязательно одинаковые модификации в каждой). Модификации могут происходить одновременно, или модификация может происходить изначально в первой гомологичной хромосоме, тогда как гомозиготность затем достигается с помощью клетки с использованием первой гомологичной хромосомы в качестве донорной последовательности для репарации одного или более двухцепочечных разрывов во второй гомологичной хромосоме через гомологичную рекомбинацию, такую как конверсия генов.
[000328] Если используется донорная последовательность (например, экзогенная матрица для репарации), биаллельная модификация может содержать делецию между последовательностями, распознаваемыми первой и второй направляющими РНК, или сайтами расщепления Cas, а также введение вставки нуклеиновой кислоты между 5' и 3'-последовательностей-мишеней в паре первой и второй гомологичных хромосом, что приводит к гомозиготному модифицированному геному. Альтернативно, биаллельная модификация может содержать делецию между 5'- и 3'-последовательностей-мишеней, а также введение вставки нуклеиновой кислоты между 5'- и 3'-последовательностей-мишеней в паре первой и второй гомологичных хромосом, что приводит к гомозиготному модифицированному геному. Делеция и вставка могут происходить одновременно в обеих хромосомах, или делеция и вставка могут первоначально происходить в первой гомологичной хромосоме, тогда как гомозиготность затем достигается с помощью клетки с использованием первой гомологичной хромосомы в качестве донорной последовательности для репарации двухцепочечного разрыва(ов) во второй гомологичной хромосоме посредством гомологичной рекомбинации, такой как конверсия генов. Например, не желая быть связанными какой-либо конкретной теорией, введение вставки нуклеиновой кислоты может происходить в первой гомологичной хромосоме (с или без расщепления белком Cas), а вторая гомологичная хромосома может быть затем модифицирована путем события конверсии гена, которое стимулируется расщеплением белком Cas на второй гомологичной хромосоме.
[000329] В альтернативном варианте, если экзогенная матрица для репарации содержит 5' и 3' плечи гомологии без вставки нуклеиновой кислоты, биаллельная модификация может содержать делецию между 5'- и 3'-последовательностей-мишеней в паре первой и второй гомологичных хромосом, что приводит к гомозиготному модифицированному геному. Делеция может происходить одновременно в обеих хромосомах, или делеция может первоначально происходить в первой гомологичной хромосоме, тогда как гомозиготность затем достигается с помощью клетки с использованием первой гомологичной хромосомы в качестве донорной последовательности для репарации двухцепочечного разрыва(ов) во второй гомологичной хромосоме посредством гомологичной рекомбинации, такой как конверсия генов. Например, не желая быть связанными какой-либо конкретной теорией, делеция может происходить в первой гомологичной хромосоме (с или без расщепления белком Cas), а вторая гомологичная хромосома может быть затем модифицирована путем события конверсии гена, которое стимулируется расщеплением белком Cas на второй гомологичной хромосоме.
[000330] Делеция между последовательностями, распознаваемыми первой и второй направляющими РНК, или делеция между 5'- и 3'-последовательностей-мишеней может быть точной делецией, в которой удаленная нуклеиновая кислота состоит только из последовательности нуклеиновой кислоты между первым и вторым сайтами расщепления нуклеазы или только последовательности нуклеиновой кислоты между 5'- и 3'-последовательностей-мишеней, так что нет дополнительных делеции или вставок в модифицированном геномном локусе-мишени. Делеция между последовательностями, распознаваемыми первой и второй направляющими РНК, может также быть неточной делецией, выходящей за пределы первого и второго сайтов расщепления нуклеазы, что согласуется с неточной репарацией путем не гомологичного соединения концов (NHEJ), что приводит к дополнительным делециям и/или вставкам в модифицированном геномном локусе. Например, делеция может распространяться на около 1 п.о., около 2 п.о., около 3 п.о., около 4 п.о., около 5 п.о., около 10 п.о., около 20 п.о., около 30 п.о., около 40 п.о., около 50 п.о., около 100 п.о., около 200 п.о., около 300 п.о., около 400 п.о., около 500 п.о. и более за пределами первого и второго сайтов расщепления белка Cas. Аналогично, модифицированный геномный локус может содержать дополнительные вставки, совместимые с неточной репарацией NHEJ, такие как вставки около 1 п.о., около 2 п.о., около 3 п.о., около 4 п.о., около 5 п.о., около 10 п.о., около 20 п.о., около 30 п.о., около 40 п.о., около 50 п.о., около 100 п.о., около 200 п.о., около 300 п.о., около 400 п.о., около 500 п.о. или более.
[000331] Целевые вставки, созданные с использованием экзогенной матрицы для репарации, могут быть любого размера. Примеры вставок нуклеиновых кислот в экзогенных матрицах для репарации и примеры размеров вставок нуклеиновых кислот описаны в другом месте данного документа.
[000332] Гомозиготные нацеленные генетические модификации являются выгодными, поскольку процесс получения генетически модифицированных животных с этими модификациями (более подробно описаны ниже) может быть более эффективным и менее трудоемким. Во многих ситуациях, таких как удаление или разрушение гена для изучения эффекта его отсутствия, сама по себе гетерозиготность для нацеленной генетической модификации (т.е. модификация в одном аллеле и отсутствие изменений в другой аллеле) недостаточна. При обычных стратегиях нацеливания могут быть получены животные F0 поколения, которые являются гетерозиготными для большой целевой геномной делеции, но последующее скрещивание этих гетерозиготных животных необходимо для получения животных F1 поколения, которые гомозиготны по делеций. Эти дополнительные стадии скрещивания являются дорогостоящими и трудоемкими. Способность создавать F0 поколения генетически модифицированных животных, гомозиготных для нацеленной генетической модификации, приводит к значительному увеличению эффективности и экономии времени, поскольку требуется меньшее количество шагов разведения.
Н. Идентификация клеток с нацеленными генетическими модификациями
[000333] Способы, описанные в данном документе, могут дополнительно содержать идентификацию клетки, имеющей модифицированную нуклеиновую кислоту-мишень (например, модифицированный геном). Различные способы могут быть использованы для идентификации клеток, имеющих нацеленную генетическую модификацию, такую как делеция или вставка. Такие способы могут включать идентификацию одной клетки, имеющей нацеленную генетическую модификацию в геномном локусе-мишени. Скрининг может быть проведен для идентификации таких клеток с модифицированными геномными локусами.
[000334] Стадия скрининга может содержать количественный анализ для оценки модификации аллеля (МОА) (например, анализов потери аллеля (LOA) и/или усиления аллелей (GOA)) родительской хромосомы. Например, количественный анализ может проводиться с помощью количественной ПЦР, такой как ПЦР в реальном времени (qPCR). ПЦР в реальном времени может использовать первый набор праймеров, который распознает геномный локус-мишень, и второй набор праймеров, который распознает нецелевой эталонный локус. Набор праймеров может содержать флуоресцентный зонд, который распознает амплифицированную последовательность.
[000335] Чтобы идентифицировать гомозиготно разрушенные клоны ЭС-клеток, стратегии qPCR зонда TAQMAN® могут использоваться с большей эффективностью и точностью по сравнению с традиционными способами. Гомозиготно разрушенные аллели можно идентифицировать с помощью одной пластины qPCR из-за включения «среднего» анализа LOA (см., например, mTM-зонд на фиг.4) и отсутствие анализа GOA. Поскольку каждый анализ, используемый для скрининга клонов ЭС-клеток, является анализом LOA, количество копий могут быть рассчитано точно для каждого тестируемого участка, без использования какого-либо не-мышиного калибратора ДНК.
[000336] Стадия скрининга может также содержать анализ удерживания, который представляет собой анализ, используемый для различения правильных целевых вставок вставки нуклеиновой кислоты в геномный локус-мишень из случайных трансгенных вставок вставки нуклеиновой кислоты в геномные положения вне геномного локуса-мишени. Анализы удерживания также могут использоваться для различения правильных делеции и делеции, которые выходят за пределы участка, являющегося мишенью для делеции. Обычные анализы для скрининга целевых модификаций, такие как ПЦР на большие расстояния или вестерн-блоттинг, связывают вставленный вектор нацеливания с целевым локусом. Тем не менее, из-за больших размеров плеча гомологии, LTVEC не позволяют проводить скрининге помощью таких обычных анализов. Для скрининга нацеливания LTVEC можно использовать анализы на модификацию аллелей (МОА), включая анализы потери аллеля (LOA) и усиления аллелей (GOA) (см., например, US 2014/0178879 и Frendewey et al. (2010) Methods Enzymol. 476:295-307, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Анализ потери аллеля (LOA) инвертирует обычную логику скрининга и количественно определяет количество копий нативного локуса, которому была направлена мутация. В правильно нацеленном клеточном клоне, анализ LOA обнаруживает один из двух нативных аллелей (для генов, не входящих в X или Y-хромосому), а другой аллель нарушается нацеленной модификацией. Тот же принцип может применяться в обратном порядке как анализ усиления аллеля (GOA) для количественной оценки количества копий вставленного вектора нацеливания. Например, совместное использование анализов GOA и LOA выявит правильно нацеленный гетерозиготный клон как потерявший одну копию нативного гена-мишени и получивший одну копию гена устойчивости к лекарственным средствам или другого вставленного маркера.
[000337] В качестве примера, количественная полимеразная цепная реакция (кПЦР) может быть использована в качестве способа количественной оценки аллелей, но любой способ, который может достоверно различать разницу между нулевой, одной и двумя копиями гена-мишени или между нулевой, одной и двумя копиями вставки нуклеиновой кислоты могут быть использованы для разработки анализа МОА. Например, TAQMAN® можно использовать для количественного определения количества копий ДНК-матрицы в образце геномной ДНК, особенно по сравнению с эталонным геном (см., например, US 6596541, включенную в данный документ в качестве ссылки во всей своей полноте для всех целей). Эталонный ген количественно определяют в той же геномной ДНК, что и ген-мишень(и) или локус(ы). Поэтому выполняются две амплификации TAQMAN® (каждая с соответствующим зондом). Один зонд TAQMAN® определяет «Ct» (пороговый цикл) эталонного гена, тогда как другой зонд определяет Ct участок гена-мишени(ей) или локуса(ов), который заменяется успешным нацеливанием (т.е. анализ LOA). Ct представляет собой количество, которое отражает количество исходной ДНК для каждого из зондов TAQMAN®, то есть менее многочисленная последовательность требует большего количества циклов ПЦР для достижения порогового цикла. Уменьшение наполовину количества копий последовательности матрицы для реакции TAQMAN® приведет к увеличению около одной единицы Ct. Реакции TAQMAN® в клетках, где один аллель гена-мишени (генов-мишеней) или локуса(ов) был заменен с помощью гомологичной рекомбинации, приведет к увеличению одного Ct для целевой реакции TAQMAN® без увеличения в Ct для эталонного гена по сравнению с ДНК из нецелевых клеток. Для анализа GOA можно использовать другой зонд TAQMAN® для определения Ct вставки нуклеиновой кислоты, который заменяет целевой ген(ы) или локус(ы) путем успешного нацеливания.
[000338] Поскольку спаренные гРНК могут создавать крупные Cas-опосредуемые делеции в геномном локусе-мишени, это может быть полезно для усиления стандартных анализов LOA и GOA для проверки правильного нацеливания с помощью LTVEC (т.е. в клетках, отличных от эмбрионов на одноклеточной стадии). Например, только анализы LOA и GOA не могут отличить правильно нацеленные клеточные клоны от клонов, в которых большая Cas-индуцированная делеция геномного локуса-мишени совпадает со случайной интеграцией LTVEC в другом месте в геноме, особенно если в анализе GOA используется зонд против селекционной кассеты внутри вставки LTVEC. Поскольку давление отбора в целевой клетке основано на селекционной кассете, случайная трансгенная интеграция LTVEC в другом месте в геноме будет включать в себя селекционную кассету и смежные участки LTVEC, но исключает более дистальные участки LTVEC. Например, если часть LTVEC случайным образом интегрирована в геном, a LTVEC содержит вставку нуклеиновой кислоты длиной около 5 т.п.о. или более с селекционной кассетой, смежной с плечом 3'-гомологии, обычно плечом 3'-гомологии, но не плечом 5'-гомологии, будет трансгенно интегрирована с селекционной кассетой. В качестве альтернативы, если селекционная кассета, смежная с 5'-плечом гомологии, обычно 5'-плечом гомологии, но не 3'-плечом гомологии, будет трансгенно интегрирована с селекционной кассетой. В качестве примера, если анализы LOA и GOA используются для оценки целевой интеграции LTVEC, и в анализе GOA используются зонды против селекционной кассеты, гетерозиготная делеция в геномном локусе-мишени в сочетании со случайной трансгенной интеграцией LTVEC даст такое же считывание, как гетерозиготная целевая интеграция LTVEC в геномном локусе-мишени. Чтобы проверить правильность нацеливания с помощью LTVEC, анализы удерживания можно использовать отдельно или в сочетании с анализами LOA и/или GOA.
[000339] Анализы удерживания определяют количество копий матрицы ДНК в 5'- последовательности-мишени (соответствующей 5'-плечу гомологии LTVEC) и/или 3'- последовательности-мишени (соответствующей 3'-плечу гомологии LTVEC). В частности, полезно определить число копий матрицы ДНК в последовательности-мишени, соответствующее плечу гомологии, которое находится рядом с селекционной кассетой. В диплоидных клетках, количество копий, большее чем два, обычно указывает на трансгенную интеграцию LTVEC случайным образом вне геномного локуса-мишени, а не в геномном локусе-мишени, что нежелательно. Правильно нацеленные клоны будут сохранять количество копий два. Кроме того, количество копий менее чем две в таких тестах на удерживание обычно указывает на крупные Cas-опосредованные делеции, выходящие за пределы участка, нацеленного на делецию, что также нежелательно.
[000340] В иллюстративном анализе удерживания для идентификации целевого введения вставки нуклеиновой кислоты в геномном локусе-мишени в диплоидной клетке, ДНК сначала получают из клетки, имеющей геном, который был приведен в контакт с большим направленным вектором (LTVEC), содержащим вставку нуклеиновый кислоты, фланкированную первым плечом гомологии, которое гибридизуется с первой последовательностью-мишенью, и вторым плечом гомологии, которое гибридизуется со второй последовательностью-мишенью, причем вставка нуклеиновой кислоты содержит селекционную кассету, смежную с первым плечом гомологичным. Необязательно, селекционная кассета может содержать ген устойчивости к лекарственным средствам. Затем ДНК подвергают воздействию зонда, который связывается в первой последовательностью-мишенью, зонда, который связывается внутри вставки нуклеиновой кислоты, и зонда, который связывается в эталонном гене, имеющем известное количество копий, причем каждый зонд генерирует детектируемый сигнал при связывании. Затем регистрируются сигналы от связывания каждого из зондов. Сигнал от эталонного зонда гена сравнивают с сигналом от первого зонда последовательности-мишени, чтобы определить количество копий для первой последовательности-мишени, а сигнал от эталонного зонда гена сравнивают с сигналом от зонда вставки нуклеиновой кислоты, чтобы определить количество копий для вставки нуклеиновой кислоты. Количество копий вставки нуклеиновой кислоты одна или две и количество копий первой последовательности-мишени две обычно указывает на целевое введение вставки нуклеиновой кислоты в геномном локусе-мишени, а количество копий вставки нуклеиновой кислоты одна или более и количество копий первой последовательности-мишени три или более обычно указывает на случайное введение вставки нуклеиновой кислоты в геномном локусе, отличном от геномного локуса-мишени.
[000341] Сигнал от связывания зонда первой последовательности-мишени может использоваться для определения значения порогового цикла (Ct) для первой последовательности-мишени, сигнал от связывания эталонного зонда гена может использоваться для определения значения порогового цикла (Ct) для эталонного гена, а количество копий первой последовательности-мишени может быть определено путем сравнения значения Ct первой последовательности-мишени и значения Ct эталонного гена. Аналогично, сигнал от связывания зонда вставки нуклеиновой кислоты может быть использован для определения значения порогового цикла (Ct) для вставки нуклеиновой кислоты, а количество копий вставки нуклеиновой кислоты может быть определено путем сравнения значения Ct первой последовательности-мишени и значения Ct эталонного гена.
[000342] Вставка нуклеиновой кислоты в LTVEC может быть, например, по меньшей мере 5, 10, 20, 30, 40, 50, 60, 70, 80, 90,100,150, 200, 250, 300, 350, 400, 450 или 500 т.п.о. Расстояние между последовательностями, с которыми связываются зонды в первой последовательности-мишени и селекционной кассете, может быть, например, не более 100 нуклеотидов, 200 нуклеотидов, 300 нуклеотидов, 400 нуклеотидов, 500 нуклеотидов, 600 нуклеотидов, 700 нуклеотидов, 800 нуклеотидов, 900 нуклеотидов, 1 т.п.о., 1,5 т.п.о., 2 т.п.о., 2,5 т.п.о., 3 т.п.о., 3,5 т.п.о., 4 т.п.о., 4,5 т.п.о. или 5 т.п.о.
[000343] Такие способы могут дополнительно содержать дополнительные анализы удерживания для определения количества копий второй последовательности-мишени. Например, такие способы могут дополнительно включать в себя воздействие на ДНК клетки зонда, который связывает вторую последовательность-мишень, обнаруживая сигнал от связывания зонда второй последовательности-мишени, и сравнивая сигнал от эталонного зонда гена с сигналом от зонда второй последовательности-мишени, чтобы определить количество копии для второй последовательности-мишени.
[000344] Подобным образом, такие способы могут дополнительно включать дополнительные анализы GOA для определения количества копий одной или более дополнительных последовательностей внутри вставки нуклеиновой кислоты. Например, такие способы могут дополнительно включать в себя воздействие на ДНК клетки одного или более дополнительных зондов, которые связывают вставку нуклеиновой кислоты, обнаруживая сигнал от связывания одного или более дополнительных зондов, и сравнивают сигнал от эталонного зонда гена с сигналом от одного или более дополнительных зондов вставки нуклеиновой кислоты для определения количества копий для одной или более дополнительных последовательностей внутри вставки нуклеиновой кислоты.
[000345] Аналогично, когда LTVEC предназначен для удаления эндогенной последовательности из геномного локуса-мишени или при использовании парных гРНК (например, для создания парных двухцепочечных разрывов на разных сайтах в пределах одного геномного целевого локуса и удаления промежуточной эндогенной последовательности) такие способы могут дополнительно включать анализ LOA для определения количества копий эндогенных последовательностей в геномном локусе-мишени. Например, такие способы могут дополнительно включать воздействие на ДНК клетки зонда, который связывает эндогенную последовательность в геномном локусе-мишени, обнаруживая сигнал от связывания зонда эндогенной последовательности, и сравнивая сигнал от эталонного зонда гена с сигналом от зонда эндогенной последовательности, чтобы определить количество копий для эндогенной последовательности.
[000346] Анализы удерживания также могут быть использованы в экспериментах, в которых используются спаренные гРНК, но не обязательно используется экзогенная матрица для репарации. Поскольку спаренные гРНК могут создавать крупные Cas-опосредуемые делеции в геномном локусе-мишени, это может быть полезно для усиления стандартных анализов LOA, для проверки правильного нацеливания делеций с помощью спаренных гРНК, в отличие от делеций, выходящих за пределы участка, нацеленного на делецию из-за инделей после репарации NHEJ.
[000347] Анализы удерживания определяют количество копий матрицы ДНК в участке, содержащем и/или вверх по ходу транскрипции последовательности, распознаваемой первой направляющей РНК (то есть 5' последовательность, распознаваемая направляющей РНК), и/или участке, содержащем и/или вниз по ходу транскрипции и рядом с последовательностью, распознаваемой второй направляющей РНК (т.е. 3' последовательность, распознаваемая направляющей РНК). В диплоидных клетках количество копий менее чем одна указывает на большие NHEJ-опосредованные делеции, простирающиеся за участок, нацеленный на делецию, что нежелательно. Правильно нацеленные клоны будут сохранять количество копий два. Зонд для определения количества копий может быть, например, в пределах около 100 нуклеотидов, 200 нуклеотидов, 300 нуклеотидов, 400 нуклеотидов, 500 нуклеотидов, 600 нуклеотидов, 700 нуклеотидов, 800 нуклеотидов, 900 нуклеотидов, 1 т.п.о., 1,5 т.п.о., 2 т.п.о., 2,5 т.п.о., 3 т.п.о., 3,5 т.п.о., 4 т.п.о., 4,5 т.п.о. или 5 т.п.о. последовательности, распознаваемой направляющей РНК.
[000348] Другие примеры подходящих количественных анализов включают в себя флуоресцентную опосредованную гибридизацию in situ (FISH), сравнительную геномную гибридизацию, изотермическую амплификацию ДНК, количественную гибридизацию с иммобилизованным зондом(ами), зондами INVADER®, зондами молекулярного маяка TAQMAN®, или зондовой технологией ECLIPSE™ (см., например, US 2005/0144655, включенный в данном документе в качестве ссылки в полном объеме для всех целей).Также можно использовать обычные анализы для скрининга целевых модификаций, такие как ПЦР на большие расстояния, вестерн-блоттинг или сиквенирование Сэнгера. Такие анализы обычно используются для получения доказательств о связи между вставленным вектором нацеливания и геномным локусом-мишенью. Например, для ПЦР-анализа длинных фрагментов один праймер может распознавать последовательность внутри вставленной ДНК, в то время как другой распознает последовательность геномного локуса-мишени за пределами концов плеча гомологии вектора нацеливания.
[000349] Сиквенирование следующего поколения (NGS) также может быть использовано для скрининга, особенно в эмбрионах на одноклеточной стадии, которые были модифицированы. Сиквенирование следующего поколения также может упоминаться как «NGS» или «массовое параллельное сиквенирование» или «высокопроизводительное сиквенирование». Такие NGS могут использоваться в качестве инструмента для скрининга в дополнение к анализу МОА и анализу удерживания для определения точной природы нацеленной генетической модификации и обнаружения мозаицизма. Мозаицизм относится к наличию двух или более популяций клеток с разными генотипами у одного индивидуума, который развился из одного оплодотворенного яйца (т.е. зиготы). В способах, описанных в данных документах, нет необходимости скринировать целевые клоны с использованием маркеров для селекции. Например, анализы МОА и NGS, описанные в данных документах, могут использоваться без использования селекционных кассет.
[000350] Целевые клетки также могут быть скринированы на предмет уменьшения или элиминации экспрессии аутоантигена, гомологичного с или обладающего представляющий интерес эпитопом с представляющим интерес чужеродным антигеном. Например, если аутоантигеном является белок, экспрессия может быть оценена с помощью любых известных методов анализа экспрессии белка, включая, например, Вестерн-блот анализ или иммуноокрашивание белка.
III. Способы получения генетически модифицированных отличных от человека животных
[000351] Генетически модифицированные отличные от человека животные, могут быть получены с использованием различных способов, описанных в данном документе. Любой удобный способ или протокол для получения генетически модифицированного организма, включая способы, описанные в данном документ, подходит для получения такого генетически модифицированного отличного от человека животного. Такие способы, начинающиеся с генетической модификации плюрипотентной клетки, такой как эмбриональная стволовая клетка (ЭС), обычно включают: (1) модификация генома плюрипотентной клетки, которая не является эмбрионом на одноклеточной стадии, с использованием способов, описанных в данном документе; (2) определение или выбор генетически модифицированной плюрипотентной клетки; (3) введение генетически модифицированной плюрипотентной клетки в эмбрион-хозяин; и (4) имплантация и гестация эмбриона-хозяина, содержащего генетически модифицированную плюрипотентную клетку, у суррогатной матери. Суррогатная мать может затем производить F0 поколение отличных от человека животных, содержащих нацеленную генетическую модификацию и способную передавать нацеленную генетическую модификацию через зародышевую линию. Животные, несущие генетически модифицированный геномный локус, могут быть идентифицированы с помощью анализа модификации аллеля (МОА), как описано в данном документе. Донорную клетку можно вводить в эмбрион-хозяин на любой стадии, такой как стадия бластоцисты или стадия пред-морулы (т.е. 4-клеточная стадия или 8-клеточная стадия). Производится потомство, которое способно передавать генетическую модификацию через зародышевую линию. Плюрипотентной клеткой может быть, например, ЭС-клетка (например, ЭС-клетка грызуна, ЭС-клетка мыши или ЭС-клетка крысы), как обсуждается в другом месте данного документа. См., например, патент США №7294754, включенный в данный документ в качестве ссылки во всей своей полноте для всех целей.
[000352] Альтернативно, такие способы, начинающиеся с генетической модификации эмбриона на одноклеточной стадии, обычно включают: (1) модификацию генома плюрипотентной клетки, которая не является эмбрионом на одноклеточной стадии, с использованием способов, описанных в данном документе; (2) определение или выбор генетически модифицированного эмбриона; и (3) имплантацию и гестацию генетически модифицированного эмбриона у суррогатной матери. Суррогатная мать может затем производить F0 поколение отличных от человека животных, содержащих нацеленную генетическую модификацию и способную передавать нацеленную генетическую модификацию через зародышевую линию. Животные, несущие генетически модифицированный геномный локус, могут быть идентифицированы с помощью анализа модификации аллеля (МОА), как описано в данном документе.
[000353] Методы переноса ядра также могут быть использованы для генерации отличных от человека животных. Вкратце, способы ядерного переноса могут включать в себя следующие этапы: (1) энуклеация ооцита или обеспечение энуклеированного ооцита; (2) выделение или обеспечение донорной клетки или ядра, которые должны быть объединены с энуклеированным ооцитом; (3) вставка клетки или ядра в энуклеированный ооцит с образованием восстановленной клетки; (4) имплантация восстановленной клетки в матку отличного от человека животного с образованием эмбриона; и (5) развитие эмбриона. В таких способах ооциты обычно извлекают из умерших животных, хотя они могут быть выделены также из яйцеводов и/или яичников живых животных. Ооциты могут созревать в различных средах, известных специалистам в данной области, до энуклеации. Энуклеация ооцита может быть осуществлена с помощью нескольких способов, хорошо известных специалистам в данной области. Внесение донорной клетки или ядра в энуклеированный ооцит с образованием восстановленной клетки может быть проведено путем микроинъекции донорной клетки под внеклеточной оболочкой ооцита перед слиянием. Слияние может быть вызвано применением электрического импульса постоянного тока через плоскость контакта/слияния (электрослияние), путем воздействия на клетки химикатов, способствующих слиянию, таких как полиэтиленгликоль, или с помощью инактивированного вируса, такого как вирус Сендай. Восстановленную клетку можно активировать электрическими и/или неэлектрическими средствами до, во время и/или после слияния ядра донора и ооцита реципиента. Способы активации включают электрические импульсы, химически индуцированный шок, проникновение с помощью спермы, увеличение уровней двухвалентных катионов в ооците, и снижение фосфорилирования клеточных белков (как в виде ингибиторов киназы) в ооците. Активированные восстановленные клетки или эмбрионы можно культивировать в среде, хорошо известной специалистам в данной области техники, а затем переносить в матку животного. См., например, US 2008/0092249, WO 1999/005266, US 2004/0177390, WO 2008/017234 и патент US №7612250, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000354] Различные способы, предлагаемые в данном документе, позволяют генерировать генетически модифицированное отличное от человека F0 животное, в котором клетки генетически модифицированного F0 животного, которые содержат нацеленную генетическую модификацию. Признано, что в зависимости от способа, используемого для генерации F0 животного, количество клеток в пределах F0 животного, которые имеют нацеленную генетическую модификацию, будет варьироваться. Введение донорных ЭС-клеток в эмбрион на стадии пред-морулы из соответствующего организма (например, эмбрион мыши на 8-клеточной стадии) с помощью, например, способа VELOCIMOUSE® позволяет получить больший процент клеточной популяции F0 животных, чтобы содержать клетки, имеющие нацеленную генетическую модификацию. Например, по меньшей мере 50%, 60%, 65%, 70%, 75%, 85%, 86%, 87%, 87%, 88%, 89%, 90%, 91%, 92%, 93% 94%, 95%, 96%, 97%, 98%, 99% или 100% клеточного вклада отличного от человека F0 животного может содержать популяцию клеток, имеющую нацеленную генетическую модификацию. Кроме того, по меньшей мере одна или более зародышевых клеток F0 животного могут иметь нацеленную генетическую модификацию.
А. Типы отличных от человека животных и клеток
[000355] Приведенные в данном документе способы используют отличных от человека животных и клетки, и эмбрионы от отличных от человека животных. Такие отличные от человека животные предпочтительно представляют собой млекопитающих, таких как грызуны (например, крысы, мыши и хомяки). Другие отличные от человека млекопитающие включают, например, людей, отличных от человека приматов, обезьян, приматов, кошек, собак, кроликов, лошадей, быков, оленей, бизонов, скот (например, виды крупного рогатого скота, таких как коровы, волы и т.д.; виды овец, такие как овцы, козы и т.д., а также виды свиней, такие как свиньи и кабаны). Термин «отличный от человека» исключает людей. В некоторых способах, представленных в данном документе, отличные от человека животные и клетки, и эмбрионы от отличных от человека животных являются гибридными.
[000356] Клетка отличного от человека животного, используемая в предлагаемых в данном документе способах, может представлять собой, например, тотипотентную клетку или плюрипотентную клетку (например, эмбриональную стволовую (ЭС) клетку, такую как ЭС-клетка грызуна, ЭС-клетка мыши, или ЭС-клетка крысы)). Тотипотентные клетки включают недифференцированные клетки, которые могут приводить к возникновению любого типа клеток, а плюрипотентные клетки включают недифференцированные клетки, которые обладают способностью развиваться в более чем один дифференцированные типы клеток. Такими плюрипотентными и/или тотипотентными клетками могут быть, например, ЭС-клетки или ЭС-подобные клетки, такие как индуцированные плюрипотентные стволовые клетки (iPS). ЭС-клетки включают в себя эмбрион-полученные тотипотентные или плюрипотентные клетки, которые способны вносить вклад в любую ткань развивающегося эмбриона после введения в эмбрион. ЭС-клетки могут быть получены из внутренней клеточной массы бластоцисты и способны дифференцироваться в клетки любого из трех зародышевых слоев позвоночных (энтодерма, эктодерма и мезодерма).
[000357] Клетки отличного от человека животного, используемые в предлагаемых в данном документе способах, также могут включать эмбрионы на одноклеточной стадии (т.е. оплодотворенные ооциты или зиготы). Эмбрионы на одноклеточной стадии представляют собой эукариотические клетки, образованные событием оплодотворения между двумя гаметами. Такие эмбрионы на одноклеточной стадии могут быть из любого генетического фона (например, BALB/c, C57BL/6, 129 или их комбинации), могут быть свежими или замороженными и могут быть получены из естественного скрещивания или оплодотворения in vitro.
[000358] Мыши и мышиные клетки, используемые в способах, представленных в данном документе, могут быть, например, из линии 129, линии C57BL/6, линии BALB/c, линии Swiss Webster, смеси линий 129 и C57BL/6, смеси линий BALB/c и C57BL/6, смеси линий 129 и BALB/c, и смеси линий BALB/c, C57BL/6 и 129. Например, мышь или мышиная клетка, используемая в предлагаемых в данном документе способах, может быть по меньшей мере частично из линии BALB/c (например, по меньшей мере около 25%, по меньшей мере около 50%, по меньшей мере около 75% полученного из линии BALB/c, или около 25%, около 50%, около 75% или около 100% полученного из линии BALB/c). В одном примере мыши или мышиные клетки могут иметь линию, содержащую 50% BALB/c, 25% C57BL/6 и 25% 129. Альтернативно, мыши или мышиные клетки могут содержать линию или комбинацию линий, которая исключает BALB/c. У таких мышей фон BALB/c не требуется для получения достаточного репертуара антигенсвязывающих белков против представляющего интерес чужеродного антигена.
[000359] Примеры линий 129 включают 129Р1, 129Р2, 129Р3, 129X1, 129S1 (например, 129S1/SV, 129S1/Svlm), 129S2, 129S4, 129S5, 129S9/SvEvH, 129S6 (129/SvEvTac), 129S7, 129S8, 129Т1 и 129Т2. См., например, Festing et al. (1999) Mammalian Genome 10(8):836, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Примеры линий C57BL включают C57BL/A, C57BL/An, C57BL/GrFa, C57BL/Kal_wN, C57BL/6, C57BL/6J, C57BL/6ByJ, C57BL/6NJ, C57BL/10, C57BL/10ScSn, C57BL/10Cr и C57BL/Ola. Мыши и мышиные клетки, используемые в предлагаемых в данном документе способах, также могут быть из смеси вышеупомянутой линии 129 и вышеупомянутой линии C57BL/6 (например, 50% 129 и 50% C57BL/6). Аналогично, мыши и мышиные клетки, используемые в предлагаемых в данном документе способах, могут быть из смеси вышеупомянутых линий 129 или смеси вышеупомянутых линий BL/6 (например, линии 129S6 (129/SvEvTac)). Конкретным примером ЭС-клеток мыши является ЭС-клеткой мыши VGF1. ЭС-клетки мыши VGF1 (также известные как F1H4) были получены из гибридных эмбрионов, полученных путем скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac. См., например, Auerbach et al. (2000) Biotechniques 29, 1024-1028, включенный в данный документ в качестве ссылки во всей полноте для всех целей.
[000360] Мыши и мышиные клетки, используемые в предлагаемых в данном документе способах, могут также иметь любую комбинацию гаплотипов МНС. Функция молекул МНС заключается в связывании чужеродных пептидных фрагментов и их дисплея на клеточной поверхности для распознавания соответствующими Т-клетками. Например, мыши и мышиные клетки могут содержать гаплотип MHCb (например, C57BL/6), гаплотип MHCd (например, BALB/c) или могут содержать как MHCb, так и MHCd (например, комбинацию C57BL/6 и BALB/c). Такие комбинации МНС могут приводить к увеличению титра антител.
[000361] Крысы или крысиные клетки, используемые в предлагаемых в данном документе способах, могут быть от любой линии крысы, включая, например, линию крысы ACI, линию крысы Dark Agouti (DA), линию крысы Wistar, линию крысы LEA, линию крысы Sprague Dawley (SD) или линию крысы Fischer, такую как Fisher F344 или Fisher F6. Крысы или крысиные клетки также могут быть получены из линии, полученной из смеси двух или более линий, указанных выше. Например, крысы или крысиные клетки могут быть из линии DA или линии ACI. Линия крысы ACI характеризуется наличием черного агути с белым животом и ногами и гаплотипом RT1av1. Такие линии доступны из различных источников, включая Harlan Laboratories. Примером линии ЭС-клеток крысы от крысы ACI является ЭС-клетка крысы ACI.G1. Линия крысы Dark Agouti (DA) характеризуется наличием агути шерсти и гаплотипа RT1av1. Такие крысы доступны из различных источников, включая Charles River и Harlan Laboratories. Примерами линий ЭС-клеток крысы от крысы DA является линия ЭС-клеток крысы DA.2B и линия ЭС-клеток крысы DA.2C. В некоторых случаях, крысы или крысиные клетки относятся к инбредной линии крысы. См., например, US 2014/0235933 A1, включенную в данном документе в качестве ссылки в полном объеме для всех целей. В других случаях, крысы или крысиные клетки относятся к гибридной линии крысы.
[000362] Клетки, которые были имплантированы в эмбрион-хозяин, можно назвать «донорскими клетками». Донорская клетка может быть от той же линии, что и эмбрион-хозяин, или от другой линии. Аналогично, суррогатная мать может быть от той же линии, что и донорная клетка и/или эмбрион-хозяин, или суррогатная мать может быть от другой линии в качестве донорской клетки и/или эмбриона-хозяина.
[000363] В описанных в данном документе способах и композициях можно использовать множество эмбрионов-хозяев. Например, донорскую клетку (например, донорскую ЭС-клетку) можно вводить в эмбрион на стадии пред-морулы (например, эмбрион на стадии 8 клеток) из соответствующего организма. См., например, US 7576259; US 7659442; US 7294754; и US 2008/0078000, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. В других способах, донорские клетки могут быть имплантированы в эмбрион-хозяин на 2-клеточной стадии, 4-клеточной стадии, 8-клеточной стадии, 16-клеточной стадии, 32-клеточной стадии или 64-клеточной стадии. Эмбрион-хозяин также может быть бластоцистой или может быть эмбрионом до бластоцисты, эмбрионом на стадии пред-морулы, эмбрионом на стадии морулы, неплотным эмбрионом на стадии морулы или плотным эмбрионом на стадии морулы. При использовании эмбриона мыши, стадией эмбриона-хозяина может быть этап Тейлера 1 (TS1), TS2, TS3, TS4, TS5 и TS6 со ссылкой на этапы Тейлера, описанные в Theiler (1989) «The House Mouse: Atlas of Mouse Development," Springer-Verlag, Нью-Йорк, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Например, этап Тейлера может быть выбран из TS1, TS2, TS3 и TS4. В некоторых способах эмбрион-хозяин включают внеклеточную оболочку ооцита, а донорская клетка представляет собой ЭС-клетку, которая вводится в эмбрион-хозяин через отверстие во внеклеточной оболочке ооцита. В других способах, эмбрион-хозяин является зона-менее эмбриона. В других способах эмбрион-хозяин на стадии морулы агрегируется.
В. Отличные от человека животные для образования антигенсвязывающих белков
[000364] Отличное от человека животное, используемое в предлагаемых в данном документе способах, может быть любым отличным от человека животным, способным продуцировать антигенсвязывающие белки, таким как млекопитающее, грызун, крыса или мышь. Например, можно использовать отличное от человека животное (например, грызуна, такого как крыса или мышь), генетически модифицированное для оптимизации производства антител. Такие отличные от человека животные могут быть отличными от человека животными, сконструированными для облегчения крупномасштабного производства антител, которые могут быть использованы в качестве терапевтических средств для человека, включая отличных от человека животных, которые содержат гуманизированный локус иммуноглобулина. Например, отличное от человека животное (например, грызун, такой как крыса или мышь), может содержать одну или более из следующих модификаций в своей зародышевой линии: локус вариабельного участка тяжелой цепи отличного от человека животного (например, грызуна, такого как крыса или мышь) заменен полностью или частично на вариабельный локус гена тяжелой цепи человека; вариабельный участок локуса легкой цепи каппа отличного от человека животного (например, грызуна, такого как крыса или мышь) полностью или частично заменяется локусом вариабельного участка легкой цепи каппа человека; вариабельный участок локуса легкой цепи лямбда отличного от человека животного (например, грызуна, такого как крыса или мышь) полностью или частично заменяется локусом вариабельного участка легкой цепи лямбда человека; и локусы вариабельного участка тяжелой и легкой цепей заменены полностью своими человеческими гомологами или ортологами. Отличное от человека животное (например, грызун, такой как крыса или мышь) также может содержать одну или более следующих модификаций в своей зародышевой линии: полностью человеческие локусы вариабельного участка тяжелой и легкой цепей, функционально связанные с константным участком последовательности нуклеиновой кислоты отличного от человека животного (например, грызуна, такого как крыса или мышь), так что отличное от человека животное (например, грызун, такой как крыса или мышь), продуцирует В-клетку или антитело, содержащее вариабельный домен человека, слитый с константным доменом отличного от человека животного (например, грызуна, такого как крыса или мышь); или вариабельный участок тяжелой и/или легкой цепи человека, функционально связанный с константным участком последовательности нуклеиновой кислоты отличного от человека животного (например, грызун, такой как крыса или мышь), так что отличное от человека животное (например, грызун, такой как крыса или мышь) продуцирует В-клетку или антитело, содержащее вариабельный домен человека, слитый с константным участком отличного от человека животного (например, грызуна, такого как крыса или мышь). В качестве примера можно использовать мышей VELOCIMMUNE®. См., например, US 6596541, US 8791323, US 8895802, US 8895801, US 7105348, US 2002/0106629, US 2007/0061900, US 2011/0258710, US 2011/0283376, US 2013/0210137, US 2014/0017781, US 2014/0020124, US 2014/0020125, US 2014/0017782, US 2014/0018522, US 2014/0033337, US 2014/0033336, US 2014/0041068, US 2014/0073010, US 2014/0023637, US 2014/0017238, US 2014/0013457, US 2014/0017229, US 2002/0183275, US 8 502 018, US 2012/0322108, US 2013/0254911, US 2014/0213773, US 2015/0201589, US 2015/0210776, US 2014/0017228, US 8642835, US 8697940, и Murphy et al. (2014) Proc. Natl. Acad. Sci. U.S.A. 111(14):5153-5158, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Мыши VELOCIMMUNE® содержат точную крупномасштабную замену вариабельных участков зародышевой линии, которые кодируют тяжелую цепь иммуноглобулина мыши (IgH) и легкую цепь иммуноглобулина (например, легкую цепь κ, Igκ), с соответствующими вариабельными участками иммуноглобулина человека в эндогенных локусах. Эта точная замена приводит к мыши с гибридными локусами иммуноглобулина, которые образуют тяжелые и легкие цепи, которые имеют вариабельные участки человека и константный участок мыши. Точная замена сегментов VH-DH-JH и Vκ-Jκ мыши оставляет фланкирующие последовательностей мыши интактными и функциональными в гибридных локусах иммуноглобулина. Гуморальная иммунная система мыши функционирует так же, как у мыши дикого типа. Развитие В-клеток беспрепятственно в любом значительном отношении, и богатое разнообразие вариабельных участков человека генерируется у мыши на антигенную стимуляцию.
[000365] Отличные от человека животные (например, грызуны, такие как крысы или мыши), описанные выше (например, мыши VELOCIMMUNE®), могут также содержать в своей зародышевой линии функциональную эктопическую последовательность нуклеиновой кислоты, которая кодирует ADAM6 ген или гомолог, или ортолог или его функциональный фрагмент у отличного от человека животного (например, грызуна, такого как крыса или мышь). Например, такое отличное от человек животное (например, грызун, такой как крыса или мышь), может не иметь функционального эндогенного гена ADAM6 и содержать функциональную эктопическую последовательность нуклеиновой кислоты, чтобы дополнить потерю функции ADAM6 отличного от человека животного (например, грызуна, такого как крыса или мышь). Например, функциональная эктопическая последовательность может содержать один или более генов Adam6, таких как ген Adam6a мыши, ген Adam6b мыши или оба гена Adam6a и Adam6b. Эктопическая последовательность нуклеиновой кислоты может присутствовать в локусе вариабельного участка тяжелой цепи человека или в другом месте. См., например, US 2012/0322108; US 2013/0254911; US 2014/0213773; US 2015/0201589; US 2015/0210776; US 2014/0017228; и US 2013/0198879, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000366] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличных от человека животных (например, грызунов, таких как крысы или мыши), генетически модифицированных для экспрессии ограниченного репертуара вариабельных доменов легкой цепи человека, или одного вариабельного домена легкой цепи человека, из ограниченного репертуара генных сегментов вариабельного участка легкой цепи человека. Такие отличные от человека животные генерируют «универсальные легкие цепи» или «обычные легкие цепи» и могут быть полезны при создании биспецифических антител. См., например, US 2011/0195454; US 2012/0021409; US 2012/0192300; US 2015/0059009; US 2013/0045492; US 2013/0198880; US 2013/0185821; US 2013/0302836; US 2013/0247234; US 2014/0329711; и US 2013/0198879, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Например, отличное от человека животное (например, грызун, такой как крыса или мышь), может быть генетически модифицировано, чтобы включать в себя один неперестроенный генный сегмент вариабельного участка легкой цепи человека (или два генных сегмента вариабельного участка легкой цепи человека), который перестраивают для образования перестроенного гена вариабельного участка легкой цепи человека (или два перестроенных гена вариабельного участка легкой цепи), которые экспрессируют одну легкую цепь (или экспрессируют одну или обе из двух легких цепей). Перестроенные вариабельные домены легкой цепи человека способны спариваться с множеством аффинно-созревших тяжелых цепей человека, выбранных с помощью отличных от человека животных (например, грызунов, таких как крысы или мыши), причем вариабельные участки тяжелой цепи специфически связывают различные эпитопы.
[000367] Для достижения ограниченного репертуара вариантов легкой цепи отличное от человека животное (например, грызун, такой как крыса или мышь), может быть сконструировано таким образом, чтобы сделать нефункциональным или по существу нефункциональным его способность производить, или перестраивать нативный вариабельный домен легкой цепи отличного от человека животного (например, грызуна, такого как крыса или мышь). Это может быть достигнуто, например, путем удаления генных сегментов вариабельного участка легкой цепи отличного от человека животного (например, грызуна, такого как крыса или мышь). Затем эндогенный локус отличного от человека животного (например, грызуна, такого как крыса или мышь) может быть модифицирован экзогенным подходящим генным сегментом вариабельного участка легкой цепи человека, функционально связанным с константным участком легкой цепи отличного от человека животного (например, грызуна, такого как крыса или мышь) таким образом, что экзогенные генные сегменты вариабельного участка человека можно перестраивать и рекомбинировать с константным участком легкой цепи эндогенного гена отличного от человека животного (например, грызуна, такого как крыса или мышь) и образуют перестроенный обратный химерный ген легкой цепи (вариабельный человека, константный отличного от человека животного (например, грызуна, такого как крыса или мышь)).
[000368] Отличные от человека животные (например, грызуны, такие как крысы или мыши), описанные выше (например, «универсальная легкая цепь» или «обычная легкая цепь»), могут также содержать в своей зародышевой линии функциональную эктопическую последовательность нуклеиновой кислоты, которая кодирует ADAM6 ген или гомолог, или ортолог или его функциональный фрагменту отличного от человека животного (например, грызуна, такого как крыса или мышь). Аналогично, любые другие отличные от человека животные (например, грызуны, такие как крысы или мыши), описанные в данном документе, могут также содержать в своей зародышевой линии функциональную эктопическую последовательность нуклеиновой кислоты, которая кодирует ADAM6 ген или гомолог, или ортолог или его функциональный фрагменту отличного отчеловека животного (например, грызуна, такого как крыса или мышь). Например, такое отличное от человек животное (например, грызун, такой как крыса или мышь), может не иметь функционального эндогенного гена ADAM6 и содержать функциональную эктопическую последовательность нуклеиновой кислоты, чтобы дополнить потерю функции ADAM6 отличного от человека животного (например, грызуна, такого как крыса или мышь). Эктопическая последовательность нуклеиновой кислоты может присутствовать в локусе вариабельного участка тяжелой цепи человека или в другом месте. См., например, US 2012/0322108; US 2013/0254911; US 2014/0213773; US 2015/0201589; US 2015/0210776; US 2014/0017228; и US 2013/0198879, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000369] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее в своей зародышевой линии неперестроенный V-сегмент легкой цепи, и неперестроенный J-сегмент, функционально связанный с константным участком тяжелой цепи последовательности нуклеиновой кислоты. См., например, US 2012/0096572, US 2014/0130194 и US 2014/0130193, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Одним из примеров такого отличного от человека животного является отличное от человека животное, у которого геном зародышевой линии содержит модифицированный эндогенный локус тяжелой цепи иммуноглобулина, содержащий замену всех функциональных эндогенных вариабельных генных сегментов тяжелой цепи иммуноглобулина отличного от человека животного (VH), всех функциональных эндогенных разнообразных генных сегментов тяжелой цепи иммуноглобулина отличного от человека животного (DH), и всех функциональных эндогенных соединительных генных сегментов тяжелой цепи иммуноглобулина отличного от человека животного (JH) в эндогенном локусе тяжелой цепи иммуноглобулина отличного от человека животного с нуклеотидной последовательностью, которая содержит множество неперестроенных вариабельных генных сегментов легкой цепи иммуноглобулина человека (Vκ) и множество соединительных генных сегментов легкой цепи иммуноглобулина человека (Jκ) и функционально связан с эндогенной константным (CH) участком тяжелой цепи иммуноглобулина отличного от человека животного, где множество неперестроенных генных V сегментов легкой цепи иммуноглобулина человека и множество неперестроенных генных J сегментов легкой цепи иммуноглобулина человека участвуют в перестраивании в В-клетке при развитии В-клеток с образованием перестроенной последовательности гена легкой цепи Vκ/Jκ иммуноглобулина человека, функционально связанной с эндогенным CH-участком тяжелой цепи иммуноглобулина отличного от человека животного при модифицированном эндогенном локусе тяжелой цепи. Другим примером такого отличного от человека животного является отличное от человека животное, содержащее в своей зародышевой линии первый неперестроенный вариабельный генный сегмент легкой цепи каппа человека (Vκ) и неперестроенный соединительный генный сегментлегкой цепи каппа человека (Jκ), функционально связанный с эндогенным константным участком тяжелой цепи отличного от человека животного в эндогенном локусе тяжелой цепи отличного от человека животного, причем первый неперестроенный генный сегмент Vκ человека и неперестроенный генный сегмент Jκ человека заменяют все функциональные эндогенные вариабельные генные сегменты тяжелой цепи отличного от человека животного (VH), все функциональные эндогенные разнообразные генные сегменты тяжелой цепи отличного от человека животного (DH), и все функциональные эндогенные соединительные генные сегменты тяжелой цепи отличного от человека животного (JH), отличные от человека, причем первый неперестроенный генный сегмент Vκ человека и неперестроенный генный сегмент Jκ человека участвуют в перестраивании с образованием перестроенной последовательности Vκ/Jκ, функционально связанной с эндогенным константным участком тяжелой цепи отличного от человека животного у отличного от человека животного, и причем отличное от человека животное дополнительно содержит в своей зародышевой линии второй вариабельный генный сегмент легкой цепи человека (VL) и соединительный генный сегмент легкой цепи человека (JL), функционально связанный с константным геном легкой цепи отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, у которого геном содержит: (а) эндогенный локус тяжелой цепи иммуноглобулина, модифицированный, чтобы содержать замену всех функциональных эндогенных вариабельных генных сегментов (VH) тяжелой цепи иммуноглобулина отличного от человека животного, всех функциональных эндогенных разнообразных генных сегментов (DH) тяжелой цепи иммуноглобулина отличного от человека животного, и всех функциональных эндогенных соединительных генных сегментов (JH) тяжелой цепи иммуноглобулина отличного от человека животного в эндогенном локусе тяжелой цепи иммуноглобулина отличного от человека животного первым множеством неперестроенных вариабельных генных сегментов легкой цепи человека (Vκ) и первым множеством неперестроенных соединительных генных сегментов легкой цепи человека (Jκ), причем первое множество неперестроенных генных сегментов гена Vκ и Jκ легкой цепи иммуноглобулина человека функционально связано с эндогенным константным (CH) участком тяжелой цепи последовательности нуклеиновой кислоты в эндогенном локусе тяжелой цепи иммуноглобулина и участвует в перестраивании в В-клетке при развитии В-клетокдля образования первой перестроенной последовательности гена легкой цепи Vκ/Jκ человека, функционально связанной с эндогенной CH последовательностью нуклеиновой кислоты отличного от человека животного; и (b) модифицированный локус легкой цепи иммуноглобулина, содержащий второе множество неперестроенных вариабельных (Vκ) генных сегментов легкой цепи человека и второе множество неперестроенных соединительных (Jκ) генных сегментов легкой цепи человека, функционально связанное с эндогенным константным участком (Сκ) легкой цепи последовательности нуклеотидной кислоты отличного от человека животного в эндогенном локусе легкой цепи отличного от человека животного, причем второе множество неперестроенных генных сегментов Vκ и Jκ легкой цепи иммуноглобулина человека заменяет все функциональные эндогенные вариабельные (Vκ) генные сегменты легкой цепи отличного от человека животного и все функциональные эндогенные соединительные (Jκ) генные сегменты легкой цепи отличного от человека животного в эндогенном локусе цепи и участвуют в перестраивании в В-клетке при развитии В-клеток с образованием второй перестроенной последовательности участка Vκ/Jκ гена легкой цепи иммуноглобулина человека функционально связанный с эндогенным Сκ-участком последовательности нуклеиновой кислоты отличного от человека животного.
[000370] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее в геноме своей зародышевой линии локус тяжелой цепи иммуноглобулина, который содержит перестроенную нуклеотидную последовательность вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанную с эндогенным константным участком последовательности гена иммуноглобулина отличного от человека животного. См., например, US 2015/0020224, US 2014/0245468, US 2016/0100561, US 9204624 и US 14/961642, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Одним примером такого отличного от человека животные является отличное от человека животные, содержащее в геноме своей зародышевой линии в эндогенном локусе тяжелой цепи иммуноглобулина перестроенную нуклеотидную последовательность вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанную с эндогенным константным участком тяжелой цепи последовательности гена, причем перестроенная нуклеотидная последовательность вариабельного участка тяжелой цепи кодирует последовательность VH3-23/Х1Х2/-JH, где X1 представляет собой любую аминокислоту, а X2 представляет собой любую аминокислоту. Другим примером такого отличного от человека животного является отличное от человека животное, содержащее в геноме своей зародышевой линии генетически модифицированный эндогенный локус тяжелой цепи иммуноглобулина, который содержит перестроенную нуклеотидную последовательность вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанную с эндогенным константным участком последовательности гена иммуноглобулина, не относящегося к человеку, причем отличное от человека животное проявляет гуморальную иммунную систему, по существу, сходную с отличными от человека животными в отношении популяций В-клеток. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее генетически модифицированный эндогенный локус тяжелой цепи иммуноглобулина, который содержит перестроенную нуклеотидную последовательность вариабельного участка тяжелой цепи человеческого иммуноглобулина, содержащую последовательность V-сегмента тяжелой цепи (VH), которая является функционально связанный через спейсер с последовательностью J-сегментов тяжелой цепи (JH), причем спейсер содержит кодирует по меньшей мере два аминокислотных остатка, причем перестроенная нуклеотидная последовательность вариабельного участка тяжелой цепи иммуноглобулина человека функционально соответствует эндогенной последовательности гена константного участка иммуноглобулина отличного от человека животного. В одном примере, сегмент VH представляет собой VH3-23.
[000371] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное геном чьей зародышевой линии содержит: ограниченный локус тяжелой цепи иммуноглобулина, характеризующийся наличием отдельного неперестроенного генного сегмента VH человека, одного или более неперестроенного генных сегментов DH человека, и одного или более неперестроенного генных JH человека, функционально связанный с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку, причем отличное от человека животное дополнительно содержит В-клетку, содержащую перестроенную последовательность гена вариабельного участка тяжелой цепи человека, полученную из ограниченного локуса тяжелой цепи иммуноглобулина. См., например, US 2013/0323791 и US 2013/0096287, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. У некоторых таких отличных от человека животных одиночный неперестроенный генный сегмент VH человека представляет собой VH1-69. У некоторых таких отличных от человека животных одиночный неперестроенный генный сегмент VH человека представляет собой Ун1-2. Другие отличные от человека животные, которые могут быть использованы, включают в себя отличное от человека животное, чей эндогенный локус тяжелой цепи иммуноглобулина ограничен тем, что он содержит один генный сегмент VH человека, один или более генный сегмент DH человека, и один или более генный сегмент JH и который не содержит функциональный эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина; отличное от человека животное, дополнительно содержащее один или более генных сегментов VL иммуноглобулина человека, функционально связанные с одним или более генных сегментов JL человека, причем один генный сегмент VH человека, один или более генных сегментов DH человека, и один или более генных сегментов JH являются функционально связанным с геном константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку, причем один генный сегмент VH человека представляет собой VH1-69 или его полиморфный вариант.
[000372] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее в геноме своей зародышевой линии генетически модифицированный локус тяжелой цепи иммуноглобулина, содержащий неперестроенную нуклеотидную последовательность вариабельного участка тяжелой цепи иммуноглобулина человека, причем неперестроенная нуклеотидная последовательность вариабельного участка тяжелой цепи содержит добавление по меньшей мере одного гистидинового кодона или замещение по меньшей мере одного не гистидинового кодона с гистидиновым кодоном, причем гистидиновый кодон не кодируется соответствующим генным сегментом вариабельного участка тяжелой цепи зародышевой линии человека; и причем добавленный или замещенный гистидиновый кодон присутствует в комплементарной определяющем участке 3 (CDR3), кодирующей последовательность. См., например, US 2013/0247235, US 9301510 и US 14/046501, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей.
[000373] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее генетическую модификацию зародышевой линии, которая содержит делецию по меньшей мере части нуклеотидной последовательности, кодирующей домен CH1 эндогенного константного участка гена IgG; причем отличное от человека животное экспрессирует константный участок гена IgM, который содержит функциональный домен CH1, и отличное от человека животное экспрессирует в своей сыворотке антитело IgG, которое не содержит домен CH1 полностью или частично, и которое не содержит родственную легкую цепь. См., например, US 2011/0145937, US 2014/0289876, US 2015/0197553, US 2015/0197554, US 2015/0197555, US 2015/0196015, US 2015/0197556, US 2015/0197557 и US 8754287, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию нуклеотидной последовательности, кодирующую ген CH1-домена константного участка эндогенного IgG; и (b) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG (а); причем отличное от человека животное содержит ген константного участка интактного IgM, и отличное от человека животное экспрессирует тяжелую цепь антитела IgG, содержащее вариабельный домен человека, лишенный домена СН1, полностью или частично, и не обладает родственной легкой цепью и секретирует тяжелую цепь указанного антитела IgG в свою сыворотку. См., например, US 2011/0145937. Другим примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен и ген константного участка шарнирного участка эндогенного IgG; и (b) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0197553. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен и гена константного участка эндогенного IgG; (b) делецию гена константного участка эндогенного IgG2a; (с) делецию гена константного участка эндогенного IgG2b; и (d) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0197554. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен и ген константного участка шарнирного участка эндогенного IgG; (b) делецию гена константного участка эндогенного IgG2a; (с) делецию гена константного участка эндогенного IgG2b; и (d) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0197555. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен гена константного участка эндогенного IgG1; (b) делецию гена константного участка эндогенного IgD; (с) делецию гена константного участка эндогенного IgG3; (d) делецию гена константного участка эндогенного IgG2a; (е) делецию гена константного участка эндогенного IgG2b; (f) делецию гена константного участка эндогенного IgE; (g) делецию гена константного участка эндогенного IgA; и (h) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgGI (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0196015. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а)делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен гена константного участка эндогенного IgG1; (b) делецию последовательности нуклеиновой кислоты, кодирующей ген CH1 домен константного участка эндогенного IgG2a; (с) делецию гена константного участка эндогенного IgD; (d) делецию гена константного участка эндогенного IgG3; (e) делецию гена константного участка эндогенного IgG2b; (f) делецию гена константного участка эндогенного IgE; (g) делецию гена константного участка эндогенного IgA; и (h) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG1 (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0197556. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее модификацию зародышевой линии, причем эта модификация содержит: (а) делецию последовательности нуклеиновой кислоты, кодирующей CH1-домен и ген константного участка шарнирного участка эндогенного IgG1; (b) делецию гена константного участка эндогенного IgD; (с) делецию гена константного участка эндогенного IgG3; (d) делецию гена константного участка эндогенного lgG2a; (e) делецию гена константного участка эндогенного IgG2b; (f) делецию гена константного участка эндогенного IgE; (g) делецию гена константного участка эндогенного IgA; и (h) включение одного или более генных сегментов вариабельного участка тяжелой цепи человека, причем один или более генных сегментов вариабельного участка тяжелой цепи человека функционально связаны с константным участком эндогенного IgG1 (а); причем отличное от человека животное содержит ген константного участка интактного IgM. См., например, US 2015/0197557.
[000374] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее последовательность вариабельного участка легкой цепи λ (Vλ) и по меньшей мере одну J-последовательность (J), смежную с последовательностью константного участка легкой цепи к отличного от человека животного. См., например, US 2012/0073004, US 2014/0137275, US 2015/0246976, US 2015/0246977, US 2015/0351371, US 9035128, US 9066502, US 9163092 и US 9150662, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Одним из примеров такого отличного от человека животного является отличным от человека животным, содержащее: (а) по меньшей мере 12 до по меньшей мере 40 неперестроенных генных сегментов вариабельного участка человеческой легкой цепи λ человека и по меньшей мере один генный сегмент Jλ человека на эндогенном локусе легкой цепи отличного от человека животных; (b) межгенную последовательность Vκ-Jκ человека, расположенную между по меньшей мере 12 до по меньшей мере 40 генных сегментов вариабельного участка легкой цепи человека и по меньшей мере одну последовательность Jλ человека; причем отличное от человека животное экспрессирует антитело, которое содержит легкую цепь, содержащую домен Vλ человека и домен Сκ отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее в эндогенном локусе легкой цепи к в его зародышевой линии: (а) неперестроенный вариабельный участок легкой цепи, содержащий множество смежных неперестроенных функциональных V генных сегментов легкой цепи λ (hVλ) человека и множество смежных неперестроенных функциональных J генных сегментов легкой цепи λ человека (hJλ), причем множество генных сегментов hVλ и множество генных сегментов hJλ являются только функциональными генными сегментами вариабельного участка в неперестроенном вариабельном участке легкой цепи; и (b) ген константного участка легкой цепи к отличного от человека животного, причем множество смежных неперестроенных V генных сегментов легкой цепи λ человека (hVλ) и множество смежных неперестроенных J генных сегментов легкой цепи λ человека (hJλ) являются функционально связанными с геном константного участка легкой цепи к отличного от человека животного, так что неперестроенный вариабельный участок легкой цепи способна перестраиваться, чтобы сформировать перестроенный вариабельный участок легкой цепи λ человека, а отличное от человека животное экспрессирует антитела, содержащие легкую цепь, содержащую вариабельный участок, кодируемый с помощью перестроенного вариабельного участка легкой цепи λ человека и константного участка, кодируемого с помощью гена константного участка легкой цепи к отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее в эндогенном локусе легкой цепи к в его зародышевой линии: (а) неперестроенный вариабельный участок легкой цепи, содержащую: (i) по меньшей мере 12 смежных неперестроенных функциональных V генных сегментов вариабельного участка легкой цепи λ (hVλ) человека и множество смежных неперестроенных функциональных J генных сегментов легкой цепи λ (hJλ), причем по меньшей мере 12 функциональных генных сегментов hVλ и множество функциональных генных сегментов hJλ являются только функциональными генными сегментами вариабельного участка в неперестроенном вариабельном участке легкой цепи; и (ii) межгенную последовательность Vκ-Jκ человека, расположенную между смежными генными сегментами hVλ и множеством смежных генных сегментов hJλ; и (b) ген константного участка легкой цепи к отличного от человека животного; причем по меньшей мере 12 смежных неперестроенных функциональных V генных сегментов легкой цепи λ человека (hVλ) и множество смежных неперестроенных функциональных J генных сегментов легкой цепи λ человека (hJλ) являются функционально связанными с геном константного участка легкой цепи к отличного от человека животного, так что неперестроенный вариабельный участок легкой цепи способна перестраиваться, чтобы сформировать перестроенный вариабельный участок легкой цепи λ человека, а отличное от человека животное экспрессирует антитела, содержащие легкую цепь, содержащую вариабельный участок, кодируемый с помощью перестроенного вариабельного участка легкой цепи λ человека и константного участка, кодируемого с помощью гена константного участка легкой цепи к отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее в его зародышевой линии: (а) неперестроенный вариабельный участок легкой цепи, содержащую множество смежных неперестроенных функциональных V генных сегментов легкой цепи λ (hVλ) человека и множество смежных неперестроенных функциональных J генных сегментов легкой цепи λ человека (hJλ), причем множество генных сегментов hVλ и множество генных сегментов hJλ являются только функциональными генными сегментами вариабельного участка в неперестроенном вариабельном участке легкой цепи; и (b) ген константного участка легкой цепи к отличного от человека животного, причем множество смежных неперестроенных функциональных hVλ генных сегментов и множество смежных неперестроенных функциональных hJλ генных сегментов являются функционально связанными с геном константного участка легкой цепи к отличного от человека животного, так что неперестроенный вариабельный участок легкой цепи способен перестраиваться, чтобы сформировать перестроенный вариабельный участок легкой цепи λ человека, и отличное от человека животное экспрессирует антитела, содержащие легкую цепь, содержащую вариабельный домен, кодируемый с помощью перестроенного вариабельного участка легкой цепи λ человека, и константный домен, кодируемый с помощью гена константного участка легкой цепи к отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее в его зародышевой линии: (а) неперестроенный вариабельный участок легкой цепи, содержащий: (i) по меньшей мере 12 смежных неперестроенных функциональных участков генных сегментов легкой цепи λ (hVλ) человека и множество смежных неперестроенных функциональных J генных сегментов легкой цепи λ (hJλ), причем по меньшей мере 12 функциональных генных сегментов hVλ и множество функциональных генных сегментов hJλ являются только функциональными генными сегментами вариабельного участка в неперестроенном вариабельном участке легкой цепи; и (ii) межгенную последовательность Vκ-Jκ человека, расположенную между смежными генными сегментами hVλ и множеством смежных генных сегментов hJλ; и (b) ген константного участка легкой цепи к отличного от человека животного; причем по меньшей мере 12 смежных неперестроенных функциональных hVλ генных сегментов и множество смежных неперестроенных функциональных hJλ генных сегментов являются функционально связанными с геном константного участка легкой цепи к отличного от человека животного, так что неперестроенный вариабельный участок легкой цепи способен перестраиваться, чтобы сформировать перестроенный вариабельный участок легкой цепи λ человека, и отличное от человека животное экспрессирует антитела, содержащие легкую цепь, содержащую вариабельный домен, кодируемый с помощью перестроенного вариабельного участка легкой цепи λ человека, и константной домен, кодируемый с помощью гена константного участка легкой цепи к отличного от человека животного. Еще одним примером такого отличного от человека животного является отличное от человека животное, геном которого содержит локус иммуноглобулина, содержащий генные сегменты Vλ и Jλ человека, функционально связанные с геном Сκ отличного от человека животного, так что отличное от человека животное экспрессирует легкую цепь иммуноглобулина которая содержит последовательность вариабельного домена λ человека, слитую с константным доменом к отличного от человека животного. См., например, US 9226484
[000375] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее в своей зародышевой линии, в эндогенном локусе легкой цепи отличного от человека, последовательность вариабельного участка легкой цепи λ человека, причем последовательность вариабельного участка лямбда человека экспрессируется в легкой цепи, которая содержит последовательность гена константного участка иммуноглобулина отличного от человека животного. См., например, US 2013/0323790, US 2013/0326647, US 2015/0089680, US 2015/0173331, US 2015/0176002, US 2015/0173332, US 2012/0070861, US 2015/0320023, US 2016/0060359, US 2016/0057979, US 9029628, US 9006511, US 9012717, US 9206261, US 9206262, US 9206263, и US 9226484, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, которое экспрессирует легкую цепь иммуноглобулина, которая содержит вариабельную последовательность лямбда человека, слитую с константным участком отличного от человека животного, причем отличное от человека животное проявляет κ до λ коэффициент использования около 1:1. См., например, US 9029628. Еще одним примером такого отличного от человека животного является отличное от человека животное, геном которого содержит эндогенный неперестроенный локус легкой цепи к иммуноглобулина, содержащий замещение эндогенных генных сегментов Vκ и Jκ генными сегментами Vλ и Jλ человека, и причем генные сегменты Vλ и Jλ человека функционально связаны с геном Сκ отличного от человека животного, таким образом, что отличное от человека животное экспрессирует легкую цепь иммуноглобулина, которая содержит вариабельную последовательность λ человека, слитую с константным участком отличного от человека животного. См., например, US 9006511. Еще одним примером такого отличного от человека животного является отличное от человека животное, геном которого содержит эндогенный локус легкой цепи λ иммуноглобулина, содержащий: (i) делецию первого эндогенного кластера гена Vλ-Jλ-Cλ; и (ii) замещение фрагмента эндогенных генных сегментов Vλ и Jλ во втором эндогенном кластере гена Vλ-Jλ-Cλ с генными сегментами Vκ и Jλ человека, причем генные сегменты Vλ и Jλ человека содержат по меньшей мере один генный сегмент Vλ человека и по меньшей мере один генный сегмент Jλ человека, и причем генные сегменты Vλ и Jλ человека функционально связаны с геном Сλ отличного от человека животного. См., например, US 9012717.
[000376] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, имеющее геном, содержащий модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет функцию эндогенного ADAM6, и отличное от человека животное дополнительно содержит последовательность нуклеиновой кислоты, кодирующую белок ADAM6 отличного от человека животного, или ортолог, или его гомолог, или функциональный фрагмент соответствующего белка ADAM6. См., например, US 2012/0322108, US 2013/0254911, US 2014/0213773, US 2015/0201589, US 2015/0210776, US 2014/0017228, US 8642835 и US 8697940, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, геном которого содержит: (а) эктопическое размещение гена ADAM6; и (b) локус вариабельного участка тяжелой цепи иммуноглобулина человека, содержащий вставку одного или более генных сегментов VH человека, одного или более генных сегментов DH человека, и одного или более генных сегментов JH человека в эндогенный локус тяжелой цепи отличного от человека животного, причем генные сегменты VH, DH и JH человека функционально связаны с геном константного участка тяжелой цепи; так что отличное от человека животное характеризуется тем, что: (i) оно фертильно; и (ii) когда оно иммунизировано антигеном, то продуцирует антитела, содержащие вариабельные домены тяжелой цепи, кодируемые одним или более генными сегментами VH человека, одним или более DH человека, и одним или более JH человека, функционально связанными с константными доменами тяжелой цепи, кодируемыми геном константного участка тяжелой цепи, причем антитела проявляют специфическое связывание с антигеном. См., например, US 8642835.
[000377] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее: (а) вставку одного или более генных сегментов Vλ и Jλ человека вверх по ходу транскрипции константного участка легкой цепи иммуноглобулина, не относящегося к человеку, (b) вставку одного или более VH человека, одного или более DH человека, и одного или более генных сегментов JH человека по ходу транскрипции константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку, и (с) нуклеотидную последовательность, которая кодирует белок ADAM6 или его функциональный фрагмент, причем белок ADAM6 экспрессируется из эктопической последовательности нуклеиновой кислоты ADAM6. См., например, US 2013/0160153 и US 2014/0017228, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, геном которого содержит: (а) вставку одного или более генных сегментов Vλ человека и одного или более генных сегментов Jλ человека по ходу транскрипции гена константного участка легкой цепи иммуноглобулина отличного от человека животного, (b) вставку одного или более генных сегментов VH человека, одного или более генных сегментов DH человека, и одного или более генных сегментов JH человека по ходу транскрипции гена константного участка тяжелой цепи иммуноглобулина отличного от человека животного, и (с) эктопическую нуклеотидную последовательность, которая кодирует белок ADAM6 отличного от человека животного, причем белок ADAM6 отличного от человека животного экспрессируется из эктопической нуклеотидной последовательности. См., например, US 2013/0160153.
[000378] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее в своей зародышевой линии локус иммуноглобулина, который содержит неперестроенную вариабельную последовательность гена иммуноглобулина, содержащую в кодирующей CDR3 последовательности замену по меньшей мере одного негистидинового кодона на гистидиновый кодон или вставку по меньшей мере одного гистидинового кодона, причем отличное от человека животное дополнительно содержит in vivo разнообразный репертуар антител, каждое из которых специфично для представляющего интерес антигена и содержит CDR3 вариабельного домена в по меньшей мере одной гистидиновой аминокислоте, кодируемой по меньшей мере одной заменой или вставкой гистидинового кодона в неперестроенную вариабельную последовательность гена иммуноглобулина. См., например, US 2013/0247236 и US 2014/0082760, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. В одном примере первый локус гена вариабельного участка иммуноглобулина содержит функциональную часть неперестроенной последовательности вариабельного участка тяжелой цепи иммуноглобулина, которая содержит неперестроенные генные сегменты VH, DH и JH, и причем один или более неперестроенных генных сегментов VH, DH и JH содержат вставленный или замещенный гистидиновыи кодон, который не кодируется соответствующим генным сегментом зародышевой линии дикого типа. В другом примере неперестроенными генными сегментами VH, DH и JH являются неперестроенный VH человека, неперестроенный DH человека и неперестроенный JH генные сегменты человека. В другом варианте осуществления изобретения, содержит в его зародышевой линии второй локус гена вариабельного участка иммуноглобулина, содержащий последовательность вариабельного участка легкой цепи иммуноглобулина, содержащую вставку по меньшей мере одного гистидинового кодона или замещение по меньшей мере одного негистидинового кодона на гистидиновыи кодон, причем вставленный или замещенный гистидиновыи кодон не кодируется соответствующей последовательностью вариабельного участка иммуноглобулина зародышевой линии дикого типа, причем отличное от человека животное экспрессирует вариабельный домен легкой цепи иммуноглобулина, который содержит гистидин, полученный из замены гистидина или вставки в зародышевую линию отличного от человека животного. См., например, US 2013/0247236.
[000379] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее: (а) вставку одного или более VL человека и одного или более JL генных сегментов человека вверх по ходу транскрипции константного участка легкой цепи иммуноглобулина, не относящегося к человеку; (b) вставку одного или более VL человека и одного или более генных сегментов JL человека по ходу транскрипции константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку, и (с) нуклеотидную последовательность, которая кодирует белок ADAM6 или его функциональный фрагмент, причем белок ADAM6 экспрессируется из эктопической последовательности нуклеиновой кислоты ADAM6. См., например, US 2013/0212719, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Примером такого отличного от человека животного является отличное от человека животное, геном которого содержит: (а) вставку одного или более генных сегментов VL человека и одного или более генных сегментов JL человека по ходу транскрипции гена константного участка легкой цепи иммуноглобулина, не относящегося к человеку, причем один или более генных сегментов VL человека и один или более генных сегментов JL человека функционально связаны с геном константного участка легкой цепи иммуноглобулина, не относящегося к человеку; (b) вставку одного или более генных сегментов VL человека и одного или более генных сегментов JL человека по ходу транскрипции гена константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку, причем один или более генных сегментов VL человека и один или более генных сегментов JL человека функционально связаны с геном константного участка тяжелой цепи иммуноглобулина, не относящегося к человеку; и (с) вставленную последовательность нуклеиновой кислоты, которая кодирует белок ADAM6 отличного от человека животного (например, грызуна, такого как крыса или мышь), причем белок ADAM6 отличного от человека животного (например, грызуна, такого как крыса или мышь) экспрессируется из вставленной последовательности нуклеиновой кислоты, так что В-клетки отличного от человека животного экспрессируют антитела, каждое из которых содержит две легкие цепи иммуноглобулина спаренные с двумя тяжелыми цепями иммуноглобулина, причем каждая легкая цепь содержит вариабельный домен легкой цепи человека и константный домен легкой цепи, не относящейся к человеку, и каждая тяжелая цепь содержит вариабельный домен легкой цепи человека и константный домен тяжелой цепи, не относящейся к человеку. См., например, US 2013/0212719.
[000380] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, имеющее в своей зародышевой линии: (а) геномную последовательность человека, содержащую один генный сегмент VH человека, один или более генных сегментов DH и один или более генных сегментов JH; и (b) последовательность, которая кодирует белок ADAM6, который функционирует у самца отличного от человека животного, причем последовательность, которая кодирует ADAM6, расположена в положении, отличном от локуса ADAM6 отличного от человека животного дикого типа. См., например, US 2013/0333057, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Примером такого отличного от человека животного является отличное от человека животное, имеющее в своей зародышевой линии: (а) неперестроенную геномную последовательность человека, содержащую один генный сегмент VH человека, один или более генных сегментов DH человека и один или более генных сегментов JH человека, причем один генный сегмент VH человека представляет собой VH1-2, VH1-69, VH2-26, VH2-70 или его полиморфный вариант; и (b) последовательность, которая кодирует белок ADAM6, который функционирует у самца отличного от человека животного, причем последовательность, которая кодирует белок ADAM6, расположена в положении, отличном от локуса ADAM6 отличного от человека животного дикого типа. См., например, US 2013/0333057.
[000381] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее: (а) один перестроенный вариабельный участок легкой цепи иммуноглобулина человека (VL/JL.), которая кодирует VL домен легкой цепи иммуноглобулина человека, причем один перестроенный участок VL/JL человека выбирается из генного сегмент Vκ1-39/J человека или генного сегмента Vκ3-20/J человека (например, генного сегмента Vκ1-39/Jκ5 или генного сегмента Vκк3-20/Jκ1 человека); и (b) замещение генных сегментов эндогенной тяжелой цепи (VH) одним или более генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном константного участка эндогенной тяжелой цепи (CH), а генные сегменты VH человека способны перестраивать и формировать ген химерной тяжелой цепи человека/отличного от человека животного. Такие отличные от человека животные можно назвать отличными от человека животными с «универсальной легкой цепью» (ULC) или «обычной легкой цепью». См., например, US 2011/0195454, US 2012/0021409, US 2012/0192300, US 2015/0059009, US 2013/0045492, US 2013/0198880, US 2013/0185821, US 2013/0302836, US 2015/0313193 и US 15/056713, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Аналогичным образом, другое отличное от человека животное (например, грызун, такой как крыса или мышь), которое может быть использовано, включает отличное от человека животное, которое экспрессирует популяцию антител, причем зародышевая линия отличного от человека животного включает только один ген вариабельного участка легкой цепи каппа иммуноглобулина, который представляет собой перестроенный ген вариабельного участка легкой цепи каппа зародышевой линии человека, причем отличное от человека животное является либо гетерозиготным для гена вариабельного участка легкой цепи каппа иммуноглобулина, поскольку оно содержит только одну копию, или гомозиготным для одного гена вариабельного участка легкой цепи каппа иммуноглобулина, поскольку оно содержит две копии; отличное от человека животное характеризуется активным созреванием аффинности, так что: (i) каждый легкая цепь каппа иммуноглобулина популяции содержит вариабельный домен легкой цепи, который кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, или его соматически мутированным вариантом; (ii) популяция содержит антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, и антитела, содержащие легкие цепи каппа иммуноглобулина, чей вариабельный домен легкой цепи кодируется их соматически мутированными вариантами; и (iii) отличное от человека животное образует разнообразный набор соматически мутированных высокоаффинных тяжелых цепей, которые успешно соединяются с легкими цепями каппа иммуноглобулина с образованием антител к популяции. Примером такого отличного от человека животного является отличное от человека животное, которое является гетерозиготным или гомозиготным в своей зародышевой линии для: (а) вставки в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к отличного от человека животного перестроенной последовательности Vκ/Jκ, содержащей: одну последовательность Vκ зародышевой линии человека, при этом последовательность Vκ зародышевой линии человека представлена в SEQ. ID NO: 148 или SEQ ID NO: 149; и одну последовательность Jk зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенной константного участка к отличного от человека животного; и (b) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина отличного от человека животного из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина отличного от человека животного, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраивать и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/отличного от человека животного. SEQ ID NO: 148 представляет собой последовательность сконструированного локуса Vκ1-39Jκ5 человека, и SEQ ID NO: 149 представляет собой последовательность сконструированного локуса Vκ3-20Jκ1 человека. См., например, US 2011/0195454, включенную в данном документе в качестве ссылки в полном объеме для всех целей.
[000382] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное полезное для получения домена VL/CH x ULC человека, содержащего в геноме своей зародышевой линии: (i) гибридный локус иммуноглобулина который кодирует гибридную цепь иммуноглобулина, причем гибридный локус иммуноглобулина содержит неперестроенные генные сегменты вариабельного участка легкой цепи иммуноглобулина человека (VL и JL), функционально связанные с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина, содержащей один или более генов константного участка тяжелой цепи, каждый из которых кодирует по меньшей мере функциональный домен CH1, причем генные сегменты VL и JL способны перестраиваться с образованием гибридной последовательности, содержащей перестроенную последовательность гена VL/JL человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка тяжелой цепи иммуноглобулина; (ii) локус легкой цепи, который кодирует универсальную легкую цепь человека, и содержит перестроенную нуклеотидную последовательность вариабельного участка универсальной легкой цепи человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи иммуноглобулина; причем отличное от человека животное способно продуцировать антигенсвязывающий белок, который содержит гибридную цепь иммуноглобулина человека, полученную из гибридного локуса, и родственную универсальную легкую цепь человека, полученной из локуса легкой цепи, причем гибридная цепь иммуноглобулина человека содержит вариабельный домен легкой цепи иммуноглобулина человека (hVL/CH × ULC), слитую с константным участком тяжелой цепи IgG, IgG, IgE или IgA, содержащей функциональный домен CH1, и в котором универсальная легкая цепь человека содержит легкую цепь иммуноглобулина человека, слитую с константным доменом легкой цепи. См., например, PCT/US2016/023289, включенный в данный документ в качестве ссылки во всей полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, пригодное для получения домена VL/CH × ULC человека, содержащего в геноме своей зародышевой линии: (i) модифицированный эндогенный локус тяжелой цепи иммуноглобулинов, содержащий замену всех функциональных эндогенных вариабельных генных сегментов VH тяжелой цепи иммуноглобулина отличного от человека животного, всех функциональных эндогенных разнообразных генных сегментов DH тяжелой цепи иммуноглобулина отличного от человека животного, и всех функциональных эндогенных соединительных генных сегментов JH тяжелой цепи иммуноглобулина отличного от человека животного со множеством неперестроенных вариабельных Vκ генных сегментов легкой цепи иммуноглобулина человека и множеством неперестроенных соединительных Jκ генных сегментов легкой цепи иммуноглобулина человека, функционально связанных с эндогенным константным участком тяжелой цепи иммуноглобулина отличного от человека животного, содержащей один или более генов константного участка тяжелой цепи, каждый из которых кодирует по меньшей мере функциональный домен CH1, причем множество неперестроенных генных Vκ сегментов легкой цепи иммуноглобулина человека и множество неперестроенных генных Jκ сегментов легкой цепи иммуноглобулина человека участвуют в перестраивании в В-клетке при развитии В-клеток с образованием первой перестроенной нуклеотидной последовательности вариабельного участка легкой цепи Vκ/Jκ иммуноглобулина человека, функционально связанной с последовательность нуклеиновой кислоты эндогенного константного участка тяжелой цепи иммуноглобулина отличного от человека животного в эндогенном локусе тяжелой цепи иммуноглобулина отличного от человека животного; и (ii) модифицированный эндогенный локус легкой цепи, содержащий одну перестроенную последовательность гена вариабельного участка легкой цепи иммуноглобулина человека, полученную из перестроенной последовательности гена Vκ1-39/Jκ5 или Vκ3-20/Jκ1, причем одна перестроенная последовательность гена вариабельного участка легкой цепи иммуноглобулина человека функционально связана с последовательностью гена эндогенного константного участка k легкой цепи иммуноглобулина отличного от человека животного; причем отличное от человека животное способно продуцировать антигенсвязывающий белок, который содержит гибридную цепь иммуноглобулина человека, полученную из модифицированного эндогенного локуса тяжелой цепи иммуноглобулина, и родственную универсальную легкую цепи человека, полученную из модифицированного эндогенного локуса легкой цепи, причем гибридная цепь иммуноглобулина человека содержит вариабельный домен легкой цепи иммуноглобулина человека (hVL/CH × ULC), слитый с константным участком тяжелой цепи IgD, IgG, IgE или IgA, содержащим функциональный домен CH1, и в котором универсальная легкая цепь человека содержит легкую цепь иммуноглобулина человека, слитую с константным доменом легкой цепи.
[000383] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, содержащее в геноме своей зародышевой линии локус иммуноглобулина легкой цепи, например, в эндогенном локусе легкой цепи, отличного от человека, содержащем перестроенную нуклеотидную последовательность вариабельного участка легкой цепи иммуноглобулина человека, функционально связанную с последовательностью нуклеиновой кислоты константного участка легкой цепи иммуноглобулина, причем перестроенная нуклеотидная последовательность вариабельного участка легкой цепи иммуноглобулина человека, функционально связанная с последовательностью нуклеиновой кислоты константного участка легкой цепи иммуноглобулина, кодирует универсальную легкую цепь, и причем отличное от человека животное способно продуцировать или продуцировать клетку, например, лимфоцит, например В-клетку, которая экспрессирует антигенсвязывающий белок, содержащий гибридную цепь иммуноглобулина и универсальную легкую цепь. См., например, US 2013/0247234, US 2014/0329711, US 2014/0013456, US 2015/0119556, US 2015/0250151, US 9334334, and US 9332742, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Некоторые такие отличные от человека животные являются гомозиготными по отношению к перестроенной нуклеотидной последовательности вариабельного участка легкой цепи иммуноглобулина человека. Некоторые такие отличные от человека животные являются гетерозиготными по отношению к перестроенной нуклеотидной последовательности вариабельного участка легкой цепи иммуноглобулина человека. У некоторых таких отличных от человека животных, последовательность нуклеиновой кислоты константного участка легкой цепи представляет собой последовательность каппа. У некоторых таких отличных от человека животных, последовательность нуклеиновой кислоты константного участка легкой цепи представляет собой последовательность лямбда. У некоторых таких отличных от человека животных, второй локус иммуноглобулина представляет собой локус легкой цепи каппа. В некоторых вариантах осуществления изобретения, второй локус иммуноглобулина представляет собой локус легкой цепи лямбда. Примером такого отличного от человека животного является отличное от человека животное, содержащее в своей зародышевой линии локус легкой цепи иммуноглобулина, который содержит единственную перестроенную последовательность гена вариабельного участка легкой цепи человека иммуноглобулина человека, содержащую последовательности сегментов Vκ и Jκ человека, причем последовательность сегмента Vκ получают из генного сегмента Vκ1-39 или Vκ3-20 человека, и причем одна перестроенная последовательность гена вариабельного участка легкой цепи иммуноглобулина человека содержит замещение по меньшей мере одного негистидинового кодона последовательности сегмента Vκ на гистидиновый кодон, который экспрессирован в положении, выбранном из группы, состоящей из 105, 106, 107, 108, 109, 111 и их комбинации (согласно нумерации IMGT).
[000384] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животное, чей геном содержит: (а) вариабельный локус тяжелой цепи гуманизированного иммуноглобулина, содержащий по меньшей мере один неперестроенный VH человека, по меньшей мере один неперестроенный DH человека, и по меньшей мере один неперестроенный сегмент JH человека, функционально связанный с геном константного участка тяжелой цепи; (b) вариабельный локус легкой цепи гуманизированного иммуноглобулина, содержащий не более одной, или не более двух перестроенных последовательностей V/J легкой цепи человека, функционально связанных с геном константного участка легкой цепи; и (с) эктопическая последовательность нуклеиновой кислоты, которая экспрессирует функциональный белок ADAM6 отличного от человека животного, или функциональный ортолог или функциональный гомолог или его функциональный фрагмент. См., например, US 2013/0198879, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Примером такого отличного от человека животного является отличное от человека животное, содержащее в своей зародышевой линии: (а) вариабельный локус тяжелой цепи гуманизированного иммуноглобулина, содержащий по меньшей мере один неперестроенный генный сегмент VH человека, по меньшей мере один неперестроенный генный сегмент DH человека, и по меньшей мере один неперестроенный генный сегмент JH человека, причем вариабельный локус тяжелой цепи гуманизированного иммуноглобулина функционально связан с геном константного участка тяжелой цепи иммуноглобулина; (b) вариабельный локус легкой цепи гуманизированного иммуноглобулина, содержащий (i) одну перестроенную последовательность V/J легкой цепи человека, причем одна перестроенная последовательность V/J легкой цепи человека представляет собой перестроенную последовательность Vκ1-39/Jκ человека или перестроенную последовательность Vκ3-20/Jκ человека, или (ii) не более одного генного сегмента V легкой цепи человека и не более одного генного сегмента J легкой цепи человека, причем не более одного генного сегмента V легкой цепи человека представляет собой Vκ1-39 или Vκ3-20, причем вариабельный локус легкой цепи гуманизированного иммуноглобулина функционально связан с геном константного участка легкой цепи иммуноглобулина; и (с) эктопическая последовательность нуклеиновой кислоты, которая экспрессирует белок ADAM6 отличного от человека животного, или ортолог, или гомолог или его функциональный фрагмент, который функционирует у самца отличного от человека животного.
[000385] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают отличное от человека животного, содержащее в своей зародышевой линии: (а) делецию или инактивирующую мутацию в нуклеотидной последовательности, кодирующей домен CH1 по меньшей мере одного гена константного участка тяжелой цепи эндогенного иммуноглобулина в эндогенном локусе тяжелой цепи иммуноглобулина, причем по меньшей мере один ген константного участка тяжелой цепи эндогенного иммуноглобулина представляет собой IgG, IgA, IgE, IgD или их комбинацию; и (b) одну или обе (i) последовательности нуклеиновой кислоты, содержащую по меньшей мере один неперестроенный генный сегмент вариабельного участка легкой цепи иммуноглобулина (VL), и по меньшей мере один неперестроенный соединительный генный сегмент (JL) легкой цепи иммуноглобулина, причем неперестроенные генные сегменты VL и JL способны к рекомбинации с образованием перестроенной нуклеотидной последовательности вариабельного участка легкой цепи иммуноглобулина (VL/JL), функционально связанной с геном константного участка тяжелой цепи иммуноглобулина, содержащим делецию или инактивирующую мутацию в нуклеотидной последовательности, кодирующей домен CH1; и/или (ii) локус легкой цепи иммуноглобулина, который содержит одну перестроенную последовательность гена VL/JL вариабельного участка легкой цепи иммуноглобулина, содержащую последовательности генных сегментов VL и JL, причем одна перестроенная последовательность гена вариабельного участка легкой цепи иммуноглобулина функционально связана с последовательностью гена константного участка легкой цепи иммуноглобулина. См., например, US 2015/0289489, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Примером такое отличное от человека животное представляет собой отличное от человека животное, содержащее: (а) замещение в локусе тяжелой цепи отличного от человека животного всех или практически всех генных сегментов V, D и J тяжелой цепи эндогенного иммуноглобулина с либо (i) одним или более неперестроенными генными сегментами VH тяжелой цепи иммуноглобулина человека, одним или более неперестроенными генными сегментов DH тяжелой цепи иммуноглобулина человека, и одним или более неперестроенными генными сегментов -1н тяжелой цепи иммуноглобулина человека, причем один или более неперестроенные генные сегменты VH, DH и JH тяжелой цепи иммуноглобулина человека функционально связаны с последовательностью гена константного участка тяжелой цепи отличного от человека животного; или (ii) одним или более неперестроенными генными сегментами VL легкой цепи человека, и одним или более неперестроенными генными сегментами JL легкой цепи человека, причем один или более неперестроенные генные сегменты VL и JL легкой цепи человека функционально связаны с последовательностью гена константного участка тяжелой цепи отличного от человека животного, причем последовательность гена константного участка тяжелой цепи отличного от человека животного содержит полноразмерный ген IgM и делецию или инактивирующую мутацию в нуклеотидной последовательности, кодирующей домен CH1 в гене IgG, выбранном из группы, состоящей из IgGI, IgG2a, IgG2b, IgG2c, IgG3 и их комбинации; и (b) замещение всех или практически всех генных сегментов V и J легкой цепи эндогенного иммуноглобулина с одной перестроенной вариабельной последовательностью гена Vκ/Jκ человека, и причем отличное от человека животное, экспрессирует рецептор В-клетки, которая содержит тяжелую цепь IgM связанную с родственной легкой цепью.
[000386] Другие отличные от человека животные (например, грызуны, такие как крысы или мыши), которые могут быть использованы, включают в себя отличное от человека животное, содержащее в своей зародышевой линии локус легкой цепи иммуноглобулина, содержащий не более двух генных сегментов VL человека, и один или более генных сегментов JL человека, функционально связанные с последовательностью константного участка легкой цепи иммуноглобулина, причем каждый из не более чем двух генных сегментов VL человека содержит по меньшей мере один гистидиновый кодон, который не кодируется соответствующим генным сегментом VL зародышевой линии человека, и причем генные сегменты VL и генные сегменты JL человека способны перестраивать и кодировать вариабельный домен легкой цепи антитела человека. См., например, US 2014/0013456, US 2015/0119556, US 2015/0250151, US 2013/0247234 и US 9332742, каждая из которых включена в настоящее описание посредством ссылки во всей их полноте для всех целей. Примером такого отличного от человека животного является отличное от человека животное, которое содержит не более двух генных сегментов VL человека, каждый из которых способен перестраиваться с генным сегментом JL человека (выбранным из одного или множества сегментов JL) и кодирование вариабельного домена человека легкой цепи иммуноглобулина, причем каждый из не более двух генных сегментов VL и/или генного сегмента JL содержит замену по меньшей мере одного негистидинового остатка гистидиновым остатком. См., например, US 2014/0013456. Еще одним примером такого отличного от человека животного является отличное от человека животное, содержащее в своей зародышевой линии локус легкой цепи иммуноглобулина, содержащий два неперестроенных генных сегмента Vκ человека, и один или более неперестроенный генный сегмент(ов) Jκ человека, функционально связанных с последовательностью константного участка легкой цепи иммуноглобулина, причем два неперестроенных генных сегментов Vκ человека представляют собой генные сегменты Vκ1-39 и Vκ3-20 человека, каждый из которых содержит одну или более замен негистидинового кодона с гистидиновым кодоном, и причем генные сегменты Vκ и Jκ человека могут быть перестраивать, а генные сегменты Vκ и Jκ человека кодируют вариабельный домен легкой цепи человека, содержащий один или более гистидинов в положении, выбранном из группы, состоящей из 105, 106, 107,108, 109, 111 (согласно нумерации IMGT), и их комбинацию, причем один или более гистидинов получают из одной или более замен. См., например, US 2015/0250151.
IV. Способы генерации антигенсвязывающих белков
[000387] Генетически модифицированное F0 поколение отличных от человека животных, полученных описанными в данном документе способами, могут быть использованы для создания антигенсвязывающего белка против представляющего интерес чужеродного антигена-мишени. Было описано несколько методов получения антигенсвязывающих белков (например, антител). Антигенсвязывающие белки могут быть выделены непосредственно из В-клеток иммунизированной мыши (см., например, US 2007/0280945, включенную в данный документ в качестве ссылки во всей своей полноте для всех целей), и/или В-клетки иммунизированной мыши могут быть использованы для создания гибридомы (см., например, Kohler and Milstein (1975) Nature 256: 495-497, включенную в данный документ в качестве ссылки во всей своей полноте для всех целей). ДНК, кодирующая антигенсвязывающие белки (тяжелые и/или легкие цепи) из отличных от человека животных, как описано в данном документе, может быть легко выделена и сиквенирована с использованием обычных методов. Гибридомы и/или В-клетки, полученные из отличных от человека животных, как описано в данном документе, служат в качестве предпочтительного источника такой ДНК. После выделения ДНК можно помещать в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, которые иначе не продуцируют белок иммуноглобулина, чтобы получить синтез моноклональных антител в рекомбинантных клетках-хозяевах.
[000388] Например, генетически модифицированное F0 поколение отличных от человека животных, полученное описанными в данном документе способами, может быть подвергнуто воздействию антигена-мишени и поддерживаться в условиях, достаточных для инициирования иммунного ответа на представляющий интерес чужеродный антиген-мишень. Первая последовательность нуклеиновой кислоты, кодирующая вариабельный домен тяжелой цепи иммуноглобулина человека, и/или вторая последовательность нуклеиновой кислоты, кодирующая вариабельный домен легкой цепи иммуноглобулина человека, затем может быть получена из генетически модифицированного F0 поколения отличного от человека животного. Альтернативно, антигенсвязывающий белок может быть затем выделен из генетически модифицированного F0 поколения отличного от человека животного. В качестве примера может быть идентифицирован клонально выбранный лимфоцит, который экспрессирует антитело, которое специфически связывает представляющий интерес чужеродный антиген.
[000389] В одном примере антигенсвязывающие белки могут быть получены путем иммунизации генетически модифицированного F0-поколения отличного от человека животного с представляющим интерес чужеродным антигеном-мишенью, позволяя отличному от человека животному повышать иммунный ответ, собирая лимфоцит (например, В-клетку) от иммунизованного животного, сливая лимфоцит с клеткой миеломы с образованием клетки гибридомы, получая из клетки гибридомы последовательность нуклеиновой кислоты, которая кодирует домен VH, который специфически связывает антиген-мишень и/или последовательность нуклеиновой кислоты, которая кодирует домен VL, который специфически связывает антиген-мишень, клонируя последовательность нуклеиновой кислоты в рамке (то есть в функциональной связи) с последовательностью нуклеиновой кислоты, кодирующей константный участок иммуноглобулина или его функциональную часть, чтобы создать тяжелую цепь иммуноглобулина и/или легкую цепь иммуноглобулина, и экспрессируя тяжелые и легкие цепи в клетке (например, клетке СНО), способной экспрессировать антигенсвязывающий белок.
[000390] В другом примере антигенсвязывающие белки могут быть получены путем иммунизации генетически модифицированного F0-поколения отличного от человека животного с представляющим интерес чужеродным антигеном-мишенью, позволяя отличному от человека животному повышать иммунный ответ, собирая лимфоцит (например, В-клетку) от иммунизованного животного, получая из лимфоцита последовательность нуклеиновой кислоты, которая кодирует домен VH, который специфически связывает антиген-мишень и/или последовательность нуклеиновой кислоты, которая кодирует домен VL, который специфически связывает антиген-мишень, клонируя последовательность нуклеиновой кислоты в рамке (то есть в функциональной связи) с последовательностью нуклеиновой кислоты, кодирующей константный участок иммуноглобулина или его функциональную часть, чтобы создать тяжелую цепь иммуноглобулина и/или легкую цепь иммуноглобулина, и экспрессируя тяжелые и легкие цепи в клетке (например, клетке СНО), способной экспрессировать антигенсвязывающий белок.
[000391] Иммунизация чужеродным антигеном, представляющим интерес, может быть проведена с белком, ДНК, комбинацией ДНК и белка, или клетками, экспрессирующими представляющий интерес чужеродный антиген. Полученные лимфоциты могут быть получены из любого источника, включая, например, селезенку, лимфатический узел или костный мозг иммунизованного животного.
[000392] В некоторых таких способах, домен VH и/или домен VL являются человеческими (например, когда генетически модифицированное F0-поколение отличного от человека животного является гомозиготно гуманизированным как у IgH, так и Igκ), домен VH и/или домен VL клонируют в рамке с последовательностью нуклеиновой кислоты, кодирующей константный участок человека, и образующиеся антигенсвязывающие белки являются полностью антителами человека.
[000393] Получение антигенсвязывающих белков против представляющего интерес чужеродного антигена, полученного в генетически модифицированном F0 поколении отличных от человека животных, описанных в данном документе (т.е. генетически модифицированный в первом геномном локусе-мишени), обычно увеличивается по сравнению с контрольными отличными от человека животными (т.е., которые являются диким типом в первом геномном локусе-мишени). То есть антигенсвязывающие белки против представляющего интерес чужеродного антигена, полученного в генетически модифицированном F0 поколении отличных от человека животных, описанных в данном документе (т.е. генетически модифицированный в первом геномном локусе-мишени), обычно имеют более высокий титр, чем антигенсвязывающие белки, полученные после иммунизации контрольного отличного от человека животного, которое является диким типом в первом геномном локусе-мишени. Например, титр может быть по меньшей мере в 1,5 раза, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз или в 10 раз выше. Термин титр антител включает в себя измерение концентрации специфического антитела, присутствующего в сыворотке. Например, титр антител может быть измерением количества антител, продуцируемых организмом, которые распознают конкретный эпитоп, экспрессированный как инверсия наибольшего разведения, которая все еще дает положительный результат. Аналогично, более разнообразный репертуар антигенсвязывающих белков против чужеродного антигена, представляющего интерес, обычно получают после иммунизации генетически модифицированного F0-поколения отличных от человека животных с интересующим чужеродным антигеном, по сравнению с антигенсвязывающими белками, полученными после иммунизации контрольного отличного от человека животного, которое являются диким типом в первом геномном локусе-мишени. Контрольное отличное от человека животное относится к отличному от человека животному, которое является диким типом в первом геномном локусе-мишени. Предпочтительно, единственное существенное различие между генетически модифицированным F0 поколением отличного от человека животного, и контрольным животным является статусом первого геномного локуса-мишени. Например, предпочтительно, чтобы контрольное животное не имело других существенных генетических модификаций и являлось одним и тем же видом отличного от человека животного, являлось одной и той же линией отличного от человека животного, имело тот же генетический фон (отличный от первого геномного локуса-мишени), и было того же возраста, что и генетически модифицированное F0 поколение отличного от человека животного.
[000394] Все патентные заявки, веб-сайты, другие публикации, номера доступа и тому подобное, упомянутые выше или ниже, включены в качестве ссылки во всей их полноте для всех целей в той же степени, как если бы каждый отдельный элемент был конкретно и индивидуально указан, чтобы быть включенным путем ссылки. Если разные версии последовательности связаны с номером доступа в разное время, подразумевается версия, связанная с номером доступа, в эффективную дату подачи этой заявки. Эффективная дата подачи означает более раннюю дату фактической подачи или дату подачи приоритетного приложения, относящуюся к номеру доступа, если это применимо. Аналогичным образом, если разные версии публикации, веб-сайта или тому подобного публикуются в разное время, подразумевается версия, которая была недавно опубликована в дату фактической подачи заявки, если не указано иное. Любая функция, шаг, элемент, вариант осуществления изобретения или аспект изобретения могут использоваться в сочетании с любым другим, если специально не указано иное. Хотя настоящее изобретение было описано более подробно с помощью иллюстрации и примера для ясности и понимания, будет очевидно, что некоторые изменения и модификации могут быть реализованы в рамках прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[000395] Нуклеотидные и аминокислотные последовательности, перечисленные в списке сопровождающих последовательностей, показаны с использованием стандартных сокращений для нуклеотидных оснований и трехбуквенного кода для аминокислот. Нуклеотидные последовательности следуют стандартному соглашению, начинающемуся с 5'-конца последовательности и идущему вперед (т.е. слева направо в каждой строке) до 3'-конца. Показана только одна цепь каждой нуклеотидной последовательности, но понимается, что комплементарная цепь включает любую ссылку на отображаемую цепь. Аминокислотные последовательности ел еду ют стандартному соглашению, начинающемуся с аминоконца последовательности и идущей вперед (т.е. слева направо в каждой линии) на карбоксильный конец.


ПРИМЕРЫ
Пример 1. Генерирование эмбриональных стволовых клеток КО (ЭС), эмбрионов на одноклеточной стадии, и мышей для производства антител с использованием спаренных направляющих РНК, нацеленных на старт и стоп кодоны.
[000397] Технологии VELOCIGENE® и VELOCIMOUSE® позволили создать мышь VELOCIMMUNE®, которая позволяет производить полностью человеческие антитела. Мыши VELOCIMMUNE® экспрессируют каппа (Igκ) и тяжелые (IgH) цепи иммуноглобулина, в которых полностью гуманизированный вариабельный участок соединен с константным участком мыши. Поскольку функционально важные участки белков, как правило, сохраняются у разных видов, иммунологическая толерантность к аутоантигенам часто создает проблему для получения антител к этим ключевым эпитопам. Традиционно, мышей VELOCIMMUNE® разводили для F0 мышей, несущих гетерозиготную нокаутную мутацию в представляющем интерес аутоантигене-мишени, для преодоления иммунологической толерантности. Чтобы получать трижды гомозиготных мышей (гомозиготных нулевых по интересующей мишени и гомозиготных гуманизированных как IgH, так и Igκ), подходящих для иммунизации, потребовалось еще два поколения разведения и от 15 до 16 месяцев общего времени. Для ускорения этого процесса, были получены эмбриональные стволовые клетки (ЭС) VELOCIMMUNE®, которые могут быть нацелены для создания нулевых аллелей в представляющей интерес мишени. Однако, к сожалению, для получения гомозиготных нулевых клонов ЭС клеток VELOCIMMUNE® требуются последовательные шаги нацеливания, что отнимает много времени. Что еще более важно, не только клоны ЭС клеток VELOCIMMUNE® традиционно демонстрируют небольшую способность продуцировать полностью полученное на основе ЭС-клеток F0 VELOCIMICE® (то есть полностью полученное на основе ЭС-клеток F0 поколение мыши, полученное от инъекции ЭС-клеток в эмбрионы на 8-клеточной стадии) в КО для проектов иммунизации (см., например, таблицу 2), но также последовательно нацеленные клоны ЭС клеток VELOCIMMUNE® демонстрируют еще более уменьшенную способность продуцировать полностью полученное на основе ЭС-клеток FO VELOCIMICE® (то есть полностью полученное на основе ЭС-клеток F0 поколение мыши, полученное от инъекции ЭС-клеток в эмбрионы на 8-клеточной стадии). См., например, таблицу 3 (сравнивается эффективность продукции VELOCIMOUSE® с использованием типичной ЭС клеточной линии, используемой для получения нацеленных генетических модификаций и VELOCIMICE® (F1H4 ЭС клеточной линии) и двух ЭС клеточных линий с универсальной легкой цепью (ULC) и VELOCIMMUNE® ЭС клеточной линии (VI-3Adam6)).
[000398]
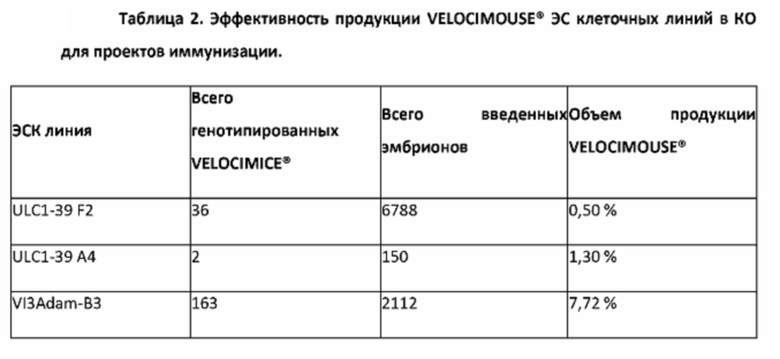
[000398]
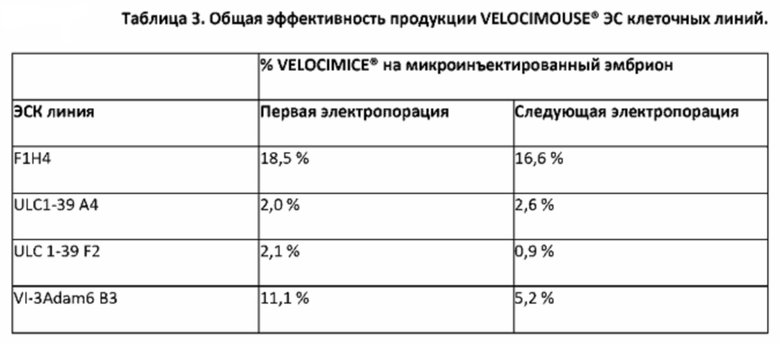
[000400] Для того чтобы получать мышей с пониженной толерантностью к чужеродным антигенам-мишени человека, которые представляют интерес, мы разработали способ быстрого получения ЭС клеток VELOCIMMUNE®, содержащих функциональный эктопический ген мыши Adam6, которые гомозиготны для нулевых аллелей в представляющей интерес мишени в одном этапе модификации. Мы оптимизировали процедуру для использования пары направляющих РНК для эффективного создания больших делеций на обоих аллелях представляющей интерес мишени в ЭС клетках VELOCIMMUNE®, содержащих функциональный эктопический ген мыши Adam6, тем самым устраняя необходимость разработки и создания больших направленных векторов (LTVECs). Используя этот подход, FO VELOCIMICE®, гомозиготные по нулевой аллели в представляющей интерес мишени и готовое к иммунизации, может быть получено через 4-5 месяцев вместо 15-16 месяцев (мышиные щенки, гомозиготные по нулевой аллели в представляющей интерес мишени, могут быть получены через ~ 3 месяца, но затем подвергаются в возрасте 4-5 недель иммунизации). В этом эксперименте спаренные направляющие РНК были спроектированы и клонированы для нацеливания на аутоантигены, ортологичные для этих представляющих интерес чужеродных антигенов-мишеней для гомозиготной делеций. Направляющие РНК были предназначены для нацеливания на участки старт и конца кодона эндогенных генов, кодирующих аутоантигены. Для некоторых целей были разработаны две пары гРНК (v1 и v2). Процесс конструирования направляющей РНК описан в нижеприведенных Материалах и Методах. Направляющие РНК были электропорированы или нуклеотидированы вместе с Cas9 в ЭС-клетки, полученные от мышей VELOCIMMUNE®, содержащих функциональный эктопический ген мыши Adam6 (VI-3 Adam6) мышей (замененный эндогенный вариабельный участок тяжелой и легкой цепи иммуноглобулина мыши с соответствующей ДНК человека вместе с регенерированным мышиным геном Adam6) или мышей с универсальной легкой цепью (ULC 1-39) (мышей с одним перестроенным вариабельным участком легкой цепи иммуноглобулина человека, которая является генным сегментом Vκ1-39/J человека). См. Фигуру 32. Протоколы электропорации и нуклеофекции описаны в нижеприведенных Материалах и Методах. В некоторых экспериментах, Cas9 и спаренные направляющие РНК были электропорированы вместе с большим направленным вектором (LTVEC), нацеленным на эндогенный ген, кодирующий аутоантиген для делеций (см., например, фигуру 4). Сравнительная эффективность делеций наблюдалась с использованием CRISPR/Cas9 (СС9) с или без LTVEC (см. Таблицу 4).
[000401]
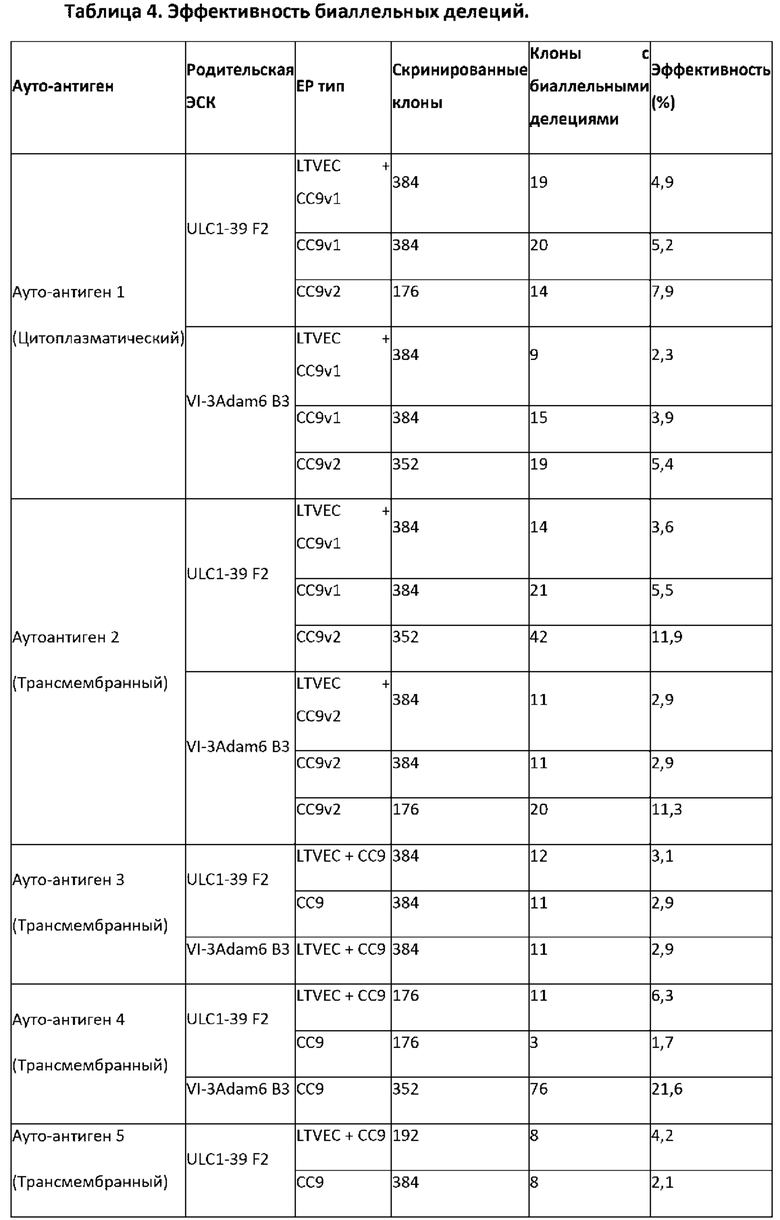
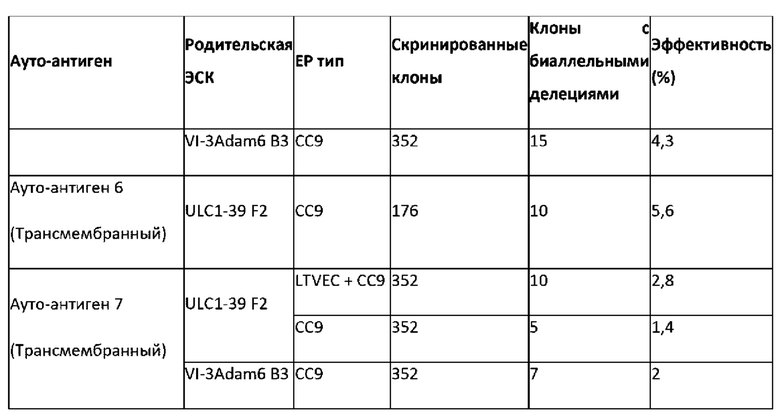
[000402] Временна шкала от начала эксперимента (дизайн гРНК) до конца (генотипированное F0 мыши с гомозиготным нулевым аллелем в отношении эндогенного гена, кодирующего аутоантиген) составляла приблизительно 3 месяца. В качестве примера, временная шкала для получения F0 мышей гомозиготных нулевых в отношении аутоантигена, соответствующего Мишени 1 (ауто-антиген 1), показан в таблице 5.
[000403]
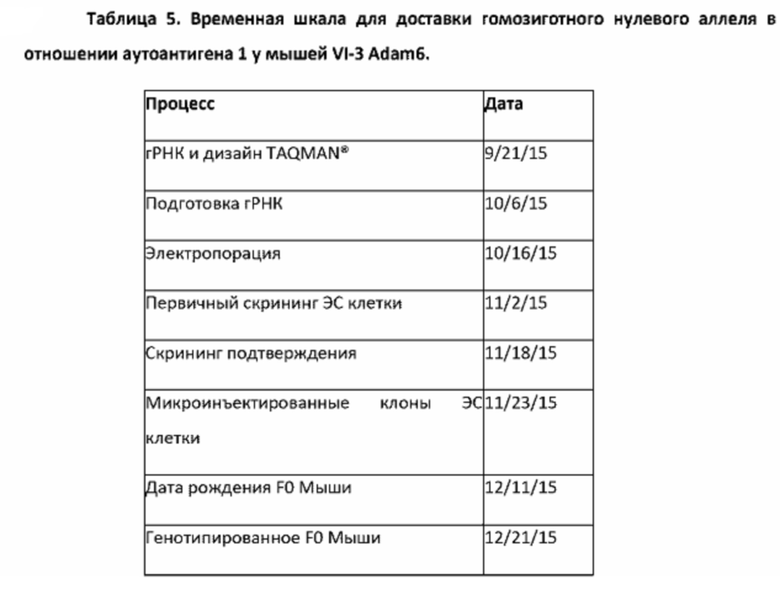
[000404] Было проведено несколько экспериментов с целью нацеливания на различные аутоантигены для делеции в эмбриональных стволовых клетках (ЭС) у мышей VI-3-Adam6 и ULC 1-39 с использованием спаренных направляющих РНК, нацеленных на участки старт и стоп кодона каждого аутоантигена, в одиночку или вместе с большим направленным вектором (LTVEC), нацеленным на аутоантиген для делеции. Cas9 и направляющие РНК вводили в ЭС-клетки в форме ДНК. Как показано в таблице 6 и на фигуре 28, делеция (т.е. разрушение) была достигнута для всех тестируемых аутоантигенов с размерами делеции в диапазоне между 0,1 т.п.о. до 165 т.п.о., и была отрицательная корреляция между размером делеции (т.е. разрушением) и эффективностью производства мышат, несущих делеции (т.е. разрушения). Биаллельное разрушение также может быть достигнут для гораздо больших размеров. Например, мы достигли биаллельного разрушения для размера делеции ~ 400 т.п.о. Аналогично, биаллельное разрушение ~ 900 т.п.о. - 1 Мб в локусе IgH мыши был достигнут за счет использования двух 5'-гРНК и двух 3'-гРНК и вектора репарации с эффективностью ~ 1,2% (данные не показаны).
[000405]
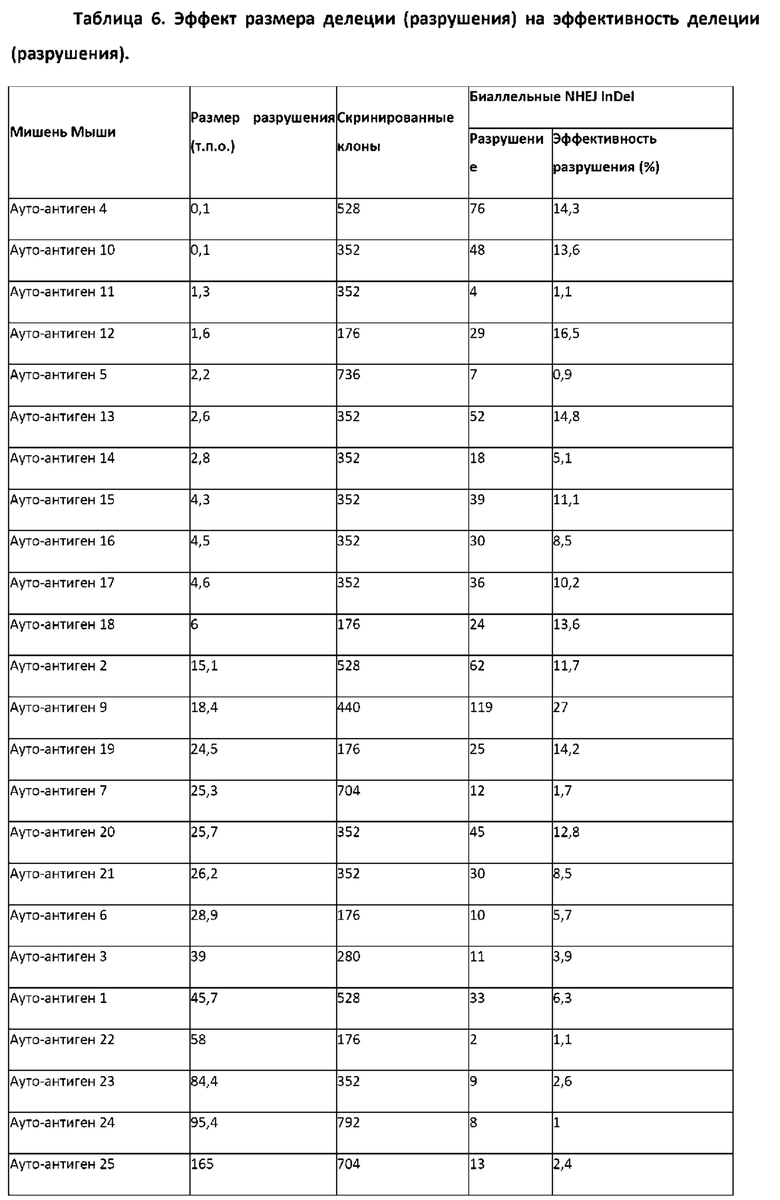
[000406] Подобно процедуре с использованием ЭС-клеток, для того чтобы получать мышей с пониженной толерантностью к чужеродным антигенам-мишени человека, которые представляют интерес, мы разработали способ быстрого получения эмбрионов на одноклеточной стадии, которые гомозиготны для нулевых аллелей в представляющей интерес мишени в одном этапе модификации. Мы оптимизировали процедуру для использования пары направляющих РНК для эффективного создания больших делеций на обоих аллелях представляющей интерес мишени в эмбрионах на одноклеточной стадии, тем самым устраняя необходимость разработки и создания больших направленных векторов (LTVEC). Кроме того, использование эмбрионов на одноклеточной стадии может повысить эффективность производства целевых мышей по сравнению с использованием ЭС клеточных линий (например, ЭС клеточных линий ULC 1-39). Используя этот подход, F0 мыши гомозиготные по нулевой аллели в представляющей интерес мишени, которые готовы к иммунизации, может быть получено через 4-5 месяцев (мышиные щенки F0, гомозиготные по нулевой аллели в представляющей интерес мишени, могут быть получены через ~ 3 месяца) вместо 15-16 месяцев. В этом эксперименте спаренные направляющие РНК были спроектированы и клонированы для нацеливания на аутоантигены, ортологичные для этих представляющих интерес чужеродных антигенов-мишеней для гомозиготной делеций. Направляющие РНК были предназначены для нацеливания на участки старт и конца кодона эндогенных генов, кодирующих аутоантигены. Процесс конструирования направляющей РНК описан в нижеприведенных Материалах и Методах. Вкратце, супер-овулированные самки спаривались с племенными самцами для получения эмбрионов. Если бы имелось только несколько самцов, использовалось оплодотворение in vitro. Возраст самок составлял 3-16 недель, ооциты на донора варьировались от 15-46 (медиана = 32 ооцита), а зиготы на донора варьировались от 5-32 (медиана = 15 зигот). Направляющие РНК подвергали микроинъекции (цитоплазматическая инъекция) вместе с мРНК Cas9 в эмбрионах на одноклеточной стадии от мышей VELOCIMMUNE®, содержащих функциональный эктопический ген мыши Adam6 (VI-3 Adam6) мышей (замененный эндогенный вариабельный участок тяжелой и легкой цепи иммуноглобулина мыши с соответствующей ДНК человека вместе с регенерированным мышиным геном Adam6) или мышей с универсальной легкой цепью (ULC 1-39) (мышей с одним перестроенным вариабельным участком легкой цепи иммуноглобулина человека, которая является генным сегментом Vκ1-39/J κ5 человека). Количество инъектированных эмбрионов варьировалось от 99-784 (медиана = 334), процент выживших эмбрионов варьировался от 56% до 73% (медиана = 63%), количество перенесенных эмбрионов варьировалось от 59-442 (медиана = 226), количество щенков для каждого проекта варьировалось от 10-46 (медиана = 32), а коэффициент рождаемости варьировался от 2%-59% (медиана = 13%). Как показано в таблице 7 и на фигуре 29, живые щенки, имеющие целевую делеция (т.е. разрушение) были получены для всех тестируемых аутантигенов с размерами делеции в диапазоне между 0,1 т.п.о. до 94 т.п.о., и была отрицательная корреляция между размером делеции (т.е. разрушением) и эффективностью производства мышат, несущих делеции (т.е. разрушения).
[000407]
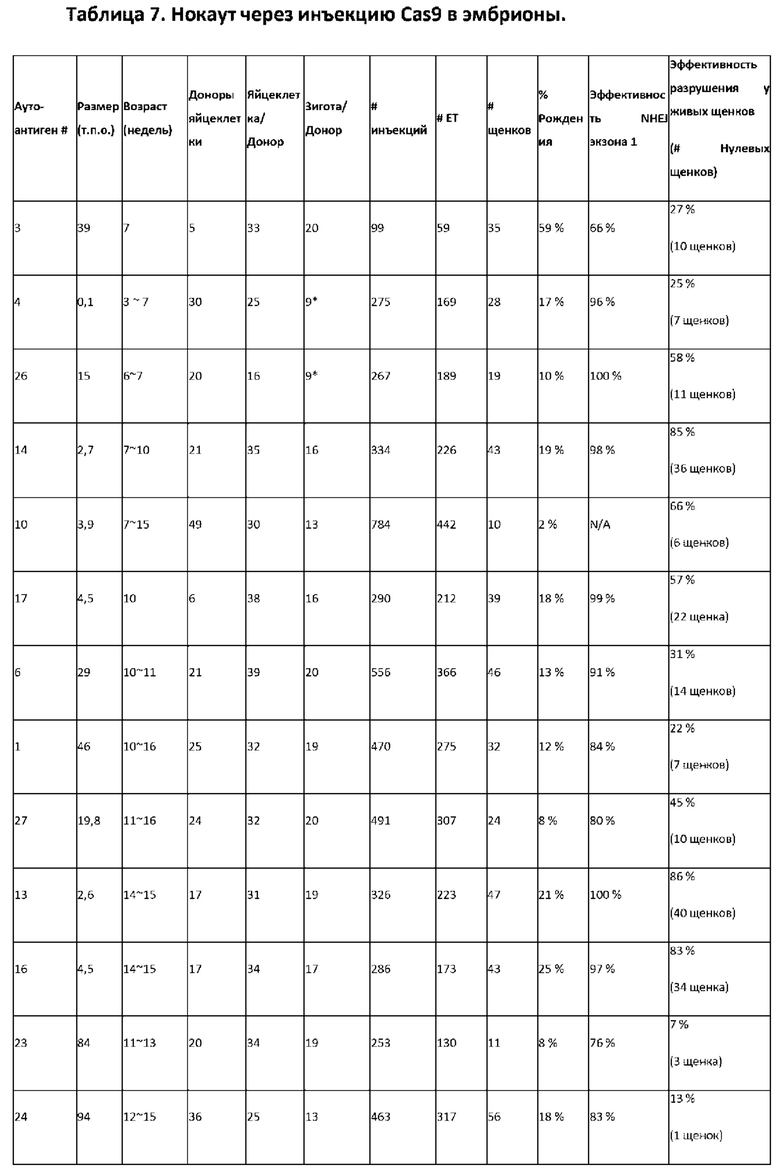
*Эко или Триада (вместо парного естественного спаривания
Материалы и методы
[000408] Дизайн анализа направляющей РНК и TAQMAN®: Направляющие РНК (гРНК) длиной 23 пары оснований были сконструированы на основе кодирующей последовательности консенсуса (CCDS) для каждого локуса в формате 5'  , где N представляет собой любой нуклеотид. Последние три нуклеотида (NGG) представляют собой мотив, прилегающий к протоспейсеру (РАМ), а двухцепочечное расщепление ДРК с тупым концом ферментом Cas9 имеет 3 нуклеотида 5' в NGG (между остатками нижнего регистра выше). ГРНК были выбраны на основе оценок, полученных из различных поисковых систем гРНК, включая crispr.mit.edu, crispr.med.harvard.edu/sgRNAScorer/ и broadinstitute.org/rnai/public/analysis-tools/sgrna-design. Вкратце, 100-150 п.о. последовательности непосредственно 5' и 3' старт ATG и 100-150 п.о. непосредственно 5' и 3' стоп-кодона соответственно анализировали на гРНК на обеих цепях ДНК. Две гРНК (перекрывающиеся каждая друг с другом не более чем на 25%) вблизи ATG и две гРНК около стоп-кодона с высокими оценками из всех используемых поисковых систем были дополнительно опрошены на предмет уникальности в геноме мыши и ни одной вариации нуклеотидов (SNV) в Универсальной легкой цепи (ULC или общая легкая цепь), мыши VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (VI-3-Adam6), и эмбриональные стволовые клетки (ЭСК) VGB6 VELOCIGENE® мыши. Если не были найдены гиды с высокими оценками с использованием вышеприведенных спецификаций поиска, была осуществлен поиск дополнительной последовательности вокруг ATG и стоп-кодонов до тех пор, пока не будут найдены два высококачественных гида.
, где N представляет собой любой нуклеотид. Последние три нуклеотида (NGG) представляют собой мотив, прилегающий к протоспейсеру (РАМ), а двухцепочечное расщепление ДРК с тупым концом ферментом Cas9 имеет 3 нуклеотида 5' в NGG (между остатками нижнего регистра выше). ГРНК были выбраны на основе оценок, полученных из различных поисковых систем гРНК, включая crispr.mit.edu, crispr.med.harvard.edu/sgRNAScorer/ и broadinstitute.org/rnai/public/analysis-tools/sgrna-design. Вкратце, 100-150 п.о. последовательности непосредственно 5' и 3' старт ATG и 100-150 п.о. непосредственно 5' и 3' стоп-кодона соответственно анализировали на гРНК на обеих цепях ДНК. Две гРНК (перекрывающиеся каждая друг с другом не более чем на 25%) вблизи ATG и две гРНК около стоп-кодона с высокими оценками из всех используемых поисковых систем были дополнительно опрошены на предмет уникальности в геноме мыши и ни одной вариации нуклеотидов (SNV) в Универсальной легкой цепи (ULC или общая легкая цепь), мыши VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (VI-3-Adam6), и эмбриональные стволовые клетки (ЭСК) VGB6 VELOCIGENE® мыши. Если не были найдены гиды с высокими оценками с использованием вышеприведенных спецификаций поиска, была осуществлен поиск дополнительной последовательности вокруг ATG и стоп-кодонов до тех пор, пока не будут найдены два высококачественных гида.
[000409] Анализы TAQMAN® были спроектированы с использованием PRIMER EXPRESS® с помощью APPLIED BIOSYSTEMS® Custom TAQMAN® MGB-зондов, так что последовательности зондов всегда перекрывали участки среза cas9 для каждого гида. Некоторые анализы TAQMAN® были также получены с использованием зондов Biosearch Technologies Dual Labeled BHQ® (biosearchtech.com/ProbelTy/design/inputsequences.aspx). Эти анализы служат анализом потери аллеля, если Cas9 разрезает последовательность, связанную с помощью гида. Все анализы были скринированы для SNV. Гиды были названы следующим образом: mGU и mGU2 (вверх по ходу транскрипции для мышиного геномного); и mGD и mGD2 (вниз по ходу транскрипции для мышиного геномного). Анализы TAQMAN® были названы следующим образом: mTGU и mTGU2 (для анализов TAQMAN®, охватывающих mGU и mGU2 соответственно) и mTGD и mTGD2 (для анализов TAQMAN®, охватывающих mGD и mGD2 соответственно). Дополнительный анализ TAQMAN® был спроектирован примерно на равном расстоянии от гидов mGU/mGU2 и mGD/mGD2 в середине локуса, который был разрушен, называемый mTM (для мышиного TAQMAN® Middle). Этот анализ потери аллеля определяет, происходит ли делеция участка, фланкированного с помощью гида (разрушения).
[000410] Дальнейшие анализы TAQMAN® были спроектированы на 200-800 п.о. вверх по ходу транскрипции mGU/mGU2 (в зависимости от того, что больше всего 5') и вниз по ходу транскрипции mGD/mGD2 (в зависимости от того, что больше всего 3'). Эти анализы назывались retU (для удерживания вверх по ходу транскрипции) и retD (для удерживания вниз по ходу транскрипции) соответственно. Эти анализы определяют наибольший допустимый размер делеции и были проведены для скрининга на SNV, как указано выше.
[000411] Клонирование направляющей РНК: Дуплексы направляющей РНК были спроектированы и синтезированы. Поскольку промотор U6 предпочитает начинать с гуанина, гуанин добавляли к 5', если последовательность уже не начиналась с гуанина. Лиофилизированные дуплексы гРНК ресуспендировали до 100 мкМ со стерильной водой, и в микроцентрифужной пробирке 0,5 мл проводили следующую реакцию лигирования: 14,5 мкл воды, сертифицированной для ПЦР; 2 мкл 10Х Т4 ДНК-лигазный буфер (NEB), 1 мкл pMB_огРНК_BsmBI Вектор (~ 60 нг), 1 мкл гРНК-дуплекса (100 мкМ) и 1,5 мкл ДНК-лигазы Т4 (40 ед/мкл, NEB). Реакцию лигирования затем инкубировали в течение 1 часа при комнатной температуре и затем использовали в реакции трансформации в клетках TOP10. Колонии затем отбирали и проверяли с помощью ПЦР и сиквенирования.
[000412] Протокол электропорации ВТХ®: Направляющую смесь готовили следующим образом: 10 мкг каждой плазмиды огРНК и 5 мкг плазмиды дикого типа Cas9. В день электропорации клетки питали ЭС-средой за полчаса до часа до процесса электропорации. Клетки затем дважды промывали PBS и добавляли 0,25% трипсин-ЭДТА и клетки инкубировали при 37°С в течение 15 минут. Планшет(ы) удаляли после инкубации, добавляли ЭС-среду для нейтрализации трипсина, клетки осторожно пипетировали 4 раза, чтобы разбить клеточные агрегаты, и переносили на желатинированный планшет(ы), и клетки инкубировали в течение 20 минут при 37°С. Планшет(ы) встряхивали и осторожно промывали один раз средой, и все клетки затем переносили в 15-мл пробирки, которые затем вращали в течение 5 минут при 1200 об/мин. Все осадки объединяли в 10 мл PBS и клетки подсчитывали и при необходимости разбавляли. Объем 20 мкл клеточной суспензии добавляли к стеклу CELLOMETER® и подсчитывали с использованием счетчика жизнеспособности клеток Nexcelom CELLOMETER AUTO Т4™. Затем пробирки центрифугировали в течение 5 минут при 1200 об/мин. Осадок ресуспендировали в буфере для электропорации, используя 7,5×106 клеток для каждой электропорации. Клетки добавляли к направляющей смеси в микроцентрифужных пробирках с объемом в каждой пробирке 120 мкл. Пробирки перемешивали 2-3 раза и переносили в 96-луночный кювет для электропорации (зазор 2 мм) с использованием насадок с широкими отверстиями, и кювету герметизировали. Электрический импульс подавался при 700 В, 400 Ом, 25 мкФ с использованием электропоратора ВТХ® ЕСМ® 630. Затем кювету инкубировали на льду в течение 10 минут.Электропорированные клетки затем переносили в планшет с глубокой лункой (добавляли 0,8 мл/лунка, в то время как кювета находилась на льду). Клетки высевали на 2×15 см желатинизированные планшеты/проект с 25 мл среды в каждом планшете. Переходный отбор начинался с 1 мкг/мл пиромицина в течение 3 дней и среду заменяли на неселективную среду до 10 дней после электропорации, после чего колонии собирали.
[000413] Протокол электропорации NUCLEOFECTOR®: В день электропорации клетки питали ЭС-средой за полчаса до часа до процесса электропорации. Клетки затем дважды промывали 10 мл PBS и добавляли 2 мл 0,25% трипсин-ЭДТА и клетки инкубировали при 37°С в течение 15 минут. Планшет(ы) удаляли после инкубации, добавляли 8 мл ЭС-среды для нейтрализации трипсина, клетки осторожно пипетировали 4 раза, чтобы разбить клеточные агрегаты, и переносили на желатинированный планшет(ы), и клетки инкубировали в течение 20 минут при 37°С. Планшет(ы) встряхивали и осторожно промывали один раз средой, и все клетки затем переносили в 15-мл пробирки, которые затем вращали в течение 3 минут при 90 X g. Осадки ресуспендировали в 10 мл PBS и клетки подсчитывали и при необходимости разбавляли. Объем 20 мкл клеточной суспензии добавляли к стеклу CELLOMETER® и подсчитывали с использованием системы Nexcelom Vision CBA. В общей сложности 2×106 клеток были разделены на аликвоты и центрифугированы в пробирках EPPENDORF® в течение 3 минут при 90 × g. Затем осадок ресуспендировали в буфере LONZA® Р4, смешанном с 5 мкг плазмиды Cas9 дикого типа и 2,5 мкг каждой плазмиды огРНК в общем объеме 100 мкл. Затем клетки переносили в большую кювету LONZA®. Электрический импульс подавался с использованием LONZA® 4D-NUCLEOFECTOR™ и программы СР-105. Добавляли объем 400 мкл свежей среды ЭС, и клетки переносили в новую пробирку EPPENDORF® для перемешивания. Затем клетки высевали на желатинизированные чашки размером 2×10 см с 10 мл среды ЭС. Переходный отбор начинали через 2 дня пост-ЕР с пиромицином (1,5 мкг/мл) в течение 2 дней. После отбора использовалась неселективная среда до 10 дней после электропорации, после чего отбирались колонии.
[000414] Скрининг: Разрезание с помощью Cas9 с помощью направляющих mGU, mGU2, mGD и mGD2 оценивали с использованием анализов TAQMAN® mTGU, mTGU2, mTGD и mTGD2. Разрезание по одному аллелю, но не по-другому, определяли, когда количество копий уменьшилось с двух (родительская не модифицированная контрольная ДНК) до одной. Гомозиготное расщепление по Cas9 определяли, когда анализы давали число копий ноль. Поскольку разрезание Cas9 рядом с ATG и стоп-кодоном не гарантирует удаления промежуточной последовательности, гетерозиготное и гомозиготное разрушение оценивали, когда числа анализов mTM переходили от двух (родительских) к одному или нулю соответственно. Наконец, внешний лимит размера делеций был установлен с использованием анализов retU и retD. Анализы удерживания должны были остаться интактными (удержанными) с копией номер два, как родительскими.
[000415] Клоны ЭСК, полученные после электропорации с mGU, mGU2, mGD и mGD2 или какой-либо их комбинацией, сначала подвергали скринингу на расщепление Cas9 и/или разрушение с использованием анализов mTGU, mTGU2, mTM, mTGD и mTGD2 или какой-либо их комбинации. Колонии с нулевым числом копий для всех анализов затем подвергали дополнительному скринингу с использованием retU и retD, и только колонии с числом копий retU и retD, равным двум, были переданы для дальнейшего анализа.
[000416] Первичный и повторный скрининг эмбриональных стволовых клеток мыши: Модифицированные колонии mESC подвергали скринингу на гомозиготную делецию локуса-мишени с помощью мультиплекса ПЦР TAQMAN® LOA (Loss-Of-Allele) (4-плексная). Для первого прохода скрининга (первичного), ДНК 176 уникальных клонов выделяли в колонках 1-11 двух 96-луночных планшетов. Колонка 12 была заполнена ДНК ЭС клеток дикого типа, которая была ранее выделена из той же родительской линии mESC и использовалась в качестве калибратора для числа копий; так что каждая ДНК-пластина для скрининга содержит 88 модифицированных клонов и 8 калибровочных клонов. ДНК каждого клона распределяли в четырех экземплярах на 384-луночный планшет и анализировали на гомозиготный LOA по трем участкам локуса-мишени в одной реакционной смеси, с помощью зондов TAQMAN® в FAM, VIC, ABY и Quasar, используемых для одновременного определения числа копий в относительных участках вверх, по средине и вниз по ходу транскрипции гена-мишени с Quasar, амплифицирующим Wnt-2b для калибровки по концентрации ДНК. После определения числа копий до восьми клонов «наилучшего» качества с нулевыми копиями всех трех анализов, охватывающих локус-мишень, были отобраны для последующего роста расширением, повторной посадки и подвергнуты анализу расширенного репертуара числа копий (подтверждение). Каждый размноженный клон высевали и выделяли ДНК в шести повторностях, занимая первые шесть колонок одного ряда (А-Н) 96-луночного планшета, предоставляя тем самым дополнительный генетический материал и повторы данных для дополнительных используемых анализов. Анализы, используемые при первичном скрининге, повторяли для подтверждения первичного генотипа, а анализы удерживания использовали для определения степени делеций. Анализы удерживания были расположены непосредственно вверх и вниз по ходу транскрипции от участка, на который нацелена делеция, и обычно равны двум копиям. Дополнительные анализы были использованы для подтверждения родительского генотипа ЭСК в Иммуноглобулин тяжелый (IgH) и каппа (Igκ) мышиных локусах (LOA для IgH и Igκ мыши, и GOA для гуманизации).
[000417] Сиквенирование следующего поколения (NGS) для идентификации Cas9-опосредованных аллелей: Небольшую биопсию хвоста у F0 Cas9-модифицированных мышей, экстрагировали на геномную ДНК с использованием стандартных способов солевой преципитации. Для каждого локуса-мишени были разработаны ПЦР-праймеры со следующими ограничениями: (1) размер ампликона составляет между 280-380 п.о. в длину; (2) сайты расщепления гРНК центрированы в продукте ПЦР с праймерами на расстоянии по меньшей мере 35 п.о. для размещения более крупных вставок/делеций (инделей), (3) длина праймера составляет 22-25 п.о. с температурой плавления (Tm) между 62-65°С, с зажимом CG 2 п.о. на 3 'конце; и (4) праймеры проверяются по геномным последовательностям на вариации мононуклеотида линии BALB/c, C57BL/6 или 129. Затем к локус-специфическим последовательностям добавляли специфические универсальные адаптерные последовательности, предоставленные Illumina®. Полученные ампликоны визуализировали на агарозных гелях и очищали/нормализовали с использованием набора для нормализации планшетов Thermo Fisher Scientific® SequalPrep™. Продукты количественно определяли с помощью Qubit®, и 1 нг каждого продукта использовали в качестве матрицы для штрих-кодирования с помощью дополнительной ПЦР с праймерами Nextera® и ПР мастер-смесью Nextera®. ПЦР проводили в термоциклере при 72°С в течение 3 минут, 95°С в течение 30 секунд, 12 циклов {95°С в течение 10 секунд, 55°С в течение 30 секунд, 72°С в течение 30 секунд), 72°С в течение 5 минут, и выдерживали 10°С. Полученные продукты ПЦР со штрих-кодом очищали с помощью шариков Ampure® ХР, нормализовали с помощью нормализующих шариков Illumina® в наборе Nextera® XT, объединяли и загружали в MiSeq™ для сиквенирования и сбора необработанных данных.
[000418] Микроинъекция эмбрионов мыши на 8-клеточной стадии: Приблизительно 2 мл стандартной среды для клеток ЭС (- LIF) добавляли в стерильную крышку для культуральной чашки диаметром 35 мм и покрывали отфильтрованным минеральным маслом. ЭС клетки высевали на нижнюю половину чашки с помощью ротовой пипетки. Криоконсервированные SW эмбрионы-хозяева на 8-клеточной стадии были депонированы к верхней части чашки. Чтобы свести к минимуму повреждение эмбриона во время инъекции, кончик новой инъекционной пипетки был притуплен путем легкого удара по удерживающей пипетке. ЭС-клетки выбирали на основе морфологии и яркости и собирали в инъекционную пипетку. Эмбрион был помещен на удерживающую пипетку так, чтобы пространство между бластомерами присутствовало в положении на 3 часа. ЭС клетки вводили в перивителлиновое пространство эмбриона с помощью осторожного прокалывания зоны в положении на 3 часа и осаждая клетки в этом месте. Всего 7-9 ЭС клеток на эмбрион было введено. Инъектированные эмбрионы помещали в 35-мм чашку, содержащую каплю культуральной среды для эмбрионов KSOM, покрытой отфильтрованным минеральным маслом, и эмбрионы культивировали в течение ночи при 37,0°С с 7,5% CO2. Эмбрионы были перенесены хирургическим путем в псевдобеременных самок на следующее утро.
Пример 2 Генерирование КО ЭС-клеток и мышей для продуцирования антител с использованием многих направляющих РНК, нацеленных на участок стартового кодона.
[000419] В другом эксперименте по получению мышей с пониженной толерантностью к представляющим интерес чужеродным антигенам-мишеням были сконструированы и клонированы три направляющие РНК для нацеливания аутоантигенов, ортологичных к этим чужеродным антигенам-мишеням для гомозиготной делеции. Три перекрывающиеся направляющие РНК были разработаны для нацеливания на перекрывающиеся участки, охватывающие старт кодон эндогенного гена, кодирующего аутоантиген (см. Фигуру 5). Направляющие РНК подвергали электропорации или нуклеофекции вместе с Cas9 в клетки ЭС, полученные от мышей с универсальной легкой цепью (ULC 1-39) (мышей, содержащих в своей зародышевой линии: (i) вставку в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к мыши перестроенной последовательности Vκ/Jκ, содержащей: одну последовательность Vκ зародышевой линии человека; и одну последовательность Jκ зародышевой линии человека, причем перестроенная последовательность Vκ/Jk функционально связана с эндогенным константным участком к мыши; и (ii) вставку в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанных с константным участком эндогенной тяжелой цепи иммуноглобулина мыши). В некоторых экспериментах, Cas9 и три направляющие РНК были электропорированы вместе с большим направленным вектором (LTVEC), нацеленным на эндогенный ген, кодирующий аутоантиген для делеции (см., например, фигуру 5).
Использование LTVEC в сочетании с CRISPR/Cas9 (СС9) значительно увеличило шансы на получение биаллельной мутации в локусе-мишени (см. Таблицу 8), но нацеливание с помощью LTVEC и CRISPR/Cas9 требует гораздо большего скрининга, чтобы исключить ложно-позитивные результаты.
[000420]
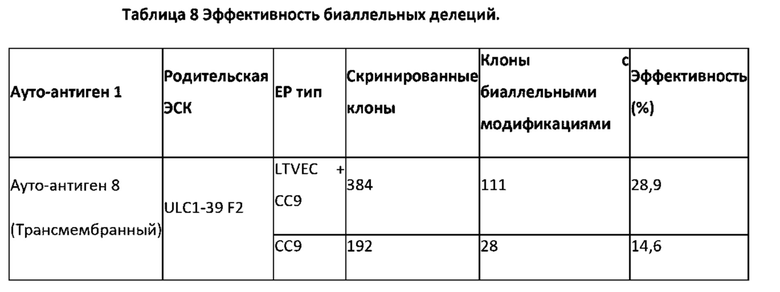
Пример 3 Иммунизация мышей и анализ сывороточных антител в ответ на иммуногены.
Иммунизация
[000421] Мыши VELOCIMMUNE®, содержащие функциональный эктопический ген Adam6 мыши (VI-3), мыши с универсальной легкой цепью (ULC 1-39) (мыши, содержащие в своей зародышевой линии: (i) вставку в эндогенный локус вариабельного участка легкой цепи иммуноглобулина к мыши перестроенной последовательности Vκ/Jκ, содержащей: одну последовательность Vκ зародышевой линии человека; и одну последовательность Jκ зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком к мыши; и (ii) вставку в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши из множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, функционально связанных с константным участком эндогенной тяжелой цепи иммуноглобулина мыши), KO (нокаут)/VI-3 мыши (мыши VI-3, у которых аутоантигены, ортологичные по отношению к чужеродным антигенам-мишеням, нокаутированы), и мыши KO/ULC 1-39 (мыши ULC 1-39, у которых аутоантигены, ортологичные по отношению к чужеродным антигенам-мишеням, нокаутированы) иммунизировали многочисленными транс-мембранами мишенями, с использованием различных иммуногенов, таких как белки. Преиммунную сыворотку собирали у мышей до начала иммунизации. Мышей бустировали различными путями с различными интервалами времени в общей сложности 3-6 бустов с использованием стандартных адъювантов. У мышей периодически брали кровь и анализировали титры антисыворотки на соответствующие антигены. В примере с мишенью 8 мышей иммунизировали рекомбинантным внеклеточным доменом мишени 8 с Fc-меткой мыши через лапку. Титры были от 2-го взятия крови (после первичного + 6 бустов для ULC 1-39) или от 3-го взятия крови (после первичного + 3 бустов для ауто-антигена-8-KO/ULC 1-39).
Определение антисывороточных титров
[000422] Титры антител в сыворотке против соответствующих иммуногенов определяли с помощью ИФА. Девяносто шести-луночные планшеты для микротитрования (Thermo Scientific®) покрывали соответствующими антигенами-мишенями в натрий-фосфатном буфере (PBS, Irvine Scientific ®) в течение ночи при 2 мкг/мл. Планшеты промывали натрий-фосфатным буфером, содержащим 0,05% Твин 20 (PBS-T, Sigma-Aldrich®), и блокировали 250 мкл 0,5% бычьим сывороточным альбумином (BSA, Sigma-Aldrich®) в PBS в течение 1 часа при комнатной температуре. Планшеты промывали PBS-T. Преиммунные и иммунные антисыворотки серийно разводили в три раза в 0,5% BSA-PBS и добавляли в планшеты в течение 1 часа при комнатной температуре. Планшеты промывали и к планшетам добавляли козью антимышиную IgG-Fc-конскую пероксидазу (HRP) конъюгированную с вторичным антителом (Jackson ImmunoResearch) и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали и проявляли, используя ТМВ/H2O2 в качестве субстрата, путем инкубации в течение 20 минут. Реакцию останавливали кислотой и планшеты считывали на спектрофотометре (Victor®, PerkinElmer®) при 450 нм. Титры антител рассчитывали с использованием программного обеспечения Graphpad PRISM®. В примере с мишенью 8 использованный титровый антиген представлял собой рекомбинантный внеклеточный домен мишени 8 человека с метками Myc-Myc-His.
Результаты
[000423] Гуморальные иммунные ответы у мышей VI-3, ULC1-39, KO/VI-3 и KO/ULC 1-39 были исследованы путем иммунизации различными трансмембранными мишенями. Высокие титры антител были выявлены в линиях KO/VI-3 и KO/ULC 1-39 для всех иммунизированных мишеней. Титры также были высокими у мышей линий VI-3 и ULC 1-39. В целом, однако, линии KO, по-видимому, имели более высокий титр ответа. Полученный иммунный ответ представлен в таблице 9 в виде титров антител, определяемых как обратная величина от самого высокого разведения сыворотки, при котором абсорбция связывания антигена в два раза выше по сравнению с фоном. Следовательно, чем выше число, тем больше гуморальный иммунный ответ на иммуноген. В общей сложности более 16 мишеней были успешно иммунизированы в линиях KO. Моноклональные антитела были выделены с помощью платформ BST и гибридом для мишеней 1 и 9 и с помощью BST для мишеней 4 и 5, и дальнейшая характеристика этих антител продолжается. Данные по выработке антител против одного представляющего интерес человеческого антигена-мишени (мишень 8; ортологичны аутоантигену 8 мыши, выше) у мышей ULC 1-39 и аутоантиген-8-KO/ULC 1-39 представлены в таблице 9 и на фигуре 6. F0 KO мыши давали приблизительно в 5 раз более высокий ответ на заражение белком, чем мыши дикого типа ULC 1-39, на что указывает средний титр антител к мишени. В Таблице 9 также представлено число антител, которые специфически связываются с антигеном (при поглощении, вдвое превышающем поглощение фона). Подобные результаты показаны у мышей ауто-антиген-9-KO/VI-3 по сравнению с мышами VI-3. См. фигуры 30А и 30В. В этом эксперименте мышей дикого типа VI-3-Adam6 и мышей ауто-антиген-9-KO/VI-3-Adam6 иммунизировали либо ДНК, кодирующей мишень 9 дикого типа, интрадермальным путем. Титры определяли с использованием клеток, сконструированных для экспрессии мишени 9 или родительских клеток VI-3T3. Тогда как титры антител у мышей VI-3-Adam6 были не лучше контрольных, титры антител у мышей ауто-антиген-9-KO/VI-3-Adam6 были значительно повышены. Это показывает, что линии KO/VI-3 и KO/ULC вызывают устойчивые иммунные ответы.
[000424]
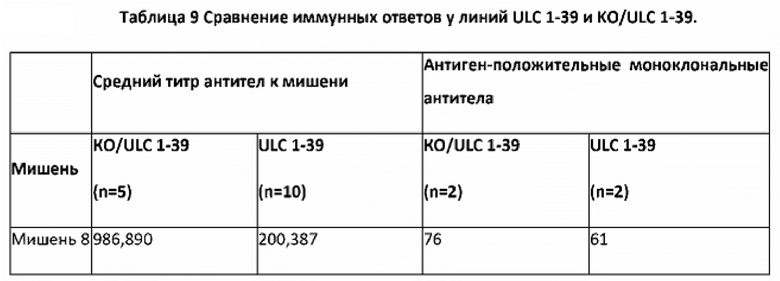
Пример 4 Иммунизация мышей и анализ разнообразия антител и использование V генных сегментов.
[000425] Мышей VELOCIMMUNE®, содержащих функциональный эктопический ген Adam6 мыши (VI-3) и мышей ауто-антиген-3-KO (нокаут)/VI-3, иммунизировали мишенью 3. Преиммунную сыворотку собирали у мышей до начала иммунизации. Мышей бустировали различными путями с различными интервалами времени в общей сложности 3-6 бустов с использованием стандартных адъювантов. У мышей периодически брали кровь и анализировали титры антисыворотки на соответствующие антигены.
[000426] В-клетки выделяли из селезенки мышей VI-3 дикого типа и мышей ауто-антиген-3-KO VI-3, и антитела сиквенировали для определения использования V-гена. ДНК, кодирующая домены VH и VL, была выделена непосредственно из одиночных антиген-позитивных В-клеток и сиквенирована. См., например, US 7582298, включенную в данном документе в качестве ссылки в полном объеме для всех целей. Данные об использовании гена V для мышей VI-3 дикого типа представлены в таблице 10, а данные об использовании гена V для мышей ауто-антиген-3-KO VI-3 представлены в таблице 11. Как показано в таблицах 10 и 11, у мышей ауто-антиген-3-KO VI-3 наблюдалось большее разнообразие в использовании как V генных сегментов тяжелой цепи, так и V генных сегментов легкой цепи по сравнению с мышами дикого типа VI-3. Например, только 4 V генных сегмента тяжелой цепи и 6 V генных сегментов легкой цепи были использованы для антител у мышей VI-3 дикого типа, и 79% антител использовали V генные сегменты IgH V4-59 и Igκ V1-12. Напротив, 6 V генных сегмента тяжелой цепи и 10 V генных сегментов легкой цепи были использованы для антител у мышей ауто-антиген-3-KO VI-3, с наиболее распространенной комбинацией использования (IgH V3-23 и Igκ V4-1) составляет только 42% антител.
[000427]
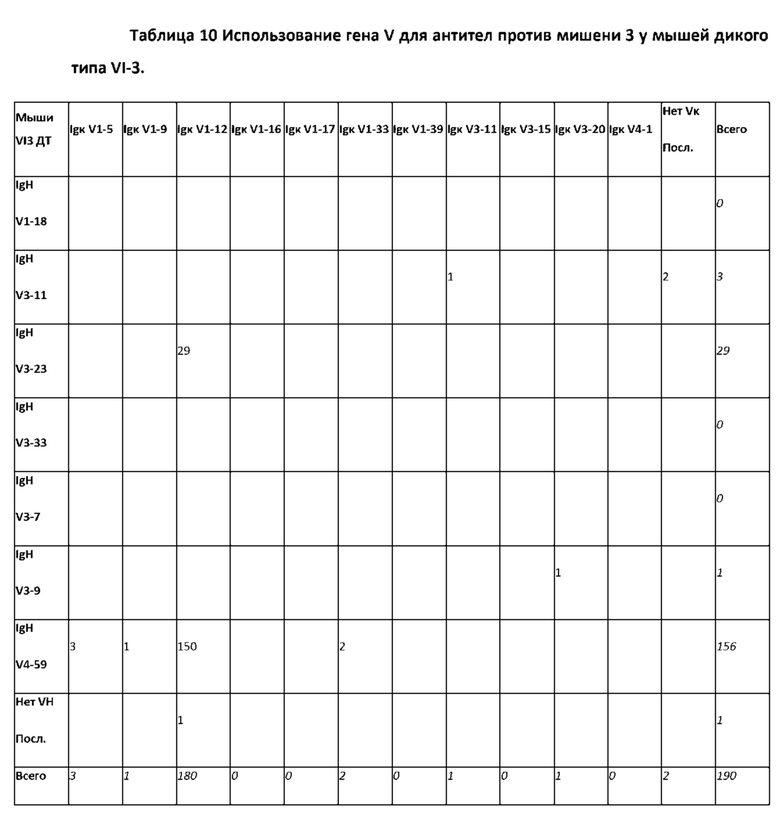
[000428]
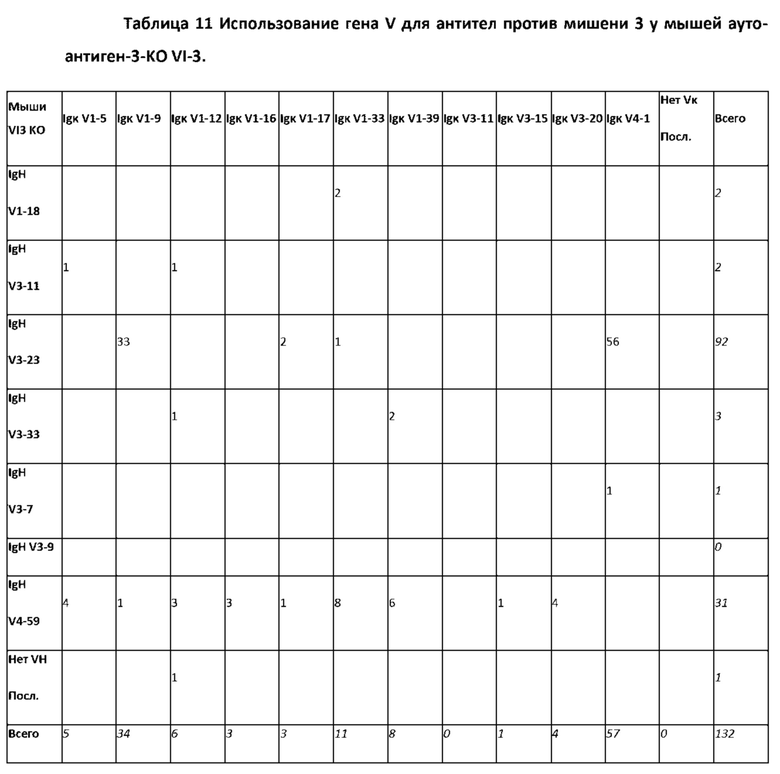
[000429] Кроме того, у мышей ауто-антиген-3-KO VI-3 продуцировались антитела с перекрестной реактивностью к ауто-антигену 3 мыши (т.е. антитела, которые связывают как мишень 3 человека, так и аутоантиген 3 мыши) (см., например, Таблицу 12). Сходные результаты были получены с аутоантигеном 4 и мишенью 4 человека у мышей VI-3 и ULC 1-39. См. фигуры 31А и 31В. В этом эксперименте мышей ауто-антиген-4-KO/VI-3-Adam6 и ауто-антиген-4-KO/ULC 1-39 иммунизировали His-меченным белком мишени 4 человека и/или His-меченным белком аутоантигена 4 мыши (His-меченным) с использованием пути введения в лапки. Титры определяли с использованием His-меченой мишени 4 человека, His-меченого ауто-антигена 4 мыши или His-меченого Fel d 1 (контроль) в качестве антигена для покрытия.
[000430] Способность генерировать антитела против эпитопов, которые делятся между аутоантигеном 3 мыши и мишенью 3 (или делятся между аутоантигеном 4 мыши и мишенью 4 человека), выгодна тем, что расширяет пул антител: антитела без перекрестной реактивности к аутоантигену 3 мыши были получены у мышей дикого типа VI-3. Кроме того, фармакокинетические свойства перекрестно реагирующих антител можно легче тестировать in vivo из-за их перекрестной реактивности с эндогенными аутоантигенами у мышей дикого типа. Следовательно, мыши, генетически сконструированные для экспрессии антигенов-мишеней (например, антигенов-мишеней человека) таких перекрестно реагирующих антител, могут не нуждаться в генерировании.
[000431]

Пример 5 CRISPR/Cas9-опосредованное нацеливание с использованием одной направляющей РНК или двух направляющих РНК.
Материалы и методы
ЭС клеточная культура, скрининг и электропорация
[000432] Описанные в данном документе эксперименты были выполнены с VGF1, нашей гибридной XY ЭС-клеточной линией C57BL6NTac/129S6SvEvF1 (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99; Valenzuela et al. (2003) Nat. Biotechnol. 21:652-659). ЭС клетки культивировали, как описано ранее (Matise et al. (2000) in Joyner, A.L ed. Gene Targeting: a practical approach, pp. 100-132, Oxford University Press, Нью-Йорк). Клетки VGF1 были созданы путем скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac для получения мышей C57BL6(XB6)/129S6(Y129). См. Фигуру 7.
[000433] Электропорацию (ЕР) проводили с 7,5 миллионами клеток в кювете с 2-мм зазором в конечном объеме 0,12 мл. Электрические условия для ЕР составляли 700 В, сопротивление 400 Ом и емкость 25 мкФ с использованием системы электропорации BTX ЕСМ 630 (Harvard Apparatus, Холлистон, Массачусетс). Количество LTVEC на ЕР составило 0,0015 мг, плазмиды, экспрессирующей Cas9, было 0,005 мг, а плазмиды, экспрессирующей огРНК, было 0,010 мг. Некоторые ЕР выполняли с добавлением 100 нг плазмиды, обеспечивающей устойчивость к пиромицину, чтобы обеспечить отбор клонов без отбора на устойчивость к неомицину, экспрессируемую с помощью LTVEC. После ЕР клетки высевали на две 15 см желатинизированные чашки и среду меняли ежедневно. Отбор сред, содержащих либо 100 мкг/мл сульфата G-418, либо 0,0015 мг/мл пиромицина, начинался через 48 часов после ЕР и продолжался до 10 дней после ЕР. Колонии отбирали в PBS и добавляли в 96-луночный планшет, содержащий 0,05% трипсина, и позволяли диссоциировать в течение 15 минут, нейтрализовали средой и использовали для выделения ДНК для скрининга.
[000434] Способ модификации аллеля (Frendewey et al. (2010) Methods Enzymol. 476:295-307) использовали для идентификации правильно нацеленных клонов ЭС-клеток и для определения генотипов аллелей мыши.
Дизайн направляющей последовательности
[000435] Приблизительно 200 п.о. ДНК, окружающей положение 50 п.о., 100 п.о., 500 п.о. или 1 т.п.о. внутри удаленного участка Lrp5 или других целевых генов как вверх, так и вниз по ходу транскрипции, было введено в инструмент проектирования CRISPR (crispr.mit.edu) чтобы получить возможные последовательности гРНК. Потенциальные последовательности гРНК затем фильтровали, чтобы гарантировать, что они позволят только разрезать эндогенную ДНК, а не вставку гуманизации в LTVEC.
Клонирование одной направляющей РНК
[000436] огРНК были либо клонированы в виде дуплексных олигонуклеотидов (IDT) в рМВ_огРНК (промотор U6) в сайтах BsmbI, слитых с каркасом размером 77 п.о. для бесшовной экспрессии РНК, либо приобретены в качестве валидированных плазмид экспрессии из GeneCopoeia (LRP5 гиды А, В, В2, Е2, Е и F). Плазмиды собственного производства были подтверждены с помощью ПЦР и сиквенирования по Сенгеру.
Матрицы ДНИ для подтверждения генотипа
[000437] ДНК очищали из ЭС-клеток, клонов, полученных из ЭС-клеток, которые были подвергнуты электропорации с направленным вектором, и плазмидой, экспрессирующей Cas9, и плазмидой, экспрессирующей одну из нескольких направляющих РНК (гРНК) или двумя плазмидами, экспрессирующими различные комбинации гРНК. Клоны, идентифицированные с помощью количественных анализов ПЦР с модификацией аллеля (то есть с потерей аллеля или усилением аллеля), имеют целевую делецию локуса-мишени мыши и вставку нацеливающего вектора или имеют Cas9/гРНК-индуцированные делеций, были отобраны для последующих обычных анализов ПЦР.
Дизайн олигонуклеотида
[000438] Два ПЦР-анализа были разработаны для каждой комбинации гРНК. Первая ПЦР представляла собой анализ делеций для выявления разрушения между последовательностями, узнаваемыми направляющей РНК, различных комбинаций гРНК. Второй анализ ПЦР, который представляет собой 5'-анализ, включал два анализа ПЦР. Первым был анализ 5'-человека для гуманизированных аллелей, который был разработан через участок соединения мыши-человека. Вторым был 5'-анализ мыши на эндогенные мышиные аллели, и он был разработан через участок соединения 5'-целевую делецию.
Реакция ПЦР и клонирование ТОРО
[000439] TaKaRa LA Taq ДНК-полимераза (кат. № RR002M) была использована для амплификации ДНК-матрицы ЭС-клетки. Каждую реакционную смесь для анализа ПЦР проводили с отрицательным контролем воды. Смеси для анализа содержали следующее: 0,005 мл ДНК-матрицы ЭС-клеток; 1X LA ПЦР-буфер II (Mg2+ плюс); 0,01 мМ смесь дНТФ; 0,0075 мМ прямого олигонуклеотида (каждый); 0,0075 мМ обратного олигонуклеотида (каждый); 5000 единиц/мл LA Taq-полимеразы; и ddH2O до 0,025 мл.
[000440] Программа термоциклирования ПЦР состояла из 94°С в течение одной минуты; затем 35 циклов при 94°С в течение 30 секунд, градиенте отжига при 60°С в течение 30 секунд и амплификация при 68°С в течение одной минуты на т.п.о.; с последующей полимеризацией при 72°С в течение 10 минут.
[000441] Продукты ПЦР фракционировали электрофорезом в 2% агарозном геле с Invitrogen 1 т.п.о. плюс ДНК-лестницей (кат. №10787-018) и/или Invitrogen 50 п.о. ДНК-лестницей (кат. №10416-014). Оставшиеся продукты ПЦР клонировали в вектор pCR4-TOPO, следуя инструкциям из набора для клонирования Invitrogen ТОРО ТА (кат. № K4575-02) для сиквенирования. Реакции клонирования химически трансформировали в клетках One Shot Top10 и высевали на чашки с агаром 0,06 мг/мл X-gal и 0,025 мг/мл канамицина.
Сиквенирование
[000442] Белые колонии инокулировали в LB, содержащий 0,025 мг/мл канамицина, и инкубировали в течение ночи при встряхивании при 37°С. Каждая колония представляла один ампликон из популяции проанализированных продуктов. ДНК выделяли из каждой бактериальной культуры с использованием набора для минимизации плазмиды QIAGEN (кат. №12123). Последовательность ДНК вставок определяли в реакционной смеси для сиквенирования, которая содержала 0,002 мл ТОРО-клонированной ПЦР, 1x PCRx Усиливающий раствор (10х исходный раствор) (кат. Х11495-017), 0,0075 мМ олигонуклеотида (M13F или M13R) и ddH2O до 0,015 мл.
Анализ сиквенирования
[000443] От результатов сиквенирования отрезали промежуточную последовательность и последовательность вектора pCR4-TOPO, изолируя последовательность ПЦР-вставки. Сиквенированные фрагменты были затем выровнены с эталоном, и вариации были проанализированы.
Сиквенирование разрушенных клонов
[000444] Продукты ПЦР из разрушенных положительных клонов клонировали в вектор pCR4-ТОРО, следуя инструкциям производителя (Invitrogen cat. # K4575-02), затем химически трансформировали в клетки One Shot Top10 и высевали на чашки с агаром 0,060 мг/мл X-gal и 0,025 мг/мл канамицина. ДНК выделяли из бактериальных культур с использованием набора для минимизации плазмиды QIAGEN (кат. №12123). Затем результаты сиквенирования вставки были выровнены в соответствие с прогнозируемым эталоном разрушения, и индел вариации были проанализированы. Было предсказано, что Cas9 расщепляет 3 пары оснований из РАМ в последовательность, распознаваемую гРНК.
Последовательность в пределах предсказанного расщепления была удалена из эталона, а оставшаяся часть была использована для выравнивания результатов.
Анализы TAQMAN® для аллельной дискриминации для одиночных нуклеотидных вариантов (SNV)
[000445] Реакция аллельной дискриминации TAQMAN® на 0,008 мл содержала геномную ДНК, специфические зонды/праймеры для каждого полиморфизма, и ПЦР мастер-смесь TAQMAN® для экспрессии гена. Зонды были заказаны у Life Technologies (Thermo) и праймеры от IDT. Зонд для аллеля 129 был помечен красителем VIC; зонд для аллеля В6 был помечен красителем FAM. Каждый аллельный анализ TAQMAN® проводили в четырех повторностях на 384-луночном планшете и проводили на платформе Applied BioSystems ViiA 7. Цикловая программа ПЦР SNV была следующей: при 95°С в течение 10 минут следует 40 циклов следующего: 95°С в течение 15 секунд, 60°С в течение 60 секунд и 60°С в течение 30 секунд. Анализ прогона и оценка результатов были выполнены с использованием программного обеспечения ViiA 7 v1.1.
Анализ FISH
[000446] Отобранные клоны ЭС-клеток анализировали либо с помощью Cell Line Genetics (Мэдисон, Висконсин), либо с помощью Института Ван-Андела (Гранд-Рапидс, Мичиган), используя флуоресцентную гибридизацию in situ (FISH) с помощью их стандартных процедур. Мы предоставили ВАС мыши и человека в качестве зондов для двухцветного анализа.
Улучшенное разрушение генома и/или гуманизация локусов-мишеней
[000447] Чтобы добиться точной, одноэтапной делеции всего или части гена грызуна и, возможно, одновременной замены всего или части его человеческого гомолога, мы ввели электропорацией в ЭС клетки грызунов следующие молекулы нуклеиновой кислоты: (1) LTVEC; (2) плазмида или мРНК, кодирующая эндонуклеазу Cas9; и (3) одну или более плазмид, кодирующих одну или более CRISPR одиночных направляющих РНК (гРНК) или сами гРНК. В каждом эксперименте LTVEC линеаризовали. В некоторых экспериментах, LTVEC включал весь человеческий ген или его часть, которая кодирует продукт гена (белок или РНК), фланкированный плечами гомологии ДНК грызунов, предназначенный для направления события гомологичной рекомбинации, которое удаляет ген грызуна и вставляет ген человека. В других экспериментах, LTVEC был разработан, чтобы нацеливаться на отдельный локус, такой как локус Ch25h. В любом случае, LTVEC также содержал кассету селекции лекарств, которая направляет экспрессию фермента (например, неомицин фосфотрансферазы), который придает устойчивость к препарату антибиотика (например, G418).
[000448] ЭС клетки, которые брали LTVEC и включали его в свои геномы, были способны расти и образовывать колонии на чашке для тканевых культур в среде для выращивания, содержащей препарат антибиотика. Поскольку мы ввели в 500-1000 раз больше CRISPR/Cas9-кодирующих и гРНК-кодирующих нуклеиновых молекул, чем молекул LTVEC, большинство LTVEC-содержащих устойчивых к лекарственным средствам колоний также содержали, по меньшей мере временно, компоненты CRISPR/Cas9. Мы отобрали устойчивые к лекарствам колонии и провели скрининг их способом модификации аллелей (Valenzuela et al. (2003) Nat. Biotech. 21:652-660; Frendewey et al. (2010) Methods Enzymol. 476:295-307; включенный в данное описание посредством ссылки во всей их полноте) для идентификации клонов, которые имели правильно нацеленный гуманизированный аллель. Кроме того, анализы ПЦР в реальном времени, распознающие последовательности в плечах гомологии LTVEC, называемые анализами удерживания, были использованы для проверки правильного нацеливания LTVEC в геном мыши. Определение количества копий этих анализов удерживания дало дополнительное пояснение, чтобы помочь отличить правильно нацеленные ЭС клоны, которые сохранили число копий два, от клонов, в которых большая Cas9-индуцированная делеция локуса-мишени мыши совпадает со случайной интеграцией LTVEC в другом месте в геноме, и в этом случае анализы удерживания имели число копий три (или более). Способность спаренных гРНК создавать большие Cas9-опосредованные делеции в локусе-мишени мыши означала, что стандартные анализы LOA и GOA, как описано ранее, могут быть дополнены анализами удерживания, чтобы обеспечить дополнительное уточнение и проверить правильность нацеливания. Поэтому анализы удерживания были разработаны и использованы в сочетании с анализами LOA и GOA.
[000449] В каждом эксперименте использовали одну или две гРНК. ГРНК использовали однонаправленное Cas9 расщепление вблизи 5'-конца локуса-мишени (т.е. делеция гена-мишени мыши), середины локуса-мишени или 3'-конца локуса-мишени. Когда использовали две гРНК, одна гРНК направила Cas9 расщепление рядом с 5'-концом локуса-мишени, а другая гРНК направила Cas9 расщепление в середине локуса-мишени или около 3'-конца локуса-мишени.
Lrp5 Локус
[000450] В одной серии экспериментов, LTVEC был спроектирован для создания делеции 68 т.п.о. части гена Lrp5 мыши (белка 5, связанного с рецептором липопротеина низкой плотности), кодирующего эктодомен, и одновременной замены на фрагмент 91 т.п.о. гомологичной последовательности из гена LRP5 человека (см. фигуру 8). LTVEC содержал фрагмент размером 91 т.п.о. гена LRP5 человека, фланкированный плечами гомологии, содержащий 7 т.п.о. и 33 т.п.о. геномной ДНК, полученной из частей локуса Lrp5 мыши, которые фланкируют последовательность 68 т.п.о. гена Lrp5 мыши, являющегося мишенью для делеции. В отдельных экспериментах, Lrp5 гуманизированный LTVEC комбинировали с плазмидой, кодирующей Cas9, и второй плазмидой, кодирующей одну из восьми гРНК (А, В, В2, С, D, Е2, Е, F), предназначенную для создания двухцепочечных разрывов внутри участка гена Lrp5 мыши, которая была нацелена на делецию. Эти гРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена LRP5 человека. В других экспериментах мы объединили LTVEC и Cas9-кодирующую плазмиду с плазмидами, кодирующими две разные гРНК, которые нацелены на разные сайты в участке гена Lrp5 мыши, который был нацелен на делецию.
[000451] Устойчивые к лекарственным средствам клоны ЭС-клеток подвергали скринингу на предмет целевой гуманизации с помощью анализа модификации аллелей (Valenzuela et al. (2003) Nat. Biotechnol. 21:652-659; Frendewey et al. (2010) Methods Enzymol. 476:295-307) для последовательностей в делеции и для последовательностей в кассете селекции лекарств и вставке гена человека. Клоны были оценены как правильно нацеленные, если они потеряли одну из двух эндогенных последовательностей мышиных генов и получили одну копию человеческой вставки, а также сохранили две копии удерживающих последовательностей (расположенных в плече гомологии LTVEC). Двумя анализами удерживания для этого скрининга были анализы TAQMAN® с использованием следующих праймеров и зондов: 7064retU прямой праймер 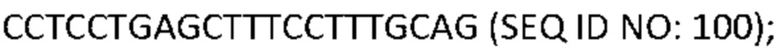 7064retU обратный праймер
7064retU обратный праймер  7064retU TAQMAN® зонд
7064retU TAQMAN® зонд 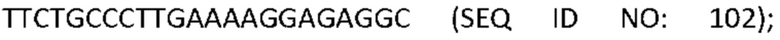 7064retD прямой праймер
7064retD прямой праймер 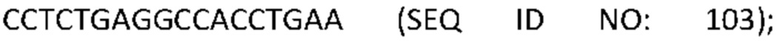 7064retD обратный праймер
7064retD обратный праймер 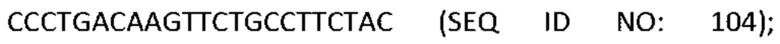 7064retD TAQMAN® зонд
7064retD TAQMAN® зонд 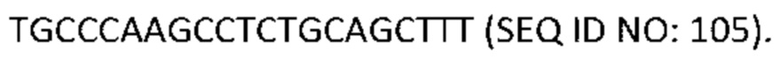
[000452] Результаты CRISPR/Cas9-ассистированной гуманизации гена Lrp5 суммированы в таблице 13. Когда в ЭС клетки вводили только LTVEC, 1,9% скринированных лекарственно-устойчивых клонов содержали правильно нацеленный гетерозиготный гуманизированный аллель (см. Гет. Нац. столбец в таблице 13, который включает клоны, в которых нецелевой аллель не был мутирован вообще или имел небольшую CRISPR-индуцированную мутацию такую как небольшая делеция, вызванная NHEJ). Напротив, объединение LTVEC с эндонуклеазами Cas9, управляемыми семью из восьми протестированных гРНК (А, В, В2, С, D, Е2, Е и F; см. Таблицу 1), приводило к правильно нацеленным моноаллельным гетерозиготным мутациям с эффективностью, варьирующейся от 2,1 до 7,8%. Для Cas9-управляемого расщепления с помощью В2 и D, помимо моноаллельного нацеливания, была обнаружена биаллельная гомозиготная гуманизация с частотой 1,0-2,1%. Мы никогда не наблюдали биаллельного нацеливания с помощью LTVEC, даже для небольших простых делеционных аллелей. Гомозиготные Lrp5 гуманизированные ЭС-клетки могут быть преобразованы способом VELOCIMOUSE® (Poueymirou et al. (2007) Nat. Biotech. 25:91-99, включенной в настоящее описание в качестве ссылки во всей своей полноте) непосредственно на полностью полученных из ЭС клеток мышей, готовых к фенотипическим исследованиям и исследованиям эффективности лекарственных средств.
[000453] Анализы МОА, разработанные для обнаружения гРНК/Cas9-индуцированных NHEJ мутаций в или около предсказанных сайтов расщепления, продемонстрировали мутационную активность для всех протестированных гРНК (данные не показаны). Доля моноаллельных или биаллельных гРНК-индуцированных мутаций, обнаруженных среди всех проанализированных клонов, варьировалась с помощью локуса и положения. Не было сильной корреляции между мутационной активностью гРНК и нацеливанием LTVEC, но самая низкая эффективность нацеливания часто ассоциировалась с гРНК, которые имели самые низкие частоты мутаций.
[000454] Объединение двух гРНК, которые распознают разные концы участка гена Lrp5, который был нацелен на делецию, увеличивало общую эффективность нацеливания на гуманизацию, преимущественно за счет увеличения частоты гомозиготных событий нацеливания для трех из пяти протестированных комбинаций (таблица 13). Поскольку комбинация гРНК потенциально может создавать большие делеции между сайтами расщепления Cas9, запрограммированными с помощью гРНК, мы также наблюдали клоны гемизиготных ЭС-клеток, которые несут целевую гуманизацию на одном аллеле Lrp5 и большую CRISPR-индуцированную делецию на другом аллеле (комбинация гРНК А+F, таблица 13). Кроме того, для двух комбинаций гРНК (А+F и А+Е2) мы идентифицировали клоны ЭС-клеток с уникальным генотипом: большие CRISPR-опосредованные делеции на обоих аллелях Lrp5.
[000455]
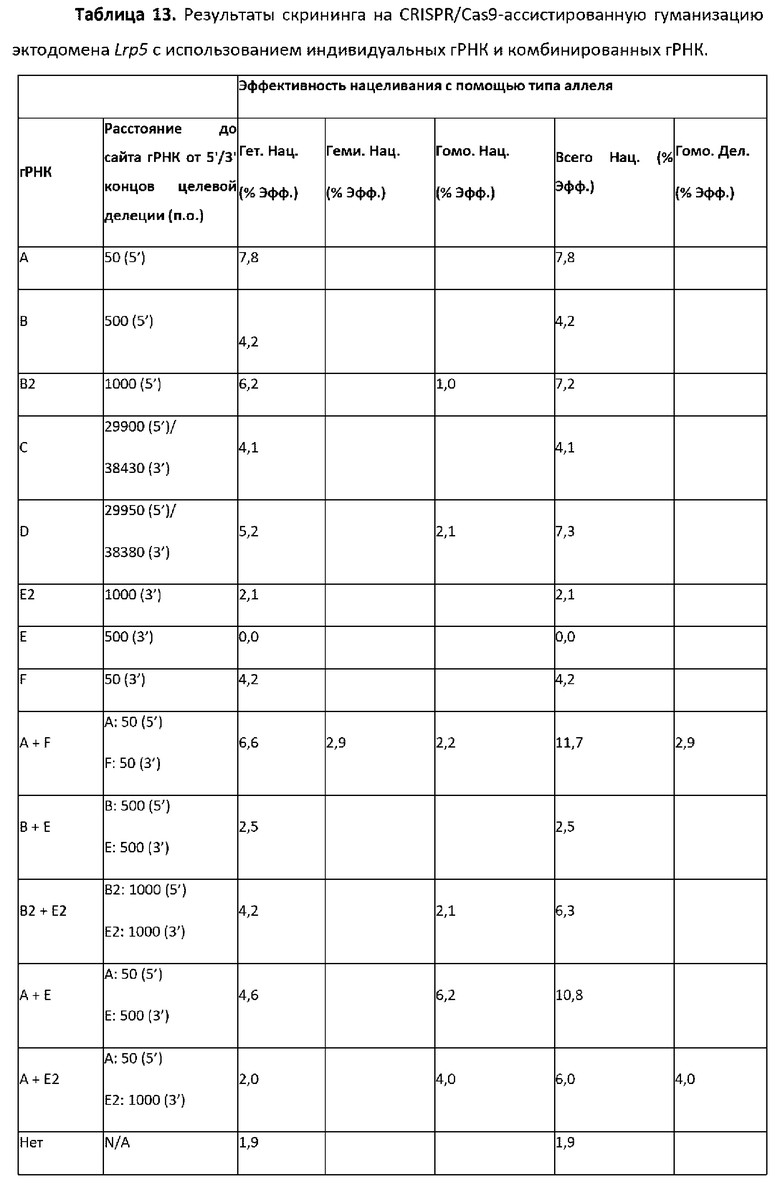
[000456] Как показано в Таблице 13, значительное увеличение процента клонов, у которых было биаллельное нацеливание, наблюдалось при использовании двух гРНК, которые нацелены на один локус, а не на одну гРНК (см. Фигуру 9А), что указывает на то, что использование комбинаций гРНК способствует биаллельным модификациям. На фигуре 9А показана общая схема одновременной делеции мышиного гена и замены соответствующей человеческой версии с использованием LTVEC и двух направляющих РНК (А и В). Уникальные мутантные типы аллелей, которые наблюдаются с гораздо более высокой частотой при использовании двух гРНК, включают гомозиготно разрушенные аллели (фигура 9В; Δ/Δ), гомозиготно нацеленные аллели (фигура 9С; Hum/Hum), гемизиготно нацеленные аллели (фигура 9D; (Hum/Δ)) и другие сложные гетерозиготно нацеленные аллели (например, один аллель имеет LTVEC-нацеленную гуманизацию, а другой аллель имеет CRISPR-индуцированную мутацию, такую как небольшая делеция) (фигура 9Е).
[000457] Было проведено несколько анализов ПЦР для поддержания и подтверждения генотипов на основе анализов МОА. Праймеры можно найти в таблице 1. Lrp5 LTVEC имел 5' плечо гомологии, которая была достаточно короткой (6,9 т.п.о.), чтобы доказать нацеливание с помощью ПЦР, которая анализировала физическую связь между человеческой вставкой и соседней последовательностью генома мыши. Мы наблюдали ожидаемый 7,5 т.п.о. продукт ПЦР с ДНК из клонов, оцениваемых как гетерозиготные, гемизиготные или гомозиготные, но не с ДНК из линии родительских ЭС-клеток или из клонов, оцениваемых как имеющие биаллельные большие делеции (фигуры 10А), таким образом подтверждая направленные вызовы, сделанные с помощью МОА (т.е. LOA и GOA) скрининга и поддержки предполагаемых биаллельных больших делеций. ПЦР-анализ 5'-Del-J, в котором изучались последовательности в соединениях делеции и вставки (фигура 10В), позволил получить продукт размером 330 п.о. с ДНК из родительской линии ЭС-клеток и из большинства гетерозиготных гуманизированных клонов (данные не представлены). Для гетерозиготного клона AW-C3, в результате анализа 5'-Del-J был получен продукт, меньший, чем ожидалось (фигура 10В), что позволяет предположить, что расщепление гРНК A/Cas9 индуцировало небольшую делеционную мутацию на нецелевом аллеле, которая также была обнаружена с помощью анализа МОА для расщепления гРНК А (данные не показаны). Как и ожидалось, 5'-Del-J анализ был отрицательным для клонов с гемизиготными, гомозиготными и биаллельными делеционными аллелями. ПЦР 5'-Ins-J (фигура 10В), которая исследовала последовательности на стыке между 5'-концом вставки ДНК человека и соседней фланкирующей последовательности мыши, продуцировала продукт длиной 478 п.о. в гетерозиготных, гемизиготных и гомозиготных клонах, поскольку они имеют по меньшей мере один целевой гуманизированный аллель. ПЦР-анализ 5'-Ins-J не дал продукта для клонов с биаллельными большими делециями (фигура 10В). Чтобы подтвердить большие делеции в гемизиготных и биаллельных делеционных клонах, мы провели ПЦР с праймерами, которые распознавали последовательности вне сайтов-мишеней двойной гРНК. Del(A+F) ПЦР, которая анализировала делецию между сайтами гРНК А и F, давала один продукт размером приблизительно 360 п.о. с ДНК из клонов AW-A8 и BO-F10 (фигура 10В), подтверждая, что по меньшей мере один из аллелей Lrp5 имел большую делецию. Аналогично, Del(A+Е2) ПЦР, которая анализировала большую делецию между сайтами гРНК А и Е2, давала один продукт размером приблизительно 250 п.о. с ДНК из клона ВА-А7. ПЦР делеции вместе с анализами соединения, LOA и GOA поддерживают биаллельный генотип большой делеции. Результаты анализа, показанные на фигуре 10А и 10В, являются репрезентативными примерами аналогичных анализов, которые мы проводили в дополнение к флуоресцентной гибридизации in situ (FISH; фигура 11А-С), чтобы подтвердить биаллельные генотипы, обобщенные в таблице 13.
[000458] Флуоресцентную гибридизацию in situ (FISH) использовали для подтверждения гомозиготной направленной гуманизации гена Lrp5. Клоны ЭС-клеток, оцениваемые с помощью количественных и общепринятых анализов ПЦР как гомозиготные по мишеням из экспериментов по нацеливанию, в которых Lrp5 гуманизацию LTVEC объединяли с Cas9, и две гРНК (А плюс F или А плюс Е2) отправляли в коммерческую цитологическую службу для анализа FISH и кариотипа. Бактериальная искусственная хромосома (ВАС), несущая ген Lrp5 мыши, была помечена красным флуоресцентным маркером и использована в качестве зонда для идентификации эндогенных локусов Lrp5, а ВАС, несущий ген LRP5 человека, был помечен зеленым флуоресцентным маркером и использован в качестве зонда для идентификации хроматиды, на которые нацелена человеческая вставка. Меченые зонды ВАС были гибридизованы с метафазными пластинками от клонов-мишеней и визуализированы с помощью флуоресцентной микроскопии. Хромосомы на пластинках визуализировали путем окрашивания DAPI (4',6-диамидино-2-фенилиндол), а отдельные кариотипы для каждого клона определяли окрашиванием по Гимзе. Типичный результат показан на фигуре 11А для клона AW-D9, у которого был обнаружен нормальный кариотип 40XY (не показан). Сводная фотография на фигуре 11А показывает, что как сигнал красного зонда ВАС мыши, так и сигнал зеленого человеческого зонда ВАС совмещены с цитологической полосой В на обеих копиях хромосомы 19 мыши, известного местоположения гена Lrp5. Сводная фотография на фигуре 11С показывает то же гомозиготное нацеливание для другого клона (BA-D5). Эти результаты подтверждают, что фрагмент размером 91 т.п.о. гена LRP5 человека в гуманизированном LTVEC был правильно вставлен в предполагаемый локус Lrp5 мыши в обеих гомологах хромосомы 19 в клонах AW-D9 и BA-D5. Напротив, сводная фотография на фигуре 11В показывает, что как сигнал красного зонда ВАС мыши, так и сигнал зеленого человеческого зонда ВАС совмещены с цитологической полосой В на одной копии хромосомы 19 мыши (закрашенная стрелка), тогда как только сигнал красного зонда ВАС мыши локализуется в цитологической полосе В на другой копии хромосомы 19 мыши. Эти результаты подтверждают, что фрагмент размером 91 т.п.о. гена LRP5 человека в гуманизированном LTVEC был правильно вставлен в предполагаемый локус Lrp5 мыши только на одну копию хромосомы 19 (гетерозиготное нацеливание). Они также указывают (наряду с другими контролями не показано), что зонд ВАС человека не подвергается перекрестной гибридизации с локусом Lrp5 мыши, но распознает только вставку LRP5 человека.
[000459] Присутствие в определенных клонах идентичных CRISPR-индуцированным инделям мутаций, образованных на обоих аллелях посредством явной негомологичной репарации соединения конца, наводит на мысль о возникновении событий конверсии генов в гибридных клетках F1H4 (которые состоят из 50% линии 129SvS6 и 50% C57BL/6N линии). Чтобы получить представление о механизме, лежащем в основе усиленного биаллельного нацеливания, когда используются две гРНК, был проведен скрининг семи клонов, которые были нацелены либо на гомозиготные гуманизации, либо на гомозиготные CRISPR-индуцированные большие делеции после нацеливания с LTVEC и, либо с А+F, либо с А+Е2 комбинации гРНК.
[000460] На фигуре 12 показаны примеры анализов, предназначенных для изучения событий конверсии генов, опосредованных двумя направляющими РНК. В частности, возможность конверсии генов была исследована путем анализа потери гетерозиготности (LOH) в гибридных F1H4 ЭС-клетках (которые состоят из 50% линии 129 SvS6 и 50% линии C57BL/6N). Конверсия генов может быть продемонстрирована потерей гетерозиготности в известных полиморфизмах между 129SvS6 (129) и C57BL/6N (В6), и, таким образом, ПЦР-анализы были разработаны для дифференциации между этими двумя типами аллелей. Структурные варианты (SV) полиморфизмов анализировали с помощью обычных ПЦР, разработанных для выявления различий между 129 и В6 аллелями. Хотя только один из SV-анализов, использованных ниже, показан на фигуре 12, концепция для всех одинакова. Праймеры были разработаны на основе структурных вариаций (SV) между линиями мышей В6 и 129 и показаны в таблице 1. Условия конструирования праймера были ограничены необходимостью идентификации ~25 п.о. SV и получения продуктов ПЦР ~300 п.о.; эти условия были выбраны таким образом, чтобы любые изменения были видны при гель-электрофорезе.
[000461] Перед проведением ПЦР на клонах анализы были валидированы и оптимизированы против ДНК ЭС-клеток дикого типа из линий В6, 129 и из F1H4 линии ЭС клеток. Наборы праймеров, которые продуцировали различимые полосы ПЦР, специфичные для аллелей В6 или 129, и были последовательны в получении этих же двух различимых полос с использованием ДНК F1H4, были отобраны для тестирования на клонах. Для хромосомы 19 (местоположение гена Lrp5), шесть праймеров наборов - ID 190045, 190061, 190068, 190030, 190033, 190013 - были выбраны для использования на гуманизированных клонах Lrp5, генотипированных как «гомозиготная мишень» или «гомозиготное разрушение» с помощью анализов модификации аллеля (МОА) и обычной ПЦР. SV ПЦР-анализы были разнесены вдоль хромосомы 19 от локуса Lrp5 до теломерного конца хромосомы, в пределах от ~13,7 до ~56,2 Мб от локуса Lrp5. Приблизительные расстояния (в Мб) SV анализов на хромосоме 19 от локуса Lrp5 следующие: 13,7 для анализа 190045, 19,0 для анализа 190061, 35,0 для анализа 190068, 37,4 для анализа 190030, 48,3 для анализа 190033, и 56,2 для анализа 190013. Только анализ 190033 показан на фигуре 12 (показан как SV 48,3), но праймеры для анализов 190045, 190061, 190068, 190030, 190033 и 190013 показаны в таблице 1.
[000462] ПЦР проводили на ДНК этих клонов, а также на контрольной ДНК F1H4, контрольной ДНК 129 и контрольной ДНК В6. Продукты ПЦР фракционировали электрофорезом на 6% полиакриламидных гелях, которые впоследствии окрашивали GelRed. Клоны, продуцирующие две полосы, соответствовали контролю F1H4, который из предыдущей оптимизации показал, что верхняя полоса специфична для аллеля 129, а нижняя полоса специфична для аллеля В6. Клоны, которые создали только одну полосу, отображали либо только В6, либо только 129 полос. Клоны AW-A7, AW-F10, BA-D5, BA-F2, ВС-Н9 и BR-B4 показали только полосу В6 для всех шести анализов, тогда как клон ВО-А8 показал только полосу 129 для всех шести анализов. Как упоминалось ранее, эти клоны были генотипированы как гомозиготно нацеленные или гомозиготно разрушенные с помощью МОА и/или ПЦР, и включали различные комбинации гРНК (А плюс F, А плюс Е2, В2 и D). Присутствие только одной аллельной полосы указывает на то, что имеет место событие конверсии гена - если бы не было конверсии, обе полосы все равно присутствовали бы, как в контроле F1H4.
[000463] Кроме того, одиночные нуклеотидные варианты (SNV) между аллелями 129 и В6 были проанализированы с помощью анализа аллельной дискриминации TAQMAN®. Приблизительные положения анализов SNV на карте хромосомы 19 на фигуре 12 показаны стрелками с их расстояниями (в Мб) от локуса Lrp5, приведенными ниже. Расстояния (в Мб) от локуса Lrp5 следующие: 0,32 центромера Lrp5 (С2), 1,2 теломера Lrp5 (Т3), 11,1 теломера Lrp5 (T6), 13,2 теломера Lrp5 (T7), 17,5 теломера Lrp5 (T8), 25,8 теломера Lrp5 (T9), 33,0 теломера Lrp5 (T10), 38,3 теломера Lrp5 (T11), 49,6 теломера Lrp5 (T13) и 57,2 теломера Lrp5 (T14). 129-специфичные и В6-специфичные зонды и пары праймеров показаны в таблице 1.
[000464] В таблице 14 показаны семь примеров клонов ЭС-клеток, которые демонстрировали явные события конверсии генов в длинном плече хромосомы 19 в направлении теломеры от локуса-мишени Lrp5 с помощью LOH как для аллелей SV, так и для SNV. Клоны ЭС-клеток были получены из независимых экспериментов по нацеливанию, которые объединяли Lrp5 гуманизированный LTVEC с одной или двумя гРНК, как указано. Положения последовательностей узнавания гРНК показаны над изображением гена Lrp5 на фигуре 12 (толстая стрелка, указывающая влево). Анализ генотипирования показал, что шесть из семи клонов имели гомозиготную целевую гуманизацию гена Lrp5, в то время как один из них имел гомозиготное разрушение (большую делецию между сайтами гРНК). В шести из семи клонов, 129 аллели были потеряны, оставив только аллели В6. В другом клоне, аллели В6 были потеряны, оставив только 129 аллели. Все клоны оставались гетерозиготными по аллелям, проанализированным на центромерной стороне локуса Lrp5 (то есть все клоны были гетерозиготными по В6/129 с помощью анализа С2 SNV). LOH, наблюдаемый в семи клонах, указывает на то, что один механизм, посредством которого гомозиготные генетически модифицированные аллели получают, когда LTVEC комбинируется с одной или более часто двумя гРНК, представляет собой первую нацеленную генетическую модификацию на одном аллеле с последующим гомологически направленным рекомбинацией событием конверсии гена, которое копирует нацеленную генетическую модификацию из одной хромосомы в ее гомолог.
[000465]
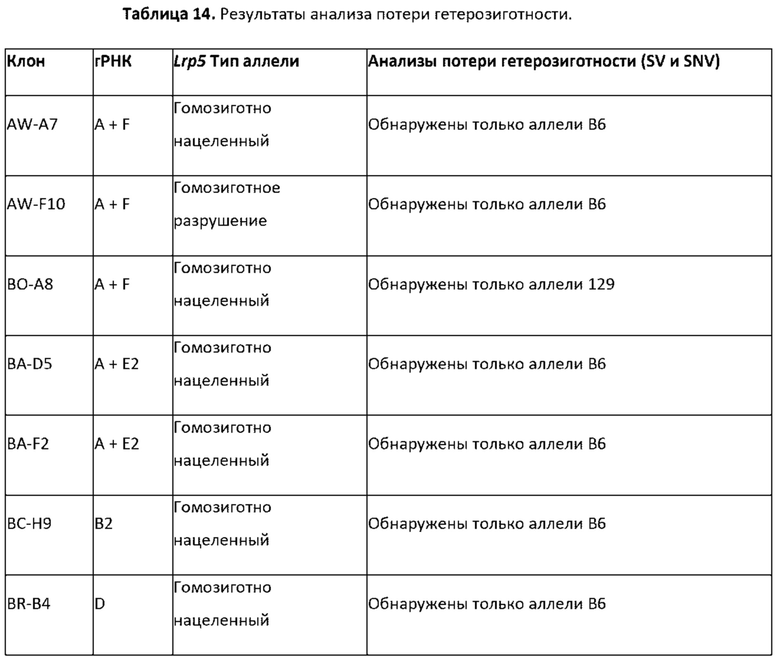
С5 (Hc) локус
[000466] В другой серии экспериментов LTVEC был разработан для создания делеции 76 т.п.о. гена мыши для комплемента компонента 5 (С5 или Hc (гемолитический комплемент)) и одновременной замены фрагментом 97 т.п.о. гомологичного гена С5 человека. Локус-мишень содержал экзон 2 для стоп-кодона гена С5 (Hc). LTVEC содержал фрагмент размером 97 т.п.о. гена С5 человека, фланкированный плечами гомологии, содержащий 35 т.п.о. и 31 т.п.о. геномной ДНК, полученной из частей локуса С5 (Hc) мыши, которые фланкируют последовательность 76 т.п.о. гена С5 (Hc) мыши, являющегося мишенью для делеции. В отдельных экспериментах, С5 (Hc) гуманизированный LTVEC комбинировали с плазмидой, кодирующей Cas9, и второй плазмидой, кодирующей одну из шести гРНК (А, В, С, D, Е и Е2; см. таблицу 1), предназначенную для создания двухцепочечных разрывов внутри участка гена С5 (Hc) мыши, который был нацелен на делецию. Эти гРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена С5 человека. В других экспериментах мы объединили LTVEC и Cas9-кодирующую плазмиду с плазмидами, кодирующими две разные гРНК, которые нацелены на разные сайты в участке гена С5 (Hc) мыши, который был нацелен на делецию. В некоторых экспериментах, контрольный LTVEC, нацеленный на локус Ch25h, использовали вместо С5 (Hc), гуманизирующего LTVEC. Контрольный LTVEC, который предназначен для удаления всей кодирующей последовательности Ch25h (~1 т.п.о.) и вставки селекционных кассет пиромицина и неомицина в локус Ch25h, использовали в качестве средства для отбора устойчивых к лекарствам клонов, которые не были нацелены на гомологичную рекомбинацию в локусе С5 (Hc).
[000467] Результаты CRISPR/Cas9-ассистированной гуманизации гена С5 (Нс) показаны в таблице 15 и аналогичны результатам, полученным для CRISPR/Cas9-ассистированной гуманизации гена Lrp5. Эффективность нацеливания с одним LTVEC была выше (6,1%) для гуманизации С5 (Нс), чем для Lrp5, но добавление Cas9 и гРНК усилило эффективность нацеливания для четырех из шести протестированных гРНК. Как и в случае Lrp5, комбинирование гРНК (то есть использование двух гРНК) для гуманизации С5 (Нс) еще более увеличивало общую эффективность нацеливания, главным образом за счет увеличения частоты гемизиготных и гомозиготных событий нацеливания. Мы также обнаружили клоны ЭС-клеток с большими CRISPR-индуцированными делециями на обоих аллелях (наблюдаемые с частотами от 1,8% до 3,6%). Кроме того, когда LTVEC, нацеленный на локус Ch25h, использовали в комбинации с двумя С5 (Нс) гРНК, клоны с гомозиготными аллелями, которые были разрушены между двумя последовательностями, распознаваемыми направляющей РНК, наблюдались с частотами от 1,2% до 6%, что указывает на то, что события разрушения происходят независимо от событий гомологичной рекомбинации в локусе-мишени. Как и в случае Lrp5, для подтверждения правильности нацеленных клонов использовались анализы удерживания. Двумя анализами удерживания для этого скрининга были анализы TAQMAN® с использованием следующих праймеров и зондов: 7140retU прямой праймер 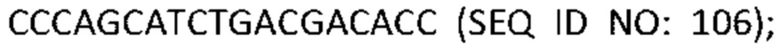 7140retU обратный праймер
7140retU обратный праймер 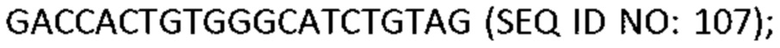 7140retU TAQMAN®-зонд
7140retU TAQMAN®-зонд  7140retD прямой праймер
7140retD прямой праймер 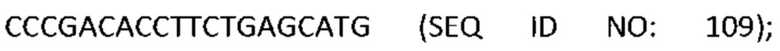 7140retD обратный праймер
7140retD обратный праймер  7140retD TAQMAN®-зонд
7140retD TAQMAN®-зонд 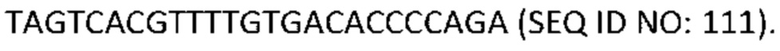
[000468]
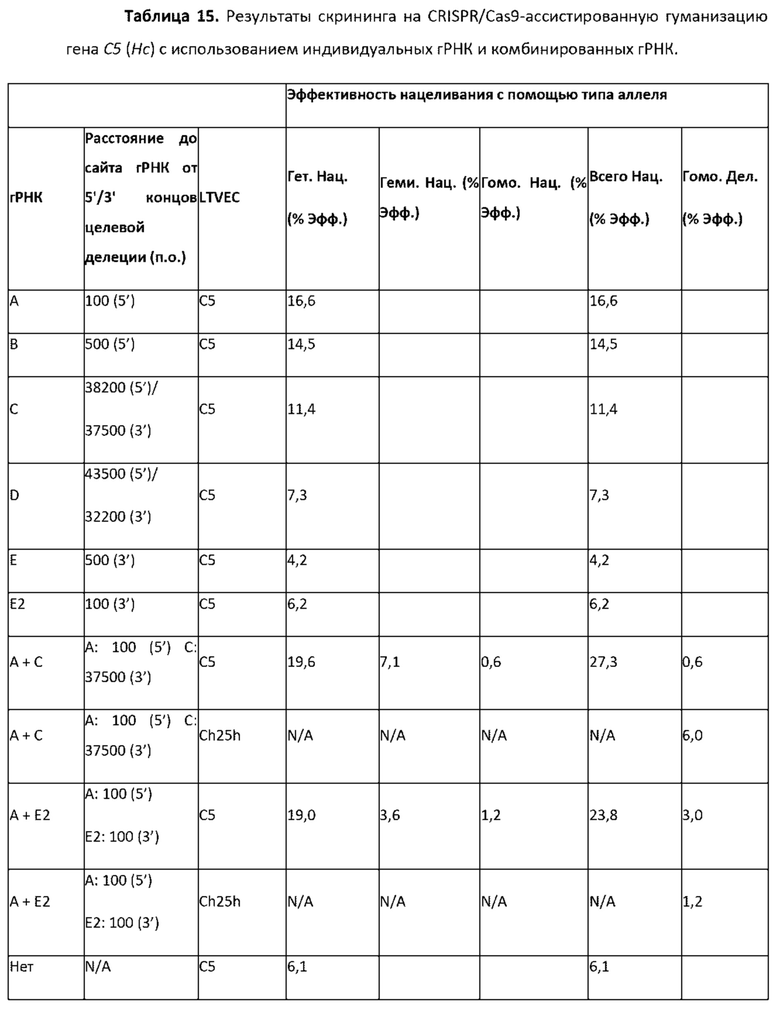
[000469] Флуоресцентную гибридизацию in situ (FISH) использовали для подтверждения гомозиготной направленной гуманизации гена С5 (Hc). Клоны ЭС-клеток, оцениваемые с помощью количественных и общепринятых анализов ПЦР как гомозиготные по мишеням из экспериментов по нацеливанию, в которых С5 (Hc) гуманизацию LTVEC объединяли с Cas9, и две гРНК отправляли в коммерческую цитологическую службу для анализа FISH и кариотипа. Бактериальная искусственная хромосома (ВАС), несущая ген С5 (Hc) мыши, была помечена красным флуоресцентным маркером и использована в качестве зонда для идентификации эндогенных локусов, а ВАС, несущий ген С5 человека, был помечен зеленым флуоресцентным маркером и использован в качестве зонда для идентификации хроматиды, на которые нацелена человеческая вставка. Меченые зонды ВАС были гибридизованы с метафазными пластинками от клонов-мишеней и визуализированы с помощью флуоресцентной микроскопии. Хромосомы на пластинках визуализировали путем окрашивания DAPI (4',6-диамидино-2-фенилиндол), а отдельные кариотипы для каждого клона определяли окрашиванием по Гимзе. Типичный результат показан на фигуре 13В для клона О-Е. Сводная фотография на фигуре 13В показывает, что как сигнал красного зонда ВАС мыши, так и сигнал зеленого человеческого зонда ВАС совмещены с локусом С5 (Hc) на обеих копиях хромосомы 2 мыши, известного местоположения гена С5 (Hc). Эти результаты подтверждают, что фрагмент размером 97 т.п.о. гена С5 человека в гуманизированном LTVEC был правильно вставлен в предполагаемый локус С5 (Hc) мыши в обеих гомологах хромосомы 2 в клонах О-Е3. Напротив, сводная фотография на фигуре 13А показывает, что как сигнал красного зонда ВАС мыши, так и сигнал зеленого человеческого зонда ВАС совмещены на одной копии хромосомы 2 мыши (закрашенная стрелка), тогда как только сигнал красного зонда ВАС мыши локализуется в локусе С5 (Hc) на другой копии хромосомы 2 мыши. Эти результаты подтверждают, что фрагмент размером 97 т.п.о. гена С5 человека в гуманизированном LTVEC был правильно вставлен в предполагаемый локус С5 (Hc) мыши только на одну копию хромосомы 2 (гетерозиготное нацеливание) в клоне Q-Е9.
[000470] Затем клоны анализировали для изучения событий конверсии генов, опосредованных двумя направляющими РНК. В частности, возможность конверсии генов была исследована путем анализа потери гетерозиготности (LOH) в гибридных F1H4 ЭС-клетках (которые состоят из 50% линии 129 SvS6 и 50% линии C57BL/6N). Конверсия генов может быть продемонстрирована потерей гетерозиготности в известных полиморфизмах между 129SvS6 (129) и C57BL/6N (В6), и, таким образом, ПЦР-анализы были разработаны для дифференциации между этими двумя типами аллелей. Структурные варианты (SV) полиморфизмов анализировали с помощью обычных ПЦР, разработанных для выявления различий между 129 и В6 аллелями. Праймеры были разработаны на основе структурных вариаций (SV) между линиями мышей В6 и 129 и показаны в таблице 1. Условия конструирования праймера были ограничены необходимостью идентификации ~25 п.о. SV и получения продуктов ПЦР ~300 п.о.; эти условия были выбраны таким образом, чтобы любые изменения были видны при гель-электрофорезе.
[000471] Перед проведением ПЦР на клонах анализы были валидированы и оптимизированы против ДНК ЭС-клеток дикого типа из линий В6, 129 и из F1H4 линии ЭС клеток. Наборы праймеров, которые продуцировали различимые полосы ПЦР, специфичные для аллелей В6 или 129, и были последовательны в получении этих же двух различимых полос с использованием ДНК F1H4, были отобраны для тестирования на клонах. Пять наборов праймеров - ID SV 6,1, SV 6,3, SV 7,8, SV 16 и SV 25,5 - были выбраны для использования на клонах из эксперимента по нацеливанию. Четыре из ПЦР-анализа SV были распределены вдоль хромосомы от локуса С5 до теломерного конца хромосомы, в пределах от ~6,3 до ~25,5 Мб от локуса С5. Финальный SV ПЦР-анализ составлял ~6,1 Мб центромеры к локусу С5. Приблизительные расстояния (в Мб) SV анализов от локуса С5 следующие: 6,1 (центромерный) для анализа SV 6,1, 6,3 (теломерный) для анализа SV 6,3, 7,8 (теломерный) для анализа SV 7,8, 16,0 для анализа SV 16,0 и 25,5 для анализа SV 25,5 (см. фигуру 14).
[000472] Все 21 клонов оставались гетерозиготными по аллелям, проанализированным на центромерной стороне локуса С4 (то есть все клоны были гетерозиготными по В6/129). Два из 21 протестированных клонов демонстрировали явные события конверсии генов в направлении теломер от локуса-мишени С5 с помощью LOH (см. Таблицу 16). Анализ генотипирования показал, что один из клонов был гомозиготно нацелен на гуманизацию гена С5, а другой клон имел гомозиготное разрушение. LOH, наблюдаемый в двух клонах, указывает на то, что один механизм, посредством которого гомозиготные генетически модифицированные аллели получают, когда LTVEC комбинируется с одной или более часто двумя гРНК, представляет собой первую нацеленную генетическую модификацию на одном аллеле с последующим гомологически направленным рекомбинацией событием конверсии гена, которое копирует нацеленную генетическую модификацию из одной хромосомы в ее гомолог.
[000473]

Ror1 Локус
[000474] В другой серии экспериментов LTVEC был спроектирован для создания делеции 110 т.п.о. гена Ror1 мыши (тирозин-протеинкиназного трансмембранного рецептора ROR1) и одновременной замены фрагментом 134 т.п.о. гомологичного гена ROR1 человека. LTVEC содержал фрагмент размером 134 т.п.о. гена ROR1 человека, фланкированный плечами гомологии, содержащий 41,8 т.п.о. и 96,4 т.п.о. геномной ДНК, полученной из частей локуса Ror1 мыши, которые фланкируют последовательность 110 т.п.о. гена Ror1 мыши, являющегося мишенью для делеции. В отдельных экспериментах, Ror1 гуманизированный LTVEC комбинировали с плазмидой, кодирующей Cas9, и второй плазмидой, кодирующей одну из шести гРНК (А, В, С, D, Е и F; см. таблицу 1), предназначенную для создания двухцепочечных разрывов внутри участка гена Ror1 мыши, который был нацелен на делецию. Эти гРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена ROR1 человека. В других экспериментах мы объединили LTVEC и Cas9-кодирующую плазмиду с плазмидами, кодирующими две разные гРНК, которые нацелены на разные сайты в гене Ror1, который был нацелен на делецию.
[000475] Результаты CRISPR/Cas9-ассистированной гуманизации гена Ror1 показаны в таблице 17 и аналогичны результатам, полученным для CRISPR/Cas9-ассистированной гуманизации генов Lrp5 и С5 (Нс). Эффективность нацеливания только с LTVEC составила 0,3%, и добавление Cas9 и гРНК слегка увеличивало эффективность нацеливания для двух из шести протестированных гРНК. Сочетание А и F гРНК увеличило общую эффективность нацеливания на Ror1 до 6,3% за счет увеличения частоты как гетерозиготных, так и гемизиготных событий нацеливания. Мы также обнаружили клоны ЭС-клеток с большими CRISPR-индуцированными делециями на обоих аллелях (наблюдаемые с частотой 1,6%). Гомозиготных клонов-мишеней не наблюдалось. В дополнительных экспериментах, гРНК А и D также объединяли, но гомозиготного нацеливания все еще не наблюдалось.
[000476]
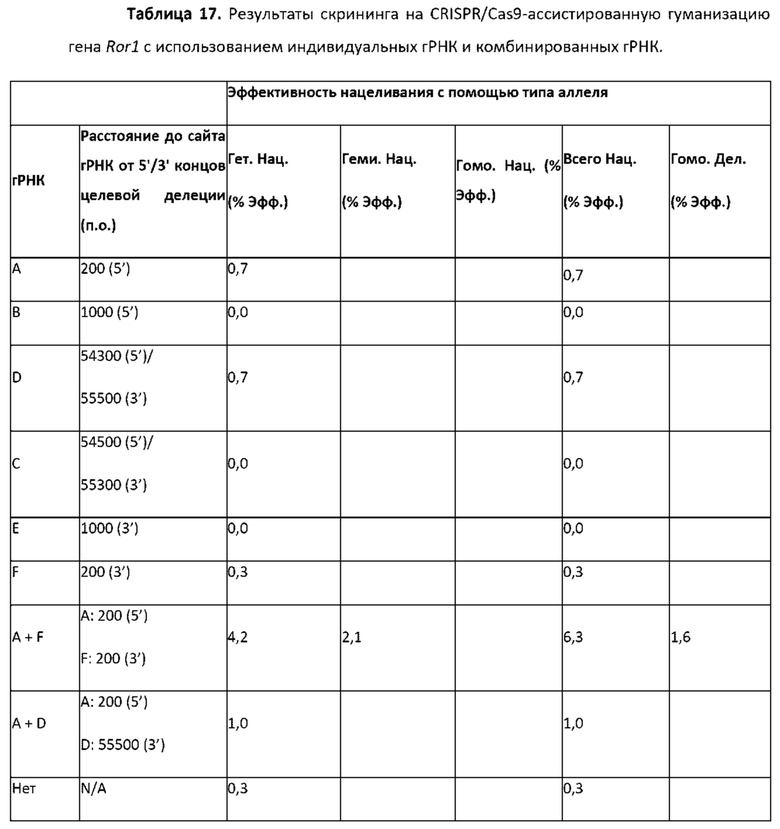
Trpa1 Локус
[000477] В другой серии экспериментов, LTVEC был спроектирован для создания делеции в 45,3 т.п.о. гена Trpa1 мыши (катионный канал транзиторного рецепторного потенциала, подсемейство А, член 1) и одновременной замены фрагментом 54,5 т.п.о. гомологичного гена TRPA1 человека. LTVEC содержал фрагмент размером 54,5 т.п.о. гена TRPA1 человека, фланкированный плечами гомологии, содержащий 41,0 т.п.о. и 58,0 т.п.о. геномной ДНК, полученной из частей локуса Trpa1 мыши, которые фланкируют последовательность 45,3 т.п.о. гена Trpa1 мыши, являющегося мишенью для делеции. В отдельных экспериментах, Trpa1 гуманизированный LTVEC комбинировали с плазмидой, кодирующей Cas9, и второй плазмидой, кодирующей одну из восьми гРНК (А, А2, В, С, D, Е2, Е и F; см. таблицу 1), предназначенную для создания двухцепочечных разрывов внутри участка гена Trpa1 мыши, который был нацелен на делецию. Эти гРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена TRPA1 человека. В других экспериментах мы объединили LTVEC и Cas9-кодирующую плазмиду с плазмидами, кодирующими две разные гРНК, которые нацелены на разные сайты в гене Trpa1, который был нацелен на делецию.
[000478] Результаты CRISPR/Cas9-ассистированной гуманизации гена Trpa1 показаны в таблице 18 и аналогичны результатам, полученным для CRISPR/Cas9-ассистированной гуманизации генов Lrp5 и С5 (Hc). Эффективность нацеливания только с LTVEC составила 0,3%, и добавление Cas9 и гРНК увеличивало эффективность нацеливания для шести из восьми протестированных гРНК. Сочетание В и F гРНК увеличило общую эффективность нацеливания на Trpa1 до 3,4% за счет увеличения частоты гетерозиготных, гемизиготных и гомозиготных событий нацеливания. Мы также обнаружили клоны ЭС-клеток с большими CRISPR-индуцированными делециями на обоих аллелях (наблюдаемые с частотой 0,3%).
[000479]
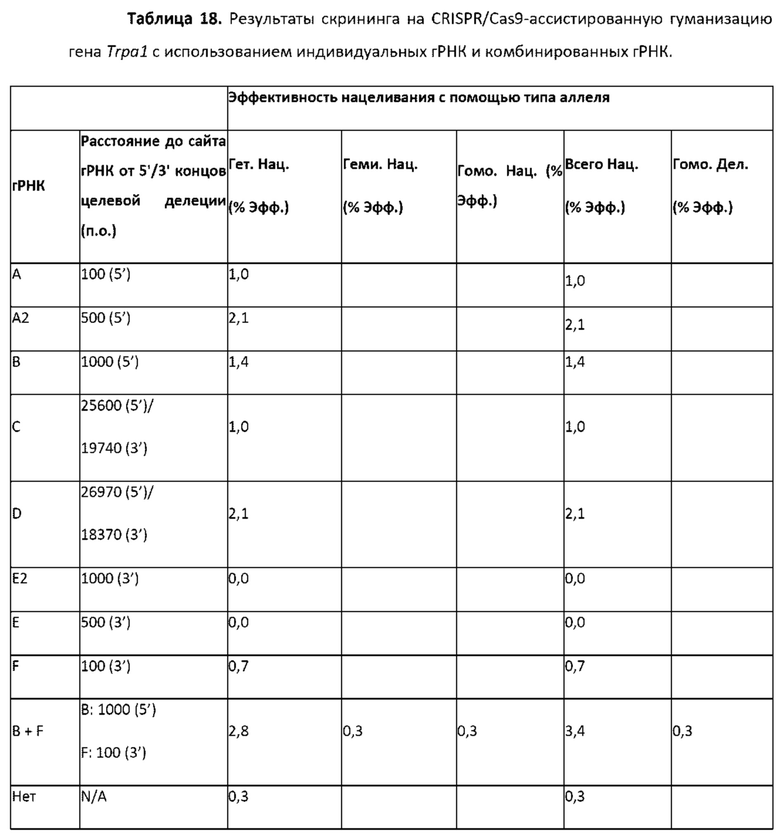
[000480] Как показывают эти примеры, использование двойных направляющих РНК в широко разделенных сайтах улучшило усиление гетерозиготной гуманизации по сравнению с одиночными гРНК. Кроме того, использование двойных направляющих РНК способствует развитию биаллельных событий по сравнению с одиночными гРНК. В отличие от нацеливания на одну гРНК, нацеливание на две гРНК приводит к созданию гомозиготно нацеленных клеток (Hum/Hum), в которых оба аллеля обладали направленной гуманизацией, гомозиготно удаленными клетками (Δ/Δ), в которых ни один аллель не был нацелен с помощью гуманизации LTVEC, но обе имели большие делеции, и гемизиготно нацеленные клетки (Hum/Δ), в которых один аллель имел направленную гуманизацию, а другой имел большую двойную гРНК/Cas9-индуцированную делецию. Во-первых, мы нашли правильно нацеленные клоны, которые имели точные и идентичные очень большие гуманизации на обоих аллелях-мишенях (например, клетки, которые были гомозиготными по нацеленной модификации гена). Хотя гомозиготно нацеленные клоны также наблюдались, когда мы использовали одну гРНК для достижения гуманизации Lrp5, они происходили с гораздо меньшей частотой, чем, когда мы использовали две гРНК (см. Таблицу 13). Аналогично, мы не наблюдали гомозиготного нацеливания при использовании одной гРНК для достижения гуманизации С5 (Hc) или гуманизации Trpa1, но мы наблюдали гомозиготное нацеливание при использовании двух гРНК с направленным вектором (см. Таблицы 15 и 18). Точно так же мы нашли правильно нацеленные клоны, которые были гемизиготными по модификации гена (т.е. они имели точно нацеленную гуманизацию на один аллель и очень большую, иногда генную абляцию, делецию на другом аллеле) для нацеливания на Lrp5, нацеливания на С5 (Hc), нацеливания на Ror1 и нацеливания на Trpa1. Таких модификаций вообще не происходило при использовании одной гРНК для достижения гуманизации Lrp5, С5 (Hc), Ror1 или Trpa1 (см. Таблицы 13, 15, 17 и 18 соответственно).
[000481] Во-вторых, мы обнаружили клоны, которые имели идентичные очень большие делеции (>45 т.п.о.), индуцированные событиями расщепления Cas9, управляемыми обеими гРНК на обоих нацеленных аллелях (т.е. клетки были гомозиготными по большой, иногда генно-абляционной, делеции в локусе-мишени). Эти типы мутаций не требуют нацеливающего вектора, направленного против того же гена. Например, как показано в таблице 15, мы получили ЭС-клетки с гомозиготными CRISPR-индуцированными делециями, путем объединения Cas9 и двух гРНК с направленным вектором, направленным против другого гена, не связанного с геном, на который нацелены гРНК. Таким образом, нуклеаза Cas9, управляемая двумя гРНК, может индуцировать большую делецию в клетках без добавления нацеливающего вектора. В таких случаях временный или стабильный лекарственный отбор, обеспечиваемый вектором, который экспрессирует ген лекарственной устойчивости, может облегчить выделение редких гомозиготных делеционных клонов путем обогащения ЭС-клеток, которые поглощают ДНК.
Пример 6. Анализ больших делеций, вызванных комбинированными гРНК.
Аллельные структуры для больших делеций, индуцированных комбинированными гРНК
[000482] Дополнительный анализ последовательности проводили на клонах, содержащих большие делеции, индуцированные событиями расщепления Cas9, управляемыми двумя гРНК (см. Таблицу 19). Эти большие делеции, по-видимому, не зависят от событий LTVEC-направленной гомологичной рекомбинации в том же локусе, поскольку мы получили большие делеции в локусе Lrp5 примерно с той же частотой, когда мы объединили гРНК либо с LTVEC Lrp5, либо с одной, направленной на ген Ch25h почти 30 Мб (данные не показаны). Чтобы охарактеризовать большие делеции, мы провели ПЦР, охватывающую делецию, для 40 клонов, 15 гемизиготных и 25 с биаллельными крупными делециями, из шести гуманизации и сиквенированных отдельных клонов продуктов ПЦР. Последовательности подтвердили большие делеции, которые варьировались от 38 т.п.о. до 109 т.п.о. Три из клонов ЭС-клеток (Lrp5 клоны AW-A8 и BP-D3 и Adamts5 клон Х-В11) имели идеально восстановленные точные делеции (68,2 т.п.о.) между предсказанными сайтами расщепления Cas9, в то время как один клон (Hc клон Р-В12) имел вставку одной пары оснований в дополнение к делеции 38,1 т.п.о. Двадцать семь из клонов ЭС-клеток имели делеции, которые выходили за пределы сайтов расщепления Cas9, что согласуется с неточной репарацией посредством негомологичного соединения конца (NHEJ). Оставшиеся девять клонов ЭС-клеток имели мутации, которые объединяли очевидные NHEJ-индуцированные делеции и вставки (например, клон Lrp5 BP-F6 и клон Hc O-Е4), пять из которых имели вставки размером более чем 200 п.о., которые мы могли сопоставить с их источником геномных локусов (данные не показаны). Вставка длиной 210 п.о. в клоне Lrp5 ВО-Е9 находилась в инвертированной ориентации относительно идентичной последовательности, лежащей примерно в 2600 п.о. за пределами сайта-мишени гРНК F в центромерном направлении (хромосома 19+, 3589138-3589347). Эта последовательность присутствовала в длинном 3' плече гомологии Lrp5 LTVEC. Клоны Lrp5 BP-F6 и BP-G7 были получены из эксперимента, в котором мы объединили Lrp5 гРНК А и F с Cas9 и LTVEC, который нацелен на ген Ch25h на расстоянии 30 Мб от Lrp5 в теломерном направлении. Клон BP-F6 имел вставку размером 266 п.о., которая, по-видимому, происходила от одного конца LTVEC Ch25h, поскольку он состоял из фрагмента длиной 103 п.о., идентичного части вектора остова, связанной с фрагментом длиной 163 п.о., который был идентичен последовательности около Ch25h и также присутствует в длинном плече LTVEC (хромосома 19+, 34478136-34478298); этот фрагмент был вставлен при делеции в инвертированной ориентации по отношению к эндогенной хромосомной последовательности. Hc клон O-Е4 имел вставку размером 254 п.о., которая была инвертирована относительно идентичной последовательности, обнаруженной в удаленной последовательности, приблизительно на расстоянии 3,1 т.п.о. от последовательности, узнаваемой гРНК А. Вставка длиной 1304 п.о. в Hc клон S-D5 была составлена из двух фрагментов: кусок размером в 1238 п.о., который находился в той же ориентации, что и идентичная последовательность, обнаруженная в удаленной последовательности, на расстоянии приблизительно 1,4 т.п.о. от предсказанного гРНК Е2-направленного сайта расщепления Cas9, и второй кусок размером в 66 п.о., который представлял собой дупликацию в инвертированной ориентации идентичной последовательности в 25 п.о. вне сайта разрезания гРНК Е2.
[000483]
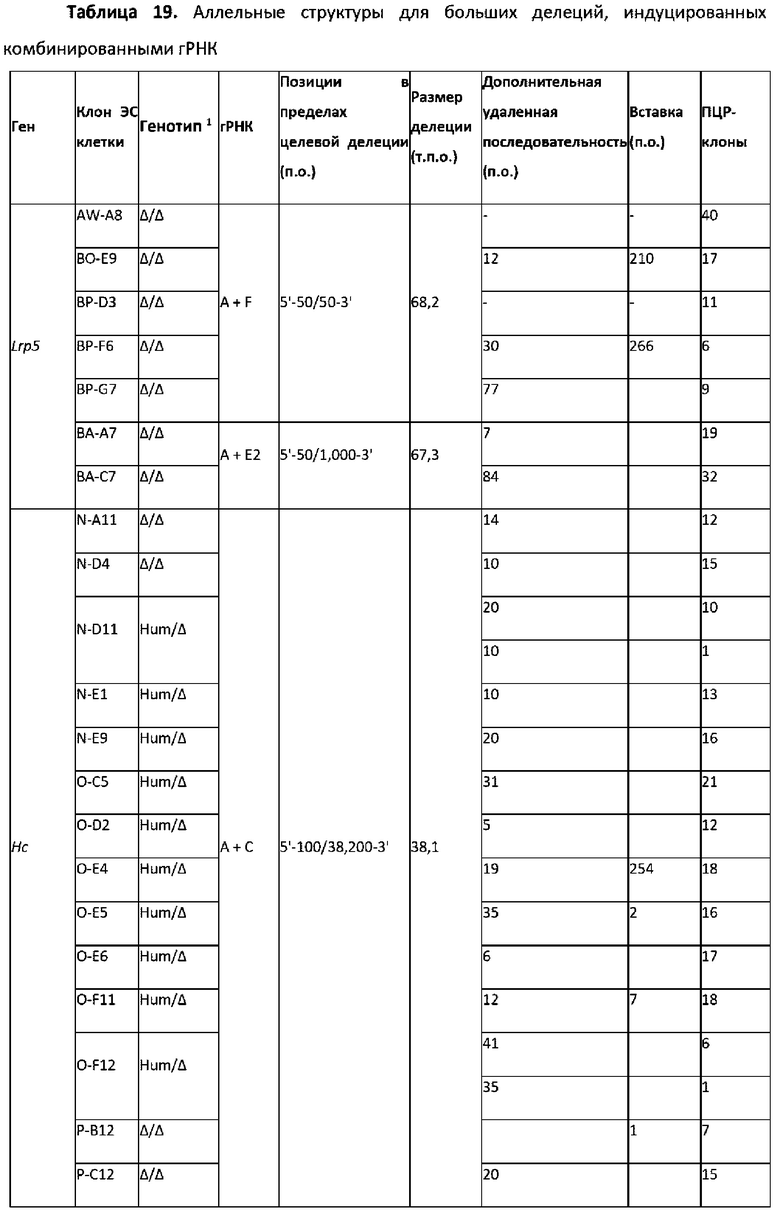
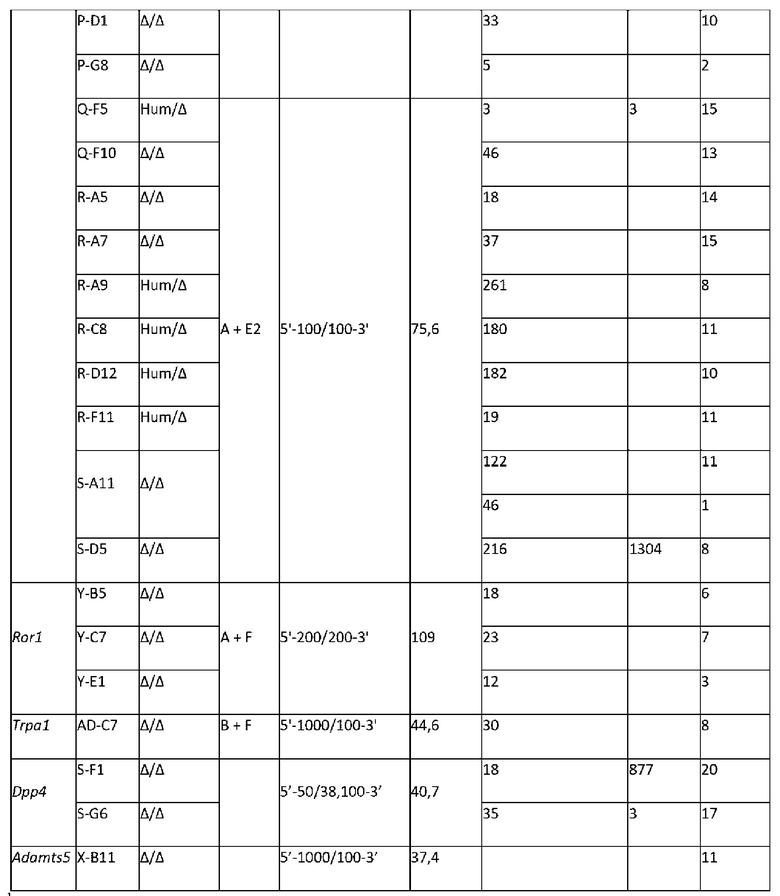
1Hum/+, направленная гуманизация одного из двух нативных аллелей, приводящая к гетерозиготному генотипу; Hum/Δ, биаллельная модификация, в которой один аллель имеет целевую гуманизацию, а другой имеет большую Cas9-гРНК-индуцированную делецию, приводящую к гемизиготному генотипу; Hum/Hum, биаллельная модификация, в которой оба аллеля имеют целевую гуманизацию, приводящую к гомозиготному генотипу; Δ/Δ биаллельная модификация, в которой оба аллеля имеют большую Cas9-гРНК-индуцированную делецию.
Доказательства конверсии генов в гомозиготных аллелях
[000484] Двадцать четыре из двадцати пяти клонов ЭС-клеток с биаллельными крупными делециями имели только одну уникальную последовательность (таблица 19), что указывает на то, что они были гомозиготными аллелями. Для Hc клона S-A11 мы нашли ту же последовательность в 11 из 12 ПЦР клонов. Одиночный клон с другой последовательностью может указывать на два разных делеционных аллеля, но мы также обнаружили один и тот же результат для двух гемизиготных Hc клонов, N-D11 и O-F12. Различные гомозиготные делеционные аллели во многих клонах позволяют предположить, что они могли возникнуть по механизму конверсии генов, в котором делеция на одной хромосоме служила матрицей для гомологичной рекомбинационной репарации Cas9 расщеплений на гомологичной хромосоме. Мы использовали гибридную композицию 129S6SvEvTac (129) и C57BL/6NTac (В6) F1 клеточной линии VGF1 ЭС (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99; Valenzuela et al. (2003) Nat. Biotechnol. 21: 652-659) для анализа конверсии генов в виде потери гетерозиготности (Lefebvre et al. (2001) Nat. Genet. 27: 257-258) для структурных (SV) и однонуклеотидных (SNV) вариантов между линиями вокруг локуса Lrp5 на хромосоме 19 (см. фигуру 12 для пяти SV-анализов и десяти SNV-анализов, использованных ниже) и локуса Hc на хромосоме 2 (не показано). Чтобы подтвердить, что любая потеря гетерозиготности не была результатом потери всей хромосомы, мы выполнили анализы количества копий хромосом (CCN) в сайтах, которые были идентичны между линиями 129 и В6. Для Lrp5 гуманизированных или удаленных аллелей мы проанализировали многие SV и SNV, расположенные на расстоянии 1,2 Мб от Lrp5 в теломерном направлении до конца длинного плеча хромосомы 19 (фигура 12). Из-за местоположения Lrp5 вблизи центромеры мы не обнаружили SV и только одно SNV на центромерной стороне гена. Для Hc мы смогли проанализировать многие SV и SNV с обеих сторон гена в хромосоме 2 (не показано). Результаты для шести клонов Lrp5 показаны на фигуре 15А-Е и 16А-С.
[000485] На фигуре 15А-Е показаны результаты пяти анализов SV, чьи позиции варьировались от 13,7 Мб от Lrp5 до 56,7 Мб рядом с теломерным концом длинного плеча. В результате пяти SV-анализов были получены два продукта разных размеров для аллелей 129 (больше) и В6 (меньше) в контролях 129, В6 и VGF1. Приблизительные положения SV-анализов на карте хромосомы 19 показаны на фигуре 12 (см. анализ SV 13,7, анализ SV 20,0, анализ SV 36,9, анализ SV 48,3 и анализ SV 56,7). Номер анализа представляет количество Мб теломера до Lrp5. Праймеры для этих анализов показаны в Таблице 1, а результаты показаны на Фигуре 15А-Е. Два из клонов, ВС-Н9 (Lrp5Hum/Hum, гРНК В2) и BR-B4 (Lrp5Hum/Hum, гРНК D), продемонстрировали потерю гетерозиготности, которая сохранила все аллели В6 SV, в то время как третий клон, В0-А8 (Lrp5Hum/Hum, гРНК А+F), сохранил все 129 аллелей. Остальные три клона, BO-F10 (Lrp5Hum/Hum, гРНК А+F), BO-G11 (Lrp5Hum/Hum, гРНК А+F) и BP-G7 (Lrp5Δ/Δ, гРНК А+F), остались гетерозиготными.
[000486] Кроме того, одиночные нуклеотидные варианты (SNV) между аллелями 129 и В6 были проанализированы с помощью анализа аллельной дискриминации TAQMAN®. Приблизительные положения анализов SNV на карте хромосом 19 на фигуре 12 показаны стрелками с номерами анализов внизу, а их расстояния (в Мб) от локуса Lrp5 приведены ниже. Расстояния (в Мб) от локуса Lrp5 следующие: 0,32 центромера Lrp5 (С2), 1,2 теломера Lrp5 (T3), 11,1 теломера Lrp5 (T6), 13,2 теломера Lrp5 (T7), 17,5 теломера Lrp5 (T8), 25,8 теломера Lrp5 (T9), 33,0 теломера Lrp5 (T10), 38,3 теломера Lrp5 (T11), 49,6 теломера Lrp5 (Т13) и 57,2 теломера Lrp5 (T14). 129-специфичные и В6-специфичные зонды и пары праймеров показаны в таблице 1. Результаты для трех клонов (ВС-Н9, ВО-А8 и BR-B4), которые показали теломерную потерю гетерозиготности (LOH) с помощью SV-анализов, показаны на фигуре 16А-С. Анализы SNV (фигура 16А-С и данные не показаны) подтвердили события конверсии генов на длинном плече хромосомы 19 на теломерной стороне Lrp5 (SNV 1,2 и SNV 57,2; см. фигуру 16В и фигуру 16С соответственно), но анализ SNV 0,32 (см. фигуру 16А) показал, что все клоны оставались гетерозиготными для аллеля в 320 т.п.о. от Lrp5 на центромерной стороне. Из 24 проанализированных клонов Lrp5Hum/Hum или Lrp5Δ/Δ мы обнаружили шесть, у которых были признаки потери гетерозиготности по всему длинному плечу хромосомы 19 на теломерной стороне Lrp5. Пять из клонов (четыре Lrp5Hum/Hum и один Lrp5Δ/Δ) превращаются из гетерозиготных в гомозиготные В6, а шестой клон (Lrp5Hum/Hum) превращается в гомозиготный 129. Анализы CCN продемонстрировали сохранение двух копий хромосомы 19. Аналогичные анализы потери гетерозиготности для 21 гомозиготных Hc клона показали, что два, R-E2 (HcHum/Hum, гРНК А+F) и R-E8 (HcΔ/Δ, гРНК А+F), показали потерю гетерозиготности по отношению к гомозиготным 129 для всех SV и SNV на теломерной стороне гена Hc, сохраняя при этом гетерозиготность по всем аллелям на центромерной стороне. Анализы CCN показали отсутствие потери хромосомы 2.
[000487] Наши результаты впервые демонстрируют, что CRISPR/Cas9 может улучшить гомологически направленную репарацию для больших одношаговых гуманизаций размером более 100 т.п.о., что расширяет возможности для крупномасштабной инженерии генома. Самым замечательным и неожиданным преимуществом объединения LTVEC и гРНК/Cas9 была их способность стимулировать гомозиготную целевую гуманизацию. Хотя в других экспериментах CRISPR/Cas9 сообщалось о биаллельных мутациях и событиях гомозиготного нацеливания, большинство этих модификаций генов и вставок были на порядки меньше, чем наши гуманизированные аллели. До использования CRISPR/Cas9 мы никогда не обнаруживали гомозиготное нацеливание с помощью LTVEC, и мы не видели одновременного нацеливания более чем на один ген, когда мы объединяли несколько LTVEC, нацеленных на отдельные гены. Учитывая этот опыт, гомозиготное гРНК/Cas9-индуцированное нацеливание, позволило предположить, что вместо двух LTVEC, по отдельности нацеливающихся на оба аллеля, начальное событие нацеливания на один аллель может служить матрицей для гомологичного превращения другого аллеля, стимулируемого одним или более разрезами Cas9. Раскрытие того факта, что двойные гРНК/Cas9-индуцированные большие биаллельные делеции также были гомозиготными (таблица 19), обеспечило дополнительную поддержку механизма конверсии генов.
[000488] Анализ потери гетерозиготности (фигура 12) продемонстрировал, что крупномасштабная конверсия генов многих аллелей, покрывающих большой фрагмент хромосомы на теломерной стороне гена-мишени, была ответственна за некоторые гомозиготные гуманизации и большие делеции. Этот тип направленной конверсии генов на большие расстояния согласуется с митотической рекомбинацией между реплицированными хроматидами гомологичных хромосом в фазе G2 клеточного цикла (Lefebvre et al. (2001) Nat. Genet. 27:257-258) (Фигура 17A-C). Хотя это объяснило лишь меньшую часть гомозиготных событий, этот механизм может обеспечить средство, с помощью которого расщепление гРНК/Cas9 может использоваться для стимулирования крупномасштабной конверсии из гетерозиготного в гомозиготного по многим аллелям на большой части хромосомы. Однако большинство гомозиготных явлений, по-видимому, были результатом локальной конверсии генов, механизм которой заслуживает дальнейшего изучения.
[000489] Дальнейшие доказательства направленной конверсии генов на большие расстояния были предоставлены с помощью анализа трех клонов, полученных после электропорации гибридных ЭС-клеток F1H4 (которые состоят из 50% линии 129SvS6 и 50% линии C57BL/6N) с плазмидами, кодирующими Lrp5 гРНК А и F, а плазмида, кодирующая Cas9, и LTVEC, который нацелен на ген Ch25h в 30 Мб от Lrp5 в теломерном направлении. Три клона первоначально были оценены как дикий тип после первичного скрининга с использованием анализов TAQMAN® внутри предсказанной делеции между 2 гРНК (500 п.о. на 5'-конце и 2 т.п.о. на 3'-конце), но последующие анализы аллельной дискриминации TAQMAN®, анализирующие только варианты нуклеотидов (SNV) между аллелями 129 и В6 неожиданно выявили потерю гетерозиготности. Использовали анализы SNV: один центромерный анализ (SNV 0,32) и два теломерных анализа (SNV 1,2 и SNV 57,2) (см. фигуру 12). Как показано в таблице 20, центромерный SNV анализ (0,32 Мб) подтвердил сохранение гетерозиготности во всех трех клонах. Однако оба теломерных анализа SNV показали, что ВР-Е7 и ВР-Н4 были гомозиготными по аллелю 129, а оба теломерных анализа SNV показали, что ВР-Е6 был гомозиготным по аллелю В6. Все три клона показали сохранение двух копий хромосомы 19, и все три клона были трансгенными для нацеливания LTVEC (то есть, был нацелен на локус Ch25h). Эти результаты открывают возможность принудительной гомозиготности с помощью направленного расщепления CRISPR/Cas9.
[000490]

[000491] Несколько возможных механизмов могут объяснить результаты, наблюдаемые в экспериментах по CRISPR/Cas9-ассистированной гуманизации LTVEC в гибридных ЭС-клетках F1H4 мыши (которые состоят из 50% линии 129SvS6 и 50% линии C57BL/6N) (см. Фигуру 18A-F). Такие механизмы могут происходить посредством реципрокного обмена хроматидами путем митотического кроссинговера (см. Фигуру 18А-С) или путем копирования хроматид посредством репликации, вызванной разрывом (см. Фигуру 18D-E). В любом случае может произойти гетерозиготная модификация, в которой хромосома 129 или хромосома В6 нацеливается с помощью LTVEC до репликации генома (см. Фигуру 18А и 18D). В качестве альтернативы, одна хроматида 129 или одна хроматида В6 может быть мишенью LTVEC после репликации генома с последующей конверсией гена между хроматидами (см. Фигуру 18В и 18Е). Альтернативно, может быть недостаток нацеливания LTVEC на геномный локус-мишень, но расщепление Cas9 может происходить на хромосоме 129 или В6 (см. Фигуру 18С и 18F). Эта последняя возможность может объяснить результаты, наблюдаемые с клонами ВР-Е7, ВР-Н4 и ВР-Е6. Потенциальные результаты показаны на фигуре 18A-F. На фигуре 18F также можно наблюдать потерю гетерозиготности (LOH), сохраняя аллели В6, если Cas9 расщепляет хроматиду 129. В описанных выше экспериментах наблюдались события потери гетерозиготности, в результате чего оба аллеля были целевыми (Hum/Hum) или оба аллеля были аллелями дикого типа (+/+).
Пример 7. Гомозиготное нацеливание на гены с наименьшим изменением между В6 и 129 аллелями.
[000492] Несколько других локусов также были протестированы на гомозиготное нацеливание. В другом эксперименте, LTVEC был разработан для создания 38 т.п.о. делеции гена Adamts5 мыши (дисинтегрин и металлопротеиназа с мотивами тромбоспондина 5) и одновременной замены фрагментом в 43 т.п.о. гена ADAMTS5 человека. LTVEC содержал фрагмент размером 43 т.п.о. гена ADAMTS5 человека, фланкированный плечами гомологии, содержащий 22 т.п.о. и 46 т.п.о. геномной ДНК, полученной из частей локуса Adamts5 мыши, которые фланкируют последовательность 38 т.п.о. гена Adamts5 мыши, являющегося мишенью для делеции. В отдельных экспериментах, мы объединяли Adamts5 гуманизирующий LTVEC с плазмидой, кодирующей Cas9, и второй плазмидой или плазмидами, кодирующими одну или две из восьми огРНК (gA, gA2, gB, gC, gD, gE, gE2 и gF), предназначенных для создания двухцепочечных разрывы цепи в участке гена Adamts5 мыши, который был нацелен на делецию. Эти огРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части ADAMTS5 человека.
[000493] Результаты CRISPR/Cas9-ассистированной гуманизации гена Adamts5 показаны в таблице 21. Когда в ЭС клетки вводили только LTVEC, мы обнаружили, что ни один из 96 скринированных устойчивых к лекарству клонов не содержит правильно нацеленного моноаллельного гетерозиготного гуманизированного аллеля. Напротив, объединение LTVEC с эндонуклеазой Cas9, управляемой двумя из восьми протестированных огРНК (В и F; см. Таблицу 1), давало правильно нацеленные моноаллельные гетерозиготные мутации или гетерозиготные мутации биаллельного соединения с эффективностью 1,0%. Гомозиготных целевых модификаций не наблюдалось. В дополнительных экспериментах, гРНК А2 и Е2 также объединяли, но гомозиготного нацеливания все еще не наблюдалось.
[000494]
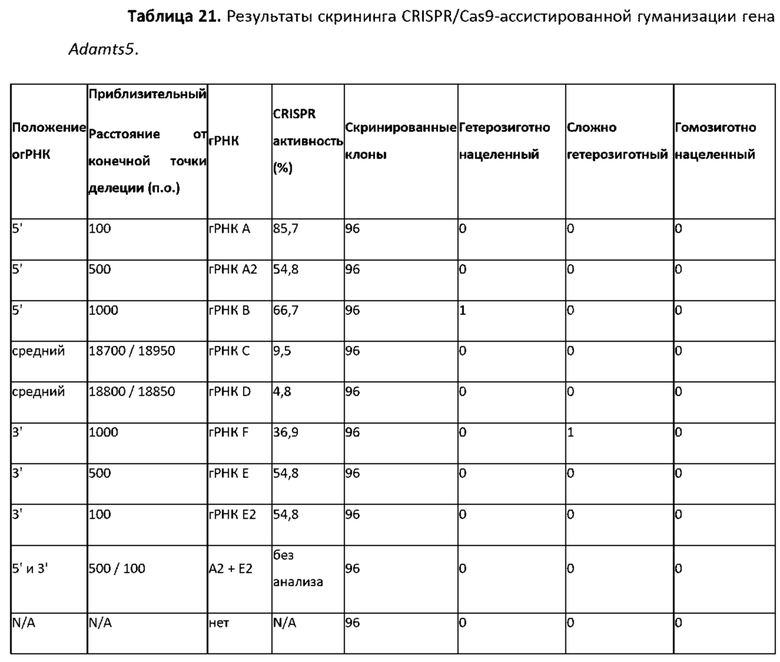
[000495] В другом эксперименте, LTVEC был разработан для создания делеции размером 79 т.п.о. гена Dpp4 мыши (дипептидил пептидазы 4) и одновременной замены фрагментом размером 82 т.п.о. гомологичного гена DPP4 человека. LTVEC содержал фрагмент размером 82 т.п.о. гена DPP4 человека, фланкированный 5' и 3' плечами гомологии, каждое из которых содержит 46 т.п.о. геномной ДНК, полученной из частей локуса Dpp4 мыши, которые фланкируют последовательность 79 т.п.о. гена Dpp4 мыши, являющегося мишенью для делеции. В отдельных экспериментах, мы объединяли Dpp4 гуманизирующий LTVEC с плазмидой, кодирующей Cas9, и второй плазмидой или плазмидами, кодирующими одну или две из восьми огРНК (gA, gB, gB2, gC, gD, gE, gE2 и gF), предназначенных для создания двухцепочечных разрывы цепи в участке гена Dpp4 мыши, который был нацелен на делецию. Эти огРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена DPP4 человека.
[000496] Результаты гуманизации гена Dpp4 с помощью CRISPR/Cas9 показаны в таблице 22. Когда в ЭС клетки вводили только LTVEC, мы обнаружили, что 2,1% скринированных устойчивых к лекарству клонов не содержит правильно нацеленного моноаллельного гетерозиготного гуманизированного аллеля. Напротив, объединение LTVEC с эндонуклеазой Cas9, управляемой любой из восьми протестированных огРНК (А, В, В2, С, D, Е, Е2 и F; см. Таблицу 1), приводит к правильно нацеленным моноаллельным гетерозиготным мутациям с эффективностью, которая варьируется от 2,1 до 7,3%. Гомозиготных целевых модификаций не наблюдалось. В дополнительных экспериментах, гРНК А и F или гРНК А и D также объединяли, но гомозиготного нацеливания все еще не наблюдалось.
[000497]
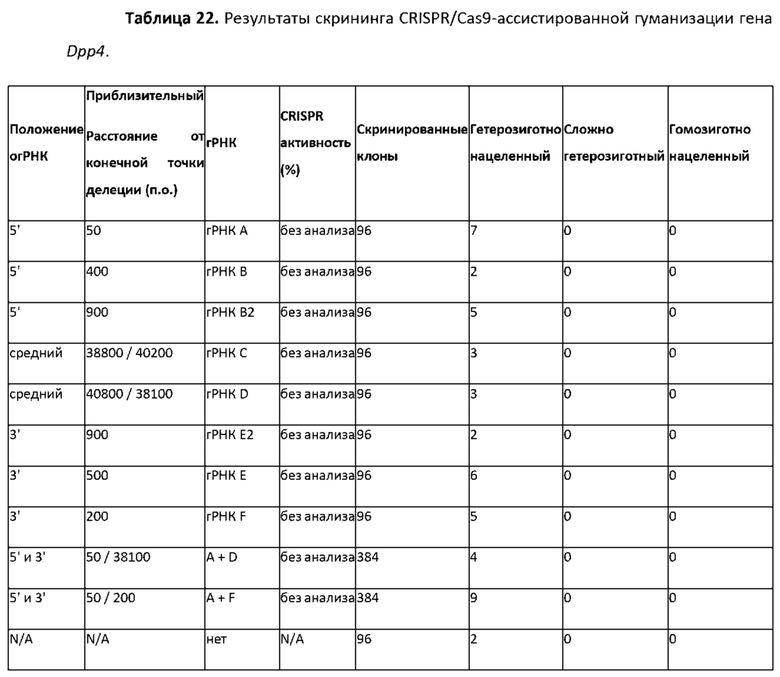
[000498] В другом эксперименте, LTVEC был разработан для создания делеции размером 55 т.п.о. гена Folh1 мыши (глутамат карбоксипептидазы 2) и одновременной замены фрагментом размером 61 т.п.о. гомологичного гена FOLH1 человека. LTVEC содержал фрагмент размером 61 т.п.о. гена FOLH1 человека, фланкированный плечами гомологии, содержащий 22 т.п.о. и 46 т.п.о. геномной ДНК, полученной из частей локуса Folh1 мыши, которые фланкируют последовательность 55 т.п.о. гена Folh1 мыши, являющегося мишенью для делеции. В отдельных экспериментах, мы объединяли Folh1 гуманизирующий LTVEC с плазмидой, кодирующей Cas9, и второй плазмидой или плазмидами, кодирующими одну или две из восьми огРНК (gA, gA2, gB, gC, gD, gF, gE и gE2), предназначенных для создания двухцепочечных разрывов цепи в участке гена Folh1 мыши, который был нацелен на делецию. Эти огРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части гена FOLH1 человека.
[000499] Результаты CRISPR/Cas9-ассистированной гуманизации гена Folh1 показаны в таблице 23. Когда в ЭС клетки вводили только LTVEC, мы обнаружили, что ни один из 96 скринированных устойчивых к лекарству клонов не содержит правильно нацеленного моноаллельного гетерозиготного гуманизированного аллеля. Напротив, объединение LTVEC с эндонуклеазой Cas9, управляемой тремя из шести протестированных огРНК (A, D, и Е2; см. Таблицу 1), приводит к правильно нацеленным моноаллельным гетерозиготным мутациям с эффективностью, которая варьируется от 1,0 до 3,1%. Гомозиготных целевых модификаций не наблюдалось. В дополнительных экспериментах, гРНК А и Е2 или гРНК А и D также объединяли, но гомозиготного нацеливания все еще не наблюдалось.
[000500]
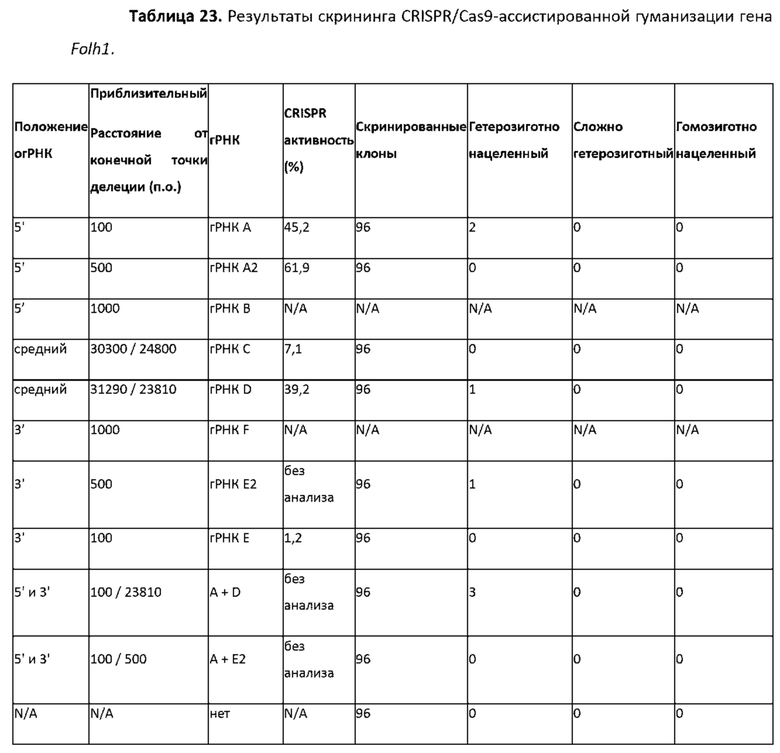
[000501] Сумма гомозиготных целевых клонов, наблюдаемых при нацеливании на разные локусы, представлена в таблице 24.
[000502]
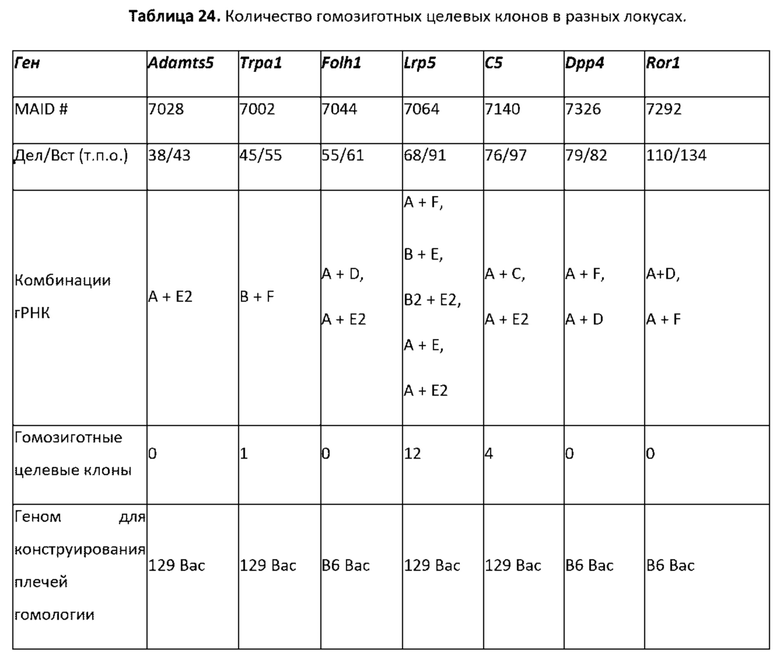
[000503] В этих экспериментах, гомозиготное нацеливание было самым высоким для генов с наименьшей вариацией последовательности между аллелями В6 и 129. Это изображено на фигурах 19-25. Участок внутри пунктирных вертикальных линий на каждой фигуре указывает на целевой участок (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Например, для Lrp5 (см. фигуру 19) плечи гомологии LTVEC были разработаны на основе генома 129. Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с линией 129S6/SvEv от Taconic Biosciences, линией C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N. Вертикальные линии представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью. На фигурах 20-25 представлен аналогичный анализ для Hc, Trpa1, Adamts5, Folh1, Dpp4, Ror1 и CD3 соответственно.
[000504] Как показано в таблице 24 и на фигурах 19-25, наибольшее количество нацеленных гомозиготных клонов было продуцировано в локусе Lrp5 (12 гомозиготных клонов) и локусе Нс/С5 (4 гомозиготных клона). Каждый из этих геномных локусов-мишеней имел очень мало единичных нуклеотидных вариаций, особенно в или около последовательностей, распознаваемых гРНК, или фланкирующих участок, являющийся мишенью для делеции и замены (см. Фигуру 19 (Lrp5) и 20 (С5)).
[000505] Напротив, гомозиготное нацеливание было низким или отсутствовало для генов с высокой плотностью вариации аллельной последовательности между аллелями В6 и 129, особенно в или около последовательностей, распознаваемых гРНК, или фланкирующих участок, являющуюся мишенью для делеции и замены. Например, при нацеливании на локусы Adamts5, Folh1, Dpp4 или Ror1 не было получено гомозиготных клонов (Фигуры 22-25, соответственно). Однако при нацеливании на локус Trpa1 был получен гомозиготный клон, который имеет высокую плотность вариации аллельной последовательности 3' участка, являющегося мишенью для делеции и замены, но низкую плотность вариации аллельной последовательности 5' участка, являющегося мишенью для делеции и замены (т.е. в или около 5'-последовательности, распознаваемой гРНК) (Фигура 21).
Пример 8. Использование направленных векторов, созданных против каждой хромосомы в гомологичной хромосомной паре, не увеличивает гомозиготное нацеливание.
[000506] Чтобы дополнительно проверить, генерировались ли гомозиготные нацеленные модификации с помощью независимых событий нацеливания на каждую хромосому в гомологичной паре хромосом или с помощью события нацеливания на одну хромосому в гомологичной паре хромосом, а затем конверсии гена или потери гетерозиготности даже между гомологичной парой хромосом, был нацелен другой геномный локус, который имеет большое количество вариаций аллельной последовательности между гомологичной парой хромосом в или около последовательности, распознаваемой гРНК, или фланкирующей участок, являющийся мишенью для делеции и замены. См., например, Фигура 26. Это позволило нам изучить влияние аллельных вариаций на гомозиготное разрушение или гомозиготное нацеливание. Участок внутри пунктирных вертикальных линий является участком-мишенью (участок внутри 5' и 3' последовательностей-мишеней LTVEC). Эталонной последовательностью для определения одиночных нуклеотидных вариаций была геномная последовательность линии мыши C57BL/6J от Jackson Laboratory. Эта эталонная последовательность сравнивалась с вариантом MP линии 129S6/SvEv от Taconic Biosciences, вариантом RGC линии C57BL/6N от Taconic Biosciences и гибридной клеточной линией VGF1, полученной из линии 129S6/SvEv и линии C57BL/6N (представленного в трех рядах в нижней части фигуры). Вертикальные линии в каждом из трех рядов представляют собой одиночные нуклеотидные вариации по сравнению с эталонной последовательностью.
[000507] В этом эксперименте два LTVEC были спроектированы для создания делеции мышиного локуса размером 33 т.п.о. и одновременной замены фрагментом размером 34,5 т.п.о., включающим три сегмента (6,8 т.п.о., 0,1 т.п.о. и 1,7 т.п.о.) ортологичного гена человека с промежуточными сегментами локуса мыши между человеческими сегментами. Эксперименты были выполнены с VGF1 (F1H4), нашей гибридной XY ЭС-клеточной линией C57BL6NTac/129S6SvEvF1 (Poueymirou et al. (2007) Nat. Biotechnol. 25:91-99; Valenzuela et al. (2003) Nat. Biotechnol. 21:652-659). ЭС клетки культивировали, как описано ранее (Matise et al. (2000) in Joyner, A.L. ed. Gene Targeting: a practical approach, pp. 100-132, Oxford University Press, Нью-Йорк). Клетки VGF1 были созданы путем скрещивания самки мыши C57BL/6NTac с самцом мыши 129S6/SvEvTac для получения мышей C57BL6(XB6)/129S6(Y129). См. Фигуру 7.
[000508] Один LTVEC имел плечи гомологии, сконструированные против хромосомы 129 в клетках VGF1, и включал в себя кассету для селекции Neo (MAID # 7170), а другой LTVEC имел плечи гомологии, сконструированные против хромосомы C57BL6, и включал кассету для селекции Hyg (MAID # 7314). В остальном два LTVEC были одинаковыми.
[000509] В отдельных экспериментах мы объединили два гуманизированных LTVEC с плазмидой, кодирующей Cas9, и второй плазмидой или плазмидой, кодирующей четыре огРНК (mGU, mGU2, mGD, mGD2), предназначенных для создания двухцепочечных разрывов в участке гена мыши, который являлся мишенью для делеции. Эти огРНК были сконструированы так, чтобы избежать распознавание любой последовательности во вставленной части человеческого гена.
[000510] Всего был проведен скрининг 192 клонов Neo+, 128 клонов Hyg+ и 16 клонов Neo+/Hyg+. Комбинирование LTVEC с эндонуклеазой Cas9, управляемой четырьмя огРНК, привело к образованию некоторых гетерозиготно нацеленных клонов, гемизиготно нацеленных клонов, клонов с двойным разрушением, гетерозиготно нацеленных клонов с делециями NHEJ, клонов с биаллельными делециями NHEJ, и гетерозиготно разрушенных клонов с NHEJ делециями. Однако, гомозиготных клонов-мишеней не наблюдалось. Это говорит о том, что события локальной конверсии генов ответственны за гомозиготно нацеленные клоны, наблюдаемые в других экспериментах, а не за отдельные события нацеливания на каждую хромосому в пределах гомологичной пары хромосом. Если независимые события нацеливания на каждую хромосому в пределах гомологичной пары хромосом ответственны за гомозиготно нацеленные клоны, наблюдаемые в других экспериментах, можно ожидать, что использование двух направленных векторов, специально предназначенных для каждой из двух хромосом в пределах гомологичной пары хромосом, приведет к получению гомозиготно нацеленных клонов, несмотря на высокий процент вариации аллельных последовательностей в 5'- и 3'-последовательностях-мишенях для 5'- и 3'-плечах гомологии, поскольку нацеливающие векторы, предназначенные для каждого адреса хромосомы, которые имеют вариации аллельных последовательностей в 5'- и 3'-последовательностях-мишенях. Однако использование двух LTVEC не давало любых гомозиготно нацеленных клонов. Это также подтверждает идею о том, что гомозиготно нацеленные модификации или продуцируются в результате локальных событий конверсии генов, как изображено на фигуре 27. Мы наблюдали локальную потерю гетерозиготности по обеим сторонам целевых делеций и вставок с более высокой скоростью, чем полярную генную конверсию.
--->
Перечень последовательностей
<110> Regeneron Pharmaceuticals, Inc.
<120> СПОСОБЫ НАРУШЕНИЯ ИММУНОЛОГИЧЕСКОЙ ТОЛЕРАНТНОСТИ
С ИСПОЛЬЗОВАНИЕМ МНОЖЕСТВА НАПРАВЛЯЮЩИХ РНК
<130> 057766/497023
<150> 62/339472
<151> 2016-05-20
<150> 62/368604
<151> 2016-07-29
<160> 152
<170> FastSEQ для Windows версия 4.0
<210> 1
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность, распознаваемая направляющей РНК
<220>
<221> misc_feature
<222> (2)...(21)
<223> n = A, T, C, или G
<400> 1
gnnnnnnnnn nnnnnnnnnn ngg 23
<210> 2
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность, распознаваемая направляющей РНК
<220>
<221> misc_feature
<222> (1)...(21)
<223> n = A, T, C, или G
<400> 2
nnnnnnnnnn nnnnnnnnnn ngg 23
<210> 3
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность, распознаваемая направляющей РНК
<220>
<221> misc_feature
<222> (3)...(23)
<223> n = A, T, C, или G
<400> 3
ggnnnnnnnn nnnnnnnnnn nnngg 25
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК A ДНК-нацеливающий сегмент (100 п.о. от конечной
точки локуса-мишени)
<400> 4
atcacaaacc agttaaccgg 20
<210> 5
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК B ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 5
tttcagacga gccgacccgg 20
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК C ДНК-нацеливающий сегмент (38200 и 37500 п.о.
от конечной точки локуса-мишени)
<400> 6
tgtgtgtcat agcgatgtcg 20
<210> 7
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК D ДНК-нацеливающий сегмент (43500 и 32200 п.о.
от конечной точки локуса-мишени)
<400> 7
aacaggtacc ctatcctcac 20
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК E ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 8
ggcccggacc tagtctctct 20
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C5 (Hc) гРНК E2 ДНК-нацеливающий сегмент (100 п.о. от конечной
точки локуса-мишени)
<400> 9
tcgtggttgc atgcgcactg 20
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК A ДНК-нацеливающий сегмент (50 п.о. от конечной
точки локуса-мишени)
<400> 10
gggaacccac agcatactcc 20
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК B ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 11
gaatcatgca cggctacccc 20
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК B2 ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 12
tgctcctatg gggaggcgcg 20
<210> 13
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК C ДНК-нацеливающий сегмент (29900 и 38430 п.о. от конечной
точки локуса-мишени)
<400> 13
actgagatca atgaccccga 20
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК D ДНК-нацеливающий сегмент (29950 и 38380 п.о. от конечной
точки локуса-мишени)
<400> 14
gggtcgcccg gaacctctac 20
<210> 15
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК E2 ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 15
cttggataac attgataccc 20
<210> 16
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК E ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 16
ggggcagagc ccttatatca 20
<210> 17
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Lrp5 гРНК F ДНК-нацеливающий сегмент (50 п.о. от конечной
точки локуса-мишени)
<400> 17
tcgctcacat taatccctag 20
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК A ДНК-нацеливающий сегмент (200 п.о. от конечной
точки локуса-мишени)
<400> 18
tgtgggcctt tgctgatcac 20
<210> 19
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК B ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 19
aatctatgat cctatggcct 20
<210> 20
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК D ДНК-нацеливающий сегмент (54300 и 55500 п.о. от
конечной точки локуса-мишени)
<400> 20
tgccaatagc agtgacttga 20
<210> 21
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК C ДНК-нацеливающий сегмент (54500 и 55300 п.о. от
конечной точки локуса-мишени)
<400> 21
gggaagaatg ggctattgtc 20
<210> 22
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК E ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 22
ggttgtttgt gctgatgacg 20
<210> 23
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Ror1 гРНК F ДНК-нацеливающий сегмент (200 п.о. от конечной
точки локуса-мишени)
<400> 23
ccgtcctagg ccttctacgt 20
<210> 24
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК A ДНК-нацеливающий сегмент (100 п.о. от конечной
точки локуса-мишени)
<400> 24
gtactgggga atcggtggtc 20
<210> 25
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК A2 ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 25
cacgcactcc aaatttatcc 20
<210> 26
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК B ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 26
ctaagtgtgt atcagtacat 20
<210> 27
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК C ДНК-нацеливающий сегмент (25600 и 19740 п.о.
от конечной точки локуса-мишени)
<400> 27
tgccctgcac aataagcgca 20
<210> 28
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК D ДНК-нацеливающий сегмент (26970 и 18370 п.о. от
конечной точки локуса-мишени)
<400> 28
actcattgaa acgttatggc 20
<210> 29
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК E2 ДНК-нацеливающий сегмент (1000 п.о. от конечной
точки локуса-мишени)
<400> 29
agtaagggtg gattaaattc 20
<210> 30
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК E ДНК-нацеливающий сегмент (500 п.о. от конечной
точки локуса-мишени)
<400> 30
gccatctaga ttcatgtaac 20
<210> 31
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Trpa1 гРНК F ДНК-нацеливающий сегмент (100 п.о. от конечной
точки локуса-мишени)
<400> 31
gactagaaat gttctgcacc 20
<210> 32
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190045 прямой праймер
<400> 32
gagctcatag ccaacagctt g 21
<210> 33
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190061 прямой праймер
<400> 33
atgcatcaga tcacgctcag 20
<210> 34
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190068 прямой праймер
<400> 34
gtccttgtgg catttccaac 20
<210> 35
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190030 прямой праймер
<400> 35
ccagtatggt gtcagttaat agcg 24
<210> 36
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190033 прямой праймер (такой же как прямой праймер
для SV 48.3 на Фиг. 6)
<400> 36
ctgtgcagaa agcagcctc 19
<210> 37
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190013 прямой праймер
<400> 37
cctctccctc taggcacctg 20
<210> 38
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190045 обратный праймер
<400> 38
tctttaaggg ctccgttgtc 20
<210> 39
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190061 обратный праймер
<400> 39
aagaccaacc attcacccag 20
<210> 40
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190068 обратный праймер
<400> 40
ttcccagtcc aagtcaaagg 20
<210> 41
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190030 обратный праймер
<400> 41
ctgttatctg caaggcaccc 20
<210> 42
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190033 обратный праймер (такой же как обратный праймер
для SV 48.3 на Фиг. 6)
<400> 42
acaactggat cctgattcgc 20
<210> 43
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 190013 обратный праймер
<400> 43
taagagggca tgggtgagac 20
<210> 44
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C2 зонд (B6) - SNV 0.32 на Фиг. 6
<400> 44
aattcagaag acctatcgta 20
<210> 45
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T3 зонд (B6) - SNV 1.2 на Фиг. 6
<400> 45
tatgtgtata ggtgtttgga t 21
<210> 46
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T6 зонд (B6) - SNV 11.1 на Фиг. 6
<400> 46
tacattgcta aatgaaacc 19
<210> 47
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T7 зонд (B6) - SNV 13.2 на Фиг. 6
<400> 47
cgcagtcatg cacata 16
<210> 48
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T8 зонд (B6) - SNV 17.5 на Фиг. 6
<400> 48
ttataaagcc cagtatgtac 20
<210> 49
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T9 зонд (B6) - SNV 25.8 на Фиг. 6
<400> 49
tgctgcataa tcag 14
<210> 50
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T10 зонд (B6) - SNV 33.0 на Фиг. 6
<400> 50
tcaggagtga attggata 18
<210> 51
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T11 зонд (B6) - SNV 38.3 на Фиг. 6
<400> 51
ctgctactta cctttg 16
<210> 52
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T13 зонд (B6) - SNV 49.6 на Фиг. 6
<400> 52
aggaggaaaa cgc 13
<210> 53
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T14 зонд (B6) - SNV 57.2 на Фиг. 6
<400> 53
cctttgttcc tcataag 17
<210> 54
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C2 зонд (129) - SNV 0.32 на Фиг. 6
<400> 54
aattcagaag acctattgta 20
<210> 55
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T3 зонд (129) - SNV 1.2 на Фиг. 6
<400> 55
tatgtgtata ggtgtttgca t 21
<210> 56
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T6 зонд (129) - SNV 11.1 на Фиг. 6
<400> 56
cattgctaca tgaaac 16
<210> 57
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T7 зонд (129) - SNV 13.2 на Фиг. 6
<400> 57
cgcagtcatg cacgta 16
<210> 58
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T8 зонд (129) - SNV 17.5 на Фиг. 6
<400> 58
tgagaattta taaagcccaa tat 23
<210> 59
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T9 зонд (129) - SNV 25.8 на Фиг. 6
<400> 59
tgctgcatga tcag 14
<210> 60
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T10 зонд (129) - SNV 33.0 на Фиг. 6
<400> 60
tcaggagtga atcgg 15
<210> 61
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T11 зонд (129) - SNV 38.3 на Фиг. 6
<400> 61
ctgctagtta cctttg 16
<210> 62
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T13 зонд (129) - SNV 49.6 на Фиг. 6
<400> 62
aggaggaaga cgcag 15
<210> 63
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T14 зонд (129) - SNV 57.2 на Фиг. 6
<400> 63
ctttgttctt cataagc 17
<210> 64
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C2 прямой праймер - SNV 0.32 на Фиг. 6
<400> 64
atgagggatt tccttaatca gacaa 25
<210> 65
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T3 прямой праймер - SNV 1.2 на Фиг. 6
<400> 65
tggtatgttt attcttactc aaggttttg 29
<210> 66
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T6 прямой праймер - SNV 11.1 на Фиг. 6
<400> 66
gggcaactga tggaaagaac tc 22
<210> 67
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T7 прямой праймер - SNV 13.2 на Фиг. 6
<400> 67
gactgacgca caaacttgtc ctt 23
<210> 68
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T8 прямой праймер - SNV 17.5 на Фиг. 6
<400> 68
cccaaagcat ataacaagaa caaatg 26
<210> 69
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T9 прямой праймер - SNV 25.8 на Фиг. 6
<400> 69
gcaggacgca ggcgttta 18
<210> 70
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T10 прямой праймер - SNV 33.0 на Фиг. 6
<400> 70
gcatcctcat ggcagtctac atc 23
<210> 71
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T11 прямой праймер - SNV 38.3 на Фиг. 6
<400> 71
cctgcccctt gatgagtgtt 20
<210> 72
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T13 прямой праймер - SNV 49.6 на Фиг. 6
<400> 72
ccctctttga tatgctcgtg tgt 23
<210> 73
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T14 прямой праймер - SNV 57.2 на Фиг. 6
<400> 73
tcccacaggt ccatgtcttt aa 22
<210> 74
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> C2 обратный праймер - SNV 0.32 на Фиг. 6
<400> 74
agactacaat gagctaccat cataaggt 28
<210> 75
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T3 обратный праймер - SNV 1.2 на Фиг. 6
<400> 75
caaccatcta aaactccagt tcca 24
<210> 76
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T6 обратный праймер - SNV 11.1 на Фиг. 6
<400> 76
tgtgtaacag gacagttgaa tgtagaga 28
<210> 77
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T7 обратный праймер - SNV 13.2 на Фиг. 6
<400> 77
cttaaaaccc gccctgcat 19
<210> 78
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T8 обратный праймер - SNV 17.5 на Фиг. 6
<400> 78
ctacaggaga tgtggctgtt ctatgt 26
<210> 79
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T9 обратный праймер - SNV 25.8 на Фиг. 6
<400> 79
tcagcgtgat tcgcttgtag tc 22
<210> 80
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T10 обратный праймер - SNV 33.0 на Фиг. 6
<400> 80
tgcatagctg tttgaataat gacaag 26
<210> 81
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T11 обратный праймер - SNV 38.3 на Фиг. 6
<400> 81
tgcagcatct ctgtcaagca a 21
<210> 82
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T13 обратный праймер - SNV 49.6 на Фиг. 6
<400> 82
gcaacaacat aacccacagc ataa 24
<210> 83
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> T14 обратный праймер - SNV 57.2 на Фиг. 6
<400> 83
gctaagcgtt tggaagaaat tcc 23
<210> 84
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 13.7 на Фиг. 6
<400> 84
taggctctaa ggatgctggc 20
<210> 85
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 13.7 на Фиг. 6
<400> 85
aagcagcttc aaaccctctg 20
<210> 86
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 20.0 на Фиг. 6
<400> 86
ttacttggcc ttggaactgc 20
<210> 87
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 20.0 на Фиг. 6
<400> 87
tgattcgtaa tcgtcactgc c 21
<210> 88
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 36.9 на Фиг. 6
<400> 88
tcctgtcccg agaaactgtc 20
<210> 89
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 36.9 на Фиг. 6
<400> 89
agctggcttt cagagagctg 20
<210> 90
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 56.7 на Фиг. 6
<400> 90
ttagaaagtg ccaaccaggc 20
<210> 91
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 56.7 на Фиг. 6
<400> 91
ctctggctag gaacaatggc 20
<210> 92
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-lr-f праймер для Lrp5 локуса
<400> 92
gttaggtgca gggtctactc agctg 25
<210> 93
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-5'-f праймер для Lrp5 локуса
<400> 93
ggaggagagg agaagcagcc 20
<210> 94
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-A праймер для Lrp5 локуса
<400> 94
ggaggagagg agaagcagcc 20
<210> 95
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> h-lr-r праймер для Lrp5 локуса
<400> 95
gcaaacagcc ttcttcccac attcgg 26
<210> 96
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-5'-r праймер для Lrp5 локуса
<400> 96
ttgctttcag tagttcaggt gtgc 24
<210> 97
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> h-5'-r праймер для Lrp5 локуса
<400> 97
ggcgttgtca ggaagttgcc 20
<210> 98
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-F праймер для Lrp5 локуса
<400> 98
tgaagttgag aggcacatga gg 22
<210> 99
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> m-E2 праймер для Lrp5 локуса
<400> 99
tagagtagcc acaggcagca aagc 24
<210> 100
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retU прямой праймер
<400> 100
cctcctgagc tttcctttgc ag 22
<210> 101
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retU обратный праймер
<400> 101
cctagacaac acagacactg tatca 25
<210> 102
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retU TAQMAN зонд
<400> 102
ttctgccctt gaaaaggaga ggc 23
<210> 103
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retD прямой праймер
<400> 103
cctctgaggc cacctgaa 18
<210> 104
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retD обратный праймер
<400> 104
ccctgacaag ttctgccttc tac 23
<210> 105
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7064retD TAQMAN зонд
<400> 105
tgcccaagcc tctgcagctt t 21
<210> 106
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retU прямой праймер
<400> 106
cccagcatct gacgacacc 19
<210> 107
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retU обратный праймер
<400> 107
gaccactgtg ggcatctgta g 21
<210> 108
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retU TAQMAN зонд
<400> 108
ccgagtctgc tgttactgtt agcatca 27
<210> 109
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retD прямой праймер
<400> 109
cccgacacct tctgagcatg 20
<210> 110
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retD обратный праймер
<400> 110
tgcaggctga gtcaggattt g 21
<210> 111
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 7140retD TAQMAN зонд
<400> 111
tagtcacgtt ttgtgacacc ccaga 25
<210> 112
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК A ДНК-нацеливающий сегмент
<400> 112
tgaaccaatt gtgtagcctt 20
<210> 113
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК A2 ДНК-нацеливающий сегмент
<400> 113
aatagtggta aagcaccatg 20
<210> 114
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК B ДНК-нацеливающий сегмент
<400> 114
gtgtgctaag gatcgaagtc 20
<210> 115
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК C ДНК-нацеливающий сегмент
<400> 115
caccgagatg cttgggtatt 20
<210> 116
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК D ДНК-нацеливающий сегмент
<400> 116
tgtaaccgcc ctgaatgacc 20
<210> 117
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК E ДНК-нацеливающий сегмент
<400> 117
aaaagggcat cataaatccc 20
<210> 118
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК E2 ДНК-нацеливающий сегмент
<400> 118
tcaaaaatag tcatacacct 20
<210> 119
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Folh1 гРНК F ДНК-нацеливающий сегмент
<400> 119
ggtctctagt acattgtaga 20
<210> 120
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК A ДНК-нацеливающий сегмент
<400> 120
ggtggtggtg ctgacggaca 20
<210> 121
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК A2 ДНК-нацеливающий сегмент
<400> 121
tatgagatca acactcgcta 20
<210> 122
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК B ДНК-нацеливающий сегмент
<400> 122
ccaaggactt ccccacgtta 20
<210> 123
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК C ДНК-нацеливающий сегмент
<400> 123
tgcttccctt atgcaagatt 20
<210> 124
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК D ДНК-нацеливающий сегмент
<400> 124
ttaggtaccc tatttgaata 20
<210> 125
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК E2 ДНК-нацеливающий сегмент
<400> 125
tgcagtgggt gacaggtcca 20
<210> 126
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК E ДНК-нацеливающий сегмент
<400> 126
agggttatac tgacgttgtg 20
<210> 127
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Adamts5 гРНК F ДНК-нацеливающий сегмент
<400> 127
tgtctttcaa ggagggctac 20
<210> 128
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК A ДНК-нацеливающий сегмент
<400> 128
actagtagac ctgaggggtt 20
<210> 129
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК B ДНК-нацеливающий сегмент
<400> 129
gctccagtgt ttaggccttg 20
<210> 130
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК B2 ДНК-нацеливающий сегмент
<400> 130
ggcaagctga aaacgcatgc 20
<210> 131
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК C ДНК-нацеливающий сегмент
<400> 131
gtagatcgct ttccactacc 20
<210> 132
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК D ДНК-нацеливающий сегмент
<400> 132
gaactccact gctcgtgagc 20
<210> 133
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК E2 ДНК-нацеливающий сегмент
<400> 133
ataggtgggc actattgaag 20
<210> 134
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК E ДНК-нацеливающий сегмент
<400> 134
atgggaaggt ttataccagc 20
<210> 135
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Dpp4 гРНК F ДНК-нацеливающий сегмент
<400> 135
cggtgtaaaa acaacgggaa 20
<210> 136
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 6.1 на Фиг. 8
<400> 136
ggaatgccaa ggctactgtc 20
<210> 137
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 6.1 на Фиг. 8
<400> 137
aaaagtctgc tttgggtggt 20
<210> 138
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 6.3 на Фиг. 8
<400> 138
cttcatgaac ctcactcagg a 21
<210> 139
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 6.3 на Фиг. 8
<400> 139
tctcggagtc aggatttacc t 21
<210> 140
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 7.8 на Фиг. 8
<400> 140
tgtctctttg cctgttgctg 20
<210> 141
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 7.8 на Фиг. 8
<400> 141
tctgctctac aaggcttacg tg 22
<210> 142
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 16 на Фиг. 8
<400> 142
caaccaggca gacttacagc 20
<210> 143
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 16 на Фиг. 8
<400> 143
ggcctaggaa ccagtcaaaa 20
<210> 144
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Прямой праймер для SV 25.5 на Фиг. 8
<400> 144
gcttactgga aagctacata ggg 23
<210> 145
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Обратный праймер для SV 25.5 на Фиг. 8
<400> 145
caacaacata gaaacccctg tc 22
<210> 146
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность S. aureus Cas9 PAM
<220>
<221> misc_feature
<222> (1)...(2)
<223> n = A, T, C, или G
<220>
<221> misc_feature
<222> (4)...(5)
<223> r = A или G
<400> 146
nngrrt 6
<210> 147
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность S. aureus Cas9 PAM
<220>
<221> misc_feature
<222> (1)...(2)
<223> n = A, T, C, или G
<220>
<221> misc_feature
<222> (4)...(5)
<223> r = A или G
<400> 147
nngrr 5
<210> 148
<211> 3155
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сконструированный человеческий Vk1-39Jk5 локус
<400> 148
ggcgcgccgt agctttgaat tttaaacatc tatttgacaa gaaatgcata gttccttctc 60
tttaaaataa tgtaatgttt ctttcaagaa taagcttggt ttgatgcctc tctccccaac 120
atgatagaag tgtagcataa atctatgaaa aattccattt ccctgtgcct acaacaacta 180
cctgggattg aaaacttctt cccttgctct agtcctttct tctacaccta cttccacatc 240
atctgtgact caaaacaata cttgtcagga aagatcccgg aaagagcaaa aaagacttcc 300
ttagaggtgt cagagattcc tatgccacta tctgtcatct ctagaagggg ttgtgagtat 360
gaggaagagc agagcttgta aattttctac ttgctttgac ttccactgta tttcctaaca 420
acaacaacca cagcaacacc cataacatca caggacaaac ttctagtact tccaaggctt 480
tagtctcagt aaatcttctc tacctccatc acagcagcta gaaggtttga tactcataca 540
aatagtactg tagctttctg ttcataattg gaaaaataga caagacccaa tgtaatacag 600
gctttccttc agccagttag cgttcagttt ttggatcacc attgcacaca tatacccagc 660
atatgtctaa tatatatgta gaaatccgtg aagcaagagt tataatagct tgtgttttct 720
attgtattgt attttcctct tatatcatct tcttcttcgt tcattaaaaa aaaaccgttc 780
aagtaggtct aaattaatta ttggatcata agtagataaa atattttatt tcataacaca 840
ttgacccgat gaatatgttt ctttgccaga catagtcctc atttccaagg taacaagcct 900
gaaaaaatta tactggagca agtcaacagg taatgatggt agcttttcct tattgtcctg 960
gggcaagaat aagacaaaag ataacagggt agaataaaga ttgtgtaaga aagaaggaca 1020
gcaacaggac atgggaacct tttatagagt aacattttga taatggatga tgagaattaa 1080
tgagttagac agggatgggt gggaatgatt gaaggtgtga gtactttagc acagattaag 1140
accaaatcat taggatttaa agagttgtgt agagttagtg aaggaaaagc cttagaatta 1200
aatttggctg cggataaaac attcttggat tagactgaag actcttttct gtgctaagta 1260
agtatattta tgataatgat gatgactgta gtgctgaata tttaataaat aaaaacaaaa 1320
ttaattgccg catacataat gtcctgaata ctattgtaaa tgttttatct tatttccttt 1380
aaactgtcta cagcactata aggtaggtac cagtattgtc acagttacac agatatggaa 1440
accgagacac agggaagtta agttacttga tcaatttcaa gcaatcggca agccatggag 1500
catctatgtc agggctgcca ggacatgtga ctgtaaacag aagtttttca ctttttaact 1560
caaagagggt atgtggctgg gttaatggaa agcttcagga ccctcagaaa acattactaa 1620
caagcaaatg aaaggtgtat ctggaagatt aagttttaac agactcttca tttccatcga 1680
tccaataatg cacttaggga gatgactggg catattgagg ataggaagag agaagtgaaa 1740
acacagcttt ttatattgtt cttaacaggc ttgtgccaaa catcttctgg gtggatttag 1800
gtgattgagg agaagaaaga cacaggagcg aaattctctg agcacaaggg aggagttcta 1860
cactcagact gagccaacag acttttctgg cctgacaacc agggcggcgc aggatgctca 1920
gtgcagagag gaagaagcag gtggtctttg cagctgaaag ctcagctgat ttgcatatgg 1980
agtcattata caacatccca gaattcttta agggcagctg ccaggaagct aagaagcatc 2040
ctctcttcta gctctcagag atggagacag acacactcct gctatgggtg ctgctgctct 2100
gggttccagg tgagggtaca gataagtgtt atgagcaacc tctgtggcca ttatgatgct 2160
ccatgcctct ctgttcttga tcactataat tagggcattt gtcactggtt ttaagtttcc 2220
ccagtcccct gaattttcca ttttctcaga gtgatgtcca aaattattct taaaaattta 2280
aatgaaaagg tcctctgctg tgaaggcttt taaagatata taaaaataat ctttgtgttt 2340
atcattccag gtgccagatg tgacatccag atgacccagt ctccatcctc cctgtctgca 2400
tctgtaggag acagagtcac catcacttgc cgggcaagtc agagcattag cagctattta 2460
aattggtatc agcagaaacc agggaaagcc cctaagctcc tgatctatgc tgcatccagt 2520
ttgcaaagtg gggtcccatc aaggttcagt ggcagtggat ctgggacaga tttcactctc 2580
accatcagca gtctgcaacc tgaagatttt gcaacttact actgtcaaca gagttacagt 2640
acccctccga tcaccttcgg ccaagggaca cgactggaga ttaaacgtaa gtaatttttc 2700
actattgtct tctgaaattt gggtctgatg gccagtattg acttttagag gcttaaatag 2760
gagtttggta aagattggta aatgagggca tttaagattt gccatgggtt gcaaaagtta 2820
aactcagctt caaaaatgga tttggagaaa aaaagattaa attgctctaa actgaatgac 2880
acaaagtaaa aaaaaaaagt gtaactaaaa aggaaccctt gtatttctaa ggagcaaaag 2940
taaatttatt tttgttcact cttgccaaat attgtattgg ttgttgctga ttatgcatga 3000
tacagaaaag tggaaaaata cattttttag tctttctccc ttttgtttga taaattattt 3060
tgtcagacaa caataaaaat caatagcacg ccctaagatc tagatgcatg ctcgagtgcc 3120
atttcattac ctctttctcc gcacccgaca tagat 3155
<210> 149
<211> 3166
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сконструированный человеческий Vk3-20Jk1 локус
<400> 149
ggcgcgccgt agctttgaat tttaaacatc tatttgacaa gaaatgcata gttccttctc 60
tttaaaataa tgtaatgttt ctttcaagaa taagcttggt ttgatgcctc tctccccaac 120
atgatagaag tgtagcataa atctatgaaa aattccattt ccctgtgcct acaacaacta 180
cctgggattg aaaacttctt cccttgctct agtcctttct tctacaccta cttccacatc 240
atctgtgact caaaacaata cttgtcagga aagatcccgg aaagagcaaa aaagacttcc 300
ttagaggtgt cagagattcc tatgccacta tctgtcatct ctagaagggg ttgtgagtat 360
gaggaagagc agagcttgta aattttctac ttgctttgac ttccactgta tttcctaaca 420
acaacaacca cagcaacacc cataacatca caggacaaac ttctagtact tccaaggctt 480
tagtctcagt aaatcttctc tacctccatc acagcagcta gaaggtttga tactcataca 540
aatagtactg tagctttctg ttcataattg gaaaaataga caagacccaa tgtaatacag 600
gctttccttc agccagttag cgttcagttt ttggatcacc attgcacaca tatacccagc 660
atatgtctaa tatatatgta gaaatccgtg aagcaagagt tataatagct tgtgttttct 720
attgtattgt attttcctct tatatcatct tcttcttcgt tcattaaaaa aaaaccgttc 780
aagtaggtct aaattaatta ttggatcata agtagataaa atattttatt tcataacaca 840
ttgacccgat gaatatgttt ctttgccaga catagtcctc atttccaagg taacaagcct 900
gaaaaaatta tactggagca agtcaacagg taatgatggt agcttttcct tattgtcctg 960
gggcaagaat aagacaaaag ataacagggt agaataaaga ttgtgtaaga aagaaggaca 1020
gcaacaggac atgggaacct tttatagagt aacattttga taatggatga tgagaattaa 1080
tgagttagac agggatgggt gggaatgatt gaaggtgtga gtactttagc acagattaag 1140
accaaatcat taggatttaa agagttgtgt agagttagtg aaggaaaagc cttagaatta 1200
aatttggctg cggataaaac attcttggat tagactgaag actcttttct gtgctaagta 1260
agtatattta tgataatgat gatgactgta gtgctgaata tttaataaat aaaaacaaaa 1320
ttaattgccg catacataat gtcctgaata ctattgtaaa tgttttatct tatttccttt 1380
aaactgtcta cagcactata aggtaggtac cagtattgtc acagttacac agatatggaa 1440
accgagacac agggaagtta agttacttga tcaatttcaa gcaatcggca agccatggag 1500
catctatgtc agggctgcca ggacatgtga ctgtaaacag aagtttttca ctttttaact 1560
caaagagggt atgtggctgg gttaatggaa agcttcagga ccctcagaaa acattactaa 1620
caagcaaatg aaaggtgtat ctggaagatt aagttttaac agactcttca tttccatcga 1680
tccaataatg cacttaggga gatgactggg catattgagg ataggaagag agaagtgaaa 1740
acacagcttt ttatattgtt cttaacaggc ttgtgccaaa catcttctgg gtggatttag 1800
gtgattgagg agaagaaaga cacaggagcg aaattctctg agcacaaggg aggagttcta 1860
cactcagact gagccaacag acttttctgg cctgacaacc agggcggcgc aggatgctca 1920
gtgcagagag gaagaagcag gtggtctttg cagctgaaag ctcagctgat ttgcatatgg 1980
agtcattata caacatccca gaattcttta agggcagctg ccaggaagct aagaagcatc 2040
ctctcttcta gctctcagag atggagacag acacactcct gctatgggtg ctgctgctct 2100
gggttccagg tgagggtaca gataagtgtt atgagcaacc tctgtggcca ttatgatgct 2160
ccatgcctct ctgttcttga tcactataat tagggcattt gtcactggtt ttaagtttcc 2220
ccagtcccct gaattttcca ttttctcaga gtgatgtcca aaattattct taaaaattta 2280
aatgaaaagg tcctctgctg tgaaggcttt taaagatata taaaaataat ctttgtgttt 2340
atcattccag gtgccagatg tataccaccg gagaaattgt gttgacgcag tctccaggca 2400
ccctgtcttt gtctccaggg gaaagagcca ccctctcctg cagggccagt cagagtgtta 2460
gcagcagcta cttagcctgg taccagcaga aacctggcca ggctcccagg ctcctcatct 2520
atggtgcatc cagcagggcc actggcatcc cagacaggtt cagtggcagt gggtctggga 2580
cagacttcac tctcaccatc agcagactgg agcctgaaga ttttgcagtg tattactgtc 2640
agcagtatgg tagctcacct tggacgttcg gccaagggac caaggtggaa atcaaacgta 2700
agtaattttt cactattgtc ttctgaaatt tgggtctgat ggccagtatt gacttttaga 2760
ggcttaaata ggagtttggt aaagattggt aaatgagggc atttaagatt tgccatgggt 2820
tgcaaaagtt aaactcagct tcaaaaatgg atttggagaa aaaaagatta aattgctcta 2880
aactgaatga cacaaagtaa aaaaaaaaag tgtaactaaa aaggaaccct tgtatttcta 2940
aggagcaaaa gtaaatttat ttttgttcac tcttgccaaa tattgtattg gttgttgctg 3000
attatgcatg atacagaaaa gtggaaaaat acatttttta gtctttctcc cttttgtttg 3060
ataaattatt ttgtcagaca acaataaaaa tcaatagcac gccctaagat ctagatgcat 3120
gctcgagtgc catttcatta cctctttctc cgcacccgac atagat 3166
<210> 150
<211> 82
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Каркас v1 направляющей РНК
<400> 150
gttggaacca ttcaaaacag catagcaagt taaaataagg ctagtccgtt atcaacttga 60
aaaagtggca ccgagtcggt gc 82
<210> 151
<211> 76
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Каркас v2 направляющей РНК
<400> 151
gttttagagc tagaaatagc aagttaaaat aaggctagtc cgttatcaac ttgaaaaagt 60
ggcaccgagt cggtgc 76
<210> 152
<211> 86
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Каркас v3 направляющей РНК
<400> 152
gtttaagagc tatgctggaa acagcatagc aagtttaaat aaggctagtc cgttatcaac 60
ttgaaaaagt ggcaccgagt cggtgc 86
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПРЕОДОЛЕНИЯ ИММУНОЛОГИЧЕСКОЙ ТОЛЕРАНТНОСТИ С ИСПОЛЬЗОВАНИЕМ МНОЖЕСТВА НАПРАВЛЯЮЩИХ РНК | 2017 |
|
RU2829155C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2725520C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2014 |
|
RU2685914C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАПРАВЛЕННОЙ МОДИФИКАЦИИ ГЕНОМА | 2020 |
|
RU2751237C1 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МОДИФИКАЦИИ ЦЕЛЕВОГО ЛОКУСА | 2015 |
|
RU2704283C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ ПОСРЕДСТВОМ ОДНОЭТАПНОГО МНОЖЕСТВЕННОГО НАЦЕЛИВАНИЯ | 2015 |
|
RU2707137C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННОЙ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ С ИСПОЛЬЗОВАНИЕМ ПАРНЫХ ГИДОВЫХ РНК | 2015 |
|
RU2734770C2 |
| НАПРАВЛЕННАЯ МОДИФИКАЦИЯ ГЕНОМА КРЫСЫ | 2014 |
|
RU2676708C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2771532C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛЕННЫХ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2711740C2 |
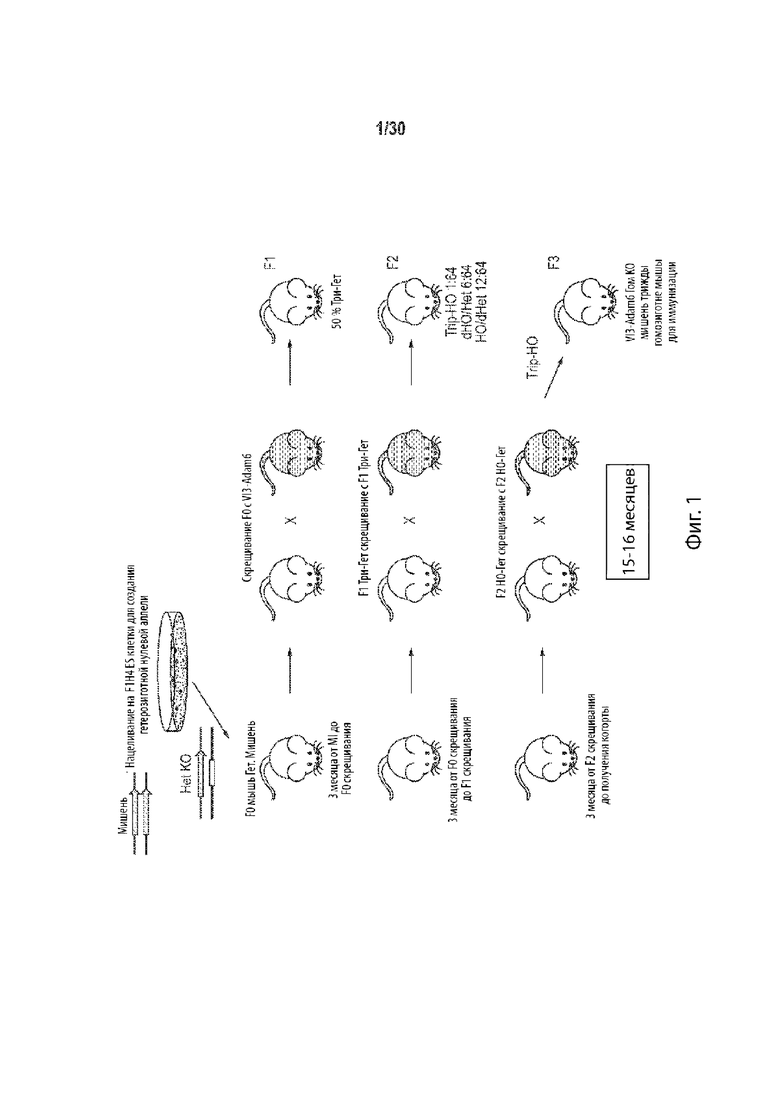
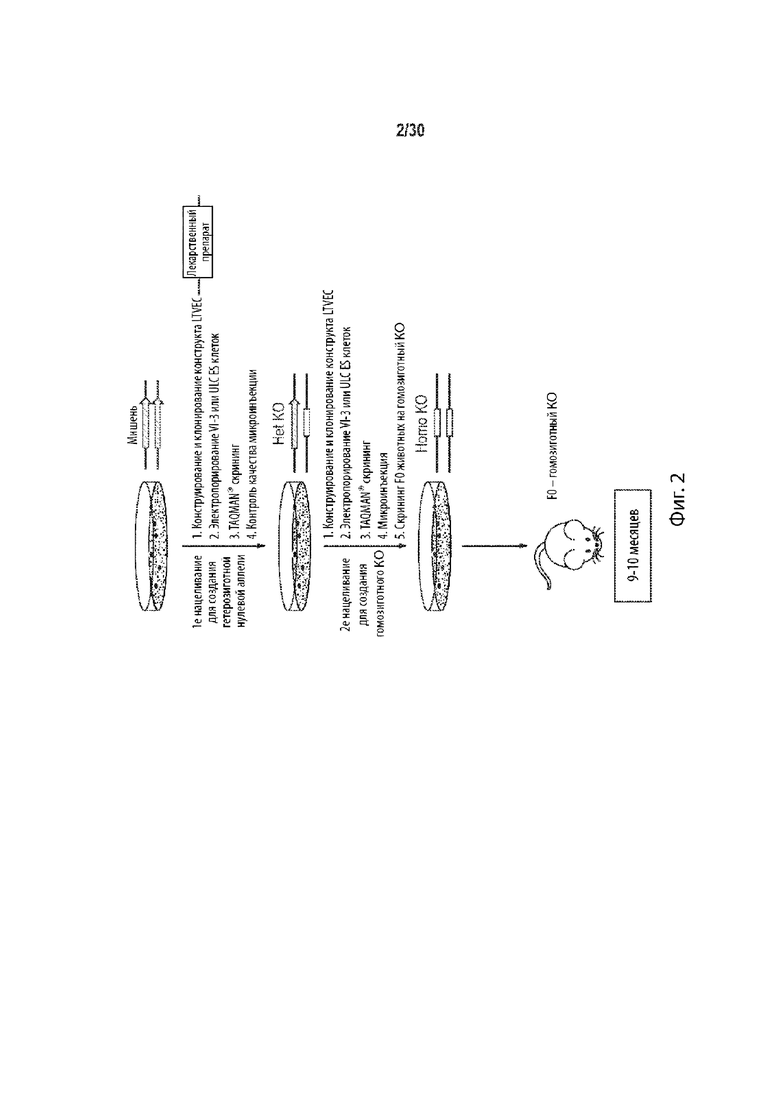
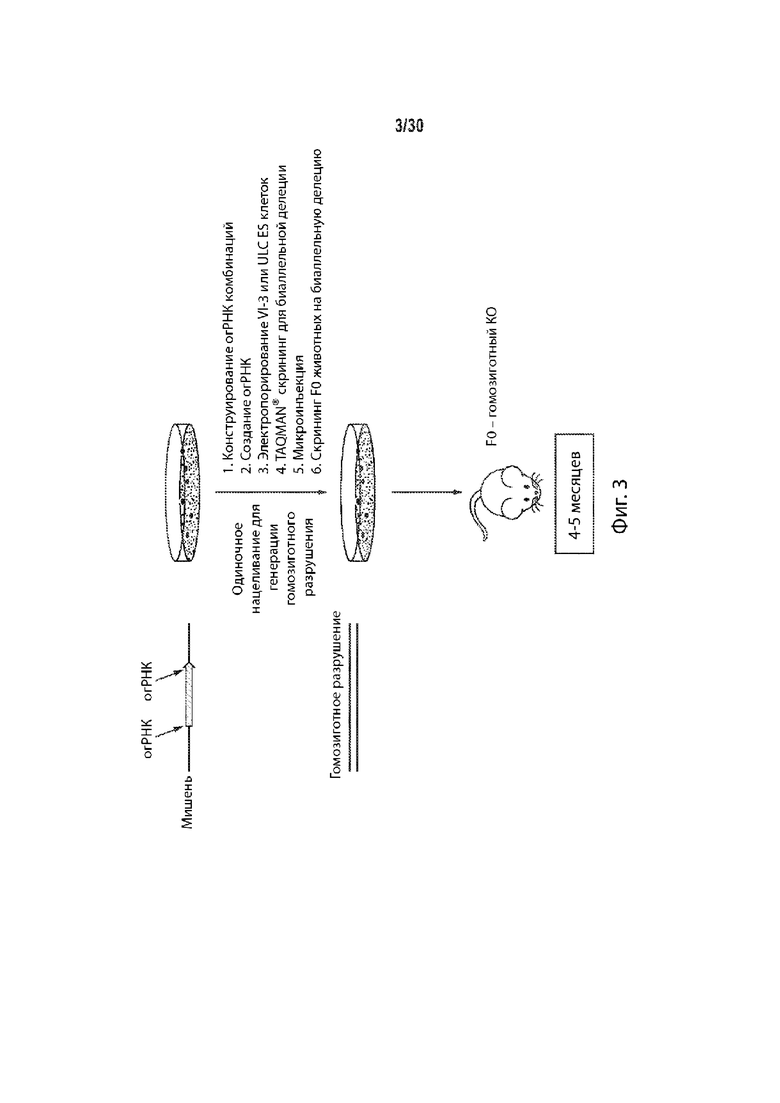
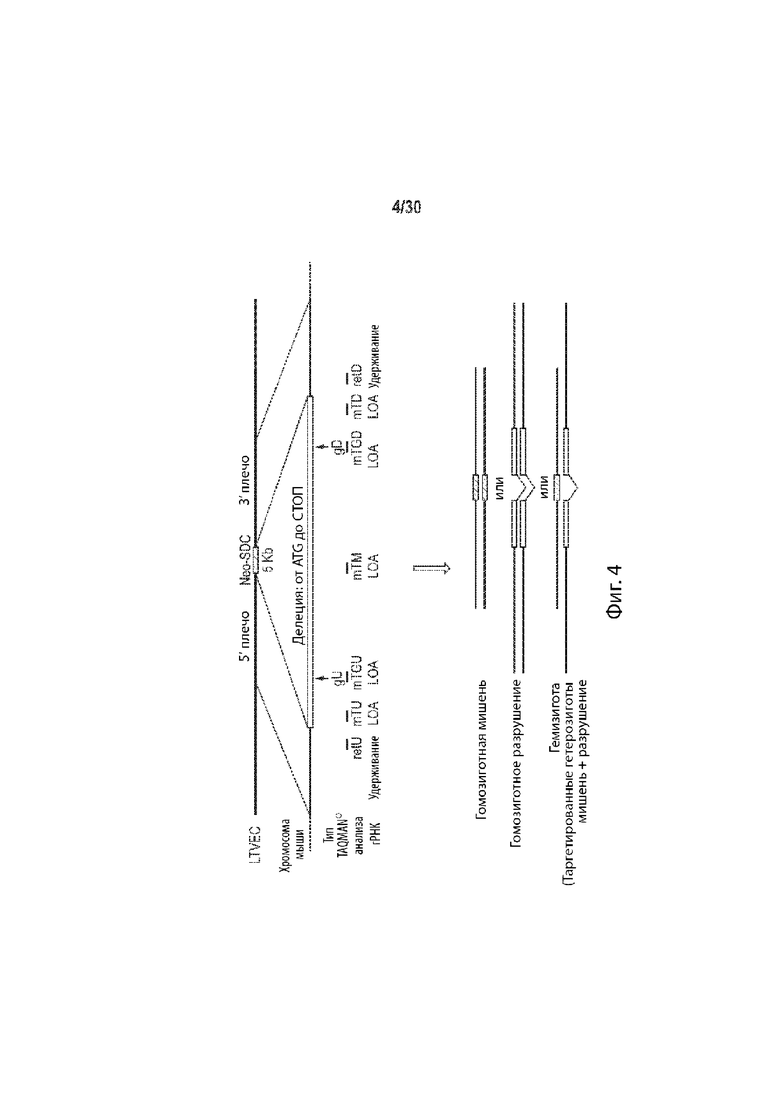
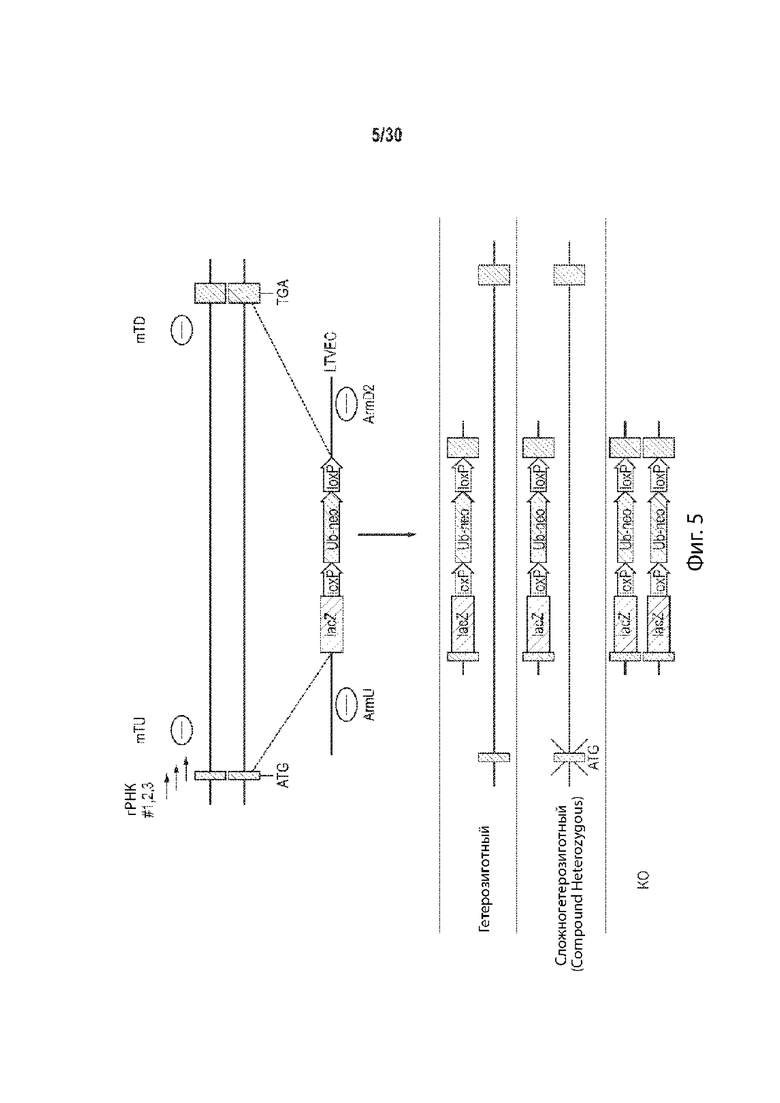
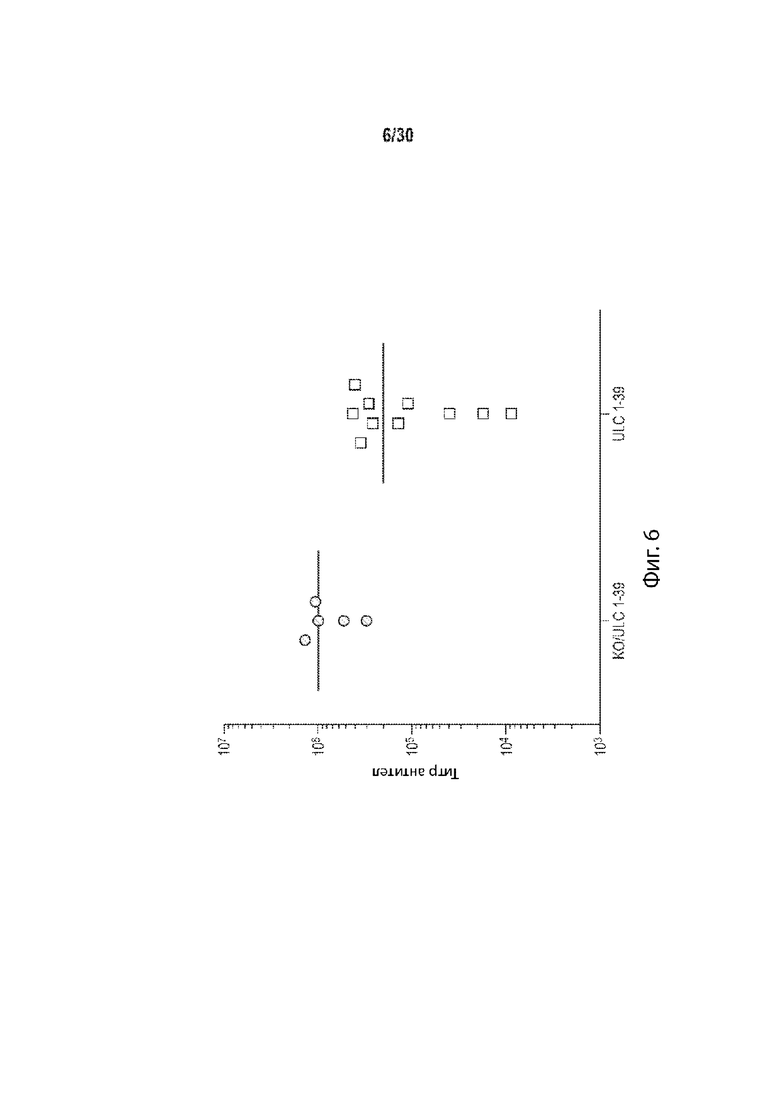
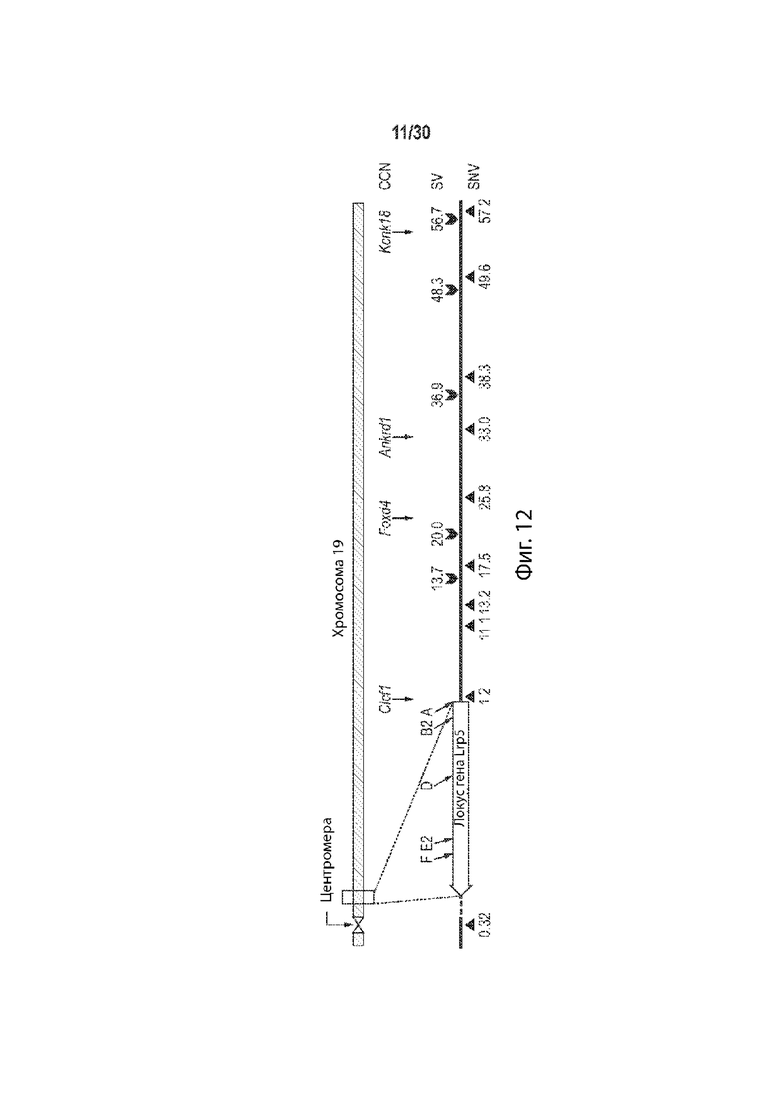
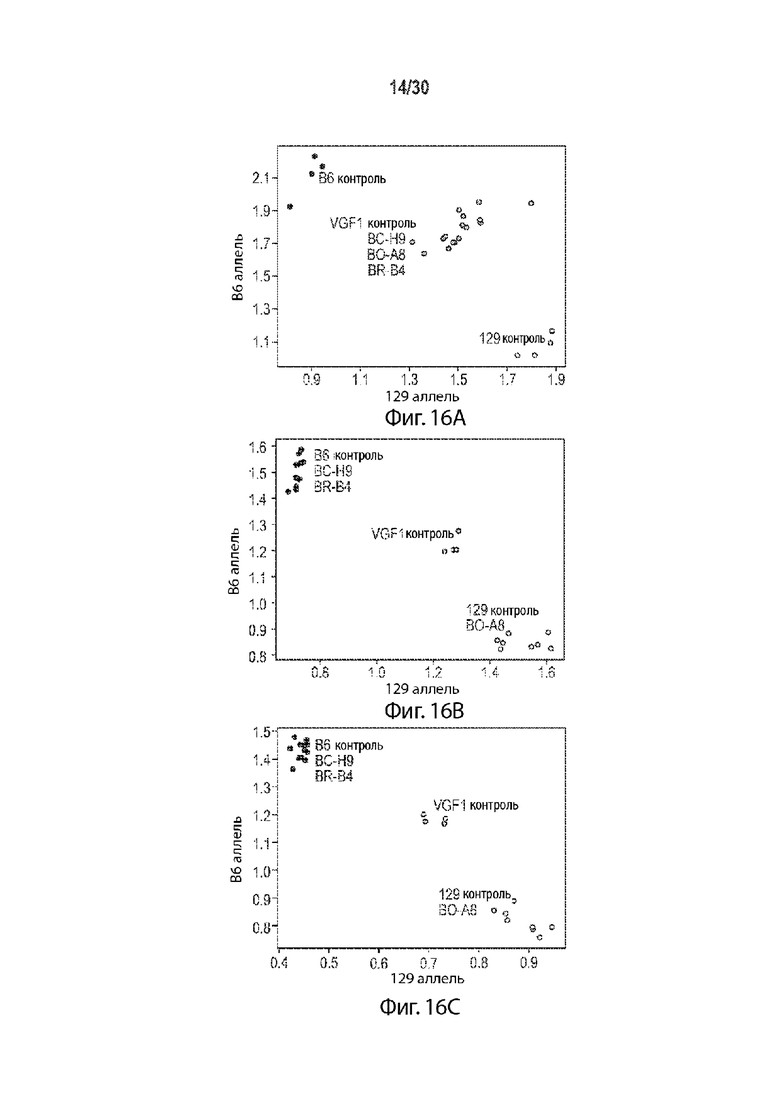
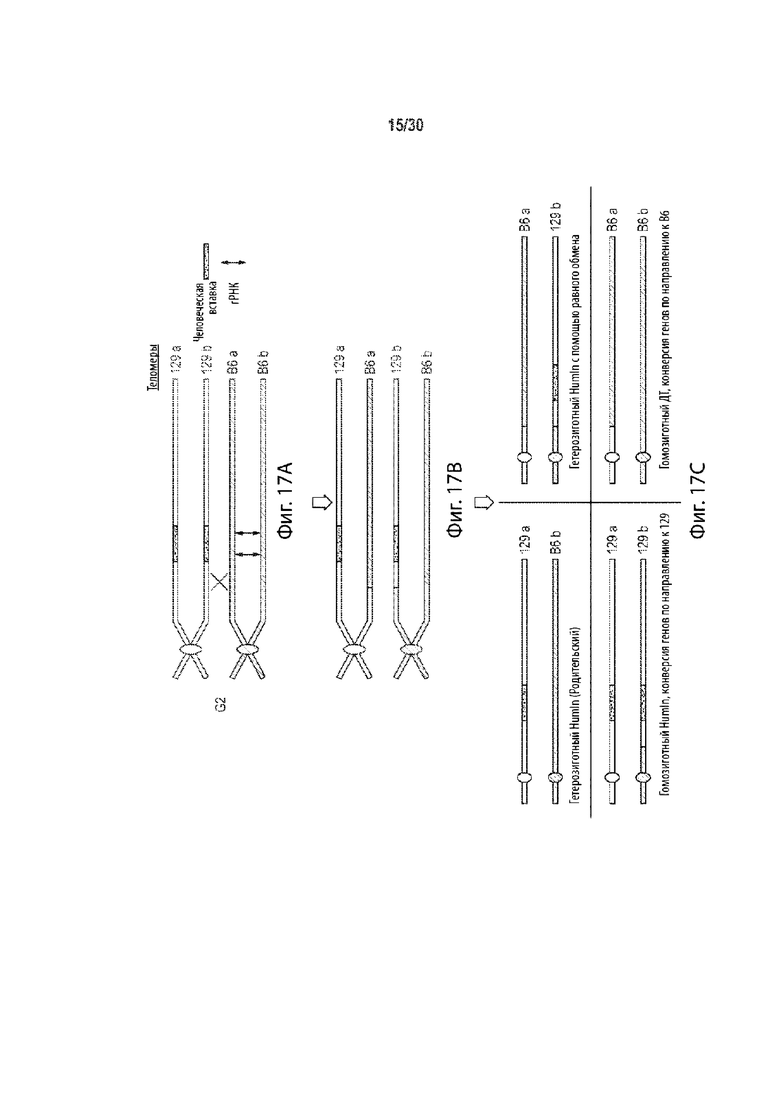
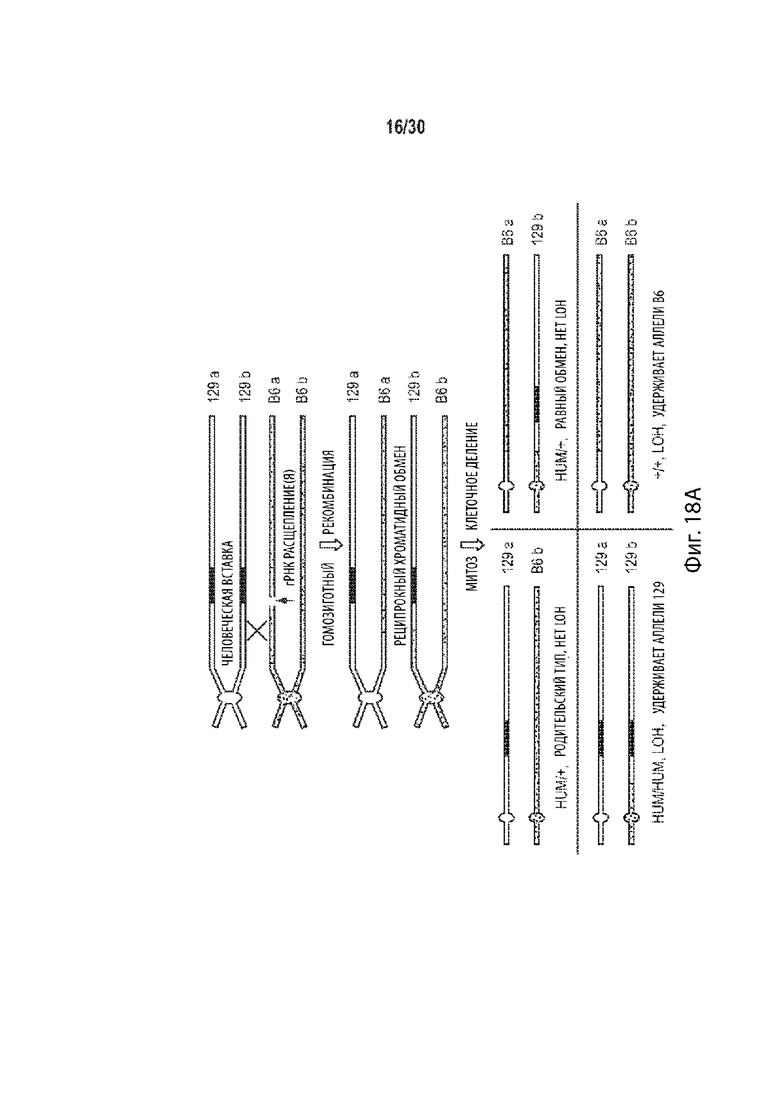
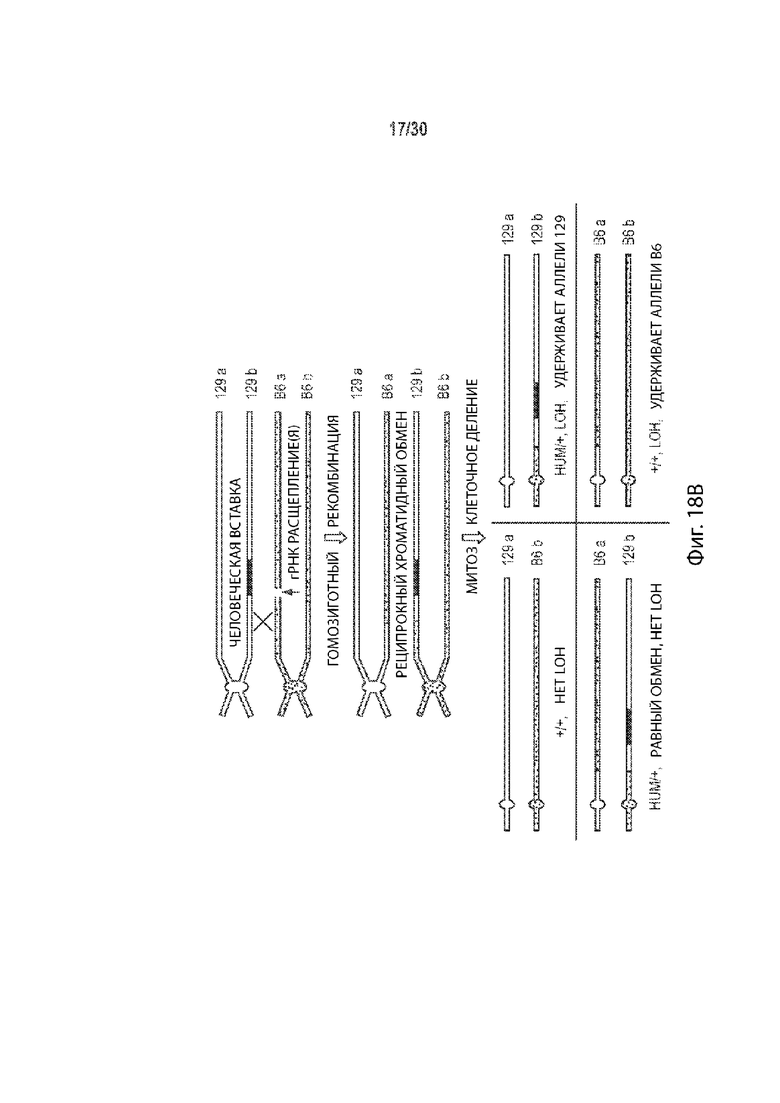
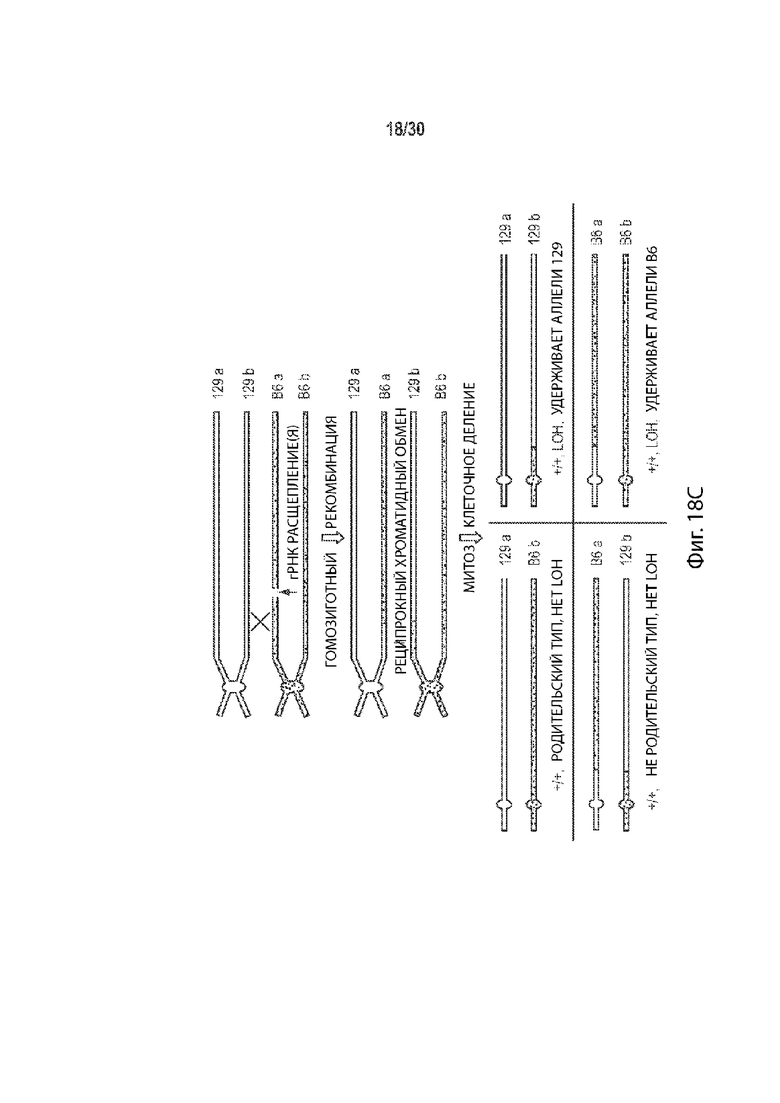
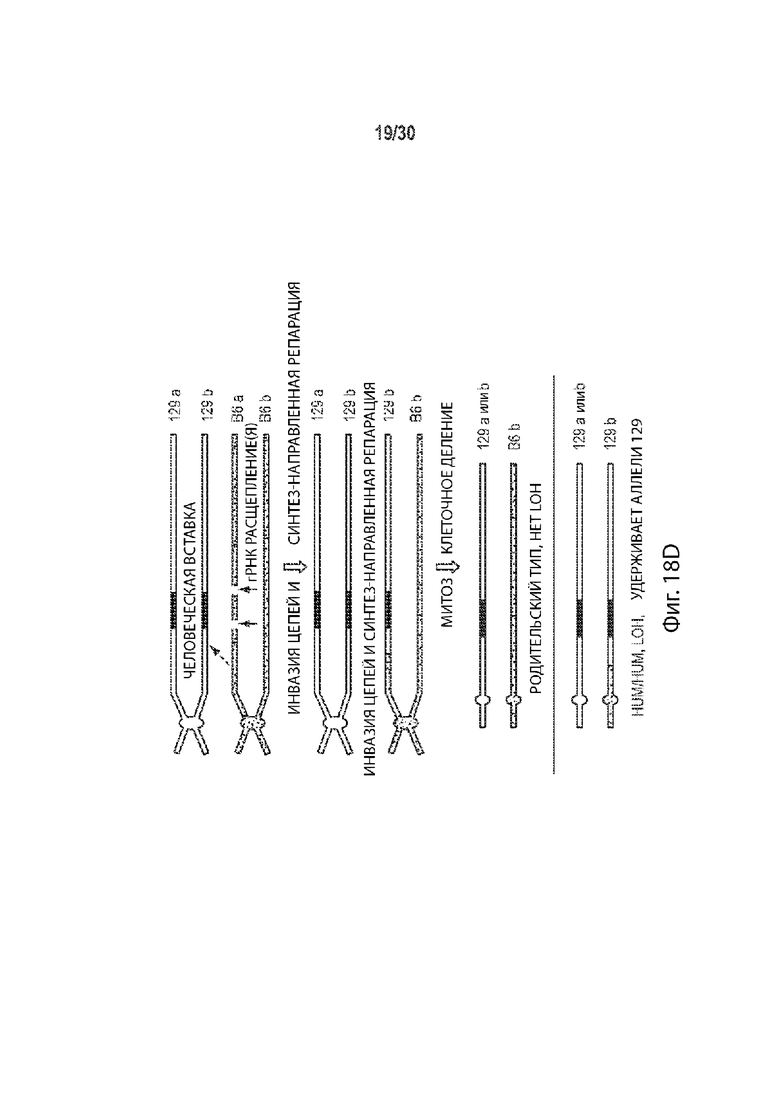
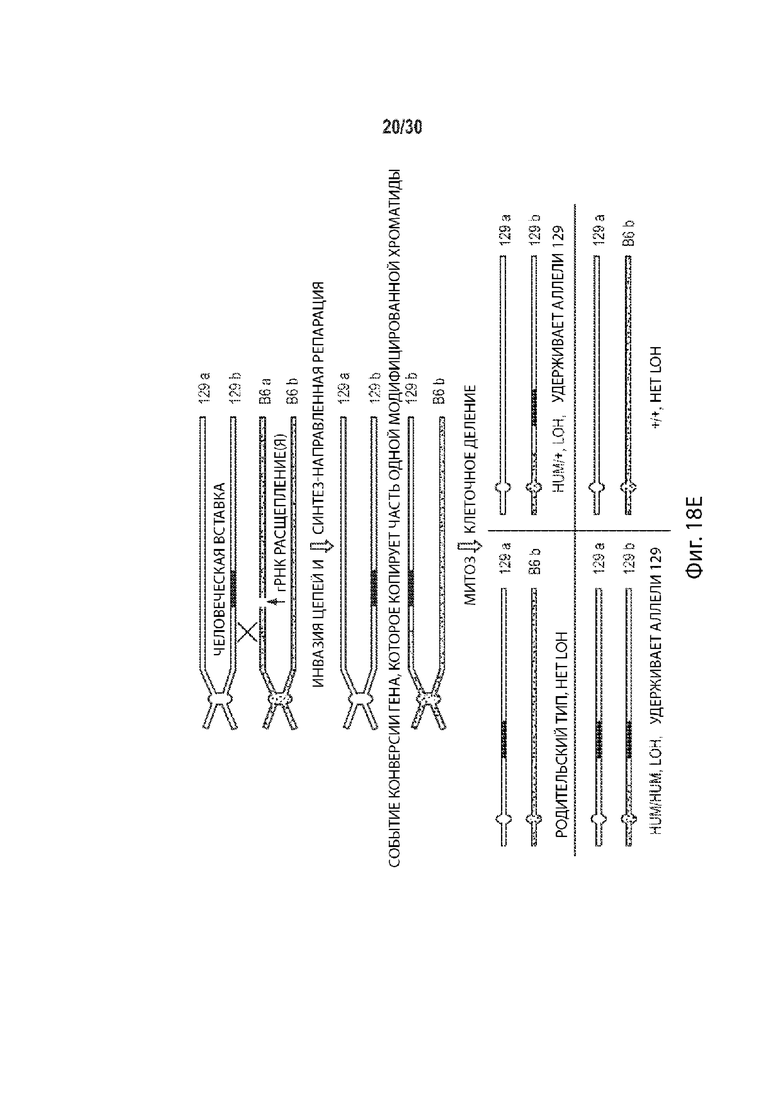
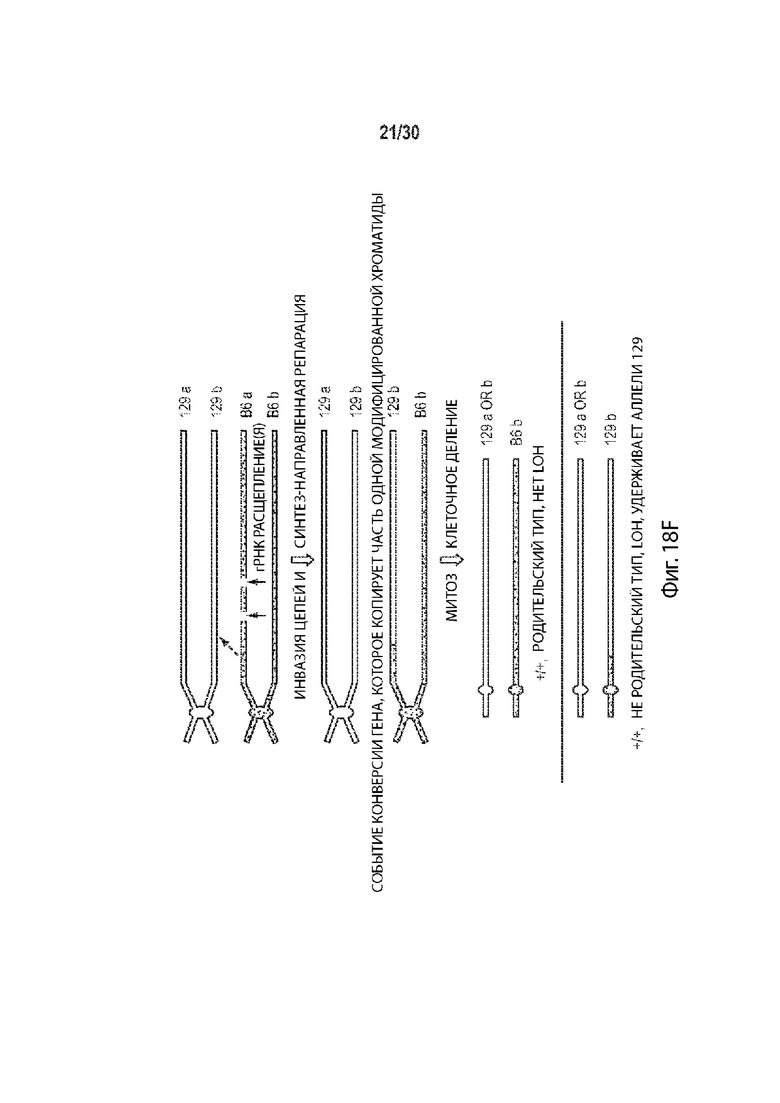
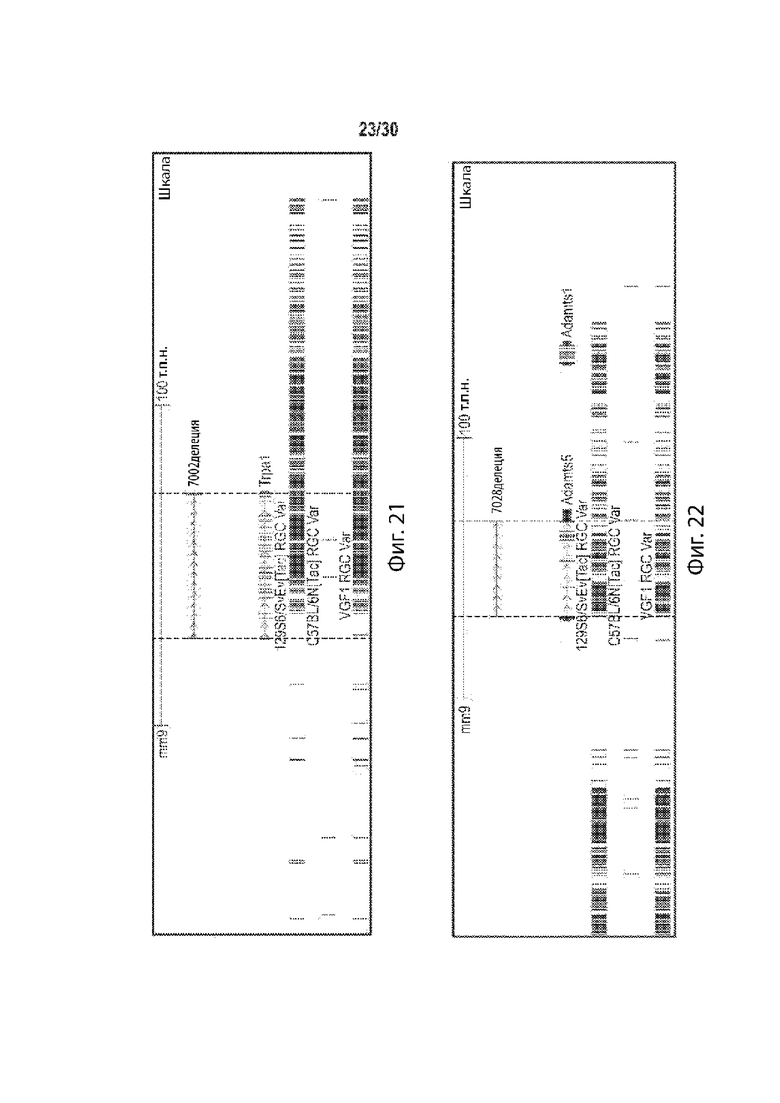

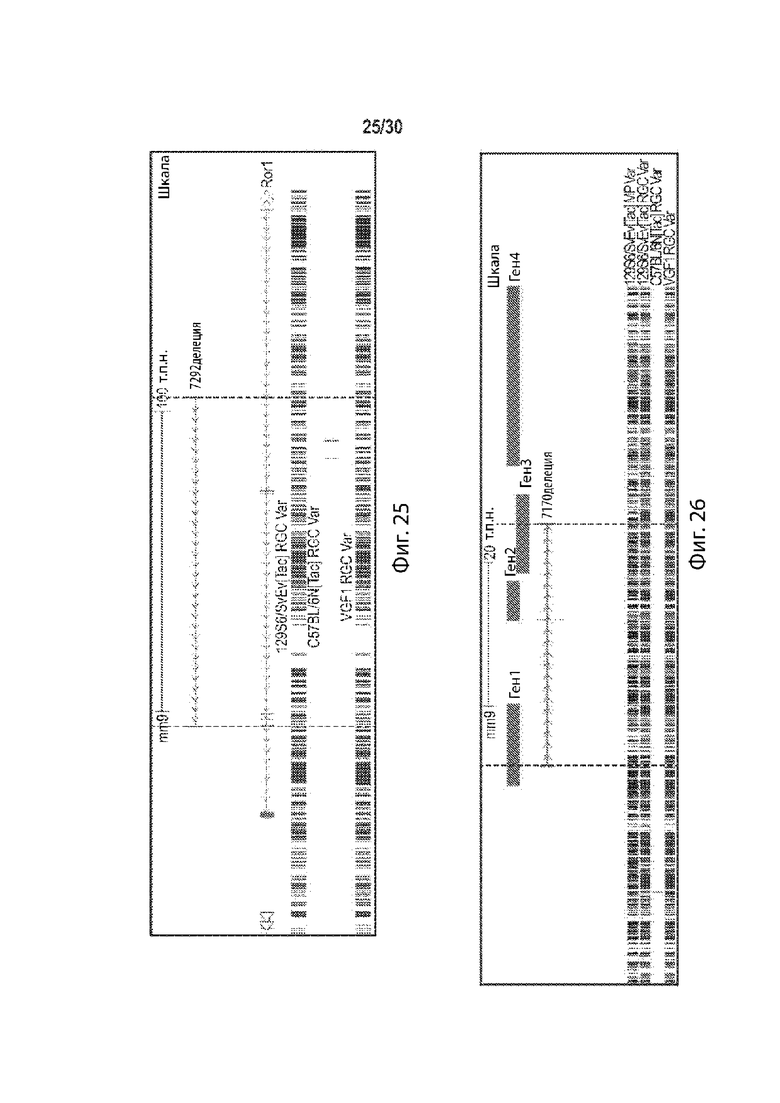
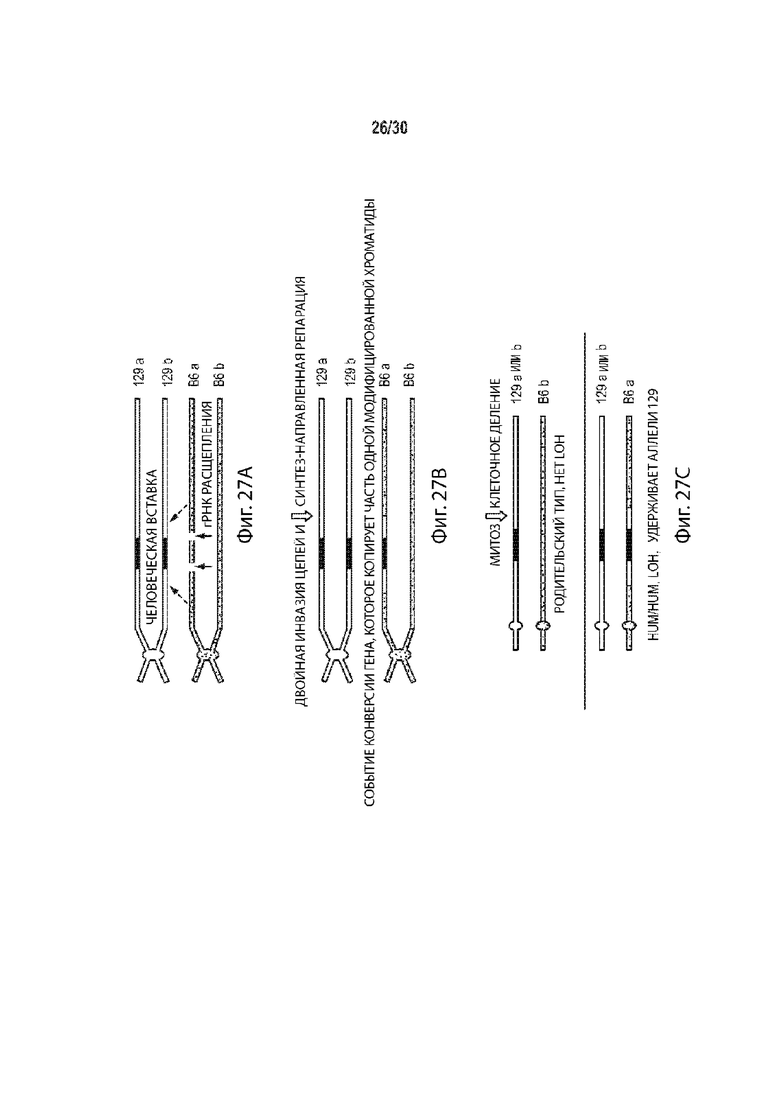
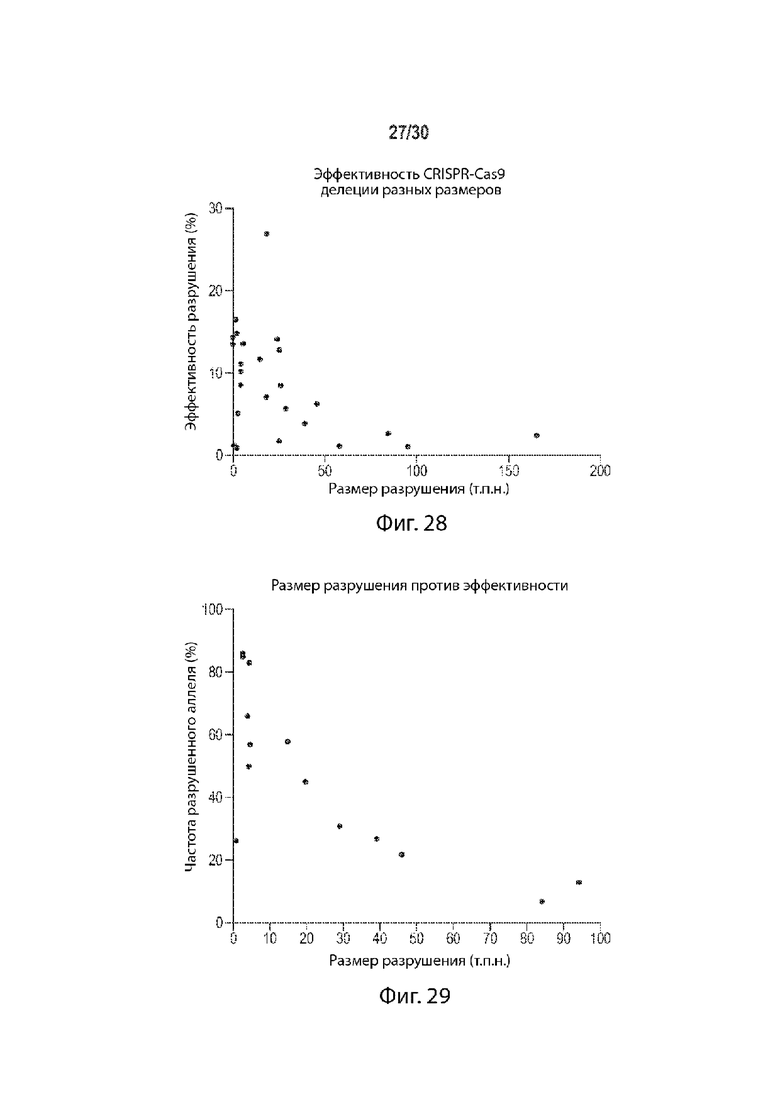
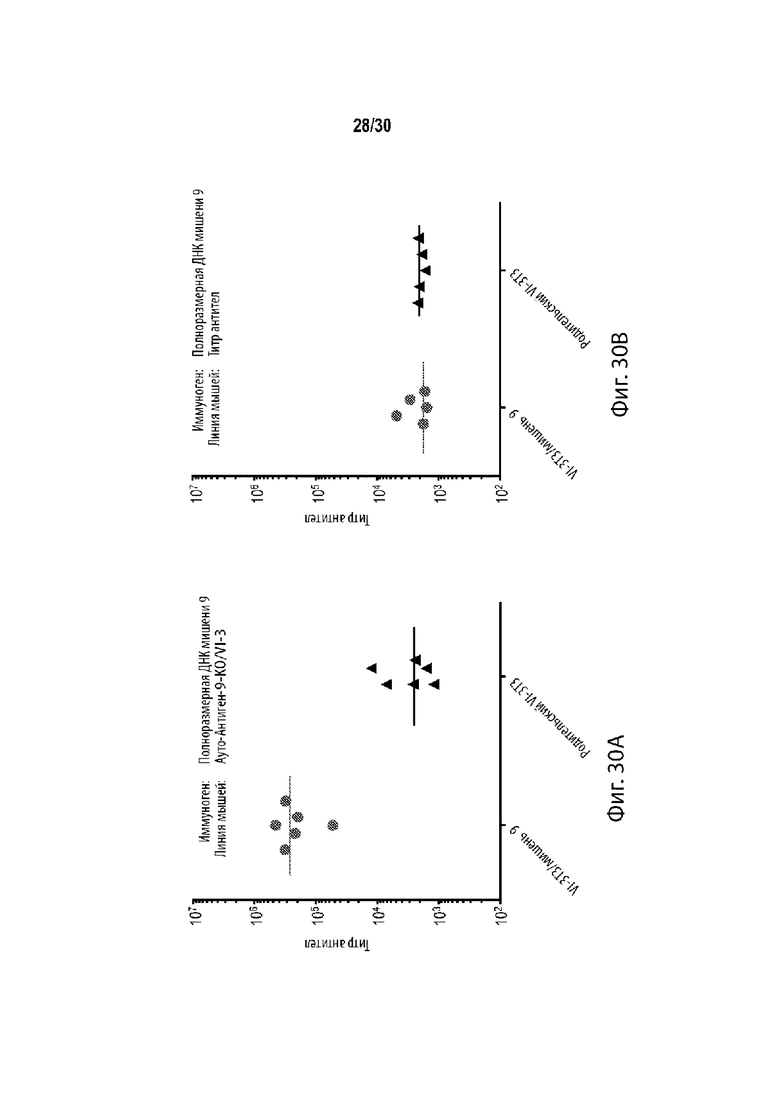
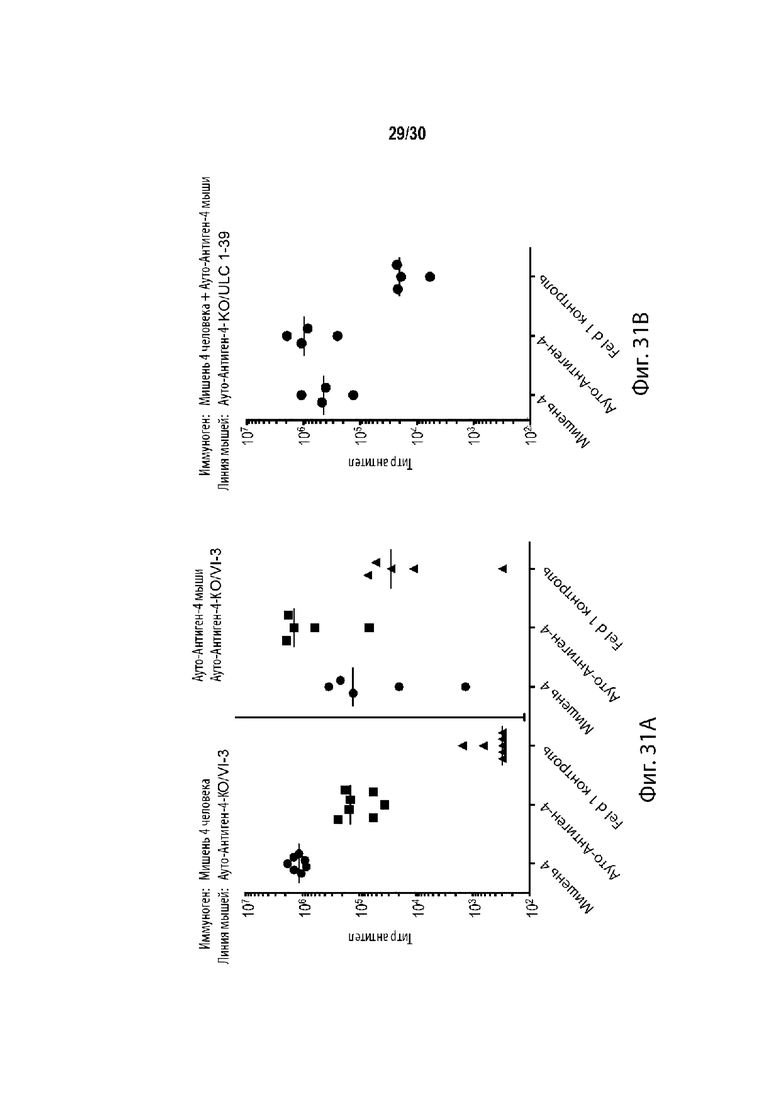
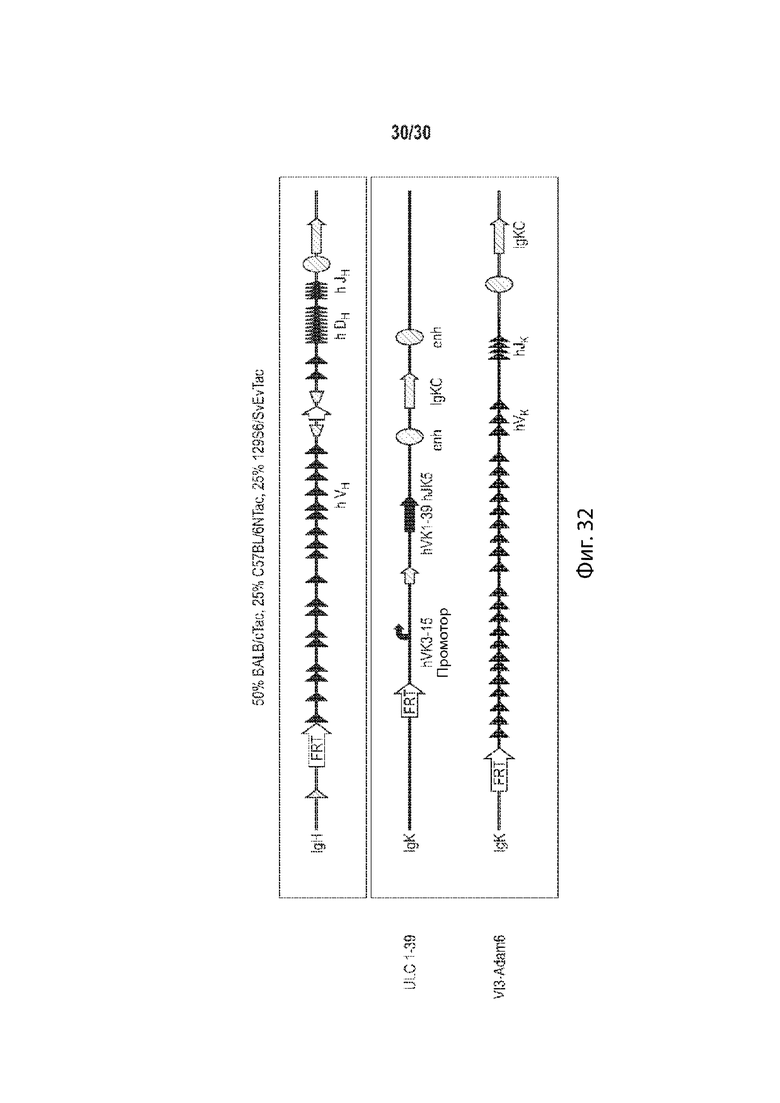
Изобретение относится к области биохимии, в частности к способу получения антигенсвязывающих белков против представляющего интерес чужеродного антигена, предусматривающему получение генетически модифицированной крысы или мыши, у которой локус-мишень содержит биаллельную делецию всего или части гена, кодирующего аутоантиген. При этом получение вышеуказанной мыши или крысы включает введение в эмбрион мыши или крысы белка Cas9 или нуклеиновой кислоты, кодирующей белок Cas9, а также первой и второй направляющей нуклеотидной последовательности. Изобретение позволяет эффективно сократить сроки получения генетически модифицированной мыши или крысы с пониженной толерантностью к представляющему интерес чужеродному антигену, а также обеспечивает получение большего количества антител против представляющего интерес чужеродного антигена. 2 н. и 34 з.п. ф-лы, 32 ил., 24 табл., 8 пр.
1. Способ получения антигенсвязывающих белков против представляющего интерес чужеродного антигена, включающий:
(а) создание генетически модифицированной мыши или крысы с пониженной толерантностью к представляющему интерес чужеродному антигену, включающее:
(i) введение в эмбрион мыши или крысы на одноклеточной стадии или эмбриональную стволовую клетку мыши или крысы, которая не является эмбрионом на одноклеточной стадии:
(I) белка Cas9 или нуклеиновой кислоты, кодирующей белок Cas9;
(II) первой направляющей РНК или ДНК, кодирующей первую направляющую РНК, где первая направляющая РНК гибридизуется с последовательностью, распознаваемой первой направляющей РНК в геномном локусе-мишени, причем геномный локус-мишень содержит весь или часть гена, кодирующего аутоантиген, гомологичный, ортологичный или обладающий общим представляющим интерес эпитопом с представляющим интерес чужеродным антигеном; и
(III) второй направляющей РНК или ДНК, кодирующей вторую направляющую РНК, где вторая направляющая РНК гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени;
(ii) идентификацию модифицированного эмбриона мыши или крысы на одноклеточной стадии или модифицированной эмбриональной стволовой клетки мыши или крысы с биаллельной модификацией в геномном локусе-мишени, причем биаллельная модификация содержит биаллельную делецию всего или части гена, кодирующего аутоантиген, и причем экспрессия аутоантигена устраняется; и
(iii) получение генетически модифицированного F0-поколения мыши или крысы из модифицированного эмбриона мыши или крысы на одноклеточной стадии или модифицированной эмбриональной стволовой клетки мыши или крысы, причем геномный локус-мишень содержит биаллельную делецию всего или части гена, кодирующего аутоантиген у генетически модифицированного F0-поколения мыши или крысы, таким образом устраняя экспрессию аутоантигена;
(b) иммунизацию генетически модифицированного F0-поколения мыши или крысы, полученного на стадии (а), представляющим интерес чужеродным антигеном; и
(c) поддержание генетически модифицированного F0-поколения мыши или крысы в условиях, достаточных для инициирования иммунного ответа на представляющий интерес чужеродный антиген,
причем генетически модифицированное F0-поколение мыши или крысы продуцирует антигенсвязывающие белки против представляющего интерес чужеродного антигена.
2. Способ по п. 1, в котором белок Cas9 обладает индуцирующей двухцепочечные разрывы активностью, и белок Cas9 и направляющая РНК создают парные двухцепочечные разрывы на разных сайтах в пределах одного геномного целевого локуса.
3. Способ по п. 1 или 2, где:
(I) клетка или эмбрион на стадии (а)(i) представляет собой эмбрион мыши или крысы на одноклеточной стадии, и продуцирование генетически модифицированного F0-поколения мыши или крысы на стадии (а)(iii) включает имплантацию модифицированного эмбриона мыши или крысы на одноклеточной стадии суррогатной матери для получения генетически модифицированного F0-поколения мыши или крысы, у которого геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом так, что экспрессия аутоантигена устранена, или
(II) клетка или эмбрион на стадии (а)(i) представляет собой эмбриональную стволовую клетку мыши или крысы, и продуцирование генетически модифицированного F0-поколения мыши или крысы на стадии (а)(iii) включает введение модифицированной эмбриональной стволовой клетки мыши или крысы в эмбрион-хозяин и гестация эмбриона-хозяина у суррогатной матери для получения генетически модифицированного F0-поколения мыши или крысы, у которого геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом так, что экспрессия аутоантигена устранена.
4. Способ по п. 3, в котором клетка или эмбрион на стадии (а)(i) представляет собой эмбриональную стволовую клетку мыши или крысы.
5. Способ по любому из пп. 1-4, дополнительно включающий получение гибридомы из В-клеток, выделенных из иммунизированного генетически модифицированного F0-поколения мыши или крысы.
6. Способ по любому из пп. 1-5, дополнительно включающий получение от иммунизированного генетически модифицированного F0-поколения мыши или крысы первой последовательности нуклеиновой кислоты, кодирующей вариабельный домен тяжелой цепи иммуноглобулина одного из антигенсвязывающих белков против представляющего интерес чужеродного антигена и/или второй последовательности нуклеиновой кислоты, кодирующей вариабельный домен легкой цепи иммуноглобулина одного из антигенсвязывающих белков против представляющего интерес чужеродного антигена, необязательно, причем последовательность первой нуклеиновой кислоты и/или последовательность второй нуклеиновой кислоты получают из лимфоцита генетически модифицированного F0-поколения мыши или крысы или из гибридомы, полученной из лимфоцитов, и, необязательно, причем генетически модифицированное F0-поколение мыши или крысы содержит гуманизированный локус иммуноглобулина, и причем первая последовательность нуклеиновой кислоты кодирует вариабельный домен тяжелой цепи иммуноглобулина человека, а вторая последовательность нуклеиновой кислоты кодирует вариабельный домен легкой цепи иммуноглобулина человека.
7. Способ по любому из пп. 1-6, в котором:
(I) антигенсвязывающие белки, продуцируемые генетически модифицированным F0-поколением мыши или крысы, против представляющего интерес чужеродного антигена имеют более высокий титр, чем антигенсвязывающие белки, продуцируемые контрольной мышью или крысой, которая является диким типом в геномном локусе-мишени, после иммунизации контрольной мыши или крысы представляющим интерес чужеродным антигеном; и/или
(II) более разнообразный генетический репертуар антигенсвязывающих белков против представляющего интерес чужеродного антигена продуцируется генетически модифицированным F0-поколением мыши или крысы после иммунизации генетически модифицированного F0-поколения мыши или крысы представляющим интерес чужеродным антигеном по сравнению с антигенсвязывающими белками, продуцируемыми контрольной мышью или крысой, которая является диким типом в указанном геномном локусе-мишени, после иммунизации контрольной мыши или крысы представляющим интерес чужеродным антигеном; и/или
(III) антигенсвязывающие белки, продуцируемые генетически модифицированным F0-поколением мыши или крысы, против представляющего интерес чужеродного антигена используют большее разнообразие сегментов тяжелой цепи V гена и/или сегментов легкой цепи V гена по сравнению с антигенсвязывающими белками, продуцируемыми контрольной мышью или крысой, которая является диким типом в геномном локусе-мишени, после иммунизации контрольной мыши или крысы представляющим интерес чужеродным антигеном; и/или
(IV) некоторые из антигенсвязывающих белков, продуцируемых генетически модифицированным F0-поколением мыши или крысы, против представляющего интерес чужеродного антигена, перекрестно реагируют с аутоантигеном.
8. Способ по любому из пп. 1-7, в котором последовательность, распознаваемая первой направляющей РНК, расположена в 5' положении относительно последовательности, распознаваемой второй направляющей РНК в геномном локусе-мишени, и в котором стадия (а)(ii) включает в себя проведение анализа удерживания для определения того, что число копий равно 2 для участка в 5' положении и в пределах около 1 т.п.о. последовательности, распознаваемой первой направляющей РНК, и/или для участка в 3' положении и в пределах около 1 т.п.о. последовательности, распознаваемой второй направляющей РНК.
9. Способ по любому из пп. 1-8, в котором представляющий интерес чужеродный антиген представляет собой ортолог аутоантигена, и/или представляющий интерес чужеродный антиген содержит весь или часть белка человека.
10. Способ по любому из пп. 1-9, в котором геномный локус-мишень модифицируется для содержания вставки одного или более нуклеотидов или замены одного или более нуклеотидов.
11. Способ по п. 10, в котором биаллельная делеция является точной делецией без случайных вставок и делеций (инделей), и необязательно при этом геномный локус-мишень модифицируется для содержания биаллельной делеции размером от около 0,1 т.п.о. до около 200 т.п.о.
12. Способ по любому из пп. 1-11, в котором:
(I) последовательность, распознаваемая первой направляющей РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, и последовательность, распознаваемая второй направляющей РНК, содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от стоп-кодона; или
(II) последовательности, распознаваемые первой и второй направляющими РНК, различны, и каждая из последовательностей, распознаваемых первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, и при этом модификация содержит биаллельное разрушение старт-кодона гена, кодирующего аутоантиген.
13. Способ по любому из пп. 1-12, в котором стадия введения (а)(i) дополнительно включает введение в эмбриональную стволовую клетку мыши или крысы или эмбриона мыши или крысы на одноклеточной стадии:
(IV) третьей направляющей РНК или ДНК, кодирующей третью направляющую РНК, где третья направляющая РНК гибридизуется с последовательностью, распознаваемой третьей направляющей РНК в геномном локусе-мишени; и
(V) четвертой направляющей РНК или ДНК, кодирующей четвертую направляющую РНК, где четвертая направляющая РНК гибридизуется с последовательностью, распознаваемой четвертой направляющей РНК в геномном локусе-мишени.
14. Способ по любому из пп. 1-13, в котором:
(I) клетка или эмбрион на стадии (а)(i) представляет собой эмбриональную стволовую клетку мыши или крысы, и стадия (а)(i) включает введение ДНК, кодирующей белок Cas9; ДНК, кодирующей первую направляющую РНК, и ДНК, кодирующей вторую направляющую РНК, и необязательно при этом все из ДНК, кодирующей белок Cas9, ДНК, кодирующей первую направляющую РНК, и ДНК, кодирующей вторую направляющую РНК, вводят в эмбриональную стволовую клетку мыши или крысы путем электропорации или нуклеофекции, или где
(II) клетка или эмбрион на стадии (а)(i) представляет собой эмбрион мыши или крысы на одноклеточной стадии, и стадия (а)(i) включает введение РНК, кодирующей белок Cas9; первой направляющей РНК, и второй направляющей РНК, и необязательно при этом РНК, кодирующую белок Cas9, РНК, кодирующую первую направляющую РНК, и РНК, кодирующую вторую направляющую РНК, вводят в эмбрион мыши или крысы на одноклеточной стадии путем пронуклеарной инъекции или цитоплазматической инъекции.
15. Способ по любому из пп. 1-14, в котором на стадии (а)(i) не вводится экзогенная матрица для репарации.
16. Способ по любому из пп. 1-14, в котором стадия введения (а)(i) дополнительно включает введение в эмбриональную стволовую клетку мыши или крысы или эмбрион мыши или крысы на одноклеточной стадии экзогенной матрицы для репарации, содержащий 5'-плечо гомологии, которое гибридизуется с 5' последовательностью-мишенью в геномном локусе-мишени, и 3'-плечо гомологии, которое гибридизуется с 3' последовательностью-мишенью в геномном локусе-мишени, при условии, что, если клетка или эмбрион на стадии (а)(i) представляет собой эмбрион мыши или крысы на одноклеточной стадии, экзогенная матрица для репарации составляет не более чем около 5 т.п.о. в длину, и необязательно при этом последовательность удаленной нуклеиновой кислоты из биаллельной делеции состоит из последовательности нуклеиновой кислоты между 5' и 3' последовательностями-мишенями.
17. Способ по п. 16, в котором экзогенная матрица для репарации дополнительно содержит вставку нуклеиновой кислоты, фланкированную 5'-плечом гомологии и 3'-плечом гомологии, и необязательно при этом вставка нуклеиновой кислоты гомологична или ортологична геномному локусу-мишени, и вставка нуклеиновой кислоты замещает последовательность удаленной нуклеиновой кислоты из биаллельной делеции.
18. Способ по п. 16 или 17, в котором длина экзогенной матрицы для репарации находится в промежутке от около 50 нуклеотидов до около 1 т.п.о., необязательно при этом длина экзогенной матрицы для репарации находится в промежутке от около 80 нуклеотидов до около 200 нуклеотидов, и необязательно при этом экзогенная матрица для репарации представляет собой одноцепочечный олигодезоксинуклеотид.
19. Способ по п. 16 или 17, в котором клетка или эмбрион на стадии (а)(i) представляет собой эмбриональную стволовую клетку мыши или крысы и в котором:
(a) экзогенная матрица для репарации представляет собой большой нацеливающий вектор (LTVEC), который имеет длину по меньшей мере 10 т.п.о.; или
(b) экзогенная матрица для репарации представляет собой LTVEC, причем общая сумма 5'- и 3'-плеч гомологии LTVEC имеет длину по меньшей мере 10 т.п.о.
20. Способ по любому из пп. 1-19, в котором мышь или крыса содержит гуманизированный локус иммуноглобулина.
21. Способ по любому из пп. 1-20, в котором мышь или крыса представляет собой крысу.
22. Способ по п. 21, в котором мышь или крыса представляет собой мышь, необязательно при этом линия мыши содержит линию BALB/c.
23. Способ по п. 22, в котором линия мышей содержит линии BALB/c, C57BL/6 и 129.
24. Способ по п. 23, в котором линия мышей представляет собой 50 % BALB/c, 25 % C57BL/6 и 25 % 129, и необязательно при этом гаплотип MHC мыши представляет собой MHCb/d.
25. Способ по любому из пп. 22-24, в котором мышь содержит в своей зародышевой линии неперестроенные генные сегменты вариабельного участка человека, вставленные в эндогенный локус иммуноглобулина мыши, при этом неперестроенные генные сегменты вариабельного участка человека являются генными сегментами тяжелой цепи, а локус иммуноглобулина мыши является локусом тяжелой цепи, и/или в котором неперестроенные генные сегменты вариабельного участка человека являются сегментами легкой цепи каппа или лямбда, и локус иммуноглобулина мыши является локусом легкой цепи.
26. Способ по п. 25, в котором мышь содержит в своих зародышевых линиях неперестроенные генные сегменты вариабельного участка человека, функционально связанные с геном константного участка мыши, причем мышь не имеет гена константного участка человека, и причем ген константного участка мыши находится в эндогенном локусе иммуноглобулина мыши, и необязательно при этом мышь содержит:
(I) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и
(II) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (I) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (II) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека.
27. Способ по любому из пп. 22-26, в котором мышь содержит в своей зародышевой линии гуманизированный вариабельный локус легкой цепи иммуноглобулина, содержащий не более одной или не более двух перестроенных последовательностей V/J легкой цепи человека, функционально связанных с константным участком легкой цепи мыши, и при этом мышь дополнительно содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина, содержащий по меньшей мере один неперестроенный V человека, по меньшей мере один неперестроенный D человека и по меньшей мере один неперестроенный J сегмент человека, функционально связанный с геном константного участка тяжелой цепи мыши, и необязательно при этом мышь содержит гуманизированный вариабельный локус тяжелой цепи иммуноглобулина и гуманизированный вариабельный локус легкой цепи иммуноглобулина, причем мышь экспрессирует одну легкую цепь.
28. Способ по п. 27, в котором мышь содержит:
(a) один перестроенный вариабельный участок легкой цепи иммуноглобулина человека (VL/JL), который кодирует VL домен легкой цепи иммуноглобулина человека, причем один перестроенный участок VL/JL человека выбирается из генного сегмента Vκ1-39/Jκ5 человека или генного сегмента Vκ3-20/Jκ1 человека; и
(b) замещение вариабельных генных сегментов эндогенной тяжелой цепи (VH) одним или более генными сегментами VH человека, причем генные сегменты VH человека функционально связаны с геном константного участка эндогенной тяжелой цепи (CH), и генные сегменты VH человека способны перестраиваться и формировать ген химерной тяжелой цепи человека/мыши.
29. Способ по п. 27, в котором мышь экспрессирует популяцию антител, и зародышевая линия мыши содержит только один ген вариабельного участка легкой цепи каппа иммуноглобулина, который представляет собой перестроенный ген вариабельного участка легкой цепи каппа зародышевой линии человека, причем мышь является либо гетерозиготной по указанному одному гену вариабельного участка легкой цепи каппа иммуноглобулина в том, что она содержит только одну копию, либо гомозиготна по одному гену вариабельного участка легкой цепи каппа иммуноглобулина в том, что она содержит две копии, причем мышь характеризуется активным созреванием аффинности так, что:
(a) каждая легкая цепь каппа иммуноглобулина популяции содержит вариабельный домен легкой цепи, который кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека или его соматически мутированным вариантом;
(b) популяция содержит антитела, содержащие легкие цепи каппа иммуноглобулина, вариабельный домен легкой цепи которых кодируется перестроенным геном вариабельного участка легкой цепи каппа зародышевой линии человека, и антитела, содержащие легкие цепи каппа иммуноглобулина, вариабельный домен легкой цепи которых кодируется его соматически мутированными вариантами; и
(c) мышь генерирует разнообразную коллекцию соматически мутированных тяжелых цепей с высокой аффинностью, которые успешно спариваются с легкими цепями каппа иммуноглобулина с образованием антител популяции.
30. Способ по п. 27, в котором мышь является гетерозиготной или гомозиготной по своей зародышевой линии для:
(a) вставки в эндогенный локус вариабельного участка лёгкой цепи иммуноглобулина κ мыши перестроенной Vκ/Jκ последовательности, содержащей:
(i) одну последовательность Vκ зародышевой линии человека, причем указанная одна последовательность Vκ зародышевой линии человека присутствует в SEQ ID NO: 148 или SEQ ID NO: 149; и
(ii) одну последовательность Jκ зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком κ мыши; и
(b) вставки в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраиваться и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
31. Способ по любому из пп. 25-30, в котором мышь содержит модификацию локуса тяжелой цепи иммуноглобулина, причем модификация уменьшает или устраняет эндогенную функцию ADAM6, причем мышь содержит эктопическую последовательность нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент функционируют у самца мыши и причем эктопическая последовательность нуклеиновой кислоты, кодирующая белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, присутствует в локусе вариабельного участка тяжелой цепи человека.
32. Способ по любому из пп. 1-31, в котором мышь или крыса представляет собой мышь, которая, по меньшей мере, частично получена из линии BALB/c, и мышь содержит гуманизированный локус иммуноглобулина, причем представляющий интерес чужеродный антиген представляет собой весь или часть человеческого белка, который ортологичен аутоантигену, и при этом:
(I) последовательность, распознаваемая первой направляющей РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, и последовательность, распознаваемая второй направляющей РНК, содержит стоп-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от стоп-кодона; или
(II) последовательности, распознаваемые первой и второй направляющими РНК, различны, и каждая из последовательностей, распознаваемых первой и второй направляющими РНК, содержит старт-кодон для гена, кодирующего аутоантиген, или находится в пределах около 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеотидов от старт-кодона, и при этом модификация содержит биаллельное разрушение старт-кодона гена, кодирующего аутоантиген, в результате чего экспрессия аутоантигена устранена.
33. Способ по п. 32, в котором мышь содержит:
(a) последовательность эктопической нуклеиновой кислоты, кодирующую белок ADAM6 мыши, его ортолог, его гомолог, или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши;
(b) гибридный локус тяжелой цепи, содержащий вставку генных сегментов V, D и J тяжелой цепи иммуноглобулина человека, причем генные сегменты V, D и J тяжелой цепи иммуноглобулина человека функционально связаны с геном тяжелой цепи иммуноглобулина мыши, причем ген тяжелой цепи иммуноглобулина мыши находится в эндогенном локусе иммуноглобулина мыши; и
(c) гибридный локус легкой цепи, содержащий вставку генных сегментов V и J легкой цепи иммуноглобулина человека, причем генные сегменты V и J человека функционально связаны с последовательностью гена константного участка легкой цепи иммуноглобулина мыши; причем (b) перестраивается с образованием гибридной последовательности тяжелой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и (c) перестраивается с образованием гибридной последовательности легкой цепи, содержащей вариабельный участок человека, функционально связанный с константным участком мыши, и причем мышь неспособна образовывать антитело, которое содержит вариабельный участок человека и константный участок человека.
34. Способ по п. 32, в котором мышь является гетерозиготной или гомозиготной в своей зародышевой линии по:
(a) последовательности эктопической нуклеиновой кислоты, кодирующей белок ADAM6 мыши, его ортолог, его гомолог или его фрагмент, причем белок ADAM6, его ортолог, его гомолог или его фрагмент, функционируют у самца мыши;
(b) вставке в эндогенный локус вариабельного участка лёгкой цепи иммуноглобулина κ мыши перестроенной Vκ/Jκ последовательности, содержащей:
(i) одну последовательность Vκ зародышевой линии человека, причем указанная одна последовательность Vκ зародышевой линии человека присутствует в SEQ ID NO: 148 или SEQ ID NO: 149; и
(ii) одну последовательность Jκ зародышевой линии человека, причем перестроенная последовательность Vκ/Jκ функционально связана с эндогенным константным участком κ мыши; и
(c) вставке в эндогенный локус вариабельного участка тяжелой цепи иммуноглобулина мыши множества генных сегментов вариабельного участка тяжелой цепи иммуноглобулина человека, причем генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека функционально связаны с константным участком эндогенной тяжелой цепи иммуноглобулина мыши, и генные сегменты вариабельного участка тяжелой цепи иммуноглобулина человека способны перестраиваться и формировать перестроенный ген тяжелой цепи химерного иммуноглобулина человека/мыши.
35. Способ по любому из пп. 1-34, в котором эмбриональная стволовая клетка мыши или крысы представляет собой гибридную клетку, или эмбрион мыши или крысы на одноклеточной стадии представляет собой гибридный эмбрион на одноклеточной стадии, и причем способ дополнительно включает:
(a') сравнение последовательности пары соответствующих первой и второй хромосом в геномном локусе-мишени и выбор участка-мишени в пределах геномного локуса-мишени перед стадией приведения в контакт (а) на основе участка-мишени, имеющего более высокий процент идентичности между парой соответствующих первой и второй хромосом относительно всего или части остатка геномного локуса-мишени, причем участок-мишень содержит: последовательность, распознаваемую первой направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о. , 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6, т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о. или 10 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или на каждой стороне последовательности, распознаваемой первой направляющей РНК, и/или последовательность, распознаваемую второй направляющей РНК, и по меньшей мере 10 п.о., 20 п.о., 30 п.о., 40 п.о., 50 п.о., 100 п.о., 200 п.о., 300 п.о., 400 п.о., 500 п.о., 600 п.о., 700 п.о., 800 п.о., 900 п.о. , 1 т.п.о., 2 т.п.о., 3 т.п.о., 4 т.п.о., 5 т.п.о., 6, т.п.о., 7 т.п.о., 8 т.п.о., 9 т.п.о. или 10 т.п.о. фланкирующей последовательности на 5' стороне, 3' стороне или на каждой стороне последовательности, распознаваемой второй направляющей РНК, и необязательно при этом участок-мишень имеет более высокий процент идентичности последовательности между парой соответствующих первой и второй относительно остальной части геномного локуса-мишени, и необязательно при этом участок-мишень имеет по меньшей мере 99,9 % идентичности последовательности между парой соответствующих первой и второй хромосом, а остальная часть целевого геномного локуса-мишени имеет не более чем 99,8% идентичности последовательности между парой соответствующих первой и второй хромосом.
36. Способ создания генетически модифицированной мыши или крысы с пониженной толерантностью к представляющему интерес чужеродному антигену, включающий:
(a) введение в эмбрион мыши или крысы на одноклеточной стадии или эмбриональную стволовую клетку мыши или крысы, которая не является эмбрионом на одноклеточной стадии:
(i) белка Cas9 или нуклеиновой кислоты, кодирующей белок Cas9;
(ii) первой направляющей РНК или ДНК, кодирующей первую направляющую РНК, где первая направляющая РНК гибридизуется с последовательностью, распознаваемой первой направляющей РНК в геномном локусе-мишени, причем геномный локус-мишень содержит весь или часть гена, кодирующего аутоантиген, гомологичный, ортологичный или обладающий общим представляющим интерес эпитопом с представляющим интерес чужеродным антигеном; и
(iii) второй направляющей РНК или ДНК, кодирующей вторую направляющую РНК, где вторая направляющая РНК которая гибридизуется с последовательностью, распознаваемой второй направляющей РНК в геномном локусе-мишени;
(b) идентификацию модифицированного эмбриона мыши или крысы на одноклеточной стадии или модифицированной эмбриональной стволовой клетки мыши или крысы с биаллельной модификацией в геномном локусе-мишени, причем биаллельная модификация содержит биаллельную делецию всего или части гена, кодирующего аутоантиген, и причем экспрессия аутоантигена устраняется; и
(c) получение генетически модифицированного F0-поколения мыши или крысы из модифицированного эмбриона мыши или крысы на одноклеточной стадии или модифицированной эмбриональной стволовой клетки мыши или крысы, причем геномный локус-мишень модифицирован в паре соответствующих первой и второй хромосом у генетически модифицированного F0-поколения мыши или крысы так, что экспрессия аутоантигена устранена.
| ESTHER LATRES et al | |||
| Myostatin blockade with a fully human monoclonal antibody induces muscle hypertrophy and reverses muscle atrophy in young and aged mice, Skelet Muscle, 2015, Vol.5, N.34 doi: 10.1186/s13395-015-0060-8 | |||
| YANLIANG WANG et al | |||
| Highly efficient generation of biallelic reporter gene knock-in mice via CRISPR-mediated genome editing |
Авторы
Даты
2021-03-29—Публикация
2017-05-19—Подача