Изобретение относится к экспериментальной медицине, медицинской микробиологии и инфектологии и может быть использовано для изучения роли колонизационной резистентности слизистой оболочки желудка экспериментальных животных в предупреждении колонизации и приживаемости в организме млекопитающих бактерий Helicobacter pylori, предотвращении развития инфекционного процесса и вызываемых возбудителем патологических изменений в желудке, а также для оценки эффективности новых и разрабатываемых средств эрадикационной терапии хеликобактериоза.
Хеликобактериоз - инфекционное заболевание с фекально - оральным механизмом передачи, вызываемое бактериями Helicobacter pylori, имеющими выраженную тропность к эпителию слизистой оболочки желудка. В настоящее время Helicobacter pylori рассматривается в качестве патогенного биологического агента, вызывающего хроническое воспаление желудка -хеликобактериоз и способствующего развитию гастрита, язвенной болезни и новообразований желудка (Goodwin C.S., Armstrong J.A., Marshall B.J. Campylobacter pyloris, gastritis, and peptic ulcer // J. Clin. Pathol. - 1986. - Vol. 39. - P.353-365). Хеликобактер приспособился к длительному пребыванию в желудке, в антральной части которого он скапливается в большом количестве. Именно здесь относительно мало клеток, секретирующих соляную кислоту, что способствует выживанию хеликобактера на поверхности эпителия желудка.
Колонизационная резистентность слизистой оболочки желудка является важнейшим барьером на пути многих возбудителей кишечных заболеваний, среди которых бактерии Helicobacter pylori занимают ведущие позиции в патологии человека, инфицируя подавляющее большинство жителей многих стран на всех континентах Земли (Шкитин В.А., Шпирна А.И., Старовойтов Г.Н. Роль Helicobacter pylori в патологии человека // Клин, микробиол. и антимикроб. химиотерапия. 2002; 4(2): 128-145). Полное избавление от возбудителя даже в настоящее время представляет ой довольно сложную медицинскую проблему.
В научной литературе интегративную функцию желудочно-кишечного тракта по защите организма от патогенных микроорганизмов и вредных веществ связывают с колонизационной резистентностью, полностью ассоциированной с таким морфо-функциональным образованием, как микробно-тканевой комплекс (Минушкин О.Н., Елизаветина Г.А., Ардатская М.Д. Нарушение баланса микрофлоры и ее коррекция //Эффективная фармакотерапия. Гастроэнтерология. 2013; 4:4-8). Это сложное эволюционно сложившееся полифункциональное объединение, состоящее из колонизирующей пристеночную зону слизистой оболочки желудочно-кишечного тракта мукозной микробиоты и подлежащих тканевых структур желудка и кишечника. Неразделимость желудочно-кишечной микробиоты и колонизационной резистентности оформилась в соответствующей формулировке как совокупность механизмов, обеспечивающих способность микробиоты и макроорганизма, кооперативно взаимодействуя, защищать экосистему желудочно-кишечного тракта от воздействия патогенной микрофлоры (Савина В.Е., Погорельский И.П. Колонизационная резистентность кишечника // Всерос. науч. -практ. конф. «Общество, наука, инновации (НПК-2013)». Сборник материалов. Киров: Изд-во Вятского госуниверситета; 2013: 76-78; Звягицева Т.Д., Гриднева С.В. Коррекция нарушений колонизационной резистентности кишечника //health-ua.com/article/15722-korrectciya-narushenij-kolonizacionnoj-rezistentnosti-kishechnika). Иными словами, колонизационная резистентность - это комплекс механизмов, обеспечивающих защиту от доступа патогенов к эпителию желудка и кишечника и последующего их проникновения в организм.
Под колонизационной резистентностью Б.А. Шендеров (Шендеров Б.А. Медицинская микробная экология и функциональное питание: в 3 т.Том 1: Микрофлора человека и животных и ее функции. М.: ГРАНТЪ; 1998, 288 с.) понимает совокупность механизмов, придающих стабильность нормальной микрофлоре и обеспечивающих предотвращение заселения организма хозяина патогенными либо условно-патогенными микроорганизмами. По его данным, в понятие колонизационной резистентности входит целый ряд защитных механизмов: прямых - микробно-тканевой комплекс как сложная специфическая приэпителиальная структура, и опосредованных -инактивация иммунной системы, стимуляция системы мононуклеаров, интерфероногенная функция, ингибирование конъюгации желчных кислот и т.д. Важной составляющей перечисленных механизмов является, по мнению Б.А. Шендерова, в первую очередь, анаэробная микрофлора, которая нейтрализует состав условно-патогенных микроорганизмов толстой кишки и является основным источником эндогенной инфекции (Шендеров Б.А. Нормальная микрофлора и ее роль в поддержании здоровья человека // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1998; 7(1):61-65). Естественно, что множественность механизмов, обеспечивающих колонизационную резистентность, предполагает и множественность вариантов, комбинаций ее состояния в конкретных ситуациях. Количественный и качественный состав микрофлоры желудочно-кишечного тракта, а также состояние среды ее обитания, является одним из определяющих условий эффективности колонизационной резистентности (Lammers K.М., Brigidi P., Vitali В., Gionchetti P., Rizello F., Caramelli E., Matteuzzi D., Canepieri M. Immunomodulatori effects of probiotic bacteria DNA: IL-1 and IL-10 response in human peripheral blood mononuclear cells //FEMS Immunol. Med. Microbiol. 2003; 38(2): 165-172; Veckman V., Miettinen M., Matikainen S., Lande P.,Giacomini E., Coccia E. M. Lactobacilli and streptococci induce inflammatory chemokine production in human macrophages that stimulates Th 1 cell chemotaxis //J. Leukoc. Biol. 2003; 74(3): 395-402).
Ввиду того, что довольно часто о состоянии микробиоценоза биотопов желудочно-кишечного тракта судят по численности так называемых микроорганизмов-бенефициаров, к которым относят бифидобактерии, лактобациллы и эшерихии, нами были получены данные о количественном составе микробиоты желудка человека с интактной слизистой оболочкой. Так, численность бифидобактерий в 1 мл желудочного содержимого колеблется от 0 до 4,0×102 КОЕ, лактобацилл - достигает 5,0×103 КОЕ; эшерихии как и протей отсутствуют; численность дрожжей достигает 7,0×103 КОЕ, а количество Sarcina ventriculi может достигать 6,0×103 КОЕ. Для сравнения приводим данные о численности бенефициаров в желудке здоровых конвенциональных белых мышей: бифидобактерии (4,6±0,6)×104 КОЕ × мл-1; лактобациллы (3,9±0,6)×105 КОЕ × мл-1; эшерихии (4,6±0,7)×103 КОЕ × мл-1). Очевидно, что образ жизни грызунов, в частности домовых мышей (вид Mus musculus) обусловил естественную эволюционно сложившуюся микробиоту желудка, соответствующую типу питания, а также более мощный уровень колонизационной резистентности, которые координированно противодействуют адгезии и колонизации слизистой оболочки желудка бактериями Helicobacter pylori еще в начале инфекционного процесса. Таким образом, существующий тип микробиома желудка мышей как атрибут вида, а также колонизационная резистентность слизистой оболочки желудка обеспечивают полную защиту животных от хеликобактера как возбудителя антропонозного инфекционного заболевания в классическом его понимании. Но если убрать с помощью медикаментов (антибактериальных препаратов) эти барьеры, то тогда инфекционный процесс будет инициирован бактериями Helicobacter pylori. Важно при этом подчеркнуть, что развившийся хеликобактерный гастрит сопровождается распрстранением бактерий Helicobacter pylori с желудочным содержимым в двенадцатиперстную кишку и далее в тонкую и толстую кишку. Обнаружение бактерий Helicobacter pylori в фекалиях на вторые сутки после адгезии и колонизации слизистой оболочки желудка является прямым доказательством развития инфекционного процесса и, наоборот, исчезновение бактерий Helicobacter pylori в фекалиях свидетельствует об эрадикации возбудителя.
К сожалению, как в России, так и за рубежом, практические врачи при лечении хеликобактериоза не обращают внимание на состояние желудочной микробиоты пациентов и связанную с ней колонизационную резистентность. Но игнорировать результаты научных исследований недальновидно, поскольку научный прогресс необратим. К этому следует добавить недавно полученные данные об антимикробных пептидах, которые экспрессируются слизистой оболочкой желудка у больных хеликобактероиозом независимо от их клинического состояния пациентов (Cremniter J., Bodet С, Tougeron D., Dray X., Guilhot J., Jegou J.-F., Morel F., Lecron J.-C, Silvain C, Burucoa C. Th-17 response and antimicrobial peptide expression in gastric mucosa of Helicobacter pylori - infected patients independently of their clinical outcomes. 23 (3): MAR 2018. https://doi.org/10.1111/hel.12479). Существуют согласительные документа международного уровня, в которых сформулированы существенные для практического врача положения (Malferthiner P., Megraud F., OMorain С.et al. Management of Helicobacter pylori infection - the Maastricht V/Florence Consensus // Report.Gut. 2017;66(1): 6-30; Пиманов С.И., Макаренко E.B. Оптимизированные эрадикационные протоколы: рекомендации американской коллегии гастроэнтерологов, Маастрихт V/ Флорентийского и Торонтского консенсусов // Медицинский совет. 2017; 5: 10-17). Этими документами предписан выбор эрадикационного лечения с учетом популяционной антибиотикорезистентности возбудителя и индивидуального анамнеза применения антибиотиков, а в случае неэффективности лечения -последовательно переходить от одной линии терапии к последующей и так далее к последней 16 линии (тройной терапии с рифабутином).
Такую ситуацию с эрадикационной терапией хеликобактериоза можно с большой долей вероятности связать с отсутствием до недавнего времени способа моделирования данного инфекционного заболевания на животных, поскольку они не болеют данной инфекцией ввиду того, что само заболевание относится к разряду антропонозов. Предварительная апробация тех или иных схем лечения хеликобактериоза на биопробных (модельных) животных позволила бы избежать многих ошибок при ведении больных и повысила бы эффективность эрадикационной терапии.
Известен способ оценки состояния колонизационной резистентности слизистой оболочки кишечника организма человека на основе определения индекса колонизационной резистентности с учетом бактериологического исследования биологического материала и определения качественного и количественного состава микроорганизмов, присутствующих в исследуемом биологическом материале (Горелов А.В., Плоскирева А.А. Способ оценки состояния колонизационной резистентности микробиоценоза биотопа организм человека (варианты). Патент РФ №2381504 от 10.02.2008, опубл. 10.02.2010, бюл. №4. Номер охранного документа G01N 33/48). Значительная трудоемкость исполнения заявленного объекта изобретения, персонификация проведения бактериологического и других методов изучения микробиоты биотопов организма не позволяют использовать разработанный способ в широких экспериментальных исследованиях с привлечением модельных животных.
Существенным прорывом в изучении патогенза хеликобактериоза является предложенный способ его моделирования на лабораторных животных, а также селективная плотная питательная среда с гемином и антибиотиком рифампицином для выращивания бактерий Helicobacter pylori КМ-11(RifR) (Погорельский И.П., Чичерин И.Ю., Лундовских И.А., Смирнова Д.Н., Богачева Н.В. Способ моделирования хеликобактериоза. Патент РФ №2690943 от 07.06.2019, опубл. 07.06.209. бюл. №16. Номер охранного документа G09B 23/28). Для этого подопытным конвенциональным белым мышам вводят бактерии Helicobacter pylori КМ-11(RifR), маркированные по признаку устойчивости к антибиотику рифампицину, на фоне подавления финальной стадии секреции соляной кислоты под действием ингибиторов протонного насоса в желудке препаратами Париет либо Омепразол, или на фоне иммуносупрессивного эффекта от внутримышечного введения Дексаметазона, отбирают фекалии и определяют в них бактерии Helicobacter pylori КМ-11(RifR) с использованием селективной плотной питательной среды с гемином и рифампицином до начала, в ходе проведения экспериментов, по окончании введения и в последующем в течение 10-14 дней. Способ позволяет судить об интенсивности, длительности и продолжительности бактериовыделения Helicobacter pylori КМ-11(RifR). В то же время следует признать, что реализация данного способа, предполагающего создание в организме лабораторных животных иммуносупрессивного состояния и подавление секреции желудочного сока вследствие блокирования финальной стадии продукции соляной кислоты, как бы искусственно исключает влияние на развитие хеликобактерной инфекции этих двух важных для жизнедеятельности организма физиологических процессов, которые прямо не нацелены на желудочную микробиоту. Такой способ моделирования хеликобактериоза безусловно имеет большое значение, прежде всего, для апробации новых средств эрадикационной терапии, но с его помощью нельзя установить сущность интимных механизмов взаимодействия возбудителя с микробно-тканевым комплексом стенки желудка на ранней стадии инициации инфекционного процесса. Именно поэтому в соответствии с целевой установкой в заявляемом способе основное внимание уделено воздействию на микробиоту желудка, локализующуюся в мукозальном слое слизистой оболочки, не затрагивают иммунную систему и синтез желудочного сока.
Результаты экспериментальных исследований, посвященных изучению некоторых аспектов эрадикационной терапии при остром экспериментальном хеликобактериозе у лабораторных животных и людей-добровольцев (Чичерин И.Ю., Погорельский И.П., Дармов И.В., Лундовских И.А., Шабалина М.Р., Колеватых Е.П., Козлов П.А., Корнаухов А.С. Оценка эрадикационной эффективности метапребиотика Стимбифид плюс при остром экспериментальном хеликобактериозе у лабораторных животных и людей-добровольцев // Инфекционные болезни. 2018;16(4):62-74) свидетельствуют о возможном участии экзогенных метаболитов лактобацилл в формировании и поддержании колонизационной резистентности слизистой оболочки кишечника, на что указывают также результаты, полученные рядом других исследователей (Ленцнер А.А. Лактофлора животного организма и ее защитная функция. Теоретические и практические проблемы биологии. М.: Агропромиздат; 1986:200 с; Freter R., De Maclas М.Е. Factors affecting the colonization of the gut by lactobacilli and other bacteria. Probiotics: prospects of the use in opportunistic infections. Old Herborn University Seminar. Monograph. Ind. Microbiol., Biochem., Herborn-Dill. Germany; 1995:19-34.; Droy M.T., Drounet Y., Geraud G., Schatz B. Intestinal cytoprotection // Gastroenterol. Clin. Biol.1985; 9(12): 37-44). Действительно, продемонстрированная в экспериментах протективная эффективность надосадочной жидкости нативной культуры лактобацилл L. plantarum 8Р-А3, введенной per os конвециональным белым мышам, инфицированным возбудителями псевдотуберкулеза и кишечного иерсиниоза (Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Дармов И В., Маракулин И.В. Экспериментальный псевдотуберкулез: оценка возможности профилактики, лечения и коррекции дисбиотических нарушений кишечной микрофлоры // Журн. инфектологии. 2012; 4(4): 71-79; Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Бессолицына Е.А., Дармов И В., Шабалина М.Р. Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Бессолицына Е.А., Дармов И В., Шабалина М.Р. Колонизационная резистентность слизистой оболочки кишечника при экспериментальном иерсиниозе // Журн. инфектологии. 2013; 5(1): 75-82; Чичерин И.Ю., Погорельский И.П., Лундовских И. А., Дармов И.В., Малов А.А. Антибактериальная активность и состав надосадочной жидкости нативной культуры Lactobacillus plantarum 8Р-А3 // Журн. международной медицины. 2013; 1(2): 131-139) со всей очевидностью доказала вероятность блокирования рецепторов эпителиальных клеток слизистой оболочки кишечника, предотвращения адгезии патогенных иерсиний и начального этапа инфекционного процесса (Ленцнер А.А., Ленцнер Х.П., Микельсаар М.Э., Тюри М.Э., Брилене Т.А., Брилене В.И., Левков А.А. Лактофлора и колонизационная резистентность // Антибиотики и медицинская биотехнология. 1987; 32(3): 173-179; Хавкин А.И. Микробиоценоз кишечника и иммунитет // Рос.мед. журн. 2003; 11(3): 122-126). Именно этим обстоятельством можно объяснить факт выживания подопытных животных и отсутствие дисбиотических нарушений в составе микробиоценоза кишечника.
Таким образом, имеющиеся результаты экспериментальных исследований дают основание полагать, что подавив колонизационную резистентность слизистой оболочки желудка, создав условия для развития в данном биотопе бионесовместимости по типу «патоген против хозяина» (Глушанова Н.А., Шендеров Б.А. Взаимоотношения пробиотических и индигенных лактобацилл хозяина в условиях совместного культивирования in vitro // Журн. микробиол. 2005; 2: 56-61), можно инициировать развитие острого хеликобактериоза, обеспечив на ранней стадии развития инфекционного процесса адгезию и колонизацию слизистой оболочки желудка бактериями Helicobacter pylori.
Важным показателем, характеризующим степень угнетения колонизационной резистентности слизистой оболочки желудка, а в последующем адгезию и размножение хеликобактера и его дальнейшее проникновение в кишечник, является выделение бактерий Helicobacter pylori из желудочного содержимого, мазков-отпечатков и фекалий животных. Такое бактериологическое исследование стало возможным благодаря использованию для перорального введения животным в экспериментах маркированного по признаку устойчивости к антибиотику рифампицину штамма Helicobacter pylori КМ-11(RifR). Признак устойчивости к рифампицину обеспечивает возможность выявления и идентификации хеликобактера в фекалиях животных при их высеве на специальную селективную плотную питательную среду с гемином и рифампицином в концентрации 150 мкг × мл-1, на которой бактерии кишечной микрофлоры и другие бактерии не растут.
Гистологическое исследование желудка у павших лабораторных животных проводят после фиксации ткани в 10% растворе нейтрального формалина, обезвоживают в изопропаноле и заливают в парафин. Приготовленные на микротоме препараты желудка окрашивают гематоксилином Эрлиха и эозином, просматривают на микроскопе «Микмед -2» (ООО «ЛОМО», Россия) при увеличении х200, х1000, после чего выносят суждение о выраженности патологического процесса.
Пример
Выращивают культуру бактерий Helicobacter pylori КМ-11(RifR) в микроаэрофильных условиях при температуре 37°С в течение 24 ч, после чего готовят бактериальную суспензию на изотоническом растворе хлорида натрия исходя из расчета 1×105 микробных клеток в объеме 0,2 мл.
Берут необходимое количество прошедших акклиматизацию белых мышей массой 18 - 20 г, рассаживают их в индивидуальные кюветы с крышками. Ежедневно отбирают от каждого животного фекалии, взвешивают их, после чего суспендируют в 1,0 мл изотонического раствора хлорида натрия и высевают на селективную плотную питательную среду с рифампицином (150 мкг × мл-1) в чашках Петри, которые инкубируют при температуре 37°С в течение 24-48 ч в микроаэрофильных условиях. С учетом массы фекалий, полученных от каждого животного, делают перерасчет числа бактерий на 1 г фекалий (КОЕ × г-1).
Целью изобретения является разработка способа, позволяющего подавлять колонизационную резистентность слизистой оболочки желудка лабораторных животных.
Технический результат, который может быть получен при использовании данного способа, заключается в том, что у лабораторных животных на фоне угнетения желудочной микробиоты и связанных с этим подавлением локальной иммунной защиты слизистой оболочки желудка, созданием в данном биотопе искусственной микроэкологической и микробиологической бионесовместимости по типу «патоген против хозяина», можно установить временные рамки развития инфекции, начиная от адгезии бактерий Helicobacter pylori и колонизации слизистой оболочки желудка, вплоть до определения морфологически и гистологически различимых проявлений патологического процесса. Другим аспектом решения указанной проблемы является возможность изучения длительности пребывания возбудителя Helicobacter pylori в тканях желудка на основании количественного определения бактерий Helicobacter pylori, выделяемых из организма с кишечным содержимым, как критерия оценки терапевтической эффективности использования эрадикационных протоколов, рекомендованных Маастрихт V/ Флорентийским и Торонтским консенсусов.
Технический результат достигается тем, что заявляемый способ предусматривает селективное воздействие антибактериального препарата на желудочную микробиоту путем перорального введения лабораторным животным однократно в сутки в течение 5 дней в дозе, превышающей его терапевтическую дозу при парентеральном введении в 4 раза. Важным в реализации способа является использование такого антибактериального препарата, который не всасывается в организм в желудочно-кишечном тракте, но оказывает при транзите через желудок локальное воздействие на представителей желудочной микробиоты, снижая их численность и иммунологическую эффективность, способствуя адгезии бактерий Helicobacter pylori, их размножению и развитию тотального хеликобактерного гастрита. Согласно описанию фармакологического действия, приведенному в инструкции по применению (Препарат для медицинского применения Гентамицин. Раствор для внутривенного и внутримышечного введения, 40 мг гентамицина сульфата в 1 мл; регистрационный номер П N016270/01; производитель РУП «Белмедпрепараты», Республика Беларусь), такой характеристикой обладает антибиотик Гентамицин - представитель аминогликозидов (наряду с Канамицином и Стрептомицином). Абсорбция антибиотика при приеме внутрь незначительная - он практически не всасывается при введении в желудочно-кишечный тракт и оказывает местное действие на желудочную микробиоту. В качестве ориентира при выборе вводимой перорально лабораторным животным дозы антибиотика Гентамицина использовали суточную дозу препарата при парентеральном введении, равной 3 мг на 1 кг массы тела больного (всего 240 мг). Соответствующая доза антибиотика для конвенциональных белых мышей в пересчете на единицу поверхности тела составляет 0,6 мг, а для перорального введения с учетом четырехкратного увеличения - 2,4 мг на одно животное.
В экспериментах по изучению состава желудочной и кишечной микробиоты использовали конвенциональных белых мышей обоего пола массой 18-20 г, прошедших акклиматизацию в виварии. У животных в процессе экспериментов отбирали желудки, гомогенизировали в изотоническом растворе хлорида натрия и высевали на плотную питательную среду для подращивания при температуре 37°С и подсчета выросших колоний; в случае выделения хеликобактера суспензию гомогената высевали на селективную плотную питательную среду с рифампицином. Отбор фекалий у экспериментальных животных для проведения исследований проводили ежедневно в течение всего периода выполнения экспериментов.
Количество представителей желудочной микробиоты (КОЕ) бифидобактерий, лактобацилл и эшерихий, выделенных из фекалий животных, определяли высевом соответствующих десятикратных разведений изучаемых суспензий на плотные питательные среды рекомендованного состава [Бондаренко В.М., Лиходед В.Г. Методические рекомендации: микробиологическая диагностика дисбактериоза кишечника. М.: ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН, 2007; 70] в чашках Петри и подсчетом выросших колоний по истечении времени инкубации.
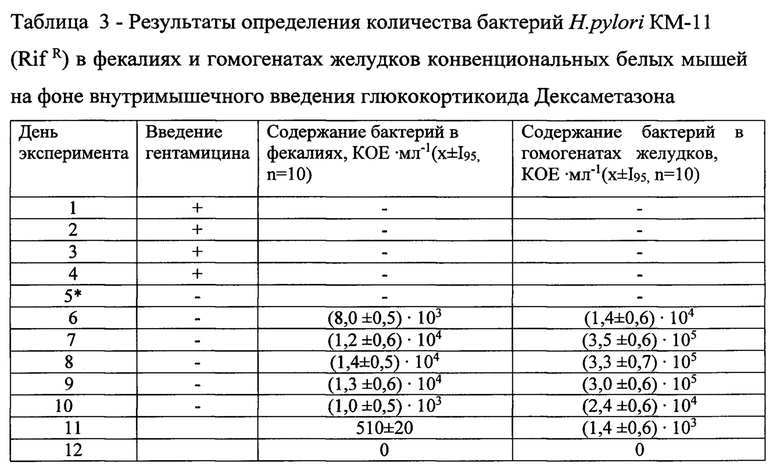
Формирование хеликобактериоза у белых мышей осуществляли путем перорального введения конвенциональным белым мышам трех групп суспензий бактерий H.pylori КМ-11(RifR): животным первой группы на фоне перорального введения антибиотика Гентамицина в суточной дозе 2,4 мг (раствор для внутривенного и внутримышечного введения, 40 мг в 1 мл; производитель РУП «Белмедпрепараты», Республика Беларусь) [Дармов И.В., Чичерин И.Ю., Ердякова А.С., Лундовских И.А., Погорельский И.П. Способ моделирования дисбактериоза кишечника у лабораторных животных. Патент №2477894 от 20.03.2013. Российская Федерация, опубл. 20.03.2013. бюл. №8. Номер охранного документа МПК G09B 23/28]; животным второй группы на фоне перорального введения ингибитора протонной помпы Омепразола в суточной дозе 52 мкг (производитель АО «Акрихин», Россия) [Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Шабалина М.Р., Колеватых Е.П. Изменения в кишечной микробиоте экспериментальных животных под воздейстаием ингибитора протонной помпы Омепразола. Инфекционные болезни. 2018; 16 (3): 60-68]; животным третьей группы на фоне иммунносупрессивного эффекта от внутримышечного введения Дексаметазона в суточной дозе 40 мкг (раствор для инъекций, 4 мг в 1 мл (производитель KRKA, Словения) [Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Горшков А.С., Шабалина М.Р., Смирнова Д.Н., Богачева Н.В. Экспериментальный хеликобактериоз у конвенциональных белых мышей при инфицировании возбудителем Helicobacter pylori. Инфекционные болезни. 2018; 16 (2): 77-85].
Количественный и качественный состав микрофлоры желудочно-кишечного тракта, а также состояние среды ее обитания, является одним из определяющих условий эффективности колонизационной резистентности (Lammers К.М., Brigidi P., Vitali В., Gionchetti P., Rizello F., Caramelli E., Matteuzzi D., Canepieri M. Immunomodulatori effects of probiotic bacteria DNA: IL-1 and IL-10 response in human peripheral blood mononuclear cells. FEMS Immunol. Med. Microbiol. 2003; 38(2): 165-172; Veckman V., Miettinen M., Matikainen S., Lande P.,Giacomini E., Coccia E. M. Lactobacilli and streptococci induce inflammatory chemokine production in human macrophages that stimulates Th 1 cell chemotaxis. J. Leukociol. 2003;74(3): 395-402]. Представители нормальной микрофлоры кишечника - бифидобактерии, лактобациллы, эшерихии, пропионовые бактерии, лактококки и др. обладают высокими иммуногенными свойствами, проявляющимися прежде всего в поддержании концентрации секреторного IgA (sIgA) слизистой оболочке, регуляции созревания лимфоидного аппарата кишечника, генерализации иммунного ответа [Gill Н.С.Stimulation of the immune system by lactic culture. Int. Dairy J.1998; 8: 535-544.].
Таким образом, сохранив колонизационную резистентность слизистой оболочки желудка, обеспечив в данном биотопе бионесовместимость по типу «хозяин против патогена» [Глушанова Н.А., Шендеров Б.А. Взаимоотношения пробиотических и индигенных лактобацилл хозяина в условиях совместного культивирования in vitro. Журн. микробиол. 2005; 2: 56-61.], можно купировать развитие острого хеликобактериоза на ранней стадии развития инфекционного процесса, предотвратив адгезию и колонизацию слизистой оболочки желудка бактериями Н. pylori.
Синтезируемые бактериями H.pylori КМ-11(RifR) экзометаболиты проявляют довольно высокую антимикробную активность в отношении желудочных бенефициаров (бифидобактерий, лактобацилл, эшерихий), которая прогнозируемо может проявиться как в организме экспериментальных животных, так и людей. Действительно, бактерии хеликобактера, обладая полным набором факторов агрессии, таких как факторы вирулентности и факторы колонизации [Шкитин В.А., Шпирна А.И., Старовойтов Г.Н. Роль Helicobacter pylori в патологии человека. Клин. микробиол. и антимикроб. химиотерапия. 2002;4(2): 128-145], уничтожают нормальную желудочную микробиоту и подавляют колонизационную резистентность как бы «прокладывают» себе путь, обеспечивая адгезию и колонизацию слизистой оболочки желудка [Чичерин И.Ю., Погорельский И.П., Дармов И.В., Лундовских И.А., Шабалина М.Р., Колеватых Е.П., Козлов П.А., Корнаухов А.С. Оценка эрадикационной эффективности метапребиотика Стимбифид плюс при остром экспериментальном хеликобактериозе у лабораторных животных и людей-добровольцев. Инфекционные болезни. 2018; 16(4):62-74].
Другие микроорганизмы, поступающие с пищей в желудок и увеличивающие численность микробиоты, не могут конкурировать с бактериями Н. pylori, поскольку для них создаются относительно неблагоприятные условия и где они подвергаются воздействию таких негативных факторов, как повышенная кислотность, протеолитические ферменты, довольно быстрая эвакуация содержимого желудка и других факторов, лимитирующих их рост и размножение. Моделируя с использованием соответствующих медикаментозных средств лимитирующие ситуации, ограничивающие рост и размножение желудочной микробиоты, можно установить факт их влияния как барьера на пути к адгезии и колонизации слизистой оболочки желудка бактериями H.pylori. Такими медикаментозными средствами являются антибиотик Гентамицин, ингибитор протонной помпы Омепразол и глюкокортикоид Дексаметазон [Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Горшков А.С., Шабалина М.Р., Смирнова Д.Н., Богачева Н.В. Экспериментальный хеликобактериоз у конвенциональных белых мышей при инфицировании возбудителем Helicobacter pylori. Инфекционные болезни. 2018; 16 (2): 77-85].
Судя по описанию фармакологического действия, приведенного в инструкции по медицинскому применению [Дармов И.В., Чичерин И.Ю., Ердякова А.С., Лундовских И.А., Погорельский И.П. Способ моделирования дисбактериоза кишечника у лабораторных животных. Патент №2477894 от 20.03.2013. Российская Федерация, опубл. 20.03.2013. бюл. №8. Номер охранного документа МПК G09B 23/28; Инструкция по применению Гентамицина сульфата (Gentamicin sulfat). Производитель РУП «Белмедпрепараты», Республика Беларусь], антибиотик Гентамицин обладает способностью при пероральном введении угнетать жизнедеятельность микроорганизмов, вызывая микроэкологические нарушения в желудочно-кишечном тракте. Связано это с тем, что абсорбция антибиотика при приеме внутрь незначительная, он практически не всасывается в желудочно-кишечном тракте, оказывая при этом местное антибактериальное действие.
Ожидаемые результаты изменения состава желудочной микробиоты в ответ на введение в организм подопытных животных: антибиотика Гентамицина - выраженные дисбиотические изменения в составе желудочной и кишечной микробиоты; ингибитора протонной помпы Омепразола -количественное снижение численности бенефициаров в содержимом желудка и кишечника, возрастание численности «заносной» микрофлоры; глюкокортикоида Дексаметазона - снижение/инактивация иммунного статуса слизистой оболочки желудочно-кишечного тракта, адгезия и размножение бактерий H.pylori на фоне обеднения естественной микробиоты.
Указанные выше лекарственные препараты в соответствующих дозах вводили трем группам конвенциональных белых мышей (по 10 животных в каждой группе): животным первой и второй групп вводили перорально в течение 4 дней, соответственно, антибиотик Гентамицин (2,4 мг) и ингибитор протонной помпы Омепразол (52 мкг), а животным третьей группы -внутримышечно Дексаметазон (40 мкг).
На пятые сутки эксперимента животным трех групп однократно перорально вводили суспензию бактерий H.pylori КМ-11(RifR), содержащую 2×107 живых микробных клеток (в таблицах с результатами определений день введения животным суспензии хеликобактера отмечен символом 5*). В течение последующих дней за животными наблюдали, отбирали биоматериал для бактериологического изучения.
Непосредственно в день инфицирования бактериями H.pylori КМ-11(RifR) у животных отбирали фекалии для определения численности бифидобактерий, лактобацилл и эшерихий. Установлено, что у животных первой группы в фекалиях практически отсутствовали указанные выше бактерии, не были выявлены и микроорганизмы заносной микрофлоры; у животных второй группы выявлено снижение в фекалиях численности лактобацилл и эшерихий при полном отсутствии бифидобактерий, но были выявлены кандиды, клебсиеллы и синегнойная палочка; у животных третьей группы в фекалиях присутствовали все три бенефициара кишечной микробиоты, но в сниженном количестве.
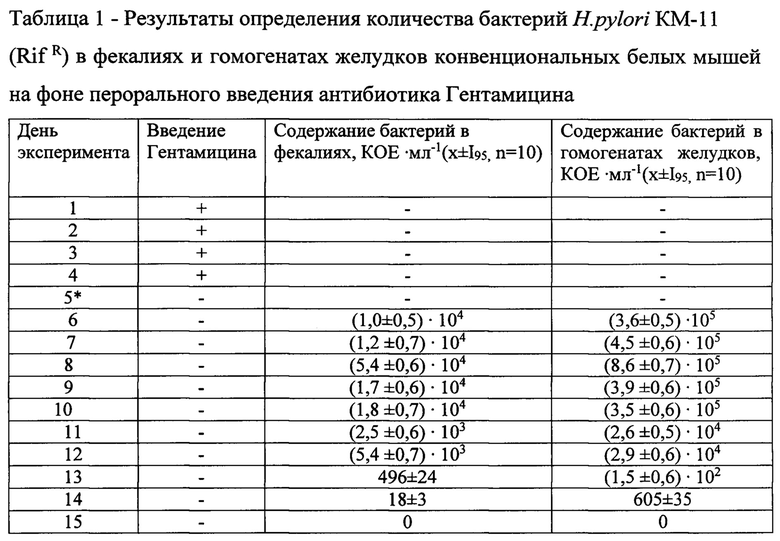
Также в день инфицирования животных трех групп бактериями H.pylori КМ-11(RifR) была определена численность бенефициаров в содержимом желудка: у животных первой группы при пероральном введении гентамицина: бифидобактерии (1,6±0,6)×102 КОЕмл-1, лактобациллы (1,9±0,5)×102 КОЕ⋅мл-1, эшерихии - единичные клетки; у животных второй группы на фоне перорального введения Омепразола бифидобактерии (2,8±0,5)×104 КОЕ⋅мл-1, лактобациллы (2,7±0,5)×105 КОЕ⋅мл-1, эшерихии (1,9±0,5)×103 КОЕ⋅мл-1, заносная микрофлора (1,6±0,7)×104 КОЕ⋅мл-1; у животных третьей группы на фоне иммунносупрессивного эффекта от внутримышечного введения Дексаметазона бифидобактерии (1,1±0,7)×104 КОЕ⋅мл-1, лактобациллы (1,2±0,7)×105 КОЕ-мл-1, эшерихии (1,3±0,6)×103 КОЕ⋅мл-1, заносная микрофлора (3,6±0,6)×104 КОЕ⋅мл-1. Результаты выполненных экспериментов по определению количества бактерий H.pylori КМ-11(RifR) в фекалиях и гомогенатах желудков конвенциональных белых мышей представлены в таблицах 1-3.
Представленные в таблицах 1-3 результаты однозначно свидетельствуют о том, что каждый из трех взятых в эксперименты лечебных препаратов в той или иной степени содействует экспансии бактерий H.pylori КМ-11(RifR) путем реализации богатого потенциала агрессии возбудителя, сказавшегося, в частности, на депривации (т.е. упрощении, нарушении) микроэкологического биоценоза и на колонизационной резистентности слизистой оболочки желудка подопытных животных. В наиболее манифестной форме это проявилось у животных первой группы, которым перорально вводили суспензию бактерий H.pylori КМ-11(RifR) на фоне перорального введения антибиотика Гентамицина. Данный антибиотик практически не всасывается в желудочно-кишечном тракте и поэтому оказывает местное антибактериальное действие, угнетая жизнедеятельность микроорганизмов. Действительно, у животных первой группы выявлены выраженные дисбиотические изменения в составе желудочной микробиоты: численность бифидобактерий уменьшилась в 287 раз, лактобацилл - в 2052 раза, эшерихии - исчезли практически полностью (в фекалиях бактериологическим методом выявлялись единичные микробные клетки). Создавшийся медикаментозный дисбиоз желудочной микробиоты не препятствовал даже после однократного перорального поступления бактерий H.pylori КМ-11(RifR) в желудок животных их адгезии на эпителиоцитах слизистой оболочки и возможности «продержаться» в таком адгезированном состоянии в течение 10 суток. Согласно опубликованным данным [Шкитин В.А., Шпирна А.И., Старовойтов Г.Н. Роль Helicobacter pylori в патологии человека. Клин. микробиол. и антимикроб. химиотерапия. 2002; 4(2): 128-145; Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Горшков А.С., Шабалина М.Р., Смирнова Д.Н., Богачева Н.В. Экспериментальный хеликобактериоз у конвенциональных белых мышей при инфицировании возбудителем Helicobacter pylori. Инфекционные болезни. 2018; 16 (2): 77-85], на эпителиоцитах адгезируются всего 10-13% бактерий хеликобактера из числа поступивших в желудок, но даже этого количества хватает, чтобы в условиях снижения численности микробиоты и значительной утраты колонизационной резистентности произошло «приживление» возбудителя и его размножение, что было зафиксировано бактериологическим методом при исследовании гомогенатов желудков и фекалий подопытных животных.
В то же время следует отметить, что прекращение поступления в желудок антибиотика Гентамицина позволило на 8 сутки после однократного перорального введения бактерий H.pylori КМ-11 (RifR) начаться процессу самовосстановления микробиоты и колонизационной резистентности слизистой оболочки желудка. Важно также и то, что очищение желудка и кишечника подопытных животных от бактерий хеликобактера шло параллельно, хотя более ускоренными темпами этот процесс происходил именно в желудке, где после отмены введения антибиотика Гентамицина начала восстанавливаться микробиота и активизироваться колонизационная резистентность, в частности за счет сохранения локального иммунного статуса слизистой оболочки желудка, на который вводимый в желудок антибиотик не влиял. В итоге на 10 сутки после однократного введения в желудок бактерии H.pylori КМ-11(RifR) и отсутствия антибактериального и дисбиотического эффекта антибиотика Гентамицина желудок и кишечник подопытных животных были полностью освобождены от инфекционного патогена.
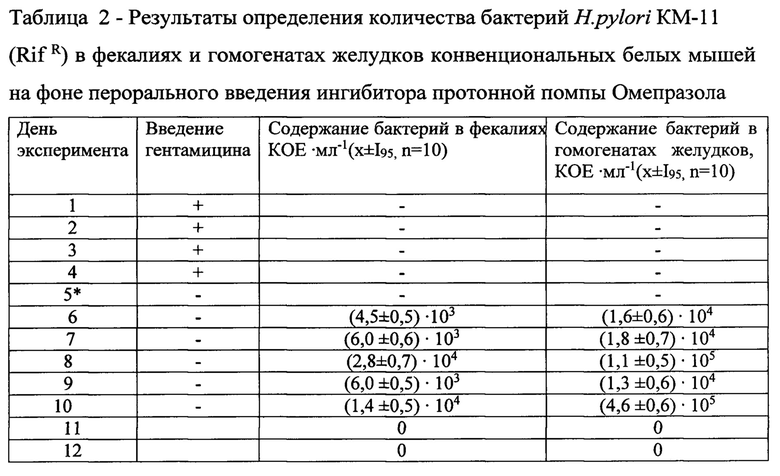
Механизм действия ингибитора протонной помпы Омепразола в корне отличается от такового антибиотика Гентамицина: нет выраженного непосредственного воздействия (местного антибактериального действия, угнетения жизнедеятельности микроорганизмов) на микроорганизмы желудочной микробиоты. В то же время нельзя сбрасывать со счетов имеющихся данных [Инструкция по медицинскому применению лекарственного препарата Омепразол-Акрихин. Производитель АО «Арихин», Россия], свидетельствующих о выраженных изменениях в составе желудочной микробиоты и появлении заносной микробиоты [Поздеев O.K. Медицинская микробиология /Под ред. В.И. Покровского. М.: ГЭОТАР-МЕД, 2001;768], что сопровождается ухудшением общего состояния животных, неопрятностью внешнего вида, гиподинамией, тремором конечностей. Кроме того, в Инструкции по медицинскому применению ингибитора протонной помпы Омепразола [Инструкция по медицинскому применению лекарственного препарата Омепразол-Акрихин. Производитель АО «Арихин», Россия] прямо указывается на побочные расстройства в организме в процессе его применения, в том числе на развитие кандидоза желудочно-кишечного тракта.
Установлено (см. таблица 3) небольшое, но явное снижение под влиянием ингибитора протонной помпы Омепразола желудочных бенефициаров: бифидобактерий - в 1,6 раза, лактобацилл - в 1,4 раза и эшерихий в 2,4 раза и появление заносной микробиоты, достигающей значения (1,6±0,7)×104 КОЕ×мл-1. Полученные данные свидетельствуют о том, что в данном случае мы имеем дело с разбалансировкой микробиоты желудка. Однако в отличие от классического дисбиоза желудочной микробиоты, при котором отмечается абсолютное уменьшение численности нормобиоты, бактериологическим методом в настоящем эксперименте фиксируется относительное снижение ее численности при уверенном размножении заносной микробиоты. И если на фоне перорального введения животным антибиотика Гентамицина бактерии хеликобактера удерживались в их желудке в течение 10 суток, то при аналогичном способе введения ингибитора протонной помпы Омепразола только 5 суток. Это свидетельствует о довольно высокой скорости самовосстановления общего количества представителей желудочной микробиоты после прекращения перорального введения Омепразола, что соответствует полученным нами ранее результатам [Чичерин И.Ю., Погорельский И.П., Лундовских И.А., Шабалина М.Р., Колеватых Е.П. Изменения в кишечной микробиоте экспериментальных животных под воздейстаием ингибитора протонной помпы Омепразола. Инфекционные болезни. 2018; 16 (3): 60-68]. Акцентируя внимание на самовосстановлении желудочной нормобиоты после прекращения перорального введения животным ингибитора протонной помпы Омепразола и восстановления кислотно-протеолитического барьера желудка, можно с большой долей вероятности считать, что оба эти события стали действительным началом самовосстановления микробиоценоза желудка, чему в значительной мере содействовали сохранившаяся в достаточной степени колонизационная резистентность желудка и эффективная моторно-эвакуационная функция кишечника.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ эрадикации бактерий Helicobacter pylori при экспериментальном хеликобактериозе у конвенциональных белых мышей и средство для его осуществления | 2020 |
|
RU2746590C1 |
| Способ моделирования хеликобактериоза | 2018 |
|
RU2690943C1 |
| Антихеликобактерное средство и способ его применения | 2018 |
|
RU2713154C1 |
| СРЕДСТВО ДЛЯ ВОССТАНОВЛЕНИЯ КИШЕЧНОГО МИКРОБИОЦЕНОЗА ПРИ ДИСБИОЗАХ | 2015 |
|
RU2593584C1 |
| АНТИБАКТЕРИАЛЬНОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ КИШЕЧНОГО ИЕРСИНИОЗА ИЛИ ПСЕВДОТУБЕРКУЛЕЗА ИЛИ ЭШЕРИХИОЗА | 2013 |
|
RU2564014C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ИНГИБИТОРА ПРОТОННОЙ ПОМПЫ И ПРЕБИОТИКА ДЛЯ ЛЕЧЕНИЯ ЯЗВЕННЫХ ПОРАЖЕНИЙ ЖЕЛУДКА И 12-ПЕРСТНОЙ КИШКИ | 2009 |
|
RU2410100C2 |
| Способ монотерапии гастрита, ассоциированного с инфекцией Helicobacter pylori | 2020 |
|
RU2758246C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ГАСТРОЭЗОФАГЕАЛЬНОЙ РЕФЛЮКСНОЙ БОЛЕЗНИ | 2012 |
|
RU2501549C1 |
| Способ лечения синдрома избыточного бактериального роста в тонком кишечнике у больных сахарным диабетом 2 типа в сочетании с гастродуоденальным хеликобактериозом | 2017 |
|
RU2674447C1 |
| СПОСОБ ОЦЕНКИ ВЫЖИВАЕМОСТИ БИФИДО- И ЛАКТОБАКТЕРИЙ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ | 2012 |
|
RU2528867C2 |
Изобретение относится к медицине, а именно к экспериментальной медицине, медицинской микробиологии и инфектологии, и может быть использовано для исследования желудочной и кишечной микробиоты при подавлении колонизационной резистентности слизистой оболочки желудка экспериментальных животных. Проводят селективное воздействие на желудочную микробиоту антибактериального препарата гентамицина сульфата, содержащего 40 мг антибиотика в 1 мл и разведенного изотоническим раствором хлорида натрия до концентрации 24 мг в 1 мл, путем его перорального введения конвенциональным белым мышам однократно в сутки в течение 5 дней в дозе 2,4 мг на одну мышь. Пероральное введение гентамицина сопровождается одновременным в течение 8 суток ежедневным отбором фекалий для определения представителей желудочной и кишечной микробиоты, выводимых из организма белых мышей, путем высева фекалий на плотную питательную среду в чашках Петри, которые инкубируют в микроаэрофильных условиях при температуре 37°С в течение 24 ч. Затем обрабатывают полученные результаты высева фекалий, основываясь на количестве выросших колоний бактерий, и выносят суждение о численности и убыли нормобиоты желудочно-кишечного тракта. Способ обеспечивает возможность установления временных рамок развития инфекции у лабораторных животных, начиная от адгезии бактерий Helicobacter pylori, и колонизации слизистой оболочки желудка, вплоть до определения морфологически и гистологически различимых проявлений патологического процесса, и возможность изучения длительности пребывания Helicobacter pylori в тканях желудка на основании количественного определения бактерий, выделяемых из организма с кишечным содержимым, за счет создания в данном биотопе искусственной микроэкологической и микробиологической бионесовместимости по типу «патоген против хозяина» на фоне угнетения желудочной микробиоты и связанного с этим подавления локальной иммунной защиты слизистой оболочки желудка. 1 з.п. ф-лы, 3 табл.
1. Способ исследования желудочной и кишечной микробиоты при подавлении колонизационной резистентности слизистой оболочки желудка экспериментальных животных, включающий селективное воздействие на желудочную микробиоту антибактериального препарата гентамицина сульфата, содержащего 40 мг антибиотика в 1 мл и разведенного изотоническим раствором хлорида натрия до концентрации 24 мг в 1 мл, путем его перорального введения конвенциональным белым мышам однократно в сутки в течение 5 дней в дозе 2,4 мг на одну мышь, причем пероральное введение гентамицина сопровождается одновременным в течение 8 суток ежедневным отбором фекалий для определения представителей желудочной и кишечной микробиоты, выводимых из организма белых мышей, путем высева фекалий на плотную питательную среду в чашках Петри, которые инкубируют в микроаэрофильных условиях при температуре 37°С в течение 24 ч, затем обрабатывают полученные результаты высева фекалий, основываясь на количестве выросших колоний бактерий, и выносят суждение о численности и убыли нормобиоты желудочно-кишечного тракта.
2. Способ подавления колонизационной резистентности по п. 1, отличающийся тем, что начало выполнения дальнейшего цикла исследований на фоне искусственно созданной в желудке белых мышей микроэкологической и микробиологической среды проводят не ранее чем через 3 суток после прекращения перорального введения антибактериального препарата гентамицина, с учетом полученных результатов высева фекалий животных и подсчета выросших на питательной среде колоний бактерий, свидетельствующих об убыли нормобиоты желудочно-кишечного тракта.
| СПОСОБ МОДЕЛИРОВАНИЯ ДИСБАКТЕРИОЗА КИШЕЧНИКА У ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2011 |
|
RU2477894C1 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ КОЛОНИЗАЦИОННОЙ РЕЗИСТЕНТНОСТИ МИКРОБИОЦЕНОЗА БИОТОПА ОРГАНИЗМА ЧЕЛОВЕКА (ВАРИАНТЫ) | 2008 |
|
RU2381504C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЛОНИЗАЦИОННОЙ РЕЗИСТЕНТНОСТИ ЭКОЛОГИЧЕСКОЙ НИШИ ТЕЛА ЧЕЛОВЕКА | 2000 |
|
RU2175673C1 |
| АГЕЙЧЕНКО А.В | |||
| Состояние микробиоценоза толстого кишечника, липидного состава клеточных мембран и антиоксидантного статуса животных при экспериментальном дисбиозе | |||
| Диссер | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| ДОБРЫНЯ Ю.М | |||
| Экспериментальная оценка морфофункциональных показателей | |||
Авторы
Даты
2021-03-30—Публикация
2019-12-30—Подача