ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области медицинской химии и фармакологии, в частности к классу фторзамещенных соединений циклопропиламина, способу их получения, фармацевтической композиции и ее применения в качестве ингибитора лизин-специфической деметилазы 1 (ЛСД1), в частности, для получения лекарственного препарата для лечения таких заболеваний, как рак, лейкоз и подобных.
УРОВЕНЬ ТЕХНИКИ
Эпигенетика - это раздел генетики, который изучает индукцию наследственных изменений в экспрессии генов путем обратимой модификации нуклеотидов или хромосом без изменения последовательности ДНК изучаемого гена. Механизмы регулирования эпигенетики в основном включают метилирование ДНК, модификацию гистонов и некодирующее действие РНК. В большинстве случаев эпигенетическая информация сохраняется путем изменения химической модификации цитозина и гистонов, которые изменяют структуру хроматина. Нормальный эпигенетический процесс играет важную роль в жизнедеятельности, такой как эмбриональное развитие и дифференциация клеток. Исследования показали, что возникновение многих заболеваний связано с аномальной эпигенетической модификацией. В последние годы эпигенетика стала «горячей точкой» исследований в области биологии и медицины. Проводимые эпигенетические исследования имеют большое значение для профилактики и лечения многих заболеваний человека.
В 2004 году Ши и др. подтвердили структуру ЛСД1 (также известную, как ВНС110, p110b и NPAO), которая оказалась консервативной в клетках от дрожжей до человека. В клетках способность ЛСД1 к деметилированию очень специфична для генов, субстратов и внешней среды, и оказывает различное (или даже противоположное) влияние на экспрессию генов в разных местах. Исследования показали, что ЛСД1 играет важную роль в стимулировании дифференцирования клеток, но также обнаружено, что ЛСД1 аномально рекрутируется для ненадлежащего ингибирования отклоняющихся от нормы генов-мишеней, вызывающих лейкоз генов (например, MLL-AF9). В данном случае, ЛСД1 поддерживает активность воздействия на стволовые клетки лейкоза (СКЛ), вызванные первоначальным повреждением, а последующие клеточные эффекты ЛСД1 также значительно отличаются от нормального состояния клеток. На самых примитивных уровнях развития гемопоэтических стволовых клеток (ГСК) во время нормального кроветворения никаких изменений в экспрессии генов не наблюдалось, что согласуется с прямо противоположным наблюдением цитопении, вызванной недостатком ЛСД1. Следовательно, ЛСД1 можно использовать в качестве потенциальной мишени лекарственных препаратов для лечения лейкоза, если он может продуцировать контролируемую и обратимую токсичность для нормальных кроветворных клеток.
Разработка новых низкомолекулярных ингибиторов ЛСД1 имеет важное научное значение для лечения таких заболеваний, как злокачественные опухоли и лейкоз.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является получение фторзамещенного циклопропиламинового соединения формулы I, фармацевтически приемлемой соли, рацемата, R-изомера, S-изомера или их смеси.
Другой задачей настоящего изобретения является разработка способа получения фторзамещенного соединения циклопропиламина формулы I.
Еще одной задачей настоящего изобретения является разработка фармацевтической композиции, содержащей терапевтически эффективное количество одного или нескольких фторзамещенных соединений циклопропиламина формулы I, фармацевтически приемлемой соли, рацемата, R-изомера, S-изомера или их смесей.
Еще одной задачей настоящего изобретения является разработка ингибитора лизин-специфической деметилазы 1 (ЛСД1) фармацевтической композиции, состоящей из одного или нескольких фторзамещенных соединений циклопропиламина формулы I, фармацевтически приемлемой соли, рацемата, R-изомера, S-изомера или их смесей.
Еще одной задачей настоящего изобретения является обеспечение применения фторзамещенного циклопропиламинового соединения формулы I, фармацевтически приемлемой соли, рацемата, R-изомера, S-изомера или их смеси при приготовлении лекарственного средства для лечения злокачественных опухолевых заболеваний, связанных с ингибитором лизин-специфической деметилазы 1 (ЛСД1), таких как рак, лейкоз или тому подобные.
Еще одной задачей настоящего изобретения является разработка способа лечения заболеваний, связанных с ингибитором лизин-специфической деметилазы 1 (ЛСД1), таких как рак, лейкоз и других, что включает в себя введение нуждающемуся в таком лечении пациенту, одного или нескольких соединений фторзамещенного циклопропиламина упомянутой общей формулы I, фармацевтически приемлемых солей, изомеров или их смесей.
Исходя из упомянутых задач, настоящее изобретение обеспечило разработку соединения фторзамещенного циклопропиламина со структурой, представленной нижеприведенной общей формулой I, а также рацемата, R-изомера, S-изомера, фармацевтически приемлемой соли или их смесей:

в которой
А выбран из группы, состоящей из замещенного или незамещенного бензольного кольца, или замещенного или незамещенного С5-С12 ароматического гетероциклического кольца, содержащего от 1 до 4 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, при этом каждое замещенное бензольное кольцо или замещенные ароматические гетероциклы содержат от 1 до 3 заместителей;
причем заместитель в замещенном бензольном кольце или замещенном ароматическом гетероциклическом кольце представляет собой водород, изотоп водорода, галоген, линейный или разветвленный С1-С12-алкил, который является незамещенным или в качестве заместителей содержит 1-3 галоген, линейный или разветвленный С1-С12-алкокси группу, который является незамещенным или в качестве заместителей содержит 1-3 галоген или фенильные группы, линейную или разветвленную ненасыщенную углеводородную группу С2-С12, которая является незамещенной или в качестве заместителей содержит 1 или 3 галогена, С3-С6-циклоалкильную группу, которая является незамещенной или в качестве заместителей содержит 1 или 3 галогена, линейный или разветвленный С1-С6-алкил, замещенный С1-С6-алкоксигруппой, линейный или разветвленный С1-С6-алкил, замещенный С3-С6-циклоалкилом, гидрокси-, циано-, нитро-группами, линейным или разветвленным С1-С6-гидроксиалом или тиолом;
В соответствии с другим вариантом осуществления изобретения, любые два заместителя в замещенном бензольном кольце или замещенном ароматическом гетероциклическом кольце могут связываться с их соседним углеродом или гетероатомом с образованием 5-7-членного гетероциклического кольца, содержащего от 1 до 3 гетероатомов, выбранных из N, О и S, а 5-7-членное гетероциклическое кольцо может содержать заместитель, выбранный из группы, состоящей из водорода, изотопа водорода, галогена, линейного или разветвленного С1-С6-алкила, незамещенного или замещенного 1-3 галогенами, линейной или разветвленной С1-С6-алкокси группы, незамещенного или в качестве заместителей содержащего от 1 до 3 галогенов, и гидроксила;
Каждый R1 независимо выбирается из: замещенного или незамещенного арила, замещенного или незамещенного гетероарила, водорода, замещенного или незамещенного C1-С6-алкила, -SO2Ra, -NC(O)Ra, -CH2C(O)ORa, -C(O)ORa, -C(O)Ra, -C(O)NRaRb, -NRcRd, замещенной или незамещенной аминогруппы, мочевины, амида сульфонамида, замещенного или незамещенного арилалкила и замещенного или незамещенного гетероарилалкила;
Каждый Ra независимо является водородом, фенилом, фенилметилом, 3,5-диметилизооксазол-4-ил, 1,2-диметил-1Н-имидазол-4-илом, С3-С7-циклоалкильной группой, С1-С6-алкильной группой, С1-С4-алкоксильной группой, С1-С3 алкиламино-группой или -NHPh;
Rb является водородом или С1-С3-алкилом, или при присоединении к одному и тому-же атому,
Ra и Rb вместе образуют 5- или 6-членное гетероциклоалкильное кольцо;
Rc и Rd независимо выбираются из водорода, линейного или разветвленного С1-С3-алкила, С3-С5-циклоалкила, С1-С3-алкокси-группы, 4-6-членной гетероциклической группы, С1-С3-алкилацила, С5-С7-арилацила, бензила, С5-С7-арила; линейный или разветвленный С1-С3-алкил может содержать один или более заместитель из группы, состоящей из метилсульфонила, С1-С3-алкокси-группы, С1-С3-алкокси-карбонильной группы; гетероциклическая группа, содержащая один гетероатом выбирается из группы, состоящей из кислорода, серы и азота;
R2 является водородом или СООН;
R3 является С1-С4-алкилом, ацилом, -C(O)CF3 или водородом;
W является -(СН2)1-4 или -CH(Re)(CH2)0-3, причем Re это CN или С1-С4-алкилом;
Y это N или С;
X это N или С;
Z это О или (CH2)q, причем q=0-2, и когда q=0, Z представляет собой связь;
n=0-3;
при условии, что Z является О, Y является N, а X является С;
Также, когда X является С, по меньшей мере, одна R1 группа, присоединенная к X не является водородом.
В другом предпочтительном варианте осуществления изобретения, когда X является N, к X присоединен только один R1.
В другом предпочтительном варианте осуществления изобретения, W является -CH2-.
В другом предпочтительном варианте осуществления изобретения, Z является (CH2)q, причем q=1.
В другом предпочтительном варианте осуществления изобретения, X является С, и, по меньшей мере одним R1, присоединенным к X, является NRcRd, a Rc и Rd независимо выбираются из водорода, линейного или разветвленного C1-С3-алкила, С3-С5-циклоалкила, С1-С3-алкокси группы, 4-6-членной гетероциклической группы, C1-С3-алкилацила, С5-С7-арилацила, бензила, С5-С7-арила; линейный или разветвленный С1-С3 алкил может содержать один или более заместитель из группы, состоящей из метилсульфонила, С1-С3-алкокси группы, С1-С3-алкоксикарбонила; гетероциклическая группа, содержащая один гетероатом выбирается из группы, состоящей из кислорода, серы и азота;
В другом предпочтительном варианте осуществления изобретения, X является N, и по меньшей мере один R1, присоединенный к X, выбирается из замещенного или незамещенного арила, гетероалкила, аралкила, и гетероарилалкила.
В другом предпочтительном варианте осуществления изобретения, X является N, и, по меньшей мере, один R1, присоединенный к (X), выбирается из замещенного или незамещенного арила-С1-С4-алкила или гетероарил-С1-С4-алкила.
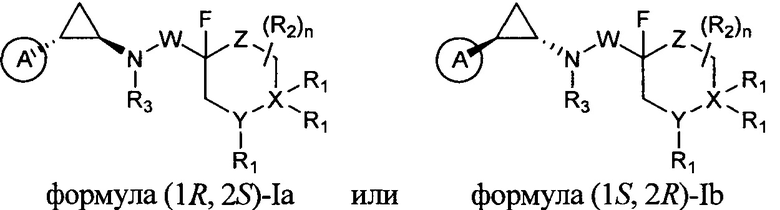
В другом предпочтительном варианте структура соединения показана формулой (1R, 2S)-Ia или формулой (1S, 2R)-Ib:
В настоящем изобретении галогеном является F, Cl, Br или I.
Используемые в настоящем изобретении термины имеют общее значение, известное специалистам в данной области техники, если не указано иное.
В настоящем изобретении термин «С1-С6 алкил» означает линейный или разветвленный алкил с 1-6 атомами углерода, неограничивающие примеры которого содержат метил-, этил-, пропил-, изопропил-, бутил-, изобутил-, втор-бутил-, трет-бутил-, пентил- и гексил- или тому подобные группы; предпочтительно этил-, пропил-, изопропил-, бутил-, изобутил-, втор-бутил- и трет-бутил.
В настоящем изобретении термин «С1-С6-алкокси» означает алкокси-группу с прямой или разветвленной цепью, содержащей от 1 до 6 атомов углерода, неограничивающие примеры которой содержат метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, бутокси- или аналогичные группы.
В настоящем изобретении термин «С2-С6-алкенил» означает линейный или разветвленный алкенил с одной двойной связью и 2-6 атомами углерода, неограничивающие примеры которого содержат винил-, пропенил-, бутенил-, изобутенил-, пентенил- и гексенильные группы.
В настоящем изобретении термин «С2-С6-алкинил» означает линейный или разветвленный алкинил с одной тройной связью и 2-6 атомами углерода, включая без ограничений, этинил, пропинил, бутинил, изобутинил-, пентинил- и гексинил.
В настоящем изобретении термин «С3-С10 циклоалкил» означает циклический алкил с 3-10 атомами углерода в кольце, неограничивающие примеры которого содержат циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и циклодецил. Термины «С3-С8 циклоалкил», «С3-С7 циклоалкил» и «С3-С6 циклоалкил» имеют аналогичное значение.
В настоящем изобретении термин «С3-С10 -циклоалкенил» означает циклический алкенил с 3-10 атомами углерода в кольце, неограничивающие примеры которого содержат циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил и циклодеценил. Термин «С3-С7-циклоалкенил» имеет аналогичное значение.
В настоящем изобретении термин «ароматическое кольцо» или «арил» имеют одно и то же значение, и, предпочтительно, «арил» является «С6-С12-арилом»или «С6-С10-арилом». Термин «С6-С12-арил» относится к арилу с 6-12 атомами углерода, который не содержит гетероатомов в кольце, например, фенил-, нафтил- или подобный. Термин «С6-С10-арил» имеет аналогичное значение.
В настоящем изобретении термин «ароматическое гетероциклическое кольцо» или «гетероарил» имеют одно и то же значение, и относится к гетероароматической группе, содержащей один или больше гетероатомов. Гетероатомами здесь являются кислород, сера и азот. Например, фурил, триэнил, пиридил, пиразолил, пирролил, N-алкилпирролил, пиримидинил, пиразинил, имидазолил, тетразолил и подобные. Гетероарильное кольцо может быть соединено с арилом, гетероциклической группой или циклоалкильным кольцом, в котором кольцо, к которому присоединена исходная структура, является гетероарильным кольцом. Гетероарильное кольцо может быть замещенным или незамещенным.
В настоящем изобретении термин «3-12-членный гетероциклил» обозначает насыщенную или ненасыщенную 3-12-членную кольцевую группу с 1-3 гетероатомами в кольце, выбранными из кислорода, серы и азота, например, оксепанил. Термин «3-7-членный гетероциклил» имеет аналогичное значение.
В настоящем изобретении термин «замещенный» означает, что один или несколько атомов водорода в определенной группе заменены определенным заместителем. Определенный заместитель соответственно представляет собой заместитель, который описан выше, или это заместитель, который описан в определенном варианте осуществления изобретения. Если не указано иное, замещенная группа может содержать заместитель, выбранный из определенной группы в любой замещаемой позиции группы, в которой заместители могут быть одинаковыми или разными в каждой позиции. Циклический заместитель, такой как гетероциклоалкил, может быть присоединен к другому кольцу, такому как циклоалкил, с образованием спиробициклической кольцевой системы, например, двух колец, имеющих общий атом углерода. Специалистам в данной области техники будет понятно, что комбинации заместителей, рассматриваемые в настоящем изобретении, пригодны для использования, при условии, что они являются стабильными и химически достижимыми. Заместителями являются, но без ограничения, C1-8-алкил, С2-8-алкенил, С2-8-алкинил, С3-8-циклоалкил, 3-12-членная гетероциклическая группа, арил, гетероарил, галоген, гидрокси, карбокси (-СООН), C1-8-альдегидная группа, С2-10-ацил, С2-10-сложноэфирная группа, амино, алкокси, C1-10-сульфонил, и т.д.
В более предпочтительном варианте осуществления настоящего изобретения соединения с общей формулой (I) представляют собой следующие конкретные соединения:



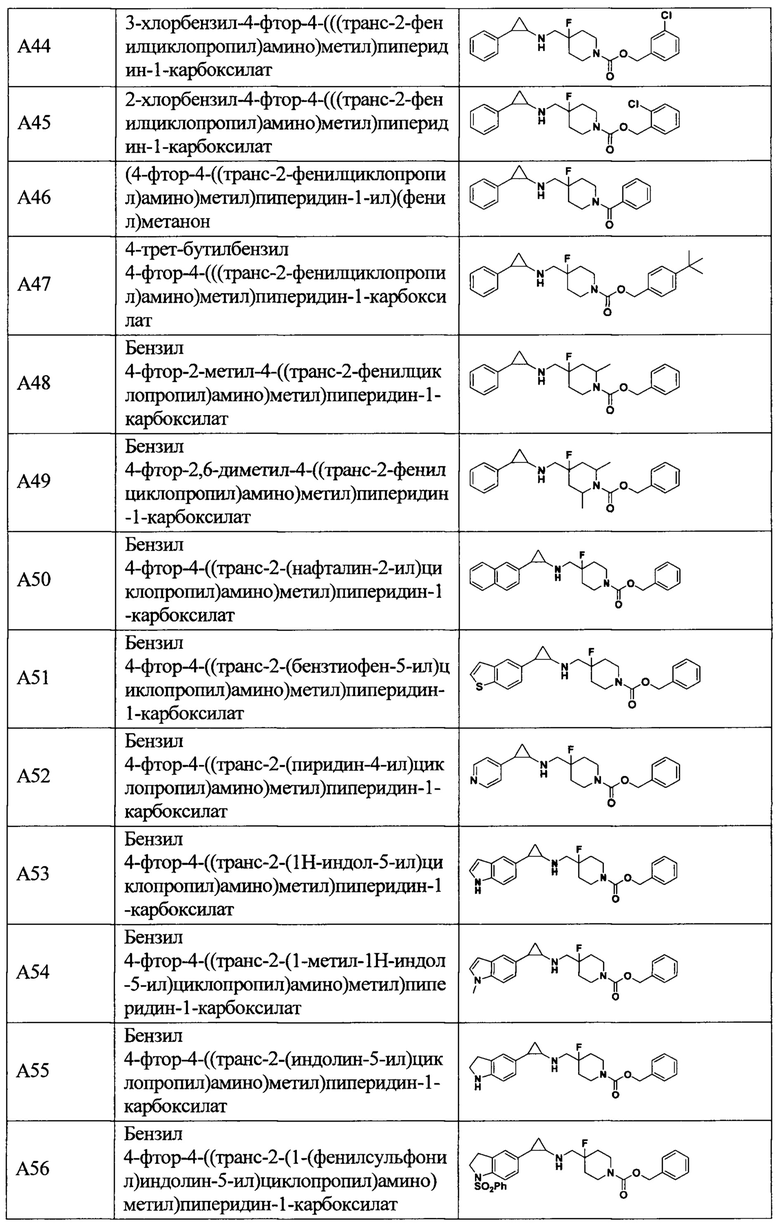
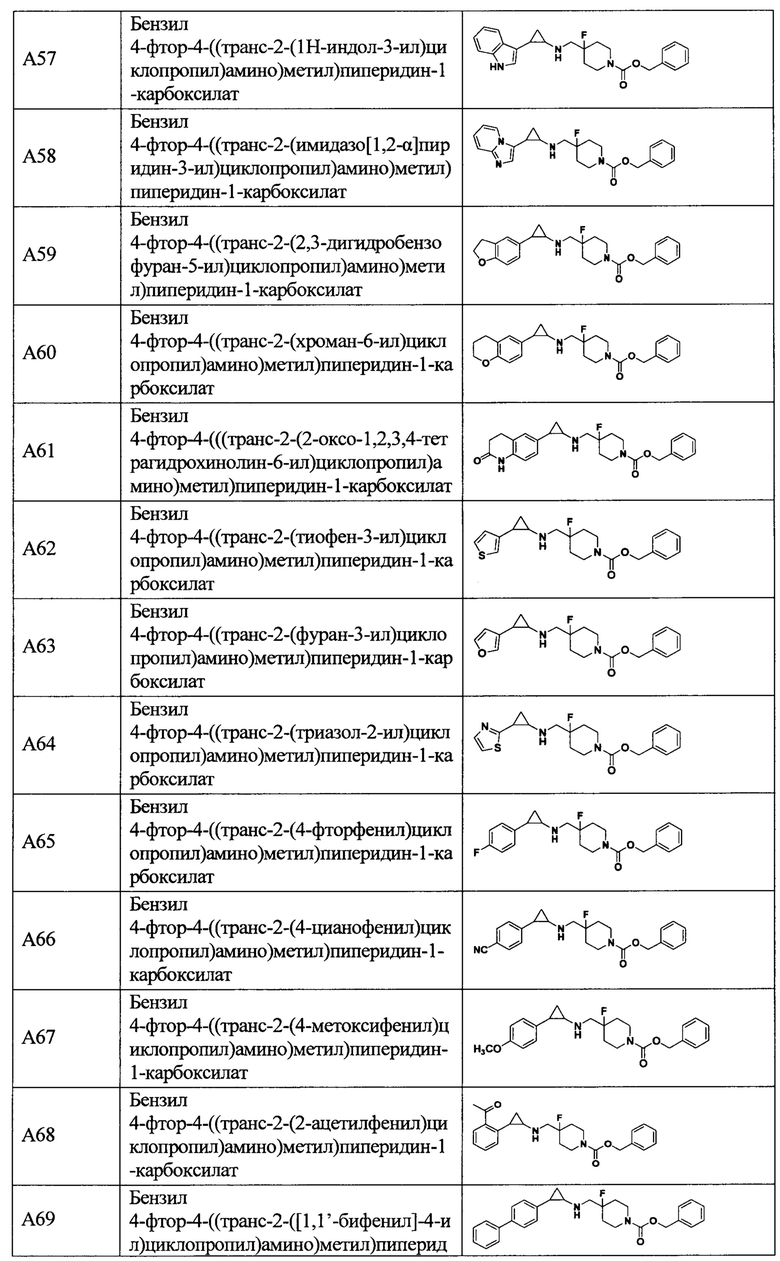

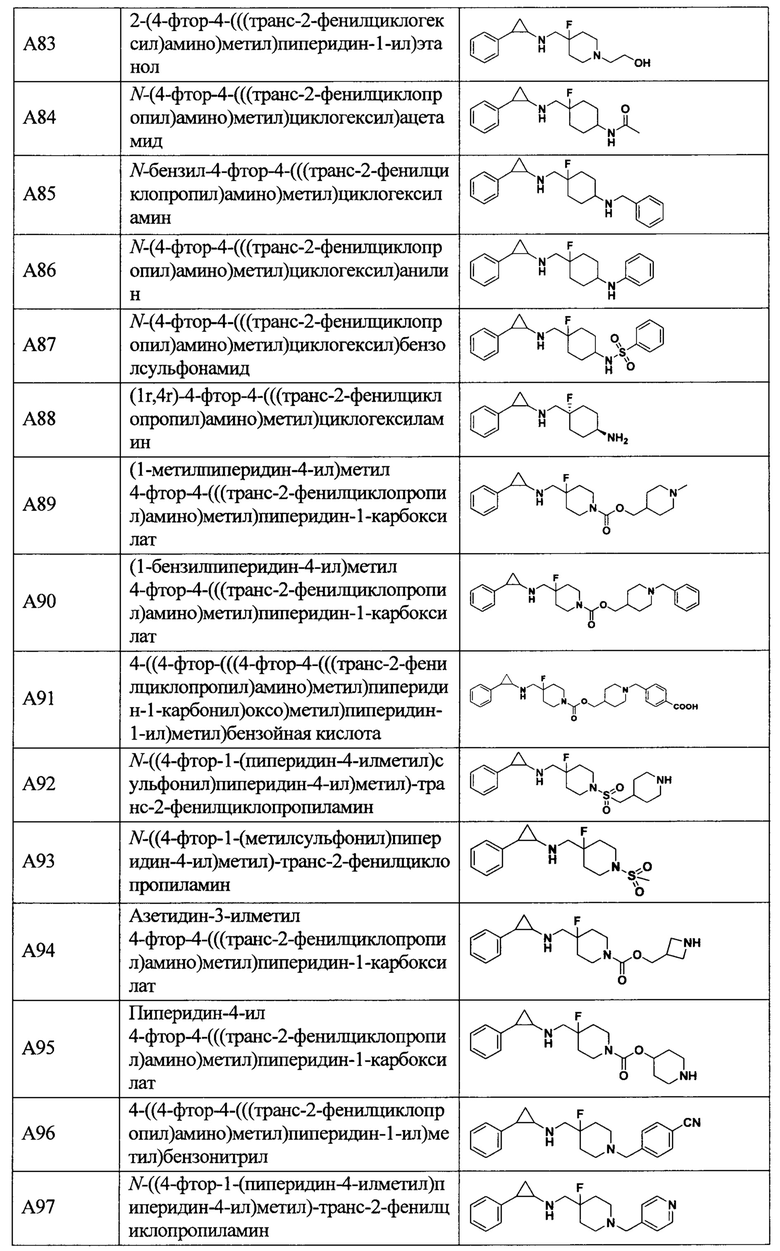


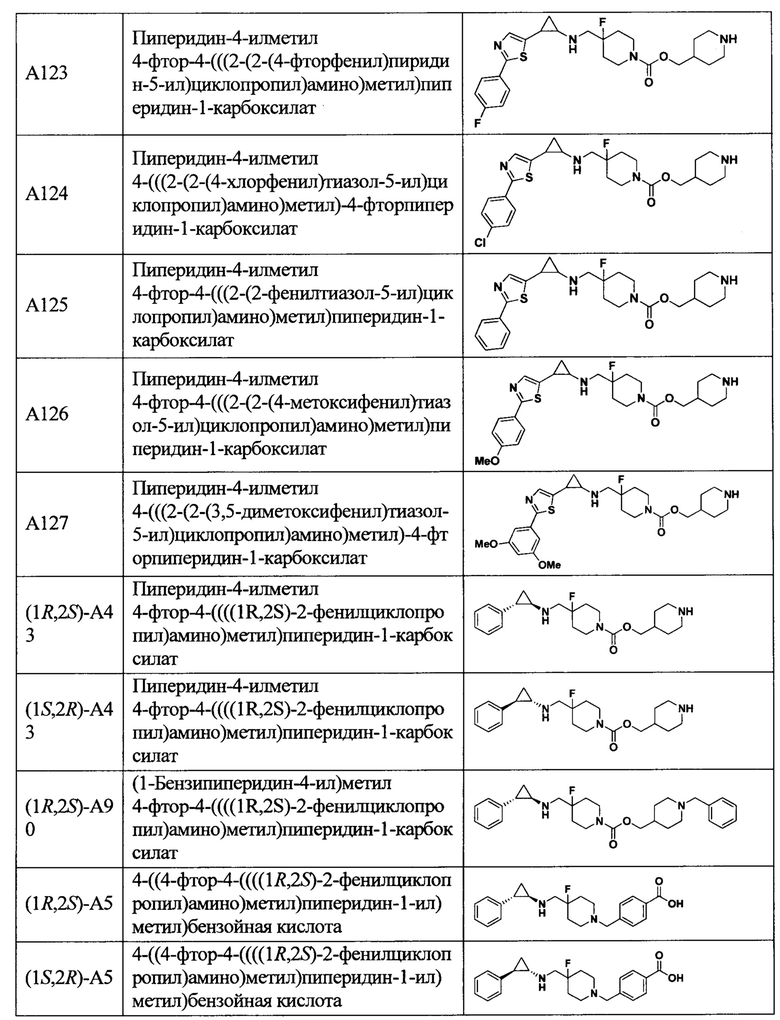
Соединения в данном изобретении имеют ассиметричные центры, хиральные оси и хиральные плоскости, и могут существовать в форме рацематов, R-изомеров или S-изомеров. Специалисты в данной области техники смогут отделить R-изомер и(или) S-изомер от рацемата с помощью традиционных способов.
В настоящем изобретении происходит получение фармацевтически приемлемой соли или соединения формулы I, в частности, обычной фармацевтически приемлемой соли, образованной из соединения формулы I при его взаимодействии с неорганической или органической кислотой. Например, обычные фармацевтически приемлемые соли могут быть получены при взаимодействии соединения формулы I с неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, аминосульфоновая кислота и фосфорная кислота и т.д., или с органическими кислотами, в которые входят лимонная кислота, винная кислота, молочная кислота, пировиноградная кислота, уксусная кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, нафталинсульфоновая кислота, этансульфоновая кислота, нафталиндисульфоновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, фумаровая кислота, янтарная кислота, пропионовая кислота, щавелевая кислота, трифторуксусная кислота, стеариновая кислота, памовая кислота, гидроксималеиновая кислота, фенилуксусная кислота, бензойная кислота, салициловая кислота, глутаминовая кислота, аскорбиновая кислота, п-анилинсульфоновая кислота, 2-ацетоксибензойная кислота и изэтионовая кислота; или это натриевые, калиевые, кальциевые, алюминиевые или аммониевые соли соединения формулы I, полученные при его взаимодействии с неорганическим основанием; или соль, образованная при взаимодействии соединения формулы I с органическим основанием, такая как метанаминовая соль, этиламиновая соль или этаноламиновая соль.
В другом варианте данного изобретения приводится процесс получения соединения формулы I, который выполняется по приведенным ниже схемам 1, 2 или 3:
Соединение формулы (I) можно получить по приведенной ниже схеме 1.
Структурная формула и метки группы R, применяемые в нижеследующих схемах, используются только в данном разделе. Соединения формулы (II) и (III) являются коммерчески доступными или их можно синтезировать с использованием принятых в данной области техники способов. Специалисты в данной области техники должны понимать, что при использовании HCl на последней стадии синтеза приведенные ниже в качестве примера соединения могут присутствовать в форме хлористоводородной соли.
Соединения формулы (II) и (III) могут взаимодействовать в условиях восстановительного аминирования с получением соединения формулы (I). Реакция присоединения обычно проводится в присутствии полярного растворителя, такого как метанол, и кислоты, как например, уксусная кислота. Кислота обычно присутствует в количестве 100 мол. % относительно соединения формулы (I). В качестве восстанавливающего вещества обычно используются борогидриды (например, цианоборогидрид натрия).
Схема 1

Причем A, W, X, Y, Z, R1, R2, и R3 - это описанные выше вещества, соответственно, R4 выбирается из группы, состоящей из Н и метила, а V это -СН2-W- или -W-СН2-.
Соединение формулы (I) можно получить реакцией, приведенной на схеме 2, из синтетического циклопропиламина (IV) и защищенного соответствующим образом альдегида (V). Амин (IV) и альдегид (V) подвергаются восстановительному аминированию с образованием промежуточного продукта формулы (VI). Затем происходит сохранение аминной группы. Затем защитная группа из X или Y групп удаляется с получением соединения формулы (VII) для того, чтобы функционализировать соответствующий заместитель R1 для получения соединения формулы (VIII). После этого с амина можно снять защиту и функционализировать группой R3.
Схема 2
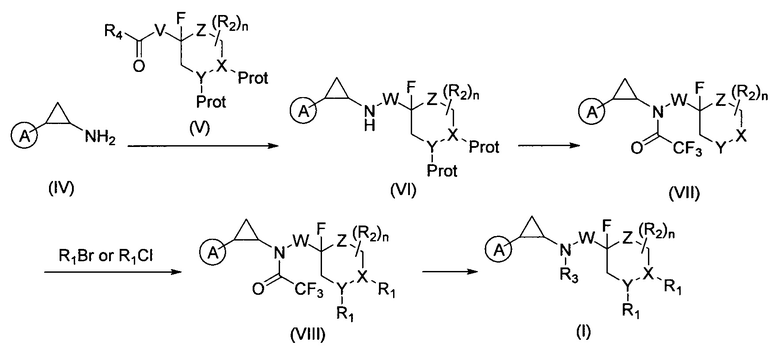
Причем A, W, X, Y, Z, R1, R2, и R3 - это описанные выше вещества, соответственно, R4 выбирается из группы, состоящей из Н и метила, а V это -CH2-W- или -W-CH2-.
Соединения формулы (II) и (IV) можно синтезировать, как это показано на схеме 3, из коричной кислоты (IX) и конденсировать с диметилгидроксиламином в присутствии конденсирующего агента (например, HATU - гексафторфосфат азабензотриазол тетраметил урониум - ГАТУ) и основания (например, DIPEA - диизопропилэтиламин - ДИПЭА) с получением амида (X). Затем выполняется процесс циклопропилирования в стандартных условиях (например, в присутствии иодида триметилсульфоксида и гидрида натрия) с получением соединения формулы (XI). Затем выполняется гидролиз амида с образованием кислоты с формулой (XII). Затем она вступает в реакцию в стандартных условиях перегруппировки Курциуса с получением соединения с формулой (IV). Соединение с формулой (IV) можно перевести в соединение с формулой (II) в стандартных условиях.
Схема 3

Соединения формулы (1R, 2S)-I и (1S, 2R)-I могут быть получены при помощи способов, описанных соответственно на схеме 4 и схеме 5, а конкретные стадии процесса аналогичны, указанным на схеме 2.
Схема 4

Схема 5

В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения, выбранного из соединений с упомянутой общей формулой (I), фармацевтически приемлемых солей, энантиомеров, диастереомеров или рацематов и, в качестве варианта, одно или несколько фармацевтически приемлемых носителей, наполнителей, адъювантов, вспомогательных веществ и(или) разбавителей. Вспомогательными веществами являются, например, ароматизаторы, вкусовые добавки, заменители сахара и др.
Фармацевтическая композиция, представленная в настоящем изобретении, в предпочтительном варианте осуществления изобретения содержит активный ингредиент в массовом отношении от 1 до 99%. Его предпочтительная пропорция исходит из того, что соединение с общей формулой I в качестве активного ингредиента составляет от 65 до 99 массовых % от общей массы, а остальную массу составляют фармацевтически приемлемые носители, разбавители, растворы или солевые растворы.
Соединения и фармацевтические композиции, приведенные в настоящем изобретении, могут быть представлены в различных лекарственных формах, таких как таблетки, капсулы, порошки, сиропы, растворы, суспензии, аэрозоли и т.д., а также могут присутствовать в подходящих твердых или жидких носителях или разбавителях, а также в дезинфекторах, подходящих для инъекций или вливаний.
Различные лекарственные формы фармацевтической композиции настоящего изобретения могут быть получены с применением обычных способов, принятых в фармацевтической промышленности. Единичная дозировка составляет 0,05-200 мг соединения формулы I; в предпочтительном варианте стандартная доза препарата содержит 0,1 мг - 100 мг соединения формулы I.
Соединения и фармацевтические композиции настоящего изобретения могут быть использованы в клинических исследованиях на млекопитающих, включая людей и животных, а также могут вводиться через рот, нос, кожу, легкие или желудочно-кишечный тракт, чаще всего перорально. Наиболее предпочтительная суточная доза составляет 0,01-200 мг/кг массы тела, при одноразовом приеме, или 0,01-100 мг/кг массы тела при приеме в виде разделенных доз. Независимо от способа введения, оптимальная индивидуальная доза должна основываться на особенностях лечения. Обычно начинают с небольшой дозы и постепенно ее увеличивают, пока не будет найдена наиболее подходящая доза.
В следующем аспекте настоящего исследования, предложен ингибитор лизин-специфической деметилазы 1 (ЛСД1), который содержит одно или несколько компонентов, выбранных из группы, состоящей из соединения формулы I, фармацевтически приемлемых солей, рацематов, R-изомеров, S-изомеров и их смесей, и может содержать один или несколько фармацевтически приемлемых носителей, наполнителей, адъювантов, вспомогательных веществ и(или) разбавителей.
Соединения и композиции данного изобретения подходят для лечения и предупреждения злокачественных опухолевых заболеваний, связанных с ингибиторами лизин-специфической деметилазы 1 (ЛСД1), включая, но не ограничиваясь такими заболеваниями, как рак, лейкоз, и др.
Следовательно, еще одной задачей настоящего изобретения является обеспечение использования соединения с формулой I, фармацевтически приемлемой соли, рацемата, R-изомера, S-изомера или их смеси при приготовлении лекарственного препарата для лечения злокачественных опухолевых заболеваний, связанных с ингибитором лизин-специфической деметилазы 1 (ЛСД1), таких как рак, лейкоз или тому подобные.
Еще одной задачей настоящего изобретения является разработка способа лечения заболеваний, связанных с ингибитором лизин-специфической деметилазы 1 (ЛСД1), таких как рак, лейкоз и др., что включает в себя введение нуждающемуся в таком лечении пациенту, одного или нескольких соединений с упомянутой формулой I, фармацевтически приемлемых солей, рацемата, R-изомера, S-изомера или их смесей.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
АКТИВНЫЕ ИНГРЕДИЕНТЫ
Настоящее изобретение обеспечило разработку соединения фторзамещенного циклопропиламина со структурой, представленной нижеприведенной общей формулой I, а также рацемата, R-изомера, S-изомера, фармацевтически приемлемой соли или их смесей:

в которой
А выбран из группы, состоящей из замещенного или незамещенного кольца (предпочтительно бензольного кольца) или замещенного или незамещенного 5-12-членного ароматического гетероциклического кольца, содержащего от 1 до 4 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, причем каждое замещенное бензольное кольцо или замещенные ароматические гетероциклы содержат от 1 до 3 заместителей;
Причем заместитель в замещенном ароматическом кольце или замещенном ароматическом гетероциклическом кольце независимо выбран из водорода, изотопа водорода, галогена, незамещенной или замещенной С1-С12 линейной или разветвленной алкильной группы, незамещенного или замещенного С1-С12 линейного или разветвленного алкокси, незамещенной или замещенной С2-С12 линейной или разветвленной ненасыщенной углеводородной группы, незамещенного С3-С6 циклоалкила, С1-С6 линейного или разветвленного ал кил а, замещенного С1-С6-алкокси, С1-С6 линейного или разветвленного алкила, замещенного С3-С6 циклоалкилом, гидрокси, циано, нитро, С1-С6 линейного или разветвленного гидроксиалкила или тиола, кислорода (=O), незамещенного или замещенного С6-С12 арила (как например, фенил, нафтил), незамещенного или замещенного С6-С12 арилокси (как например, фенил, нафтил), незамещенного или замещенного фенилокси, карбокси, ацил (как например, ацетил) и сульфонил (включая фенилсульфонил, алкилсульфонил); заместитель предпочтительно выбран из группы, состоящей из галогена, С1-С4 -алкила с линейной или разветвленной цепью, галогензамещенного С1-С4 алкила с линейной или разветвленной цепью, С1-С4 алкилокси, цианозамещенного фенила;
В соответствии с другим вариантом осуществления изобретения, любые два заместителя в замещенном бензольном кольце или замещенном ароматическом гетероциклическом кольце могут связываться с их соседним углеродом или гетероатомом с образованием 5-7-членного гетероциклического кольца, содержащего от 1 до 3 гетероатомов, выбранных из N, О и S, а 5-7-членное гетероциклическое кольцо может содержать заместитель, выбранный из группы, состоящей из водорода, изотопа водорода, галогена, линейного или разветвленного С1-С6-алкила, незамещенного или замещенного 1-3 галогенами, линейного или разветвленного С1-С6-алкокси, незамещенного или в качестве заместителей содержащего от 1 до 3 галогенов, и гидроксила;
Каждый R1 независимо выбран из группы, состоящей из замещенного или незамещенного арила, замещенного или незамещенного гетероарила, водорода, замещенной или незамещенной С1-С6 алкильной группы, -SO2Ra, -NC(O)Ra, -(CH2)mC(O)ORa, -С(O)O(CH2)mRa, -C(O)ORa, -C(O)Ra, -(CH2)mORa, -C(O)NRaRb, -C(S)NRaRb, -CORa, -NRcRd, замещенного или незамещенного амино, замещенной или незамещенной мочевины, замещенного или незамещенного амида, замещенного или незамещенного сульфонамида, замещенного или незамещенного арилалкила и замещенного или незамещенного гетероарилалкила, причем m представляет собой целое число от 1 до 3; предпочтительно, заместитель выбирается из группы, состоящей из галогена, гидрокси, карбокси, циано, амино, С1-С4 алкила, галогензамещенного С1-С4 алкила, С1-С4 алкильной сложноэфирной группы, С1-С4 алкилсульфонила, аминофениламидной группы ( ), арил алкила и арила;
), арил алкила и арила;
Каждый Ra представляет собой водород, замещенный или незамещенный фенил, замещенный или незамещенный фенилметил, 3,5-диметилизоксазол-4-ил, 1,2-диметил-1Н-имидазол-4-ил, замещенный или незамещенный С3-С7 циклоалкил, замещенную или незамещенную С3-С7 гетероциклическую группу, замещенный или незамещенный С3-С7 гетероциклоалкил, замещенный или незамещенный С1-С6 алкил, замещенный или незамещенный С1-С6 алкенил, замещенный или незамещенный С1-С4 алкокси, замещенный или незамещенный С1-С3 алкил амино, -NHPh, замещенный или незамещенный 5-10-членный гетероарил, замещенную или незамещенную арилалкильную группу или замещенную или незамещенную гетероарилалкильную группу; предпочтительно группа заместителей выбрана из группы, состоящей из: С1-С4 алкила, галогензамещенного С1-С4 алкила, фенил-замещенного С1-С4 алкила, С1-С4 алкильной сложноэфирной группы, С3-С7 циклической группы, С3-С7 циклической группы, С3-С7 гетероциклической группы, бензилзамещенного С3-С7 гетероциклоалкила, арила, галогена, С1-С4 алкокси, С1-С4 галогеноалкила, карбоксила и карбоксилзамещенного бензила;
Rb является водородом или С1-С3-алкилом, или при присоединении к одному и тому-же атому,
Ra и Rb вместе образуют 5- или 6-членное гетероциклоалкильное кольцо;
Rc и Rd каждый по-отдельности выбран из водорода, замещенного или незамещенного С1-С3 алкила с линейной или разветвленной цепью, замещенного или незамещенного С3-С5-циклоалкила, замещенного или незамещенного С1-С3-алкокси, замещенной или незамещенной 4-6-членной гетероциклической группы, замещенного или незамещенного С1-С3 алкилацила, замещенного или незамещенного арилацила, замещенного или незамещенного арилсульфонила, замещенного или незамещенного бензила, замещенного или незамещенного арила; С1-С3 линейный или разветвленный алкил с одним или несколькими заместителями, выбранными из группы, состоящей из метилсульфонила, С1-С3 алкокси, С1-С3 алкоксикарбонильной группы, арила; гетероциклической группы, содержащей один гетероатом, выбранный из группы, состоящей из кислорода, серы и азота;
R2 является водородом или СООН;
R3 является С1-С4-алкилом, ацилом, -C(O)CF3 или водородом;
W является -(СН2)1-4 или -CH(Re)(CH2)0-3, причем Re это CN или С1-С4-алкилом;
Y это N, С или ни одного;
X это N или С;
Z это О или (CH2)q, причем q=0-2, и когда q=0, Z представляет собой связь;
n=0-3;
при условии, что Z это О, Y это N, а X это С.
В предпочтительном варианте осуществления настоящего изобретения А представляет собой замещенное или незамещенное бензольное кольцо или замещенное или незамещенное 5-12-членное ароматическое гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, причем каждое замещенное бензольное кольцо или замещенные ароматические гетероциклы содержат от 1 до 3 заместителей;
Причем заместитель в замещенном ароматическом кольце или в замещенном ароматическом гетероциклическом кольце независимо выбран из группы, состоящей из водорода, изотопа водорода, галогена, карбоксила, нитро, С1-С4-алкила, С1-С4-алканоила, С1-С4-алкокси, циано, кислорода (=O), сульфонила.
В предпочтительном варианте осуществления настоящего изобретения каждый R1 независимо выбирается из: замещенного или незамещенного арила, замещенного или незамещенного гетероарила, водорода, замещенного или незамещенного С1-С4 алкила, -SO2Ra, -NC(O)Ra, -(CH2)mC(O)ORa, -C(O)ORa, -C(O)Ra, -(CH2)mORa, -C(O)NRaRb, -NRcRd, замещенного или незамещенного арил алкила и замещенного или незамещенного гетероарилалкила, причем m целое число 1-3;
Каждый Ra независимо представляет собой водород, замещенный или незамещенный фенил, замещенный или незамещенный фенилметил, замещенный или незамещенный С3-С7 циклоалкил, замещенный или незамещенный С1-С4 алкил, замещенный или незамещенный С1-С4 алкенил, замещенный или незамещенный С1-С4 алкокси, замещенный или незамещенный С1-С3 алкиламино, -NHPh или замещенный или незамещенный 5-10-членный гетероарил;
Rb это водород или С1-С3 алкил;
Rc и Rd каждый независимо выбран из водорода, неразветвленного или разветвленного С1-С3 алкила, замещенного или незамещенного С3-С5-циклоалкила, замещенного или незамещенного С1-С3-алкокси, замещенной или незамещенной 4-6-членной гетероциклической группы, замещенного или незамещенного С1-С3 алкилацила, замещенного или незамещенного арилацила, замещенного или незамещенного арилсульфонила, замещенного или незамещенного бензила, замещенного или незамещенного арила; гетероциклической группы, содержащей один гетероатом, выбранный из группы, состоящей из кислорода, серы и азота;
Заместители выбраны из группы, состоящей из С1-С8 алкила, С2-С8 алкенила, С2-С8 алкинила, С3-С8 циклоалкила, 3-12-членной гетероциклической группы, арила, гетероарила, галогена, гидрокси, карбокси (-СООН), С1-С8 альдегида, С2-С10 ацила, С2-С10 сложноэфирной группы, амино и алкокси.
В другом предпочтительном ванианте настоящего изобретения X это N, a R1 присоединенный к X выбран из: замещенного или незамещенного: арила, гетероарила, аралкила и гетероарилалкила, причем заместитель выбран из группы, состоящей из С1-С8 алкила, С2-С8 алкенила, С2-С8 алкинила, С3-С8 циклоалкила, 3-12-членной гетероциклической группы, арила, гетероарила, галогенагидрокси, карбокси (-СООН), С1-С8 альдегидной группы, С2-С10 ацила, С2-С10 эфирной группы, амино и алкокси.
В другом предпочтительном варианте осуществления изобретения, X это N, a R1 присоединенный к X выбран из замещенного или незамещенного: арил-С1-С4 алкила, и гетероарил-С1-С4 алкила, причем заместитель выбран из группы, состоящей из С1-С8 алкила, С2-С8 алкенила, С2-С8 алкинила, С3-С8 циклоалкила, 3-12-членной гетероциклической группы, арила, гетероарила, галогена, гидрокси, карбокси (-СООН), С1-С8 альдегида, С2-С10 ацила, С2-С10 эфирной группы, амино и алкокси.
В предпочтительном варианте изобретения W это -(CH2)1-2.
В предпочтительном варианте изобретения структура соединения показана формулой (1R, 2S)-Ia или формулой (1S, 2R)-Ib:

СПОСОБ ПОЛУЧЕНИЯ
Способ получения фторзамещенного циклического амина как активного ингредиента настоящего изобретения может быть выбран из приведенной ниже схемы 1 или схемы 2:
Схема 1
Соединения формулы (II) и (III) взаимодействовали в условиях восстановительного аминирования с получением соединения формулы (I).

Схема 2
Соединение формулы (IV) и соединение формулы (V) подвергались реакции с образованием соединения формулы (VI), затем можно защитить аминогруппу и получить соединение формулы (VII) путем удаления защитной группы X и(или) Y группы. Соединение формулы (VII) функционализируется R1 заместителем с образованием соединения формулы (VIII), депротекционная группа амина удаляется и соединение формулы (VIII) функционализируется R3 группой с получением соединения формулы (I);

Причем A, W, X, Y, Z, R1, R2, и R3 - это описанные выше вещества, соответственно, R4 выбирается из группы, состоящей из Н и метила, а V это -СН2-W- или -W-CH2-. В предпочтительном варианте осуществления настоящего изобретения способ получения соединения формулы (II) состоит из следующих стадий:
Соединение коричной кислоты формулы (IX) конденсируют с диметилгидроксиламином в присутствии конденсирующего агента и основания с получением амидного соединения формулы (X); затем его подвергают циклопропилированию с получением соединения формулы (XI); соединение (XI) гидролизуют, с получением соединения формулы (XII); и затем подвергают взаимодействию в условиях перегруппировки Курциуса с получением соединения формулы (IV), а затем соединение формулы (IV) функционализируют группой R3 с получением соединения формулы (II);

Соединения формул (1R, 2S)-I и (1S, 2R)-I могут быть получены способами, описанными соответственно на схеме 4 и схеме 5, а конкретные стадии процесса те-же, что и упомянутые на схеме 2.
Схема 4

Схема 5

Изобретение будет проиллюстрировано приведенными ниже примерами. Следует понимать, что данные примеры предназначены только для иллюстрации изобретения, а не для ограничения объема прав.
Пример 1. Бензил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А1)

20 мл безводного метанола помещают во флакон из темного стекла объемом 100 мл, добавляют 167 мг транс-2-фенилциклопропиламиновой кислоты и 300 мг бензил 4-фтор-4-формилпиперидин-1-карбоксилата. Затем в систему добавляют 72 мкл уксусной кислоты, нагревают с обратным током в течение 10 минут в атмосфере азота, затем охлаждают до комнатной температуры. В раствор добавляют 142 мг цианоборогидрида натрия и перемешивают при комнатной температуре в течение 5 часов. Контроль реакции проводился методом тонкослойной хроматографии (ТСХ). После завершения реакции метанол подвергался испарению под вакуумом, добавляли 50 мл воды и использовали 50 мл дихлорметана для экстракции 3 раза. Органический слой подвергался испарению под вакуумом до сухости, и очищению посредством колоночной хроматографии смесью метиленхлорид:метанол в соотношении 50: 1 для получения продукта А1 (310 мг, выход 72%). 1Н ЯМР (600 МГц, MeOD) δ 7.41-7.34 (m, 4Н), 7.36-7.30 (m, 3Н), 7.27-7.24 (m, 1H), 7.22-7.19 (m, 2H), 5.15 (s, 2H), 4.14-4.08 (m, 2H), 3.54 (d, J=20.1 Гц, 2H), 3.27-3.14 (m, 2H), 3.07 (dt, J=8.0, 4.1 Гц, 1H), 2.60 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.02-1.95 (m, 2H), 1.87-1.72 (m, 2H), 1.60 (ddd, J=10.4, 6.8, 4.4 Гц, 1H), 1.41 (dt, J=7.8, 6.7 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей) был использован для определения молекулярной массы: 383.21 [М+Н]+.
Пример 2. N-((4-фторпиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А2)

2.1 Синтез трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилата

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилат, а другие исходные материалы, реагенты и способы, используемые для получения трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилазы, были теми же, что и в примере 1 (выход: 75%).
2.2 Синтез конечного продукта А2
3.5 г трет-бутил 4-фтор-4-((транс-2-фенилциклопрпил)амино)метил)пиперидин-1-карбоксилата растворяли в 30 мл 2М хлороводородной кислоты 1,4-диоксан, и перемешивали при комнатной температуре в течение 10 часов. После завершения реакции растворитель испаряли до получения твердого продукта. Твердый продукт растворяли в небольшом количестве метанола, добавляли большое количество этилацетата и посредством обработки ультразвуком получали белое твердое вещество. После аспирационной фильтрации осадок на фильтре просушивали и получали 4.4 г дигидрохлорида желаемого продукта А2 (выход: 97%). 1Н ЯМР (400 МГц, D2O) δ 7.30 (t, J=7.4 Гц, 2Н), 7.22 (t, J=7.3 Гц, 1Н), 7.14 (d, J=7.5 Гц, 2Н), 3.55 (d, J=20.3 Гц, 2Н), 3.38 (dd, J=13.4, 4.7 Гц, 2Н), 3.21 (td, J=13.2, 3.1 Гц, 2Н), 2.97 (dt, J=8.0, 4.1 Гц, 1Н), 2.52 (ddd, J=10.4, 6.7, 3.6 Гц, 1H), 2.25-2.10 (m, 2Н), 1.96 (dtd, J=37.8, 14.7, 4.9 Гц, 2Н), 1.50 (ddd, J=10.9, 7.1, 4.4 Гц, 1Н), 1.36 (q, J=7.2 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 249.17 [М+Н]+.
Пример 3. Метил 4-((4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (A3)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на метил 4-((4-фтор-4-формилпиперидин-1-ил)метил)бензоат, тогда как другие исходные материалы, реагенты и способ получения продукта A3 были теми же, что и в примере 1 (выход: 63%). 1Н ЯМР (400 МГц, D2O) δ 7.95 (d, J=8.3 Гц, 2Н), 7.48 (d, J=8.2 Гц, 2Н), 7.27-7.18 (m, 2Н), 7.18-7.12 (m, 1Н), 7.08-7.04 (m, 2Н), 4.31 (s, 2Н), 3.79 (s, 3Н), 3.48 (d, J=20.2 Гц, 2Н), 3.39 (d, J=12.5 Гц, 2Н), 3.23 (t, J=12.2 Гц, 2Н), 2.90 (dt, J=7.9, 4.0 Гц, 1Н), 2.44 (ddd, J=10.4, 6.7, 3.6 Гц, 1Н), 2.21-2.07 (m, 2Н), 2.04-1.81 (m, 2Н), 1.43 (ddd, J=10.9, 7.2,4.4 Гц, 1Н), 1.29 (q, J=7.3 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 4. (1s, 4s)-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексиламин (А4)

Трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на трет-бутил ((1s,4s)-4-фтор-4формилциклогексил)карбамат, тогда как другие исходные материалы, реагенты и способ получения продукта A3 были теми же, что и в примере 1 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.33-7.27 (m, 2Н), 7.25-7.16 (m, 3Н), 3.51 (d, J=19.8 Гц, 2Н), 3.28-3.18 (m, 1Н), 3.05 (dt, J=7.9,4.1 Гц, 1H), 2.61 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.21-2.10 (m, 2H), 2.08-1.97 (m, 2H), 1.87-1.66 (m, 4H), 1.60 (ddd, J=10.5, 6.8, 4.4 Гц, 1H), 1.38 (dt, J=7.9, 6.7 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 263.18 [М+Н]+.
Пример 5 4-((4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (А5)

5.1 Синтез трет-бутил 4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-карбоксилата

210 мг трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилата, полученного в примере 2.1 растворяли в 15 мл хлороформа. Добавляли 1.2 мл триэтиламина, затем к раствору медленно по каплям добавляли 0.44 мл трифторуксусного ангидрида и перемешивали при комнатной температуре в течение 30 минут, после этого реакцию прекращали добавлением 6 мл 1М раствора карбоната натрия и отделяли органический слой. Экстракцию водного слоя выполняли дважды 5 мл дихлорметана, органические слои объединяли и раствор подвергали просушиванию под вакуумом и очищали посредством колоночной хроматографии (соотношение петролейный эфир : EtOAc = 10:1) с тем, чтобы получить 1.09 г желтого масла, которое является трет-бутил 4-фтор-N-(4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-карбоксилатом (выход 85%).
5.2 Синтез 2,2,2-трифтор-N-((4-фторпиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамида гидрохлорида

1.09 г трет-бутил 4-фтор-4-((2,2,2-трифтор-N-транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-карбоксилат растворяли в 15 мл 2М 1,4-диоксангидрохлорида, перемешивали при комнатной температуре в течение 4 часов для завершения реакции и растворитель испаряли с получением 2,2,2-трифтор-N-((4-фторпиперидин) 4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамида гидрохлорида (выход 99%) в виде желтого твердого вещества.
5.3 Синтез трет-бутил 4-((4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-илметил)бензоата

1.1 г 2,2,2-трифтор-N-(4-фторпиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамида гидрохлорида растворяли в 20 мл ацетонитрила и в систему успешно добавляли 784 мг т-бутил 4-бромометилбензоата и 1,2 г карбоната калия, смесь нагревали до рефлюкса в течение 2 часов. Контроль реакции проводился методом тонкослойной хроматографии (ТСХ). После завершения реакции ацетонитрил удаляли под вакуумом, добавляли 30 мл воды и экстрагировали трехкратно 20 мл дихлорметана. Органический слой просушивали и отделяли посредством колоночной хроматографии (соотношение петролейный эфир : этил ацетат = 2:1) с получением 720 мг трет-бутил 4-((4-фтор-4-((2,2,2-трифтор-N-(2-фенилциклопропил)ацетамидо)метил)пиперидин-1-илметил)бензоата (выход 47%).
5.4 Синтез конечного продукта А5
720 мг трет-бутил 4-((4-фтор-4-((2,2,2-трифтор-N-(2-фенилциклопропил)ацетамидо)метил)пиперидин-1-илметил)бензоата растворяли в 20 мл этанола, добавляли 10 мл раствора 1М гидроксида натрия, нагревали с рефлюксом в течение 2 часов, и по окончании нагрева охлаждали до комнатной температуры. Растворитель испаряли, добавляли 30 мл воды и для экстракции органического слоя 3-кратно использовали 20 мл дихлорметана. Органический слой просушивали над безводным сульфатом натрия и затем испаряли до сухости. Полученное светло-желтое масло растворяли в 1М хлороводородной кислоте, нагревали при 90°С в течение 1 часа, и реакцию гасили. Реакционную смесь перемешивали на ледяной бане в течение 1 часа для осаждения твердого вещества. Осадок на фильтре, полученный в результате аспирационной фильтрации, просушивали с получением белого твердоговещества, дигидрохлорида А5, 540 мг (выход 88%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.00-7.93 (m, 2Н), 7.44 (dt, J=7.4, 1.2 Гц, 2Н), 7.26-7.11 (m, 5Н), 3.54 (d, J=1.5 Гц, 2Н), 3.11 (dt, J=12.6, 7.2 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.62-2.49 (m, 3Н), 2.05-1.85 (m, 3Н), 1.45 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.95 (td, J=7.0, 4.9 Гц, 1Н), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 383.21 [М+Н]+.
Пример 6 N-((1-бензил-4-фторпиперидан-4-ил)метил)-транс-2-фенилциклопропиламин (А6)

6.1 Синтез N-((1-бензил-4-фторпиперидин-4-ил)метил)-2,2,2-трифтор N-(транс-2-фенилциклопропил)ацетамида

Трет-бутил-4-бромометилбензоат заменили на бромометилбензол, а другие исходные материалы, реагенты и способы получения те же, что и в случае примера 5.3. В результате получено 210 мг N-(1-бензил-4-фторпиперидин-4-ил)метил)-2,2,2-трифтор-N-(2-фенилциклопропил)ацетамида(выход 70%).
6.2 Синтез конечного продукта А6.
210 мг N-((1-бензил-4-фторпиперидин-4-ил)метил)-2,2,2-трифтор-N-(2-фенилциклопропил)ацетамида растворяли в 10 мл этилового спирта, добавляли 5 мл 1М гидроксида натрия и нагревали до рефлюкса в течении 2 часов. По завершении нагрева смесь охлаждали до комнатной температуры, растворитель испаряли и добавляли 30 мл воды и для экстракции органического слоя 3 раза использовали 20 мл дихлорметана. Органический слой просушивали под вакуумом, отделяли посредством колоночной хроматографии (дихлорметан : метанол = 40:1) для получения 149 мг А6 (выход: 91%). 1Н ЯМР (500 МГц, D2O) δ 7.50-7.41 (m, 5Н), 7.35-7.28 (m, 2Н), 7.27-7.22 (m, 1Н), 7.18-7.12 (m, 2H), 4.32 (s, 2H), 3.54 (d, J=20.3 Гц, 2H), 3.47 (d, J=8.3 Гц, 2H), 3.28 (t, J=12.7 Гц, 2H), 2.97 (dt, J=8.0, 4.1 Гц, 1H), 2.52 (ddd, J=10.4, 6.7, 3.6 Гц, 1H), 2.22 (dd, J=15.3, 8.4 Гц, 2H), 2.11-1.86 (m, 2H), 1.50 (ddd, J=10.9, 7.2, 4.4 Гц, 1H), 1.37 (q, J=7.2 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 339.22 [М+Н]+.
Пример7 Метил 3-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)-пропионат (А7)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на метил 3-(4-фтор-4-формилпиперидин-1-ил)-пропионат, тогда как другие исходные материалы, реагенты и способ получения продукта А7 были теми же, что и в примере 1 (выход: 57%). 1Н ЯМР (500 МГц, D2O) δ 7.32 (t, J=7.5 Гц, 2Н), 7.25 (t, J=7.4 Гц, 1Н), 7.16 (d, J=7.5 Гц, 2Н), 3.68 (s, 3Н), 3.61-3.54 (m, 4Н), 3.46 (t, J=7.0 Гц, 2Н), 3.32-3.23 (m, 2Н), 3.00 (dt, J=8.0, 4.1 Гц, 1Н), 2.93-2.85 (m, 2Н), 2.55 (ddd, J=10.4, 6.7, 3.6 Гц, 1Н), 2.30-2.20 (m, 2Н), 2.16-1.94 (m, 2Н), 1.52 (ddd, J=11.1, 7.2, 4.4 Гц, 1Н), 1.38 (q, J=7.3 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 335.21 [М+Н]+.
Пример 8 1-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)-3-фенил-1-пропанон (А8)
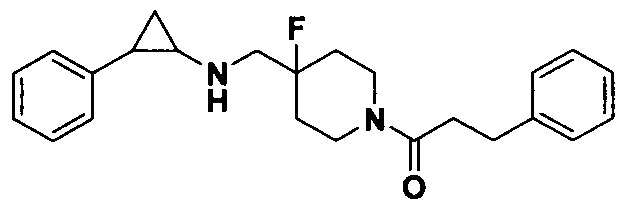
8.1 синтез 2,2,2-трифтор-N-((4-фтор-1-(3-фенилпропаноил)пиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамид

200 мг продукта, полученного в примере 5.2, 2,2,2-трифтор-N-(4-фторпиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамида гидрохлорид растворяли в 10 мл сухого дихлорметана, добавляли 0.22 мл триэтиламина и по каплям 106 мг 3-фенилпропионил хлорида в дихлорметане при охлаждении льдом, смесь перемешивали при комнатной температуре в течение 2 часов. В конце реакции для экстракции добавляли 15 мл воды и 15 мл дихлорметана. Органический слой собирали и просушивали под вакуумом с получением сырого 2,2,2-трифтор-N-((4-фтор-1-(3-фенил)пропионил)пиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамида в виде бесцветного масла.
8.2 Синтез конечного продукта А8
N-((1-бензил-4-фторпиперидин-4-ил)метил)-2,2,2-трифтор-N-(2-фенилциклопропил)ацетамид заменяли на 2,2,2-трифтор-N-((4-фтор-1-(3-фенилциклопропаноил)пиперидин-4-ил)метил)-N-(транс-2-фенилциклопропил)ацетамид, тогда как другие исходные материалы, реагенты и способ получения продукта А8 были теми же, что и в примере 6.2 (выход: 72%). 1Н ЯМР (400 МГц, D2O) δ 7.28-7.12 (m, 5Н), 7.14-7.04 (m, 5Н), 4.14 (d, J=13.5 Гц, 1Н), 3.61 (d, J=14.1 Гц, 1H), 3.21 (d, J=20.3 Гц, 2Н), 3.06 (t, J=13.2 Гц, 1Н), 2.90-2.62 (m, 5Н), 2.57-2.47 (m, 1Н), 2.46-2.37 (m, 1Н), 1.78 (t, J=12.4 Гц, 1Н), 1.62 (t, J=12.5 Гц, 1Н), 1.48-1.21 (m, 3Н), 0.81 (dt, J=39.9, 13.9 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 381.23 [М+Н]+.
Пример 9 Фенил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А9)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на фенил 4-фтор-4-формилпиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А9 были теми же, что и в примере 1 (выход: 79%). 1Н ЯМР (400 МГц, D2O) δ 7.30 (t, J=7.4 Гц, 2H), 7.24 (t, J=7.2 Гц, 2H), 7.16 (t, J=7.1 Гц, 2H), 7.08 (d, J=7.4 Гц, 2H), 6.98 (d, J=7.6 Гц, 2H), 4.11 (d, J=13.8 Гц, 1H), 3.87 (d, J=13.6 Гц, 1H), 3.41 (d, J=20.4 Гц, 2H), 3.23 (t, J=12.7 Гц, 1H), 3.10 (t, J=12.9 Гц, 1H), 2.94-2.85 (m, 1H), 2.49-2.40 (m, 1H), 1.94-1.83 (m, 2H), 1.83-1.58 (m, 2H), 1.43 (ddd, J=10.8, 7.1, 4.0 Гц, 1H), 1.35-1.22 (m, 1H).; масс-спектрометр с низкой разрешающей способностью (электроспрей): 369.19 [М+Н]+.
Пример 10 3-Циклогексил-1-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)-3-фенил-1-пропанон (А10)

3-фенилпропионилхлорид был заменен на 3-циклогексилпропаноилхлорид, тогда как другие исходные материалы, реагенты и способ получения продукта А10 были теми же, что и в примере 8 (выход: 54%). 1Н ЯМР (400 МГц, DMSO) δ 7.34-7.27 (m, 2Н), 7.25-7.16 (m, 3Н), 4.48-4.41 (m, 1H), 3.95-3.88 (m, 1Н), 3.53 (d, J=20.1 Гц, 2Н), 3.40 (ddd, J=14.2, 12.4, 2.9 Гц, 1H), 3.05 (dt, J=7.9, 4.1 Гц, 1Н), 2.96 (td, J=12.8, 3.0 Гц, 1Н), 2.58 (ddd, J=10.3, 6.5, 3.5 Гц, 1Н), 2.42 (td, J=7.5, 3.6 Гц, 2Н), 2.11-1.93 (m, 2Н), 1.93-1.54 (m, 8Н), 1.53-1.34 (m, 3Н), 1.33-1.09 (m, 4Н), 1.01-0.82 (m, 2Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 387.27 [М+Н]+.
Пример 11 4-фтор-N-метил-4-(((транс-2-фенилциклопропил)амино)метил)циклогексан-1-амин (A11)

11.1 Синтез N-((4-амино-1-фторциклогекси)метил)-2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамида гидрохлорида

Бензиловый эфир 4-фтор-4-формилпиперидин-1-карбоксиловой кислоты был заменен на трет-бутиловый эфир (4-фтор-4-формилциклогексил)карбаминовой кислоты, а другие исходные материалы, реагенты и способ получения продукта N-((4-амино-1-фторциклогексил)метил)-2,2,2-трифтор-N-(транс-2-фенилциклопропил)фцетамида гидрохлорида были теми же, что и в примере 1, 5.1 и 5.2 (выход: 39%).
11.2 Синтез конечного продукта A11
Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на раствор формальдегида (содержащего 8%-14% метанола), а транс-2-фенилциклопропил-1-амин был заменен на N-((4-амино-1-фторциклогексил)метил)-2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамид, тогда как другие исходные материалы, реагенты и способ получения продукта А11 были теми же, что и в примерах 1 и 6.2 (выход: 64%). 1Н ЯМР (400 МГц, D2O) δ 7.24-7.17 (m, 2Н), 7.16-7.10 (m, 1Н), 7.07-7.02 (m, 2H), 3.34 (d, J=20.4 Гц, 2H), 3.06-2.9 D2O 5 (m, 1H), 2.85 (dt, J=8.0, 4.1 Гц, 1H), 2.54 (s, 3H), 2.41 (ddd, J=10.4, 6.7, 3.6 Гц, 1H), 2.01-1.89 (m, 4H), 1.64-1.43 (m, 4H), 1.39 (ddd, J=10.5, 7.2, 4.4 Гц, 1H), 1.30-1.19 (m, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 277.20 [М+Н]+.
Пример 12 N-((4-фтор-1-(3-фенилпропил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А12)

бромметилбензол был заменен на бромпропилбензол, тогда как другие исходные материалы, реагенты и способ получения продукта А12 были теми же, что и в примере 6 (выход: 75%). 1Н ЯМР (400 МГц, D2O) δ 7.45-7.39 (m, 4Н), 7.38-7.31 (m, 4Н), 7.28-7.23 (m, 2Н), 3.71-3.58 (m, 4Н), 3.33-3.16 (m, 4Н), 3.09 (dt, J=8.0, 4.1 Гц, 1Н), 2.77 (t, J=7.4 Гц, 2H), 2.64 (ddd, J=10.4, 6.7, 3.6 Гц, 1Н), 2.38-2.26 (m, 2H), 2.22-2.01 (m, 4H), 1.62 (ddd, J=10.5, 7.2, 4.4 Гц, 1H), 1.48 (q, J=7.2 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 367.25 [М+Н]+.
Пример 13 N-((1-([1,1'-бифенил]-4-метил)-4-фторпиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А13)

Бромметилбензол был заменен на 4-бромметил-1,1'-бифенил, тогда как другие исходные материалы, реагенты и способ получения продукта А12 были теми же, что и в примере 6 (выход: 80%). 1Н ЯМР (400 МГц, MeOD) δ 7.78 (d, J=8.1 Гц, 2Н), 7.74-7.64 (m, 4Н), 7.49 (t, J=7.6 Гц, 2Н), 7.44-7.38 (m, 1Н), 7.33 (t, J=7.4 Гц, 2Н), 7.29-7.14 (m, 3Н), 4.48 (s, 2Н), 3.72-3.54 (m, 4Н), 3.38 (d, J=13.2 Гц, 2Н), 3.09 (t, J=4.6 Гц, 1H), 2.64 (t, J=9.6 Гц, 1H), 2.40-2.13 (m, 4Н), 1.67-1.59 (m, 1Н), 1.42 (q, J=7.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 415.27 [М+Н]+.
Пример 14 N-((1-(3-циклогексилпропил)-4-фторпиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А14)
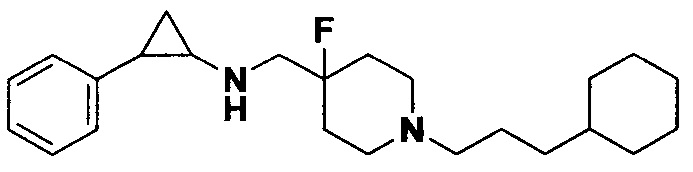
Бромметилбензол был заменен на бромпропилциклогексан, тогда как другие исходные материалы, реагенты и способ получения продукта А14 были теми же, что и в примере 6 (выход: 74%). 1Н ЯМР (400 МГц, D2O) δ 7.45-7.39 (m, 2Н), 7.38-7.32 (m, 1Н), 7.28-7.23 (m, 2Н), 3.73-3.58 (m, 4Н), 3.29 (td, J=13.2, 2.9 Гц, 2Н), 3.22-3.15 (m, 2Н), 3.10 (dt, J=8.0, 4.0 Гц, 1Н), 2.64 (ddd, J=10.5, 6.9, 3.7 Гц, 1Н), 2.41-2.30 (m, 2Н), 2.25-2.02 (m, 2Н), 1.86-1.55 (m, 8Н), 1.49 (q, J=7.3 Гц, 1Н), 1.35-1.04 (m, 6Н), 0.99-0.82 (m, 2Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 373.29 [М+Н]+.
Пример 15 N-((4-фтор-1-метилпиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А15)

Трет-бутил (4-фтор-4-формилциклогексил)карбамат был заменен на-трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А15 были теми же, что и в примере 11 (выход: 34%). 1Н ЯМР (400 МГц, D2O) δ 7.30-7.24 (m, 2Н), 7.22-7.17 (m, 1Н), 7.11 (dd, J=7.1, 1.8 Гц, 2H), 3.52 (d, J=20.3 Гц, 2H), 3.43 (dd, J=12.7, 4.5 Гц, 2H), 3.20 (td, J=13.2, 3.1 Гц, 2H), 2.94 (dt, J=8.0, 4.1 Гц, 1H), 2.81 (s, 3H), 2.49 (ddd, J=10.4, 6.7, 3.6 Гц, 1H), 2.19 (dd, J=15.1, 8.6 Гц, 2H), 2.03 (td, J=15.1, 14.7, 4.9 Гц, 1H), 1.93 (td, J=14.5, 4.8 Гц, 1H), 1.47 (ddd, J=10.5, 7.2, 4.4 Гц, 1H), 1.33 (q, J=7.2 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 263.18 [М+Н]+.
Пример 16 N-((4-фтор-1-(4-(металсульфонил)бензил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А16)

Бромметилбензол был заменен на 1-бромметил-4-метансульфонилбензол, тогда как другие исходные материалы, реагенты и способ получения продукта А16 были теми же, что и в примере 6 (выход: 72%). 1Н ЯМР (400 МГц, MeOD) δ 8.10-8.06 (m, 2Н), 7.92-7.87 (m, 2Н), 7.33-7.28 (m, 2Н), 7.25-7.16 (m, 3Н), 4.53 (s, 2Н), 3.65 (d, J=20.1 Гц, 2Н), 3.53 (d, J=12.5 Гц, 2Н), 3.42-3.30 (m, 2Н), 3.16 (s, 3Н), 3.10-3.05 (m, 1Н), 2.66-2.56 (m, 1H), 2.37-2.16 (m, 4H), 1.61 (dt, J=11.0, 6.2 Гц, 1H), 1.40 (q, J=7.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 417.19 [М+Н]+.
Пример 17 N-((4-фтор-1-(нафтил-2-метил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А17)

Бромметилбензол был заменен на 2-бромметилнафталин, тогда как другие исходные материалы, реагенты и способ получения продукта А17 были теми же, что и в примере 6 (выход: 60%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.95-7.77 (m, 3Н), 7.69 (d, J=1.5 Гц, 1Н), 7.61-7.47 (m, 3Н), 7.26-7.11 (m, 5H), 3.66 (s, 2H), 3.00 (dt, J=12.6, 7.2 Гц, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 2.46 (dt, J=12.6, 7.2 Гц, 2H), 1.93 (ddt, J=25.1, 14.2, 7.2 Гц, 3Н), 1.53 (ddt, J=25.1, 13.1, 7.0 Гц, 2H), 0.95 (td, J=7.0, 5.1 Гц, 1H), 0.70 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 389.23 [М+Н]+.
Пример 18 N-((1-фторциклогексил)метил)-транс-2-фенилциклопропиламин (А18)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на метил 1-фторциклогексан-1-карбальдегид, тогда как другие исходные материалы, реагенты и способ получения продукта А18 были теми же, что и в примере 1 (выход: 82%). 1Н ЯМР (400 МГц, MeOD) δ 7.36-7.30 (m, 2Н), 7.28-7.24 (m, 1Н), 7.22 (tt, J=5.9, 1.2 Гц, 2H), 3.47 (d, J=20.0 Гц, 2H), 3.06 (dt, J=8.0, 4.1 Гц, 1H), 2.59 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 1.99-1.88 (m, 2H), 1.74-1.62 (m, 6H), 1.59 (ddd, J=10.3, 6.8, 4.4 Гц, 2H), 1.40 (dt, J=7.9, 6.7 Гц, 2H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 248.17 [М+Н]+.
Пример 19 Бензил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)циклогексил)карбамат (А19)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на-метилбензил (4-фтор-4-формилциклогексил)карбамат, тогда как другие исходные материалы, реагенты и способ получения продукта А19 были теми же, что и в примере 1 (выход: 64%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.02 (s, 2Н), 4.11 (р, J=7.0 Гц, 1Н), 2.73-2.64 (m, 2Н), 1.94-1.72 (m, 5Н), 1.65-1.50 (m, 2Н), 1.54-1.43 (m, 2Н), 0.99 (td, J=6.9, 5.0 Гц, 1Н), 0.67 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 20 N-((4-фтор-1-фенилпиперидин-4-ил)метил)-транс-2-фенилциклопропилам (А20)

Бромметилбензол был заменен на бромбензол, тогда как другие исходные материалы, реагенты и способ получения продукта А20 были теми же, что и в примере 6 (выход: 41 1Н ЯМР (400 МГц, DMSO-d6) δ 7.30-7.11 (m, 7Н), 7.07-6.99 (m, 2Н), 6.80 (tt, J=7.4, 2.0 Гц, 1Н), 4.00 (dt, J=12.6, 7.2 Гц, 2H), 3.33 (dt, J=12.4, 7.0 Гц, 2H), 2.77-2.64 (m, 2H), 2.60 (s, 1H), 2.06-1.84 (m, 3H), 1.50 (ddt, J=25.2, 13.2, 7.1 Гц, 2H), 0.97 (td, J=7.0, 5.1 Гц, 1H), 0.69 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 325.20 [М+Н]+.
Пример 21 Циклогексилметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А21)

3-фенилпропионилхлорид был заменен на циклогексилметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А21 были теми же, что и в примере 8 (выход: 63%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.02 (dt, J=12.4, 7.1 Гц, 2Н), 3.91-3.85 (m, 2Н), 3.27 (dt, J=12.4, 7.1 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.04-1.85 (m, 3Н), 1.77-1.65 (m, 2Н), 1.70-1.56 (m, 4Н), 1.60-1.42 (m, 2Н), 1.34-1.12 (m, 6Н), 0.95 (td, J=7.0, 5.0 Гц, 1Н), 0.71 (td, J=6.9, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 389.25 [М+Н]+.
Пример 22 Пиридин-4-илметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А22)

3-фенилпропионилхлорид был заменен на пиридин-4-илметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А22 были теми же, что и в примере 8 (выход: 53%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.58 (d, J=5.1 Гц, 2Н), 7.70 (d, J=5.1 Гц, 2Н), 7.26-7.11 (m, 5Н), 5.80 (s, 2Н), 4.17 (dt, J=12.6, 7.2 Гц, 2Н), 3.10 (dt, J=12.5, 7.0 Гц, 2Н), 2.75-2.64 (m, 2Н), 2.04-1.83 (m, 3Н), 1.63 (ddt, J=25.2, 13.2, 7.1 Гц, 2Н), 0.92 (td, J=6.9, 5.0 Гц, 1Н), 0.70 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 384.20 [М+Н]+.
Пример 23 Фенэтил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А23)

3-фенилпропионил хлорид был заменен на фенил этил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А23 были теми же, что и в примере 8 (выход: 60%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.27-7.11 (m, 10Н), 4.41 (t, J=7.5 Гц, 2Н), 4.05 (dt, J=12.4, 7.0 Гц, 2H), 3.30 (dt, J=12.6, 7.2 Гц, 2H), 2.86 (t, J=7.5 Гц, 2H), 2.78-2.64 (m, 2Н), 2.05-1.86 (m, 3Н), 1.65 (ddt, J=25.2, 13.2, 7.1 Гц, 2H), 0.96 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 24 Этил 4-фтор-4-(((транс-2-фенилциклопропил)амиино)метил)пиперидин-1-карбоксилат (А24)

3-фенилпропионил хлорид был заменен на этил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А24 были теми же, что и в примере 8 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.10-3.98 (m, 4Н), 3.25 (dt, J=12.5, 7.1 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.60 (s, 1H), 2.00-1.82 (m, 3Н), 1.64 (ddt, J=25.2, 13.2, 7.1 Гц, 2Н), 1.17 (t, J=8.0 Гц, 3Н), 0.94 (td, J=7.0, 5.0 Гц, 1Н), 0.71 (td, J=6.9, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 321.19 [М+Н]+.
Пример 25 (1Н-индол-5-ил)метил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А25)
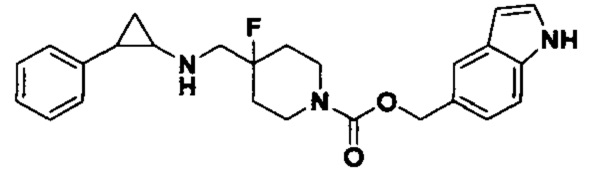
3-фенилпропионил хлорид был заменен на (1Н-индол-5-ил)метил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А25 были теми же, что и в примере 8 (выход: 36%). 1Н ЯМР (400 МГц, DMSO-d6) δ 11.53 (s, 1Н), 8.06 (t, J=1.5 Гц, 1H), 7.61 (d, J=7.5 Гц, 1H), 7.50-7.40 (m, 2H), 7.26-7.11 (m, 5H), 6.65 (dd, J=7.6, 1.5 Гц, 1H), 5.02 (s, 2H), 4.04 (dt, J=12.4, 7.1 Гц, 2H), 3.30 (dt, J=12.6, 7.2 Гц, 2H), 2.76-2.64 (m, 2H), 2.60 (s, 1H), 2.05-1.86 (m, 3H), 1.64 (ddt, J=25.2, 13.2, 7.1 Гц, 2H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 422.22 [М+Н]+.
Пример 26 1-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиридин-1-ил)-1-этанон (А26)
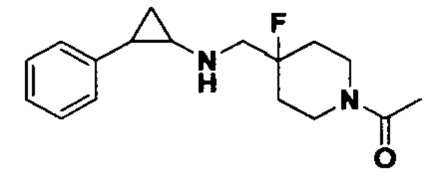
3-фенилпропионил хлорид был заменен на ацетилхлорид, тогда как другие исходные материалы, реагенты и способ получения продукта А26 были теми же, что и в примере 8 (выход: 76%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 3.96 (dt, J=12.5, 7.1 Гц, 2Н), 2.93 (dt, J=12.5, 7.1 Гц, 2Н), 2.71-2.61 (m, 2Н), 2.60 (s, 1H), 2.10 (s, 3Н), 2.00-1.82 (m, 3Н), 1.63 (ddt, J=25.3, 13.2, 7.2 Гц, 2Н), 0.99 (td, J=7.0, 5.0 Гц, 1Н), 0.66 (td, J=7.0, 5.1 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 291.18 [М+Н]+.
Пример 27 Тиофен-2-илметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А27)

3-фенилпропионилхлорид был заменен на тиофен-2-илметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А27 были теми же, что и в примере 8 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.30 (dd, J=6.4, 2.5 Гц, 1H), 7.26-7.11 (m, 5H), 7.05-6.96 (m, 2H), 5.61 (s, 2H), 4.19 (dt, J=12.5, 7.1 Гц, 2H), 3.11 (dt, J=12.5, 7.1 Гц, 2H), 2.75-2.64 (m, 2H), 2.08-1.82 (m, 3Н), 1.73-1.55 (m, 2H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.70 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 389.16 [М+Н]+.
Пример 28 Фуран-2-илметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А28)
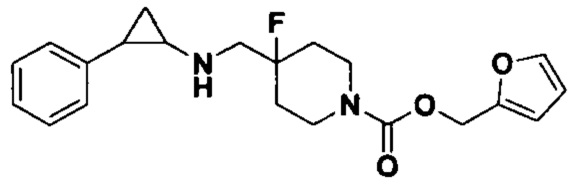
3-фенилпропионилхлорид был заменен на фуран-2-илметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А28 были теми же, что и в примере 8 (выход: 76%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.45 (dd, J=7.0, 1.9 Гц, 1H), 7.26-7.11 (m, 5H), 6.44-6.32 (m, 2H), 5.09 (s, 2H), 4.06 (dt, J=12.5, 7.1 Гц, 2H), 3.31 (dt, J=12.5, 7.2 Гц, 2H), 2.76-2.64 (m, 2H), 2.60 (s, 1H), 1.99 (dt, J=10.9, 6.0 Гц, 1H), 1.98-1.86 (m, 2H), 1.65 (ddt, J=25.3, 13.3, 7.1 Гц, 2H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 373.18 [М+Н]+.
Пример 29 4-Фторбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А29)

3-фенилпропионил хлорид был заменен на 4-фторбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А29 были теми же, что и в примере 8 (выход: 74%).1Н ЯМР (400 МГц, DMSO-d6) δ 7.35 (dd, J=7.2, 5.7 Гц, 2Н), 7.26-7.11 (m, 7Н), 5.21-5.15 (m, 2Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.25 (dt, J=12.5, 7.1 Гц, 2Н), 2.75-2.64 (m, 2Н), 2.00-1.82 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.0 Гц, 2Н), 0.94 (td, J=7.0, 5.0 Гц, 1Н), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 401.20 [М+Н]+.
Пример 30 4-хлорбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А30)

3-фенилпропионил хлорид был заменен на 4-хлорбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А30 были теми же, что и в примере 8 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39 (d, J=7.5 Гц, 2Н), 7.34-7.26 (m, 2Н), 7.26-7.11 (m, 5Н), 5.18 (s, 1Н), 4.04 (dt, J=12.5, 7.1 Гц, 2H), 3.25 (dt, J=12.5, 7.1 Гц, 2H), 2.75-2.64 (m, 2H), 2.60 (s, 1H), 2.00-1.82 (m, 3Н), 1.64 (ddt, J=25.3, 13.2, 7.2 Гц, 2H), 0.94 (td, J=6.9, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 417.17 [М+Н]+.
Пример 31 4-бромбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (A31)
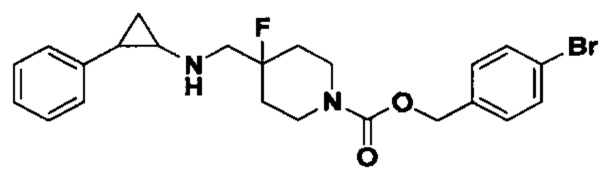
3-фенилпропионил хлорид был заменен на 4-бромбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А31 были теми же, что и в примере 8 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.58 (d, J=7.6 Гц, 2Н), 7.29-7.22 (m, 2Н), 7.27-7.11 (m, 5Н), 5.18 (s, 1Н), 4.02 (dt, J=12.5, 7.1 Гц, 2H), 3.28 (dt, J=12.5, 7.1 Гц, 2H), 2.75-2.64 (m, 2H), 2.60 (s, 1H), 2.04-1.86 (m, 3H), 1.63 (ddt, J=25.3, 13.2, 7.2 Гц, 2H), 0.95 (td, J=7.0, 4.9 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 461.12 [М+Н]+.
Пример 32 4-метоксибензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А32)

3-фенилпропионил хлорид был заменен на 4-метоксибензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А32 были теми же, что и в примере 8 (выход: 76%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 7.03-6.96 (m, 2Н), 6.94-6.87 (m, 2Н), 5.18 (s, 1Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.79 (s, 3Н), 3.28 (dt, J=12.5, 7.1 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.60 (s, 1H), 2.04-1.85 (M, 3Н), 1.72-1.54 (m, 2Н), 0.95 (td, J=7.0, 5.0 Гц, 1Н), 0.71 (td, J=7.0, 5.1 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (элекгроспрей): 413.22 [М+Н]+.
Пример 33 4-трифторметилбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А33)

3-фенилпропионилхлорид был заменен на 4-трифторметилбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А33 были теми же, что и в примере 8 (выход: 68%). 1H ЯМР (400 МГц, DMSO-d6) δ 7.69 (d, J=7.2 Гц, 2Н), 7.58-7.52 (m, 2Н), 7.26-7.11 (m, 5Н), 5.18 (s, 1Н), 4.03 (dt, J=12.5, 7.2 Гц, 2H), 3.27 (dt, J=12.5, 7.1 Гц, 2H), 2.74-2.64 (m, 2H), 2.60 (s, 1H), 1.94 (ddt, J=25.0, 14.1, 7.1 Гц, 3Н), 1.73-1.54 (m, 2H), 0.96 (td, J=7.0, 5.0 Гц, 1H), 0.70 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 451.19 [М+Н]+.
Пример 34 3,5-диметоксибензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А34)

3-фенилпропионилхлорид был заменен на 3,5-диметоксибензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А34 были теми же, что и в примере 8 (выход: 77%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 6.59 (dt, J=2.2, 1.0 Гц, 2Н), 6.33 (t, J=2.0 Гц, 1Н), 5.02 (d, J=1.2 Гц, 2Н), 4.16 (dt, J=12.6, 7.2 Гц, 2Н), 3.66 (s, 6Н), 3.09 (dt, J=12.5, 7.1 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.60 (s, 1Н), 2.05-1.81 (m, 3Н), 1.61 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.94 (td, J=7.0, 5.0 Гц, 1Н), 0.69 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 443.23 [М+Н]+.
Пример 35 4-((4-фтор-4-(((транс-2-фенилциклопропил)амиино)метил)пиперидин-1-карбонилокси)метил)бензойная кислота (А35)

35.1 Синтез 4-(трет-бутоксикарбонил)бензил 4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-формат
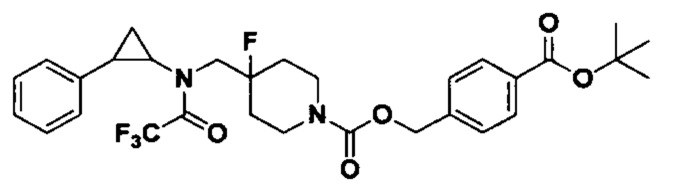
3-фенилпропионилхлорид был заменен на 4-((хлорформилокси)метил)бензоат, а другие исходные материалы, реагенты и способ получения 4-(трет-бутоксикарбонил)бензил 4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-формата были теми же, что и в примере 8.1 (выход: 77%).
35.2 Синтез конечного продукта A35
Трет-бутил 4-((4-фтор-4-((2,2,2-трифтор-N-(2-фенилциклопропил)ацетамидо)метил)пиперидин 1-илметил)бензоат был заменен на 4-(трет-бутоксикарбонил)бензил 4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацеталамин)метил пиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения гидрохлоридной соли продукта А35 были теми же, что и в примере 5.4 (выход: 85%). 1Н ЯМР (400 МГц, DMSO-d6) δ 12.91 (s, 1Н), 7.93-7.86 (m, 2Н), 7.46-7.39 (m, 2Н), 7.26-7.11 (m, 5Н), 5.18 (s, 1Н), 4.03 (dt, J=12.6, 7.2 Гц, 2Н), 3.29 (dt, J=12.5, 7.2 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.60 (s, 1Н), 2.05-1.86 (m, 3Н), 1.63 (ddt, J=25.3, 13.2, 7.2 Гц, 2Н), 0.95 (td, J=7.0, 5.1 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 427.20 [М+Н]+.
Пример 36 (Е)-1-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)-3-фенил-2-эне-1-пропанон (А36)

3-фенилпропионилхлорид был заменен на хлорангидрид коричной кислоты, тогда как другие исходные материалы, реагенты и способ получения продукта А36 были те же, что и в примере 8 (выход: 88%). 1Н ЯМР (400 МГц, CD3OD) δ 7.66-7.54 (m, 3Н), 7.43-7.34 (m, 3Н), 7.31 (tt, J=6.9, 1.0 Гц, 2Н), 7.25-7.16 (m, 4Н), 4.56 (d, J=12.8 Гц, 1Н), 4.27 (d, J=13.3 Гц, 1H), 3.61-3.45 (m, 3H), 3.17-3.09 (m, 1H), 3.06 (dt, J=7.9, 4.0 Гц, 1H), 2.58 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.07 (q, J=12.6, 11.4 Гц, 2H), 1.85 (tt, J=25.7, 13.1 Гц, 2H), 1.58 (ddd, J=10.6, 6.8, 4.4 Гц, 1H), 1.40 (dt, J=7.9, 6.7 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 379.21 [М+Н]+.
Пример 37 N-бензил-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-тиоамид (A37)

3-фенилпропионил хлорид был заменен на бензилизотиоцианат, тогда как другие исходные материалы, реагенты и способ получения продукта А37 были теми же, что и в примере 8 (выход: 58%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.36-7.13 (m, 10Н), 7.13 (s, 1Н), 4.75 (s, 2Н), 3.97 (dt, J=12.5, 7.1 Гц, 2Н), 2.82 (q, J=7.0 Гц, 1H), 2.66 (s, 1Н), 2.60 (s, 1Н), 2.47 (dt, J=12.5, 7.0 Гц, 2Н), 1.89 (q, J=7.0 Гц, 1Н), 1.77 (ddt, J=25.3, 13.2, 7.2 Гц, 2Н), 1.47 (ddt, J=25.3, 13.2, 7.2 Гц, 2Н), 0.97 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 398.20 [М+Н]+.
Пример 38 N-бензил-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксамид (А38)

3-фенилпропионилхлорид был заменен на бензилизотиоцианат, тогда как другие исходные материалы, реагенты и способ получения продукта A38 были теми же, что и в примере 8 (выход: 52%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.30 (s, 3Н), 7.34-7.23 (m, 2Н), 7.27-7.11 (m, 5Н), 4.27 (s, 2Н), 4.11 (dt, J=12.5, 7.1 Гц, 2Н), 3.09 (dt, J=12.5, 7.1 Гц, 2Н), 2.72-2.57 (m, 3Н), 2.04-1.85 (m, 3Н), 1.59 (ddt, J=25.1, 13.2, 7.1 Гц, 2Н), 0.94 (td, J=7.0, 5.0 Гц, 1Н), 0.68 (td, J=7.0, 4.9 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 382.22 [М+Н]+.
Пример 39 N-((1-((бензилокси)метил)-4-фторпиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А39)

Бромметилбензол был заменен на бензил хлорометиловый эфир, тогда как другие исходные материалы, реагенты и способ получения продукта A39 были теми же, что и в примере 6 (выход: 64%). 1Н ЯМР (400 МГц, DMSC-d6) δ 7.37-7.25 (m, 5Н), 7.29-7.11 (m, 5Н), 4.68 (s, 1Н), 4.44 (s, 2Н), 3.06 (dt, J=12.5, 7.2 Гц, 2Н), 2.75-2.64 (m, 2Н), 2.63-2.51 (m, 3Н), 1.96-1.78 (m, 3Н), 1.47 (ddt, J=25.3, 13.3, 7.1 Гц, 2Н), 0.94 (td, J=7.0, 4.9 Гц, 1Н), 0.69 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 369.23 [М+Н]+.
Пример 40 Бензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексан-1-карбоксилат (А40)
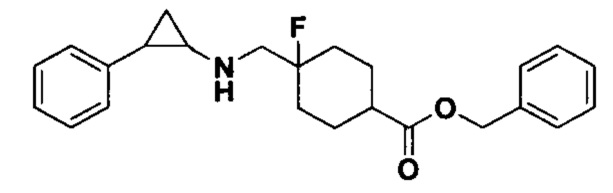
Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 4-фтор-4-формилциклогексан-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А40 были теми же, что и в примере 1 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.38-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.11 (s, 2Н), 2.74-2.64 (m, 2Н), 2.27 (р, J=6.9 Гц, 1Н), 2.18-2.05 (m, 2Н), 1.98-1.74 (m, 6Н), 1.61-1.42 (m, 2Н), 0.95 (td, J=7.0, 5.0 Гц, 1Н), 0.68 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 382.21 [М+Н]+.
Пример 41 Циклопентилметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин)-1-карбоксилат (А41)
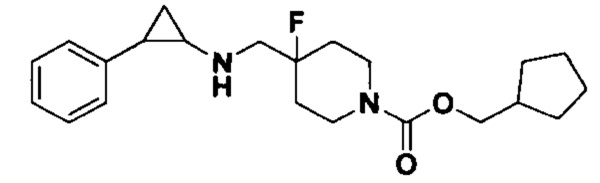
3-фенилпропионилхлорид был заменен на циклопентилметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А41 были теми же, что и в примере 8 (выход: 69%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.04 (dt, J=12.5, 7.1 Гц, 2Н), 3.88 (s, 2Н), 3.28 (dt, J=12.6, 7.2 Гц, 2Н), 2.72 (s, 1Н), 2.66 (s, 1Н), 2.60 (s, 1H), 1.96 (ddt, J=25.1, 13.2, 7.0 Гц, 2H), 1.86 (s, 1H), 1.71-1.42 (m, 7H), 1.07 (tdd, J=7.8, 4.8, 1.5 Гц, 2H), 0.94 (s, 1H), 0.69 (s, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 375.24 [М+Н]+.
Пример 42 Циклобутилметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А42)

3-фенилпропионилхлорид был заменен на циклобутилметил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А42 были теми же, что и в примере 8 (выход: 71%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.13 (dt, J=12.5, 7.1 Гц, 2Н), 3.88 (d, J=7.0 Гц, 2Н), 3.11 (dt, J=12.5, 7.0 Гц, 2Н), 2.90 (q, J=6.9 Гц, 1Н), 2.62-2.47 (m, 2H), 2.14-1.96 (m, 4H), 1.90-1.77 (m, 2H), 1.80-1.68 (m, 2H), 1.71-1.58 (m, 4H), 0.93 (td, J=6.9, 5.0 Гц, 1Н), 0.71 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 361.22 [М+Н]+.
Пример 43 Пиперидин-4-илметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А43)

3-фенилпропионил хлорид был заменен на терт-бутил 4-((хлороформилокси)метил)пиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А43 были теми же, что и в примерах 8.1 и 5.4 (выход: 61%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.88 (s, 2Н), 3.27 (dt, J=12.6, 7.2 Гц, 2Н), 3.04 (dt, J=12.5, 7.2 Гц, 2Н), 2.75-2.57 (m, 5Н), 2.44 (s, 1H), 2.04-1.86 (m, 2Н), 1.91 (s, 1Н), 1.66 (s, 1H), 1.64 (ddt, J=25.3, 13.7,7.1 Гц, 2Н), 1.45 (dt, J=13.1, 7.1 Гц, 2Н), 1.18 (dt, J=13.3, 7.2 Гц, 2Н), 0.95 (s, 1Н), 0.71 (s, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 390.25 [М+Н]+.
Пример 44 3-хлорбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А44)

3-фенилпропионил хлорид был заменен на 3-хлорбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А44 были теми же, что и в примере 8 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.51-7.45 (m, 1Н), 7.39-7.26 (m, 3Н), 7.26-7.11 (m, 5H), 5.02 (s, 2H), 4.04 (dt, J=12.5, 7.1 Гц, 2Н), 3.26 (dt, J=12.5, 7.0 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.01-1.83 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.0 Гц, 2Н), 0.93 (td, J=7.0, 5.1 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 417.17 [М+Н]+.
Пример 45 2-хлорбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А45)
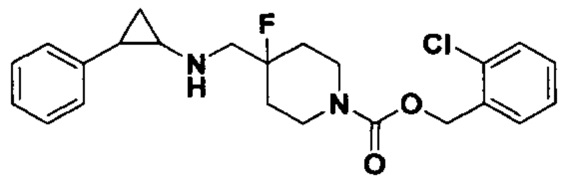
3-фенилпропионил хлорид был заменен на 2-хлорбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А45 были теми же, что и в примере 8 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.45-7.31 (m, 2Н), 7.26-7.05 (m, 7Н), 5.09 (d, J=0.9 Гц, 2Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.26 (dt, J=12.5, 7.0 Гц, 2Н), 2.75-2.64 (m, 2Н), 2.00-1.82 (m, 3Н), 1.73-1.55 (m, 2Н), 0.94 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.1 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 417.17 [М+Н]+.
Пример 46 (4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)(фенил)метанон (А46)

3-фенилпропионил хлорид был заменен на бензоилхлорид, тогда как другие исходные материалы, реагенты и способ получения продукта А46 были теми же, что и в примере 8 (выход: 66%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.59 (tt, J=12, 2.2 Гц, 1H), 7.50-7.36 (m, 4H), 7.26-7.11 (m, 5H), 3.75 (dt, J=12.5, 7.1 Гц, 2H), 3.13 (dt, J=12.6, 7.2 Гц, 2H), 2.76-2.64 (m, 2H), 2.60 (s, 1H), 1.98-1.86 (m, 2H), 1.90-1.80 (m, 1H), 1.63 (ddt, J=25.1, 13.2, 7.0 Гц, 2H), 0.96 (td, J=6.9, 5.0 Гц, 1H), 0.70 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 353.20 [М+Н]+.
Пример 47 4-трет-бутилбензил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А47)

3-фенилпропионил хлорид был заменен на 4-трет-бутилбензил хлороформат, тогда как другие исходные материалы, реагенты и способ получения продукта А47 были теми же, что и в примере 8 (выход: 69%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39 (t, J=6.3 Гц, 4Н), 7.26-7.11 (m, 5Н), 5.18 (d, J=1.2 Гц, 2Н), 4.04 (dt, J=12.6, 7.2 Гц, 2Н), 3.25 (dt, J=12.5, 7.1 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.00-1.82 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 1.31 (s, 9Н), 0.94 (td, J=7.0, 5.1 Гц, 1Н), 0.70 (td, J=7.0, 5.1 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 439.27 [М+Н]+.
Пример 48 Бензил 4-фтор-2-метил-4-(((транс-2-фенилпиклопропил)амино)метил)пиперидин-1-карбоксилат (А48)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 4-фтор-2-метил-4-формилпиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А48 были теми же, что и в примере 1 (выход: 68%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.50 (d, J=12.3 Гц, 1H), 5.31 (d, J=12.4 Гц, 1Н), 4.16 (dt, J=12.4, 7.1 Гц, 1H), 3.79 (h, J=6.8 Гц, 1H), 3.21 (dt, J=12.4, 7.1 Гц, 1H), 3.04 (dd, J=25.2, 12.4 Гц, 1H), 2.90-2.66 (m, 2H), 2.12-1.60 (m, 4H), 1.46 (ddd, J=25.3, 13.1,7.0 Гц, 1H), 1.25 (d, J=6.8 Гц, 3Н), 0.94 (td, J=7.0, 5.0 Гц, 1H), 0.69 (td, J=7.0, 4.9 Гц, 1H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 49 Бензил 4-фтор-2,6-диметил-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А49)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 4-фтор-2,6-диметил-4-формилпиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А49 были теми же, что и в примере 1 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.35 (d, J=12.4 Гц, 1Н), 3.88 (q, J=6.9 Гц, 2Н), 2.74-2.64 (m, 2Н), 2.60 (s, 1H), 1.94-1.78 (m, 3Н), 1.51 (ddd, J=25.3, 13.2, 7.0 Гц, 2Н), 1.25 (d, J=6.8 Гц, 6Н), 0.95 (td, J=7.0, 5.0 Гц, 1Н), 0.69 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 411.24 [М+Н]+.
Пример 50 Бензил 4-фтор-4-(((транс-2-(нафталин-2-ил)лциклопропил)амино)метил)пиперидин-1-карбоксилат (А50)

транс-2-фенилпропионил хлорид был заменен на транс-2-(нафталин-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А50 были теми же, что и в примере 1 (выход: 60%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.94-7.81 (m, 3Н), 7.57-7.39 (m, 4Н), 7.39-7.26 (m, 5Н), 5.22 (s, 2Н), 4.04 (dt, J=12.4, 7.2 Гц, 2Н), 3.30 (dt, J=12.5, 7.1 Гц, 2Н), 2.76 (q, J=7.0 Гц, 1Н), 2.66 (s, 1Н), 2.60 (s, 1Н), 2.05-1.87 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.99 (td, J=7.0, 5.0 Гц, 1Н), 0.75 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 433.22 [М+Н]+.
Пример 51 Бензил 4-фтор-4-(((транс-2-(бензтиофен-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А51)
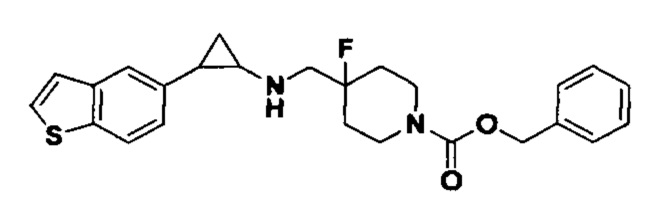
транс-2-фенилпропиламин был заменен на транс-2-(бензотиофен-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А51 были теми же, что и в примере 1 (выход: 55%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96 (d, J=7.5 Гц, 1H), 7.68 (s, 1H), 7.55-7.44 (m, 2H), 7.32 (dtd, J=8.9, 7.4, 2.3 Гц, 6H), 5.22 (s, 2H), 4.03 (dt, J=12.6, 7.2 Гц, 2H), 3.30 (dt, J=12.5, 7.0 Гц, 2H), 2.77 (q, J=7.0 Гц, 1H), 2.66 (s, 1H), 2.60 (s, 1H), 2.05-1.87 (m, 3H), 1.73-1.55 (m, 2H), 0.99 (td, J=7.0, 4.9 Гц, 1H), 0.77 (td, J=7.0, 4.9 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 439.18 [М+Н]+.
Пример 52 Бензил 4-фтор-4-(((транс-2-(пиридин-4-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А52)
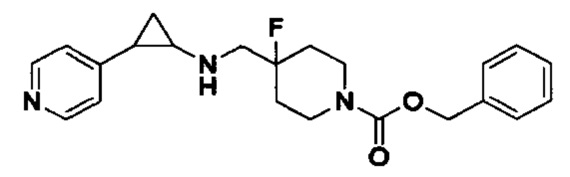
транс-2-фенилциклопропиламин был заменен на транс-2-(пиридин-4-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А52 были теми же, что и в примере 1 (выход: 65%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.50 (d, J=5.1 Гц, 2Н), 7.39-7.26 (m, 5Н), 7.22 (d, J=5.2 Гц, 2Н), 5.22 (s, 2Н), 4.02 (dt, J=12.5, 7.0 Гц, 2Н), 3.34-3.13 (m, 3Н), 2.66 (s, 1Н), 2.60 (s, 1Н), 1.94 (ddt, J=25.3, 13.9, 7.1 Гц, 2Н), 1.79-1.54 (m, 3Н), 0.86 (td, J=7.0, 4.9 Гц, 1Н), 0.61 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 384.20 [М+Н]+.
Пример 53 Бензил 4-фтор-4-(((транс-2-(1Н-индол-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А53)
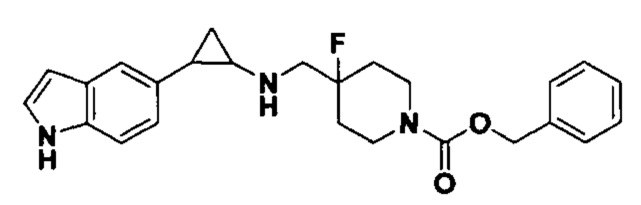
транс-2-фенилциклопропиламин был заменен на транс-2-(1Н-индол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А53 были теми же, что и в примере 1 (выход: 57%). 1Н ЯМР (400 МГц, DMSO-d6) δ 11.53 (s, 1Н), 7.82 (s, 1H), 7.56 (d, J=7.5 Гц, 1H), 7.43 (d, J=7.5 Гц, 1Н), 7.39-7.24 (m, 6Н), 6.64 (dd, J=7.4, 1.4 Гц, 1H), 5.22 (s, 2Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.29 (dt, J=12.5, 7.1 Гц, 2Н), 2.76 (q, J=7.0 Гц, 1H), 2.66 (s, 1Н), 2.60 (s, 1Н), 2.05-1.87 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.99 (td, J=7.0, 4.9 Гц, 1Н), 0.76 (td, J=6.9, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 422.22 [М+Н]+.
Пример 54 Бензил 4-фтор-4-(((транс-2-(1-метил-1Н-индол-5-ил)циклопропил)амино)метил)пиперидин (А54)

транс-2-фенилциклопропиламин был заменен на транс-2-(1-метил-1Н-индол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А54 были теми же, что и в примере 1 (выход: 67%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.66 (t, J=1.5 Гц, 1Н), 7.52 (d, J=7.5 Гц, 1Н), 7.39-7.26 (m, 5Н), 7.17 (d, J=7.5 Гц, 1Н), 7.02 (dd, J=7.5, 1.5 Гц, 1H), 6.53 (dd, J=7.5, 1.6 Гц, 1Н), 5.22 (s, 2Н), 4.12 (dt, J=12.5, 7.1 Гц, 2Н), 3.79 (s, 3Н), 3.12 (dt, J=12.5, 7.1 Гц, 2Н), 2.75 (q, J=6.9 Гц, 1Н), 2.66 (s, 1Н), 2.60 (s, 1Н), 2.02-1.84 (m, 3Н), 1.65 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.96 (td, J=7.0, 5.0 Гц, 1Н), 0.72 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 436.23 [М+Н]+.
Пример 55 Бензил 4-фтор-4-(((транс-2-(индолин-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А55)
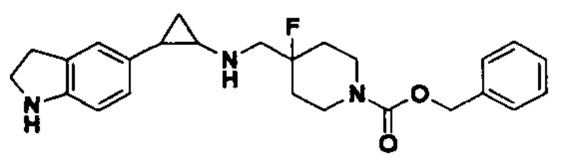
транс-2-фенилциклопропиламин был заменен на транс-2-(индолин-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А55 были теми же, что и в примере 1 (выход: 55%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 6.95 (d, J=2.0 Гц, 1Н), 6.69 (dd, J=7.4, 2.0 Гц, 1H), 6.47 (d, J=7.5 Гц, 1H), 5.83 (s, 1H), 5.22 (s, 2H), 4.02 (dt, J=12.5, 7.2 Гц, 2H), 3.65-3.43 (m, 2H), 3.28 (dt, J=12.5, 7.1 Гц, 2H), 2.88 (ddd, J=18.5, 10.3, 8.0 Гц, 1H), 2.77-2.57 (m, 4H), 2.04-1.82 (m, 3H), 1.63 (ddt, J=25.1, 13.2, 7.1 Гц, 2H), 0.95 (td, J=7.0, 5.1 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей):424.23 [М+Н]+.
Пример 56 Бензил 4-фтор-4-(((транс-2-(1-(фенилсульфонил)индолин-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А56)

транс-2-фенилциклопропиламин был заменен на транс-2-(1-фенилсульфонил)индолин-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А56 были теми же, что и в примере 1 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.68-7.51 (m, 5Н), 7.39-7.26 (m, 5Н), 7.17 (d, J=2.0 Гц, 1Н), 6.75 (dd, J=7.5, 1.9 Гц, 1H), 6.63 (d, J=7.5 Гц, 1H), 5.22 (s, 2H), 4.43-4.22 (m, 2H), 4.19-4.09 (m, 1H), 3.99 (dt, J=12.5, 7.1 Гц, 1H), 3.32 (dt, J=12.5, 7.1 Гц, 1H), 3.08 (dt, J=12.5, 7.1 Гц, 1H), 2.97 (q, J=6.9 Гц, 1H), 2.92-2.83 (m, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 2.09-1.72 (m, 4H), 1.63 (ddt, J=25.1, 13.2, 7.1 Гц, 1H), 0.90 (td, J=7.0, 5.0 Гц, 1H), 0.69 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 564.23 [М+Н]+.
Пример 57 Бензил 4-фтор-4-(((транс-2-(1Н-индол-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А57)

транс-2-фенилциклопропиламин был заменен на транс-2-(1Н-индол-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А57 были теми же, что и в примере 1 (выход: 61%). 1Н ЯМР (400 МГц, DMSO-d6) δ 10.75 (s, 1Н), 7.58 (dd, J=7.4, 1.5 Гц, 1Н), 7.39-7.26 (m, 3Н), 7.32 (s, 3Н), 7.17 (s, 1Н), 7.02 (dtd, J=32.8, 7.4, 1.5 Гц, 2Н), 5.22 (s, 2Н), 3.89-3.71 (m, 3Н), 2.89 (dt, J=12.5, 7.2 Гц, 2Н), 2.66 (s, 1H), 2.60 (s, 1H), 1.88 (ddt, J=25.1, 12.3, 7.1 Гц, 2Н), 1.72-1.46 (m, 3Н), 0.71 (td, J=6.9, 5.0 Гц, 1Н), 0.46 (td, J=7.0, 5.1 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 422.22 [М+Н]+.
Пример 58 Бензил 4-фтор-4-(((транс-2-((имидазо[1,2-α]пиридин-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А58)
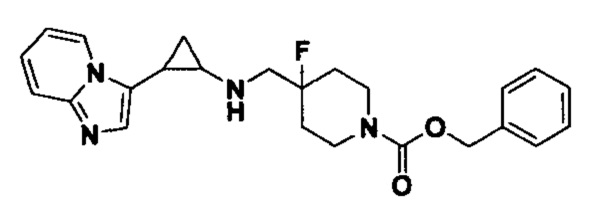
транс-2-фенилциклопропиламин был заменен на транс-2-(имидазо[1,2-α]пиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А58 были теми же, что и в примере 1 (выход: 51%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.47 (dd, J=7.4, 1.5 Гц, 1Н), 7.89 (s, 1H), 7.47 (dd, J=7.5, 1.6 Гц, 1H), 7.39-7.26 (m, 5H), 7.21 (td, J=7.5, 1.5 Гц, 1H), 6.85 (td, J=7.4, 1.4 Гц, 1H), 5.22 (s, 2H), 3.83 (dt, J=12.4, 7.2 Гц, 2H), 3.76 (q, J=7.0 Гц, 1H), 2.89 (dt, J=12.5, 7.2 Гц, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 1.88 (ddt, J=25.1, 12.3, 7.1 Гц, 2H), 1.72-1.46 (m, 3H), 0.82 (td, J=7.0, 4.9 Гц, 1H), 0.57 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 422.21 [М+Н]+.
Пример 59 Бензил 4-фтор-4-(((транс-2-(2,3-дигидробензофуран-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А59)
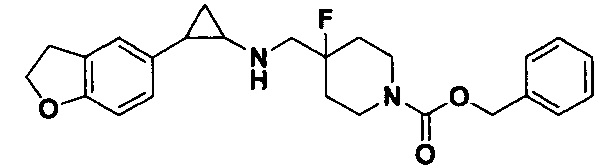
транс-2-фенилциклопропиламин был заменен на транс-2-(2,3-дигидробензофуран-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А59 были теми же, что и в примере 1 (выход: 65%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.05 (d, J=2.0 Гц, 1Н), 6.96 (dd, J=7.5, 2.1 Гц, 1H), 6.78 (d, J=7.5 Гц, 1H), 5.22 (s, 2H), 4.47-4.37 (m, 2H), 4.03 (dt, J=12.5, 7.1 Гц, 2H), 3.29 (dt, J=12.5, 7.1 Гц, 2H), 2.99 (ddd, J=18.6, 6.2, 2.5 Гц, 1H), 2.77-2.57 (m, 4H), 2.04-1.84 (m, 3H), 1.63 (ddt, J=25.1, 13.2, 7.1 Гц, 2H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 425.22 [М+Н]+.
Пример 60 Бензил 4-фтор-4-(((транс-2-(хроман-6-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А60)

транс-2-фенилциклопропиламин был заменен на транс-2-(хроман-6-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А60 были теми же, что и в примере 1 (выход: 66%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.04-6.98 (m, 1Н), 6.96-6.89 (m, 1H), 6.77 (d, J=7.4 Гц, 1H), 5.22 (s, 2H), 4.08-3.91 (m, 3H), 3.94-3.84 (m, 1H), 3.28 (dt, J=12.5, 7.1 Гц, 2H), 2.77-2.64 (m, 3H), 2.60 (s, 1H), 2.50-2.36 (m, 1H), 2.04-1.74 (m, 5H), 1.73-1.54 (m, 2H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 4.9 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 439.23 [М+Н]+.
Пример 61 Бензил 4-фтор-4-(((транс-2-(2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)ццклопропил)амино)метил)пиперидин-1-карбоксилат (А61)

транс-2-фенилциклопропиламин был заменен на транс-2-(2-оксо-1,2,3,4-тетрагидрохинолин-6-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А61 были теми же, что и в примере 1 (выход: 69%). 1Н ЯМР (400 МГц, DMSO-d6) δ 10.01 (s, 1Н), 7.39-7.26 (m, 5H), 7.20 (d, J=2.1 Гц, 1H), 7.11 (dd, J=7.5, 1.9 Гц, 1H), 6.98 (d, J=7.5 Гц, 1H), 5.22 (s, 2H), 4.14 (dt, J=12.5, 7.1 Гц, 2H), 3.31-3.07 (m, 4H), 2.89-2.70 (m, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 2.48 (ddd, J=15.2, 4.4, 1.7 Гц, 1H), 2.11 (ddt, J=25.1, 13.2, 7.2 Гц, 2H), 1.89 (q, J=7.0 Гц, 1H), 1.67 (ddt, J=25.3, 13.2, 7.2 Гц, 2H), 0.96 (td, J=6.9, 5.0 Гц, 1H), 0.72 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 452.23 [М+Н]+.
Пример 62 Бензил 4-фтор-4-(((транс-2-(тиофен-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А62)
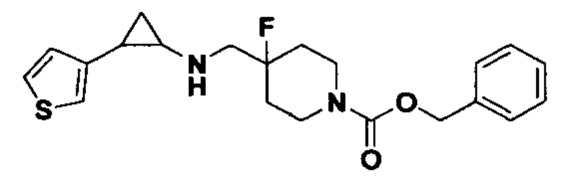
транс-2-фенилпропиламин был заменен на транс-2-(тиофен-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А62 были теми же, что и в примере 1 (выход: 75%). 1H ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.22 (d, J=7.5 Гц, 1Н), 6.95-6.86 (m, 2H), 5.22 (s, 2H), 3.83 (dt, J=12.4, 7.2 Гц, 2H), 3.76 (q, J=7.0 Гц, 1H), 2.89 (dt, J=12.5, 7.2 Гц, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 1.88 (ddt, J=25.1, 12.3, 7.1 Гц, 2H), 1.63 (ddt, J=25.3, 12.5, 7.1 Гц, 2H), 1.51 (q, J=7.0 Гц, 1H), 0.69 (td, J=6.9, 5.0 Гц, 1H), 0.44 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 389.16 [М+Н]+.
Пример 63 Бензил 4-фтор-4-(((транс-2-(фуран-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А63)
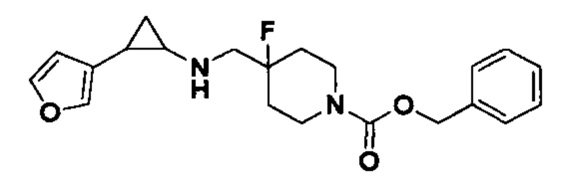
транс-2-фенилциклопропиламин был заменен на транс-2-(фуран-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А63 были теми же, что и в примере 1 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 6Н), 7.11 (d, J=1.5 Гц, 1H), 6.13 (dd, J=7.5, 1.5 Гц, 1H), 5.22 (s, 2H), 3.83 (dt, J=12.5, 7.2 Гц, 2H), 3.76 (q, J=7.0 Гц, 1H), 2.89 (dt, J=12.4, 7.2 Гц, 2H), 2.66 (s, 1H), 2.60 (s, 1H), 1.88 (ddt, J=25.1, 12.3,7.1 Гц, 2H), 1.63 (ddt, J=25.3, 12.5, 7.1 Гц, 2H), 1.51 (q, J=7.0 Гц, 1H), 0.78 (td, J=7.0, 5.0 Гц, 1H), 0.53 (td, J=6.9, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 373.18 [М+Н]+.
Пример 64 Бензил 4-фтор-4-(((транс-2-(тиазол-2-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А64)

транс-2-фенилциклопропиламин был заменен на транс-2-(тиазол-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А64 были теми же, что и в примере 1 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.69 (d, J=7.5 Гц, 1Н), 7.58 (d, J=7.5 Гц, 1H), 7.39-7.26 (m, 5H), 5.22 (s, 2H), 3.83 (dt, J=12.4, 7.2 Гц, 2H), 3.76 (q, J=7.0 Гц, 1H), 2.89 (dt, J=12.5, 7.2 Гц, 2H), 2.66 (s, 1H), 2.60 (s, 1Н), 1.88 (ddt, J=25.1, 12.3, 7.1 Гц, 2H), 1.63 (ddt, J=25.3, 12.5, 7.1 Гц, 2H), 1.51 (q, J=7.0 Гц, 1H), 0.78 (td, J=7.0, 4.9 Гц, 1H), 0.53 (td, J=6.9, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 390.16 [М+Н]+.
Пример 65 Бензил 4-фтор-4-((транс-2-(4-фторфенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А65)

транс-2-фенилциклопропиламин был заменен на транс-2-(4-фторфенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А65 были теми же, что и в примере 1 (выход: 78%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.16 (ddd, J=7.0, 5.8, 1.1 Гц, 2Н), 7.12-7.03 (m, 2Н), 5.22 (s, 2Н), 4.04 (dt, J=12.5, 7.1 Гц, 2Н), 3.25 (dt, J=12.5, 7.1 Гц, 2Н), 2.75-2.64 (m, 2Н), 2.00-1.82 (m, 3Н), 1.64 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.95 (td, J=7.0, 4.9 Гц, 1Н), 0.71 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 401.20 [М+Н]+.
Пример 66 Бензил 4-фтор-4-((транс-2-(4-цианофенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А66)

транс-2-фенилциклопропиламин был заменен на транс-2-(4-цианофенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А66 были теми же, что и в примере 1 (выход: 72%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.73-7.66 (m, 2Н), 7.33 (tdd, J=8.7, 4.2, 2.8 Гц, 7Н), 5.22 (s, 2Н), 4.09 (dt, J=12.4, 7.1 Гц, 2Н), 3.23 (dt, J=12.4, 7.1 Гц, 2Н), 2.73-2.64 (m, 2Н), 2.01-1.83 (m, 3Н), 1.67 (ddt, J=25.3, 13.2, 7.2 Гц, 2Н), 0.95 (td, J=7.0, 4.9 Гц, 1H), 0.69 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 408.20 [М+Н]+.
Пример 67 Бензил 4-фтор-4-((транс-2-(4-метоксифенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А67)
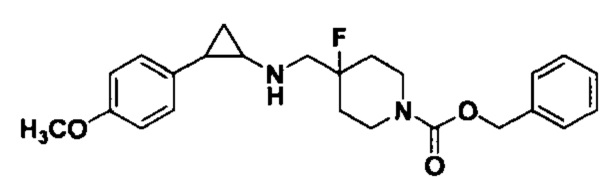
транс-2-фенилциклопропиламин был заменен на транс-2-(4-метоксифенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А67 были теми же, что и в примере 1 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.10-7.03 (m, 2Н), 6.95-6.88 (m, 2Н), 5.22 (s, 2Н), 4.03 (dt, J=12.5, 7.1 Гц, 2Н), 3.79 (s, 3Н), 3.28 (dt, J=12.5, 7.2 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.04-1.82 (m, 3Н), 1.63 (ddt, J=25.1, 13.2, 7.1 Гц, 2Н), 0.95 (td, J=7.0, 5.1 Гц, 1Н), 0.71 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 413.22 [М+Н]+.
Пример 68 Бензил 4-фтор-4-((транс-2-(2-ацетилфенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А68)

транс-2-фенилциклопропиламин был заменен на транс-2-(2-ацетилфенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А68 были теми же, что и в примере 1 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.66 (dd, J=7.5, 2.0 Гц, 1H), 7.46 (td, J=7.5, 2.1 Гц, 1H), 7.39-7.26 (m, 5Н), 7.27-7.12 (m, 2Н), 5.22 (s, 2Н), 4.04 (dt, J=12.6, 7.2 Гц, 2Н), 3.24 (dt, J=12.5, 7.0 Гц, 2Н), 2.73-2.64 (m, 2Н), 2.60 (s, 1Н), 2.50 (s, 3Н), 2.08-1.82 (m, 3Н), 1.72-1.54 (m, 2Н), 0.85 (td, J=7.0, 5.0 Гц, 1Н), 0.53 (td, J=7.0, 5.0 Гц, 1Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 425.22 [М+Н]+.
Пример 69 Бензил 4-фтор-4-((транс-2-([1,1'-бифенил]-4-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А69)
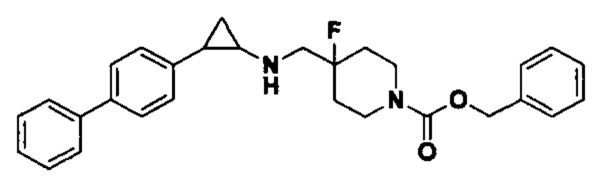
транс-2-фенилциклопропиламин был заменен на транс-2-([1,1'-бифенил]-4-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А69 были теми же, что и в примере 1 (выход: 68%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.70 (dd, J=7.6, 2.0 Гц, 2H), 7.54-7.37 (m, 5Н), 7.37-7.26 (m, 7Н), 5.22 (s, 2Н), 4.04 (dt, J=12.4, 7.1 Гц, 2H), 3.29 (dt, J=12.5, 7.1 Гц, 2H), 2.75 (q, J=6.9 Гц, 1H), 2.66 (s, 1H), 2.60 (s, 1H), 2.04-1.85 (m, 3H), 1.73-1.55 (m, 2H), 0.96 (td, J=7.0, 4.9 Гц, 1H), 0.72 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 459.24 [М+Н]+.
Пример 70 Бензил 4-фтор-4-((транс-2-(4-метилфенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А70)
транс-2-фенилциклопропиламин был заменен на транс-2-(4-метилфенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А70 были теми же, что и в примере 1 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.12-7.04 (m, 2Н), 7.06-6.98 (m, 2Н), 5.22 (s, 2Н), 4.03 (dt, J=12.6, 7.2 Гц, 2Н), 3.29 (dt, J=12.5, 7.1 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.21 (s, 3Н), 2.04-1.84 (m, 3Н), 1.63 (ddt, J=25.1, 13.2, 7.0 Гц, 2Н), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 71 Бензил 4-фтор-4-((транс-2-(4-нитрофенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А71)
транс-2-фенилциклопропиламин был заменен на транс-2-(4-нитрофенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А71 были теми же, что и в примере 1 (выход: 72%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.22-8.13 (m, 2Н), 7.39-7.26 (m, 7Н), 5.22 (s, 2Н), 3.95 (dt, J=12.6, 7.2 Гц, 2Н), 3.19 (dt, J=12.4, 7.1 Гц, 2Н), 2.81 (q, J=7.0 Гц, 1Н), 2.66 (s, 1H), 2.60 (s, 1H), 1.96-1.72 (m, 3H), 1.56 (ddt, J=25.3, 13.7, 7.1 Гц, 2H), 0.95 (td, J=7.0, 4.9 Гц, 1H), 0.70 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 428.19 [М+Н]+.
Пример 72
4-(транс-2-((1-((бензилокси))карбонил)-4-фторпиперидин-4-ил)метил)амино)циклопропил)бензойная кислота (А72)
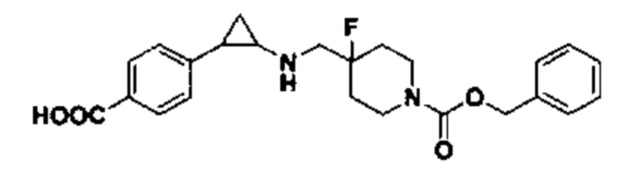
транс-2-фенилциклопропиламин был заменен на 4-(транс-2-аминоциклопропил)бензойная кислота, тогда как другие исходные материалы, реагенты и способ получения продукта А72 были теми же, что и в примере 1 (выход: 60%). 1H ЯМР (400 МГц, DMSO-d6) δ 12.91 (s, 1Н), 7.87-7.81 (m, 2H), 7.39-7.26 (m, 5H), 7.22 (dd, J=7.4,1.1 Гц, 2H), 5.22 (s, 2H), 4.03 (dt, J=12.4, 7.1 Гц, 2H), 3.29 (dt, J=12.5, 7.1 Гц, 2H), 2.77-2.64 (m, 2H), 2.60 (s, 1H), 2.04-1.86 (m, 3H), 1.64 (ddt, J=25.1, 13.2, 7.1 Гц, 2H), 0.97 (td, J=7.0, 4.9 Гц, 1H), 0.72 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 427.20 [М+Н]+.
Пример 73 Бензил 4-фтор-4-((транс-2-(3,4-дифторфенил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А73)
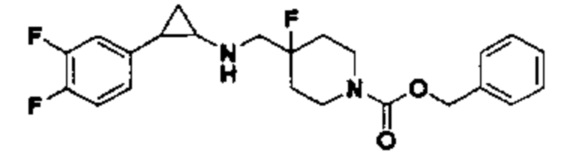
транс-2-фенилциклопропиламин был заменен на транс-2-(3,4-дифторфенил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А73 были теми же, что и в примере 1 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.22 (m, 6Н), 7.01-6.88 (m, 2Н), 5.22 (s, 2Н), 4.03 (dt, J=12.4, 7.0 Гц, 2Н), 3.29 (dt, J=12.6, 7.2 Гц, 2Н), 2.77-2.64 (m, 2Н), 2.03-1.85 (m, 3H), 1.64 (ddt, J=25.3, 13.7, 7.1 Гц, 2Н), 0.98 (td, J=6.9, 5.0 Гц, 1Н), 0.72 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 419.19 [М+Н]+.
Пример 74 Бензил 4-фтор-4-((2,2,2-трифтор-N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-карбоксилат
(А74)
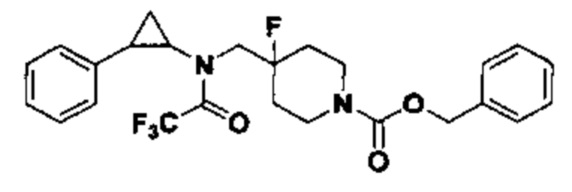
Трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат был заменен на продукт А1, полученный в примере 1, тогда как другие исходные материалы, реагенты и способ получения продукта А74 были теми же, что и в примере 5.1 (выход: 80%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 3.99 (dt, J=12.4, 7.1 Гц, 2Н), 3.31 (s, 1Н), 3.25 (s, 1H), 3.16 (dt, J=12.5, 7.1 Гц, 2H), 2.85 (q, J=7.0 Гц, 1H), 2.10-1.86 (m, 3H), 1.67-1.48 (m, 2H), 1.04 (td, J=7.0, 4.9 Гц, 1H), 0.76 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 479.19 [М+Н]+.
Пример 75 Бензил 4-фтор-4-(метил(транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А75)

Транс-2-фенилциклопропиламин был заменен на N-метил-транс-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А75 были теми же, что и в примере 1 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 4.02 (dt, J=12.5, 7.1 Гц, 2Н), 3.24 (dt, J=12.5, 7.1 Гц, 2Н), 2.67 (q, J=7.0 Гц, 1H), 2.40 (d, J=6.3 Гц, 4Н), 1.99-1.80 (m, 3H), 1.62 (ddt, J=25.1, 13.2, 7.0 Гц, 2Н), 0.94 (td, J=6.9, 5.0 Гц, 1Н), 0.70 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 76 Бензил 4-фтор-4-(1-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А76)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 4-ацетил-4-фторпиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А76 были теми же, что и в примере 1 (выход: 48%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 4.02 (dt, J=12.5, 7.1 Гц, 2Н), 3.30 (dt, J=12.5, 7.1 Гц, 2Н), 3.02 (dq, J=25.1, 6.8 Гц, 1Н), 2.80 (q, J=7.0 Гц, 1Н), 2.11 (s, 1H), 2.07-1.86 (m, 3H), 1.65 (ddt, J=25.1, 13.2, 7.0 Гц, 2H), 1.10 (d, J=6.7 Гц, 3H), 0.96 (td, J=7.0, 5.0 Гц, 1H), 0.71 (td, J=7.0, 5.1 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 77 Бензил 4-фтор-4-((N-(транс-2-фенилциклопропил)ацетамидо)метил)пиперидин-1-карбоксилат (А77)

Трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат был заменен на продукт А1, полученный в примере 1, а трифторуксусный ангидрид был заменен на уксусный ангидрид, тогда как другие исходные материалы, реагенты и способ получения продукта А77 были теми же, что и в примере 5.1 (выход: 84%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 4.09 (dt, J=12.6, 7.2 Гц, 2Н), 3.42-3.29 (m,3H), 3.25 (s, 1Н), 2.78 (q, J=7.0 Гц, 1H), 2.08 (s, 3H), 1.96-1.70 (m, 3H), 1.55 (ddt, J=25.1, 13.2, 7.1 Гц, 2H), 0.99 (td, J=7.0, 5.0 Гц, 1H), 0.69 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 425.22 [М+Н]+.
Пример 78 Бензил 3-фтор-3-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А78)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 3-фтор-3-формилазетидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А78 были теми же, что и в примере 1 (выход: 68%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 4.16 (d, J=11.3 Гц, 1H), 4.09 (d, J=11.1 Гц, 1H), 3.85 (d, J=11.1 Гц, 1Н), 3.79 (d, J=11.2 Гц, 1H), 2.90 (q, J=7.0 Гц, 1H), 2.66 (s, 1Н), 2.60 (s, 1H), 1.91 (q, J=6.9 Гц, 1H), 0.95 (td, J=7.0, 5.0 Гц, 1Н), 0.72 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 355.17 [М+Н]+.
Пример 79 Бензил 2-фтор-2-((транс-2-фенилциклопропил)амино)метил)пиперидин-4-карбоксилат (А79)
Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 2-фтор-2-формилморфолин-4-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения продукта А79 были теми же, что и в примере 1 (выход: 60%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.41 (d, J=1.2 Гц, 2Н), 4.10 (dd, J=25.2, 12.6 Гц, 1Н), 3.86-3.72 (m, 1H), 3.74-3.61 (m, 2Н), 3.51-3.36 (m, 2Н), 3.15 (dd, J=25.2, 12.4 Гц, 1H), 2.88 (dd, J=25.1, 12.5 Гц, 1Н), 2.78 (q, J=7.0 Гц, 1H), 1.88 (q, J=7.0 Гц, 1H), 1.55 (s, 1H), 0.95 (td, J=7.0, 5.0 Гц, 1H), 0.69 (td, J=7.0, 4.9 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 385.18 [М+Н]+.
Пример 80 Бензил 4-фтор-4-(2-(транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А80)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 4-фтор-4-(2-оксоэтил)пиперидин-1-карбоксилат, оставшиеся исходные материалы, реагенты и способ получения продукта А80 были теми же, что и в примере 1 (выход: 78%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.39-7.26 (m, 5Н), 7.26-7.11 (m, 5Н), 5.22 (s, 2Н), 4.11 (dt, J=12.4, 7.0 Гц, 2Н),3.11 (tt, J=12.0, 7.4 Гц, 3H), 2.97 (dt, J=12.3, 7.8 Гц, 1H), 2.71 (q, J=7.0 Гц, 1H), 1.96-1.77 (m, 3H), 1.72-1.41 (m, 4Н), 0.89 (td, J=7.0, 4.9 Гц, 1Н), 0.64 (td, J=7.0, 4.9 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 397.22 [М+Н]+.
Пример 81 Бензил 3-фтор-3-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А81)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на бензил 3-фтор-3-формилпиперидин-1-карбоксилат, оставшиеся исходные материалы, реагенты и способ получения продукта А81 были теми же, что и в примере 1 (выход: 77%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.32 (dq, J=6.0, 3.2 Гц, 5Н), 7.26-7.11 (m, 5Н), 6.44 (d, J=12.3 Гц, 1H), 4.63 (d, J=12.5 Гц, 1H), 4.11 (dd, J=25.1, 12.5 Гц, 1H), 3.76 (d, J=12.5 Гц, 1H), 3.38-3.18 (m, 2H), 3.02 (dd, J=25.2, 12.4 Гц, 1H), 2.75 (dd, J=25.3, 12.5 Гц, 1H), 2.74 (s, 1H), 1.98-1.80 (m, 3H), 1.70 (d, J=13.2 Гц, 1H), 1.57 (dd, J=25.1, 13.2 Гц, 1H), 0.94 (s, 1H), 0.70 (s, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 383.21 [М+Н]+.
Пример 82 N-((4-фтор-1-(фенилсульфонил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А82)

3-фенилпропионил хлорид был заменен на бензолсульфонил хлорид, тогда как другие исходные материалы, реагенты и способ получения продукта А82 были теми же, что и в примере 8 (выход: 74%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.92-7.84 (m, 2Н), 7.63 (hept, J=2.5 Гц, 3H), 7.26-7.11 (m, 5Н), 3.79 (dt, J=12.4, 7.1 Гц, 2Н), 3.35 (dt, J=12.4, 7.2 Гц, 2Н), 2.72-2.64 (m, 2Н), 1.75 (ddt, J=25.1, 13.1, 7.0 Гц, 2Н), 1.67-1.49 (m, 3H), 0.89 (td, J=7.0, 5.0 Гц, 1H), 0.63 (td, J=6.9, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 389.16 [М+Н]+.
Пример 83 2-(4-фтор-4-(((транс-2-фенилциклогексил)амино)метил)пиперидин-1-ил)этанол (А83)

Бромметилбензол был заменен на 2-бромэтанол, тогда как другие исходные материалы, реагенты и способ получения продукта А83 были теми же, что и в примере 6 (выход: 55%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.25 (t, J=5.0 Гц, 1Н), 3.53 (td, J=7.2, 5.0 Гц, 2H), 3.08 (dt, J=12.5, 7.2 Гц, 2H), 2.74-2.64 (m, 2H), 2.60 (s, 1H), 2.49 (dt, J=12.2, 7.2 Гц, 4H), 2.00-1.89 (m, 1H), 1.94-1.82 (m, 2H), 1.42 (ddt, J=25.1, 13.2, 7.0 Гц, 2H), 0.95 (td, J=6.9, 5.0 Гц, 1H), 0.68 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 293.20 [М+Н]+.
Пример 84 N-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексил)ацетамид (А84)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на N-(4-фтор-4-формилциклогексил)ацетамид, тогда как другие исходные материалы, реагенты и способ получения продукта А84 были теми же, что и в примере 1 (выход: 65%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 5.49 (s, 1Н), 3.44 (р, J=7.0 Гц, 1Н), 2.72-2.61 (m, 2Н), 2.60 (s, 1Н), 2.33-2.18 (m, 2Н), 1.99 (s, 3H), 1.95-1.75 (m, 3H), 1.77-1.66 (m, 2Н), 1.67 (dd, J=5.8, 4.3 Гц, 1Н), 1.61 (dt, J=12.3, 6.8 Гц, 1Н), 0.99 (td, J=7.0, 5.0 Гц, 1H), 0.66 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 305.21 [М+Н]+.
Пример 85
N-бензил-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексиламин (А85)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на 4-(6ензиламино)-1-фторциклогексан-1-карбальдегид, тогда как другие исходные материалы, реагенты и способ получения продукта А85 были теми же, что и в примере 1 (выход: 72%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.37-7.11 (m, 10Н), 4.09 (s, 2Н), 2.72-2.57 (m, 3H), 2.09-1.98 (m, 2Н), 1.98-1.83 (m, 5Н), 1.67-1.49 (m, 4Н), 0.99 (td, J=7.0, 4.9 Гц, 1Н), 0.66 (td, J=6.9, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 353.23 [М+Н]+.
Пример 86 N-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексил)анилин (А86)

Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на 1-фтор-4-(анилино)циклогексан-1-карбальдегид, тогда как другие исходные материалы, реагенты и способ получения продукта А86 были теми же, что и в примере 1 (выход: 64%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.12 (m, 5Н), 7.17-7.03 (m, 2Н), 6.74-6.60 (m, 3H), 6.26 (s, 1H), 3.06 (р, J=7.0 Гц, 1Н), 2.76-2.64 (m, 2H), 2.60 (s, 1H), 1.97-1.71 (m, 5H), 1.53 (ddt, J=25.3, 11.6, 6.4 Гц, 2H), 1.42 (dq, J=12.7, 6.9 Гц, 2H), 0.95 (td, J=6.9, 5.0 Гц, 1H), 0.68 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 339.22 [М+Н]+.
Пример 87
N-(4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексил)бензолсульфонамид (А87)
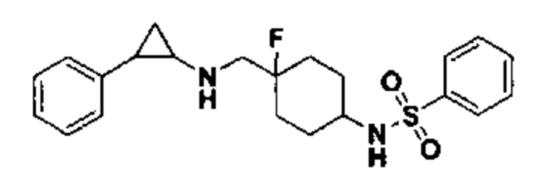
Бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на N-(4-фтор-4-формилциклогексил)бензолсульфонамид, тогда как другие исходные материалы, реагенты и способ получения продукта А87 были теми же, что и в примере 1 (выход: 68%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.86-7.77 (m, 2Н), 7.68-7.55 (m, 4Н), 7.26-7.11 (m, 5Н), 3.05 (р, J=7.0 Гц, 1Н), 2.75 (q, J=7.0 Гц, 1H), 2.66 (s, 1Н), 2.60 (s, 1H), 1.93-1.74 (m, 5Н), 1.68-1.57 (m, 1Н), 1.62-1.44 (m, 3H), 0.94 (td, J=7.0, 5.1 Гц, 1H), 0.67 (td, J=6.9, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 403.18 [М+Н]+.
Пример 88 (1r,4r)-4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)циклогексиламин (А88)

Трет-бутил 4-фтор-4-формилпиперидин-1-карбоксилат заменяли на трет-бутил ((1r,4r)-4-фтор-4-формилциклогексил)карбамат, тогда как другие исходные материалы, реагенты и способ получения продукта А88 были теми же, что и в примере 2 (выход: 72%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 2.83 (р, J=7.0 Гц, 1H), 2.76-2.64 (m, 2Н), 2.60 (s, 1H), 1.91-1.69 (m, 5Н), 1.62-1.44 (m, 2Н), 1.47-1.32 (m, 2Н), 1.30 (s, 2Н), 0.90 (td, J=6.9, 5.0 Гц, 1Н), 0.67 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 263.18 [М+Н]+.
Пример 89 (1-метилпиперидин-4-ил)метил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А89)

3-фенилпропионил хлорид был заменен (1-метилпиперидин-4-ил)метил хлороформат, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А89 были теми же, что и в примерах 8.1 и 5.4 (выход: 66%). 1Н ЯМР (400 МГц, MeOD) δ 7.33 (tt, J=7.9, 1.5 Гц, 2Н), 7.30-7.22 (m, 1H), 7.26-7.19 (m, 2Н), 4.08 (d, J=15.2 Гц, 4Н), 3.62-3.51 (m, 4Н), 3.29-3.14 (m, 2Н), 3.08 (р, J=4.2 Гц, 2Н), 3.03 (dd, J=13.0, 2.5 Гц, 1Н), 2.88 (s, 3H), 2.64 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.09-1.95 (m, 5Н), 1.94-1.76 (m, 2Н), 1.76-1.58 (m, 3H), 1.41 (dt, J=7.9, 6.7 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 404.26 [М+Н]+.
Пример 90 (1-бензилпиперидин-4-ил)метил 4-фтор-4-(((транс-2-фенилциклопроил)амино)метил)пиперидин-1-карбоксилат (А90)

3-фенилпропионил хлорид был заменен на (1-бензилпиперидин-4-ил)метил хлороформат, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А90 были теми же, что и в примерах 8.1 и 5.4 (выход: 57%). 1Н ЯМР (400 МГц, MeOD) δ 7.57 (dd, J=6.7,2.9 Гц, 2Н), 7.52-7.46 (m, 3H), 7.31 (tt, J=8.3, 1.6 Гц, 2Н), 7.26-7.22 (m, 1H), 7.22-7.17 (m, 2Н), 4.32 (s, 2Н), 4.06 (d, J=16.2 Гц, 4Н), 3.56 (s, 1H), 3.54-3.45 (m, 3H), 3.28-2.95 (m, 5H), 2.61 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.04-1.92 (m, 5H), 1.91-1.75 (m, 2H), 1.74-1.64 (m, 2H), 1.60 (ddd, J=10.4, 6.8, 4.4 Гц, 1H), 1.39 (dt, J=7.8, 6.7 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 478.29 [М+Н]+.
Пример 91 4-((4-(((4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбонил)оксо)метил)пиперидин-1-ил)метил)бензойная кислота (А91)

Трет-бутил 4-фтор-4-((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат был заменен на (1-(трет-бутоксикарбонил)пиперидин-4-ил)метил
4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат, тогда как другие исходные материалы, реагенты и способ получения хлористоводородной соли продукта А91 были теми же, что и в примере 5 (выход 35%). 1Н ЯМР (500 МГц, D2O) δ 7.98 (d, J=8.2 Гц, 2Н), 7.51 (d, J=8.1 Гц, 2Н), 7.28 (t, J=7.5 Гц, 2Н), 7.24-7.19 (m, 1H), 7.12 (d, J=7.2 Гц, 2Н), 4.27 (s, 2Н), 3.91-3.88 (m, 4Н), 3.48-3.39 (m, 4Н), 3.15-3.03 (m, 2Н), 3.00-2.90 (m, 3H), 2.50 (ddd, J=10.4, 6.7, 3.6 Гц, 1H), 1.99-1.81 (m, 5Н), 1.69 (td, J=13.3, 5.0 Гц, 1Н), 1.62 (td, J=13.3, 5.1 Гц, 1Н), 1.48 (ddd, J=11.0, 7.0, 4.4 Гц, 1Н), 1.45-1.37 (m, 2Н), 1.34 (q, J=7.2 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 524.28 [М+Н]+.
Пример 92 N-((4-фтор-1-(пиперидин-4-илметил)сульфонил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А92)
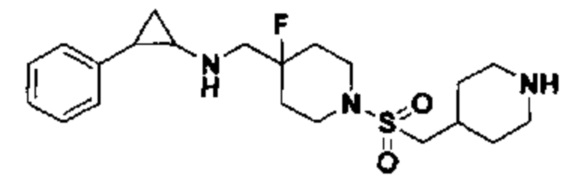
3-фенилпропионил хлорид был заменен на трет-бутил 4-((хлоросульфонил)метил)пиперидин-1-карбоновую кислоту, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А92 были теми же, что и в примерах 8.1 и 5.4 (выход: 68%). 1Н ЯМР (500 МГц, MeOD) δ 7.31 (t, J=7.5 Гц, 2Н), 7.24 (d, J=7.5 Гц, 1Н), 7.20 (d, J=7.3 Гц, 2H), 3.79-3.71 (m, 2H), 3.58 (d, J=20.1 Гц, 2H), 3.51 (dt, J=12.6, 3.4 Гц, 3H), 3.36-3.23 (m, 4H), 3.16-2.99 (m, 3H), 2.62 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.30 (dd, J=14.7, 3.7 Гц, 2H), 2.10-1.86 (m, 6H), 1.61 (ddd, J=10.8, 6.8, 4.4 Гц, 1H), 1.39 (q, J=7.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 410.22 [М+Н]+.
Пример 93 N-((4-фтор-1-(метилсульфонил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А93)

3-фенилпропионил хлорид был заменен на метилсульфонил хлорид, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А93 были теми же, что и в примерах 8.1 и 5.4 (выход: 80%). 1Н ЯМР (400 МГц, DMSO-d6) δ 9.71 (s, 2Н), 7.33-7.28 (m, 2Н), 7.25-7.21 (m, 1Н), 7.21-7.17 (m, 2H), 3.54-3.42 (m, 4H), 2.99-2.93 (m, 3H), 2.92 (s, 3H), 2.64 (ddd, J=10.1, 6.4, 3.5 Гц, 1H), 2.14-2.04 (m, 2H), 1.97-1.87 (m, 1H), 1.87-1.77 (m, 1H), 1.66 (ddd, J=10.4, 6.1, 4.4 Гц, 1H), 1.27 (dt, J=7.7, 6.3 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 327.15 [М+Н]+.
Пример 94 Азетидин-3-илметил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А94)
3-фенилпропионил хлорид был заменен на трет-бутил 3-((хлороформил)оксо)метил)азетидин-1-карбоновую кислоту, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А94 были теми же, что и в примерах 8.1 и 5.4 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.27-7.10 (m, 5Н), 4.13 (dt, J=12.5, 7.1 Гц, 2Н), 3.88 (d, J=7.0 Гц, 2Н), 3.43 (dd, J=11.1, 7.0 Гц, 2Н), 3.15-3.02 (m, 4Н), 2.71-2.56 (m, 4Н), 2.01-1.86 (m, 3H), 1.75-1.58 (m, 2Н), 0.99 (td, J=7.0, 5.1 Гц, 1H), 0.67 (td, J=7.0, 5.0 Гц, 1Н).; масс-спектрометр с низкой разрешающей способностью (электроспрей): 362.22 [М+Н]+.
Пример 95 Пиперидин-4-ил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат (А95)

3-фенилпропионил хлорид был заменен на трет-бутил 4-((хлороформил)оксо)пиперидин-1-карбоновую кислоту, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А95 были теми же, что и в примерах 8.1 и 5.4 (выход: 65%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.26-7.11 (m, 5Н), 4.82 (р, J=7.0 Гц, 1Н), 4.13 (dt, J=12.5, 7.1 Гц, 2Н), 3.11 (dt, J=12.5, 7.1 Гц, 2Н), 2.90 (dt, J=12.4, 7.1 Гц, 2Н), 2.72-2.56 (m, 5Н), 2.02-1.84 (m, 3H), 1.77-1.53 (m, 4Н), 1.29 (dq, J=13.9, 7.1 Гц, 2Н), 0.99 (td, J=7.0, 5.0 Гц, 1Н), 0.67 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 376.23 [М+Н]+.
Пример 96 4-((4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензонитрил (А96)

Бромметилбензол был заменен на 4-(бромметил)бензонитрил, тогда как другие исходные материалы, реагенты и способ получения продукта А96 были теми же, что и в примере 6 (выход: 62%). 1Н ЯМР (400 МГц, MeOD) δ 7.91-7.83 (m, 4Н), 7.35-7.30 (m, 2Н), 7.28-7.24 (m, 1Н), 7.24-7.19 (m, 2H), 4.52 (s, 2H), 3.67 (d, J=20.1 Гц, 2H), 3.54 (d, J=12.4 Гц, 2H), 3.44-3.34 (m, 2H), 3.10 (dt, J=7.8,4.0 Гц, 1H), 2.70-2.60 (m, 1H), 2.40-2.20 (m, 4H), 1.64 (dt, J=11.0, 6.0 Гц, 1H), 1.42 (dt, J=7.8, 6.8 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 364.21 [М+Н]+.
Пример 97 N-((4-фтор-1-(пиперидин-4-илметил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А97)

Бромметилбензол был заменен на 4-(бромметил)пиперидин, тогда как другие исходные материалы, реагенты и способ получения продукта А97 были теми же, что и в примере 6 (выход: 73%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.46 (d, J=5.1 Гц, 2Н), 7.40 (d, J=5.1 Гц, 2Н), 7.26-7.11 (m, 5Н), 4.33 (s, 2Н), 2.97 (dt, J=12.5, 7.1 Гц, 2Н), 2.72-2.57 (m, 3H), 2.33 (dt, J=12.5, 7.1 Гц, 2Н), 1.95-1.73 (m, 3H), 1.56 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.99 (td, J=7.0, 5.0 Гц, 1Н), 0.67 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 340.21 [М+Н]+.
Пример 98 N-((4-фтор-1-(тиофен-3-илметил)пиперидин-4-ил)метил)-транс-2-фенилциклопропиламин (А98)

Бромметилбензол был заменен на 3-(бромметил)тиофен, тогда как другие исходные материалы, реагенты и способ получения продукта А98 были теми же, что и в примере 6 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.31-7.11 (m, 6Н), 6.96-6.87 (m, 2Н), 3.69 (s, 2Н), 3.04 (dt, J=12.5, 7.1 Гц, 2Н), 2.72-2.57 (m, 3H), 2.34 (dt, J=12.5, 7.2 Гц, 2Н), 1.95-1.74 (m, 3H), 1.56 (ddt, J=25.1, 13.2, 7.0 Гц, 2H), 0.99 (td, J=7.0, 5.0 Гц, 1H), 0.67 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 345.17 [М+Н]+.
Пример 99 (1-(циклопропилметил)пиперидин-4-ил)метил 4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-формат (А99)
3-фенилпропионил хлорид был заменен (1-(циклопропилметил)пиперидин-4-ил)метил хлороформат, тогда как другие исходные материалы, реагенты и способ получения дигидрохлорида продукта А99 были теми же, что и в примерах 8.1 и 5.4 (выход: 60%). 1Н ЯМР (400 МГц, MeOD) δ 7.34-7.28 (m, 2Н), 7.26-7.22 (m, 1Н), 7.22-7.17 (m, 2H), 4.15-3.98 (m, 4H), 3.78-3.66 (m, 2H), 3.55 (d, J=20.2 Гц, 2H), 3.25-3.10 (m, 2H), 3.10-2.96 (m, 5H), 2.61 (ddd, J=10.3, 6.6, 3.6 Гц, 1H), 2.09-1.94 (m, 5H), 1.92-1.65 (m, 4H), 1.61 (ddd, J=10.5, 6.8, 4.4 Гц, 1H), 1.39 (dt, J=7.9, 6.7 Гц, 1H), 1.16 (ddtd, J=12.4, 9.7, 7.3,4.5 Гц, 1H), 0.80-0.74 (m, 2H), 0.46 (dt, J=6.3, 4.7 Гц, 2H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 404.26 [М+Н]+.
Пример 100 N-(2аминофенил)-4-((4-фтор-4-(((транс-2-фенилциклопропил)амино)метил)пиперидин-1-ил))бензоиламид (А100)

Бромметилбензол был заменен на т-бутил(2-(4-(бромметил)бензамид)фенил)карбамат, тогда как другие исходные материалы, реагенты и способ получения продукта А100 были теми же, что и в примере 6 (выход: 45%). 1Н ЯМР (400 МГц, MeOD) δ 8.21 (d, J=7.9 Гц, 2Н), 7.86 (d, J=8.0 Гц, 2Н), 7.60-7.46 (m, 4Н), 7.33 (t, J=7.4 Гц, 2Н), 7.24 (dd, J=14.2, 7.2 Гц, 3H), 4.55 (s, 2Н), 3.68 (d, J=20.0 Гц, 2Н), 3.57 (d, J=10.4 Гц, 2Н), 3.47-3.36 (m, 2Н), 3.14-3.06 (m, 1Н), 2.71-2.64 (m, 1Н), 2.45-2.21 (m, 4Н), 1.70-1.62 (m, 1Н), 1.43 (dd, J=13.9, 7.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 473.26 [М+Н]+.
Пример 101 Трет-Бутил 4-((4-(((2-(5-бромтиен-2-ил))циклопропил)амино)метил)-4-фторпиперидин-1-ил)метил)бензоат (А101)
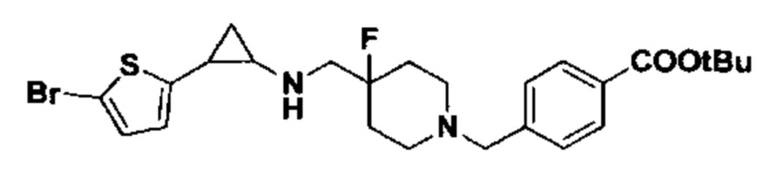
Транс-2-фенилциклопропиламин был заменен на транс-2-(5-бромтиен-2-ил)циклопропиламин, а бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на т-бутил 4-((4-фтор-4-формилпиперидин-1-ил)метил)бензоат, тогда как другие исходные материалы, реагенты и способ получения продукта А101 были теми же, что и в примере 1 (выход: 61%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.34 (dt, J=8.4,1.1 Гц, 2Н), 7.00 (d, J=8.4 Гц, 1Н), 6.77 (d, J=8.4 Гц, 1H), 3.57 (t, J=1.0 Гц, 2H), 3.18 (ddd, J=25.1, 14.5, 4.9 Гц, 1H), 3.04 (dt, J=7.5, 4.9 Гц, 1H), 2.96 (ddd, J=25.1, 14.6, 4.9 Гц, 1H), 2.87 (ddd, J=12.1, 6.2, 4.3 Гц, 2H), 2.81 (dtd, J=7.5, 6.4, 5.7 Гц, 1H), 2.59-2.49 (m, 3H), 2.11-1.93 (m, 4H), 1.89 (td, J=6.4, 1.3 Гц, 2H), 1.55 (s, 6H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 523.14 [М+Н]+.
Пример 102 Трет-Бутил 4-((4-(((2-(5-бромтиен-2-ил))циклопропил)амино)метил)-4-фторпиперидин-1-ил)метил)бензойная кислота (А102)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-бромтиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А102 были теми же, что и в примере 5 (выход: 73%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.99-7.93 (m, 2Н), 7.37 (dt, J=8.4, 1.1 Гц, 2Н), 7.02 (d, J=8.4 Гц, 1Н), 6.71 (d, J=8.4 Гц, 1Н), 3.55 (t, J=1.0 Гц, 2Н), 3.16 (ddd, J=25.1, 14.4, 5.0 Гц, 1Н), 3.08 (dt, J=7.3, 4.9 Гц, 1Н), 3.01 (ddd, J=25.1, 14.4, 4.9 Гц, 1H), 2.91-2.78 (m, 3H), 2.61 (ddd, J=12.3, 6.4, 4.1 Гц, 2Н), 2.48 (td, J=6.4, 5.6 Гц, 1H), 2.11-1.85 (m, 6Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 467.07 [М+Н]+.
Пример 103 Метил 4-((4-(((2-(5-бромтиен-2-ил))циклопропил)амино)метил)-4-фторпиперидин-1-ил)метил)бензоат (А103)

Транс-2-фенилпропиламин был заменен на транс-2-(5-бензотиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А103 были теми же, что и в примере 3 (выход: 67%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.34 (dt, J=8.4, 1.1 Гц, 2Н), 7.03 (d, J=8.4 Гц, 1Н), 6.68 (d, J=8.4 Гц, 1H), 3.89 (s, 2Н), 3.55 (t, J=1.0 Гц, 2Н), 3.16 (ddd, J=25.1, 14.4, 5.0 Гц, 1H), 3.08 (dt, J=13, 4.9 Гц, 1Н), 3.01 (ddd, J=25.1, 14.4, 5.0 Гц, 1Н), 2.91-2.78 (m, 3H), 2.61 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 2.48 (td, J=6.4, 5.6 Гц, 1Н), 2.11-1.85 (m, 6Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 481.09 [М+Н]+.
Пример 104 Этил 4-((4-(((2-(5-бромтиен-2-ил))циклопропил)амино)метил)-4-фторпиперидин-1-ил)метил)бензоат (А104)
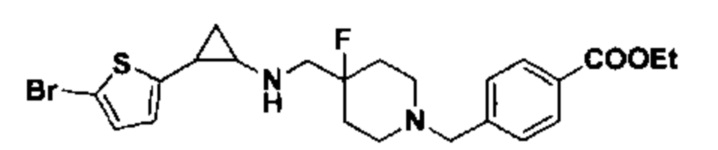
Транс-2-фенилциклопропиламин был заменен на транс-2-(5-бромтиен-2-ил)циклопропиламин, а бензил 4-фтор-4-формилпиперидин-1-карбоксилат был заменен на этил 4-((4-фтор-4-формилпиперидин-1-ил)метил)бензоат, тогда как другие исходные материалы, реагенты и способ получения продукта А104 были теми же, что и в примере 1 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.89 (m, 2Н), 7.35 (dt, J=8.4, 1.1 Гц, 2Н), 7.03 (d, J=8.4 Гц, 1Н), 6.68 (d, J=8.4 Гц, 1Н), 4.44-4.27 (m, 2Н), 3.58 (dt, J=12.8, 1.1 Гц, 1Н), 3.52 (dt, J=12.8, 1.1 Гц, 1Н), 3.22 (ddd, J=25.3, 14.6, 4.9 Гц, 1H), 3.07 (dt, J=7.3, 4.8 Гц, 1Н), 3.02-2.88 (m, 1Н), 2.91-2.82 (m, 3H), 2.59 (ddd, J=12.3, 6.1,4.5 Гц, 2Н), 2.53 (td, J=6.4, 5.6 Гц, 1H), 2.11-1.93 (m, 4Н), 1.89 (td, J=6.4, 1.3 Гц, 2Н), 1.39 (t, J=7.0 Гц, 3Н).. Масс-спектрометр с низкой разрешающей способностью (электроспрей): 495.10 [М+Н]+.
Пример 105 Трет-Бутил 4-((4-фтор-4-(((2-(5-(4-фторфенил)тиофен-2-ил)циклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (А 105)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-(4-фторфенил)тиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А105 были теми же, что и в примере 101 (выход: 71%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.63-7.55 (m, 2Н), 7.31 (dt, J=8.5, 1.0 Гц, 2Н), 7.21-7.13 (m, 3H), 6.73 (d, J=8.4 Гц, 1H), 3.57 (t, J=1.0 Гц, 2Н), 3.20 (ddd, J=25.1, 14.6, 4.8 Гц, 1H), 3.01 (dt, J=7.3, 4.9 Гц, 1H), 2.97-2.78 (m, 4H), 2.58 (ddd, J=12.3, 6.3, 4.2 Гц, 2H), 2.28 (td, J=6.4, 5.6 Гц, 1H), 2.07 (ddd, J=13.6, 6.4, 4.2 Гц, 1H), 2.02 (dd, J=13.5, 4.2 Гц, 1H), 2.02-1.94 (m, 1H), 1.98-1.89 (m, 2H), 1.92-1.85 (m, 1H), 1.55 (s, 7H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 539.25 [М+Н]+.
Пример 106 Трет-Бутил 4-((4-(((2-(5-(4-хлорфенил)тиофен-2-ил)циклопропил)амино)метил)-4-фторпиперидин-1-ил)метил)бензоат (А106)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-(4-хлорфенил)тиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А106 были теми же, что и в примере 106 (выход: 77%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.54-7.47 (m, 2Н), 7.42-7.36 (m, 2Н), 7.31 (dt, J=8.4, 1.0 Гц, 2Н), 7.19 (d, J=8.4 Гц, 1H), 6.74 (d, J=8.4 Гц, 1Н), 3.57 (t, J=1.0 Гц, 2Н), 3.20 (ddd, J=25.1, 14.7, 4.9 Гц, 1Н), 3.01 (dt, J=7.3, 4.8 Гц, 1H), 2.97-2.78 (m, 4Н), 2.58 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 2.28 (td, J=6.4, 5.6 Гц, 1H), 2.11-1.86 (m, 6Н), 1.55 (s, 7Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 555.22 [М+Н]+.
Пример 107 Трет-бутил 4-((4-фтор-4-(((2-(5-(4-(трифторметил)фенил)тиофен-2-ил)циклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (А107)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-(4-(трифторметилфенил)тиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А107 были теми же, что и в примере 101 (выход: 66%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.97-7.90 (m, 2Н), 7.77-7.70 (m, 2Н), 7.64-7.58 (m, 2Н), 7.37-7.28 (m, 3H), 6.91 (d, J=8.4 Гц, 1Н), 3.59 (dt, J=12.6, 0.9 Гц, 1Н), 3.53 (dt, J=12.6, 1.0 Гц, 1Н), 3.23-3.10 (m, 1Н), 3.08-2.82 (m, 5Н), 2.49 (ddd, J=12.3, 6.3, 4.4 Гц, 2Н), 2.29 (td, J=6.5, 5.6 Гц, 1Н), 2.11-1.93 (m, 5Н), 1.89 (t, J=6.4 Гц, 2Н), 1.55 (s, 7Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 589.24 [М+Н]+.
Пример 108 Трет-бутил 4-((4-фтор-4-(((2-(5-фенилтеофен-2-ил)циклопропил)амино)метил)пиперидин-1-ил)метил)бензоат (А108)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-фенилтиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А108 были теми же, что и в примере 108 (выход: 73%). 1H ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.78-7.70 (m, 2Н), 7.49-7.40 (m, 3H), 7.32 (dd, J=8.4, 1.5 Гц, 3H), 6.88 (d, J=8.4 Гц, 1H), 3.59 (dt, J=12.6, 0.9 Гц, 1Н), 3.53 (dt, J=12.6, 1.0 Гц, 1H), 3.18 (ddd, J=25.3, 14.5, 5.1 Гц, 1H), 3.07-2.95 (m, 1H), 2.99-2.92 (m, 1H), 2.91-2.79 (m, 3H), 2.53-2.42 (m, 3H), 2.11-1.90 (m, 4H), 1.89 (t, J=6.4 Гц, 2H), 1.55 (s, 7H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 521.26 [М+Н]+.
Пример 109 Трет-бутил 4-((4-фтор-4-(((2-(5-(нафталин-1-ил)тиофен-2-ил)метил)бензоат (А109)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-(нафталин-1-ил)тиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А109 были теми же, что и в примере 101 (выход: 77%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.06-7.99 (m, 1Н), 7.98-7.89 (m, 4H), 7.69 (dd, J=7.9,0.8 Гц, 1H), 7.61 (t, J=7.8 Гц, 1H), 7.52 (pd, J=7.4, 1.5 Гц, 2H), 7.37-7.28 (m, 3H), 6.88 (d, J=8.4 Гц, 1H), 3.59 (dt, J=12.6, 0.9 Гц, 1H), 3.53 (dt, J=12.6, 1.0 Гц, 1H), 3.17 (ddd, J=25.1, 14.3, 5.1 Гц, 1H), 3.10-2.95 (m, 2H), 2.94 (ddd, J=12.1, 6.2, 4.3 Гц, 2H), 2.85 (dtd, J=7.3, 6.3, 5.6 Гц, 1H), 2.59 (ddd, J=12.1, 6.1, 4.4 Гц, 2H), 2.29 (td, J=6.4, 5.6 Гц, 1H), 2.11-1.96 (m, 4H), 1.99-1.87 (m, 2H), 1.55 (s, 7H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 571.27 [М+Н]+.
Пример 110 Пиперидин-4-илметил 4-фтор-4-(((2-(5-(4-трифторметил)фенил)тиофен-2-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А110)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-(4-(трифторметилфенил)тиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А110 были теми же, что и в примере 43 (выход: 55%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.68-7.62 (m, 2Н), 7.57-7.51 (m, 2Н), 7.30 (d, J=8.4 Гц, 1H), 6.81 (d, J=8.4 Гц, 1Н), 4.23 (dd, J=10.6, 6.2 Гц, 1H), 4.02 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.83 (dd, J=10.4, 6.2 Гц, 1H), 3.70 (ddd, J=11.9, 6.4, 4.0 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.20 (ddd, J=25.3, 14.6, 4.9 Гц, 1H), 3.08 (dt, J=7.5, 4.9 Гц, 1H), 3.04-2.95 (m, 1H), 2.99-2.91 (m, 2H), 2.84 (dtd, J=7.5, 6.3, 5.6 Гц, 1H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.46 (td, J=6.4, 5.6 Гц, 1H), 2.06 (dddd, J=25.1, 13.6, 6.4, 4.1 Гц, 2H), 2.00-1.81 (m, 5H), 1.63-1.53 (m, 2H), 1.51-1.41 (m, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 540.22 [М+Н]+.
Пример 111 Пиперидин-4-илметил 4-(((2-(5-бромтиен-2-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (A111)

Транс-2-фенилциклопропиламин был заменен на транс-2-(5-бромтиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта A111 были теми же, что и в примере 43 (выход: 65%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.02 (d, J=8.4 Гц, 1H), 6.72 (d, J=8.4 Гц, 1Н), 4.25 (dd, J=10.4, 6.2 Гц, 1Н), 4.02 (ddd, J=12.1, 6.5, 4.1 Гц, 2Н), 3.83 (dd, J=10.4, 6.2 Гц, 1Н), 3.69 (ddd, J=12.1, 6.4, 4.0 Гц, 2Н), 3.35 (р, J=4.1 Гц, 1Н), 3.15 (ddd, J=25.3,14.5, 5.0 Гц, 1Н), 3.09-2.97 (m, 1H), 3.01-2.92 (m, 3H), 2.85-2.71 (m, 3H), 2.48 (td, J=6.4, 5.6 Гц, 1H), 2.06 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2Н), 1.99-1.80 (m, 5Н), 1.64-1.54 (m, 2Н), 1.50-1.40 (m, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 474.11 [М+Н]+.
Пример 112 Пиперидин-4-илметил 4-фтор-4-(((2-(6-(4-метоксифенил)пиридин-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А112)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(4-метоксифенил)пиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А112 были теми же, что и в примере 43 (выход: 63%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.40 (d, J=1.8 Гц, 1Н), 7.83-7.76 (m, 2H), 7.66 (d, J=8.5 Гц, 1H), 7.41 (dd, J=8.4, 1.8 Гц, 1H), 7.03-6.97 (m, 2H), 4.08 (dd, J=10.6, 6.2 Гц, 1H), 4.06-3.96 (m, 3H), 3.83 (s, 2H), 3.68 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.37 (p, J=4.1 Гц, 1H), 3.18 (ddd, J=25.1, 14.7, 4.8 Гц, 1H), 3.11-2.97 (m, 2H), 3.00-2.92 (m, 2H), 2.76 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.40 (td, J=6.4, 5.6 Гц, 1H), 2.09 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2H), 2.01-1.78 (m, 6H), 1.65-1.55 (m, 2H), 1.52-1.42 (m, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 497.28 [М+Н]+.
Пример 113 Пиперидин-4-илметил 4-(((2-(5-циклопропилтиен-2-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А113)
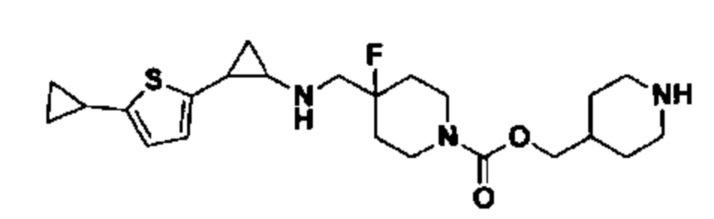
Транс-2-фенилциклопропиламин был заменен на транс-2-(5-циклопропилтиофен-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А113 были теми же, что и в примере 43 (выход: 67%). 1Н ЯМР (400 МГц, DMSO-d6) δ 6.75 (q, J=8.4 Гц, 2Н), 4.25 (dd, J=10.5, 6.3 Гц, 1H), 4.02 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.83 (dd, J=10.6, 6.2 Гц, 1H), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.22-3.11 (m, 1H), 3.14-3.08 (m, 1H), 3.09-2.92 (m, 4H), 2.85-2.71 (m, 3H), 2.38 (td, J=6.4, 5.5 Гц, 1H), 2.32 (p, J=5.8 Гц, 1H), 2.06 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2H), 1.99-1.87 (m, 2H), 1.91-1.80 (m, 3H), 1.63-1.53 (m, 6H), 1.49-1.39 (m, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 436.24 [М+Н]+.
Пример 114 Пиперидин-4-илметил 4-(((2-(5-((4-цианофенил)этинил)тиофен-2-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А114)
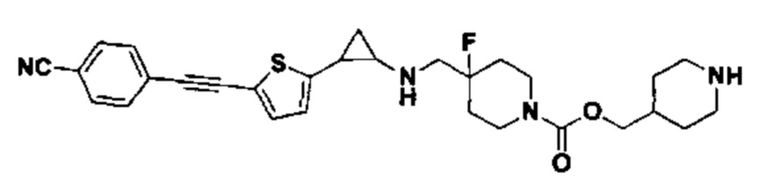
Транс-2-фенилциклопропиламин был заменен на транс-4-((5-(2-аминоциклопропил)тиофен-2-ил)этинил)бензонитрил, тогда как другие исходные материалы, реагенты и способ получения продукта А114 были теми же, что и в примере 43 (выход: 51%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.65-7.59 (m, 2Н), 7.59-7.53 (m, 2Н), 7.24 (d, J=8.4 Гц, 1H), 6.85 (d, J=8.4 Гц, 1Н), 4.08 (dd, J=10.5, 6.3 Гц, 1H), 4.07-3.97 (m, 3H), 3.68 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.37 (p, J=4.1 Гц, 1H), 3.18 (ddd, J=25.1, 14.1, 5.2 Гц, 1H), 3.11-2.98 (m, 2H), 3.01-2.88 (m, 3H), 2.76 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.39 (td, J=6.4, 5.6 Гц, 1H), 2.09 (dddd, J=25.3, 13.6, 6.6, 4.2 Гц, 2H), 2.01-1.80 (m, 5H), 1.60 (dtd, J=13.4, 6.4, 4.2 Гц, 2H), 1.47 (dtd, J=13.4, 6.3, 4.2 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 521.23 [М+Н]+.
Пример 115 Пиперидин-4-илметил 4-фтор-4-(((2-(6-фенилпиридин-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А115)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-фенилпиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта A115 были теми же, что и в примере 43 (выход: 68%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.45 (d, J=1.9 Гц, 1Н), 8.02-7.94 (m, 2H), 7.69 (d, J=8.4 Гц, 1H), 7.45 (dd, J=8.4, 2.0 Гц, 1H), 7.44-7.34 (m, 3H), 4.15 (dd, J=10.4, 6.2 Гц, 1H), 4.03 (ddd, J=12.0, 6.5, 4.1 Гц, 2H), 3.93 (dd, J=10.5, 6.3 Гц, 1H), 3.69 (ddd, J=12.1, 6.4, 4.2 Гц, 2H), 3.36 (p, J=4.1 Гц, 1H), 3.27-3.19 (m, 1H), 3.23-3.10 (m, 1H), 3.05 (ddd, J=25.3, 14.7, 4.9 Гц, 1H), 2.98 (dt, J=6.3, 4.1 Гц, 1H), 2.98-2.92 (m, 1H), 2.77 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.40 (td, J=6.4, 5.6 Гц, 1H), 2.09 (dddd, J=25.1, 13.4, 6.4, 4.1 Гц, 2H), 2.03-1.92 (m, 2H), 1.95-1.79 (m, 4H), 1.59 (dtd, J=12.8, 6.3, 4.1 Гц, 2H), 1.46 (dtd, J=13.2, 6.2, 4.0 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 467.27 [М+Н]+.
Пример 116 Пиперидин-4-илметил 4-(((2-(6-(4-этилфенокси)пиперидин-3-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А116)
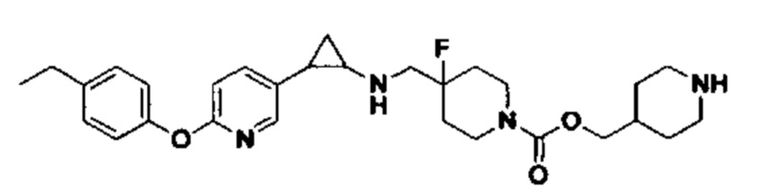
Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(4-этилфенокси)пиперидин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А116 были теми же, что и в примере 43 (выход: 64%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.97 (d, J=1.9 Гц, 1Н), 7.61-7.55 (m, 2H), 7.36 (dd, J=8.4, 1.8 Гц, 1H), 7.12 (dt, J=8.4, 1.1 Гц, 2H), 7.01 (d, J=8.4 Гц, 1H), 4.23 (dd, J=10.4, 6.2 Гц, 1H), 4.03 (ddd, J=12.1, 6.4, 4.2 Гц, 2H), 3.82 (dd, J=10.5, 6.3 Гц, 1H), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.28-3.12 (m, 2H), 3.06 (ddd, J=25.3, 14.7,4.8 Гц, 1H), 2.96 (ddt, J=14.6, 6.4, 4.1 Гц, 2H), 2.80-2.63 (m, 3H), 2.59-2.48 (m, 1H), 2.40 (td, J=6.4, 5.6 Гц, 1H), 2.09 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2H), 2.03-1.81 (m, 6H), 1.64-1.54 (m, 2H), 1.46 (dtd, J=13.4, 6.3, 4.2 Гц, 2H), 1.24 (t, J=7.2 Гц, 3Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 511.30 [М+Н]+.
Пример 117 Пиперидин-4-илметил 4-фтор-4-(((2-(6-(3-(трифторметил)фенил)пиридин-3-ил)циклопропил)амино)метил)пиридин-1-карбоксилат (А117)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(3-(трифторметил)фенил)пиперидин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А117 были теми же, что и в примере 43 (выход: 71%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.46 (d, J=1.9 Гц, 1H), 8.34 (t, J=2.2 Гц, 1H), 7.86 (ddd, J=7.7, 2.2, 1.2 Гц, 1H), 7.77 (ddd, J=7.9, 2.2, 1.3 Гц, 1H), 7.72-7.63 (m, 2H), 7.47 (dd, J=8.4,2.0 Гц, 1H), 4.08 (dd, J=10.4, 6.2 Гц, 1H), 4.08-3.97 (m, 3H), 3.68 (ddd, J=12.1, 6.5, 4.2 Гц, 2Н), 3.37 (р, J=4.1 Гц, 1H), 3.18 (ddd, J=25.1, 14.7, 4.8 Гц, 1Н), 3.06 (dtd, J=7.5, 6.4, 5.6 Гц, 1H), 3.04-2.91 (m, 3H), 2.76 (ddt, J=14.5, 6.4, 4.1 Гц, 2Н), 2.20 (td, J=6.5, 5.7 Гц, 1Н), 2.08 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2Н), 2.00-1.78 (m, 6Н), 1.65-1.55 (m, 2Н), 1.47 (dtd, J=13.2, 6.2, 4.0 Гц, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 535.26 [М+Н]+.
Пример 118 Пиперидин-4-илметил 4-фтор-4-(((2-(6-(4-фторфенил)пиридин-3-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А118)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(4-фторфенил)пиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А118 были теми же, что и в примере 43 (выход: 75%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.41 (d, J=1.8 Гц, 1H), 8.18-8.11 (m, 2H), 7.66 (d, J=8.5 Гц, 1H), 7.42 (dd, J=8.4, 1.8 Гц, 1H), 7.20-7.12 (m, 2H), 4.14 (dd, J=10.6, 6.2 Гц, 1H), 4.03 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.83 (dd, J=10.4, 6.2 Гц, 1H), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.16 (ddd, J=25.3, 14.7, 4.9 Гц, 1H), 3.09-2.96 (m, 1H), 3.00-2.90 (m, 3H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.40 (td, J=6.4, 5.6 Гц, 1H), 2.07 (dddd, J=25.1, 13.5, 6.4,4.0 Гц, 2H), 1.97 (ddd, J=13.4, 6.4, 4.0 Гц, 1H), 1.96-1.86 (m, 3H), 1.89-1.81 (m, 2H), 1.64-1.54 (m, 2H), 1.45 (dtd, J=13.2, 6.3, 4.0 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 485.26 [М+Н]+.
Пример 119 Пиперидин-4-илметил 4-(((2-(6-(4-хлорфенил)пиридин-3-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А119)
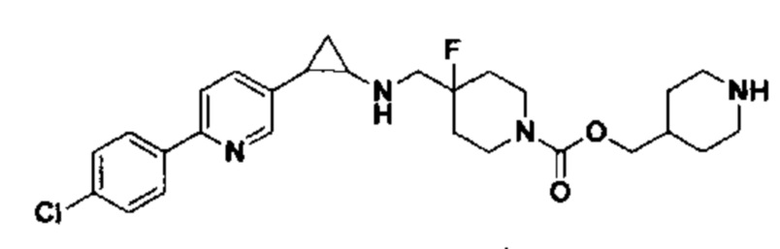
Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(4-хлорфенил)пиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А119 были теми же, что и в примере 43 (выход: 71%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.41 (d, J=1.9 Гц, 1Н), 7.85-7.79 (m, 2H), 7.68 (d, J=8.4 Гц, 1H), 7.46-7.35 (m, 3H), 4.14 (dd, J=10.4, 6.2 Гц, 1H), 4.02 (ddd, J=12.1, 6.4, 4.2 Гц, 2H), 3.82 (dd, J=10.4, 6.2 Гц, 1H), 3.69 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.15 (ddd, J=25.3, 14.7, 4.9 Гц, 1H), 3.09-2.90 (m, 4H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.40 (td, J=6.4, 5.6 Гц, 1H), 2.07 (dddd, J=25.1, 13.5, 6.4, 4.1 Гц, 2H), 2.01-1.88 (m, 2H), 1.92-1.85 (m, 2H), 1.89-1.81 (m, 2H), 1.58 (dtd, J=12.8, 6.3, 4.0 Гц, 2H), 1.45 (dtd, J=13.4, 6.3, 4.2 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 501.24 [М+Н]+.
Пример 120 Пиперидин-4-илметил 4-(((2-(6-(3,5-диметилфенил)пиридин-3-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А120)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-(3,5-метоксифенил)пиридин-3-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А120 были теми же, что и в примере 43 (выход: 61%). 1H ЯМР (400 МГц, DMSO-d6) δ 8.40 (d, J=1.9 Гц, 1Н), 7.68 (d, J=8.4 Гц, 1H), 7.34 (dd, J=8.4, 2.0 Гц, 1H), 7.19 (d, J=2.0 Гц, 2H), 6.58 (t, J=2.2 Гц, 1H), 4.23 (dd, J=10.4, 6.2 Гц, 1H), 4.04 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.86-3.80 (m, 1H), 3.81 (s, 5H), 3.68 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.18 (ddd, J=25.3, 14.7, 4.9 Гц, 1H), 3.06 (dtd, J=7.3, 6.2, 5.4 Гц, 1H), 3.04-2.95 (m, 1H), 2.99-2.91 (m, 2H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.21 (td, J=6.5, 5.7 Гц, 1H), 2.09 (dddd, J=25.3, 13.6, 6.4, 4.1 Гц, 2H), 2.00-1.78 (m, 6H), 1.59 (dtd, J=13.4, 6.3, 4.0 Гц, 2H), 1.45 (dtd, J=13.4, 6.3, 4.1 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 527.30 [М+Н]+.
Пример 121 Пиперидин-4-илметил 4-(((2-(6-бромпиридин-3-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А121)

Транс-2-фенилциклопропиламин был заменен на транс-2-(6-бромпиридин-2-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А121 были теми же, что и в примере 43 (выход: 62%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.18 (d, J=1.8 Гц, 1H), 7.49 (d, J=8.4 Гц, 1Н), 7.34 (dd, J=8.4, 1.8 Гц, 1H), 4.25 (dd, J=10.4, 6.2 Гц, 1H), 4.02 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 3.82 (dd, J=10.6, 6.2 Гц, 1Н), 3.68 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 3.35 (р, J=4.1 Гц, 1Н), 3.15 (ddd, J=25.1, 14.7, 4.9 Гц, 1Н), 3.08-2.94 (m, 2Н), 2.98-2.89 (m, 2Н), 2.76 (ddt, J=14.5, 6.4, 4.1 Гц, 2Н), 2.23 (td, J=6.4, 5.6 Гц, 1Н), 2.06 (dddd, J=25.1, 13.4, 6.4, 4.1 Гц, 2Н), 2.01-1.89 (m, 2Н), 1.90 (dd, J=6.4, 4.1 Гц, 0Н), 1.90 (s, 1H), 1.91-1.80 (m, 3H), 1.64-1.54 (m, 2Н), 1.45 (dtd, J=13.4, 6.3, 4.1 Гц, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 469.15 [М+Н]+.
Пример 122 Пиперидин-4-илметил 4-(((2-(2-хлортиазол-5-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А122)

Транс-2-фенилциклопропиламин был заменен на транс-2-(2-хлортиазол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А122 были теми же, что и в примере 43 (выход: 65%).1 ЯМР (400 МГц, DMSO-d6) δ 7.35 (s, 1Н), 4.16 (dd, J=10.6, 6.2 Гц, 1Н), 4.04 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 3.94 (dd, J=10.4, 6.2 Гц, 1Н), 3.69 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 3.20-3.07 (m, 2Н), 3.10-2.87 (m, 5Н), 2.82-2.72 (m, 3H), 2.16-1.88 (m, 6Н), 1.84 (hept, J=6.2 Гц, 1Н), 1.64-1.54 (m, 2Н), 1.50-1.40 (m, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 431.16 [М+Н]+.
Пример 123 Пиперидин-4-илметил 4-фтор-4-(((2-(2-(4-фторфенил)тиазол-5-ил)циклопропил)амино)метил)пиперин-1-карбоксилат (А123)

Транс-2-фенилциклопропиламин был заменен на транс-2-(2-(4-фторфенил)тиазол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А123 были теми же, что и в примере 43 (выход: 70%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.70-7.62 (m, 2Н), 7.58 (s, 1Н), 7.26-7.18 (m, 2H), 4.13 (dd, J=10.5, 6.3 Гц, 1H), 4.03 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.82 (dd, J=10.5, 6.3 Гц, 1H), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.16 (ddd, J=25.1, 14.6, 4.9 Гц, 1H), 3.09-2.97 (m, 1H), 3.00-2.90 (m, 4H), 2.93-2.85 (m, 1H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.09 (ddd, J=13.4, 6.4, 4.0 Гц, 1H), 2.08- 1.97 (m, 3H), 2.00-1.81 (m, 3H), 1.64-1.54 (m, 2H), 1.45 (dtd, J=13.4, 6.3, 4.2 Гц, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 491.22 [М+Н]+.
Пример 124 Пиперидин-4-илметил 4-(((2-(2-(4-хлорфенил)тиазол-5-ил)циклопропил)амино)метил)-4-фторпиперидин-1-карбоксилат (А124)

Транс-2-фенилциклопропиламин был заменен на транс-2-(2-(4-хлорфенил)тиазол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А124 были теми же, что и в примере 43 (выход: 71%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.05-7.99 (m, 2Н), 7.60-7.50 (m, 3H), 4.13 (dd, J=10.4, 6.2 Гц, 1H), 4.02 (ddd, J=12.1, 6.4, 4.2 Гц, 2Н), 3.82 (dd, J=10.6, 6.2 Гц, 1Н), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2Н), 3.35 (р, J=4.1 Гц, 1H), 3.16 (ddd, J=25.1, 14.5, 5.1 Гц, 1H), 3.09-2.97 (m, 1Н), 3.01-2.94 (m, 2Н), 2.97-2.90 (m, 2Н), 2.93-2.85 (m, 1H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2Н), 2.09 (ddd, J=13.4, 6.4, 4.0 Гц, 1Н), 2.08-1.99 (m, 3H), 2.02-1.81 (m, 3H), 1.64-1.54 (m, 2Н), 1.45 (dtd, J=13.4, 6.3, 4.2 Гц, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 507.19 [М+Н]+.
Пример 125 Пиперидин-4-илметил 4-фтор-4-(((2-(2-фенилтиазол-5-га)циклопропил)амино) (А125)

Транс-2-фенилциклопропиламин был заменен на транс-2-(2-фенилтиазол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А125 были теми же, что и в примере 43 (выход: 69%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.96-7.90 (m, 2Н), 7.58 (s, 1Н), 7.53-7.41 (m, 3H), 4.14 (dd, J=10.4,6.2 Гц, 1Н), 4.03 (ddd, J=12.1, 6.5, 4.1 Гц, 2Н), 3.83 (dd, J=10.4, 6.2 Гц, 1H), 3.70 (ddd, J=11.9, 6.4, 4.0 Гц, 2Н), 3.35 (р, J=4.1 Гц, 1H), 3.16 (ddd, J=25.1, 14.4, 5.0 Гц, 1H), 3.09-2.97 (m, 1Н), 3.01-2.94 (m, 2Н), 2.97-2.90 (m, 2Н), 2.93-2.85 (m, 1Н), 2.76 (ddt, J=14.5, 6.4, 4.1 Гц, 2Н), 2.09 (ddd, J=13.5, 6.5, 4.1 Гц, 1Н), 2.08-1.99 (m, 3H), 2.01-1.81 (m, 3H), 1-64-1.54 (m, 2Н), 1.45 (dtd, J=13.2, 6.3, 4.0 Гц, 2Н). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 473.23 [М+Н]+.
Пример 126 Пиперидин-4-илметил 4-фтор-4-(((2-(2-(4-метоксифенил)тиазол-5-ил)циклопропил)амино)метил)пиперидин-1-карбоксилат (А126)

Транс-2-фенилциклопропиламин был заменен на транс-2-(2-(4-метоксифенил)пиридин-5-ил)циклопропиламин тогда как другие исходные материалы, реагенты и способ получения продукта А126 были теми же, что и в примере 43 (выход: 67%). 1Н ЯМР (400 МГц, DMSO-d6) δ 8.11-8.05 (m, 2Н), 7.57 (s, 1Н), 7.25-7.19 (m, 2H), 4.15 (dd, J=10.5, 6.3 Гц, 1H), 4.02 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.86-3.80 (m, 1H), 3.81 (s, 3H), 3.69 (ddd, J=12.1, 6.4, 4.0 Гц, 2H), 3.36 (p, J=4.1 Гц, 1H), 3.16 (ddd, J=25.1, 14.6, 4.9 Гц, 1H), 3.09-2.85 (m, 6H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.09 (ddd, J=13.6, 6.5, 4.2 Гц, 1H), 2.08-2.00 (m, 2H), 2.03-1.92 (m, 2H), 1.96-1.80 (m, 2H), 1.63-1.53 (m, 2H), 1.50-1.40 (m, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 503.24 [М+Н]+.
Пример 127 Пиперидин-4-илметил 4-(((2-(2-(3,5-диметоксифенил)тиазол-5-ил)циклопропил)амин)метил)-4-фторпиперидин-1-карбоксилат (А127)
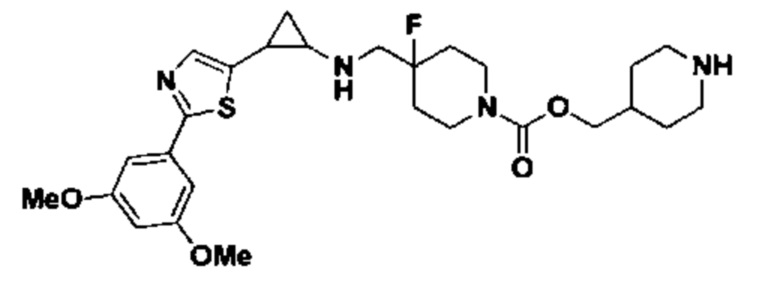
Транс-2-фенилциклопропиламин был заменен на транс-2-(2-(3,5-диметоксифенил)тиазол-5-ил)циклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта А127 были теми же, что и в примере 43 (выход: 59%). 1Н ЯМР (400 МГц, DMSO-d6) δ 7.56 (s, 1H), 7.10 (d, J=2.2 Гц, 2H), 6.59 (t, J=2.2 Гц, 1H), 4.13 (dd, J=10.4,6.2 Гц, 1H), 4.03 (ddd, J=12.1, 6.4,4.2 Гц, 2H), 3.86-3.80 (m, 1H), 3.81 (s, 4H), 3.69 (ddd, J=12.1, 6.5, 4.1 Гц, 2H), 3.35 (p, J=4.1 Гц, 1H), 3.16 (ddd, J=25.1, 14.2, 5.2 Гц, 1H), 3.09-2.85 (m, 6H), 2.75 (ddt, J=14.5, 6.4, 4.1 Гц, 2H), 2.09 (ddd, J=13.6, 6.4, 4.0 Гц, 1H), 2.08-1.96 (m, 3H), 1.95 (ddd, J=13.6, 6.5, 4.2 Гц, 1H), 1.95-1.81 (m, 2H), 1.64-1.54 (m, 2H), 1.50-1.40 (m, 2H). Масс-спектрометр с низкой разрешающей способностью (электроспрей): 533.25 [М+Н]+.
Пример 128 Пиперидин-4-илметил 4-фтор-4-(((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат ((1R, 2S)-А43)

Транс-2-фенилциклопропиламин был заменен на (1R,2S)-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта (1R, 2S)-A43 были теми же, что и в примере 43 (выход: 49%). 1Н ЯМР (400 МГц, D2O) δ 7.32 (t, J=7.4 Гц, 2Н), 7.24 (t, J=7.3 Гц, 1Н), 7.16 (d, J=7.3 Гц, 2H), 3.95 (d, J=6.0 Гц, 4H), 3.47 (d, J=20.5 Гц, 2H), 3.38 (d, J=13.0 Гц, 2H), 3.12 (t, J=12.0 Гц, 2H), 3.01 -2.87 (m, 3H), 2.53 (ddd, J=10.3, 6.6, 3.5 Гц, 1H), 2.04-1.85 (m, 5H), 1.79-1.70 (m, 1H), 1.65 (td, J=13.7, 5.1 Гц, 1H), 1.55-1.33 (m, 4H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 390.25 [М+Н]+.
Пример 129 Пиперидин-4-илметил 4-фтор-4-(((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат ((1S, 2S)-А43)

Транс-2-фенилциклопропиламин был заменен на (1S,2R)-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта (1S, 2R)-A43 были теми же, что и в примере 43 (выход: 52%). 1Н ЯМР (400 МГц, D2O) δ 7.31 (t, J=7.4 Гц, 2Н), 7.24 (t, J=7.3 Гц, 1Н), 7.15 (d, J=7.2 Гц, 2Н), 3.94 (d, J=5.9 Гц, 4Н), 3.47 (d, J=20.5 Гц, 2Н), 3.38 (d, J=12.8 Гц, 2Н), 3.12 (t, J=12.4 Гц, 2Н), 2.95 (ddd, J=19.8, 10.5, 7.1 Гц, 3H), 2.52 (ddd, J=10.3, 6.7, 3.6 Гц, 1Н), 2.04-1.86 (m, 5Н), 1.74 (td, J=13.3, 5.0 Гц, 1H), 1.64 (td, J=13.7, 5.2 Гц, 1H), 1.55-1.33 (m, 4Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 390.25 [М+Н]+.
Пример 130 (1-Бензипиперидин-4-ил)метил 4-фтор-4-(((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-карбоксилат ((1R, 2S)-A90)

Транс-2-фенилциклопропиламин был заменен на (1R,2S)-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта (1R, 2S)-A90 были теми же, что и в примере 90 (выход: 44%). 1Н ЯМР (500 МГц, MeOD) δ 7.58 (dd, J=6.6, 2.8 Гц, 2Н), 7.51-7.45 (m, 3H), 7.31 (t, J=7.4 Гц, 2Н), 7.25-7.21 (m, 1Н), 7.21-7.18 (m, 2Н), 4.31 (s, 2Н), 4.05 (d, J=13.7 Гц, 4Н), 3.58-3.46 (m, 4Н), 3.24-3.13 (m, 2Н), 3.09-2.99 (m, 3H), 2.62 (ddd, J=10.3, 6.6, 3.6 Гц, 1Н), 2.08-1.77 (m, 7Н), 1.69 (td, J=15.0, 3.5 Гц, 2Н), 1.64-1.58 (m, 1Н), 1.39 (dd, J=14.5, 6.8 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 478.29 [М+Н]+.
Пример 131 4-((4-фтор-4-((((1R,2S)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензоат ((1R, 2S)-A5)

Транс-2-фенилциклопропиламин был заменен на (1R,2S)-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта (1R, 2S)-A5 были теми же, что и в примере 5 (выход: 22%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 8.02-7.93 (m, 2Н), 7.50 (dt, J=7.4,1.2 Гц, 2Н), 7.26-7.10 (m, 5Н), 3.54 (d, J=1.5 Гц, 2Н), 3.11 (dt, J=12.6, 7.2 Гц, 2Н), 2.76-2.62 (m, 2Н), 2.62-2.49 (m, 3H), 2.05-1.82 (m, 3H), 1.45 (ddt, J=25.1, 13.2, 7.1 Гц, 2Н), 0.95 (td, J=7.0, 4.9 Гц, 1Н), 0.71 (td, J=7.0, 5.0 Гц, 1Н); масс-спектрометр с низкой разрешающей способностью (электроспрей): 383.21 [М+Н]+.
Пример 132
4-((4-фтор-4-((((1S,2R)-2-фенилциклопропил)амино)метил)пиперидин-1-ил)метил)бензоат ((1S,2R)-A5)
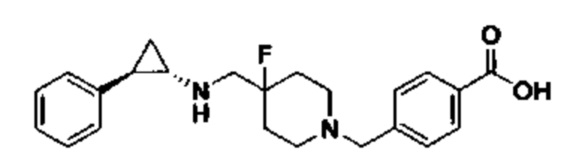
Транс-2-фенилциклопропиламин был заменен на (1S,2R)-2-фенилциклопропиламин, тогда как другие исходные материалы, реагенты и способ получения продукта (1S, 2R)-A5 были теми же, что и в примере 90 (выход: 24%). 1Н ЯМР (400 МГц, ДМСО-d6) δ 8.00-7.93 (m, 2Н), 7.44 (dt, J=7.4, 1.2 Гц, 2Н), 7.26-7.11 (m, 5Н), 3.54 (d, J=1.5 Гц, 2Н), 3.11 (dt, J=12.6, 7.2 Гц, 2Н), 2.76-2.64 (m, 2Н), 2.62-2.49 (m, 3H), 2.05-1.85 (m, 3H), 1.45 (ddt, J=25.1, 13.2, 7.2 Гц, 2Н), 0.95 (td, J=7.0, 4.9 Гц, 1H), 0.71 (td, J=7.0, 5.0 Гц, 1H); масс-спектрометр с низкой разрешающей способностью (электроспрей): 383.21 [М+Н]+.
Пример теста на фармакологическую активность
Пример 1. Тест на активность на молекулярном уровне:
1. Анализ активности ЛСД1 in vitro
Способ скрининга: скрининг активности лизин-специфической деметилазы 1 (ЛСД1)
Прибор: микропланшетный ридер Envision™ (PerkinElmer, США).
МАТЕРИАЛЫ: Человеческая рекомбинантная ЛСД1, представляющая собой фрагмент белка ЛСД1, соединенный с белком GST (aa158-end), был экспрессирован в системе экспрессии Е. coli и очищен в лаборатории компании.
Набор LANCE Ultra для определения активности ЛСД1 - анализа гистона Н3-лизина 4 деметилазы - был приобретен у компании Perkin Elmer.
Полипептидный субстрат Н3 ARTK (me1) QTARKSTGGKAPRKQLA-GG-K (биотин) - NH2 был синтезирован в компании Jill Biochemical.
Принцип метода: ЛСД1 специфически удаляет модификацию метилирования в лизине К4 в субстрате полипептида Н3, делая его субстратом без модификации метилированием. В этом способе в качестве субстрата используется метилированный полипептид гистона Н3 (1-24) для введения биотиновой метки в С-сегмент субстрата. ЛСД1 инициирует реакцию с участием ФАД (флавинадениндинуклеотида) для удаления модификации метилированием в субстрате H3K4. Фоновое антитело, меченное Eu, связывается с субстратом H3K4 при помощи реакции антиген-антитело, в то время как рецептор, меченный стрептавидином, связан специфическим взаимодействием стрептавидина и биотина. Это позволяет донору, меченному Eu, взаимодействовать с меченным стрептавидином рецептором. При передаче энергии флуоресцентного резонанса, когда два флуорофора сближаются из-за биомолекулярного взаимодействия, часть энергии с длиной волны излучения 620 нм, захваченной криптатом во время возбуждения, будет высвобождаться; другая часть энергии передается на рецептор (акцептор), у которого длина волны излучения составляет 665 нм. Излучение с длиной волны 665 нм производится только при реакции FRET (Ферстеровским резонансным переносом энергии), вызванной донором. Поэтому, когда биомолекулы взаимодействуют, существуют два источника возбуждения в длиной волны 620 нм и 665 нм; когда нет взаимодействия, есть только один источник возбуждения с длиной волны 620 нм. Деметилирующая активность ЛСД1 отражалась определением соотношения сигналов флуоресценции на двух длинах волн излучения 665 нм и 620 нм. При этом, для определения силы активности фермента проводился контрольный анализ пустого образца. В качестве положительных ингибиторов в эксперименте использовались ORY-1001 и GSK-2879552.
Подготовка образцов: Образцы растворяли в ДМСО, хранили при низкой температуре, и концентрацию ДМСО в конечной системе контролировали в пределах диапазона, который не влияет на активность анализа.
Активность образца проверяли путем первичного скрининга в одной концентрации, например, 20 мкМ. Для образцов, проявляющих активность при определенных условиях, например, степень ингибирования (% ингибирования), превышающая 50%, активное дозозависимое соотношение, т.е., значение ИК50, получали путем нелинейного подбора активности образца в зависимости от концентрации образца, для вычисления использовали программу Graphpad Prism 5, для аппроксимации использовали модель сигмоидной кривой зависимости от дозы (с переменным наклоном), а для большинства моделей скрининга ингибитора нижняя и верхняя части подгоночной кривой были установлены на 0 и 100.

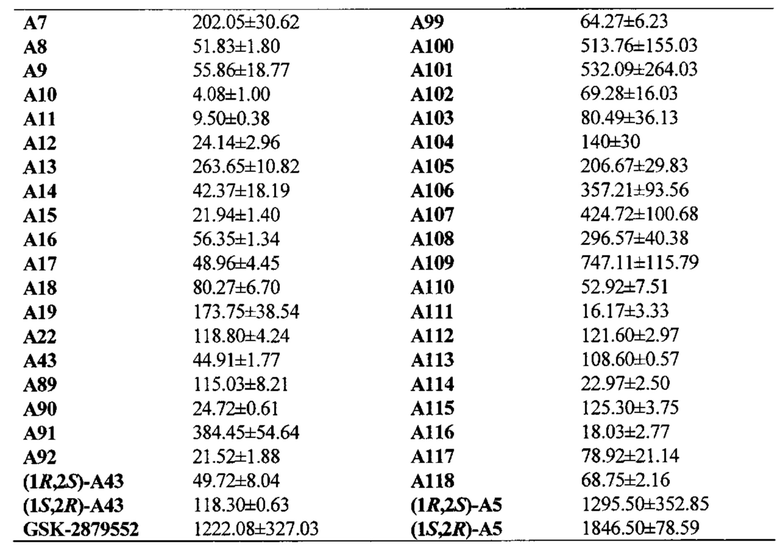
2. Эксперименты по in vitro активности МАО-А и МАО-Б
Способ скрининга: Проверка активности моноаминоксидаз МАО-А и МАО-Б.
Прибор: микропланшетный ридер Envision™ (PerkinElmer, США).
МАТЕРИАЛЫ: Рекомбинантная МАО-А человека, приобретенная у компании Promega; рекомбинантная МАО-Б человека, приобретенная у компании Sigma;
Набор для анализа активности МАО-А и МАО-Б - MAO-Glo был приобретен у компании Promega.
Принцип: В этом способе используется конкретное производное люциферина в качестве субстрата, МАО-А или МАО-Б могут катализировать превращение субстрата в метиловый эфир люциферина, а продукт, метиловый эфир люциферина, может вызывать флуоресценцию под воздействием люциферазы, что отражает активность МАО-А или МАО-Б по интенсивности флуоресцентного сигнала. При этом, для определения силы активности фермента проводился контрольный анализ пустого образца. В качестве положительного ингибитора в эксперименте использовался транилциклопромин (ТЦП).
Подготовка образцов: Образцы растворяли в ДМСО, хранили при низкой температуре, и концентрацию ДМСО в конечной системе контролировали в пределах диапазона, который не влияет на активность анализа.
Активность образца проверяли путем первичного скрининга в одной концентрации, например, 100 мкМ. Для образцов, проявляющих активность в определенных условиях, например, степень ингибирования (% ингибирования), превышающая 50%, активное дозозависимое соотношение, т.е., значение ИК50, получали путем нелинейного подбора активности образца в зависимости от концентрации образца; для вычисления использовалась программа Graphpad Prism 5; для подгонки использовалась модель сигмоидной кривой зависимости от дозы (с переменным наклоном), а для большинства моделей скрининга ингибитора нижняя и верхняя части подгоночной кривой были установлены на 0 и 100.
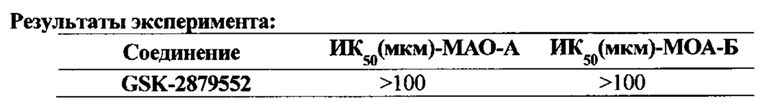

Пример 2. Тест на активность на клеточном уровне:
1. Тест активации экспрессии гена CD86:
Принцип эксперимента: Количественная ПЦР в реальном времени является способом измерения общего количества продукта после каждого цикла полимеразной цепной реакции (ПЦР) посредством использования флуоресцирующих химических веществ в реакции амплификации ДНК. Количественный анализ цепи ДНК образца выполнен по принятому внутри компании способу или по эталонному способу, принятому в другой компании. Между значением Ct матричной ДНК и исходным номером копии матричной ДНК во время экспоненциальной фазы амплификации ПЦР существует линейная зависимость, которая служит основой для количественного определения.
МАТЕРИАЛЫ: Клеточная линия лейкоза MV4-11: острый лимфобластный лейкоз у детей, иммуно-бифенотип, содержащая слияние AF4-MLL t(4,11), которая является чувствительной клеточной линией, в которой ингибиторы ЛСД1 активируют экспрессию CD86 (Analytical Biochemistry 442 (2013)) 104-106).
Способ проведения эксперимента:
1. 350 w/мл клеток MV4-11 тщательно подсчитывались в 12-луночном планшете при 900 мкл на лунку.
2. 3 мкл испытуемого соединения или положительного контрольного соединения добавляли к 147 мкл питательной среды, хорошо перемешивали, отбирали 100 мкл и добавляли в 12-луночный планшет с клетками, перемешивали и инкубировали при 37°С в течение 24 часов в инкубаторе в 5% СО2.
3. Образец переносили в пробирку типа эппендорф (ЭП) объемом 1,5 мл, центрифугировали со скоростью 2000 об/мин в течение 3 минут и удаляли надосадочную жидкость. Добавляли 500 мл тризола для лизиса и давали постоять 3 минуты.
4. Добавляли 100 мкл хлороформа и ЭП пробирку энергично встряхивали в течение 15 секунд и давали постоять 3 минуты, центрифугировали со скоростью 12000 об/мин 15 минут.
5. Надосадочную жидкость переносили в новую ЭП пробирку, добавляли 200 мкл изопропанола и помещали холодильник с температурой 20°С на 15 минут, центрифугировали при скорости 12000 об/мин 10 минут.
6. Надосадочную жидкость удаляли, добавляли 500 мкл 4° 75% этанола и перемешивали, смесь центрифугировали со скоростью 7500 об/мин 10 минут.
7. Надосадочную жидкость удаляли и ЭП пробирку просушивали на воздухе в вытяжном шкафу. Добавляли 20-30 мкл РНКазы инактивированной деионизированной водой и перемешивали для измерения концентрации РНК.
8. Все образцы равномерно доводили до 750 нг/8 мкл, добавляли фермент и субстрат из набора РТ, проводили обратную транскрипцию в течение 15 минут при температуре 42°, и затем инактивировали фермент при 85° в течение 2 минут.
9. В ЭП пробирку добавляли 100 мкл деионизированной воды и перемешивали.
10. Образец количественной ПЦР готовили в соотношении 7.6 мкл образца + 0.65 мкл прямого праймера + 0.65 мкл обратного праймера + 11.1 мкл красителя SYBR помещали в восьми-пробирочную пробирку, центрифугировали со скоростью 1500 об/мин в течение 1 минуты и затем начинали количественную ПЦР.
11. Полученные данные собирали и для вычисления кратности активации использовали способ 2^(-ΔΔct) (как описано в BLOOD, 8 АВГУСТА 2013, ТОМ 122, НОМЕР 6).
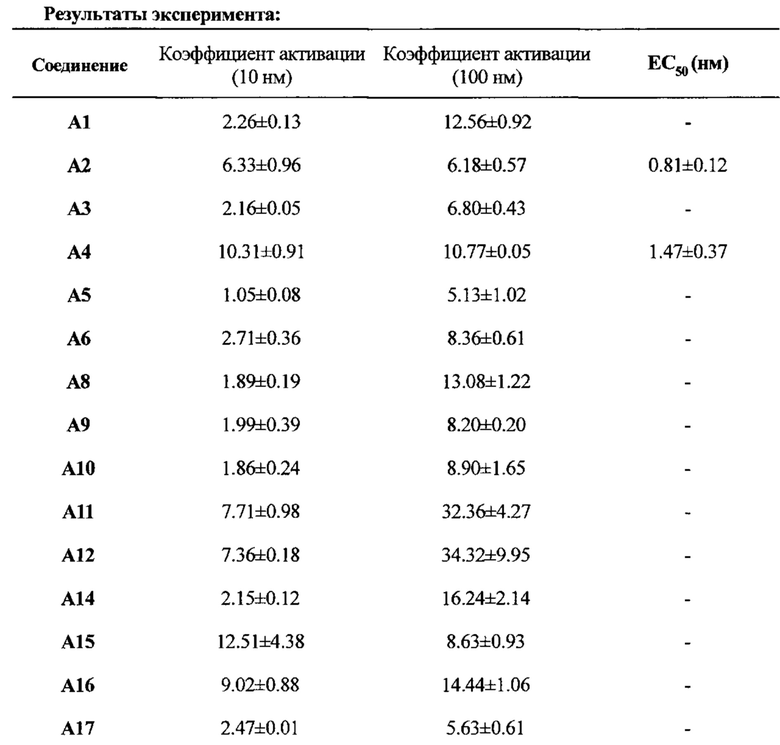

2. Проверка ингибирующего воздействия соединения на рост МТТ-тестом.
Принцип эксперимента: МТТ-тестом определяется ингибирующее воздействие испытуемого соединения на рост лейкозных клеток MV (4:11). Принцип заключается в том, что сукцинат дегидрогеназа в митохондриях в живых клетках может восстанавливать экзогенный тиазол синий до нерастворимого синего кристалла формазана.
МАТЕРИАЛЫ: Клеточная линия лейкемии MV4-11: острый лимфобластный лейкоз у детей, иммуно-бифенотип, содержащая слияние AF4-MLL t(4,11), которая является клеточной линией, чувствительной к ингибиторам ЛСД1, ингибирующим рост клеток (Cancer cell. 2012, 1721(4): 473-487).
Способ проведения эксперимента:
1. Клетки MV4-11 в логарифмической фазе роста точно подсчитывали при 16000 клеток/мл, и разбавленный раствор клеток добавляли в 96-луночные планшеты по 90 мкл на лунку.
2. Свежую питательную среду последовательно добавляли в 96-луночный планшет с клеточной жидкостью по 90 мкл на лунку.
3. На планшете с соединениями, 10 мМ испытуемого соединения, положительные соединения ORY-1001 и GSK2879552 последовательно разбавляли ДМСО в 3-кратном градиенте, по 8 точек для каждого.
4. 2 мкл разбавленного соединения соответственно добавляли в 96-луночный планшет, содержащий 98 мкл холостой питательной среды, а для группы ДМСО в 2 мкл ДМСО добавляли 98 мкл холостой питательной среды и перемешивали для дальнейшего использования.
5. Соединение, смешанное с питательной средой, отдельно в трех повторностях добавляли в 96-луночный планшет с клетками, по 20 мкл на лунку и смешивали. В холостую группу образцов добавляли 200 мкл питательной среды IMDM (среда, модифицированная по способу Дульбекко), а в группу ДМСО добавляли 180 мкл, содержащей клетки питательной среды в ДМСО, разбавленной питательной средой.
6. Инкубирование проводилось в течение 10 дней при температуре 37°С, 5% СО2;
7. Спустя 10 дней добавляли МТТ и считывали значения после 2.5 часов инкубации.
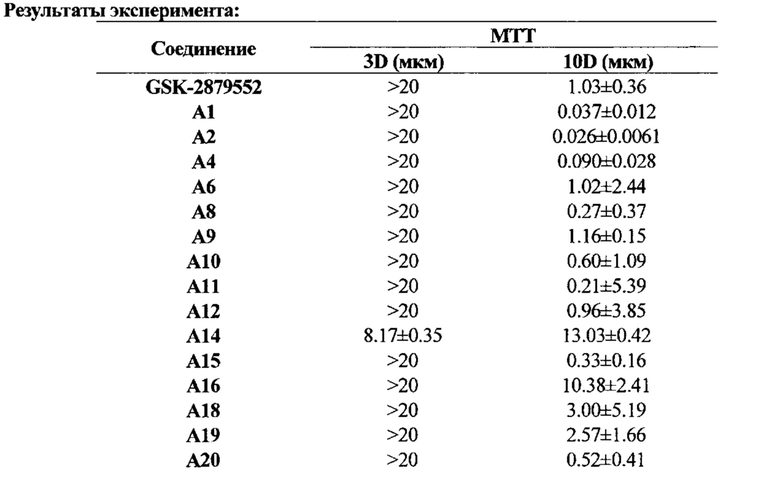

Пример 3: Оценка хронической эффективности на уровне животных:
Ингибирующее воздействие ингибитора ЛСД1 на рост подкожно пересаженной опухоли у голых мышей с острым миелоидным лейкозом человека MV4-11
Способ приготовления: лекарственное средство тщательно взвешивали, добавляли физиологический раствор и готовили в дозе 0,3 мг/мл, а объем дозы составлял 10 мл/кг.
Животные: Иммунодефицитные голые мыши Balb/c, самки, весом 17-20 г, приобретенные у компании Beijing Weitong Lihua Experimental Animal Technology Co., Ltd., 5 животных в группе. Клеточная линия: Для инокуляции в правую подмышку голых мышей использовалась клеточная линия MV4-11, и количество инокулята составляло 5×106 клеток/животное. Эксперимент начинали после образования трансплантированной опухоли.
Способ проведения эксперимента:
Для самок голых мышей весом 20±3 г, клетки MV4-11 вводили в правую подмышку голых мышей в количестве, равном 5×106/мышь. После образования опухоли диаметр трансплантированной опухоли измеряли с помощью штангенциркуля. И после того как опухоль выросла до 100-300 мм3, животных разделяли на контрольную группу и группу, которой вводили лекарственное средство, в зависимости от массы тела и объема опухоли, по 5 мышей в каждой группе. Модельной контрольной группе давали равное количество простого растворителя. После разделения животных на группы применяли кормление через желудочный зонд ежедневно на протяжении 21 дня.
Степень ингибирования массы опухоли, % = (Wc-WT)/Wc×100%
Примечание: Wc: масса опухоли в контрольной группе, WT: масса опухоли в группе лечения.
Обработка данных: данные выражали в виде среднего значения ± стандартное отклонение, а статистические методы, используемые для получения значимого результата, представляли собой двусторонний анализ T-TEST.

Пример 4: Фармакокинетический эксперимент на мышах
Способ проведения эксперимента:
GSK2879552 15 мкл образца плазмы помещали в центрифужную пробирку и добавляли 60 мкл смеси метанол : ацетонитрил (1:1, объем/объем), перемешивали в течение 1 минуты и центрифугировали (11000 об/мин) в течение 5 минут, затем к 20 мкл надосадочной жидкости, добавляли 80 мкл воды, перемешивали и анализировали. Линейный диапазон GSK2879552 составлял 0.3-12500 нг/мл.
А1 15 мкл образца плазмы помещали в центрифужную пробирку и добавляли 60 мкл смеси метанол : ацетонитрил (1:1, объем/объем), перемешивали в течение 1 минуты, и центрифугировали (11000 об/мин) в течение 5 минут, затем к 20 мкл надосадочной жидкости добавляли 80 мкл воды, перемешивали и анализировали. Линейный диапазон А1 составлял 3.0-25000 нг/мл.
А2 15 мкл образца плазмы помещали в центрифужную пробирку и добавляли 60 мкл смеси метанол : ацетонитрил (1:1, объем/объем), перемешивали в течение 1 минуты, и центрифугировали (11000 об/мин) в течение 5 минут, затем к 20 мкл надосадочной жидкости добавляли 40 мкл воды, перемешивали и анализировали. Линейный диапазон А2 составлял 0.3-5000 нг/мл.
А4 15 мкл образца плазмы помещали в центрифужную пробирку и добавляли 60 мкл смеси метанол : ацетонитрил (1:1, объем/объем), перемешивали в течение 1 минуты, и центрифугировали (11000 об/мин) в течение 5 минут, затем к 20 мкл надосадочной жидкости добавляли 40 мкл воды, перемешивали и анализировали. Линейный диапазон А4 составлял 1.0-5000 нг/мл.
Способы проведения эксперимента А43, А90, (1R, 2S)-A43 и (1R, 2S)-А90 аналогичны А1.
Результаты эксперимента:
Сводная таблица фармакокинетических параметров GSK2879552, А1, А2, А4, А43, А90, (1R, 2S)-A43 и (1R, 2S)-A90

Все материалы, упомянутые в настоящей заявке, включены в настоящий документ посредством ссылки, как если бы каждый из них был включен отдельно посредством ссылки. Также следует понимать, что после прочтения упомянутых руководств специалисты в данной области техники могут вносить различные изменения и поправки в настоящее изобретение. Данные эквиваленты также входят в область, определяемую прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЕ ИЗОИНДОЛИН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813232C2 |
| Соединения С,O-спиро-арил-гликозидов, их приготовление и их использование | 2016 |
|
RU2746858C2 |
| О-АМИНОГЕТЕРОАРИЛАЛКИНИЛСОДЕРЖАЩЕЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2797694C2 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2833035C2 |
| СПОСОБ СИНТЕЗИРОВАНИЯ НОВОГО ХИРАЛЬНОГО ЛИГАНДА, ХЕЛАТА МЕТАЛЛА, РАЗЛИЧНЫХ НЕПРИРОДНЫХ АМИНОКИСЛОТ, МАРАВИРОКА И ЕГО ОСНОВНЫХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2017 |
|
RU2727723C1 |
| ПРОИЗВОДНЫЕ ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ C-KIT | 2016 |
|
RU2754858C2 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2758686C2 |
| КЛАСС БИФУНКЦИОНАЛЬНЫХ ХИМЕРНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ ДЛЯ НАПРАВЛЕННОГО РАЗРУШЕНИЯ АНДРОГЕННЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2825000C2 |
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| Гетероциклическое соединение в качестве ингибитора протеинкиназы | 2018 |
|
RU2783723C2 |
Изобретение относится к соединению формулы I, которое является ингибитором лизинспецифической деметилазы 1 (ЛСД1) его рацемату, R-изомеру, S-изомеру, фармацевтической соли и их смеси, способам их получения, фармацевтической композиции на их основе, их применению для лечения и способу лечения злокачественного опухолевого заболевания, связанного с активностью ЛСД1, ингибитору ЛСД1. В общей формуле I А выбран из группы, состоящей из замещенного или незамещенного 6-12-членного ароматического кольца, замещенного или незамещенного 5-10-членного ароматического гетероциклического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, при этом каждое замещенное ароматическое кольцо или замещенное ароматическое гетероциклическое кольцо содержит от 1 до 2 заместителей, каждый R1 независимо или отсутствует, или выбран из группы, состоящей из незамещенного фенила, водорода, замещенного или незамещенного C1-C6 алкила, -SO2Ra, -NНC(O)Ra, -C(O)O(CH2)mRa, -C(O)ORa, -C(O)Ra, -C(O)NRaRb, -C(S)NRaRb, -NRcRd, замещенной или незамещенной аминогруппы, замещенного или незамещенного сульфонамида, замещенного или незамещенного 6-12-членного арилС1-С3алкила и незамещенного 5-6-членного гетероарилС1-С3алкила с одним атомом азота или серы в качестве гетероатома, причем m представляет собой целое число от 1 до 2; каждый Ra независимо представляет собой водород, незамещенный фенил, замещенный или незамещенный С3-С7 циклоалкил, замещенную или незамещенную 6-членную гетероциклическую группу с одним атомом азота в качестве гетероатома, замещенный или незамещенный C3-C7гетероциклоС1-алкил с одним атомом азота в качестве гетероатома, замещенный или незамещенный C1-C6 алкил, замещенный или незамещенный C1-C6 алкенил, замещенный или незамещенный C1-C4 алкокси, замещенный или незамещенный фенилС1-С2алкил или замещенный или незамещенный 5-9-членный гетероарилС1-С2алкил с одним гетероатомом, выбранным из азота, серы и кислорода, Rb является водородом или C1-C3-алкилом, или при присоединении к одному и тому же атому Ra и Rb вместе образуют 5- или 6-членное гетероциклоалкильное кольцо; Rc и Rd каждый независимо выбран из водорода, незамещенного C1-C3 алкила с линейной или разветвленной цепью, незамещенного бензила; R3 является C1-C4-алкилом, ацилом, -C(O)CF3 или водородом; W является -(CH2)1-2- или -CH(Re)-, причем Re представляет собой CN или C1-алкил; Y является N, C или отсутствует; X является N или C; Z является O или (CH2)q, где q = 0-1, причем когда q = 0, Z представляет собой связь; n равно 0, при условии, что когда Z является O, то Y является N и X является C. 7 н. и 11 з.п. ф-лы, 7 табл., 136 пр.

1. Фторзамещенное соединение циклопропиламина, представляющее собой соединение со структурой общей формулы I, его рацемат, R-изомер, S-изомер или фармацевтически приемлемую соль:
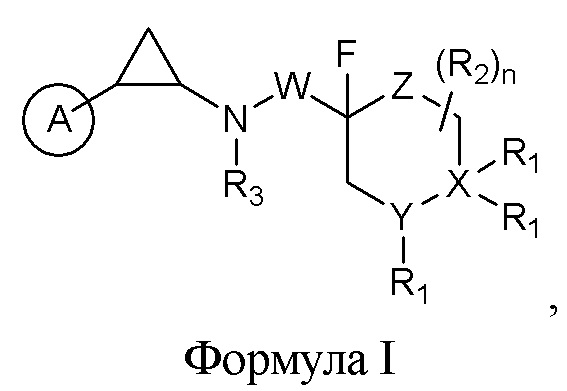
в которой
А выбран из группы, состоящей из замещенного или незамещенного 6-12-членного ароматического кольца, замещенного или незамещенного 5-10-членного ароматического гетероциклического кольца, содержащего от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, при этом каждое замещенное ароматическое кольцо или замещенное ароматическое гетероциклическое кольцо содержит от 1 до 2 заместителей, независимо выбранных из
галогена,
незамещенного C1-C12 линейного или разветвленного алкила,
незамещенной C1-C12 линейной или разветвленной алкоксигруппы,
незамещенной или замещенной C2-C12 линейной или разветвленной ненасыщенной углеводородной группы,
незамещенного C3-C6 циклоалкила,
C1-C6 линейного или разветвленного алкила, замещенного C1-C6-алкоксигруппой,
C1-C6 линейного или разветвленного алкила, замещенного C3-C6 циклоалкилом,
цианогруппы,
нитрогруппы,
оксогруппы,
незамещенного или замещенного C6-C12 арила,
замещенной фенилоксигруппы,
карбоксигруппы,
ацетила и
фенилсульфонила,
при этом заместитель выбран из группы, состоящей из галогена, C1-C4-алкила с линейной или разветвленной цепью, галогензамещенного C1-C4 алкила с линейной или разветвленной цепью, C1-C4 алкилокси, цианозамещенного фенила;
каждый R1 независимо или отсутствует, или выбран из группы, состоящей из незамещенного фенила, водорода, замещенного или незамещенного C1-C6 алкила, -SO2Ra, -NНC(O)Ra, -C(O)O(CH2)mRa, -C(O)ORa, -C(O)Ra, -C(O)NRaRb, -C(S)NRaRb, -NRcRd, замещенной или незамещенной аминогруппы, замещенного или незамещенного сульфонамида, замещенного или незамещенного 6-12-членного арилС1-С3алкила и незамещенного 5-6-членного гетероарилС1-С3алкила с одним атомом азота или серы в качестве гетероатома, причем m представляет собой целое число от 1 до 2;
а заместитель выбирается из группы, состоящей из галогена, гидрокси, карбокси, циано, C1-C4 алкильной сложноэфирной группы, C1-C4 алкилсульфонила, аминофениламида ( ), циклогексила и фенила;
), циклогексила и фенила;
каждый Ra независимо представляет собой водород, незамещенный фенил,
замещенный или незамещенный С3-С7 циклоалкил,
замещенную или незамещенную 6-членную гетероциклическую группу с одним атомом азота в качестве гетероатома,
замещенный или незамещенный C3-C7гетероциклоС1-алкил с одним атомом азота в качестве гетероатома,
замещенный или незамещенный C1-C6 алкил,
замещенный или незамещенный C1-C6 алкенил,
замещенный или незамещенный C1-C4 алкокси,
замещенный или незамещенный фенилС1-С2алкил
или замещенный или незамещенный 5-9-членный гетероарилС1-С2алкил с одним гетероатомом, выбранным из азота, серы и кислорода,
при этом заместитель выбран из группы, состоящей из: C1-C4 алкила, C3-C7 циклоалкила 3-членной циклическойС1алкильной группы, 4-6-членной гетероциклической группы с одним атомом азота в качестве гетероатома, бензилзамещенного 6-членного гетероциклоалкила с одним атомом азота в качестве гетероатома, фенила, галогена, C1-C4 алкокси, C1-C4 галогеналкила, карбоксила и карбоксилзамещенной бензиловой группы;
Rb является водородом или C1-C3-алкилом, или при присоединении к одному и тому же атому Ra и Rb вместе образуют 5- или 6-членное гетероциклоалкильное кольцо;
Rc и Rd каждый независимо выбран из водорода, незамещенного C1-C3 алкила с линейной или разветвленной цепью, незамещенного бензила;
R3 является C1-C4-алкилом, ацилом, -C(O)CF3 или водородом;
W является -(CH2)1-2- или -CH(Re)-, причем Re представляет собой CN или C1-алкил;
Y является N, C или отсутствует;
X является N или C;
Z является O или (CH2)q, где q = 0-1, причем когда q = 0, Z представляет собой связь;
n равно 0,
при условии, что когда Z является O, то Y является N и X является C,
причем, если не указано иное, арил представляет собой C6-C12 арил, а гетероарил представляет собой 5-10-членный гетероарил;
или соединение
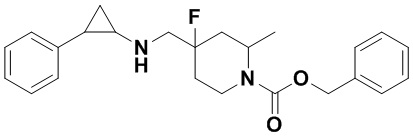 или
или  ,
,
или фармацевтически приемлемую соль одного из этих соединений.
2. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что А представляет собой замещенное или незамещенное бензольное кольцо или замещенное или незамещенное 5-10-членное ароматическое гетероциклическое кольцо, содержащее от 1 до 2 гетероатомов, выбранных из группы, состоящей из кислорода, серы и азота, причем каждое замещенное бензольное кольцо или замещенное ароматическое гетероциклическое кольцо содержит от 1 до 2 заместителей,
выбранных из галогена, нитрогруппы, C1-C4-алкила, C1-C4-алкокси, цианогруппы, оксогруппы, фенилсульфонила, незамещенного или замещенного фенила, содержащего 1-2 заместителя, выбранных из галогена, C1-C2-алкила, галогензамещенного C1-алкила, C1-C2 алкилокси.
3. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что
каждый R1 независимо выбирается из: замещенного или незамещенного фенила, водорода, замещенного или незамещенного C1-C6 алкила, -SO2Ra, -NНC(O)Ra, -C(O)ORa, -C(O)Ra, -C(O)NRaRb, -NRcRd, замещенного или незамещенного 6-12-членного арилС1-С3алкила и незамещенного 5-6-членного гетероарилС1-С3алкила с одним атомом азота или серы в качестве гетероатома,
а заместитель выбирается из группы, состоящей из гидрокси, карбокси, циано, C1-C4 алкильной сложноэфирной группы, C1-C4 алкилсульфонила, аминофениламида, циклогексила и фенила;
каждый Ra независимо представляет собой водород, незамещенный фенил, замещенный или незамещенный C3-C7 циклоалкил, замещенный или незамещенный C1-C4 алкил, замещенный или незамещенный C1-C4 алкенил, замещенный C1-C4 алкокси, при этом заместитель выбран из группы, состоящей из: C1-C4 алкила, C3-C7 циклоалкила, 4-6-членной гетероциклической группы с одним атомом азота в качестве гетероатома, бензилзамещенного 6-членного гетероциклоалкила с одним атомом азота в качестве гетероатома, фенила, галогена, C1-C4 алкокси, C1-C4 галогеналкила, карбоксила;
Rb является водородом или C1-C3 алкилом;
Rc и Rd каждый независимо выбран из водорода, неразветвленного или разветвленного C1-C3 алкила или незамещенного бензила.
4. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что X является N,
а R1, присоединенный к X, выбран из замещенного или незамещенного фенила, замещенного или незамещенного 6-12-членного арилС1-С3алкила и незамещенного 5-6-членного гетероарилС1-С3алкила с одним атомом азота или серы в качестве гетероатома,
причем заместитель выбран из группы, состоящей из циклогексила, фенила, гидрокси, карбокси, С1-С4 алкильной сложноэфирной группы.
5. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что X является N,
а R1, присоединенный к X, выбран из замещенного или незамещенного 6-12-членного арилC1-C3алкила и незамещенного 5-6-членного гетероарилC1-C3алкила с одним атомом азота или серы в качестве гетероатома, причем заместитель выбран из группы, состоящей из циклогексила, фенила, гидрокси, карбокси, и С1-С4 алкильной сложноэфирной группы.
6. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что W является группой -(CH2)1-2.
7. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что структура соединения показана формулой (1R, 2S)-Ia или формулой (1R, 2S)-Ib:

в которых радикалы A, W, X, Y, Z, R1, R2 и R3 имеют значения в соответствии с указанным в п. 1.
8. Фторзамещенное соединение циклопропиламина по п. 1, выбранное из следующих соединений:







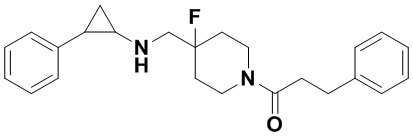
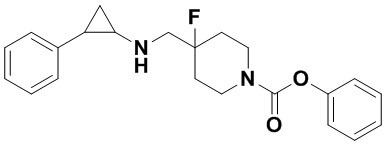







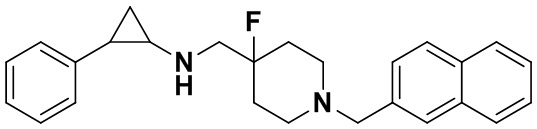




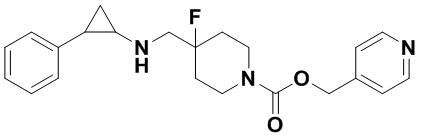
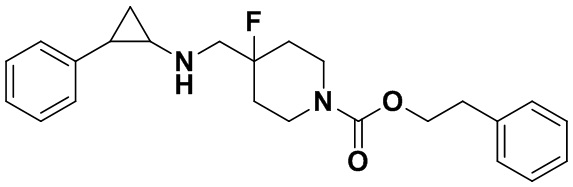
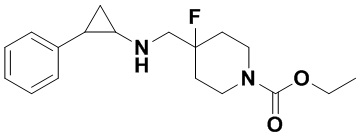











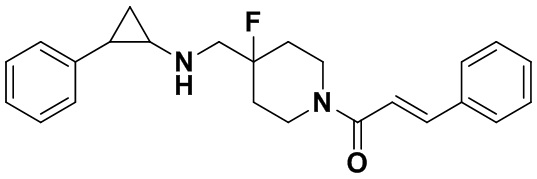
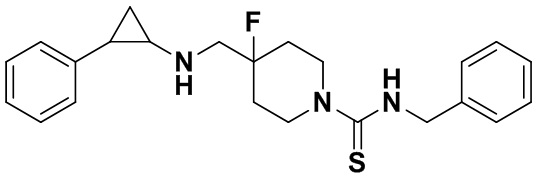



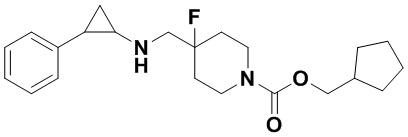


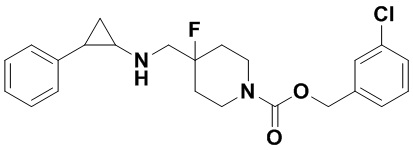






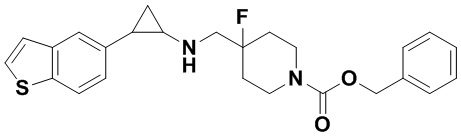






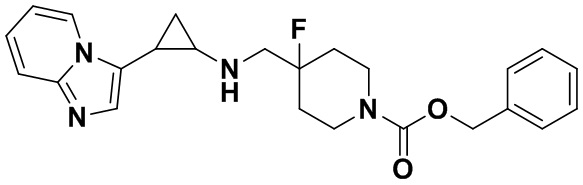






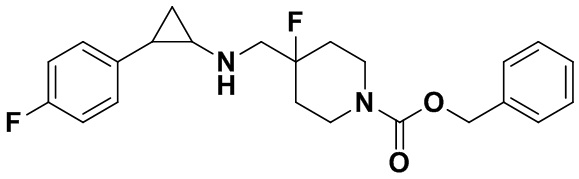
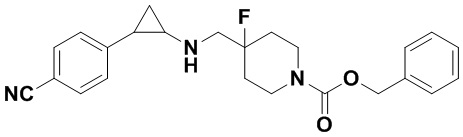




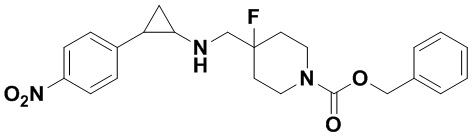
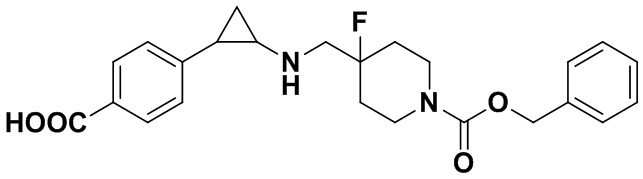


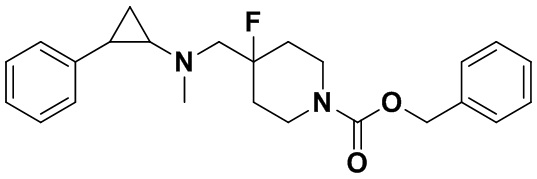





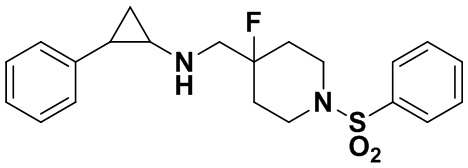

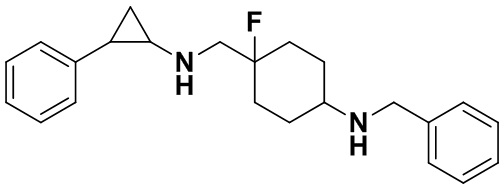


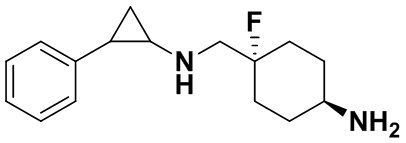


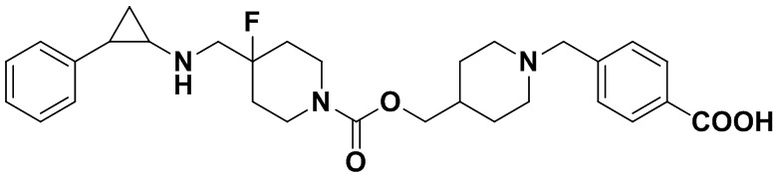





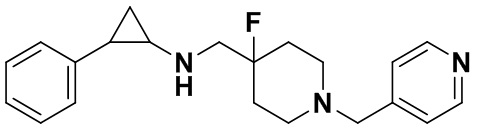





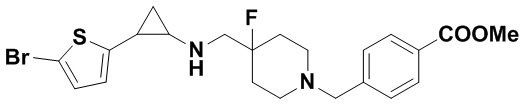

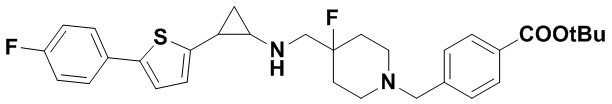

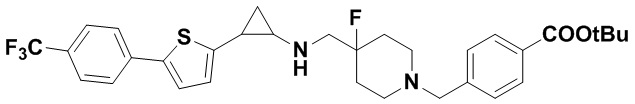

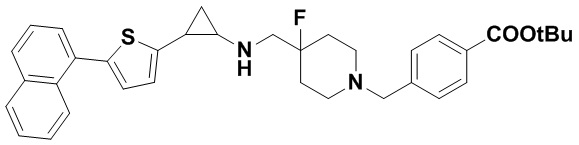







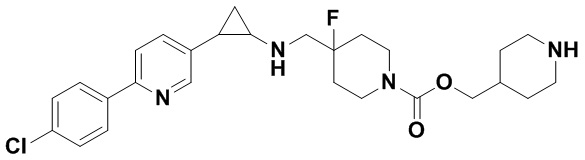


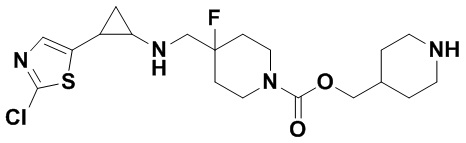


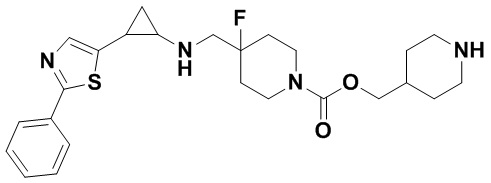

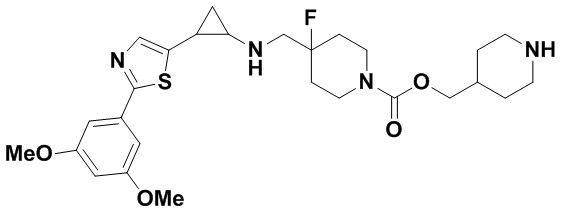
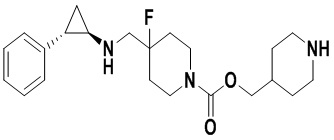
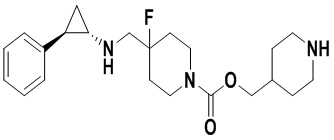
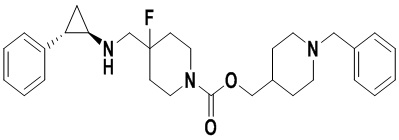
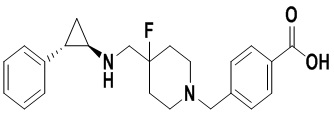

9. Фторзамещенное соединение циклопропиламина по п. 1, характеризующееся тем, что фармацевтически приемлемая соль получена при взаимодействии соединения формулы I с неорганической кислотой, такой как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, аминосульфоновая кислота или фосфорная кислота, или с органической кислотой, такой как лимонная кислота, винная кислота, молочная кислота, пировиноградная кислота, уксусная кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, нафталинсульфоновая кислота, этансульфоновая кислота, нафталиндисульфоновая кислота, малеиновая кислота, яблочная кислота, малоновая кислота, фумаровая кислота, янтарная кислота, пропионовая кислота, щавелевая кислота, трифторуксусная кислота, стеариновая кислота, памовая кислота, гидроксималеиновая кислота, фенилуксусная кислота, бензойная кислота, салициловая кислота, глутаминовая кислота, аскорбиновая кислота, п-анилинсульфоновая кислота, 2-ацетоксибензойная кислота и изэтионовая кислота; или является натриевой, калиевой, кальциевой, алюминиевой или аммониевой солью соединения формулы I, полученной при его взаимодействии с неорганическим основанием; или является солью, образованной при взаимодействии соединения формулы I с органическим основанием, такой как метанаминовая соль, этиламиновая соль или этаноламиновая соль.
10. Способ получения фторзамещенного соединения циклопропиламина по п. 1, характеризующийся тем, что процесс осуществляют по схеме 1,
согласно которой обеспечивают взаимодействие соединений с формулой (II) и (III) в условиях восстановительного аминирования с получением соединения с формулой (I):
 ,
,
где радикалы A, W, X, Y, Z, R1, R2 и R3 имеют значения в соответствии с указанным в п. 1, а n равно 0-1, R4 выбирается из группы, состоящей из H и метила, V является группой -CH2-W- или -W-CH2.
11. Способ получения фторзамещенного соединения циклопропиламина по п. 1, характеризующийся тем, что процесс осуществляют по схеме 2, согласно которой обеспечивают взаимодействие соединения с формулой (IV) и соединения с формулой (V) с образованием соединения с формулой (VI); затем защищают аминогруппу и получают соединение с формулой (VII) путем удаления защитной группы у X группы, Y группы или у обеих групп; функционализируют соединение с формулой (VII) заместителем R1 с образованием соединения формулы (VIII); удаляют защиту с аминогруппы и функционализируют соединение формулы (VIII) группой R3 с получением соединения формулы (I):
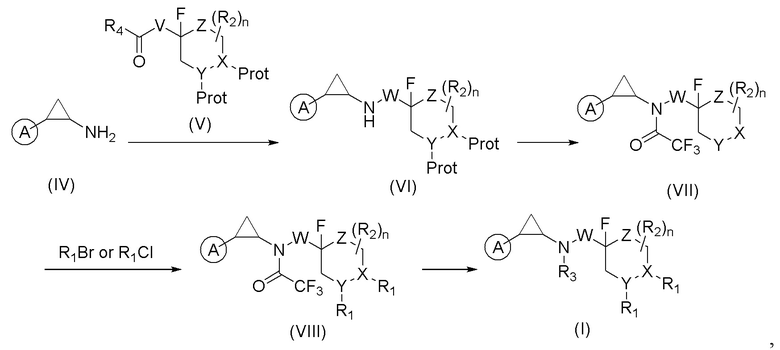 ,
,
причем радикалы A, W, X, Y, Z, R1, R2 и R3 имеют значения в соответствии с указанным в п. 1, R4 выбирается из группы, состоящей из H и метила, V является группой -CH2-W- или -W-CH2-, а n равно 0-1.
12. Способ получения по п. 10, характеризующийся тем, что способ получения соединения с формулой (II), включает следующую стадию:
конденсируют соединение коричной кислоты формулы (IX) с диметилгидроксиламином в присутствии конденсирующего агента и основания с получением амидного соединения формулы (X); подвергают соединение формулы (X) циклопропилированию с получением соединения формулы (XI); гидролизуют соединение формулы (XI) с получением соединения формулы (XII); подвергают взаимодействию соединение формулы (XII) в условиях перегруппировки Курциуса с получением соединения формулы (IV); функционализируют соединение с формулой (IV) группой R3 с получением соединения с формулой (II) согласно схеме 3:
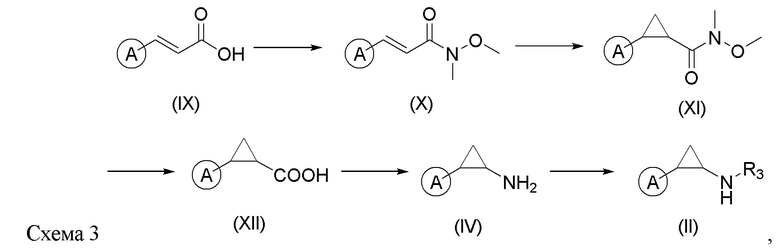
где радикалы A и R3 имеют значения в соответствии с указанным в п. 1.
13. Фармацевтическая композиция, обладающая свойством ингибитора лизинспецифической деметилазы 1 (ЛСД1), включающая терапевтически эффективное количество фторзамещенного соединения циклопропиламина по любому из пп. 1-9 и по меньшей мере один фармацевтически приемлемый носитель, наполнитель, адъювант, вспомогательное вещество и/или разбавитель.
14. Ингибитор лизинспецифической деметилазы 1 (ЛСД1), включающий терапевтически эффективное количество по меньшей мере одного фторзамещенного соединения циклопропиламина по любому из пп. 1-9 и по меньшей мере один фармацевтически приемлемый носитель, наполнитель, адъювант, вспомогательное вещество и/или разбавитель.
15. Применение фторзамещенного соединения циклопропиламина по любому из пп. 1-9 для лечения или профилактики злокачественного опухолевого заболевания, связанного с активностью лизинспецифической деметилазы 1 (ЛСД1).
16. Применение по п. 15, в котором опухолевое заболевание, связанное с активностью лизинспецифической деметилазы 1 (ЛСД1), выбрано из группы, состоящей из рака головного мозга (глиомы), глиобластомы, лейкоза, синдрома Баннаяна-Зонана, болезни Коудена, диспластической мозжечковой ганглионевромы, рака молочной железы, воспалительного рака молочной железы, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, рака почек, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, гигантоклеточной опухоли щитовидной железы и костей.
17. Способ лечения злокачественного опухолевого заболевания, связанного с активностью лизинспецифической деметилазы 1 (ЛСД1), заключающийся во введении больному терапевтически эффективного количества фторзамещенного соединения циклопропиламина по любому из пп. 1-9.
18. Способ по п. 17, в котором опухолевое заболевание, связанное с активностью лизинспецифической деметилазы 1 (ЛСД1), выбрано из группы, состоящей из рака головного мозга (глиомы), глиобластомы, лейкоза, синдрома Баннаяна-Зонана, болезни Коудена, диспластической мозжечковой ганглионевромы, рака молочной железы, воспалительного рака молочной железы, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака толстой кишки, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, рака почек, рака яичников, рака поджелудочной железы, рака простаты, саркомы, остеосаркомы, гигантоклеточной опухоли щитовидной железы и костей.
| WO 2015123437 A1, 20.08.2015 | |||
| WO 2015123465 A1, 20.08.2015 | |||
| RU 2013108702 A, 10.09.2014. |
Авторы
Даты
2021-04-12—Публикация
2017-03-16—Подача