[Область изобретения]
[0001]
Настоящее изобретение относится к противоопухолевому средству, потенциирующему противоопухолевый эффект средству и препарату в наборе, содержащему ингибитор функции ДНК и иммуномодулятор.
[Предпосылки изобретения]
[0002]
В качестве нового терапевтического средства, сосредоточенного на механизме репликации ДНК в клетках, общеизвестно лекарственное средство, содержащее трифлуридин (также известный как α,α,α-трифтортимидин; далее в настоящем описании также обозначаемый как «FTD») и гидрохлорид типирацила (химическое название: 5-хлор-6-[(2-иминопирролидин-1-ил)метил]пиримидин-2,4(1H,3H)-диона гидрохлорид; далее в настоящем описании также обозначаемый как «TPI»). FTD проявляет противоопухолевый эффект благодаря ингибированию синтеза ДНК посредством ингибирующей образование тимидилата активности и ингибированию функции ДНК посредством встраивания в ДНК. TPI обладает ингибирующей тимидинфосфорилазу активностью и подавляет разрушение FTD тимидинфосфорилазой в живом организме, тем самым потенцируя противоопухолевый эффект FTD (патентная литература 1). В настоящее время разрабатывают противоопухолевое средство, содержащее FTD и TPI в молярном соотношении 1:0,5 (далее в настоящем описании также обозначаемое как «комбинированное FTD/TPI лекарственное средство»), в качестве терапевтического средства для солидной злокачественной опухоли. Оно одобрено в качестве терапевтического средства для метастатической злокачественной опухоли толстой кишки в Японии и Соединенных Штатах (непатентная литература 1 и 2).
[0003]
Также в последние годы дезоксиуридинтрифосфатаза (далее в настоящем описании также обозначаемая как «дУТФаза») привлекал внимание в качестве нового механизма действия для лечения злокачественных опухолей, сосредоточенного на механизме репликации ДНК (патентная литература 2). ДУТФаза специфически распознает только дезоксиуридинтрифосфат (дУТФ), представляет собой один из ферментов, которые разрушают его до дезоксиуридинмонофосфата (дУМФ) и пирофосфорной кислоты, а также специфически распознает и разрушает фтордезоксиуридинтрифосфат (F-дУТФ), такой как 5-фторурацил (далее в настоящем описании также обозначаемый как «5-FU»), метаболизируемый из фторированного антиметаболита пиримидина. Известно, что когда фторированный антиметаболит пиримидина и ингибитор дУТФазы действуют на клетки одновременно, уров*нь дУТФ и уровень F-дУТФ в клетках возрастает и, следовательно, встраивание F-дУТФ в ДНК значительно возрастает, вызывая ингибирование функции ДНК (патентная литература 3).
Стандартно 5-FU и его производные, широко используемые в клинической практике, претерпевают фосфорилирование в организме для формирования фтордезоксиуридинмонофосфат (F-дУМФ), подавляют синтез тимидилата и ингибируют синтез ДНК. Кроме того, в клетке 5-FU и его производные метаболизируются до фторуридинтрифосфата (F-УТФ) и встраиваются в РНК, чтобы вызывать ингибирование функции РНК. Известно, что F-дУМФ, образуемый в организме, встраивается в ДНК в виде F-дУТФ, но его количество слишком мало, чтобы вызывать ингибирование функции ДНК (непатентная литература 3). Таким образом, 5-FU и его производные представляют собой лекарственные средства, проявляющие противоопухолевый эффект через ингибирование синтеза ДНК и ингибирование функции РНК и сами по себе не являются лекарственными средствами, проявляющими противоопухолевый эффект через ингибирование функции ДНК, таким образом, отличаясь от вышеуказанного комбинированного FTD/TPI лекарственного средства, а также от лекарственного средства, содержащего ингибитор дУТФазы и фторированный антиметаболит пиримидина.
[0004]
С другой стороны, в настоящее время разработка иммунотерапии злокачественных опухолей продвинулась вперед в качестве одного из новых способов терапии злокачественных опухолей.
Активацию адаптивного иммунного ответа начинают с ассоциирования комплекса антигенного пептида и MHC с T-клеточным рецептором (TCR). Ассоциирование дополнительно регулируют с помощью совместной стимуляции или совместного ингибирования посредством ассоциирования между семейством B7, которое представляет собой костимулирующую молекулу, и семейством CD28, которое является ее рецептором. В частности, чтобы активировать T-клетки антиген-специфическим образом, необходимы два характерных сигнальных события, а T-клетки, получающие только антигенную стимуляцию без получения совместной стимуляции от семейства B7, становятся молчащими посредством анергии, что ведет к возникновению иммунологической толерантности.
Клетки злокачественной опухоли супрессируют активацию антиген-специфических T-клеток с использованием этого механизма, тем самым уходя от иммунного надзора и продолжая рост. Следовательно, для лечения злокачественных опухолей считают эффективным индуцировать противоопухолевый иммунный ответ в живом организме пациента со злокачественной опухолью посредством усиления совместной стимуляции и блокирования совместного ингибирования, а также управлять ускользанием опухоли от иммунного ответа. Предложены различные виды иммунотерапии злокачественных опухолей, направленные на костимулирующую молекулу (стимулирующую костимулирующую молекулу) или совместно ингибирующую молекулу (ингибирующую костимулирующую молекулу) (непатентная литература 4). Например, ниволумаб (моноклональное антитело IgG4 человека к PD-1 человека) использовали для лечения, например, злокачественной меланомы в качестве иммуномодулятора, который активирует T-клетки посредством ингибирования связывания между PD-1 и его лигандом (PD-L1 и PD-L2) (патентная литература 4 и непатентная литература 5).
[0005]
Кроме того, также исследовали комбинированное лечение с помощью комбинации иммунотерапии злокачественной опухоли с другим способом(ами) лечения злокачественных опухолей, и, например, сообщалось о комбинированном лечении, включающем антагонист связывания PD-1 и 5-FU (патентная литература 5).
Однако, как описано выше, фторированные антиметаболиты пиримидина, такие как 5-FU, не являются такими лекарственными средствами, поскольку проявляют противоопухолевый эффект через ингибирование функции ДНК. Таким образом, до сих пор не предпринято попыток комбинированного лечения между ингибитором функции ДНК и иммуномодулятором, таким как антитело против PD-1.
[Список цитируемой литературы]
[Патентная литература]
[0006]
Патентная литература 1: WO 96/30346
Патентная литература 2: WO 2009/147843
Патентная литература 3: WO 2011/065541
Патентная литература 4: WO 2004/004771
Патентная литература 5: WO 2013/181452
[Непатентная литература]
[0007]
Непатентная литература 1: Invest New Drugs. 2008; 26(5): 445-54.
Непатентная литература 2: Lancet Oncol. 2012; 13(10): 993-1001.
Непатентная литература 3: Mol Pharmacol. 2004; 66(3): 620-6.
Непатентная литература 4: Nat Rev Cancer. 2012; 12(4): 252-64.
Непатентная литература 5: N Engl J Med. 2012; 366(26): 2443-54.
[Сущность изобретения]
[Проблемы, подлежащие решению с помощью изобретения]
[0008]
Цель настоящего изобретения состоит в том, чтобы предоставить новый способ лечения злокачественных опухолей со сниженными побочными эффектами, который при этом демонстрирует удивительно превосходный противоопухолевый эффект.
[Средство решения проблемы]
[0009]
Автор настоящего изобретения исследовал противоопухолевый эффект с использованием
- лекарственного средства, содержащего FTD, который представляет собой ингибитор функции ДНК, или лекарственного средства, содержащего как ингибитор дУТФазы, так и фторированный антиметаболит пиримидина, и
- антитела против PD-1 или антитела против PD-L1, которое представляет собой иммуномодулятор, в комбинации, и, следовательно, обнаружил, что происходит дополнительное удивительное потенцирование противоопухолевого эффекта без возникновения серьезных побочных эффектов, по сравнению со случаем использования любого из этих лекарственных средств.
[0010]
Таким образом, настоящее изобретение предусматривает следующие изобретения с [1] до [81]:
[1] противоопухолевое средство, включающее введение ингибитора функции ДНК и иммуномодулятора в комбинации.
[2] Противоопухолевое средство в соответствии с [1], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее трифлуридин, или лекарственное средство, содержащее ингибитор дезоксиуридинтрифосфатазы и фторированный антиметаболит пиримидина.
[3] Противоопухолевое средство в соответствии с [1] или [2], где ингибитор функции ДНК представляет собой комбинированное лекарственное средство, содержащее трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5.
[4] Противоопухолевое средство в соответствии с [1] или [2], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид или его фармацевтически приемлемую соль и фторированный антиметаболит пиримидина.
[5] Противоопухолевое средство в соответствии с [4], в котором фторированный антиметаболит пиримидина представляет собой комбинированное лекарственное средстве, содержащее тегафур, гимерацил и отерацил калия в молярном соотношении 1:0,4:1, или капецитабин.
[6] Противоопухолевое средство в соответствии с любым одним из [1]-[5], где иммуномодулятор представляет собой антагонист пути PD-1, антагонист пути ICOS, антагонист пути CTLA-4, антагонист пути CD28 или их комбинацию.
[7] Противоопухолевое средство в соответствии с [6], где антагонист пути PD-1 представляет собой антитело против PD-1, антитело против PD-L1, антитело против PD-L2 или их комбинацию.
[8] Противоопухолевое средство в соответствии с [7], в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
[9] Противоопухолевое средство в соответствии с [6], где антагонист пути CTLA-4 представляет собой антитело против CTLA-4.
[10] Противоопухолевое средство в соответствии с [9], где антитело против CTLA-4 представляет собой ипилимумаб или тремелимумаб.
[11] Противоопухолевое средство в соответствии с любым одним из [1]-[3] и [6]-[10], где суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
[12] Противоопухолевое средство в соответствии с любым одним из [1]-[3] и [6]-[10], где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
[13] Противоопухолевое средство в соответствии с любым одним из [1]-[12], где злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
[14] Противоопухолевое средство в соответствии с любым одним из [1]-[13], где злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
[15] Потенциирующее противоопухолевый эффект средство, содержащее ингибитор функции ДНК для потенциирования противоопухолевого эффекта иммуномодулятора.
[16] Потенциирующее противоопухолевый эффект средство, содержащее иммуномодулятор для потенциирования противоопухолевого эффекта ингибитора функции ДНК.
[17] Противоопухолевое средство, содержащее ингибитор функции ДНК, для лечения пациента со злокачественной опухолью, которому вводили иммуномодулятор.
[18] Противоопухолевое средство, содержащее иммуномодулятор, для лечения пациента со злокачественной опухолью, которому вводили ингибитор функции ДНК.
[19] Противоопухолевое средство, содержащее ингибитор функции ДНК, которое используют в комбинации с иммуномодулятором.
[20] Противоопухолевое средство, содержащее иммуномодулятор, который используют в комбинации с ингибитором функции ДНК.
[21] Препарат в наборе, содержащий противоопухолевое средство, содержащее ингибитор функции ДНК, и инструкцию по использованию, инструкция по использованию описывает, что ингибитор функции ДНК и иммуномодулятор вводят пациенту со злокачественной опухолью в комбинации.
[22] Использование ингибитора функции ДНК и иммуномодулятора для получения противоопухолевого средства.
[23] Использование в соответствии с [22], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее трифлуридин, или лекарственное средство, содержащее ингибитор дезоксиуридинтрифосфатазы и фторированный антиметаболит пиримидина.
[24] Использование в соответствии с [22] или [23], в котором ингибитор функции ДНК представляет собой комбинированное лекарственное средство, содержащее трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5.
[25] Использование в соответствии с [22] или [23], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид или его фармацевтически приемлемую соль и фторированный антиметаболит пиримидина.
[26] Использование в соответствии с [25], в котором фторированный антиметаболит пиримидина представляет собой комбинированное лекарственное средство, содержащее тегафур, гимерацил и отерацил калия в молярном соотношении 1:0,4:1, или капецитабин.
[27] Использование в соответствии с любым из [22]-[26], в котором иммуномодулятор представляет собой антагонист пути PD-1, агонист пути ICOS, антагонист пути CTLA-4, агонист пути CD28 или их комбинацию.
[28] Использование в соответствии с [27], в котором антагонист пути PD-1 представляет собой антитело против PD-1, антитело против PD-L1, антитело против PD-L2 или их комбинацию.
[29] Использование в соответствии с [28], в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
[30] Использование в соответствии с [27], в котором антагонист пути CTLA-4 представляет собой антитело против CTLA-4.
[31] Использование в соответствии с [30], в котором антитело против CTLA-4 представляет собой ипилимумаб или тремелимумаб.
[32] Использование в соответствии с любым из [22]-[24] и [27]-[31], в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
[33] Использование в соответствии с любым из [22]-[24] и [27]-[31], в котором суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
[34] Использование в соответствии с любым из [22]-[33], в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
[35] Использование в соответствии с любым из [22]-[34], в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
[36] Использование ингибитора функции ДНК для получения потенциирующего противоопухолевый эффект средства для потенциирования противоопухолевого эффекта иммуномодулятора.
[37] Использование иммуномодулятора для получения потенциирующего противоопухолевый эффект средства для потенциирования противоопухолевого эффекта ингибитора функции ДНК.
[38] Использование ингибитора функции ДНК для получения противоопухолевого средства для лечения пациента со злокачественной опухолью, которому вводили иммуномодулятор.
[39] Использование иммуномодулятора для получения противоопухолевого средства для лечения пациента со злокачественной опухолью, которому вводили ингибитор функции ДНК.
[40] Использование ингибитора функции ДНК для получения противоопухолевого средства, используемого в комбинации с иммуномодулятором.
[41] Использование иммуномодулятора для получения противоопухолевого средства, используемого в комбинации с ингибитором функции ДНК.
[42] Комбинация ингибитора функции ДНК и иммуномодулятора для использования в лечении опухоли.
[43] Комбинация в соответствии с [42], в которой ингибитор функции ДНК представляет собой лекарственное средство, содержащее трифлуридин, или лекарственное средство, содержащее ингибитор дезоксиуридинтрифосфатазы и фторированный антиметаболит пиримидина.
[44] Комбинация в соответствии с [42] или [43], в которой ингибитор функции ДНК представляет собой комбинированное лекарственное средство, содержащее трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5.
[45] Комбинация в соответствии с [42] или [43], в которой ингибитор функции ДНК представляет собой лекарственное средство, содержащее (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид или его фармацевтически приемлемую соль и фторированный антиметаболит пиримидина.
[46] Комбинация в соответствии с [45], в которой фторированный антиметаболит пиримидина представляет собой комбинированное лекарственное средство, содержащее тегафур, гимерацил и отерацил калия в молярном соотношении 1:0,4:1, или капецитабин.
[47] Комбинация в соответствии с любым из [42]-[46], в которой иммуномодулятор представляет собой антагонист пути PD-1, агонист пути ICOS, антагонист пути CTLA-4, агонист пути CD28 или их комбинацию.
[48] Комбинация в соответствии с [47], в которой антагонист пути PD-1 представляет собой антитело против PD-1, антитело против PD-L1, антитело против PD-L2 или их комбинацию.
[49] Комбинация в соответствии с [48], в которой антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
[50] Комбинация в соответствии с [47], в которой антагонист пути CTLA-4 представляет собой антитело против CTLA-4.
[51] Комбинация в соответствии с [50], в которой антитело против CTLA-4 представляет собой ипилимумаб или тремелимумаб.
[52] Комбинация в соответствии с любым из [42]-[44] и [47]-[51], в которой суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
[53] Комбинация в соответствии с любым из [42]-[44] и [47]-[51], в которой суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
[54] Комбинация в соответствии с любым из [42]-[53], в которой злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
[55] Комбинация в соответствии с любым из [42]-[54], в которой злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
[56] Ингибитор функции ДНК для использования в потенциировании противоопухолевого эффекта иммуномодулятора.
[57] Иммуномодулятор для использования в потенциировании противоопухолевого эффекта ингибитора функции ДНК.
[58] Ингибитор функции ДНК для использования в лечении пациента со злокачественной опухолью, которому вводили иммуномодулятор.
[59] Иммуномодулятор для использования в лечении пациента со злокачественной опухолью, которому вводили ингибитор функции ДНК.
[60] Ингибитор функции ДНК для использования в лечении опухоли, используемый в комбинации с иммуномодулятором.
[61] Иммуномодулятор для использования в лечении опухоли, используемый в комбинации с ингибитором функции ДНК.
[62] Способ лечения опухоли, способ включает введение эффективных доз ингибитора функции ДНК и иммуномодулятора нуждающемуся в этом субъекту.
[63] Способ в соответствии с [62], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее трифлуридин, или лекарственное средство, содержащее ингибитор дезоксиуридинтрифосфатазы и фторированный антиметаболит пиримидина.
[64] Способ в соответствии с [62] или [63], в котором ингибитор функции ДНК представляет собой комбинированное лекарственное средство, содержащее трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5.
[65] Способ в соответствии с [62] или [63], в котором ингибитор функции ДНК представляет собой лекарственное средство, содержащее (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид или его фармацевтически приемлемую соль и фторированный антиметаболит пиримидина.
[66] Способ в соответствии с [65], в котором фторированный антиметаболит пиримидина представляет собой комбинированное лекарственное средство, содержащее тегафур, гимерацил и отерацил калия в молярном соотношении 1:0,4:1, или капецитабин.
[67] Способ в соответствии с любым из [62]-[66], в котором иммуномодулятор представляет собой антагонист пути PD-1, агонист пути ICOS, антагонист пути CTLA-4, агонист пути CD28 или их комбинацию.
[68] Способ в соответствии с [67], в котором антагонист пути PD-1 представляет собой антитело против PD-1, антитело против PD-L1, антитело против PD-L2 или их комбинацию.
[69] Способ в соответствии с [68], в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
[70] Способ в соответствии с [67], в котором антагонист пути CTLA-4 представляет собой антитело против CTLA-4.
[71] Способ в соответствии с [70], в котором антитело против CTLA-4 представляет собой ипилимумаб или тремелимумаб.
[72] Способ в соответствии с любым из [62]-[64] и [67]-[71], в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
[73] Способ в соответствии с любым из [62]-[64] и [67]-[71], в котором суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
[74] Способ в соответствии с любым из [62]-[73], в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
[75] Способ в соответствии с любым из [62]-[74], в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
[76] Способ потенциирования противоопухолевого эффекта иммуномодулятора, способ включает введение эффективной дозы ингибитора функции ДНК нуждающемуся в этом субъекту.
[77] Способ потенциирования противоопухолевого эффекта ингибитора функции ДНК, способ включает введение эффективной дозы иммуномодулятора нуждающемуся в этом субъекту.
[78] Способ лечения пациента со злокачественной опухолью, которому вводили иммуномодулятор, способ включает введение эффективной дозы ингибитора функции ДНК нуждающемуся в этом субъекту.
[79] Способ лечения пациента со злокачественной опухолью, которому вводили ингибитор функции ДНК, способ включает введение эффективной дозы иммуномодулятора нуждающемуся в этом субъекту.
[80] Способ лечения опухоли в комбинации с использованием иммуномодулятора, способ включает введение эффективной дозы ингибитора функции ДНК нуждающемуся в этом субъекту.
[81] Способ лечения опухоли в комбинации с использованием ингибитора функции ДНК, способ включает введение эффективной дозы иммуномодулятора нуждающемуся в этом субъекту.
[Эффекты изобретения]
[0011]
В соответствии с противоопухолевым средством по настоящему изобретению, возможно осуществлять лечение злокачественных опухолей, демонстрирующее высокий противоопухолевый эффект (в частности, эффект уменьшения размера опухоли и скорости роста опухоли (эффект пролонгирования жизни)), при этом супрессируя начало побочных эффектов. В конечном итоге, это приносит долгосрочную выживаемость пациентов со злокачественной опухолью.
[Краткое описание фигур]
[0012]
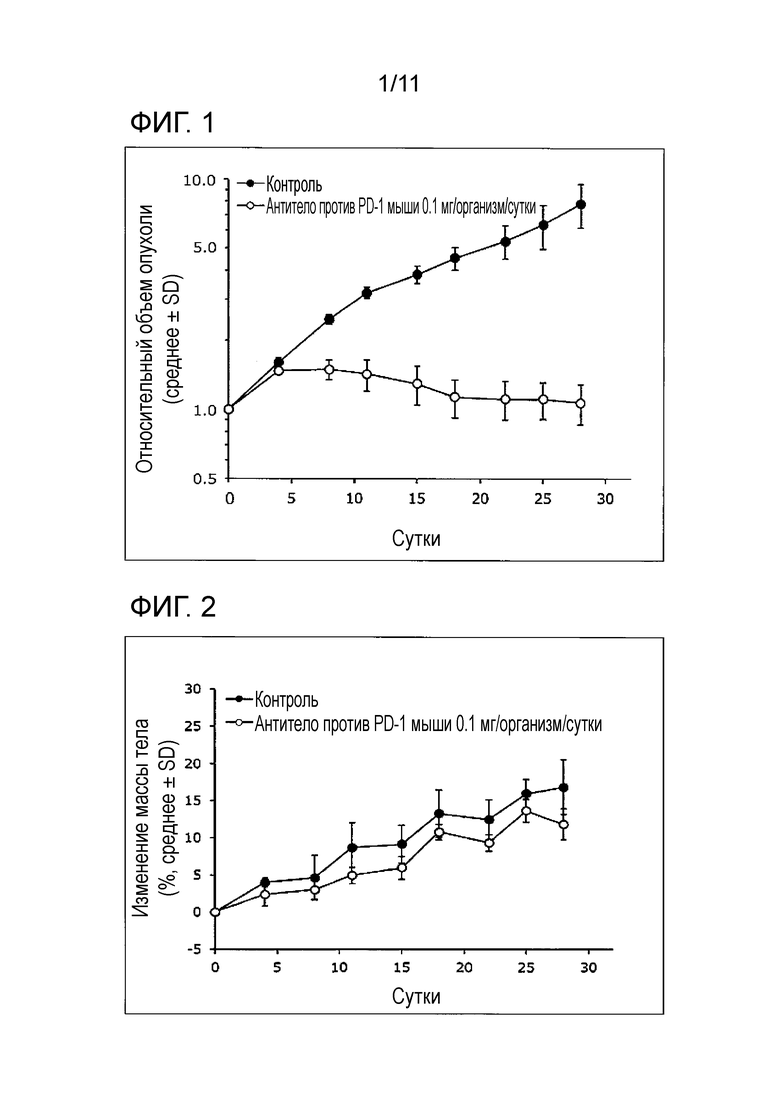
[Фиг. 1] На фиг. 1 проиллюстрирован противоопухолевый эффект, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93), в группе введения одного антитела против PD-1 мыши.
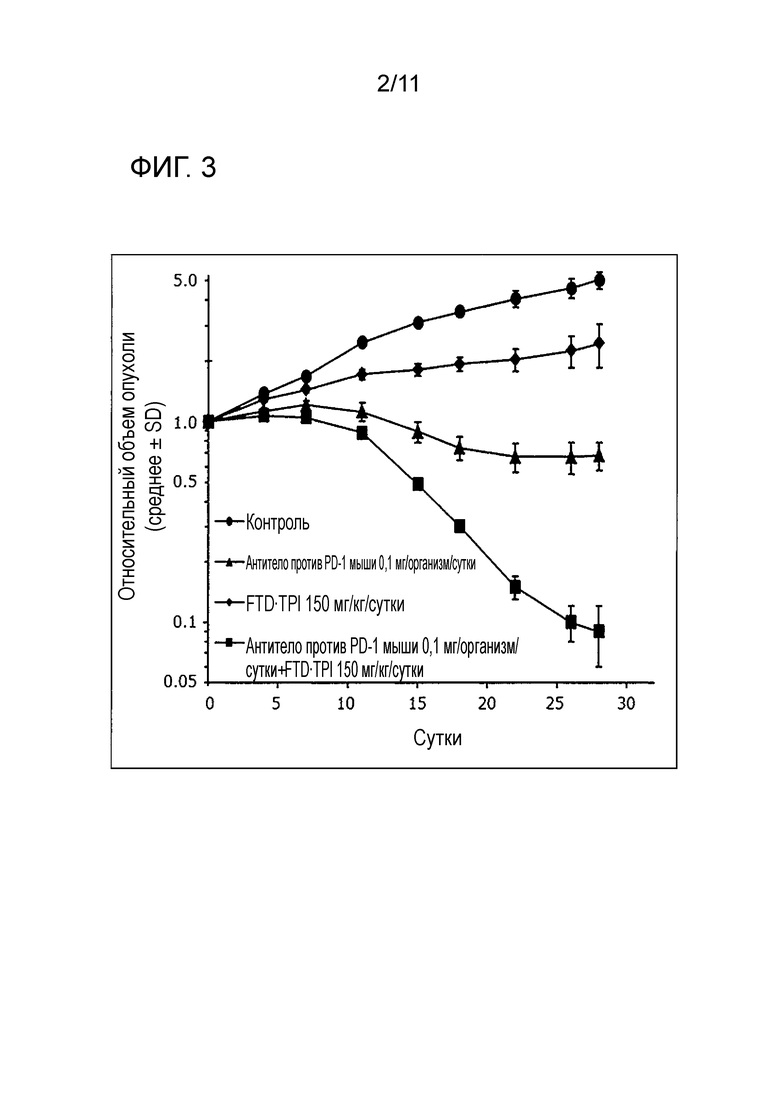
[Фиг. 2] На фиг. 2 проиллюстрировано изменение массы мыши со злокачественной опухолью толстой кишки (CMT-93) в группе введения одного антитела против PD-1 мыши.
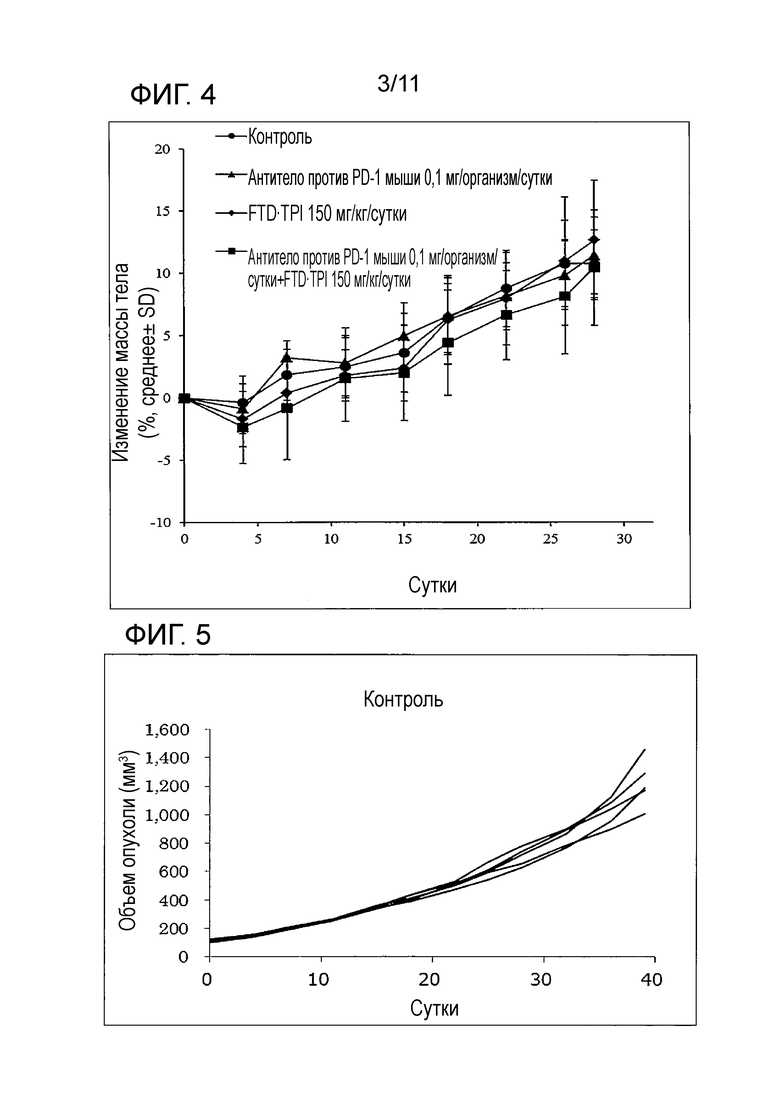
[Фиг. 3] На фиг. 3 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93).
[Фиг. 4] На фиг. 4 проиллюстрировано изменение массы мыши со злокачественной опухолью толстой кишки (CMT-93) в группе совместного введения с использованием комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши в комбинации.
[Фиг. 5] На фиг. 5 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в контрольной группе.
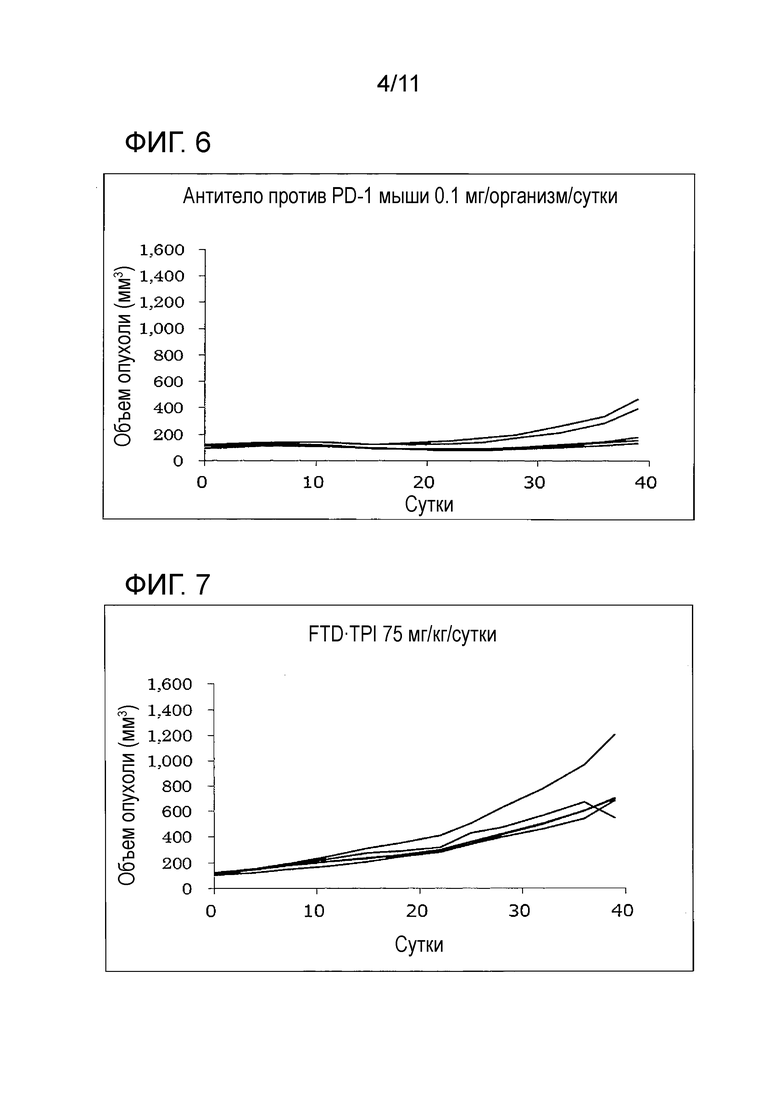
[Фиг. 6] На фиг. 6 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе антитела против PD-1 мыши 0,1 мг/организм/сутки.
[Фиг. 7] На фиг. 7 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе FTD/TPI 75 мг/кг/сутки.
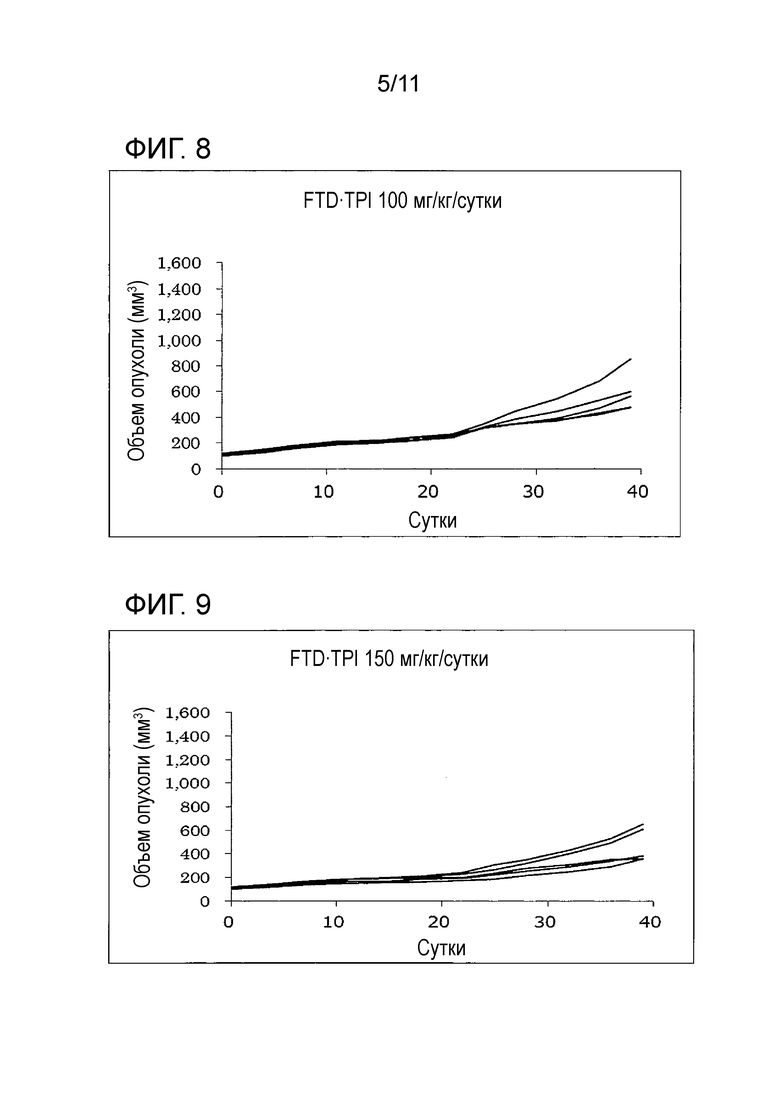
[Фиг. 8] На фиг. 8 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе FTD/TPI 100 мг/кг/сутки.
[Фиг. 9] На фиг. 9 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе FTD/TPI 150 мг/кг/сутки.
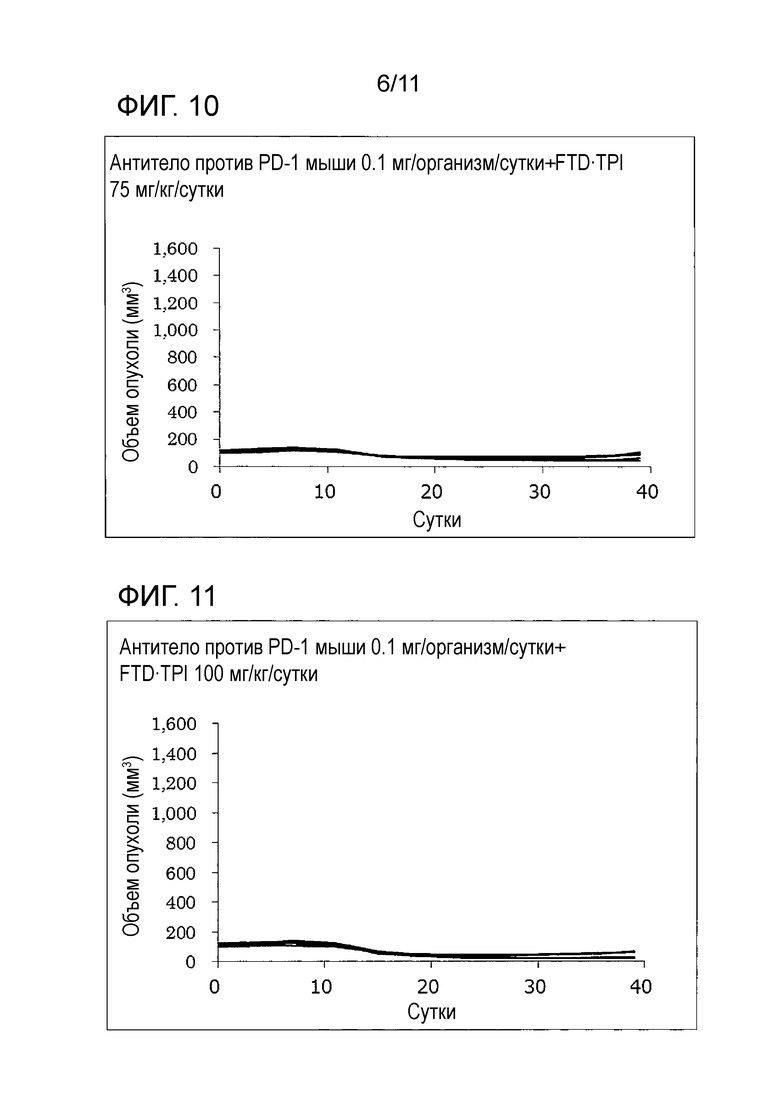
[Фиг. 10] На фиг. 10 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе антитела против PD-1 мыши 0,1 мг/организм/сутки+FTD/TPI 75 мг/кг/сутки.
[Фиг. 11] На фиг. 11 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе антитела против PD-1 мыши 0,1 мг/организм/сутки+FTD/TPI 100 мг/кг/сутки.
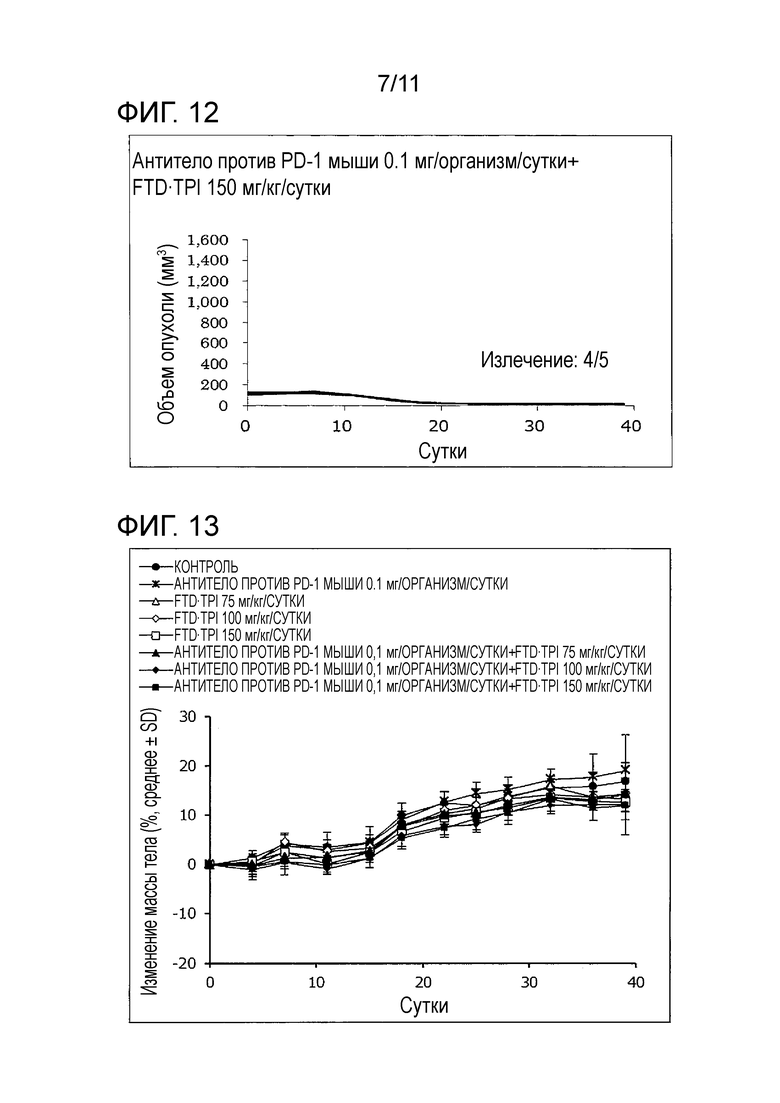
[Фиг. 12] На фиг. 12 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93); в группе антитела против PD-1 мыши 0,1 мг/организм/сутки+FTD/TPI 150 мг/кг/сутки.
[Фиг. 13] На фиг. 13 проиллюстрировано изменение массы мыши со злокачественной опухолью толстой кишки (CMT-93) в группе совместного введения с использованием комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши в комбинации.
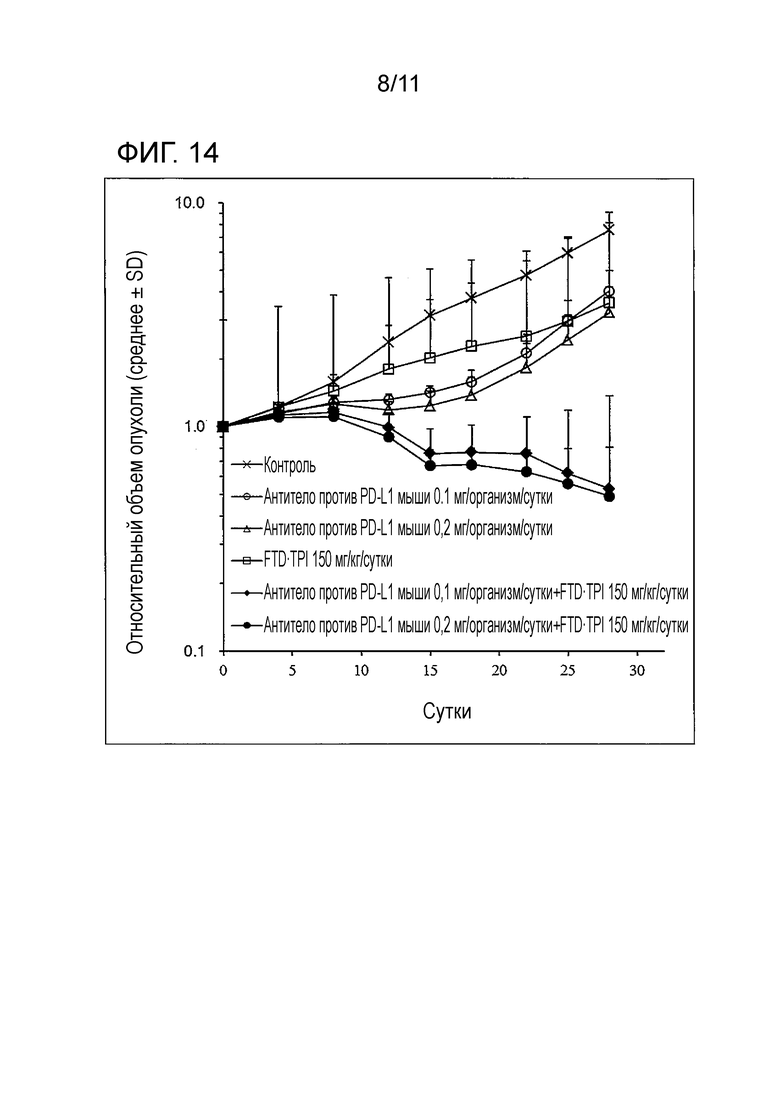
[Фиг. 14] На фиг. 14 проиллюстрирован эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-L1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93).
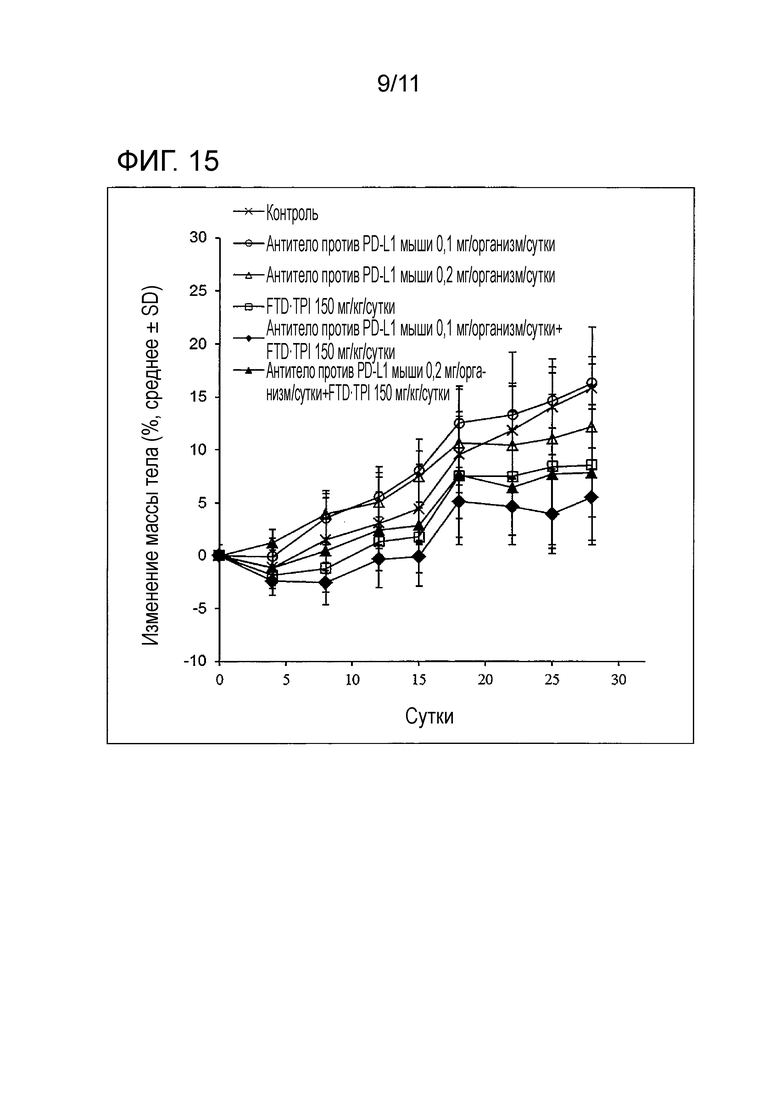
[Фиг. 15] На фиг. 15 проиллюстрировано изменение массы мыши со злокачественной опухолью толстой кишки (CMT-93) в группе совместного введения с использованием комбинированного FTD/TPI лекарственного средства и антитела против PD-L1 мыши в комбинации.
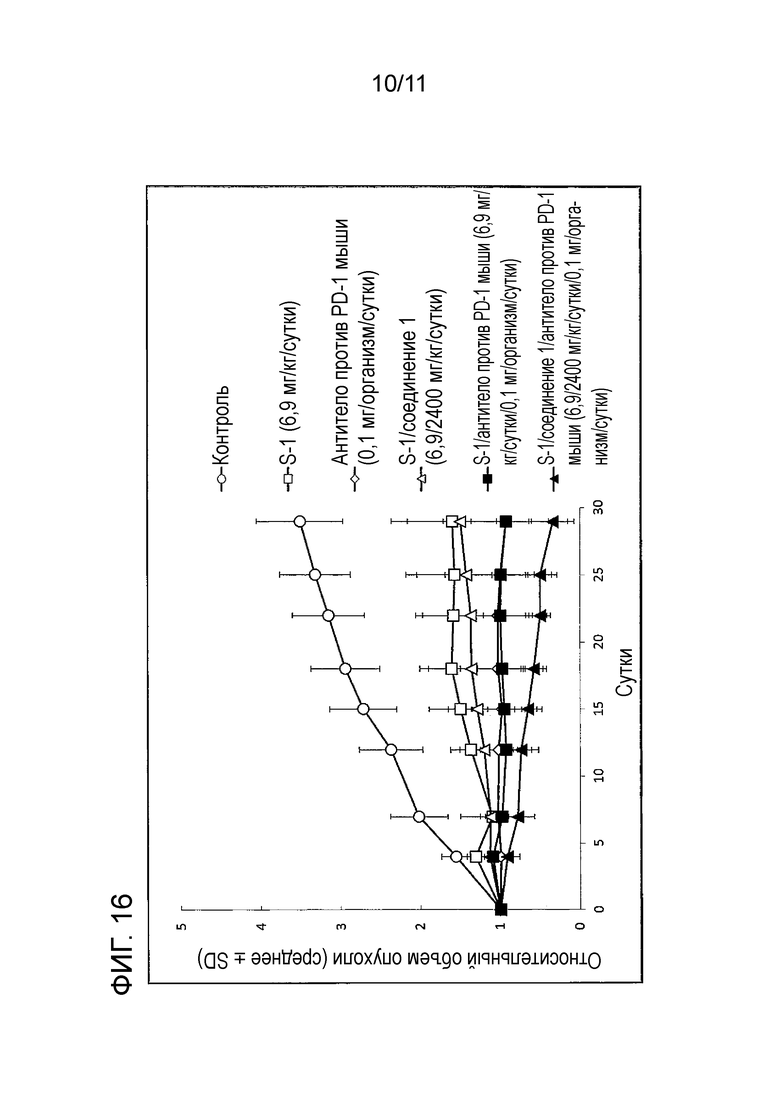
[Фиг. 16] На фиг. 16 проиллюстрирован эффект комбинаторного использования S-1+соединение 1 и антитела против PD-1 мыши, оказываемый на злокачественную опухоль толстой кишки мыши (CMT-93).
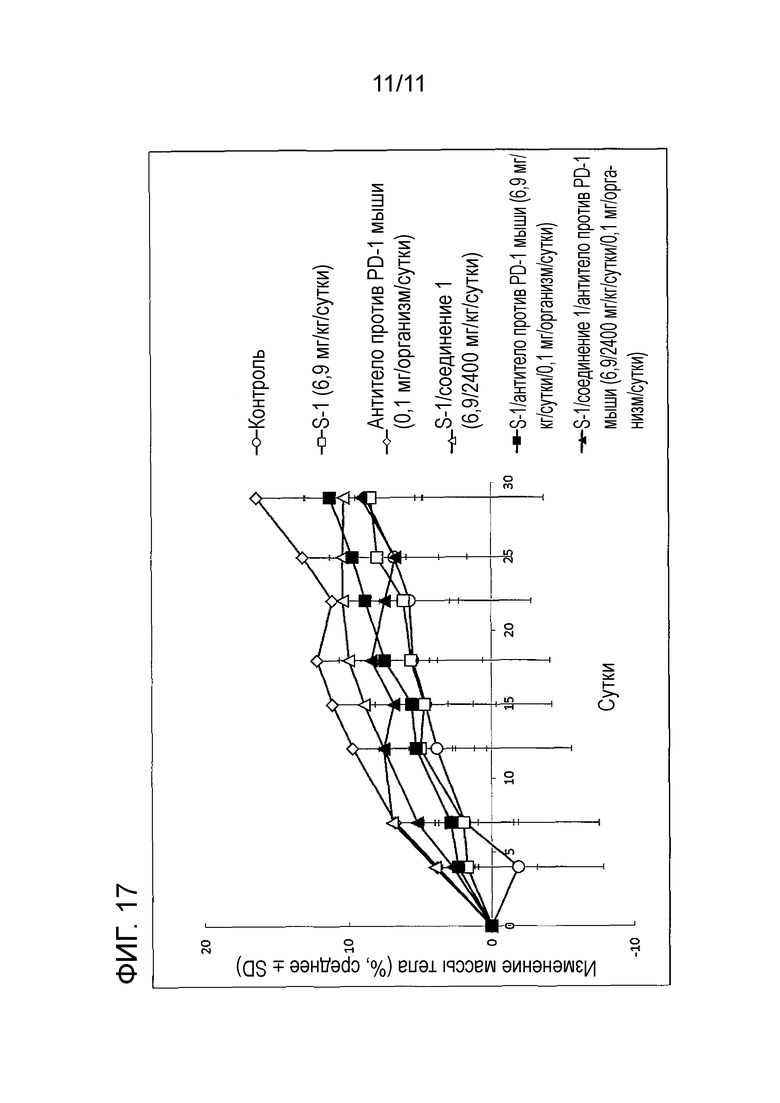
[Фиг. 17] На фиг. 17 проиллюстрировано изменение массы мыши со злокачественной опухолью толстой кишки (CMT-93) в группе совместного введения с использованием S-1+соединение 1 и антитела против PD-1 мыши в комбинации.
[Подробное описание изобретения]
[0013]
Настоящее изобретение относится к противоопухолевому средству, потенциирующему противоопухолевый эффект средству, препарату в наборе, для введения ингибитора функции ДНК (в частности, комбинированного FTD/TPI лекарственна средства) и иммуномодулятора (в частности, антитела против PD-1) в комбинации, и использованию этих средств, способу лечения опухоли и способу потенциирования противоопухолевого эффекта.
[0014]
Ингибитор функции ДНК в настоящем изобретении относится к лекарственному средству, которое увеличивает встраивание неправильных нуклеиновых оснований в ДНК внутри опухолевой клетки, чтобы вызывать ингибирование функции ДНК, и, таким образом, проявляет противоопухолевый эффект.
Примеры конкретного ингибитора функции ДНК включают лекарственное средство, содержащее FTD, и лекарственное средство, содержащее ингибитор дУТФазы и фторированный антиметаболит пиримидина.
Примеры лекарственного средства, содержащего FTD, в настоящем изобретении включают комбинированное лекарственное средство, содержащее FTD и TPI, и предпочтительно содержат FTD и TPI в молярном соотношении 1:0,5. Каждое из FTD и TPI представляет собой известное соединение, и его можно синтезировать, например, в соответствии со способом, описанным в WO 1996/30346. Комбинированное лекарственное средство, содержащее FTD и TPI в молярном соотношении 1:0,5, также общеизвестно (непатентная литература 1 и 2). Кроме того, комбинированное FTD/TPI лекарственное средство одобрено в качестве терапевтического средства для метастатической злокачественной опухоли толстой кишки в Японии и Соединенных Штатах, и, что касается использования и дозы, 70 мг/м2/сутки в виде FTD вводят перорально два раза в сутки в течение 5 последовательных суток, после чего следует отдых в течение 2 суток. Это повторяют два раза, после чего следует отдых в течение 14 суток. Определено, что введение повторяют с использованием вышеуказанной процедуры в виде одного курса.
[0015]
«Ингибитор дУТФазы» в «лекарственном средстве, содержащем ингибитор дУТФазы и фторированный антиметаболит пиримидина», по настоящему изобретению конкретно не ограничен до тех пор, пока соединение обладает ингибирующей дУТФазу активностью. Примеры предпочтительно включают (R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид, представленный следующей формулой (1) (далее в настоящем описании, также обозначаемый как «соединение 1»), или его фармацевтически приемлемую соль. Соединение 1 включает оптические изомеры и гидраты.
[0016]
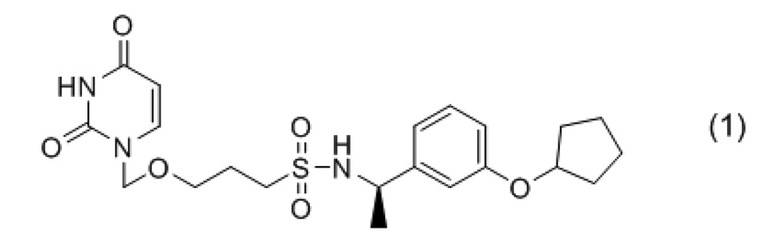
[0017]
Соединение 1 представляет собой известное соединение, которое обладает хорошей ингибирующей дУТФазу активностью, и его можно синтезировать с помощью следующего способа, например, описанного в международной публикации № WO2009/147843. Также известно, что соединение 1 потенциирует противоопухолевый эффект фторированных антиметаболитов пиримидина, таких как 5-FU (международная публикация № WO2011/065541).
[0018]
«Фторированный антиметаболит пиримидина» в «лекарственном средстве, содержащем ингибитор дУТФазы и фторированный антиметаболит пиримидина» по настоящему изобретению конкретно не ограничен до тех пор, пока он имеет структуру фторированного пиримидина и проявляет противоопухолевый эффект, как 5-FU в клетках, и включает 5-FU, его производные и его пролекарственные средства. В частности, примеры включают 5-FU, тегафур, комбинированное лекарственное средство, содержащее тегафур, гимерацил и отерацил калия в молярном соотношении 1:0,4:1 (далее в настоящем описании также обозначаемое как «комбинированное лекарственное средство тегафур/гимерацил/отерацил калия», «S-1»), комбинированное лекарственное средство, содержащее тегафур и урацил в молярном соотношении 1:4 (далее в настоящем описании также обозначаемое как «комбинированное лекарственное средство тегафур/урацил», «UFT»), капецитабин, доксифлуридин, 5-фтор-2'-дезоксиуридин (FdUrd) и кармофур и 5-FU, комбинированное лекарственное средство тегафур/гимерацил/отерацил калия, комбинированное лекарственное средство тегафур/урацил и капецитабин являются предпочтительными, комбинированное лекарственное средство тегафур/гимерацил/отерацил калия и капецитабин являются более предпочтительными и комбинированное лекарственное средство тегафур/гимерацил/отерацил калия является особенно предпочтительным.
[0019]
Иммуномодулятор в настоящем изобретении обладает активностью индуцирования противоопухолевого иммунного ответа в живом организме пациента со злокачественной опухолью и контроля ускользания опухоли от иммунного ответа.
Пример такого вещества включает вещество, способствующее функции костимулирующей молекулы (стимуляторной костимулирующей молекулы), или вещество, способствующее функции совместно ингибирующей молекулы (ингибирующей костимулирующей молекулы). В настоящее время идентифицировано большое число семейства B7 и семейства CD28, и вещества, направленные на них, можно использовать в настоящем изобретении без конкретного ограничения. Примеры включают антагонист пути PD-1, антагонист пути ICOS, антагонист пути CTLA-4, антагонист пути CD28 и антагонист пути BTLA.
В настоящем изобретении, иммуномодулятор предпочтительно представляет собой антагонист пути PD-1, антагонист пути ICOS, антагонист пути CTLA-4, антагонист пути CD28 или их комбинацию, более предпочтительно антагонист пути PD-1 или антагонист пути CTLA-4 и, с точки зрения супрессии побочных эффектов, еще более предпочтительно антагонист пути PD-1.
[0020]
Антагонист пути PD-1 ингибирует PD-1, экспрессированный на T-клетках, или иммуноингибирующий сигнал с помощью PD-L1 или PD-L2, который является его лигандом, и предпочтительно представляет собой антитело против PD-1, антитело против PD-L1, антитело против PD-L2, внеклеточный домен PD-1, внеклеточный домен PD-L1, внеклеточный домен PD-L2, PD-1-Ig (слитый белок из внеклеточного домена PD-1 и FC-области Ig), PD-L1-Ig и PD-L2-Ig, более предпочтительно антитело против PD-1, антитело против PD-L1 и антитело против PD-L2 и более предпочтительно антитело против PD-1 и антитело против PD-L1. Среди них предпочтительным является антитело против PD-1.
Антагонист пути CTLA-4 ингибирует CTLA-4, экспрессированный на T-клетках, или иммуноингибирующий сигнал с помощью B7-1 (CD80) или B7-2 (CD86), который является его лигандом, и предпочтительно представляет собой антитело против CTLA-4, внеклеточный домен CTLA-4, CTLA-4-Ig, антитело против B7-1/CD80 и антитело против B7-2/CD86, и более предпочтительно антитело против CTLA-4 и CTLA-4-Ig. Среди них предпочтительным является антитело против CTLA-4.
[0021]
Эти антитела могут представлять собой любое антитело из полученного у человека антитела, полученного у мыши антитела, полученного у крысы антитела, полученного у кролика антитела, полученного у козы антитела, полученного у ламы антитела и полученного у курицы антитела, и могут представлять собой любое из его поликлонального антитела, моноклонального антитела и полного или усеченного (например, фрагмента F(ab')2, Fab', Fab или Fv) антитела, химерного антитела, гуманизированного антитела или полностью человеческого антитела.
Предпочтительно, антитело представляет собой гуманизированное антитело или полностью человеческое антитело и представляет собой моноклональное антитело.
[0022]
Конкретные примеры антитела против PD-1 в настоящем изобретении включают ниволумаб или пембролизумаб, и ниволумаб является предпочтительным.
Примеры антитела против PD-L1 в настоящем изобретении в частности включают атезолизумаб, дурвалумаб и авелумаб, и атезолизумаб является предпочтительным.
Конкретные примеры антитела против CTLA-4 в настоящем изобретении включают ипилимумаб или тремелимумаб, и ипилимумаб является предпочтительным.
Конкретные примеры CTLA-4-Ig в настоящем изобретении включают абатацепт.
Эти антитела можно получать стандартным известным способом получения антител, например, можно получать способом из патентной литературы 2.
Кроме того, антитело против PD-1 в виде ниволумаба или пембролизумаба, антитело против PD-L1 в виде атезолизумаба, дурвалумаба или авелумаба, антитело против CTLA-4 в виде ипилимумаба или тремелимумаба и CTLA-4-Ig в виде абатацепта уже продается или будет продаваться, и их также можно использовать.
[0023]
Суточная доза на дату введения ингибитора функции ДНК в настоящем изобретении, в случае комбинированного FTD/TPI лекарственного средства (FTD и TPI в молярном соотношении 1:0,5), предпочтительно составляет от 50 до 115% от рекомендованной дозы, когда комбинированное FTD/TPI лекарственное средство вводят отдельно, более предпочтительно от 50 до 100%, более предпочтительно от 67 до 100%, и особенно предпочтительно 100%, с точки зрения активности потенциирования противоопухолевого эффекта иммуномодулятора с помощью комбинированного FTD/TPI лекарственного средства. В частности, рекомендованная доза, когда комбинированное FTD/TPI лекарственное средство вводят отдельно, у человека составляет 70 мг/м2/сутки в виде FTD, что составляет дозу, одобренную в Японии, как описано выше, таким образом суточная доза на дату введения комбинированного FTD/TPI лекарственного средства в настоящем изобретении предпочтительно составляет от 35 до 80 мг/м2/сутки, более предпочтительно от 35 до 70 мг/м2/сутки, более предпочтительно от 50 до 70 мг/м2/сутки и особенно предпочтительно 70 мг/м2/сутки в виде FTD.
[0024]
Кроме того, когда ингибитор функции ДНК представляет собой лекарственное средство, содержащее соединение 1 или его фармацевтически приемлемую соль и комбинированное лекарственное средство тегафур/гимерацил/отерацил калия, суточная доза соединения 1 на дату введения предпочтительно составляет от 12 до 1200 мг/м2/сутки, более предпочтительно от 120 до 600 мг/м2/сутки и особенно предпочтительно от 240 до 480 мг/м2/сутки. Кроме того, когда суточную дозу соединения 1 на дату введения определяют на основании особенностей пациента, предпочтительной является от 20 до 2000 мг/организм/сутки, более предпочтительной является от 200 до 1000 мг/организм/сутки и особенно предпочтительной является от 400 до 800 мг/организм/сутки.
Кроме того, суточная доза комбинированного лекарственного средства тегафур/гимерацил/отерацил калия на дату введения составляет, в виде количества тегафура, предпочтительно от 10 до 200 мг/м2/сутки, более предпочтительно от 20 до 80 мг/м2/сутки и особенно предпочтительно от 40 до 72 мг/м2/сутки.
Кроме того, когда ингибитор функции ДНК представляет собой лекарственное средство, содержащее соединение 1 или его фармацевтически приемлемую соль и капецитабин, суточная доза соединения 1 на дату введения предпочтительно составляет от 12 до 3000 мг/м2/сутки, более предпочтительно от 240 до 1200 мг/м2/сутки и особенно предпочтительно от 480 до 720 мг/м2/сутки. Дополнительно, когда суточную дозу соединения 1 на дату введения определяют на основании особенностей пациента, предпочтительной является от 20 до 5000 мг/организм/сутки, более предпочтительной является от 400 до 2000 мг/организм/сутки и особенно предпочтительной является от 800 до 1200 мг/организм/сутки.
Кроме того, суточная доза капецитабина на дату введения предпочтительно составляет от 200 до 3000 мг/м2/сутки, более предпочтительно от 480 до 1400 мг/м2/сутки и особенно предпочтительно от 600 до 900 мг/м2/сутки.
[0025]
Дозу для пациента можно определять на основании площади поверхности тела (BSA), вычисляемой по росту и массе тела пациентов. В качестве способа вычисления площадь поверхности тела, стандартный способ используют надлежащим образом, в зависимости от, например, расы, пола, состояния здоровья и симптомов пациента, например, следующие расчетные формулы с 1 до 6 и предпочтительно следующую формулу 1 или 2(a).
1. Формула Мостеллера (См. N Engl J Med 1987 Oct 22; 317(17): 1098 (letter))
BSA (м2)=([рост(см)×масса(кг)]/3600)1/2
2. Формула Дюбуа и Дюбуа (См. Arch Int Med 1916 17: 863-71; J Clin Anesth. 1992; 4(1): 4-10)
(a) BSA (м2)=0,20247×рост(м)0,725×масса(кг)0,425
(b) BSA (м2) =0,007184×рост(см)0,725×масса(кг)0,425
3. Формула Хэйкока (См. The Journal of Pediatrics 1978 93: 1: 62-66)
BSA (м2)=0,024265×рост(см)0,3964×масса(кг)0,5378
4. Формула Гехана-Джорджа (см. Cancer Chemother Rep 1970 54: 225-35)
BSA (м2)=0,0235×рост(см)0,42246×масса(кг)0,51456
5. Формула Бойда (См. Minneapolis: university of Minnesota Press, 1935)
BSA (м2)=0,0003207×рост(см)0,3×масса(г)(0,7285-(0,0188×LOG(г))
6. Формула Фуджимото (См. Nihon Eiseigaku Zasshi, 1968 23(5): 443-450)
BSA (м2)=0,008883×рост(см)0,663×масса(кг)0,444
Например, когда площадь поверхности тела пациента со злокачественной опухолью ростом 175 см и массой 70 кг вычисляют с использованием вышеуказанной расчетной формулы 1, площадь поверхности тела вычисляют как [175(см)×70(кг)]/3600)1/2=1,84 (м2). Когда доза для пациента составляет 60 мг/м2/сутки, общую суточную дозу вычисляют как 1,84×60=111 мг и принимают приблизительно равной 110 мг.
[0026]
Суточная доза иммуномодулятора на дату введения в настоящем изобретении предпочтительно составляет от 50 до 100% и более предпочтительно 100% от рекомендованной дозы, когда ингибитор функции ДНК вводят отдельно, с точки зрения активности потенциирования противоопухолевого эффекта иммуномодулятора с помощью ингибитора функции ДНК.
В частности, рекомендованная доза, когда ниволумаб вводят отдельно, составляет 2 мг/кг (массы) за раз, что составляет дозу, одобренную в Японии, таким образом суточная доза ниволумаба на дату введения в настоящем изобретении предпочтительно составляет 1 до 2 мг/кг (массы) за раз и более предпочтительно 2 мг/кг (массы) за раз.
Рекомендованная доза, когда атезолизумаб вводят отдельно, составляет 1200 мг за раз, что составляет дозу, одобренную в США, и, таким образом, суточная доза атезолизумаба на дату введения в настоящем изобретении предпочтительно составляет от 600 до 1200 мг за раз и более предпочтительно 1200 мг за раз.
Термин «рекомендованная доза» в настоящем изобретении относится к дозе, имеющей максимальный терапевтический эффект в диапазоне, который можно безопасно использовать без серьезных побочных эффектов, например, определяемых с помощью клинических исследований, и конкретный пример включает дозы, которые одобрены, рекомендованы и предложены общественными институтами и ассоциациями, такими как PMDA; Pharmaceuticals and Medical Devices Agency, FDA; Food and Drug Administration), и EMA; European Medicines Agency, и описаны в приложенном документе, консультативной форме и руководствах по лечению, и доза, одобренная любым из общественных институтов из PMDA, FDA или EMA, является предпочтительной.
[0027]
Схему введения противоопухолевого средства по настоящему изобретению можно должным образом выбирать, например, в зависимости от карциномы и стадии.
В случае комбинированного FTD/TPI лекарственного средства, схему введения из 5-дневного ежедневного введения и 2-дневого отдыха повторяют два раза, после чего следует отдых в течение 2 недель, или схему введения из 5-дневного ежедневного введения и 9-дневного отдыха повторяют два раза является предпочтительной.
В случае соединения 1 или его фармацевтически приемлемой соли, комбинированного лекарственного средства тегафур/гимерацил/отерацил калия и капецитабина, предпочтительной является схема введения из 1-4 недель введения и 1-2 недель отдыха повторяют, более предпочтительной является схема введения из 2-3 недель введения и 1 недели отдыха повторяют и особенно предпочтительной является схема введения из 2 недель введения и 1 недели отдыха повторяют.
В случае ниволумаба или атезолизумаба, предпочтительной является схема введения, при которой осуществляют введение с 3-недельными интервалами.
[0028]
Число введений противоопухолевого средства по настоящему изобретению в сутки можно должным образом выбирать, например, в зависимости от карциномы и стадии.
Число введений предпочтительно составляет два раза в сутки в случае комбинированного FTD/TPI лекарственного средства, два раза в сутки в случае соединения 1 или его фармацевтически приемлемой соли, комбинированного лекарственного средства тегафур/гимерацил/отерацил калия и капецитабина и один раз в сутки в случае ниволумаба или атезолизумаба.
Порядок введения ингибитора функции ДНК и иммуномодулятора по настоящему изобретению можно должным образом выбирать, например, в зависимости от карциномы и стадии, и одно можно вводить сначала и оба можно вводить одновременно.
[0029]
Конкретные примеры злокачественной опухоли, подлежащей направленному воздействию с помощью противоопухолевого средства по настоящему изобретению, включают злокачественную опухоль головы и шеи, злокачественную опухоль желудочно-кишечного тракта (например, злокачественную опухоль пищевода, злокачественную опухоль желудка, злокачественную опухоль двенадцатиперстной кишки, злокачественную опухоль печени, злокачественную опухоль желчных путей (например, злокачественную опухоль желчного пузыря/желчного протока), злокачественную опухоль поджелудочной железы, злокачественную опухоль тонкой кишки и злокачественную опухоль толстой кишки (например, злокачественную опухоль толстой кишки, злокачественную опухоль ободочной кишки и злокачественную опухоль прямой кишки)), злокачественную опухоль легких (например, немелкоклеточную злокачественную опухоль легких, мелкоклеточную злокачественную опухоль легких), злокачественную опухоль молочной железы, злокачественную опухоль яичников, злокачественную опухоль матки (например, злокачественную опухоль шейки матки и злокачественную опухоль эндометрия), злокачественную опухоль почки, злокачественную опухоль мочевого пузыря, злокачественную опухоль предстательной железы и злокачественную опухоль кожи. Здесь, злокачественная опухоль включает не только первичную опухоль, но также опухоль, произошедшую из солидной злокачественной опухоли, которая метастазировала в другие органы (такие как печен). Среди них, с точки зрения противоопухолевых эффектов и побочных эффектов, мишенью противоопухолевого средства по настоящему изобретению предпочтительно является злокачественная опухоль головы и шеи, злокачественная опухоль желудочно-кишечного тракта, злокачественная опухоль легких, злокачественная опухоль молочной железы, злокачественная опухоль почки и злокачественная опухоль кожи, более предпочтительно злокачественная опухоль желудочно-кишечного тракта, злокачественная опухоль легких или злокачественная опухоль молочной железы, более предпочтительно злокачественная опухоль толстой кишки, злокачественная опухоль желудка или злокачественная опухоль легких, и особенно предпочтительно злокачественная опухоль толстой кишки. Противоопухолевое средство по настоящему изобретению может представлять собой то, которое используют для послеоперационной вспомогательной химиотерапии, которую осуществляют для предотвращения рецидива после хирургического извлечения опухоли, а также может представлять собой то, которое используют для дооперационной вспомогательной химиотерапии, которую осуществляют перед хирургическим извлечением опухоли.
[0030]
Поскольку способ введения и схема введения различны в для каждого активного ингредиента, и когда все активные ингредиенты ингибитора функции ДНК и иммуномодулятора нельзя формулировать в одной дозированной форме, предпочтительно противоопухолевое средство по настоящему изобретению формулируют отдельно во множестве дозированных форм для каждого активного ингредиента. В частности, предпочтительно комбинированное FTD/TPI лекарственное средство и комбинированное лекарственное средство тегафур/гимерацил/отерацил калия формулируют в виде комбинированных лекарственных средств, и соединение 1 или его фармацевтически приемлемую соль, капецитабин, антитело против PD-1, антитело против PD-L1 или антитело против CTLA-4 формулируют в виде одного средства.
[0031]
Кроме того, до тех пор пока каждый активный ингредиент вводят в соответствии с дозой по настоящему изобретению, каждый препарат можно изготавливать и продавать вместе в одной упаковке, подходящей для введения в комбинации, или каждый препарат можно изготавливать и продавать после выделения в отдельную упаковку.
[0032]
Нет конкретного ограничения на дозированную форму противоопухолевого средства по настоящему изобретению, ее можно надлежащим образом выбирать в зависимости от терапевтических задач, и она включает, в частности, например, оральные препараты (например, таблетки, покрытые таблетки, порошки, гранулы, капсулы и растворы), инъекции, суппозитории, пластыри и мази. Оральный препарат является предпочтительным в случае комбинированного FTD/TPI лекарственного средства, соединения 1 или его фармацевтически приемлемой соли, комбинированного лекарственного средства тегафур/гимерацил/отерацил калия и капецитабина. В случае антитела против PD-1, антитела против PD-L1 или антитела против CTLA-4, примеры включают вышеуказанную дозированную форму, и инъекция является предпочтительной.
[0033]
В зависимости от дозированной формы, противоопухолевое средство по настоящему изобретению обычно можно получать известным способом с использованием фармацевтически приемлемого носителя, также для ингибитора функции ДНК и иммуномодулятора. Такой носитель включает различные носители, которые широко используют в стандартных лекарственных средствах, такие как эксципиенты, связывающие средства, дезинтегрирующие средства, смазывающие средства, разбавители, солюбилизаторы, суспендирующие средства, изотонические средства, корректирующие pH средства, буферные средства, стабилизаторы, красители, ароматизаторы и улучшающие запах средства.
[0034]
Настоящее изобретение также относится к потенциирующему противоопухолевый эффект средству, содержащему ингибитор функции ДНК для потенциирования противоопухолевого эффекта иммуномодулятора, оказываемого на пациента со злокачественной опухолью. Потенциирующее противоопухолевый эффект средство имеет форму препарата вышеуказанного противоопухолевого средства.
Настоящее изобретение также относится к потенциирующему противоопухолевый эффект средству, содержащему иммуномодулятор для потенциирования противоопухолевого эффекта ингибитора функции ДНК, оказываемого на пациента со злокачественной опухолью. Потенциирующее противоопухолевый эффект средство имеет форму препарата вышеуказанного противоопухолевого средства.
[0035]
Настоящее изобретение также относится к противоопухолевому средству, содержащему ингибитор функции ДНК для лечения пациента со злокачественной опухолью, которому вводили иммуномодулятор. Противоопухолевое средство имеет вышеуказанную форму препарата.
Настоящее изобретение также относится к противоопухолевому средству, содержащему иммуномодулятор для лечения пациента со злокачественной опухолью, которому вводили ингибитор функции ДНК. Противоопухолевое средство имеет вышеуказанную форму препарата.
«Лечение» включает послеоперационную вспомогательную химиотерапию, которую осуществляют для предотвращения рецидива после хирургического извлечения опухоли, и дооперационную вспомогательную химиотерапию, которую осуществляют перед хирургическим извлечением опухоли.
Настоящее изобретение также относится к противоопухолевому средству, содержащему ингибитор функции ДНК, который используют в комбинации с иммуномодулятором у пациента со злокачественной опухолью. Противоопухолевое средство имеет вышеуказанную форму препарата.
Настоящее изобретение также относится к противоопухолевому средству, содержащему иммуномодулятор, который используют в комбинации с ингибитором функции ДНК у пациента со злокачественной опухолью. Противоопухолевое средство имеет вышеуказанную форму препарата.
[0036]
Настоящее изобретение также относится к препарату в наборе, содержащему противоопухолевое средство, содержащее ингибитор функции ДНК, и инструкцию по использованию, описывающую, что ингибитор функции ДНК и иммуномодулятор подлежат введению пациенту со злокачественной опухолью в комбинации. Термин «инструкция по использованию» может быть любой до тех пор, пока она описывает вышеуказанную дозу; однако инструкция по использованию, в которой вышеуказанная доза рекомендована, хотя и не имеет обязательной юридической силы, является предпочтительной. Инструкция по использованию включает, в частности, например, вкладыш в упаковку и брошюру. Также препаратом в наборе, содержащим инструкцию по использованию, может быть тот, в котором инструкция по использованию напечатана на или прикреплена к упаковке препарата в наборе, или может быть тот, в котором инструкция по использованию заключена в упаковку препарата в наборе вместе с противоопухолевым средством.
[Примеры]
[0037]
Далее в данном описании настоящее изобретение объяснено более подробно в качестве примеров и эталонных примеров. Однако это изобретение не ограничено этими примерами никаким образом, и средний специалист в данной области может использовать многие вариации в пределах технической идеи по настоящему изобретению.
[0038]
Эталонный пример 1
Культивируемые клетки (1×107 клеток/мышь), полученные из клеточной линии злокачественной опухоли толстой кишки человека (KM20C), интраперитонеально трансплантировали мышам BALB/cA Jcl-nu в возрасте 5-6 недель. Мышей делили на группы с тем, чтобы средняя масса тела в каждой группе могла быть одинаковой, и дату образования групп (n=10) обозначали как сутки 0.
Комбинированное FTD/TPI лекарственное средство (смесь FTD и TPI в молярном соотношении 1:0,5, далее в настоящем описании то же самое) получали для введения в количестве 75, 100, 150, 300 и 450 мг/кг/сутки в виде FTD. Введение лекарственного средства начинали в сутки 3 и осуществляли 5-дневное ежедневное оральное введение комбинированного FTD/TPI лекарственного средства с 2-дневным отдыхом в течение 6 недель.
В качестве показателя противоопухолевого эффекта сравнивали число мышей, выживших в каждой группе, а также время выживания и увеличенную продолжительность жизни для каждой группы. Увеличенную продолжительность жизни (ILS) вычисляли следующим образом.
[0039]
ILS(%)=[{(средняя продолжительность жизни в группе введения)/(средняя продолжительность жизни в группе без лечения)}-1]×100
[0040]
Результаты представлены в таблице 1.
[0041]
[Таблица 1]
[0042]
Как описано в таблице 1, для комбинированного FTD/TPI лекарственного средства наблюдают эффект увеличения продолжительности жизни во всех группах от 75 до 450 мг/кг/сутки в виде количества FTD, и среди них продолжительность жизни является самой длинной в группе 150 мг/кг/сутки, таким образом рекомендованная доза (RD) комбинированного FTD/TPI лекарственного средства у мышей составляет 150 мг/кг/сутки в виде FTD. Таким образом, показано, что комбинированное FTD/TPI лекарственное средство проявляет эффект увеличения продолжительности жизни по меньшей мере в дозе от 50 до 300% от RD.
При этом известно, что RD, когда комбинированное FTD/TPI лекарственное средство вводят отдельно, у человека составляет 70 мг/м2/сутки в виде FTD. Таким образом, доза комбинированного FTD/TPI лекарственного средства в виде FTD соответствует 150 мг/кг/сутки у мышей и 70 мг/м2/сутки у человека.
[0043]
Эталонный пример 2
Клеточную линию злокачественной опухоли толстой кишки мыши (CMT-93) трансплантировали с правой стороны грудной клетки мышей C57BL/6 в возрасте от 5 до 6 недель от рождения. После трансплантации опухоли измеряли большую ось (мм) и малую ось (мм) опухоли и вычисляли объем опухоли (TV). Затем мышей делили на группы с тем, чтобы среднее TV для каждой группы могло быть одинаковым и сутки, когда формировали группы (n=6), обозначали как сутки 0.
Антитело против PD-1 мыши (клон RMP1-14, производства BioXCell, далее в настоящем описании то же самое) получали для введения в количестве 0,1 мг/организм/сутки, что составляет дозу, для которой сообщали о противоопухолевом эффекте у мышей (Clin Cancer Res. 2013 Oct 15; 19(20): 5626-35). Антитело против PD-1 мыши вводили интраперитонеально в сутки 1, сутки 5 и сутки 9.
В качестве показателя противоопухолевого эффекта в каждой группе вычисляли TV в сутки 0, 4, 8, 11, 15, 18, 22, 25 и 28, и определяли относительный объем опухоли (RTV) в сутки 0 с помощью следующей формулы и сравнивали с RTV группы без лечения (контроль).
[0044]
TV (мм3)=(большая ось×малая ось2)/2
RTV=(TV в сутки 28)/(TV в сутки 0)
[0045]
RTV наносили на график для каждой даты измерения, и на фиг. 1 представлен результат сравнения изменения RTV с течением времени (сутки) для группы без лечения и группы введения одного антитела против PD-1 мыши.
[0046]
Скорость ингибирования роста опухоли (TGI) на основании значения RTV в сутки 28 вычисляли в соответствии со следующей формулой.
[0047]
TGI (%)=[1-(средний RTV группы лечения)/(средний RTV группы без лечения)]×100
[0048]
Для оценки эффекта с использованием одного средства, определяли, что имел место усиливающий эффект, когда среднее значение RTV для группы одного введения было статистически значимо (закрытая процедура тестирования; тест пересечения-объединения p < 0,01) меньше среднего значения RTV группы без лечения (контроль).
Результаты представлены в таблице 2.
[0049]
[Таблица 2]
[0050]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
a): объем опухоли (TV) в сутки 28 вычисляли в соответствии со следующей формулой: TV=(длина)×(ширина)×(ширина)/2
b): Относительный объем опухоли (RTV) в сутки 28 вычисляли как соотношение TV в сутки 28 к таковому в сутки 0 в соответствии со следующей формулой:
RTV=(TV в сутки 28)/(TV в сутки 0)
c): Скорость ингибирования роста опухоли (TGI) в сутки 28 на основании RTV вычисляли в соответствии со следующей формулой:
TGI(%)=[(среднее RTV для контрольной группы)-(среднее RTV для группы лечения)]/(среднее RTV для контрольной группы)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
При этом, в качестве показателя, отражающего системную токсичность из-за введения лекарственного средства, использовали изменение массы тела (BWC). BWC вычисляли в соответствии со следующей формулой, и средние значения BWC представлены на фиг. 2 и в таблице 3.
[0051]
BWC (%)=([(масса тела мыши в сутки 28)-(масса тела мыши в сутки 0)]/(масса тела мыши в сутки 0)×100
[0052]
[Таблица 3]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
a): Изменение массы тела (BWC, %; среднее±SD) в сутки 28 вычисляли в соответствии со следующей формулой:
BWC (%)=[(BW в сутки 28)-(BW в сутки 0)]/(BW в сутки 0)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
[0053]
Как показано на фиг. 1, фиг. 2, в таблице 2 и таблице 3, когда антитело против PD-1 мыши составляло 0,1 мг/организм/сутки, демонстрировали статистически значимый противоопухолевый эффект. В группе введения одного антитела против PD-1 мыши не наблюдали серьезное снижение массы, превышающее -20%, а побочные эффекты имели приемлемую степень.
[0054]
Пример 1: комбинаторное использование комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши
Клеточную линию злокачественной опухоли толстой кишки мыши (CMT-93) трансплантировали с правой стороны грудной клетки мышам C57BL/6 в возрасте 5-6 недель от рождения. После трансплантации опухоли измеряли большую ось (мм) и малую ось (мм) опухоли и вычисляли объем опухоли (TV). Затем мышей делили на группы с тем, чтобы средний TV для каждой группы мог быть одинаковым, а сутки формирования групп (n=6) обозначали как сутки 0.
Комбинированное FTD/TPI лекарственное средство получали для введения в количестве 150 мг/кг/сутки в виде дозы FTD. Антитело против PD-1 мыши получали для введения в количестве 0,1 мг/организм/сутки. Комбинированное FTD/TPI лекарственное средство вводили перорально ежедневно в сутки 1-14, а антитело против PD-1 мыши вводили интраперитонеально в сутки 1, сутки 5 и сутки 9.
В качестве показателя противоопухолевого эффекта в каждой группе вычисляли TV в сутки 0, 4, 7, 11, 15, 18, 22, 26 и 28 и определяли относительный объем опухоли (RTV) в сутки 0 с помощью вышеуказанной формулы и сравнивали с RTV группы без лечения (контроль).
Вышеуказанный RTV наносили на график для каждой даты измерения. Результат сравнения изменения RTV с течением времени (сутки) между группой без лечения, группой введения комбинированного FTD/TPI лекарственного средства, группой введения одного антитела против PD-1 мыши и группой совместного введения комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши представлен на фиг. 3.
Вычисляли скорость ингибирования роста опухоли (TGI) на основании значения RTV в сутки 28.
[0055]
Определяли, что имел место усиливающий эффект, когда среднее значение RTV для группы совместного введения статистически значимо (закрытая процедура тестирования; тест пересечения-объединения p<0,01) меньше среднего значения RTV для группы одного индивидуального введения.
Результаты представлены в таблице 4.
[0056]
[Таблица 4]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
##: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой против PD-1 мыши.
$$: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой FTD⋅TPI.
a): Объем опухоли (TV) в сутки 28 вычисляли в соответствии со следующей формулой:
TV=(длина)×(ширина)×(ширина)/2
b): Относительный объем опухоли (RTV) в сутки 28 вычисляли как соотношение TV в сутки 28 к таковому в сутки 0 в соответствии со следующей формулой:
RTV=(TV в сутки 28)/(TV в сутки 0)
c): Скорость ингибирования роста опухоли (TGI) в сутки 28 на основании RTV вычисляли в соответствии со следующей формулой:
TGI(%)=[(средний RTV для контрольной группы)-(средний RTV для группы лечения)]/(средний RTV для контрольной группы)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
[0057]
В качестве показателя системной токсичности из-за введения лекарственного средства вычисляли изменение массы тела (BWC), и среднее значение BWC и его ежедневная вариация представлены в таблице 5 и на фиг. 4, соответственно.
[0058]
[Таблица 5]
**:p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
a): Изменение массы тела (BWC,%; среднее±SD) в сутки 28 вычисляли в соответствии со следующей формулой: BWC (%)=[(BW в сутки 28)-(BW в сутки 0)]/(BW в сутки 0)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD-TPI
[0059]
Как показано на фиг. 3, фиг. 4, в таблице 4 и таблице 5, посредством комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши подтверждали статистически значимо удивительно потенциированный противоопухолевый эффект.
Подтверждали, что, хотя ожидаемое TGI при комбинаторном использовании, когда полагали, что эффект комбинаторного использования обоих лекарственных средств был аддитивным, составлял 93,4%, фактически подтверждали более превосходный противоопухолевый эффект, такой как 98,2%. Таким образом, демонстрировали, что эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши представляет собой синергический эффект.
В группе совместного введения комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши не наблюдали серьезное снижение массы, превышающее -20%, и побочные эффекты имели приемлемую степень.
[0060]
Пример 2: Комбинаторное использование комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши
75, 100, 150 мг/кг/сутки (в виде FTD) комбинированного FTD/TPI лекарственного средства и 0,1 мг/организм/сутки антитела против PD-1 мыши вводили мышам, которым трансплантировали клеточную линию злокачественной опухоли толстой кишки мыши (CMT-93) в соответствии с примером 1, и измеряли противоопухолевые эффекты и снижение массы. Результаты представлены на фиг. с 5 до 13, в таблице 6 и таблице 7.
[0061]
[Таблица 6]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
###: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой mAb против PD-1 мыши.
$, $$: p<0,05, p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой FTD⋅TPI.
a): Объем опухоли (TV) в сутки 28 вычисляли в соответствии со следующей формулой: TV=(длина)×(ширина)×(ширина)/2
b): Относительный объем опухоли (RTV) в сутки 28 вычисляли как соотношение TV в сутки 28 к таковому в сутки 0 в соответствии со следующей формулой:
RTV=(TV в сутки 28)/(TV в сутки 0)
c): Скорость ингибирования роста опухоли (TGI) в сутки 28 на основании RTV вычисляли в соответствии со следующей формулой:
TGI(%)=[(средний RTV для контрольной группы)-(средний RTV для группы лечения)]/(средний RTV для контрольной группы)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
[0062]
[Таблица 7]
**:p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
a): Изменение массы тела (BWC%; среднее±SD) в сутки 28 вычисляли в соответствии со следующей формулой:
BWC (%)=[(BW в сутки 28)-(BW в сутки 0)]/(BW в сутки 0)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
[0063]
Как показано на фиг. с 5 до 13, в таблице 6 и таблице 7, статистически значимо удивительно потенциированные противоопухолевые эффекты подтверждали во всех группах комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши.
Подтверждали, что, хотя ожидаемое TGI при комбинаторном использовании, когда полагали, что эффект комбинаторного использования обоих лекарственных средств был аддитивным, составлял 87,8%, 90,1% и 92,6%, соответственно, в группах 75, 100, 150 мг/кг/сутки в виде FTD, фактически подтверждали более превосходные противоопухолевые эффекты, такие как 91,8%, 95,7%, и 98,4%. Таким образом, демонстрировали, что эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-1 мыши представляет собой синергический эффект.
Во всех группах совместного введения не наблюдали серьезное снижение массы, превышающее -20%, и побочные эффекты имели приемлемую степень.
Кроме того, значимое потенцирование противоопухолевого эффекта с помощью антитела к PD-1, даже при половинном количестве FTD, было неожиданным результатом.
Кроме того, в группе комбинаторного использования FTD 150 мг/кг/сутки, исчезновение опухолей подтверждали у 4 мышей из 5 мышей. Это верифицирует, что противоопухолевый эффект чрезвычайно высок во время комбинаторного использования.
[0064]
Пример 3: Комбинаторное использование комбинированного FTD/TPI лекарственного средства и антитела против PD-L1 мыши
150 мг/кг/сутки (в виде FTD) комбинированного FTD/TPI лекарственного средства и 0,1 и 0,2 мг/организм/сутки антитела против PD-L1 мыши (клон 10F.9G2, производства BioXCell, далее в настоящем описании то же самое) вводили мышам, которым трансплантировали линию злокачественной опухоли толстой кишки мыши (CMT-93) в соответствии с примером 1, и измеряли противоопухолевые эффекты и снижение массы. Результаты представлены на фиг. 14 и 15, в таблице 8 и таблице 9.
[0065]
[Таблица 8]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
##: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой mAb против PD-1 мыши.
$$: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой FTD⋅TPI.
a): Объем опухоли (TV) в сутки 28 вычисляли в соответствии со следующей формулой: TV=(длина)×(ширина)×(ширина)/2
b): Относительный объем опухоли (RTV) в сутки 28 вычисляли как соотношение TV в сутки 28 к таковому в сутки 0 в соответствии со следующей формулой:
RTV=(TV в сутки 28)/(TV в сутки 0)
c): Скорость ингибирования роста опухоли (TGI) в сутки 28 на основании RTV вычисляли в соответствии со следующей формулой:
TGI(%)=[(средний RTV для контрольной группы)-(средний RTV для группы лечения)]/(средний RTV для контрольной группы)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD⋅TPI
[0066]
[Таблица 9]
**: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой.
a): Изменение массы тела (BWC,%; среднее±SD) в сутки 28 вычисляли в соответствии со следующей формулой: BWC(%)=[(BW в сутки 28)-(BW в сутки 0)]/(BW в сутки 0)×100
SD: стандартное отклонение
Контрольной группе давали носитель для FTD TPI
[0067]
Как показано на фиг. 14 и 15, в таблице 8 и таблице 9, статистически значимо удивительно потенциированные противоопухолевые эффекты подтверждали во всех группах комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-L1 мыши.
Дополнительно, подтверждали, что, хотя ожидаемое TGI при комбинаторном использовании, когда полагали, что эффект комбинаторного использования обоих лекарственных средств был аддитивным, составлял 74,7% и 79,8%, соответственно, в группах 0,1 и 0,2 мг/организм/сутки антитела против PD-L1 мыши, фактически подтверждали более превосходные противоопухолевые эффекты, такие как 93,0% и 93,5%. Таким образом, демонстрировали, что эффект комбинаторного использования комбинированного FTD/TPI лекарственного средства и антитела против PD-L1 мыши представляет собой синергический эффект.
Во всех группах совместного введения не наблюдали серьезное снижение массы, превышающее -20%, и побочные эффекты имели приемлемую степень.
[0068]
Пример 4: Комбинаторное использование S-1+соединение 1 и антитела против PD-1 мыши
Клеточную линию злокачественной опухоли толстой кишки мыши (CMT-93) трансплантировали с правой стороны грудной клетки мышам C57BL/6NJcl в возрасте 5-6 недель от рождения. После трансплантации опухоли измеряли большую ось (мм) и малую ось (мм) опухоли и вычисляли объем опухоли (TV). Затем мышей делили на группы с тем, чтобы средний TV в каждой группе мог быть одинаковым, и сутки формирования групп (n=8) обозначали как сутки 0.
Комбинированное лекарственное средство тегафур/гимерацил/отерацил калия («S-1», тегафур:гимерацил:отерацил=1:0,4:1 (молярное соотношение), далее в настоящем описании то же самое) и соединение 1 ((R)-N-(1-(3-(циклопентилокси)фенил)этил)-3-((2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)метокси)пропан-1-сульфонамид) суспендировали в водном растворе 0,5% гидроксипропилметилцеллюлозы. Дозу S-1 устанавливали равной 6,9 мг/кг/сутки (количество тегафура) (Anticancer Res. 32:2807-2812 (2012)) и соединение 1 задавали равным 2400 мг/кг/сутки, что предполагали в качестве максимальной дозы, которую можно вводить мыши. Получали антитело против PD-1 мыши 0,1 мг/организм/сутки.
S-1 и смешанный раствор для введения S-1 и соединения 1 вводили перорально ежедневно один раз в сутки в течение 28 суток, начиная со следующих суток формирования групп, и антитело против PD-1 мыши вводили интраперитонеально в сутки 1, 8, 15 и 22. Контрольной группе вводили перорально водный раствор 0,5% гидроксипропилметилцеллюлозы ежедневно один раз в сутки в течение 28 суток.
В качестве показателя противоопухолевого эффекта в каждой группе вычисляли TV для того, чтобы определять относительный объем опухоли (RTV) в сутки 0 и вычисляли лечение/контроль (T/C, %) с помощью следующей формулы, используя средние значения RTV для групп введения лекарственного средства и группы без лечения (контроль), чтобы оценивать противоопухолевые эффекты.
[0069]
TV (мм3)=(большая ось×малая ось2)/2
RTV=(TV в сутки 29)/(TV в сутки 0)
T/C (%)=(средний RTV в сутки 29 для групп введения лекарственного средства)/(средний RTV в сутки 29 для группы без лечения)×100
[0070]
Вышеуказанный RTV наносили на график для каждой даты измерения. Результат сравнения изменения RTV с течением времени (сутки) между каждой группой введения представлен на фиг. 16 и в таблице 10.
[0071]
[Таблица 10]
***: p<0,001 с использованием критерия Аспина-Велча, как сравнивали с контрольной группой
#: p<0,05 с использованием критерия Аспина-Велча, как сравнивали с группой антитела против PD-1 мыши
$$: p<0,01 с использованием критерия Аспина-Велча, как сравнивали с группой S-1/соединения 1
a): Объем опухоли (TV) в сутки 29 вычисляли в соответствии со следующей формулой: TV=(длина)×(ширина)×(ширина)/2
b): Относительный объем опухоли (RTV) в сутки 29 вычисляли как соотношение TV в сутки 29 к таковому в сутки 0 в соответствии со следующей формулой:
RTV=(TV в сутки 29)/(TV в сутки 0)
c): Лечение/контроль (T/C) в сутки 29 на основании RTV вычисляли в соответствии со следующей формулой:
T/C(%)=(средний RTV в группе введения)/(средний RTV в контрольной группе)×100
SD: стандартное отклонение
[0072]
В качестве показателя, отражающего системную токсичность из-за введения лекарственного средства, использовали изменение массы тела (BWC). BWC вычисляли в соответствии со следующей формулой, и средние значения BWC представлены на фиг. 17 и в таблице 11.
[0073]
BWC (%)=([(масса тела мыши в сутки 29)-(масса тела мыши в сутки 0)]/(масса тела мыши в сутки 0))×100
[0074]
[Таблица 11]
a): Изменение массы тела (BWC) (%; среднее±SD) в каждые сутки вычисляли в соответствии со следующей формулой:
BWC(%)=[(BW в сутки 29)-(BW в сутки 0)]/(BW в сутки 0)×100
SD: стандартное отклонение
[0075]
Как показано на фиг. 17 и в таблице 11, статистически значимые противоопухолевые эффекты наблюдали во всех группах введения лекарственного средства, когда сравнивали с контрольной группой, и не наблюдали серьезное снижение массы, превышающее -20%, и побочные эффекты имели приемлемую степень.
Группа введения S-1+антитело против PD-1 мыши и группа введения антитела против PD-1 мыши имели одинаковое T/C (%), что, таким образом не позволило подтверждать очевидный потенцирующий эффект.
Между тем, при сравнении с группой введения S-1+соединение 1+антитело против PD-1 мыши, группой введения S-1+соединение 1 и группой введения антитела против PD-1 мыши обнаруживали, что группа совместного введения 3 лекарственных средств имеет статистически значимый эффект комбинаторного использования относительно любых групп.
Принимая во внимание вышеуказанные результаты, обнаруживали, что S-1, который представляет собой фторированный антиметаболит пиримидина, не оказывает заметного потенциирования противоопухолевого эффекта антитела против PD-1 в качестве одного средства, но заметно потенциирует противоопухолевый эффект антитела против PD-1, когда используют в комбинации с соединением 1, которое представляет собой ингибитор дУТФазы. Таким образом, результаты данных тестов показывают, что ингибитор функции ДНК может потенцировать противоопухолевый эффект антитела против PD-1.
[0076]
Здесь настоящее изобретение не ограничено каждым из вариантов осуществления и примеров, описанных выше, и различные модификации можно использовать в пределах объема, представленного в формуле изобретения. Варианты осуществления, полученные посредством надлежащего комбинирования технических средств, каждое раскрыто в различных вариантах осуществления, также входят в технический объем настоящего изобретения. Вся научная литература и справочная литература, описанная в настоящем описании, включена, таким образом, посредством ссылки.
Группа изобретений относится к области фармацевтики и может быть использована для лечения злокачественных опухолей, в частности злокачественных опухолей желудочно-кишечного тракта, легких или молочной железы. Способ лечения опухоли включает введение эффективных доз ингибитора функции ДНК и иммуномодулятора нуждающемуся в этом субъекту, где ингибитор функции ДНК представляет собой комбинацию лекарственных средств, содержащую трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5, а иммуномодулятор представляет собой антитело против PD-1 или антитело против PD-L1 и где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки. Группа изобретений относится также к способу потенциирования противоопухолевого эффекта указанного иммуномодулятора, включающему введение эффективной дозы указанного ингибитора функции ДНК нуждающемуся в этом субъекту. Группа изобретений обеспечивает усиление противоопухолевого эффекта иммуномодулятора. 4 н. и 16 з.п. ф-лы, 11 табл., 4 пр., 17 ил.
1. Способ лечения опухоли, включающий введение эффективных доз ингибитора функции ДНК и иммуномодулятора нуждающемуся в этом субъекту, где ингибитор функции ДНК представляет собой комбинацию лекарственных средств, содержащую трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5, где иммуномодулятор представляет собой антитело против PD-1 или антитело против PD-L1 и где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
2. Способ по п. 1, в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
3. Способ по п. 1 или 2, в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
4. Способ по любому одному из пп. 1-3, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
5. Способ по любому одному из пп. 1-4, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
6. Способ потенциирования противоопухолевого эффекта иммуномодулятора, включающий введение эффективной дозы ингибитора функции ДНК нуждающемуся в этом субъекту, где ингибитор функции ДНК представляет собой комбинацию лекарственных средств, содержащую трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5, где иммуномодулятор представляет собой антитело против PD-1 или антитело против PD-L1 и где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
7. Способ по п. 6, в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
8. Способ по п. 6 или 7, в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
9. Способ по любому одному из пп. 6-8, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
10. Способ по любому одному из пп. 6-9, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
11. Способ лечения пациента со злокачественной опухолью, которому вводили иммуномодулятор, включающий введение эффективной дозы ингибитора функции ДНК нуждающемуся в этом субъекту, где ингибитор функции ДНК представляет собой комбинацию лекарственных средств, содержащую трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5, где иммуномодулятор представляет собой антитело против PD-1 или антитело против PD-L1 и где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
12. Способ по п. 11, в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
13. Способ по п. 11 или 12, в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
14. Способ по любому одному из пп. 11-13, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
15. Способ по любому одному из пп. 11-14, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
16. Способ лечения опухоли, включающий введение эффективной дозы ингибитора функции ДНК и иммуномодулятора нуждающемуся в этом субъекту, где ингибитор функции ДНК представляет собой комбинацию лекарственных средств, содержащую трифлуридин и гидрохлорид типирацила в молярном соотношении 1:0,5, где иммуномодулятор представляет собой антитело против PD-1 или антитело против PD-L1 и где суточная доза трифлуридина на дату введения составляет от 35 до 80 мг/м2/сутки.
17. Способ по п. 16, в котором антитело против PD-1 представляет собой ниволумаб или пембролизумаб и антитело против PD-L1 представляет собой атезолизумаб, дурвалумаб или авелумаб.
18. Способ по п. 16 или 17, в котором суточная доза трифлуридина на дату введения составляет от 50 до 115% от рекомендованной дозы, когда вводят отдельно.
19. Способ по любому одному из пп. 16-18, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль легких или злокачественную опухоль молочной железы.
20. Способ по любому одному из пп. 16-19, в котором злокачественная опухоль, подлежащая направленному воздействию, представляет собой злокачественную опухоль толстой кишки.
| WO 2013181452 A1, 05.12.2013 | |||
| W | |||
| JOOST LESTERHUIS ET AL, "Synergistic Effect of CTLA-4 Blockade and Cancer Chemotherapy in the Induction of Anti-Tumor Immunity", PLOS ONE, (20130423), vol | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| US 8883759 B2, 11.11.2014 | |||
| NUKATSUKA MAMORU ET AL, "Efficacy of combination chemotherapy using a novel oral chemotherapeutic agent, | |||
Авторы
Даты
2021-05-05—Публикация
2017-01-06—Подача