Область техники, к которой относится изобретение
Настоящее изобретение относится к области терапии онкологического заболевания. В частности, настоящее изобретение относится к способу предотвращения, лечения или ингибирования развития опухолей и/или метастазов у субъекта.
Уровень техники изобретения
У людей с прогрессирующим онкологическим заболеванием противоопухолевый иммунитет часто оказывается неэффективным вследствие жестко регулируемого взаимодействия провоспалительных и противовоспалительных, иммуностимулирующих и иммуносупрессивных сигналов. Например, потеря противовоспалительных сигналов приводит к хроническому воспалению и длительной пролиферативной сигнализации. Интересно отметить, что на месте опухоли продуцируются цитокины, которые как способствуют, так и подавляют пролиферацию опухолевых клеток. Именно дисбаланс между воздействием указанных различных процессов содействует продвижению опухоли.
На сегодняшний день основным препятствием для попыток разработать эффективную иммунотерапию онкологических заболеваний является неспособность преодолеть иммуносупрессию в месте развития онкологического заболевания и восстановить нормальные сети иммунной реактивности. Физиологический подход в иммунотерапии заключается в нормализации иммунной реактивности таким образом, чтобы, например, распознавались эндогенные опухолевые антигены и развивались эффективные цитолитические ответы против опухолевых клеток. Ранее не было ясно, существует ли иммунный надзор, однако теперь полагают, что иммунная система постоянно отслеживает и устраняет новые трансформированные клетки. Соответственно, в ответ на иммунное давление раковые клетки могут изменять свой фенотип с тем, чтобы избежать атаки ("иммуноредактирования") и усилить экспрессию ингибирующих сигналов. Посредством иммуноредактирования и других разрушительных процессов, первичная опухоль и метастазы сохраняют свою жизнеспособность.
Один из основных механизмов разрушительного противоопухолевого действия иммунитета известен как Т-клеточное истощение, который является результатом длительного воздействия антигенов и характеризуется повышением уровня ингибирующих рецепторов. Указанные ингибирующие рецепторы служат в качестве иммунных контрольных точек, предназначенных для предотвращения протекания неконтролируемых иммунных реакций.
PD-1 и коингибирующие рецепторы, такие как антиген цитотоксического Т-лимфоцита 4 (CTLA-4, В- и Т-лимфоцитарный аттенюатор (BTLA; CD272), Т-клеточный иммуноглобулин и домен-3 муцина (Tim-3), ген-3 активации лимфоцитов (Lag-3; CD223) и другие, часто называют регуляторами контрольных точек. Они выступают в качестве молекулярных "пунктов взимания платы", которые позволяют внеклеточной информации предписывать, должно ли продолжаться развитие клеточного цикла и других внутриклеточных процессов сигнальной системы.
В дополнение к специфическому распознаванию антигена посредством TCR, активация Т-клеток регулируется балансом положительных и отрицательных сигналов, поступающих от ко-стимулирующих рецепторов. Указанные поверхностные белки, как правило, являются членами суперсемейств либо рецептора TNF, либо В7. Агонистические антитела, направленные против активации ко-стимулирующих молекул и блокирования антител против отрицательных ко-стимулирующих молекул, могут усилить стимуляцию Т-клеток, способствуя разрушению опухоли.
Белок 1 запрограммированной гибели клеток (PD-1, или CD279), трансмембранный белок типа 1 размером 55 кДа, является членом семейства CD28 ко-стимулирующих рецепторов Т-клеток, которые включают член суперсемейства иммуноглобулинов CD28, CTLA-4, индуцируемый ко-стимулятор (ICOS) и BTLA. PD-1 с высоким уровнем экспрессируется на активированных Т-клетках и В-клетках. Экспрессия PD-1 также может быть обнаружена у субпопуляции Т-клеток памяти с переменными уровнями экспрессии. Были идентифицированы два лиганда, специфичные для PD-1: лиганд 1 запрограммированной гибели (PD-L1, также известный как B7-H1 или CD274) и PD-L2 (также известный как B7-DC или CD273). Было показано, что PD-L1 и PD-L2 снижают активацию Т-клеток путем связывания с PD-1 как в мышиных, так и человеческих системах (Okazaki et al., Int. Immunol., 2007; 19: 813-824). Взаимодействие PD-1 с его лигандами, PD-L1 и PD-L2, которые экспрессируются на антиген-презентирующих клетках (АРСs) и дендритных клетках (DCs), передает отрицательные регуляторные сигналы с тем, чтобы снизить иммунный ответ активированных Т-клеток. Блокада PD-1 подавляет этот негативный сигнал и усиливает ответные реакции Т-клеток.
Многочисленные исследования показывают, что микроокружение злокачественной опухоли манипулирует сигнальным путем PD-L1/PD-1 и что индукция экспрессии PD-L1 связана с угнетением иммунных реакций против злокачественной опухоли, позволяя тем самым прогрессировать онкологическому заболеванию и метастазам. Сигнальный путь PD-L1/PD-1 является основным механизмом ускользания онкологического заболевания от механизмов иммунологического надзора по нескольким причинам. Во-первых, и что самое главное, указанный путь участвует в ослаблении иммунных реакций активированных эффекторных Т-клеток, обнаруженных на периферии. Во-вторых, PD-L1 усиливается в микроокружении злокачественной опухоли, но PD-1 также усиливается в инфильтрирующих опухоль Т-клетках, тем самым, вероятно, способствуя образованию замкнутого цикла ингибирования. В-третьих, указанный путь замысловато участвует как во врожденном, так и адаптивном иммунном регулировании посредством двунаправленной передачи сигналов. Указанные факторы делают комплекс PD-1/PD-L1 центральной точкой, через которую злокачественная опухоль может манипулировать иммунными реакциями и способствовать собственному развитию.
Первым ингибитором иммунных контрольных точек, который прошел испытания в клинических условиях, является ипилимумаб (Yervoy, Bristol-Myers Squibb), моноклональное антитело CTLA-4. CTLA-4 относится к иммуноглобулиновому суперсемейству рецепторов, которое также включает PD-1, BTLA, TIM-3 и содержащий V-домен иммуноглобулина супрессор активации Т-клеток (VISTA). Моноклональное антитело против CTLA-4 является мощным ингибитором контрольных точек, который удаляет "разрыв" как у нативных, так и подвергнутых воздействию антигена клеток. Терапия усиливает противоопухолевую функцию CD8+ Т-клеток, увеличивает отношение CD8+ Т-клеток к регуляторным клеткам Foxp3+ T и ингибирует супрессивную функцию регуляторных Т-клеток. Основным недостатком моноклональной терапии против CTLA-4 является развитие аутоиммунной токсичности вследствие направленного воздействия сверхизбыточной иммунной системы, которая потеряла способность убавляться. Сообщалось, что у вплоть до 25% пациентов, получавших лечение с использованием ипилимумаба, развились серьезные неблагоприятные события/побочные эффекты 3-4 степени аутоиммунного типа, включая дерматит, энтероколит, гепатит, эндокринопатию (в том числе гипофизит, тиреоидит и адреналит), артрит, увеит, нефрит и вирусный менингит. В отличие от накопленного опыта против CTLA-4, терапия против PD-1, по-видимому, лучше переносится и индуцирует относительно низкую частоту побочных эффектов аутоиммунного типа.
TIM-3 был идентифицирован как еще один важный ингибирующий рецептор, экспрессируемый истощенными CD8+ Т-клетками. В мышиных моделях рака было показано, что наиболее дисфункциональные инфильтрующиеся в опухоль CD8+ Т-клетки на самом деле ко-экспрессируют PD-1 и TIM-3.
LAG-3 является еще одним недавно идентифицированным ингибирующим рецептором, который действует, ограничивая функцию эффекторных Т-клеток и усиливая супрессивную активность регуляторных Т-клеток. Недавно было установлено, что PD-1 и LAG-3 интенсивно ко-экспрессируются инфильтрующимися в опухоль Т-клетками у мышей и что комбинированная блокада PD-1 и LAG-3 вызывает действенные синергические противоопухолевый иммунные ответы в мышиных моделях рака.
Блокаду сигнального пути PD-1 можно комбинировать с применением других вакцин или других иммуномодулирующих антител, с целью повышения терапевтической эффективности (Hirano, F. et al, Cancer Res., 65(3): 1089-1096 (2005); Li, B. et al, Clin. Cancer Res., 15: 1507-1509 (2009); и Curran, M.A. et al, Proc. Natl. Acad. Sci., 107(9): 4275-4280 (2010)).
В настоящее время антагонистические моноклональные антитела как против PD-1, так и против его лиганда PD-L1 находятся на различных стадиях развития для использования при лечении онкологических заболеваний, и недавние испытания на людях дали обнадеживающие результаты для онкологических больных с прогрессирующим, трудно поддающимся лечению заболеванием.
Первым из агентов, блокирующих путь В7-H1/PD-1, который дошел до фазы I клинических испытаний, был Nivolumab (MDX-1 106/BMS-936558/ONO-4538), полностью человеческое lgG4 моноклональное антитело против PD-1, разработанное компанией Bristol-Myers Squibb. Другим моноклональным антителом против PD-1, которое проходит клинические испытания, является CT-01 1, гуманизированное lgG1 моноклональное антитело, специфичное для PD-1, которое разработано компанией CureTech Ltd. Другие агенты включают Lambrolizumab (MK-3475 - Merck), гуманизированное lgG4 моноклональное антитело PD-1; BMS-936559, полностью человеческое lgG4 антитело PD-L1 и MPDL3280A компании Roche, человеческое моноклональное антитело, которое нацелено на путь PD-L1.
Соответственно, предметом настоящего изобретения является комбинированная терапия для лечения онкологического заболевания, включающая иммуномодулятор и блокаду ингибиторов контрольных точек, обладающая потенциальной способностью вызывать действенные и длительные иммунные ответные реакции.
Сущность изобретения
В настоящем изобретении предлагается эффективный способ лечения и/или предотвращения онкологического заболевания и/или развития метастазов путем введения ингибитора контрольных точек, который действует синергически с цельноклеточной Mycobacterium.
В соответствии с первым аспектом настоящего изобретения, предлагается иммуномодулятор для использования с целью лечения, уменьшения, ингибирования или контролирования опухолевого заболевания у пациента, который предназначен для проведения терапии с применением ингибирования контрольных точек одновременно, раздельно или последовательно с введением иммуномодулятора.
В соответствии со вторым аспектом настоящего изобретения, предлагается способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту, (i) ингибитора контрольных точек и (ii) иммуномодулятора, при этом указанный способ приводит к повышенной терапевтической эффективности, по сравнению с введением ингибитора контрольных точек или иммуномодулятора по одиночке.
В соответствии с третьим аспектом настоящего изобретения, предлагается способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) субтерапевтического количества и/или продолжительности воздействия ингибитора контрольных точек и (ii) иммуномодулятора, при этом указанный способ приводит к повышенной терапевтической эффективности, по сравнению с введением ингибитора контрольных точек или иммуномодулятора по одиночке.
Таким образом, в настоящем изобретении предлагается комбинированная терапии с применением ингибирования контрольных точек вместе со специфическим типом иммунотерапии, которая включает введение иммуномодулятора. Авторы настоящего изобретения обнаружили, что сочетание обоих методов лечения является синергическим, которое превышает простые аддитивные эффекты каждой терапии, когда их используют по отдельности.
Описание чертежей
Настоящее изобретение описано со ссылкой на следующие чертежи, где:
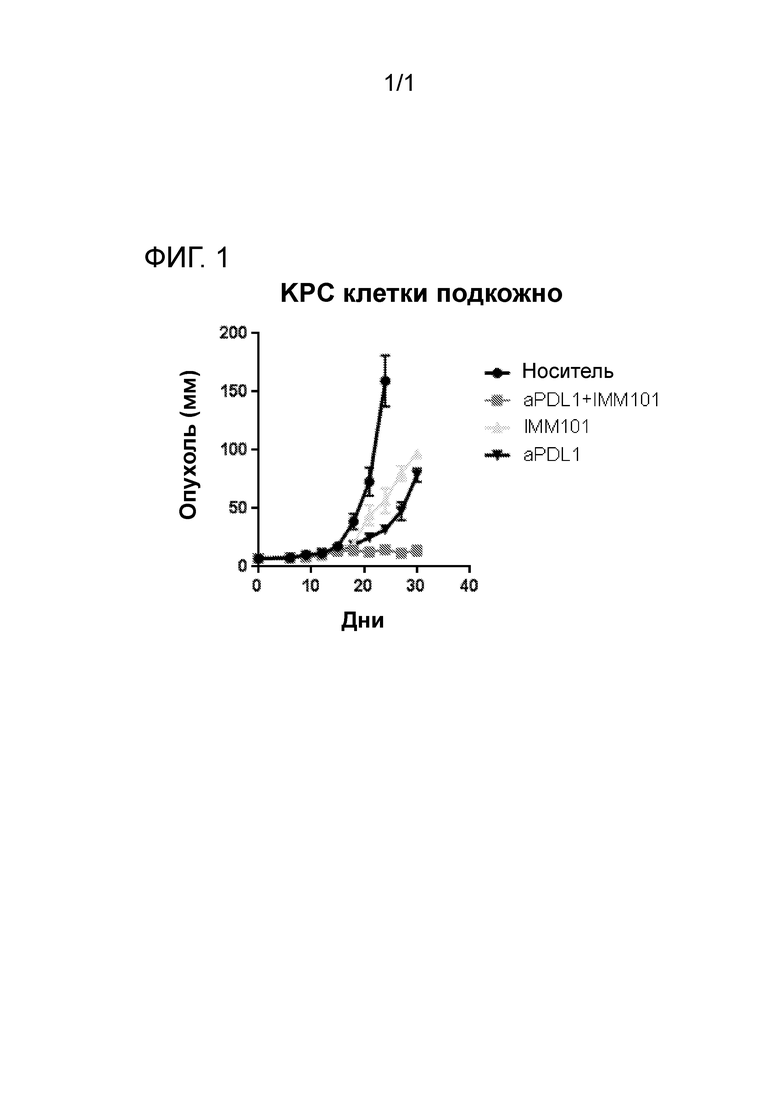
на фигуре 1 показано воздействие препарата термоинактивированной Mycobacterium obuense (NCTC 13365) с совместным введением или без совместного введения ингибитора контрольных точек (моноклонального антитела против PD-L1) в модели ксенотрансплантата рака поджелудочной железы (клетки KPC вводили подкожно).
Подробное описание изобретения
В настоящем изобретении предлагается способ лечения, уменьшения, ингибирования или контролирования неоплазии, опухоли или онкологического заболевания у субъекта, который включает введение иммуномодулятора и ингибитора контрольных точек. Он основан на обнаружении того факта, что введение иммуномодулятора (цельноклеточной термоинактивированной Mycobacterium) в комбинации с антителом против PD-L1 (ингибитором контрольных точек) приводит к синергической противоопухолевой активности и/или противоопухолевой активности, которая является более действенной, чем введение иммуномодулятора или антитела против PD-L1 по одиночке.
Для лучшего понимания настоящего изобретения вначале определены некоторые термины. Дополнительные определения приведены с подробным описанием.
"Ингибитор контрольных точек" представляет собой агент, который действует на поверхностные белки, являющиеся членами суперсемейств либо рецептора TNF, либо В7, в том числе представляет собой агенты, которые связываются с негативно ко-стимулирущими молекулами, выбранными из CTLA-4, PD-1, TIM-3, BTLA, VISTA, LAG-3 и/или их соответствующих лигандов, в том числе PD-L1. (Mellman et al., см. выше).
Иммуномодулятор, как определено в настоящем изобретении, представляет собой компонент, который стимулирует врожденный иммунитет и иммунитет 1-го типа, в том числе иммунитет Th1 и активацию макрофагов и цитотоксическую активность клеток, а также независимо ослабляет не соответствующие ответные реакции против Th2 посредством иммунорегуляторных механизмов.
Термины "опухоль", "онкологическое заболевание" и "неоплазия" используются взаимозаменяемо и относятся к клетке или популяции клеток, рост, пролиферация или выживание которых превышает рост, пролиферацию или выживание аналогичной нормальной клетки, например, относятся к клеточному пролиферативному или дифференцирующему расстройству. Как правило, рост является неконтролируемым. Термин "злокачественное развитие" относится к инвазии в близлежащие ткани. Термин "метастазирование" относится к распространению или рассеиванию опухоли, онкологического заболевания или неоплазии в другие места, локализации или области внутри субъекта, при этом места, локализации или области отличны от первичной опухоли или онкологического заболевания.
Термины "запрограммированная смерть 1", "запрограммированная гибель клеток 1", "белок PD-1", "PD-1", и "PD1" используются взаимозаменяемо и включают в себя варианты, изоформы, видовые гомологи человеческого PD-1 и аналоги, имеющие, по меньшей мере, один общий эпитоп с PD-1. Полную последовательность PD-1 можно найти в GenBank по номеру доступа U64863.
Термины "антиген цитотоксического Т-лимфоцита 4", "CTLA-4", "CTLA4" и "антиген CTLA-4" (см, например, Murata, Am. J. Pathol. (1999) 155: 453-460) используются как взаимозаменяемые и включают в себя варианты, изоформы, видовые гомологи человеческого CTLA-4, и аналоги, имеющие, по меньшей мере, один общий эпитоп с CTLA-4 (см., например, Balzano (1992) Int. J. Cancer Suppl. 7: 28-32). Полную последовательность нуклеиновых кислот CTLA-4 можно найти в GenBank, No. L15006.
Используемый в данном описании термин "субтерапевтическая доза" означает дозу терапевтического соединения (например, антитела) или продолжительность терапии, которая меньше, чем обычная или типичная доза терапевтического соединения или лечение с более короткой продолжительностью, при введении по отдельности, с целью лечения злокачественной опухоли. Например, субтерапевтическая доза антитела CTLA-4 представляет собой разовую дозу антитела, равную меньше чем приблизительно 3 мг/кг, т.е. известную дозу антитела против CTLA-4.
Термин "терапевтически эффективное количество" определяется как количество ингибитора контрольных точек, в сочетании с иммуномодулятором, которое, предпочтительно, приводит к уменьшению выраженности симптомов заболевания, увеличению частоты и продолжительности бессимптомных периодов болезни или предотвращению ухудшения патологии или нарушения здоровья по причине болезни. Термины "эффективное количество" или "фармацевтически эффективное количество" относятся к достаточному количеству агента, которое обеспечивает желаемый биологический или терапевтический результат. Указанный результат может представлять собой ослабление, уменьшение интенсивности симптомов заболевания, временное облегчение проявления болезни, ослабление, задержку и/или облегчения одного или нескольких признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Что касается онкологического заболевания, то эффективное количество может включать количество, достаточное для того, чтобы заставить опухоль сокращаться и/или уменьшить скорость роста опухоли (например, подавить рост опухоли) или предотвратить или задержать другую нежелательную пролиферацию клеток. В некоторых вариантах осуществления настоящего изобретения эффективное количество представляет собой количество, достаточное для того, чтобы задержать развитие или продлить выживание или вызвать стабилизацию онкологического заболевания или опухоли.
В некоторых вариантах осуществления настоящего изобретения терапевтически эффективное количество представляет собой количество, достаточное для предотвращения или задержки рецидива заболевания. Терапевтически эффективное количество можно вводить в один или несколько приемов. Терапевтически эффективное количество лекарственного средства или комбинации может привести к одному или нескольким из следующих результатов: (i) уменьшить количество раковых клеток; (ii) уменьшить размер опухоли; (iii) ингибировать, затормозить развитие, в некоторой степени замедлить и, предпочтительно, остановить инфильтрацию раковых клеток в периферические органы; (iv) ингибировать (т.е. до некоторой степени замедлить и, предпочтительно, остановить) метастазирование опухоли; (v) ингибировать рост опухоли; (vi) предотвратить или отсрочить возникновение и/или рецидив опухоли; и/или (vii) облегчить в некоторой степени один или несколько симптомов, связанных с онкологическим заболеванием.
Например, при лечении опухолей "терапевтически эффективная доза" может вызвать уменьшение размеров опухоли, по меньшей мере, приблизительно на 5% по сравнению с исходном уровнем измерений, например, по меньшей мере, приблизительно на 10%, или приблизительно на 20%, или приблизительно на 60% или более. Исходные измерения могут быть проведены для не подвергавшихся лечению субъектов.
Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли или иным образом ослабить симптомы заболевания у субъекта. Обычный специалист в данной области техники способен определить подобные количества на основе таких факторов, как размер субъекта, тяжесть симптомов заболевания у субъекта, а также конкретная композиция или выбранный путь введения.
Термин "иммунный ответ" относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитарных клеток, гранулоцитов и растворимых макромолекул, продуцированных вышеуказанными клетками или печенью (включая антитела, цитокины и комплемент), которое приводит к селективному повреждению, разрушению или удалению раковых клеток из организма человека.
Термин "антитело" в данном описании включает целые антитела и любой их антигенсвязывающий фрагмент (т.е. "антигенсвязывающую часть") или их одиночные цепи.
Термин "антигенсвязывающая часть" антитела (или просто "часть антитела") в данном описании относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с рецептором и его лигандом (например, PD-1), в том числе таким как: (i) фрагмент Fab, (ii) фрагмент F(аb')2; (iii) фрагмент Fd, состоящий из доменов VH и CHI; (iv) фрагмент Fv, (v) фрагмент dAb (Ward et al, Nature, 341: 544-546 (1989)), который состоит из домена VH; и (vi) выделенный гипервариабельный участок (CDR). Предполагается, что термин "антигенсвязывающая часть" антитела охватывает также одноцепочечные антитела. Указанные фрагменты антител получают с использованием традиционных методов, известных специалистам в данной области техники, и указанные фрагменты подвергают скринингу на пригодность таким же образом, что и интактные антитела.
Термины "моноклональное антитело" или "композиция моноклонального антитела" в данном описании относятся к препарату молекул антител одного молекулярного состава. Композиция моноклонального антитела проявляет одну специфичность связывания и аффинность к конкретному эпитопу.
Термин "человеческое антитело" в данном описании включает антитела, имеющие вариабельные области, в которых как каркасные области, так и CDR области получены из последовательностей иммуноглобулина зародышевой линии человека.
Термин "гуманизированное антитело" относится к антителам, в которых последовательности CDR, полученные из зародышевой линии других видов млекопитающих, таких как мышь, были привиты в каркасные последовательности человека. Дополнительные модификации каркасной области могут быть сделаны в пределах каркасных последовательностей человека.
Помимо антител, в качестве ингибиторов контрольных точек могут выступать другие биологические молекулы, в том числе пептиды, обладающие аффинностью связывания с соответствующей мишенью.
Термин "лечение" или "терапия" относится к введению активного агента с целью вылечить, исцелить, частично снять, облегчить, изменить, залечить, уменьшить интенсивность, улучшить или повлиять на состояние (например, болезни), симптомы состояния или предотвратить или отсрочить возникновение симптомов, осложнений, биохимических признаков заболевания, или иным образом задержать или воспрепятствовать дальнейшему развитию заболевания, состояния или расстройства статистически значимым образом.
В данном описании термин "субъект" включает человека и отличных от человека животных. Предпочтительные субъекты включают больных людей, нуждающихся в повышении ответной реакции иммунной системы. Указанные способы особенно пригодны для лечения пациентов-людей, имеющих расстройство, которое можно лечить путем усиления опосредованного Т-клетками иммунного ответа. В конкретном варианте осуществления настоящего изобретения указанные способы особенно пригодны для лечения раковых клеток в живом организме.
В данном описании термины "сопутствующее введение" или "сопутствующим образом" или "одновременно" означает, что введение происходит в тот же день. Термины "последовательное введение" или "последовательно" или "отдельно" означают, что введение происходит в разные дни.
"Одновременное" введение, как определено в данном описании, включает введение иммуномодулятора и агента или процедуры, включающей терапию с использованием ингибитора контрольных точек, в течение приблизительно 2 час или приблизительно 1 час или менее друг от друга, еще более предпочтительно, в то же самое время.
"Раздельное" введение, как определено в данном описании, включает введение иммуномодулятора и агента или процедуры, включающей терапию с использованием ингибитора контрольных точек, с разницей более чем приблизительно 12 час, или приблизительно 8 час, или приблизительно 6 час, или приблизительно 4 час, или приблизительно 2 час друг от друга.
"Последовательное" введение, как определено в данном описании, включает введение иммуномодулятора и химиотерапевтического агента, каждого в виде нескольких аликвот, и/или доз, и/или в виде отдельных событий. Иммуномодулятор может назначаться пациенту либо до, либо после введения ингибитора контрольных точек. В качестве альтернативы, иммуномодулятор продолжают применять для пациента после лечения с использованием ингибитора контрольных точек.
Использование альтернативных значений (например, "или") следует понимать либо как одну, другую, или любую их комбинацию, соответствующую альтернативному значению. Используемую в данном описании неопределенную форму следует понимать как относящуюся к "одному или нескольким" из любых указанных обозначенных компонентов.
В данном описании "приблизительно" означает в пределах приемлемого диапазона ошибок для конкретного значения, как определено специалистом в данной области техники, которое будет частично зависеть от того, как величина измеряется или определяется, т.е. от ограничений системы измерения. Например, "приблизительно" может означать в пределах 1 или более чем 1 стандартного отклонения в практике данной области техники. В качестве альтернативы, "приблизительно" может означать диапазон вплоть до 20%. В том случае, когда в заявке и в формуле изобретения представлены отдельные значения, то, если не указано иное, значение "приблизительно" следует считать находящимся в пределах приемлемого диапазона ошибок для данной конкретной величины.
В соответствии с одним аспектом настоящего изобретения, иммуномодулятор включает термоинактивированную Mycobacterium, предпочтительно, цельноклеточную Mycobacterium. Примеры видов микобактерий для использования в настоящем изобретении включают M. vaccae, M. thermoresistibile, M. flavescens, M. duvalii, M. phlei, M. obuense, M. parafortuitum, M. sphagni, M. aichiense, M. rhodesiae, M. neoaurum, M. chubuense, M. tokaiense, M. komossense, M. aurum, M. w, M. tuberculosis, M. microti; M. africanum; M. kansasii, M. marinum; M. simiae; M. gastri; M. nonchromogenicum; M. terrae; M. triviale; M. gordonae; M. scrofulaceum; M. paraffinicum; M. intracellulare; M. avium; M. xenopi; M. ulcerans; M. diernhoferi, M. smegmatis; M. thamnopheos; M. flavescens; M. fortuitum; M. peregrinum; M. chelonei; M. paratuberculosis; M. leprae; M. Lepraemurium и их комбинации.
Предпочтительно, термоинактивированная Mycobacterium не является патогенной. Непатогенная термоинактивированная Mycobacterium, предпочтительно, выбрана из M. vaccae, М. obuense, М. parafortuitum, М. aurum, М. indicus pranii, М. phlei и их комбинации. Более предпочтительно, непатогенная термоинактивированная Mycobacterium представляет собой морфологический вариант. Количество Mycobacterium, которое вводят пациенту, достаточно, чтобы вызывать защитный иммунный ответ у пациента, в результате которого иммунная система пациента способна дать эффективный иммунный ответ на онкологическое заболевание или опухоль. В некоторых вариантах осуществления настоящего изобретения предлагаются средства сдерживания распространения заболевания, включающие эффективное количество термоинактивированной Mycobacterium для использования в настоящем изобретении, которое, как правило, может включать от 103 до 1011 микроорганизмов, предпочтительно, от 104 до 1010 микроорганизмов, более предпочтительно, от 106 до 1010 организмов и, еще более предпочтительно, от 106 до 109 организмов. Эффективное количество термоинактивированной Mycobacterium для использования в настоящем изобретении может включать от 103 до 1011 микроорганизмов, предпочтительно, от 104 до 1010 микроорганизмов, более предпочтительно, от 106 до 1010 микроорганизмов и, еще более предпочтительно, от 106 до 109 организмов. Наиболее предпочтительно количество термоинактивированной Mycobacterium для использования в настоящем изобретении, составляет от 107 до 109 клеток или организмов. Как правило, для использования применительно к человеку и животным композицию по настоящему изобретению можно вводить с дозой от 108 до 109 клеток. В качестве альтернативы, доза составляет от 0,01 мг до 1 мг или 0,1 мг до 1 мг организма, приготовленного либо в виде суспензии, либо в виде сухого препарата.
М. vaccae и М. obuense являются наиболее предпочтительными.
М. vaccae и М. obuense индуцируют у хозяина сложный иммунный ответ. Лечение с применением указанных препаратов стимулирует врожденный иммунитет и иммунитет 1-го типа, в том числе вызывает активацию Th1 и макрофагов, и стимулирует активность цитотоксических клеток. Указанных препараты также независимо снижают неадекватные ответные реакции Th2 посредством иммунорегуляторных механизмов. В итоге восстанавливается здоровый баланс иммунной системы.
Настоящее изобретение может быть использовано для лечения неопластических заболеваний, таких как солидные или несолидные злокачественные опухоли. Используемый в данном описании термин "лечение" охватывает предотвращение, сокращение, контролирование и/или ингибирование неопластического заболевания. Подобные заболевания включают саркому, карциному, аденокарциному, меланому, миелому, бластому, глиому, лимфому или лейкоз. Типичные виды онкологических заболеваний включают, например, карциному, саркому, аденокарциному, меланому, опухоль нервной системы (бластому, глиому), мезотелиому и ретикулоэндотелиальные, лимфатические или кроветворные неопластические расстройства (например, миелому, лимфому или лейкоз). В соответствии с конкретными аспектами, новообразование, опухоль или онкологическое заболевание включает аденокарциному легкого, рак легкого, диффузный или интерстициальный рак желудка, аденокарциному толстой кишки, аденокарциному предстательной железы, рак пищевода, рак молочной железы, аденокарциному поджелудочной железы, аденокарциному яичников, аденокарциному надпочечников, аденокарциному эндометрия или аденокарциному матки.
Неоплазии, опухоли и онкологические заболевания включают доброкачественные, злокачественные, метастатические и неметастатические типы, а также включают любую стадию (I, II, III, IV или V) или степень (G1, G2, G3 и т.д.) неоплазии, опухоли или онкологического заболевания, или неоплазию, опухоль, онкологическое заболевание или метастазирование, которое прогрессирует, ухудшается, стабилизируется или находится в стадии ремиссии. Онкологические заболевания, которые можно лечить в соответствии с настоящим изобретением, включают, однако этим не ограничиваясь, опухоли или новообразования мочевого пузыря, крови, кости, костного мозга, головного мозга, молочной железы, толстого кишечника, пищевода, желудочно-кишечного тракта, десны, головы, почки, печени, легкого, носоглотки, шеи, яичников, предстательной железы, кожи, желудка, яичек, языка или матки. Кроме того, онкологическое заболевание может специфически иметь следующий гистологический тип, хотя оно не ограничивается следующими типами: злокачественное новообразование; карцинома; недифференцированная карционома; гигантоклеточная и веретеноклеточная карцинома; мелкоклеточная карцинома; папиллярная карцинома; плоскоклеточная карцинома; лимфоэпителиальная карцинома; базальноклеточная карцинома; пиломатриксная карцинома; переходноклеточная карцинома; папиллярная переходноклеточная карцинома; аденокарцинома; злокачественная гастринома; холангиокарцинома; гепатоклеточная карцинома; комбинированная гепатоклеточная карцинома и холангиокарцинома; трабекулярная аденокарцинома; аденокистозная карцинома; аденокарцинома в аденоматозном полипе; семейная коли-полипозная аденокарцинома; солидная карцинома; злокачественная карциноидная опухоль; бронхиоло-альвеолярная аденокарцинома; папиллярная аденокарцинома; хромофобная карцинома; рак из ацидофильных клеток; оксифильная аденокарцинома; базофильная карцинома; светлоклеточная аденокарцинома; зернистоклеточная карцинома; фолликулярная аденокарцинома; папиллярная и фолликулярная аденокарцинома; неинкапсулированная склерозирующая карцинома; рак коры надпочечников; эндометриоидная карцинома; рак из придатков кожи; апокринная аденокарцинома; сальная аденокарцинома; аденокарцинома церуминозных желез; мукоэпидермоидная карцинома; цистаденокарцинома; папиллярная цистаденокарцинома; папиллярная серозная цистаденокарцинома; муцинозная цистаденокарцинома; муцинозная аденокарцинома; рак из перстневидных клеток; инфильтративно-протоковая карцинома; медуллярная карцинома; лобулярная карцинома; воспалительная карцинома; рак соска молочной железы Педжета; ацинарная карцинома; аденосквамозная карцинома; аденокарцинома с плоскоклеточной метаплазией; злокачественная тимома; злокачественная стромальная опухоль яичников; злокачественная текома; злокачественная гранулезоклеточная опухоль; злокачественная андробластома; злокачественная опухоль из клеток Сертоли; злокачественная опухоль из клеток Лейдига; злокачественная липидноклеточная опухоль; злокачественная параганглиома; злокачественная экстрамамиллярная параганглиома; феохромоцитома; гломангиосаркома; злокачественная меланома; амеланотическая меланома; поверхностно распространяющаяся меланома; злокачественная меланома в большой пигментированной родинке; меланома эпителиоидных клеток; злокачественный меланоформный невус; саркома; фибросаркома; злокачественная фиброзная гистиоцитома; миксосаркома; липосаркома; лейомиосаркома; рабдомиосаркома; эмбриональная рабдомиосаркома; альвеолярная рабдомиосаркома; стромальная саркома; смешанная опухоль; смешанная опухоль Мюллера; нефробластома; гепатобластома; карциносаркома; злокачественная мезенхимома; злокачественная опухоль Бреннера; злокачественная филлоидная опухоль; синовиальная саркома; злокачественная мезотелиома; дисгерминома; эмбриональная карцинома; злокачественная тератома; злокачественная струма яичника; хориокарцинома; злокачественная мезонефрома; гемангиосаркома; злокачественная гемангиоэндотелиома; саркома Капоши; злокачественная гемангиоперицитома; лимфангиосаркома; остеосаркома; юкстакортикальная остеосаркома; хондросаркома; злокачественная хондробластома; мезенхимальная хондросаркома; гигантоклеточная опухоль костей; саркома Юинга; злокачественная одонтогенная опухоль; амелобластическая одонтосаркома; злокачественная амелобластома; амелобластическая фибросаркома; злокачественная пинеалома; хордома; злокачественная глиома; эпендимома; астроцитома; протоплазматическая астроцитома; фибриллярная астроцитома; астробластома; глиобластома; олигодендроглиома; олигодендробластома; примитивная нейроэктодермальная опухоль; мозжечковая саркома; ганглионейробластома; нейробластома; ретинобластома; ольфакторная нейрогенная опухоль; злокачественная менингиома; нейрофибросаркома; злокачественная нейрилеммома; злокачественная зернистоклеточная опухоль; злокачественная лимфома; болезнь Ходжкина; парагранулема Ходжкина; мелкоклеточная злокачественная лимфоцитарная лимфома; диффузная злокачественная большеклеточная лимфома; злокачественная фолликулярная лимфома; фунгоидозный микоз; другие специфицированные неходжкинские лимфомы; злокачественный гистиоцитоз; множественная миелома; саркома тучных клеток; иммунопролиферативное заболевание тонкого кишечника; лейкемия; лимфоидная лейкемия; лейкоз клеток плазмы; эритролейкоз; лимфатическая лейкемия; миелоидная лейкемия; базофильная лейкемия; эозинофильная лейкемия; моноцитарный лейкоз; лейкемия тучных клеток; мегакариобластический лейкоз; миелоидная саркома; и волосатоклеточный лейкоз. Преимущественно, опухолевое заболевание может представлять собой опухоли, связанные с онкологическим заболеванием, выбранным из рака предстательной железы, рака печени, рака почки, рака легкого, рака молочной железы, колоректального рака, рака поджелудочной железы, рака мозга, гепатоклеточного рака, лимфомы, лейкемии, рака желудка, рака шейки матки, рака яичников, рака щитовидной железы, меланомы, рака головы и шеи, рака кожи и саркомы мягких тканей и/или другие формы карциномы. Опухоль может быть метастатической или злокачественной опухолью.
Более предпочтительно, подлежащее лечению неопластическое заболевание представляет собой рак поджелудочной железы, рак молочной железы, рак легкого, рак предстательной железы и рак кожи. Наиболее предпочтительно, подлежащее лечению неопластическое заболевание представляет собой рак поджелудочной железы.
В одном варианте осуществления настоящего изобретения терапия с использованием ингибитора контрольных точек, в виде комбинированной терапии с иммуномодулятором, наиболее предпочтительно, цельноклеточной термоинактивированной Mycobacterium, используется для уменьшения или ингибирования метастазирования первичной опухоли или онкологического заболевания в другие места, или образования или восстановления метастатических опухолей или онкологических заболеваний в других местах, отдаленных от первичной опухоли или онкологического заболевания и, таким образом, для ингибирования или уменьшения рецидива опухоли или онкологического заболевания или прогрессирования опухоли или онкологического заболевания.
В еще одном варианте осуществления настоящего изобретения, предлагается комбинированная терапия для лечения онкологического заболевания, которая включает иммуномодулятор и блокаду ингибиторов контрольных точек с потенциальной возможностью вызывать действенные и продолжительные иммунные ответные реакции с повышенным терапевтическим эффектом и более контролируемой токсичностью.
В еще одном варианте осуществления настоящего изобретения предлагается комбинированная терапии для лечения онкологического заболевания, включающая иммуномодулятор, который (i) стимулирует врожденный иммунитет и иммунитет 1-го типа, в том числе вызывает активацию Th1 и макрофагов и стимулирует активность цитотоксических клеток, и (ii) независимо снижает неадекватные ответные реакции Th2 посредством иммунорегуляторных механизмов; и блокаду ингибитора контрольных точек, где необязательно иммуномодулятор представляет собой цельноклеточную Mycobacterium, выбранную из M. vaccae или M. obuense.
В одном варианте осуществления настоящего изобретения предлагается способ лечения онкологического заболевания и/или предотвращения развития метастазов, включающий использование ингибитора контрольных точек, который действует синергически с цельноклеточной Mycobacterium.
В других вариантах осуществления настоящего изобретения способы по настоящему изобретению включают одно или несколько из следующих воздействий: 1) снижение или ингибирование роста, пролиферации, изменчивости или инвазивности опухолевых или раковых клеток, которые потенциально способны развивать или действительно развивают метастазы, 2) снижение или ингибирование образования или развития метастазов, возникающих из первичной опухоли или онкологического заболевания, в одном или нескольких других местах, локализациях или областях, отличных от расположения первичной опухоли или онкологического заболевания; 3) снижение или ингибирование роста или пролиферации метастазов в одном или нескольких других местах, локализациях или областях, отличных от нахождения первичной опухоли или онкологического заболевания, после того, как метастазы образовались или развились, 4) снижение или ингибирование образования или развития дополнительных метастазов после того, как метастазы образовались или развились, 5) продление срока общей выживаемости, 6) продление срока выживаемости без прогрессирования заболевания или 7) стабилизация заболевания.
В одном варианте осуществления настоящего изобретения применение терапии с использованием ингибитора контрольных точек, в виде комбинированной терапии с иммуномодулятором, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, обеспечивает обнаруживаемое или измеримое улучшение состояния данного субъекта, такое как облегчение или снижение интенсивности одного или нескольких неблагоприятных (физических) симптомов или последствий, связанных с наличием пролиферативного клеточного расстройства или гиперпролиферативного клеточного расстройства, неоплазии, опухоли или онкологического заболевания или метастазирования, т.е. обеспечивает терапевтический эффект или благоприятное воздействие.
Терапевтический эффект или благоприятное воздействие представляет собой любое объективное или субъективное, переходное, временное или долгосрочное улучшение состояния или патологии, или снижение вероятности появления, тяжести, продолжительности или частоты неблагоприятных симптомов, связанных с или вызванных пролиферацией клеток или гиперпролиферативным клеточным расстройством, таким как неоплазия, опухоль или онкологическое заболевание, или метастазированием. Указанное воздействие может привести к улучшению выживаемости. Удовлетворительный клинический результат способа лечения в соответствии с настоящим изобретением достигается, например, в том случае, когда наблюдается постепенное или частичное уменьшение тяжести, продолжительности или частоты одной или нескольких ассоциированных патологий, неблагоприятных симптомов или осложнений или ингибирование или обращение одного или нескольких физиологических, биохимических или клеточных проявлений или характеристик клеточной пролиферации или гиперпролиферативного клеточного расстройства, такого как неоплазия, опухоль или онкологическое заболевание, или метастазирования. Таким образом, терапевтическое эффект или улучшение может представлять собой, однако этим не ограничиваясь, разрушение пролиферирующих клеток-мишеней (например, неоплазии, опухоли или онкологического заболевания или метастазов) или устранение одного или нескольких, большинства или всех патологий, неблагоприятных симптомов или осложнений, связанных с или вызванных пролиферацией клеток или гиперпролиферативным клеточным расстройством, таким как неоплазия, опухоль или онкологическое заболевание, или метастазированием. Тем не менее, терапевтический эффект или улучшение не обязательно может представлять собой излечивание или полное уничтожение всех пролиферирующих клеток-мишеней (например, неоплазии, опухоли или онкологического заболевания, или метастазов) или устранение всех патологий, неблагоприятных симптомов или осложнений, связанных с или вызванных пролиферацией клеток или гиперпролиферативным клеточным расстройством, таким как неоплазия, опухоль или онкологическое заболевание, или метастазированием. Например, частичное разрушение опухоли или массы раковых клеток или стабилизация опухоли или массы, размера или количества раковых клеток путем ингибирования прогрессирования или обострения опухоли или онкологического заболевания может снизить смертность и продлить продолжительность жизни хотя бы на несколько дней, недель или месяцев, даже если сохраняется часть или большая часть опухоли или массы, размера или количества раковых клеток.
Конкретные не ограничивающие примеры терапевтического эффекта включают уменьшение неоплазии, опухоли или онкологического заболевания, или сокращение объема метастазирования (размера или клеточной массы) или количества клеток, ингибирование или предотвращение роста неоплазии или увеличения объема опухоли или онкологического заболевания (например, стабилизация), замедление или ингибирование прогрессирования, ухудшения или метастазирования неоплазии, опухоли или онкологического заболевания или ингибирование пролиферации, роста или метастазирования неоплазии, опухоли или онкологического заболевания.
В одном варианте осуществления настоящего изобретения, введение ингибитора контрольных точек в виде комбинированной терапии с иммуномодулятором, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, обеспечивает обнаруживаемое или измеримое улучшение или общую реакцию в соответствии с irRC (как следует из оценок отклика в контрольные моменты времени и на основании опухолевой нагрузки), в том числе одно или несколько из следующих: (i) irCR - полное исчезновение всех очагов, как измеряемых, так и не измеряемых, и отсутствие новых очагов (подтверждение путем проведения повторной последующей оценки не менее через 4 недели с даты первого документирования), (ii) irPR - уменьшение опухолевой нагрузки > 50% по сравнению с исходным уровнем (подтверждается последующей оценкой, по крайней мере, через 4 недели после первого документирования).
Способ по настоящему изобретению может не проявиться немедленно. Например, лечение может сопровождаться увеличением неоплазии, опухоли или увеличением количества или массы раковых клеток, но с течением времени возможна стабилизация или снижение массы опухолевых клеток, размера или количества раковых клеток у данного субъекта.
Дополнительные неблагоприятные симптомы и осложнения, связанные с неоплазией, опухолью, онкологическим заболеванием и метастазированием, которые могут быть подавлены, снижены, уменьшены, отсрочены или предотвращены, включают, например, тошноту, отсутствие аппетита, апатию, боль и дискомфорт. Так, конкретными не ограничивающими настоящее изобретение примерами терапевтического эффекта являются частичное или полное снижение или уменьшение тяжести, продолжительности или частоты неблагоприятного симптома или осложнения, связанного с или вызванного клеточным гиперпролиферативным расстройством, улучшение качества жизни и/или самочувствия субъекта, например, увеличение энергии, повышение аппетита и психологического комфорта.
Таким образом, терапевтический эффект или улучшение может также включать субъективное улучшение качества жизни субъекта, лечение которого проводят. В дополнительном варианте осуществления настоящего изобретения указанный способ пролонгирует или увеличивает продолжительность жизни (выживание) субъекта. В еще одном варианте осуществления настоящего изобретения указанный способ улучшает качество жизни субъекта.
В наиболее предпочтительном варианте осуществления настоящего изобретения введение ингибитора контрольных точек, в виде комбинированной терапии с иммуномодулятором, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, приводит к соответствующему клиническому улучшению одного или нескольких маркеров статуса и прогрессирования заболевания, выбранного из одного или нескольких следующих: (i): общая выживаемость, (ii): выживаемость без прогрессирования заболевания, (iii): суммарная эффективность терапии, (iv): снижение метастатического процесса, (v): уровни циркулирующих опухолевых антигенов, таких как углеводный антиген 19.9 (CA19.9) и карциноэмбриональный антиген (СЕА) или других, в зависимости от опухоли, (vii) диетарный статус (вес, аппетит, сывороточный альбумин), (viii): устранение боли или использования анальгетиков, (ix): отношение CRP/альбумин.
Лечение с использованием цельноклеточной термоинактивированной M. vaccae и М. obuense повышает совокупный иммунитет, включая не только развитие врожденного иммунитета и иммунитета типа 1, но и усиление иммунорегуляции, которая более эффективно восстанавливает соответствующие иммунные функции.
Иммуномодулятор по настоящему изобретению вводят в комбинации с ингибитором контрольных точек.
В предпочтительном варианте осуществления настоящего изобретения терапия с ингибированием контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1, TIM-3, BTLA, VISTA, LAG-3 и их комбинации.
В другом предпочтительном варианте осуществления настоящего изобретения терапия с ингибированием контрольных точек включает введение субтерапевтического количества и/или продолжительности воздействия блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента антитела, направленного против CTLA-4, PD-1, PD-L1, TIM-3, BTLA, VISTA, LAG-3 и их комбинации.
В еще одном предпочтительном варианте осуществления настоящего изобретения терапия с ингибированием контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-1 и/или PD-L1.
В еще одном предпочтительном варианте осуществления настоящего изобретения терапия с ингибированием контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-1 и/или PD-L1, одновременно, раздельно или последовательно с введением блокирующего антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4.
Следует понимать, что термин "комбинация", используемый в данном описании, охватывает введение ингибитора контрольных точек одновременно, раздельно или последовательно с введением Mycobacterium. Таким образом, ингибитор контрольных точек и Mycobacterium могут присутствовать в одних и тех же или отдельных фармацевтических композициях и назначаться в одно и то же время или в разное время.
Так, Mycobacterium и ингибитор контрольных точек могут быть приготовлены в виде отдельных препаратов для введения в то же самое время или в разное время.
Предпочтительно, Mycobacterium и ингибитор контрольных точек готовят в виде отдельных препаратов для введения в разное время. При введении по отдельности и в разное время, в первую очередь может вводиться либо Mycobacterium, либо ингибитор контрольных точек; тем не менее, удобно вводить ингибитор контрольных точек с последующим введением Mycobacterium. Кроме того, оба препарата могут быть введены в тот же день или в разные дни, и их можно вводить, используя тот же режим или различные режимы введения лекарств в течение цикла лечения.
В одном варианте осуществления настоящего изобретения цикл лечения включает введения Mycobacterium ежедневно, еженедельно, раз в две недели или раз в месяц одновременно с еженедельным введением ингибитора контрольных точек. В качестве альтернативы, Mycobacterium вводят до и/или после введения ингибитора контрольных точек.
В другом варианте осуществления настоящего изобретения Mycobacterium вводят пациенту до и после введения ингибитора контрольных точек. Таким образом, в одном варианте осуществления настоящего изобретения иммуномодулятор вводят пациенту до и после ингибитора контрольных точек.
Задержки дозы и/или снижения дозы и корректировки режимов введения лекарственных средств проводятся по мере необходимости в зависимости от индивидуальной переносимости пациента к осуществляемому лечению.
В качестве альтернативы, введение ингибитора контрольных точек можно осуществлять одновременно с введением эффективных количеств Mycobacterium.
Иммуномодулятор, предпочтительно, цельноклеточную термоинактивированную Mycobacterium можно вводить пациенту парентеральным, пероральным, подъязычным, назальным или внутрилегочным путем. В предпочтительном варианте осуществления настоящего изобретения иммуномодулятор вводят парентеральным путем, выбранным из подкожной, интрадермальной, субдермальной, внутрибрюшинной, внутривенной и внутрипузырном инъекции. Более предпочтительно, введение парентеральным путем не включает внутриопухолевую инъекцию экстракта клеточной стенки микобактерии.
Субъект, который должен пройти терапию с применением ингибирования контрольных точек в соответствии с настоящим изобретением, может сделать это одновременно, раздельно или последовательно с введением иммуномодулятора, предпочтительно цельноклеточной термоинактивированной Mycobacterium.
В соответствии с одним аспектом настоящего изобретения, эффективное количество иммуномодулятора можно вводить в виде однократной дозы. В качестве альтернативы, эффективное количество иммуномодулятора можно вводить в виде нескольких (повторных) доз, например, в виде двух или более, трех или более, четырех или более, пяти или более, десяти или более или двадцать или более повторных доз. Иммуномодулятор можно вводить приблизительно от 4 недель и приблизительно за 1 день до применения терапии с ингибированием контрольных точек, например, приблизительно от 4 недель до 1 недели, или приблизительно от 3 недель до 1 недели, или приблизительно от 3 недель до 2-х недель. Введение может быть осуществлено в виде одной или нескольких доз.
В предпочтительном варианте осуществления настоящего изобретения предлагается Mycobacterium для использования при лечении неопластического заболевания в комбинации с ингибитором контрольных точек, где указанную Mycobacterium вводят субъекту до, одновременно с и/или после того, как водят ингибитор контрольных точек.
Другим предпочтительным вариантом осуществления настоящего изобретения является способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) ингибитора контрольных точек и (ii) иммуномодулятора, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, при этом указанный способ приводит к повышению терапевтической эффективности, по сравнению с введением ингибитора контрольных точек или иммуномодулятора по одиночке.
Другим предпочтительным вариантом осуществления настоящего изобретения является способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) ингибитора контрольных точек и (ii) иммуномодулятора, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, где указанная терапия с применением ингибирования контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1, TIM-3, BTLA, VISTA, LAG-3 и их комбинации.
Другим предпочтительным вариантом осуществления настоящего изобретения является способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) ингибитора контрольных точек и (ii) иммуномодулятора, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, где указанная терапия с применением ингибирования контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-1 и/или PD-L1.
Еще одним предпочтительным вариантом осуществления настоящего изобретения является способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) ингибитора контрольных точек и (ii) иммуномодулятора, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, где указанная терапия с применением ингибирования контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1, TIM-3, BTLA, VISTA, LAG-3 и их комбинаций, при этом указанная терапия с применением ингибирования контрольных точек включает введение субтерапевтического количества и/или продолжительности воздействия указанного блокирующего антитела или его антигенсвязывающего фрагмента.
Наконец, в еще одном варианте осуществления настоящего изобретения предлагается способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) двух или нескольких ингибиторов контрольных точек и (ii) иммуномодулятора, предпочтительно, цельноклеточной термоинактивированной Mycobacterium, где указанная терапия с применением ингибирования контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1, TIM-3, BTLA, VISTA, LAG-3 и их комбинаций, при этом указанная терапия с ингибированием контрольных точек необязательно включает введение субтерапевтического количества и/или продолжительности воздействия указанного блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента.
В одном варианте осуществления настоящего изобретения, Mycobacterium может представлять собой лекарственное средство, вводимое пациенту в виде готовой лекарственной формы.
Контейнер по настоящему изобретению в некоторых случаях может представлять собой пузырек, ампулу, шприц, капсулу, таблетку или канюлю. В некоторых случаях микобактерии могут быть лиофилизованы и приготовлены в виде состава для ресуспендирования перед введением. Тем не менее, в других случаях микобактерии суспендируют в объеме фармацевтически приемлемой жидкости. В некоторых наиболее предпочтительных вариантах осуществления настоящего изобретения предлагается контейнер, содержащий однократную дозу микобактерий, суспендированных в фармацевтически приемлемом носителе, при этом стандартная доза содержит от приблизительно 1*106 до приблизительно 1*1010 организмов. В некоторых конкретных вариантах осуществления настоящего изобретения жидкость, содержащую суспендированные микобактерии, готовят в объеме от приблизительно 0,1 мл до 10 мл, или от приблизительно 0,3 мл до 2 мл, или от приблизительно 0,5 мл до 2 мл. Вышеуказанные композиции являются идеальными готовыми лекарственными формами для иммунотерапевтических применений, рассмотренных в данном описании.
Варианты осуществления настоящего изобретения, описанные в контексте способов и/или композиций по настоящему изобретению, могут быть применены по отношению к любому другому способу или композиции, приведенных в данном описании. Так, один вариант осуществления настоящего изобретения, относящийся к одному способу или композиции, может быть также применен к другим способам и композициям по настоящему изобретению.
В некоторых случаях непатогенные термоинактивированные микобактерии вводят в конкретные места, находящиеся на субъекте или внутри субъекта. Например, микобактериальные композиции по настоящему изобретению, такие как композиции, содержащие, в частности, M. obuense, могут быть введены вблизи опухолей или вблизи лимфатических узлов, таких как лимфатические узлы, которые дренируют ткани, окружающие опухоль. Так, в некоторых случаях места для введения микобактериальной композиции могут быть вблизи задне-бокового, тонзиллярного, подмышечного, пахового, передне-шейного, поднижнечелюстного, подбородочного или надключичного лимфатических узлов.
Иммуномодулятор можно вводить в течение периода времени, пока у пациента имеется онкологическое заболевание или опухоль, или до тех пор, пока онкологическое заболевание не начнет регрессировать или не стабилизируется. Иммуномодулятор также можно продолжать вводить пациентам до тех пор, пока онкологическое заболевание или опухоль не начнет регрессировать или не стабилизируется.
Микобактериальные композиции по настоящему изобретению содержат эффективное количество микобактерий, как правило, диспергированных в фармацевтически приемлемом носителе. Фраза "фармацевтически или фармакологически приемлемый" относится к молекулярным соединениям и композициям, которые не вызывают неблагоприятные, аллергические или другие нежелательные реакции при введении животному, такому как, например, человек, в зависимости от обстоятельств. Способы приготовления фармацевтической композиции, которая содержит микобактерии, известны специалистам в данной области техники в свете настоящего описания, и примером является Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990. Более того, при введении животному (например, человеку), следует понимать, что препараты должны отвечать требованиям стерильности, пирогенности, общей безопасности и стандартам чистоты. Конкретным примером фармакологически приемлемого носителя, как указано в данном описании, является боратный буфер или стерильный физиологический раствор (0,9% NaCl).
В данном описании термин "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), изотонические агенты, замедляющие абсорбцию агенты, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, гели, связующие соединения, наполнители, разрыхлители, лубриканты, подсластители, ароматизаторы, красители, такие как вещества и их комбинации, которые должны быть известны специалисту с обычной квалификацией в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329).
В предпочтительном варианте осуществления настоящего изобретения иммуномодулятор вводят парентеральным путем, выбранным из подкожной, внутридермальной, субдермальной, внутрибрюшинной, внутривенной и внутрипузырной инъекции. Внутридермальная инъекция обеспечивает доставку всей микобактериальной композиции в слой дермы, который доступен для иммунного надзора и, таким образом, способен сделать выбор в пользу иммунного ответа против онкологического заболевания и содействовать пролиферации иммунных клеток в локальных лимфатических узлах.
Хотя в наиболее предпочтительных вариантах осуществления настоящего изобретения микобактериальные композиции вводят путем прямой внутридермальной инъекции, предполагается также, что в некоторых случаях могут быть использованы другие способы введения.
Так, в некоторых случаях термоинактивированные микобактерии по настоящему изобретению могут быть введены путем инъекции, вливания, непрерывного вливания, внутривенно, внутридермально, внутриартериально, внутрибрюшинно, внутриочагово, интравитреально, интравагинально, ректально, местно, внутрь опухоли, внутримышечно, внутрибрюшинно, подкожно, субконъюнктивально, внутривезикулярно, мукозально, интраперикардиально, интраумбиликально, внутриокулярно, перорально, внутричерепно, внутрисуставно, внутрь предстательной железы, интраплеврально, внутритрахеально, интраназально, местно, локально, путем ингаляции (например, аэрозольной ингаляции), через катетер, путем орошения полости или иным способом или посредством любого сочетания вышеуказанных способов, как должно быть известно специалисту в данной области (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990). Более предпочтительно, введение парентеральным путем, не включает внутриопухолевую инъекцию экстракта клеточной стенки микобактерии.
Все публикации, упомянутые в вышеприведенном описании, включены посредством ссылки. Различные модификации и вариации описанных способов и системы настоящего изобретения станут очевидны специалистам в данной области техники и при этом не выходят за рамки объема и сущности настоящего изобретения. Хотя настоящее изобретение описано в связи с конкретными предпочтительными вариантами его осуществления, следует понимать, что заявленное изобретение не должно быть ненадлежащим образом ограничено подобными конкретными вариантами его осуществления. Действительно, предполагается, что различные модификации описанных способов осуществления настоящего изобретения, которые очевидны специалистам в области биохимии и иммунологии или смежных областях, находятся в пределах объема нижеследующей формулы изобретения.
Настоящее изобретение дополнительно описано со ссылкой на следующий не ограничивающий изобретение пример.
Пример 1
Взрослым мышам C57BL/6 вводили подкожно в подвздошную область 105 клеток из линии раковых клеток поджелудочной железы, полученных от мышей KPC (Hingorani et al,. Cancer Cell, 2005, 7: 469-48). Указанные мышиные клетки рака поджелудочной железы несут мутации в Kras, р53 и PDX-Cre (Hingorani et al,. Cancer Cell, 2005, 7: 469-48).
Когда введенные опухолевые клетки выросли до размера пульпируемой опухоли (день 0), мышей оставляли без лечения или назначали им лечение, используя следующие средства:
1) 0,1 мг M. obuense NTCT 13365/мышь подкожно, чередуя попеременно инъекции в загривок с инъекциями в основание хвоста в течение 5 дней с 2 дневным перерывом на протяжении всего исследования;
2) 10 мг/кг моноклонального антитела против PDL-1 внутрибрюшинно один раз в неделю;
3) комбинация реагента против PDL-1 и М. obuense NTCT 13365 с дозой и схемой введения препарата, описанной выше для двух соединений, используемых по одиночке.
За ростом опухоли следили в течение всего исследования с тем, чтобы определить, дает ли применяемое лечение эффект с точки зрения уменьшения размера опухоли и улучшения перспективы выживания.
Данные, представленные на фигуре 1, показывают, что мыши, которые получали комбинированное лечение с использованием реагента против PDL-1 и М. obuense NTCT 13365, продемонстрировали дальнейшее уменьшение размера опухоли и возможность контролировать опухоль. Указанное уменьшение размера опухоли было более выраженным, по сравнению с мышами, получавшими лечебные препараты по отдельности. У мышей, которых оставили без лечения, опухоль росла неконтролируемо, и они вскоре погибли от болезни.
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта. Для этого применяют непатогенную термоинактивированную Mycobacterium obuense у пациента, для которого предусмотрена терапия с применением ингибирования иммунных контрольных точек одновременно, раздельно или последовательно с введением указанной Mycobacterium. Также предложен способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта путем одновременного, раздельного или последовательного введения субъекту ИИКТ, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента против CTLA-4, PD-1, PD-L1 и их комбинации, и непатогенной термоинактивированной Mycobacterium obuense. Группа изобретений позволяет повысить эффективность лечения опухолей за счет синергетического эффекта. 2 н. и 28 з.п. ф-лы, 1 ил., 1 пр.
1. Применение непатогенной термоинактивированной Mycobacterium obuense для лечения, уменьшения, ингибирования или контролирования неопластического заболевания у пациента, для которого предусмотрена терапия с применением ингибирования иммунных контрольных точек одновременно, раздельно или последовательно с введением указанной Mycobacterium, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1 и их комбинации.
2. Применение по п. 1, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение субтерапевтического количества и/или продолжительности воздействия указанного блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента.
3. Применение по п. 1, где указанное неопластическое заболевание связано с онкологическим заболеванием, выбранным из рака предстательной железы, рака печени, рака почки, рака легкого, рака груди, колоректального рака, рака молочной железы, рака поджелудочной железы, рака мозга, гепатоцеллюлярного рака, лимфомы, лейкоза, рака желудка, рака шейки матки, рака яичника, рака щитовидной железы, меланомы, карциномы, рака головы и шеи, рака кожи и саркомы мягких тканей.
4. Применение по п. 3, где указанное неопластическое заболевание связано с раком поджелудочной железы.
5. Применение по п. 1, где указанное неопластическое заболевание является метастатическим.
6. Применение по любому из пп. 1-5, где указанная Mycobacterium включает цельноклеточную Mycobacterium.
7. Применение по п. 6, где указанная непатогенная термоинактивированная Mycobacterium, преимущественно, является морфологическим вариантом.
8. Применение по п. 6, где указанная непатогенная термоинактивированная Mycobacterium приготовлена для введения парентеральным, пероральным, подъязычным, назальным или внутрилегочным путем.
9. Применение по п. 8, где указанный парентеральный путь выбран из подкожного, интрадермального, субдермального, внутрибрюшинного или внутривенного введения.
10. Применение по п. 9, где указанный парентеральный путь не включает внутриопухолевую инъекцию.
11. Применение по любому из пп. 1-5 или 7-10, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-L1 или PD-1.
12. Применение по п. 6, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-L1 или PD-1.
13. Применение по любому из пп. 1-5 или 7-10, где указанный иммуномодулятор вводят до и/или после терапии с применением ингибирования иммунных контрольных точек.
14. Применение по п. 6, где указанный иммуномодулятор вводят до и/или после терапии с применением ингибирования иммунных контрольных точек.
15. Способ лечения, уменьшения, ингибирования или регулирования неоплазии, опухоли или онкологического заболевания у субъекта, где указанный способ включает одновременное, раздельное или последовательное введение указанному субъекту (i) ингибитора иммунных контрольных точек и (ii) непатогенной термоинактивированной Mycobacterium obuense, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против CTLA-4, PD-1, PD-L1 и их комбинации, при этом указанный способ приводит к повышенной терапевтической эффективности, по сравнению с введением ингибитора иммунных контрольных точек или иммуномодулятора по одиночке.
16. Способ по п. 15, где указанный ингибитор иммунных контрольных точек представляет собой блокирующий агент, выбранный из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента, направленного против PD-1 или PD-L1.
17. Способ по п. 15 или 16, где указанная терапия с применением ингибирования иммунных контрольных точек включает введение субтерапевтического количества указанного блокирующего агента, выбранного из клетки, белка, пептида, антитела или его антигенсвязывающего фрагмента.
18. Способ по п. 15 или 16, где указанная неоплазия, опухоль или онкологическое заболевание связано с онкологическим заболеванием, выбранным из рака предстательной железы, рака печени, рака почки, рака легкого, рака груди, колоректального рака, рака молочной железы, рака поджелудочной железы, рака мозга, гепатоцеллюлярного рака, лимфомы, лейкоза, рака желудка, рака шейки матки, рака яичника, рака щитовидной железы, меланомы, карциномы, рака головы и шеи, рака кожи и саркомы мягких тканей.
19. Способ по п. 18, где указанная неоплазия, опухоль или онкологическое заболевание связано с раком поджелудочной железы.
20. Способ по п. 15 или 16, где указанная неоплазия, опухоль или онкологическое заболевание является метастатическим.
21. Способ по п. 15 или 16, где указанная непатогенная термоинактивированная Mycobacterium включает цельноклеточную Mycobacterium.
22. Способ по п. 21, где указанная непатогенная термоинактивированная Mycobacterium является морфологическим вариантом.
23. Способ по п. 21, где указанную непатогенную термоинактивированную Mycobacterium вводят парентеральным, пероральным, подъязычным, назальным или внутрилегочным путем.
24. Способ по п. 23, где указанный парентеральный путь выбран из подкожного, интрадермального, субдермального, внутрибрюшинного или внутривенного введения.
25. Способ по п. 23, где указанный парентеральный путь не включает внутриопухолевую инъекцию.
26. Способ по любому из пп. 21-25, где количество вводимой непатогенной термоинактивированной Mycobacterium равно от 107 до 109 клеток.
27. Способ по п. 15, где повышенная терапевтическая эффективность определяется по увеличению общей продолжительности жизни.
28. Способ по п. 15, где повышенная терапевтическая эффективность определяется по увеличению выживаемости без прогрессирования заболевания.
29. Способ по п. 15, где повышенная терапевтическая эффективность определяется по уменьшению или стабилизации размера опухоли.
30. Способ по п. 15, где повышенная терапевтическая эффективность определяется по повышению качества жизни.
| US 2013209517 A1, 15.08.2013 | |||
| WO 2013079980 A1, 06.06.2013 | |||
| WO 2012177624 A2, 27.12.2012 | |||
| WO 2004006837 A2, 22.01.2004 | |||
| СПОСОБ ЛЕЧЕНИЯ ПОВЕРХНОСТНОГО РАКА МОЧЕВОГО ПУЗЫРЯ | 2007 |
|
RU2350338C2 |
| САФИУЛЛИН К.Н | |||
| и др | |||
| Отдаленные результаты лечения рецидивов рака мочевого пузыря вакциной БЦЖ "Имурон" // Онкоурология, 2006, No 2, с | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| STEBBING J | |||
| et al | |||
| An intra-patient placebo-controlled | |||
Авторы
Даты
2020-04-23—Публикация
2014-12-16—Подача