Изобретение относится к медицине и фармакологии, а именно к средствам адресной доставки лекарств в клетки-мишени, и касается фармацевтической композиции, включающей хлорин е6 в составе фосфолипидных наночастиц с использованием специфического и проникающего пептидов как адресных молекул для направленного транспорта.
По статистике среди причин смертности населения второе место занимают онкологические заболевания. Несмотря на большое количество эффективных препаратов с их выраженными побочными проявлениями на здоровые органы и ткани и недостаточным проникновением в опухолевые клетки существует острая необходимость снижения негативного действия лекарств. Фотодинамическая терапия (ФДТ), как один из методов лечения злокачественных опухолей, основана на введении в организм специальных веществ - фотосенсибилизаторов (ФС), способных накапливаться в опухолевой ткани, с последующим локальным световым облучением очага поражения. Активация ФС световым воздействием сопровождается генерированием активных форм кислорода и свободных радикалов, обладающих высоким цитотоксическим и цитостатическим потенциалом [1; 2].
Одной из главных проблем современной фармакологии является низкая растворимость соединений и их биодоступность. Поэтому в настоящее время ведется направленный поиск новых соединений различных классов для ФДТ и развивается несколько направлений по поиску транспортных систем ФС для увеличения селективности накопления: конъюгация с белками, моноклональными антителами, включение в наноцастицы и липосомы разного строения [3]. Следует отметить, что липосомы обладают значительным потенциалом как для липофильных, так и гидрофобных соединений, способствуют снижению токсичности и/или повышению терапевтической эффективности. В свою очередь присоединение к поверхности липосом адресных лигандов, способных специфически связываться с антигенами или рецепторами на поверхности клетки, обеспечивает направленный транспорт липосом к клеткам-мишеням [4]. Во многих лабораториях проводятся исследования возможности использования для этой цели новых, полученных в последние годы данных о специфических свойствах ряда коротко цепочечных пептидов.
Наибольшее внимание уделяется опухоль-специфичным пептидам, для которых известно несколько отдельных видов [3; 5]. В некоторых работах было показано, что присоединение их к частицам, транспортирующим лекарство, чаще всего, липосомам, приводило к повышению цитостатического эффекта лекарства как на культурах опухолевых клеток, так на экспериментальных моделях опухолей у животных. Наибольшее число таких работ проводилось с различными вариантами пептидов с последовательностью RGD (Arg-Gly-Asp), обладающей афинностью к экспрессирующимся на клетках ряда опухолей белкам интегринам [6], а также с последовательностью NGR (Asn-Gly-Arg), аффинной к белку клеток опухолей и/или эндотелия сосудов опухолевой ткани [7]. К липосомам с включенным лекарством присоединяли также и некоторые другие пептиды, аффинные к эпидермальному фактору роста, фактору роста фибробластов, повышенно экспрессирующихся на клетках некоторых видов опухолей [3; 5].
В ряде работ использовали другой вид пептидов, проявляющих не специфичность, а способствующих большему проникновению лекарства в клетку, при этом точный механизм их клеточной интернализации в литературе еще только обсуждается. Такие клеточно-проникающие пептиды конъюгировали непосредственно с лекарством, хотя имеются работы и по их присоединению к липосомам. Для этого использовали пептид, называемый ТАТ (транс-активирующий транскрипционный активатор), содержащий 13 аминокислот, в том числе 6 аргининовых групп [8]. Имеются данные о выраженном клеточно-проникающем эффекте для линейных олигоаргининов с числом звеньев от 4 до 16 (от R4 до R16), что, в частности, показано в работе при присоединении гептааргинина (R7) к фосфолипидным наночастицам с включенным хлорином е6 [9; 10].
Наиболее перспективным подходом для максимально возможной доставки лекарств в органы и клетки-мишени является попытка одновременного использования в комплексных системах доставки двух видов рассмотренных выше пептидов - опухоль-специфичных и клеточно-проникающих. При этом в качестве первых используют чаще всего пептиды с последовательностями RGD или NGR, в качестве клеточно-проникающих пептидов - с последовательностью Cys-Ala-Thr. Следует отметить, что наряду с клеточно-проникающим и свойствами некоторые пептиды проявляют некоторую опухолевую направленность, например, пептид из трех молекул фенилаланина (F3) или с последовательностью Val-Glu-Cys [11; 12]. Для осуществления включения пептидов в фосфолипидные липосомы, точнее присоединения к их поверхности, авторами вышеупомянутых и других работ разработаны и используются специфические подходы, учитывающие высокую гидрофобность жирно-кислотных цепей фосфолипидов. Условием присоединения пептида является его предварительная конъюгация с каким-либо фосфолипидом, что осуществляется через присоединенную к нему цепь полиэтиленгликоля (ПЭГ) различной длины. Чаще всего для этого используют конъюгат ПЭГ с дистеароилфосфатидилэтаноламином. В процессе получения липосом такой конъю6ат встраивается в них, оставляя на поверхности цепь ПЭГ с присоединенным пептидом. При этом важна длина цепи ПЭГ, играющего в данном случае роль т.н. «линкера» (т.е. связующего звена), оказывающая существенное влияние на взаимодействие частицы с клеткой.
В отличие от перечисленных примеров, задачей настоящего изобретения является разработка фармацевтической композиции на основе растительных фосфолипидных наночастиц размером менее 40 нм, представляющей собой ультратонкую эмульсию, со встроенным препаратом хлорина еб и одновременно специфическим и проникающим пептидами.
В соответствии с изобретением описывается способ получения фармацевтической композиции хлорина е6 адресного действия с повышенной проникающей способностью в клетки-мишени за счет использования специфического и проникающего пептидов. Процесс получения проводится путем последовательного смешивания раствора фосфолипидов, DSPE-PEG2000-NGR и противоопухолевого препарата, с последующей обработкой ультразвуком и добавлением водного раствора гептааргинина (R7). Описываются также свойства полученной фармацевтической композиции, а также ее «поведение» в опытах с клетками опухолевых тканей.
Техническим результатом настоящего изобретения является получение фармацевтической композиции хлорина е6, включенного в фосфолипидные наночастицы, с использованием специфического и проникающего пептидов, в качестве адресных молекул, обладающей повышенной клеточно-проникающей способностью, большей цитотоксической и высокой фотоиндуцированной активностями.
Поставленная задача решается фосфолипидной композицией хлорина е6 в виде фосфолипидных наночастиц размером менее 40 нм с включенными специфическим и проникающим пептидами при следующем соотношении компонентов, мас. %:
Изобретение иллюстрируется следующими примерами.
Пример 1. Способ получения фармацевтической композиции хлорина е6, встроенного в фосфолипидные наночастицы с проникающим и специфическим пептидами
Для получения грубой водной эмульсии фосфолипида Lipoid S100 («Lipoid») с конъюгатом DSPE-PEG2000-NGR оба компонента растворяли в 96% этиловом спирте («Медхимпром», Россия), смешивали спиртовые растворы в соотношении Lipoid : DSPE-PEG2000-NGR, равном 10:1. После этого проводили отгонку спирта на роторном испарителе Heidolph Laborota4003 («Heidolph», Германия) и полученную пленку регидратировали дистиллированной водой. В образовавшуюся грубую водную эмульсию фосфолипидов (Lipoid S100 и DSPE-PEG2000_NGR, 10:1) добавляли N-метилглюкаминовую соль хлорина е6 в соотношении с Lipoid S100 (по хлорину е6) 1:10 и обрабатывали на ультразвуковом дезинтеграторе Bandelin Sonopuls («Bandelin», Германия) с использованием стержня KE72 в течение 6 мин при мощности 50%. Полученную ультратонкую эмульсию пропускали через фильтр 220 нм («Merck Millipore», США). «Контрольные» наночастицы без NGR готовили так же, используя только соевый фосфатидилхолин (Lipoid S100). Встраивание хлорина е6 в наночастицы, как было показано ультрафильтрацией, достигало более 95%, размер частиц составлял до 40 нм. В полученные водные эмульсии фосфолипидных наночастиц с хлорином е6, приготовленных или только из Lipoid S100, или из его смеси с DSPE-PEG2000-NGR, добавляли водный раствора гептааргинина (R7) в весовом соотношении к хлорину е6 6:1 и встряхивали при скорости 2000 об/мин на шейкере IKA MS 3 basic («IKA», США). Процент R7, присоединенного к наночастицам, определяемый ультрафильтрацией после центрифугирования эмульсии при 10000 об/мин 20 мин при 25°С (Mini Spin plus, «Eppendorf», Германия) в патроне Ultrafree-MC («Millipore», США), составлял 83%. Характеристики полученных образцов хлорина е6 представлены в таблице 1.
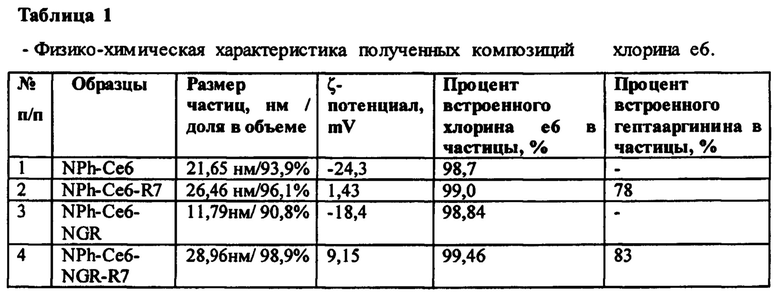
Для композиции хлорина е6, встроенного в фосфолипидные наночастицы с двумя видами пептидов, также было подобрано оптимальное соотношение компонентов. Оптимальными считали такие соотношения компонентов, при которых полученная эмульсия характеризовалась наименьшим размером частиц, высоким показателем ζ-потенциала и высоким процентом включения субстанции хлорина е6 и пептидов, в частности гептааргинина.
Ранее проведенные экспериментальные исследования показали, что только 10% (вес.) растительных фосфолипидов образуют фосфолипидные наночастицы с включенной в них лекарственной субстанцией. Были проведены эксперименты с различным весовым соотношением лекарственной субстанции хлорина е6 и растительных фосфолипидов (таблица 2).
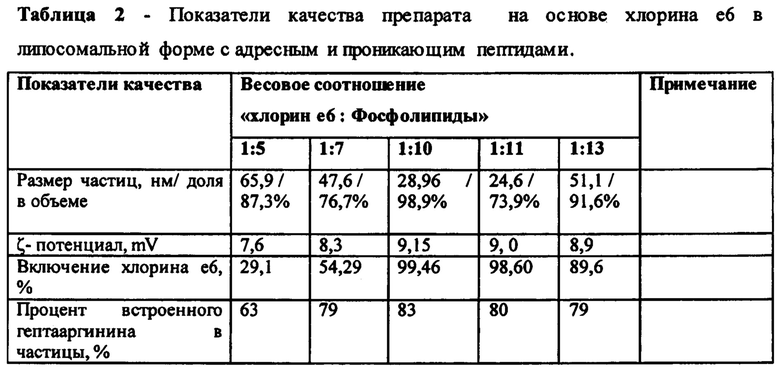
Полученные экспериментальные данные показали, что оптимальным соотношением хлорина е6 и фосфолипидов является соотношение 1:10, близкие показатели были получены в вариантах соотношений 1:11 и 1:13. Однако размер частиц был представлен большими значениями и неравномерным распределением по объему.
Пример 2. Оценка клеточного связывания и проникающей способности хлорина е6 в исследуемых композициях
Были использованы клеточные линии: аденокарциномы молочной железы (культура клеток MCF-7) и фибросаркомы (культура клеток НТ-1080), полученные из ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздрава России. Культивирование опухолевых клеток in vitro проводилось согласно рекомендациям, указанным в сертификате культуры клеток с использованием соответствующих сред с добавлением 10% эмбриональной телячьей сыворотки, при 37°С во влажной атмосфере с содержанием 5% CO2. В работе использовали клеточные линии от 3 до 10 пассажей. Клетки рассеивали в 6-луночные культуральные планшеты в концентрации 10б клеток на лунку и инкубировали в течение 24 часов при 37°С. Далее к клеткам добавляли указанные выше образцы (табл. 1) в концентрации 25 мкг/мл (по хлорину е6) и инкубировали в течение 2-х часов при температуре: 37°С в CO2-инкубаторе («Sanyo», Япония) и 4°С (холодильник Атлант, Белоруссия). После инкубации среду с исследуемыми композициями удаляли и промывали клетки дважды фосфатно-солевым буфером (ПанЭко, Россия). Для определения содержания хлорина е6 в клетках проводили экстракцию раствором 0,1% муравьиной кислоты (Sigma, США) в метаноле (Fisher Scientific, Великобритания) (по 1 мл в лунку). Экстракты переносили в пробирки Eppendorf, центрифугировали при 10000 об/мин в течение 10 мин (при 4°С) (Eppendorf 5810R, ротор FA-45-30-11, «Eppendorf», Германия), после чего анализировали методом ВЭЖХ с масс-спектрометрическим детектором. Использовали хроматографическую систему (подвижная фаза, состоящая из смеси метанол / вода, 5:95 (об./об.) с 0,1% TFA) для ВЭЖХ Agilent 1200 Series с колонкой Eclipse XDB-C18 (Agilent Technologies) и с масс-спектрометрическим детектором 6130 Quadrupole LC/MS (AgilentTechnologies, США). Содержание хлорина е6 в клетках нормировали на уровень белка (мг), определяемого методом Лоури. Полное проникновение хлорина е6 в клетку (интернализацию) рассчитывали по разности его содержания при 37°С (общее накопление в клетках) и при 4°С - на основании данных, показавших, что при этой температуре взаимодействие пептида с клеткой ограничивается его ассоциацией с наружной клеточной мембраной, и входит он в клетку только при более высоких температурах [13].
Достоверными считали различия при р<0,05. Эксперименты повторяли дважды. На рисунке представлены данные как среднее значение ± стандартная ошибка среднего.
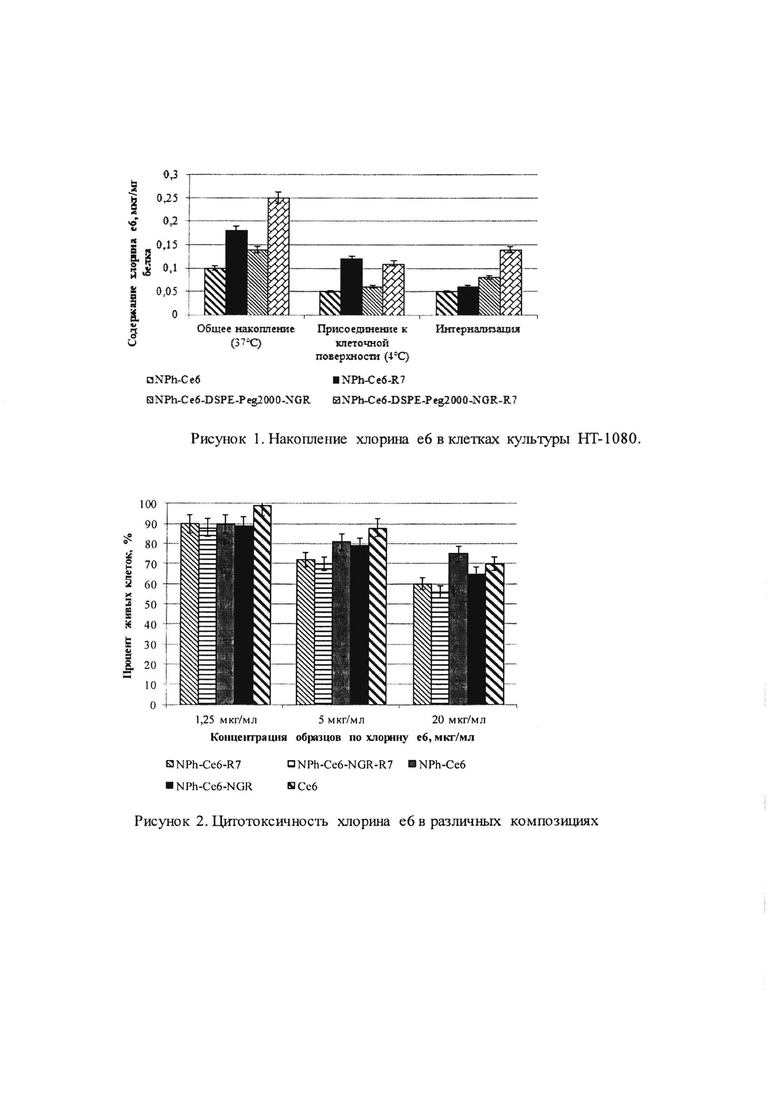
Результаты. Проникновение хлорина е6 в клетки НТ-1080 после 2 часов инкубации с включающими его фосфолипидными наночастицами, содержащими пептид R7, или пептид, включающий последовательность NGR, или их сочетание, показано на рисунке 1.
Как видно из рисунка 1, общее накопление хлорина е6 в клетках при инкубации с транспортирующими его фосфолипидными НЧ существенно выше (в среднем в 1,5-2 раза) в случае присутствия в них пептидов по сравнению с исходными наночастицами. Особенно выраженным - как на общее накопление, так и на интернализацию (проникновение в клетки) - был эффект их сочетания, т.е. присутствия и адресного (NGR), и клеточно-проникающего (R7) пептидов (NPh- Ce6-NGR-R7). Интернализация хлорина е6 в клетку была для этой, сочетанной композиции в 3 раза выше, чем для исходных наночастиц, при относительно небольшом эффекте присутствия этих пептидов в отдельности - NPh-Ce6-NGR и особенно NPh-Ce6-R7. Результаты свидетельствуют о наличии у фосфолипидной композиции с двумя пептидами не только обусловленного NGR адресного, но и проникающего действия, усиленного влиянием этого пептида.
Пример 3. Оценка цитотоксичности фармацевтической композиции хлорина е6, встроенного в фосфолипидные наночастицы с проникающим и специфическим пептидами
Клетки линии НТ-1080 и MCF-7 рассеивали в стерильные 96-луночные культуральные планшеты в концентрации 104 клеток на лунку и инкубировали при 37°С в атмосфере 5% CO2 (CO2- инкубатор Binder, Германия) в течение 24-26 часов. Далее в планшеты вносили сравниваемые композиции в концентрациях по хлорину е6 от 0,016 мкг/мл до 20 мкг/мл (разведение с шагом 5); разведения образцов осуществляли культуральной средой без сыворотки. Клетки инкубировали с образцами 24 часа при 37°С в атмосфере 5% CO2. Оценку жизнеспособности клеток проводили с использованием МТТ теста (Sigma, США) (Якубовская Р.И., 2012). Регистрировали поглощение при 550 нм (Multiscan FC, ThermoSpectronic, США) и нормировали на необработанный контроль.
Уровень ингибирования роста клеток вычисляли по формуле:
ИР (%) - [(ODк-ODо)/ODк]×100%,
где: ИР - уровень ингибирования роста клеток в культуре; ODо и ODк - оптическая плотность раствора формазана (при проведении МТТ теста) в опытных и контрольных лунках, соответственно.
Достоверными считали различия при р<0,05. Эксперименты повторяли дважды. На рисунке представлены данные как среднее значение ± стандартная ошибка среднего.
Результаты. При оценке биологических свойств ФС оказалось, что соединения NPh-Ce6-R7 и NPh-Ce6-NGR-R7 в отсутствии светового воздействия оказывали цитотоксическое действие в отношении опухолевых клеток культур НТ-1080 и MCF-7. Так при внесении этих соединений в культуральную среду в концентрации 20 мкг/мл, наблюдали ингибирование пролиферации опухолевых клеток на 40-44%. При использовании других соединений (NPh-Се6, NPh-Се6-NGR, и липосомальная форма хлорина е6), внесенных в аналогичной концентрации, ингибирование роста клеток было менее выраженным и составляло 25-35% (рисунок 2).
Пример 4. Изучение Фото индуцированной активности фармацевтической композиции хлорина е6, встроенного в фосфолипидные наночастицы с проникающим и специфическим пептидами
Для оценки специфического фотодинамического действия хлорина е6 в исследуемых фосфолипидных композициях подготовка клеток и инкубация с исследуемыми композициями проводилась аналогично определению цитотоксического эффекта (описано выше). Далее клетки подвергались облучению светом (источник облучения - галогеновая лампа (Россия) с широкополосным фильтром КС-13 (λ≥640 нм), мощностью 500 Вт). Доза света составляла 10 Дж/см2. После облучения клетки оставляли при стандартных условиях (при 37°С в атмосфере 5% CO2) на 24-28 ч, затем проводили оценку выживаемости опухолевых клеток с использованием МТТ-теста, как описано выше. Критерием оценки специфической активности являлась величина ИК50 - концентрация хлорина е6, вызывающая 50% гибель опухолевых клеток [13].
Достоверными считали различия при р<0,05. Эксперименты повторяли дважды. На рисунках представлены данные как среднее значение ± стандартная ошибка среднего.
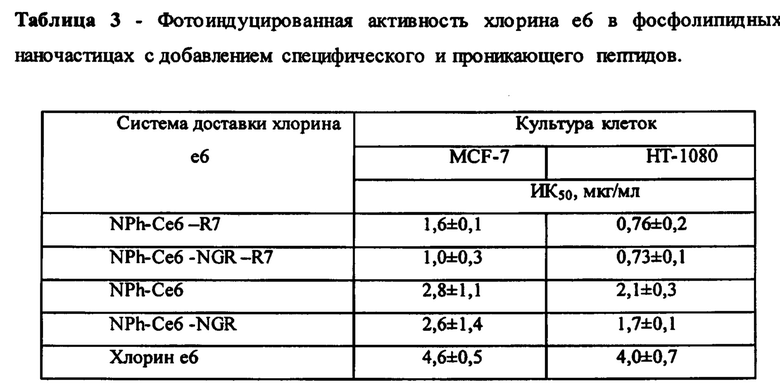
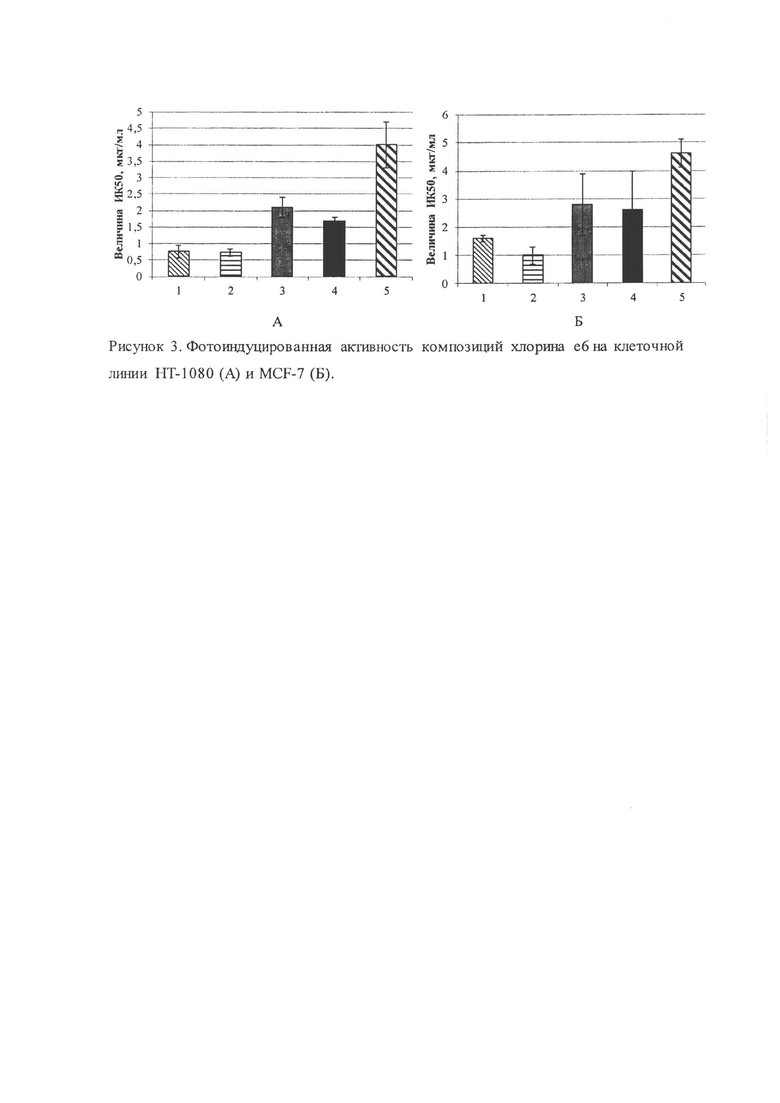
Результаты. Образцы ФС обладали высокой специфической активностью в системе in vitro (рисунок 3). На рисунке даны величины ИК50 - концентрации хлорина е6, вызывающей 50% гибель клеток.
Следует отметить, что опухолевые клетки фибросаркомы человека (культура клеток НТ-1080) оказались более чувствительными к ФДВ, чем с опухолевые клетки аденокарциномы молочной железы человека (культура клеток MCF-7). Установлено, что наибольшей фотоиндуцированной активностью в отношении клеток линии НТ-1080 обладают композиции NPh-Ce6-R7 и NPh-Ce6-NGR-R7: величина ИК50 составила 0,76±0,2 и 0,73±0,1 мкг/мл, соответственно. Композиции NPh-Се6 и NPh-Ce6-NGR показали сопоставимую фотоиндуцированную активность относительно опухолевых клеток культур НТ-1080 и MCF-7, при этом хлорин е6 обладал меньшей фото индуцированной активностью, чем его модифицированные формы с адресным фрагментом на основе пептидов (таблица 3).
В результате исследований образцов композиций хлорина е6 в фосфолипидных наш частицах с использование специфического (с NGR-мотивом) и проникающего (гептааргинин) пептидов было показано, что в образцах, где присутствует проникающий пептид, увеличивается цитотоксическая активность (без светового воздействия), по сравнению с другими композициями. При оценке фотоиндуцированной активности исследуемых фотосенсибилизаторов было показано, что наибольшей специфической противоопухолевой активностью обладали композиции хлорина е6 как с проникающим (NPh-Ce6-R7), так и со специфическим и проникающим пептидами в составе (NPh-Ce6-NGR-R7), что делает эти соединения перспективными для дальнейшего изучения и использования в области ФДТ.
Пояснения к рисункам.
На рис. 1 представлено накопление хлорина е6 в клетках культуры НТ-1080 после 2 часов инкубации с композициями. Интернализацию рассчитывали по разности его содержания при 37°С и при 4°С.
На рис. 2 показана цитотоксичгость (без воздействия света) хлорина е6 в различных композициях (усредненные показатели для культур клеток НТ-1080 и MCF-7).
На рис. 3 представлена фотоиндуцированная активность композиций хлорина е6 на клеточной линии НТ-1080 (А) и MCF-7 (Б) после инкубации с включающими его фосфолипидными наночастицами. (1) NPh-Ce6-R7; (2) NPh-Ce6-NGR-R7; (3) NPh-Се6; (4) NPh-Ce6-NGR; (5) Себ
Литература
1. Daeihamed М., Dadashzadeh S., Haeri A., Akhlaghi M.F. Potential of Liposomes for Enhancement of Oral Drug Absorption / Curr. Drug Deliv., 2017. 14(2), 289-303.DOI:10.2174/1567201813666160115125756.
2. Kloesch B, Gober L, Loebsch S, Vcelar B, Helson L, Steiner G. In Vitro Study of a Liposomal Curcumin Formulation (Lipocurc™: Toxicity and Biological Activity in Synovial Fibroblasts and Macrophages / In Vivo, 2016.30(4), 413-419.
3. Прозоровский B.H., Торховская Т.Н., Кострюкова Л.В., Ипатова О.М. Использование специфических пептидов для адресной доставки наночастиц с противоопухолевыми лекарствами (обзор). // Биофармацевтический журнал. - 2018. - Т. 10(4). - С. 3-18.
4. Raucher D. Tumor targeting peptides: novel therapeutic strategies in glioblastoma / Curr. Opin. Pharmacol., 2019. 47, 14-19. DOI: 10.1016/j.coph.2019.01.006.
5. Kapoor P., Singh H., Gautam A. A database of tumor homing peptides / PLoS One. 2012. V. 7. No. 4.e35187.
6. Nasongkla N., Shuai X., Ai H., Weinberg B. D. cRGD functionalized polymer micelles for targeted doxorubicin delivery / Angew. Chem. Int. Ed.Engl. - 2004. - V. 43. No. 46. P. 6323-6327.
7. Schreiber C.L., Smith B.D. Molecular Imaging of Amino peptidase N in Cancer and Angiogenesis. Contrast Media Mol Imaging. 2018 Jun 25; 2018: 5315172. DOI: 10.115 5/2018/5315172. eCollection 2018.
8. Koren E., Apte A., Sawant R. R., Grunwald J., Torchilin V. P. Cell-penetrating TAT peptide in drug delivery systems: proteolytic stability requirements / Drug Deliv. 2011. V. 18. P. 377-384.
9. Futaki S., Nakase I., Tadokoro A., Takeuchi Т., Jones A. Arginine-rich peptides and their internalization mechanisms / Biochem. Soc. Trans. 2007. V. 35. P. 784-787.
10. Кострюкова Л.В., Короткевич Е.И., Морозевич Г.Е., Колесанова Е.Ф., Мельникова М.В., Филатова Ю. В., Торховская Т.И., Прозоровский В.Н., Тихонова Е.Г., Ипатова О.М. Влияние клеточно-проникающего аргининового пептида на взаимодействие с опухолевыми клетками фотосенсибилизатора хлорина Е6, включенного в фосфолипидные наночастицы // Бюллетень экспериментальной биологии и медицины. - 2019. - Т. 167. - №3 - С. 319-323.
11. Li Y., Нао L., Liu F., Yin L., Yan S., Zhao H., Ding X., Guo Y., Cao Y., Li P., Wang Z., Ran H., Sun Y. Cell penetrating peptide-modified nanoparticles for tumor targeted imaging and synergistic effect of sonodynamic/hifu therapy. Int J Nanomedicine. 2019; 14:5875-5894. DOI: 10.2147/IJN.S212184.
12. Sugiyama Т., Asai Т., Nedachi Y.M., Katanasaka Y., Shimizu K., Maeda N., Oku N. Enhanced active targeting via cooperative binding of ligands on liposomes to target receptors. PLoS One. 2013 Jun 28; 8(6):E67550. DOI: 10.1371/journal.pone.0067550. Print 2013.
13. Якубовская Р.И., Казачкина Н.И., Кармакова Т.А., Морозова Н.Б., Панкратов А.А., Плютинская А.Д., Феофанов А.В., Чиссов В.И., Зебрев А.И., Тихомирова А.В. (2012): Руководство по проведению доклинических исследований лекарственных средств (Под ред. А.Н. Миронова и др.) Гриф и К., Москва, 655-669. ISBN 978-5-8125-1466-3.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция, включающая доксорубицин в составе фосфолипидных наночастиц, с использованием селективных молекул ДНК-аптамера для направленного транспорта в опухолевые клетки | 2021 |
|
RU2794798C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ НА ОСНОВЕ ХЛОРИНА Е6, ВКЛЮЧЕННОГО В ФОСФОЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2013 |
|
RU2535054C1 |
| СРЕДСТВО ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2016 |
|
RU2646834C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ДОКСОРУБИЦИНА И ФОСФОЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2411935C1 |
| КОМПОЗИЦИЯ ДЛЯ ФОТОДИНАМИЧЕСКОГО ПОВРЕЖДЕНИЯ КЛЕТОК-МИШЕНЕЙ И СПОСОБ ФОТОДИНАМИЧЕСКОГО ПОВРЕЖДЕНИЯ КЛЕТОК-МИШЕНЕЙ | 1996 |
|
RU2066552C1 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2021 |
|
RU2837542C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПРЕПАРАТ | 2011 |
|
RU2451509C1 |
| Фосфолипидная композиция доксорубицина для лечения больных раком молочной железы | 2019 |
|
RU2714137C1 |
| Способ фотодинамической терапии | 2015 |
|
RU2637279C2 |
| Липидное производное сарколизина в составе фосфолипидных наночастиц | 2017 |
|
RU2662086C1 |
Изобретение относится к медицине, а именно к средствам адресной доставки лекарств в клетки-мишени. Предложена фармацевтическая композиция хлорина е6 в виде фосфолипидных наночастиц размером менее 40 нм для фотодинамической терапии при лечении онкологических заболеваний, включающая специфический пептид с NGR мотивом и проникающий пептид R7, представляющий собой гептааргинин, и способ ее получения. Фармацевтическая композиция обладает повышенной клеточно-проникающей способностью, высокой цитотоксической и фотоиндуцированной активностями. 2 н.п. ф-лы, 3 табл., 4 пр., 3 ил.
1. Способ получения фармацевтической композиции хлорина е6 в виде фосфолипидных наночастиц размером менее 40 нм с включенными специфическим и проникающим пептидами, заключающийся в смешивании спиртовых растворов Lipoid S100 («Lipoid») и DSPE-PEG2000-NGR в соотношении 10:1, отгонке спирта, регидратировании полученной пленки, добавлении N-метил-D-глюкаминовой соли хлорина е6 (по хлорину е6) к Lipoid S100 в соотношении 1:10, обработке на ультразвуковом дезинтеграторе, фильтрации с последующим добавлением водного раствора гептааргинина (R7) в весовом соотношении к хлорину е6 1:6 и интенсивном перемешивании.
2. Фармацевтическая композиция хлорина е6 в виде фосфолипидных наночастиц размером менее 40 нм для фотодинамической терапии при лечении онкологических заболеваний, включающая специфический пептид с NGR мотивом и проникающий пептид R7, представляющий собой гептааргинин, полученная способом по п. 1.
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ НА ОСНОВЕ ХЛОРИНА Е6, ВКЛЮЧЕННОГО В ФОСФОЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2013 |
|
RU2535054C1 |
| WO 2016061256 A1, 21.04.2016 | |||
| Кострюкова Л.В | |||
| др | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2021-05-05—Публикация
2020-05-18—Подача