Изобретение относится к медицине и фармакологии, а именно к средствам адресной доставки лекарств в клетки-мишени, и касается фармацевтической композиции, состоящей из наночастиц на основе растительных фосфолипидов с включенным в них доксорубицином и конъюгатом дивалентного аптамера (специфического олигонуклеотида) в качестве адресной молекулы для направленного транспорта.
Существенной проблемой онкологии, ограничивающей терапевтическое использование даже самых эффективных противоопухолевых препаратов, является их частичное проникновение в здоровые ткани, что сопряжено с проявлением побочных эффектов [1]. На преодоление этого направлены разработки многих исследователей, и одним из первых примененных подходов было включение лекарств в различные наночастицы, чаще всего на основе фосфолипидов - липосомы. Для активно используемого противоопухолевого препарата цитостатика доксорубицина созданы сходные по составу липосомальные композиции, представляющие собой липосомы диаметром 80-120 нм с включенным лекарством, в большинстве случаев стабилизированные цепями биосовместимого полимера полиэтиленгликоля (Доксил, Келикс, Миоцет и их дженерики) [2]. В основе оптимизирующего действия таких систем лежит большее проникновение липосом в опухоли, чем в здоровые ткани, т.н. «пассивная адресность», за счет более крупных пор в кровеносных сосудах, что способствует «эффекту повышенной проницаемости и удерживания». Эти препараты одобрены и широко применяются, однако, для них, несмотря на меньшие побочные эффекты, отмечается лишь небольшое повышение терапевтического действия по сравнению со свободным доксорубицином, что указывает на необходимость дальнейшего увеличения их доставки в опухоли [3]. Для этого в последние годы разрабатываются наночастицы, включая липосомы, с дополнительной, «активной адресностью», т.е. с какими-либо специфическими свойствами например, чувствительностью к изменению рН, температуры, облучения (рН-, термо-, фоточувствительные), или с дополнительными фрагментами - лигандами, обладающими аффинностью к некоторым повышенно экспрессирующимся белкам опухолевых клеток.
В качестве лигандов используют специфические пептиды, антитела или их фрагменты, нуклеиновые кислоты, некоторые малые молекулы с такими «адресными» свойствами.
Во многих работах последних лет среди адресных, опухоль-направляющих лигандов для наночастиц все большее место занимают [3, 4]. Аптамеры это короткие одноцепочечные молекулы ДНК и РНК, чаще всего из 30-80 нуклеотидов, которые могут с высокой аффинностью и специфичностью связываться со структурой-мишенью, обычно с клеточным белком. В основе этого лежит способность нуклеотидной цепи принимать определенную пространственную организацию, которая оказывается аффинной для конкретной мишени [5]. Выявление структуры аптамера, т.е. последовательности нуклеотидов в цепи, и проведение его синтеза осуществляется с помощью специальной последовательной технологии SELEX (Systematic evolution of ligands by exponential enrichment - систематическая эволюция лигандов экспоненциальным обогащением), идентифицирующей и выбирающей аффинные к заданной структуре нуклеотидные цепи из произвольно взятых ДНК- и РНК-библиотек. Уже известные аптамеры синтезируют также на автоматическом ДНК синтезаторе путем последовательной подачи нуклеотидов (в виде производных) к иммобилизованному исходному соединению [6]. Благодаря высокой степени афинности (не меньшей, чем у антител) к тем или иным белковым мишеням на опухолевых клетках, наряду с их относительно более легким получением и большей стабильностью, при меньшей иммуногенности, аптамеры находят все большее применение в разработках противоопухолевых лекарственных композиций направленного действия. При этом большой интерес вызывает использование аптамерных конструкций, состоящих из нескольких аптамеров (мультивалентные аптамеры). Мультивалентные аптамеры имеют более высокую аффинность к молекулярным мишеням на клеточной поверхности по сравнению с моновалентными аптамерами [7]. Их получают, объединяя две и более аптамерных последовательности в одну полинуклеотидную цепь в ходе химического синтеза или путем направленной сборки аптамеров в молекулярную конструкцию с помощью комплементарных участков, добавляемых к аптамерным последовательностям при их синтезе. Показано, что дивалентные и трехвалентные аптамерные конструкции, несущие доксорубицин, обеспечивают, наряду с высокой цитотоксичностью, повышенную селективность узнавания клеток-мишеней [8].
В литературе описано и охарактеризовано несколько конкретных аптамеров, и один из наиболее часто используемых из них - AS1411, - представляет собой цепочку из 26 нуклеотидов с высоким содержанием гуанина [9]. Для него характерна аффинность к белку нуклеолину, повышенно экспрессирующемуся в клетках многих опухолей, и участвующему в их пролиферации. Это свойство объясняют способностью аптамера образовывать G-квадруплексы - структуры, самообразующиеся путем ассоциации четырех нитей нуклеиновой кислоты, характерные в наибольшей степени для цепей, богатых гуанином [10]. Аптамер AS1411 использовали сначала как непосредственный действующий противоопухолевый агент, тормозящий клеточную пролиферацию путем блокирования нуклеолина, и он был первым аптамером, достигшим стадии клинических испытаний.
Впоследствии были опубликованы работы по использованию его как адресного лиганда в системах доставки лекарств, путем присоединения к транспортирующим лекарство наночастицам. Так, в 2009 г. группа авторов в Университете Иллинойса (США) показала большее включение в экспрессирующие нуклеолин клетки MCF-7 липосом с присоединенным аптамером AS1411, с соответственно большей доставкой флуоресцентного красителя или включенного лекарства (цисплатина), по сравнению с такими же липосомами без аптамера [11]. Впоследствии теми же авторами была сконструирована сходная липосомальная система с этим аптамером и доксорубицином, показавшая повышенную интернализацию лекарства в клетки MCF-7, наряду с более выраженным противоопухолевым действием при введении in vivo, мышам с опухолью [12]. Однако в большинстве работ аптамеры (в том числе AS1411) присоединяли не к липосомам, а к другим наночастицам, чаще на основе различных полимеров, что может быть связано с более легким их встраиванием, включая конъюгацию.
Известны фосфолипидные липосомы с включенным доксорубицином [13]. Были получены липосомы, содержащие растворимый комплекс аптамера AS1411 с доксорубицином во внутреннем водном пространстве, то есть используя его только для внутриклеточной доставки к нуклеолину, уже после доставки в клетку. Это было обусловлено специальной направленностью работы на линию опухолевых клеток с множественной лекарственной устойчивостью (MCF-7/Adr), за счет овер-экспрессии Р-гликопротеина, препятствующего входу в клетку противоопухолевых лекарств, и аптамер здесь как бы «помогал» преодолевать ее. И лишь в одной, упомянутой выше [12] была сконструирована липосомальная система с локализующимся на поверхности аптамером AS1411 и доксорубицином для таргетной (направленной) доставки этого цитостатика специфично именно в опухолевые клетки. Авторы брали исходно аптамер с присоединенным к цепи холестерином, за счет которого осуществлялось его включение в липосомы. Для приготовления липосом использовали гидрогенизированный соевый фосфатидилхолин, холестерин и конъюгат дистеароилофосфатидилэтаноламина с метокси-полиэтиленгликолем (mPEG200-DSPE), специально повторяя состав липосом коммерческого препарата доксорубицина Доксил (в мол. отношении 2:1:0.16). Размер полученных липосом с присоединенным аптамером составлял 210±20 нм.
Задачей настоящего изобретения является разработка новой улучшенной фармацевтической композиции в виде ультратонкой эмульсии на основе наночастиц из растительного (соевого) фосфолипида с встроенным препаратом доксорубицином и локализованным на поверхности аптамером AS1411, аффинным к белку нуклеолину опухолевых клеток, или его дивалентным производным.
В соответствии с изобретением описывается также способ получения фармацевтической композиции доксорубицина с повышенной проникающей способностью в опухолевые клетки-мишени за счет использования аптамера AS1411, как исходного, так и в виде дивалентного производного, т.е. двух цепей по 26 нуклеотидов, соединенных линкером из 9 молекул этиленгликоля, а также подтверждается способность полученных композиций повышать интернализацию включенного в наночастицы доксорубицина в опухолевые клетки MCF-7 в культуре.
Способ получения композиции состоит из следующих этапов:
1) предварительное получение конъюгата аптамера AS1411 с фосфолипидом дистеароилфосфатидилэтаноламином (DSPE), ковалентно сшитым с полиэтиленгликолем и малеимидом (DSPE-PEG2000-Mal);
2) растворение конъюгата аптамера с фосфолипидом в спирте с последующим удалением растворителя;
3) гидратация образовавшейся «пленки» водой;
4) смешивание полученной грубой эмульсии с раствором доксорубицина;
5) обработка смеси ультразвуком;
6) фильтрование через мембрану с размером пор 0,22 мкм.
Описываются физико-химические свойства полученной фармацевтической композиции, а также ее способность индуцировать проникновение (интернализацию) доксорубицина в клетки MCF-7 в сравнении ее и композиций с моно- и дивалентным аптамером. В качестве контролей (на присутствие аптамера и на его специфичность) определение проводилось также для композиций, соответственно, без аптамера или с аптамером из 26 нуклеотидов, но произвольного состава, со всеми 4 нуклеотидами (в отличие от AS1411 с преимущественным содержанием гуанина). Последовательности нуклеотидов в аптамерах, сравниваемые в изобретении в качестве компонентов фармацевтической композиции, приведены в таблице 1.

Техническим результатом настоящего изобретения является получение фармацевтической композиции доксорубицина, включенного в фосфолипидные наночастицы из соевого фосфолипида (Lipoid S100, Германия) с использованием дивалентного аптамера AS1411 в качестве адресного лиганда, эффективной для повышения доставки лекарственного агента в опухолевые клетки.
Поставленная задача решается конструированием фосфолипидной композиции доксорубицина в виде фосфолипидных наночастиц размером около 50 нм с присоединенным аптамером AS1411 при следующем соотношении компонентов (% м/м):
Примеры
Пример 1. Способ получения конъюгата аптамера AS1411 с DSPE-PEG2000-Mal
Перед получением конъюгата проводили разблокирование тиоловой группы в исходных коммерческих аптамерах (ООО «НПФ «Синтол») путем удаления с нее защитной тритильной группы нитратом серебра. Для этого аптамер растворяли в 0,1 М триэтиламинацетатном буферном растворе (ТЕАА) до концентрации 100 нмоль/мл, добавляли 0,15 объема 1 М водного раствора нитрата серебра, перемешивали и инкубировали 1 час при комнатной температуре. К инкубационной смеси добавляли 0,2 объема 1 М водного раствора дитиотреитола (DTT), оставляли на 20 мин при комнатной температуре, после чего центрифугировали 10 мин при 14500 об/мин на центрифуге MiniSpin Plus (Eppendorf, Германия). Супернатант отбирали, к осадку добавляли объем 0,1 раствора ТЕАА, соответствующий объему супернатанта, и оставляли инкубироваться при 40°С и перемешивании на ночь. На следующий день смесь повторно центрифугировали в тех же условиях и отбирали супернатант, содержащий раствор с деблокированным олигонуклеотидом. Его вносили в подготовленную микроколонку с сефарозой G-25, помещенную в микропробирку для сбора фильтрата, центрифугировали 2 минуты при 3300 об/мин (700×g). Колонку промывали объемом воды, соответствующим объему супернатанта. Оба фильтрата объединяли.
Для получения конъюгата в полученный деблокированный аптамер добавляли раствор DSPE-PEG2000-Mal в 0,1 М растворе ТЕАА (в соотношении аптамер/DSPE-PEG2000-Mal 1:5) и инкубировали 1 час при температуре 40°С и перемешивании. Образовавшийся конъюгат очищали с помощью ультрафильтрации в пробирках Amicon Ultracel с мембраной, имеющей порог отсечения 10 кДа.
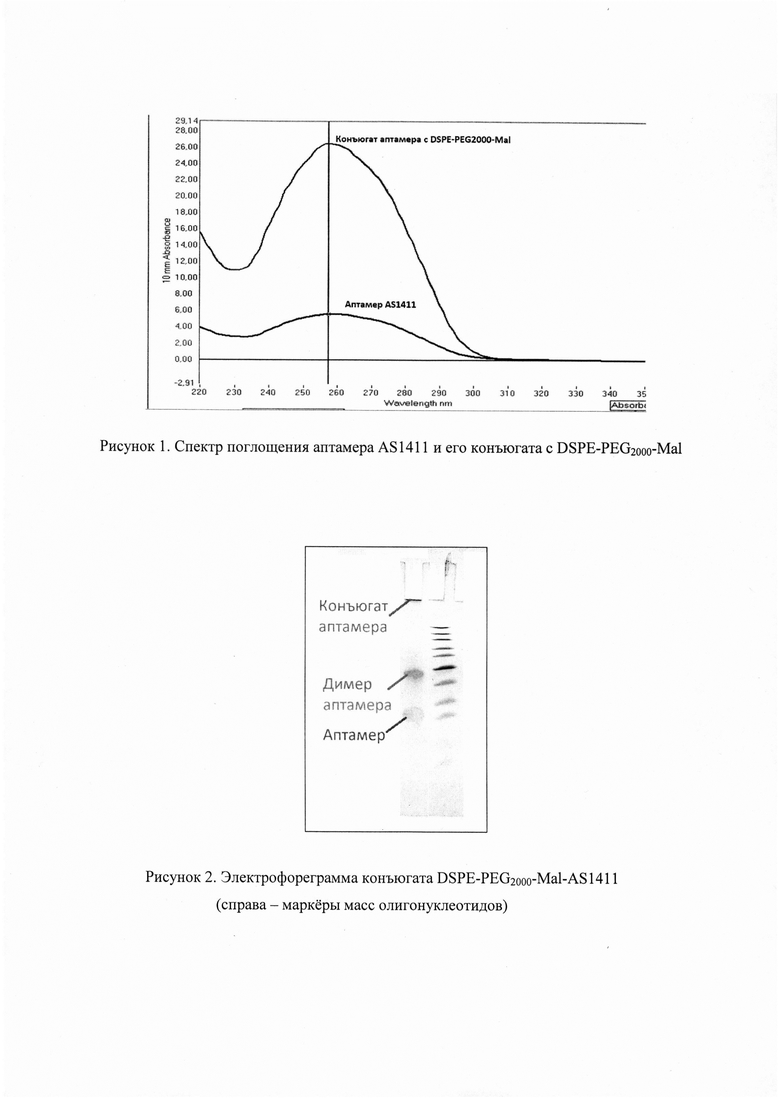
Контроль содержания в растворе олигонуклеотида осуществляли спектрофотометрически при 260 нм на спектрофотометре NanoDrop ND-1000 (Thermo Scientific, США). На рисунке 1 приведен спектр поглощения аптамера AS1411 и его конъюгата с DSPE-PEG2000-Mal с максимумом при длине волны примерно 260 нм.
В аналогичных условиях получали конъюгаты с контрольным олигонуклеотидом (Apt 2) и с дивалентным аптамером AS1411 (Apt 3).
Наличие конъюгата в продукте качественно подтверждали с помощью денатурирующего электрофореза в полиакриламидном геле (рисунок 2) и масс-спектрометрии MALDI-TOF (рисунок 3).
Пример 2. Способ получения фармацевтической композиции доксорубицина, встроенного в фосфолипидные наночастицы с аптамером в виде конъюгата DSPE-PEG2000-Mal-AS1411
В пробирке Eppendorf вместимостью 2 мл взвешивали около 3 мг фосфолипидов Lipoid S100 (Германия) и растворяли навеску в 400 мкл спирта. К водному раствору конъюгата DSPE-PEG2000-Mal-AS1411 приливали 300 мкл спирта, перемешивали, выдерживали 1 ч при 20°С, затем центрифугировали при 14500 об/мин и 4°С, отбирали супернатант и фильтровали его через мембрану с размером пор 0,22 мкм. Фильтрат смешивали со спиртовым раствором фосфолипидов, перемешивали, удаляли спирт на вакуумном концентраторе Concentrator 5301 (Eppendorf, Германия). К остатку приливали 925 мкл воды, перемешивали, затем добавляли 75 мкл раствора доксорубицина гидрохлорида в воде с концентрацией 1 мг/мл, снова перемешивали. Смесь переливали в пробирку вместимостью 15 мл, обрабатывали ультразвуком на ультразвуковой бане в течение 1 мин, затем на ультразвуковом гомогенизаторе SONOPULSHD 2070/2200 с титановым наконечником MS-72 при мощности 50%, 5 циклов по 30 с, охлаждая через 2-3 цикла. Полученную дисперсию фильтровали через мембрану с размером пор 0,22 мкм.
Определяли размер частиц, дзета-потенциал, содержание и процент включения доксорубицина (таблица 2).

Большая часть фосфолипидных наночастиц в полученной эмульсии имела размер 49±7 нм, что в 3 раза ниже, чем для полученных ранее [12] фосфолипидных липосом с доксорубицином и встроенным конъюгатом того же аптамера AS1411 с холестерином (~210 нм), и вдвое ниже липосом с включенным в центральное водное пространство растворимым комплексом AS1411-доксорубицин (128 нм) [13]. Около 98% доксорубицина в композиции оказывается встроенным в наночастицы.
Пример 3. Оценка клеточного связывания и проникающей способности доксорубицина в составе композиций с аптамерами
Использовали клеточную линию аденокарциномы молочной железы (культура клеток MCF-7), полученную из ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздрава России. Культивирование опухолевых клеток проводилось согласно рекомендациям, указанным в сертификате культуры клеток, с использованием соответствующих сред с добавлением 10% эмбриональной телячьей сыворотки, при 37°С во влажной атмосфере с содержанием 5% СО2. Использовали клеточные линии от 3 до 10 пассажей. Клетки рассеивали в 6-луночные культуральные планшеты по 106 клеток на лунку и инкубировали в течение 24 часов при 37°С. Далее к клеткам добавляли образцы с указанными выше (таблица 1) аптамерами и контрольным олигонуклеотидом (Apt 1, Apt 2 и Apt 3) до концентрации 14 мкг/мл (по доксорубицину). В качестве препаратов сравнения использовали доксорубицин, включенный в фосфолипидные наночастицы без аптамера и свободный доксорубицин. Лунки с клетками инкубировали в течение 5 часов при температуре 37°С в СО2-инкубаторе (Sanyo, Япония) и при 4°С (холодильник Атлант, Белоруссия), после чего среду с исследуемыми композициями удаляли, и промывали клетки дважды фосфатно-солевым буферным раствором (ПанЭко, Россия).
Экстракцию доксорубицина проводили раствором 0,1% муравьиной кислоты (Sigma, США) в ацетонитриле (Fisher Scientific, Великобритания) из расчета 1 мл на лунку. Полученные экстракты центрифугировали при 10000 об/мин в течение 10 мин (при 4°С) (Eppendorf 5810R, ротор FA-45-30-11, Eppendorf, Германия). Определение содержания доксорубицина в образцах проводили с использованием ВЭЖХ системы Agilent 1200 Series с колонкой Eclipse XDB-C18 (Agilent Technologies, США) и масс-спектрометрическим детектором 6130 Quadrupole LC/MS (Agilent Technologies, США) [15 Зыкова 2011]. Содержание доксорубицина в клетках нормировали на уровень белка (мг), определяемого методом Лоури. Полное проникновение доксорубицина в клетку (интернализацию) рассчитывали по разности его содержания при 37°С (общее накопление в клетках) и при 4°С, так как ранее было показано, что при 4°С взаимодействие включенного в наночастицы лекарственного агента с клеткой ограничивается его ассоциацией с наружной клеточной мембраной, а проникновение в клетку происходит при более высоких температурах [Sheldon K. et al., 1995] [14].
При проведении статистического анализа достоверными считали различия при р<0,05.
Проникновение доксорубицина в клетки MCF-7 после инкубации с включающими его фосфолипидными наночастицами, содержащими аптамер AS1411 (Apt 1), олигонуклеотид аналогичной длины, но случайного состава (Apt 2) и дивалентный аптамер (с двумя последовательностями AS1411) (Apt 3) показано на рисунке 4.
Результаты свидетельствуют о наличии у фосфолипидной композиции с аптамером AS1411 адресного действия по отношению к опухолевым клеткам MCF-7, особенно выраженного для его дивалентной формы. Отсутствие действия композиции с контрольным олигонуклотидом той же длины цепи подтверждает проявление опухолевой специфичности выбранного аптамера.
Таким образом, исследование фармацевтических композиций доксорубицина в фосфолипидных наночастицах с аптамерами, имеющими сродство к белку нуклеолину опухолевых клеток, в экспериментах по клеточному накоплению доксорубицина, показало ее преимущественное действие, особенно для дивалентного аптамера, в сравнении с композициями с аптамером, не имеющим сродства к нуклеолину (случайная последовательность), без аптамеров, а также свободным доксорубицином.
Описание рисунков
На рисунке 1 представлены спектры поглощения аптамера AS1411 и его конъюгата с DSPE-PEG2000-Mal. Полученный раствор содержит незначительное количество свободного, неконъюгированного аптамера, что указывает на почти полную его конъюгацию с DSPE-PEG2000-Mal.
На рисунке 2 представлена электрофореграмма конъюгата DSPE-PEG2000-Mal-AS1411 (справа - маркеры масс олигонуклеотидов). Рядом с лэддером (маркером масс DNA Ladder, справа) имеется пятно, соответствующее конъюгату. Оно расположено выше всех полос маркеров (верхняя полоса соответствует олигонуклеотиду длиной 300 нуклеотидов, т.е. примерно 100 кДа), поскольку образующиеся в ходе реакции конъюгаты находятся предположительно в агрегированном виде. Также имеются пятна, соответствующие непрореагировавшему аптамеру и его димеру (дисульфиду).
На рисунке 3 показан MALDI-TOF-спектр конъюгата DSPE-PEG2000-Mal-AS1411. В продукте присутствует соединение с молекулярной массой 11647, соответствующей конъюгату DSPE-PEG2000-Mal-AS1411 (расчетная молекулярная масса - 11749).
На рисунке 4 представлено накопление доксорубицина в клетках MCF-7 после 5 ч инкубации с содержащими его фосфолипидными наночастицами с олигонуклеотидами.
Интернализацию рассчитывали по разности его содержания при 37°С и 4°С [Sheldon K. et al., 1995].
Как видно из рисунка 4, общее накопление доксорубицина в клетках не возрастало при введении его в свободном виде и при включении его в фосфолипидные наночастицы. Присоединение к наночастицам как единичного аптамера AS1411 (Apt1), так и равного ему по длине другого олигонуклеотида (Apt2) не давало увеличения клеточного накопления доксорубицина. В противоположность этому, для наночастиц с дивалентным аптамером оно оказалось в 2,5 раза выше, чем для всех остальных образцов. При этом, как видно, основная часть лекарства проникает внутрь клетки (правая группа столбиков), и интернализация почти в 5 раз превышает таковую для фосфолипидных наночастиц без аптамера (NPh-Dox). В правой части рисунка можно видеть также относительно меньшее, но тоже значимое повышение интернализации под действием моновалентного аптамера (Apt1) - почти вдвое по сравнению с исходными частицами.
В результате исследований образцов композиций доксорубицина в составе фосфолипидных наночастиц со специфическим богатым гуанином аптамером AS1411 из 26 нуклеотидов, было показано, что в образцах, где к наночастицам присоединен этот аптамер, увеличивается проникновение лекарства в опухолевую клетку (интернализация), особенно в случае дивалентного аптамера, что делает эту фармацевтическую композицию перспективной для дальнейшего изучения и использования в области противоопухолевой терапии с направленной доставкой цитостатика в опухоль.
Литература
1. Schirrmacher V. From chemotherapy to biological therapy: A review of novel concepts to reduce the side effects of systemic cancer treatment (Review). Int J Oncol. 2019 Feb; 54(2):407-419.
2. Pattni B.S., Chupin V.V., Torchilin V.P., New developments in liposomal drug delivery, Chem. Rev. 115 (2015) 10938-10966.
3. Moosavian S.A., Sahebkar A. Aptamer-functionalized liposomes for targeted cancer therapy Cancer Letters 448 (2019) 144-154.
4. Fu Z., Xiang J. Aptamer-Functionalized Nanoparticles in Targeted Delivery and Cancer Therapy. Int. J. Mol. Sci. 2020, 21, 9123; doi:10.3390/ijms21239123.
5. Fu, Z.; Xiang, J. Aptamers, the Nucleic Acid Antibodies, in Cancer Therapy. Int. J. Mol. Sci. 2020,21,2793.
6. Радько С.П., Рахметова С.Ю., Бодоев Н.В., Арчаков А.И.. Аптамеры как перспективные аффинные реагенты для клинической протеомики. Биомедицинская химия, 2007, 53 (1), 5-24.90.
7. Freage L., Boykoff N., Mallikaratchy P. Utility of Multivalent Aptamers to Develop Nanoscale DNA Devices against Surface Receptors. ACS Omega 2021, 6, 12382-12391.
8. Prusty D.K., Adam V., Zadegan R.M., Irsen S., Famulok M. Supramolecular aptamer nano-constructs for receptor-mediated targeting and light-triggered release of chemotherapeutics into cancer cells. Nat Commun 2018 Feb 7; 9(1):535. doi:10.1038/s41467-018-02929-2.
9. Koutsioumpa M., Papadimitriou E. Cell surface nucleolin as a target for anti-cancer therapies Recent Pat Anticancer Drug Discov. 2014 May; 9(2): 137-52.
10. Bates PJ, Reyes-Reyes EM, Malik MT, Murphy EM, O'Toole MG, Trent JO. G-quadruplex oligonucleotide AS1411 as a cancer-targeting agent: Uses and mechanisms. Biochim Biophys Acta Gen Subj. 2017 May; 1861 (5 Pt B):1414-1428.
11. Cao Z., Tong R., Mishra A., Xu W., Wong G.C., Cheng J., Lu Y., Reversible cellspecific drug delivery with aptamer-functionalized liposomes, Angew. Chem. 48 (2009) 6494-6498.
12. Xing H., Tang L., Yang X., Hwang K., Wang W., Yin Q., Wong N.Y., Dobrucki L.W., Yasui N., Katzenellenbogen J.A., Helferich W.G., Cheng J., Lu Y. Selective delivery of an anticancer drug with aptamer-functionalized liposomes to breast cancer cells in vitro and in vivo, J. Mater. Chem. В 1 (2013) 5288-5297.
13. Li X., Wu, X., Yang H., Li L., Ye Z., Rao Y.-F. A nuclear targeted Dox-aptamer loaded liposome delivery platform for the circumvention of drug resistance in breast cancer. Biomed. Pharmacother. 2019, 117, 109072.
14. Sheldon K., Liu D, Ferguson J., Gariepy J. Loligomers: design of de novo peptide-based intracellular vehicles 1995) Proc. Natl. Acad. Sci. USA. 92 (6), 2056-206018.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция, включающая хлорин е6 в составе фосфолипидных наночастиц, с использованием специфического и проникающего пептидов как адресных молекул для направленного транспорта | 2020 |
|
RU2747485C1 |
| ПРОТИВООПУХОЛЕВЫЙ ПРЕПАРАТ | 2011 |
|
RU2451509C1 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА IN VIVO И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2799045C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ДОКСОРУБИЦИНА И ФОСФОЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2411935C1 |
| ВЫСОКОЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ АДРЕСНОГО ДЕЙСТВИЯ ДЛЯ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2727924C1 |
| КОНЪЮГАТ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ С РЕКОМБИНАНТНЫМ АЛЬФА-ФЕТОПРОТЕИНОМ И ЕГО ФУНКЦИОНАЛЬНЫМИ ФРАГМЕНТАМИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2630974C1 |
| НОВЫЕ КОНЪЮГАТЫ ОЛИГОНУКЛЕОТИДОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2599449C1 |
| Фосфолипидная композиция доксорубицина для лечения больных раком молочной железы | 2019 |
|
RU2714137C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2019 |
|
RU2710273C1 |

Изобретение относится к области биотехнологии. Описана группа изобретений, включающая фармацевтическую композицию доксорубицина, включенного в фосфолипидные наночастицы с аптамером AS1411 в виде конъюгата с DSPE-PEG2000-Mal, для направленной доставки цитостатика в опухоль и способ получения композиции. В одном из вариантов реализации изобретения фармацевтическая композиция содержит в себе фосфолипиды, доксорубин и конъюгат аптамера AS1411 с DSPE-PEG2000-Mal. Изобретение расширяет арсенал средств для направленной доставки цитостатика в опухоль. 2 н.з. ф-лы, 4 ил., 2 табл., 3 пр.
1. Фармацевтическая композиция доксорубицина, включенного в фосфолипидные наночастицы с аптамером AS1411 в виде конъюгата с DSPE-PEG2000-Mal, для направленной доставки цитостатика в опухоль следующего состава (%):
2. Способ получения фармацевтической композиции по п. 1, заключающийся в предварительном получении конъюгата аптамера AS1411 с фосфолипидом дистеароилфосфатидилэтаноламином (DSPE), который ковалентно сшивают с полиэтиленгликолем и малеимидом (DSPE-PEG2000-Mal); растворяют в спирте с последующим удалением растворителя, образовавшуюся «пленку» растворяют в воде, полученную грубую эмульсию смешивают с водным раствором доксорубицина гидрохлорида, обрабатывают полученную смесь ультразвуком и фильтруют через мембрану с размером пор 0,22 мкм.
| Способ приготовления лекал | 1929 |
|
SU15168A1 |
| US 20190338284 A1, 07.11.2019 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ДОКСОРУБИЦИНА И ФОСФОЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2411935C1 |
| ГЕРМЕТИЧНЫЙ ОПТИЧЕСКИЙ КАБЕЛЬ | 2018 |
|
RU2691116C1 |
| Liao Z.X | |||
| et al | |||
| Станок для получения тонких и узких полосок древесины (лапши), предназначенных для приготовления целлюлозы | 1925 |
|
SU1411A1 |
| Устройство для усиления микрофонного тока с применением самоиндукции | 1920 |
|
SU42A1 |
| Xing H | |||
| et al | |||
Авторы
Даты
2023-04-25—Публикация
2021-11-22—Подача