Область техники
Изобретение относится к области биологии и медицины, более конкретно к области травматологии, ортопедии и стоматологии, а также регенеративной медицины, и может быть использовано при проведении сканирующей электронной микроскопии для изучения костной репаративной регенерации.
Уровень техники
Кость имеет сложную гистологическую архитектуру, которая в процессах роста и развития постоянно подвергается структурной и функциональной оптимизации. Естественная регенерационная способность опорно-двигательного аппарата у млекопитающих и человека ограничена, поэтому крайне актуален для хирургии поиск новых высокотехнологических способов восстановления целостности и объема утраченных скелетных соединительных тканей, костей после их травматических дефектов и патологии.
Перспективы эффективного восстановления скелетных соединительных тканей связываются с развитием клеточных технологий, в том числе методов тканевой инженерии, технологий регенеративной медицины. Разработка биологических способов стимуляции остеогенеза предъявляет более высокие требования к уровню морфологических исследований, требует более высокого качества визуализации, применения современных цифровых технологий обработки изображений. Описание трехмерной организации и рельефа поверхности клеток и внеклеточного матрикса имеет огромное значение для раскрытия сути биологических процессов в регенерирующей кости, позволяет не только описывать структурную динамику кости, взаимодействий структурных элементов на клеточном и тканевом уровне, но и автоматически получать цифровые параметры для морфологической обработки таких компонентов изображения, которые могут быть полезны для представления и описания формы, математического моделирования. Сканирующая электронная микроскопия (далее - СЭМ) остается одним из наиболее часто используемых морфологических методов исследования кости, что обусловлено ключевым преимуществом этого метода - очень высоким пространственным разрешением в сочетании с большой глубиной резкости и широким полем зрения, способностью беспрепятственно отображать изображения в разных масштабах длины в мезо-микро-нано-континууме, что несомненно важно для многих уникальных и разнообразных применений.
Взаимодействия между падающими электронами и атомами на поверхности образца генерируют обратно рассеянные электроны, вторичные электроны и различные другие сигналы, включая рентгеновские лучи, которые передают композиционную и топографическую информацию. От качества образца - предмета исследований - зависит правильная интерпретация эффективности технологий стимуляции остеогенеза и регулирования жизнедеятельности кости при регенерации.
Крайне важно с наименьшими изменениями нативной структуры тканей (визуализировать без значительных изменений по сравнению с естественным состоянием) использовать образец для максимально возможного количества применимых способов исследований, образец должен быть пригоден для нескольких аналитических методов изучения микроструктуры и патофизиологии кости, компенсаторных процессов в костной ткани, развития костных регенератов, приживления тка не инженерных конструкций и/или имплантированных биоматериалов, динамики клеточных трансплантатов, а также элементного анализа, трехмерной визуализации корреляционной микроскопии и экспериментов in situ.
Следует отметить, что качество методических основ подготовки биологических объектов для СЭМ позволяют избирательно удалять или сохранять определенные компоненты скелетных тканей, в том числе матрикса (органических, неорганических составляющих), клеточных элементов, сосудов, что позволяет выяснить и оценить индивидуальный вклад отдельных компонентов в функциональных особенностях костей.
Регенерирующая кость имеет важную особенность. Регенерат отличается по плотности, степени гидратации, прочностным характеристикам, эластичности от кости скелета. Поэтому крайне важно разработать способ подготовки образцов с наименьшими деформациями, позволяющий предотвращать разрушения зоны перехода кость - регенерат или кость - тканеинженерная конструкция и проводить качественный морфологический анализ регенерации.
Самые существенные деформации образцов при подготовке к электронно-микроскопическому исследованию происходят при дегидратации и сушке. Известно, что наиболее критическим этапом метода сканирующей электронной микроскопии нативных препаратов является высушивание. Высушивание образца может осуществляться тремя способами: 1) из жидкого состояния; 2) путем перехода критической точки; 3) из твердого состояния (лиофильная сушка).
Установлено, что усадка тканей зависит от метода сушки. Материал, прошедший сушку в критической точке, может дать усадку до 60%, при лиофильной сушке - до 15%, а материал, высушенный на воздухе с испарением летучих жидкостей, теряет около 80% исходного объема.
Высушивание из жидкого состояния не совместимо с качественными СЭМ исследованиями.
Наиболее часто применим в сканирующей электронной микроскопии способ подготовки образцов биологических тканей путем высушивания с помощью метода перехода критической точки (Методы электронной микроскопии в биологии и медицине / А.
А. Миронов, Я.Ю. Комиссарчик, В.А. Миронов; Отв. ред. Н.Н. Никольский; Рос.АН, Ин-т цитологии. - СПб: Наука, 1994. с. 132-134). Сушка в критической точке проводится для вытеснения жидкостей и их паров жидкой углекислотой из исследуемых тканей, позволяет избежать грубых деформаций структуры прежде всего поверхности образца тканей, слипания, разрушения хрупких структур в процессе высушивания в условиях высокого вакуума. Суть метода состоит в том, что при некоторой температуре и давлении (в так называемой критической точке) двухфазные состояния (пар и жидкость) большинства летучих жидкостей исчезают. В критической точке две фазы находятся в равновесии, фазовая граница исчезает и, следовательно, отсутствует поверхностное натяжение, с которым связывается потеря микрорельефа, деформация и в целом разрушение микроструктур биологических объектов.
Высушивание из твердого состояния основано на процессе сублимации (возгонки) -это переход вещества из твердого состояния сразу в газообразное, минуя жидкое.
Лиофилизация представляет собой способ мягкой сушки веществ, при котором высушиваемый препарат замораживается, а потом помещается в вакуумную камеру, где и происходит возгонка (сублимация) растворителя (метод замораживания-высушивания). Лиофилизация проходит без существенной потери общей структурной целостности биологических объектов, однако, у этого способа есть ряд известных недостатков -происходят разрывы тканей, вызванные рекристаллизацией воды или дегидратанта, сжатие и перераспределение структурных элементов, выпадение на поверхность образца аморфного осадка, что совершенно недопустимо для качественного СЭМ исследования.
Высушивание из твердого состояния возможно при заливке образца тканей, который будет подвергнут исследованию в сканирующем электронном микроскопе, в вещество с высокой теплотой сублимации. Известен способ сохранения микроструктур объектов для сохранения и транспортировки хрупких объектов с помощью связующего агента, который может быть применен как временный консолидант на время исследований. На роль идеального агента с высокой теплотой сублимации были предложены четыре схожих вещества ряда алициклических углеводородов, соединения с воскоподобной консистенцией, с температурой плавления от 35 до 65°С: 1) камфен (теплота плавления 45-46°С); 2) камфен и трицикпен - смесь двух типов углеводородов (теплота плавления 35°С); 3) ментол (теплота плавления 31-35°С); 4) циклододекан (теплота плавления 58-61°С). Все эти вещества обладают хорошими пленкообразующими свойствами, низкой температурой плавления, нерастворимостью в воде, растворимостью в органических растворителях и малой или вообще отсутствием токсичности. Самое главное, что их применение легко обратимо. Эти материалы имеют в качестве наиболее важной общей характеристики способность к возгонке - медленно испаряется из твердого вещества, превращаясь непосредственно в газ в обычных условиях комнатной температуры. Эта характеристика устраняет необходимость в применении других химических или физических средств удаления, необходимых для большинства других уплотнителей (Hangleiter, Н. М., Е. Jagers, and Е. Jagers Fluchtige Bindemittel Teil I: Anwendungen Teil II: Materialien und Materialeigenschaften; 9, 2; 385-392, Werner, Worms; 1995).
Известен способ применения камфена (3,3-диметил-2-метиленбицикло-[1,2,2]-гептан) для подготовки биологических образцов (тканей зуба, зубного налета и присутствующих там бактерий) ксканирующей электронной микроскопии с максимальным сохранением их нативной структуры (Galil, K., & Gwinnett, A. J. (1973). Application of the camphene technique in the examination of teeth by scanning electron microscopy. Archives of Oral Biology, 18(7), 925-IN13).
Известен способ подготовки образцов биологических тканей для исследования в сканирующем электронном микроскопе RU2397472, данный способ предполагает исследование небольших образцов мягких тканей.
Однако, способ не применялся для исследования нативной структуры комплекса регенерирующих тканей - кость-костный регенерат и параоссальные ткани.
Таким образом, сохраняется необходимость разработки способа подготовки образцов с минимальными деформациями для проведения СЭМ.
Раскрытие изобретения
Задача настоящего изобретения состоит в разработке способа получение нативных образцов (плоскостей продольных срезов) интактной скелетной соединительной ткани, в частности костной и/или хрящевой, кости, а также прилежащих регенерирующих скелетных соединительных тканей и параоссальных тканей, предназначенных для сканирующей электронной микроскопии, с минимальной деформацией гистологических структур и сохранением их истинной архитектоники.
Технический результат настоящего изобретения заключается в разработке способа подготовки крупных образцов регенерирующей скелетной соединительной ткани, кости и иных окружающих тканей и органов для исследования морфология биологических структур в области регенерации на плоскости среза, проходящей через весь образец, с помощью метода сканирующей электронной микроскопии, который позволяет подготовить образец с минимальной деформацией гистологических структур и возможно полным сохранением их истинной архитектоники, а именно с сохранением естественных взаиморасположений клеточных и матриксных составляющих в этих биологических объектах, а также устранение грубых деформаций образцов и артефактов комплекса тканей при подготовке к сканирующему электронно-микроскопическому исследованию.
Указанный технический результат достигается посредством осуществления способа подготовки крупных образцов регенерирующей скелетной соединительной ткани, кости и окружающих мышечной и/или нервной ткани и органов для исследования морфология биологических структур в области регенерации на плоскости среза, проходящей через весь образец, с помощью метода сканирующей электронной микроскопии, включающего, по меньшей мере, следующие этапы:
- фиксация образца;
- промывка образца;
- постфиксация;
- деминерализация образца в смеси водных растворов 8%-й соляной кислоты и 8%-й щавелевой кислоты в соотношении 1:1 в течение 24-72 часов;
- пропитывание образца раствором сахарозы 1,6М в течение 1 часа;
- программированное замораживание образца со скоростью 1°С в минуту;
- обработка образца на криотоме;
- дегидратация в 70-80%-м этиловом спирте при температуре -25°С в течение, по меньшей мере, 24 часов;
- отмывка сахарозы - выдерживание образца в течение 4-6 часов в 70%-ном растворе этилового спирта при комнатной температуре;
- выдерживание образца в спирте с концентрацией 85% в течение 4 часов, в спирте с концентрацией 96% в течение 2 часов, смеси абсолютного изопропилового спирта - диэтилового эфира в течение 20 минут, диэтиловом эфире в течение 10 минут, смеси эфир-камфена в течение 30 минут, далее осуществляют пропитывание расплавленным камфеном при 42°С в течение 8-48 часов;
- высушивание с возгонкой камфена в контролируемых условиях в восходящем потоке сухого и очищенного от частиц-контаминант воздуха внутри эксикатора с 2-х кратной в час сменой воздушной смеси при температуре 30°С не менее 48 часов
В частных вариантах воплощения изобретения размер образцов регенерирующей соединительной ткани, кости и иных окружающих тканей и органов составляет 1×1-6×6 см.
В частных вариантах воплощения изобретения фиксация осуществляется в течение 48 часов в забуференной смеси, содержащей 4%-й раствор формальдегид и 1%-й раствор глутаральдегид. Более конкретно, в течение первых 24 часов фиксации процесс осуществляют при температуре 22-26°С, а в течение последующих 24 часов при температуре 20-37°С без доступа света, причем буфер представляет собой 0.1 М какодилатный или фосфатный, рН 7.2-7.4. В частных вариантах в течение первых 24 часов фиксации процесс осуществляют при температуре 22°С, а в течение последующих 24 часов при температуре 36°С без доступа света.
В частных вариантах воплощения изобретения промывку образца после фиксации осуществляют в буфере с осмолярностью 350 мОсм в течение 2-8 часов.
В частных вариантах воплощения изобретения постфиксация осуществляется в 1%-м растворе тетраоксида осмия в фосфатном буфере с рН 7 в течение 3 часов.
В частных вариантах воплощения изобретения после стадии деминерализации осуществляется стадия промывки бидистиллированной водой 3×15 минут, после чего следует нейтрализации кислот в 8%-м растворе аммиака до 1 часа.
В частных вариантах воплощения изобретения после стадии замораживания образец обрабатывается на криотоме.
В частных вариантах воплощения изобретения сахароза отмывается в 70%-ном водном растворе этилового спирта со сменой раствора, по меньшей мере, 3-5 раз в 4 кратном превышении объема раствора над объемом образца ткани.
В частных вариантах воплощения изобретения регенерирующая скелетная соединительная ткань представляет собой хрящевую ткань. В частных вариантах воплощения изобретения иные окружающие ткани подставляют собой соединительную, мышечную и/или нервную ткани.
Определения и термины
Различные термины, относящиеся к объектам настоящего изобретения, используются выше и также в описании и в формуле изобретения. Если иное не оговаривается, все технические и научные термины, используемые в данной заявке, имеют то же самое значение, которое понятно для специалистов в данной области. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
В описании данного изобретения термин «ткань» относится к системе клеток и неклеточных структур, обладающих общностью строения, в ряде случаев общностью происхождения, и специализированные на выполнении определенных функций.
Программируемое замораживание - программируемое, контролируемое, протоколируемое и воспроизводимое серийно охлаждение объекта до заданной температуры внутри специальных фризеров (программных замораживателей).
Криотомы (криостаты) предназначены для изготовления срезов замороженных образцов без предварительной обработки ткани. Считается, что структура клеток замороженных образцов соответствует нативной в большей степени по сравнению с образцами, залитыми в парафиновые блоки.
Краткое описание чертежей
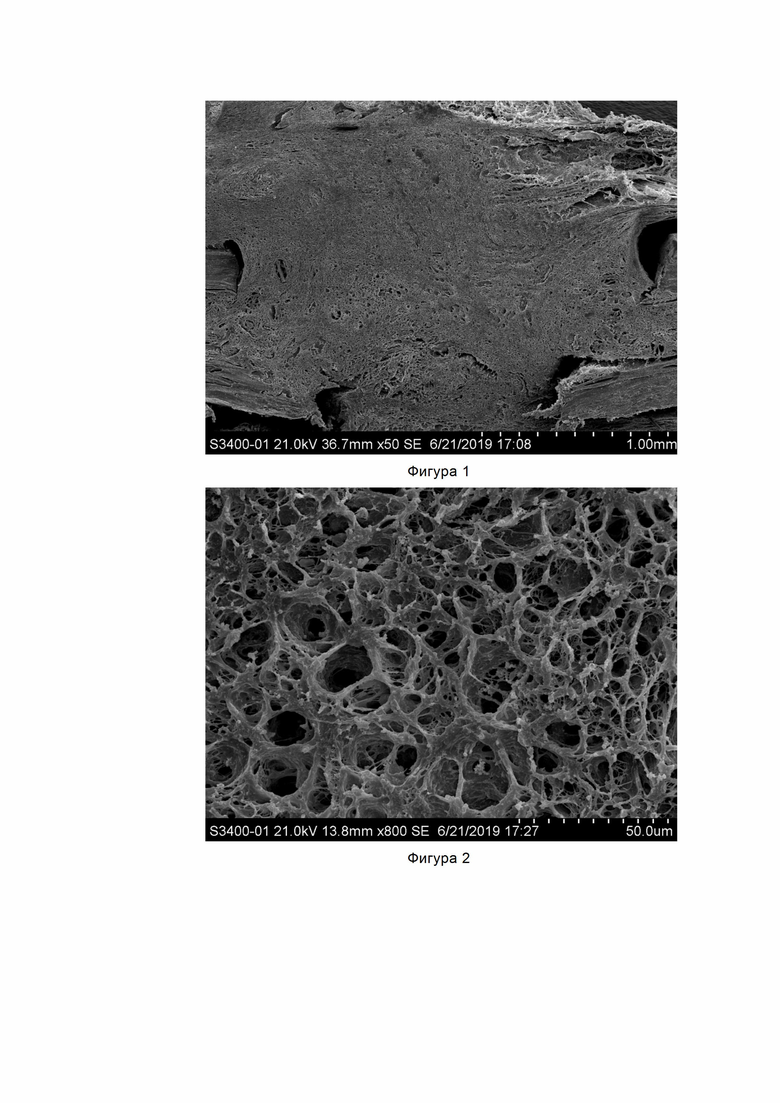
Фигура 1. СЭМ-изображение образца №1, полученного способом по изобретению, грануляционной ткани в дефекте диафиза длинной трубчатой кости между костными отломками.
Фигура 2. СЭМ-изображение образца №1, полученного способом по изобретению, с детализация грануляционной ткани при большем увеличении.
Подробное раскрытие изобретения
Регенерирующая кость имеет важную особенность. Регенерат отличается по плотности, степени гидратации, прочностным характеристикам, эластичности от кости. Поэтому крайне важно разработать способ подготовки образцов с наименьшими деформациями, позволяющий предотвращать разрушения зоны перехода кость -регенерат, кость - тканеинженерная конструкция и проводить качественный морфологический анализ регенерации в сканирующем электронном микроскопе.
Поставленная задача достигается тем, что регенерирующая кость вместе со всеми окружающими мягкими тканями единым блоком фиксируется в забуференной смеси 2 суток, содержащей 4%-й раствор формальдегида и 1%-й раствор глютаральдегида, в течение 48 часов. Причем, в течение первых 24 часов фиксации процесс осуществляют при температуре 22-26°С, а в течение последующих 24 часов при температуре 36-37°С без доступа света. Буфер представляет собой 0.1 М какодилатный или фосфатный, рН 7.2-7.4.
Далее ткани отмываются от фиксатора в буфере (собой 0.1 М какодилатный или фосфатный, рН 7.2-7.4) с осмолярностью 350 мОсм в течение 2-8 часов в зависимости от массы ткани. Затем формируется образец регенерирующей кости с окружающими параоссальными тканями в форме параллепипеда, лишние ткани отсекаются лезвиями. После чего осуществляется промывка в бидистиллированной воде в течение 15 минут.
Далее следует постфиксация в 1%-м растворе тетроксиде осмия в фосфатном буфере (рН 7) в течение 3 часов. Следующий этап - деминерализация кости. Деминерализация осуществляется смесью водных растворов 8% соляной кислоты и 8% щавелевой кислоты в соотношении 1:1, время деминерализации составляет от 24 до 72 часов в зависимости от объема тканей. Далее следует отмывка в бидистиллированной воде 3×15 минут с последующей нейтрализацией кислот в 8%-м растворе аммиака - до 1 часа. Затем осуществляется отмывка в дистиллированной воде 3×10 минут. Далее образец ткани подвергается пропитыванию раствором сахарозы (1,6 М) в течение часа для предотвращения образования крупных кристаллов воды при замораживании. После чего проводится программированное замораживание образца, пропитанного раствором сахарозы (1,6 М), со скоростью 1 градус°С в минуту, такой режим снижает криогенное повреждение тканей. Далее образец подвергается обработке на криотоме для обнажения поверхности исследований. Криотомы (криостаты) предназначены для изготовления срезов замороженных образцов, в том числе без предварительной обработки ткани. Считается, что структура клеток замороженных образцов соответствует нативной в большей степени по сравнению с образцами, залитыми в парафиновые блоки. В данном способе последовательные срезы позволяют достичь центральной части образца и получить поверхность пригодную для исследований пучком электронов в сканирующем режиме.
Далее проводили дегидратацию, причем для предотвращения деформаций образца при дегидратации процесс начинали в переохлажденном до -25°С 70%-ном водном растворе этилового спирта. При этой температуре в таком растворе образец находиться не менее суток. Затем раствор спирта меняется, и 6-12 часов образец находиться в растворе в подвешенном состоянии исследуемой поверхностью вниз по направлению действия гравитационных сил для освобождения от фрагментов тканей, образующихся при резке на криостате, при перенесении в температуру +22°С, в этот промежуток образец отмывается от остатков сахаров. Данная концентрация этилового спирта обусловлена тем, что длительное пребывание объекта в спирте низкой концентрации приводит к мацерации тканей, в то время как передержка в спирте высокой концентрации чрезмерно уплотняет их. Поэтому, используется, так называемый «индифферентный» спирт, крепость которого составляет 70-80%.
Далее образец помещается в 85%-й раствор спирта на 4 часа, затем в 96%-й раствор спирта на 2 часа, далее в смесь спирта - диэтилового эфира на 20 минут, затем в диэтиловый эфир (ОХЧ) на 10 минут, смесь диэтиловый эфир-камфен на 30 минут, после чего образец пропитывали расплавленным камфеном при 42°С - от 8 часов до 2 суток в зависимости от размера образца.
Высушивание образца - важный этап подготовки тканей к исследованию. Возгонка камфена согласно способу по изобретению осуществляется в контролируемых условиях в восходящем потоке сухого (воздух предварительно пропускается через мелкопористый силикагель для поглощения паров воды из воздуха), очищенного от частиц-контаминант (гепафильтры) воздуха внутри эксикатора с 2-х кратной в час сменой воздушной смеси при температуре 30°С не менее 2 суток. Перед ионным напылением образец на 30 мин помещается в вакуум.
Время для осуществления каждого этапа устанавливается индивидуально, с учетом размера образца, возраста субъекта (в частности, животного) и объема исследуемых тканей.
После напыления платиной в ионном напылителе препараты исследуются при помощи сканирующего электронного микроскопа Хитачи.
Примеры осуществления изобретения
Пример 1
У кролика производится забор образца регенерирующей большеберцовой кости в области дефекта критического размера длиной 1 см, регенерирующая кость вместе со всеми окружающими мягкими тканями единым блоком длиной 5 см извлекается оперативным путем, отмывается от крови в среде F12 при температуре 37°С, затем фиксируется в забуференной (0.1 М какодилатный или фосфатный, рН 7.2-7.4) смеси содержащей 4%-й раствор формальдегида и 1%-й раствор глютаральдегида, в течение 48 часов в термостате. Первые 24 часа фиксации процесс осуществляют при температуре 22°С, а в течение последующих 24 часов при температуре 36°С.
Далее комплекс тканей и кости отмываются от фиксатора в буфере (0.1 М какодилатный или фосфатный, рН 7.2-7.4) с осмолярностью 350 мОсм в течение 2-8 часов в зависимости от массы ткани. Затем формируется образец регенерирующей кости с окружающими параоссальными тканями в форме параллелепипеда, лишние ткани отсекаются острыми лезвиями. После чего осуществляется последовательная промывка при постоянном помешивании в бидистиллированной воде в течение 15 минут, через каждые 5 мин смена раствора.
Далее следует постфиксация в 1%-м растворе тетроксида осмия в фосфатном буфере (рН 7.0) в течение 3 часов. Далее образец переносят для деминерализации в смесь водных растворов 8% соляной кислоты и 8% щавелевой кислоты в соотношении 1:1, время деминерализации составляет 72 часа при постоянном помешивании. Далее следует отмывка в бидистиллированной воде 3×15 минут с последующей нейтрализацией кислот в 8%-м растворе аммиака - до 1 часа. Затем осуществляется отмывка в дистиллированной воде 3×10 минут при помешивании. Далее образецткани подвергается пропитыванию раствором сахарозы (1,6 М) в течение часа для предотвращения образования крупных кристаллов воды при замораживании. После чего проводится программированное замораживание образца, пропитанного раствором сахарозы (1,6 М), со скоростью 1 градус°С в минуту с помощью программного замораживателя Kryo 360 английской фирмы PLANER, такой режим снижает криогенное повреждение тканей. Далее образец переносится в охлажденную камеру Криотома НМ525 NX, для рутинных срезов, Thermo FS, монтируется на столике. С помощью микроподачи объекта на нож, задается толщина среза ткани с помощью лимба с делениями (цена деления 1 мк), срезается по 10 мкм серийно, под контролем глаза. При удалении нужного объема ткани и попадании в плоскость среза исследуемой области, извлекаем образец и далее проводим дегидратацию, причем для предотвращения деформаций образца при дегидратации процесс начинали в переохлажденном до -25°С 70%-ном водном растворе этилового спирта. При этой температуре в таком растворе образец находиться не менее суток, раствор в этом промежутке времени меняется трижды, соотношение объема образца к раствору спирта 1:10. Важно, чтобы образец был постоянно погружен в жидкость, подвешен в лабораторной посуде-закрытой емкости таким образом, чтобы плоскость среза находилась снизу, а универсальный шейкер S-4 обеспечивал перемешивание жидкости с помощью качания платформы шейкера в вертикальной плоскости. Это обеспечивает очищение поверхности от мелких фрагментов тканей, а именно стружки при послойном удалении ткани в криотоме. Далее следует отмывка сахарозы -выдерживание образца в течение 4-6 часов в 70-% растворе этилового спирта при комнатной температуре.
Далее образец помещается в 85%-й раствор спирта на 4 часа, затем в 96%-й раствор спирта на 2 часа, далее в смесь спирта - диэтилового эфира на 20 минут, затем в диэтиловый эфир (ОХЧ) на 10 минут. При переносе образца в смесь диэтиловый эфир-камфен на 30 минут и далее в камфен плоскость среза образца должна быть строго сверху, категорически не допускается высыхание поверхности образца, эта поверхность обязательно должна быть покрыта слоем раствора или аморфного вещества, после чего образец пропитывали расплавленным камфеном при 42°С в течение 24 часов.
Возгонка камфена осуществляется в контролируемых условиях - используется эксикатор, который устанавливается внутрь термостата, в нижнюю часть эксикатора подается поток воздуха, предварительно пропущенного через мелкопористый силикагель для поглощения паров воды из воздуха и очищенного от частиц-контаминант с помощью гепа-фильтра внутри эксикатора с 2-х кратной в час сменой воздушной смеси (через верхний патрубок в центре крышки эксикатора) при температуре 30°С не менее 2 суток. Крайне важно, чтобы плоскость среза образца находилась все дальнейшее время строго сверху в горизонтальной плоскости. Перед ионным напылением образец на 30 мин помещается в вакуум для откачки остатков жидкостей, возгоняемых веществ и газов в образце.
После напыления платиной в ионном напылителе плоскость среза биологического образца №1 исследуется при помощи сканирующего электронного микроскопа Хитачи.
Образец №1.
Электронная сканограмма развития грануляционной ткани между обломками диафиза длинной трубчатой кости. Обращает внимание ровность плоскости исследования костной регенерации. Кортекс кости и грануляционная ткань обладают совершенно разными параметрами, но способ обработки образца по изобретению позволяет исследовать их в одной плоскости, избегая критических деформаций образца.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ подготовки образцов костной ткани человека для исследования методом растровой электронной микроскопии | 2018 |
|
RU2688944C1 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ БИОПЛЕНОК МИКРООРГАНИЗМОВ ДЛЯ ИССЛЕДОВАНИЯ В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ | 2011 |
|
RU2484446C1 |
| СПОСОБ ПОДГОТОВКИ ПОВЕРХНОСТИ ОБРАЗЦОВ КОСТНОЙ ТКАНИ ДЛЯ ИЗУЧЕНИЯ ЕЁ МИКРОСТРУКТУРЫ ПРИ ПОМОЩИ СКАНИРУЮЩЕГО ЭЛЕКТРОННОГО МИКРОСКОПА | 2017 |
|
RU2668879C1 |
| СПОСОБ ПРИЖИЗНЕННОЙ ФИКСАЦИИ ПЕЧЕНИ У НАРКОТИЗИРОВАННОГО ЖИВОТНОГО | 2004 |
|
RU2269110C2 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ИССЛЕДОВАНИЯ В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ | 2008 |
|
RU2397472C1 |
| Лантаноидный краситель для контрастирования биологических препаратов при сканирующей электронной микроскопии в обратно-рассеянных электронах и способ его получения и применения | 2023 |
|
RU2837329C1 |
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ НЕДЕКАЛЬЦИНИРОВАННОГО СУСТАВНОГО ХРЯЩА С ПОДЛЕЖАЩЕЙ СУБХОНДРАЛЬНОЙ КОСТЬЮ ДЛЯ МНОГОЦЕЛЕВЫХ ИССЛЕДОВАНИЙ | 2011 |
|
RU2466375C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЕМИНЕРАЛИЗОВАННОГО КОСТНОГО МАТРИКСА В ВИДЕ КРОШКИ | 2011 |
|
RU2456003C1 |
| Способ получения костного имплантата с деминерализованным поверхностным слоем | 2019 |
|
RU2732427C1 |
| Способ подготовки тканей полукружных каналов вестибулярного аппарата для изучения в сканирующем электронном микроскопе | 1988 |
|
SU1681250A1 |
Изобретение относится к области биологии и медицины, более конкретно к области травматологии, ортопедии и стоматологии, а также регенеративной медицины, и может быть использовано при проведении сканирующей электронной микроскопии для изучения костной репаративной регенерации. Способ подготовки крупных образцов регенерирующей скелетной соединительной ткани, кости и окружающей мышечной и/или нервной ткани и органов для исследования морфологии биологических структур в области регенерации на плоскости среза, проходящей через весь образец, с помощью метода сканирующей электронной микроскопии, включающий, по меньшей мере, следующие этапы: фиксация образца; промывка образца; постфиксация; деминерализация образца в смеси водных растворов 8%-ной соляной кислоты и 8%-ной щавелевой кислоты в соотношении 1:1 в течение 24-72 часов; пропитывание образца раствором сахарозы 1,6М в течение 1 часа; программированное замораживание образца со скоростью 1°С в минуту; обработка образца на криотоме; дегидратация в 70-80%-ном этиловом спирте при температуре -25°С в течение, по меньшей мере, 24 часов; отмывка сахарозы - выдерживание образца в течение 4-6 часов в 70%-ном растворе этилового спирта при комнатной температуре; выдерживание образца в спирте с концентрацией 85% в течение 4 часов, в этиловом спирте с концентрацией 96% в течение 2 часов, смеси абсолютного изопропилового спирта - диэтилового эфира в течение 20 минут, диэтиловом эфире в течение 10 минут, смеси диэтиловый эфир-камфена в течение 30 минут, далее осуществляют пропитывание расплавленным камфеном при 42°-45°С в течение 8-48 часов; высушивание с возгонкой камфена в контролируемых условиях в восходящем потоке сухого и очищенного от частиц-контаминант воздуха внутри эксикатора с 2-кратной в час сменой воздушной смеси при температуре 30°С не менее 48 часов. Технический результат - разработка способа подготовки крупных образцов регенерирующей скелетной соединительной ткани для исследования морфология поверхности кости с помощью метода сканирующей электронной микроскопии, который позволяет подготовить образец с минимальной деформацией гистологических структур и возможно полным сохранением их истинной архитектоники, а именно с сохранением естественных взаиморасположений клеточных и матриксных составляющих в этих биологических объектах, а также устранение грубых деформаций образцов и артефактов комплекса тканей при подготовке к сканирующему электронно-микроскопическому исследованию. 10 з.п. ф-лы, 2 ил., 1 пр.
1. Способ подготовки крупных образцов регенерирующей скелетной соединительной ткани, кости и окружающей мышечной и/или нервной ткани и органов для исследования морфологии биологических структур в области регенерации на плоскости среза, проходящей через весь образец, с помощью метода сканирующей электронной микроскопии, включающий, по меньшей мере, следующие этапы:
- фиксация образца;
- промывка образца;
- постфиксация;
- деминерализация образца в смеси водных растворов 8%-ной соляной кислоты и 8%-ной щавелевой кислоты в соотношении 1:1 в течение 24-72 часов;
- пропитывание образца раствором сахарозы 1,6М в течение 1 часа;
- программированное замораживание образца со скоростью 1°С в минуту;
- обработка образца на криотоме;
- дегидратация в 70-80%-ном этиловом спирте при температуре -25°С в течение, по меньшей мере, 24 часов;
- отмывка сахарозы - выдерживание образца в течение 4-6 часов в 70%-ном растворе этилового спирта при комнатной температуре;
- выдерживание образца в спирте с концентрацией 85% в течение 4 часов, в этиловом спирте с концентрацией 96% в течение 2 часов, смеси абсолютного изопропилового спирта - диэтилового эфира в течение 20 минут, диэтиловом эфире в течение 10 минут, смеси диэтиловый эфир-камфена в течение 30 минут, далее осуществляют пропитывание расплавленным камфеном при 42-45°С в течение 8-48 часов;
- высушивание с возгонкой камфена в контролируемых условиях в восходящем потоке сухого и очищенного от частиц-контаминант воздуха внутри эксикатора с 2-кратной в час сменой воздушной смеси при температуре 30°С не менее 48 часов.
2. Способ по п. 1, в котором размер образцов регенерирующей соединительной ткани, кости и иных окружающих тканей и органов составляет 1×1-6×6 см.
3. Способ по п. 1, в котором фиксация осуществляется в течение 48 часов в забуференной смеси, содержащей 4%-ный раствор формальдегида и 1%-ный раствор глутаральдегида.
4. Способ по п. 3, в котором в течение первых 24 часов фиксации процесс осуществляют при температуре 22-26°С, а в течение последующих 24 часов при температуре 20-37°С без доступа света.
5. Способ по п. 4, в котором в течение первых 24 часов фиксации процесс осуществляют при температуре 22°С, а в течение последующих 24 часов при температуре 36°С без доступа света.
6. Способ по п. 3, в котором буфер представляет собой 0.1 М какодилатный или фосфатный, рН 7.2-7.4.
7. Способ по п. 1, в котором промывку образца после фиксации осуществляют в буфере с осмолярностью 350 мОсм в течение 2-8 часов.
8. Способ по п. 1, в котором постфиксация осуществляется в 1%-ном растворе тетраоксида осмия в фосфатном буфере с рН 7 в течение 3 часов.
9. Способ по п. 1, в котором после стадии деминерализации осуществляется стадия промывки бидистиллированной водой 3×15 минут, после чего следует нейтрализация кислот в 8%-ном растворе аммиака до 1 часа.
10. Способ по п. 1, в котором сахароза отмывается в 70%-ном водном растворе этилового спирта со сменой раствора, по меньшей мере, 3-5 раз в 4-кратном превышении объема раствора над объемом образца ткани.
11. Способ по п. 1, в котором скелетная соединительная ткань представляет собой хрящевую ткань.
| СПОСОБ ПОДГОТОВКИ ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ИССЛЕДОВАНИЯ В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ | 2008 |
|
RU2397472C1 |
| СИЛАНТЬЕВА Т.А., ГОРБАЧ Е.Н | |||
| Подготовка образцов биологических тканей для исследования в сканирующем электронном микроскопе с использованием камфена, Фундаментальные исследования, 2015, no.2-22, с.4919-4923 | |||
| СПОСОБ ПОДГОТОВКИ ПОВЕРХНОСТИ ОБРАЗЦОВ КОСТНОЙ ТКАНИ ДЛЯ ИЗУЧЕНИЯ ЕЁ МИКРОСТРУКТУРЫ ПРИ ПОМОЩИ СКАНИРУЮЩЕГО ЭЛЕКТРОННОГО МИКРОСКОПА | 2017 |
|
RU2668879C1 |
Авторы
Даты
2021-05-11—Публикация
2020-04-23—Подача