ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к самоорганизующимся наноструктурам, образованным трансмембранными белками, такими как аквапориновые водные каналы (AQP - от англ. aquaporin water channel), и полиалкилениминами (PAI - от англ. polyalkyleneimine), и к фильтрационнымм мембранам, включающим данные наноструктуры. Настоящее изобретение дополнительно относится к способам получения наноструктур и разделительных мембран, таких как полые волокна и половолоконные модули, и к их применениям.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Применение амфифильных липидов и блок-сополимеров для образования самоорганизующихся везикул, имеющих бислойные или бислой-подобные структуры, хорошо известно в данной области, в частности для иммобилизации амфифильных мембранных белков, таких как аквапориновые водные каналы (AQP). В таком случае, везикулы, содержащие AQP, могут быть использованы для получения мембран, имеющих иммобилизованные AQP, для применений, таких как, очистка воды (WO 2006/122566) или генерация энергии градиента солености (WO 2007/033675), обычно посредством осаждения везикул в виде слоя или в пленке на подложке, что делает возможным селективное прохождение молекул воды через мембраны посредством нанофильтрации, обратного осмоса, прямого осмоса и осмоса с ограниченным давлением.
В WO 2013/043118 описаны тонкопленочные композитные (TFC - от англ. thin-film composite) мембраны, в которых аквапориновые водные каналы (AQP) включены в активный слой мембраны. Кроме того, в ней раскрыт способ получения тонкопленочных композитных мембран и их применения в способах фильтрации, таких как нанофильтрация и способы осмотической фильтрации. TFC мембраны содержат везикулы на основе липида-AQP/сополимера-AQP, которые включены в TFC активный слой. В WO 2010/146365 описано получение фильтрационных мембран на основе TFC-аквапорина-Z (AqpZ), в которых в качестве вещества, образующего везикулу, используется амфифильный триблок-сополимер для включения иммобилизованных AQP. В WO 2014/108827 раскрыт половолоконный (HF - от англ. hollow-fiber) модуль, имеющий волокна, модифицированные тонкопленочным композитным (TFC) слоем, содержащим аквапориновые водные каналы, где аквапориновые водные каналы включаются в везикулы перед включением в TFC слой.
Однако, обычно в предшествующем уровне техники амфифильные липиды и блок-сополимеры, используемые в получении везикул, являются твердыми веществами, которые необходимо растворять в агрессивных растворителях, таких как тетрахлорметан (CCl4) или хлороформ (CHCl3), для солюбилизации их преимущественно гидрофобных частей. В синтезе мембран данный растворитель выпаривают для обеспечения образования пленки, которую затем регидратируют для привнесения амфифильности в разные эмульсионные формы (такие как везикулы), с одновременным включением мембранного белка AQP. Однако на практике часто сложно контролировать конечный размер везикул, что приводит к дисперсным эмульсиям, имеющим везикулы с диаметром, находящимся в диапазоне от примерно 60-80 нм до примерно 1000 нм или более. Также могут существовать ограничения по числу AQP, которое может быть включено в каждую везикулу, поскольку данные мембранные белки должны быть выровнены в соответствии с их амфифильной структурой в бислойной структуре, и по совпадению толщины гидрофобной части белка и везикулярной мембраны.
Полиэтиленимин (PEI) известен как универсальный вектор для переноса генов в клетки, поскольку он имеет высокую плотность катионов, которая позволяет ему образовывать комплексы с отрицательно заряженной ДНК. В данном применении комплексы PEI-ДНК предоставляют ДНК стабильную окружающую среду против ферментативной деградации, например, обеспечивая физический барьер для ферментов или посредством электростатических взаимодействий между PEI и ферментом (Thomas & Venkiteswaran, Biophysical Journal, 106 (2): 276-277, 2014). PEI существует как в линейной и разветвленной, так и дендритной формах. Линейные цепи содержат вторичные аминогруппы, в то время как разветвленные цепи или дендримеры могут содержать первичные, вторичные и третичные аминогруппы. Из литературы также известно, что короткий полиэтиленимин (PEI, Mw (от англ. - molecular weight - молекулярная масса) 600) был выбран в качестве катионной основной цепи, с которой сопряжены липидные хвосты при разных уровнях насыщения. В растворе данные гибриды полимер-липид самоорганизуются с образованием наночастиц, способных к комплексообразованию с миРНК (малые интерферирующие РНК). Данные комплексы подавляют гены, специфично и с низкой цитотоксичностью (Schroeder A, et al., J. of Controlled Release, 160 (2): 172-176, 2012).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В целом, настоящее изобретение относится к применению полиалкилениминов (PAI), таких как полиэтиленимин (PEI), для образования самоорганизующихся наноструктур с трансмембранными белками или определенными типами интегральных мембранных белков (белки, образующие поры), такими как аквапориновые водные каналы. Наноструктуры PAI-белок затем можно использовать в получении разделительных мембран, в которых трансмембранные белки иммобилизованы и активны, например, для обеспечения прохождения молекул воды через мембрану. Например, для получения разделительных мембран, включающих трансмембранные белки, самоорганизующиеся наноструктуры могут быть суспендированы в водной жидкой композиции, которая может быть включена в реакцию межфазной полимеризации на полупроницаемой подложке с образованием тонкопленочного композитного активного слоя мембраны, или самоорганизующиеся наноструктуры могут быть включены в фильтрационную мембрану, образованную посредством послойной методики, или другие типы фильтрационных мембран, имеющих активный селективный слой. Не желая быть связанными какой-либо определенной теорией, считается, что самоорганизующиеся наноструктуры образуются за счет электростатического взаимодействия между положительно заряженными атомами азота, находящимися в молекулах полиалкиленимина, и аминокислотными остатками в трансмембранном белке, которые отрицательно заряжены в условиях (рН, pK и т.д.), используемых для образования наноструктур и/или мембран, содержащих данные наноструктуры.
Соответственно, самоорганизующиеся наноструктуры по настоящему изобретению отличаются от везикул в предшествующем уровне техники, где мембраны, включающие трансмембранные белки, иммобилизованы в липидном бислое или бислой-подобных структурах, где белки включены в бислои индивидуальных везикул или клеток или также включены в пограничный слой между соседними клетками в жидкой мембране. В обоих примерах бислой имеет функцию отделения внутренней фазы в пределах клеток от окружающей внешней фазы, в которой суспендированы клетки. Напротив, в самоорганизующихся наноструктурах по настоящему изобретению молекулы трансмембранного белка и молекулы полиалкиленимина ассоциируют или образуют комплекс таким путем, который по существу не приводит к образованию пограничного слоя, который приводит к образованию отчетливых внутренней и внешней фаз, а скорее обеспечивает композицию наноструктур, которые могут быть отложены или иным образом предоставлены в виде активного слоя и/или селективной структуры разделительной мембраны.
Соответственно, в одном аспекте согласно настоящему изобретению предложены самоорганизующиеся наноструктуры, образованные положительно заряженными полимерами, такими как полиалкиленимины (PAI), такие как полиэтиленимин (PEI), и одним или более трансмембранными белками, такими как AQP, и особенно трансмембранными белками, являющимися солюбилизированным детергентом. Трансмембранный белок имеет отрицательно заряженные аминокислотные остатки, доступные для комплексообразования или взаимодействия зарядов с положительно заряженными полимерами, с образованием агрегатов, например, посредством электростатических взаимодействий. Более конкретно, обнаружили, что размер образованных наноструктур зависит от молекулярной структуры и молекулярной массы PAI (или PEI) полимера и используемого соотношения полимера и белка.
Таким образом, согласно настоящему изобретению предложены разделительные мембраны, такие как фильтрационные мембраны или TFC мембраны, имеющие AQP, включенные в активный слой, для облегчения транспорта воды, где AQP иммобилизованы в самоорганизующиеся PAI наноструктуры, такие как самоорганизующиеся PEI наноструктуры. Согласно настоящему изобретению дополнительно предложены жидкие композиции, содержащие наноструктуры на основе PAI-белка, которые могут быть включены в активный слой различных разделительных мембран (включая фильтрационные мембраны), таких как нанофильтрационные мембраны, мембраны прямого осмоса и мембраны обратного осмоса.
В другом аспекте согласно настоящему изобретению предложен половолоконный (HF) модуль, имеющий волокна, модифицированные селективным слоем, содержащим самоорганизующиеся наноструктуры по настоящему изобретению. В целях удобства селективный слой содержит тонкопленочный композитный (TFC) слой на внутренней поверхности волокон, хотя в определенных воплощениях TFC слой может быть образован на внешней стороне волокон.
В родственном аспекте согласно настоящему изобретению предложен способ получения половолоконного (HF) модуля, содержащего пучок волокон, окруженных защитной оболочкой, где волокна модифицированы селективным слоем, содержащим самоорганизующиеся наноструктуры по настоящему изобретению, причем способ включает приведение волокон в контакт с жидкой композицией, содержащей самоорганизующиеся наноструктуры и участие жидкой композиции в реакции межфазной полимеризации с образованием селективного слоя, содержащего самоорганизующиеся наноструктуры. Способ может дополнительно включать добавление жидкой композиции во время образования активного слоя способом послойного отложения. Способ можно использовать для образования селективных слоев на различных формах мембран, таких как плоские листовые мембраны и трубчатые мембраны.
В HF модулях защитная оболочка обычно имеет вытянутую форму, с пучком волокон, продольно расположенных внутри защитной оболочки. Эксперименты, описанные в примерах, демонстрируют, что приложение вакуума со стороны оболочки модуля, представляет преимущество в способе TFC покрытия. Кроме того, может быть дополнительно выгодным держать защитную оболочку в по существу горизонтальной ориентации во время высушивания водной фазы. Преимущества приложения указанного вакуума включают однородное высушивание поверхности мембраны от водной фазы по длине модуля перед введением органической фазы и/или снижение или предотвращение гравиметрического потока водной фазы по стороне оболочки модуля на внешней поверхности волокон внутри оболочки.
В другом аспекте согласно настоящему изобретению предложено применение HF модуля по настоящему изобретению для экстракции чистой воды посредством прямого осмоса.
В другом аспекте согласно настоящему изобретению предложено применение HF модуля по настоящему изобретению для повторной экстракции чистой воды из плазмы пациента, потерянной вследствие гемодиализа, гемодиафильтрации или гемофильтрации, например, образом, раскрытым в WO 2015/124716.
В другом аспекте согласно настоящему изобретению предложено применение HF модуля по настоящему изобретению для повышения концентрации тяжелых водных фракций из природного водного источника.
В различных аспектах изобретения используется половолоконный модуль (HF), имеющий половолоконные мембраны, модифицированные селективным слоем, содержащим самоорганизующиеся наноструктуры, образованные посредством самоорганизации полиалкиленимина (PAI), такого как PEI, и солюбилизированного детергентом трансмембранного белка. Обычно, PEI представляет собой по существу линейный полимер, имеющий среднюю молекулярную массу от примерно 2000 Да до примерно 10000 Да, как например, от примерно 3000 Да до примерно 5000 Да; а трансмембранный белок представляет собой аквапориновый водный канал; а детергент выбран из группы, состоящей из LDAO (от англ. "Lauryldimethylamine N-oxide" - лаурилдиметиламин N-оксид), OG (от англ. "n-octyl β-D-Glucopyranoside" - н-октил β-D-глюкопиранозид), DDM (от англ. "n-Dodecyl-B-D-maltopyranoside" - н-додецил-В-D-мальтопиранозид) или их комбинации; и где селективный слой содержит тонкопленочный композитный (TFC) слой, образованный на внутренней поверхности волокон в результате реакции межфазной полимеризации; и где TFC слой содержит аквапориновые водные каналы, которые функционально инкапсулированы в PAI или PEI наноструктуры, или аквапориновые водные каналы включены в амфифильные везикулы, такие как диблок-сополимерные или триблок-сополимерные везикулы, как описано ниже в Примере 11, или липидные везикулы; и где на указанные HF модули наносят покрытие с использованием способа, описанного в данном документе.
Кроме того, когда указанный трансмембранный белок включает ионный канал или аквапорин или тому подобное, и указанные нанаструктуры, включающие указанный трансмембранный белок, иммобилизованы или включены в указанный активный или селективный слой, становится возможным изготовлять разделительные мембраны или фильтрационные мембраны, имеющие разную селективность и транспортные свойства, например, ионообменные мембраны, когда указанный трансмембранный белок представляет собой ионный канал, или мембраны, фильтрующие воду, где указанный трансмембранный белок представляет собой аквапорин. Так как трансмембранный белок сохраняет свою биологически активную свернутую структуру при образовании комплекса в самоорганизующихся наноструктурах и защищен от деградации, даже чувствительные амфифильные белки могут становиться достаточно стабильными при преобразовании в разделительные мембраны в лабораторном и промышленном масштабе и, следовательно, сохраняют свою функциональность.
Кроме того, настоящее изобретение относится к жидкой композиции, содержащей самоорганизующуюся наноструктуру, где трансмембранный белок представляет собой аквапориновый водный канал, как описано выше, необязательно содержащую буфер, и способу получения данной жидкой композиции, в котором раствор полиалкиленимина смешивают с солюбилизированным детергентом трансмембранном белком с образованием жидкой композиции, которая является стабильной даже при комнатной температуре и выше. Жидкая композиция особенно полезна в качестве промежуточного продукта, который может быть добавлен в раствор MPD или иным образом применен во время процесса изготовления мембраны, как например, во время межфазной полимеризации с образованием TFC слоя. Характерной особенностью настоящего изобретения является то, что PAI наноструктуры могут быть способны участвовать в указанной межфазной полимеризации, как описано ниже, и, таким образом, укреплять тонкую пленку и усиливать иммобилизацию там аквапориновых водных каналов (Kah et al., рН stable thin film composite polyamine nanofiltration membranes by interfacial polymerisation; Journal of Membrane Science, 478: 75-84, 2015).
Разделительные мембраны no настоящему изобретению полезны в способе получения фильтрата чистой воды, таком как фильтрование водного раствора через разделительную мембрану в процессе нанофильтрации, в процессе прямого осмоса или в процессе обратного осмоса.
Кроме того, разделительная мембрана по настоящему изобретению является полезной в способе концентрирования раствора продукта, причем указанный способ включает использование разделительной мембраны по изобретению, установленной в корпус фильтра или модуль, для экстракции воды из раствора продукта, например, посредством прямого осмоса, таким образом, создавая раствор продукта, имеющий более высокую конечную концентрацию растворенных в нем желаемых веществ.
Разделительные мембраны по настоящему изобретению могут дополнительно быть полезными в способе получения энергии градиента солености с использованием осмоса с ограниченным давлением, причем указанный способ включает использование указанной разделительной мембраны для повышения гидростатического давления и использование повышения гидростатического давления в качестве источника энергии, см. также WO 2007/033675 и WO 2014128293 (А1).
Воплощения настоящего изобретения теперь будут описаны в качестве примера, а не ограничения, со ссылкой на прилагаемые примеры и графические материалы. Однако, различные другие аспекты и воплощения настоящего изобретения будут очевидны специалистам в данной области, принимая во внимание настоящее раскрытие.
Термин «и/или», в том виде, в котором он используется в данном документе, следует воспринимать как особо оговоренное раскрытие каждого из данных двух указанных признаков или компонентов с или без другого. Например, «А и/или В» следует воспринимать как особо оговоренное раскрытие каждого из (i) А, (ii) В и (iii) А и В, как если бы каждый был изложен по отдельности в данном документе.
Если контекстом не диктуется иное, описания и определения признаков, изложенных выше, не ограничены каким-либо конкретным аспектом или воплощением изобретения и применимы равной степени ко всем аспектам и воплощениям, которые описаны.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Профиль кругового дихроизма AQPZ в самоорганизующихся наноструктурах на основе PEI. Вторичная структура AQPZ. На Фиг. 1 AQPZ, воссозданный в самоорганизующихся наноструктурах на основе PEI, демонстрировал отрицательную полосу эллиптичности при 222 нм, по сравнению с 208 нм (отношение 222/208 нм, равное 1,15), аналогично тому, как сообщается для аквапорина шпината, воссозданного в общем липиде E. coli, что указывает на то, что данный белок не является несвернутым (Hansen et al., Biochimica et Biophysica Acta, 1808: 2600-2607, 2011).
Фиг. 2. Схематичная фигура, на которой показан протокол нанесения покрытия для самоорганизующихся наноструктур по настоящему изобретению, применяемых для гемофильтрационных (HF) модулей, как описано в Примере 11. I - смачивание MPD-водой, IIA - высушивание модуля со стороны 1, IIБ - высушивание модуля со стороны 2, III - взаимодействие с TMC-isopar. FV- расходомер, RH - датчик влажности.
Фиг. 3. Схематичное описание применяемой установки LPRO (от англ. Low Pressure Reverse Osmosis - обратный осмос при низком давлении), используемой для тестирования 2,3 м2 модулей. FV - расходомер, Р - манометр, С - измеритель проводимости.
Фиг. 4. Схематичное описание применяемого однопроходного способа FO (от англ. forward osmosis - прямой осмос) тестирования, используемого в тестировании 2,3 м2 модулей. Легенда: FV - расходомер, Р - манометр, С - измеритель проводимости.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Более конкретно, изобретение относится к самоорганизующимся наноструктурам, как раскрыто в данном документе, где наноструктура образована в результате самоорганизации положительно заряженного PEI в присутствии белка, являющегося отрицательно заряженным.
Примерами трансмембранных белков являются интегральные мембранные белки, включая аквапориновые водные каналы, то есть аквапорины и акваглицеропорины, такие как аквапорины и акваглицеропорины, перечисленные ниже. При рН 7,5 белок отрицательно заряжен, как доказано при воссоздании внутри протеолипосом, которые будут демонстрировать отрицательное значение их значения дзета-потенциала (Wang S. et al., Membranes, 5 (3): 369-384, 2015). Это обусловлено наличием отрицательно заряженных аминокислотных остатков (аспарагиновая кислота и глутаминовая кислота) с pKa на уровне 3,9 для аспарагиновой кислоты и 4,2 для глутаминовой кислоты (Kong S et al. RSC Adv., 4: 37592-37599, 2014). Кроме того, данные белки имеют цистеиновый остаток, расположенный на внешней поверхности, будучи как следует свернутыми, причем указанный цистеин отрицательно заряжен при рН 7,5, вызывая отрицательное значение дзета-потенциала, как показано для протеолипосом на основе 1,2-дифитаноил-sn-глицеро-3-фосфохолина (DPhPC), содержащих AqpZ (Li et al., Fusion behaviour of aquaporin Z incorporated proteoliposomes investigated by quartz crystal microbalance with dissipation (QCM-D); Colloids and Surfaces B-biointerfaces, 111:. 446-452, 2013).
Настоящее изобретение также относится к жидкой композиции, содержащей самоорганизующуюся наноструктуру, как раскрыто в данном документе, в которой трансмембранный белок солюбилизирован детергентом, например, с использованием подходящего детергента, такого как LDAO, OG, DDM или тому подобное, необязательно в комбинации с рН буфером, для сохранения отрицательно заряженных аминокислотных остатков указанного трансмембранного белка, например, для аквапоринов буферизация выше рН 4, с использованием, например, фосфатного буфера, что соответствует pKa отрицательно заряженных аминокислотных остатков. Другие необязательные компоненты жидкой композиции представляют собой биологический буфер, например, натриевую соль HEPES (от англ. N-2-hydroxyethyl-piperazine-N'-2-ethanesulfonic acid-N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), см. также 54466 натриевую соль HEPES из Fluka, (Industriestrasse 25, СН-9471 Buchs), Tris-буфер, TES, MES и MOPS буферы.
Кроме того, настоящее изобретение относится к способу получения жидкой композиции, как раскрыто, где, в качестве примера, раствор PAI, такой как полиэтиленимин (PEI), смешивают с суспензией отрицательно заряженного белка, имеющего отрицательно заряженный аминокислотный остаток. Таким образом, структуры образуются, когда раствор PEI образует комплекс с заряженным белком, как было показано для комплексов PEI-ДНК и PEI-PHК (Sun et al., Molecular Dynamics Simulations of DNA/PEI Complexes: Effect of PEI Branching and Protonation State, Biophysical Journal Volume 100 June 2011 2754-2763; Mansoor M Amiji Polymeric Gene Delivery: Principles and Applications). Примерами PEI являются линейные и разветвленные полимеры, как изложено ниже.
Кроме того, настоящее изобретение относится к разделительной мембране, как например, в виде полупроницаемой или селективно проницаемой мембраны, содержащей самоорганизующиеся наноструктуры, как раскрыто в данном документе. Разделительная мембрана может быть представлена в виде фильтрационной мембраны, содержащей пористую подложку, или мембраны положки, например, нанопористой или микропористой мембраны, имеющей разделительный слой или активный слой, в котором иммобилизованы самоорганизующиеся наноструктуры. В некоторых случаях слой пористой подложки может быть дополнительно укреплен посредством заливки на тканевый или нетканевый лист, например, образованный из полиэфирных волокон.
В качестве примера указанный активный слой может представлять собой водный селективный слой, образованный в результате межфазной полимеризации с образованием тонкой пленки или TFC слоя, например, слоя сшитого ароматического полиамида, или активный/селективный слой может быть образован посредством осаждения наноразмерных, чередующихся слоев положительно и отрицательно заряженных полиэлектролитов, то есть послойно осаждаемая пленка (LbL - от англ. layer-by-layer) (см. Wang et al., Membranes, 5 (3): 369-384, 2015).
Фильтрационная мембрана согласно настоящему изобретению может быть получена посредством добавления жидкой композиции, содержащей указанные самоорганизующиеся наноструктуры, например, с белками аквапориновые водные каналы в качестве трансмембранного белка, необходимого для образования структур, во время процесса изготовления мембраны, как например, посредством добавления жидкой композиции к раствору MPD при образовании TFC слоя или посредством добавления к жидкому положительно заряженному полиэлектролиту при образовании LbL кожи.
В одном аспекте способа по изобретению трансмембранный белок может представлять собой белок анионного канала, такого как потенциал-зависимый анионный канал, который является полезным при получении ионообменных мембран для обратного электродиализа, см. также Dlugolecki et al. (Journal of Membrane Science, 319 214-222, 2008).
Определения и термины
Термин «трансмембранный белок» (ТБ), в том виде, в котором он используется в данном документе, представляет собой тип мембранного белка, охватывающего целостность биологической мембраны, к которой он по природе постоянно прикреплен. То есть, по природе трансмембранные белки охватывают мембрану от одной стороны мембраны вплоть до другой стороны мембраны. Примерами трансмембранных белков являются переносчики аммония, переносчики мочевины, хлоридные каналы и аквапориновые водные каналы.
Термин «аквапориновый водный канал», в том виде, в котором он используется в данном документе, включает функциональный природный или синтетический аквапориновый или акваглицеропориновый водный канал, такой как аквапорин Z (AqpZ), GIPf, SoPIP2;1, аквапорин 1 и/или аквапорин 2. Аквапориновые водные каналы включают бактериальные аквапорины и эукариотические аквапорины, такие как аквапорины дрожжей, аквапорины растений и аквапорины млекопитающих, такие как аквапорины 9 и 12, а также родственные канальные белки, такие как акваглицеропорины. Примеры аквапоринов и акваглицеропоринов включают: прокариотические аквапорины, такие как AqpZ; аквапорины млекопитающих, такие как Aqp1 и Aqp2; аквапорины растений, такие как внутренние белки плазмы (PIP - от англ. plasma intrinsic protein), внутренние белки тонопласта (TIP - от англ. tonoplast intrinsic protein), внутренние белки-нодулины (NIP от англ. nodulin intrinsic protein) и малые внутренние белки (SIP - от англ. small intrinsic protein), например, SoPIP2;1, PttPIP2;5 и PtPIP2;2; аквапорины дрожжей, такие как AQY1 и AQY2; и акваглицеропорины, такие как GIpF и Yfl054. Белки аквапориновые водные каналы могут быть получены в соответствии со способами, описанными в данном документе или как изложено в Karlsson et al. (FEBS Letters 537: 68-72, 2003) или как описано в Jensen et al. US 2012/0080377 A1 (например, см. Пример 6).
Термин «разделительная мембрана», в том виде, в котором он используется в данном документе, включает плоские листовые, трубчатые или половолоконные структуры, полезные для отделения воды и возможно определенных растворенных продуктов небольшого размера, включая анионы и катионы, от других растворенных продуктов, частиц, коллоидов и макромолекул. Примерами разделительных мембран являются «фильтрационные мембраны», такие как нанофильтрационные (NF - от англ. nanofiltration) мембраны, мембраны прямого осмоса (FO - от англ. forward osmosis) и мембраны обратного осмоса (RO - от англ. reverse osmosis). Один тип фильтрационныхх мембран представляет собой «тонкопленочную композитную (или TFC) мембрану, часто относящуюся к нанофильтрационной мембране и мембране обратного осмоса. TFC плоские листовые мембраны обычно получают посредством образования полиамидного слоя в результате межфазной полимеризации поверх полиэфирсульфонового или полисульфонового пористого слоя, который был отлит поверх нетканевой или тканевой подложки. Примеры способов получения TFC слоя на внутренней или внешней поверхности полых волокон раскрыты в WO 2014/108827, включенной в данный документ посредством ссылки. Полиамидный задерживающий слой образуется в результате межфазной полимеризации водного раствора амина с раствором хлорангидрида в органическом растворителе. TFC мембраны могут быть получены, как описано в WO 2013/043118 (Nanyang Technological University & Aquaporin A/S). Другой тип фильтрационных мембран представляет собой фильтрационные мембраны, образованные способом послойного (LbL) осаждения, как например, описано в Gribova et al. (Chem. Mater., 24: 854-869, 2012) и Wang et al. (Membranes, 5 (3): 369-384, 2015). Например, самоорганизующуюся наноструктуру можно вставлять или включать в полиэлектролитные многослойные пленки (РЕМ от англ. polyelectrolyte multilayer), как изложено на Фиг. 4 Gribova et al. (2012). Polyelectrolyte Multilayer Assemblies on Materials Surfaces: From Cell Adhesion to Tissue Engineering. Chemistry of Materials: A Publication of the American Chemical Society, 24 (5), 854-869. http://doi.org/10.1021/cm2032459.
HF модули известны в данной области и обычно имеют полиэфирсульфоновые волокна (PES - от англ. polyethersulfone) или волокна из другого подходящего пористого материала подложки, такого как полисульфон, полифениленсульфон, полиэфиримид, поливинилпирролидон и полиакрилонитрил, включая их сочетания и смеси, которые были модифицированы посредством образования тонкопленочного композитного слоя, например, в результате межфазной полимеризации. Кроме того, различные лигирующие вещества можно использовать при изготовлении материалов половолоконной подложки. Такие HF модули обычно используют в сферах применения, связанных с продуктами питания и напитками, таких как фильтрование пива и вина, в некоторых сферах применения, связанных с водой и сточными водами, включая повторное использование сточных вод и повторное использование воды бассейна, и для гемодиализа. Например, немецкая компания Membrana поставляет половолоконный модуль, содержащий несколько тысяч волокон с общей площадью поверхности 75 квадратных метров на модуль. Меньшие модули с обычно 1-2 квадратными метрами и около 8000-20000 волокон обычно используют в медицинских применениях, связанных с диализом (Fresenius Medical Care, Gambro). HF модули для применения в способе по изобретению обычно представляют собой микрофильтрационные модули или нанофильтрационные модули, имеющие предельный диапазон молекулярной массы от 20 до 50 кДа или такой, как 30-40 кДа. В принципе, все эти коммерческие продукты могут быть покрыты посредством межфазной полимеризации самоорганизующимися наноструктурами или композициями по настоящему изобретению, например, что приводит к получению тонкопленочного композитного слоя, в который включены аквапориновые водные каналы. Материал корпуса HF модулей по изобретению может представлять собой любой подходящий материал, обычно используемый для HF модулей, такой как поликарбонат, полисульфон, РОМ (от англ. "polyoxymethylene" - полиоксиметилен) (все из которых являются прозрачными), или можно использовать полипропилен, полиэтилен, ПВДФ (поливинилиденфторид) и нержавеющую сталь. Волокна могут быть заключены в корпус HF модуля с использованием общеизвестных полиуретанов или эпоксидных клеящих веществ и тому подобное. Трубчатые мембраны могут быть также покрыты таким же образом, как например модули, описанные в http://synderfiltration.com/learning-center/articles/module-confiqurations-process/tubular-membranes/.
Дополнительные примеры HF модулей, которые могут представлять собой TFC, модифицированные согласно изобретению, имеются на веб-сайтах производителей мембран, таких как:
http://www.membranafiltration.com/filtration-modules/documentation.cfm
http://www.kochmembrane.com/PDFs/KMS_Puron_Hollow_Fiber_PSH300_PSH600_PSH1800_Modul.aspx
http://www.kochmembrane.com/Membrane-Products/Hollow-Fiber/Ultrafiltration/PURON-Series.aspx
http://www.daicen.co.jp/english/membrane/kogata.html
http://www.spectrumlabs.com/filtration/hfmods.html
http://www.microdyn-nadir.com/en/Products/.
«Тонкопленочные композитные» или «TFC» мембраны, в том виде, в котором они используются в данном документе, могут быть получены, используя в качестве реагента амин, предпочтительно ароматический амин, такой как диамин или триамин, например, 1,3-диаминобензол (м-фенилендиамин, больше 99%, например, приобретенный у Sigma-Aldrich), в водном растворе, и реагент ацилгалогенид, также известный в данном документе как молекула, способная вступать в реакцию с амином, как например, ди- или тригидрохлорид, предпочтительно ароматический ацилгалогенид, например, бензол-1,3,5-трикарбонилхлорид (CAS №84270-84-8, тримезоилхлорид (ТМС - от англ. trimesoyl chloride), 98%, например, как приобретено у Sigma-Aldrich), растворенный в органическом растворителе, где указанные реагенты соединяются в реакции межфазной полимеризации, см. также Патент США №4277344, в котором подробно описано образование композитной мембраны, содержащей полиамид, наслаиваемый на пористую подложку мембраны, на поверхности мембраны-подложки, например, полиэфирсульфоновой мембраны. Бензол-1,3,5-трикарбонилхлорид растворяют в растворителе, таком как С6-С12 углеводород, включая гексан (больше 99,9%, Fisher Chemicals), гептан, октан, нонан, декан и т.д. (неразветвленные или разветвленные углеводороды), или другом низкоароматическом углеводородном растворителе, например, жидкость Isopar™ G, которую получают из сырья на нефтяной основе, обрабатываемого водородом в присутствии катализатора с получением жидкости со слабовыраженным запахом, основные компоненты которой включают изоалканы. Жидкость Isopar™ G: химическое название: углеводороды, С10-С12, изоалканы, меньше 2% ароматических соединений; CAS №: 64742-48-9, химическое название: нафта (нефть) тяжелой гидроочистки (из ExxonMobil Chemical). Альтернативы реагенту 1,3-диаминобензол включают диамины, такие как гексаметилендиамин, и т.д., а альтернативы реагенту бензол-1,3,5-трикарбонилхлорид включают диацилхлорид, адипоилхлорид и т.д., как известно в данной области. Интересно что, молекула, способная вступать в реакцию с амином, такая как ТМС, может образовывать конденсационные продукты или полимеры с аминогруппами в PAI полимерах в реакции межфазной полимеризации, например, как описано X. Feng et al. (Journal of Membrane Science, 472: 141-153, 2014), которые показали, как образуются последовательные слои ароматического полиамида на PES подложке в реакции межфазной полимеризации между PEI и ТМС с созданием нанофильтрационной мембраны.
Способ «послойного» или «LbL» осаждения: последовательная послойная (LbL) адсорбция противоположно заряженных полиэлектролитов, впервые упомянутая в 1966 году (Iler, Colloid Sci. 21: 569-594, 1966), является эффективным способом образования тонкой пленки и одной из общепринятых методик в материаловедении и технологии материалов (Decher et al., Phys. Chem. 95: 1430-1434, 1991). Так как движущей силой образования полиэлектролитных мультислоев является электростатическое притяжение, LbL методика подходит для изготовления сверхтонких бездефектных слоев с оптимальным составом и регулируемыми свойствами (Joseph et al., Polym. Chem. 5: 1817-1831, 2015.) с широким диапазоном применений. Одним примером регулируемых свойств является регулирование числа слоев и, таким образом, также регулирование общей толщины в диапазоне от нм до мкм (Jian et al., Adv. Mater 18: 1068-1072, 2006). LbL организацию полиэлектролита использовали для мембранных разделений, для многих пористых подложек мембран с разными размерами и топологией, которые могут адсорбировать первоначальный полиэлектролитный слой, такой как поли(эфирсульфон) (PES), поли(виниламин), поли(4-метил-1-пентен), полиамид, полиакрилонитрил (PAN - англ. polyacrylonitrile), поли(винил пирролидон), анодный оксид алюминия в плоских листовых, трубчатых или половолоконных структурах (Duong et al., J. Memb. Sci. 427: 411-421, 2013.). Широкое разнообразие полиэлектролитов может быть использовано для образования мультислоев, приводящих к получению мембран, и число бислоев и мембран-подложек можно также варьировать, как кратко изложено ниже в таблице (из таблицы 2.2 в Zhang, Y. (2013), где таблица среди прочего основана на Zhang, P. et al (2008)).
Термин «полиалкилимин» (PAI) включает любой олигомер или полимер или их смесь, который получен в результате полимеризации мономера алкилимин, имеющего по меньшей мере одну «иминную» группу (-N(H)-), включенную в него. В одном воплощении полиалкилимин представляет собой аминосодержащий полимер, включающий алкил- или алкенил-производные звенья (как например, С2-С8 алкил- или алкенил-производные звенья) в основной цепи. Предпочтительно, PAI содержит имин-производные звенья (аминогруппы) и алкил-производные звенья и наиболее предпочтительно PAI состоит из аминогрупп и алкил-производных звеньев. Предпочтительно, PAI выбран из группы, состоящей из поли(этиленимина), поли(пропиленимина), поли(пропил-со-этиленимина), поли(аллиламина) и их смесей. В любом случае PAI предпочтительно имеет среднемассовую молекулярную массу (Mw) примерно 500 или примерно 1000 или больше, как например, примерно 2000 или 3000 или 5000 или 10000 или 20000 или 40000 Да.
Конденсационные полимеры, описанные в данном документе, обычно получают в водном растворе посредством соединения молекул, способных вступать в реакцию с амином, с PAI. Молекулы, способные вступать в реакцию с амином, представляют собой молекулы, которые включают по меньшей мере один фрагмент, который будет реагировать с амином/имином с образованием ковалентной или ионной химической связи, предпочтительно ковалентной. Желательно, имеется от 0,1 или 0,2 до 0,6 или 0,8 или 1,0 или 1,1 или 1,2 или 2,0 или 2,5 или 3,0 способных вступать в реакцию с амином эквивалентов («"ARE" от англ.- amine-reactive equivalents) молекул, способных вступать в реакцию с амином, которые соединяют с PAI. Желательно, продукт может быть выделен из водного разбавителя в растворе или по существу в растворе при рН по меньшей мере 8. Продукт реакции конденсации между PAI и молекулой, способной вступать в реакцию с амином, представляет собой конденсационный полимер, как описано в данном документе, но в определенных воплощениях необязательно специально выделять конденсационный полимер из реакционной среды, следовательно, в определенных воплощениях полезность конденсационного полимера является такой же, как у всей смеси или конденсационного продукта.
Термин «полиэтиленимин» (PEI), в том виде, в котором он используется в данном документе, включает полимер с повторяющимися звеньями, состоящими из -NHCH2CH2- (аминогруппа и две метиленовые группы):

Линейные полиэтиленимины содержат вторичные амины, тогда как разветвленные полиэтиленимины могут содержать первичные, вторичные и третичные аминогруппы. Могут быть использованы различные линейные PEI с молекулярной массой, находящейся в диапазоне от 1000 Да или 1500 Да или 2000 Да или 2500 Да до 4000 Да или 5000 Да или 8000 Да или 10000 Да, а также разветвленные PEI с молекулярной массой, находящейся в диапазоне от 800 Да до 2000 Да. В общем, увеличение разветвления и молекулярной массы PEI, которое приводит к увеличению возможной загрузки белка в структурах, образованных PEI и белком, обычно сопровождается увеличением размера образованных структур. Учитывая, что для некоторых применений, таких как получение фильтрационных мембран, конечный размер образованных структур не должен предпочтительно превышать максимум 200 нм, можно рассматривать полную библиотеку доступных PEI с разными молекулярными массами, линейных и разветвленных. Для комплексов PEI-белок узкое распределение по размеру около 200 нм (250 нм-150 нм) в настоящее время считается самым многообещающим для включения в активный слой фильтрации. Для получения фильтрационных мембран LbL способом образованные структуры могут предпочтительно быть меньше чем 200 нм, как например, меньше чем 100 нм, как например, меньше чем 50, 20, 10 нм - все в зависимости от числа образовавшихся слоев, размеров свернутой структуры трансмембранного белка и положения(ий) образующихся структур в активном слое.
В настоящее время 4000, 5000 и 10000 разветвленные PEI (боковые группы плюс более доступные положительные заряды) хорошо функционируют. Все функциональные полимеры имеют концентрацию положительных зарядов в соответствии с литературой и наблюдениями. Чем более отрицательными являются самоорганизующиеся структуры, тем больше данные структуры, как измерено посредством DLS (от англ. - dynamic light scattering - динамическое рассеяние света). LDAO является очень слабым и имеет отрицательный заряд, как измерено дзета-потенциалом. Агрегатных структур белка не наблюдали, когда дзета-потенциал падал до примерно минус 30. Коллоидная система, где структуры поддерживаются в суспензии.
Сокращение Mn обозначает среднечисловую молекулярную массу. Под этим подразумевается общая масса полимера, деленная на число молекул полимера. Таким образом, Mn представляет собой молекулярную массу, взвешенную в соответствии с числовыми долями. Сокращение Mw означает среднемассовую молекулярную массу. Молекулярная масса, взвешенная в соответствии с массовыми долями. Молекулярную массу можно измерять посредством гель-проникающей хроматографии (GPC - от англ. gel permeation chromatography) в тетрагидрофуране. Коэффициент полидисперсности, определенный как Mn/Mw, будет определяться по кривым элюирования, полученным в GPC.
Размер наноструктур: предпочтительно, наноструктуры по настоящему изобретению имеют размер частиц от примерно 10 нм диаметром вплоть до 200 нм - примерно 250 нм диаметром в зависимости от точных компонентов наноструктур и условий, используемых для их образования. Специалисту в данной области будет ясно, что размер частиц относится к диапазону размеров, и число, приведенное в данном документе, относится к среднему диаметру, чаще всего среднему гидродинамическому диаметру того диапазона частиц. Композиции наноструктур по настоящему изобретению содержат наночастицы, имеющие средние диаметры от примерно 250 нм до примерно 200 нм или меньше, в некоторых случаях средние диаметры, которые меньше чем 200 нм, такие как меньше чем 180 нм или меньше чем примерно 150.
Примеры молярных отношений трансмембранного белка к PAI (как например PEI) зависят от используемого трансмембранного белка, типа используемого PAI, степени или количества разветвленного PAI, по сравнению с линейным PAI, и желательного размера наноструктуры. В качестве примера, для наноструктур PEI и аквапориновых водных каналов, молярное отношение трансмембранного белка к PEI может составлять от 1:200 до 1:2000, как например от 1:400 до 1:1500, как например от 1:600 до 1:1000.
Примеры линейных полиэтилениминов, которые могут быть использованы в соответствии с настоящим изобретением, включают: полиэтиленимин, линейный, 764582 ALDRICH (средняя Mn 5000, PDI (от англ. polydispersity index - коэффициент полидисперсности) меньше 1,2); полиэтиленимин, линейный, 764604 ALDRICH, (средняя Mn 2500, PDI меньше 1,2); и полиэтиленимин, линейный, 765090 ALDRICH, (средняя Mn 10000, PDI меньше или равен 1,2). Примерами разветвленного полиэтиленимина являются: полиэтиленимин, разветвленный, 407819 ALDRICH (средняя Mw 800 по LS, средняя Mn 600 по GPC), Полиэтиленимин, разветвленный, 408727 ALDRICH (средняя Mw приблизительно 25000 по LS, средняя Mn приблизительно 10000 по GPC). Polysciences, Inc также является поставщиком некоторых линейных полиэтилениминов, полиаллиламина Mw приблизительно 17000, 479136 ALDRICH, CAS номер 30551-89-4, линейная формула [CH2CH(CH2NH2)]n.
BASF Lupasol®, см. также http://product-finder.basf.com/group/corporate/product-finder/de/brand/LUPASOL (по состоянию на 8 февраля 2016 года). Примерами дендритных PEI являются следующие: полиэтиленимин, дендритный, 5000 Да и 25000 Да (Nanopartica) и полиэтиленимин, дендритный, 5000 Да, функционализированный алкан (Nanopartica).
Термин «самоорганизующиеся», в том виде, в котором он используется в данном документе, относится к способу, посредством которого наноструктуры, образованные из компонентов в виде полиалкиленимина, такого как полиэтиленимин, и компонентов в виде трансмембранного белка, образуют организованные, упорядоченные структуры в результате ионных взаимодействий или взаимодействий на основе зарядов между данными компонентами, без внешнего направления. В настоящем изобретении «самоорганизующийся» является синонимом термина «молекулярная самоорганизация». Общие свойства самоорганизующихся систем описаны на https://en.wikipedia.org/wiki/Self-assembly#Interactions [по состоянию на 8 февраля 2016 года]. В настоящем изобретении самоорганизующиеся наноструктуры, образованные компонентами в виде полиэтиленимина и компонентами в виде (отрицательно) заряженного белка, как считается, определяются ионными взаимодействиями между положительно заряженными молекулами полиэтиленимина и отрицательно заряженными аминокислотными остатками компонента-белка.
Термин «наноструктуры», в том виде, в котором он используется в данном документе, относится к частицам, имеющим нонометрический масштаб, и не предназначен для выражения какого-либо ограничения конкретной формой. В частности, термин «наноструктура» охватывает наносферы, нанотрубки, наноящики, нанокластеры, наностержни и тому подобное. В определенных воплощениях наноструктуры могут представлять собой наночастицы и/или ядра наночастиц, имеющие обычно многогранную или сферическую геометрию.
Термин «размер», в том виде, в котором он используется в данном документе, относится к гидродинамическому диаметру самоорганизующихся структур.
ПРИМЕРЫ
Настоящее изобретение дополнительно проиллюстрировано со ссылкой на следующие неограничивающие примеры.
Экспериментальный раздел
Оборудование
Хроматограф для жидкостной экспресс-хроматографии белков (FPLC - от англ. fast-protein liquid chromatography)  Start, соединенный с ноутбуком, с использованием операционной системы Unicorn.
Start, соединенный с ноутбуком, с использованием операционной системы Unicorn.
Вакуумный поток.
Стерильная 0,45 мкм чашка вакуум-фильтра.
15 мл РР пробирки.
Сокращения:
CV: объем колонки.
AQP: Аквапорин Z из E.coli.
LDAO: N.N-диметилдодециламин N-оксид (#40234, Sigma).
PAGE: Электрофорез в полиакриламидном геле.
Материалы и химические реактивы:
Материал для гель-фильтрации HisTrap (Ni сефароза Ni Sepharose 6 Fast Flow #17-5318-03, GE Healthcare), наполняющий колонку XK16/20 (GE Healthcare) при известном объеме, или предварительно наполненная 1 мл, 5 мл колонка HisTrap.
AQP связывающий буфер: 20 мМ фосфат натрия, 300 мМ NaCl, 20 мМ имидазол, 10% глицерин, 0,2% LDAO, рН 8,0.
AQP связывающий буфер, не содержащий LDAO: 20 мМ фосфат натрия, 300 мМ NaCl, 20 мМ имидазол, 10% глицерин, рН 8,0.
AQP связывающий буфер, не содержащий имидазол: 20 мМ фосфат натрия, 300 мМ NaCl, 10% глицерин, 0,2% LDAO рН 8,0.
AQP элюирующий буфер: 20 мМ фосфат натрия, 300 мМ NaCl, 200 мМ имидазол, 10% глицерин, 0,2% LDAO, рН 8,0, ddH2O.
Общая очистка аквапорина и получение маточного раствора аквапорина
Рекомбинантное получение Аквапорина Z
Все типы и варианты белков - аквапориновых водных каналов, включая акваглицеропорины, можно использовать в изготовлении мембран и композиций согласно данному изобретению, также см. способы, описанные в WO 2010/146365. Репрезентативные примеры включают белок аквапорин шпината SoPIP2;1 и бактериальный аквапорин-Z из Е. coli.
Функциональный аквапорин-Z сверхпродуцировали в бактериальных культурах штамма Е. coli BL21(DE3) в виде His-меченного белка с сайтом расщепления вируса гравировки табака. Слитый белок имеет 264 аминокислоты и Mw 27234 Да. Геномную ДНК из E. coli DH5 использовали в качестве источника для амплификации гена AqpZ. Ген AqpZ амплифицировали с использованием ген-специфичных праймеров с добавлением сайта расщепления вируса гравировки табака (TEV); ENLYFQSN на N-конце AqpZ. Амплифицированный AqpZ расщепляли ферментом NdeI и BamHI и затем лигировали в аналогично расщепленный 6-His меченный экспрессионный вектор ДНК pET28b. Позитивные клоны проверяли посредством ПЦР-скрининга. Аутентичность конструкций затем подтверждали ДНК-секвенированием.
Штамм Е. coli BL21(DE3) использовали для экспрессии данного белка. Бульонные культуры Луриа, содержащие 50 мкг/мл канамицина, инкубировали в течение 13-16 часов при 37°С, разбавляли 100-кратно в свежем бульоне LB и размножали до плотности примерно 1,2-1,5 (OD (от англ. optical density - оптическая плотность) при 600 нм). Экспрессию рекомбинантного белка индуцировали добавлением 1 мМ IPTG (от англ. isopropylthiogalactoside - изопропилтиогалактозид) в течение 3 часов при 35°С перед центрифугированием. Собранные клетки ресуспендировали в ледяном связывающем буфере (20 мМ Tris рН 8,0, 50 мМ NaCl, 2 мМ β-меркаптоэтанол, 10% глицерин) в присутствии 0,4 мг/мл лизоцима, 50 единиц бензоназы и 3% н-октил β-D-глюкопиранозида. Образец пять раз подвергли циклам лизиса в микрофлюидайзере при 12000 Па. Нерастворимое вещество осаждали посредством 30 минутного центрифугирования при 40000×g. Супернатант пропускали через быстропроточную колонку с сефарозой Q-Sepharose fast flow (Amersham Pharmacia), и собирали элюат. Фракцию элюата заливали NaCl до 300 мМ перед загрузкой на предварительно уравновешенную колонку Ni-NTA. Колонку промывали 100 объемами колонки промывочного буфера (20 мМ Tris рН 8,0, 300 мМ NaCl, 25 мМ имидазол, 2 мМ β-меркаптоэтанол, 10% глицерин) с удалением неспецифично связанного вещества. Вещество, связанное с агарозой Ni-NTA, элюировали пятью объемами слоя элюирующего буфера (20 мМ Tris рН 8,0, 300 мМ NaCl, 300 мМ имидазол, 2 мМ β-меркаптоэтанол, 10% 15 глицерин, содержащий 30 мМ н-октил β-D-глюкопиранозид). AqpZ дополнительно очищали посредством анионообменной хроматографии; колонка monoQ (GE healthcare). Смесь образцов разбавляли и концентрировали для доведения концентрации соли и имидазола до приблизительно 10 мМ с помощью концентратора Amicon, пороговое значение для мембраны 10000 Да, перед загрузкой на колонку MonoQ. Буфер, используемый во время анионообменной хроматографии, выглядел следующим образом: (А) 20 мМ Tris рН 8,0, 30 мМ OG, 10% глицерин и (В) 20 мМ 20 Tris рН 8,0, 1 М NaCl, 30 мМ OG, 10% глицерин. Объединяли фракции элюируемых пиков, содержащие AqpZ, из ионообменной колонки. Очищенный экстракт AqpZ хранили замороженным при -80°С.
Способ очистки белка аквапорин
Партию замороженного экстракта белка аквапорин, такого как аквапорин Z, AQPZ, например, из ферментации Е. coli, собирали и обрабатывали следующим образом для применения в экспериментах по получению и характеристики мембран, содержащих наноструктуры белок-PAI по настоящему изобретению.
За одни сутки до эксперимента по очистке экстракт AQP (хранящийся в морозильной камере при -80°С) размораживали на льду или в холодильнике при 4°С. Порции буферов и ddH2O подготавливали при 4°С. Экстракт AQP перемешивали в достаточно охлажденном лабораторном стакане на ледяной бане посредством магнитной мешалки до растворения какого-либо осадка. 1,5 Объема предварительно охлажденного AQP связывающего буфера, не содержащего LDAO, постепенно добавляли в 1 объем солюбилизированного экстракта (используя еще 0,5 объема буфера для промывания пробирок с экстрактом и чашки фильтра), хорошо перемешивали и фильтровали через стерильную 0,45 мкм чашку вакуум-фильтра. Вакуум прикладывали к чашке фильтра для того, чтобы избежать избыточного пенообразования, и фильтрат помещали на лед для использования в пределах 2 часов.
Колонку Histrap уравновешивали стерильной водой с последующим уравновешиванием AQP связывающим буфером при КТ (комнатная температура). Скорость потока устанавливали на уровне 1 мл/мин (для 1 мл предварительно наполненной колонки) или 2,5 мл/мин (для 5 мл предварительно наполненной колонки и самонаполняющейся колонки). Экстракт, разведенный 3 раза (на ледяной водяной бане), загружали на колонку Histrap с использованием программы  Скорость потока устанавливали на уровне 1 мл/мин (для 1 мл предварительно наполненной колонки) или 2,5 мл/мин (для 5 мл предварительно наполненной колонки и самостоятельно наполняющейся колонки). Объем загрузки составлял меньше чем 30 мл/мл смолы. Элюат экстракта на ледяной водяной бане собирали и хранили при 4°С для дальнейшего применения. Колонку промывали 10 CV (объем колонки) ледяного AQP связывающего буфера. Скорость потока устанавливали на уровне 2,5 мл/мин (для 5 мл предварительно наполненной колонки и самонаполняющейся колонки) или устанавливали на уровне 1 мл/мин для 1 мл предварительно наполненной колонки. Белок AQP элюировали ледяным AQP элюирующим буфером (10 объемов колонки) при скорости потока 2,5 мл/мин с использованием программы
Скорость потока устанавливали на уровне 1 мл/мин (для 1 мл предварительно наполненной колонки) или 2,5 мл/мин (для 5 мл предварительно наполненной колонки и самостоятельно наполняющейся колонки). Объем загрузки составлял меньше чем 30 мл/мл смолы. Элюат экстракта на ледяной водяной бане собирали и хранили при 4°С для дальнейшего применения. Колонку промывали 10 CV (объем колонки) ледяного AQP связывающего буфера. Скорость потока устанавливали на уровне 2,5 мл/мин (для 5 мл предварительно наполненной колонки и самонаполняющейся колонки) или устанавливали на уровне 1 мл/мин для 1 мл предварительно наполненной колонки. Белок AQP элюировали ледяным AQP элюирующим буфером (10 объемов колонки) при скорости потока 2,5 мл/мин с использованием программы  Объем фракции устанавливали на 10 мл и сбор начинали в 15 мл РР пробирки после 0,5-1 CV.
Объем фракции устанавливали на 10 мл и сбор начинали в 15 мл РР пробирки после 0,5-1 CV.
Элюированные фракции закрывали пробкой и хранили на льду или при 4°С. Чистоту и конформацию AQP исследовали посредством денатурации и нативного PAGE анализа, соответственно. Концентрацию белка измеряли с помощью Nanodrop. Элюат экстракта при необходимости может быть обработан второй и третий раз с получением композиции AQP подходящего качества.
Когда проводят анализы качества AQP, концентрация белка может быть доведена до 5 мг/мл посредством добавления ледяного AQP связывающего буфера, не содержащего имидазол, содержащего 2% LDAO. Наконец, AQP стерилизовали посредством фильтрации через 0,45 мкм стерилизованную чашку и хранили при 4°С в холодильнике для использования в течение месяца или еще хранили при -80°С в морозильной камере.
Пример 1. Получение и тестирование на основе остановленного потока наночастиц PEI-Аквапорин-Z
Поли(этиленимин) с MW 4000 Да (линейный) (PEI) приобретали в Sigma Aldrich и использовали в состоянии поставки без какой-либо дополнительной очистки. 10 мМ фосфатно-солевой буферный раствор (PBS - от англ. phosphate saline solution) (рН 7,2,136 мМ NaCl, 2,6 мМ KCl) получали посредством растворения 8 г NaCl, 0,2 г KCl, 1,44 г Na2HPO4 и 0,24 г KH2PO4 в 800 мл MilliQ-очищенной H2O, доводя рН до 7,2 HCl и доводя объем до 1 л. N,N-диметилдодециламин N-оксид BioXtra (лаурилдиметиламин N-оксид) (чистота 99%), LDAO приобретали в Sigma Aldrich. Самоорганизующиеся структуры на основе PEI получали способом прямого растворения. Для этого, сначала получали 100 мл раствора 5 мг/мл PEI в фосфатно-солевом буферном растворе с рН 7,2 посредством растворения 500 мг порошка PEI в 100 мл PBS с рН 7,2. Далее, 100 мл 5 мг/мл PEI непосредственно смешивали с 1,5 мг в виде 0,3 мл очищенного маточного раствора Аквапорина Z (AQPZ), 5 мг/мл, в 2% LDAO, что соответствовало молярному отношению смеси данных двух компонентов AQPZ/PEI 1/800. Смесь PEI-AQPZ перемешивали в течение ночи при 170 оборотах в минуту, в течение ночи не больше чем 20 часов (но не меньше чем 12 ч).
После перемешивания на следующий день смесь переносили в 100 мл стеклянную бутыль и хранили при комнатной температуре. Смесь (жидкая композиция - или композиция самоорганизующихся структур на основе PEI-AQPZ) можно хранить в течение более чем двух месяцев. После переноса в стеклянную бутыль для хранения размер и проницаемость самоорганизующихся структур на основе PEI-AQPZ определяли посредством динамического рассеяния света, используя ZetaSizer NanoZs из Malvern, и остановленного потока, используя Bio-Logic SFM 300.
Размер самоорганизующихся структур на основе PEI-AQPZ определяли как 114 плюс/минус 20 нм (80%) генеральной совокупности, в то время как 20% имело размер около 147 плюс/минус 15 нм. Кроме того, дзета-потенциал определяли для самоорганизующихся структур на основе PEI-AQPZ как 18,4 мВ, что указывало на положительный заряд данных структур.
Данные по проницаемости, полученные на основе измерений остановленного потока в 0,3 М NaCl в качестве осмолита, приводят к коэффициенту быстрой диффузии Ki 1605 с-1, соответствующему осмотической проницаемости Pf 22 мкм/сек и проницаемости 11 ЛМЧ/бар (л/м2/ч)/бар).
Термостойкость самоорганизующихся структур на основе PEI определяли путем нагревания 5 мл в течение 10 мин при разных температурах, находящихся в интервале от 30 до 100°С, и их размер и водопроницаемость дополнительно определяли посредством динамического рассеяния света и измерений остановленного потока.
Размеры самоорганизующихся структур после тепловой обработки представлены в Таблице 1.
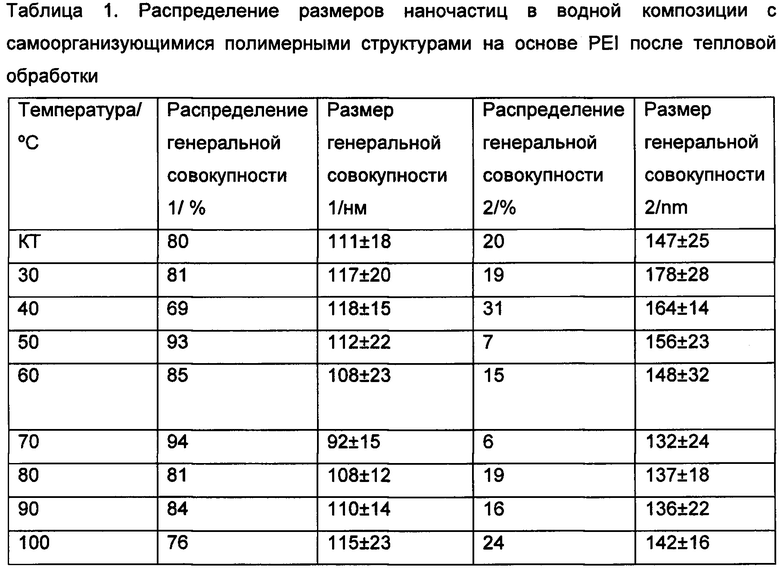
Как видно из Таблицы 1, воздействие температур не влияет на размер образованных структур, хотя легкое уменьшение на примерно 10 нм наблюдается с 60°С градусов и выше. Данное уменьшение не влияет на функциональность наноструктур, а также аквапориновых водных каналов, образующих в них комплекс при включении в активный слой фильтрационных мембран.
Проницаемость в образованных наночастицах после тепловой обработки в присутствии AQPZ определяли на основе измерений остановленного потока.
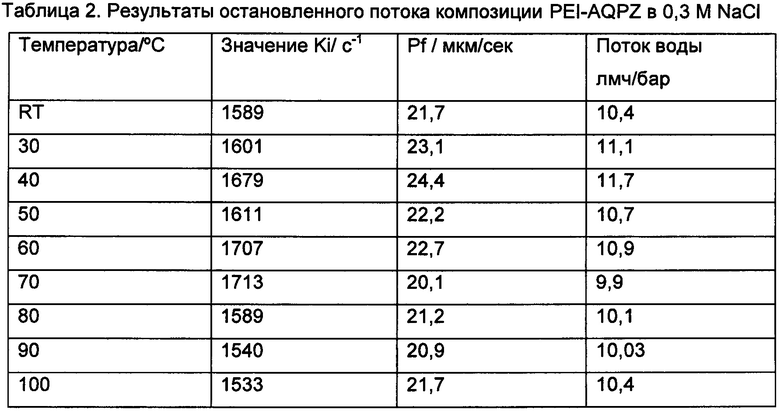
С точки зрения водопроницаемости в данном конкретном эксперименте никаких значимых изменений не наблюдается вплоть до 100°С, небольшое колебание как проницаемости, так и потока воды, коррелирует с изменением размера.
Пример 2. Получение и тестирование PIE наноструктур с AQP9 и AQP12
Аналогично, самоорганизующиеся структуры на основе PEI с человеческими аквапоринами, более конкретно аквапорином-9 и аквапорином-12, получали способом прямого растворения. Для этого сначала получали 100 мл раствора 5 мг/мл PEI в фосфатно-солевом буфере с рН 7,2 посредством растворения 500 мг порошка PEI в 100 мл PBS с рН 7,2. Затем, 100 мл 5 мг/мл PEI непосредственно смешивали с 1,5 мг в виде 0,15 мл очищенного маточного раствора Аквапорина-9, 10 мг/мл, и 0,17 мл очищенного маточного раствора Аквапорина-12, 9 мг/мл, в 2% LDAO, что соответствовало молярному отношению смеси данных двух компонентов AQP/PEI 1/800. Смесь PEI AQP перемешивали в течение ночи при 170 оборотах в минуту, в течение ночи не больше чем 20 часов (но не меньше чем 12 ч).
После перемешивания на следующий день смесь переносили в 100 мл стеклянную бутыль, хранили при комнатной температуре и измеряли на следующий день. Размер и проницаемость самоорганизующихся структур PEI-AQPZ определяли посредством динамического рассеяния света с использованием ZetaSizer NanoZs из Malvern и остановленного потока с использованием Bio-Logic SFM 300.
Размер самоорганизующихся структур на основе PEI-AQP9 определяли как 91 плюс/минус 15 нм (85%) генеральной совокупности, в то время как 15% имело размер около 325 плюс/минус 32 нм. Кроме того, дзета-потенциал определяли для самоорганизующихся структур PEI-AQP как 17,9 мВ, что указывало на положительный заряд данных структур.
Данные по проницаемости, полученные на основе измерений остановленного потока в 0,3 М NaCl в качестве осмолита, приводят к коэффициенту быстрой диффузии Ki 1326 с-1.
Размер самоорганизующихся структур на основе PEI-AQP12 определяли как 244 плюс/минус 36 нм (92%) генеральной совокупности, в то время как 8% имело размер около 3 плюс/минус 2 нм. Кроме того, дзета-потенциал определяли для самоорганизующихся структур PEI-AQP как 17,3 мВ, что указывало на положительный заряд данных структур.
Данные по проницаемости, полученные на основе измерений остановленного потока в 0,3 М NaCl в качестве осмолита, приводят к коэффициенту быстрой диффузии Ki 1432 с-1.
Пример 3. Получение и тестирование наноструктур с PEI 800b и 1000b
Аналогичным образом, как и для самоорганизующихся структур на основе PEI 4000 Да с AQPZ, и разветвленный PEI 800 и разветвленный PEI 10000 получали способом прямого растворения. Для этого, сначала получали 100 мл раствора 5 мг/мл разветвленного PEI 800 или разветвленного PEI 10000 в фосфатно-солевом буфере с рН 7,2 посредством растворения 500 мг порошка разветвленного PEI 800 или разветвленного PEI 10000 в 100 мл PBS с рН 7,2. Затем, 100 мл 5 мг/мл PEI непосредственно смешивали с 1,5 мг в виде 0,3 мл очищенного маточного раствора AqpZ, 5 мг/мл, в 2% LDAO, что соответствовало молярному отношению смеси данных двух компонентов AQP/PEI 1/800. Смеси PEI AQP перемешивали в течение ночи при 170 оборотах в минуту, в течение ночи не больше чем 20 часов (но не меньше чем 12 ч). После перемешивания на следующий день смесь переносили в 100 мл стеклянную бутыль, хранили при комнатной температуре и измеряли на следующий день. Размер и проницаемость самоорганизующихся структур PEI-AQPZ определяли посредством динамического рассеяние света с использованием ZetaSizer NanoZs от Malvern и остановленного потока с использованием Bio-Logic SFM 300.
Размер самоорганизующихся структур на основе PEI 800 b-AQPZ определяли как 180 плюс/минус 23 нм (100%) генеральной совокупности. Кроме того, дзета-потенциал определяли для самоорганизующихся структур на основе PEI-AQP как 14 мВ, что указывало на положительный заряд данных структур.
Данные по проницаемости, полученные на основе измерений остановленного потока в 0,3 М NaCl в качестве осмолита, приводят к коэффициенту быстрой диффузии Ki 747 с-1.
Размер самоорганизующихся структур на основе PEI 10000 b-AQPZ определяли как 220 плюс/минус 37 нм (100%) генеральной совокупности. Кроме того, дзета-потенциал определяли для самоорганизующихся структур на основе PEI-AQP как 4 мВ, что указывало на положительный заряд данных структур.
Данные по проницаемости, полученные на основе измерений остановленного потока в 0,3 М NaCl в качестве осмолита, приводят к коэффициенту быстрой диффузии Ki 1516 с-1.
Термостойкость самоорганизующихся структур на основе PEI определяли путем нагревания 5 мл в течение 10 мин при разных температурах, находящихся в диапазоне от 30 до 100°С, и их размер и водопроницаемость дополнительно определяли посредством динамического рассеяния света и измерений остановленного потока. Для самоорганизующихся наноструктур AQPZ на основе PEI 600 b размер не меняется вплоть до 50°С и увеличивается на более чем 200 нм с 50°С и выше, в то время как значения Ki изменяются на меньше чем 100 с-1. Для самоорганизующихся наноструктур AQPZ на основе PEI 10000b размер не меняется вплоть до 40°С, и увеличивается на больше чем 150 нм с 40°С и выше, в то время как значения Ki изменяются на меньше чем 100 с-1.
Пример 4. Флуоресцентная корреляционная спектроскопия
Флуоресцентное мечение трансмембранного белка AQPZ осуществляли посредством реакции связывания N-гидроксисукцинимидного эфира (NHS-эфир) с первичными аминами на белках. N-конец белка AQPZ содержит только гидрофильные аминокислотные остатки. Таким образом, он доступен для реакции мечения в водной фазе и он не погружен в гидрофобную часть мембранного белка. В данном случае использовали флуоресцентный краситель Oregon Green 488 (OG488).
Для мечения (также см. Itel et al., Nano. Lett., 15 (6): 3871-3878, 2015) 1 мг маточного раствора AQPZ смешивали с сукцинимидил эфиром Oregon Green 488 (OG488, 10 мг/мл в ДМСО (диметилсульфоксид)) при 10-кратном молярном избытке и инкубировали на льду при перемешивании в течение 3 часов в темноте. После удаления непрореагировавшего красителя путем центрифугирования через 2000 Да фильтры меченный AQPZ в дальнейшем использовали для восстановления в самоорганизующихся наноструктурах на основе линейного PEI 4000 Да. На основе яркости молекул число тетрамеров AQPZ на PEI наноструктуру определяли как 8 плюс/минус 1. Свободного белка не выявляли. Для PEI 600 b и 10000 b число тетрамеров AQPZ на PEI наноструктуру определяли как 4 плюс/минус 1 (PEI 600 b) и 5 плюс/минус 2 (PEI 1000 b).
Пример 5. Характеристика посредством кругового дихроизма
Конформация белка образованных самоорганизующихся наноструктур может быть охарактеризована посредством кругового дихроизма (CD - от англ. circular dichroism). CD является подходящим способом быстрого определения вторичной структуры (α-спираль и β-лист) и свойств сворачивания белков, которые определяют их функциональность. CD представляет собой спектроскопическую методику, где CD спектры молекул измеряют в диапазоне длин волн (Greenfield NJ, Nat Protoc. 2006; 1 (6): 2876-2890). Для этого, жидкую композицию самоорганизующихся структур на основе PEI-AQPZ, как получено в соответствии с Примером 1, помещали в измерительную кювету, и CD спектры записывали и анализировали для оценивания вторичной структуры включенного AQPZ, соответственно его функциональности. На Фиг. 1 показан профиль кругового дихроизма AQPZ в самоорганизующихся наноструктурах на основе PEL Вторичная структура AQPZ; На Фиг. 1 AQPZ, воссозданный в самоорганизующихся наноструктурах на основе PEI, демонстрировал отрицательную полосу эллиптичности при 222 нм, по сравнению с 208 нм (отношение 222/208 нм, равное 1,15), аналогично тому, как сообщается для аквапорина шпината, воссозданного в общем липиде E. coli, что указывает на то, что данный белок не является несвернутым (Hansen et al., Biochimica et Biophysica Acta, 1808: 2600-2607, 2011).
Пример 6. Самостоятельное получение TFC FO фильтрационных мембран
Данные мембраны получали в соответствии со стадиями, изложенными ниже:
а) растворить MPD в воде MilliQ с получением 2,5% (масс./масс.) концентрации, см. ниже;
b) растворить ТМС в Isopar до конечной концентрации 0,15% масс./об.;
c) покрыть мембрану прямоугольной формы, например, PES мембрану 5,5 см × 11 см Membrana 1FPH примерно 20 мл/м2 мембраны раствора MPD и оставить на 30 секунд при легком перемешивании;
d) сушить неактивную сторону (задняя сторона) посредством лабораторной промокательной бумаги (например, Kim-Wipe) в течение 5-10 секунд;
e) положить мембрану на стеклянную пластинку и аккуратно сушить N2 до тех пор, пока поверхность не превратится из блестящей в матовую;
f) наложить ленту вокруг краев мембраны (приблизительно 1 мм);
g) поместить стеклянную пластинку с мембраной, обмотанной лентой, в стеклянный или металлический контейнер, добавить примерно 155 мл/м2 мембраны TMC-Isopar к одному концу и осторожно покачать взад и вперед в течение 30 секунд.
h) вынуть стеклянную пластинку из резервуара и сушить N2 в течение 10-15 секунд.
После удаления ленты мембрану можно переносить в MilliQ вновь образованной активной стороной вверх и хранить влажной при обращении на последующих стадиях, при необходимости.
Расчет раствора MPD:
Отвесить 1,05 г MPD и растворить в 35 мл MilliQ. Добавить 7 мл композиции PEI-AQPZ, полученной, как описано выше (3 мг PEI/мл). Раствор хранить покрытым инертным газом (Ar или N2) сколько это представляется возможным.
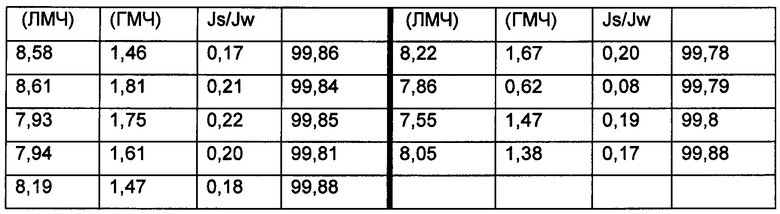
TFC мембраны с PEI-AQPZ размером 5,5 см × 11 см затем устанавливали в FO ячейку Sterlitech CF042 (www.sterlitech.com) и подвергали испытаниям продолжительностью 60 минут (5 мембран) и испытаниям продолжительностью 900 минут (4 мембраны) в режиме FO с использованием деионизированной (MilliQ) воды в качестве подаваемого компонента и 1 М водного раствора NaCl в качестве вытягивания и скоростей подачи и вытягивания 268 мл/мин. Результаты показаны ниже в Таблице 3 с воспроизводимыми высокими водопроницаемостями, Jw (ЛМЧ л/м2/ч), низким задерживанием соли при обратном осмосе, Js (ГМЧ=г/м2/ч) и очень высоким задерживанием подаваемого индикатора 5 мкМ кальцеина Rca %.

Пример 7. FO фильтрационные мембраны, полученные посредством экспериментальной установки
TFC слой получали на PES мембране-подложке с использованием экспериментальной установки для нанесения покрытия.
a) раствор MPD/вода получали в результате растворения MPD в воде MilliQ с получением 2,5% (масс./масс.) концентрации.
b) раствор аквапорин/МРО/вода получали в результате растворения 6,25 г MPD, 10 мл композиции, 240 мл Di воды.
c) ТМС растворяли в Isopar до конечной концентрации 0,15% масс./об.
d) рулон мембраны-подложки Membrana 1FPH устанавливали на разматывателе установки.
e) мембрану продевали через покрытие.
f) промывочную ванну наполняли Di водой.
g) запускали процесс нанесения покрытия (при 0,6 м/мин):
- мембрану разматывали с разматывателя;
- затем пропитывали в растворе MPD/вода в фуляровой ванне;
- поверхностную воду удаляли посредством воздушного ножа (воздух 0,5 бар (50 кПа));
- раствор аквапорин/MPD/вода наносили посредством щелевой экструзионной головки при скорости нагнетания 1,2 мл/мин;
- поверхностную воду удаляли посредством воздушного ножа для обеспечения бескапельной поверхности перед межфазной полимеризацией (0,75 бар (75 кПа));
- TMC/Isopar наносили посредством щелевой экструзионной головки при 4,2 мл/мин для начала межфазной полимеризации;
- Isopar высыхал на поверхности мембраны на воздухе окружающей среды;
- оставшиеся химические вещества удаляли в промывочной ванне;
- мембрану с покрытием сворачивали активной стороной, обращенной к рулону.
h) мембрану с покрытием пропускали через конечную стадию сушки.
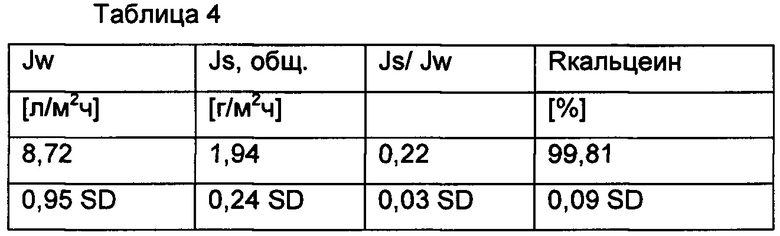
5 Мембран с покрытием нарезали формами 5,5 см × 11 см и по отдельности помещали в FO ячейку Sterlitech CF042 и заливали на 200 минут 5 мкМ кальцеином в подаваемом растворе DI воды и 1 М вытягивающем растворе NaCl. Усредненные результаты со стандартным отклонением показаны в Таблице 4.
Пример 8. FO фильтрационные мембраны с высокой проницаемостью и высоким задерживанием, полученные посредством экспериментальной установки
Используя подход, похожий на подход, описанный в Примере 4, TFC слой получали на двух типах микропористых PES мембран, имеющих нетканевую полипропиленовую основу, адаптированную для высокой водопроницаемости и для высокого задерживания солей, соответственно. Первый рулон микропористой PES мембраны устанавливали на одном конце экспериментальной установки и передавали на последующие стадии с получением сверху слоя межфазной полимеризации. Мембрану пропускали через резервуар, содержащий 2%-ный водный раствор MPD, содержащий 7 мл/100 мл композиции на основе PEI-AQP (полученной в соответствии с Примером 1), 3% ε-капролактам и 0,1% SDS (от англ. sodium dodecyl sulfate - додецилсульфат натрия). Затем мембрану подвергали непродолжительной сушке сжатым воздухом и пропускали через установленную наверху щелевую экструзионную головку для взаимодействия с 0,20% ТМС в растворе Isopar с образованием активного верхнего слоя.
Второй рулон микропористой PES мембраны устанавливали на одном конце экспериментальной установки и переносили через резервуар с получением сверху слоя межфазной полимеризации. Указанный резервуар содержал водный 2,75%-ный раствор MPD, содержащий 7 мл/100 мл композиции на основе PEI-AQP (полученной в соответствии с Примером 1). Затем мембрану подвергали непродолжительной сушке сжатым воздухом и пропускали через установленную наверху щелевую экструзионную головку для взаимодействия с 0,25% ТМС в растворе Isopar с образованием активного верхнего слоя. Участки данных двух типов полученной мембраны нарезали прямоугольной формой 5,5 см × 11 см, затем устанавливали в камеру Sterlitech CF042 и подвергали 5 испытаниям продолжительностью 60 минут в режиме PRO с использованием деионизированной воды в качестве подаваемого раствора и 1 М водного раствора NaCl в качестве вытягивающего раствора и скоростей подачи и вытягивания 268 мл/мин. Результаты показаны ниже в Таблице 5, где измеряли устойчивую высокую водопроницаемость с приемлемо низкой проницаемостью в отношении солей при обратном осмосе для высокопроницаемой мембраны, и измеряли устойчивую низкую проницаемость в отношении солей при обратном осмосе с приемлемо высокой водопроницаемостью для мембраны с высоким задерживанием.

Пример 9. Самостоятельно полученные TFC фильтрующие мембраны на основе PEI-AQPZ для RO низкого давления
Мембраны получали в соответствии со стадиями, изложенными ниже:
a) Предоставить мембрану-подложку, например, PES нетканевую, имеющую пальцеподобную структуру, размер 5,5 см × 11 см.
b) Смешать 3% масс. MPD с 3% масс. ε-капролактамом, 0,5% масс. NMP (от англ. N-Methyl-2-pyrrolidone - N-метил-2-пирролидон) и 93,5% масс. DI водой с получением раствора.
c) Добавить 0,1 мг/мл самоорганизующихся наноструктур PEI-AQPZ с получением суспензии.
d) Инкубировать суспензию из b) в течение 2 часов.
e) Приготовить раствор ТМС из 0,09% масс. ТМС, 0,9% масс. ацетона и 99,01% масс. Isopar.
f) Нанести покрытие погружением мембраны-подложки в суспензию d) на 30 секунд.
g) Применить сушку посредством воздушного ножа.
h) Добавить раствор ТМС из d) для межфазной полимеризации.
i) Продолжить 2 мин сушкой в вытяжном шкафу.
Возможная последующая обработка TFC мембраны в соответствии со следующими стадиями:
4 мин 65°С 10% лимонная кислота
2 мин DI вода
1 мин 5% IPA (от англ. Isopropyl alcohol - изопропанол)
2 мин DI вода
1 мин 0,1%NaOCl
2 мин DI вода
1 мин 0,2% NaHSO3
Получали четыре мембраны и устанавливали в RO ячейку Sterlitech CF042, www.sterlitech.com, работающую при 5 бар (500 кПа) с использованием 500 млн-1 NaCl в качестве подаваемого раствора в течение 60 минут. Результаты показаны в Таблице 6. Видно, что показатели RO являются как удовлетворительными, так и с высокой воспроизводимостью.

Пример 10. Самостоятельно полученные LbL мембраны для фильтрации с высоким задерживанием
Методику LbL осаждения полиэлектролита можно использовать для получения фильтрационной мембраны на основе PES мембраны (в качестве поддерживающей подложки) и PEI/PAA (полиэтиленимин/полиакриловая кислота) полиэлектролитного слоя, и включения самоорганизующихся наноструктур на основе PEI с аквапорином.
Мембраны могут быть получены в соответствии со способом, как изложено ниже:
Стадия 1. Выбрать и получить отрицательно заряженные PES на нетканевой подложке посредством обработки атмосферной плазмой.
Стадия 2. Адсорбировать PEI на отрицательно заряженной поверхности данной подложки посредством электростатического притяжения; посредством погружения заряженных PES в раствор PEI (концентрация аналогична композиции PEI самоорганизующихся структур на основе PEI-AQPZ, как получено в соответствии с Примером 1 - или другая концентрация, в зависимости от желаемой конечной толщины слоя).
Стадия 3. Промыть поверхность подложки деионизированной водой для удаления избытка молекул PEI, которые несильно адсорбированы на поверхности;
Стадия 4. Погрузить PES, покрытые PEI, в раствор РАА (молярная концентрация, эквивалентная концентрации PEI), где отрицательные заряды будут адсорбированы на поверхности;
Стадия 5. Промыть поверхность PES, покрытую PEI и РАА, деионизированной водой для удаления избытка молекул РАА.
Стадия 6. Повторить стадии 2-5 до достижения намеченного числа мультислоев - 2.
Стадия 7. Погрузить PES мультислоистую структуру, покрытую РАА, в композицию самоорганизующихся структур PEI-AQPZ (как получено в примере 1; используется как есть).
Стадия 8. Промыть деионизированной водой.
Стадия 9. Погрузить PES мультислоистую структуру, покрытую PEI/Аквапорином и РАА, в раствор РАА.
В случае, когда предпочтительными являются другие пары электролитов, для получения мембран будут использовать похожий способ.
В данном примере композицию самоорганизующихся структур PEI-AQPZ используют на последних стадиях для замещения поликатиона, используемого для организации мультислоев электролитов. В качестве альтернативы, композицию самоорганизующихся структур PEI-AQPZ можно использовать для замещения поликатиона в образовании нескольких LbL слоев.
Пример 11. Нанесения покрытия на половолоконный (HF) модуль для гемодиализа
В протоколах нанесения покрытия для 2,3 м2 HF модуля для гемодиализа использовались следующие три основные стадии: I - смачивание MPD-водой; II - сушка модуля и III - реакция с TMC-isopar. Как показано на Фиг. 2, на протяжении стадии сушки модуля (стадия II) модуль здесь помещают горизонтально, что может ограничивать гравитационное перемещение воды в модуле, что будет более выражено для более длинных модулей. Однако модули №74 и №75 покрывали, используя вертикальное положение на протяжении стадии II. Кроме того, вместо контактов с замкнутой оболочкой, пространство внутри оболочки соединяли с вакуумным наносом (или перистальтическим насосом), который создает небольшой вакуум со стороны оболочки и собирает накапливающуюся воду. Не желая быть связанными какой-либо конкретной теорией, авторы настоящего изобретения обнаружили, что посредством приложения вакуума со стороны оболочки внутренние каналы волокон сушат более однородно вдоль модуля. Большую часть воды удаляют из внутреннего канала волокон посредством созданного вакуума в модуле (со стороны оболочки), и воздух, применяемый для сушки, удаляет только воду, адсорбированную на поверхности. Данный принцип можно использовать независимо от того, держат оболочку модуля в вертикальном или горизонтальном положении, см. также результаты по эффективности в Таблице 7.
Тестировали разные концентрации водного раствора MPD, см. также Таблицу 7. Водную композицию аквапорина-Z добавляли к раствору MPD, как например 7 мл/100 мл композиции на основе PEI-AQP (полученной в соответствии с Примером 1), наряду с возможными добавками, см. также Пример 8. Кроме того, тестировали разные концентрации ТМС (органическая фаза). Все комбинации хорошо работали, см. также Таблицу 7.
Дополнительная водная композиция аквапорина-Z, используемая в получении HF модулей согласно способу, описанному в данном документе, содержит везикулы, образованные из смеси диблок-сополимеров РМОХА24-PDMS65 плюс PMOXA32-PDMS65, включая солюбилизированный детергентом аквапорин-Z. Указанные везикулы получают в соответствии со следующим способом:
Основные вещества, образующие везикулы:
Поли(2-метилоксазолин)-блок-поли(диметилсилоксан) диблок-сополимер PDMS65PMOXA24 (DB1), приобретенный в виде вязкой белой жидкости, используемой в состоянии поставки.
Поли(2-метилоксазолин)-блок-поли(диметилсилоксан) диблок-сополимер PDMS65PMOXA32 (DB2), приобретенный в виде вязкой белой жидкости, используемой в состоянии поставки.
В качестве добавок:
Поли(2-метилоксазолин)-блок-поли(диметилсилоксан)-блок-поли-(2-метилоксазолин) триблок-сополимер PMOXA12PDMS65PMOXA12 (ТВ), приобретенный в виде вязкой белой жидкости, используемой в состоянии поставки в качестве агента, придающего гидрофобность, и поли(диметилсилоксан) с бис(3-аминопропилом) на конце, имеющий молекулярную массу 2500 Да, приобретенный в виде жидкости у Sigma Aldrich, используемой в состоянии поставки в качестве сшивающего агента.
Фосфатный буфер 10 мМ (PBS) (рН 7,2, 136 мМ NaCl, 2,6 мМ KCl) получали посредством растворения 8 г NaCl, 0,2 г KCl, 1,44 г Na2HPO4 и 0,24 г KH2PO4 в 800 мл H2O, очищенной MilliQ, доведения рН до 7,2 HCl и доведения объема до 1 л. Дополнительные детергентные добавки представляли собой N,N-Диметилдодециламин N-оксид BioXtra (лаурилдиметиламин N-оксид) (LDAO - от англ. lauryldimethylamine N-oxide), приобретенный у Carbosynth, и Полоксамер Р123 приобретенный у Sigma Aldrich в виде 30%-ого раствора в воде.
5 мг/мл AqpZ в 0,2% LDAO в маточном растворе (очищен, как описано выше).
Способ получения:
1. Получить раствор Р123 посредством растворения 15 мл Р123 в 1 л PBS.
2. Получить 5%-ный раствор LDAO в PBS посредством растворения 5 г LDAO в 100 мл PBS.
3. В сосуд для получения взвесить DB1 до достижения концентрации 0,5 г DB1/л полученной композиции.
4. В тот же самый сосуд для получения взвесить DB2 до достижения концентрации 0,5 г DB2/л полученной композиции (массовое соотношение DB1 и DB2 1:1).
5. В тот же самый сосуд для получения взвесить, добавить добавку ТВ для придания гидрофобности до достижения концентрации 0,12 г ТВ/л полученной композиции.
6. Добавить 5% LDAO, полученный на стадии 2, в количестве 100 мл/л полученной композиции.
7. Добавить поли(диметилсилоксан) с бис(3-аминопропилом) на конце до достижения конечной концентрации 0,1%.
8. Добавить маточный раствор AqpZ до достижения концентрации 5 мг/л полученной композиции и отношения белок : полимер 1/400.
9. Добавить раствор полоксамера Р123, полученный на стадии 1, до достижения желаемого объема полученной композиции, вычитая объемы LDAO, поли(диметилсилоксана) с бис(3-аминопропилом) на конце и AQPZ, добавляемых на стадии 6 и 8.
10. Перемешать смесь со стадии 10 в течение ночи при 170 оборотах в минуту (не больше чем 20 часов) при комнатной температуре с достижением получения композиции.
11. Следующим утром взять полученную в Пр. 3 композицию, полученную в последовательности стадий 1-9, и отфильтровать ее через фильтры с размером пор 200 нм для ее стерилизации, поместить ее в герметично закрытую бутыль и хранить ее при комнатной температуре в течение не более 12 месяцев.
Модули №72 и №73 получали, используя данную композицию аквапорина-Z. Результаты по эффективности показаны в Таблице 7. На все другие тестируемые модули наносили покрытие, используя 7 мл/100 мл композиции везикул и AQP.
Кроме того, вследствие относительно низкого трансмембранного давления, вода не может быть удалена из пор волокон, так как действуют капиллярные силы, и они будут поддерживать поры наполненными водой. Наличие данных капиллярных сил предотвращает полное удаление водной фазы из подложки, таким образом, межфазная полимеризация имеет возможность происходить на поверхности мембраны, на стадии III. Нанесение покрытия в виде TFC слоя данным способом сделало возможным FO тестирование с удовлетворительными результатами, как перечислено в Таблице 7.
Эффективность прямого осмоса образованной HF TFC мембраны определяли посредством характеристик полиамидного слоя, образованного в процессе межфазной полимеризации. Для регуляции свойств такого слоя меняли содержания воды и органической фазы. Цель заключалась в получении стабильного покрытия TFC/Аквапорин Inside™ с обратным потоком соли Js меньше 4 г/м2ч и как можно более низким удельным обратным потоком соли Js/Jw. В стандартном протоколе, используемом для нанесения покрытия 0,6 м2 модулей, использовали 2,5% MPD и 0,15% ТМС. Исследуемая концентрация MPD составляла 2,5% и 5%. Концентрация ТМС варьировала от 0,1% до 0,5%. Эффективность FO полученных TFC мембран перечислена в Таблице 7.
Как показано в Таблице 7, покрытие TFC/Аквапорин Inside™ было успешным для всех перечисленных мембран и варьирующих концентраций реагентов MPD и ТМС. В общем, с возрастанием концентрации MPD Jw слегка увеличивает уменьшение Js, что не обязательно связано с более высокой задержкой солей слоя, а связано с большим конвективным потоком воды через мембрану. При увеличении концентрации ТМС с 0,1% до 0,15% и 0,2% Js уменьшается, что подразумевает то, что слой становится более сшитым и с более высоким задерживанием соли. Кроме того, большее повышение концентрации ТМС приводило к дополнительному уменьшению Js. Однако вместе с Js Jw также уменьшается. Такое поведение предполагает увеличение толщины слоя без повышения селективности слоя в отношении задерживания соли. Для сравнения на два модуля (№15 и №16) наносили покрытие без применения приложенного вакуума, приводящего к получению мембран, допускающих утечку. Использование вертикального положения на протяжении стадии сушки II, см. также Фиг. 2, также приводило к приемлемой эффективности в течение всего времени, пока прикладывали вакуум, см. также данные по модулю №73 и 74, показанные в Таблице 7.
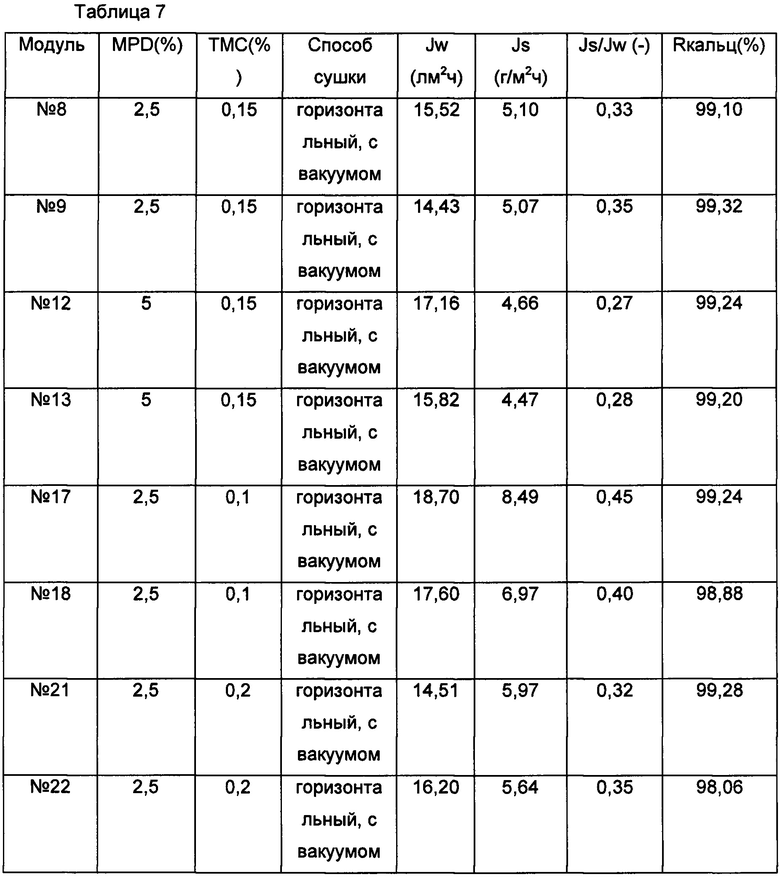
Пример 12. Тестирование эффективности обратного осмоса при низком давлении (LPRO - от англ. Low Pressure Reverse Osmosis) набора HF модулей, имеющих волокна, модифицированные селективным слоем, содержащим самоорганизующиеся наноструктуры на основе PEI/аквапорина-Z.
Целый ряд 2,3 м2 низкопроницаемых диализаторов xevonta (HF модули) приобретали у В. Braun Avitum AG, Schwarzenberger Weg 73-79, 34212 Melsungen, Германия, и впоследствии обрабатывали для модификации их внутренних поверхностей волокон, как описано в данном документе, см. также https://www.bbraun.com/content/dam/catalog/bbraun/bbraunProductCatalog/CW_01_NEW/en-01/b43/brochure-xevonta.pdf.bb-.25584796/brochure-xevonta.pdf и выше Пример 11.
Модифицированные модули использовали в эксплуатации обратного осмоса при низком давлении (LPRO, также называемый обратным осмосом для водопроводной воды (TWRO - от англ. tap water reverse osmosis) с использованием 500 млн-1 раствора NaCl в качестве подаваемой воды при приложенном давлении 4 бар (400 кПа).
Тестирование мембраны проводят с 500 млн-1 NaCl. Для получения данной концентрации 10 г NaCl (99%) растворяют в 20 л воды. После перемешивания в течение по меньшей мере 15 минут проводимость хорошо приготовленного раствора должна составлять примерно 1100 плюс/минус 100 мкСм/см. На Фиг. 3 показано схематичное описание применяемой установки LPRO, используемой в тестировании 2,3 м2 модулей. FV-расходомер, Р-манометр, С-измеритель проводимости.
Схематичное описание используемой установки показано на Фиг. 3. Конфигурацию для проведения испытания применяли для от 1 до вплоть до максимум 8 модулей, тестируемых впоследствии в держателе и соединенных с одним и тем же подаваемым раствором. Перед тестом все модули промывали RO водой (вода, очищенная с помощью обратного осмоса) (меньше 10 мкСм/см) в течение по меньшей мере 1 часа. После этого, подаваемый раствор, содержащий 500 млн-1, вводили в модуль со скоростью потока 300-500 мл/мин на модуль. Давление фильтрации (1 бар (100 мПа)) регулировали, используя клапан 3 (см. Фиг. 3). Затем систему уравновешивали после введения подаваемого раствора и еще одного регулирования давления в течение по меньшей мере 1 часа, и ретентат и пермеат переносили обратно в питательный резервуар (См. Фиг. 3, клапан 1 закрыт и клапан 2 открыт), и образцы не собирали. После уравновешивания системы пермеат не рециркулировали в резервуар, а сбор образцов начался посредством последующего закрытия клапана 2 и открытия клапана 1 (см. Фиг. 3). Во время сбора образцов измеряли время сбора, и обычно оно варьировало от 10 до 30 секунд. Собранный объем каждого образца пермеата измеряли в мерном цилиндре вместе с проводимостью пермеата. Образцы пермеата собирали 4 раза при одном и том же давлении. После этого давление повышали до 2 бар (200 кПа), и пермеат рециркулировал в устройство подачи посредством закрытия клапана 1 и открытия клапана 2 (см. Фиг. 3). Систему снова уравновешивали в течение примерно 1 часа. Процедуру повторяли для измерения при 1-4 бар (100-400 кПа). Время сбора и объем измеренного образца делали возможным расчет коэффициента водопроницаемости А в соответствии с уравнением 1:

где:
А представляет собой коэффициент водопроницаемости (л/м-2ч-1бар-1)
ΔV представляет собой объем собранного пермеата (л)
Δt представляет собой время сбора пермеата (ч)
ΔР представляет собой трансмембранное давление (бар)
π представляет собой осмотическое давление подаваемого раствора (бар)
Технологическое задерживание соли рассчитывали в соответствии с уравнением 2.

где:
 представляет собой технологическое задерживание соли (-)
представляет собой технологическое задерживание соли (-)
κF представляет собой проводимость подаваемого раствора (мкСм/см)
κР представляет собой проводимость пермеата (мкСм/см)
Коэффициент проницаемости соли В рассчитывают на основе уравнения 3:

где:
В представляет собой коэффициент проницаемости соли (л/м-2ч-1)
 представляет собой технологическое задерживание соли (-)
представляет собой технологическое задерживание соли (-)
Jw представляет собой поток воды (л/м-2ч-1)
k коэффициент массопереноса с подающей стороны (л/м-2ч-1)
Результаты по эффективности показаны ниже в Таблице 8. Данные результаты показывают хорошую воспроизводимость и эксплуатационные значения в соответствии с общепринятыми стандартами для питьевой воды.

Пример 13. FO тестирование в однопроходном режиме набора HF модулей, имеющих волокна, модифицированные селективным слоем, содержащим самоорганизующиеся наноструктуры на основе PEI/аквапорина-Z
Серию из 4 HF модулей получали, как в предыдущем примере. Стандартное тестирование мембран проводят с 1 М NaCl в качестве вытягивающего раствора и перед применением проводимость раствора, приготовленного таким образом, должна составлять примерно 92,5 плюс/минус 1,5 мСм/см. RO воду, имеющую стандартизированную проводимость меньше 10 мкСм/см, используют в качестве подаваемого раствора без какой-либо дополнительно обработки. Фиг. 4 представляет собой схематичное описание применяемого однопроходного способа тестирования, используемого в тестировании 2,3 м2 модулей. Легенда: FV - расходомер, Р - манометр, С - измеритель проводимости.
Подаваемый раствор вводили в модуль со скоростью 60 л/ч, тогда как вытягивающий раствор вводили со скоростью 25 л/ч. Вытягивающий и подаваемый растворы соединяли в противоток. Следили за давлением подаваемого раствора и вытягивающего раствора из всех входных отверстий. Тесты проводили при среднем ТМР 0,2 бар (20 кПа) со стороны подачи. Тесты проводили в течение 1 часа. Подаваемый раствор (здесь RO вода) и вытягивающий раствор (1 М NaCl) не рециркулировали. Вместо этого, концентрат подаваемого раствора собирали на весы. Поток подаваемого раствора, выходящий из модуля, рассчитывали и вычитали из потока подаваемого раствора, входящего в модуль, для расчета потока через мембрану в соответствии с уравнением 4.

где:
Jw представляет собой поток воды (л/м2ч)
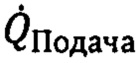 представляет собой скорость потока подаваемого раствора (л/ч)
представляет собой скорость потока подаваемого раствора (л/ч)
 представляет собой скорость потока концентрата (л/ч)
представляет собой скорость потока концентрата (л/ч)
А представляет собой площадь мембраны (м2)
Проводимость концентрированного подаваемого раствора измеряли для расчета обратного потока соли в соответствии с уравнением 5.

где:
Js представляет собой обратный поток соли (л/м2ч)
 представляет собой скорость потока концентрата (л/ч)
представляет собой скорость потока концентрата (л/ч)
А представляет собой площадь мембраны (м2)
κ представляет собой проводимость (мкСм/см)
В представляет собой коэффициент пропорциональности (0,5362 мкСм/см на 1 мг/л NaCl).
Вытягивающий раствор в потоке в модуль контролировали посредством вытягивающего насоса. Каждый модуль запускали в 3-5 последовательных тестах, и результаты показаны ниже в Таблице 9. Результаты показывают, что воспроизводимость способа является высокой, и модули сохраняют эффективность.

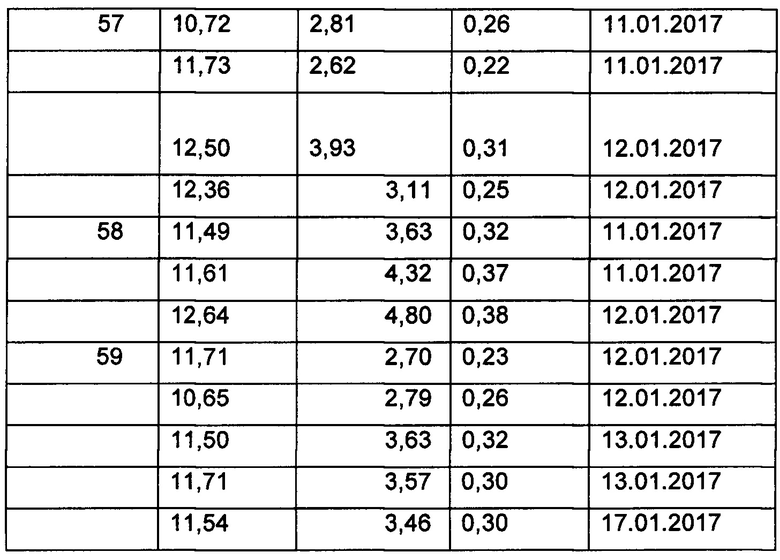
Ссылки
Ссылки, проведенные в данном документе, явным образом включены посредством ссылки для всех целей во всей их полноте.
Decher, G., J.D. Hong, Phys. Chem. 95 (1991) 1430-1434.
Dlugolecki et al. (Journal of Membrane Science, 319 214-222, 2008)
Duong, P.H.H., Zuo, J., Chung, T-S., J. Memb. Sci. 427 (2013), 411-421.
Gribova et al., Chem. Mater., 24: 854-869, 2012.
Iler, P.K, J. Colloid Sci. 21 (1966) 569-594.
Jian, S.P., Liu, Z., Tian, Z.Q., Adv. Mater 18 (2006), 1068-1072.
Joseph, N, Ahmadiannamini, P, Hoogenboom, R, Vankelecom, F.J., Polym. Chem. 5 (2015), 1817-1831.
Karlsson et al., FEBS Letters, 537: 68-72, 2003.
Kong et al., RSC Adv., 4: 37592-37599, 2014.
Schroeder et al., J. Controlled Release, 160 (2): 172-176, 2012.
Thomas & Venkiteswaran, Biophysical Journal, 106 (2): 276-277, 2014.
Wang et al., Membranes, 5 (3), 2015, 369-384
Zhang, P., Qian, J., Yang, Y., An, Q., Liu, X., Gui, Z., J. Membr. Sci. 320 (2008) 73-77.
Zhang, Y., Layer-by-layer Self-assembly Membranes for Solvent Dehydration by Pervaporation, PhD Thesis, University of Waterloo (2013)
US Patent No: 4,277,344
US Patent Application No: 2012/0080377.
WO 2010/146365 (Aquaporin A/S).
WO 2013/043118 (Aquaporin A/S).
WO 2006/122566 (Aquaporin A/S).
WO 2007/033675 (Aquaporin A/S).
WO 2013/043118 (Aquaporin A/S).
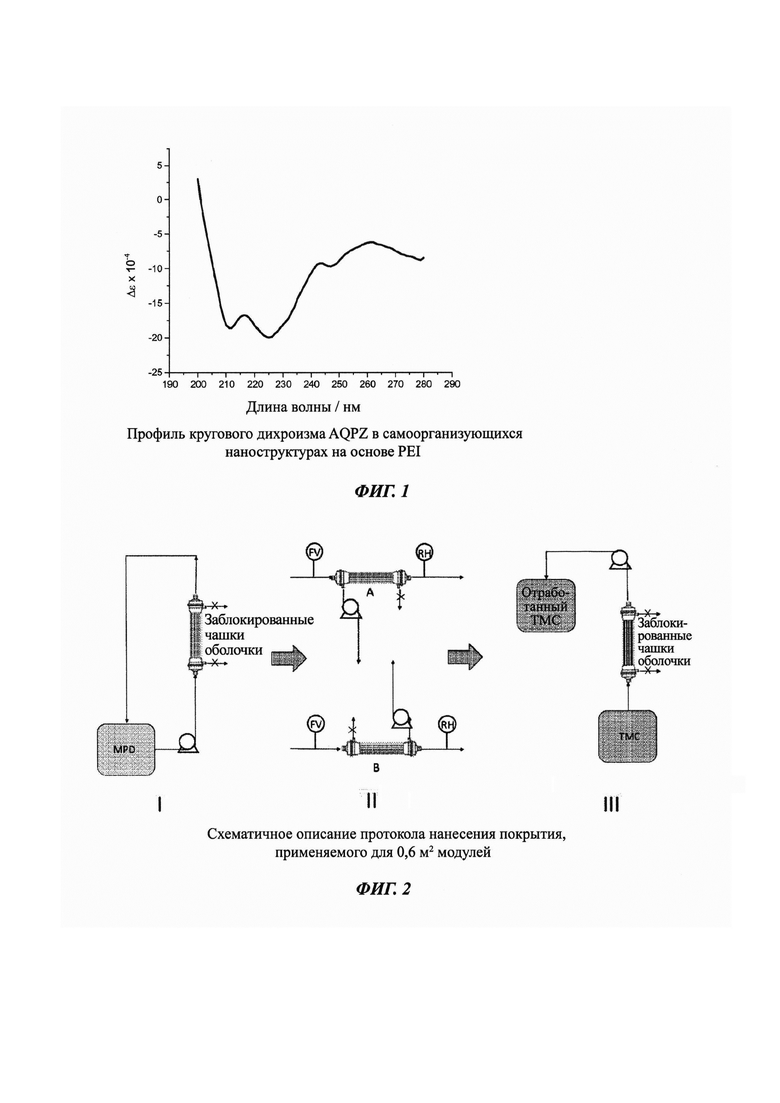
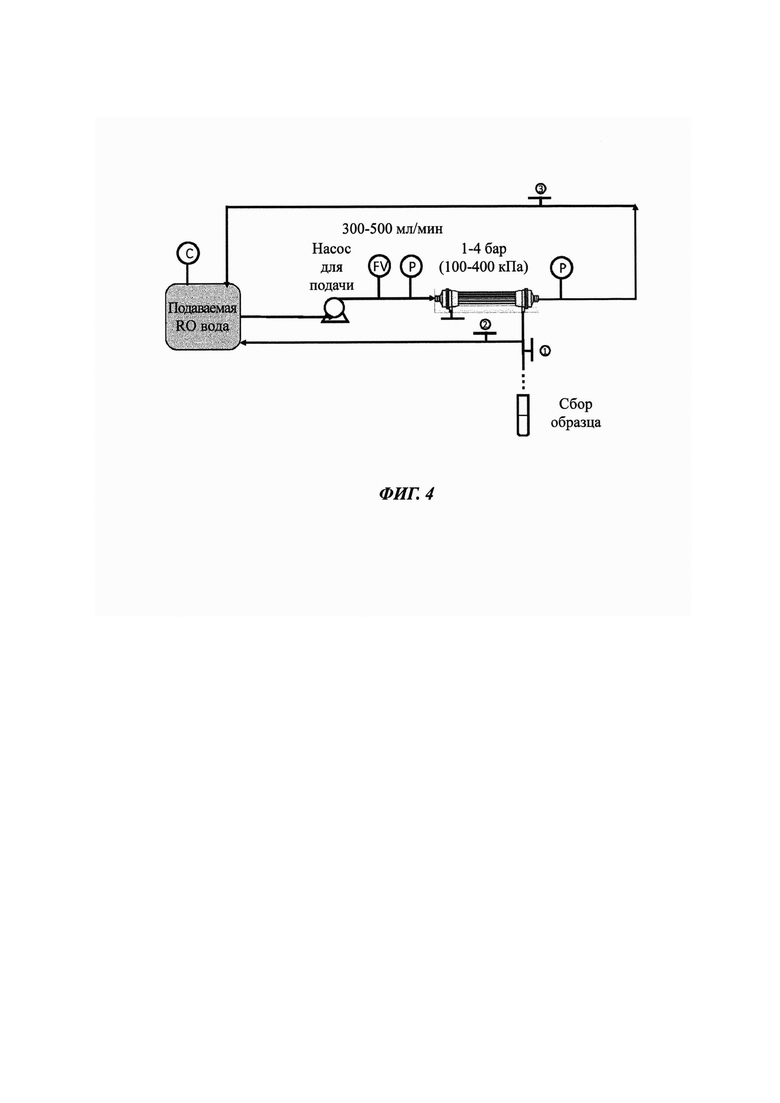
Группа изобретений относится к самоорганизующимся наноструктурам, включающим полиэтиленимин (PEI) и аквапориновый водный канал, солюбилизированный детергентом, и к их применению для получения разделительной мембраны и половолоконного (HF) модуля для фильтрации. Самоорганизующаяся наноструктура содержит полиэтиленимин (PEI), со средней молекулярной массой 2000–10000 Да, и аквапориновый водный канал, солюбилизированный детергентом, выбранным из лаурилдиметиламин N-оксида (LDAO), н-октил-β-D-глюкопиранозида (OG), н-додецил-β-D-мальтопиранозида (DDM) или их комбинации. Разделительная мембрана для фильтрации содержит поддерживающую подложку с тонкопленочным композитным слоем сшитого ароматического полиамида, в котором иммобилизована указанная самоорганизующаяся наноструктура. Способ получения разделительной мембраны включает добавление водной жидкой композиции, содержащей указанную самоорганизующуюся наноструктуру, к поддерживающей подложке во время получения тонкопленочного композитного слоя сшитого ароматического полиамида. Половолоконный (HF) модуль для фильтрации имеет волокна, модифицированные селективным слоем, содержащим тонкопленочный композитный (TFC) слой сшитого ароматического полиамида, в котором иммобилизованы указанные самоорганизующиеся наноструктуры. Изобретения обеспечивают стабильные в жидкой композиции самоорганизующиеся наноструктуры, которые могут быть иммобилизованы или включены в активный или селективный слой во время процесса изготовления мембраны, как например, во время межфазной полимеризации с образованием TFC слоя. 4 н. и 1 з.п. ф-лы, 4 ил., 9 табл., 13 пр.
1. Разделительная мембрана для фильтрации, содержащая самоорганизующуюся наноструктуру, причем указанная самоорганизующаяся наноструктура содержит полиалкиленимин (PAI) и аквапориновый водный канал, солюбилизированный детергентом, отличающаяся тем, что PAI представляет собой полиэтиленимин (PEI), имеющий среднюю молекулярную массу от примерно 2000 Да до примерно 10000 Да, детергент выбран из группы, состоящей из лаурилдиметиламин N-оксида (LDAO), н-октил-β-D-глюкопиранозида (OG), н-додецил-β-D-мальтопиранозида (DDM) или их комбинации, разделительная мембрана содержит поддерживающую подложку с активным слоем, в котором иммобилизована указанная самоорганизующаяся наноструктура, и активный слой представляет собой тонкопленочный композитный слой, причем указанный тонкопленочный композитный слой представляет собой слой сшитого ароматического полиамида.
2. Разделительная мембрана по п. 1, где PEI представляет собой по существу линейный полимер, имеющий среднюю молекулярную массу от примерно 3000 Да до примерно 5000 Да.
3. Способ получения жидкой композиции для получения разделительной мембраны, включающий смешивание водного раствора полиалкиленимина (PAI) с аквапориновым водным каналом, солюбилизированным детергентом, где PAI представляет собой полиэтиленимин (PEI), имеющий среднюю молекулярную массу от примерно 2000 Да до примерно 10000 Да, и детергент выбран из группы, состоящей из лаурилдиметиламин N-оксида (LDAO), н-октил-β-D-глюкопиранозида (OG), н-додецил-β-D-мальтопиранозида (DDM) или их комбинации.
4. Способ получения разделительной мембраны, включающий добавление водной жидкой композиции, содержащей самоорганизующуюся наноструктуру, которая содержит полиалкиленимин (PAI) и аквапориновый водный канал, солюбилизированный детергентом, где PAI представляет собой полиэтиленимин (PEI), имеющий среднюю молекулярную массу от примерно 2000 Да до примерно 10000 Да, и детергент выбран из группы, состоящей из лаурилдиметиламин N-оксида (LDAO), н-октил-β-D-глюкопиранозида (OG), н-додецил-β-D-мальтопиранозида (DDM) или их комбинации, во время процесса изготовления мембраны, отличающийся тем, что указанный способ включает добавление указанной водной жидкой композиции к поддерживающей подложке во время получения тонкопленочного композитного слоя, причем указанный тонкопленочный композитный слой представляет собой слой сшитого ароматического полиамида.
5. Половолоконный (HF) модуль для фильтрации, имеющий волокна, модифицированные селективным слоем, в котором иммобилизованы самоорганизующиеся наноструктуры, содержащие полиалкиленимин (PAI) и аквапориновый водный канал, солюбилизированный детергентом, где PAI представляет собой полиэтиленимин (PEI), имеющий среднюю молекулярную массу от примерно 2000 Да до примерно 10000 Да, и детергент выбран из группы, состоящей из лаурилдиметиламин N-оксида (LDAO), н-октил-β-D-глюкопиранозида (OG), н-додецил-β-D-мальтопиранозида (DDM) или их комбинации, где указанный селективный слой содержит тонкопленочный композитный (TFC) слой на внутренней поверхности волокон, причем указанный тонкопленочный композитный слой представляет собой слой сшитого ароматического полиамида.
| SHUZHENG WANG et al.: "Bio-Inspired Aquaporinz Containing Double-Skinned Forward Osmosis Membrane Synthesized through Layer-by-Layer Assembly", MEMBRANES, 10 August 2015, v.5, no | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| MIAOQI WANG et al.: "Layer-by-Layer Assembly of Aquaporin Z- Incorporated Biomimetic Membranes for Water Purification", | |||
Авторы
Даты
2021-06-17—Публикация
2017-02-06—Подача