Изобретение относится к производным несимметричного триазина, в частности к производным 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов, способу их получения и их применению в качестве фотогенераторов кислоты. В частности, подобные производные могут применяться по отдельности или в составе композиций в качестве добавок к полимерам, в средах для оптической записи информации, в биологических исследованиях.
Известны изобретения фотогенераторов кислоты (ФГК) различного строения, с возможностью применения в качестве инициаторов катионной полимеризации различных мономеров (WO 2020/145043 А1, 16.07.2020), компонентов фоторезистов в фотолитографии (US 2020/0133122 А1, 30.04.2020) (US 2019/0285983 A1, 19.09.2019) (US 2018/0095363 A1, 05.04.2018), при обработке полупроводников (US 2020/0096866 A1, 26.03.2020). Так, описано получение полимерных покрытий для микро- и оптоэлектронных устройств с улучшенными характеристиками, на основе составов содержащих смесь полиимидов и ФГК (US 2020/0285151 A1, 10.09.2020). Фоторезисты, предназначенные для переноса изображений на поверхности различных материалов, имеют в своем составе ФГК в матрице полимера, содержащего кислотно-чувствительные фрагменты. При УФ-облучении подобных композиций, ФГК выделяют кислоты, разрушающие либо сшивающие звенья полимера, что приводит к появлению изображения в месте подвергнутом УФ-облучению (WO 2019/178344 А1, 19.09.2019).
Ранее предложены светочувствительные полимерные материалы для оптической записи информации, основанные на фотоиндуцированной флуоресценции, содержащие ФГК и прекурсоры флуоресцирующих соединений, такие как производные Родамина (US 2003/0073031 A1, 17.04.2003). Считывание информации производится детектированием флуоресценции катионов Родамина. Процесс записи информации заключается в поглощении УФ-излучения ФГК, что ведет к выделению кислоты, которая в свою очередь приводит к раскрытию цикла прекурсора с образованием флуоресцентного катиона Родамина. Процесс протекает по следующей схеме 1:
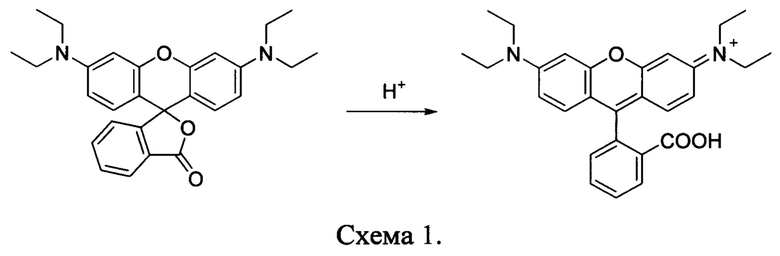
На сегодняшний день, остается актуальным поиск новых соединений со свойствами ФГК. Таким образом, создание соединений, которые могут использоваться подобным образом, представляет собой важную задачу, что и является предметом настоящего изобретения.
Описанные в литературе ФГК разделяют на две группы - ионные и неионные. Преимущество органических неионных ФГК состоит в повышенной растворимости в средах органических растворителей и полимерных пленках. Механизм образования кислот при облучении неионных ФГК заключается в гемолитическом расщеплении связей углерод-гетероатом либо гетероатом-гетероатом с дальнейшим свободнорадикальным отрывом атомов водорода от молекул растворителя (Н.А. Кузнецова, Г.В. Малков, Б.Г. Грибов «Фотохимические генераторы кислоты. Применение и современное состояние разработок.» Успехи химии, 2020, 89(2), 173-190).
В работе (V.F. Traven, D.A. Cheptsov, M.V. Bulanova, N.P. Solovjova, T.A. Chibisova, S.M. Dolotov, I.V. Ivanov. «On the Mechanism of Photodehydrogenation of Aryl(hetaryl)pyrazolines in the Presence of Perchloroalkanes.» Photochem. Photobiol. 2018, 94, 659) описаны неионные двухкомпонентные ФГК, состоящие из смеси дигидрогетарена, в частности производных пиразолина, с пергалогеналканом, таким как четыреххлористый углерод или гексахлорэтан. При облучении состава происходит фотодегидрирование, сопровождающееся ароматизацией дигидрогетарена и выделением кислоты хлороводорода по следующей схеме 2:
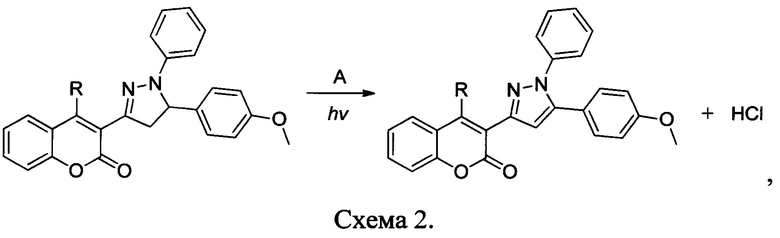
Где R - водород либо гидроксильная группа, А - CCl4 либо C2Cl6.
Подобные двухкомпонентные системы перспективны как для оптической записи информации, так и для биологических исследований, отличаются высокими скоростями генерирования кислоты. Среди недостатков ФГК данного класса отмечаются выраженная зависимость скорости генерации кислоты от применяемого растворителя, необходимость тщательного контроля соотношения вводимых реагентов, высокая летучесть выделяющегося газообразного хлороводорода, высокая токсичность полихлоралканов для человека.
Недавно предложены ионные ФГК, на основе модифицированных анионов сульфокислот содержащих группы CF2, СН2, О, а также их аналоги (US 2020/0133122 A1, 30.04.2020) имеющие формулы:
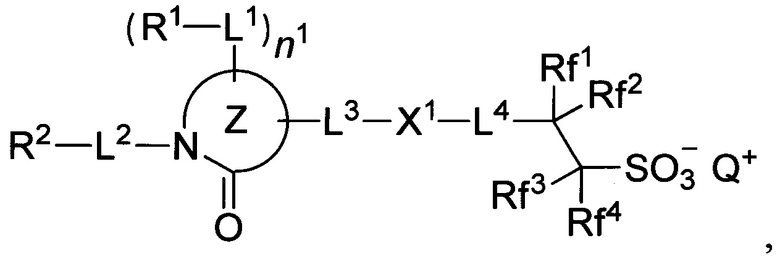
Где Z - моно- либо полициклическая группа с лактамной структурой; Rf1-Rf4 представляют собой водород, фтор либо трифторметил; R1, R2 - водород либо С1-С20 моновалентная углеводородная группа, которая может содержать гетероатом; L1-L3 - одинарная, эфирная, сложноэфирная связь, в том числе эфир сульфоновой кислоты, карбонат либо карбамат; X1 - одинарная связь либо С1-С40 дивалентный углеводородный заместитель, который может содержать гетероатом; n1 = целое число от 0 до 6, с учетом того, что R1 и R2 могут образовывать циклическую структуру; Q - ониевый катион. Примеры:
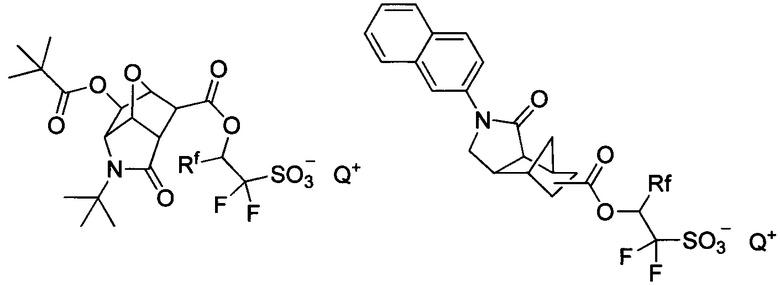
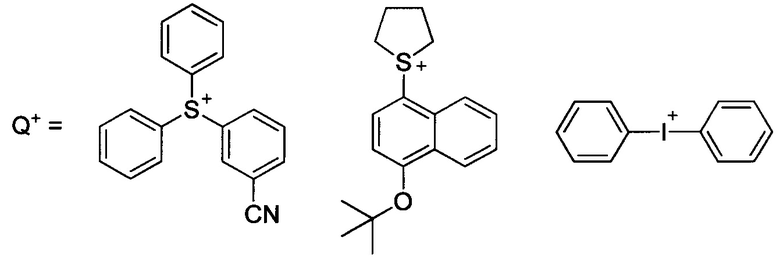
В патенте (ЕР 0 938 029 А2, 25.08.1999) описаны неионные ФГК близкого строения, а именно на основе амидов перфторированных сульфокислот, способные при облучении генерировать свободные кислоты. В патенте (WO 2006/008250 А2, 26.01.2006) представлены галогенированные О-сульфонаты оксимов, способные выступать в качестве неионных ФГК, формулы:
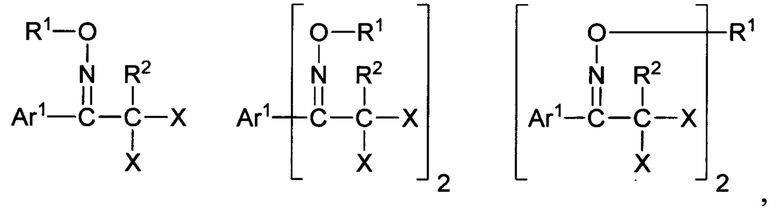
Где R1 - С1-С18-алкил- либо арилсульфонил; R1 - галоген либо C1-С10-галоалкил; X - галоген; Ar1 - бифенил, флуоренил, замещенный нафтил, либо замещенный гетарил.
Как развитие данной работы, современные патенты (WO 2016/148809 А1, 22.09.2016) (US 2020/0089110 A1, 19.03.2020) описывают неионные ФГК, представляющие собой производные О-сульфированных 2-гидрокси-1H-бензо[de]изохинолин-1,3(2H)-дионов формул:
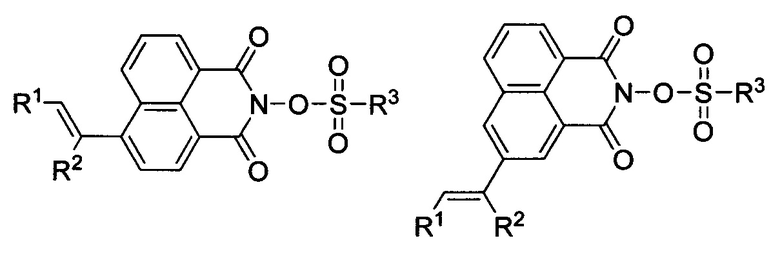
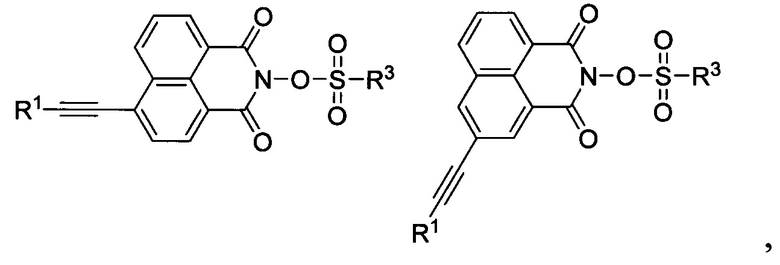
Где R1 и R2 - водород, цианогруппа, алифатические либо гетероциклические заместители C1-C18, которые кроме того могут содержать атомы галогенов, карбонильные, аминные, эфирные, сульфидные группировки; R3 - фторированная алкильная группа.
Известен патент (US 2018/0046077 A1, 15.02.2018), в котором приведены способы получения неионных ФГК содержащих фрагменты арилкетонов и эфиров сульфокислот, функционализованные группами CF2, CF3, а также объемными адамантильными формулы:
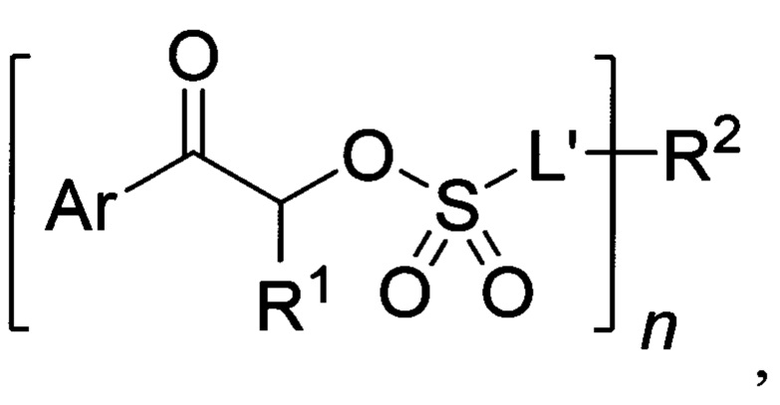
Где n=1,2,3,4; Ar - арильный радикал, включающий одно либо несколько ароматических циклов; L' - одинарная связь либо двувалентный линкер состава C1-С10; R1 - моновалентный алкильный либо перфорированный алкильный радикал состава C1-С10; R2 - радикал с валентностью n состава С1-С50. Примеры:
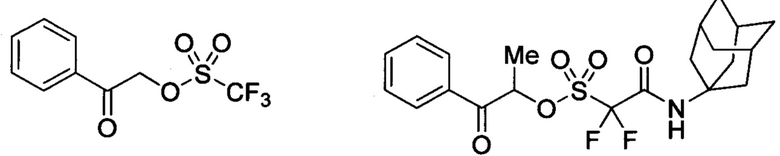
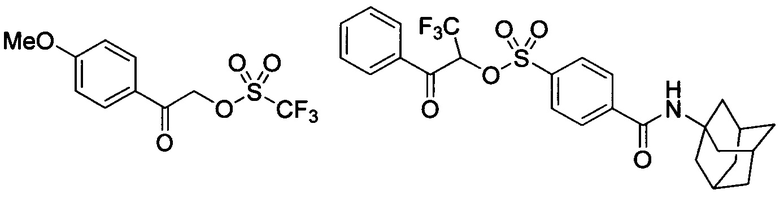
Данные соединения эффективны в качестве ФГК в диапазоне УФ-света с длинами волн 0-300 нм и предложены для использования в литографии, как компоненты в полимерных матрицах фоторезистов различного строения. ФГК описываемые в патенте эффективны как в растворах различных органических растворителей (таких как ацетон, этиленгликоль, этилацетат и др.), так и в полимерных средах (полимеры, олигомеры, молекулярные стекла, металлорганические комплексы и др.). Определенным преимуществом данных фотогенераторов является высокая сила образующихся кислот, термическая стабильность до 130-140°С. Известный патент может рассматриваться как наиболее близкое решение технической задачи предлагаемого изобретения по свойствам известных соединений и использованию их в качестве фотогенераторов.
Среди существенных недостатков известных ФГК, содержащих сульфонильный фрагмент, в том числе рассмотренных выше, отмечаются малая растворимость наряду с высокой химической устойчивостью, препятствующая биоразлагаемости, склонность к накоплению сульфокислот в биообъектах. (Н.А. Кузнецова, Г.В. Малков, Б.Г. Грибов «Фотохимические генераторы кислоты. Применение и современное состояние разработок.» Успехи химии, 2020, 89(2), 173-190). В синтезе ФГК описываемых в патенте (US 2018/0046077 A1, 15.02.2018) в качестве прекурсоров используются фторангидриды сульфоновых и карбоновых кислот, которые выделяют высокотоксичный фтороводород.
Наиболее близким по структуре предлагаемым соединениям и по способу получения является 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанон (2а), который описан в статье (С.М. Иванов, К.А. Лысенко, В.Ф. Травень, «Синтез и фотолиз 3-трет-бутил-4-окси(меркапто)-1,4-дигидропиразоло[5,1-с][1,2,4]триазинов», Изв. АН Сер. Хим. 2020, Т. 69, №4, С. 731-738). Соединение было получено путем взаимодействия 3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазина с трифторуксусным ангидридом в среде ТГФ с последующим действием водного карбоната калия при пониженной температуре. Это соединение было испытано на предмет антимикробной и антигрибковой активности.
Технической задачей предлагаемого изобретения является расширение ассортимента нового типа ФГК, обеспечивающих образование устойчивых фотопродуктов, и разработка способа их получения.
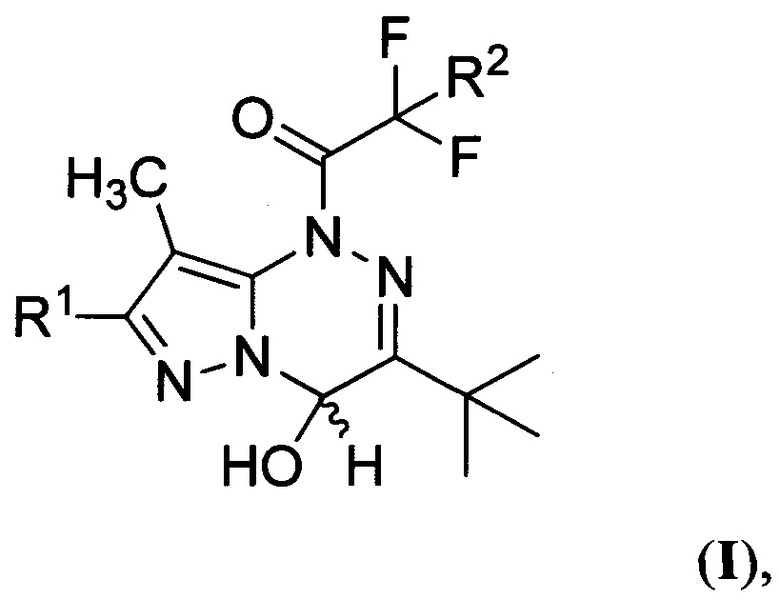
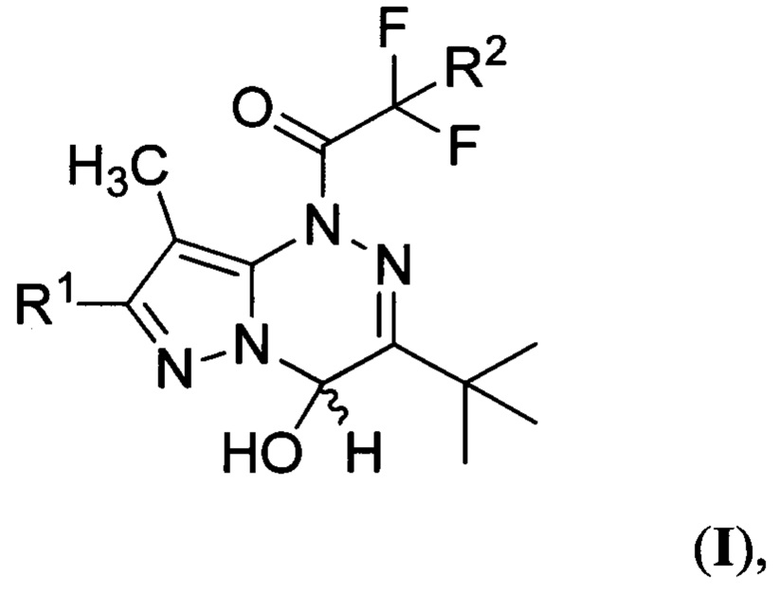
Поставленная техническая задача достигается производными 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы:
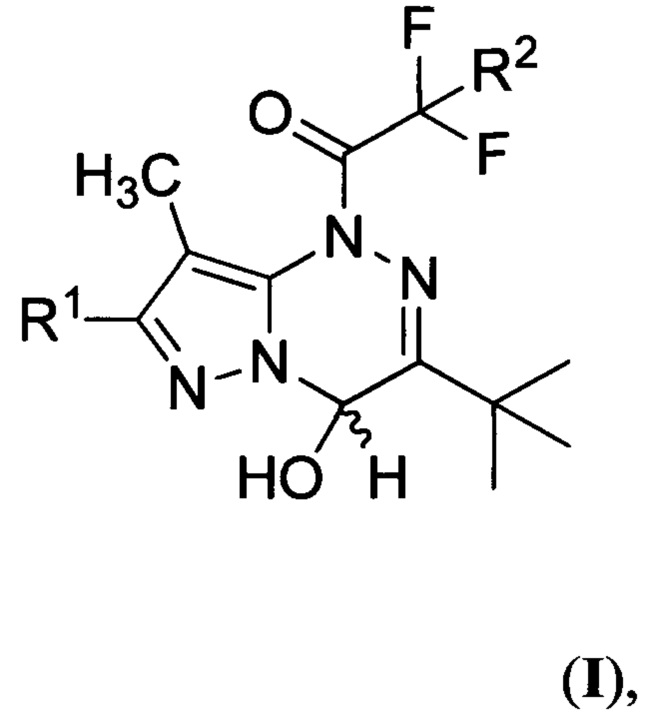
где R1 представляет собой водород, a R2 представляет собой хлор, либо R1 представляет собой бром, a R2 представляет собой хлор или фтор. Предлагаемые соединения являются новыми и в литературе не описаны. Предложен также способ получения производных 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы:
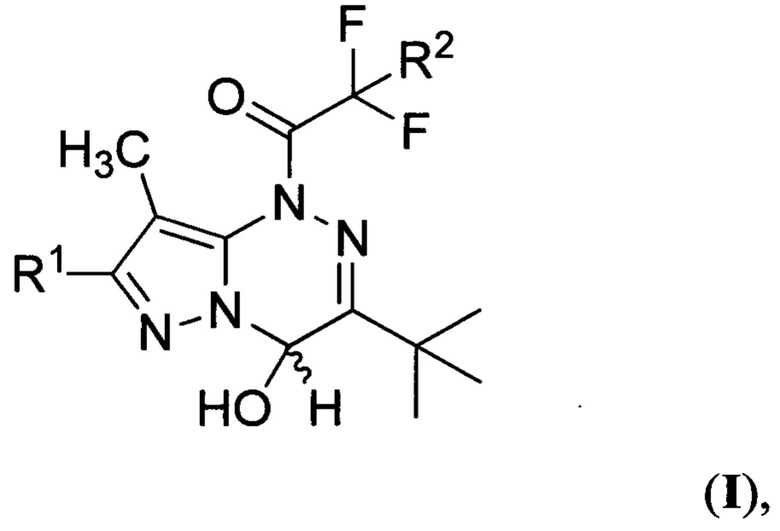
где R1 представляет собой водород или бром, a R2 представляет собой хлор или фтор, заключающийся в том, что смесь 7-R1-3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазина и 2-R2-2,2-дифторуксусного ангидрида, где R1 и R2 имеют вышеуказанные значения, взятых в эквимолярном соотношении, обрабатывают водой.
Процесс проводят при комнатной температуре в течение 5 мин в отсутствие органического растворителя по следующей схеме 3:
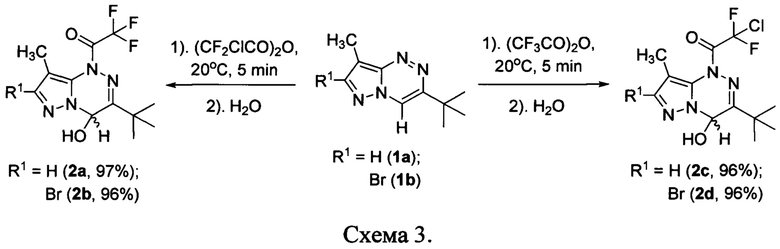
Предложенный способ отличается от известного использованием воды вместо карбоната калия в качестве реагента, точным подбором соотношения реагентов, отсутствием органического растворителя и проведением процесса при комнатной температуре, что экологичнее и проще в технической реализации.
Соединения общей формулы I, где R1 представляет собой водород или бром, a R2 представляет собой хлор или фтор, могут найти применение в качестве светочувствительных фотогенераторов устойчивых фотопродуктов, таких как трифторуксусная кислота (ТФК) либо хлордифторуксусная кислота (ХДФК), и эффективны в растворах органического растворителя и в средах оптически прозрачного полимера. Поскольку известное ранее соединение 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанон (2а) испытывалось в водном растворе, что могло вести к его гидролизу, было неочевидно, что соединение 2а может выступать как ФГК в инертной безводной среде.
Соединения 2a-d обладают свойствами ФГК, обеспечивающих при воздействии УФ-излучения в диапазоне 235-492 нм образование ТФК либо ХДФК в растворах органических растворителей, например, ацетонитриле, и в оптически прозрачном полимере, например, полиметилметакрилате (ПММА).
Полученный новый тип ФГК при УФ-облучении обеспечивает образование устойчивых фотопродуктов, не продуцирующих летучие галогенводородные кислоты или токсичные галогенированные сульфокислоты. ТФК и ХДФК являются сильными кислотами, которые хорошо растворимы как в воде, так и в средах различных органических растворителей и полимеров, отличаются умеренными температурами кипения. ТФК и соответствующие трифторацетаты (ТФА) не склонны к биоаккумуляции, в отличие от фторированных сульфокислот. К примеру, результаты анализа образцов океанической воды показывают, что найденный повсеместно ТФА в концентрации около 200 нг/л имеет природное происхождение, и гомогенно распределен в океанической воде всех возрастов (Hartmut Frank, Eugen Н Christoph, Osmund Holm-Hansen, John L Bullister. «Trifluoroacetate in Ocean Waters» Environ Sci Technol. 2002, 36(1), 12-5. doi: 10.1021/es0101532).
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1.
Синтез 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанона (2а).
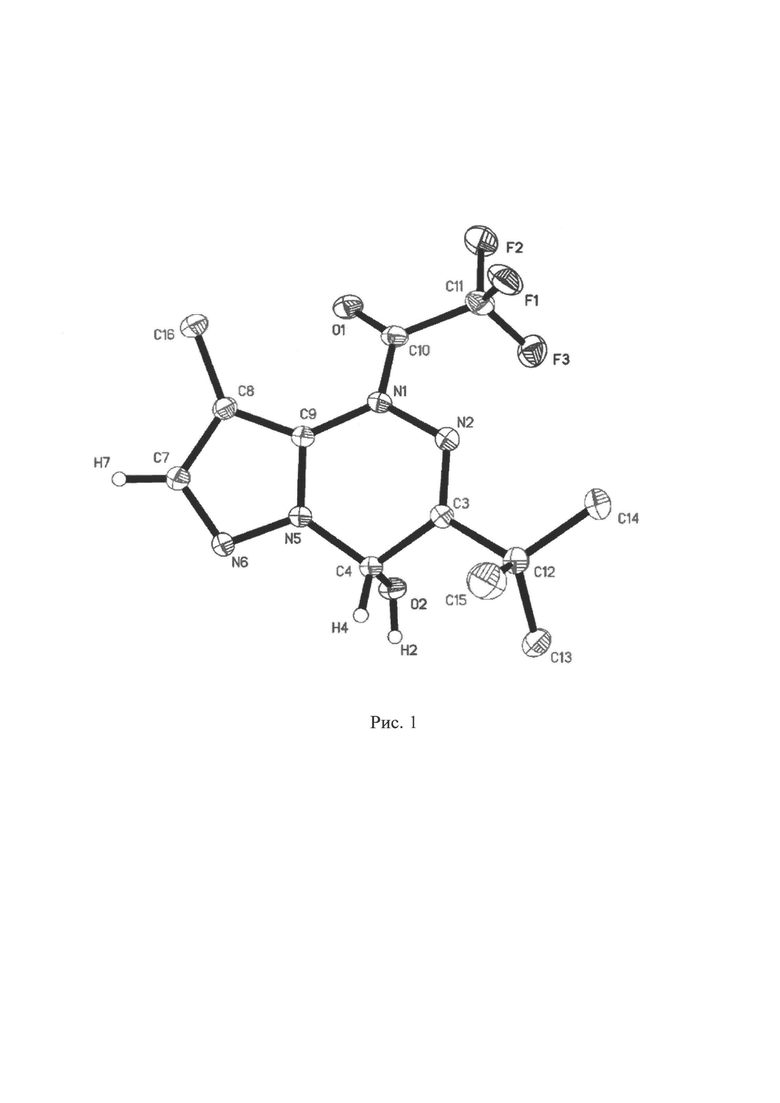
К 3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазину (1а) (10 ммоль) в течение 1 мин прибавляют 2,2,2-трифторуксусный ангидрид (10.5 ммоль). Получаемую таким образом смесь оставляют перемешиваться в течение 5 мин, затем выливают в 100 мл воды. Процесс проводят при комнатной температуре. Твердое кристаллическое вещество белого цвета фильтруют, промывают водой (1×100 мл) и высушивают на воздухе в темноте. Получают 2.95 г (97%) 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанона (2а) с т.пл. 181-183°С (разл.). Т.пл. и спектральные данные для соединения 1а соответствуют ранее описанным (С.М. Иванов, К.А. Лысенко, В.Ф. Травень, «Синтез и фотолиз 3-трет-бутил-4-окси(меркапто)-1,4-дигидропиразоло[5,1-с][1,2,4]триазинов», Изв. АН Сер. Хим. 2020, Т. 69, №4, С. 731-738). Молекулярное строение ФГК 2а в кристалле в представлении атомов эллипсоидами тепловых колебаний (р=50%) представлено на рис. 1.
Пример 2.
Синтез 1-(7-бром-3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанона (2b).
К 7-бром-3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазину (1b) (10 ммоль) в течение 1 мин прибавляют 2,2,2-трифторуксусный ангидрид (10.5 ммоль). Получаемую таким образом смесь оставляют перемешиваться в течение 5 мин, затем выливают в 100 мл воды. Процесс проводят при комнатной температуре. Твердое кристаллическое вещество белого цвета фильтруют, промывают водой (1×100 мл) и высушивают на воздухе в темноте. Получают 3.69 г (96%) 1-(7-бром-3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2,2-трифторэтанона (2b) с т.пл. 173-176°С (разл.). ИК-спектр (KBr), ν/см-1: 3168 (ОН), 2994, 2964, 2941, 2909, 2873, 2726 (СН), 1745 (СО), 1691, 1650, 1642, 1564, 1513, 1482, 1454, 1413, 1388, 1368, 1338, 1301, 1281, 1252, 1225, 1203, 1172 (CF3), 1103, 1083, 1060, 1028, 1012, 920, 857, 792, 743, 717, 667, 632, 584, 555, 533, 517, 456. 1Н ЯМР (500 МГц, Диметилсульфоксид-d6) δ/м.д. (J/Гц)=1.29 (с, 9Н, t-Bu), 2.08 (с, 3Н, С(8)-Ме), 6.33 (с, 1Н, С(4)-Н), 7.82 (д ~0.5Н, ОН, J=8.5). 13С ЯМР APT (126 МГц, Диметилсульфоксид-d6) δ/м.д. (J/Гц)=11.44 (С(8)-СН3), 28.24 (С(СН3)3), 37.84 (С(СН3)3), 70.56, 70.66 (д, С(4), J=12.0), 105.13 (С(8)), 112.90, 115.17, 117.46, 119.74 (кв, COCF3, J=286.8), 130.18 (C(7)), 130.57 (C(8a)), 151.87, 152.17, 152.47, 152.76 (кв, COCF3, J=37.5), 162.41, 162.50 (д, C(3), J=11.6). 19F ЯМР (471 МГц, Диметилсульфоксид-d6) δ/м.д. = -68.65 (с, 3F, CF3). HRMS (ESI): m/z: [M+H] вычислено для C12H14BrF3N4O2: 383.0325; найдено 383.0325.
Пример 3.
Синтез 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2-хлор-2,2-дифторэтанона (2с).
К 3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазину (1а) (10 моль) в течение 1 мин прибавляют 2-хлор-2,2-дифторуксусный ангидрид (10.5 ммоль). Получаемую таким образом смесь оставляют перемешиваться в течение 5 мин, затем выливают в 100 мл воды. Процесс проводят при комнатной температуре. Твердое кристаллическое вещество белого цвета фильтруют, промывают водой (1×100 мл) и высушивают на воздухе в темноте. Получают 3.09 г (96%) 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2-хлор-2,2-дифторэтанона (2с) с т.пл. 199-202°С (разл.). ИК-спектр (KBr), ν/см-1: 3104 (ОН), 2974, 2932, 2907, 2871, 2836, 2707 (СН), 1734 (СО), 1652, 1631, 1586, 1560, 1517, 1479, 1466, 1451, 1411, 1384, 1360, 1306, 1252, 1218, 1170 (CF2), 1147, 1105, 1095, 1060, 1040, 1015, 1002, 964, 916, 872, 849, 816, 792, 767, 699, 670, 652, 632, 612, 542, 464, 451, 431. 1Н ЯМР (500 МГц, Диметилсульфоксид-d6) δ/м.д. = 1.29 (с, 9Н, t-Bu), 2.09 (с, 3Н, С(8)-Ме), 3.60-3.70 (ушир. с, ~1Н, ОН), 6.32 (с, 1H, С(4)-Н), 7.53 (с, 1Н, С(7)-Н). 13С ЯМР APT (126 МГц, Диметилсульфоксид-d6) δ/м.д. (J/Гц) = 11.02 (С(8)-СН3), 28.35 (С(СН3)3), 37.80 (С(СН3)3), 70.69 (С(4)), 105.03 (С(8)), 116.03, 118.41, 120.78 (т, COCF3, J=299.2), 129.37 (С(8а)), 141.94 (С(7)), 153.54, 153.79, 154.04 (т, COCF3, J=30.9), 161.84 (С(3)). 19F ЯМР (471 МГц, Диметилсульфоксид-d6) δ/м.д. = -59.71, -59.38, -57.29, -56.95 (диастереотопн. м., Σ 2F, CF2). HRMS (ESI): m/z: [M+H] вычислено для C12H15ClF2N4O2: 321.0924; найдено 321.0932.
Пример 4.
Синтез 1-(7-бром-3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2-хлор-2,2-дифторэтанона (2d). К 7-бром-3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазину (1b) (10 ммоль) в течение 1 мин прибавляют 2-хлор-2,2-дифторуксусный ангидрид (10.5 ммоль). Получаемую таким образом смесь оставляют перемешиваться в течение 5 мин, затем выливают в 100 мл воды. Процесс проводят при комнатной температуре. Твердое кристаллическое вещество белого цвета фильтруют, промывают водой (1×100 мл) и высушивают на воздухе в темноте. Получают 3.85 г (96%) 1-(7-бром-3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2-хлор-2,2-дифторэтанона (2d) с т.пл. 183-184°С. ИК-спектр (KBr), ν/см-1: 3184 (ОН), 2966, 2939, 2909, 2872, 2723 (СН), 1740 (СО), 1632, 1572, 1521, 1453, 1377, 1333, 1288, 1239, 1211, 1146, 1090 (CF2), 1029, 965, 908, 853, 825, 787, 705, 667, 622, 560, 466. 1Н ЯМР (300 МГц, CDCl3) δ/м.д. = 1.41 (с, 9Н, t-Bu), 2.20 (с, 3Н, С(8)-Ме), 6.36 (с, 1H, С(4)-Н), 7.20-7.60 (ушир. с, ~1Н, ОН). 13С ЯМР APT (75 МГц, CDCl3) δ/м.д. (J/Гц) = 11.66 (С(8)-СН3), 28.49 (С(СН3)3), 38.19 (С(СН3)3), 70.24 (С(4)), 106.76 (С(8)), 113.91, 117.89, 121.88 (т, COCF3, J=301.0), 131.27, 131.99 (С(8а), С(7)), 154.29, 154.72, 155.14 (т, COCF3, J=31.8), 159.61 (С(3)). 19F ЯМР (282 МГц, CDCl3) δ/м.д. = -61.25, -60.69, -58.85, -58.29 (диастереотопн. м., Σ 2F, CF2). HRMS (ESI): m/z: [M+H] вычислено для C12H15ClF2N4O2: 399.0030; найдено 399.0026.
Пример 5.
УФ-облучение растворов соединений 2a-d в органическом растворителе.
Соединение 2a-d (1.5⋅10-3 ммоль) растворили в 5 мл ацетонитрила. Лактон Родамина Б (1 мг, 2.26⋅10-3 ммоль) растворили в 10 мл ацетонитрила. В кювету поместили 0.4 мл концентрированного раствора 2a-d и 1.6 мл ацетонитрила. Концентрация 2a-d в исследуемом растворе составила С=6⋅10-5 М.
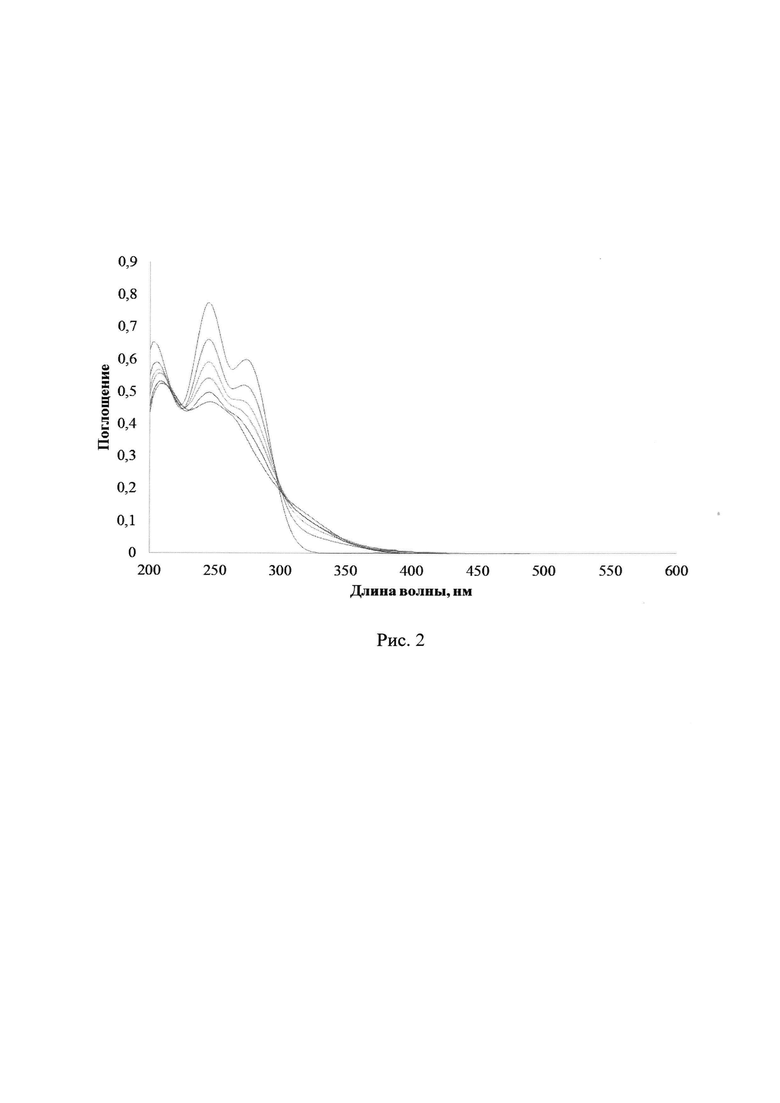
Соединения 2a-d в виде растворов в ацетонитриле обладают двумя максимумами поглощения в УФ-спектрах, а именно при 238-256 нм и около 275-290 нм. На рис. 2 отражены изменения УФ-спектров поглощения при УФ-облучении раствора ФГК 2b в ацетонитриле через светофильтр А03, максимальное время облучения 240 с. На рис. 3 показаны изменения спектров поглощения при облучении соединения 2с в ацетонитриле через светофильтр А03, максимальное время облучения 300 с.
В результате облучения растворов соединений 2a-d УФ-светом в диапазонах длин волн 235-492 нм наблюдается постепенное снижение интенсивности длинноволнового максимума, и незначительное повышение оптической плотности в области от 310 до 400 нм без образования четко выраженного максимума поглощения. Изменения относительной интенсивности длинноволнового максимума за время облучения 240 с для соединений 2a-d при одинаковых внешних параметрах экспериментов представлены в Таблице 1.

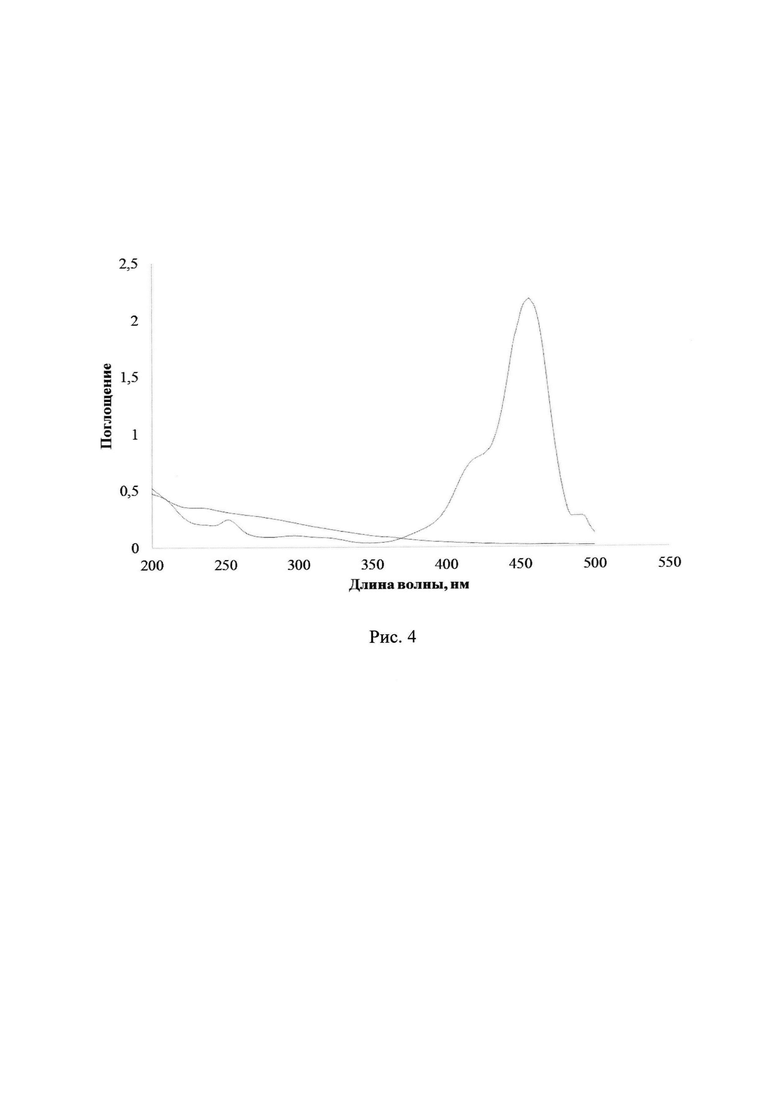
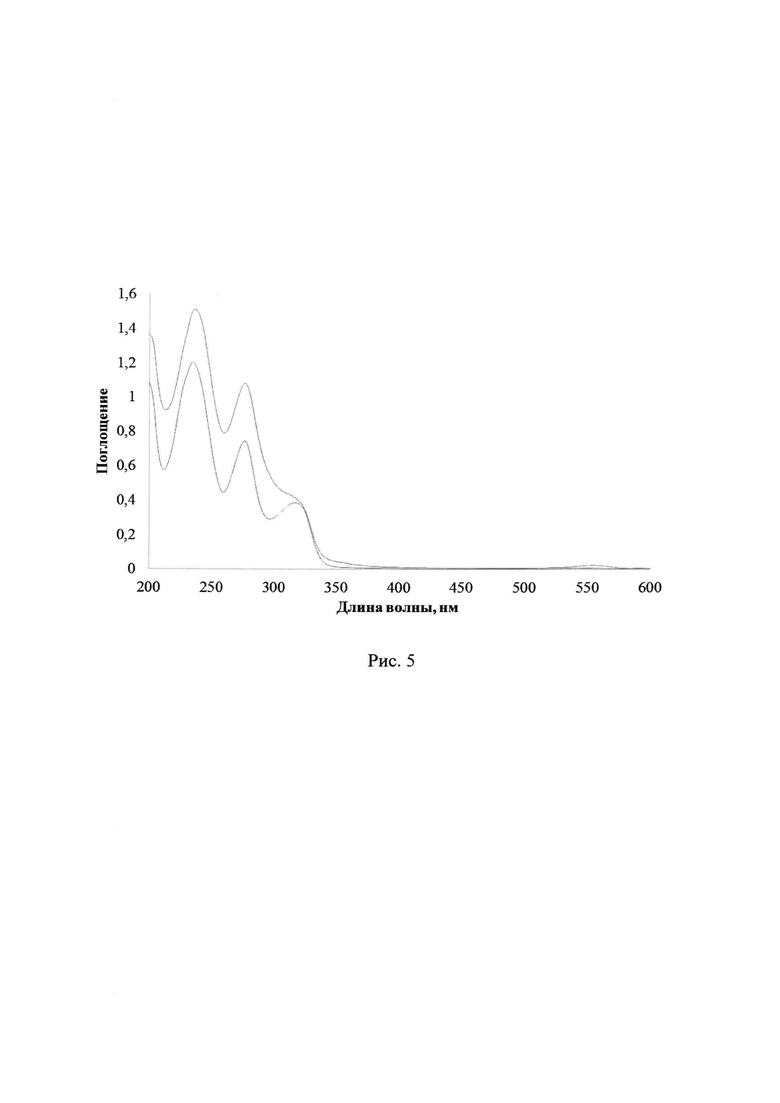
После завершения облучения 2a-d к полученному раствору добавили 200 мкл раствора лактона Родамина Б. В результате наблюдается образование интенсивного поглощения с максимумом около 556 нм, соответствующего раскрытой форме Родамина Б, что свидетельствует о наличии в системе кислоты. На рис. 4 показаны УФ-спектры поглощения раствора облученного ФГК 2а до и после добавления раствора лактона Родамина Б в ацетонитриле. Дополнительно был записан спектр поглощения разбавленного раствора лактона Родамина Б в ацетонитриле. После записи спектра было добавлено 400 мкл необлученного концентрированного раствора соединения 2a-d. На рис. 5 отражены УФ-спектры поглощения раствора лактона Родамина Б до и после добавления к нему необлученного раствора ФГК 2а в ацетонитриле. Изменения в спектре полученной смеси незначительны, что подтверждает факт образования кислоты при облучении соединений 2a-d.
Пример 6.
УФ-облучение растворов смеси соединений 2a-d и лактона родамина Б в органическом растворителе.
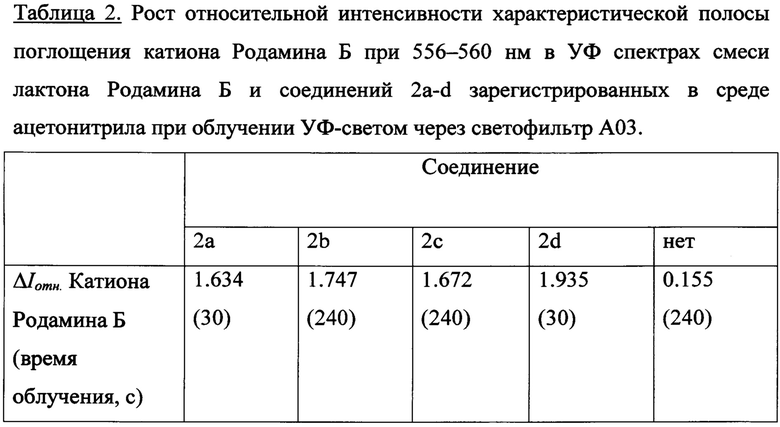
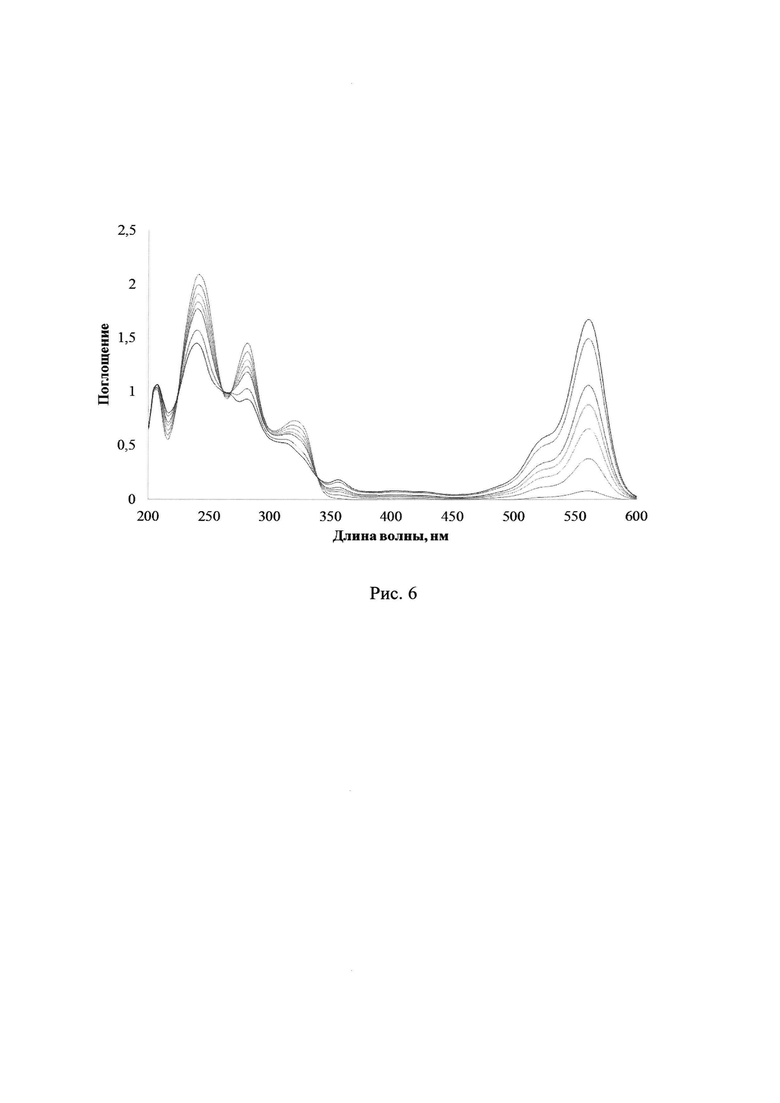
Соединение 2a-d (1.5⋅10-3 ммоль) растворили в 5 мл ацетонитрила. Лактон Родамина Б (1 мг, 2.26⋅10-3 ммоль) растворили в 10 мл ацетонитрила. В кювету поместили 0.4 мл концентрированного раствора 2a-d, 0.4 мл раствора лактона Родамина Б и 1.2 мл ацетонитрила. Концентрация 2a-d в исследуемом растворе составила С = 6⋅10-5 М. Концентрация лактона Родамина Б в исследуемом растворе составила С=4.52⋅10-5 М. При УФ-облучении растворов смеси соединений 2a-d и лактона Родамина Б в ацетонитриле УФ-светом в диапазонах длин волн 235-492 нм наблюдается снижение интенсивностей максимумов полос поглощения исходных веществ с образованием интенсивного сигнала катиона Родамина Б при 558 нм, в случае УФ-спектра 2с зафиксировано образование четких изобестических точек. На рис. 6 показаны изменения УФ-спектров поглощения при облучении раствора смеси ФГК 2с с лактоном Родамина Б в ацетонитриле через светофильтр А03, максимальное время облучения 240 с. Рост относительной интенсивности полосы поглощения катиона Родамина Б за время облучения 30-240 с для смеси лактона Родамина Б и соединений 2a-d при одинаковых внешних параметрах экспериментов представлен в Таблице 2.
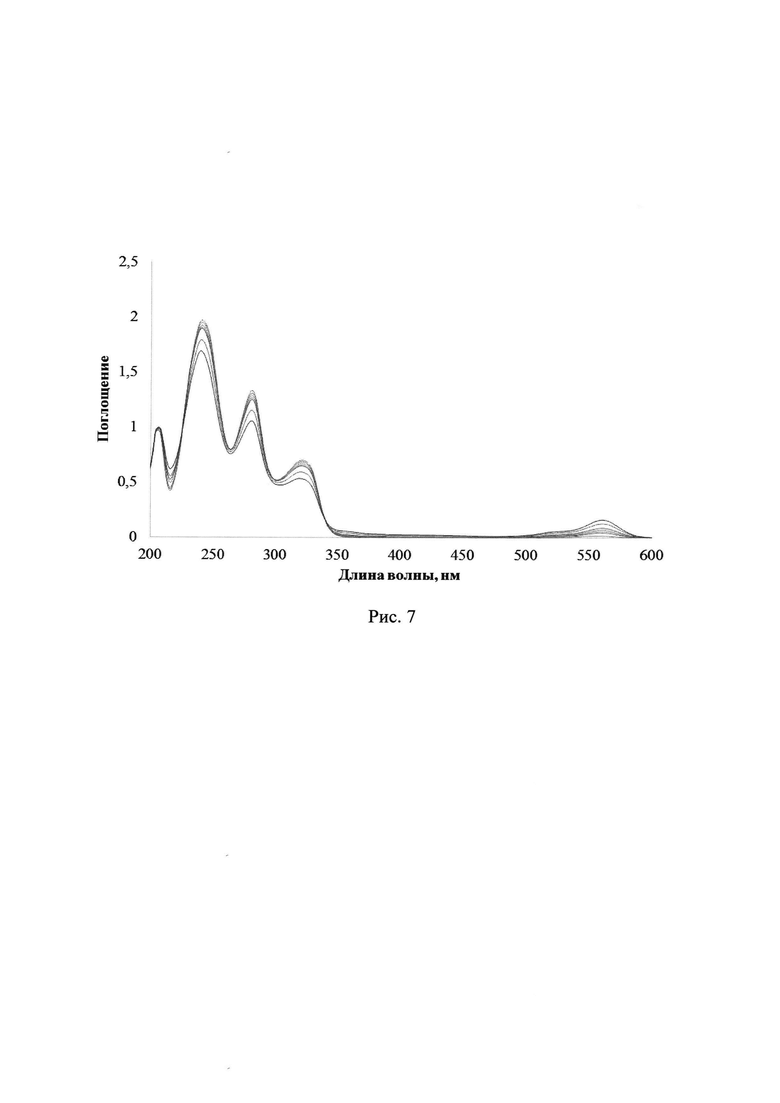
Облучение раствора лактона Родамина Б в ацетонитриле без добавления каких-либо соединений приводит к раскрытию цикла лактона с образованием флуоресцентной формы красителя, но относительная интенсивность его полосы поглощения в УФ-спектре пренебрежимо мала. На рис. 7 представлены изменения УФ-спектров поглощения раствора лактона Родамина Б в ацетонитриле без каких-либо добавок при УФ-облучении через светофильтр А03, максимальное время облучения 240 с.
Пример 7.
УФ-облучение соединений 2a-d в среде полимерной пленки полиметилметакрилата (ПММА).
Лактон Родамина Б (0.5 мг, 1.13⋅10-3 ммоль), соединение 2a-d (6⋅10-3 ммоль) и ПММА (250 мг) растворяют в смеси 3.6 мл этилацетата и 0.4 мл толуола. Раствор фильтруют через стеклянный фильтр Шотта (пор 3) в горизонтально расположенную чашку Петри. Высушивают при температуре 35-50°С в течение 24 часов, затем 15 минут при 75°С.
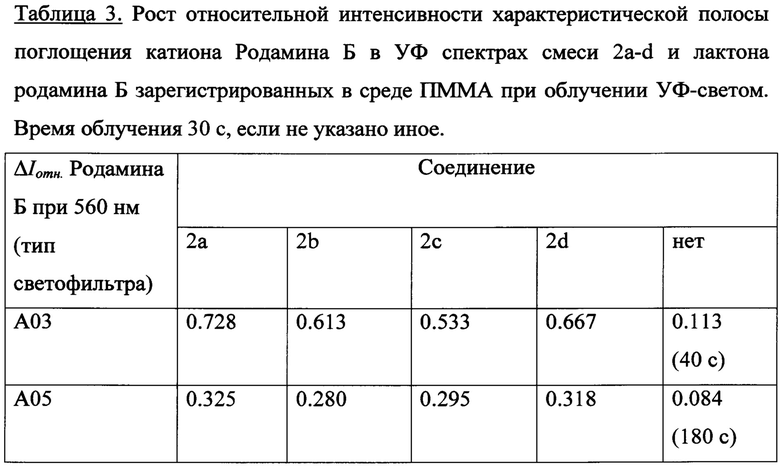
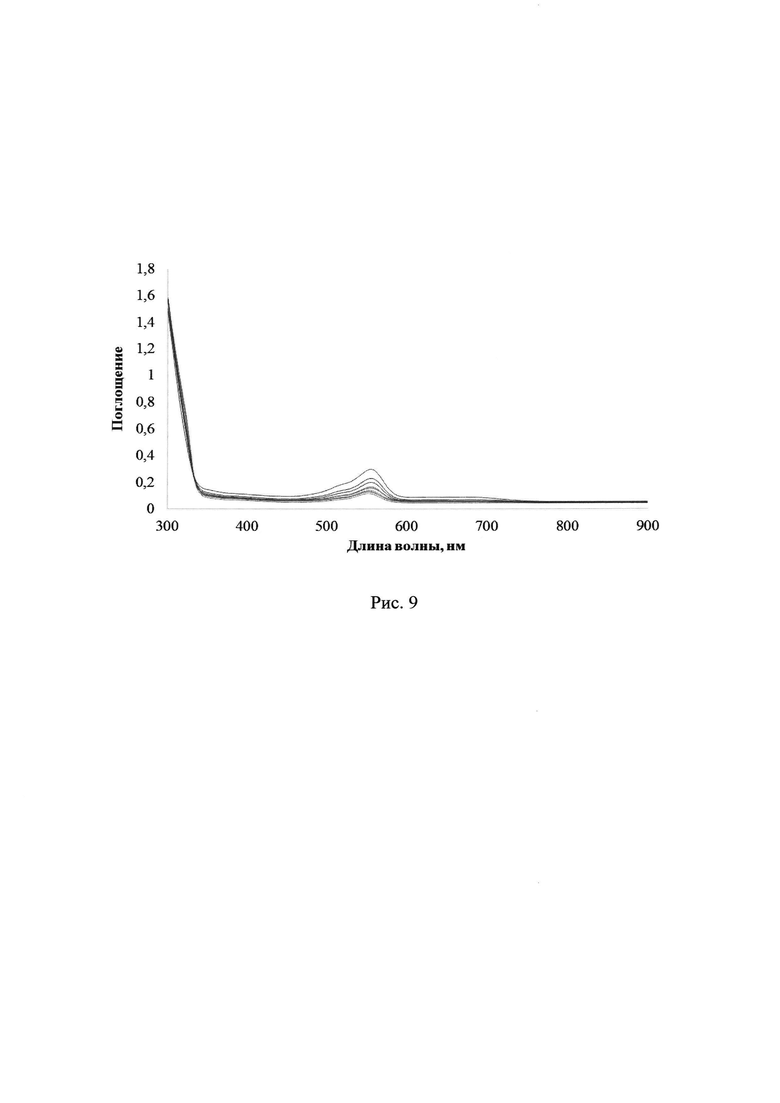
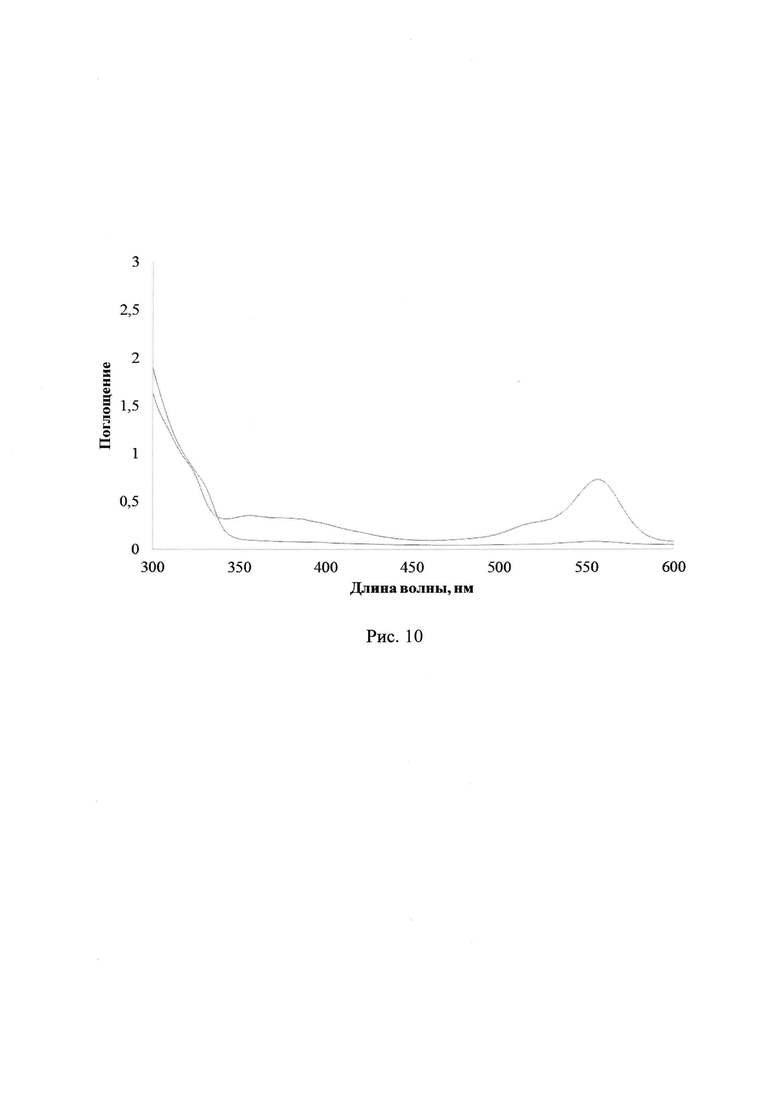
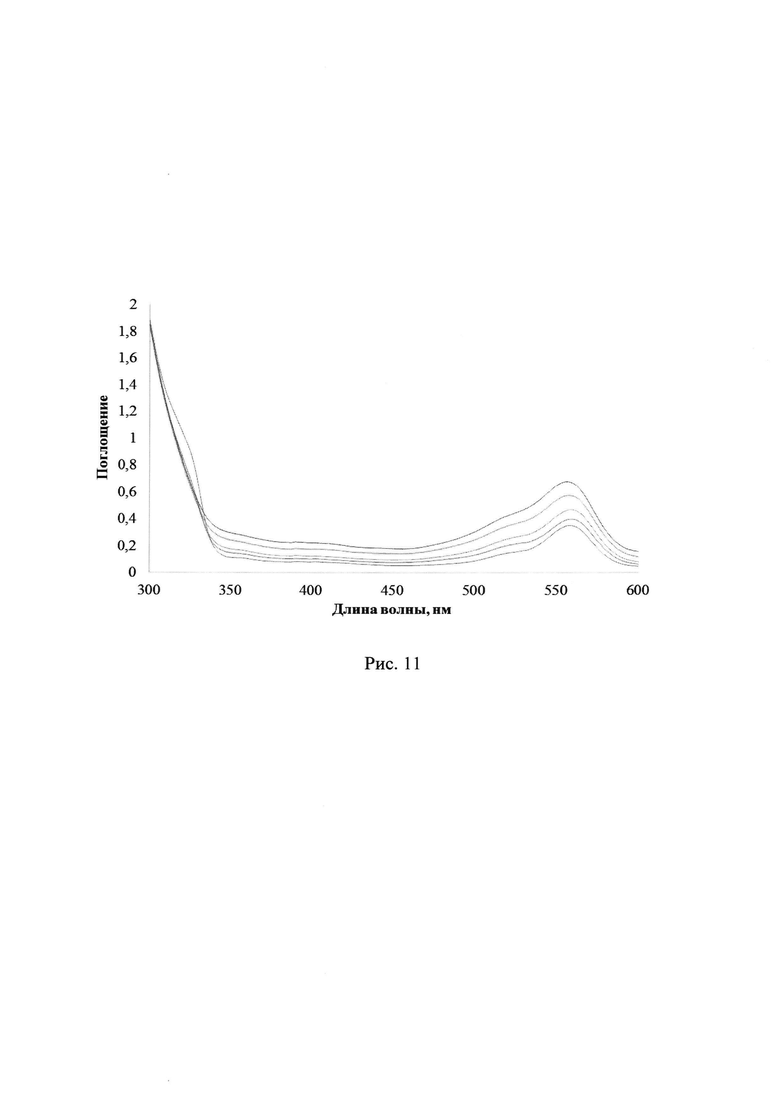
В результате УФ-облучения полимерных пленок содержащих лактон Родамина Б и соединения 2a-d УФ-светом в диапазонах длин волн 235-492 нм либо 310-460 нм наблюдается постепенное увеличение максимума поглощения в области 560 нм, соответствующее характеристической полосе поглощения раскрытой формы красителя, а именно катиону Родамина Б (см. схему 1). Так, на рис. 8 и 9 показаны изменения УФ-спектров поглощения смеси ФГК 2с с лактоном Родамина Б в полимерной пленке ПММА при УФ-облучении через светофильтры А03 либо А05, соответственно (максимальное время облучения 30 с). На рис. 10 и 11 отражены изменения УФ-спектров поглощения смеси ФГК 2а либо 2d, соответственно, с лактоном Родамина Б в полимерной пленке ПММА при УФ-облучении через светофильтр А03 (максимальное время облучения 30 с). Рост относительной интенсивности полосы поглощения катиона Родамина Б для соединений 2a-d при одинаковых внешних параметрах экспериментов представлен в Таблице 3.
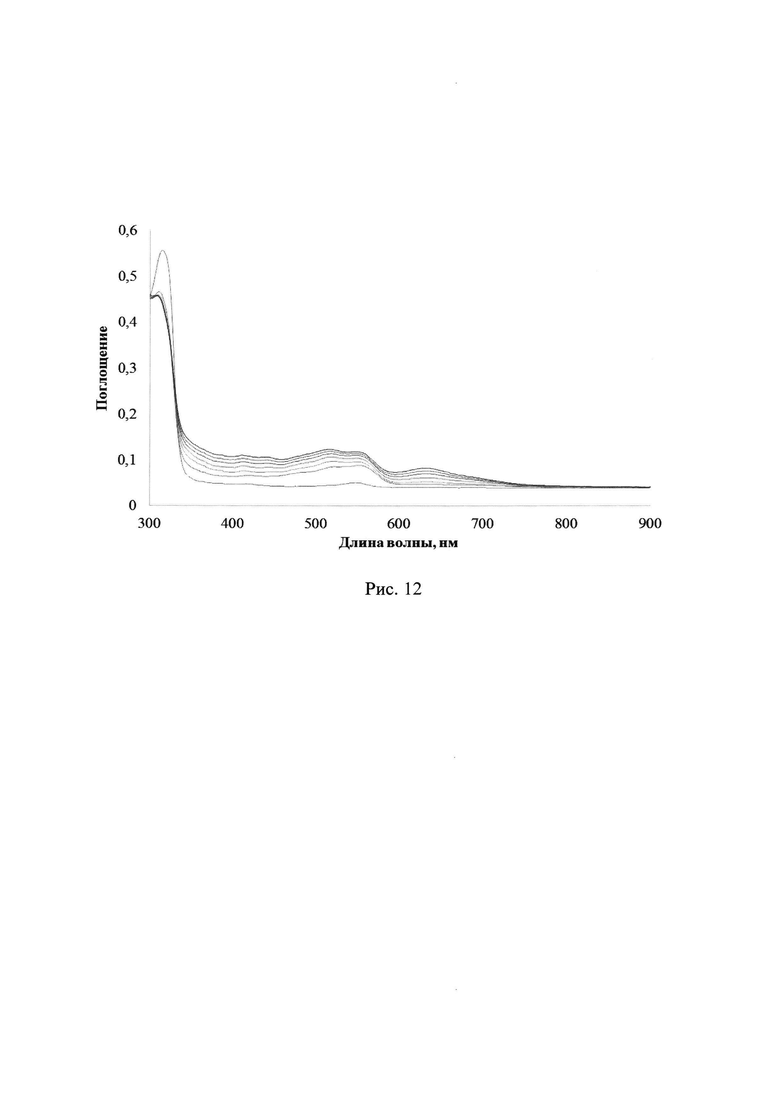
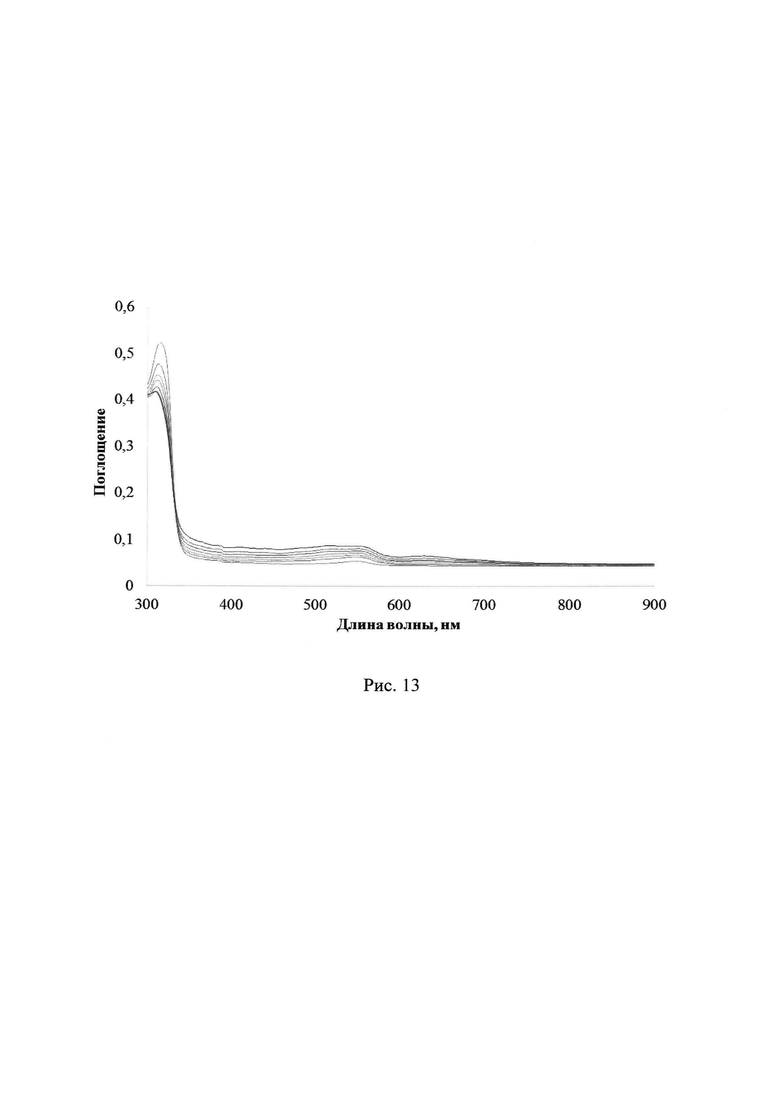
Облучение ПММА пленки с лактоном Родамина Б без добавления соединений 2a-d приводит лишь к небольшому увеличению фонового поглощения в области 340 до 750 нм. На рис. 12 и 13 отражены изменения УФ-спектров поглощения лактона Родамина Б в полимерной пленке ПММА без каких-либо добавок при УФ-облучении через светофильтры А03 либо А05, соответственно (максимальное время облучения 40 с либо 180 с, соответственно).
Анализ полученных результатов показывает, что соединения 2a-d под действием УФ-излучения с длинами волн 235-492 нм испытывают фотохимические превращения с образованием кислоты, которая фиксируется реакцией с лактоном Родамина Б и после облучения не возвращается в исходную форму. Следовательно, полученные соединения 2a-d являются светочувствительными, обеспечивают необратимое образование кислот, и представляют собой эффективные ФГК. Соединения 2a-d эффективны как ФГК в растворах органического растворителя и в пленке полимера.
Исходные соединения 7-R1-3-трет-Бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазины (R1=Н, Br) синтезируют по методикам, описанным в работах (S.M. Ivanov, A.M. Shestopalov. interaction of Fused 1,2,4-Triazinone with Diborane/Oxidation: A New Route for the Synthesis of Partially Saturated and Aromatic Pyrazolo[5,1-c][1,2,4]triazines». J. Heterocycl. Chem. 2018, Volume 55, Issue 10, Pages 2427-2433) и (S.M. Ivanov, A.O. Dmitrienko, M.G. Medvedev, L.M. Mironovich. «Metalated azolo[1,2,4]triazines. II. Generation, C(4)-substituent dependent stability and electrophile trapping of 7-lithiopyrazolo[5,1-c][1,2,4]triazines». J. Organomet. Chem. 2019, 896, 168-182). 2-R2-2,2-Дифторуксусные ангидриды (R2=F, Cl), ацетонитрил («эталонный») и полиметилметакрилат (ПММА) используют в том виде, в каком они были получены из коммерческих источников ("Sigma-Aldrich"). Температуры указаны в градусах Цельсия (°С). Все операции проводят при комнатной температуре (20°С). Спектры ЯМР 1Н, 13С (APT, тест на связанные протоны) и 19F регистрировали на приборах «Bruker АМ-300» либо «Bruker DRX-500», рабочие частоты соответственно 300, 500 МГц (1Н), 75, 126 МГц (13С), 282, 471 МГц (19F). Внутренний стандарт - ДМСО-d5, CHCl3 (1Н), ДМСО-d6 CDCl3 (13С), CF3CO2H (19F). ИК-спектры записаны на ИК-Фурье спектрометре Agilent Сагу 660 FTIR в таблетках KBr. Масс-спектры высокого разрешения (HRMS) записаны на приборе «Bruker micrOTOF II» методом электрораспылительной ионизации (ESI). Измерения выполнены на положительных (напряжение на капилляре - 4500 V) ионах, растворитель - ацетонитрил. Температуры плавления определяли на приборе "Melting point SMP30" фирмы STUART. Рентгеноструктурный анализ проводили при 100К на дифрактометре «Bruker Quest D8» (λ(MoKa) = 0.71073  ) в Отделе Структурных Исследований Института Органической Химии им. Н.Д. Зелинского РАН, Москва.
) в Отделе Структурных Исследований Института Органической Химии им. Н.Д. Зелинского РАН, Москва.
УФ-спектры регистрировали на спектрофотометре СФ-104. Фотолиз проводили в воздушной атмосфере в кварцевой колбе при облучении источником УФ-излучения «Hamamatsu LC-4» с ксеноновой лампой L8253 (мощность 150 Вт) через светофильтры А03 (диапазон пропускания 235-492 нм) либо А05 (диапазон пропускания 310-460 нм). Облучение проводилось при постоянном перемешивании (для растворов) и охлаждении внешним вентилятором для поддержания комнатной температуры (20°С). Технический результат: получены новые светочувствительные фотогенераторы кислоты, которые могут применяться в растворах органического растворителя и в оптически прозрачном полимере, а также предложен упрощенный способ их получения при комнатной температуре без использования органического растворителя, что экологичнее и проще в технической реализации. Полученный новый тип ФГК обеспечивает при воздействии УФ-излучения в диапазоне 235-492 нм образование устойчивых фотопродуктов, не продуцирующих при этом летучие галогенводородные кислоты или токсичные галогенированные сульфокислоты.


Изобретение относится к производным 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы (I), которые могут найти применение в качестве фотогенераторов кислоты в растворах органического растворителя и в оптически прозрачном полимере. В формуле (I) R1 представляет собой водород, a R2 представляет собой хлор, либо R1 представляет собой бром, a R2 представляет собой хлор или фтор. Изобретение относится также к способу получения производных 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы (I), где R1 представляет собой водород или бром, a R2 представляет собой хлор или фтор. Способ заключается в том, что смесь 7-R1-3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазина и 2-R2-2,2-дифторуксусного ангидрида, где R1 и R2 имеют вышеуказанные значения, взятых в эквимолярном соотношении, обрабатывают водой. 3 н.п. ф-лы, 13 ил., 3 табл., 7 пр.
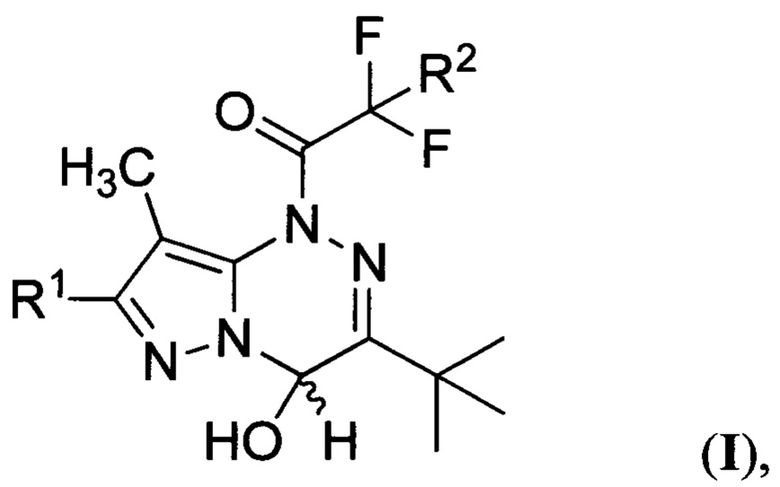
1. Производные 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы
где R1 представляет собой водород, a R2 представляет собой хлор, либо R1 представляет собой бром, a R2 представляет собой хлор или фтор.
2. Способ получения производных 1-(3-трет-бутил-4-гидрокси-8-метилпиразоло[5,1-с][1,2,4]триазин-1(4H)-ил)-2,2-дифторэтанонов общей формулы
где R1 представляет собой водород или бром, a R2 представляет собой хлор или фтор, заключающийся в том, что смесь 7-R1-3-трет-бутил-8-метилпиразоло[5,1-с][1,2,4]триазина и 2-R2-2,2-дифторуксусного ангидрида, где R1 и R2 имеют вышеуказанные значения, взятых в эквимолярном соотношении, обрабатывают водой.
3. Применение соединений общей формулы (I) по п. 1 в качестве фотогенераторов кислоты в растворах органического растворителя и в оптически прозрачном полимере.
| S.IVANOV et al., Synthesis and photolysis of 3-tert-butyl-4-oxy(mercapto)-1,4-dihydropyrazolo[5,1-c][1,2,4]triazines, RUSS | |||
| CHEM | |||
| BULL., 2020, V.69, N.4, pp.731-738 | |||
| А.И.КОНОВАЛОВ и др | |||
| Современные тенденции органической химии в университетах России, ЖУРНАЛ ОРГАНИЧЕСКОЙ ХИМИИ, 2018, Т | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| V.F.TRAVEN et al., One-pot synthesis of new | |||
Авторы
Даты
2021-06-25—Публикация
2020-11-26—Подача