Изобретение относится к медицине, а именно к инфекционным болезням, фтизиатрии и терапии, и может быть использовано для прогнозирования развития туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при клиническом течении ВИЧ-инфекции.
ВИЧ-инфекция остается одной из основных проблем глобального общественного здравоохранения. Напряженность эпидемиологической ситуации по ВИЧ-инфекции проявляется в неуклонном росте числа инфицированных ВИЧ и летальности среди заболевших людей. Прогрессия ВИЧ-ассоциированного иммунодефицита наиболее часто (в 60% случаев) приводит к развитию туберкулеза (ТБ), занимающего лидирующую позицию (в 50% случаев) среди причин смерти больных ВИЧ-инфекцией. Известно, что при туберкулезе у больных ВИЧ-инфекцией (коинфекция ВИЧ/ТБ) часто выявляется устойчивость к антитуберкулезной терапии за счет заражения лекарственно устойчивыми штаммами микобактерий туберкулеза. Множественная лекарственная устойчивость Mycobacterium tuberculosis (резистентность к двум и более препаратам, если ими являются изониазид и рифампицин) ведет к низким показателям излечения ТБ и более высокими показателям летальности в сравнении с пациентами с сохраненной лекарственной чувствительностью Mycobacterium tuberculosis.
Селекция лекарственно-устойчивых мутантных штаммов Mycobacterium tuberculosis обычно наблюдается на ранних этапах лечения, когда при неадекватных режимах терапии мутанты становятся резистентными. Большая часть чувствительных штаммов исчезает, проявляется клиническая лекарственная устойчивость (http://med.by/methods/pdf/28-9902.pdf).
Известно, что механизмы формирования лекарственной устойчивости либо чувствительности к фармакотерапии определяются и скоростью метаболизма в организме используемых лекарственных средств (ЛС). От последней зависит продолжительность и интенсивность фармакологического действия ЛС, т.е. эффективность терапии или отсутствие ожидаемого лечебного эффекта. Метаболизм ЛС осуществляется системой биотрансформации, состоящей из множества ферментов, специфичных для одной из трех фаз работы этой системы. В фазе I ферменты, такие как оксидазы цитохрома Р450, окисляют ЛС. Модифицированные ЛС посредством последующего ферментативного катализа конъюгируются с полярными соединениями в реакциях фазы II. Липофильные соединения превращаются в гидрофильные продукты, которые выводятся из организма в фазе III. Каталитическая активность ферментов обусловливает эффективность метаболизма ЛС. Поскольку многие ферменты являются продуктами экспрессии полиморфных генов, их действие генетически детерминировано, и от генотипа самого больного может зависеть возникновение нежелательной резистентности к назначаемым ЛС, являющимся субстратами метаболизирующих их ферментов.
Назначением настоящего изобретения является разработка способа определения генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции.
Назначение изобретения достигается с помощью способа определения генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции.
У пациентов с диагнозом ВИЧ-инфекции русской национальности проводят забор образцов венозной крови, выделение геномной ДНК, аллель-специфическую полимеразную цепную реакцию с целью генотипирования по полиморфным локусам NAT2Lys268Arg rs1208, NAT2Argl97Gln G590A rs1799930 и NAT2 Leu161Leu С481Т rs1799929 гена ариламин-ацетилтрансферазы 2 NAT2 и у носителей сочетания генотипов NAT2A803A × NAT2G590G × NAT2C481C прогнозируют развитие туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis с 10,775-кратным риском. Новизна изобретения:
1. Впервые изучено распределение частот встречаемости генотипов/аллелей однонуклеотидных полиморфизмов гена ариламин-ацетилтрансферазы 2 NAT2 -NAT2Lys268Arg A803G rs 1208, NAT2Arg197Gln G590A rs1799930 и NAT2Leu161Leu С481Т rs1799929 - у пациентов с клиническим течением коинфекции ВИЧ и туберкулез, резистентных и чувствительных к антитуберкулезной терапии.
2. Установлено, что пациенты с генотипом NAT2Arg197Gln G590G более подвержены к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции, нежели чувствительности, с 3,63-кратным риском.
3. Обнаружено, что носительство сочетания двух генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G усиливает риск формирования туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis до 10,65-кратного.
4. Носительство сочетания трех генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu C481C приводит к максимальному выявленному в данном исследовании риску развития туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis - 10,78-кратному.
5. Генотипирование по трем генотипам NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu C481C предлагается использовать в клинической практике для прогноза формирования туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции.
При известном прогнозе ответа пациента на определенную фармакотерапию возможно заблаговременное изменение тактики лечения и избежание формирования побочных реакций, неизбежных при использовании любых ЛС. Новый технический результат изобретения позволяет прогнозировать развитие туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis у больных ВИЧ и корректировать лечебную тактику ведения больных на этапе назначения лекарственных средств. В патентной и научной литературе отсутствуют сведения об аналогичном способе прогнозирования развития туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis у больных ВИЧ.
Причиной смерти больных коинфекцией ВИЧ/ТБ становится прогрессирование туберкулеза с полиорганным поражением. Одним из основных препаратов первого ряда для противотуберкулезного лечения является изониазид. Монотерапия туберкулеза изониазидом часто сопровождается развитием устойчивости возбудителя к этому антибиотику. Изониазид активен в отношении вне- и внутриклеточных Mycobacterium tuberculosis. Он метабо-лизируется в печени путем ацетилирования ферментом ариламин-ацетилтрансферазой 2 (NAT2) до неактивных метаболитов, и для реакции ацетилирования характерен полиморфизм ацетилирующего эффекта (Preziosi P. Isoniazid: metabolic aspects and toxicological correlates. Curr. Drug Metab. 2007; 8:839-851. doi:10.2174/138920007782798216).
Способность к ацетилированию можно измерить по реакции человека на лекарства, метаболизируемые ферментом, и теперь известно, что этот фенотип зависит от генотипа индивидуума в единственном кодирующем экзоне гена NAT2. Мутации в гене NAT2 действительно приводят к различным фенотипам ацетилирования, которые объясняют индивидуальные вариации в ответ на введение стандартной дозы лекарственного средства (от отсутствия терапевтической эффективности до побочных реакций на лекарства). В популяциях различают экстенсивных метаболизаторов с повышенной скоростью метаболизма, медленных метаболизаторов со сниженной скоростью биотрансформации и промежуточных метаболизаторов. У медленных метаболизаторов происходит синтез «дефектного» фермента либо отсутствует его продукция, ЛС накапливается в организме в высоких концентрациях, что приводит к появлению выраженных нежелательных лекарственных реакций - вплоть до интоксикации. У «сверхактивных» или «быстрых» метаболизаторов, т.е. лиц с повышенной скоростью биотрансформации ЛС результирующая концентрация ЛС в крови может быть недостаточна для достижения терапевтического эффекта. У пациентов, у которых наблюдается быстрая инактивация, ЛС рекомендуется применять в более высоких дозах.
Изоформы синтезированного фермента NAT2 отличаются аминокислотной последовательностью и активностью ацетилирующего эффекта, которая генетически детерминирована. Кодирующий ген NAT2 - локус широкого полиморфизма, который может существовать в более чем 20 аллельных формах.
Известно 95 вариантов (гаплотипов) гена NAT2, отличающихся одним (или более) однонуклеотидным полиморфизмом в 870-Ьр кодирующей области. Именно гаплотипы NAT2 определяют ацетилирующую способность (фенотип) кодируемого фермента. Активность ацетилирования in vivo у гомозиготных субъектов дикого типа значительно выше, чем у гетерозиготных генотипов. Все мутантные аллели показали низкую степень ацетилирования in vivo. Кроме того, отдельные «медленные» генотипы значительно различаются между собой по степени ацетилирования.
Таким образом, тип ацетилирования у человека влияет на продолжительность и интенсивность фармакологического действия ЛС, что может быть связано с развитием резистентности или чувствительности к соответствующим фармакопрепаратам. Тип ацетилирования можно определять генотипированием гена NAT2.
Показано, что полиморфный вариант гена NAT2 (rs1799931) ассоциирован с риском развития туберкулеза и оказывает значимое влияние на эффективность лечения пациентов с широкой лекарственной устойчивостью Mycobacterium tuberculosis (ШЛУ-ТБ) [M.M. Юнусбаева, Л.Я. Бородина, Ф.С. Билалов, Р.А. Шарипов, Т.Р. Насибуллин, Б.Б. Юнусбаев. Эффективность лечения туберкулеза с широкой лекарственной устойчивостью у пациентов с разным генотипом по генам ферментов биотрансформации CYP2B6 и NAT2. Туберкулез и болезни легких. 2020; 98 (6):40-46]. Работы по изучению генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции не проводились.
В связи с вышеизложенным целью настоящей работы явился поиск генотипов гена NAT2, носительство которых может предрасполагать к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции, и разработка способа определения генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции.
В исследование включены 70 больных коинфекцией ВИЧ и туберкулез (ВИЧ/ТБ) в возрасте от 24 до 54 (36,17±0,784) лет: - 43 мужчины, 61%, в возрасте от 27 до 49 (35,79±0,833) лет и 27 женщин, 39%, в возрасте от 24 до 54 (36,78±1,557) лет, находившихся на стационарном лечении в ГКУЗ Кемеровской области «Новокузнецком клиническом противотуберкулезном диспансере» г. Новокузнецка в период 2017-2019 гг. Из них МЛУ МБТ (резистентность одновременно к изониазиду и рифампицину) обнаружена у 47 пациентов (у 12 больных с МЛУ МБТ имелась дополнительная резистентность к фторхинолонам) в возрасте от 24 до 54 (35,85±0,982) лет, мужчин - 28 человек (60%), в возрасте от 27 до 48 (35,5±0,985) лет и женщин - 19 (40%) в возрасте от 24 до 54 (36,37±1,981) лет. Фенотипическое определение лекарственной чувствительности (ЛЧ) МБТ к препаратам основного (изониазид, рифампицин, этамбутол, стрептомицин) и резервного (канамицин, офлокса-цин, этионамид, капреомицин, циклосерин и ПАСК) рядов проводилось методом абсолютных концентраций на плотных питательных средах Левенштейна-Йенсена. Генотипическая экспресс-диагностика МЛУ МБТ проводилась с использованием GeneXpert MTB/RIF выявлением в биологическом материале (мокроте) ДНК МБТ и мутации в гене rpoB, ответственной за резистентность к рифампицину (маркер МЛУ). Лекарственная чувствительность к противотуберкулезным препаратам была установлена у 23 больных ВИЧ/ТБ (ЛЧ-ТБ). МЛУ МБТ (резистентность одновременно к изониазиду и рифампицину) была обнаружена у 47 (67,1%) пациентов, а в 12 случаях имелась дополнительная резистентность к фторхинолонам. Дополнительными критериями включения в исследование были проведение противотуберкулезной терапии [Федеральные клинические рекомендации по диагностике и лечению туберкулеза у больных ВИЧ-инфекцией, 2015 г. [Federal clinical guidelines for the diagnosis and treatment of tuberculosis in patients with HIV infection, 2015] http://roftb.ru/netcat_files/doks2016/rec2016.pdf] и согласие пациентов на участие в исследовании. Медиана количества CD4-лимфоцитов составила во всей выборке - 177,0 клеток/мкл (диапазон 9,0-1624,0 кле-ток/мкл), у пациентов с МЛУ-ТБ - 189,0 клеток/мкл (диапазон 50,0-1624,0 клеток/мкл), при ЛЧ-ТБ - 157,0 клеток/мкл (диапазон 9,0-930,0 клеток/мкл).
Постановка полимеразной цепной реакции (ПЦР)
Для выделения образцов геномной ДНК у каждого больного забирали по 3 мл цельной венозной крови из локтевой вены в стандартные пробирки, содержащие ЭДТА-K3 (IMPROVE, China). ДНК выделяли с помощью коммерческого реагента «ДНК-экспресс-кровь» (НПФ «Литех», Москва). Генотипирование проводили по полиморфным локусам гена N-ацетилтрансферазы2 - NAT2Lys268Arg A803G rs1208, NAT2Arg197GlnG590A rs1799930 и NAT2 Leu161Leu C481T rs1799929 - с помощью коммерческих комплектов реагентов «SNP-экспресс» (НПФ «Литех», Москва).
Статистический анализ. Статистическая обработка результатов исследования проводилась с использованием программ Microsoft® Excel® версия 14.4.6 (141106), Statistica 6.0, InStatll, SPSS. Относительный риск по конкретному признаку вычисляли как соотношение шансов (OR=odds ratio). Критический уровень значимости (Р) при проверке статистических гипотез принимался равным 0,05.
Способ осуществляется следующим образом. У каждого больного ВИЧ/ТБ забирают 3 мл крови из локтевой вены в коммерческие стерильные вакуумные одноразовые пластиковые пробирки, содержащие антикоагулянт ЭДТА-K3 (IMPROVE, China). Проводят центрифугирование при 3000 оборотов/минуту в течение 5 минут. Из клеточного осадка выделяют геномную ДНК. Генотипирование проводят по полиморфным локусам гена N-ацетилтрансферазы2 - NAT2Lys268ArgA803G rs1208, NAT2Arg197Gln G590A rs1799930 и NAT2Leu161Leu С481Т_rs1799929. При сочетании генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu С481С определяют генетическую предрасположенность пациента к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции с 10,775-кратным риском.
Результаты. В соответствии с результатами генотипирования обследованных лиц распределение частот генотипов всех тестируемых полиморфных локусов гена NAT2 соответствовало равновесию Харди-Вайнберга (табл. 1), что позволяет экстраполировать полученные данные на популяцию. Отличие от указанного равновесия по локусу NAT2G590A выявлено в когорте пациентов с МЛУ МБТ, что было обусловлено частой встречаемостью генотипа NAT2G592G. Более половины пациентов с МЛУ МБТ (66%) являлись его носителями. Соответственно, риск развития МЛУ МБТ в сравнении с ЛЧ МБТ у пациентов с ВИЧ/ТБ с генотипом NAT2G590G оказался высоким (OR=3,63, р=0,02), а риск развития ЛЧ МБТ - низким (OR=0,27, р=0,02). У гетерозигот NAT2G590A выявлен сниженный риск развития МЛУ МБТ, т.е. гетерозиготный генотип оказался протективным вариантом от МЛУ МБТ (OR=0,28, р=0,03) и располагающим к ЛЧ МБТ (OR=3,57, р=0,03).
По двум другим полиморфизмам NAT2A803G и NAT2C481T отличий в частотах носительства аллелей и генотипов между когортами пациентов с МЛУ МБТ и ЛЧ МБТ не обнаружено.
Результаты, представленные в табл. 2, показывают, что сочетание диких (нормальных) аллелей NAT2A803A × NAT2G590G в локусах NAT2A803G и NAT2G590A встречались у трети пациентов с МЛУ МБТ (33%) и всего лишь у 1 из 23 обследованных (4%) больных с ЛЧ МБТ. Выявлен 10,65-кратный риск развития МЛУ МБТ у носителей данного сочетания и, соответственно, очень низкая вероятность развития ЛЧ МБТ. Одновременное носительство дикого генотипа по третьему исследованному локусу NAT2C481T (сочетание генотипов NAT2A803A × NAT2G590G × NAT2C481C) не было обнаружено ни у одного пациента из когорты с ЛЧ МБТ. Поэтому вероятность развития МЛУ МБТ у носителей повысилась до OR=10,78.

Примечание: здесь и в последующих таблицах представлено число вариантов генотипов/аллелей в абсолютном значении (*) и в % (в круглых скобках); ** критерии соответствия равновесию Харди-Вайнберга


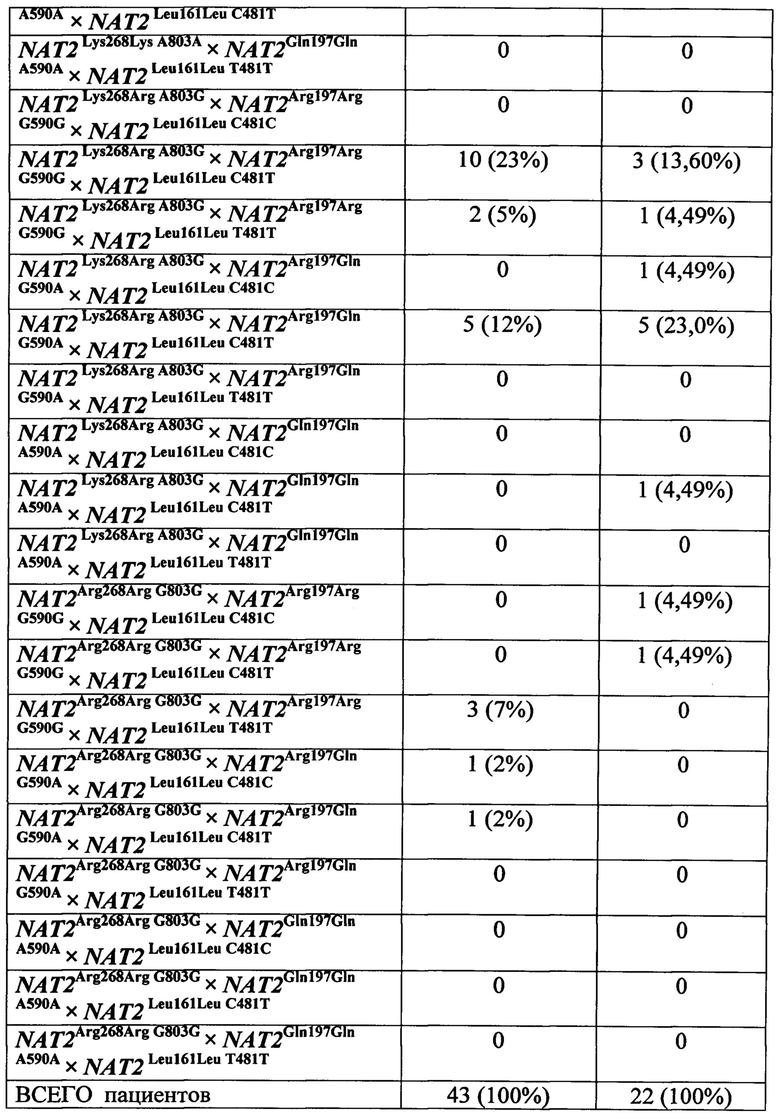
Таким образом, носительство сочетания генотипов NAT2A803A × NAT2G590G × NAT2C481C с высокой вероятностью предрасполагает к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции. А вероятность формирования лекарственной чувствительности Mycobacterium tuberculosis при таком носительстве крайне мала. Полученные данные позволяют предложить в клиническую практику способ прогнозирования развития туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis при ВИЧ-инфекции на основе генотипирования пациентов по трем полиморфным локусам гена NAT2.
Клинический пример №1.
Пациент Е., 1988 г.р., потребитель инъекционных наркотиков (ПИН) в течение многих лет. ВИЧ-инфекция была выявлена 7 лет назад во время пребывания в МЛС, APT ранее не принимал. ТБ ранее не болел, на учете у фтизиатра не состоял.
Заболел в течение 1 мес. до поступления, когда появились лихорадка до 38-39°С, боли в груди и кашель. Был госпитализирован в терапевтическое отделение общелечебной сети, откуда после выявления кислотоустойчивых микобактерий (КУМ) при микроскопии мазка мокроты (ММ) был направлен и госпитализирован в специализированное учреждение.
В ГКУЗ КО «Новокузнецкий клинический противотуберкулезный диспансер» был установлен диагноз диссеминированного туберкулеза (ТБ) с бактериовыделением по микроскопии ММ, а при молекулярно-генетическом исследовании мокроты (GeneXpert MTB/RIF) была выявлена ДНК Mycobacterium tuberculosis без обнаружения маркера МЛУ (т.е. без мутации в гене rpoB).
При обследовании по поводу ВИЧ-инфекции было установлено, что количество CD4-лимфоцитов составляло 683 кл./мкл, а вирусная нагрузка (ВН) - 33811 копий РНК ВИЧ в 1 мл.
Диагноз диссеминированного туберкулеза легких у больного ВИЧ-инфекцией в стадии вторичных заболеваний (4Б) был утвержден Центральной врачебной контрольной комиссией (ЦВКК) 27.11.2017 г.: диссеминированный ТБ легких, фаза распада, МБТ (+), чувствительность к рифампицину по МГМ, IA(+) диспансерного учета.
Учитывая, что по результатам молекулярно-генетического исследования мокроты не было выявлено маркер МЛУ, пациенту проводилась стандартная терапия по I режиму с применением изониазида, рифампицина, пиразинамида и этамбутола (всего были приняты 83 дозы препаратов), проводилась антимикробная терапия выявленного инфекционного эндокардита.
В период госпитализации были получены сведения о росте МБТ на плотных питательных средах из мокроты, взятой на исследование при выявлении - в 11.2017 г., а также данные об МЛУ МБТ (устойчивость к рифампицину, изониазиду, этамбутолу; чувствительность к препаратам второго ряда была сохранена).
В связи с выявлением МЛУ, врачебной комиссией (ВК) было принято решение о начале терапии по IV режиму химиотерапии (канамицн, лево-флоксацин, протионамид, циклосерин, ПАСК). На фоне проводимой терапии в стационаре состояние пациента было стабилизировано, уменьшились проявления воспалительной интоксикации, было отмечено прекращение бактериовыделения по ММ и частичное рассасывание легочной диссеминации через 4 мес. лечения по IV режиму.
В дальнейшем пациент в плановом порядке был выписан на амбулаторный этап лечения, где продолжал противотуберкулезную терапию. В дальнейшем амбулаторно лечился нерегулярно, привлечь для лечения пациента не удалось. Через 7 мес. с момента выявления ТБ (13.08.2020 г.) был констатирован летальный исход в связи с прогрессированием туберкулеза в отсутствие регулярной терапии.
Результаты генотипирования по полиморфным локусам
NAT2Lys268ArgA803G rs1208, NAT2Arg197GlnG590A rs1799930 и NAT2Leu161LeuC481T rs1799929 (посмертно): выявлено сочетание генотипов NAT2Lys268LysA803A × NAT2Arg197ArgG590G × NAT2Leu161Leu С481С указывающее на 10,775-кратный риск развития множественной лекарственной устойчивости Mycobacterium tuberculosis.
Клинический пример №2.
Пациент К., 1982 г.р., работающий. Ранее туберкулезом не болел. Туберкулез был выявлен впервые в марте 2017 г. при обращении в учреждение общелечебной сети. При обследовании были выявлены признаки туберкулеза легких, что стало основанием для направления пациента в противотуберкулезное учреждение.
В ГКУЗ КО «Новокузнецкий клинический противотуберкулезный диспансер» диагноз инфильтративного туберкулеза верхней доли справа, фаза распада, МБТ (-) у больного ВИЧ-инфекцией в стадии вторичных заболеваний (4Б) был подтвержден клинико-рентгенологически и утвержден Центральной врачебной контрольной комиссией (ЦВКК) 04.03.2017 г., пациент был взят в IA(-) диспансерного фтизиатрического учета.
В связи с исходным отсутствием бактериовыделения по мазкам мокроты и отрицательными результатами молекулярно-генетического исследования мокроты (GeneXpert MTB/RIF) (ДНК Mycobacterium tuberculosis не обнаружена) пациенту был назначен I режим химиотерапии ТБ (изониазид, ри-фампицин, пиразинамид и этамбутол). Лечение по I режиму проводилось амбулаторно.
ВИЧ-инфекция была впервые выявлена 1 год назад при плановом обследовании, APT ранее не принимал. В противотуберкулезном диспансере количество CD4-лимфоцитов - 306 клеток/мкл от 14.02.2018 г., вирусная нагрузка (ВН) - 43551 копий РНК ВИЧ в 1 мл.
Через 2 мес. лечения по I режиму были получены результаты посевов мокроты, взятой при выявлении туберкулеза в марте 2017 г. (рост МБТ 1+) и сведения о наличии МЛУ МБТ (устойчивость к рифампицину, изониазиду и стрептомицину; чувствительность к препаратам второго ряда была сохранена).
Результаты генотипирования по полиморфным локусам NAT2Lys268Arg A803G rs1208, NAT2Arg197Gln G590A rs1799930 и NAT2Leu161Leu С481Т rs1799929: выявлено сочетание генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu С481С, указывающее на 10,775-кратный риск развития множественной лекарственной устойчивости Mycobacterium tuberculosis.
Выявление МЛУ Mycobacterium tuberculosis стало основанием для назначения лечения по IV режиму (канамицн, левофлоксацин, протионамид, циклосерин, ПАСК) с планируемой длительностью не менее 24 мес, для чего пациент был госпитализирован. В отделении стационара врачом-инфекционистом была начата антиретровирусная терапия.
На фоне комбинированной терапии (противотуберкулезной и антирет-ровирусной) было достигнуто прекращение бактериовыделения через 1 мес, а полости распада были закрыты через 2 мес. лечения.
После 8 мес. интенсивной фазы терапии по IV режиму пациент был выписан на амбулаторный этап для проведения поддерживающей фазы с общей длительностью всего курса лечения не менее 24 мес После 24 мес.регулярного лечения курс признан эффективным с констатацией клинического излечения туберкулеза у пациента с ВИЧ-инфекцией.
Клинический пример №3.
Пациентка X., 1993 г. р., выявлена в январе 2017 г. при обращении в общелечебную сеть с жалобами на лихорадку до 38°С в течение недели. После отсутствия клинико-рентгенологического эффекта на фоне курса неспецифической антимикробной терапии по поводу предполагаемой внебольничной пневмонии была направлена в ГКУЗ КО «Новокузнецкий клинический противотуберкулезный диспансер» с связи с высоковероятным туберкулезом. Ранее туберкулезом не болела, на фтизиатрическом учете не состояла.
При поступлении в стационар НКПТД было выявлено бактериовыделение по микроскопии мазка мокроты (КУМ 1+), а при фибробронхоскопии были обнаружены признаки инфильтративного туберкулеза среднедолевого бронха с признаками стеноза.
По совокупности полученных данных было подтверждено наличие инфильтративного туберкулеза правого легкого, инфильтративного туберкулеза ср/долевого бронха, МБТ(+); диагноз был утвержден Центральной врачебной контрольной комиссией (ЦВКК) 23.01.2017 г., пациентка взята в 1А(+) группу диспансерного фтизиатрического учета.
В связи с исходным отсутствием возможности проведения молекулярно-генетического исследования мокроты (GeneXpert MTB/RIF) для экспресс-диагностики МЛУ-ТБ, больной X. проводилась терапия с применением стандартного I режима химиотерапии ТБ (изониазид, рифампицин, пиразинамид и этамбутол).
Результаты генотипирования по полиморфным локусам NAT2Lys268Arg A803G rs1208, NAT2Arg197Gln G590A rs1799930 и NAT2Leu161Leu С481Т rs1799929: выявлено сочетание генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu С481С указывающее на 10,775-кратный риск развития множественной лекарственной устойчивости Mycobacterium tuberculosis.
К моменту приема 95 доз противотуберкулезных препаратов были получены сведения о росте культуры Mycobacterium tuberculosis из мокроты, взятой при выявлении в январе 2017 г. (рост МБТ 1+). Тестирование выделенной культуры МБТ на лекарственную чувствительность показало наличие первичной МЛУ МБТ (устойчивость к рифампицину, изониазиду, этамбуто-лу и стрептомицину), чувствительность к препаратам второго ряда была сохранена.
Выявление МЛУ Mycobacterium tuberculosis стало основанием для назначения лечения по IV режиму (канамицн, левофлоксацин, протионамид, циклосерин, ПАСК) с планируемой длительностью терапии не менее 24 мес.
На фоне лечения к декабрю 2017 г. сформировались множественные туберкуломы, по поводу которых планировалось выполнение хирургическое вмешательства.
Исследование крови на антитела к ВИЧ методом ИФА было отрицательным дважды в период госпитализации (январь и апрель 2017 г.). ВИЧ-инфекция была впервые диагностирована в декабре 2017 г. (половой путь заражения в период лечения туберкулеза). При выявлении ВИЧ-инфекции количество CD4-лимфоцитов составило 957 клеток/мкл от января 2018 г., вирусная нагрузка (ВН) - 23405 копий РНК ВИЧ в 1 мл. От антиретровирсной терапии пациентка уклонялась.
В дальнейшем на фоне лечения по IV режиму лучевая картина соответствовала наличию множественных конгломератных туберкулом в ф. распада, диссеминации и частичного уплотнения. Было достигнуто прекращение бактериовыделения по ММ и посевам мокроты. Распространенность легочного поражения не позволяла провести хирургическое лечение торакального ТБ при ВИЧ-инфекции в отсутствие APT.
После 24 мес.консервативного противотуберкулезного лечения по IV режиму было констатировано завершение основного курса лечения, пациентка была переведена для наблюдения в группу хронического течения ТБ (II А(-)).
Изобретение относится к области медицины, в частности к инфекционным болезням, фтизиатрии и терапии. Предложен способ определения генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis. У пациентов группы риска проводят забор образцов венозной крови, выделение геномной ДНК, аллель-специфическую полимеразную цепную реакцию с целью генотипирования по полиморфным локусам rs1208, rs1799930 и rs1799929 гена ариламин-ацетилтрансферазы 2 NAT2. У носителей сочетания генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu С481С прогнозируют развитие туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis с 10,775-кратным риском. Изобретение позволяет прогнозировать развитие туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis у больных ВИЧ и корректировать лечебную тактику ведения больных на этапе назначения лекарственных средств. 1 з.п. ф-лы, 2 табл., 3 пр.
1. Способ определения генетической предрасположенности к развитию туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis, характеризующийся тем, что у пациентов группы риска проводят забор образцов венозной крови, выделение геномной ДНК, аллель-специфическую полимеразную цепную реакцию с целью генотипирования по полиморфным локусам гена ариламин-ацетилтрансферазы 2 NAT2 - NAT2Lys268Arg A803G rs1208, NAT2Arg197Gln G590A rs1799930 и NAT2Leu161Leu C481T rs1799929, и у носителей сочетания генотипов NAT2Lys268Lys А803А × NAT2Arg197Arg G590G × NAT2Leu161Leu С481С прогнозируют развитие туберкулеза с множественной лекарственной устойчивостью Mycobacterium tuberculosis с 10,775-кратным риском.
2. Способ по п. 1, отличающийся тем, что в группу риска входят пациенты русской национальности с диагнозом коинфекции ВИЧ и туберкулез.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЛЕТАЛЬНОГО ИСХОДА ПРИ КЛИНИЧЕСКОМ ТЕЧЕНИИ КОИНФЕКЦИИ ВИЧ И ТУБЕРКУЛЕЗ, СОПРОВОЖДАЮЩЕМСЯ МНОЖЕСТВЕННОЙ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТЬЮ MYCOBACTERIUM TUBERCULOSIS | 2019 |
|
RU2710266C1 |
| WO 2014139330 A1, 18.09.2014 | |||
| CN 106119363 A, 16.11.2016 | |||
| МАЛЬЦЕВА Н.В | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Фармакогенетика и фармакогеномика | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2021-07-01—Публикация
2020-12-23—Подача