Область техники
Настоящее изобретение относится к области медицинской химии, фармакологии, медицины и касается применения ряда сульфозамещенных химических соединений в качестве ингибиторов лактатдегидрогеназы А человека, которая необходима для выживания опухолевых клеток.
Уровень техники
Лактатдегидрогеназа А (ЛДГ-А) человека катализирует превращение продукта гликолиза пирувата в лактат, сопровождающееся окислением NADH до NAD+. Во многих опухолевых клетках наблюдается изменение метаболизма, называемое эффектом Варбурга: активация превращения пирувата с помощью ЛДГ-А и снижение окисления пирувата в митохондриях [Нилов Д.К., Куликов А.В., Прохорова Е.А., Швядас В.К. (2016) Acta Naturae, 8, 129-133; Hamanaka R.B., Chandel N.S. (2012) J. Exp. Med., 209, 211-215]. Одной из причин усиления гликолитической активности является увеличенная экспрессия ЛДГ-А [Koukourakis M.I., Giatromanolaki A., Sivridis E., Bougioukas G., Didilis V., Gatter K.C., Harris A.L. (2003) Br. J. Cancer, 89, 877-885]. Данный фермент является перспективной мишенью в терапии опухолей, так как играет важную роль в обеспечении жизни и пролиферации опухолевых клеток [Miao P., Sheng S., Sun X., Liu J., Huang G. (2013) IUBMB Life, 65. 904-910; Granchi C., Paterni I., Rani R., Minutolo F. (2013) Future Med. Chem., 5, 1967-1991; Zhang S.L., He Y., Tam K.Y. (2018) Drug Discov. Today, 23, 1407-1415], и в настоящее время весьма актуальна разработка широкого спектра соединений для подавления активности ЛДГ-А. Анализ научной литературы и патентных документов показал, что предлагаемые сульфозамещенные соединения ранее не применялись для ингибирования ЛДГ-А человека, и не было описано их влияние на пролиферацию опухолевых клеток. Ближайшим к заявляемому средству для ингибирования ЛДГ-А, прототипом, является производное этансульфоновой кислоты, содержащее бензотиазольную группу [Нилов Д.К., Куликов А.В., Прохорова Е.А., Швядас В.К. (2016) Acta Naturae, 8, 129-133]. Недостатком данного соединения является невысокая ингибиторная активность в отношении ЛДГ-А (IС50 > 1 мМ).
Раскрытие изобретения
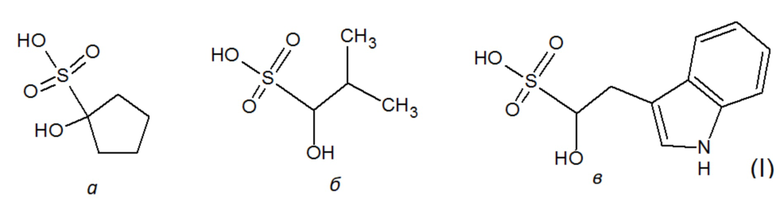
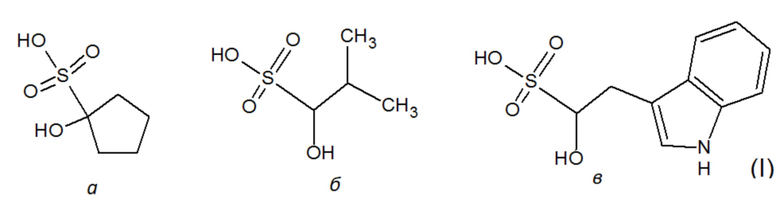
Технической задачей изобретения является применение сульфозамещенных химических соединений с гидроксильной группой в положении 1 в качестве ингибиторов ЛДГ-А человека. Технический результат заключается в подавлении активности очищенного фермента в микромолярном диапазоне концентраций (значение IC50 ≥ 380 мкМ), а также в подавлении пролиферации опухолевых клеток на примере линии А549 (рак легкого). Поставленная техническая задача решается тем, что в качестве средства для ингибирования ЛДГ-А человека предлагается использовать сульфозамещенные соединения формулы (I):
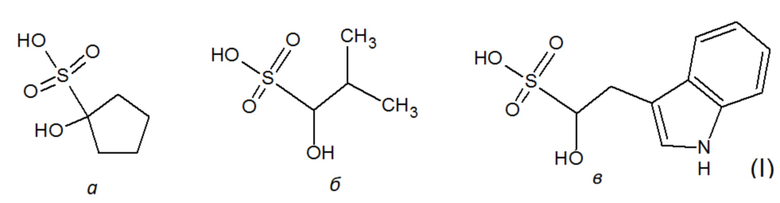
или их фармацевтически приемлемые соли, например, натриевая, калиевая, аммониевая, холиновая и др. соли.
Поскольку сульфокислоты характеризуются низким значением pKa<1, такие соединения в биологических системах будут находиться в виде аниона при любом молекулярном окружении. Инвариантным структурным элементом, обуславливающим базовую ингибиторную активность данных соединений, является сульфогруппа, а также гидроксильная группа в положении 1. Структура соединений известна из баз данных коммерчески доступных низкомолекулярных веществ Sigma-Aldrich (https://www.sigmaaldrich.com; идентификационный номер S510246 - 1-hydroxy-1-cyclopentanesulfonate) и Vitas-M (http://vitasmlab.biz; идентификационные номера STK330556 - 1-hydroxy-2-(1H-indol-3-yl)ethanesulfonate и STK332172 - 1-hydroxy-2-methylpropane-1-sulfonate).
Краткое описание чертежей
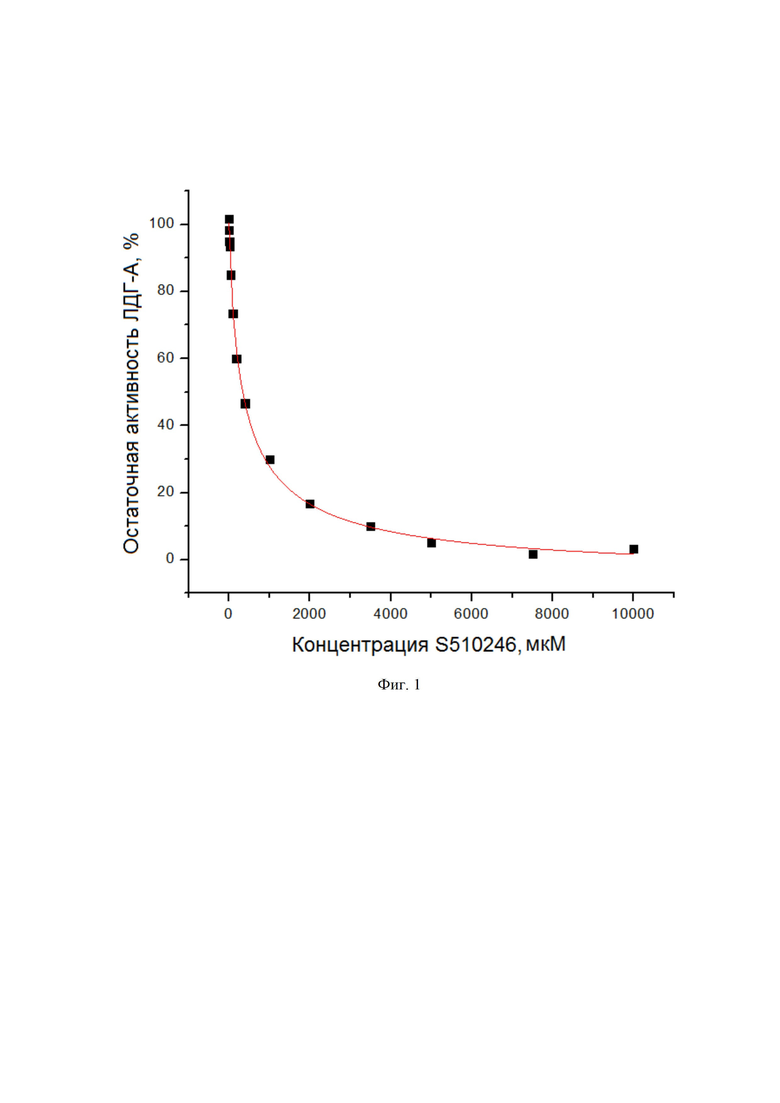
На Фиг. 1 представлена зависимость активности ЛДГ-А от концентрации ингибитора S510246 (соединение Iа), измеренная по методике А.
Осуществление изобретения
Ниже представлено более подробное описание заявляемого изобретения. Настоящее изобретение может подвергаться различным изменениям и модификациям, понятным специалисту на основе прочтения данного описания. Такие изменения не ограничивают объем притязаний.
Для исследования ингибиторной и антипролиферативной активности, а также потенциальной канцерогенности использовали следующие методики:
Методика А. Тестирование ингибиторной активности соединений проводили в отношении рекомбинантной ЛДГ-А человека (Sigma-Aldrich) при концентрациях субстратов, равных значениям соответствующих констант Михаэлиса (300 мкМ пируват, 10 мкМ NADH). Для приготовления реакционной смеси и проведения измерений использовали 0,1 М натрий-фосфатный буфер (pH 7,5 при 37°С). Раствор фермента, содержащий 1% (г/мл) бычьего сывороточного альбумина, готовили непосредственно перед измерениями. Активность ЛДГ-А измеряли спектрофотометрически при 340 нм по уменьшению поглощения NADH в реакции превращения пирувата в лактат. Измерения проводили с использованием спектрофотометра Shimadzu UV-1800. В кювету помещали реакционную смесь, содержащую буфер, пируват, NADH и тестируемый ингибитор, термостатировали в течение 8 мин при 37°С, после чего начинали реакцию добавлением аликвоты фермента и регистрировали начальную скорость. Для определения значения IC50 концентрацию ингибитора варьировали от 0 до 10 мМ.
Методика Б. Определение антипролиферативной активности проводили в отношении опухолевых клеток на примере линии А549 (рак легкого) с помощью МТТ-теста. Данный метод основан на способности живых клеток перерабатывать MTT-реагент в формазан. Количество образующегося формазана, которое затем определяется спектрофотометрически, находится в прямой зависимости от количества живых клеток. Клетки рассаживали в 96-луночный планшет и инкубировали в течение 24 ч в культуральной среде ДМЕМ. Далее клеточную среду заменяли на свежую, содержащую различные концентрации ингибитора, после чего клетки инкубировали в течение 72 ч. Далее в каждую лунку добавляли MTT-реагент (10 мкл в концентрации 5 мг/мл) и инкубировали в течение 3 ч, после чего измеряли интенсивность поглощения с помощью микропланшетного ридера Multiskan FC. Для определения значения CC50 (цитотоксичная концентрация, вызывающая гибель 50% клеток) концентрацию ингибитора варьировали от 0 до 10 мМ.
Методика В. Потенциальную канцерогенность исследовали с помощью генетического теста Эймса на Salmonella typhimurium. Данный метод является стандартом для исследования мутагенного потенциала химического соединения (оценивается приобретенная способность штамма расти в среде, не содержащей гистидин). Для проведения теста Эймса использовали индикаторные бактериальные штаммы TA100 и TA98. Для изучения мутагенного эффекта возможных метаболитов анализируемого ингибитора в отдельной серии экспериментов использовали смесь ферментов микросомного окисления (смесь S9), полученную из печени крыс. В 0,7% L-агар без гистидина последовательно вносили препарат ингибитора, суспензию бактерий, и смесь S9 (либо соответствующий объем буфера). После полного застывания L-агара чашки Петри помещали в термостат при 37°С, подсчет мутировавших колоний проводили через 48-72 часа инкубации.
Результаты тестирования ингибиторных свойств соединений в отношении очищенного фермента человека (примеры 1-3) приведены в таблице 1.
Таблица 1. Влияние соединений в концентрации 1 мМ на активность ЛДГ-А человека, определенное по методике А.
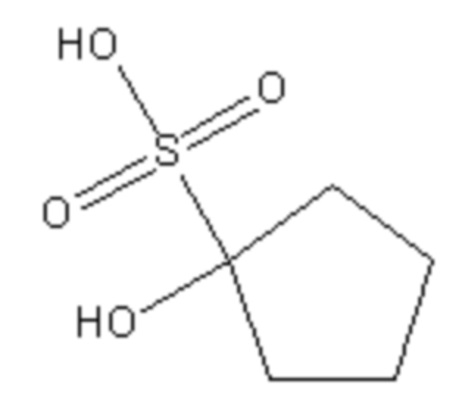 Ia
Ia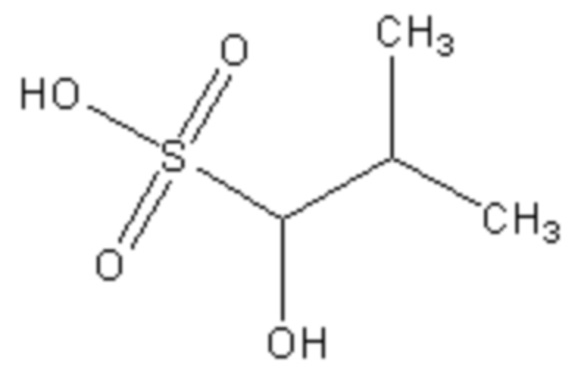 Iб
Iб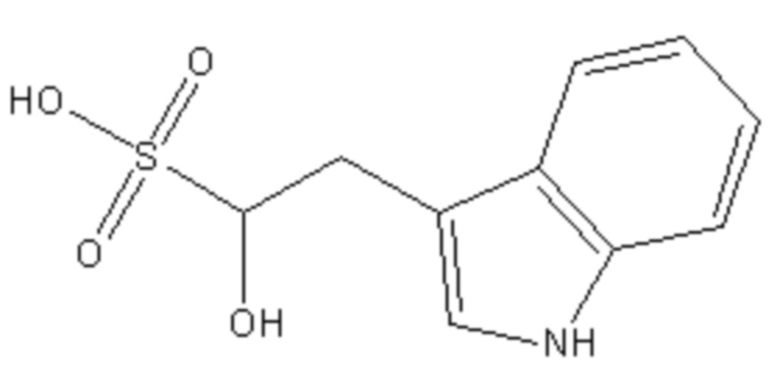 Iв
Iв
Пример 4. Значение IC50 для наиболее эффективного ингибитора S510246 было определено по методике А путем варьирования его концентрации (см. фиг. 1) и составило 380 мкМ. Данный пример свидетельствует о способности предложенных ингибиторов эффективно подавлять активность ЛДГ-А человека.
Пример 5. Значение CC50 (концентрация, вызывающая гибель 50% клеток) для наиболее эффективного ингибитора S510246 в отношении клеток А549 было определено по методике Б и составило 1,5 мМ. Данный пример свидетельствует о способности предложенных ингибиторов подавлять пролиферацию опухолевых клеток.
Пример 6. В тесте Эймса, проведенном по методике В, добавление S510246 в дозах 1000, 500, 50 и 5 мкг на чашку не приводило к увеличению числа мутировавших колоний TA100 и TA98. В пределах чувствительности метода, S510246 не обладал мутагенной активностью (в том числе в присутствии метаболической системы S9, полученной от млекопитающих), что свидетельствует о безопасности предложенных ингибиторов.
Представленные примеры демонстрируют, что испытанные ингибиторы способны подавлять активность ЛДГ-А в микромолярном диапазоне концентраций, а также могут быть использованы для подавления пролиферации опухолевых клеток.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕОБРАТИМЫЙ ИНГИБИТОР Ca-АДЕНОЗИНТРИФОСФАТАЗЫ САРКОПЛАЗМАТИЧЕСКОГО РЕТИКУЛУМА | 2001 |
|
RU2194756C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАГРУЖЕННЫХ БЕЛКОМ ПОЛИЭЛЕКТРОЛИТНЫХ НАНО- И МИКРОКАПСУЛ | 2007 |
|
RU2369386C2 |
| ШТАММ БАКТЕРИЙ SALMONELLA TYPHIMURIUM ВКПМ B-14359, УСТОЙЧИВЫЙ К СУЛЬФОНИЛМОЧЕВИНАМ И ТРИАЗОЛПИРИМИДИНАМ, ДЛЯ ВЫЯВЛЕНИЯ ПОТЕНЦИАЛЬНОЙ МУТАГЕННОСТИ ХИМИЧЕСКИХ ВЕЩЕСТВ В ТЕСТЕ ЭЙМСА | 2023 |
|
RU2814258C1 |
| МИКРОДИАГНОСТИКУМ И СПОСОБ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 2006 |
|
RU2316769C1 |
| Полипептиды для лечения онкологических заболеваний | 2017 |
|
RU2728870C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ, СОДЕРЖАЩЕЕ ПРОИЗВОДНОЕ ДИСОРАЗОЛА | 2003 |
|
RU2322236C2 |
| СПОСОБ ОЦЕНКИ ПОТЕНЦИАЛЬНОЙ МУТАГЕННОСТИ СУЛЬФОНИЛМОЧЕВИН И ТРИАЗОЛПИРИМИДИНОВ С ПРИМЕНЕНИЕМ ТЕСТА ЭЙМСА НА ИНДИКАТОРНЫХ ШТАММАХ SALMONELLA TYPHIMURIUM | 2022 |
|
RU2794797C1 |
| СПОСОБ МОДУЛИРОВАНИЯ МЕТАБОЛИЗМА ЭЙКОЗАНОИДОВ | 2006 |
|
RU2438684C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ГЛИЦЕРАЛЬДЕГИД-3-ФОСФАТДЕГИДРОГЕНАЗЫ МИКОБАКТЕРИЙ | 2017 |
|
RU2661151C1 |
| НЕОБРАТИМЫЙ ИНГИБИТОР Н,К - АДЕНОЗИНТРИФОСФАТАЗЫ | 2001 |
|
RU2186108C1 |
Изобретение относится к применению сульфонатов формулы (I) для ингибирования лактатдегидрогеназы А человека:
1 ил., 1 табл., 6 пр.
Применение сульфонатов формулы (I)
 ,
,
а также их фармацевтически приемлемых солей в качестве ингибиторов лактатдегидрогеназы А человека.
| Нилов Д.К., Куликов А.В., Прохорова Е.А., Швядас В.К | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| WO 2003047558 A2 12.06.2003 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Schlecht, Matthew F.; | |||
Авторы
Даты
2021-07-07—Публикация
2020-07-29—Подача