Изобретение относится к области клеточной биологии и биотехнологии, а именно к клеточным технологиям, в частности к способам получения применяемых в диагностике, регенеративной терапии клеток человека, содержащих компоненты, позволяющие отслеживать их в организме человека и крупных животных.
Применение клеточных технологий в терапии широкого спектра заболеваний делает возможным комплексное и целенаправленное лечение серьезных нарушений различного генеза. Однако возникает необходимость разработки методов прижизненного мечения клеток in vitro для отслеживания клеточной миграции и адгезии после их введения в организм человека. Разработанные ранее методы прижизненного мечения клеток люминофорами и флюофорами пригодны только для небольших организмов или для исследований post mortem [Progatzky F., Dallman M.J., Lo Celso C. From seeing to believing: labelling strategies for in vivo cell-tracking experiments. Interface Focus, 2013, 3: 20130001]. Методы радиоактивного мечения клеток представляют угрозу для пациента и влияют на физиологию трансплантируемых клеток, снижая скорость пролиферации [Detante О., Moisan A., Dimastromatteo J., et al. Intravenous administration of 99mTc-HMPAO-labeled human mesenchymal stem cells after stroke: in vivo imaging and biodistribution // Cell Transplant. 2009; 18(12):1369-1379] и дифференцировки [Brenner W., Aicher A., Eckey Т., et al. 111In-labeled CD34+ hematopoietic progenitor cells in a rat myocardial infarction model. J Nucl Med. 2004; 45:512-518].
Перспективным считается использование метода магнитно-резонансной томографии (МРТ) для визуализации вводимых клеток. Использование МРТ требует разработки способа прижизненного мечения клеток, при котором клетки захватывают частицы контрастирующего агента, удерживают их и могут быть визуализированы методом МРТ, при этом сохраняя свою жизнеспособность, пролиферативный статус и функциональные свойства. Однако многие разработанные контрастирующие материалы не удовлетворяют требованиям безопасности при прохождении доклинических испытаний. Так, контрастирующие препараты на основе гадолиния оказались токсичными для клеток и пациентов [Нао D., Ai Т., Goerner F., et al. MRI contrast agents: Basic chemistry and safety // J. Magn. Reson. Imaging, 2012, 36: 1060-1071]. Наиболее популярными и перспективными представляются препараты на основе суперпарамагнитных частиц оксида железа, покрытых различными органическими оболочками для защиты частиц от клеток и клеток от частиц оксида железа. Однако некоторые из таких препаратов вызывают нежелательные побочные эффекты, например, большинство контрастирующих агентов на основе покрытых декстраном частиц оксида железа, в том числе и самый известный из них - Ferridex, - сняты с производства в связи с высокой частотой нежелательных побочных эффектов [https://www.mr-tip.com/serv1.php?type=db1&gid=767, дата обращения: 15.11.2019; https://www.drugs.com/pro/feridex.html, дата обращения: 15.11.2019].
Разработка способа прижизненного мечения клеток, при котором клетки захватывают частицы контрастирующего агента, удерживают их и могут быть визуализированы методом МРТ, при этом сохраняя свою жизнеспособность, пролиферативный статус и функциональные свойства представляется актуальной.
В большинстве случаев в качестве контрастирующего агента используются наночастицы размером до 100 нм или суперпарамагнитные частицы (SPION, диаметр до 20 нм) оксида железа (смесь оксидов, формула смеси Fe3O4), покрытые какими-либо органическими веществами (декстран, полиэтиленимин и т.д.) для улучшения проникновения в клетку и снижения цитотоксичности и т.п. [Rakesh М.Р., Nanasaheb D.T., Prajkta B.S., et al. Comprehensive cytotoxicity studies of superparamagnetic iron oxide nanoparticles // Biochemistry and Biophysics Reports, 2018, 13:63-72]. Однако уже в концентрации до 80 мкг/мл таких частиц начинает проявляться цитотоксичность препаратов [Rezaei М., Mafakheri Н., Khoshgard K., et al. The Cytotoxicity of Dextran-coated Iron Oxide Nanoparticles on Hela and MCF-7 Cancerous Cell Lines // IJT. 2017; 11(5):31-36]. В такой концентрации цитотоксичность незначительна: 10-15%. По нашим собственным данным, для успешной визуализации SPION-меченых клеток на клинических МРТ-томографах необходима концентрация частиц свыше 100 мкг/мл, оптимально 150-300 мкг/мл. Однако можно ожидать, что такая концентрация магнитных частиц будет высокотоксична для клеток.
В известных из уровня техники препаратах для мечения клеток обычно используют SPION, полученные методом проведения химических реакций. В статье Zhu Х.М., Wang Y.X., Leung K.С., et al. Enhanced cellular uptake of aminosilane-coated superparamagnetic iron oxide nanoparticles in mammalian cell lines // Int J Nanomedicine. 2012; 7:953-964 описываются способы синтеза наночастиц, при которых сердцевину из оксида железа синтезируют щелочным соосаждением двух частей хлорида железа и одной части сульфата железа в растворе NaOH в атмосфере азота при перемешивании. Осадок отделяют с помощью магнита и промывают деоксигенированной водой. Частицы SPIO@SiO2 и SPIO@SiO2-NH2 получают реакцией гидролиза тетраэтоксисилана или (3-аминопропил) триэтоксисилана на поверхности наночастиц SPIO. Для получения наночастиц SPIO@dextran декстран с молекулярной массой 70 кДа предварительно растворяют в растворе NaOH и кипятят с обратным холодильником в течение 2 часов, затем этот раствор по каплям добавляют к диспергированным в ультразвуке наночастицам SPIO в воде с рН 3. Смесь перемешивают и кипятят с обратным холодильником в течение 30 минут. Продукты отделяют магнитом и промывают деоксигенированной водой.
Подобные способы получения суперпарамагнитных наночастиц трудоемки и дорогостоящи, кроме того, полученные этими способами препараты содержат остаточные следы используемых цитотоксичных веществ.
Суперпарамагнитные наночастицы магнетита, или оксида железа Fe3O4, полученные методом электрического взрыва проводника в атмосфере воздуха, не содержат побочных продуктов химических реакций, легкодоступны и дешевле покрытых аналогов. Такие частицы были использованы в качестве контрастирующего агента, предположительно отвечающего требованиям безопасности для клеток. В работе: Левчук К.А., Шумеев А.Н., Золина Т.Л., Котова А.В., Александрова Л.В., Багаева В.В., Айзенштадт А.А., Коткас И.Е., Масленникова И.И., Енукашвили Н.И. Метод прижизненного мечения мезенхимных стромальных клеток человека суперпарамагнитными частицами магнетита / Трансляционная медицина: от теории к практике: Материалы 5-й научно-практической конференции молодых ученых и специалистов // под ред. д.м.н. А.В. Силина. - СПб.: Изд-во СЗГМУ им. И.И. Мечникова, 2017. - с. 54-55 описан способ получения культуры меченых мезенхимных стромальных клеток (ММСК) из пупочного канатика и жировой ткани человека. Способ заключается в том, что ММСК инкубируют в культуральной среде, содержащей 200 нг/мл нанопорошка магнетита с размером частиц 5-20 нм в течение 24 часов. Предварительно суспензию наночастиц обрабатывают ультразвуком с частотой 37 кГц для того, чтобы разбить агрегаты наночастиц. После 24-часовой инкубации с частицами магнетита клеточные культуры ММСК сохраняли жизнеспособность на уровне контроля, то есть 95% от общего количества клеток, и содержали захваченные наночастицы. Однако по нашим собственным данным этот способ не позволяет получить устойчиво воспроизводящийся результат. Кроме того, он требует слишком большого времени инкубации клеточной культуры с наночастицами магнетита. Частицы размером 5-20 нм требуют покрытия органическими компонентами (декстран и т.д.) для предотвращения агрегации, что является трудозатратной и дорогостоящей процедурой. При этом увеличивается фактический размер частиц, а значит, уменьшается их количество на клетку, что приводит к ухудшению степени визуализации при сканировании. Кроме того, в России не производится нанопорошок магнетита с таким размером частиц, поэтому их использование неудобно, нецелесообразно и зависит от дорогостоящего и долго поставляемого сырья.
Задачей настоящего изобретения является создание способа получения культуры меченых клеток, обеспечивающего стабильное и воспроизводимое мечение клеток с сохранением их жизнеспособности и пролиферативного статуса, с возможностью визуализации клеток методом МРТ.
Поставленная задача решается тем, что в способе получения культуры меченых клеток нанопорошок магнетита со среднеарифметическим размером частиц 80-110 нм соединяют с жидкой фазой, полученную суспензию обрабатывают ультразвуком с частотой и длительностью, достаточной для диспергирования крупных агрегатов. Полученную суспензию наночастиц выдерживают не менее 10 минут для получения микроагрегатов размером не более 5 мкм, в оптимальном варианте средний размер макроагрегатов около 1 мкм. Полученную суспензию микроагрегатов вносят в культуру клеток, выращенную до не более 80% конфлуэнтности, до концентрации 50-600 мкг/мл, и затем выдерживают культуру клеток в среде для культивирования с упомянутыми микроагрегатами в течение 2-14 часов при температуре в диапазоне 37°С.
В отличие от прототипа, в заявляемом способе используют доступный и относительно недорогой порошок магнетита со среднеарифметическим размером частиц 80-110 нм, при этом концентрация частиц в суспензии выше в 250-3000 раз, что обеспечивает количество частиц, необходимое для эффективного мечения всех клеток в культуре. Кроме того, выдерживание культуры клеток в присутствии микроагрегатов магнетита производят в течение более короткого времени, что обеспечивает лучшую сохранность и пролиферативные свойства клеток. Многочисленные повторения способа показали, что он воспроизводим, клетки жизнеспособны, способны к пролиферации, и также их можно визуализировать с помощью МРТ [Коткас И.Е., Енукашвили Н.И., Асадулаев Ш.М., и др. Визуализация распределения аутологичных мезенхимальных клеток введенных в организм пациента, страдающего циррозом печени алиментарной этиологии // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова, 2017, 9(4):76-78; Коткас И.Е., Асадулаев Ш.М., Марченко Н.В., Енукашвили Н.И. Оценка изменений биохимических показателей крови у пациента с диагнозом цирроза печени на фоне использования аутологичных мезенхимальных стволовых клеток. Экспериментальная и клиническая гастроэнтерология 2018; 150(2): 174-176; Коткас И.Е., Асадулаев Ш.М., Енукашвили Н.И., и др. Возможность визуализации распределения в организме человека аутологичных мезенхимальных клеток, введенных в артериальное русло печени // Медицинская визуализация, 2017, 6:72-75.]. Суспензию микроагрегатов магнетита добавляют любым доступным способом, как в культуральной жидкости, так и в сбалансированном солевом растворе.
В одном из вариантов осуществления способа используют нанопорошок магнетита, полученный методом электрического взрыва проводников. Этот метод позволяет получить полидисперсный порошок частиц без примесей побочных продуктов, что происходит при синтезе наночастиц методом химических реакций.
В одном из вариантов осуществления способа в качестве культуры клеток используют культуру мезенхимных стволовых клеток, в другом варианте осуществления способа используют культуру фибробластов. Для мечения используют культуру любых клеток, пригодных для введения в организм человека или животных, например культуру мезенхимных стволовых клеток или культуру фибробластов. Выбор конкретных клеток зависит от типа лечения и ограничивается только медицинскими показаниями.
В одном варианте осуществления способа после выдерживания в суспензии микроагрегатов магнетита клетки промывают и рассевают в соотношении не ниже допустимого предела концентрации. Это обеспечивает увеличение количества меченых клеток и дополнительно удаляет микроагрегаты магнетита, которые не проникли внутрь клеток, а прикрепились к ним снаружи.
Задача решается также тем, что при осуществлении заявленного способа получается культура меченых клеток для введения в организм человека.
Изобретение иллюстрируется следующими графическими материалами.
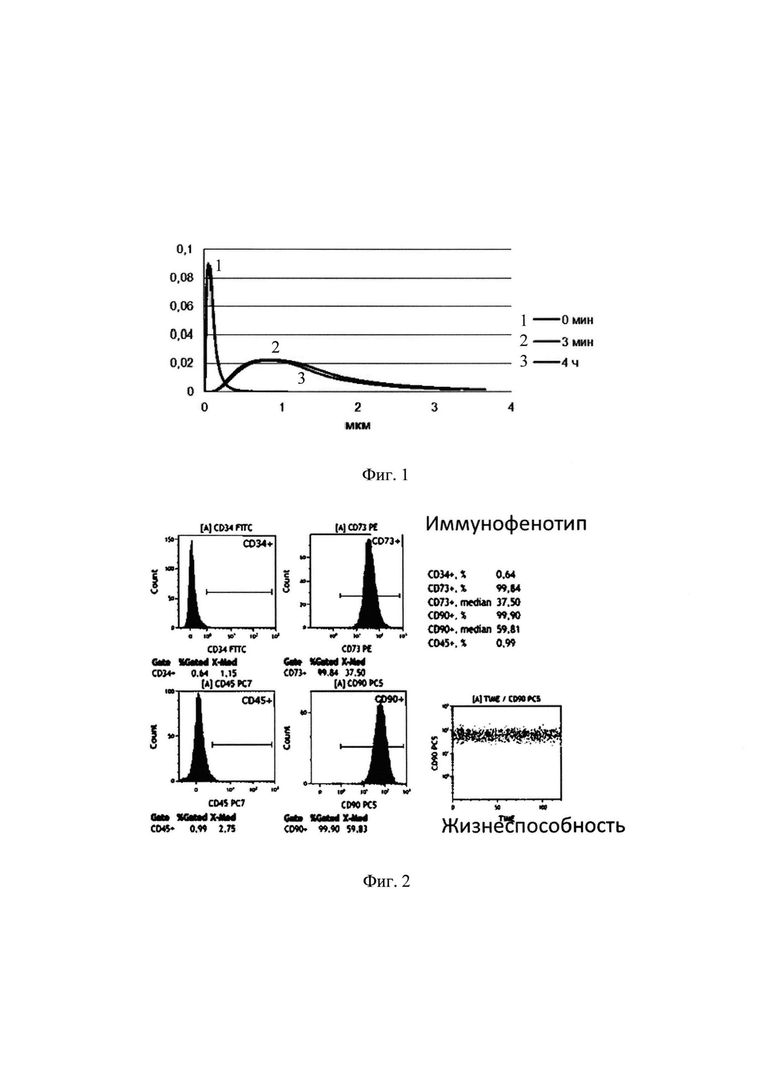
На Фиг. 1. представлены кривые распределения частиц по размеру сразу после обработки ультразвуком (линия 1), через 3 и 4 часа после отключения мешалки (линии 2 и 3). Размер частиц определяли методом лазерной дифракции.
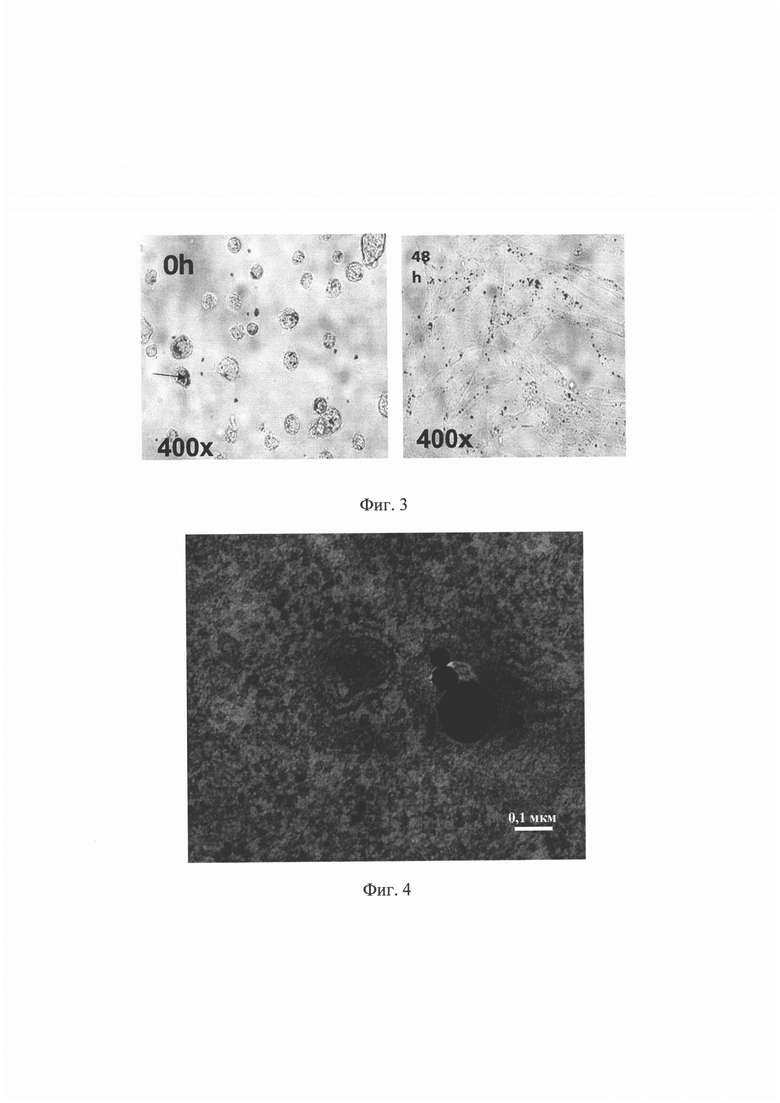
На Фиг. 2. представлены данные анализа иммунофенотипа и жизнеспособности клеток, содержащих микроагрегаты оксида железа. На четырех гистограммах приведены примеры проточной цитометрии меченых клеток по положительным (CD73, CD90) и отрицательным (CD34, CD45) маркерам. Также приведен усредненный иммунофенотип. Жизнеспособность определяли методом окрашивания 7-AAD. Процент неокрашенных клеток (99,49) соответствует проценту живых клеток.
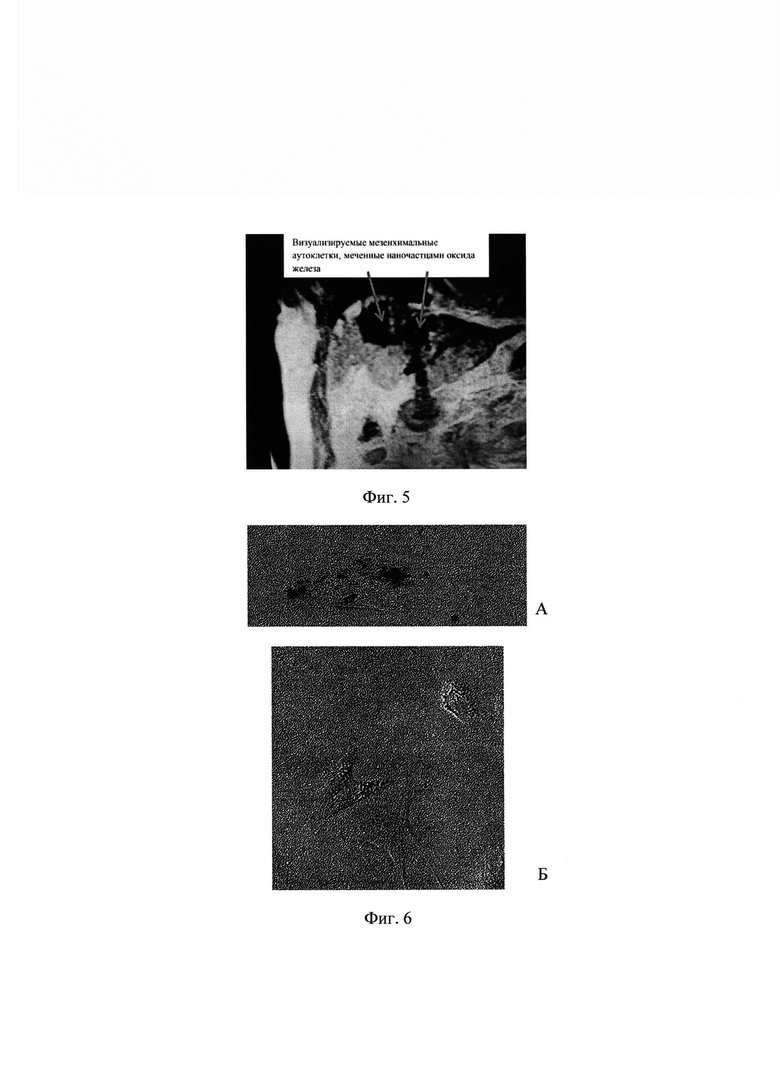
На Фиг. 3. Внешний вид культуры клеток, содержащих микроагрегаты оксида железа, после криоконсервации (0 h) и последующей культивации в течение 2 суток (48 h).
На Фиг. 4. представлена электронная микрофотография тонкой ультраструктуры клеток, содержащих микроагрегаты оксида железа.
На Фиг. 5. представлен МРТ органов брюшной полости (из: Коткас И.Е., Енукашвили Н.И., Асадулаев Ш.М., и др. Визуализация распределения аутологичных мезенхимальных клеток, введенных в организм пациента, страдающего циррозом печени алиментарной этиологии // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова, 2017, 9(4):76-78).
На Фиг. 6. представлен вид МСК, содержащих микроагрегаты оксида железа в день трансплантации (А) и клеток, выделенных через 1 год из биоптата печени в области трансплантации (Б).
Способ осуществляли следующим образом.
Пример 1. Получение культуры меченых мезенхимных стволовых клеток.
В пенициллиновый флакон, содержащий 30 мг нанопорошка магнетита с размером частиц 80-110 нм (ООО «Передовые порошковые технологии», Томск), добавляли 10 мл стерильного физиологического раствора, перемешивали и переносили в 15 мл пробирки. Далее пробирки обрабатывали ультразвуком с частотой 37 кГц в течение 15 минут, встряхивая пробирку каждые 3 минуты. Полученная взвесь частиц с концентрацией частиц 3 мг/мл стабильна в течение суток. Измерение размеров частиц (Фиг. 1) показало, что средний размер частиц после УЗ обработки составляет 80-100 нм, однако в течение 10 минут образуются микроагрегаты 0,5-1,5 мкм (80% 0,9-1,1 мкм) и далее размер микроагрегатов не меняется в течение 12 часов. Перед применением 1 мл полученной взвеси микроагрегатов переносили в 4 мл или 9 мл физиологического раствора или культуральной среды, таким образом получали готовый препарат микроагрегатов с концентрацией 600 мкг/мл или 300 мкг/мл соответственно. Взвесь микроагрегатов с концентрацией 300 мкг/мл при необходимости использовали для получения взвесей с меньшей концентрацией микроагрегатов.
Первичный материал биоптата печени или жировой ткани получали операционным путем в объеме 100 мкл. Ткани печени выдерживали в 0,1% растворе коллагеназы I и IV типов в течении 20 минут в термошейкере при температуре 37°С при постоянном помешивании. Полученную смесь центрифугировали, надосадочную жидкость удаляли, осадок ресуспендировали в 4 мл питательной среды, например, среды Advanced Stem Cell Media (HyClone, Германия) с добавлением 20% фетальной коровьей сыворотки для стволовых клеток (СК) или заменителя сыворотки Advanced Supplement for Stem Cells (HyClone, Германия) и 10 мкг/мл раствора пенициллина-стрептомицина (HyClone, Германия). Помещали суспензию клеток в культуральный флакон площадью 25 см2. Помещали флаконы в СО2-инкубатор, например, BBD 6220 (Thermo, Германия) при температуре 37°С, время экспозиции 3-5 суток в зависимости от состояния клеток. Далее СК культивировали известным способом культивирования мезенхимных СК.
При достижении 80% конфлюэнтности, меняли среду, добавляя в нее взвесь микроагрегатов с концентрацией 3, 30, 50, 100, 200, 300 или 600 мкг\мл. Для этого удаляли старую среду и добавляли 27 мл готовой новой среды и 3 мл приготовленного готового раствора с микроагрегатами. Перед добавлением взвеси микроагрегатов ее необходимо хорошо ресуспендировать. Далее клетки инкубировали в среде с микроагрегатами от 2 до 14 часов, после чего среду удаляли и заменяли на новую, без микроагрегатов. Клетки включали микроагрегаты во всем диапазоне концентрации микроагрегатов и времени инкубирования. Дальнейшие эксперименты по выявлению меченых клеток на МРТ показали, что доступны для визуализации меченые клетки, инкубировавшиеся во взвеси микроагрегатов с концентрацией не ниже 50 мкг/мл.
Иммунофенотип и жизнеспособность клеток, содержащих микроагрегаты оксида железа определяли методом проточной цитометрии меченых клеток по положительным (CD73, CD90) и отрицательным (CD34, CD45) маркерам. На Фиг. 2 приведены результаты анализа, а также приведен усредненный иммунофенотип. Жизнеспособность клеток определяли методом окрашивания 7-AAD. Процент неокрашенных клеток (99,49) соответствует проценту живых клеток (Фиг. 2).
Пример 2. Получение культуры меченых фибробластов.
Первичный материал биоптата кожи площадью 0,8-1 см2 был получен операционным путем. Удаляли остатки жировой ткани, эпителий. Препарировали дермальный слой и инкубировали его в 0, 1% растворе коллагеназы I и IV типов в течении 45 минут в термошейкере при температуре 37°С при постоянном помешивании. Полученную смесь центрифугировали, надосадочную жидкость удаляли, осадок ресуспендировали в 0,1% растворе коллагеназы I и IV типов и трипсина и инкубировали еще 30 мин. Отмывали диссоциированный биоптат от ферментов и ресуспендировали в 4 мл питательной среды, например, среды Advanced Stem Cell Media (HyClone, Германия) с добавлением 20% фетальной коровьей сыворотки для СК или заменителя сыворотки Advanced Supplement for Stem Cells (HyClone, Германия) и 10 мкг/мл раствора пенициллина-стрептомицина (HyClone, Германия). Помещали суспензию клеток в культуральный флакон площадью 25 см2.
При достижении 80% конфлюэнтности, инкубировали клетки с взвесью микроагрегатов, как описано в Примере 1.
Пример 3. Жизнеспособность клеток после криоконсервации
Клетки МСК выращивали и вводили метку как описано в Примере 1. По достижении конфлюэнтности 80% клетки снимали с подложки раствором трипсина : Версена, отмывали от этого раствора центрифугированием в культуральной среде и ресуспендировали в криосреде, содержащей 50% фетальной бычьей сыворотки, 8% диметилсульфоксида и 42% ДМЕМ с низким содержанием глюкозы. Клетки замораживали с использованием программируемого устройства для замораживания клеток CryoMed (Thermofisher Sci). Замороженные клетки хранили в жидком азоте 2-5 мес. Клетки размораживали, погружая пробирки в водяную баню при 37°С, после этого отмывали клетки от криосреды и высевали при стандартных условиях культивирования, описанных в примере 1. Оценивали наличие в клетках наночастиц оксида железа, жизнеспособность клеток, возможность их пассирования (пересева). На Фиг. 3 представлены данные, подтверждающие наличие в клетках наночастиц после криоконсервации, а также способность меченых клеток расти в культуре после размораживания.
Пример 4. Исследование тонкой ультраструктуры клеток, содержащих микроагрегаты, методом электронной микроскопии.
Для оценки тонкой ультраструктуры клеток готовили препараты для электронной микроскопии стандартным способом после фиксации глутаровым альдегидом. На электронных микрофотографиях видно, что микроагрегаты магнетита окружены мембраной, отделяющей их от остального пространства клетки. (Фиг. 4).
Пример 5. Выявление меченых клеток после трансплантации в организм человека.
У пациента К., 59 лет с диагнозом цирроза печени алиментарной этиологии был произведен забор жировой ткани на внутренний поверхности бедра с последующим выделением из нее мезенхимальных клеток. В дальнейшем выполнялось 4 пассажа культивирования выделенных мезенхимальных клеток. Полученные в результате культивирования клетки были помечены микрочастицами оксида железа, как описано в примере 1. В дальнейшем выполнена селективная ангиография на уровне собственной печеночной артерии с последующим введением меченых аутологичных мезенхимальных клеток в количестве 25 миллионов. Через сутки после введения клеток в собственную печеночную артерию, пациенту выполнена магнитно-резонансная терапия органов брюшной полости. По результатам данного исследования было возможно визуально оценить распределение введенных клеточных структур в ткани печени. Все введенные в собственную печеночную артерию клеточные структуры зафиксировались у данного пациента преимущественно в левой доле печени, в области II и III сегментов (Фиг. 5, из: Коткас И.Е., Енукашвили Н.И., Асадулаев Ш.М., и др. Визуализация распределения аутологичных мезенхимальных клеток введенных в организм пациента, страдающего циррозом печени алиментарной этиологии // Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова, 2017, 9(4):76-78). Через 1 год при проведении стандартной диагностической биопсии по медицинским показаниям 1/5 биоптата высеяли в культуральную среду как описано в примере 1. В культивируемых клетках оценивали наличие наночастиц железа как методом морфологического анализа культур, так и методом окрашивания берлинской лазурью. При микроскопическом анализе культур показано присутствие микроагрегатов оксида железа как непосредственно перед трансплантацией (Фиг. 6А), так через год после трансплантации (Фиг. 6Б).
Заявитель просит рассмотреть представленные материалы заявки «Способ получения культуры меченых клеток» на предмет выдачи патента РФ на изобретение.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2009 |
|
RU2496482C2 |
| Способ получения частиц гематита с помощью сильных минеральных кислот | 2020 |
|
RU2770641C1 |
| Способ получения частиц на основе гематита для доставки генетических конструкций в клетку | 2020 |
|
RU2780664C2 |
| Способ получения частиц для специфического таргетинга клеток | 2020 |
|
RU2777103C2 |
| КОНТРАСТНОЕ СРЕДСТВО ДЛЯ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ | 2011 |
|
RU2465010C1 |
| МАГНИТНО-РЕЗОНАНСНОЕ И РЕНТГЕНОВСКОЕ КОНТРАСТНОЕ СРЕДСТВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2497546C1 |
| ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ, ПОКРЫТЫЕ ОКСИДОМ МАГНИТНОГО МЕТАЛЛА, И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2472530C2 |
| МАГНИТНО-РЕЗОНАНСНОЕ И РЕНТГЕНОВСКОЕ КОНТРАСТНОЕ СРЕДСТВО НА ОСНОВЕ СЛОЖНОГО ОКСИДА ЖЕЛЕЗА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2419454C1 |
| ПОЛУЧЕНИЕ КРАЙНЕ МАЛЫХ И ОДНОРОДНЫХ ПО РАЗМЕРУ ПАРАМАГНИТНЫХ ИЛИ ПСЕВДОПАРАМАГНИТНЫХ НАНОЧАСТИЦ НА ОСНОВЕ ОКСИДА ЖЕЛЕЗА И, С ИХ ИСПОЛЬЗОВАНИЕМ, КОНТРАСТНЫХ ВЕЩЕСТВ ДЛЯ Т1-РЕЖИМА МРТ | 2011 |
|
RU2540472C2 |
| Способ использования мезенхимальных стволовых клеток для улучшения состояния рубца на матке | 2018 |
|
RU2699029C1 |
Изобретение относится к области клеточной биологии и биотехнологии. Предложен способ получения культуры меченых клеток, включающий обработку суспензии нанопорошка магнетита со среднеарифметическим размером частиц 80-110 нм в жидкой фазе ультразвуком с частотой и длительностью, достаточной для диспергирования крупных агрегатов, с последующим выдерживанием не менее 10 минут; затем вносят культуру клеток с конфлюэнтностью не более 80% до концентрации 50-600 мкг/мл и выдерживают в течение 2-14 ч при 37°С. Изобретение обеспечивает повышение жизнеспособности и пролиферативной активности меченых клеток, применяемых в диагностике методом МРТ. 4 з.п. ф-лы, 6 ил., 5 пр.
1. Способ получения культуры меченых клеток, заключающийся в том, что нанопорошок магнетита со среднеарифметическим размером частиц 80-110 нм соединяют с жидкой фазой, полученную суспензию обрабатывают ультразвуком с частотой и длительностью, достаточной для диспергирования крупных агрегатов, и не раньше, чем через 10 минут после этого, вносят до концентрации 50-600 мкг/мл в предварительно выращенную до не более 80% конфлюэнтности культуру клеток, выдерживают в течение 2-14 часов при температуре 37°С, при этом в качестве жидкой фазы может быть использована любая жидкость, совместимая с содержанием и/или культивированием клеток.
2. Способ по п. 1, при котором используют нанопорошок магнетита, полученный методом электрического взрыва проводников.
3. Способ по п. 1 или 2, при котором в качестве культуры клеток используют культуру мезенхимных стволовых клеток.
4. Способ по п. 1 или 2, при котором в качестве культуры клеток используют культуру фибробластов.
5. Способ по любому из пп. 1-4, при котором после выдерживания в суспензии магнетита клетки промывают и рассевают в соотношении не ниже допустимого предела концентрации.
| ЛЕВЧУК К.А | |||
| и др | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СПб.: Изд-во СЗГМУ им | |||
| И.И | |||
| Мечникова, 2017, с | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| МИЛЬТО И.В | |||
| "Биологические эффекты | |||
Авторы
Даты
2021-07-15—Публикация
2019-12-30—Подача