ПРИОРИТЕТ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке на индийский патент №201641027529, поданной 11 августа 2016, полное содержание которой для всех целей включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение в целом относится к соединениям и композициям для лечения синдрома раздраженного кишечника (СРК). Более подробно, настоящее изобретение относится к лечению субъектов с помощью фармацевтически приемлемой дозы соединений, кристаллов, сольватов, энантиомеров, стереоизомеров, сложных эфиров, солей, гидратов, пролекарств или их смесей.
УРОВЕНЬ ТЕХНИКИ
[0003] По мнению гастроэнтерологов, синдром раздраженного кишечника (СРК) является «сложным» состоянием, включающим существенные психологические и психиатрические компоненты. Была показана связь между синдромом раздраженного кишечника (СРК) и гастроэзофагеальным рефлюксом, между гастроэзофагеальным рефлюксом и астмой, а также, относительно недавно, между СРК и гиперреактивностью бронхов (ГРБ). Такую связь трудно объяснить, поскольку она затрагивает две физиологические системы. Одно из возможных объяснений заключается в том, что желудочно-кишечные и респираторные симптомы первопричинного нарушения способны вызывать симптомы более чем в одной физиологической системе и приводить к косвенной связи между, казалось бы, несравнимыми состояниями. Существует ряд подтверждающих вероятных механизмов: один из них представляет собой генерализованное нарушение бронхиальной, желудочно-кишечной и другой гладкой мускулатуры.
[0004] Синдром раздраженного кишечнка (СРК или спастический колит (спастический толстый кишечник) представляет собой диагноз на основе симптомов, характеризующийся хронической болью в животе, дискомфортом, вздутием живота и изменением частоты и характера стула. Для СРК, являющегося функциональным расстройством кишечника, не выявлено органических причин. Могут преобладать диарея или запор, или они могут чередоваться. Ранее являющийся диагнозом исключения СРК теперь может быть диагностирован только на основе симптомов, при отсутствии «сигнальных» признаков, таких как начало заболевания в возрасте более 50 лет, потеря веса, значительная по объему гематохезия, системные признаки инфекции или колита, или воспалительное заболевание кишечника в семейном анамнезе. Наиболее вероятно возникновение СРК после инфекции (постинфекционный), стрессового события или наступления зрелости.
[0005] Некоторые состояния могут проявляться как СРК, включая целиакию, малабсорбацию фруктозы, легкие инфекции, паразитарные инфекции, такие как лямблиоз, некоторые воспалительные заболевания кишечника, малабсорбация желчных кислот, функциональный хронический запор, избыточный бактериальный рост в тонком кишечнике и хроническая функциональная боль в животе. При СРК рутинные клинические исследования не выявляют никаких отклонений, хотя кишечник может быть более чувствителен к определенным раздражителям, таким как исследование с раздуванием баллона. Точная причина СРК неизвестна. Наиболее распространенная теория заключается в том, что СРК представляет собой нарушение взаимодействия между мозгом и желудочно-кишечным трактом, хотя также возможны отклонения в микрофлоре кишечника или иммунной системе.
[0006] В настоящее время в области техники существует потребность в новых композициях для лечения или отсрочки наступления синдрома раздраженного кишечника (СРК) и развития связанных с ним осложнений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] В настоящем изобретении предложены соединения, композиции, содержащие указанные соединения, и способы их применения для лечения, предотвращения и/или облегчения эффектов состояний, таких как синдром раздраженного кишечника (СРК).
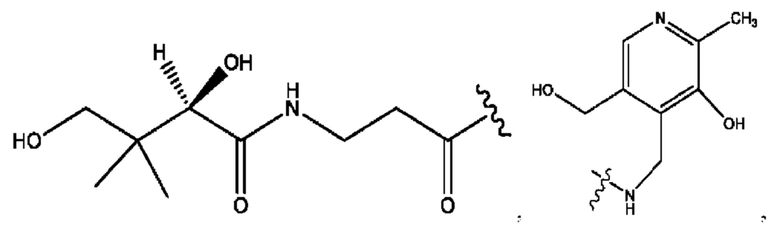
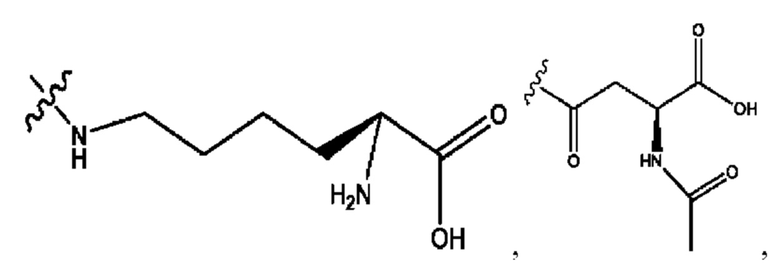
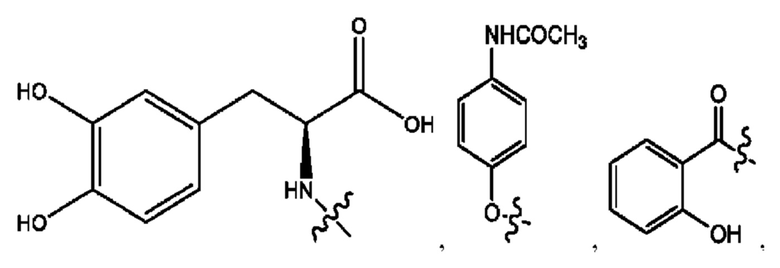
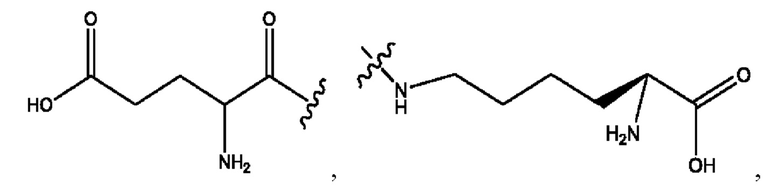
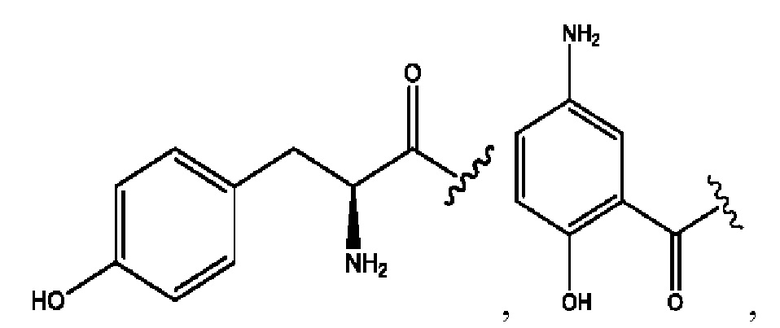
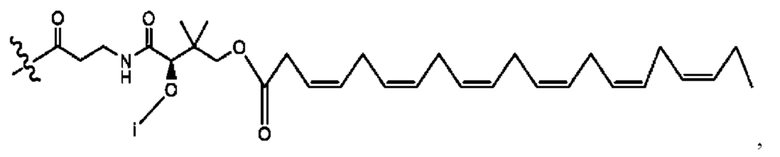
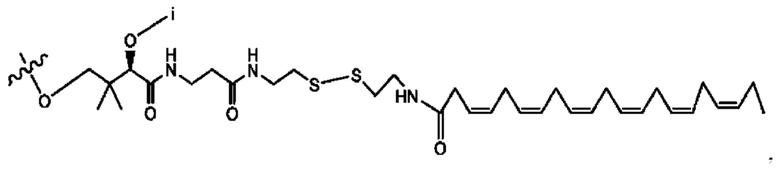
[0008] В настоящем изобретении предложены композиции, содержащие соединение формулы I или его фармацевтически приемлемые соли. Также в настоящем изобретении предложены фармацевтические композиции, содержащие одно или более соединений формулы I или его промежуточных соединений и один или более фармацевтически приемлемых носителей, наполнителей или разбавителей. Такие композиции могут применяться в лечении синдрома раздраженного кишечника (СРК) и связанных с ним осложнений.
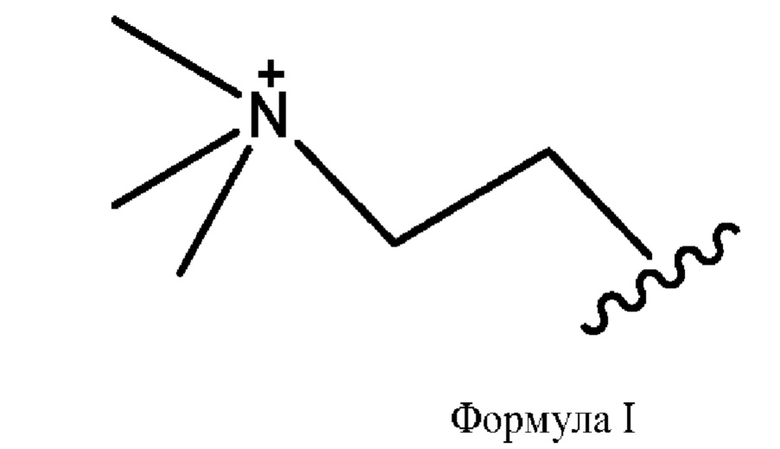
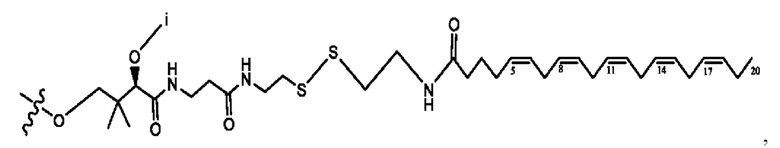
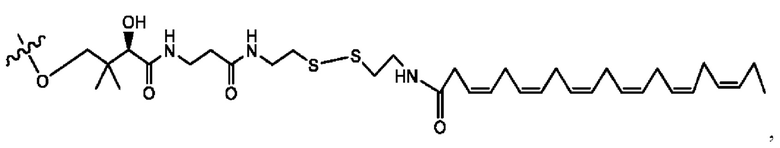
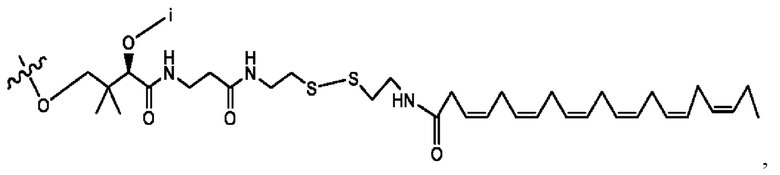
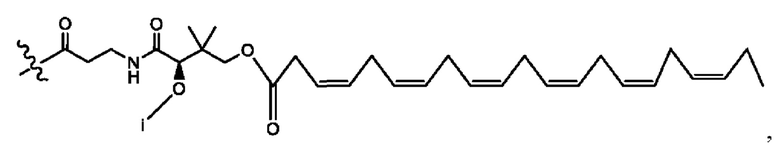
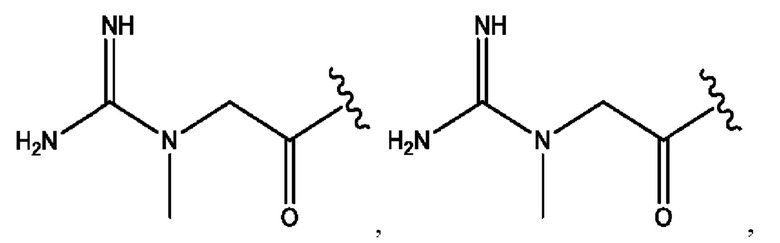
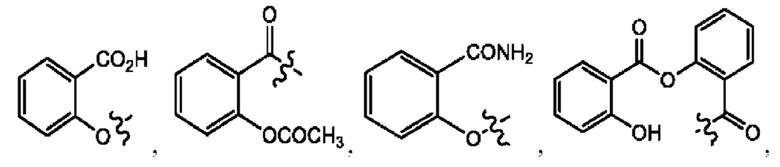
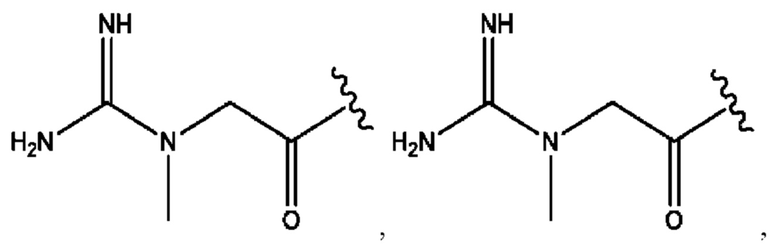
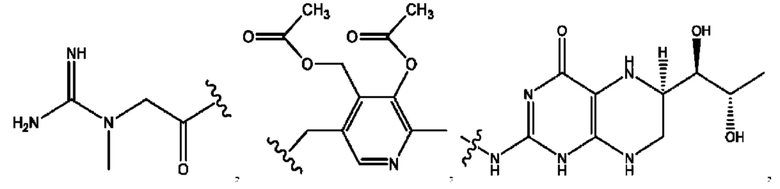
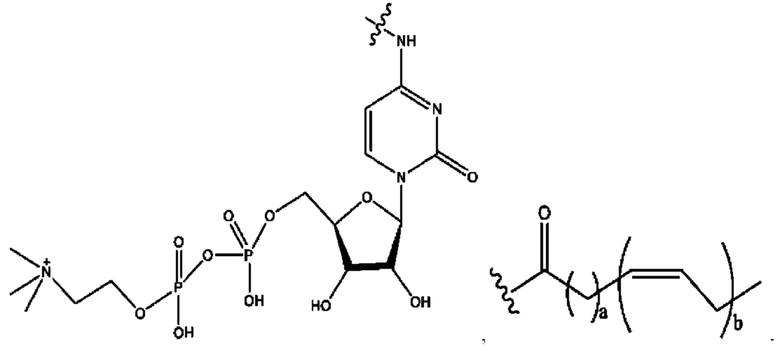
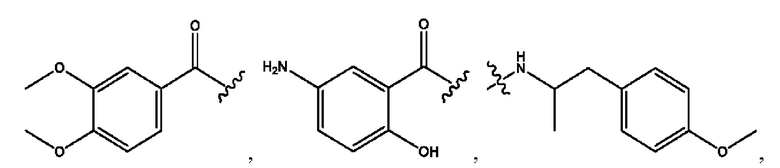
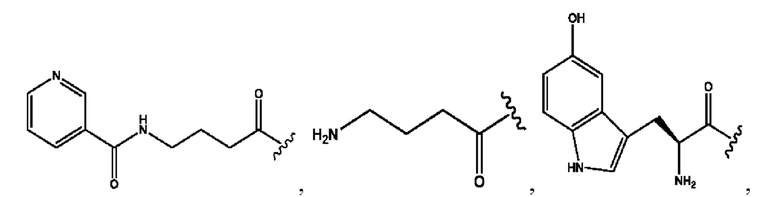
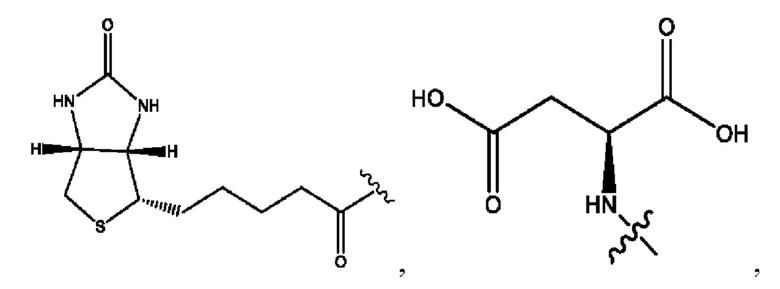
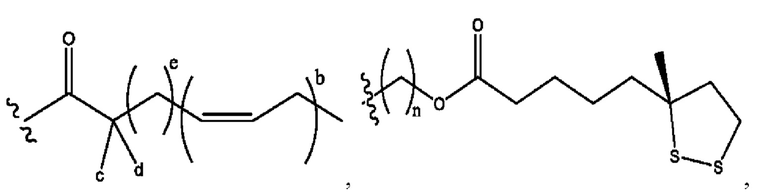
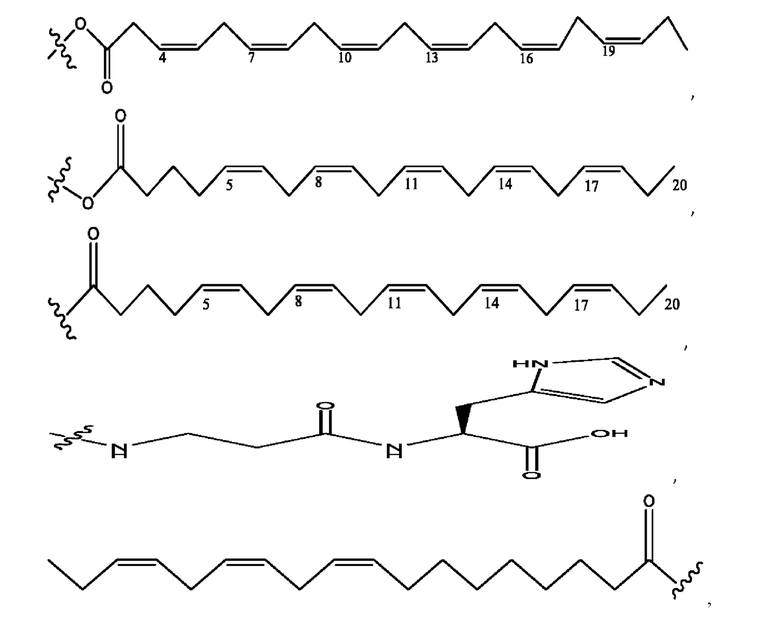
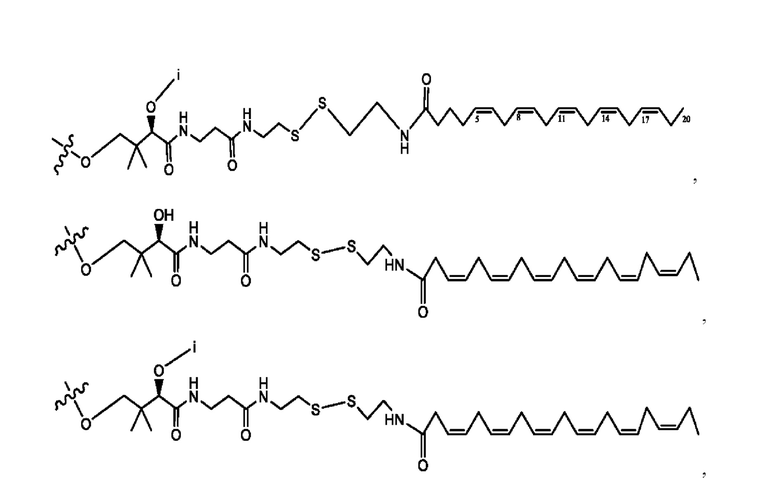
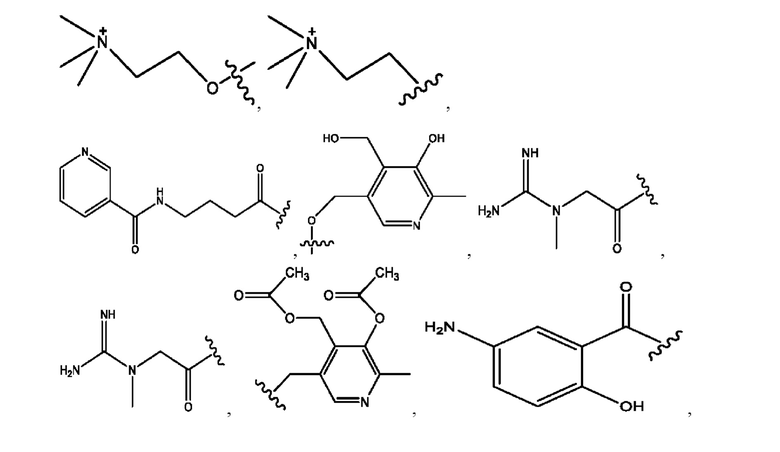
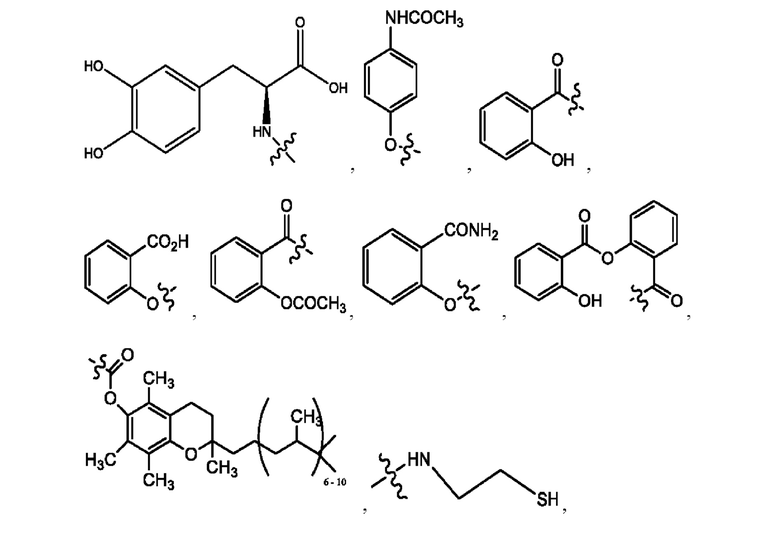
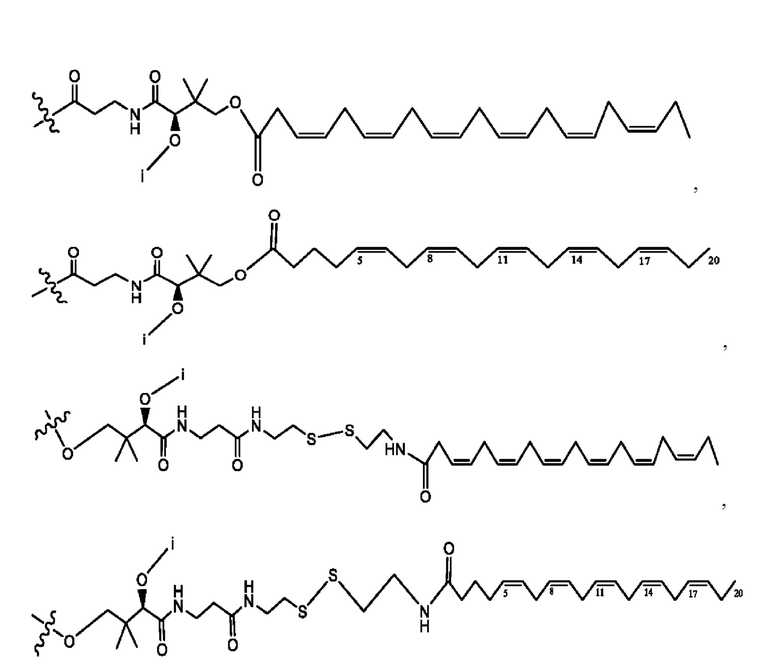
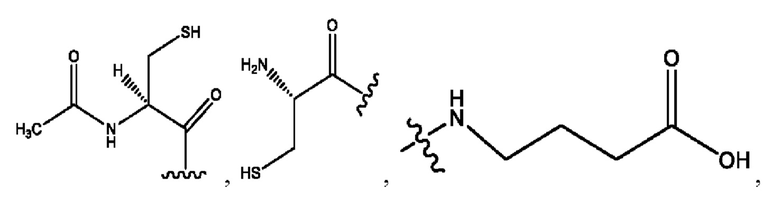
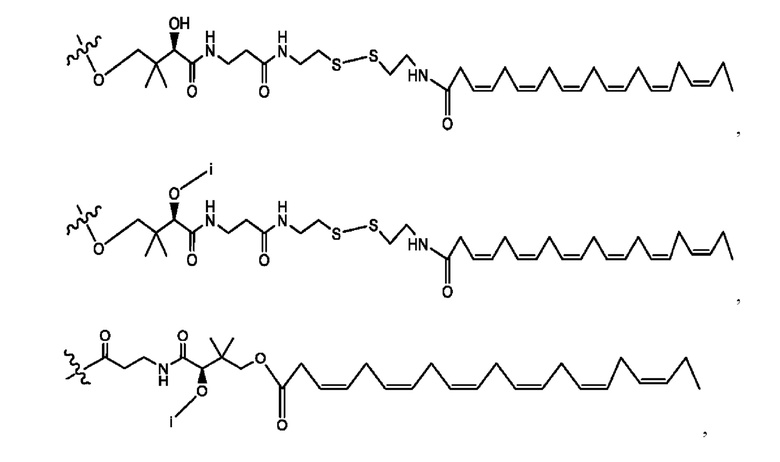
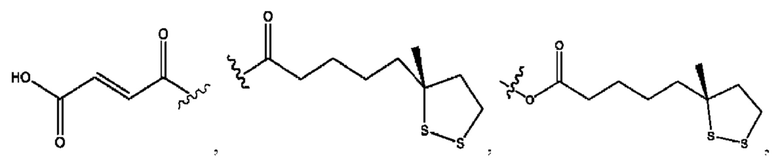
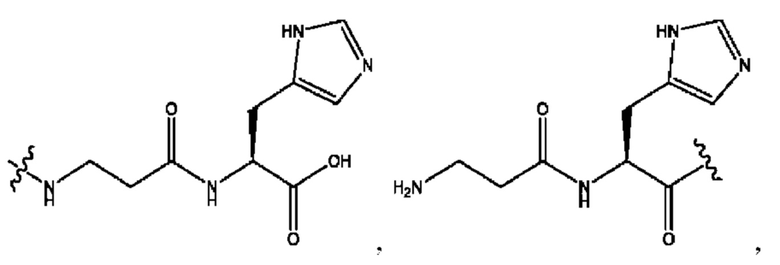
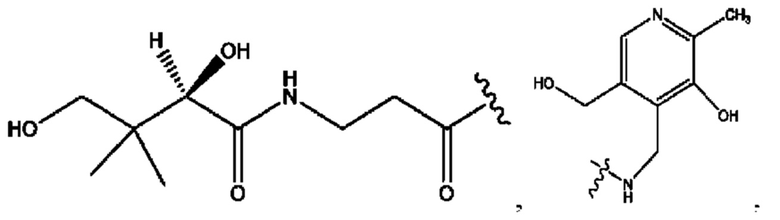
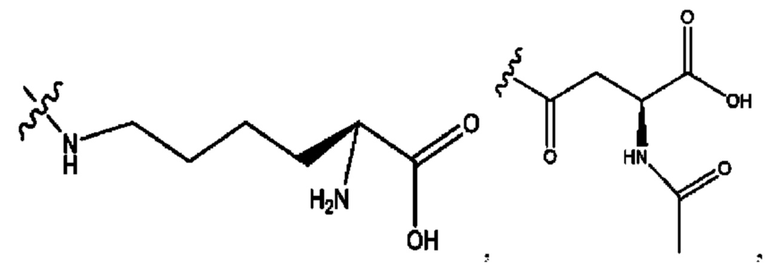
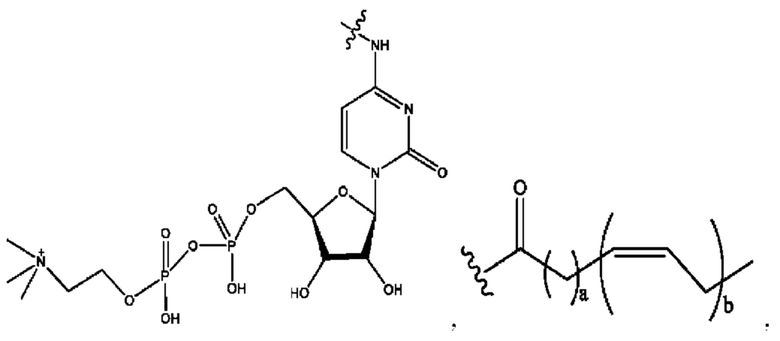
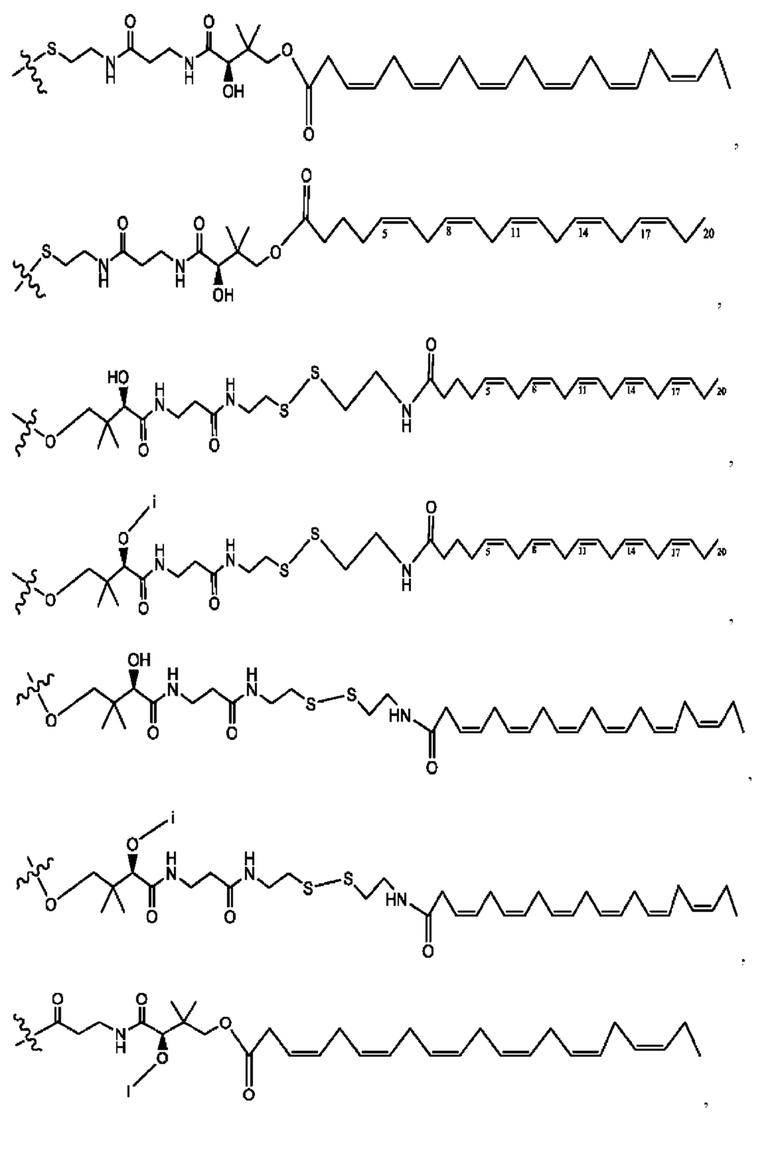
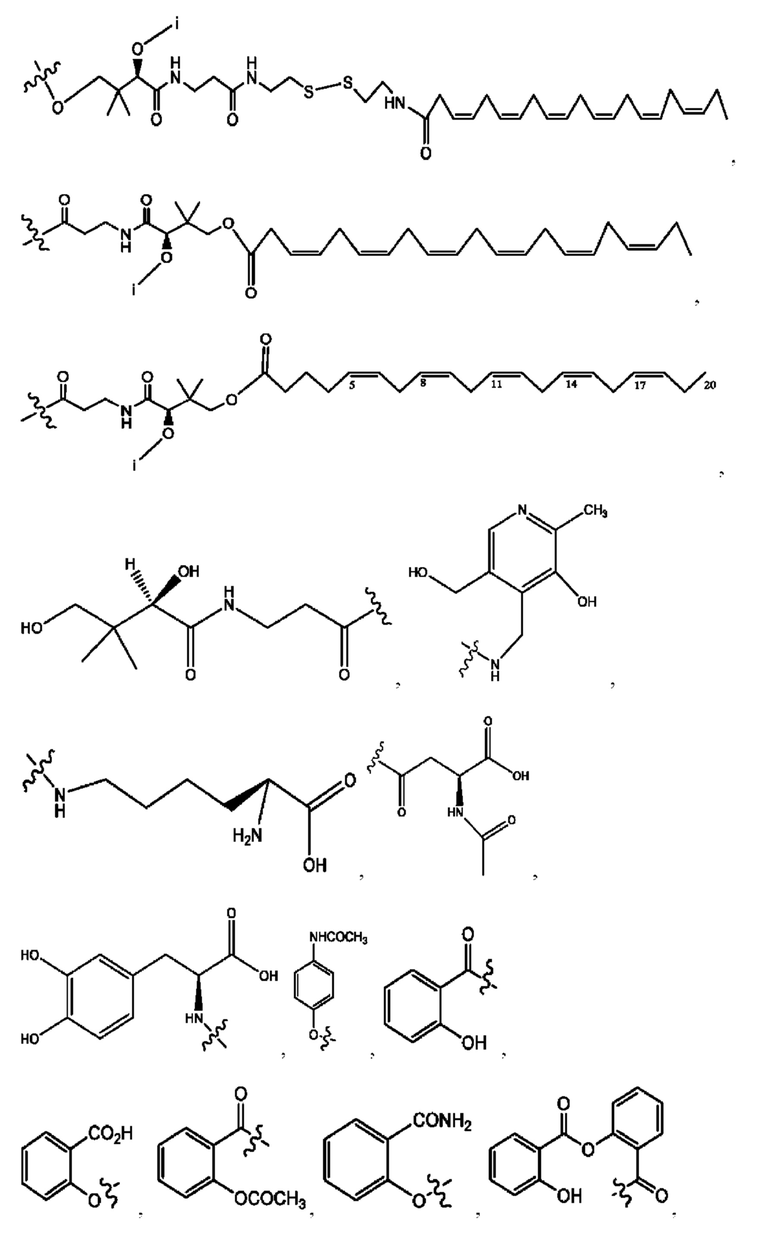
[0009] Согласно конкретным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы I, или их фармацевтически приемлемым солям,
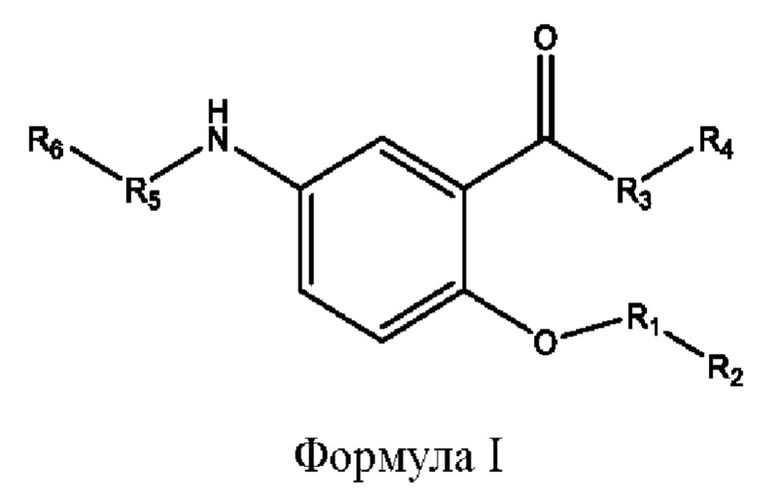
и их фармацевтически приемлемым солям, гидратам, сольватам, пролекарствам, энантиомерам и стереоизомерам;
[0010] Где,
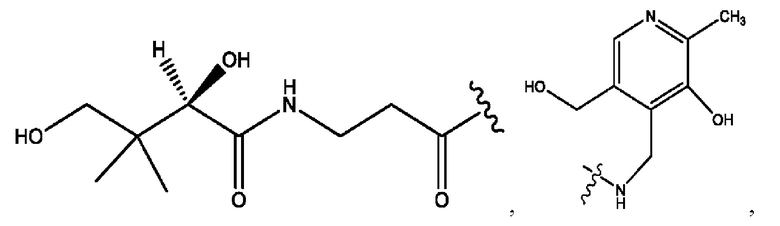
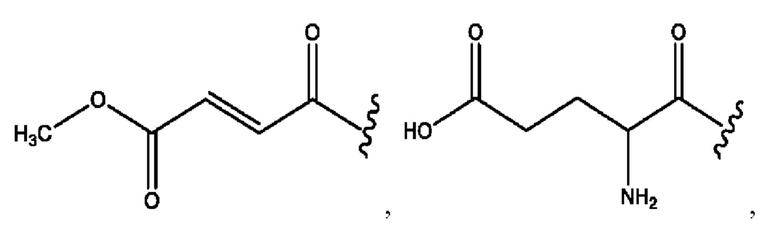
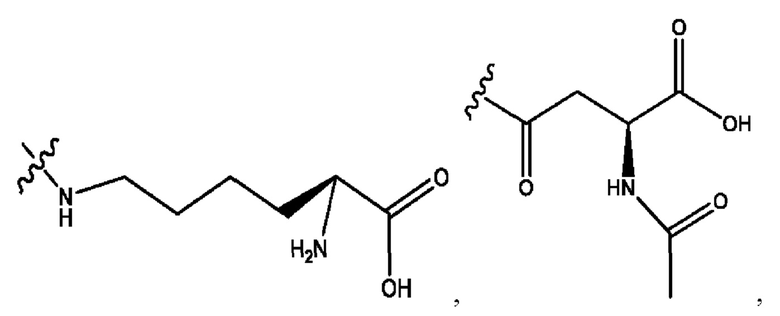
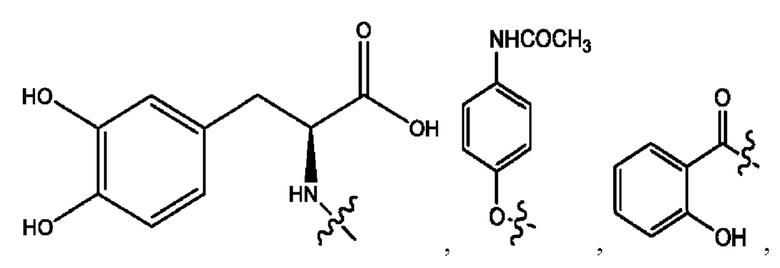
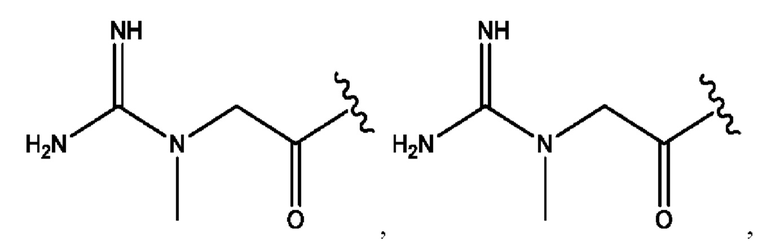
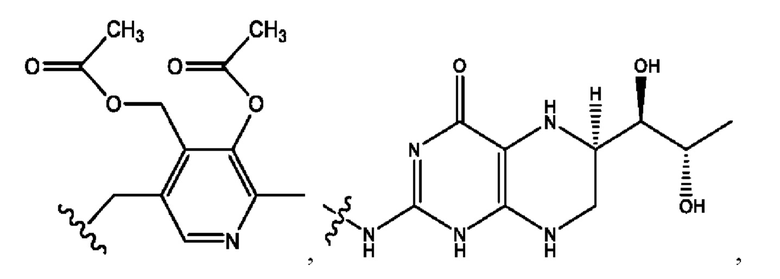
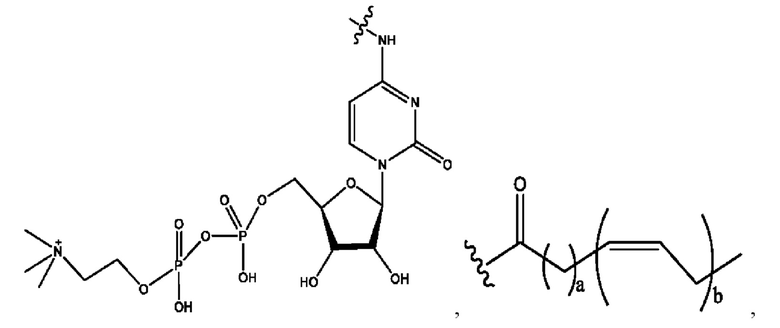
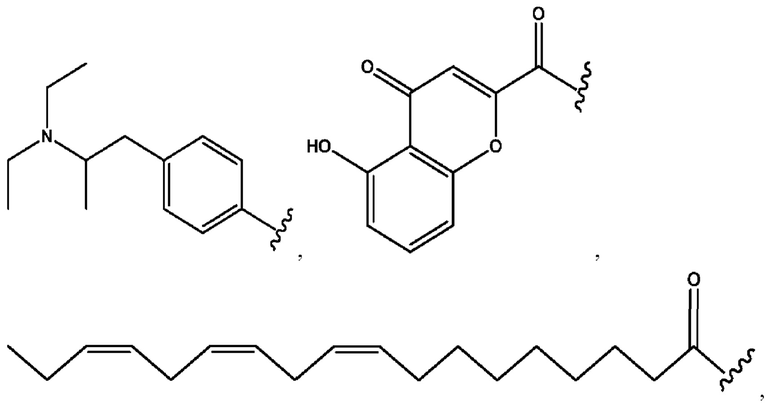
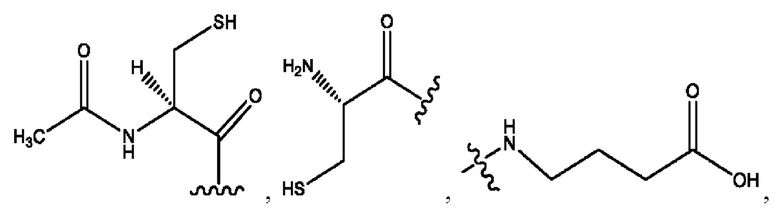
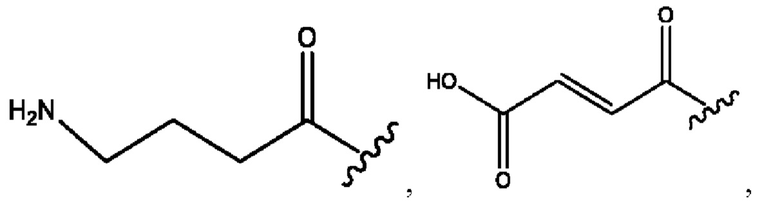
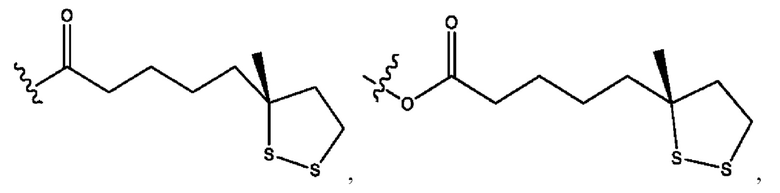
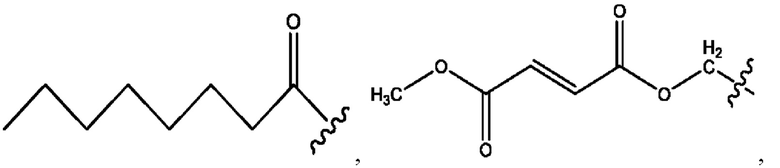
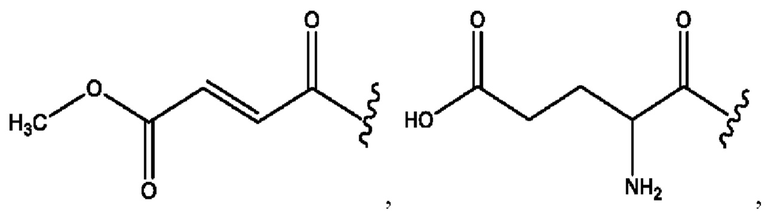
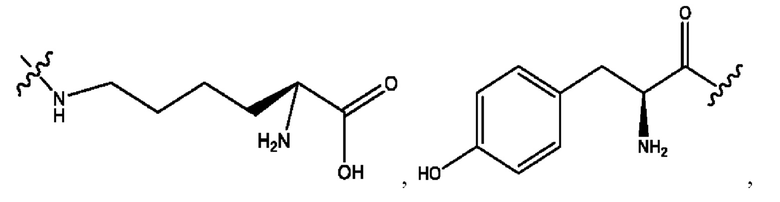
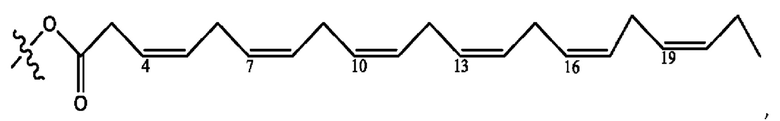
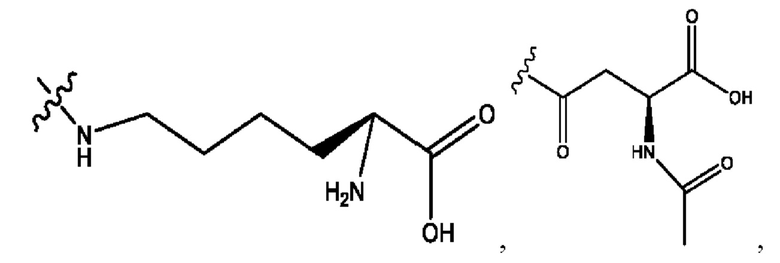
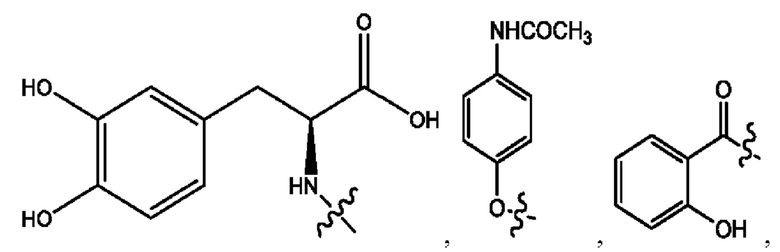
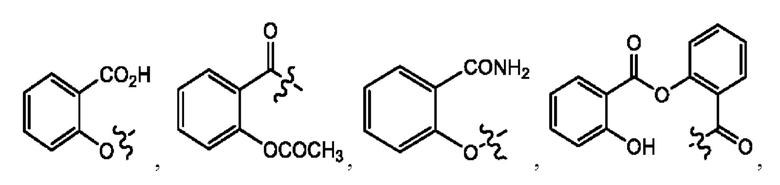
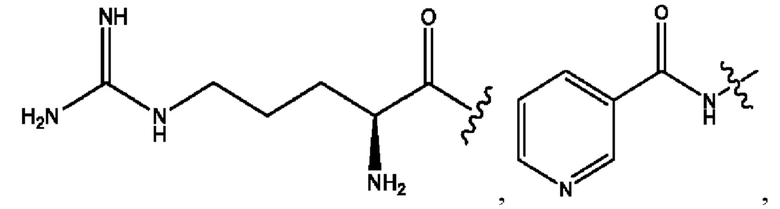
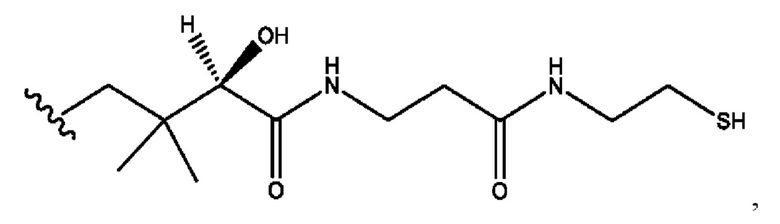
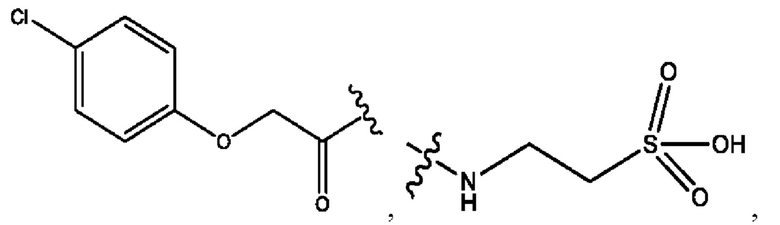
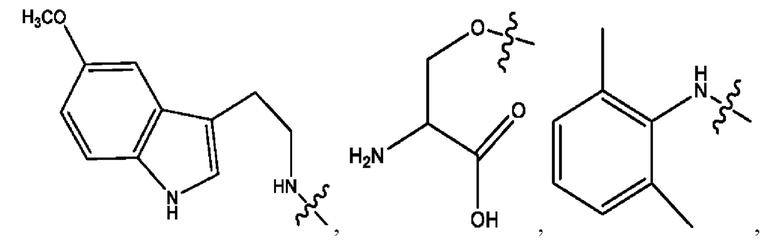
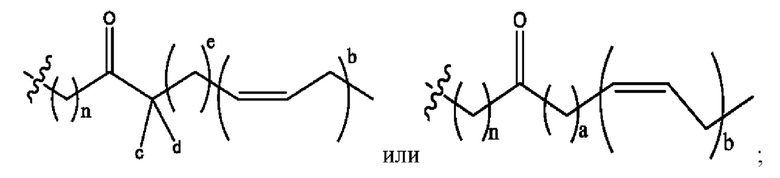
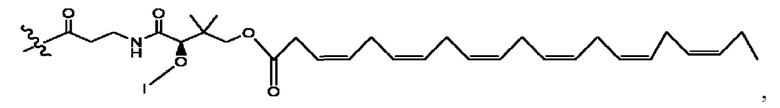
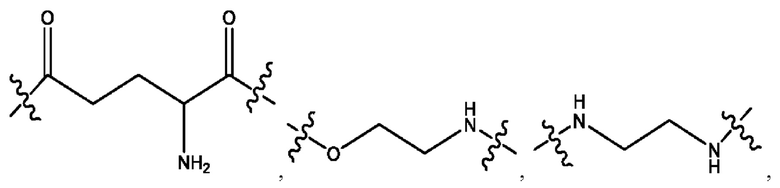
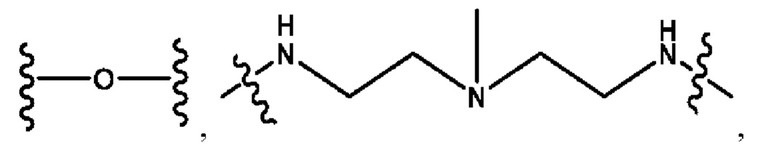
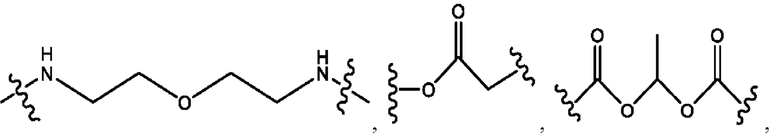
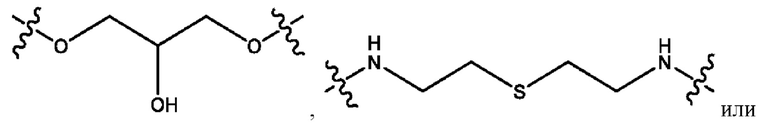
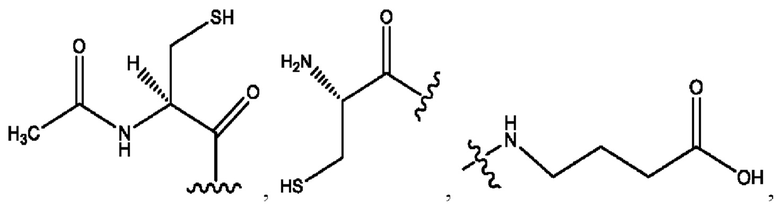
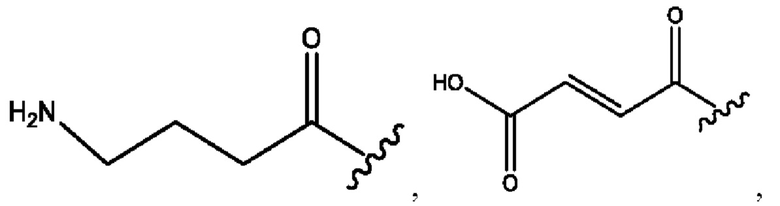
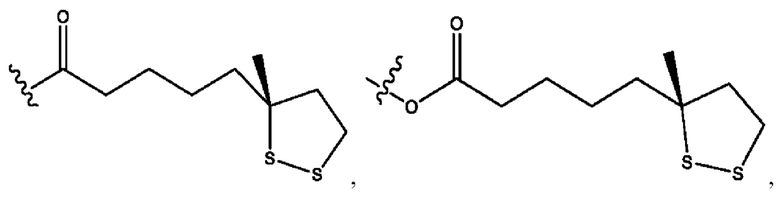
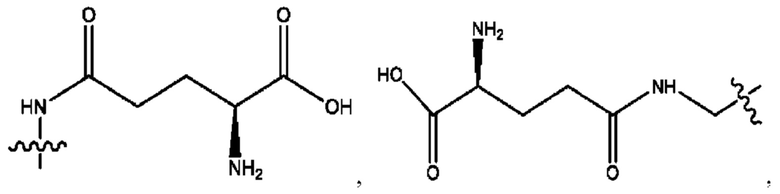
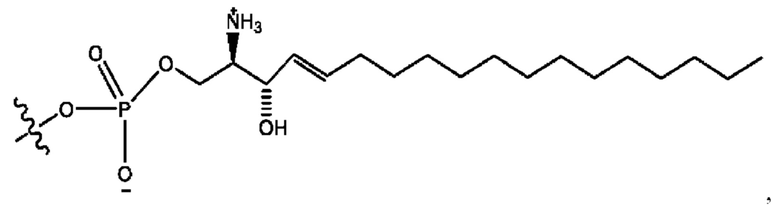
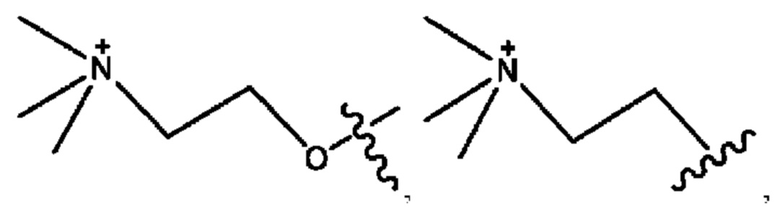
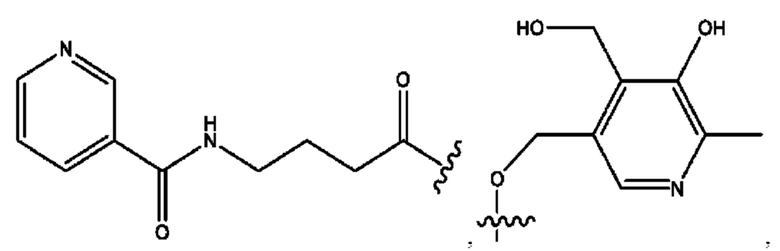
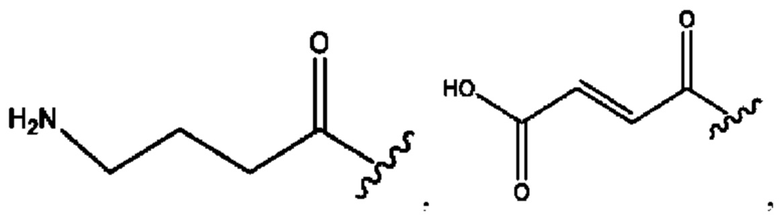
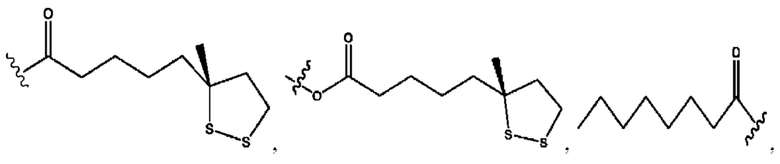
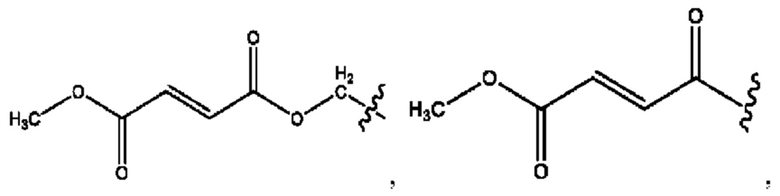
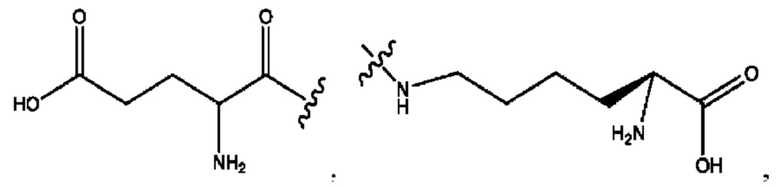
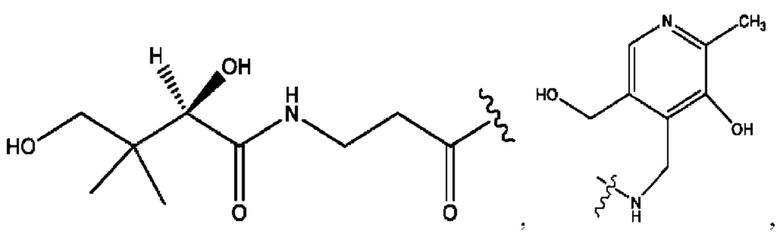
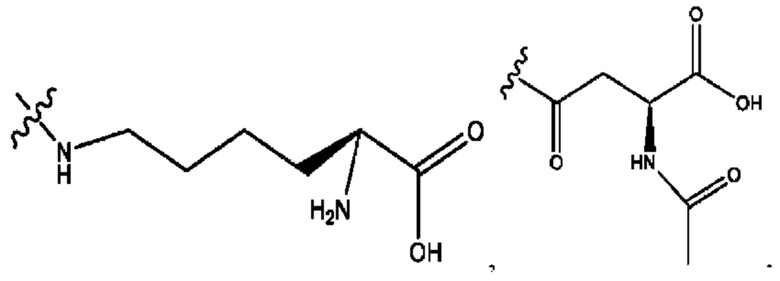
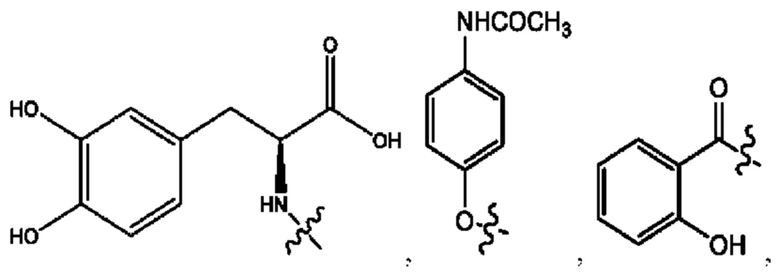
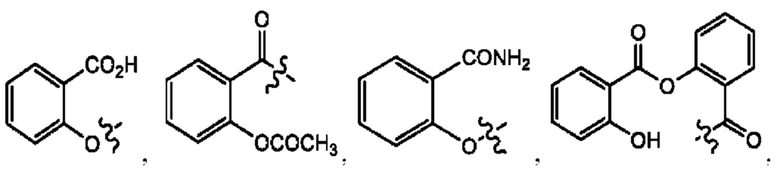
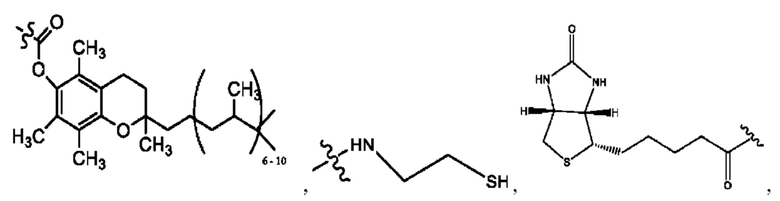
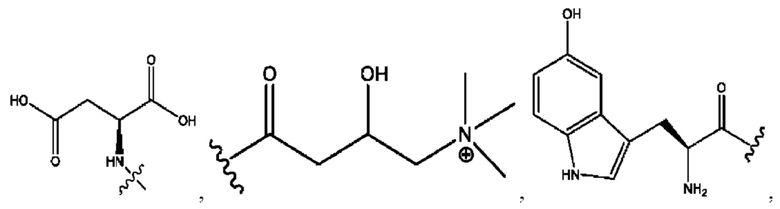
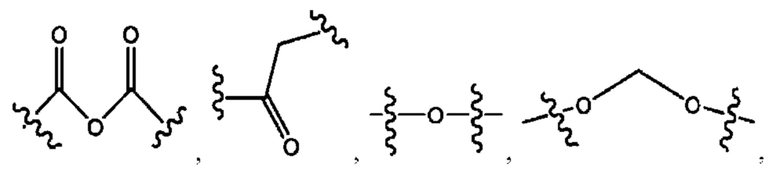
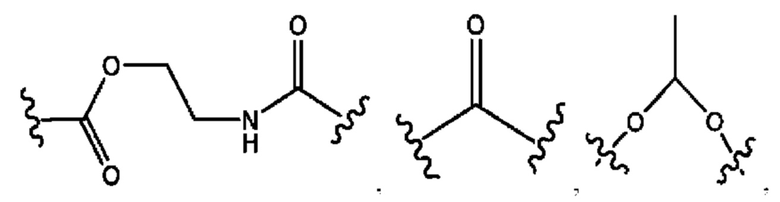
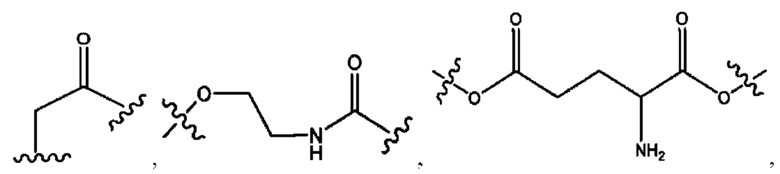
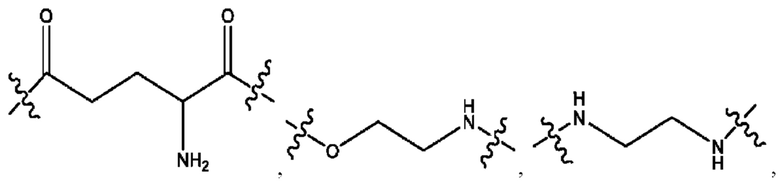
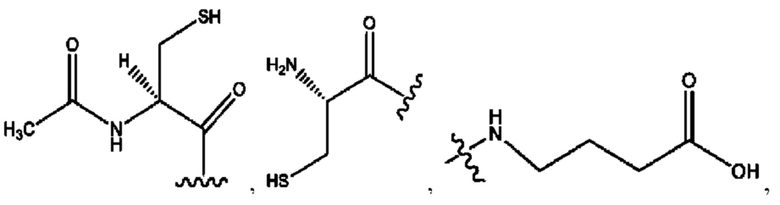
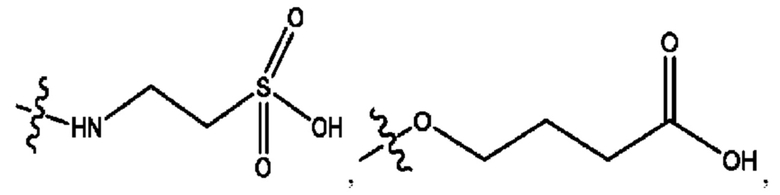
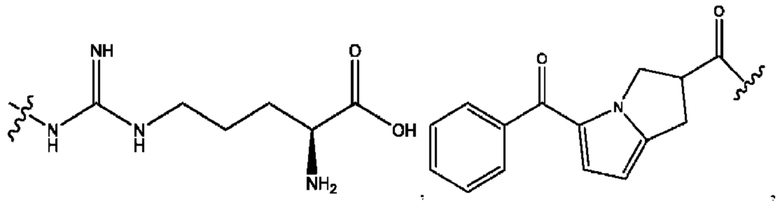
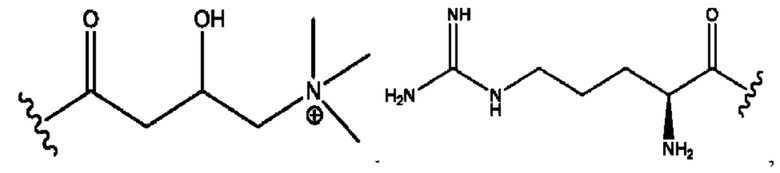
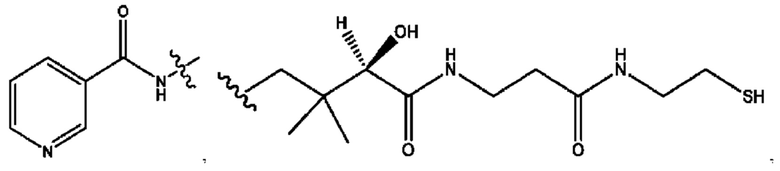
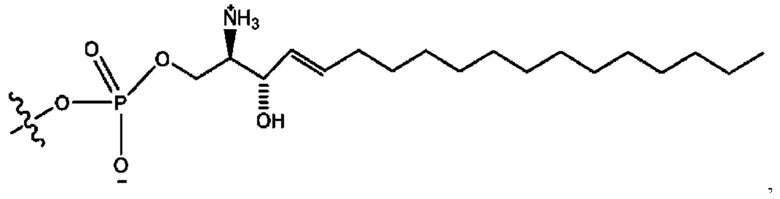
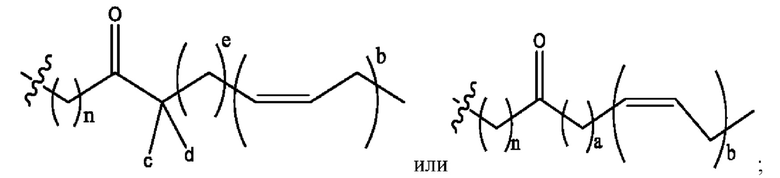
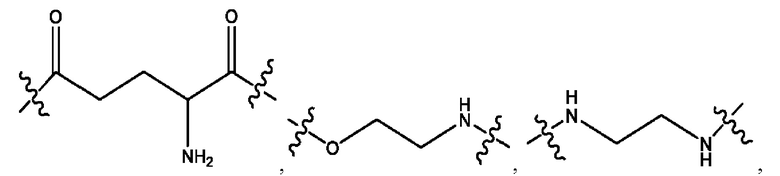
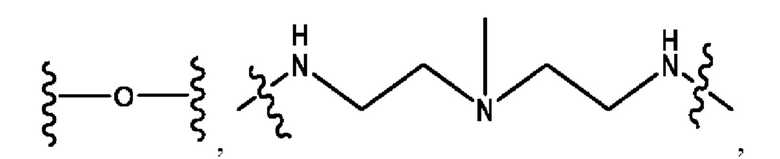
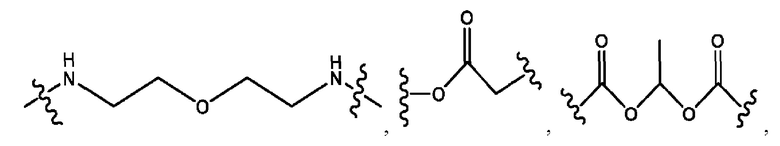
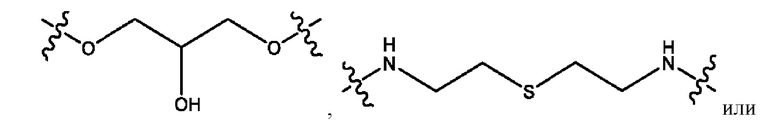
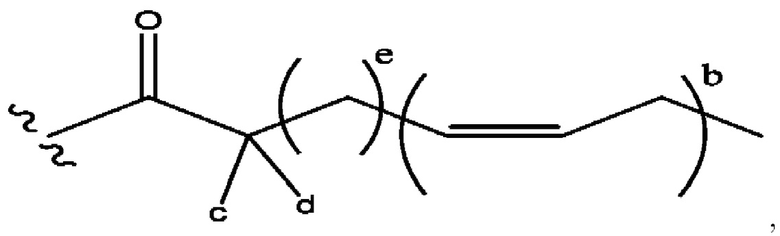
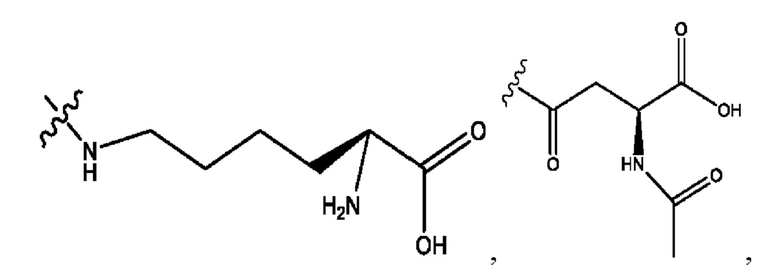
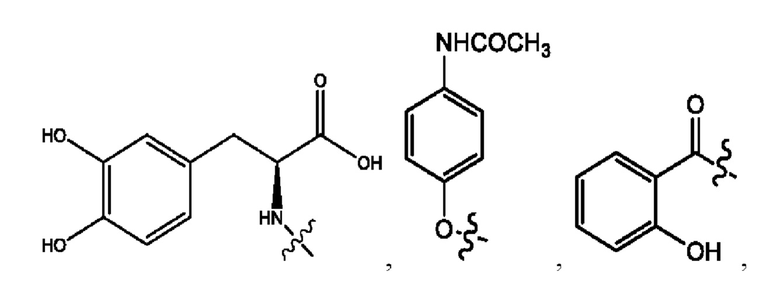
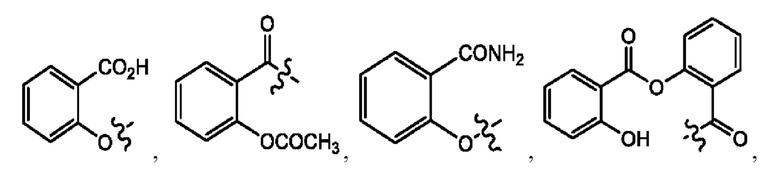
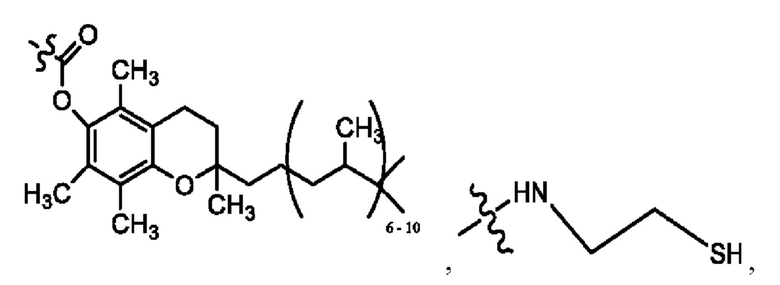
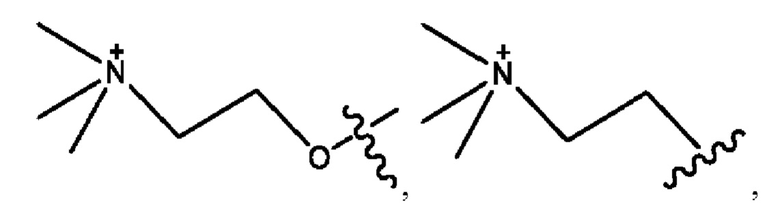
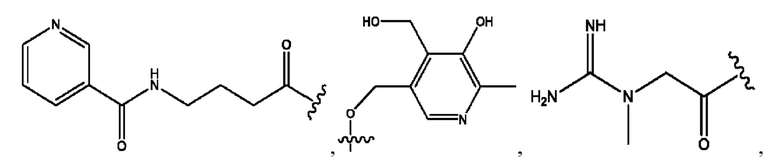
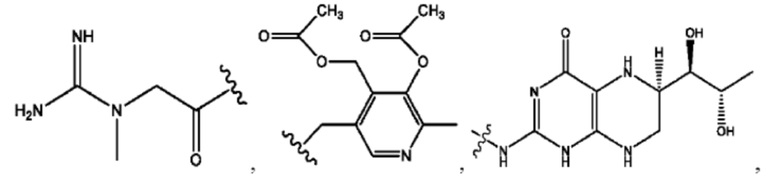
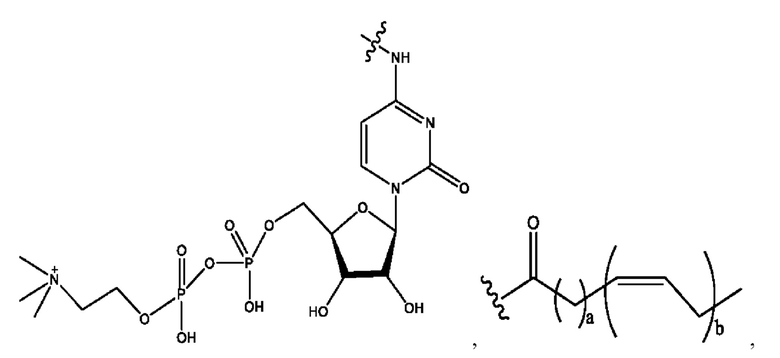
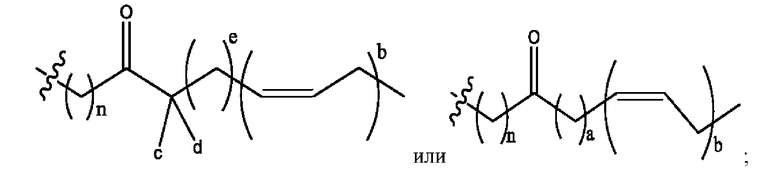
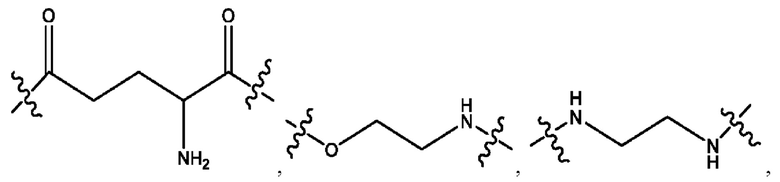
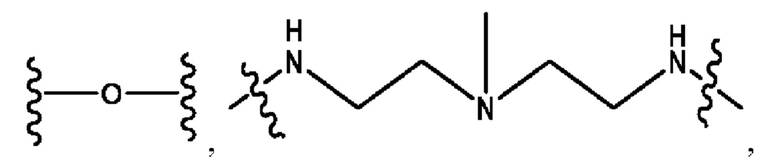
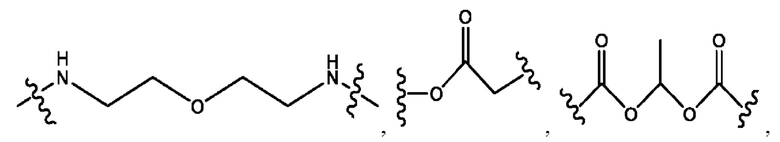
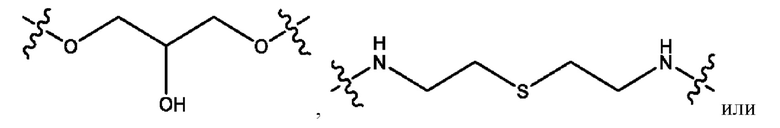
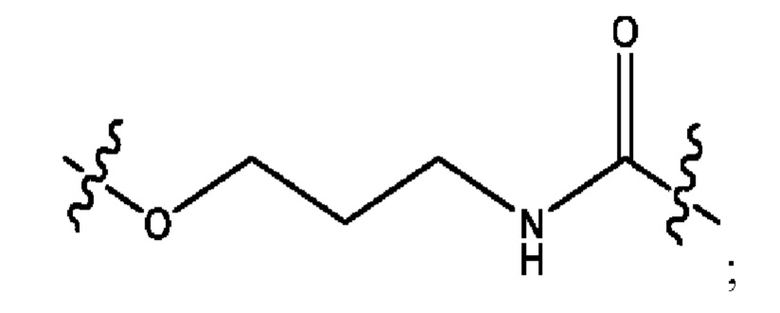
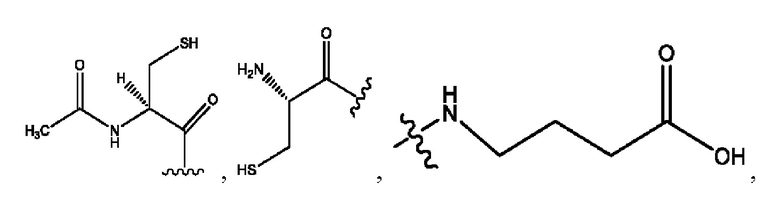
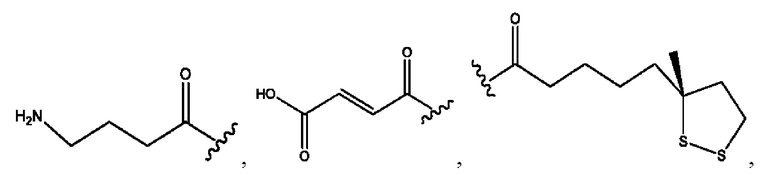
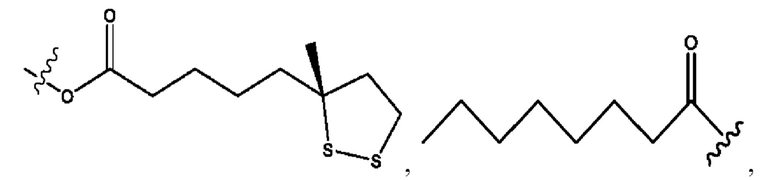
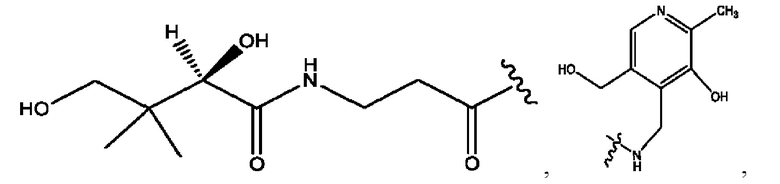
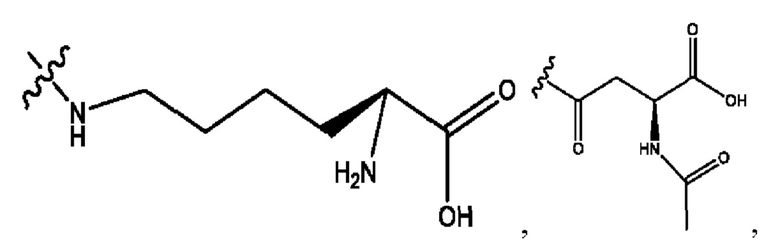
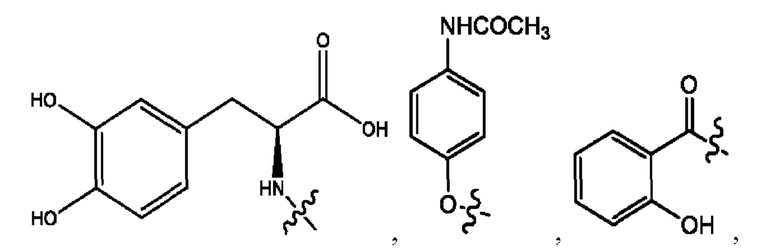
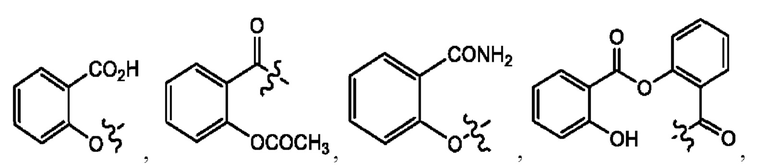
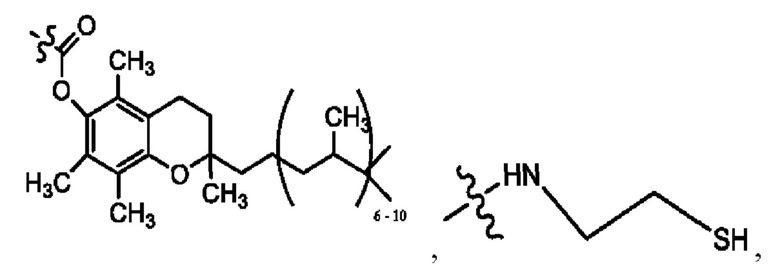
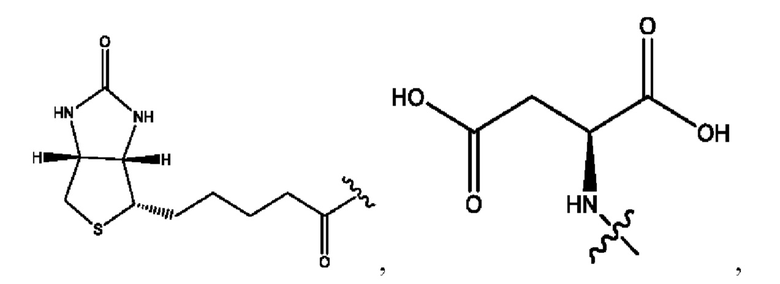
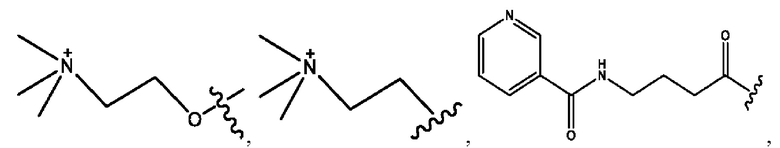
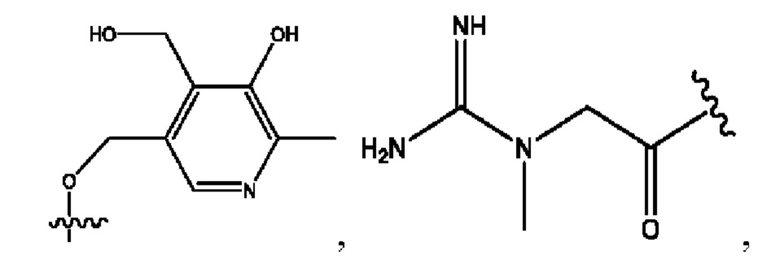
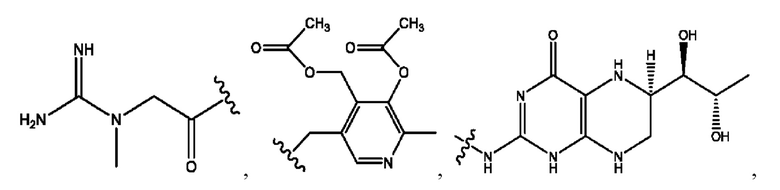
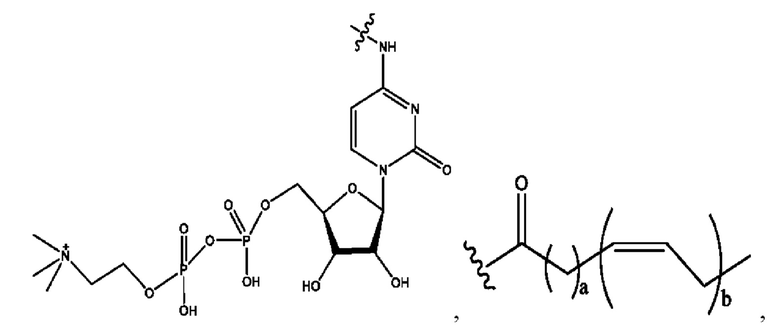
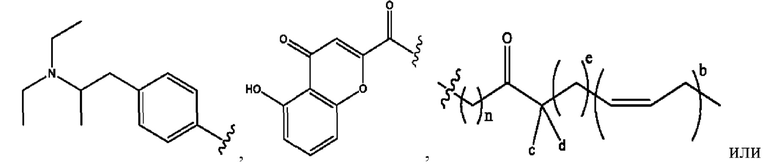
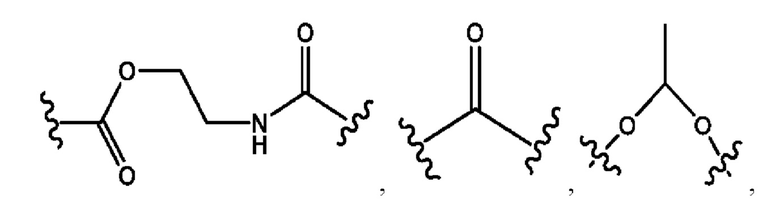
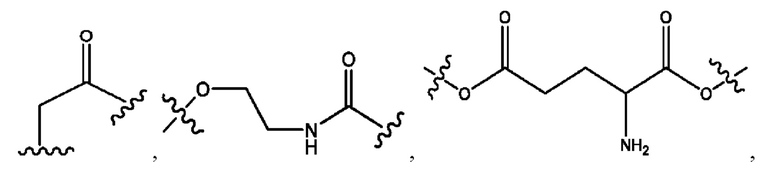
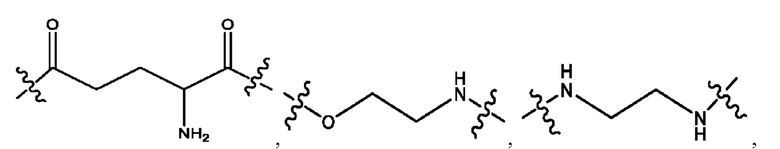
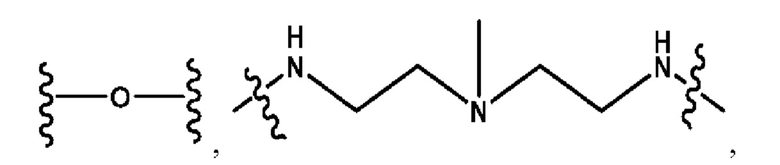
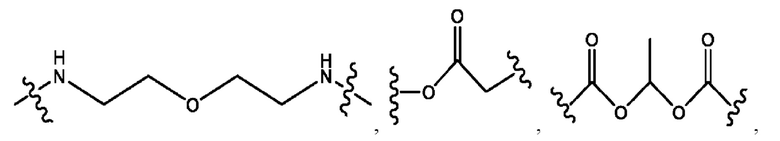
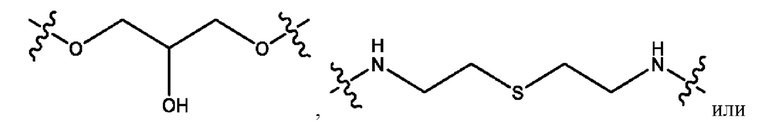
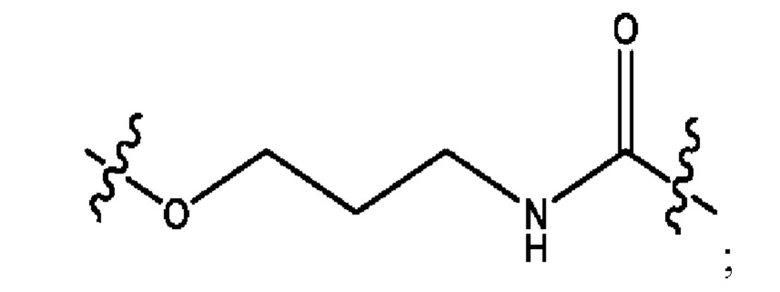
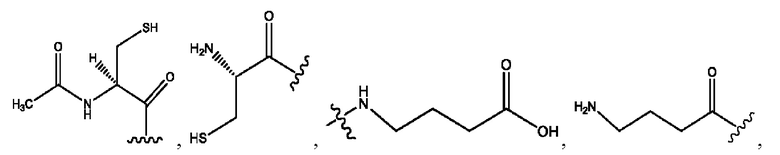
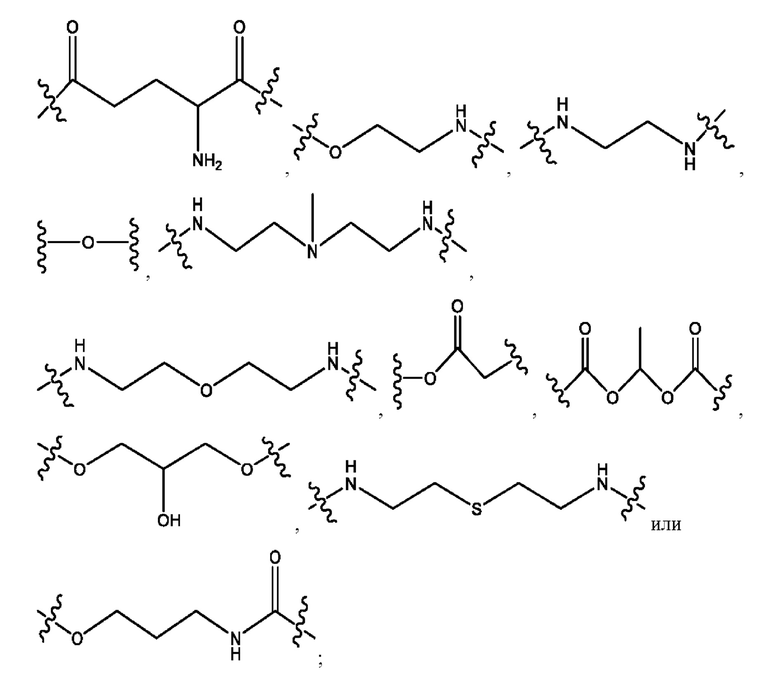
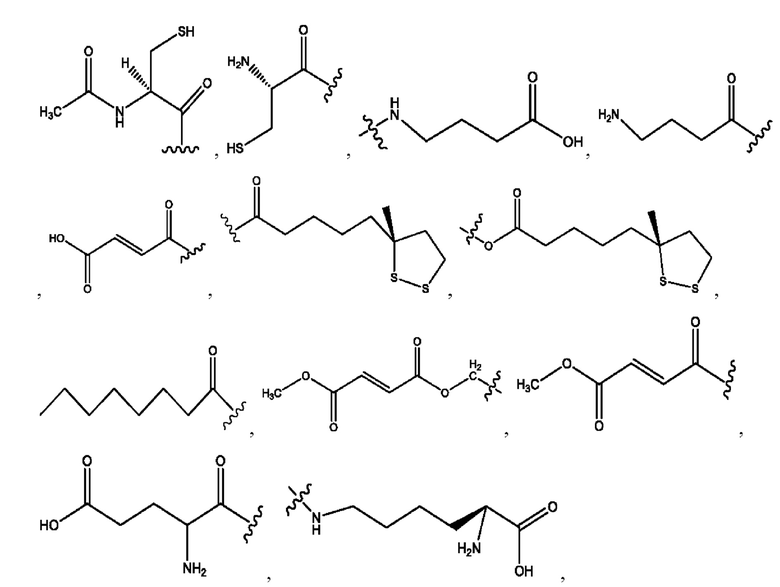
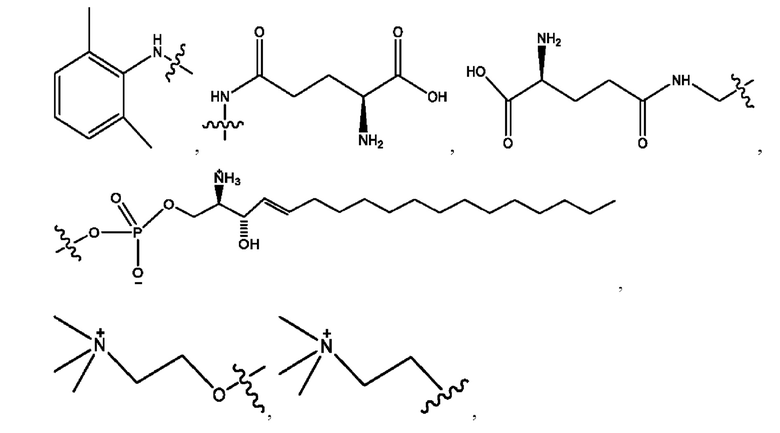
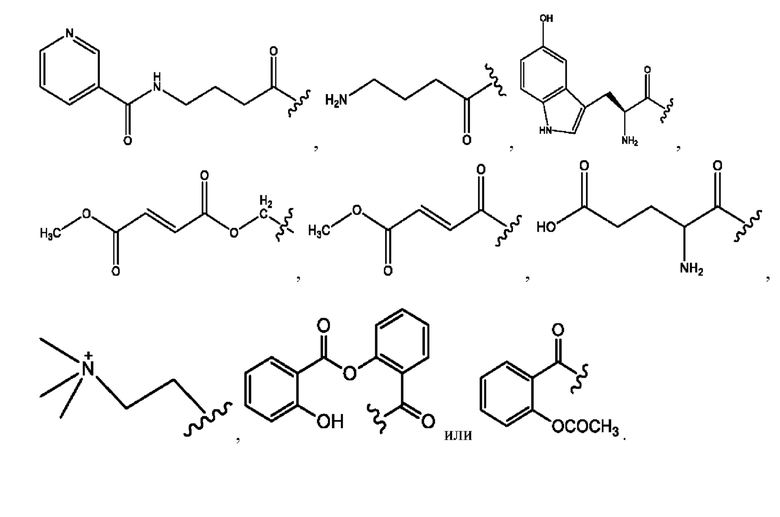
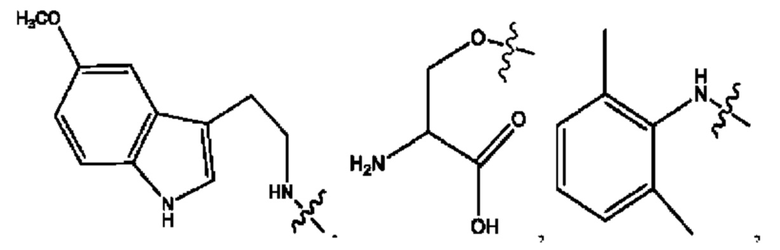
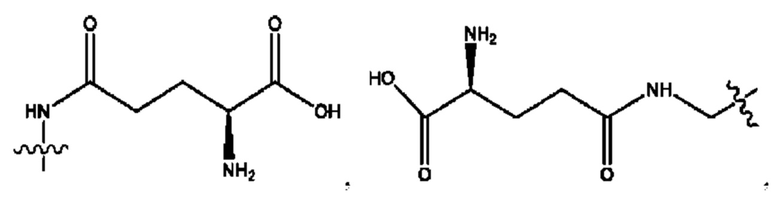
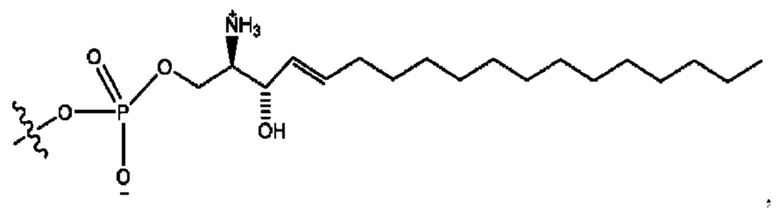
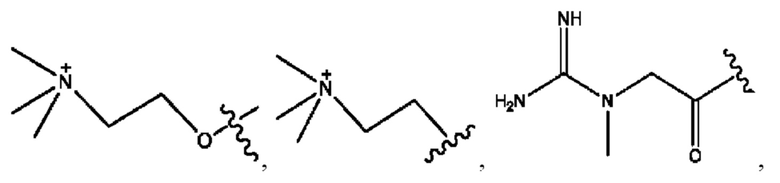
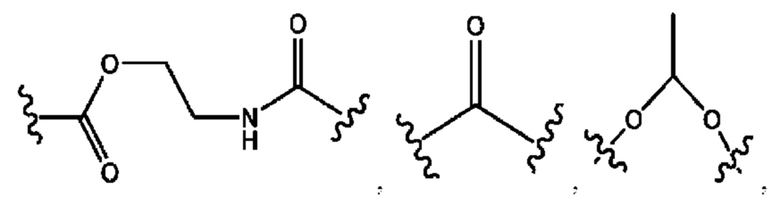
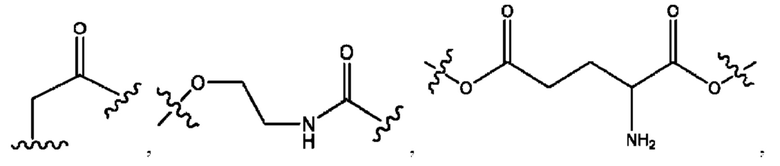
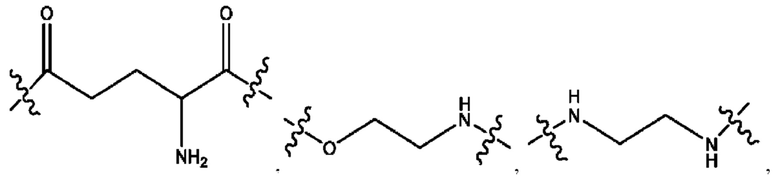
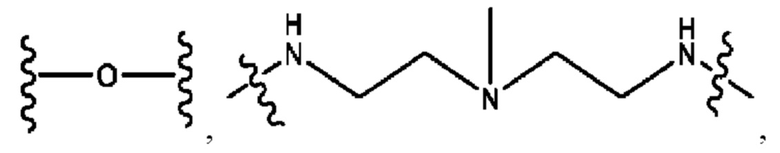
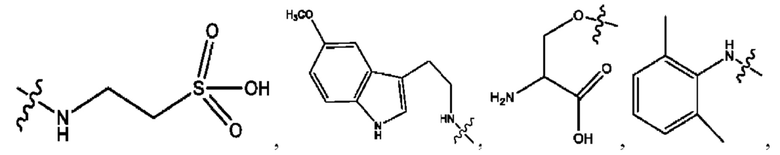
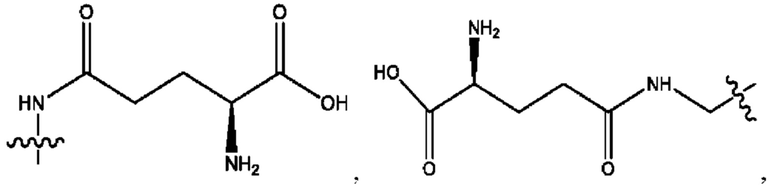
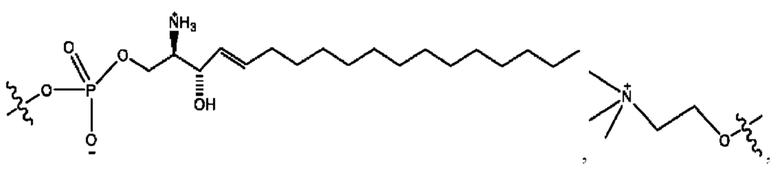
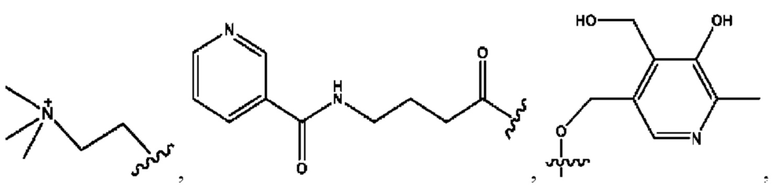
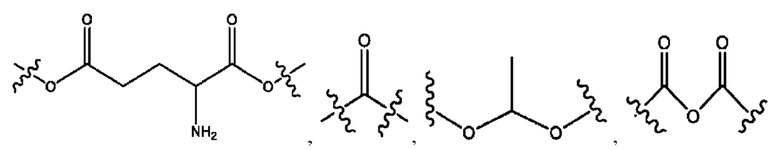
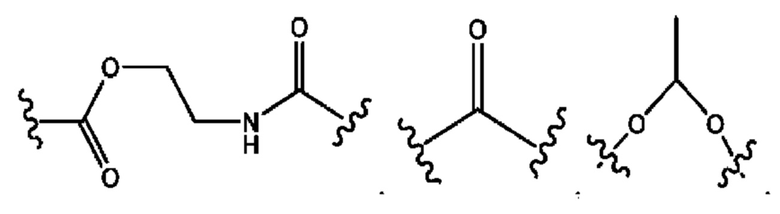
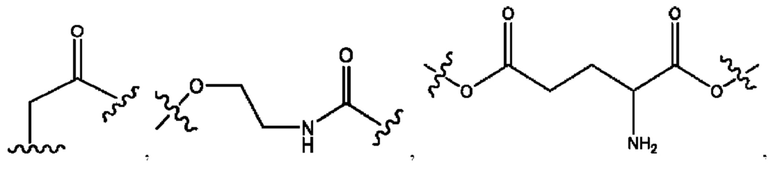
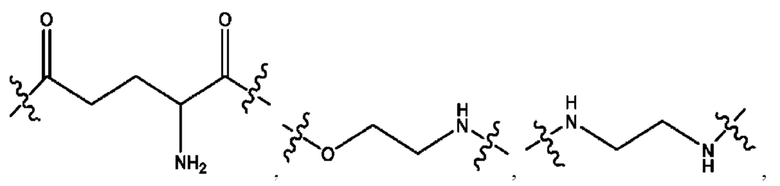
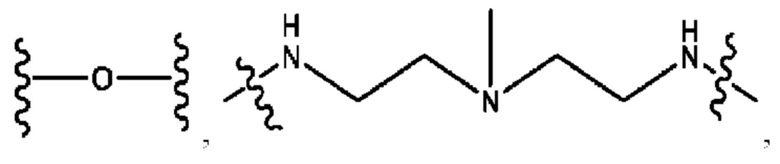
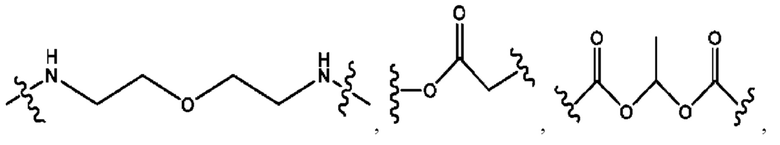
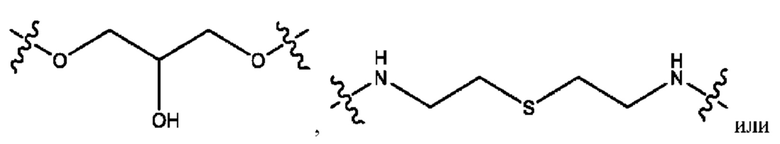
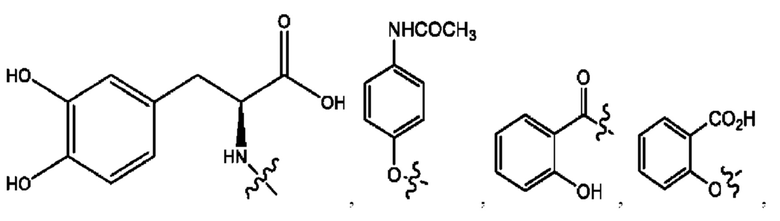
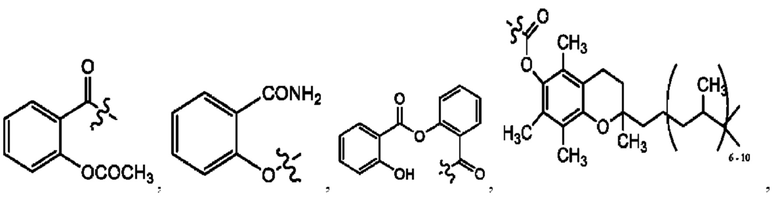
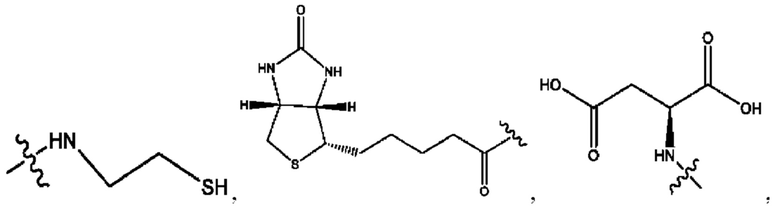
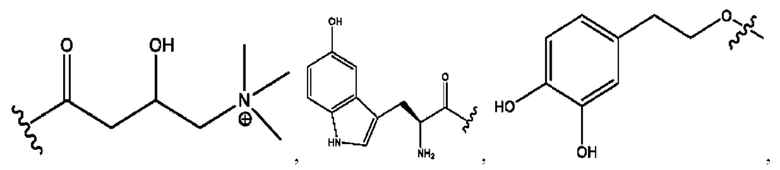
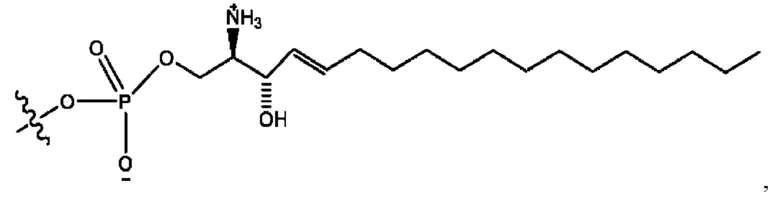
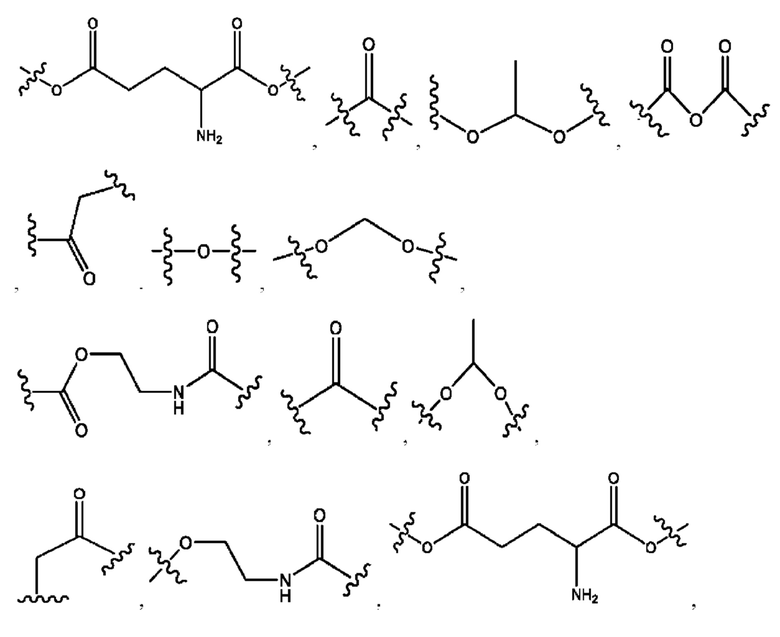
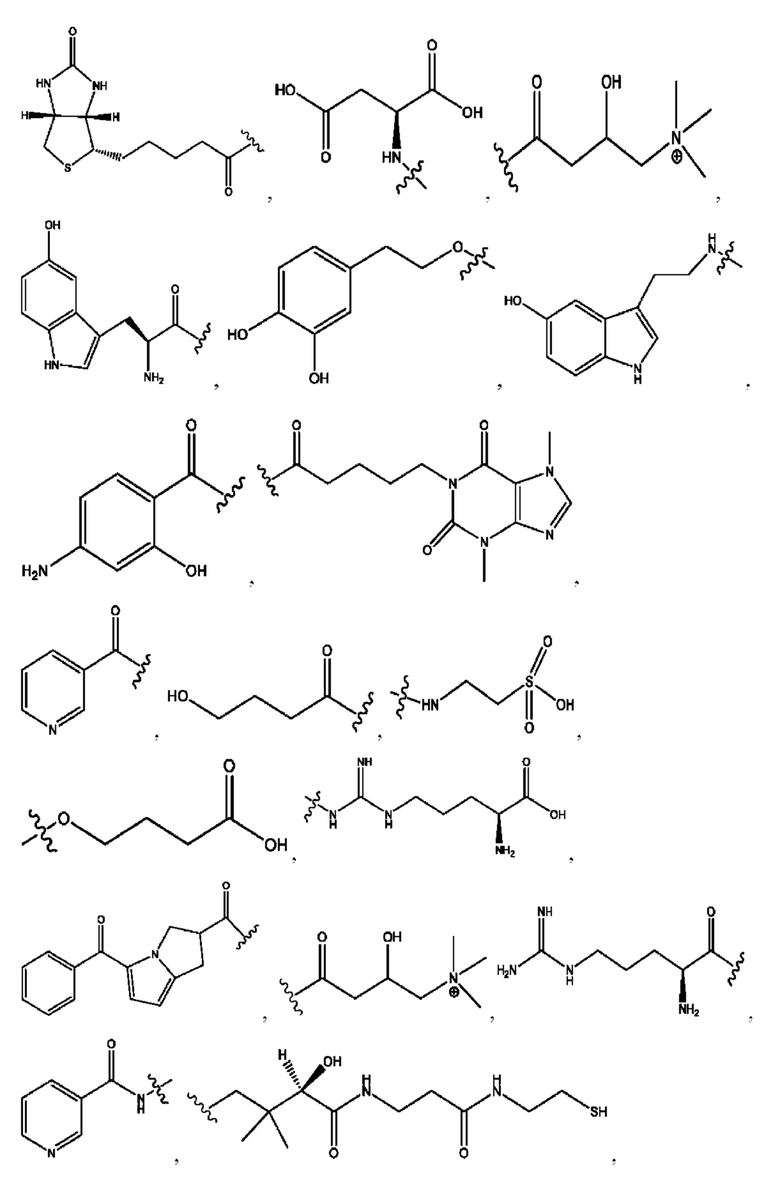
каждый из R1, R3, R5 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, представляет собой
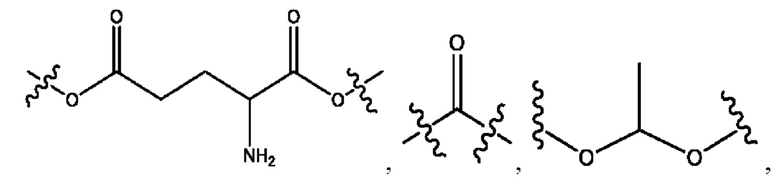
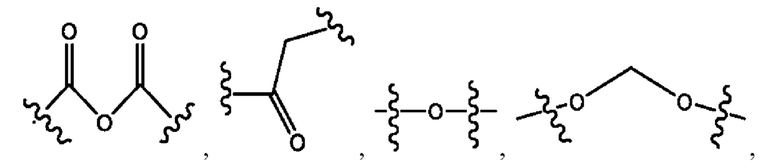
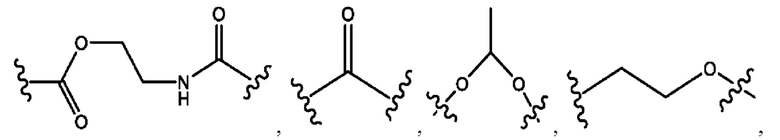
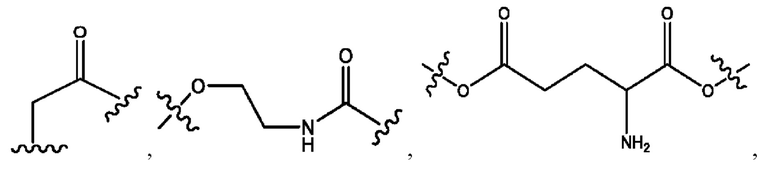
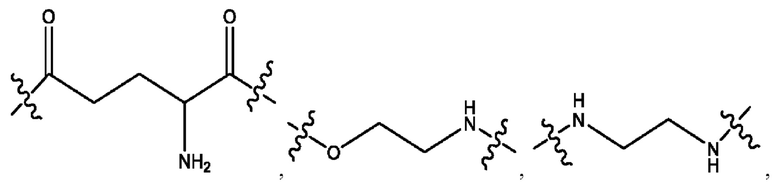
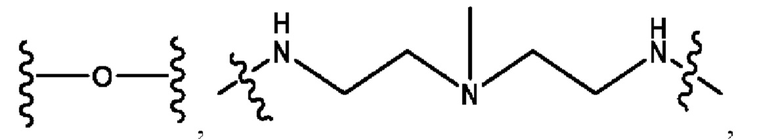
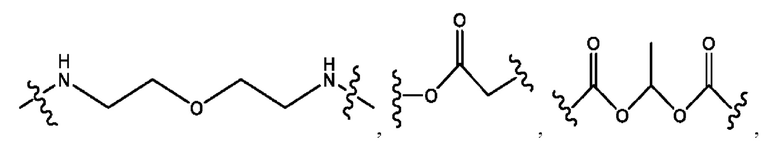
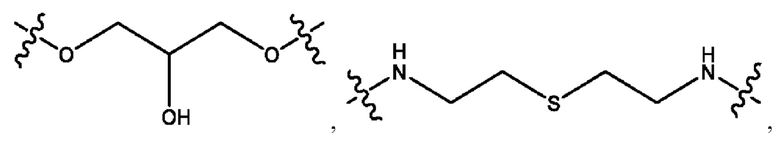
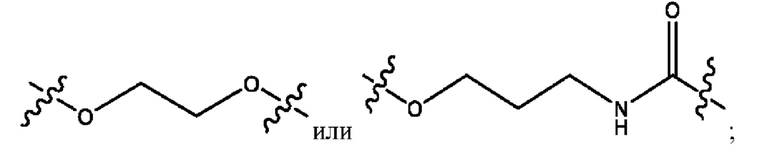
каждый из R2, R4, R6 независимо представляет собой
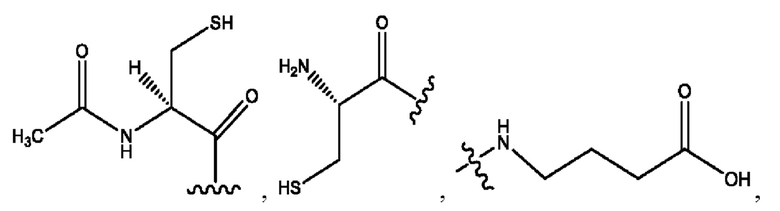
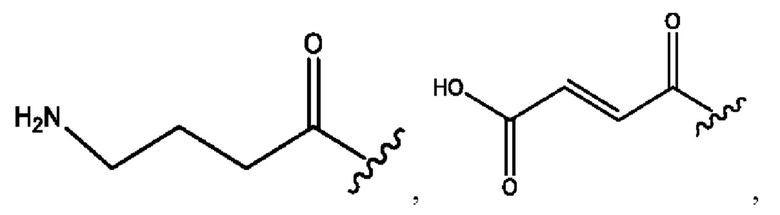
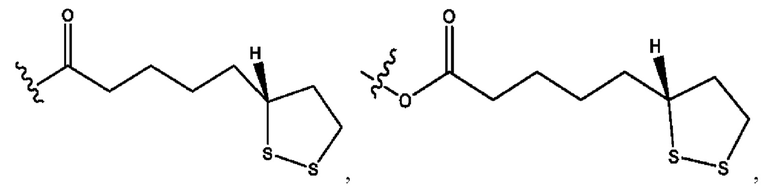
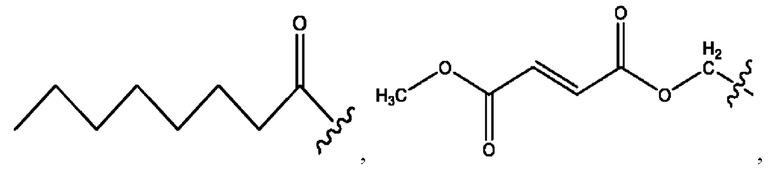
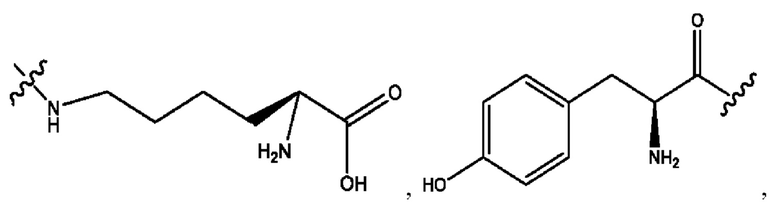
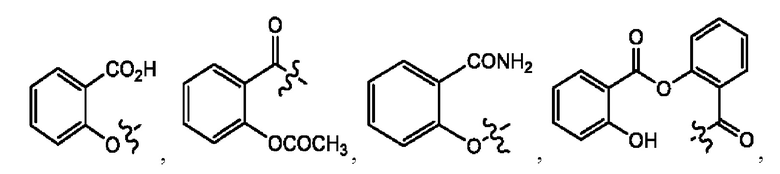
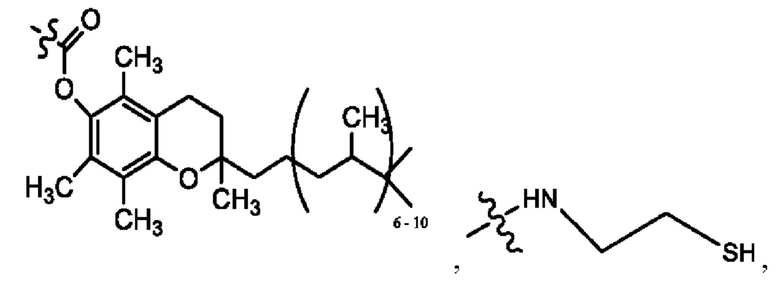
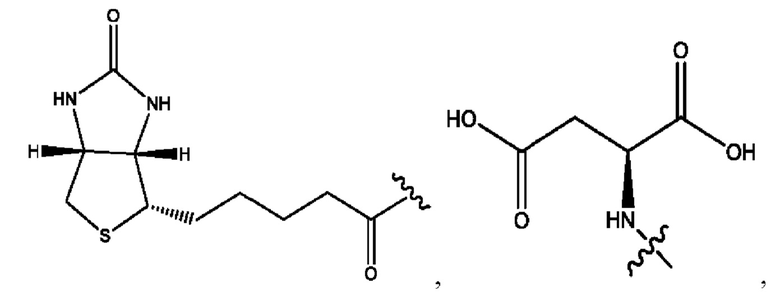
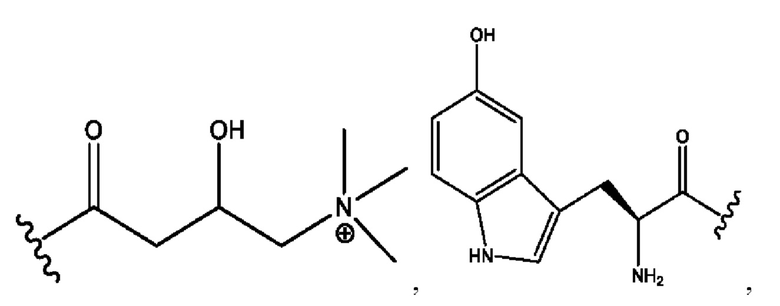
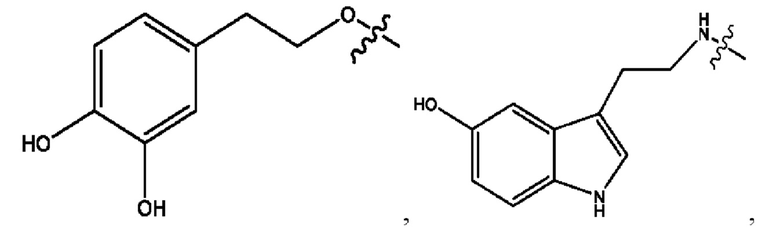

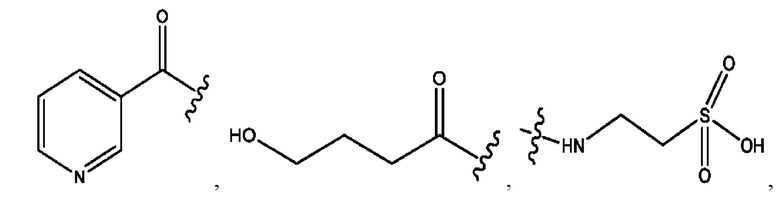
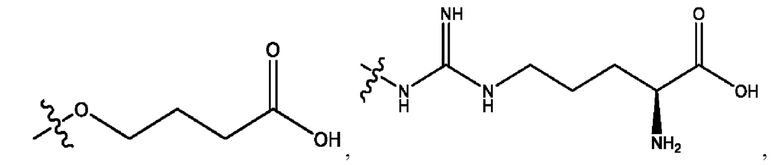
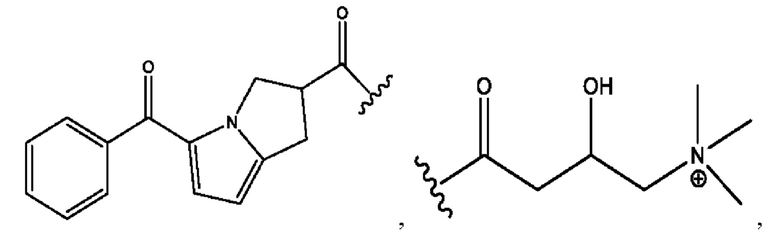
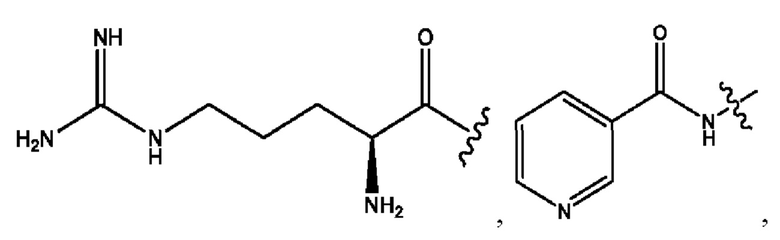
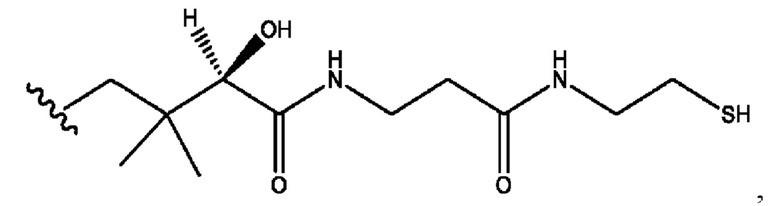
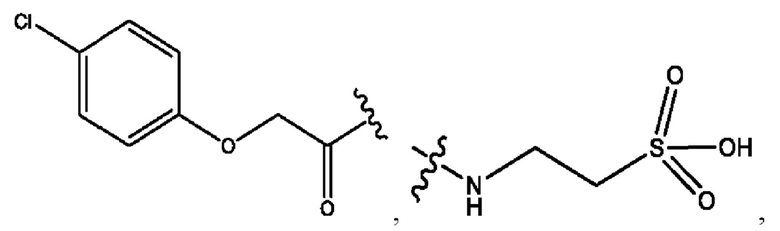
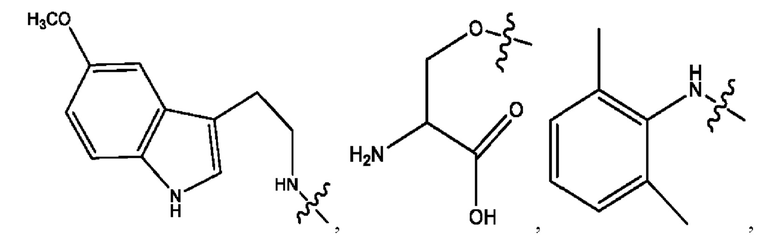
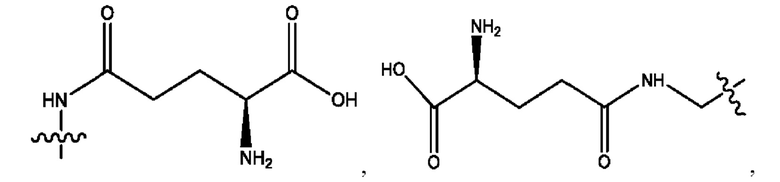
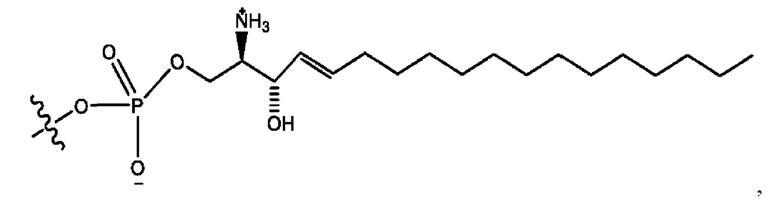
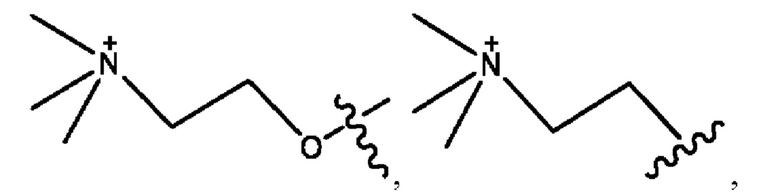
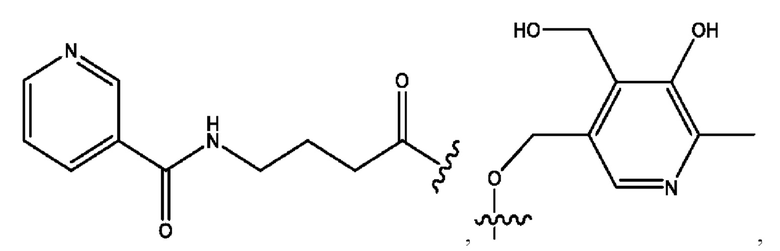
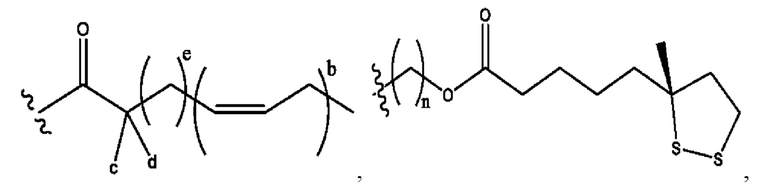
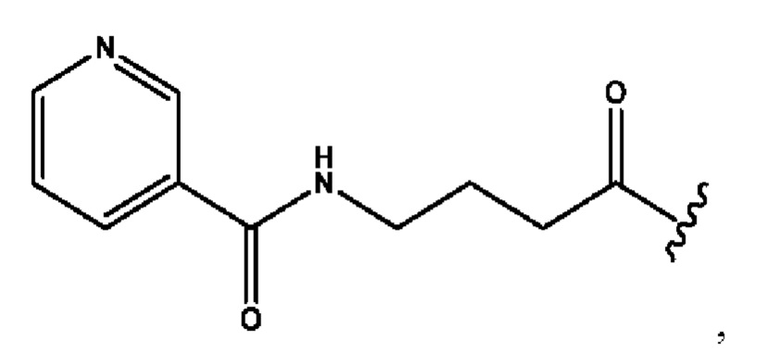
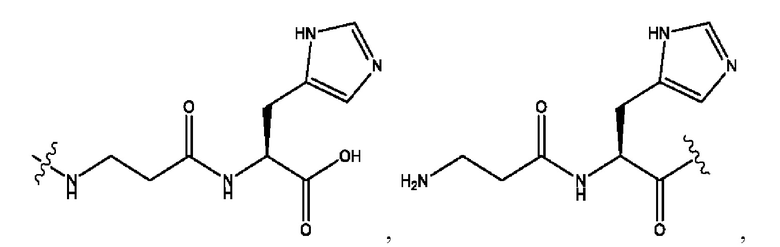
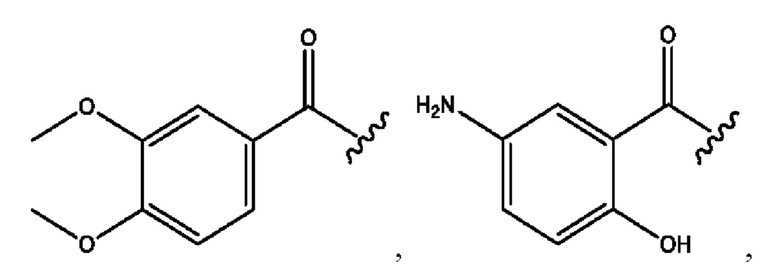
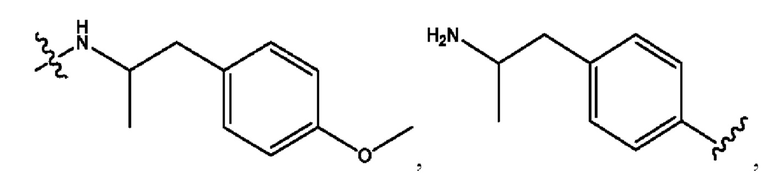

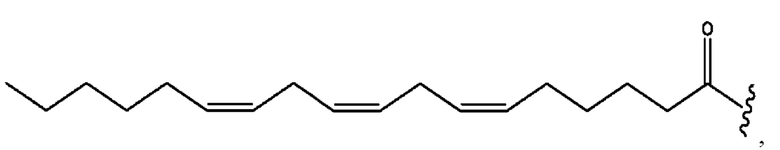
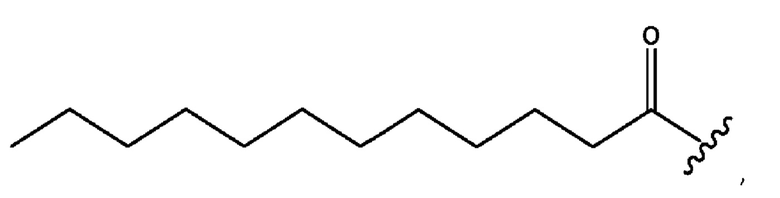
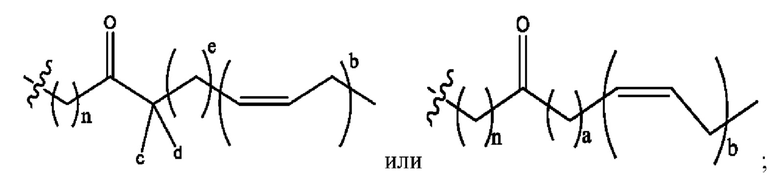
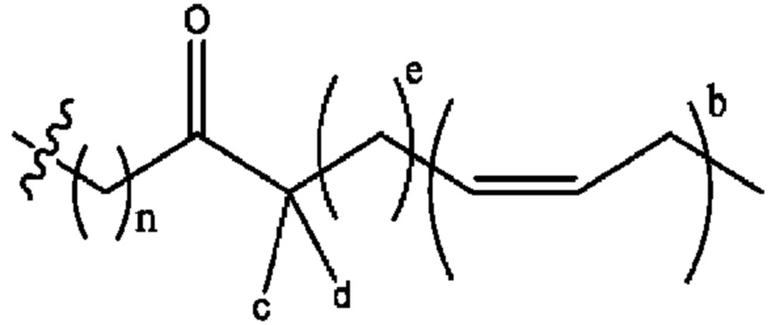
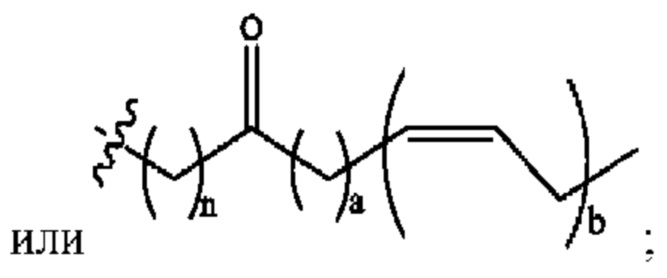
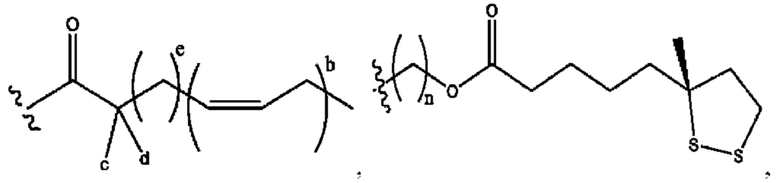
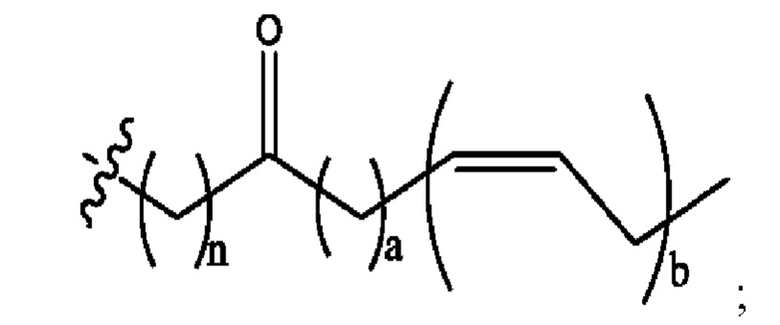
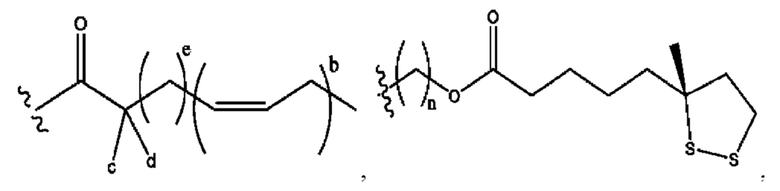
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый из с и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3.
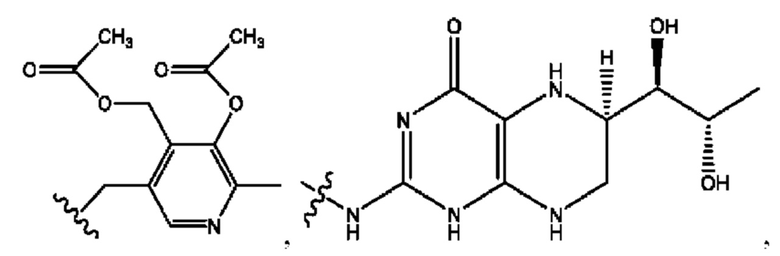
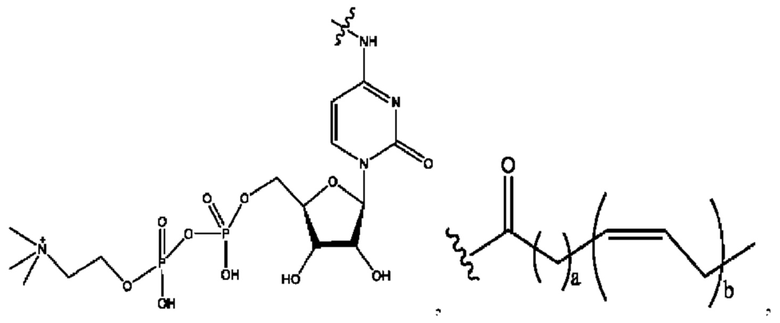
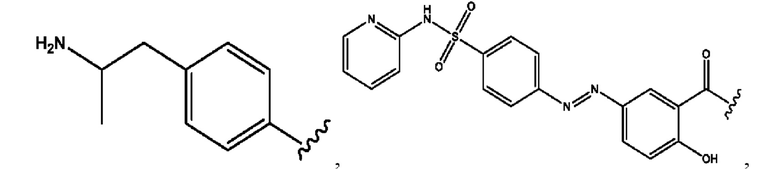
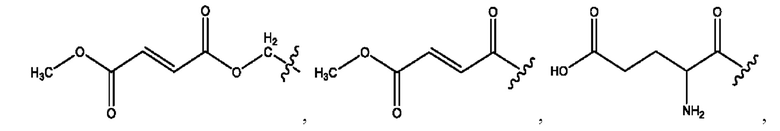
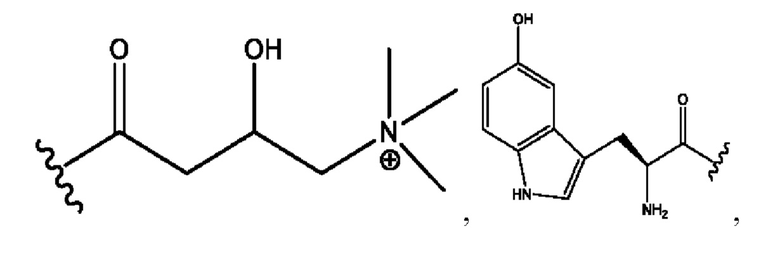
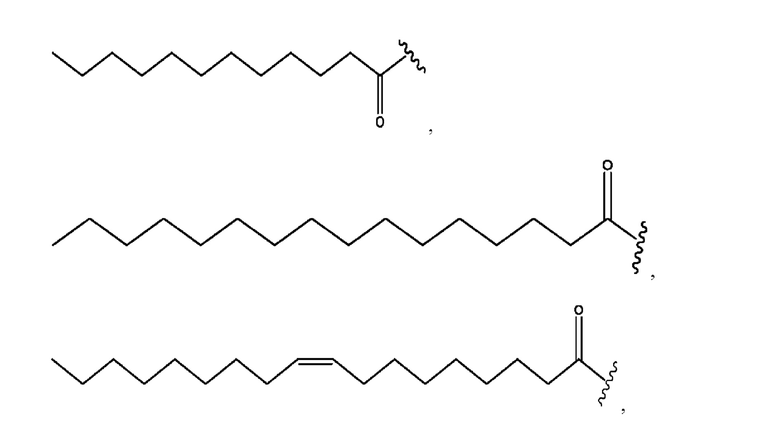
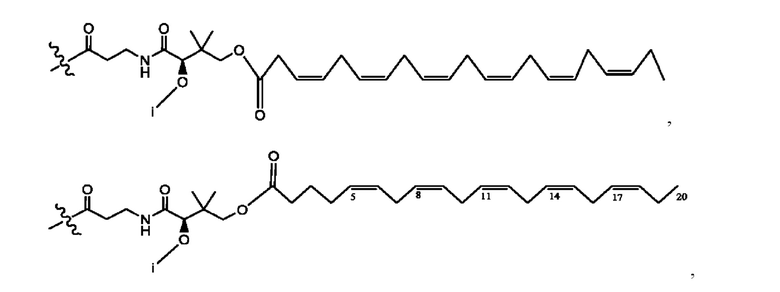
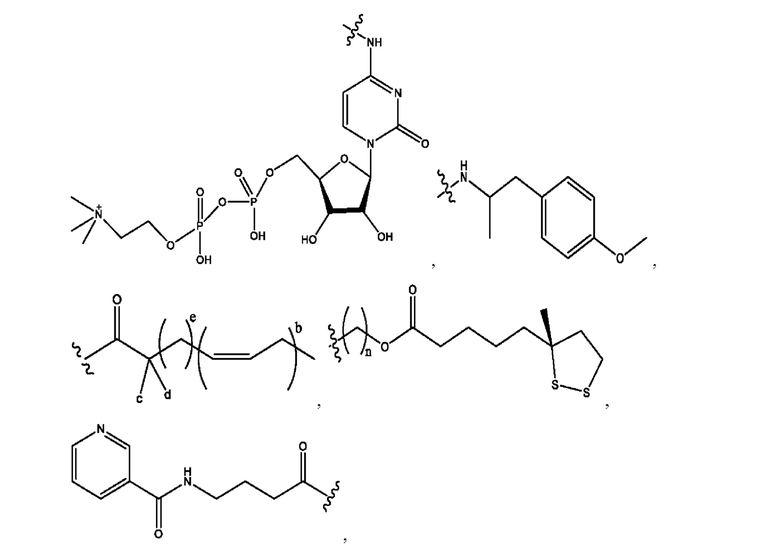
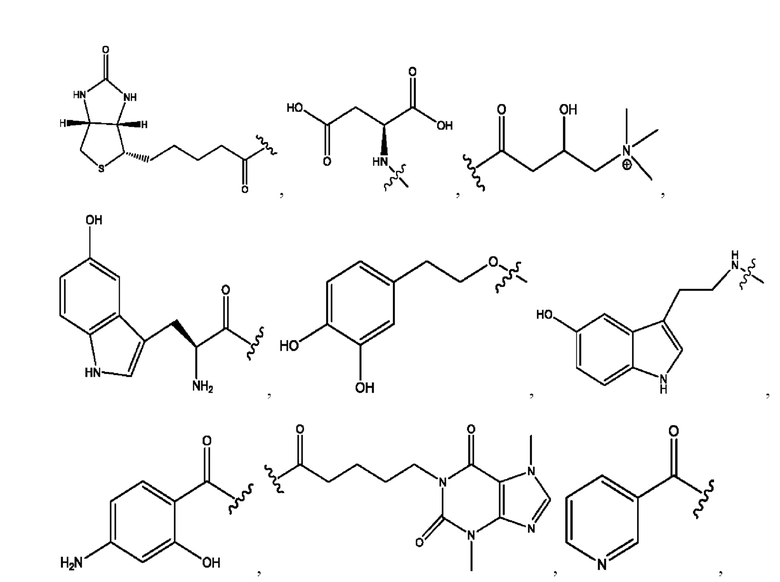
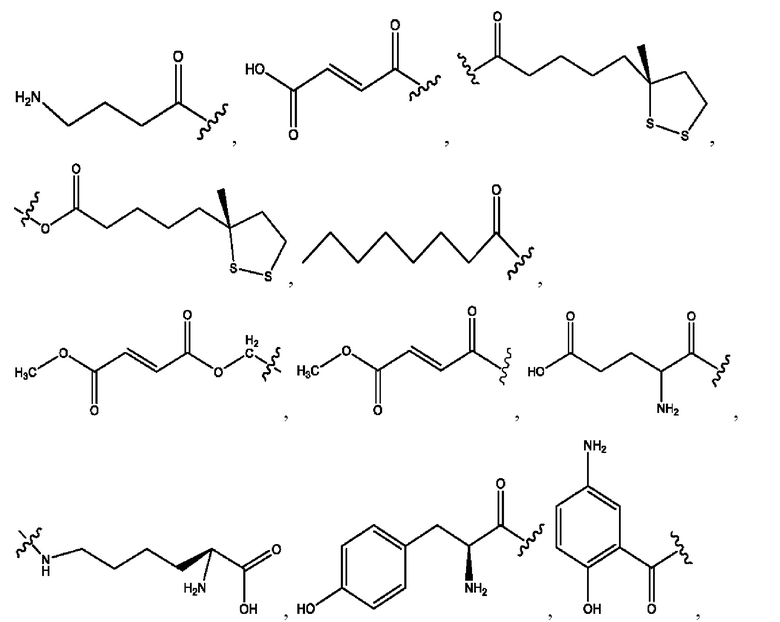
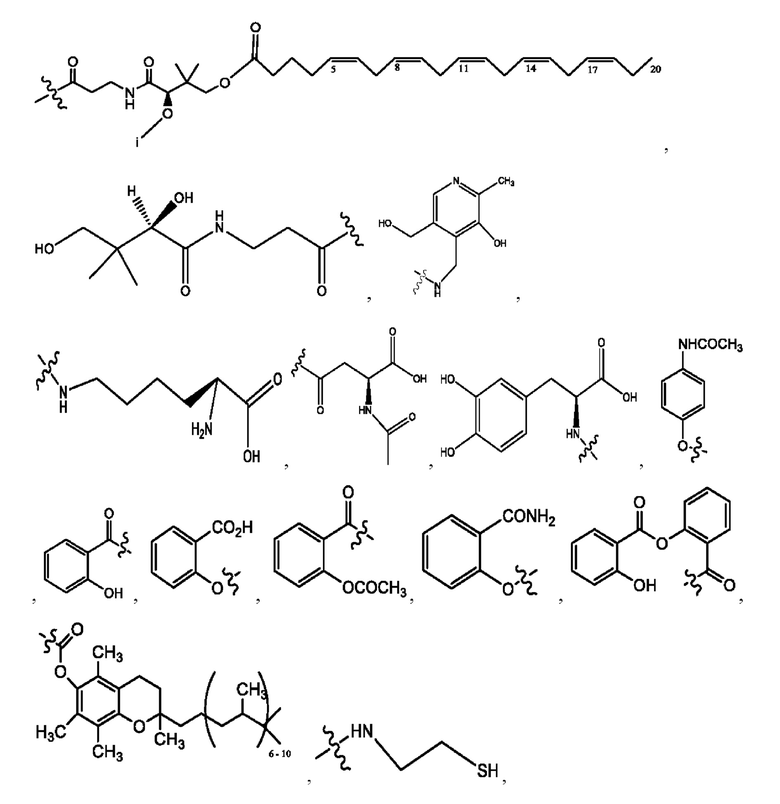
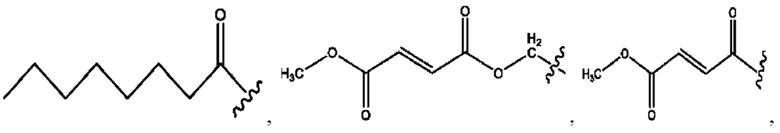
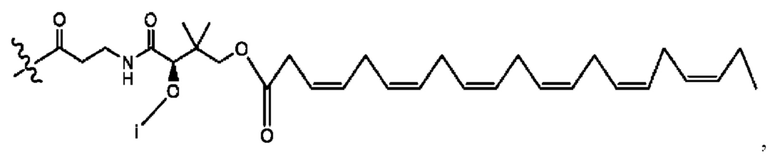
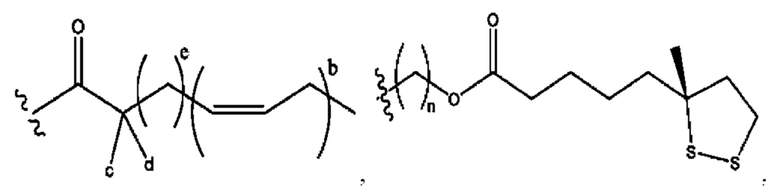
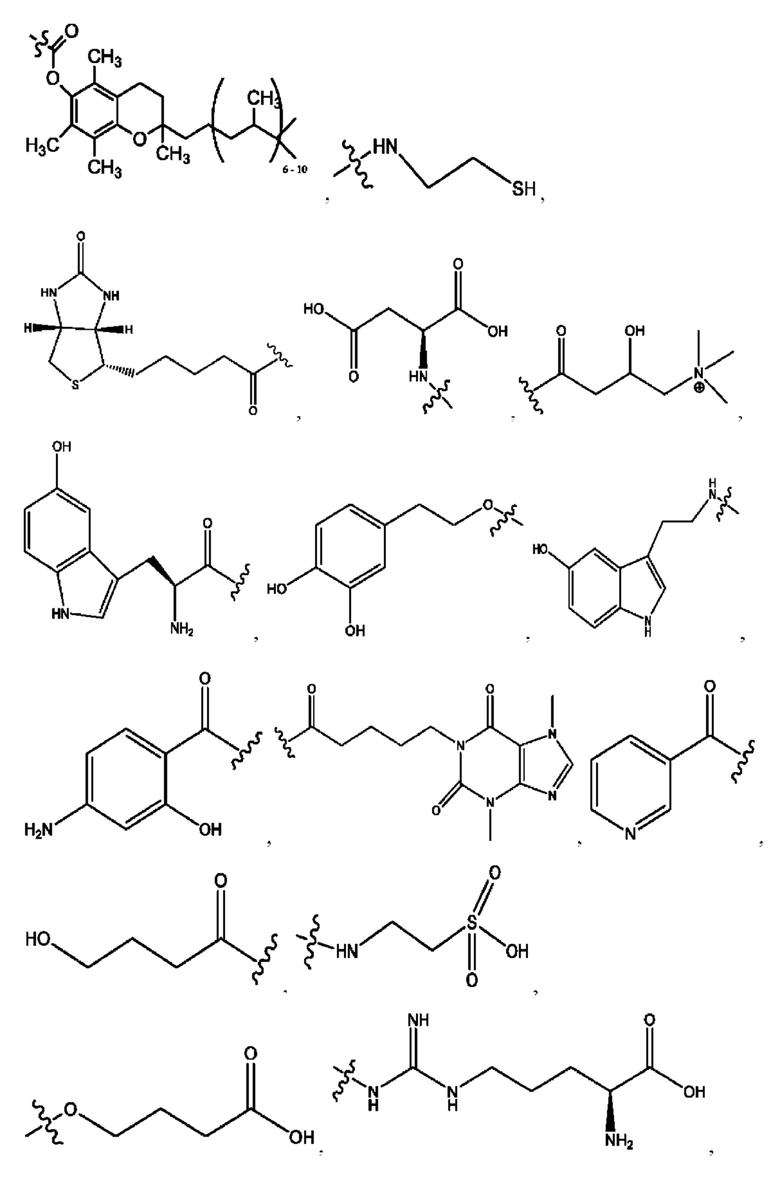
[0011] Согласно конкретным вариантам реализации представлены соединения и композиции формулы II:
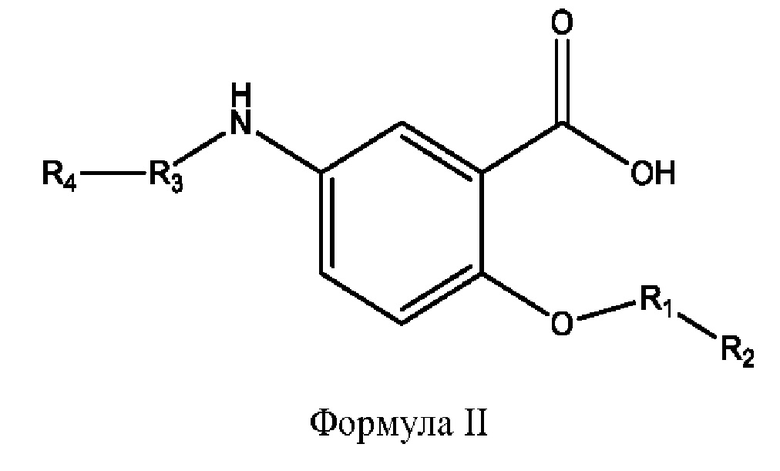
и его фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0012] Где,
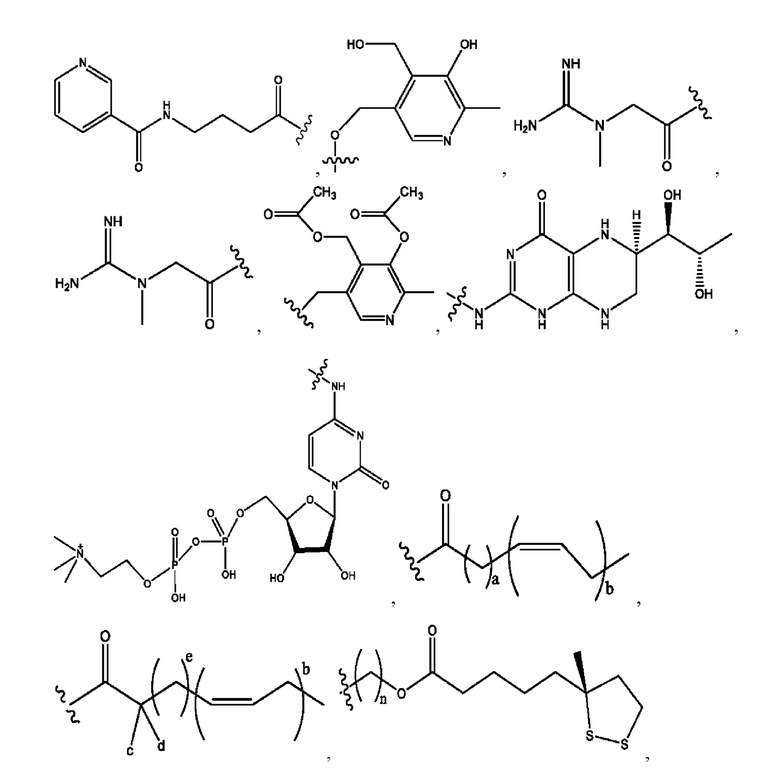
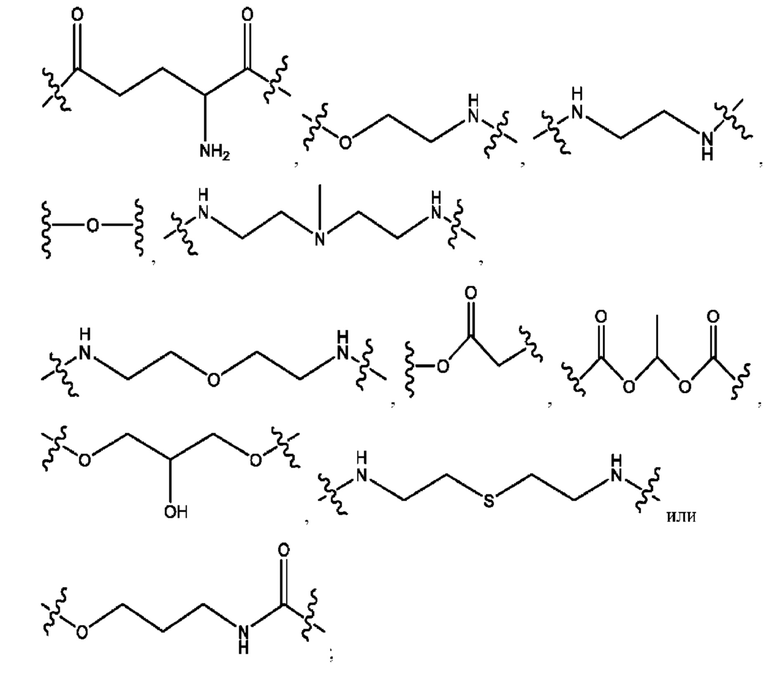
каждый R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, представляет собой
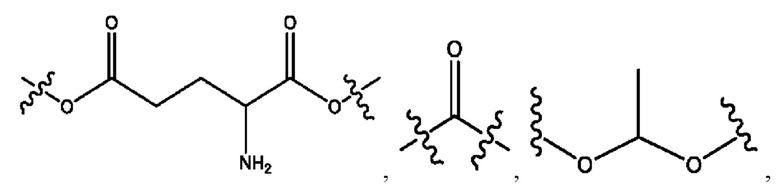
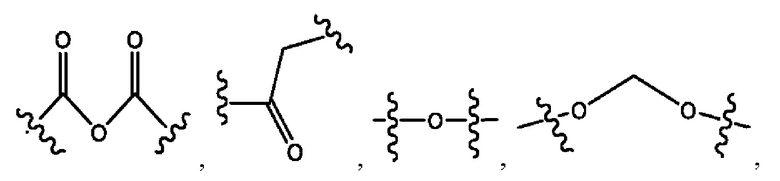
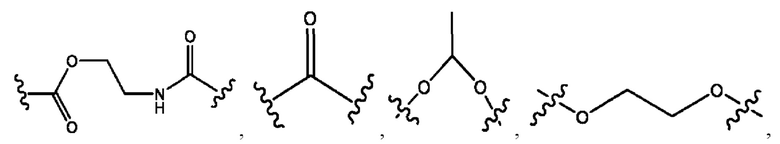
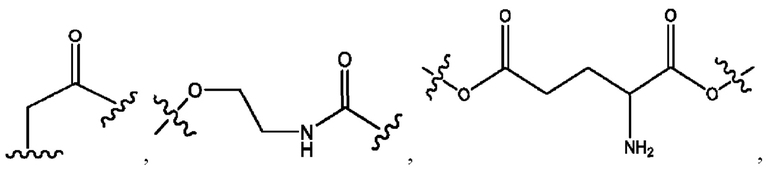
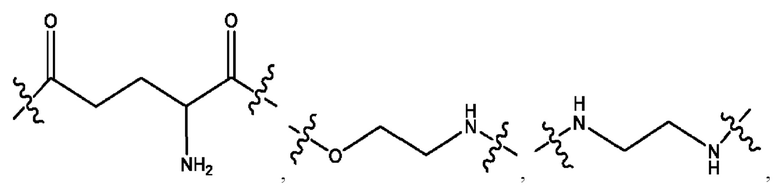
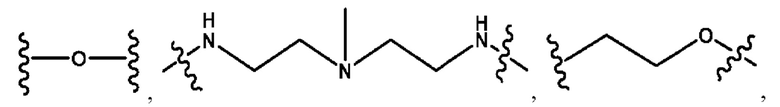
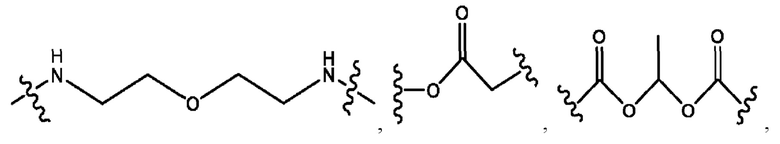
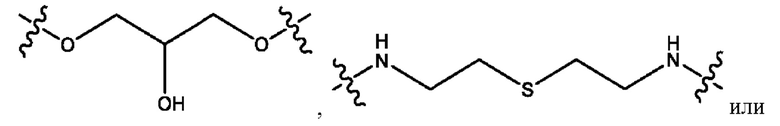
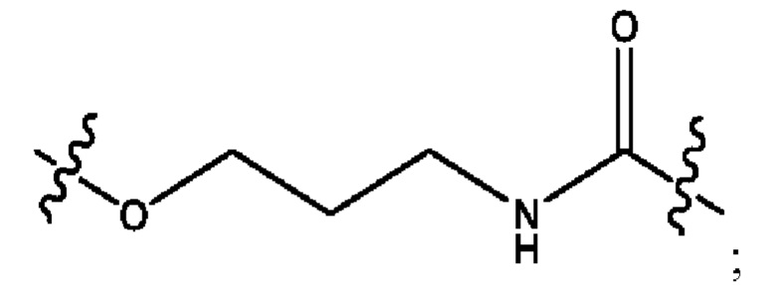
каждый R2, R4 независимо представляет собой D, OD,
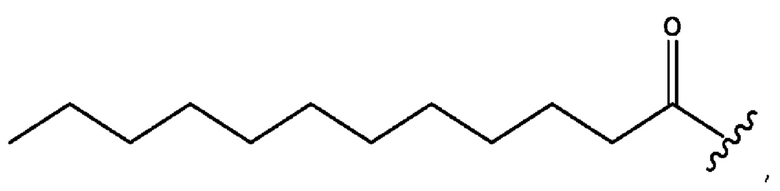
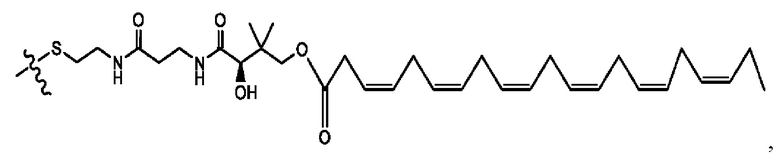
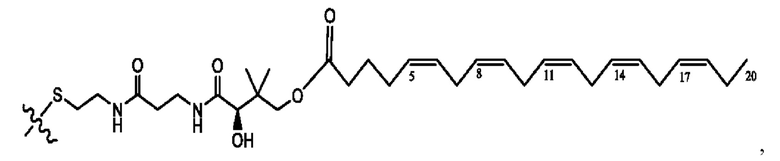
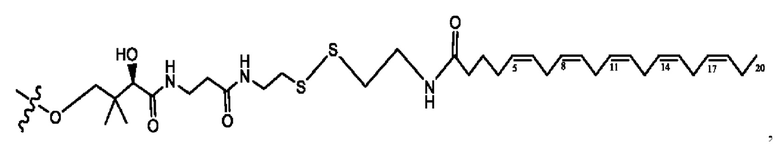

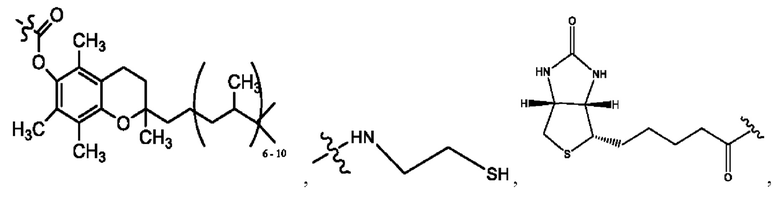
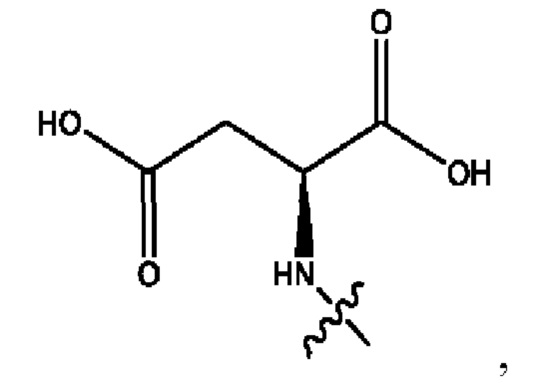
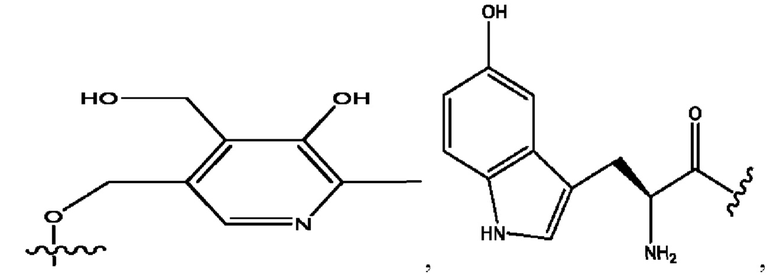
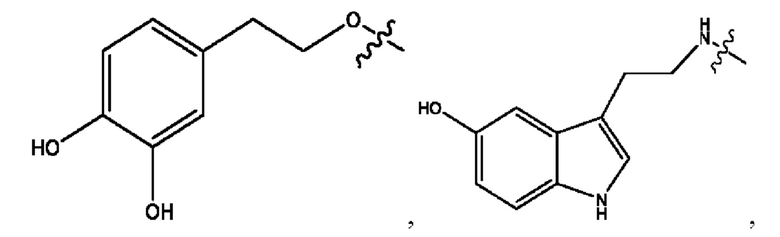
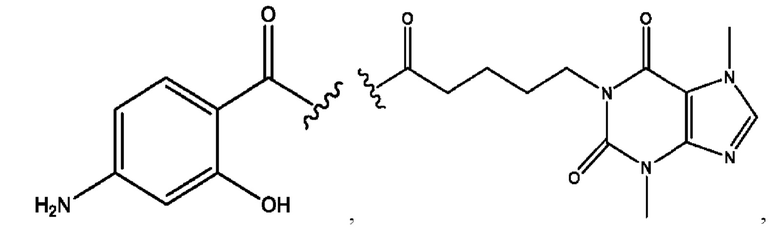
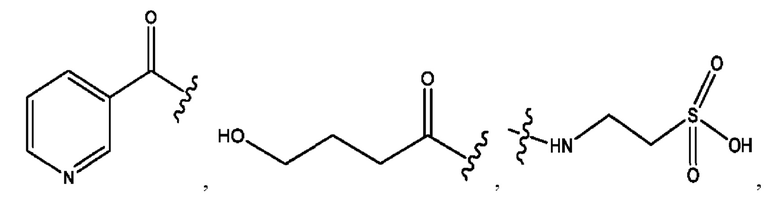
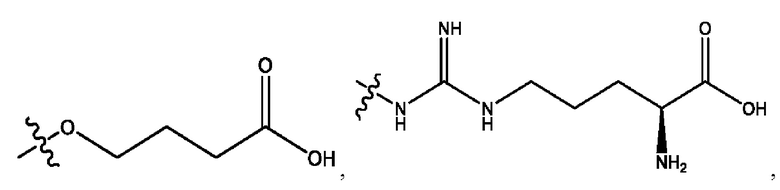
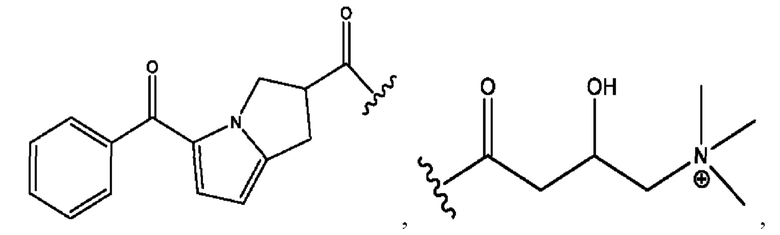
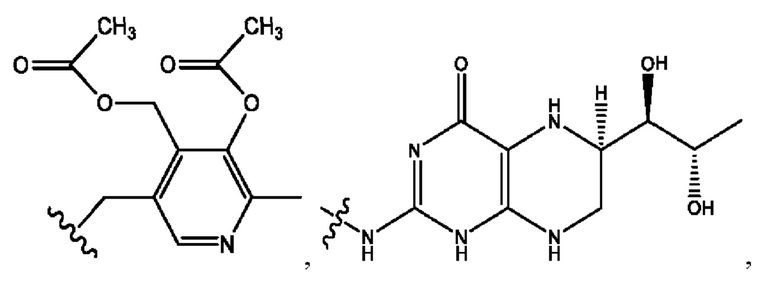
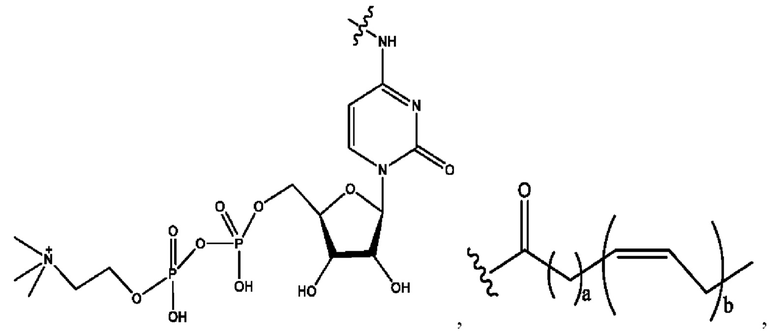
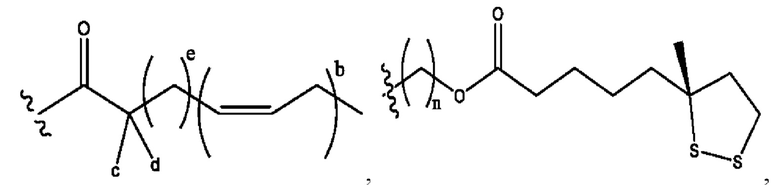
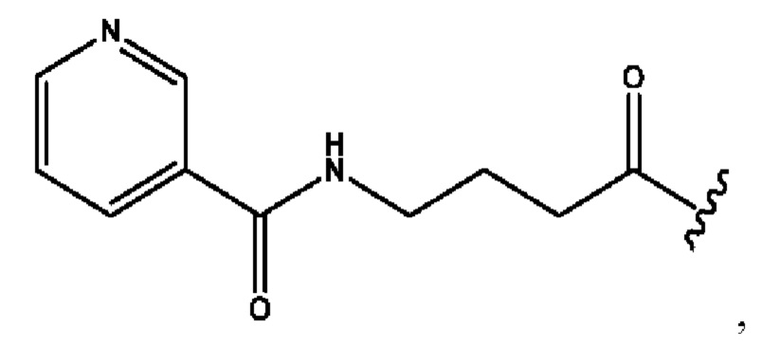
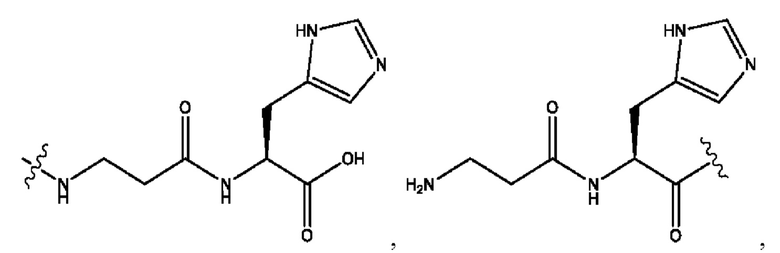
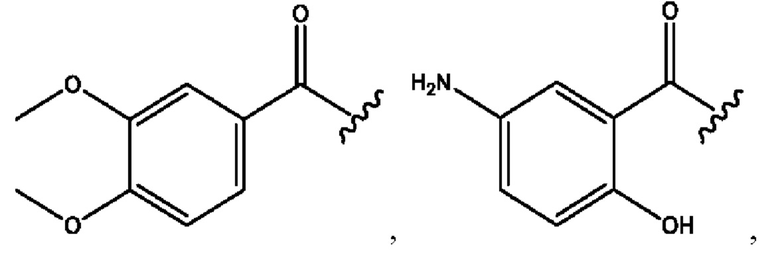
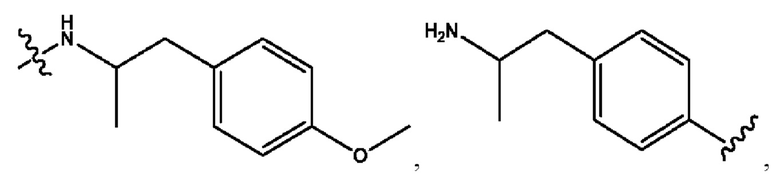
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
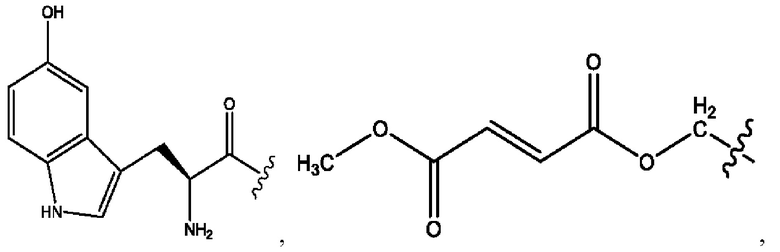
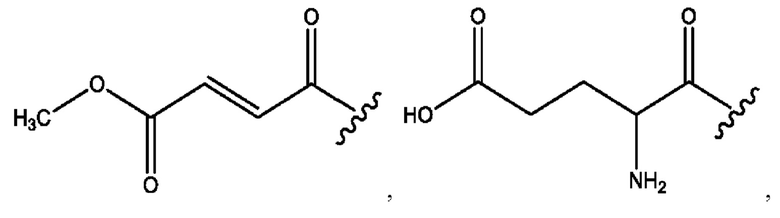
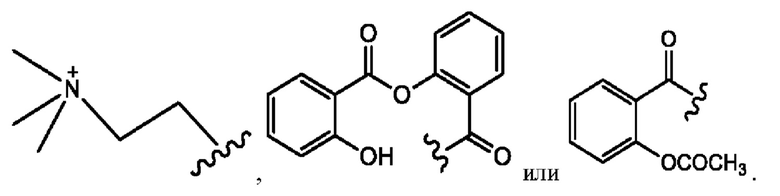
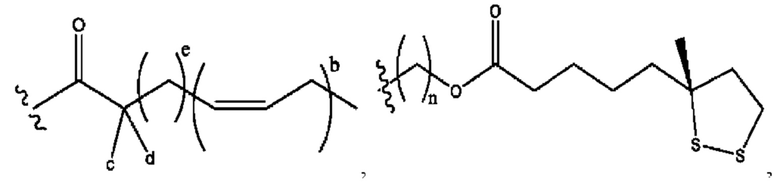
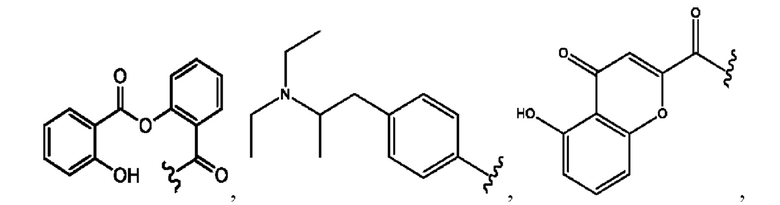
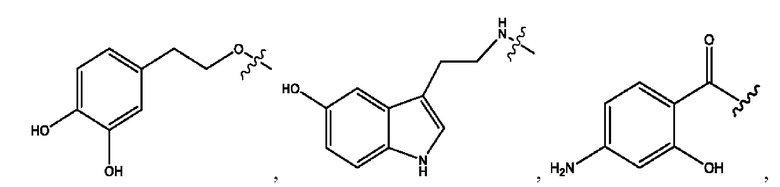
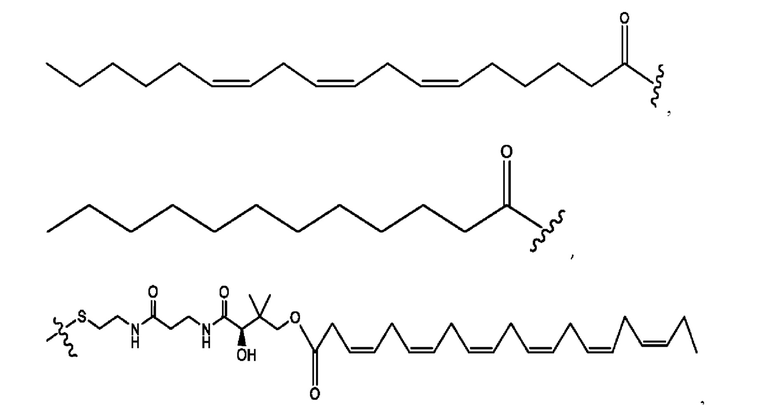
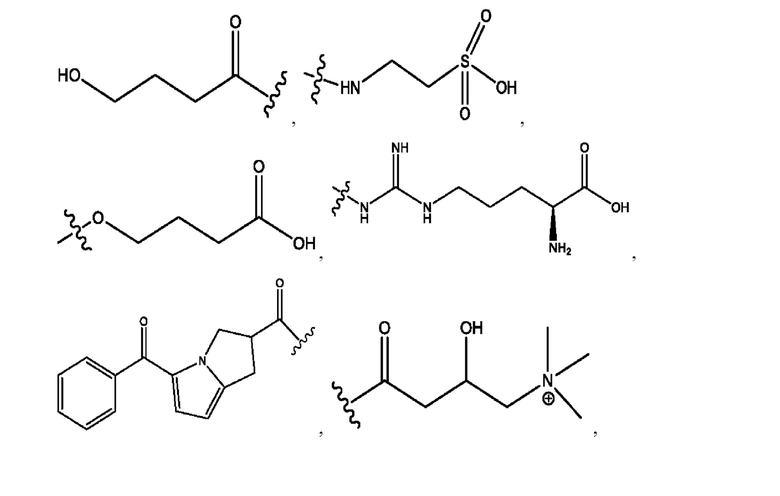
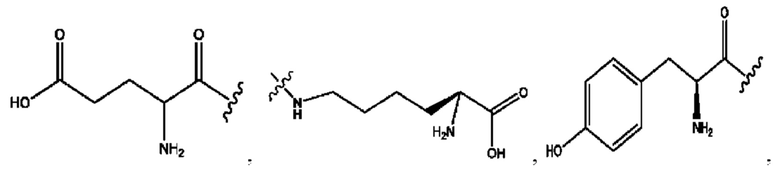
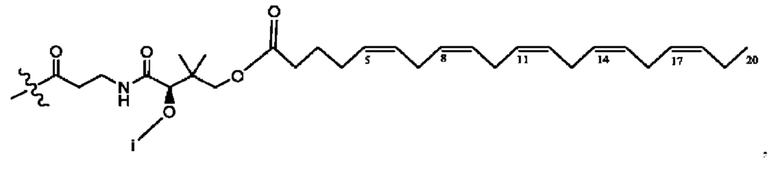
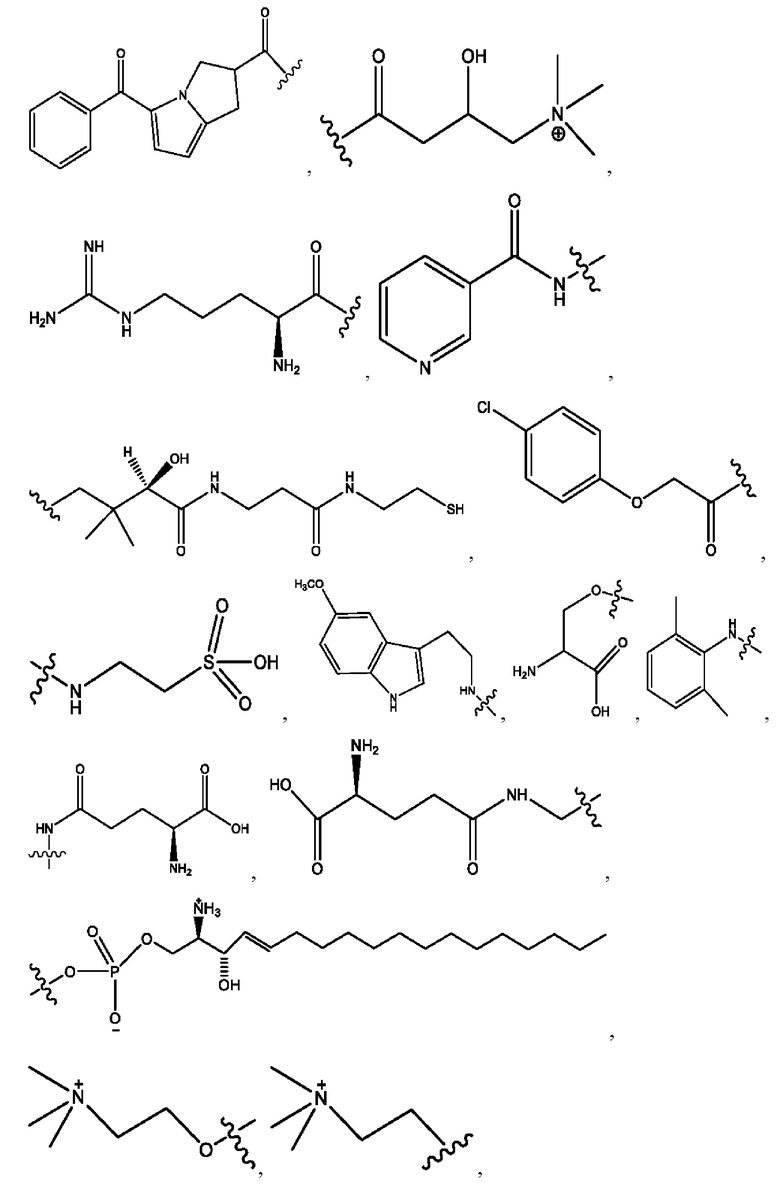
[0013] Согласно конкретным вариантам реализации изобретения представлены соединения формулы III:
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0014] Где,
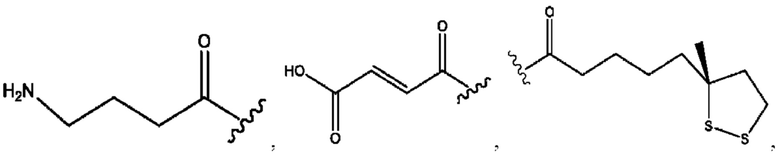
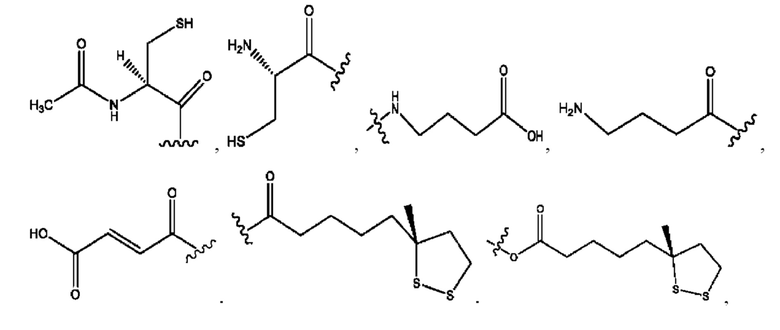
каждый R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует или представляет собой
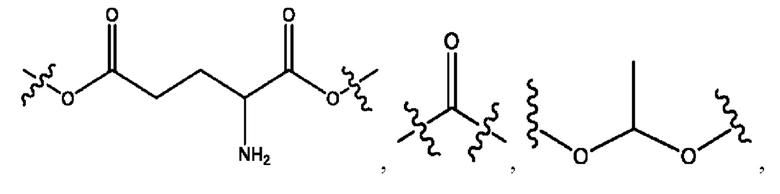
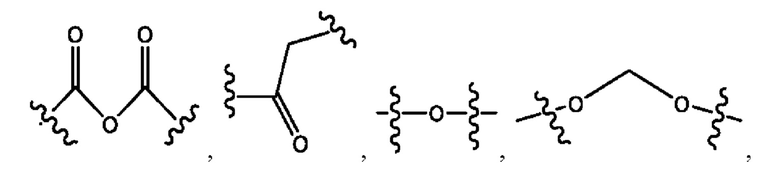
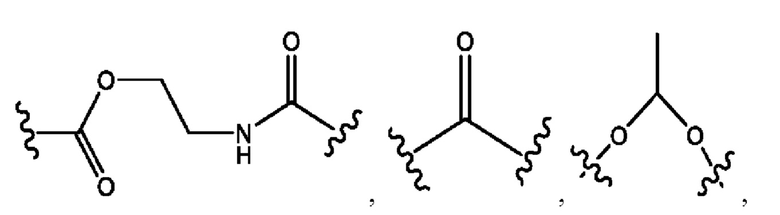
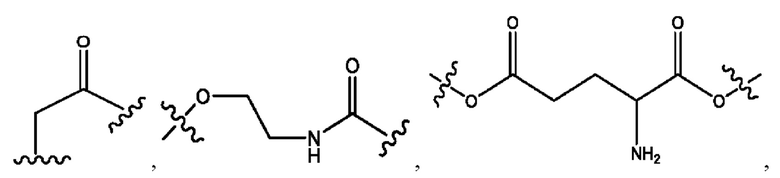
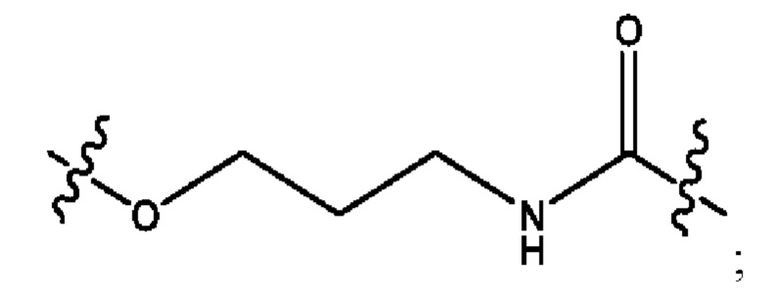
каждый R2, R4 независимо представляет собой D, OD,


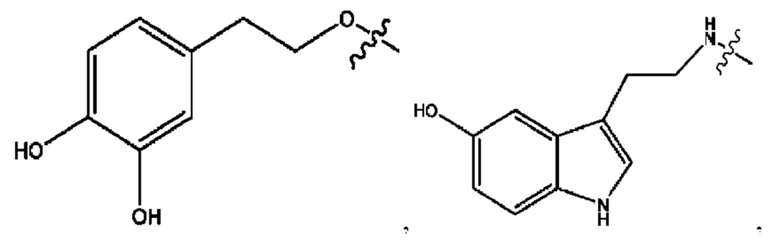
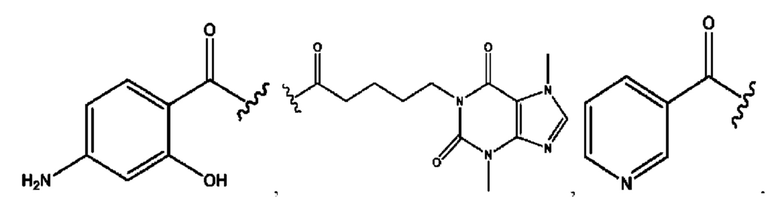
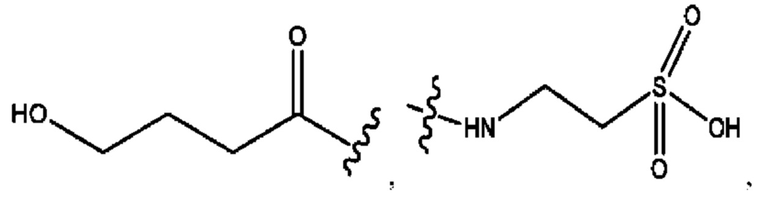
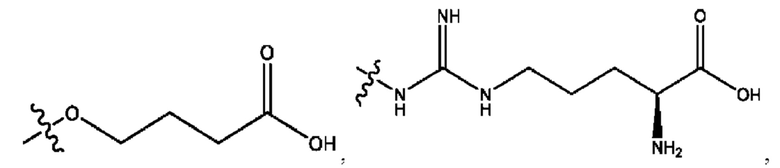

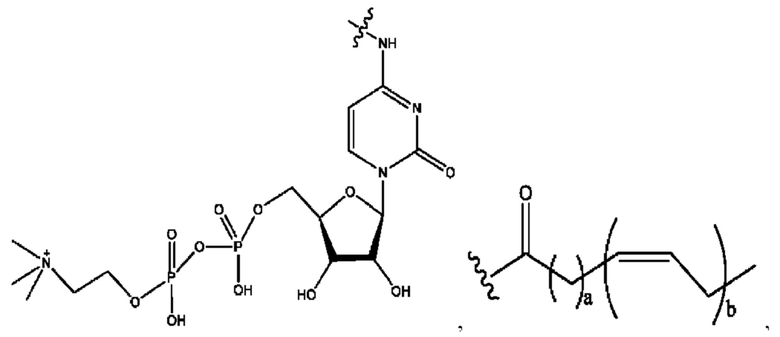
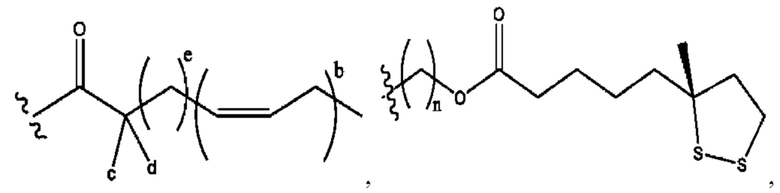
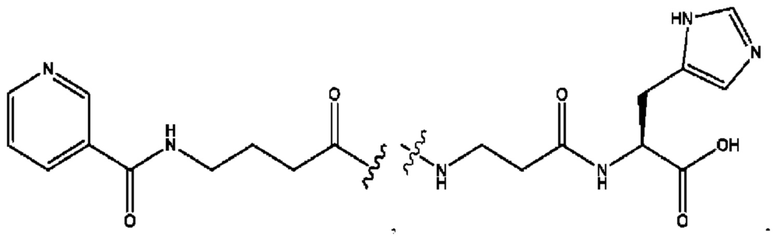
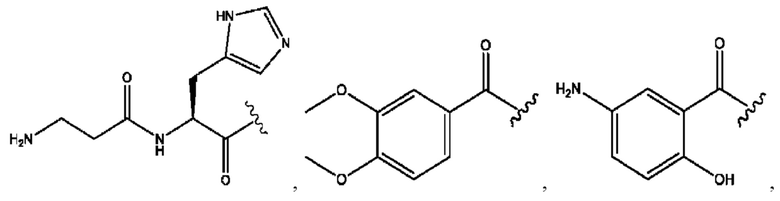
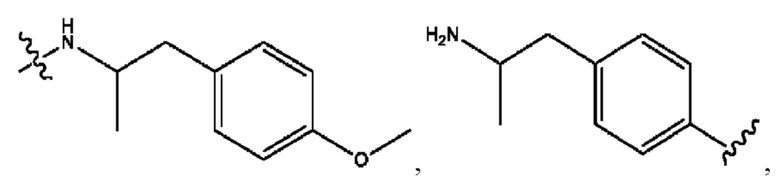
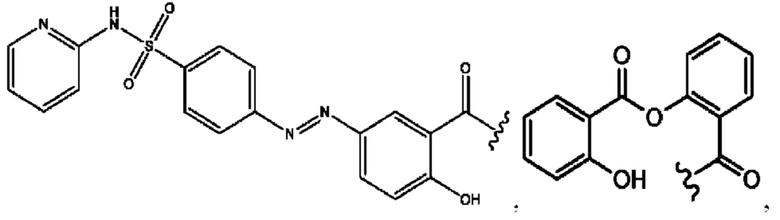

n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый с и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
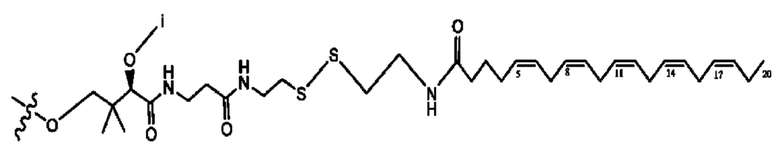
каждый i независимо представляет собой
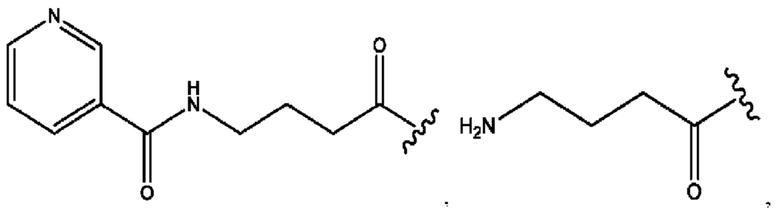
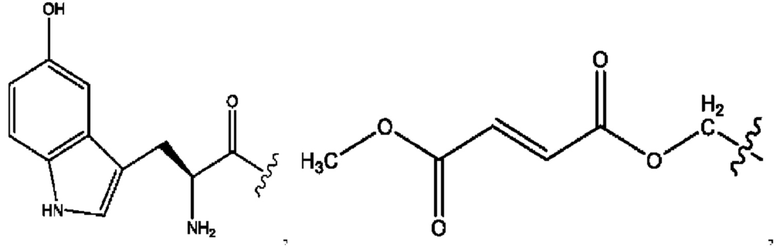
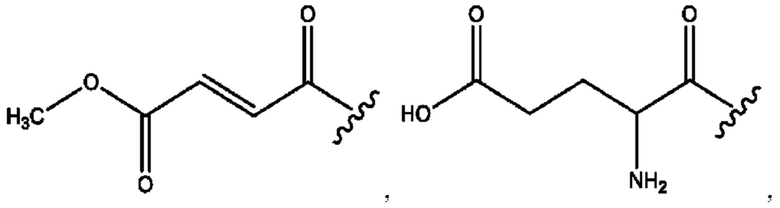
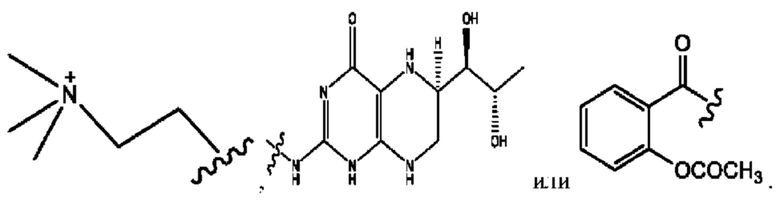
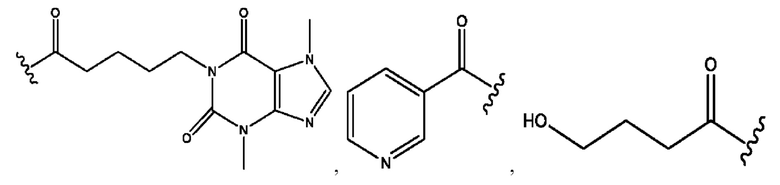
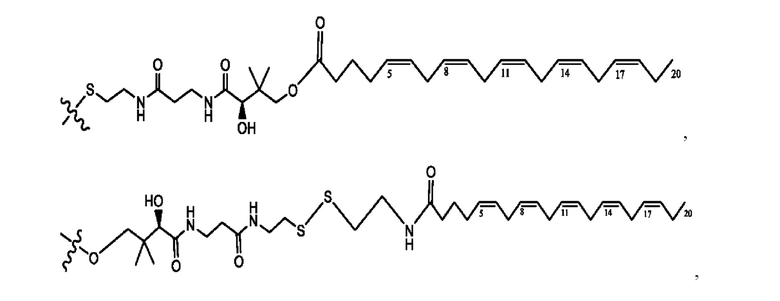
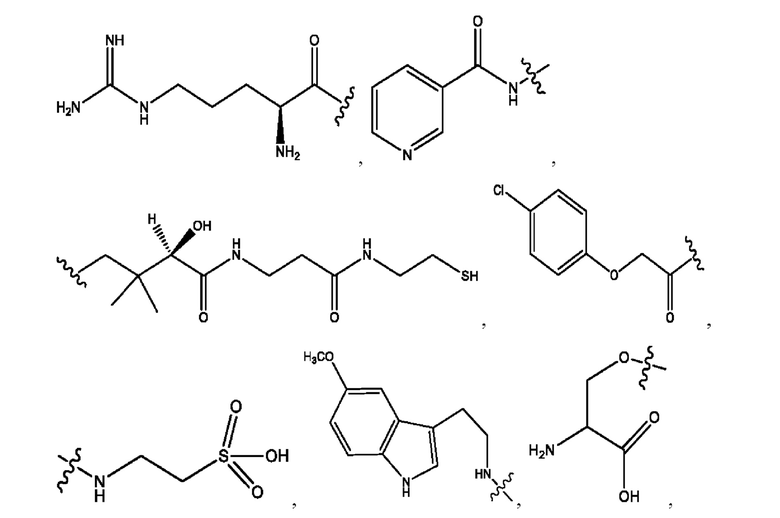
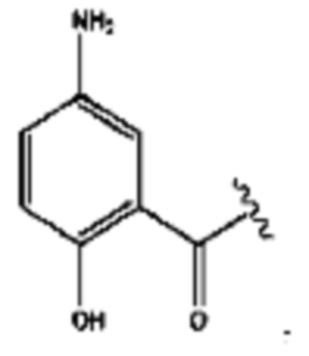
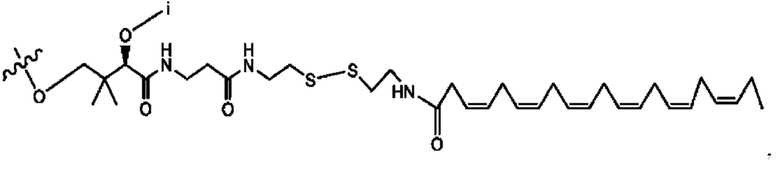
[0015] Согласно определенным вариантам реализации изобретения представлены соединения формулы IV:
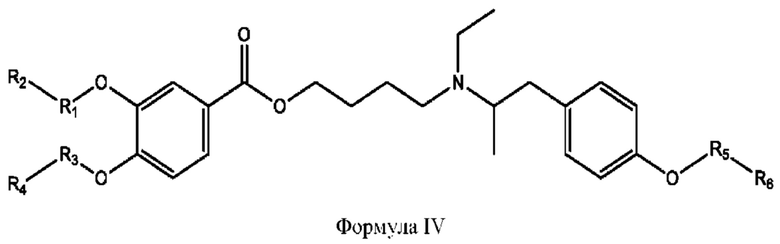
и ее фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0016] Где,
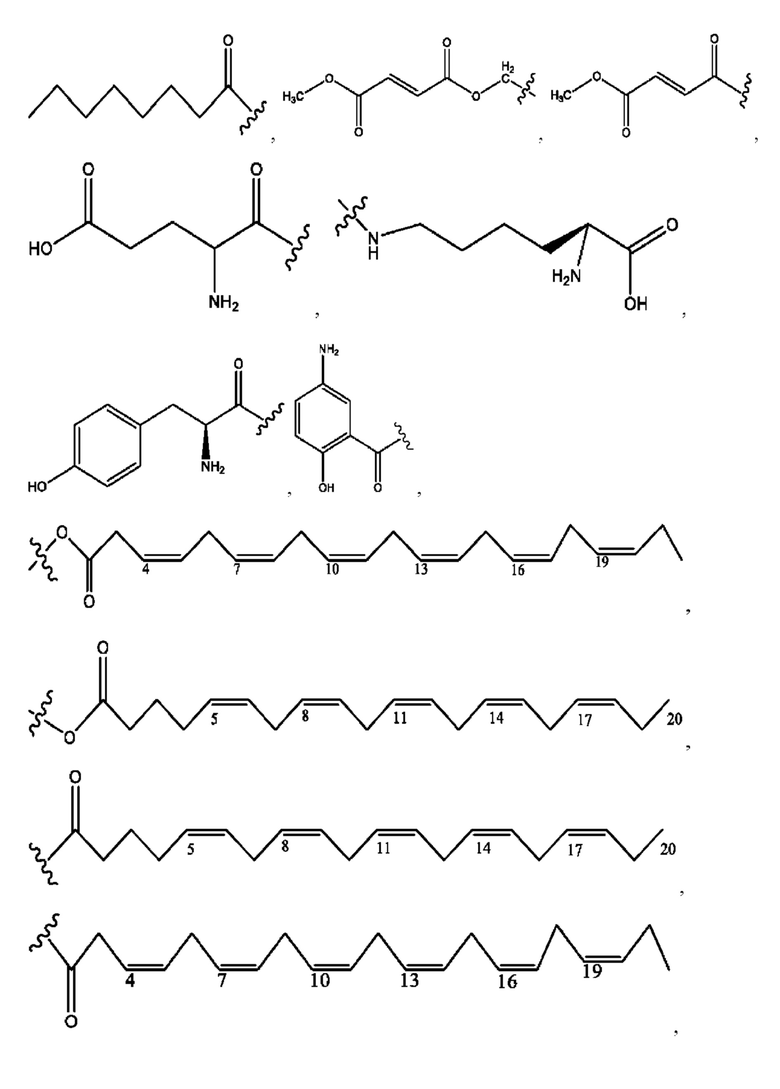
каждый R1, R3, R5 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
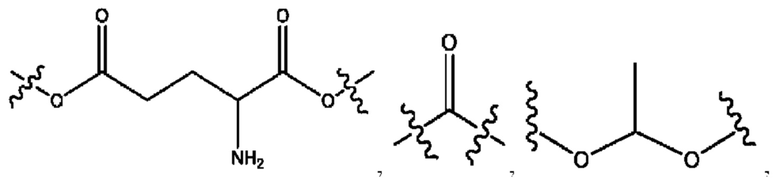
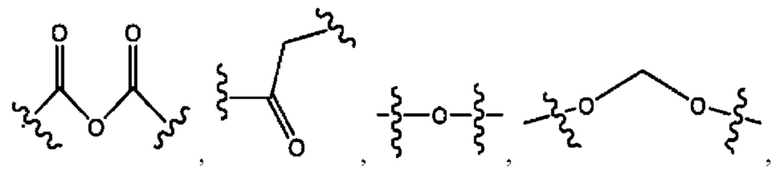
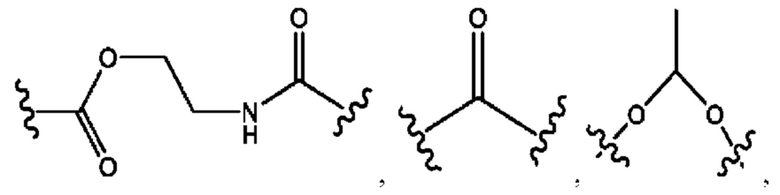
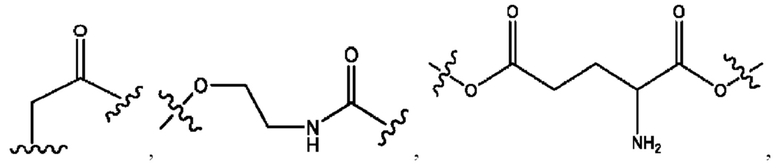
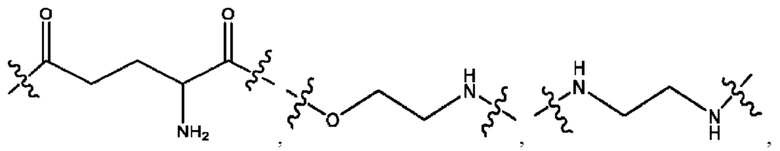
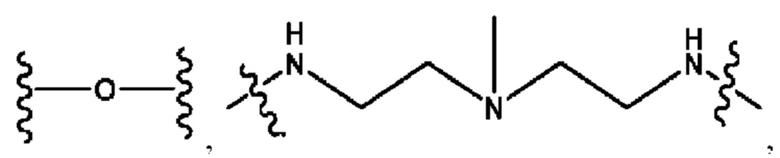
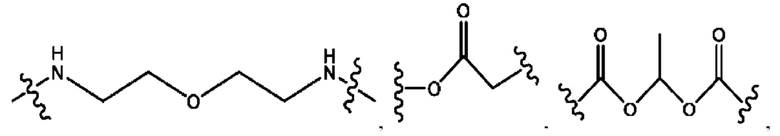
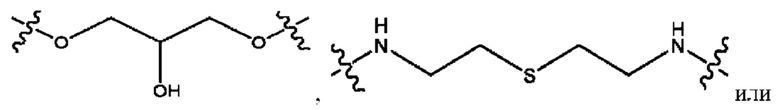
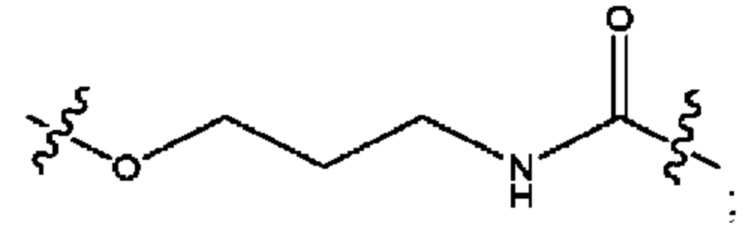
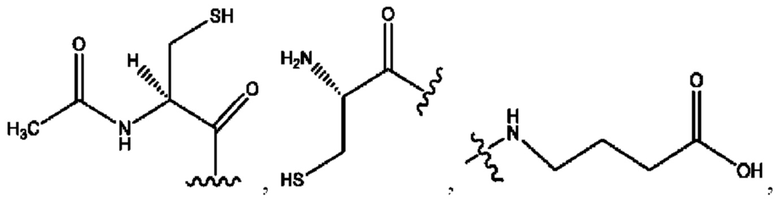
каждый R2, R4 независимо представляет собой D, OD,

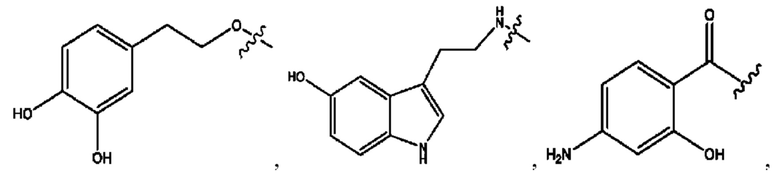
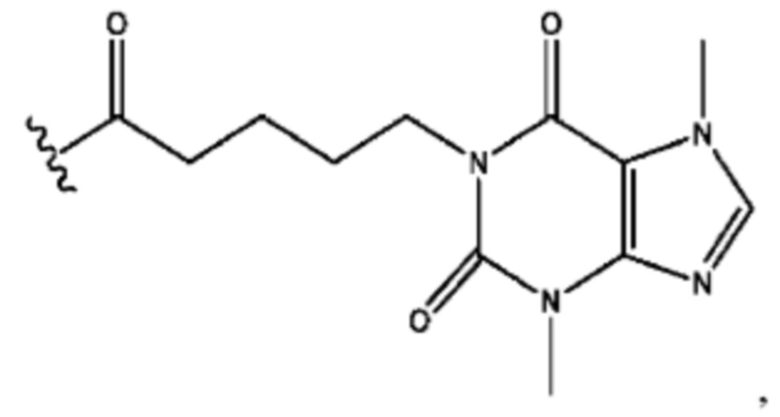
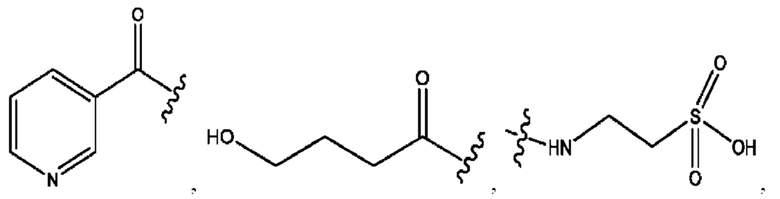

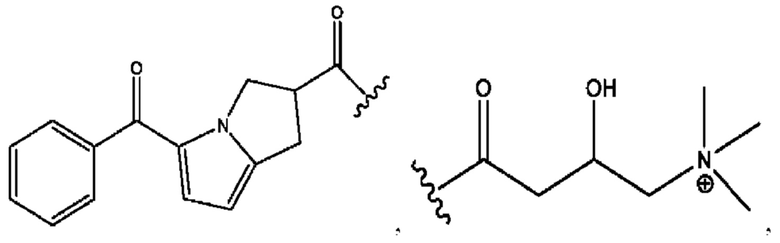
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый с и d независимо представляет собой Н, D, -ОН, -OD, C1-C6-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
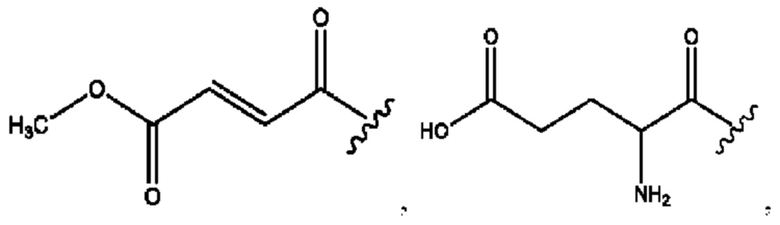
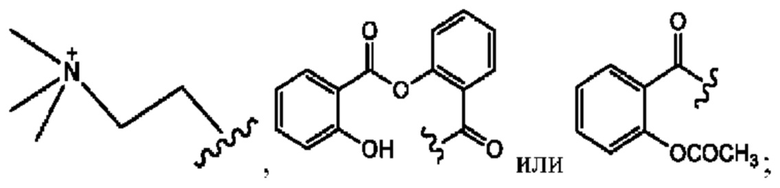
R6 независимо представляет собой D, OD, ОН или Н.
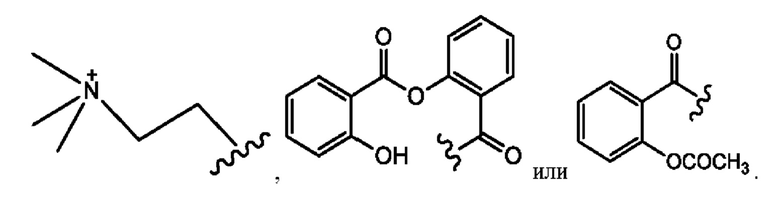
[0017] Согласно определенным вариантам реализации изобретения представлены соединения формулы V:
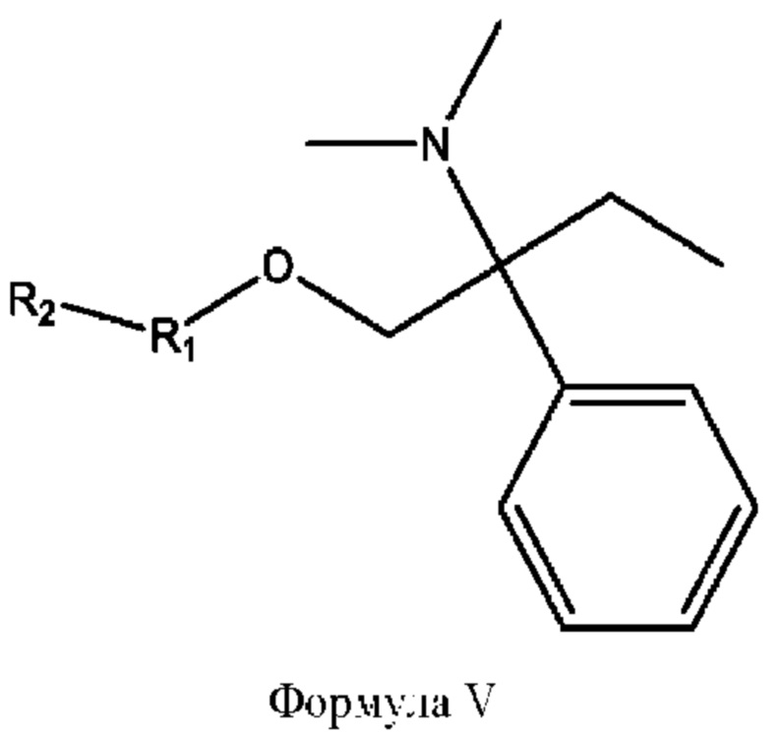
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0018] Где,
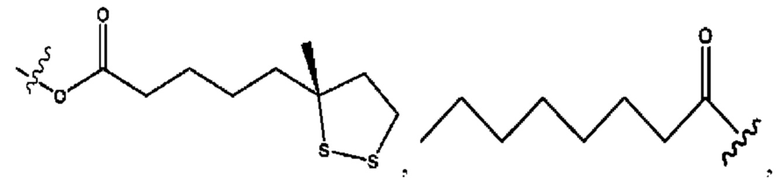
R1 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
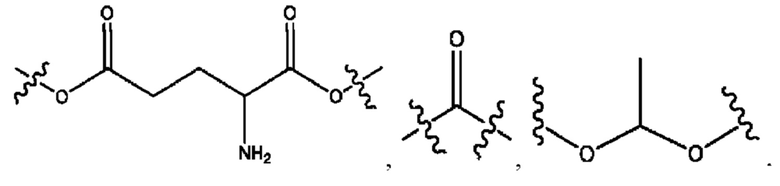
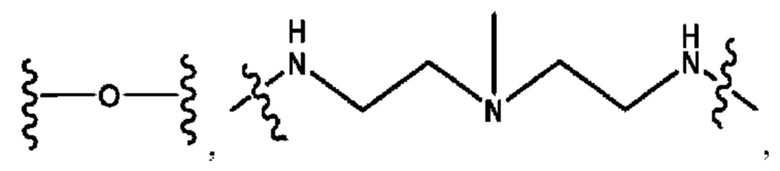
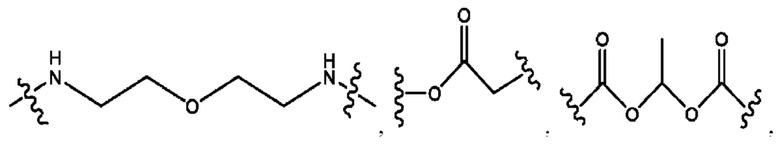
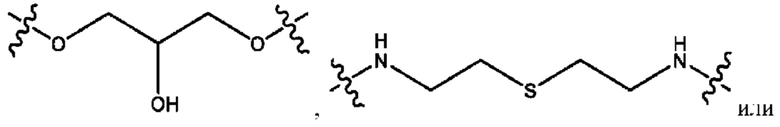
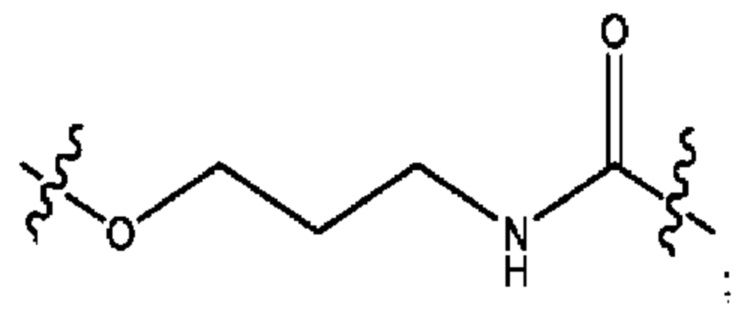
R2 независимо представляет собой D, OD,
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый e и d независимо представляет собой Н, D, -ОН, -OD, C1-C6-алкил, -NH2 или -СОСН3;
при условии присутствия
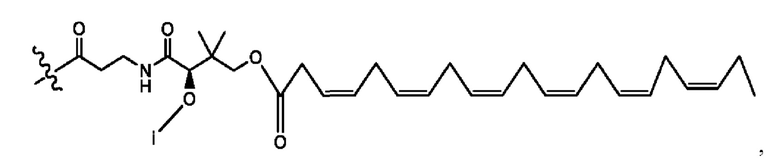
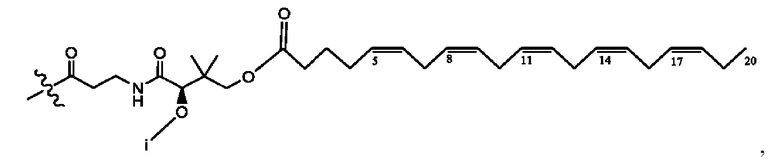
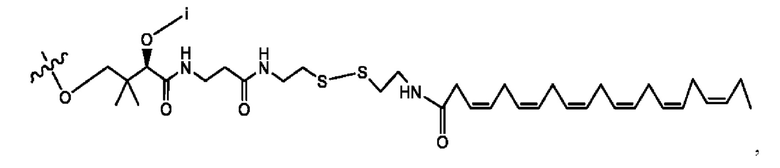
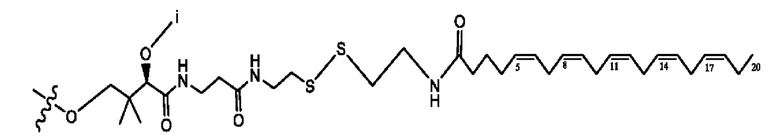
каждый i независимо представляет собой
[0019] Согласно определенным вариантам реализации изобретения представлены соединения формулы VI:
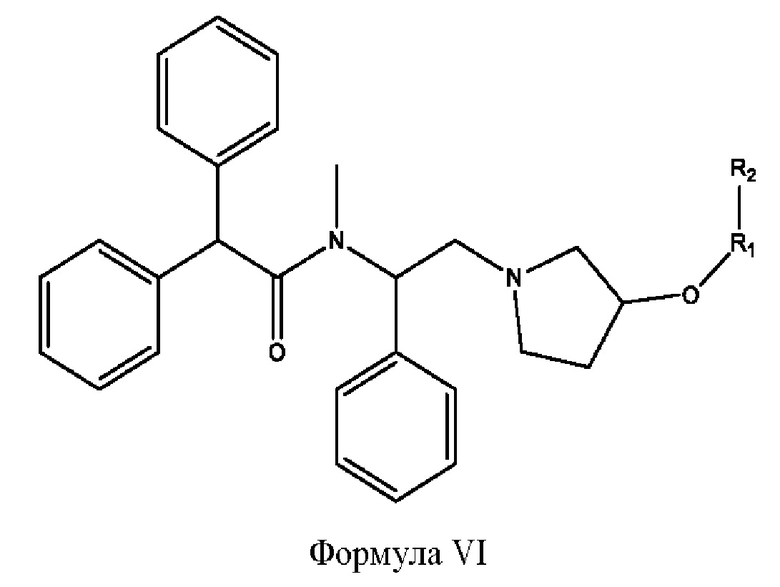
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0020] Где,
R1 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
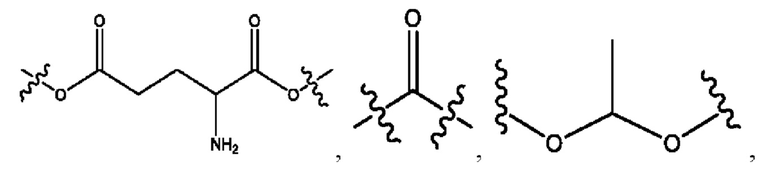
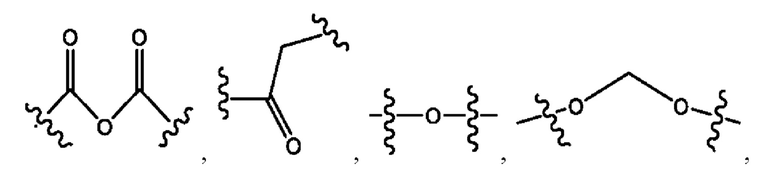
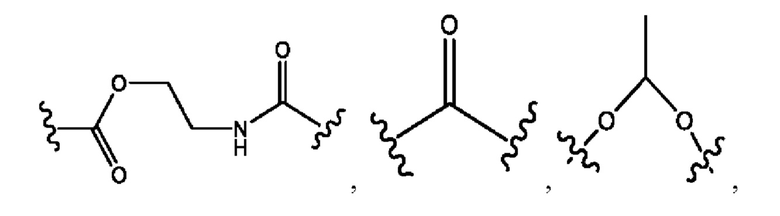
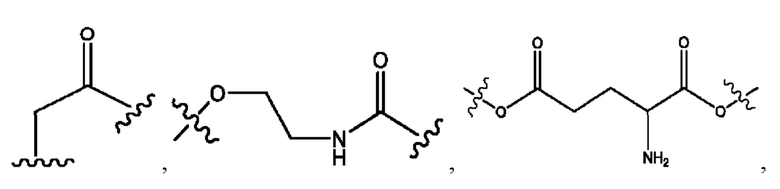
R2 независимо представляет собой D, OD,
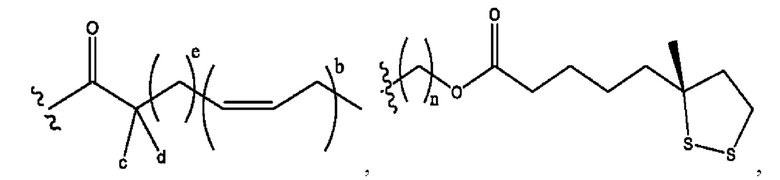
тнезависимо равен 1, 2,3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый с и d независимо представляет собой Н, D, -ОН, -OD, C1-C6-алкил, -NH2 или -СОСН3;
при условии присутствия
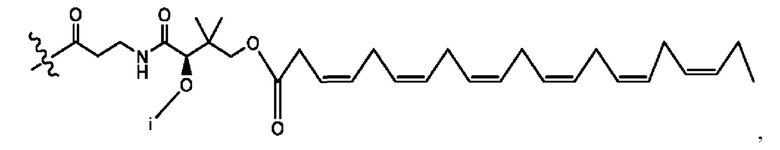
каждый i независимо представляет собой
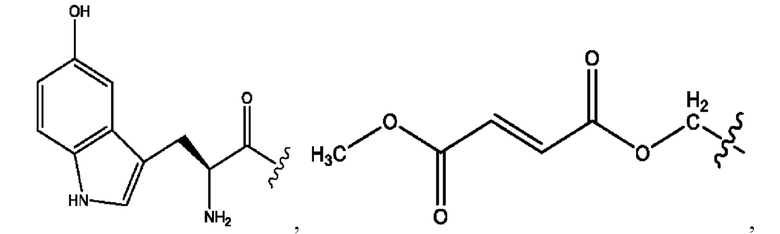
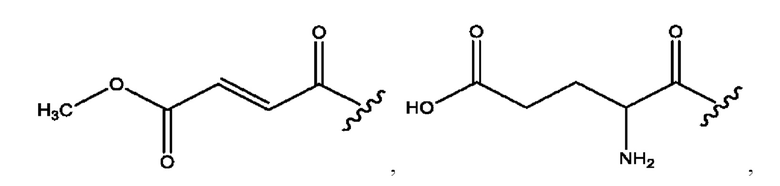
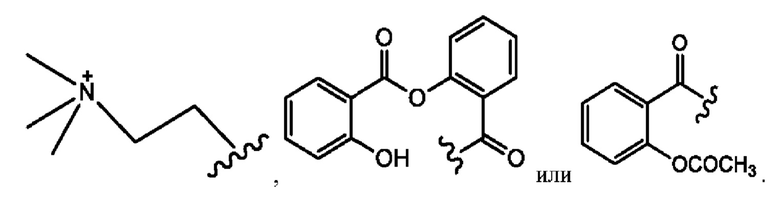
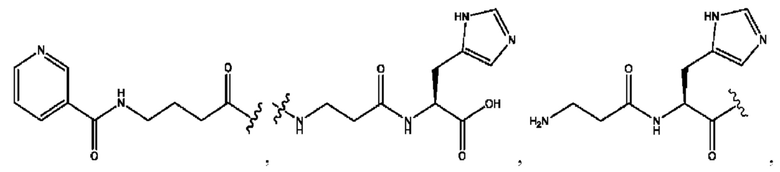
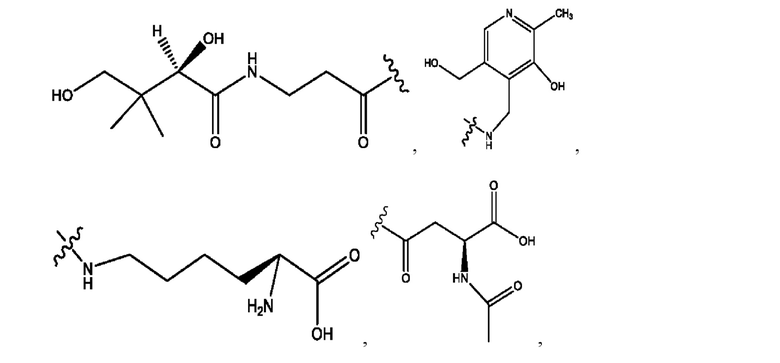
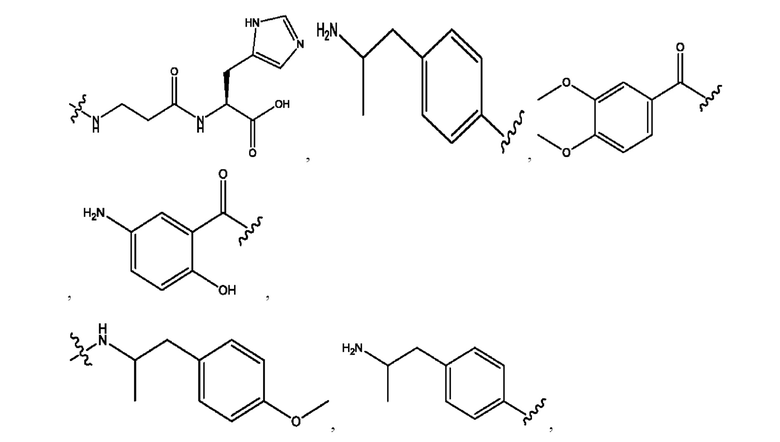
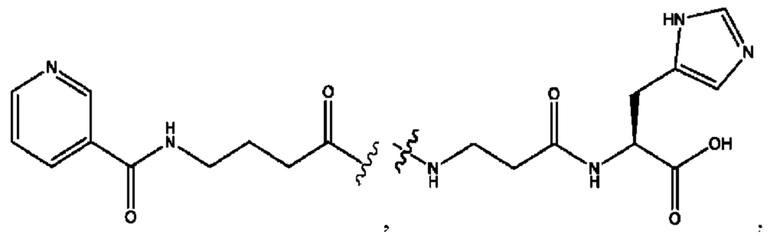
[0021] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы VII, или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
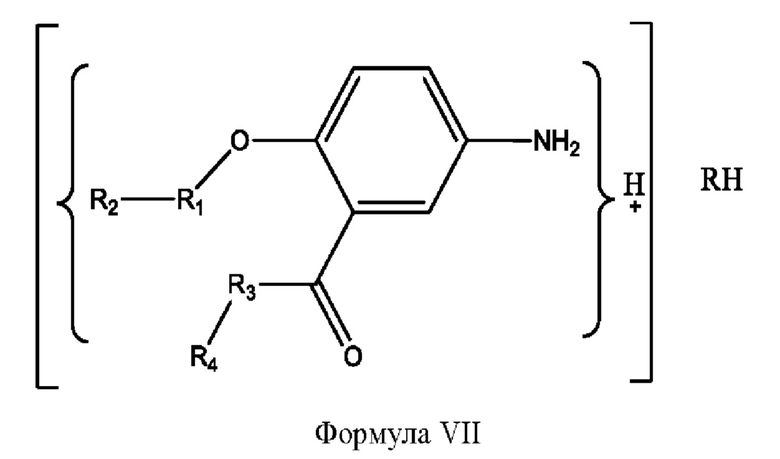
с по меньшей мере одним соединением, представленным группой RH, или их смесям,
[0022] Где,
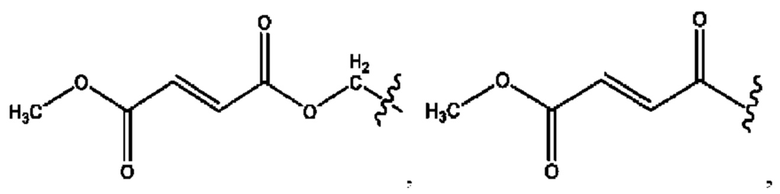
каждый R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
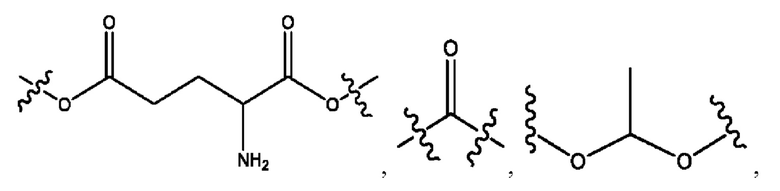
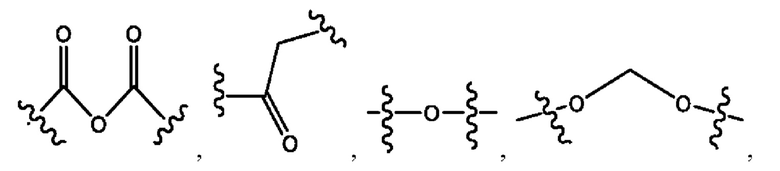
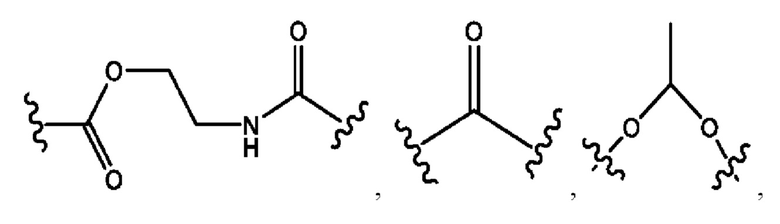
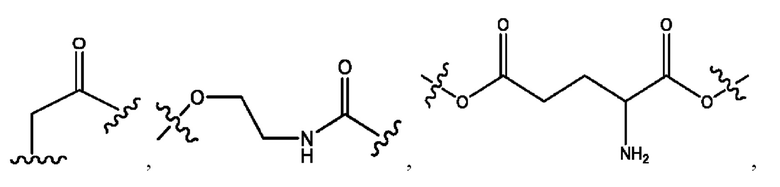
каждый R2, R4 независимо представляет собой D, OD,
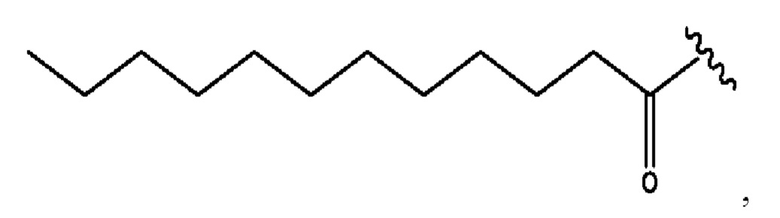
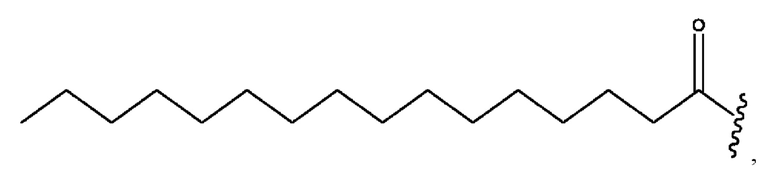
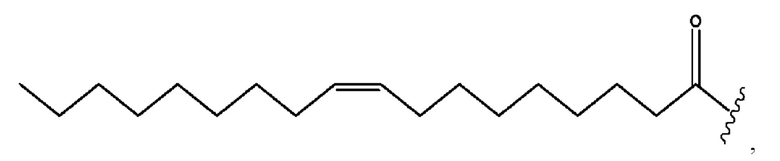
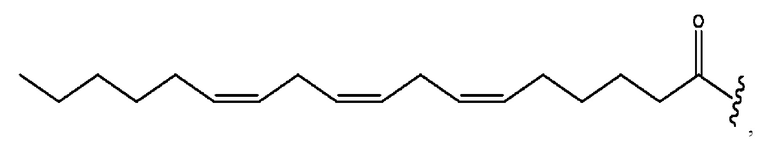



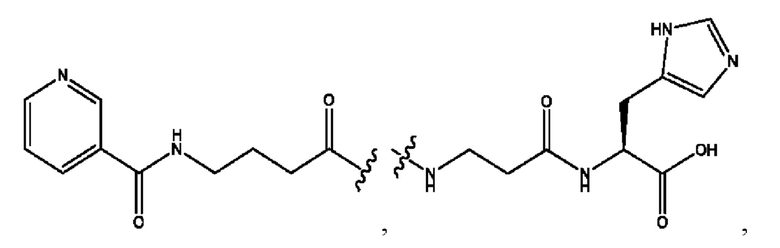
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
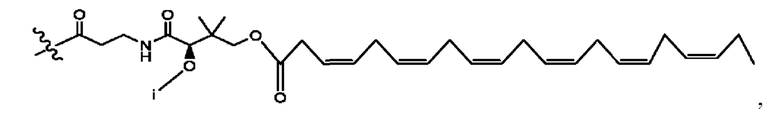
каждый i независимо представляет собой

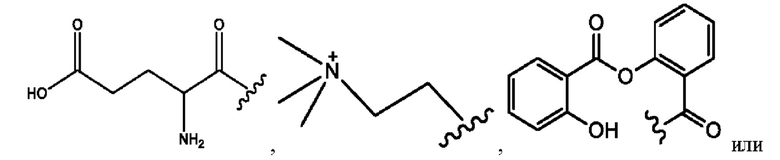
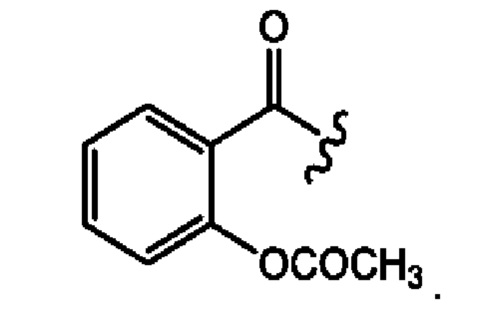
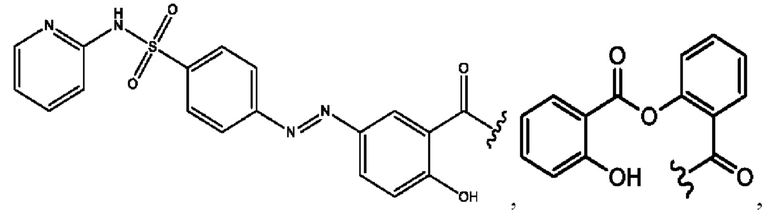
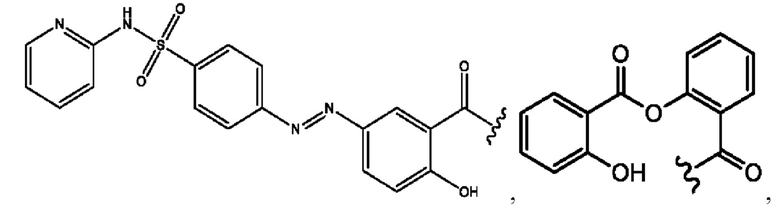
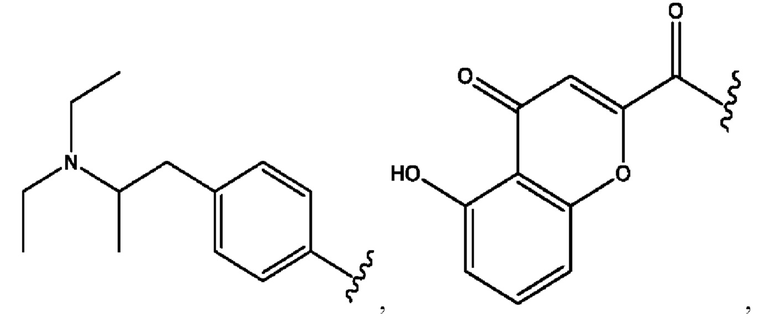
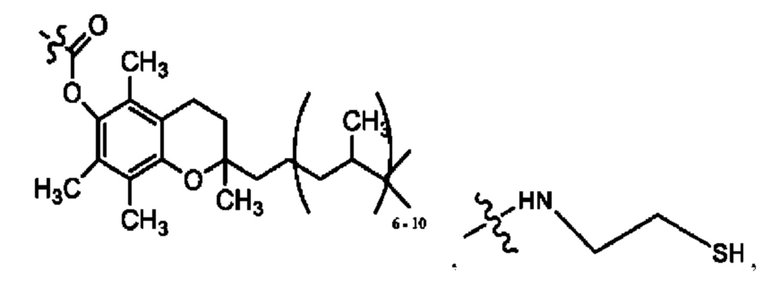
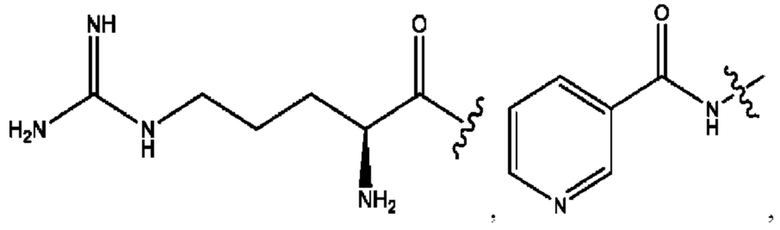
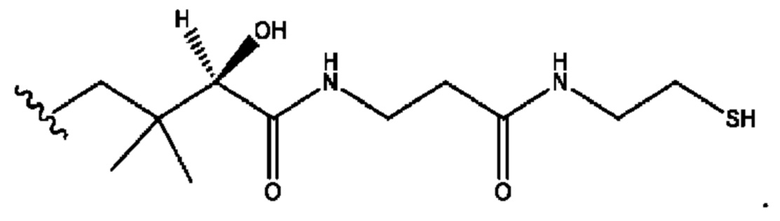
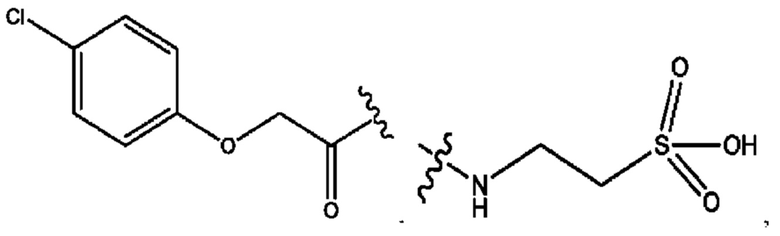
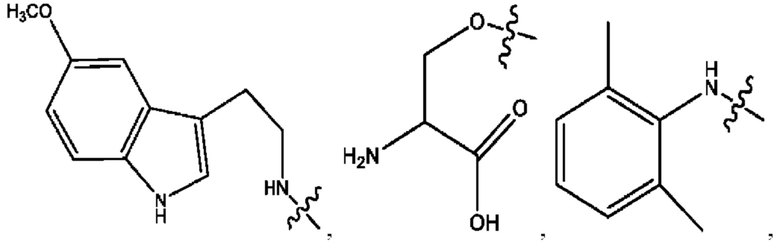
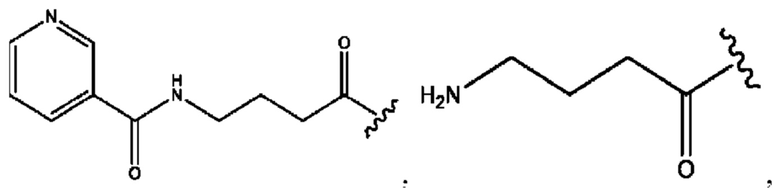
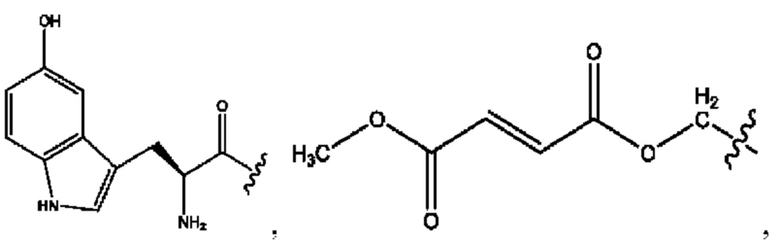
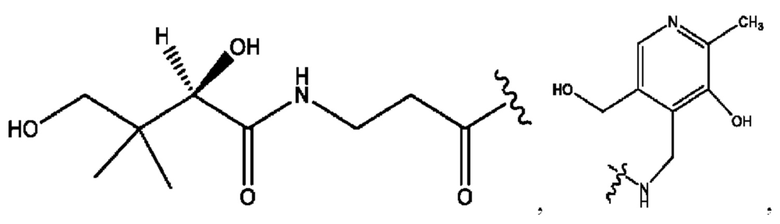
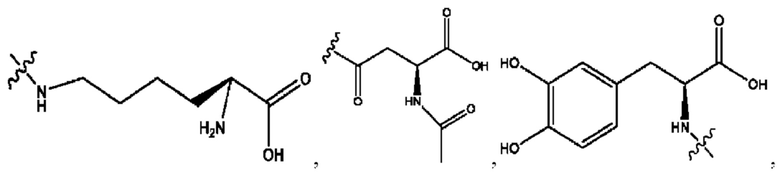
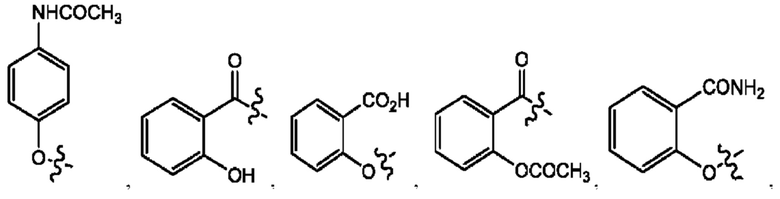
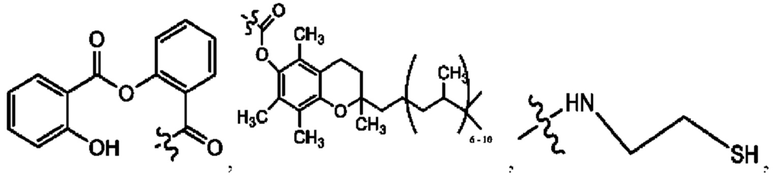
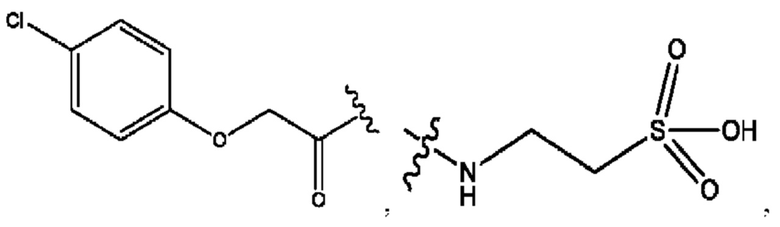
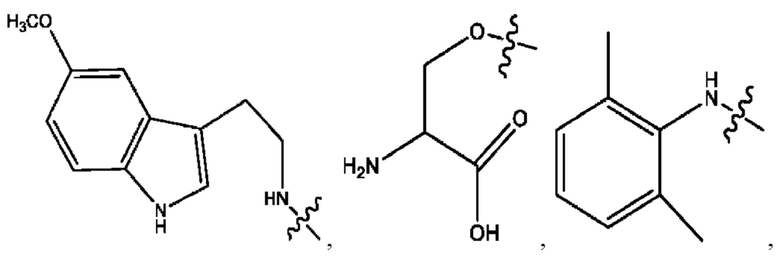
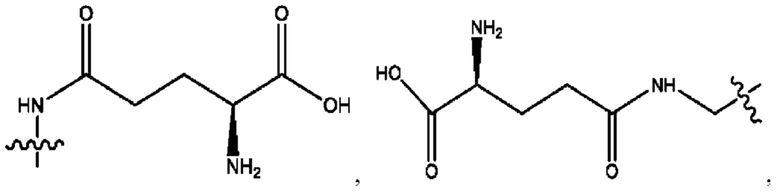
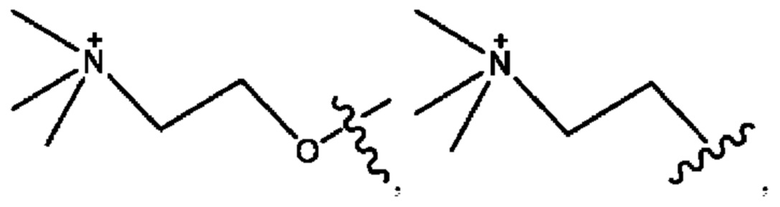
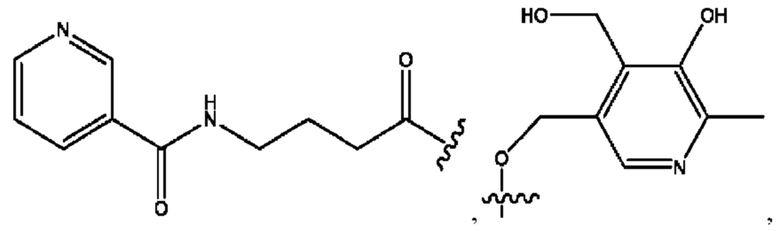
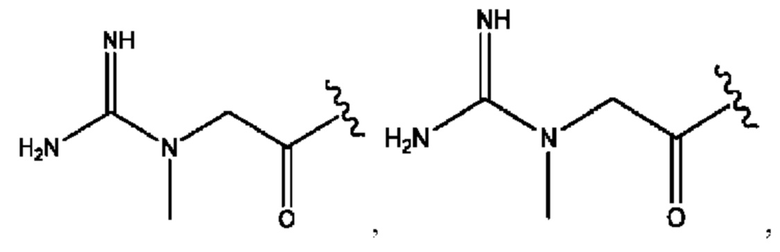
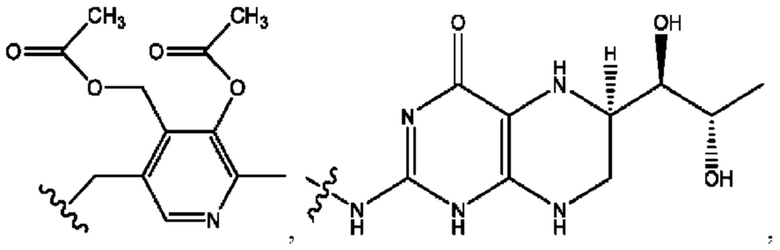
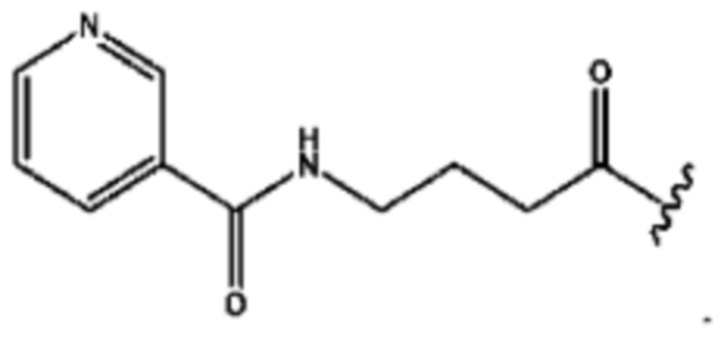
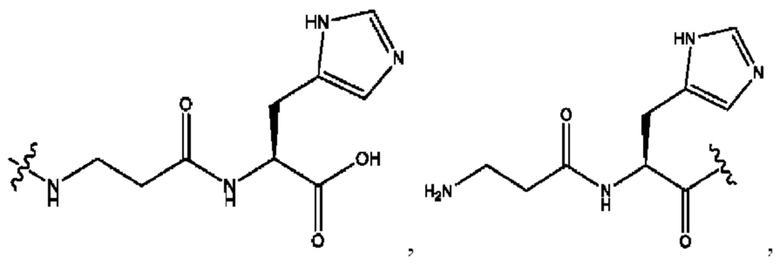
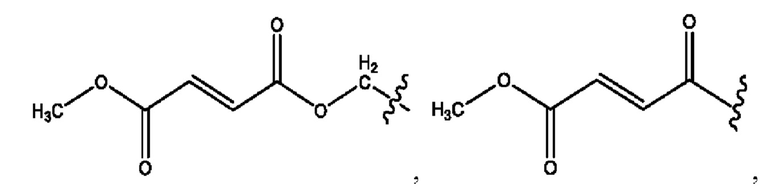
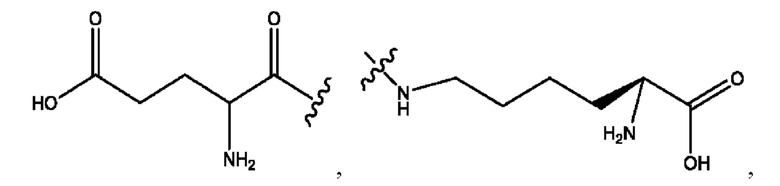
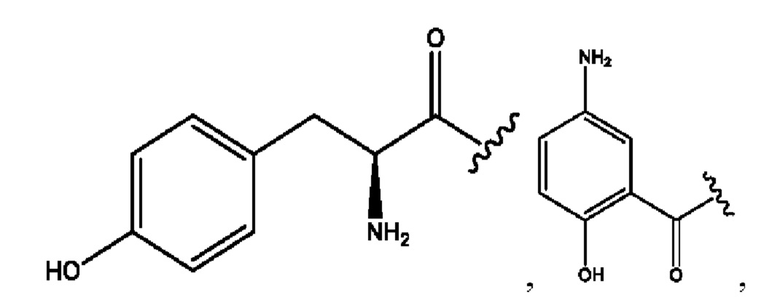
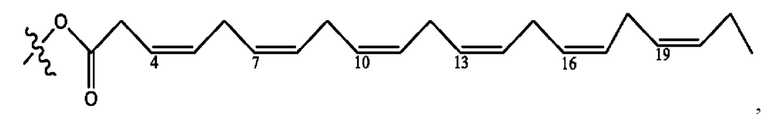
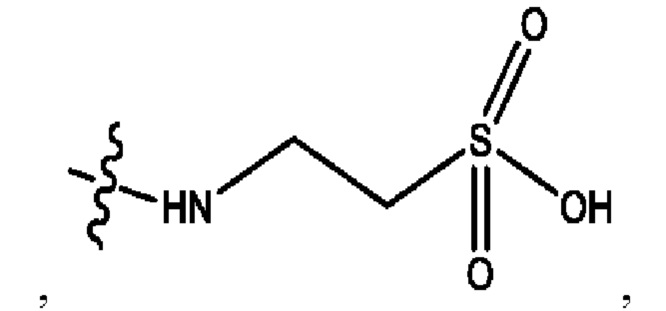
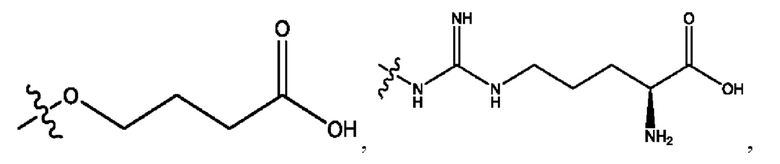
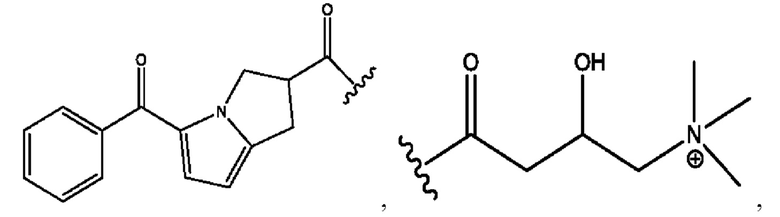
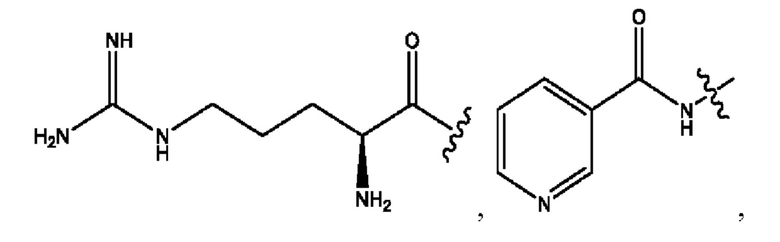
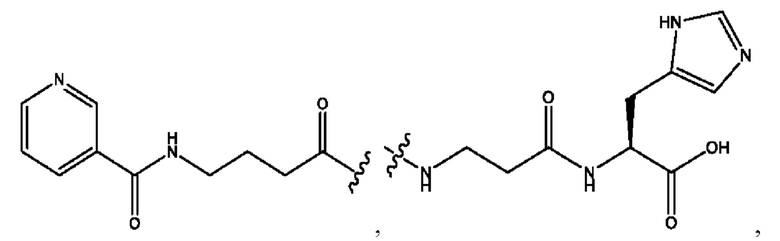
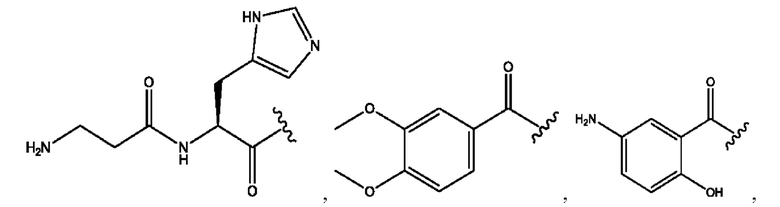
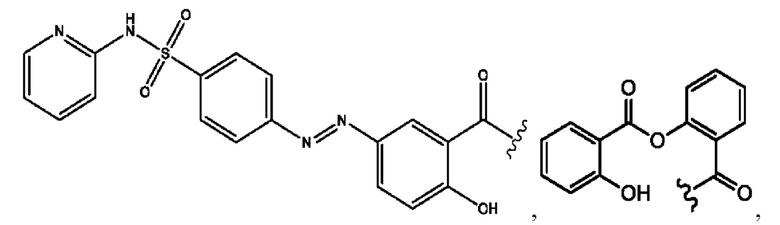
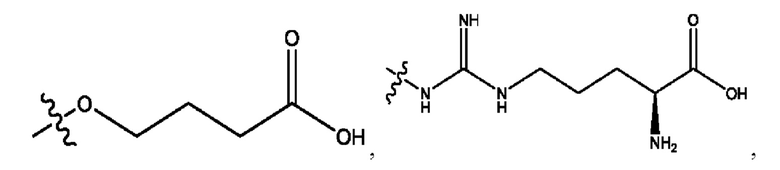
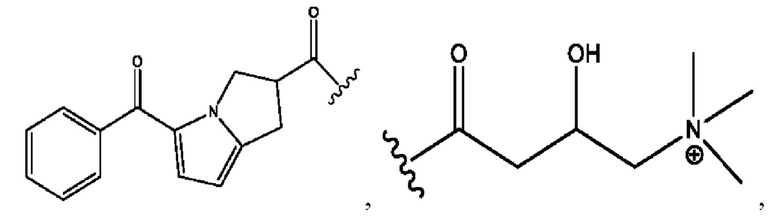
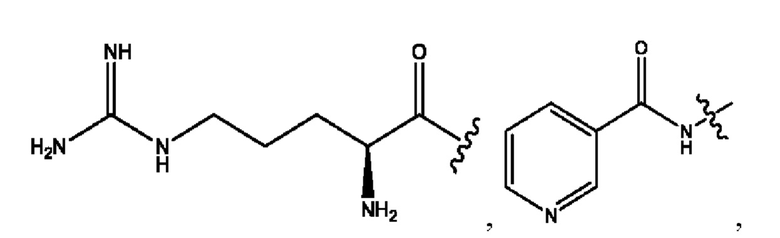
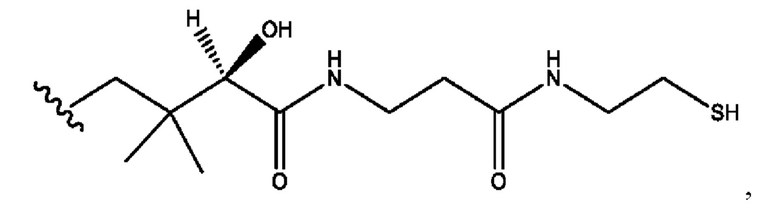
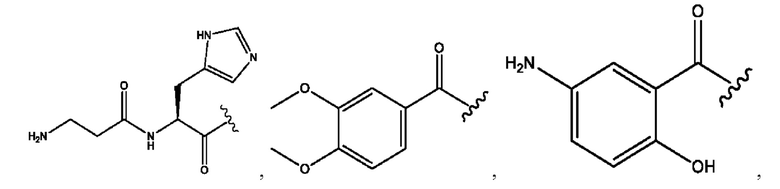
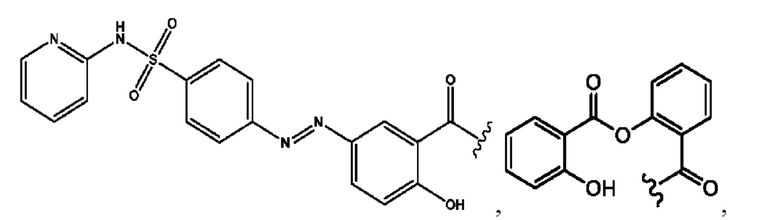
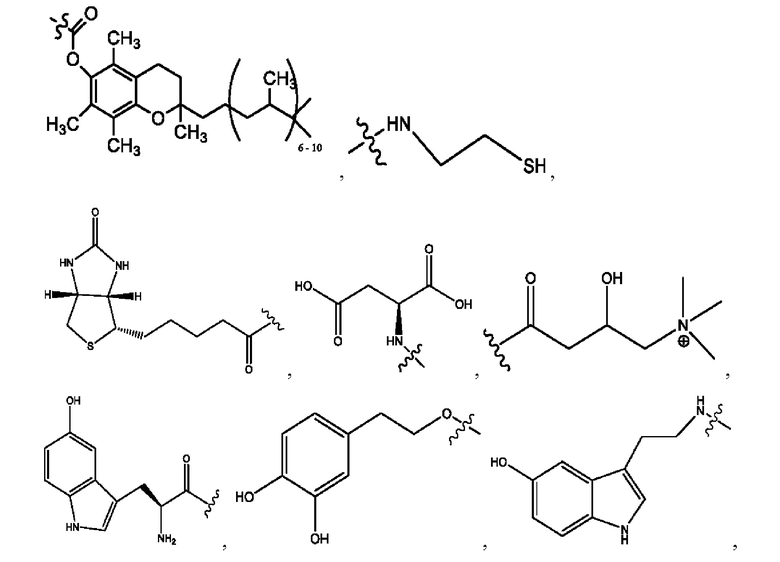
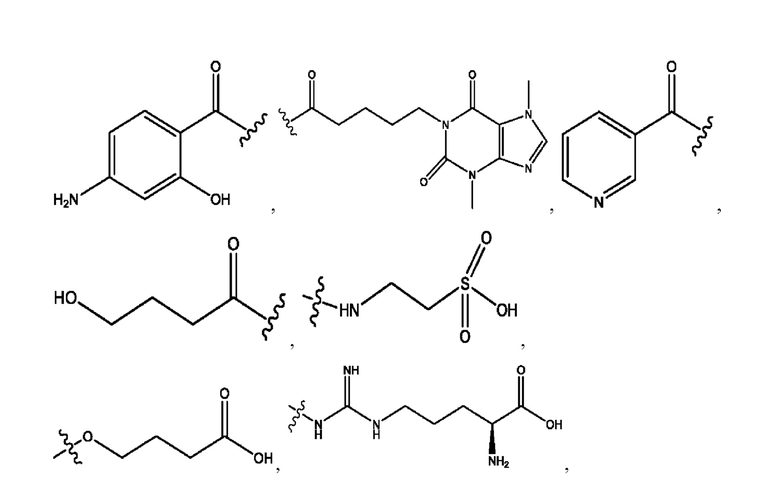
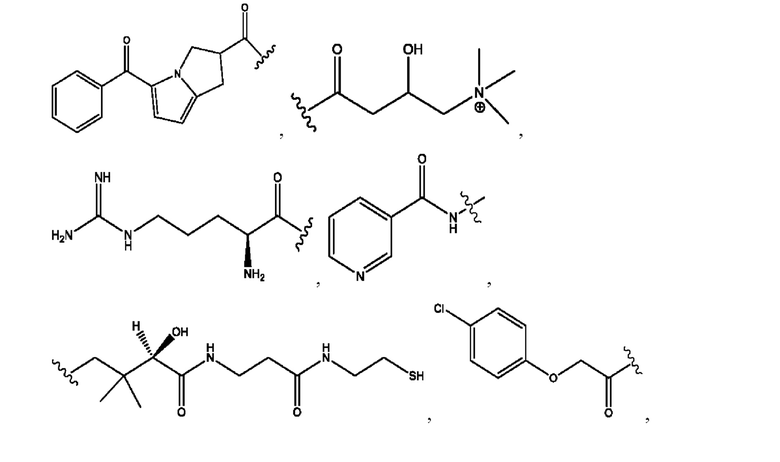
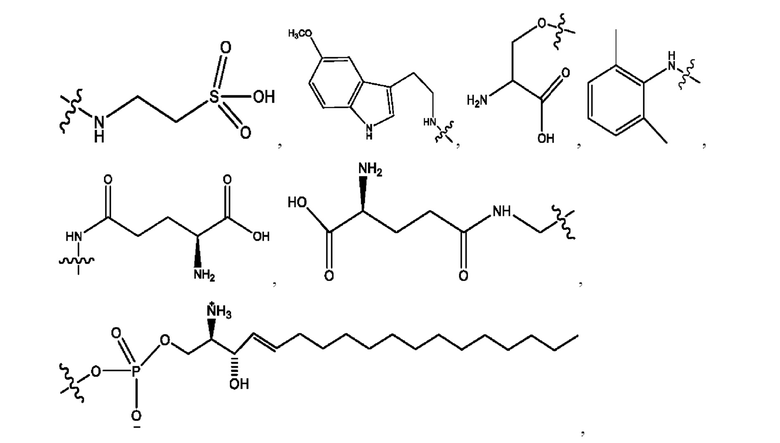
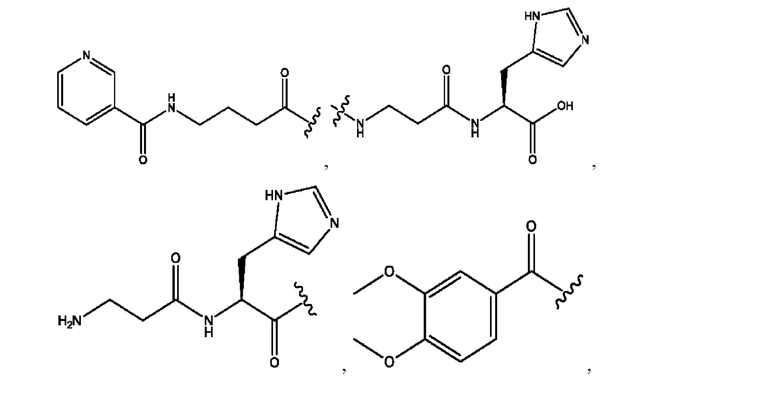
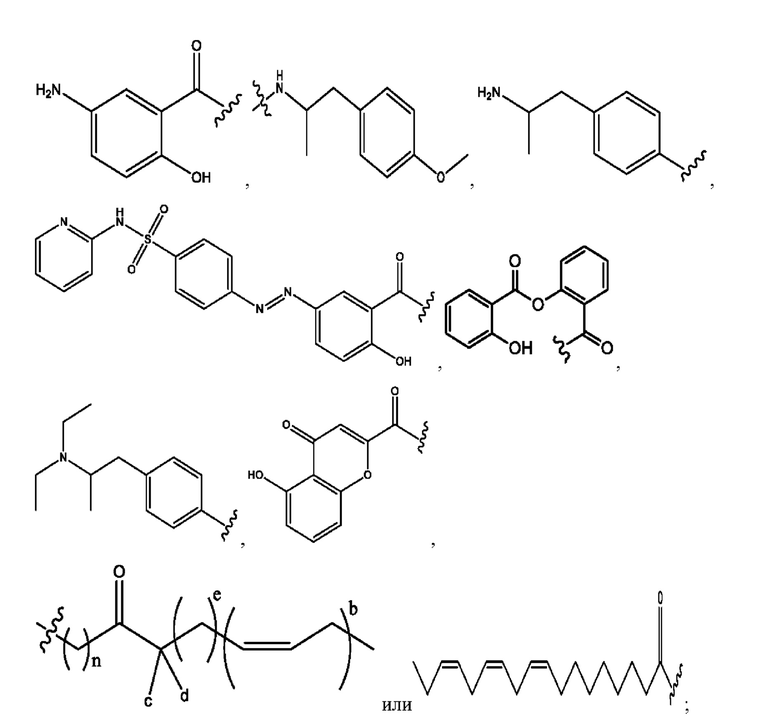
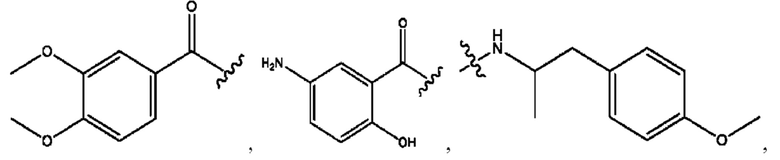
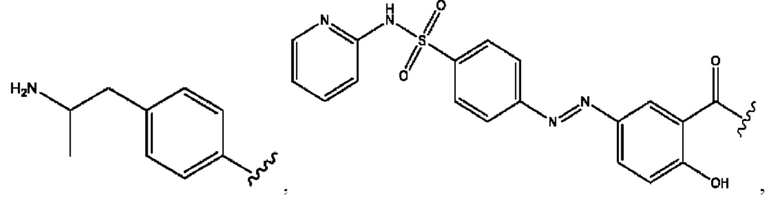
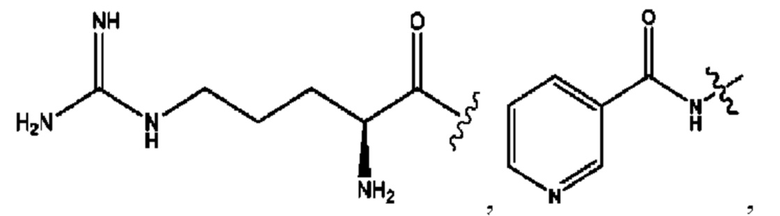
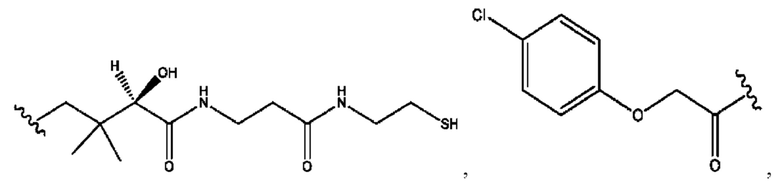
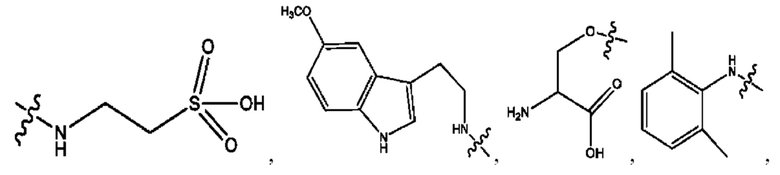
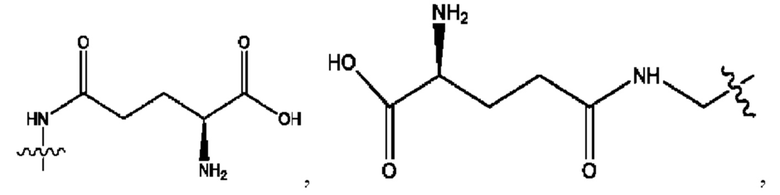
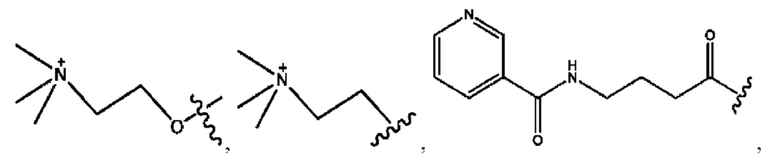
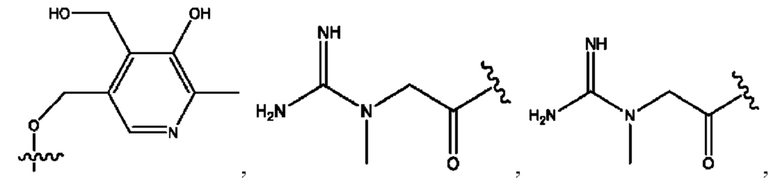
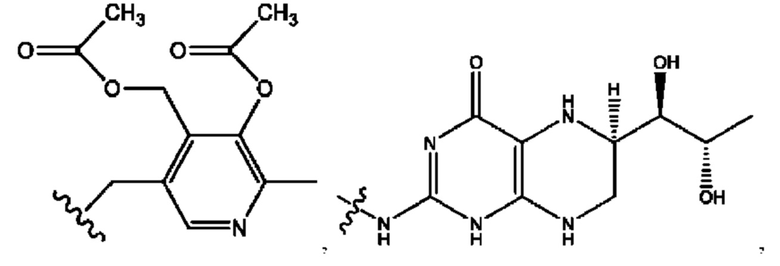
RH независимо представляет собой

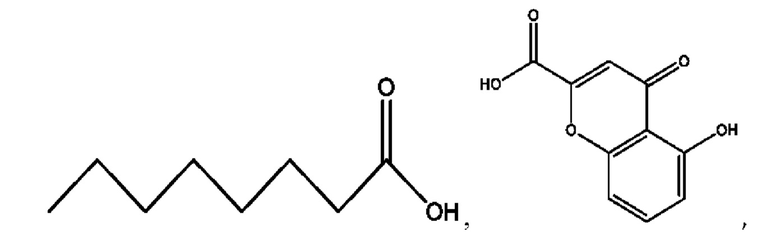
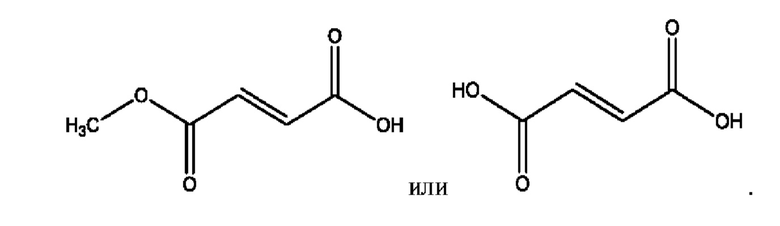
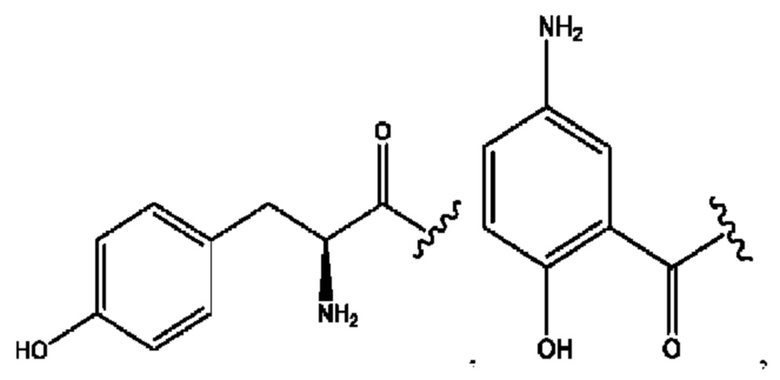
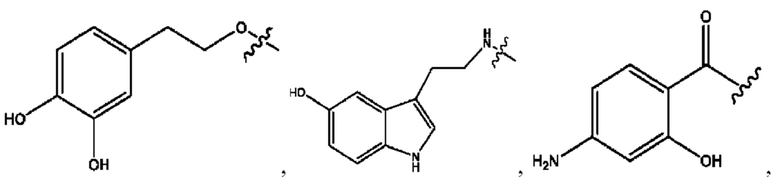
[0023] Композиции формулы VII обычно представляют собой соединения в форме солей конъюгата мезаламина и соединения, представленного группой (RH), в которых фрагмент производного мезаламина является протонированным, а кислотный остаток, представленный RH, находится по меньшей мере частично в ионной форме. В некоторых случаях, однако, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата мезаламина и кислотных компонентов. В изобретении также предложены фармацевтические композиции, содержащие композиции формулы VII и фармацевтически приемлемые вспомогательные вещества.
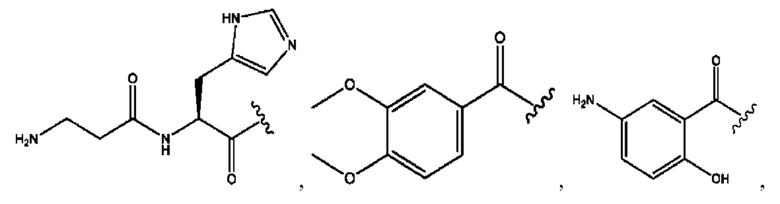
[0024] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы VIII, или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
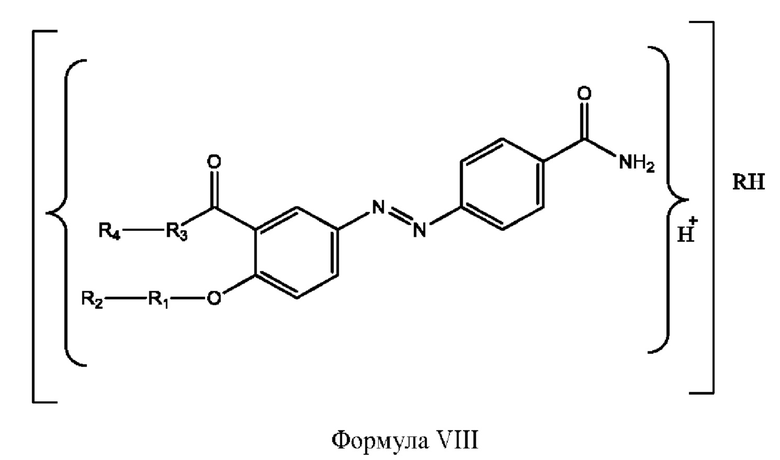
с по меньшей мере одним соединением, представленным группой RH, или их смесям
[0025] Где.
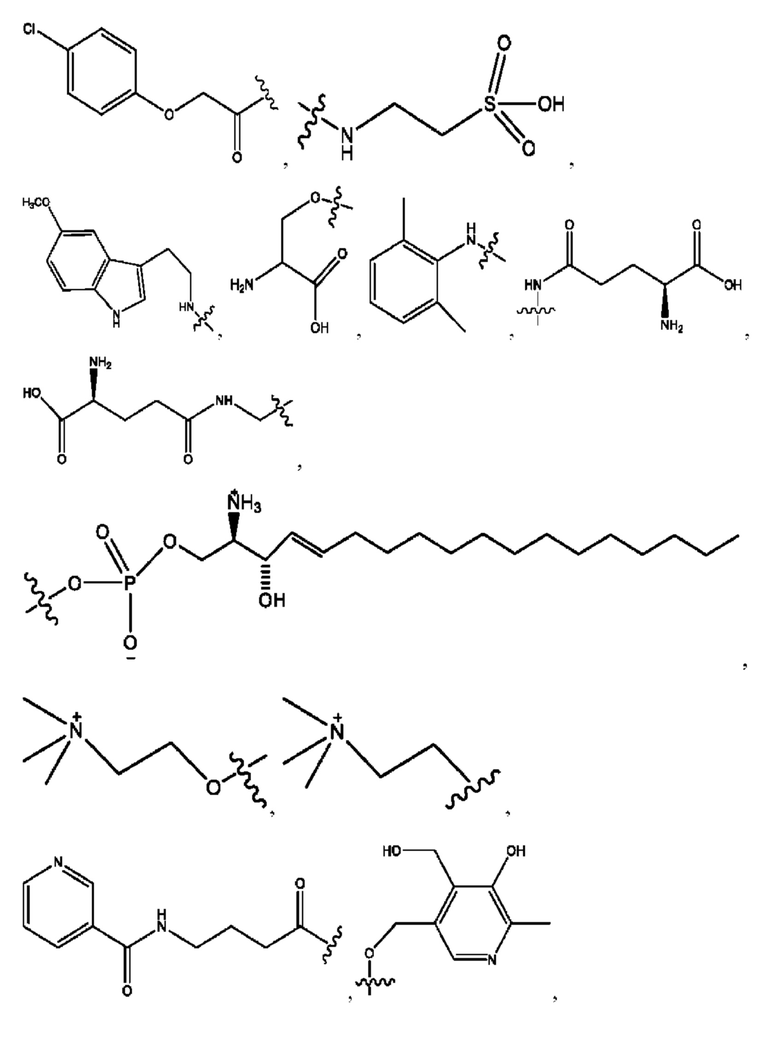
каждый R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
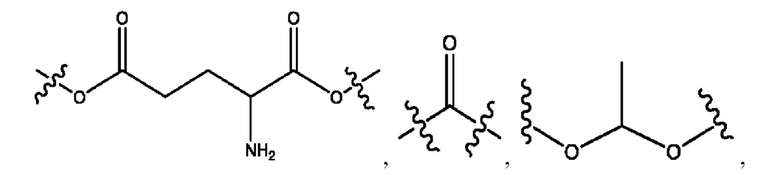
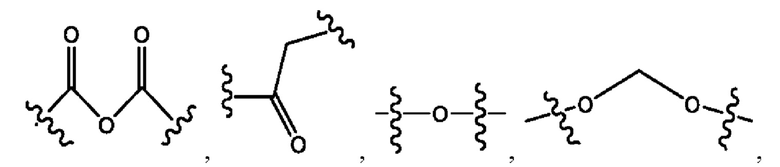
каждый R2, R4 независимо представляет собой D, OD,
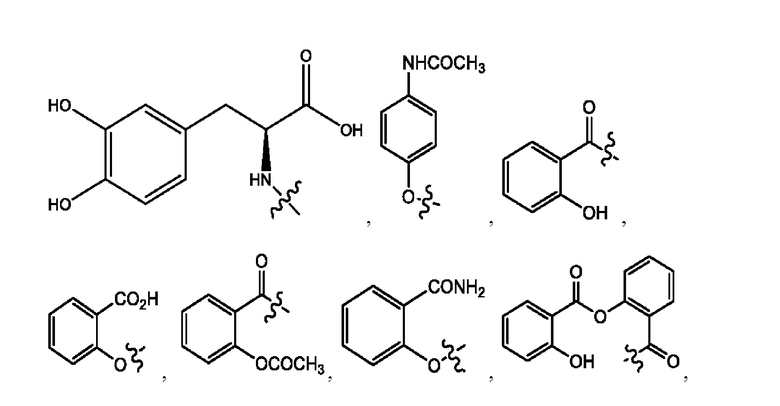
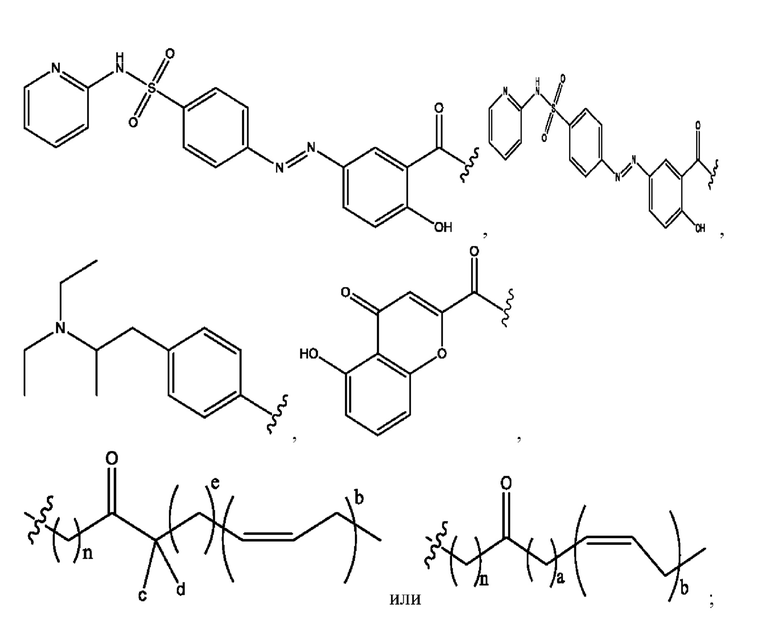
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляют собой Н, D, -ОН, -OD, C1-Сб-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
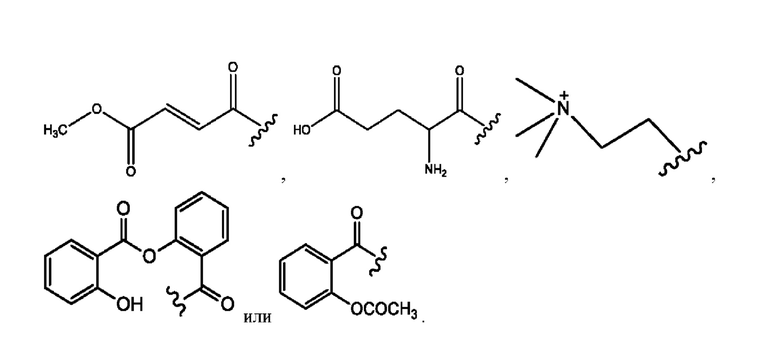
RH независимо представляет собой
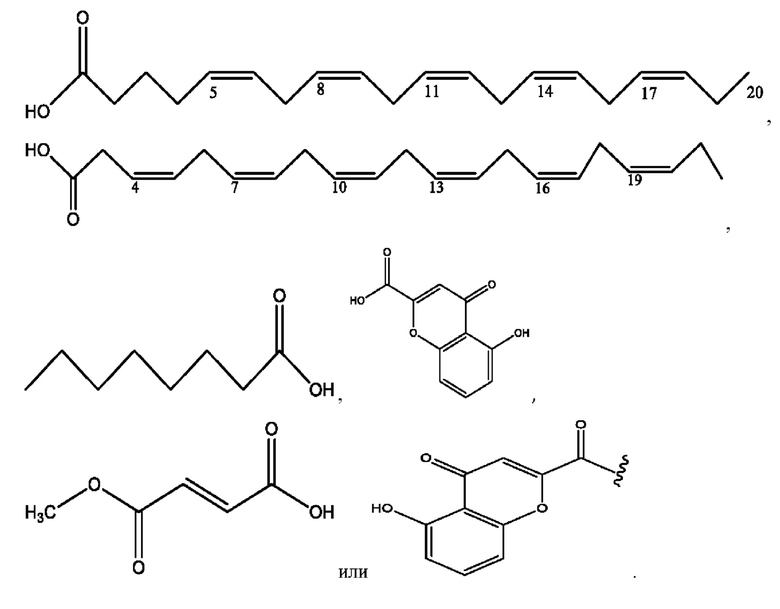
[0026] Соединения формулы VIII обычно представляют собой соединения в форме солей конъюгата балсалазида и соединения, представленного (RH), в которых фрагмент производного балсалазида является протонированным, а кислотный остаток, представленный RH, находится по меньшей мере частично в ионной форме. В некоторых случаях, однако, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата балсалазида и кислотных компонентов. В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы VIII и фармацевтически приемлемые вспомогательные вещества.
[0027] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы IX или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
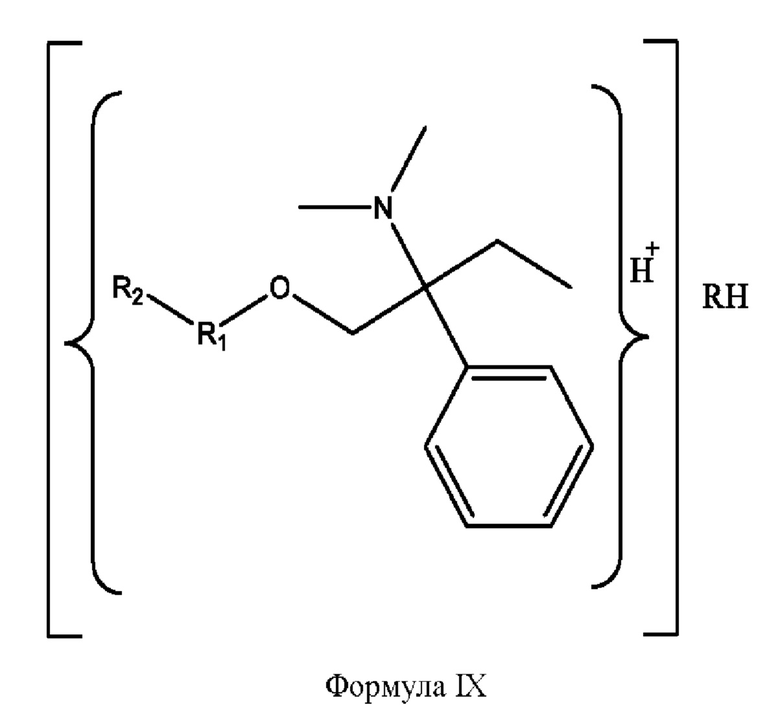
с по меньшей мере одним соединением, представленным группой RH, или их смесям
[0028] Где,
R1 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
R2 независимо представляет собой D, OD,

n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2 ,3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
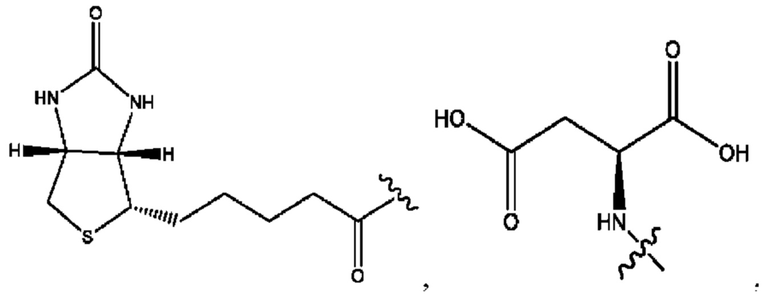
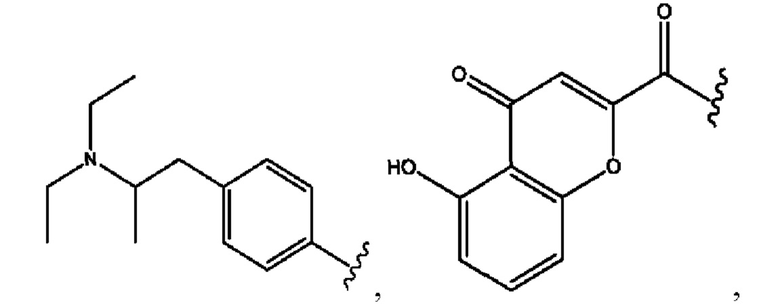
RH независимо представляет собой
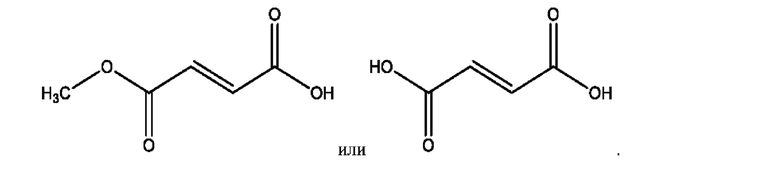
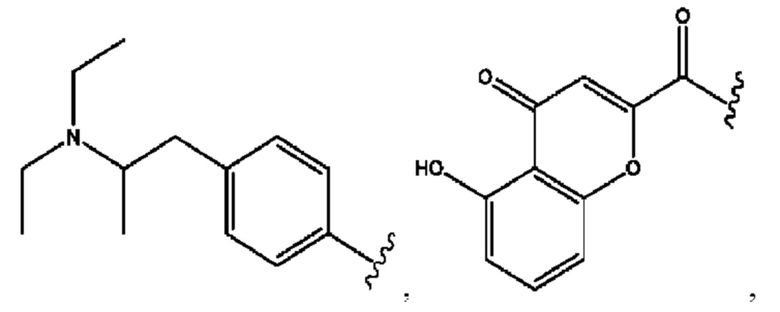
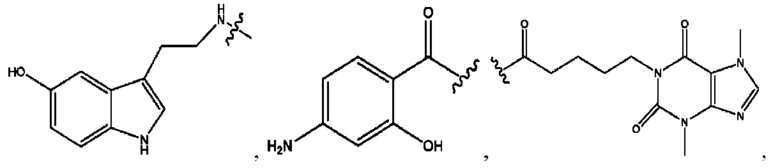
[0029] Композиции формулы IX обычно представляют собой соединения в форме солей конъюгата 2-(диметиламино)-2-фенилбутан-1-ола и соединения, представленного (RH), в которых фрагмент производного 2-(диметиламино)-2-фенилбутан-1-ола является протонированным, а кислотный остаток, представленный RH, находится по меньшей мере частично в ионной форме. Однако, в некоторых случаях, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата 2-(диметиламино)-2-фенилбутан-1-ола и кислотных компонентов. В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы IX и фармацевтически приемлемые вспомогательные вещества.
[0030] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы X или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
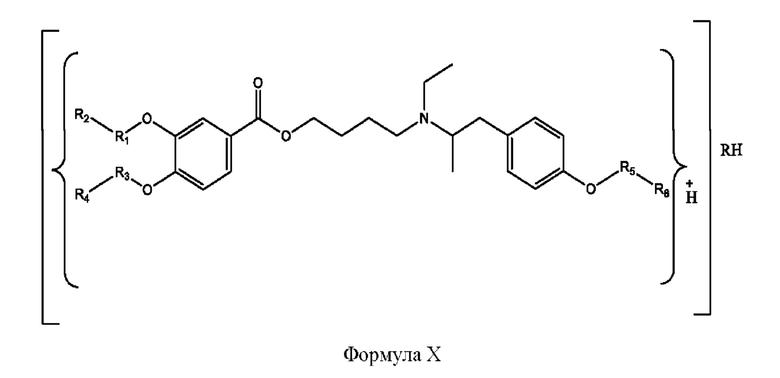
с по меньшей мере одним соединением, представленным группой RH, или их смесям
[0031] Где,
R1, R3, R5 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
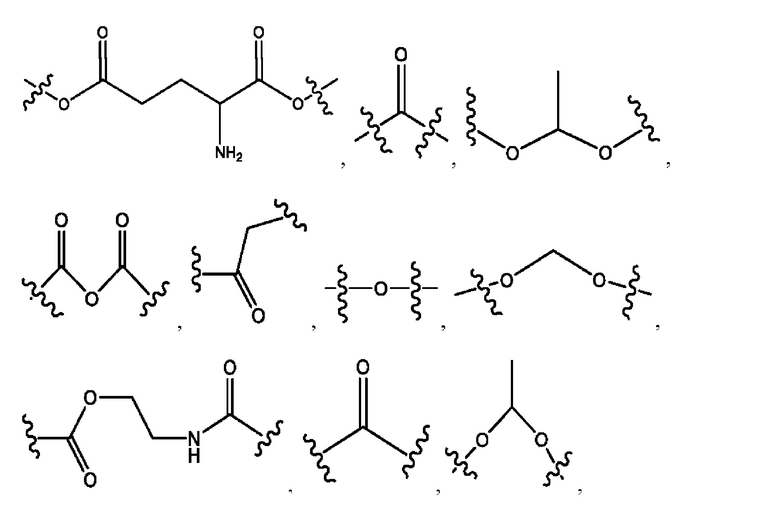
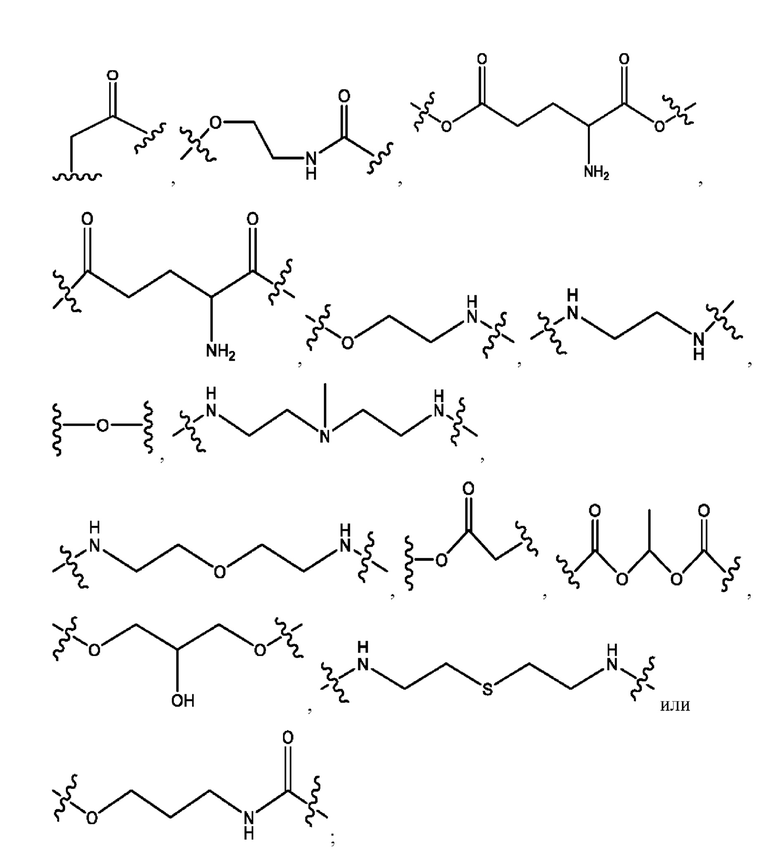
каждый R2, R4 независимо представляет собой D, OD,
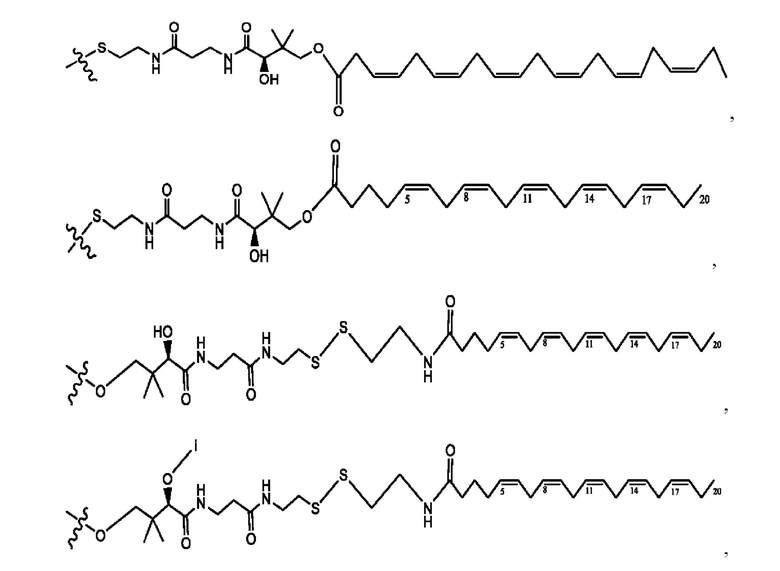
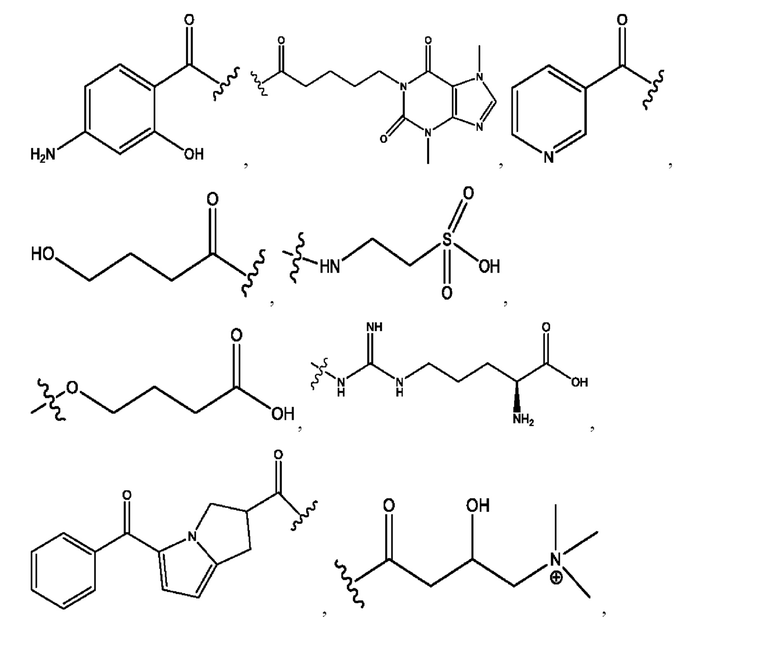
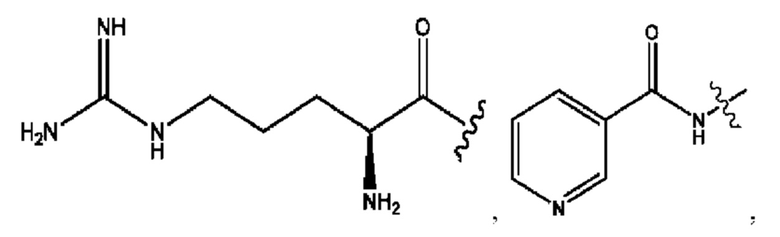
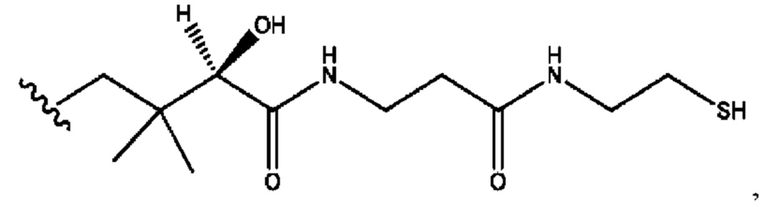
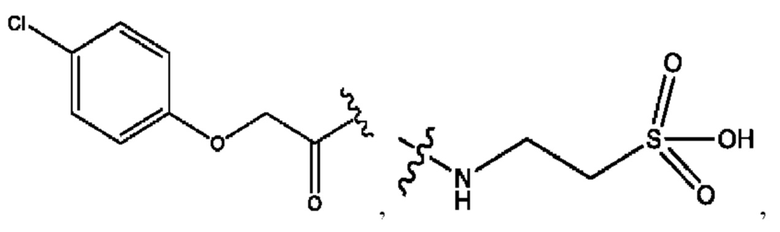
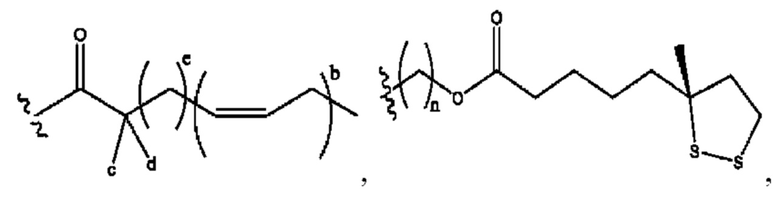
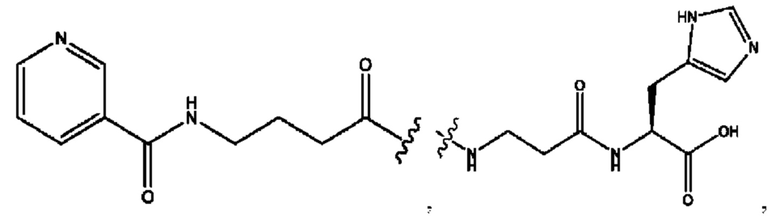
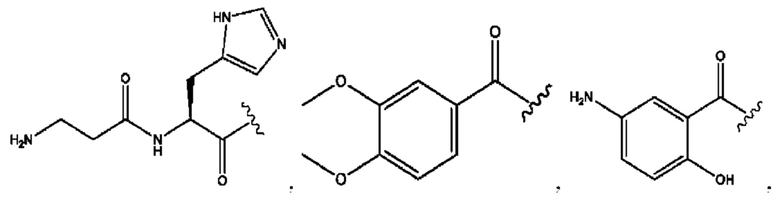
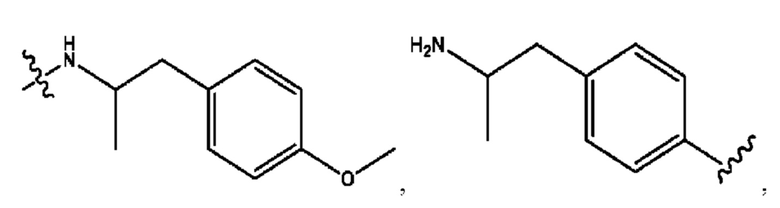
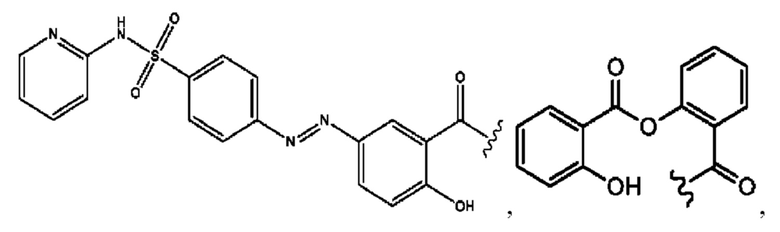
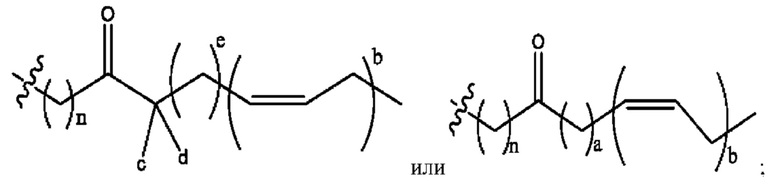
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый с и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия

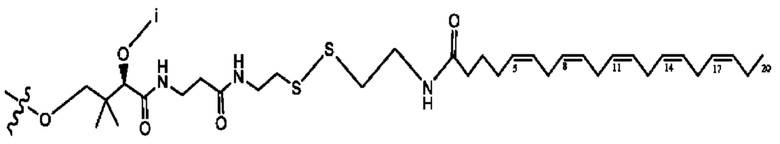
каждый i независимо представляет собой
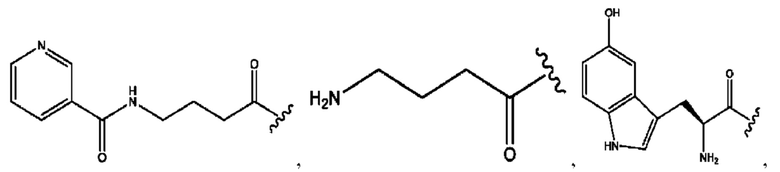
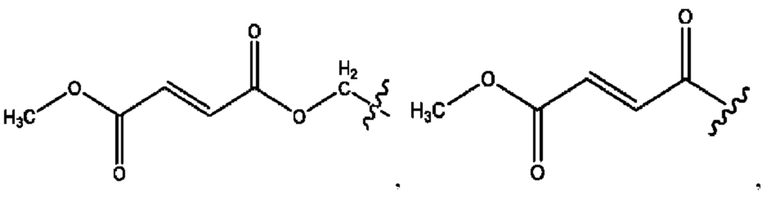
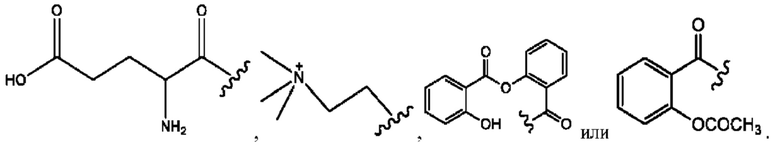
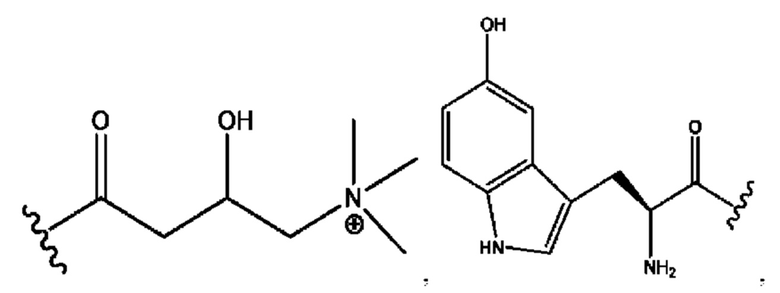
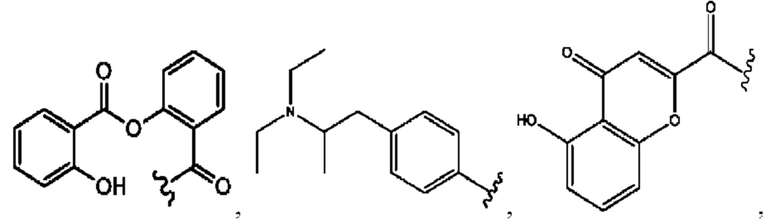
RH независимо представляет собой
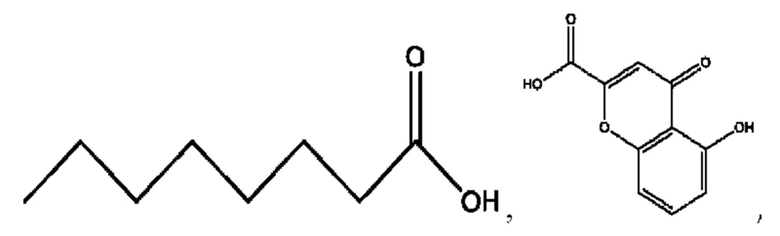
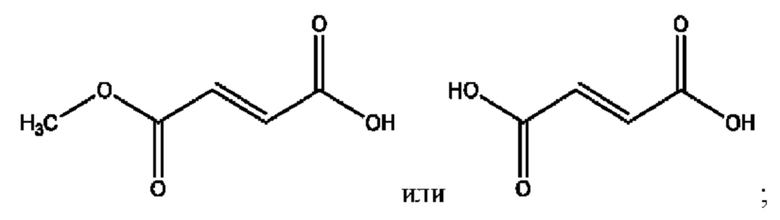
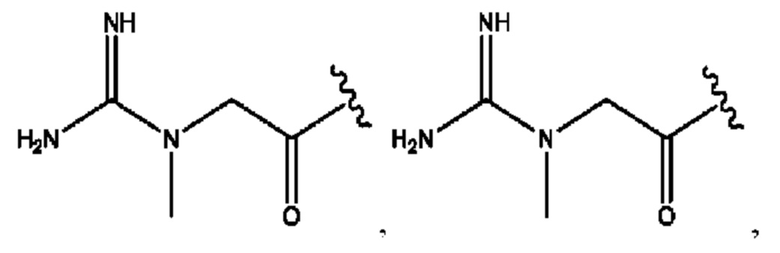
R6 независимо представляет собой D, OD, ОН, Н, CD3 или СОСН3.
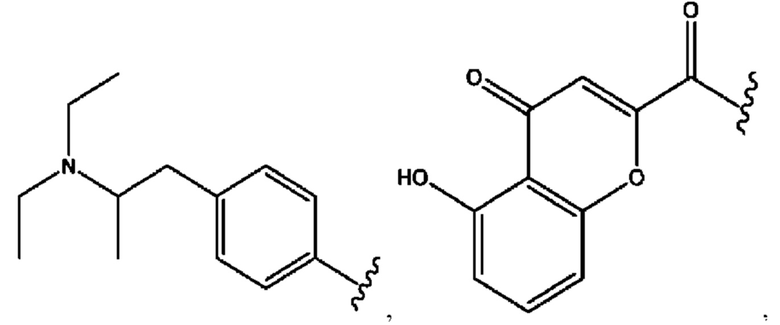
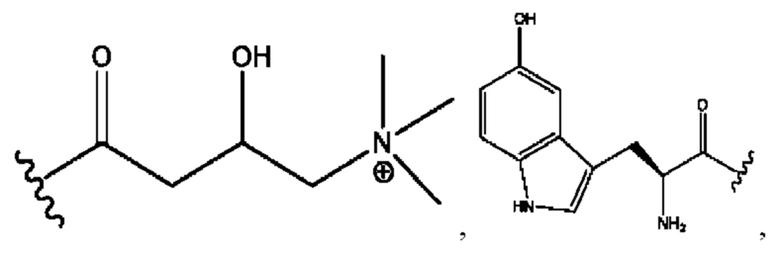
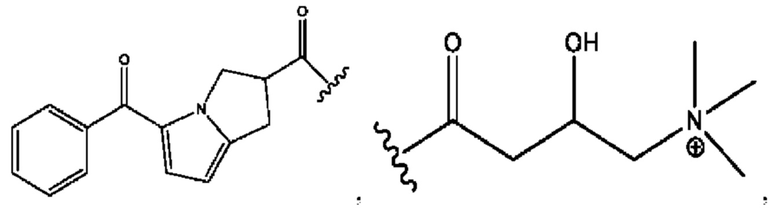
[0032] Композиции формулы X обычно представляют собой соединения в форме солей конъюгата мебеверина и соединения, представленного (RH), в которых фрагмент производного мебеверина является протонированным, а кислотный остаток, представленный RH, находится по меньшей мере частично в ионной форме. В некоторых случаях, однако, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата мебеверина и кислотных компонентов. В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы X и фармацевтически приемлемые вспомогательные вещества.
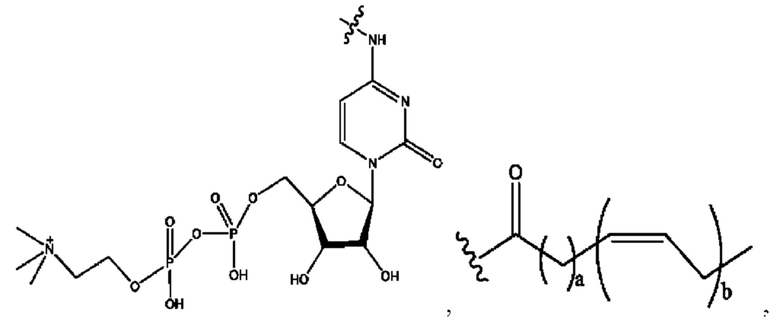
[0033] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы XI или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
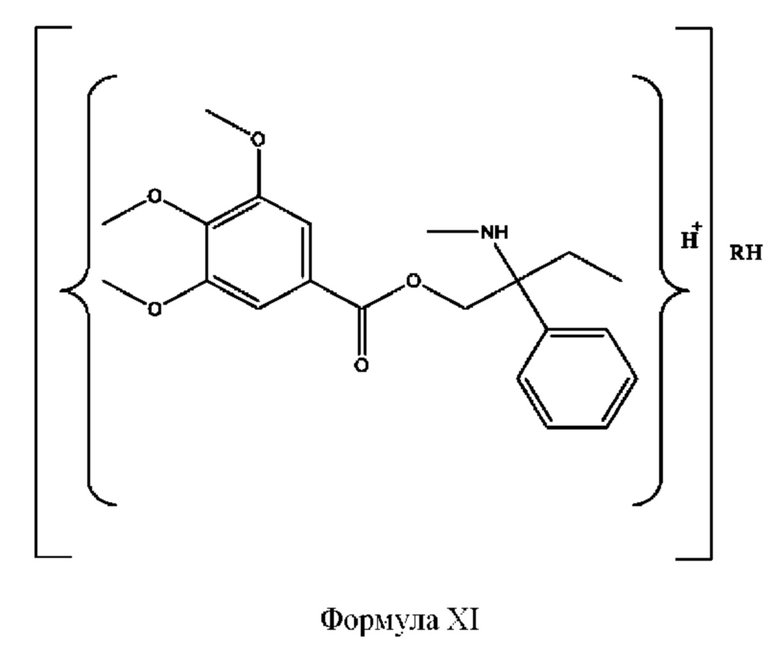
с по меньшей мере одним соединением, представленным группой RH, или их смесям.
[0034] Где,
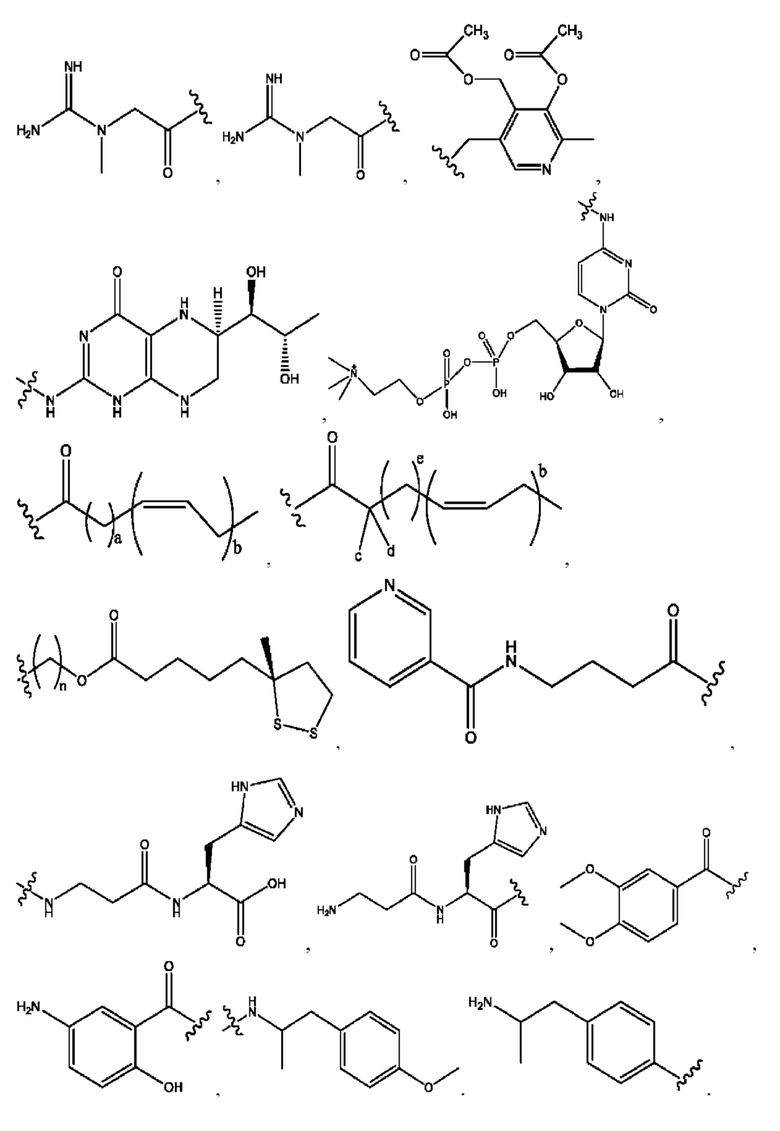
RH независимо представляет собой
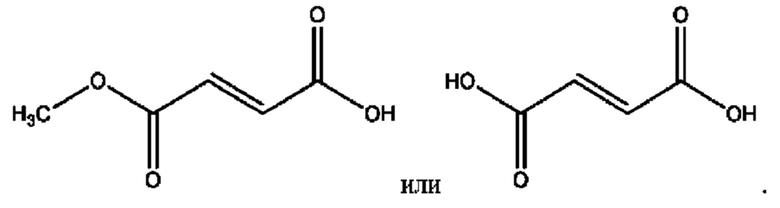
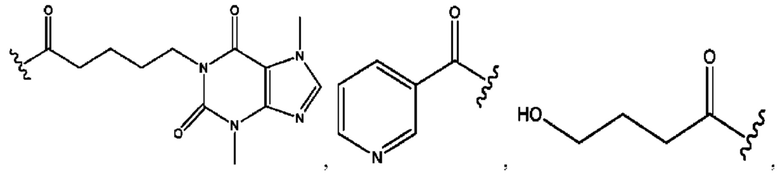
[0035] Композиции формулы XI обычно представляют собой соединения в форме солей конъюгата нортримебутина и соединения, представленного (RH), в которых фрагмент производного нортримебутина является протонированным, а кислотный остаток, представленный RH, по меньшей мере частично находится в ионной форме. Однако, в некоторых случаях, например, в зависимости от рН среды, композиция может находиться в форме смеси конъюгата нортримебутина и кислотных компонентов. В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы XI и фармацевтически приемлемые вспомогательные вещества.
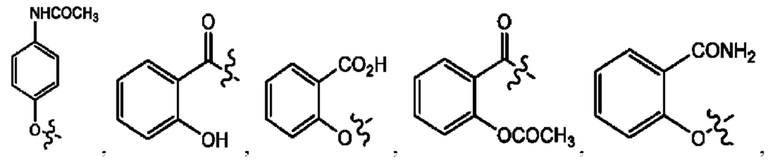
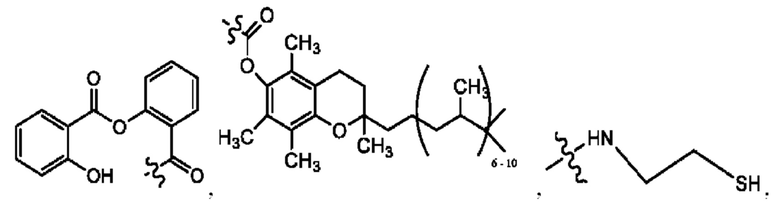
[0036] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы XII или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
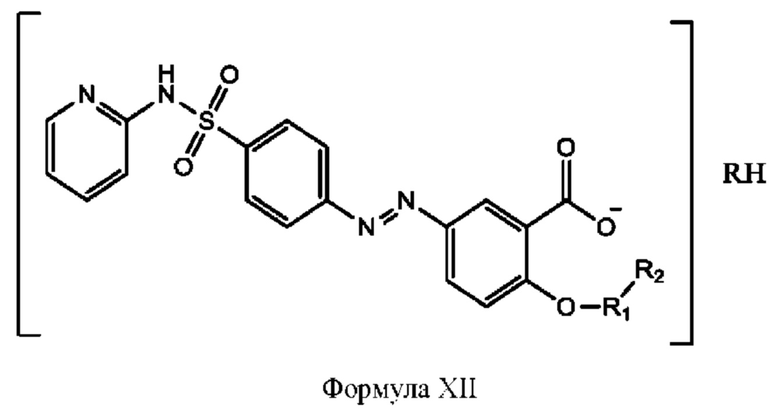
с по меньшей мере одним соединением, представленным группой RH, или их смесям
[0037] Где,
R1 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
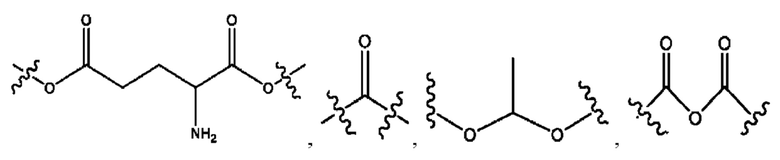
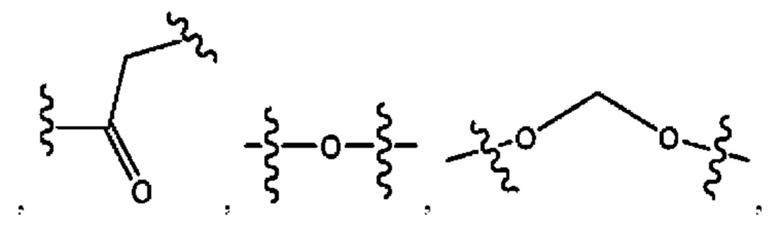
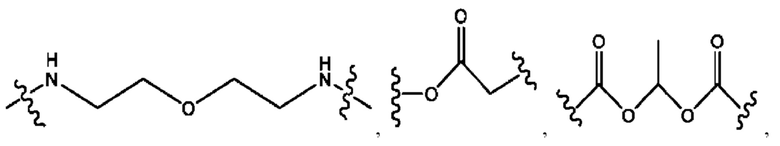
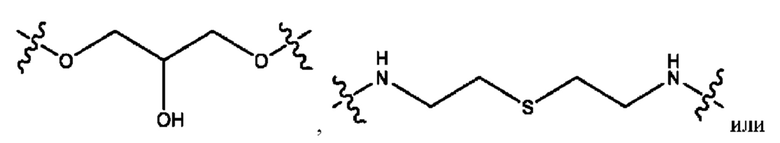
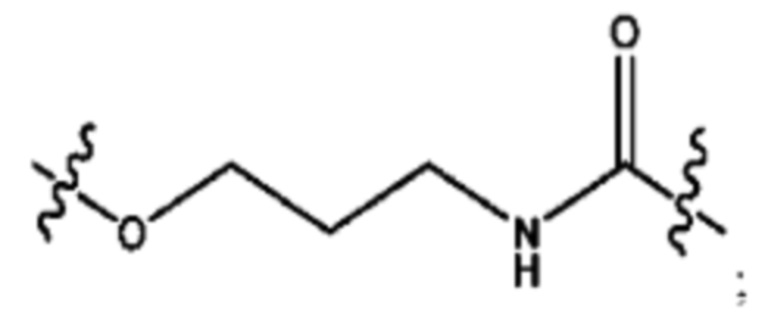
R2 независимо представляет собой D, OD,
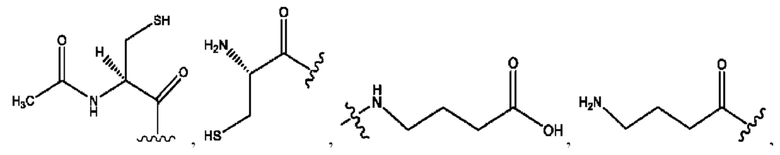
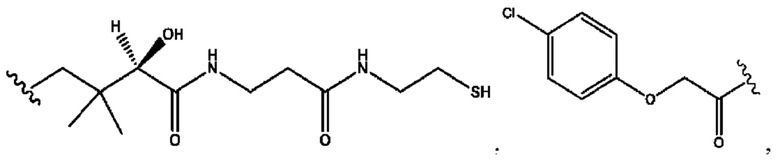
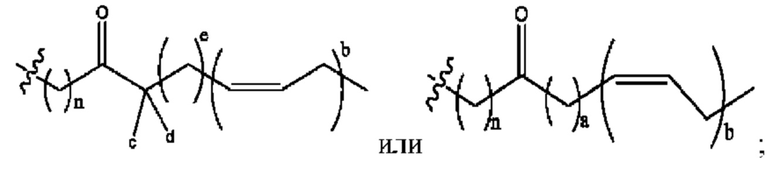
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
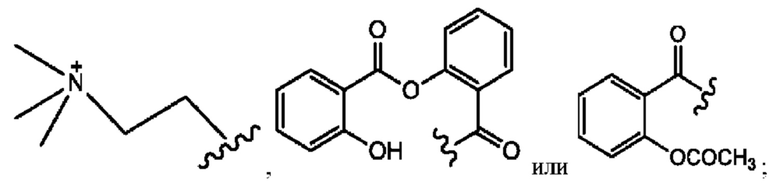
RH независимо представляет собой
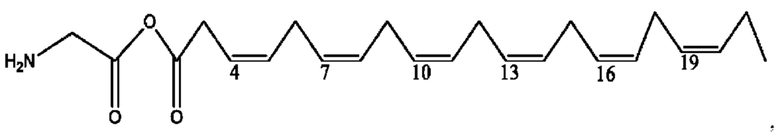
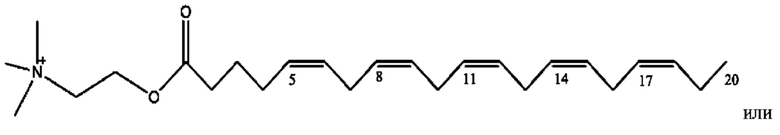
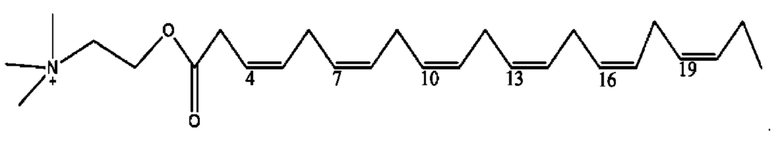
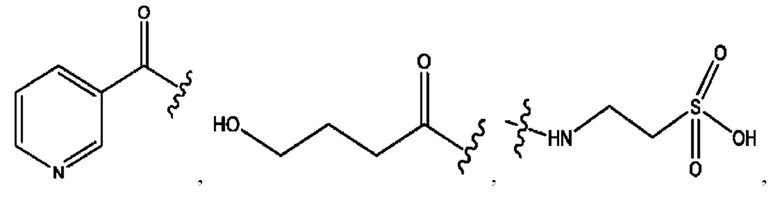
[0038] Композиции формулы XII обычно представляют собой соединения в форме солей конъюгата сульфасалазина и соединения, представленного (RH), в которых фрагмент производного сульфасалазина находится частично в ионной форме, а основный фрагмент, представленный RH, находится по меньшей мере в протонированный форме. Однако, в некоторых случаях, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата сульфасалазина и основных компонентов. В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы XII и фармацевтически приемлемые вспомогательные вещества.
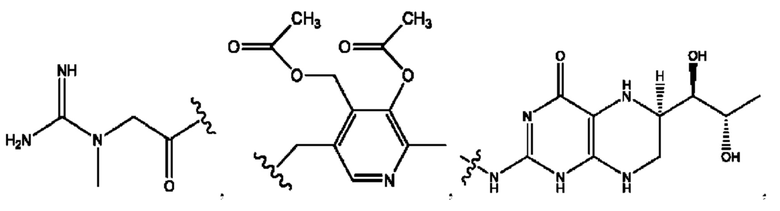
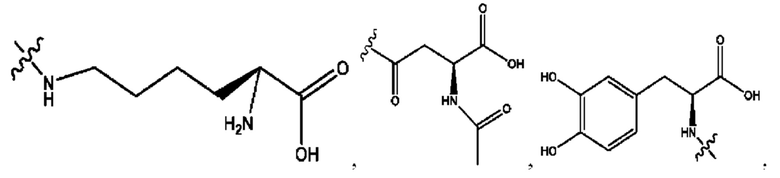
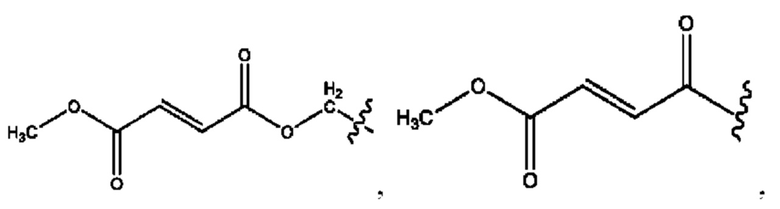
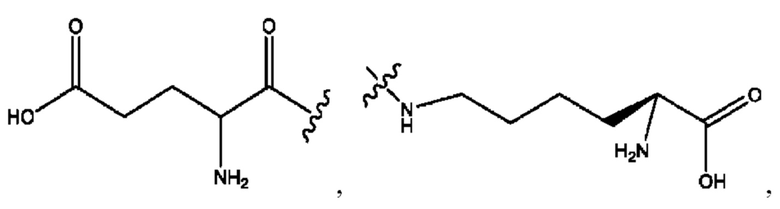
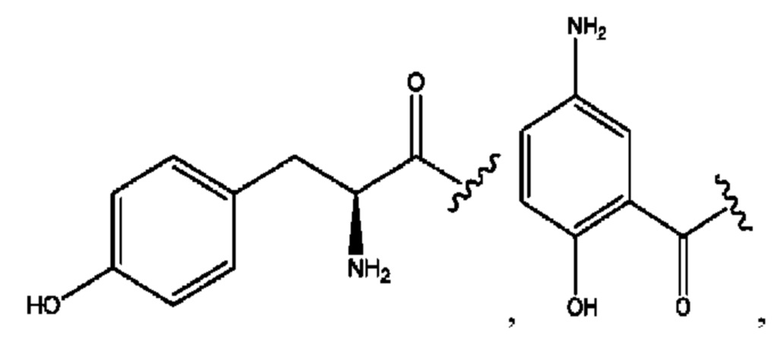
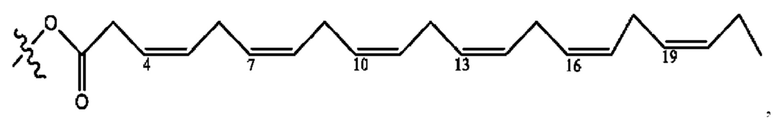
[0039] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы XIII, или их фармацевтически приемлемым сольватам, гидратам или полиморфам,
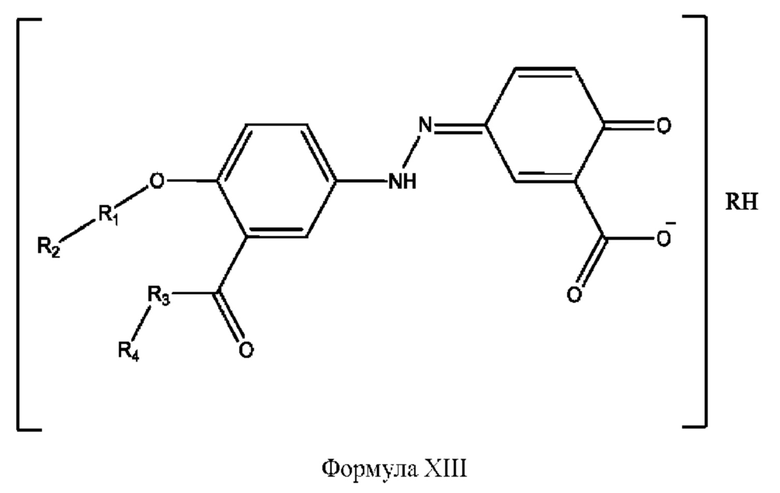
с по меньшей мере одним соединением, представленным группой RH, или их смесям,
[0040] Где,
R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
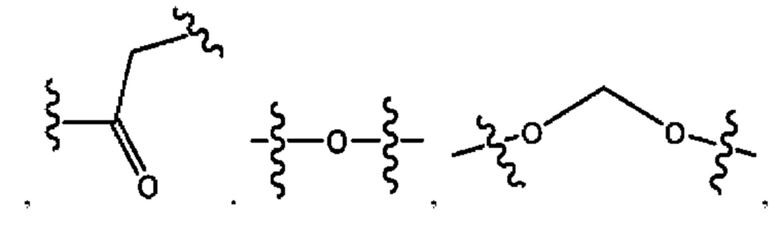
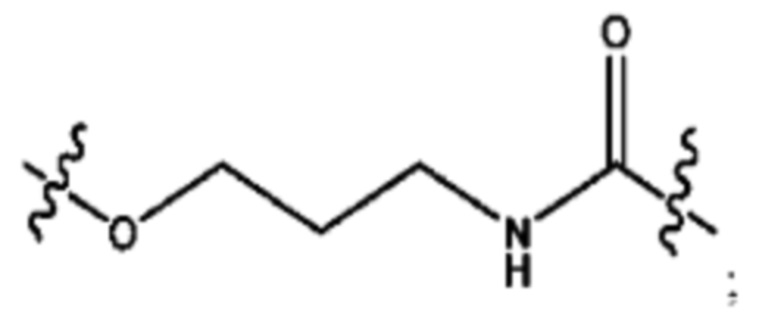
каждый R2, R4 независимо представляет собой D, OD,
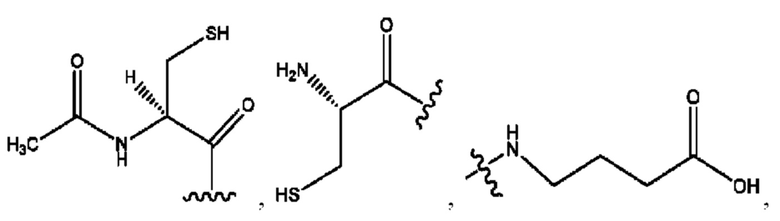
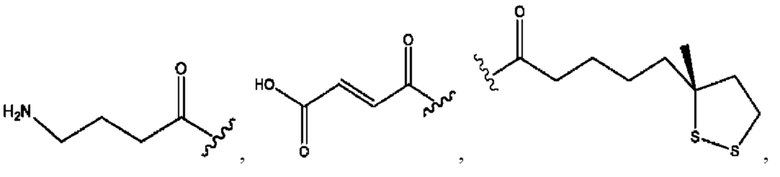
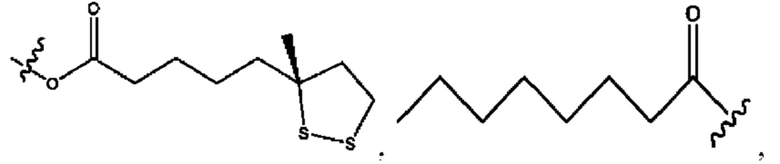


n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
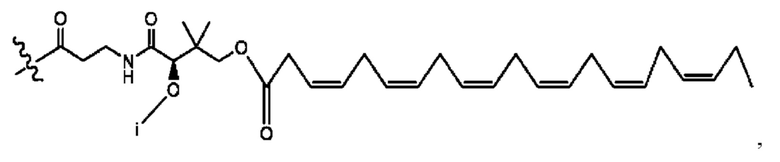
каждый i независимо представляет собой
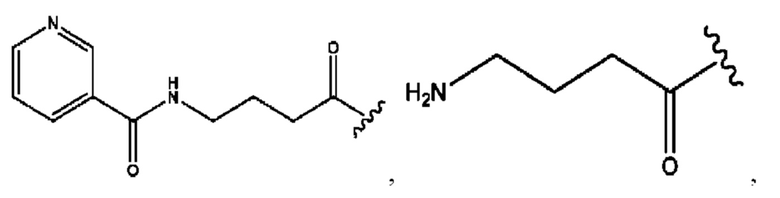
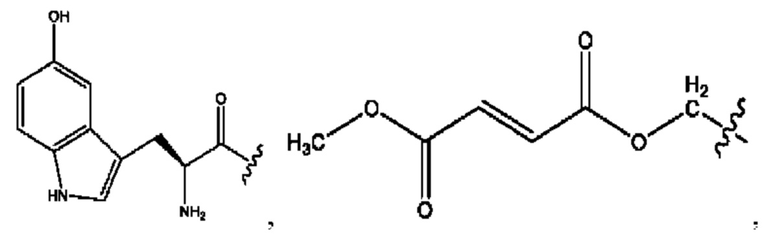
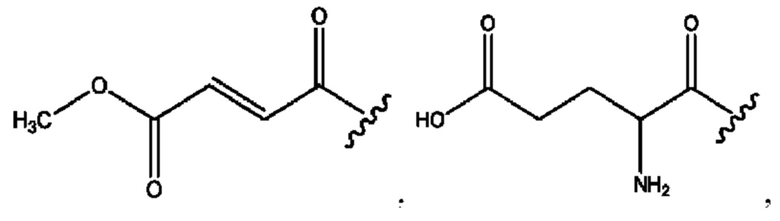
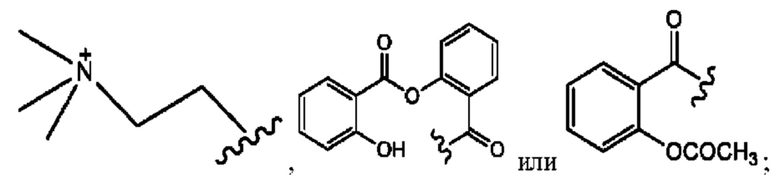
RH независимо представляет собой
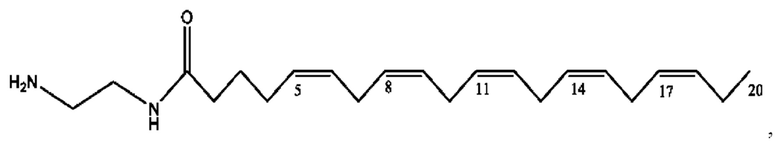
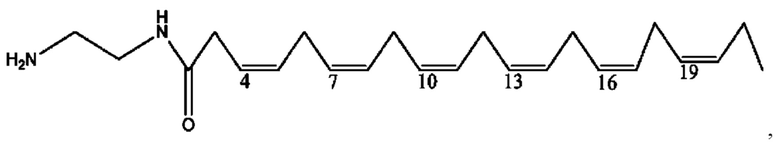
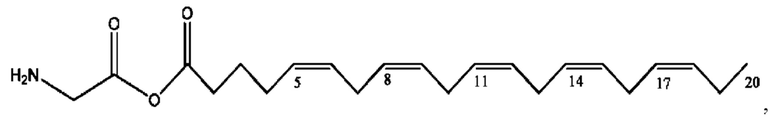
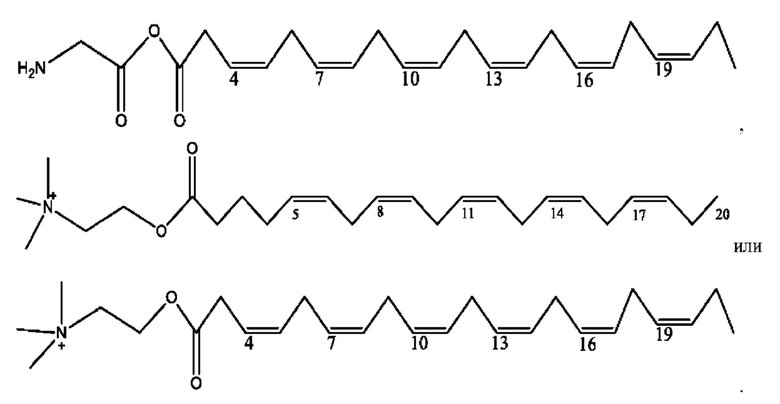
[0041] Композиции формулы XIII обычно представляют собой соединения в форме солей конъюгата олсалазина и соединения, представленного (RH), в которых фрагмент производного олсалазина находится в частично ионизированной форме, а основный остаток, представленный RH, находится по меньшей мере в протонированной форме. Однако, в некоторых случаях, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата олсалазина и основных компонентов (RH). В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы XIII и фармацевтически приемлемые вспомогательные вещества.
[0042] Согласно определенным вариантам реализации настоящее изобретение относится к соединениям и композициям формулы XIV или их фармацевтически приемлемым сольватам, гидратам и полиморфам,
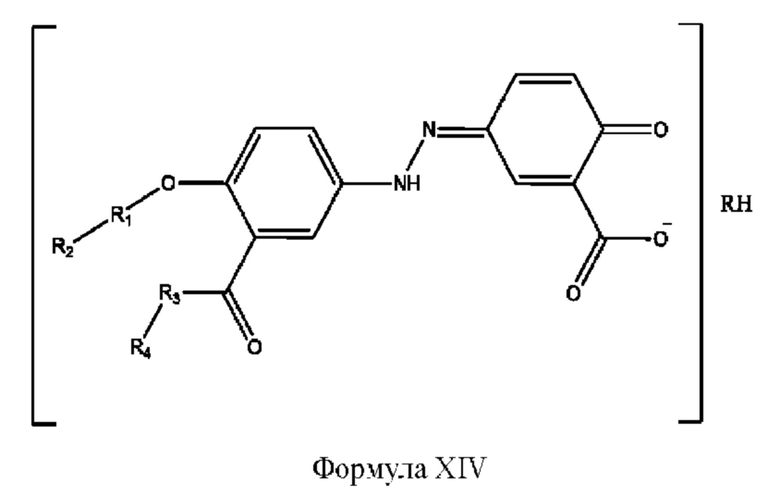
с по меньшей мере одним соединением, представленным группой RH, или их смесям, [0043] Где,
R1, R3 независимо представляет собой Н, D, CH3CO-, СН3, CD3CO-, отсутствует, или представляет собой
каждый R2, R4 независимо представляет собой D, OD,

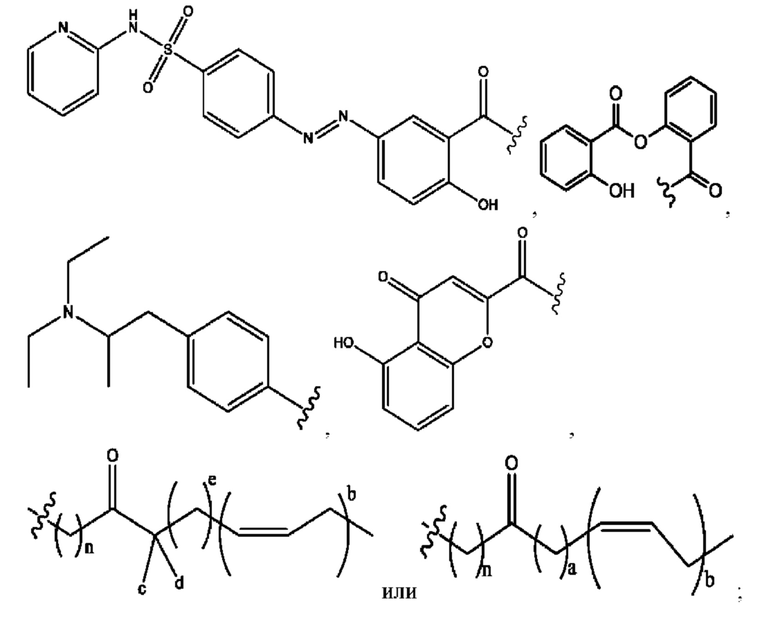
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2,3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
каждый i независимо представляет собой
RH независимо представляет собой
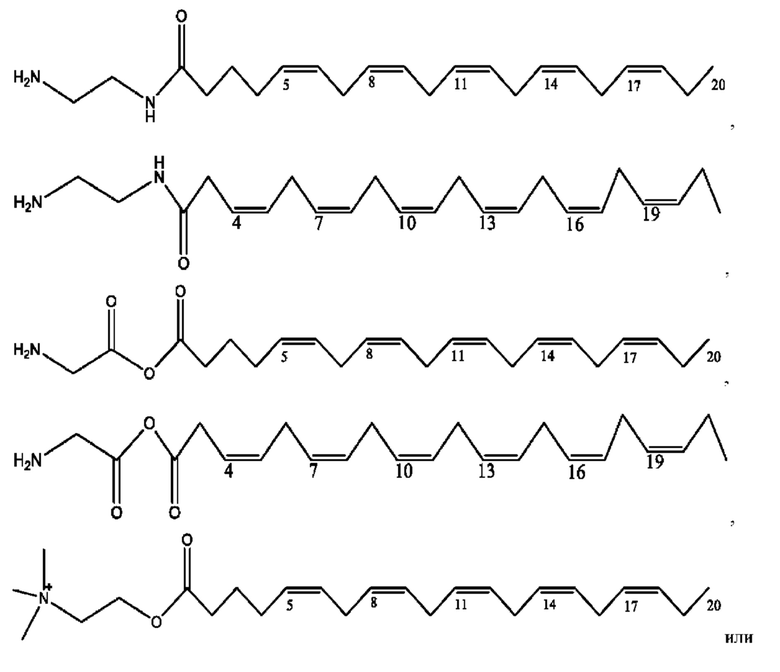
[0044] Композиции формулы XIV обычно представляют собой соединения в форме солей конъюгата балсалазида и соединения, представленного (RH), в которых фрагмент производного балсалазида находится в частично ионизированной форме, и основный остаток, представленный RH, находится по меньшей мере в протонированной форме. Однако, в некоторых случаях, например, в зависимости от рН среды, указанная композиция может находиться в форме смеси конъюгата балсалазида и основных компонентов (RH). В настоящем изобретении также предложены фармацевтические композиции, содержащие композиции формулы XIV и фармацевтически приемлемые вспомогательные вещества.
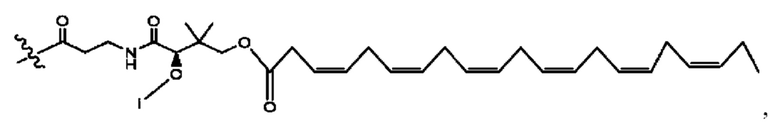
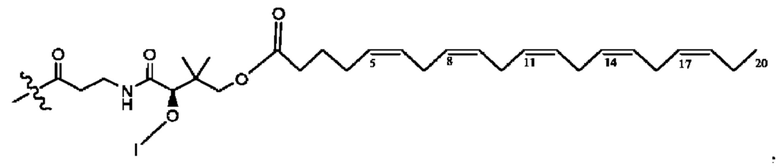
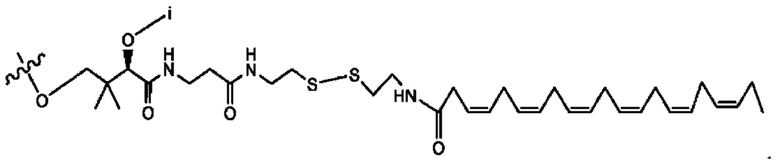
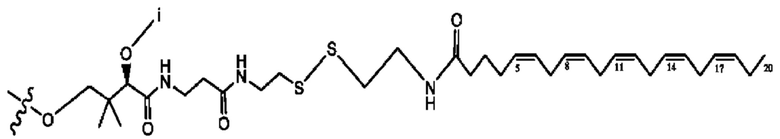
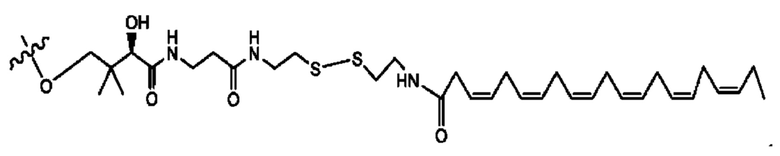
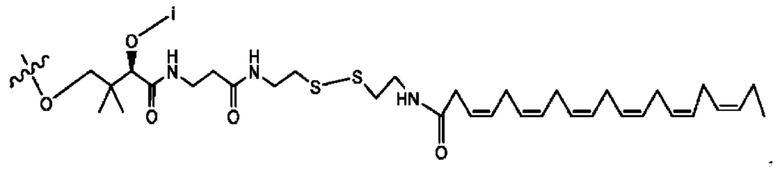
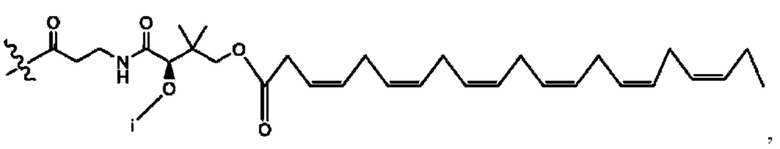
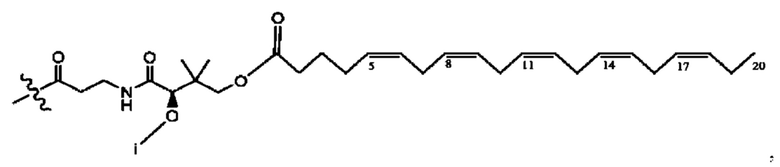
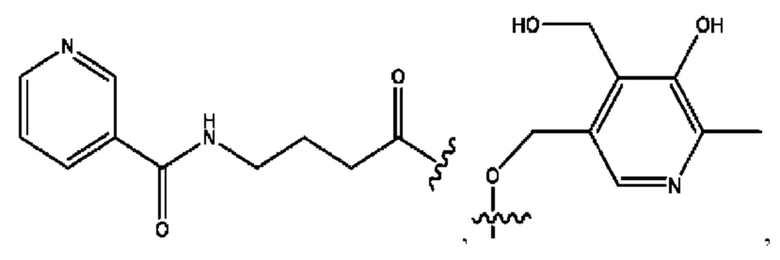
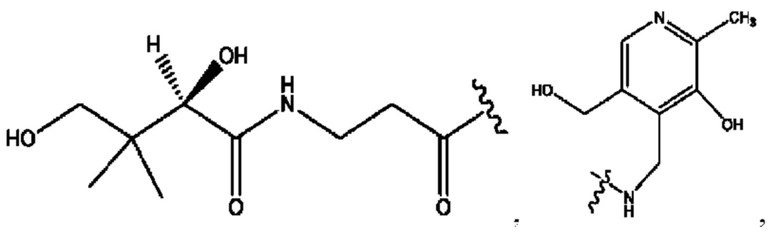
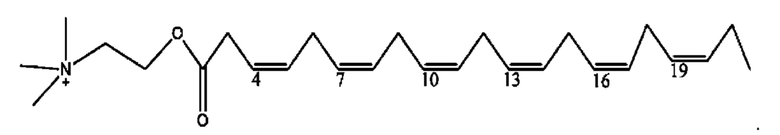
[0045] Согласно определенным вариантам реализации изобретения соединения формулы XV представлены как:
и их фармацевтически приемлемыми солями, гидратами, сольватами, пролекарствами, энантиомерами и стереоизомерами;
[0046] Где,
R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
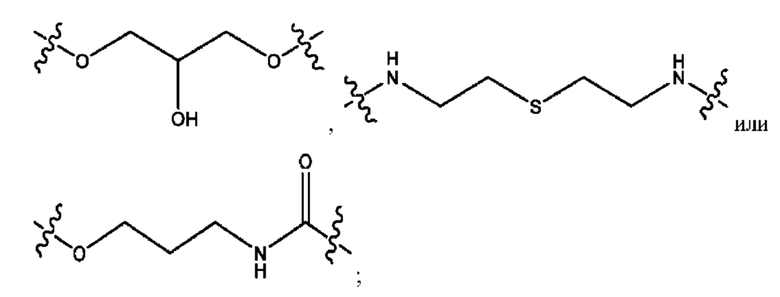
каждый R2, R4 независимо представляет собой D, OD,
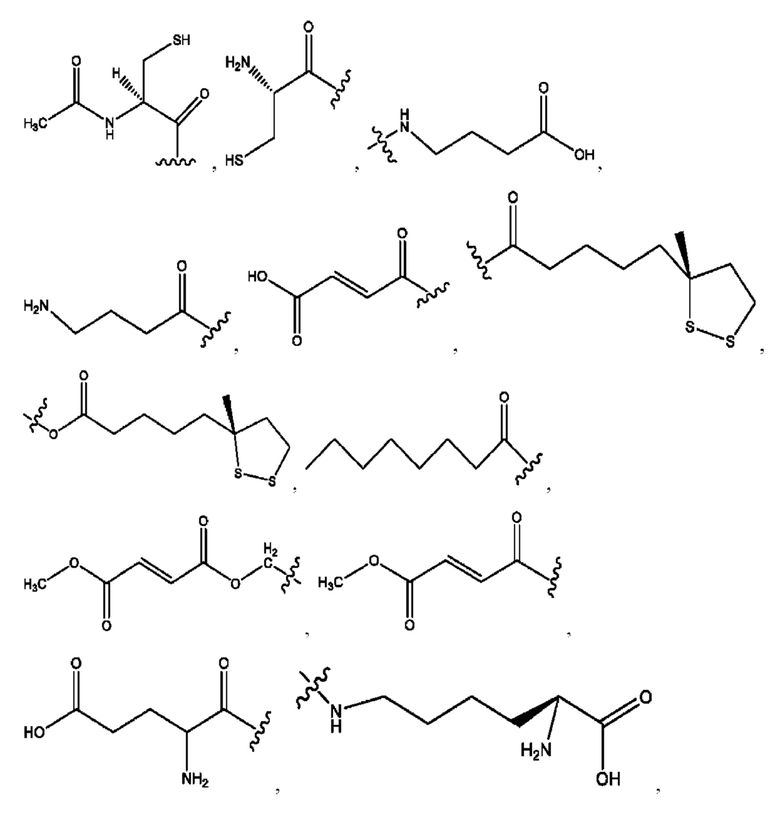
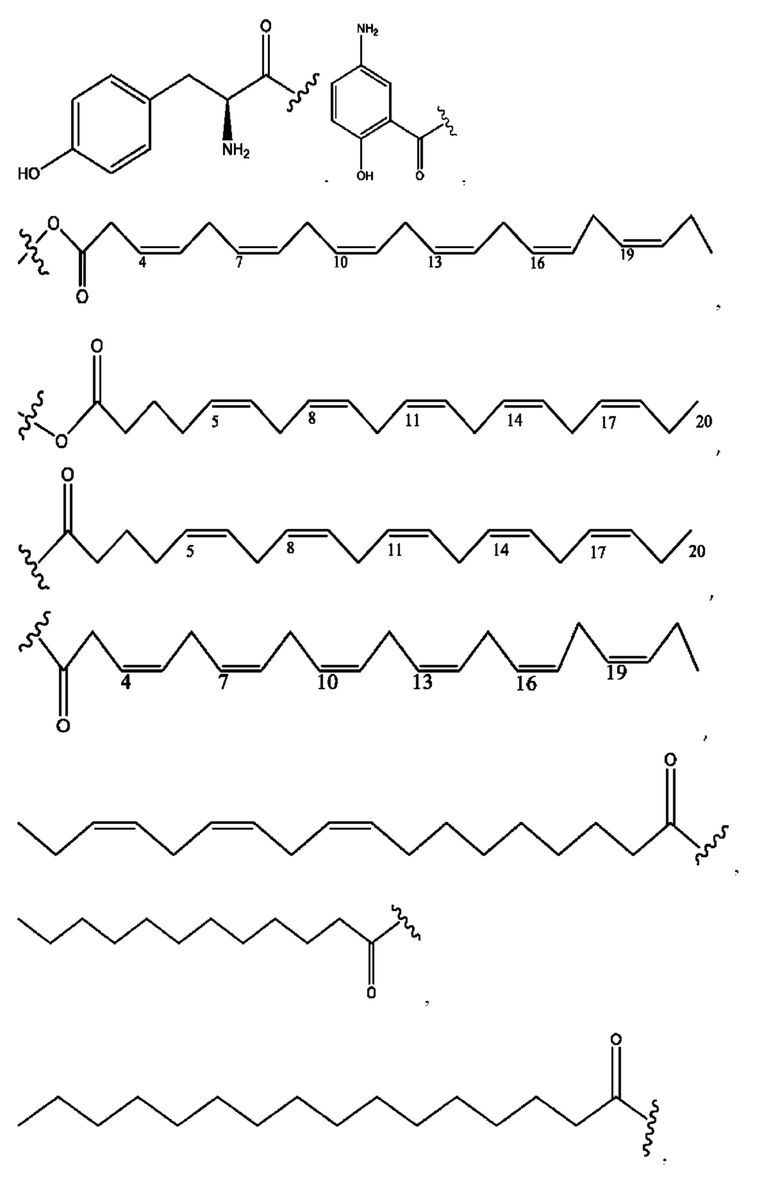
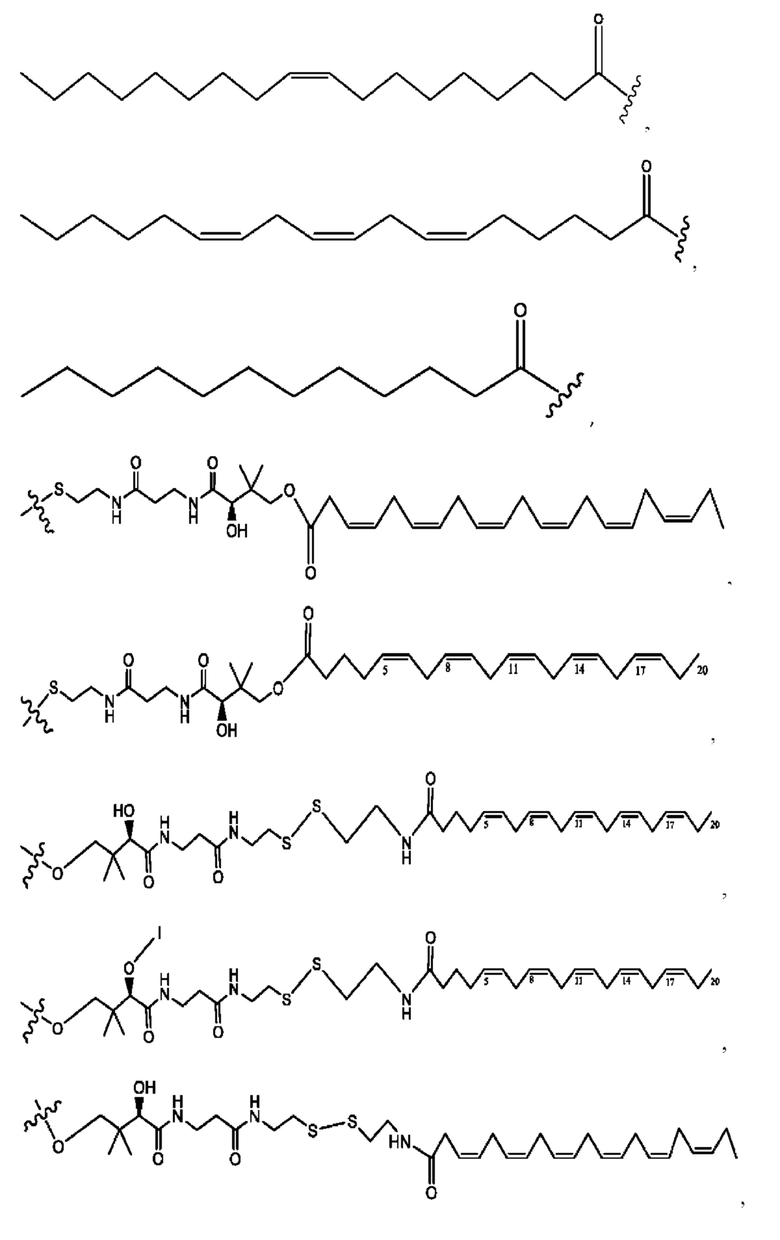
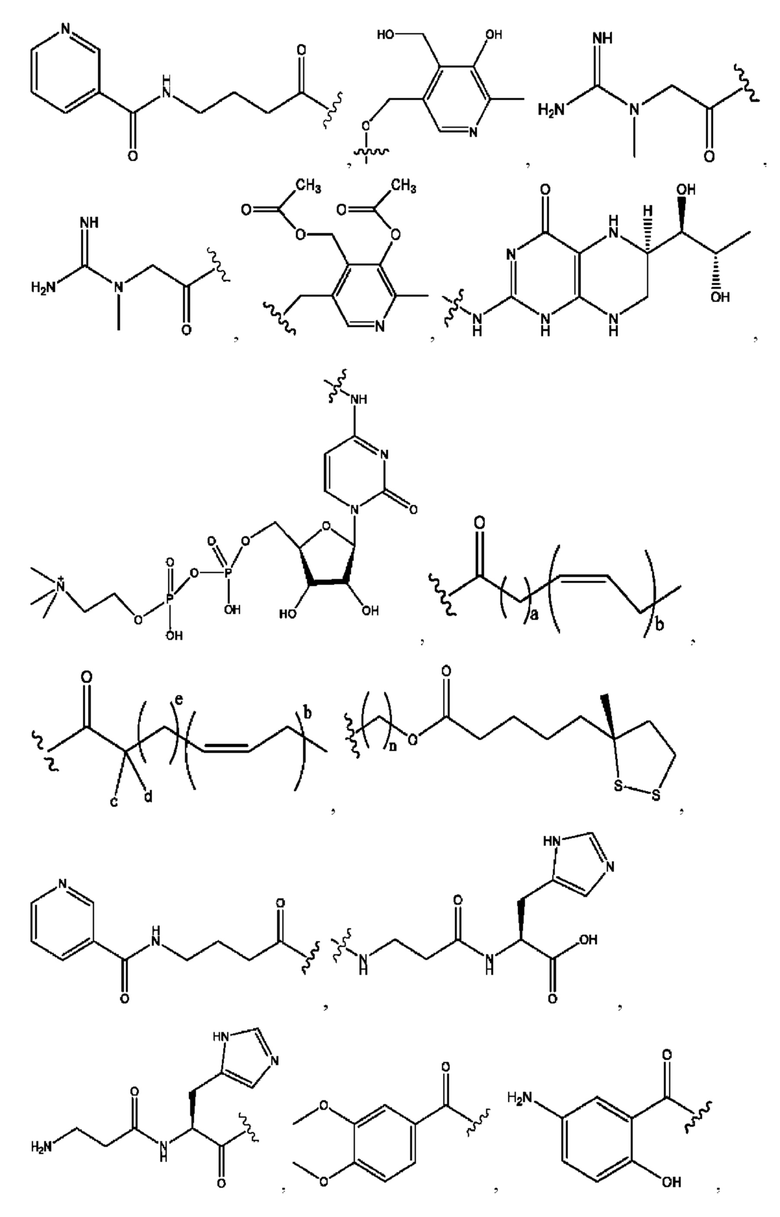
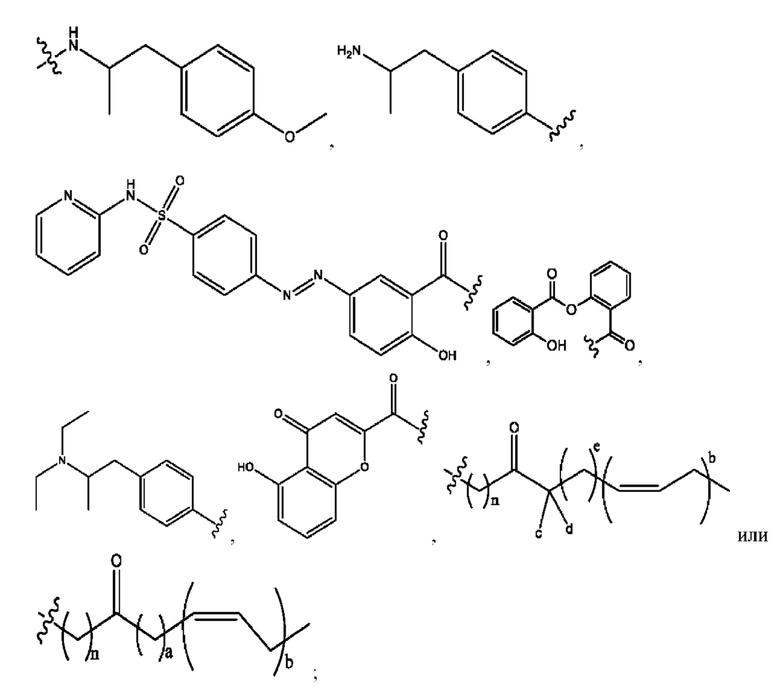
n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2,3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый с и d независимо равен Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3; при условии присутствия
каждый i независимо представляет собой
[0047] В настоящей заявке также предложен набор, содержащий любую из фармацевтических композиций, раскрытых в настоящей заявке. Указанный набор может включать инструкции для применения для лечения синдрома раздраженного кишечника (СРК) или связанных с ним осложнений.
[0048] Настоящая заявка также раскрывает фармацевтическую композицию, содержащую фармацевтически приемлемый носитель и любую из композиций согласно настоящей заявке. Согласно некоторым аспектам фармацевтическая композиция представлена в виде лекарственной формы для системного применения, перорального применения, с замедленным высвобождением, для парентерального применения, для инъекций, для подкожного применения или трансдермального применения.
[0049] Дополнительно в настоящей заявке предложены наборы, содержащие фармацевтические композиции, описанные в настоящей заявке. Указанные наборы могут включать инструкции для применения для лечения синдрома раздраженного кишечника (СРК) или связанных с ним осложнений.
[0050] Композиции, описанные в настоящей заявке, применяются по нескольким назначениям. Например, в настоящей заявке предложены способы лечения пациента, страдающего от воспалительного заболевания кишечника, заболеваний желудочно-кишечного тракта, синдрома раздраженного кишечника (СРК) или связанных осложнений, проявляющихся в виде метаболических или генетических состояний или нарушений, синдрома раздраженного кишечника (СРК), хронических заболеваний или нарушений; нейродегенеративных нарушений, гепатологических, раковых, респираторных, гематологических, ортопедических, сердечнососудистых, почечных, кожных, сосудистых или офтальмологических осложнений.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
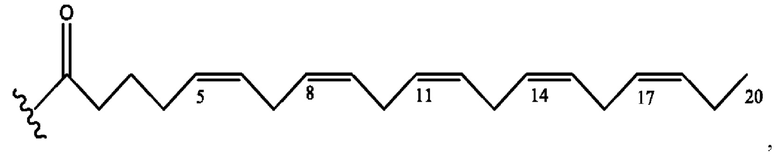
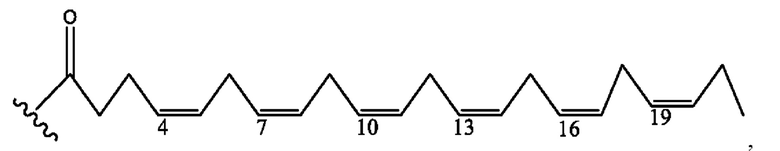
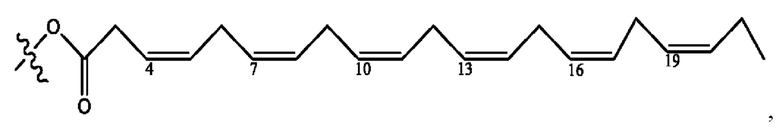
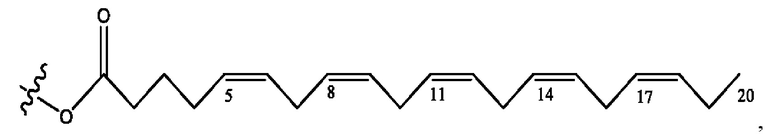
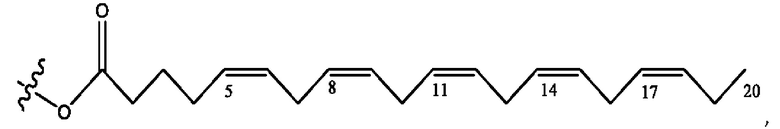
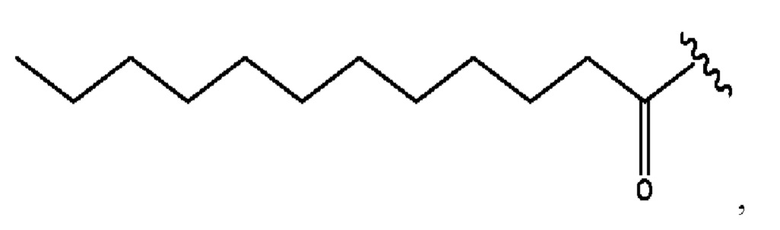
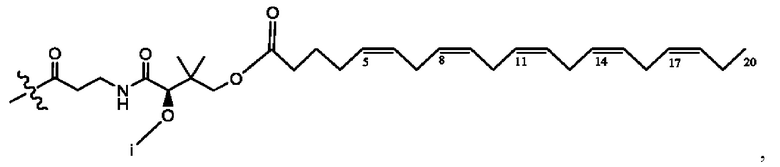
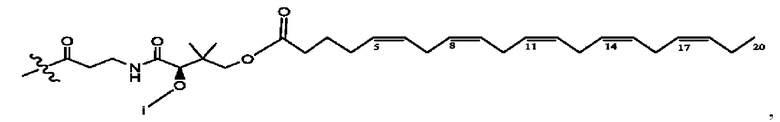
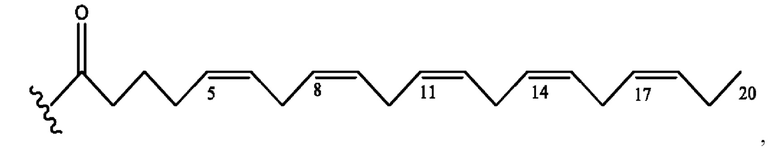
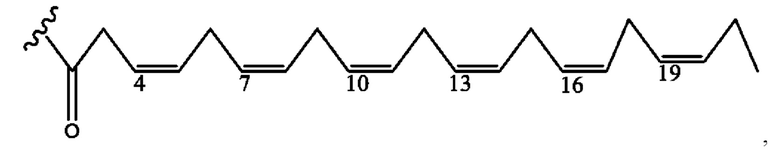
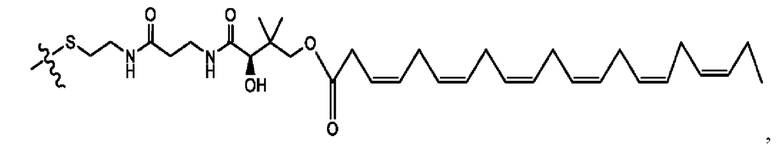
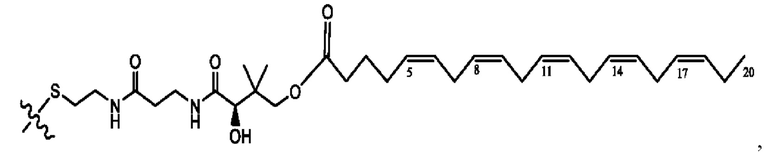
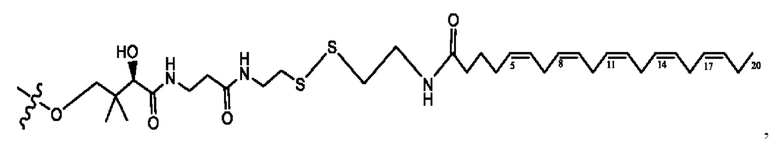
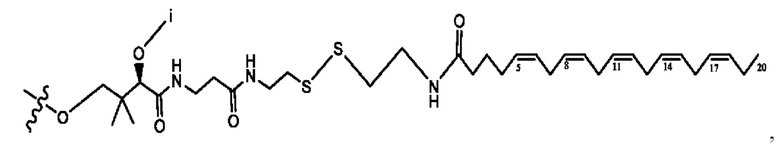
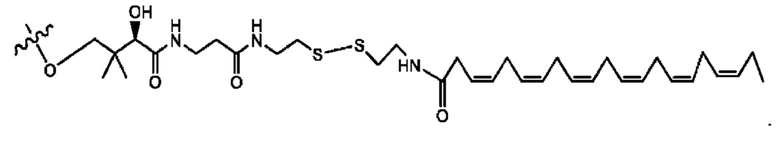
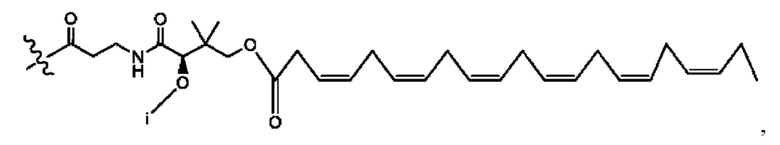
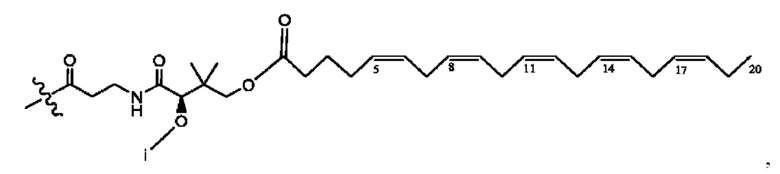
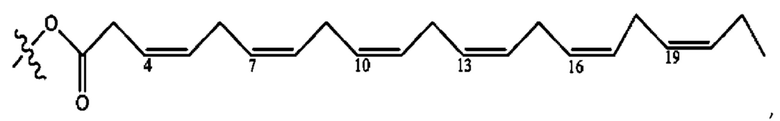
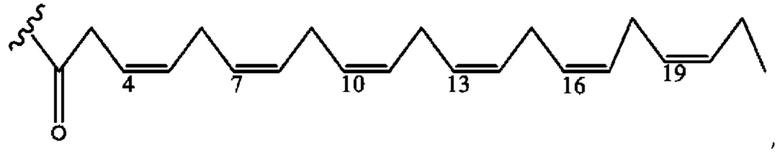
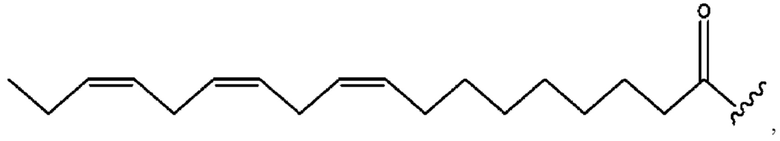
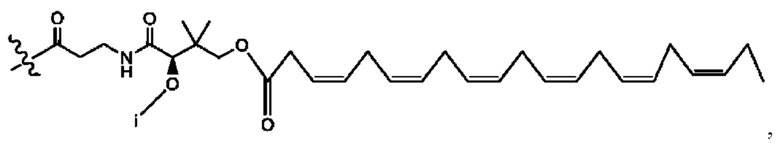
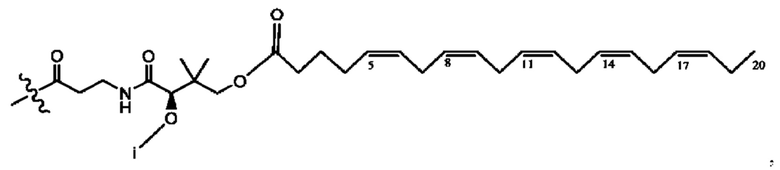
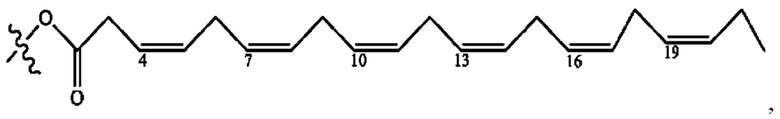
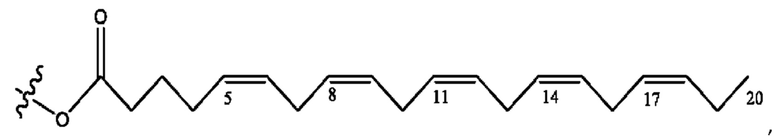
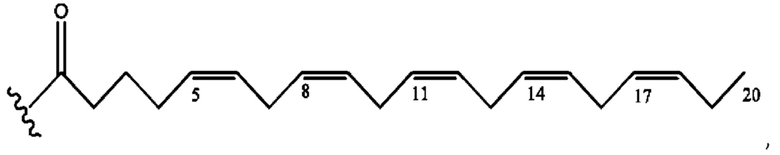
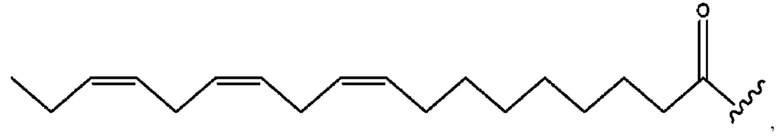
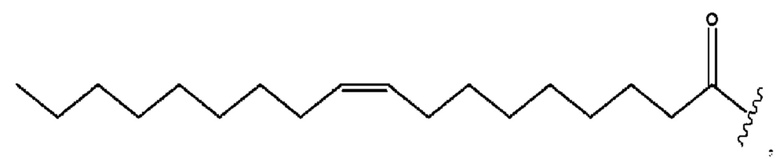
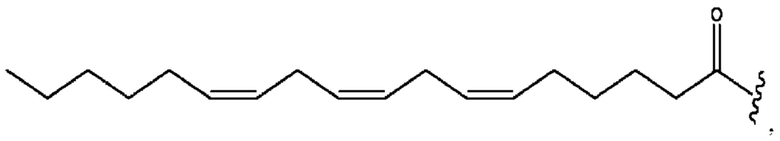
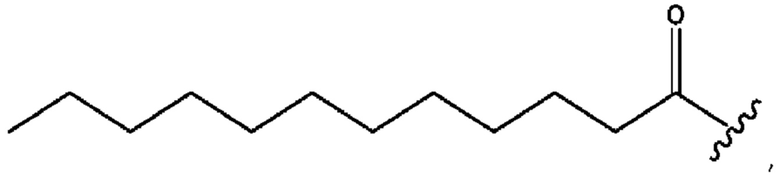
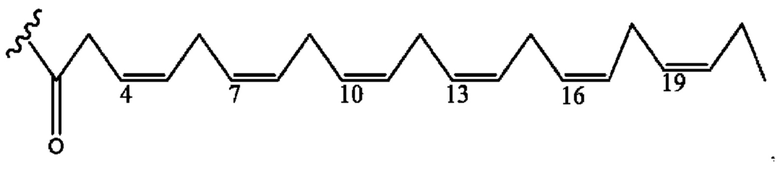
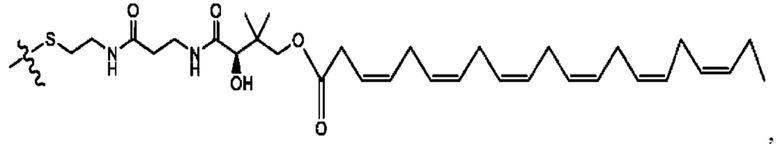
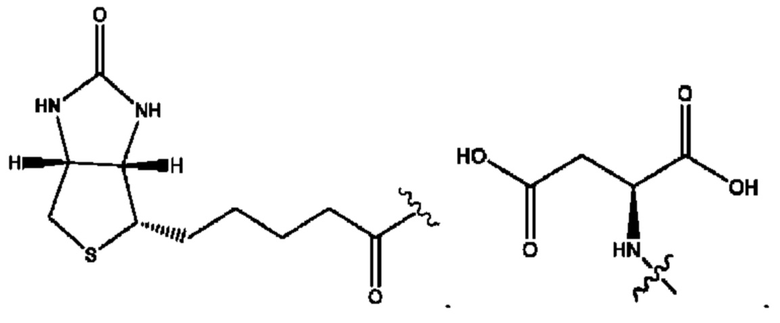
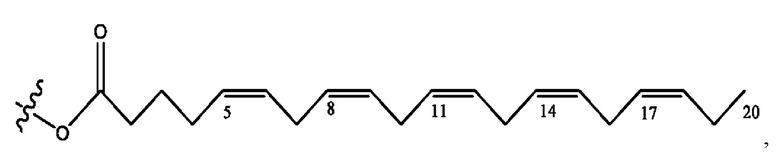
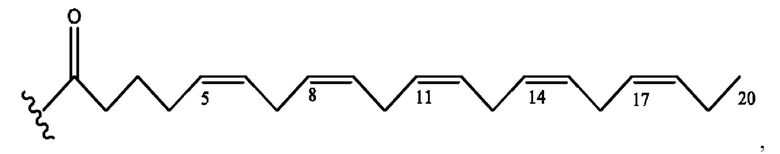
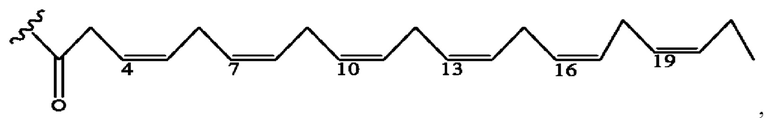
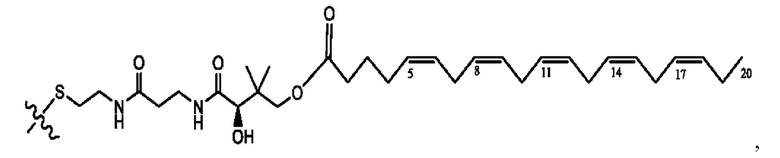
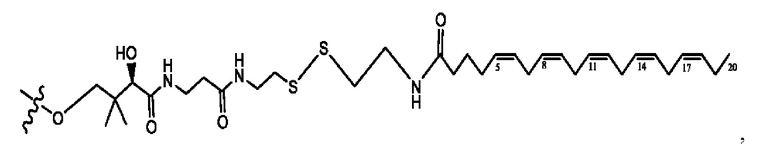
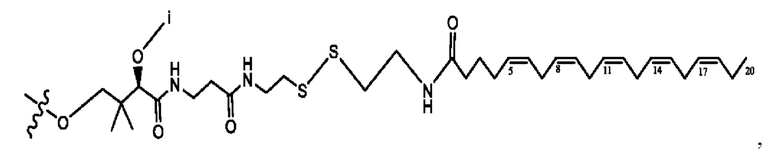
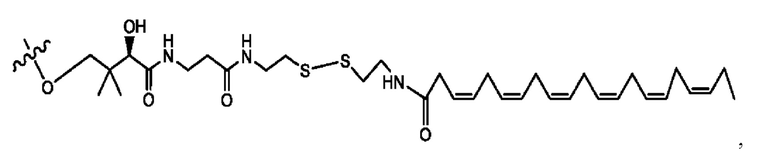
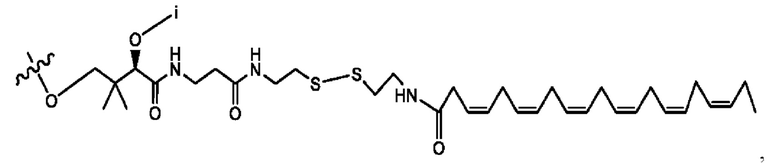
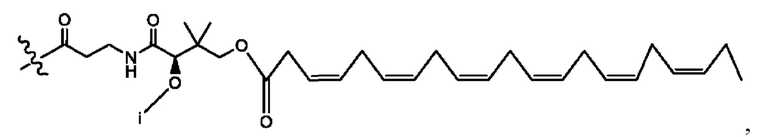
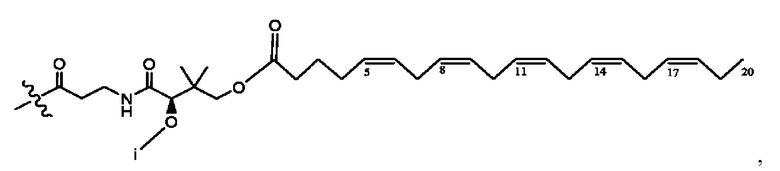
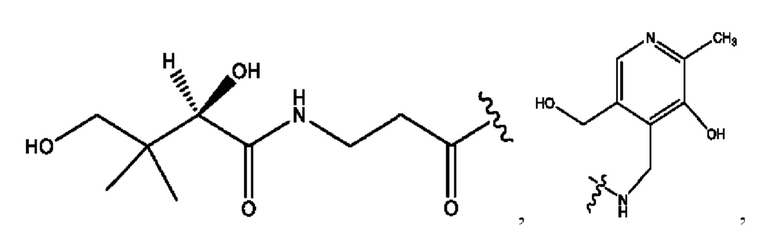
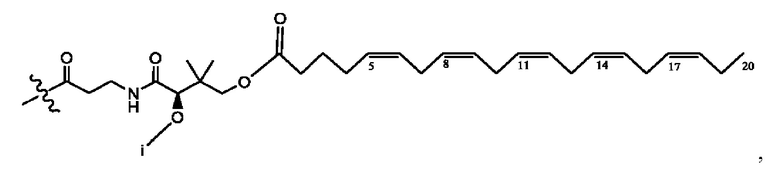
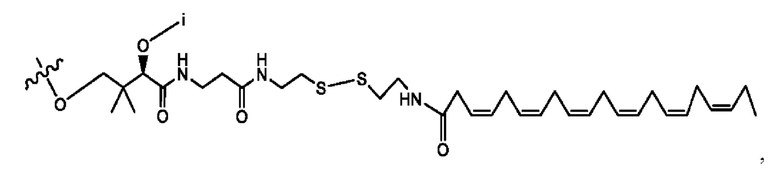
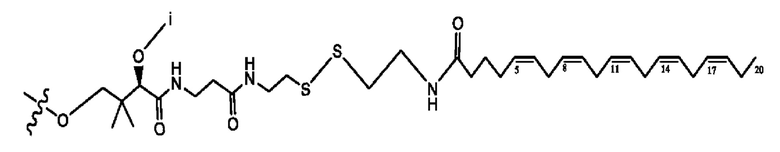
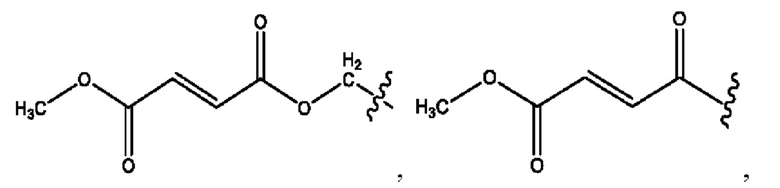
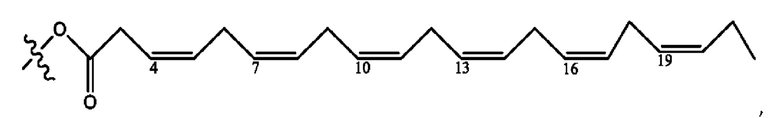
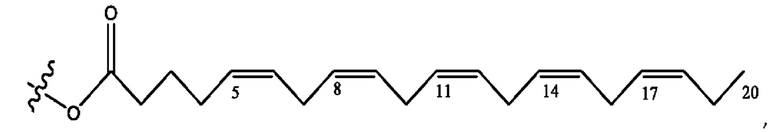
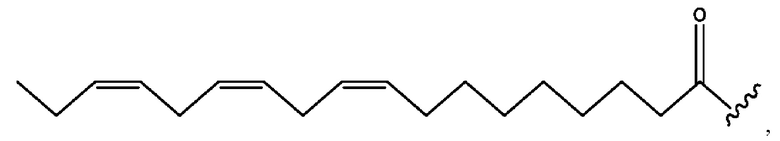
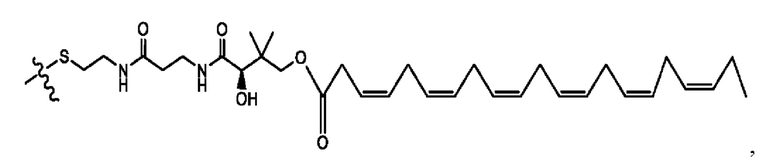
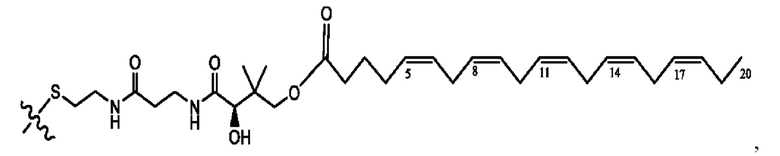
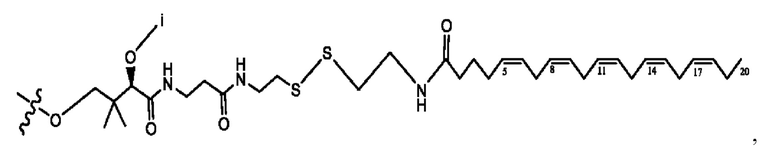
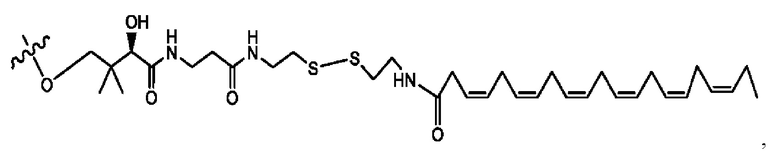
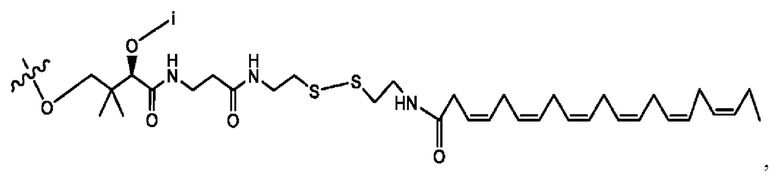
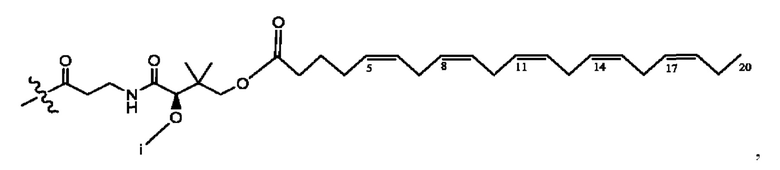
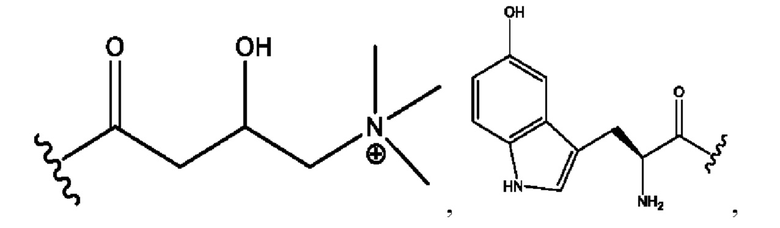
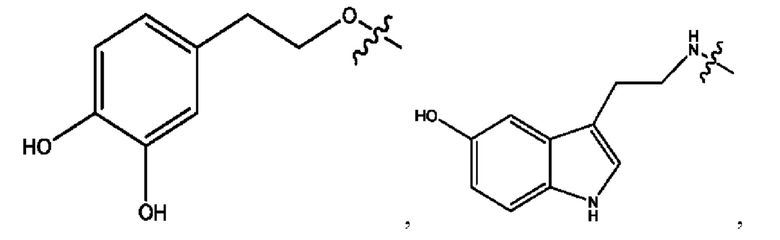
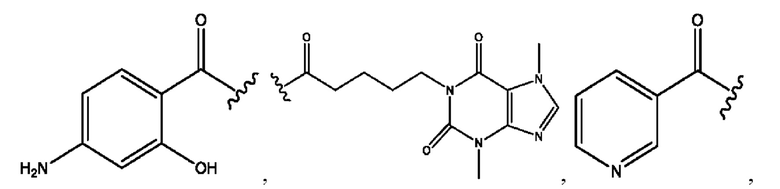
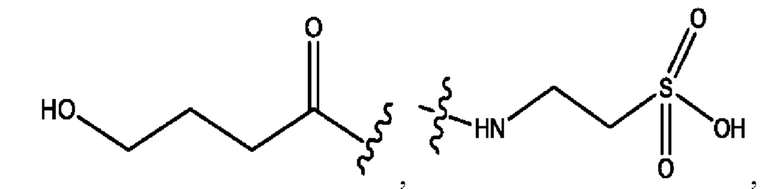
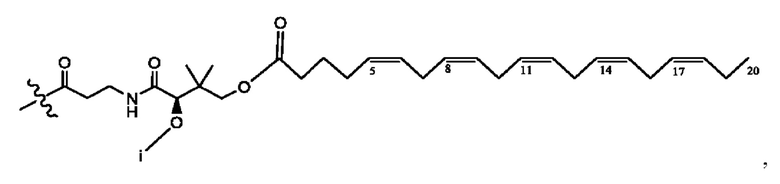
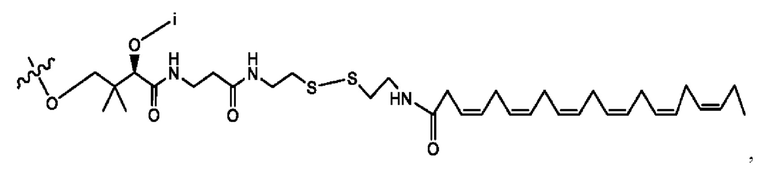
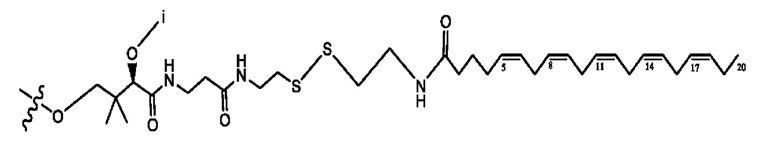
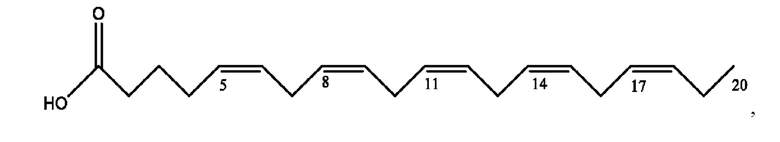
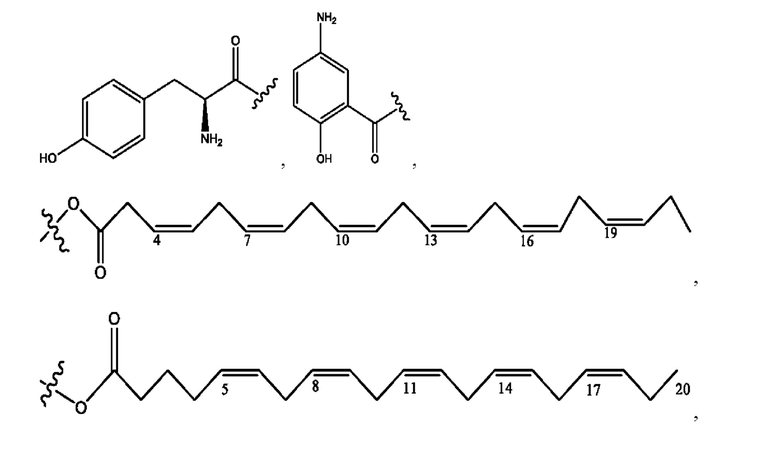
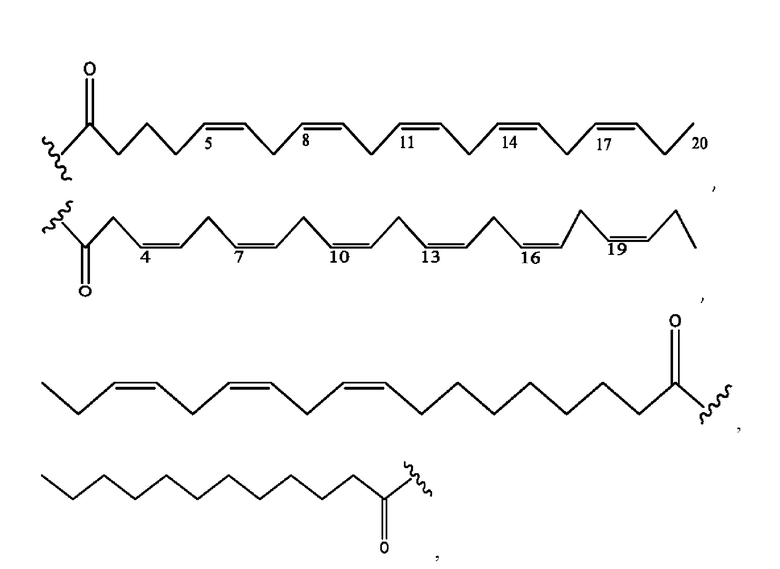
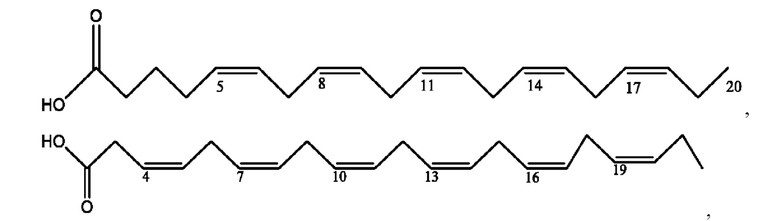
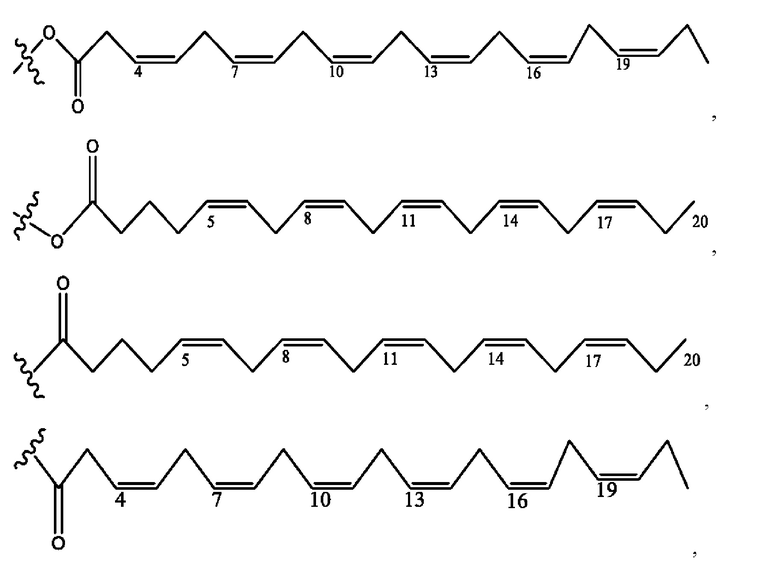
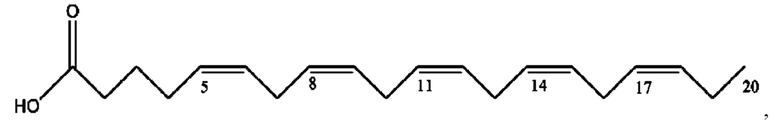
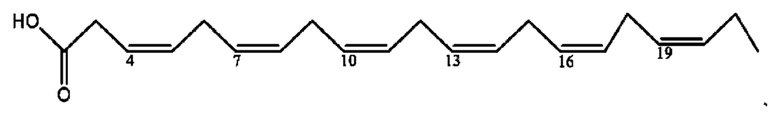
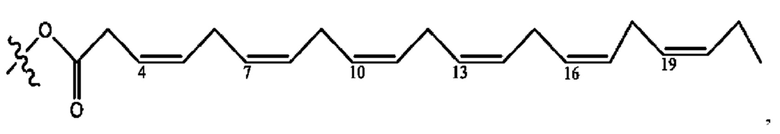
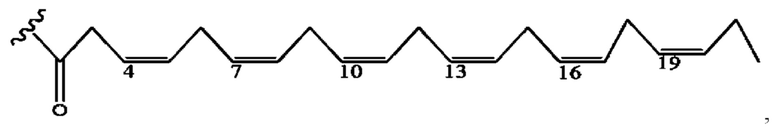
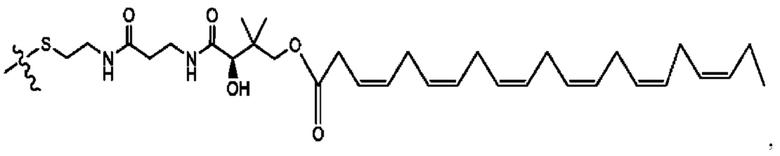
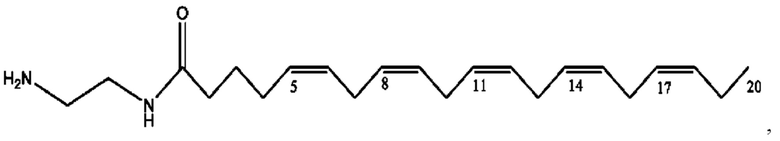
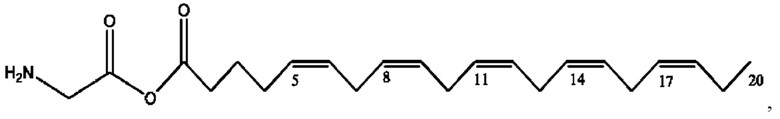
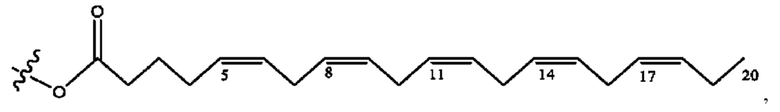
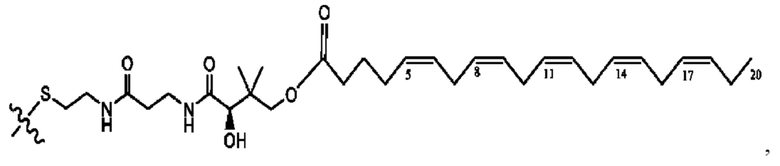
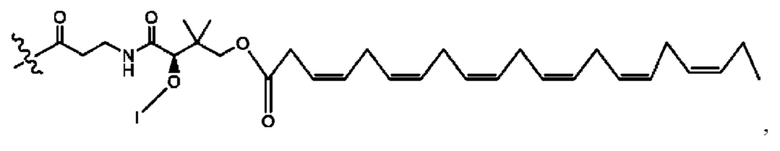
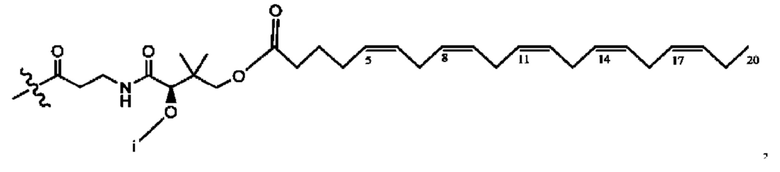
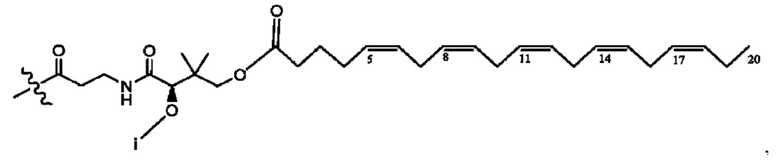
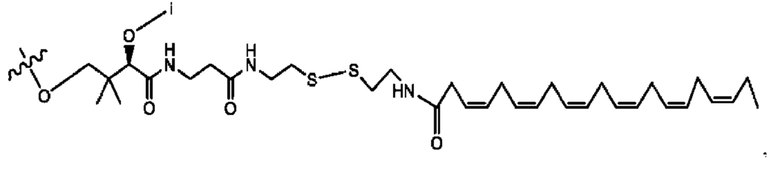
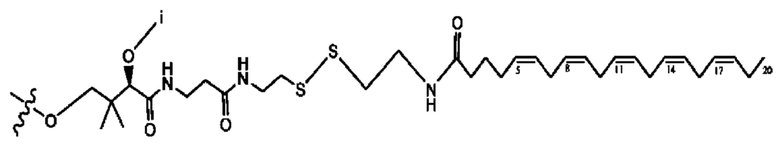
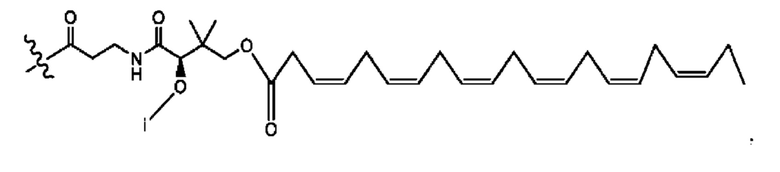
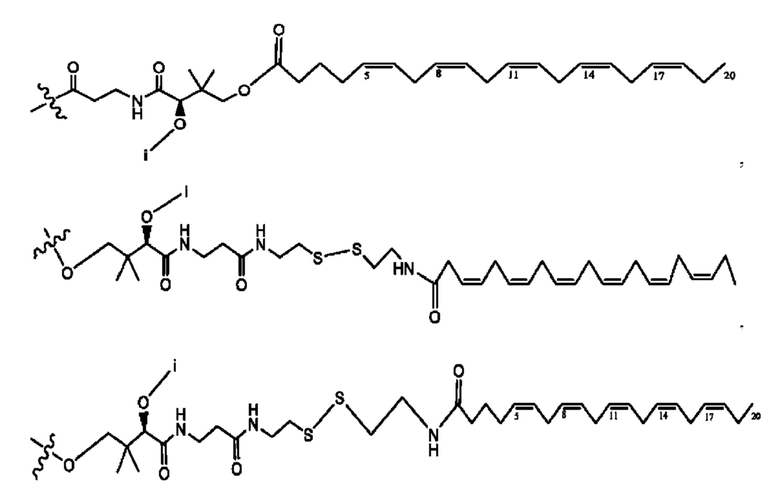
[0051] На фигуре 1 показан ЯМР спектр соединения 1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата.
[0052] На фигуре 2 показан ЯМР спектр соединения 1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата.
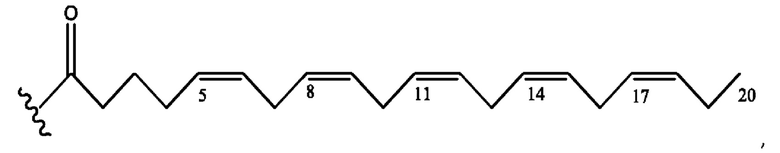
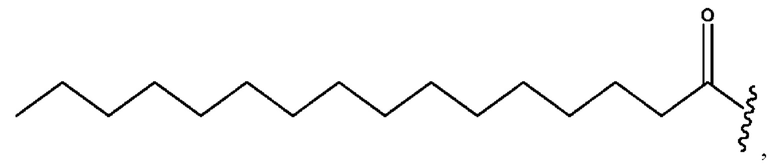
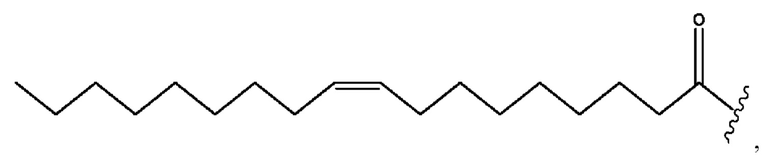
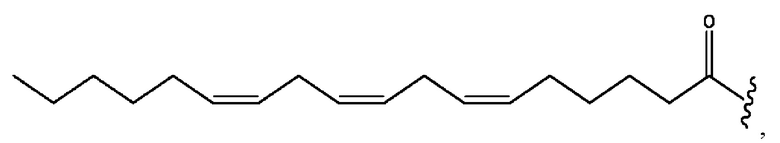
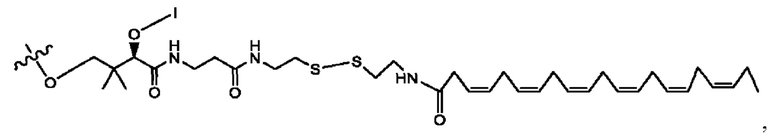
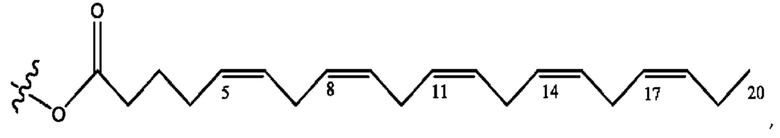
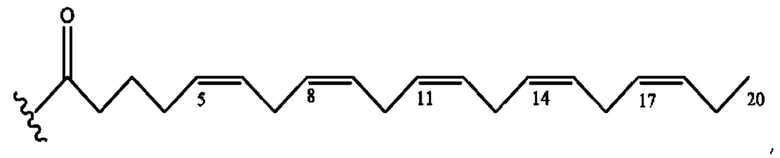
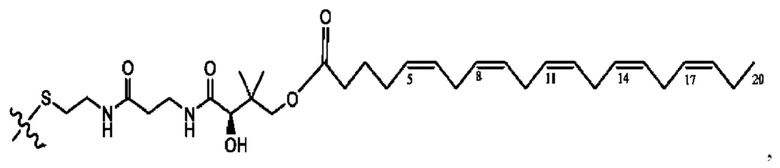
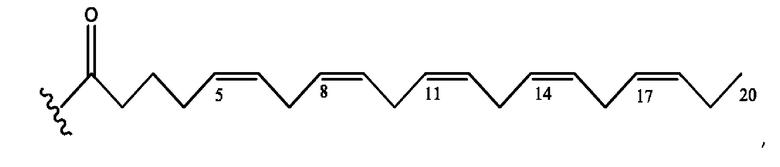
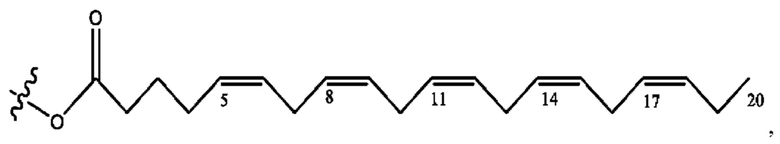
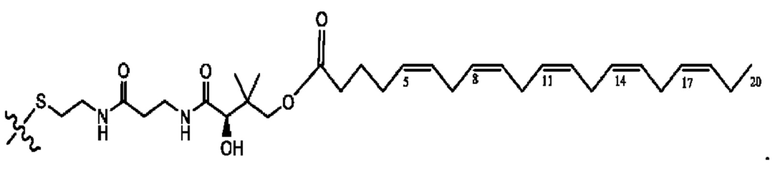
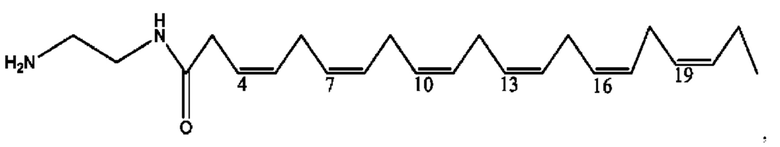
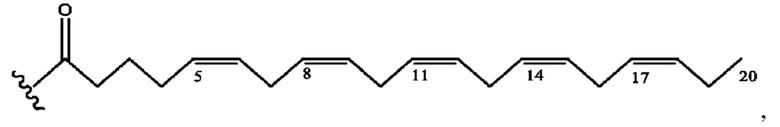
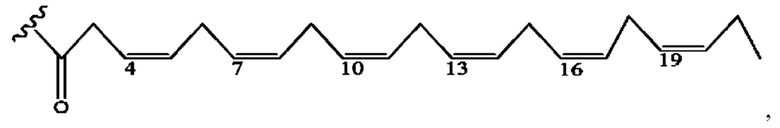
[0053] На фигуре 3 показан ЯМР спектр соединения 1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-инкоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоата.
[0054] На фигуре 4 показан ЯМР спектр соединения 1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоата.
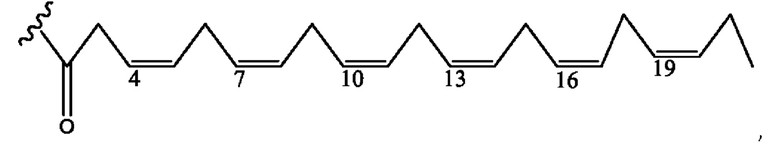
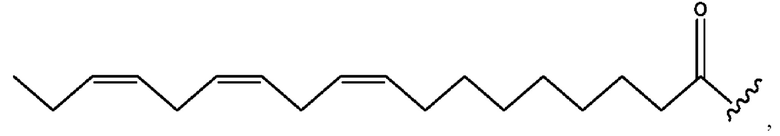
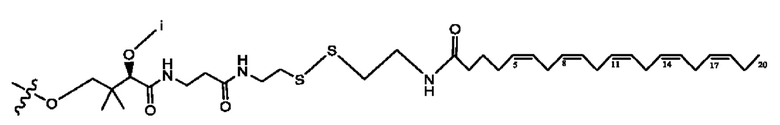
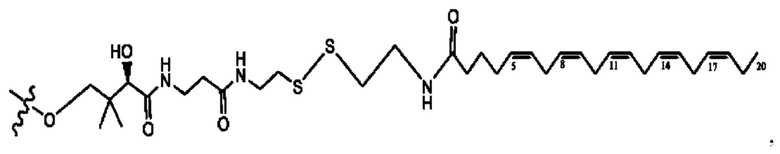
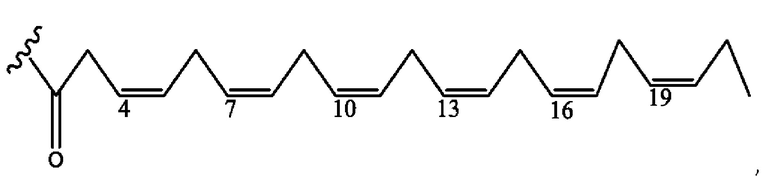
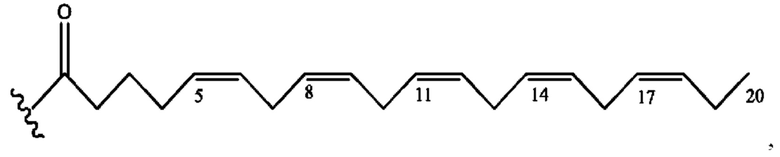
[0055] На фигуре 5 показан ЯМР спектр соединения 1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоата.
[0056] На фигуре 6 показан ЯМР спектр соединения 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(октаноилокси)бензойной кислоты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0057] Следующие термины и фразы, используемые в настоящей заявке, соответствуют значениям, представленным ниже. Если не указано иное, все технические и научные термины, используемые в настоящей заявке, соответствуют значениям, обычно подразумеваемым средним специалистом в области техники.
[0058] Соединения согласно настоящему изобретению могут быть представлены в форме фармацевтически приемлемых солей. Соединения согласно настоящему изобретению также могут быть представлены в форме фармацевтически приемлемых сложных эфиров (т.е., метиловых и этиловых сложных эфиров кислот формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, используемых в качестве пролекарств). Соединения согласно настоящему изобретению также могут быть сольватированы, т.е. гидратированы. На сольватацию может оказывать влияние процесс получения, или она может происходить, например, вследствие гигроскопических свойств изначально безводного соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV (гидратация).
[0059] Соединения, которые имеют одинаковую молекулярную формулу, но различаются по природе или последовательности связывания их атомов или расположению их атомов в пространстве, называются «изомерами». Изомеры, которые различаются расположением их атомов в пространстве, называются «стереоизомерами». Диастереомеры представляют собой стереоизомеры с противоположной конфигурацией при одном или более хиральных центрах, которые не являются энантиомерами. Стереоизомеры, имеющие один или более центров асимметрии, которые не являются совпадающими при наложении зеркальными отображениями друг друга, называются «энантиомерами». При наличии в соединении центра асимметрии, например, если атом углерода связан с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может характеризоваться абсолютной конфигурацией центра или центров асимметрии и описывается правилами R- и S-последовательности Кана-Ингольда-Прелога, или с учетом того, как указанная молекула вращает плоскость поляризованного света, и обозначают как правовращающий или левовращающий (т.е. как (+) или (-)-изомеры соответственно). Хиральное соединение может существовать либо в виде отдельного энантиомера, либо в виде их смеси. Смесь, содержащая равные пропорции энантиомеров, называется «рацемической смесью».
[0060] Используемый в настоящей заявке термин «метаболическое состояние» относится к врожденным нарушениям обмена веществ (или генетическим метаболическим состояниям) и представляет собой генетические нарушения, возникающие в результате дефекта одного или более метаболических путей; в частности, нарушается функция фермента, и она является либо недостаточной, либо полностью отсутствует.
[0061] Используемый в настоящей заявке термин «полиморф» является хорошо известным в области техники и относится к одной кристаллической структуре заявленного соединения.
[0062] Фразы «парентеральное введение» и «вводят парентерально», используемые в настоящей заявке, относятся к путям введения, отличным от энтерального и местного введения, таким как инъекции, и включают, но не ограничивается указанными, внутривенные, внутримышечные, внутриплевральные, внутрисосудистые, внутриперикардиальные, внутриартериальные, интратекальные, внутрисуставные, внутриглазные, внутрисердечные, внутрипочечные, внутрибрюшинные, транстрахеальные, подкожные, внутрикожные, интраартикулярные, субкапсулярные, субарахноидальные, внутриспинальные и интрастемальные инъекции и инфузии.
[0063] Термин «пациент», «субъект» или «хозяин», которого лечат заявленным способом, может означать либо человека, либо не являющееся человеком животное, такое как приматы, млекопитающие и позвоночные.
[0064] Фраза «фармацевтически приемлемый» является хорошо известной в области техники. Согласно определенным вариантам реализации изобретения указанный термин включает композиции, полимеры и другие вещества и/или дозированные формы, которые с медицинской точки зрения являются подходящими для применения при введении в контакт с тканями млекопитающих, людей и животных без излишней токсичности, раздражения, аллергической реакции или других проблем или осложнений, соизмеримого с разумным соотношением пользы и риска.
[0065] Фраза «фармацевтически приемлемый носитель» является хорошо известной в области техники и включает, например, фармацевтически приемлемые вещества, композиции или наполнители, такие как жидкие или твердые наполнители, разбавители, растворители или инкапсулирующие вещества, участвующие в переносе или транспортировке любой заявленной композиции, от одного органа или части тела к другому органу или части тела. Каждый носитель должен быть «приемлемым», то есть, должен быть совместим с другими ингредиентами заявленной композиции и не должен наносить вред пациенту. Согласно определенным вариантам реализации изобретения фармацевтически приемлемый носитель является апирогенным. Некоторые примеры веществ, которые могут служить фармацевтически приемлемыми носителями, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этил олеат и этиллаурат; (13) агар; (14) забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера; и (21) другие нетоксичные совместимые вещества, включенные в фармацевтические лекарственные формы.
[0066] Подразумевается, что термин «пролекарство» включает соединения, которые в физиологических условиях превращаются в терапевтически активные агенты согласно настоящему изобретению. Традиционный способ получения пролекарства заключается во включении выбранных фрагментов, которые гидролизуются в физиологических условиях, для обнаружения желаемой молекулы. Согласно другим вариантам реализации изобретения превращение указанного пролекарства происходит под действием ферментативной активности животного-хозяина.
[0067] Термин «профилактическое или терапевтическое» лечение является хорошо известным в области техники и включает введение в организм хозяина одной или более заявленных композиций. Если указанные композиции вводят до клинических проявлений нежелательного состояния (например, заболевания или другого нежелательного состояния животного-хозяина), то лечение является профилактическим,
т.е. оно защищает организм хозяина от развития нежелательного состояния, тогда как если указанные композиции вводят после проявления нежелательного состояния, лечение является терапевтическим (т.е. оно направлено на ослабление, улучшение или стабилизацию существующего нежелательного состояния или его побочных эффектов).
[0068] Термин «прогнозирование», используемый в настоящей заявке, относится к оценке вероятности заболеваний, при которых у пациента будут обнаружены аномалии или осложнения и/или терминальная стадия заболевания кишечника или кишечной недостаточности и/или будет констатирована смерть (т.е. летальный исход) в пределах определенного временного интервала (прогнозного интервала) в будущем. Летальный исход может быть вызван поражением центральной нервной системы или осложнением. Указанный прогнозный интервал - это интервал, в течение которого у субъекта развивается одно или более из указанных осложнений в соответствии с прогнозируемой вероятностью. Прогнозный интервал может представлять собой весь оставшийся период продолжительности жизни субъекта при анализе способом согласно настоящему изобретению.
[0069] Термин «лечение» является хорошо известным в области техники и включает предотвращение возникновения заболевания, нарушения или состояния у животного, которое может быть предрасположено к указанному заболеванию, нарушению и/или состоянию, но у него оно еще не было диагностировано; ингибирование указанного заболевания, нарушения или состояния, например, препятствование его развитию; и облегчение указанного заболевания, нарушения или состояния, например, вызывая регресс такого заболевания, нарушения и/или состояния. Лечение заболевания или состояния включает облегчение по меньшей мере одного симптома конкретного заболевания или состояния даже в случае, если не затронута его патофизиологическая первопричина, как, например, лечение метаболического синдрома и нарушений, связанных с диабетом, включает такие как воспалительное заболевание кишечника, синдром раздраженного кишечника (СРК) включает такие как целиакия, малабсорбция фруктозы, легкие инфекции, паразитические инфекции, такие как лямблиоз, некоторые воспалительные заболевания кишечника, малабсорбция желчных кислот, функциональный хронический запор, избыточный бактериальный рост в тонком кишечнике и хроническая функциональная боль в животе, и другие связанные заболевания или любые другие медицинские состояния, является хорошо понятным в области техники и включает введение композиции, которая снижает частоту или отсрочивает начало симптомов медицинского состояния у субъекта относительно субъекта, который не получает композиции. У субъекта, путем введения агента, даже если такой агент не лечит причину состояния. Термин «процесс лечения», «лечить» или «лечение» в контексте настоящей заявки включает лечебное, предупредительное (например, профилактическое), вспомогательное и паллиативное лечение.
[0070] Термин «терапевтически эффективное количество» является хорошо известным в данной области техники. В определенных вариантах реализации указанный термин относится к количеству соли или композиции, раскрытой в настоящей заявке, которое дает некоторый желаемый эффект при разумном соотношении пользы и риска, применимом к любому терапевтическому лечению. В некоторых вариантах реализации настоящего изобретения указанный термин относится к тому количеству, которое необходимо или достаточно для устранения или уменьшения медицинских симптомов в течение периода времени. Указанное эффективное количество может варьироваться в зависимости от таких факторов, как заболевание или состояние, которое лечат, конкретные конструкты для нацеливания, предназначенные для введения, размер субъекта или тяжесть заболевания или состояния. Специалист в данной области техники может эмпирическим путем определить эффективное количество конкретной композиции без необходимости проведения излишних экспериментов.
[0071] В некоторых вариантах реализации фармацевтические композиции, описанные в настоящей заявке, приготавливают таким образом, чтобы указанные композиции доставлялись пациенту в терапевтически эффективном количестве как часть профилактического или терапевтического лечения. Желаемое количество композиции для введения пациенту будет зависеть от скорости всасывания, инактивации и выведения лекарственного средства, а также от скорости доставки солей и композиции из заявленных композиций. Следует отметить, что величины дозы также могут варьироваться в зависимости от тяжести состояния, которое необходимо облегчить. Кроме того, следует понимать, что для любого конкретного субъекта конкретные режимы дозирования с течением времени следует корректировать в соответствии с индивидуальной потребностью и профессиональным мнением специалиста, вводящего или контролирующего введение композиции. Обычно дозирование определяют с применением методик, известных специалисту в данной области техники.
[0072] Кроме того, оптимальная концентрация и/или содержание или количества любой конкретной соли или композиции можно откорректировать для того, чтобы учесть изменения в параметрах лечения. Такие параметры лечения включают клиническое применение препарата, например, участок тела, подлежащий лечению, тип пациента, например, пациент-человек или пациент, не являющийся человеком, взрослый пациент или ребенок, и природу заболевания или состояния.
[0073] В некоторых вариантах реализации дозировку композиций, предложенных в настоящей заявке, можно определить с учетом концентраций в плазме терапевтической композиции или других инкапсулированных материалов. Например, можно применять максимальную концентрацию в плазме (Смакс) и площадь под кривой зависимости концентрация в плазме-время в период времени от 0 до бесконечности.
[0074] В случае, когда термин «замедленное высвобождение» используют в отношении фармацевтической композиции или другого вещества, то данный термин является хорошо известным в данной области техники. Например, заявленная композиция, которая высвобождает вещество с течением времени, может проявлять характеристики замедленного высвобождения в отличие от введения болюсного типа, при котором доступным с биологической точки зрения становится одновременно все количество вещества. Например, в конкретных вариантах реализации при контакте с жидкостями организма, включая кровь, спинномозговую жидкость, слизистую секрецию, лимфу или тому подобные, одно или более фармацевтически приемлемых вспомогательных веществ могут подвергаться постепенному или отсроченному разложению (например, посредством гидролиза) с сопутствующим высвобождением любого содержащегося в них вещества, например, терапевтической и/или биологически активной соли и/или композиции, в течение длительного или продолжительного периода времени (по сравнению с высвобождением из болюса). Это высвобождение может приводить к пролонгированной доставке терапевтически эффективных количеств любых из раскрытых в настоящей заявке терапевтических агентов.
[0075] Термины «системное введение», «вводимый системно», «периферическое введение», «вводимые периферически» являются хорошо известными в данной области техники и включают введение заявленной композиции, терапевтического или другого вещества в участок тела, удаленный от пораженного очага, который лечат. Введение агента для лечения заболевания, даже в случае, если указанный агент впоследствии распределяется системно, может быть обозначено термином «локальное» или «местное» или «региональное» введение, которое отлично от непосредственного введения в центральную нервную систему, например, путем подкожного ведения, так что указанный агент попадает в центральную нервную систему пациента и, таким образом, подвергается метаболизму и другим подобным процессам.
[0076] Термин «терапевтически эффективное количество» является хорошо известным в данной области техники. В определенных вариантах реализации указанный термин относится к количеству соли или композиции, раскрытой в настоящей заявке, которое дает некоторый желаемый эффект при разумном соотношении пользы и риска, применимом к любому терапевтическому лечению. В определенных вариантах реализации указанный термин относится к тому количеству, которое необходимо или достаточно для устранения или уменьшения медицинских симптомов в течение периода времени. Указанное эффективное количество может варьироваться в зависимости от таких факторов, как заболевание или состояние, которое лечат, конкретные конструкты для нацеливания, предназначенные для введения, размер субъекта или тяжесть заболевания или состояния. Специалист в данной области техники может эмпирическим путем определить эффективное количество конкретной композиции без необходимости проведения излишних экспериментов.
[0077] В настоящем изобретении также предложены пролекарства композиций, раскрытых в настоящей заявке, а также фармацевтически приемлемые соли указанных пролекарств.
[0078] В настоящей заявке также раскрыта фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и композицию соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV может быть приготовлена для системного или местного, или перорального применения. Указанная фармацевтическая композиция также может быть приготовлена для перорального применения, применения в виде перорального раствора, инъекции, подкожного введения или трансдермального введения. Указанная фармацевтическая композиция может дополнительно содержать по меньшей мере один фармацевтически приемлемый стабилизатор, разбавитель, поверхностно-активное вещество, наполнитель, связующее вещество и смазывающее вещество.
[0079] Согласно многим вариантам реализации изобретения фармацевтические композиции, описанные в настоящей заявке, включают раскрытые соединения и композиции (Формула I и Формула II), которые необходимо доставить в количестве, достаточном для доставки пациенту терапевтически эффективного количества соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII или формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV или композиции как части профилактического или терапевтического лечения. Желаемая концентрация соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV или их фармацевтически приемлемых солей зависит от скорости всасывания, инактивации и выведения лекарственного средства, а также от скорости доставки солей и композиции из заявленных композиций. Следует отметить, что величины дозировки также могут варьироваться в зависимости от тяжести состояния, которое необходимо облегчить. Кроме того, следует понимать, что для любого конкретного субъекта конкретные режимы дозирования с течением времени следует корректировать в соответствии с индивидуальной потребностью и профессиональным мнением специалиста, вводящего или контролирующего введение композиции. Обычно дозирование определяют с применением методик, известных специалисту в данной области техники.
[0080] Кроме того, оптимальная концентрация и/или содержание или количества любого конкретного соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV могут быть откорректированы с учетом изменений в параметрах лечения. Такие параметры лечения включают клиническое применение препарата, например, участок тела, подлежащий лечению, тип пациента, например, пациент-человек или пациент, не являющийся человеком, взрослый ли это пациент или ребенок, и природу заболевания или состояния.
[0081] Концентрация и/или количество любого из соединений формулы I, формулы П, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV могут быть с легкостью определены с помощью обычного скрининга на животных, например, крысах, путем скрининга диапазона концентраций и/или количеств предлагаемого вещества с применением соответствующих анализов. Также доступны известные способы для анализа локальных концентраций в тканях, скорости диффузии солей или композиций и локального кровотока до и после введения терапевтических лекарственных форм, раскрытых в настоящей заявке. Одним из таких способов является микродиализ, рассмотренный в публикации Т.Е. Robinson et al., 1991, microdialysis in the neurosciences. Techniques, volume 7, Chapter 1. Способы, рассмотренные Робинсоном, можно вкратце применить следующим образом. Зонд (loop) для микродиализа размещают in situ в исследуемом животном. Диализирующая жидкость прокачивается через указанный зонд. Когда соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII или формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, как, например, соединения, раскрытые в настоящей заявке, вводят при помощи инъекции рядом с зондом, высвобожденные лекарственные средства накапливаются в диализате пропорционально своим концентрациям в локальных тканях. Тем самым прогресс в процессе диффузии солей или композиций можно определить с помощью подходящих процедур калибровки, применяя известные концентрации солей или композиций.
[0082] Согласно определенным вариантам реализации изобретения дозировка заявленных соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, описанных в настоящей заявке, может быть определена с учетом концентраций в плазме терапевтической композиции или других инкапсулированных веществ. Например, можно применять максимальную концентрацию в плазме (Смакс) и площадь под кривой концентрация в плазме-время в период времени от 0 до бесконечности.
[0083] В целом при осуществлении способов, подробно описанных в настоящей заявке, эффективная дозировка для соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы Х находится в диапазоне от примерно 0,01 мг/кг/день до примерно 100 мг/кг/день в виде целой или дробных доз, например от 0,01 мг/кг/день до примерно 50 мг/кг/день в виде целой или дробных доз. Соединения формулы I могут быть введены в дозе. Например, меньшей, чем 0,2 мг/кг/сутки, 0,5 мг/кг/сутки, 1,0 мг/кг/сутки, 5 мг/кг/сутки, 10 мг/кг/сутки, 20 мг/кг/сутки, 30 мг/кг/сутки или 40 мг/кг/сутки. Соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, или формулы VIII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV также можно вводить пациенту-человеку в дозе, например, находящейся в интервале между 0,1 мг и 1000 мг, между 5 мг и 80 мг или меньшей чем 1,0, 9,0, 12,0, 20,0, 50,0, 75,0, 100, 300, 400, 500, 800, 1000, 2000, 5000 мг в день. Согласно определенным вариантам реализации предложенные в настоящей заявке композиции вводят в количестве, которое составляет менее 95%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, или 10% соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, необходимым для получения того же терапевтического эффекта.
[0084] Эффективное количество соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, описанных в настоящей заявке, относится к количеству указанных солей или композиций, способному замедлять или предотвращать течение заболевания.
[0085] Эффективное количество может быть достаточным для предотвращения, лечения, облегчения, улучшения, прекращения, задержки, замедления или обращения прогрессирования, или снижения тяжести осложнений, возникающих в результате повреждения или демиелинизации нерва и/или повышенных реакционно-способных окислительно-нитрозативных соединений и/или нарушений в гомеостазе нейротрансмиттеров у пациента, с риском возникновения таких осложнений. Как таковые, указанные способы включают как терапевтическое (острое) так и/или профилактическое (превентивное) применение в соответствующих случаях. Количество и продолжительность введения композиций, разумеется, будет зависеть от субъекта, который лечат, степени тяжести заболевания, пути введения и решения лечащего врача. Таким образом, в свете различий от пациента к пациенту, приведенные выше дозировки являются ориентировочными и лечащий врач может подбирать дозировки лекарственного средства для достижения лечения, которое он считает целесообразным для пациента. При подборе желаемой интенсивности лечения лечащий врач должен учитывать различные факторы, такие как возраст пациента, наличие ранее существовавшего заболевания, а также наличие других заболеваний.
[0086] Композиции, предложенные в настоящей заявке, можно вводить субъекту, нуждающемуся в лечении, различными путями, включая пероральное, местное, парентеральное, например, внутривенное, подкожное или интрамедуллярное введение. Кроме того, композиции можно вводить назально, в виде ректального суппозитория, или применяя «мгновенный» (flash) состав, т.е. позволяющий лекарственному средству растворяться во рту без необходимости применять воду. Кроме того, композиции можно вводить субъекту, нуждающемуся в лечении, при помощи дозированных форм с контролируемым высвобождением, путем сайт-специфичной доставки лекарственного средства, трансдермальной доставки лекарственного средства, доставки лекарственного средства посредством пластыря (активного/пассивного), при помощи стереотаксической инъекции или наночастиц.
[0087] Композиции можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями, наполнителями или разбавителями, либо в однократных, либо в многократных дозах. Подходящие фармацевтические носители, наполнители и разбавители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции, получаемые путем объединения композиций и фармацевтически приемлемых носителей, наполнителей или разбавителей, затем легко вводят в виде различных лекарственных форм, таких как таблетки, порошки, таблетки для рассасывания, сиропы, растворы для инъекций и тому подобное. Такие фармацевтические композиции могут, если это желательно, содержать дополнительные ингредиенты, такие как ароматизаторы, связующие вещества, вспомогательные вещества и тому подобное. Таким образом, для целей перорального введения, таблетки, содержащие различные вспомогательные вещества, такие как L-аргинин, цитрат натрия, карбонат кальция и фосфат кальция, можно применять наряду с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторыми сложными силикатами, совместно со связующими агентами, такими как поливинилпирролидон, сахароза, желатин и камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, обычно являются подходящими для применения для таблетирования. Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах. Подходящие для этих целей вещества включают лактозу или молочный сахар и полиэтиленгликоли с высокой молекулярной массой. В случае, если для перорального введения желательны водные суспензии или эликсиры, в них основной активный ингредиент может быть объединен с различными подсластителями или ароматизаторами, подкрашивающими агентами или красителями и, если это желательно, эмульгирующими или суспендирующими агентами совместно с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их комбинациями. Композиции соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII или формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV могут также содержать энтеросолюбильное покрытие, содержащее различные вспомогательные вещества, хорошо известные в фармацевтической области.
[0088] Для парентерального введения могут быть получены растворы композиций в (например) кунжутном или арахисовом масле, водном пропиленгликоле или в стерильном водном растворе. В случае, если это необходимо, такие водные растворы следует подходящим образом забуферить, и жидкий разбавитель сначала следует сделать изотоничным при помощи достаточного количества солевого раствора или глюкозы. Такие конкретные водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В связи с этим все используемые стерильные водные среды легко доступны для получения стандартными методами, известными специалистам в данной области техники.
[0089] Лекарственные формы, например, таблетки, могут содержать, например, от 10 до 100, от 50 до 250, от 150 до 500 мг, или от 350 до 800 мг, например, 10, 50, 100, 300, 500, 700, 800 мг соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, раскрытых в настоящей заявке, например, соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV или фармацевтически приемлемых солей соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV.
[0090] В целом композицию, описанную в настоящей заявке, можно вводить перорально или парентерально (например, внутривенно, внутримышечно, подкожно или интрамедуллярно). Местное применение также можно быть назначено в случае, когда, например, пациент страдает желудочно-кишечным расстройством, которое препятствует пероральному введению, или когда лекарственное средство лучше наносить на поверхность ткани или органа, что определяет лечащий врач. Локализованное применение также может быть назначено в случае, когда, например, когда желательна высокая доза в ткани-мишени или в органе-мишени. Для буккального введения активная композиция может быть представлена в форме таблеток или таблеток для рассасывания, приготовленных традиционным способом.
[0091] Вводимая дозировка будет зависеть от характера неврологического заболевания; типа хозяина, получающего лечение, включая его возраст, состояние здоровья и вес; типа сопутствующего лечения, если таковое имеется; частоты лечения и терапевтического индекса.
[0092] В качестве примера уровни дозировки вводимых активных ингредиентов составляют: внутривенно - от 0,1 до примерно 200 мг/кг; внутримышечно - от 1 до примерно 500 мг/кг; перорально - от 5 до примерно 1000 мг/кг; при интраназальных инсталляциях - от 5 до примерно 1000 мг/кг; и для аэрозоля - от 5 до примерно 1000 мг/кг массы тела хозяина.
[0093] В пересчете на концентрацию активный ингредиент может присутствовать в композиции согласно настоящему изобретению для применения местно на коже, интраназально, фаринго-ларингеально, бронхиально, интравагинально, ректально или через глаза в концентрации от примерно 0,01 до примерно 50% масс./масс. композиции; предпочтительно от примерно 1 до примерно 20% масс./масс. композиции; и для парентерального применения в концентрации от примерно 0,05 до примерно 50% масс./об. композиции и предпочтительно от примерно 5 до примерно 20% масс./об.
[0094] Композиции согласно настоящему изобретению предпочтительно представлены для введения людям и животным в виде единичных дозированных форм, таких как таблетки, капсулы, пилюли, порошки, гранулы, суппозитории, стерильные растворы или суспензии для парентерального введения, стерильные растворы суспензий для непарентерального введения и пероральные растворы или суспензии для перорального введения и тому подобное, содержащих подходящие количества активного ингредиента. Для перорального введения можно получить либо жидкие, либо твердые единичные дозированные формы.
[0095] Как обсуждалось выше, ядро таблетки содержит один или более гидрофильных полимеров. Подходящие гидрофильные полимеры включают, но не ограничиваются указанными, набухающие в воде производные целлюлозы, полиалкиленгликоли, термопластичные полиалкиленоксиды, акриловые полимеры, гидроколлоиды, глины, желирующие крахмалы, набухающие поперечно-сшитые полимеры и их смеси. Примеры подходящих набухающих в воде производных целлюлозы включают, но не ограничиваются указанными, карбоксиметилцеллюлозу натрия, поперечно-сшитую гидроксипропилцеллюлозу, гидроксипропилцеллюлозу (НРС), гидроксипропилметилцеллюлозу (НРМС), гидроксиизопропилцеллюлозу, гидроксибутилцеллюлозу, гидроксифенилцеллюлозу, гидроксиэтилцеллюлозу (НЕС), гидроксипентилцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу и гидроксипропилэтилцеллюлозу и их смеси. Примеры подходящих полиалкиленгликолей включают, но не ограничиваются указанными, полиэтиле нгликоль. Примеры подходящих термопластичных полиалкиленоксидов включают, но не ограничиваются указанными, поли(этилен оксид). Примеры подходящих акриловых полимеров включают, но не ограничиваются указанными, сополимер калий метакрилативинилбензола, полиметилметакрилат, поперечно-сшитые высокомолекулярные гомополимеры и сополимеры акриловой кислоты, такие как коммерчески доступные от компании Noveon Chemicals под товарным знаком CARBOPOL™. Примеры подходящих гидроколлоидов включают, но не ограничиваются указанными, альгинаты, агар, гуаровую камедь, камедь рожкового дерева, каппа-каррагинан, йота-каррагинан, тару, гуммиарабик, трагакант, пектин, ксантановую камедь, геллановую камедь, мальтодекстрин, галактоманнан, пусстулан, ламинарин, склероглюкан, гуммиарабик, инулин, пектин, желатин, велан, рамсан, зооглан, метилан, хитин, циклодекстрин, хитозан и их смеси. Примеры подходящих глин включают, но не ограничиваются указанными, смектиты, такие как бентонит, каолин и лапонит; магния трисиликат; магний алюминий силикат и их смеси. Примеры подходящих желирующих крахмалов включают, но не ограничиваются указанными, гидролизированные кислотой крахмалы, набухающие крахмалы, такие как натрий крахмал гликолят и его производные, и их смеси. Примеры подходящих набухающих поперечно-сшитых полимеров включают, но не ограничиваются указанными, поперечно-сшитый поливинилпирролидон, поперечно-сшитый агар и поперечно-сшитую натрий карбоксиметилцеллюлозу и их смеси.
[0096] Носитель может содержать одно или более подходящих для состава таблетки вспомогательных веществ. Примеры подходящих вспомогательных веществ включают, но не ограничиваются указанными, наполнители, адсорбенты, связующие вещества, разрыхлители, смазывающие вещества, глиданты, модифицирующие высвобождение вспомогательные вещества, суперразрыхлители, антиоксиданты и их смеси.
[0097] Подходящие связующие вещества включают, но не ограничиваются указанными, сухие связующие вещества, такие как поливинилпирролидон и гидроксипропилметилцеллюлоза; влажные связующие вещества, такие как водорастворимые полимеры, включая гидроколлоиды, такие как камедь, альгинаты, агар, гуаровую камедь, камедь бобов рожкового дерева, каррагинан, карбоксиметилцеллюлозу, тару, гуммиарабик, трагакант, пектин, ксантан, геллан, желатин, мальтодекстрин, галактоманнан, пусстулан, ламинарин, склероглюкан, инулин, велан, рамсан, зооглан, метилан, хитин, циклодекстрин, хитозан, поливинилпирролидон, целлюлозы, сахарозы и крахмалы и их смеси. Подходящие разрыхлители включают, но не ограничиваются указанными, натрий крахмал гликолят, поперечно-сшитый поливинилпирролидон, поперечно-сшитую карбоксиметилцеллюлозу, крахмалы, микрокристаллическую целлюлозу и их смеси.
[0098] Подходящие смазывающие вещества включают, но не ограничиваются указанными, длинноцепочечные жирные кислоты и их соли, такие как стеарат магния и стеариновая кислота, тальк, глицериды, воски и их смеси. Подходящие глиданты включают, но не ограничиваются указанным, коллоидный диоксид кремния. Подходящие модифицирующие высвобождение вспомогательные вещества включают, но не ограничиваются указанными, нерастворимые пищевые материалы, рН-зависимые полимеры и их смеси.
[0099] Подходящие нерастворимые пригодные в пищу вещества для применения в качестве модифицирующих высвобождение вспомогательных веществ, включают, но не ограничиваются указанными, нерастворимые в воде полимеры и гидрофобные вещества с низкой температурой плавления, их сополимеры и их смеси. Примеры подходящих нерастворимых в воде полимеров включают, но не ограничиваются указанными, этилцеллюлозу, поливиниловые спирты, поливинилацетат, поликапролактоны, ацетатцеллюлозу и ее производные, акрилаты, метакрилаты, сополимеры акриловой кислоты, их сополимеры и их смеси. Подходящие гидрофобные вещества с низкой температурой плавления включают, но не ограничиваются указанными, жиры, сложные эфиры жирных кислот, фосфолипиды, воски и их смеси. Примеры подходящих жиров включают, но не ограничиваются указанными, гидрогенизированные растительные масла, такие как, например, масло какао, гидрогенизированное пальмовое масло, гидрогенизированное хлопковое масло, гидрогенизированное подсолнечное масло и гидрогенизированное соевое масло, свободные жирные кислоты и их соли и их смеси. Примеры подходящих сложных эфиров жирных кислот включают, но не ограничиваются указанными, сложные эфиры сахарозы и жирных кислот, моно-, ди- и триглицериды, глицерилбегенат, глицерилпальмитостеарат, глицерилмоностерат, глицерилтристеарат, глицерилтрилаурилат, глицерилмиристат, ГликоВоск-932, лауроилмакрогол-32-глицериды, стеароилмакрогол-32-глицериды и их смеси. Примеры подходящих фосфолипидов включают фосфотидилхолин, фосфотидилсерен, фосфотидилэнозитол, фосфотидную кислоту и их смеси. Примеры подходящих восков включают, но не ограничиваются указанными, карнаубский воск, спермацетный воск, пчелиный воск, канделильский воск, шеллачный воск, микрокристаллический воск и парафиновый воск; жиросодержащие смеси, такие как шоколад, и их смеси. Примеры суперразрыхлителей включают, но не ограничиваются указанными, кроскармецеллюлозу натрия, натрий крахмал гликолят и поперечно-сшитый повидон (кросповидон). Согласно одному из вариантов реализации ядро таблетки содержит вплоть до примерно 5 процентов от своей массы такого суперразрыхлителя.
[00100] Примеры антиоксидантов включают, но не ограничиваются указанными, токоферолы, аскорбиновую кислоту, пиросульфит натрия, бутилгидрокситолуол, бутилир о ванный гидроксианизол, этилендиаминтетрауксусную кислоту и соли этилендиаминтетрауксусной кислоты, и их смеси. Примеры консервантов включают, но не ограничиваются указанными, лимонную кислоту, винную кислоту, молочную кислоту, яблочную кислоту, уксусную кислоту, бензойную кислоту и сорбиновую кислоту, и их смеси.
[00101] Согласно одному варианту реализации изобретения толщина покрытия с немедленным высвобождением составляет по меньшей мере 50 микрон, как, например, от примерно 50 микрон до примерно 2500 микрон; например, от примерно 250 микрон до примерно 1000 микрон. Согласно варианту реализации плотность покрытия с немедленным высвобождением обычно составляет примерно более 0,9 г/см3, что измеряют по массе и объему этого конкретного слоя.
[00102] Согласно одному варианту реализации покрытие с немедленным высвобождением содержит первую часть и вторую часть, при этом по меньшей мере одна из частей содержит второй фармацевтически активный агент. Согласно одному варианту реализации указанные части контактируют друг с другом по центральной оси таблетки. Согласно одному варианту реализации первая часть содержит первый фармацевтически активный агент, а вторая часть содержит второй фармацевтически активный агент.
[00103] Согласно одному варианту реализации первая часть содержит первый фармацевтически активный агент, а вторая часть второй фармацевтически активный агент. Согласно одному из вариантов реализации одна из частей содержит третий фармацевтически активный агент. Согласно одному из вариантов реализации одна из частей содержит вторую часть того же самого фармацевтически активного агента с немедленным высвобождением, который содержится и в ядре таблетки.
[00104] В одном из вариантов реализации внешнюю часть покрытия получают в виде сухой смеси веществ до добавления к покрытому оболочкой ядру таблетки. Согласно другому варианту реализации внешняя часть покрытия содержится в высушенном грануляте, содержащем фармацевтически активный агент.
[00105] Лекарственные формы с различными механизмами высвобождения лекарственного средства, описанными выше, можно объединить в конечную дозированную форму, содержащую одну или множественные единицы доз. Примеры множественных единиц доз включают многослойные таблетки, капсулы, содержащие таблетки, микроносители или гранулы в твердой или жидкой форме. Обычно лекарственные формы с немедленным высвобождением включают прессованные таблетки, гели, пленки, покрытия, жидкости и частицы, которые можно инкапсулировать, например, в желатиновую капсулу. Многие из способов получения покрытий, нанесения покрытий или включения лекарственных средств известны в данной области техники.
[00106] Дозировка с немедленным высвобождением, единица дозы дозированной формы, т.е. таблетка, множество микроносителей, гранул или частиц, содержащих лекарственное средство, или внешний слой дозированной формы с покрытым ядром содержат терапевтически эффективное количество активного агента с традиционными фармацевтическими вспомогательными веществами. Единица дозирования с немедленным высвобождением может содержать или не содержать покрытие, может быть или не быть смешана с единицей (или единицами) дозирования с отсроченным высвобождением (как в инкапсулированной смеси содержащих лекарственное средство гранул, частиц или микроносителей с немедленным высвобождением и содержащих лекарственное средство гранул или микроносителей с отсроченным высвобождением).
[00107] Лекарственные формы с продленным высвобождением в целом получают в виде диффузионных или осмотических систем, например, как это описано в «Remington-The Science and Practice of Pharmacy», 20th. Ed., Lippincott Williams &Wilkins, Baltimore, Md., 2000). Диффузионная система обычно состоит из одного из двух типов устройств, резервуара и матрицы, которые хорошо известны и описаны в области техники. Матричные устройства в целом получают путем прессования лекарственного средства с медленно растворяющимся полимерным носителем до формы таблетки.
[00108] Часть с немедленным высвобождением можно добавить к системе с продленным высвобождением путем либо нанесения слоя с немедленным высвобождением на поверхность ядра с продленным высвобождением, применяя способы для нанесения покрытия или прессования, либо применяя системы со множеством единиц доз, такие как капсулы, содержащие микроносители с немедленным и продленным высвобождением.
[00109] Лекарственные формы с отсроченным высвобождением получают, покрывая твердую лекарственную форму пленкой полимера, который нерастворим в кислой среде желудка, но растворим в нейтральной среде тонкого кишечника. Единицы дозирования с отсроченным высвобождением можно получить, например, путем покрытия лекарственного средства или содержащей лекарственное средство композиции выбранным материалом для покрытия. Указанная содержащая лекарственное средство композиция может представлять собой таблетку для включения в капсулу, таблетку для применения в качестве внутреннего «ядра» для дозированной формы с покрытым ядром или представлять собой множество содержащих лекарственное средство микроносителей, частиц или гранул для включения либо в таблетку, либо в капсулу.
[00110] Дозированная форма с импульсным высвобождением представляет собой форму, которая моделирует профиль многократного дозирования без повторного дозирования, и обычно позволяет по меньшей мере вдвое уменьшить частоту дозирования по сравнению с лекарственным средством, представленным в виде традиционной дозированной формы (например, в виде раствора или традиционной твердой дозированной формы с незамедлительным высвобождением). Профиль с импульсным высвобождением характеризуется периодом времени с отсутствием высвобождения (время задержки) или уменьшенным высвобождением, а затем быстрым высвобождением лекарственного средства.
[00111] Каждая дозированная форма содержит терапевтически эффективное количество активного агента. Согласно одному варианту реализации дозированных форм, которые моделируют график дозирования дважды в день, от приблизительно 30% масс. до 70% масс., предпочтительно от 40% масс. до 60% масс., от общего количества активного агента в дозированной форме высвобождается при начальном выбросе, и соответственно от приблизительно 70% масс. до 3,0% масс., предпочтительно от 60% масс. до 40% масс. от общего количества активного агента в дозированной форме высвобождается при втором выбросе. Для дозированных форм, моделирующих график дозирования дважды в день, второй выброс предпочтительно происходит через приблизительно от 3 до менее чем 14 часов, и более предпочтительно через приблизительно 5-12 часов после введения.
[00112] Другая дозированная форма включает прессованную таблетку или капсулу, содержащую единицу дозирования с лекарственным средством с немедленным высвобождением, единицу дозирования с отсроченным высвобождением и необязательно вторую единицу дозирования с отсроченным высвобождением. В таких дозированных формах единица дозирования с немедленным высвобождением содержит множество микроносителей, гранул или частиц, которые высвобождают лекарственное средство по существу сразу же после перорального введения, обеспечивая начальную дозу. Единица дозирования с отсроченным высвобождением содержит множество микроносителей или гранул, покрытых оболочкой, которые высвобождают лекарственное средство через приблизительно 3-14 часов после перорального введения, обеспечивая вторую дозу.
[00113] Для целей трансдермального (например, местного) применения могут быть приготовлены разбавленные стерильные водные или частично водные растворы (обычно в концентрации приблизительно от 0,1% до 5%), в остальном совпадающую с указанными выше парентеральными растворами.
[00114] Способы получения различных фармацевтических композиций, содержащих определенное количество одного или более соединений формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV или другие активные агенты, известны или будут очевидны специалистам в области техники в свете раскрытия настоящего изобретения. Примеры способов получения фармацевтических композиций можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 19th Edition (1995).
[00115] Кроме того, согласно определенным вариантам реализации заявленные композиции согласно настоящей заявке могут быть лиофилизированы или подвергнуты сушке с помощью другой подходящей методики, такой как распылительная сушка. Заявленные композиции могут быть введены однократно или разделены на несколько меньших доз для введения через различные интервалы времени в частичной зависимости от скорости высвобождения композиций и желательной дозировки.
[00116] Лекарственные формы, подходящие для применения в способах, предложенных в настоящей заявке, включают лекарственные формы, подходящие для перорального, назального, местного (включая буккальное и сублингвальное), ректального, вагинального введения, введения в виде аэрозоля и/или парентерального введения. Указанные лекарственные формы для удобства могут быть представлены в виде единичной дозированной формы и могут быть получены любыми способами, хорошо известными в области фармацевтики. Количество заявленной композиции, которое может быть скомбинировано с носителем для получения одной дозы, может варьироваться в зависимости от субъекта, которого лечат, и конкретного пути введения.
[00117] Способы получения указанных лекарственных форм или композиций включают стадию объединения заявленной композиции с носителем и необязательно с одним или более дополнительных ингредиентов. В целом лекарственные формы получают путем равномерного и тесного объединения заявленной композиции с жидкими носителями или мелкоизмельченными твердыми носителями или с ними обоими, и затем, при необходимости, формирования продукта.
[00118] Соединения формулы I, формулы II, формулы III, формулы IV, формулы V, формулы VI, формулы VII, формулы VIII, формулы IX, формулы X, формулы XI, формулы XII, формулы XIII, формулы XIV или формулы XV, описанные в настоящей заявке, могут быть введены в виде ингаляционных или аэрозольных лекарственных форм. Указанные ингаляционные и аэрозольные лекарственные формы могут содержать один или более активных агентов, таких как адъюванты, диагностические агенты, агенты для визуализации или терапевтические агенты, подходящие для ингаляционной терапии. Конечная аэрозольная лекарственная форма может, например, содержать 0,005-90% масс./масс., например, 0,005-50%, 0,005-5% масс./масс. или 0,01-1,0% масс./масс., лекарственного средства от общей массы состава.
[00119] В твердых дозированных формах для перорального применения (капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.п.), заявленная композиция находится в смеси с одним или более фармацевтически приемлемыми наполнителями и/или любым из следующего: (1) наполнителей или удешевляющих добавок, таких как крахмалы, лактоза, сахароза, глюкоза, маннитол и/или кремниевая кислота; (2) связующих веществ, таких как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажнителей, таких как глицерин; (4) разрыхлителей, таких как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые диоксиды кремния и карбонат натрия; (5) замедляющих растворение агентов, таких как парафин; (6) веществ, ускоряющих адсорбцию, таких как соединения четвертичного аммония; (7) смачивающих агентов, таких как, например, ацетиловый спирт и моностеарат глицерина; (8) адсорбентов, таких как каолин и бентонитовая глина; (9) смазывающих веществ, таких как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) красителей. В случае капсул, таблеток и пилюль, указанные фармацевтические композиции могут также содержать забуферивающие агенты. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах, применяя лактозу или молочные сахара, а также полиэтиленгликоли с высокой молекулярной массой и тому подобное.
[00120] Жидкие дозированные формы для перорального применения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо заявленных композиций указанные жидкие дозированные формы могут содержать инертные разбавители, традиционно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, кукурузное, арахисовое, подсолнечное, соевое, оливковое, касторовое и кунжутные масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси.
[00121] Суспензии в дополнение к заявленным композициям могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтилен сорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и их смеси.
[00122] Лекарственные формы для ректального или вагинального применения могут представлять собой суппозитории, которые могут быть получены путем смешивания заявленной композиции с одним или более подходящими носителями, не вызывающими раздражения, включающими, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, причем указанные суппозитории являются твердыми при комнатной температуре, но при температуре тела становятся жидкими и, таким образом, плавятся в соответствующей полости тела и высвобождают инкапсулированные соединение(я) и композицию(и). Лекарственные формы, подходящие для вагинального применения, также включают пессарии, тампоны, кремы, гели, пасты, пены или лекарственные формы в виде спрея, содержащие носители, которые известны в области техники как подходящие.
[00123] Дозированные формы для транс дермального применения включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. Заявленная композиция может быть смешана в стерильных условиях с фармацевтически приемлемым носителем и любыми консервантами, буферами или пропеллентами, которые могут потребоваться. Указанные комплексы для трансдермального применения могут включать липофильные и гидрофильные группы для достижения желаемых растворимости в воде и транспортных свойств.
[00124] Мази, пасты, кремы и гели в дополнение к заявленным композициям могут содержать другие носители, такие как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка, или их смеси. Порошки и спреи в дополнение к заявленным композициям могут содержать вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок, или смеси указанных соединений. Спреи дополнительно могут содержать общепринятые пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
[00125] В области техники известны способы доставки композиции или композиций с помощью трансдермальных пластырей. Примеры пластырей и способов доставки с помощью пластырей описаны в патентах США No. 6,974,588, 6,564,093, 6,312,716, 6,440,454, 6,267,983, 6,239,180, и 6,103,275.
[00126] Согласно другому варианту реализации изобретения трансдермальный пластырь может содержать: лист подложки, содержащий композитную пленку, сформированную из композиции смолы, содержащей 100 масс. частей поливинилхлорид-полиуретанового композита и 2-10 масс. частей стирол-этилен-бутилен-стирольного сополимера, первый адгезивный слой с одной стороны из композитной пленки и полиалкилентерефталатной пленки, приклеенной к одной стороне композитной пленки с помощью первого адгезивного слоя, первичный слой, который содержит насыщенную полиэфирную смолу и сформирован на поверхности полиалкилентерефталатной пленки; и второй адгезивный слой, содержащий блок-сополимер стирол-диен-стирол, содержащий фармацевтический агент, нанесенный на первичный слой. Способ изготовления упомянутого выше листа подложки включает приготовление указанной выше композиции смолы, формование композиции смолы в композитную пленку согласно календарному методу, и затем прикрепление полиалкилентерефталатной пленки на поверхность указанной композитной пленки с одной стороны при помощи адгезивного слоя, тем самым образуется указанный лист подложки для субстрата и формируется первичный слой, со держащий насыщенную полиэфирную смолу на внешней поверхности указанной полиалкилентерефталатной пленки.
[00127] Другой тип пластырей содержит включение лекарственного средства непосредственно в фармацевтически приемлемое связывающее вещество и ламинирование указанного содержащего лекарственное средство связывающего вещества на подходящем поддерживающем элементе, например, на полиэфирной поддерживающей мембране. Лекарственное средство должно присутствовать в концентрации, которая не будет влиять на адгезивные свойства, и в тоже время доставлять требуемую терапевтическую дозу.
[00128] Трансдермальные пластыри могут быть пассивными или активными. Доступные в настоящее время пассивные Трансдермальные системы для доставки лекарственных средств, такие как никотиновые, эстрогеновые и нитроглицериновые пластыри, доставляют лекарственные средства, представляющие собой малые молекулы. Многие из разработанных в последнее время белковых и пептидных лекарственных средств являются слишком большими для доставки с помощью пассивных тренсдермальных пластырей и могут быть доставлены с помощью таких технологий, как технология электрического сопровождения (ионтофорез) для лекарственных средств, представляющих собой макромолекулы.
[00129] Ионтофорез представляет собой метод, используемый для усиления потока ионизированных веществ через мембраны при применении электрического тока. Один пример мембраны для ионтофореза приведен в патенте США №5080646 Theeuwes. Основными механизмами, при помощи которых ионтофорез усиливает транспортировку молекул через кожу, являются (а) отталкивание заряженного иона от электрода с таким же зарядом, (b) электроосмос, конвективное движение растворителя, которое происходит в заряженной поре в ответ на преимущественное прохождение противоионов при воздействии электрического поля, или (с) увеличение проницаемости кожи вследствие применения электрического тока.
[00130] В некоторых случаях может быть желательным введение в форме набора, который может включать емкость для содержания отдельных композиций, такую как порциальный флакон или порциальный фольгированный пакет. Обычно указанный набор содержит инструкции для применения отдельных компонентов. Форма набора особенно эффективна, когда отдельные компоненты предпочтительно вводить в виде различных дозированных форм (например, пероральных и парентеральных), с различными интервалами дозирования, или когда титр отдельных компонентов комбинации задается лечащим врачом.
[00131] Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной промышленности и широко применяются для упаковки фармацевтических единичных дозированных форм (таблеток, капсул и т.п.). Блистерные упаковки обычно состоят из листа относительно жесткого материала, покрытого фольгой из пластикового материала, который может быть прозрачным.
[00132] Способы и композиции для лечения синдрома раздраженного кишечника. Помимо прочего в настоящем изобретении предложен способ лечения синдрома раздраженного кишечника, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения Формулы I:
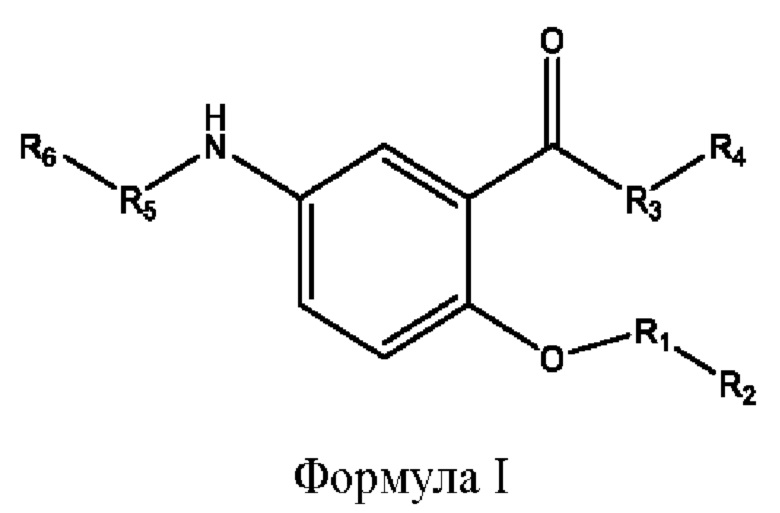
и его фармацевтически приемлемых солей, гидратов, сольватов, пролекарств, энантиомеров и стереоизомеров;
[00133] Где,
каждый R1, R3, R5 независимо представляет собой Н, D, CH3CO-, CH3, CD3CO-, отсутствует, или представляет собой
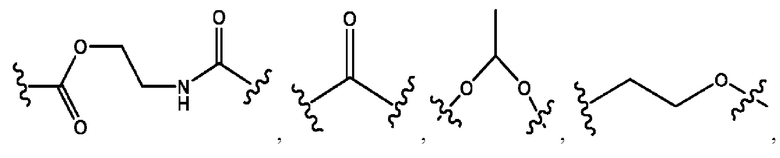
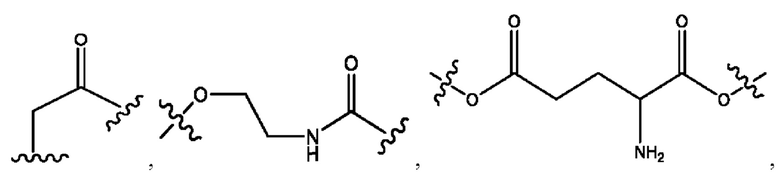
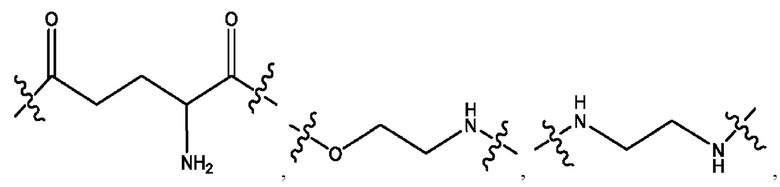
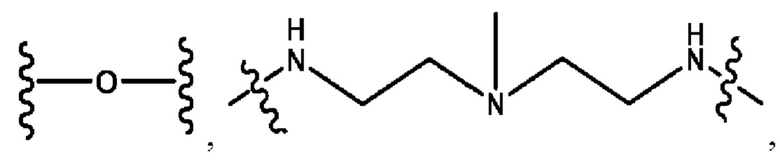
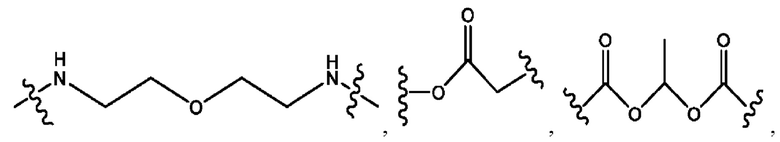
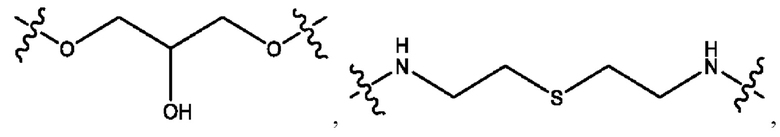
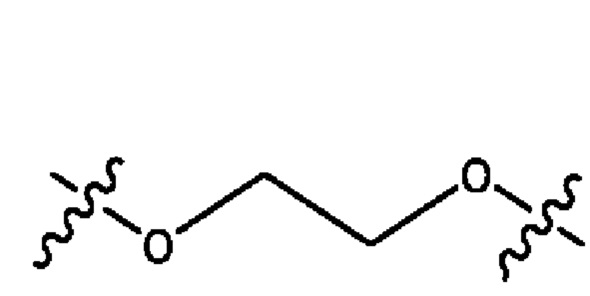 или
или 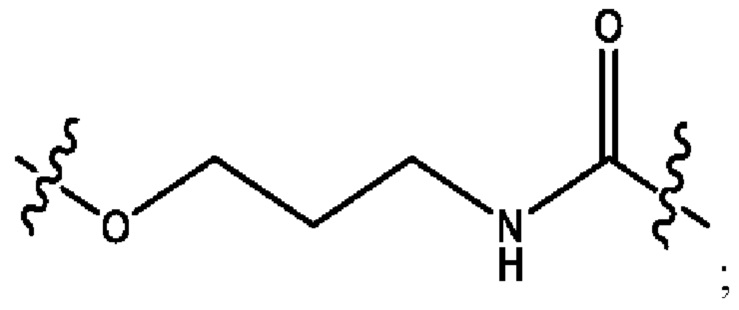
каждый R2, R4, R6 независимо представляет собой
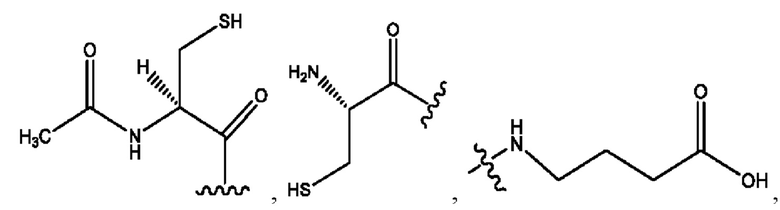
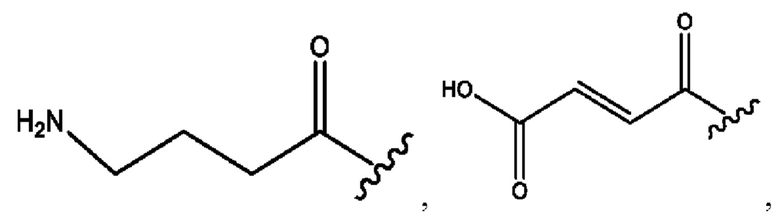
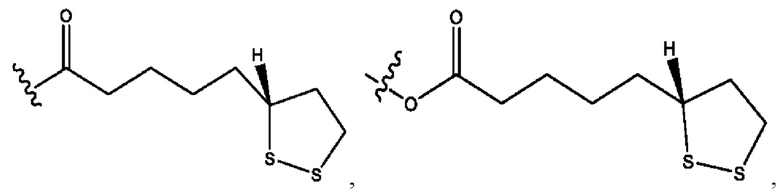
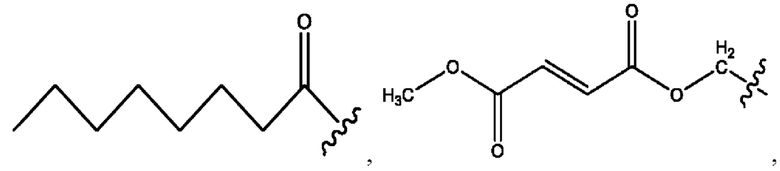
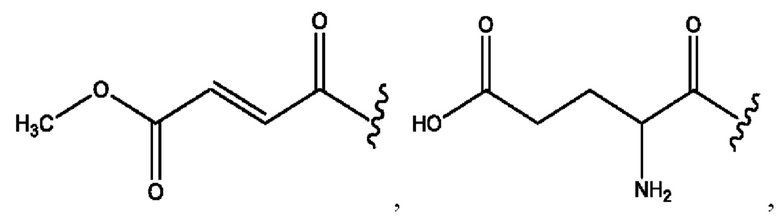
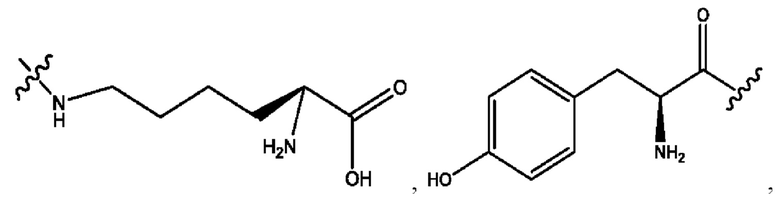
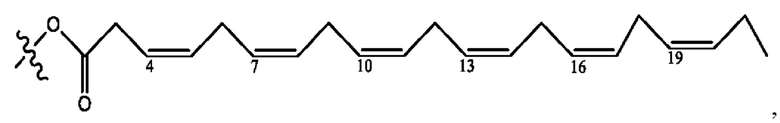
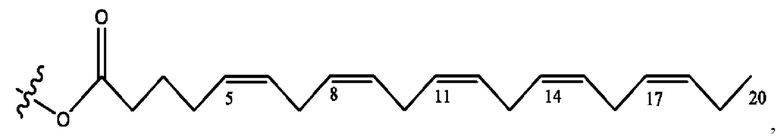
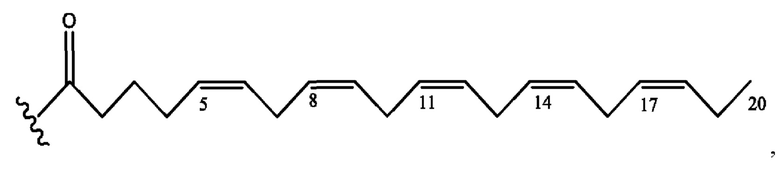
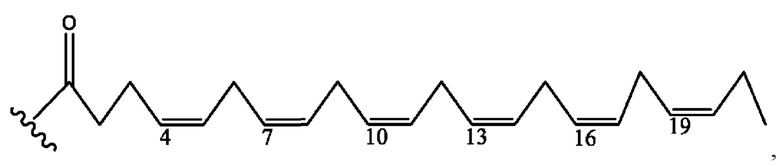
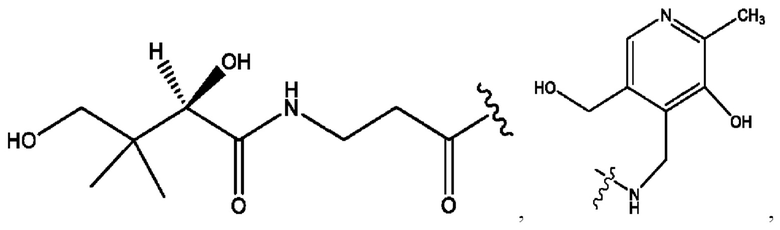
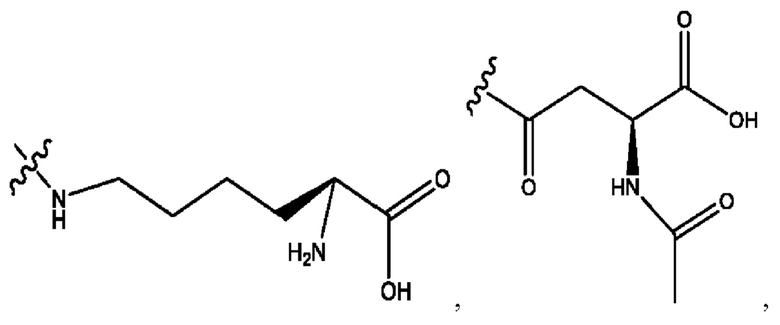
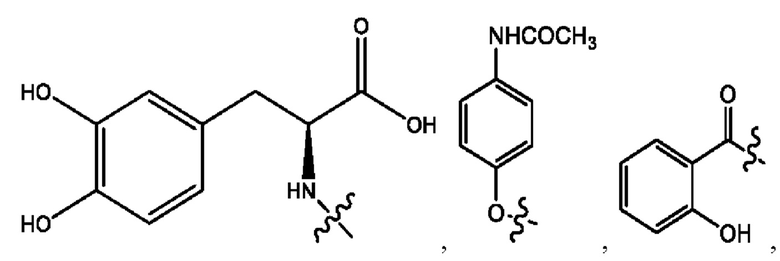
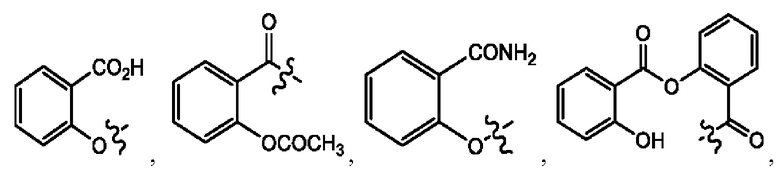
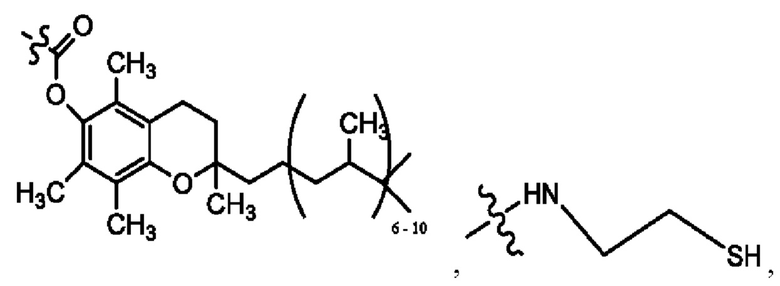
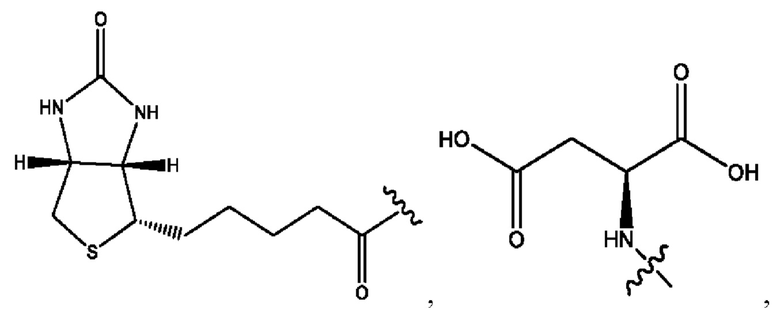
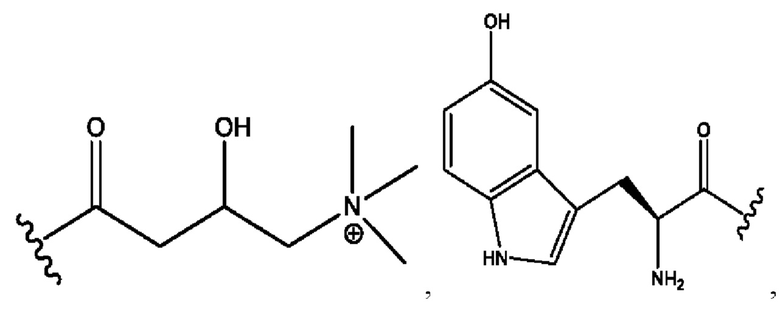
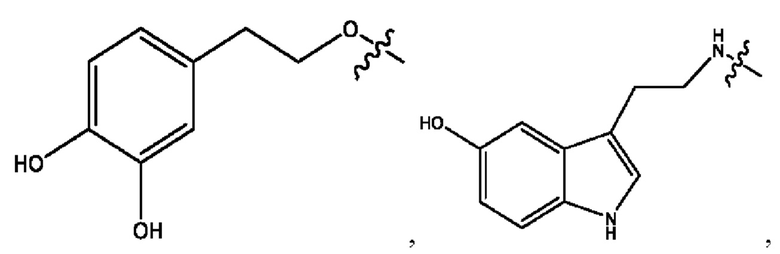
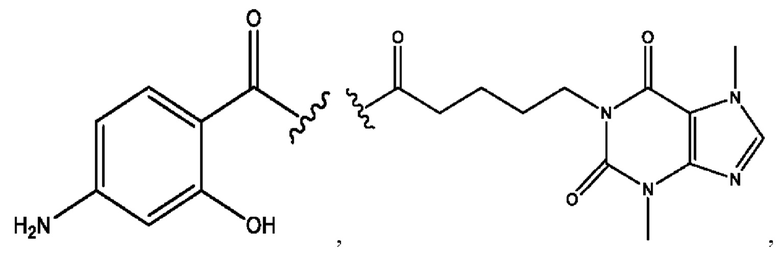
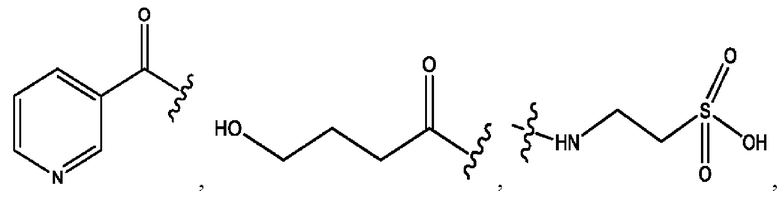
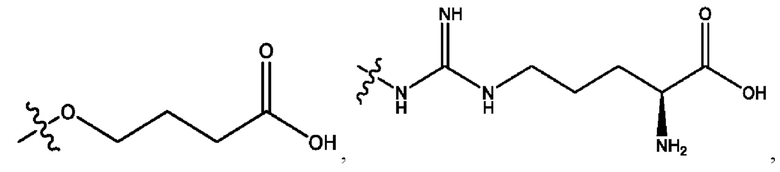
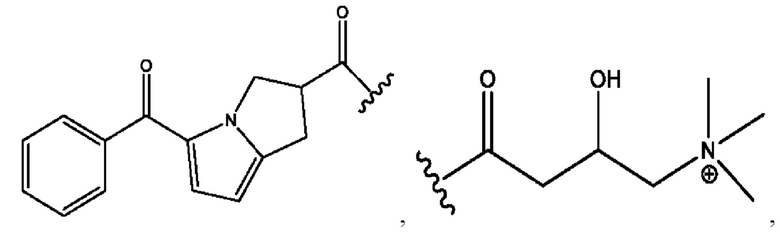
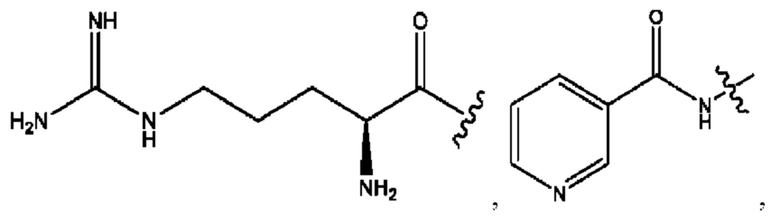
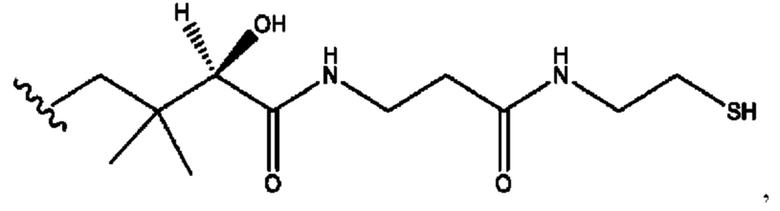
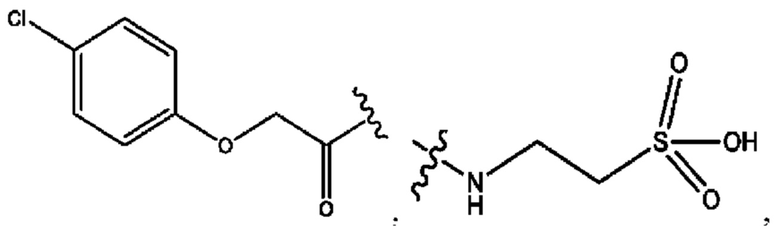
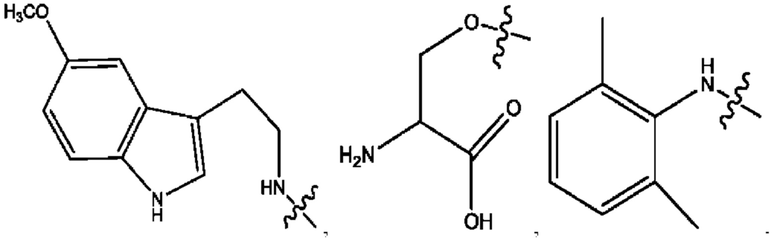
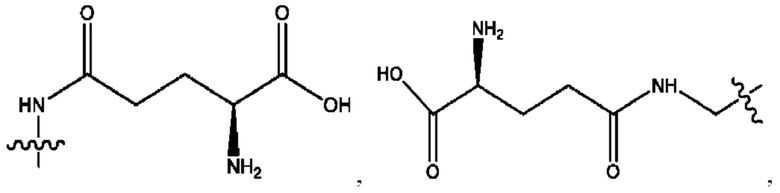
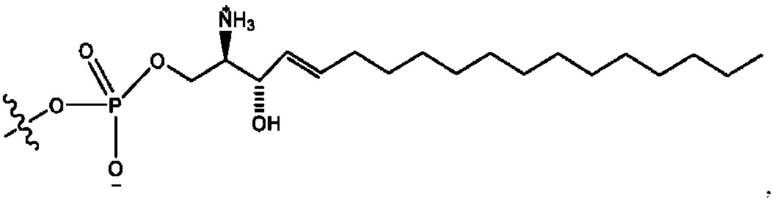
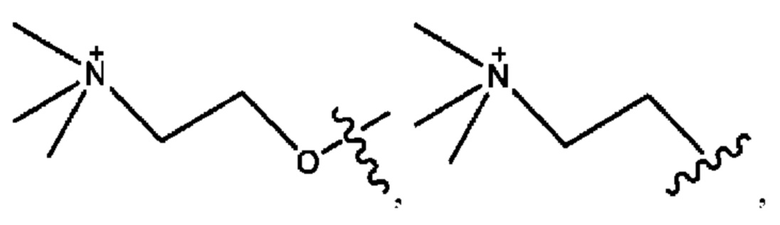
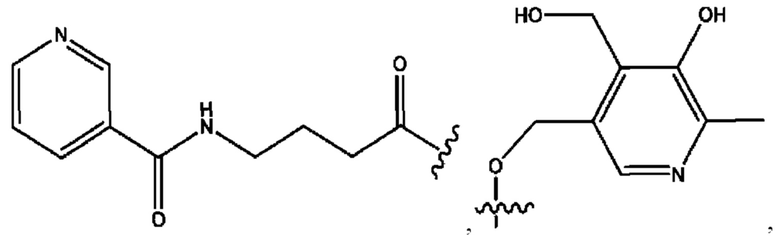
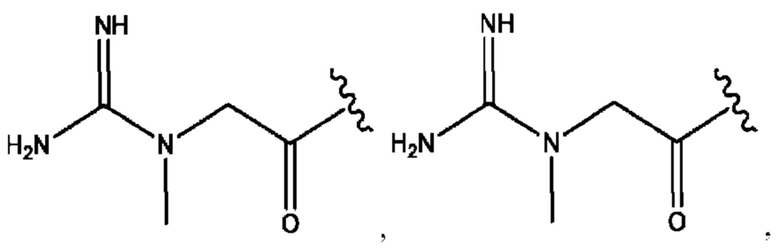
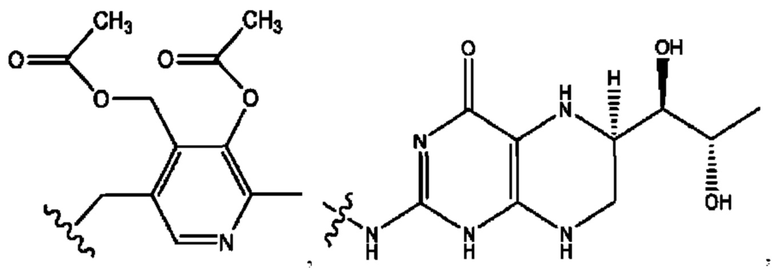
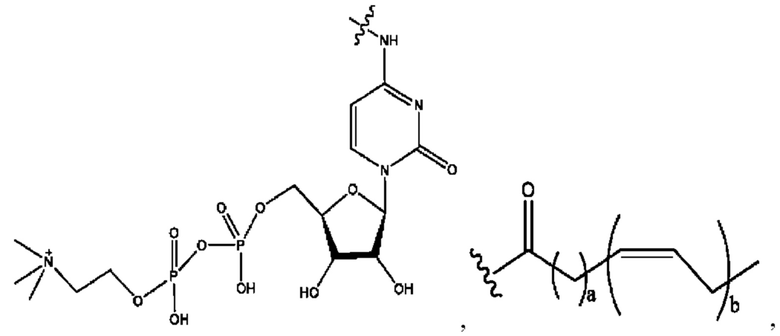
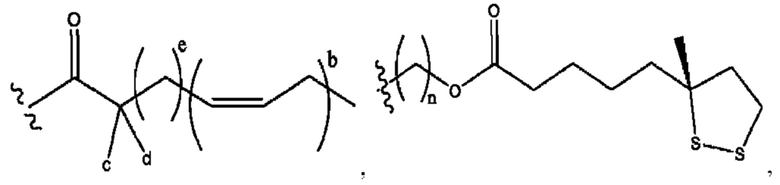
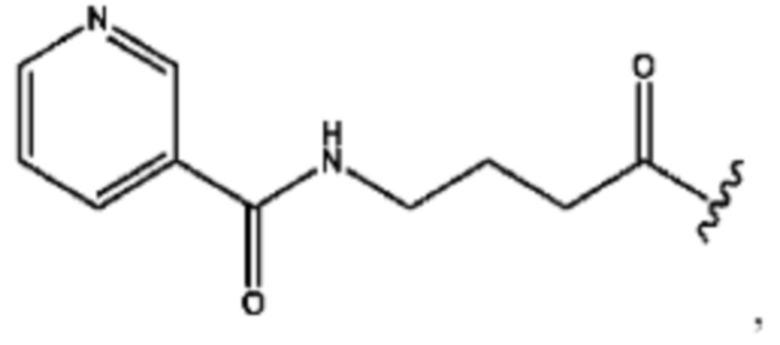
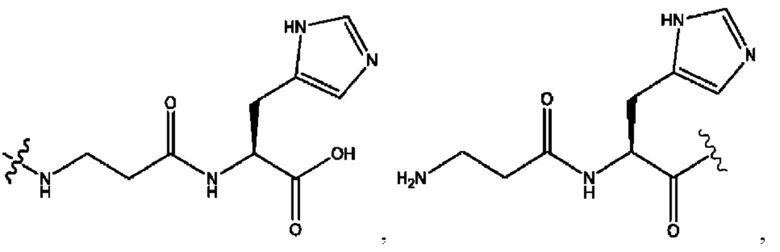
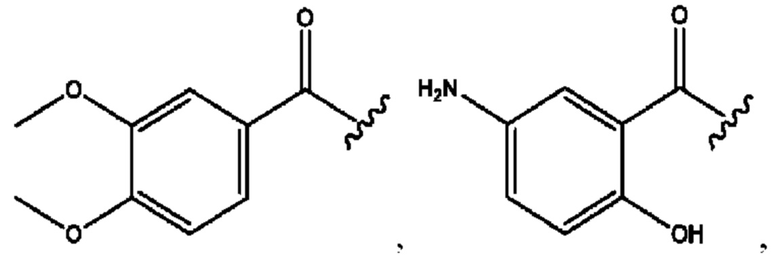
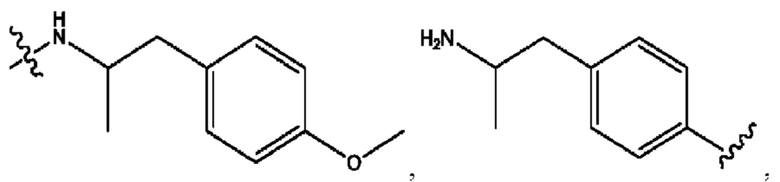
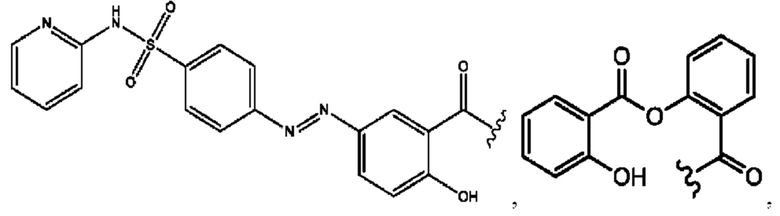
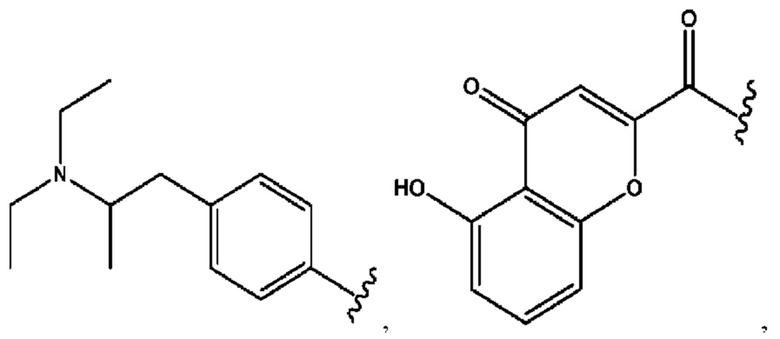
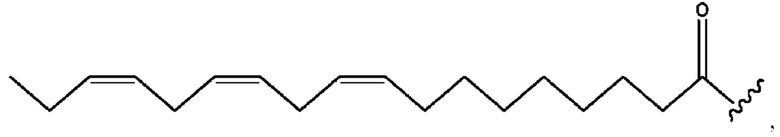
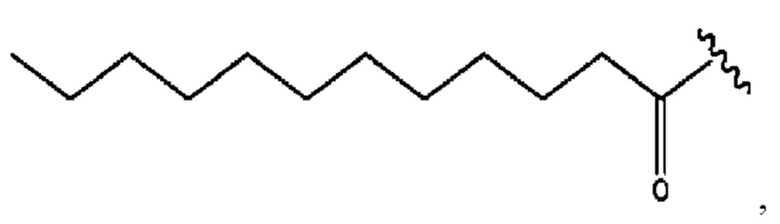
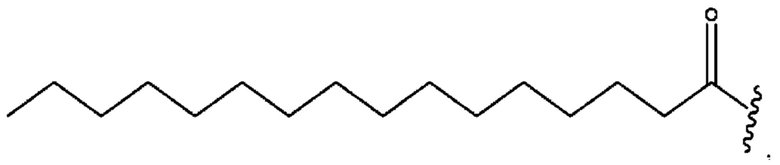
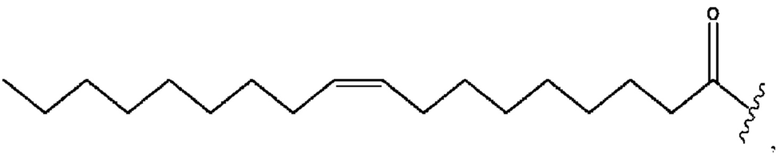
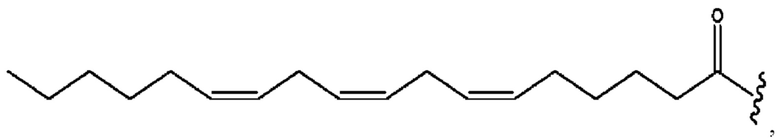

n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляют собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3.
[00134] Способы и композиции для лечения синдрома раздраженного кишечника. Среди прочего в настоящей заявке предложен способ лечения синдрома раздраженного кишечника, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения Формулы II:
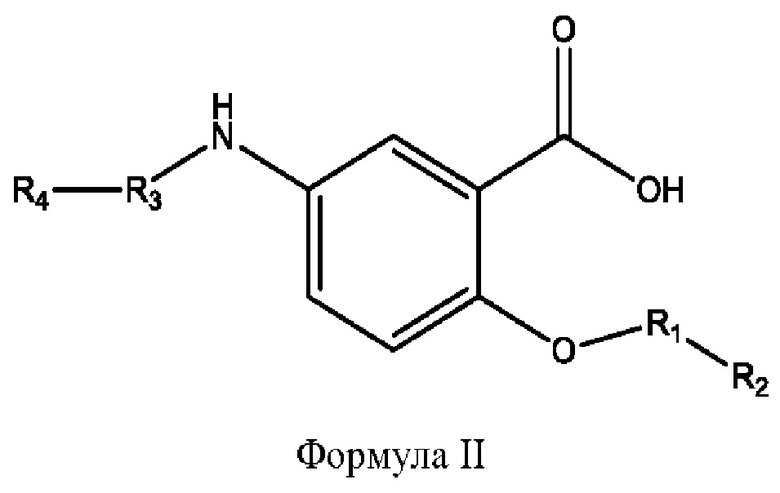
и его фармацевтически приемлемых солей, гидратов, сольватов, пролекарств, энантиомеров и стереоизомеров;
[00135] Где,
каждый R1, R3 независимо представляет собой Н, D, СН3СО-, СН3, CD3CO-, отсутствует, или представляет собой
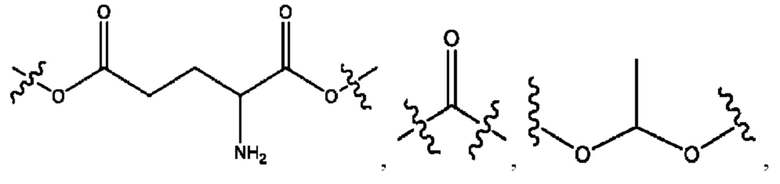
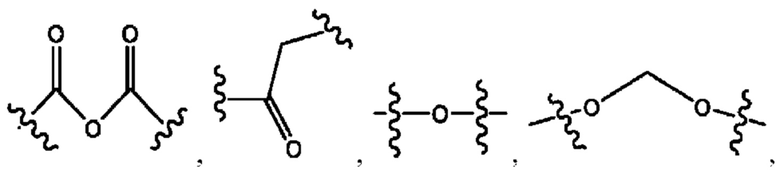
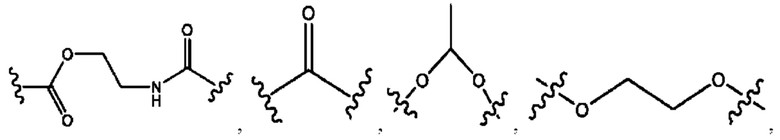
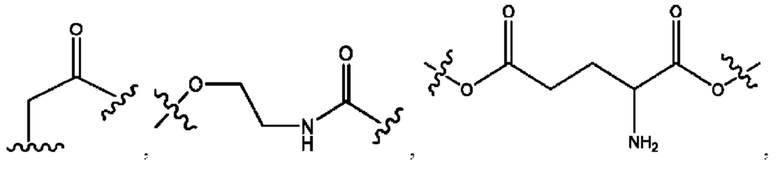
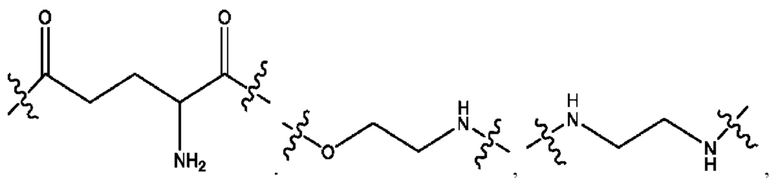
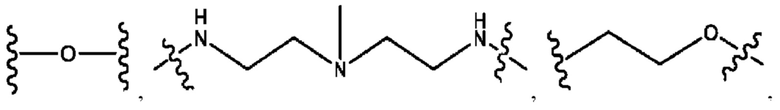
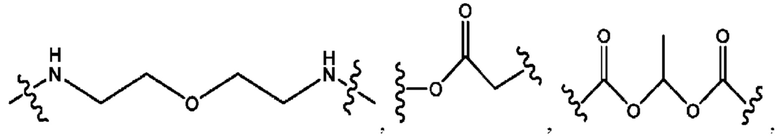
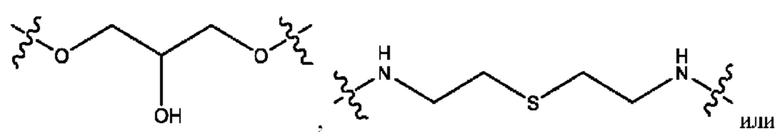
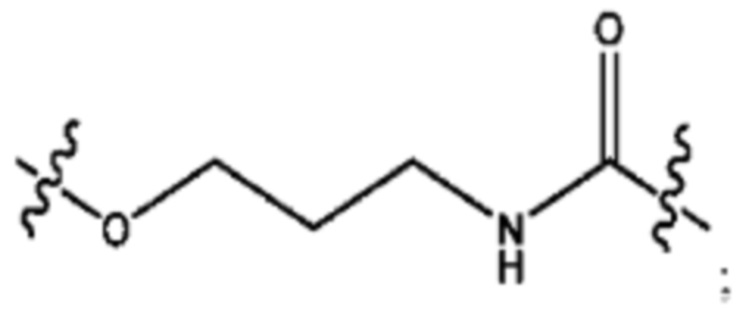
каждый R2, R4 независимо представляет собой D, OD,
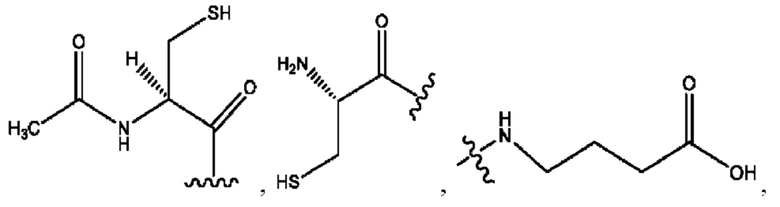
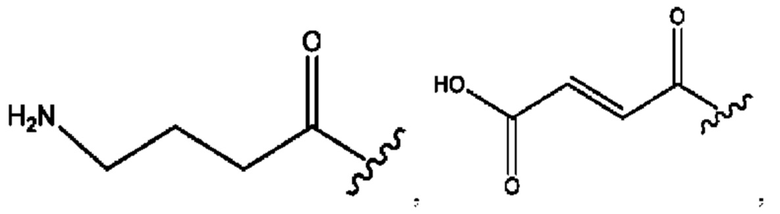
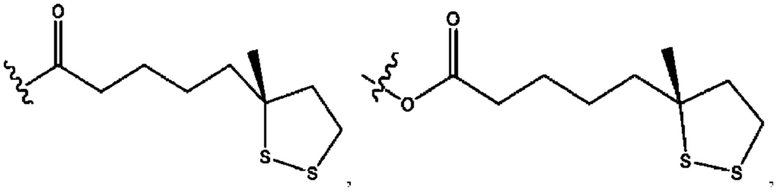
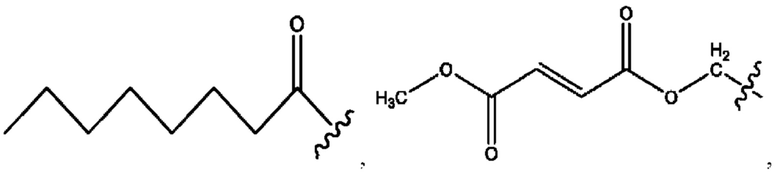
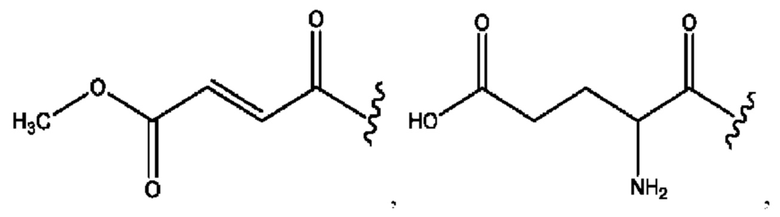
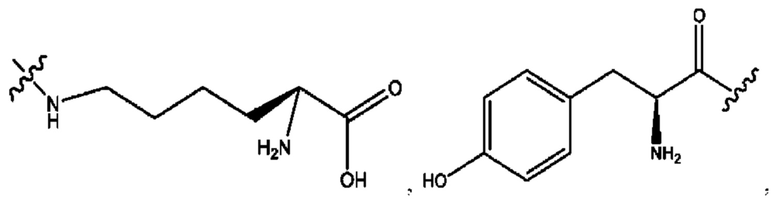
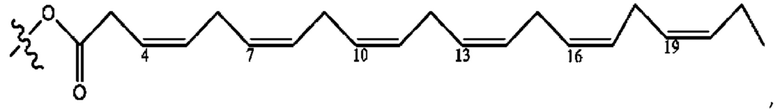
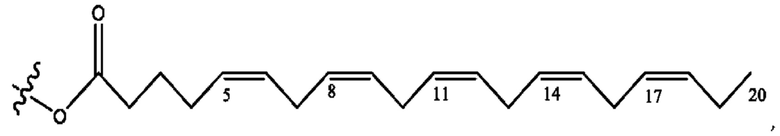
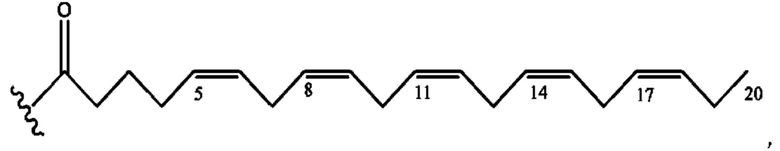
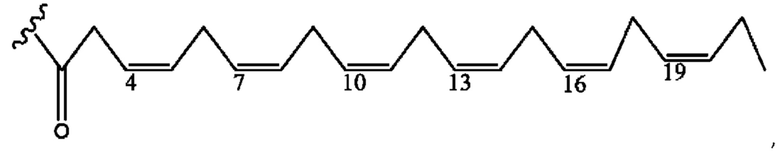
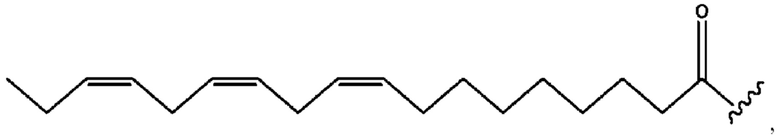
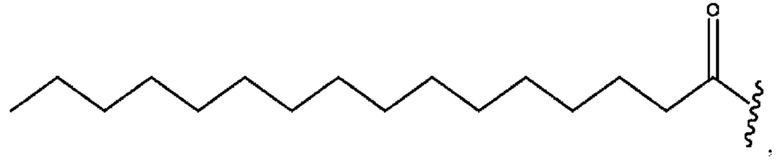

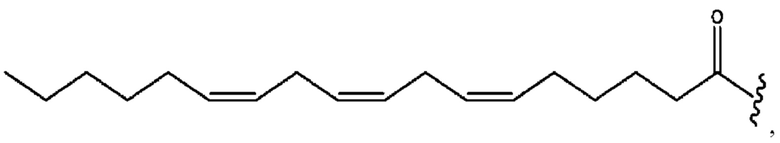
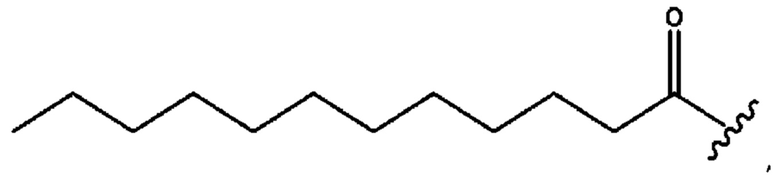
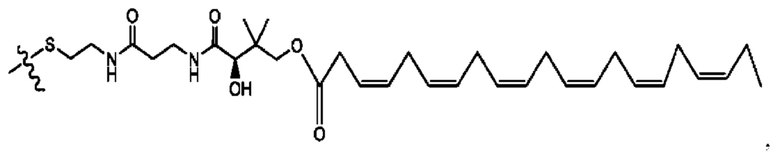
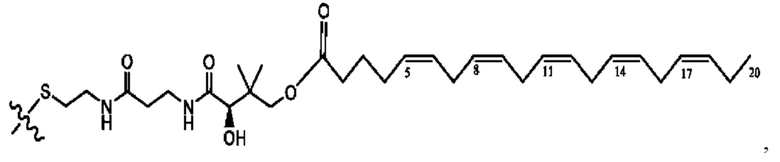
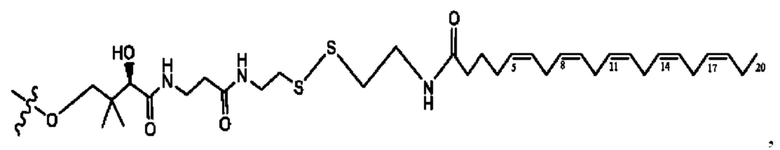
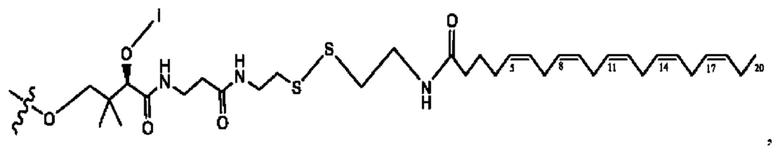
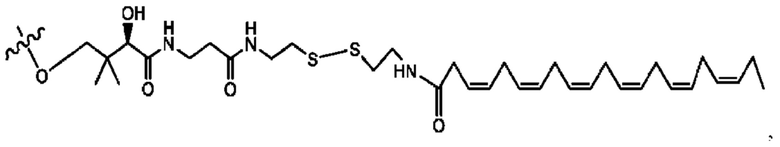
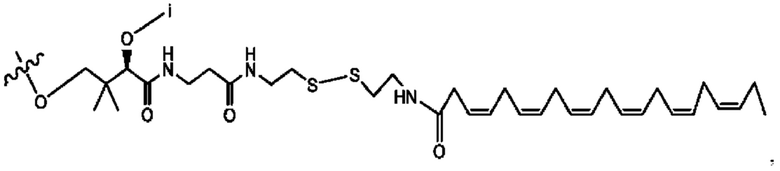
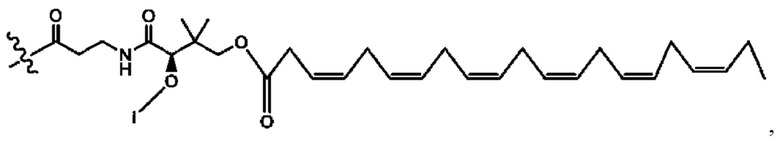
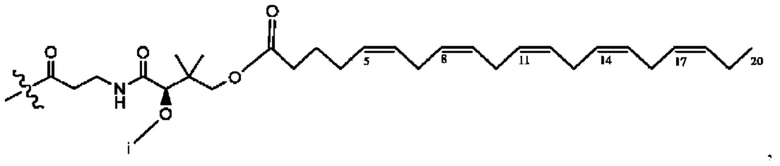
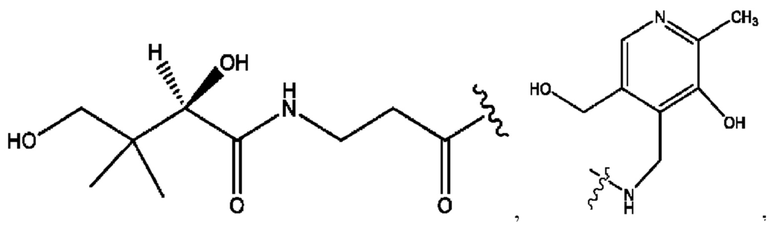
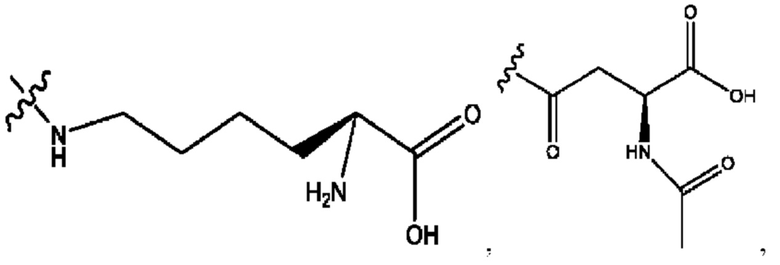
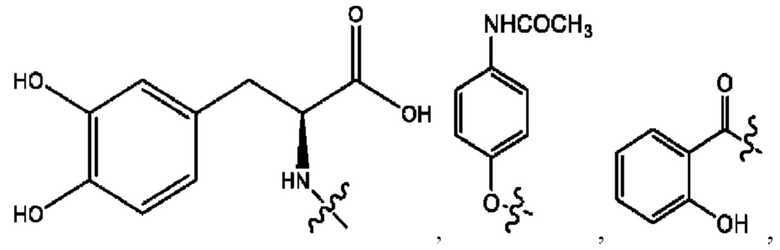
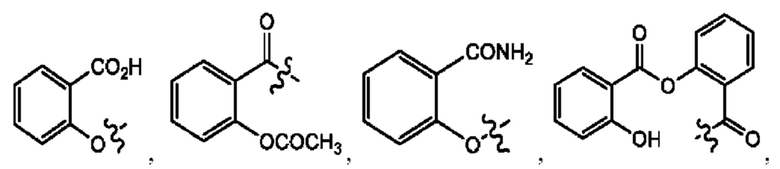
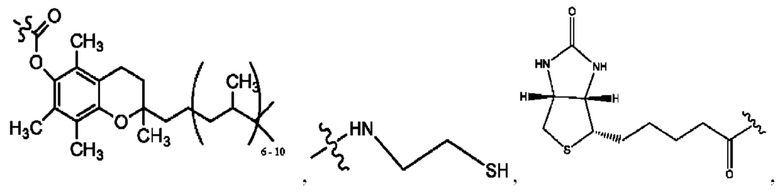
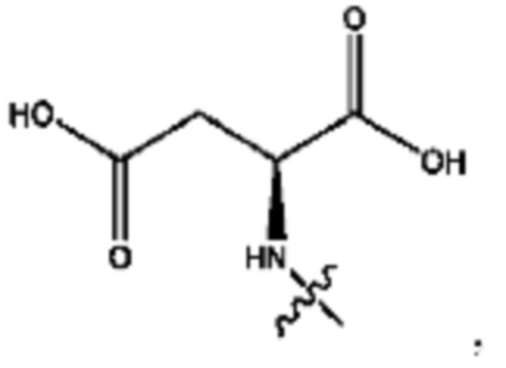
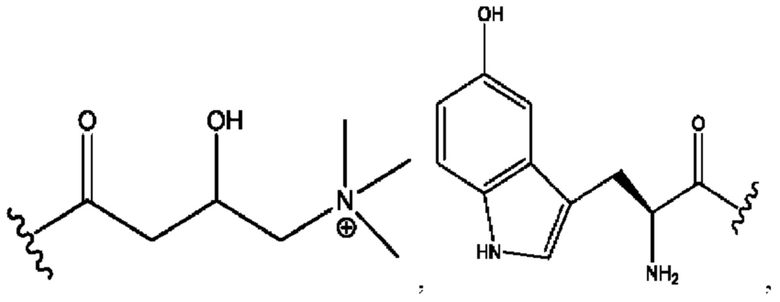
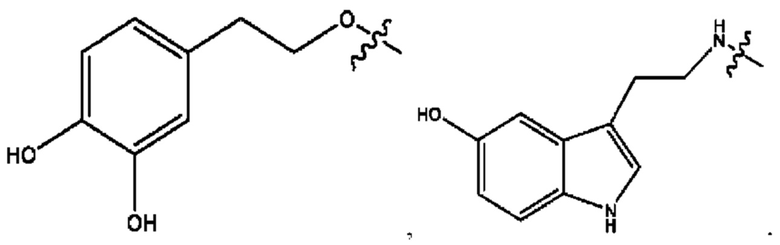
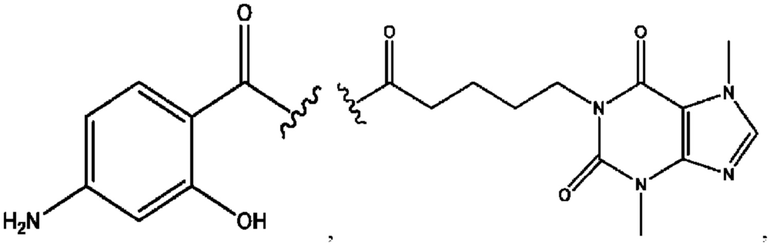
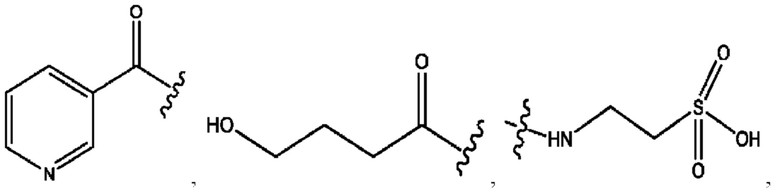
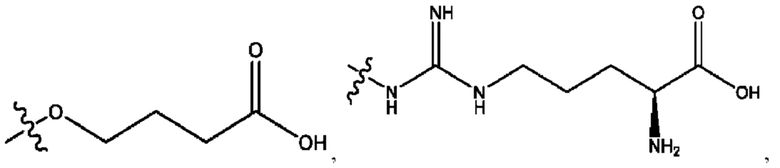
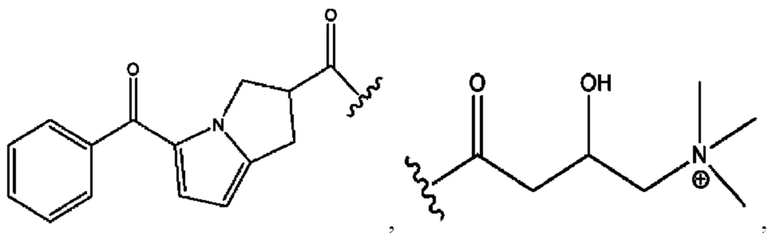
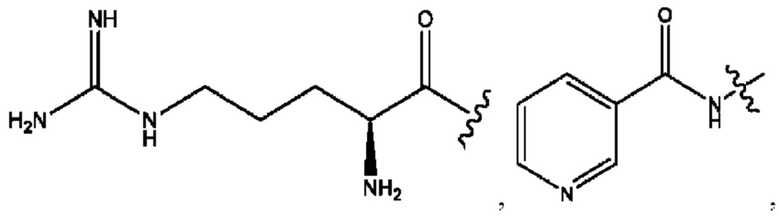
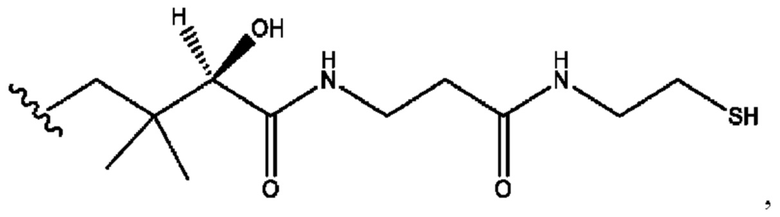
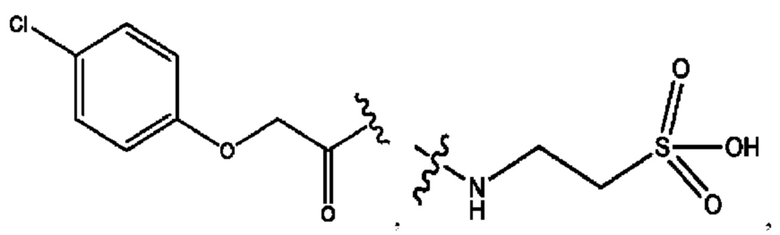
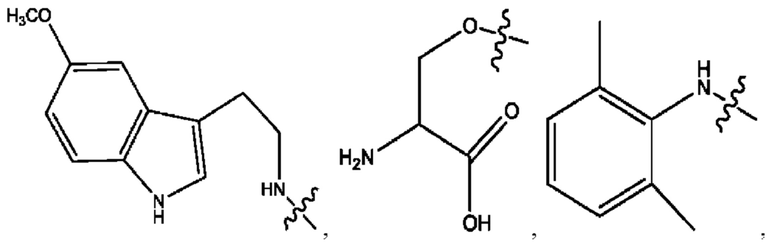
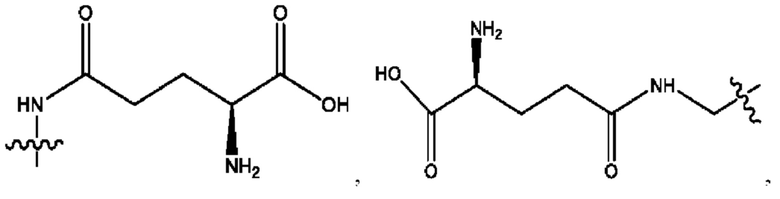
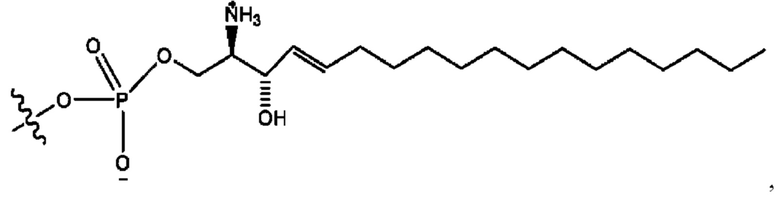
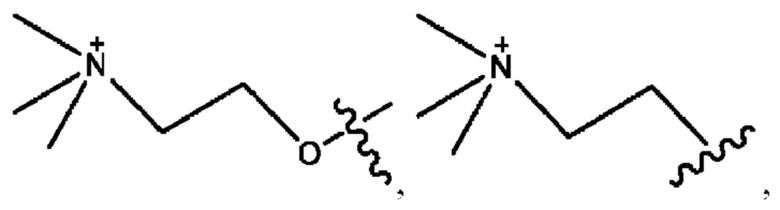
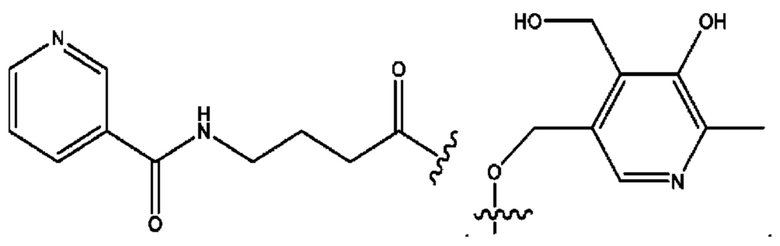
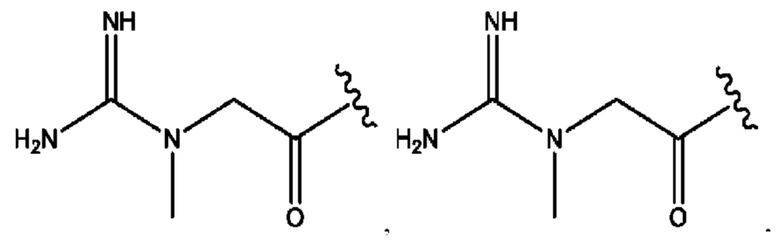
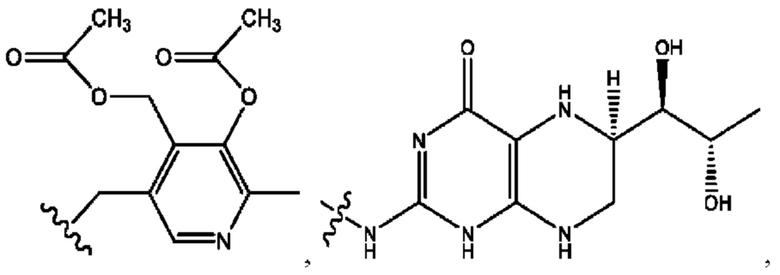
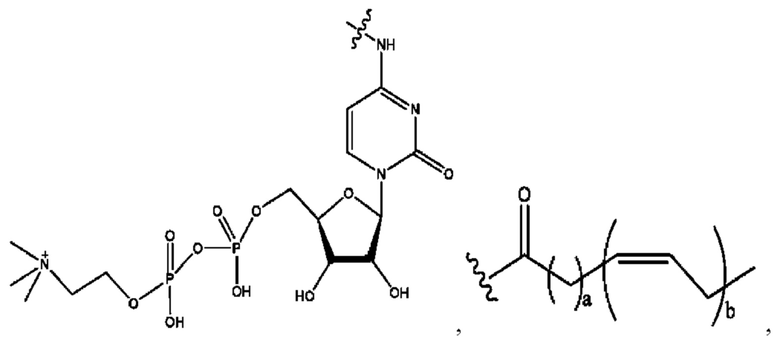
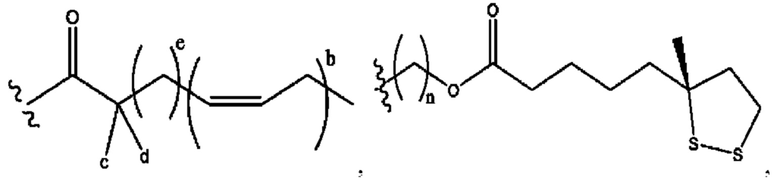
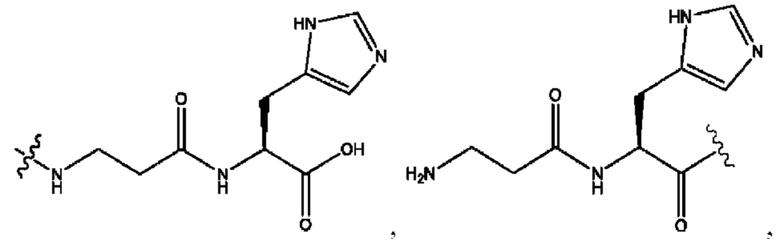
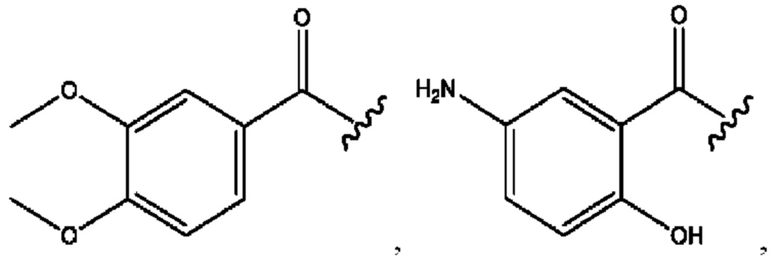
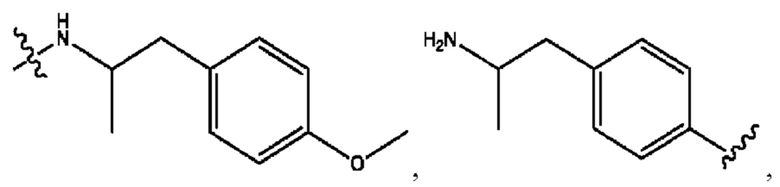
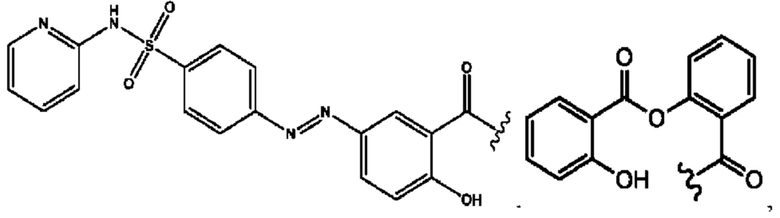
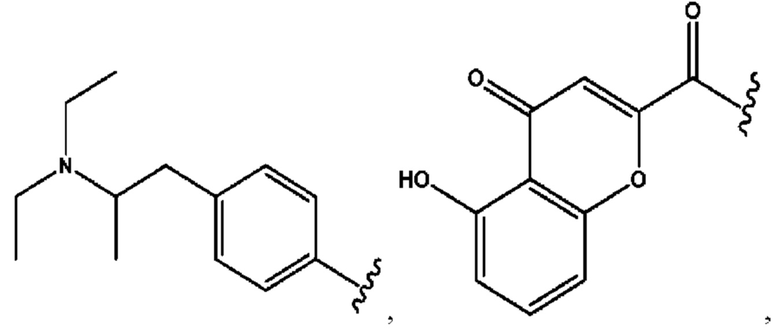

n независимо равен 1, 2, 3, 4 или 5;
а независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
е независимо равен 1, 2 или 6;
каждый c и d независимо представляет собой Н, D, -ОН, -OD, C1-С6-алкил, -NH2 или -СОСН3;
при условии присутствия
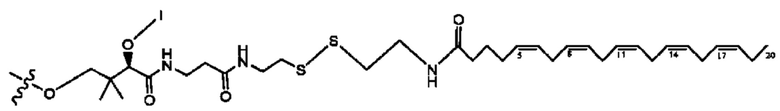
каждый i независимо представляет собой
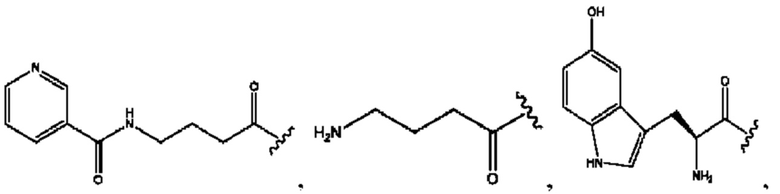
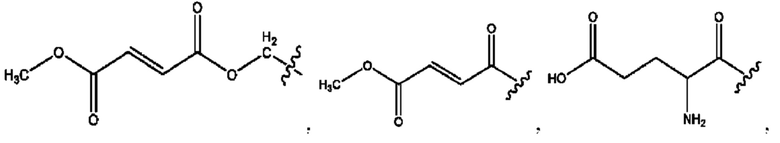
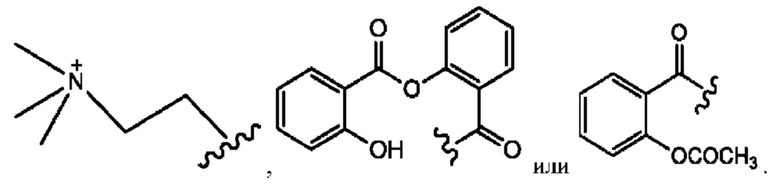
СПОСОБЫ ПОЛУЧЕНИЯ
[00136] Примеры путей синтеза, подходящих для получения соединений формулы I и формулы II представлены в примере ниже и обобщены в схеме 1, схеме 2 и схеме 3, соответственно:
Схема-1:
Получение 1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата (CLX-SYN-G3-C04)
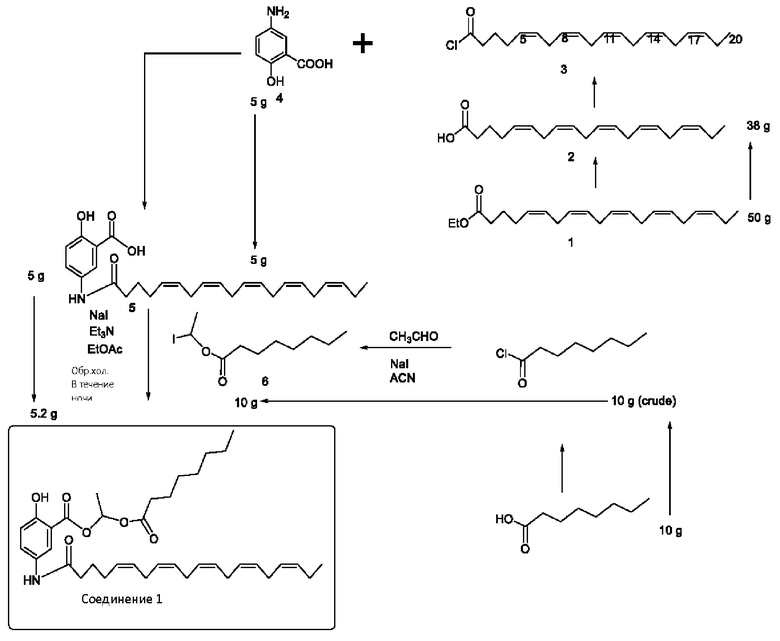
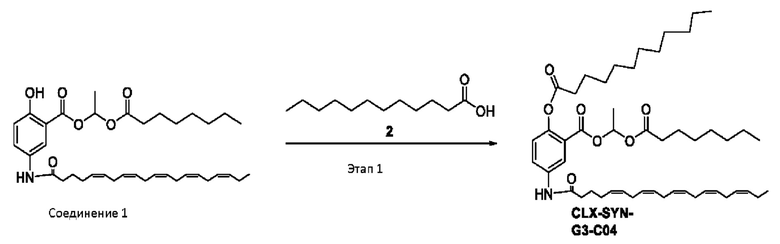
Получение соединения 2 [(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеновая кислота]:
Методика:
(5Z,8Z,11Z,14Z,17Z)-этил икоза-5,8,11,14,17-пентаеноат (1, 50 г, 0,151 моль) растворяли в метаноле (1000 мл) и добавляли водный раствор NaOH (60,5 г, 1,513 моль, 200 мл H2O). Затем реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции летучие соединения выпаривали при пониженном давлении на роторном вакуумном испарителе. Полученное неочищенное вещество разбавляли водой (200 мл) и подкисляли 3N HCI, экстрагировали этилацетатом (2×300 мл). Объединенные органические экстракты промывали солевым раствором (2×100 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухости. Методом очистки на силикагеле (20% EtOAc в гексане) получали соединение 2 (38 г, выход 83,12%); Масс (масса к заряду, m/z): 301 (М-Н).
Этап-2:
Получение (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил хлорида (3):
Методика:
К раствору соединения 2 (10 г, 0,033 моль) в DCM (40 мл) добавляли оксалил хлорид (4,32 мл, 0,049 моль) при 0°С, добавляли 1 каплю DMF. Затем реакционную смесь перемешивали в течение 1 ч при комнатной температуре. После завершения реакции смесь концентрировали в атмосфере N2. Полученный неочищенный продукт 3 (10 г) использовали на следующем этапе без дополнительного очищения.
Этап-3:
Получение соединения 5 [2-гидрокси-5-(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидобензойная кислота]:
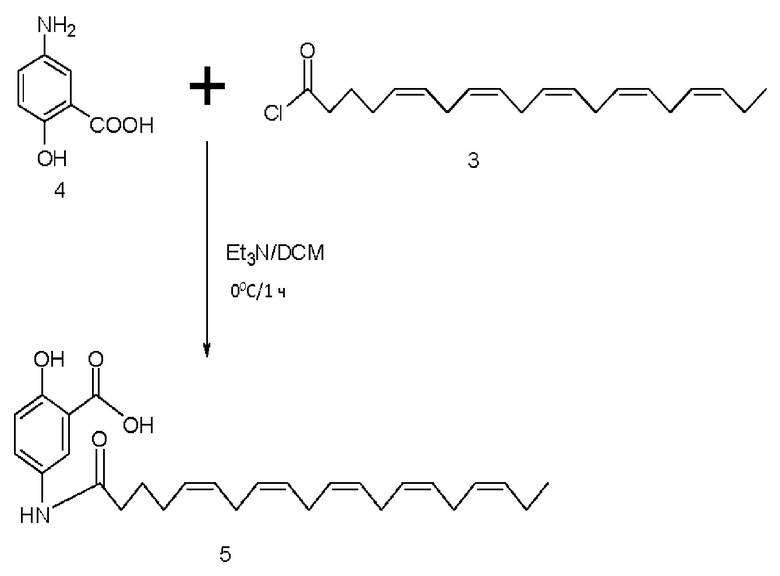
Методика:
К раствору 5-амино-2-гидроксибензойной кислоты (4, 5,06 г, 0,033 моль) в CH2Cl2 (20 мл) добавляли триэтиламин (13,8 мл, 0,099 моль) и соединение 3 при 0°С. Смесь продолжали перемешивать в течение 1 ч при этой же температуре. После завершения реакции подкисляли 2N HCl и отделяли органический слой, высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухости. Очистка путем перекристаллизации в гексане позволяла получить соединение 5 (5 г, выход 34,7%); Масс (масса к заряду, m/z): 438,5 (М+Н).
Этап-4:
Получение соединения-6 [1-йодэтил октаноат]:
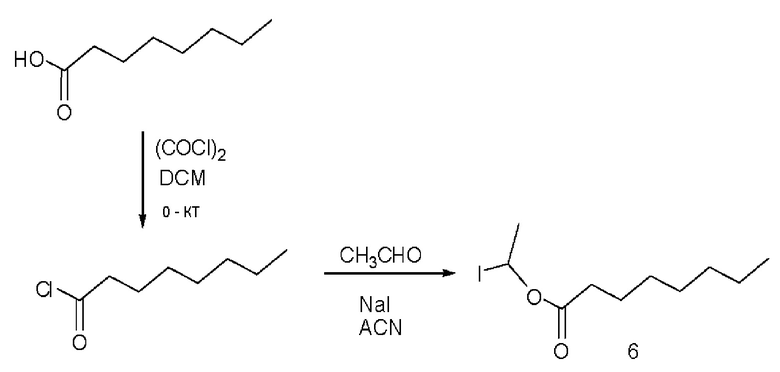
Методика:
Часть-А: К перемешиваемому раствору октановой кислоты (10 г, 0,069 моль) в дихлорметане (60 мл), по каплям добавляли 1-2 капли DMF, а затем по каплям добавляли оксалил хлорид (9,0 мл, 0,103 моль, 1,5 экв.) при 0°С в атмосфере N2 в течение 20 мин и перемешивали при комнатной температуре. После перемешивания в течение 2 ч летучие вещества концентрировали в атмосфере азота с получением октаноил хлорида [неочищенного].
Часть-В: К перемешиваемому раствору йодида натрия (10,3 г, 0,069 моль, 1 экв.) в ацетонитриле (70 мл) при 0°С добавляли ацетальдегид (3,88 мл, 0,069 моль), а затем добавляли вышеуказанный хлорангидрид [Часть-А] и перемешивали смесь в течение дополнительных 2 ч при 0-5°С. После завершения реакции (наблюдали с помощью ТЖХ) смесь выливали с ледяную воду (100 мл) и экстрагировали гексаном (2×200 мл). Объединенные органические экстракты промывали 5% водным раствором тиосульфата натрия (2×50 мл), 5% раствором бикарбоната натрия (50 мл) и затем солевым раствором (2×50 мл), высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухости с получением неочищенного соединения 6 в виде масла (10 г, 48,5%). Использовали на следующем этапе без дополнительной очистки.
Этап-5:
Получение 1-(октаноилокси)этил 2-гидрокси-5-(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидобензоата (CLX-SYN-G3-C03):
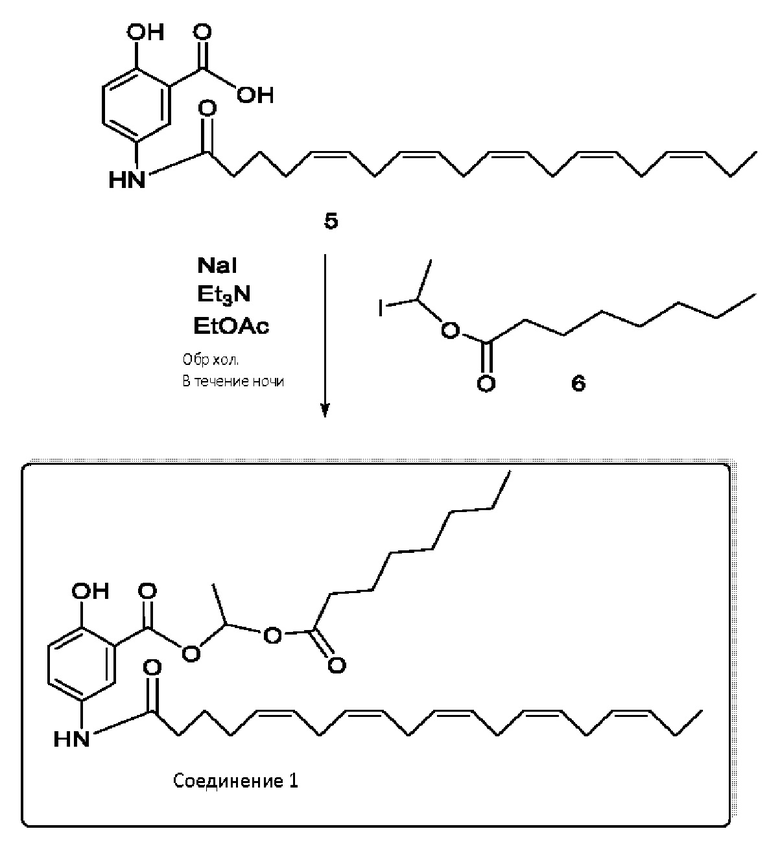
Методика:
К перемешиваемому раствору соединения 5 (5 г, 0,011 моль, 1 экв.) в этилацетате (110 мл) по каплям добавляли триэтиламин (1,98 мл, 0,0133 моль, 2 экв.) при комнатной температуре в атмосфере N2 в течение 2 мин, а затем йодид натрия (0,342 г, 0,002 моль) и соединение-6 (5,09 г, 0,011 моль). Затем температуру реакционной смеси поднимали до 50°С и продолжали перемешивать в течение ночи. После завершения реакции (наблюдаемого с помощью ТСХ) реакционную смесь разбавляли этилацетатом и водой. Органический слой отделяли и высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухости. Методом очистки на силикагеле (10% EtOAc в гексане) получали соединение 1 (5,2 г, выход 75,3% с чистотой 98,18% с помощью ЖХ-МС) в виде жидкости светло-желтого цвета. 1H-ЯМР (CDCl3): δ 10,4 (s, 1H), 8,00 (S, 1H), 7,50 (d, 1H), 7,18-7,05 (m, 2Н), 6,88 (d, 1H), 5,40 (m, 10Н), 2,82 (m, 8Н), 2,38 (m, 4Н), 2,20 (m, 2Н), 2,10 (m, 2Н), 1,82 (m, 2Н), 1,40-1,20 (m, 12Н), 1,00 (t, 3Н), 0,9 (m, 6Н); Масс: 608,5 [М+Н].
Этап-6:
Получение 1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата (CLX-SYN-G3-С04)
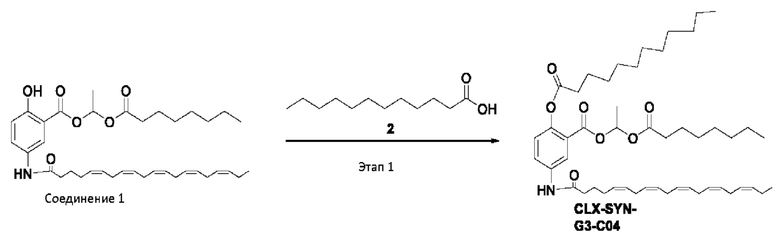
[00137] К раствору додекановой кислоты (3,30 г, 16,45 ммоль) в DCM (100 мл) при 0°С добавляли оксалил хлорид (2,12 мл, 1,5 экв.) с каплей DMF. После перемешивания при комнатной температуре в течение 1 ч, реакционную смесь концентрировали в атмосфере азота и неочищенный продукт добавляли к раствору 1-(октаноилокси)этил 2-гидрокси-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеномида)бензоата; соединения 1 (10 г, 16,45 ммоль, 1 экв), триэтиламина (6,49 мл, 3 экв) в DCM (100 мл) при 0°С. Смесь перемешивали при комнатной температуре в течение 1 ч. После того, как с помощью ТСХ было показано завершение реакции, смесь подкисляли 2N HCl (40 мл). Органический слой отделяли и высушивали над безводным сульфатом натрия и концентрировали. Неочищенный продукт очищали методом флэш хроматографии (силикагель) и элюировали 20% EtOAC в гексане. Полученный в результате продукт дополнительно очищали методом препаративной ВЭЖХ с получением 1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата (3,32 г, 25,54%) в виде жидкости коричневого цвета.
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,16 (s, 1Н), 8,15 (s, 1H), 7,90 (d, J=8,4 Гц, 1H), 7,14 (d, J=8,4 Гц, 1H), 6,92 (m, 1H), 5,35 (m, 10H), 2,79-2,74 (m, 8H), 2,56-2,49 (m, 4H), 2,32 (m, 4H), 2,09 (m, 2H), 1,99 (m, 2H), 1,65 (m, 4H), 1,53 (m, 2H), 1,49 (d, J=5,2 Гц, 3H), 1,35 (m, 2H), 1,24 (m, 20H), 0,90 (t, J=7,6 Гц, 3H), 0,83 (m, 6H); ВЭЖХ чистота: 98,70%, Macc: 788,5 [М-Н].
Схема-2:
Получение 1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоат (CLX-SYN-G3-C05)
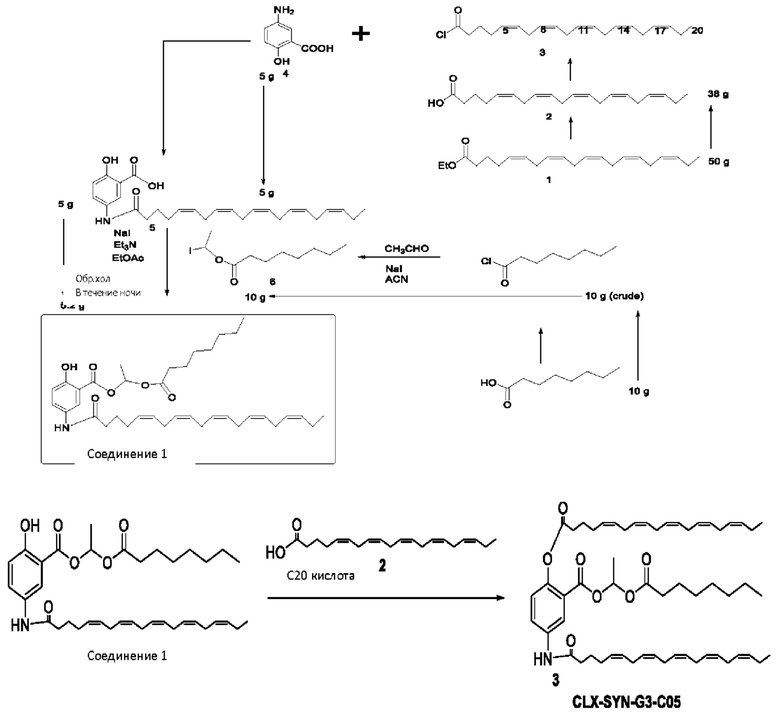
[00138] К раствору (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеновой кислоты (4,98 г, 16,45 ммоль) в DCM (100 мл) при 0°С добавляли оксалил хлорид (2,12 мл, 1,5 экв.) с каплей DMF. После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрировали в атмосфере азота и неочищенный продукт добавляли к раствору 1-(октаноилокси)этил 2-гидрокси-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо) бензоата, соединения 1 (10 г, 16,45 ммоль, 1 экв.), триэтиламина (6,49 мл, 3 экв.) в DCM (100 мл) при 0°С. Смесь перемешивали при комнатной температуре в течение 1 ч. После того, как с помощью ТСХ было зафиксировано окончание реакции, смесь подкисляли 2N HCl (40 мл). Органический слой отделяли и высушивали над безводным сульфатом натрия, и концентрировали. Неочищенный продукт очищали методом флэш хроматографии (силикагель) и элюировали 20% EtOAC в гексане. Полученный в результате продукт дополнительно очищали методом препаративной ВЭЖХ с получением 1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоата (2,85 г, 19,41%) в виде жидкости темно-коричневого цвета.
1Н-ЯМР (400 МГц, DMSO-d6): δ 10,16 (s, 1H), 8,15 (s, 1H), 7,90 (d, J=8,4 Гц, 1H), 7,13 (d, J=8,4 Гц, 1H), 6,92 (m, 1H), 5,39-5,25 (m, 20H), 2,81 (m, 14H), 2,55 (t, J=7,6 Гц, 2H), 2,32 (m, 4H), 2,15-1,98 (m, 8H), 1,67 (m, 4H), 1,51 (m, 2H), 1,48 (d, J=5,2 Гц, 3H), 1,22 (m, 10H), 0,90 (t, J=6,8 Гц, 6H), 0,83 (m, 3H); Масс.: 890,6 [М-Н].
Схема 3:
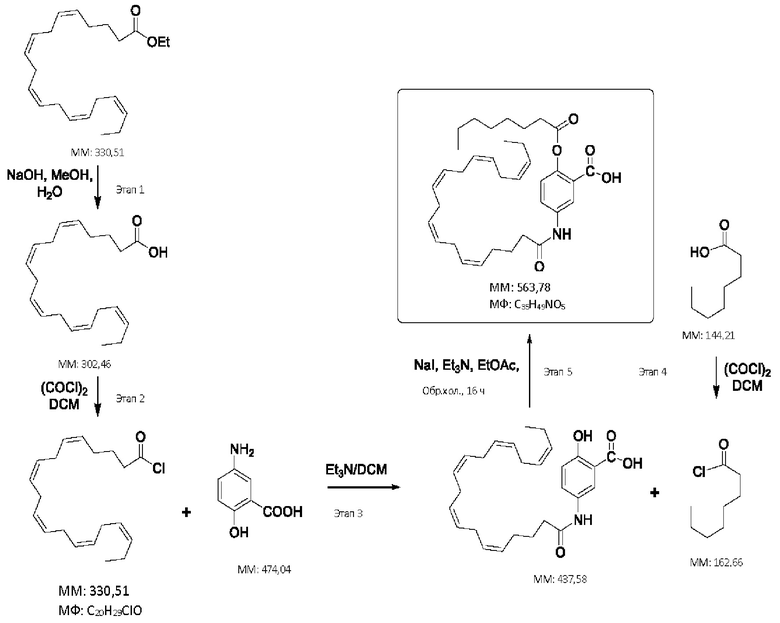
Этап-1: Получение (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеновой кислоты
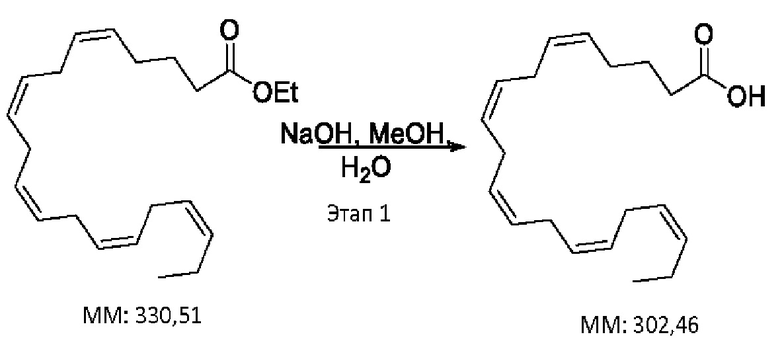
(5Z,8Z,11Z,14Z,17Z)-этил икоза-5,8,11,14,17-пентаеноат 100,0 г (0,30 моль, 1,0 экв.) растворяли в метаноле (2000 мл) и добавляли водный раствор NaOH (гидроксид натрия 121,0 г (3,02 моль, 10,0 экв.) в воде 400 мл, 4,0 об.). Затем реакционную смесь перемешивали в течение 4 ч при комнатной температуре. После завершения реакции летучие компоненты выпаривали при пониженном давлении, пока оставшаяся реакционная масса не достигнет 4,0 об. Полученное неочищенное вещество подкисляли 3N HCl для того, чтобы получить рН 1. Водный слой экстрагировали этил ацетатом (4×300 мл). Объединенные органические экстракты промывали солевым раствором (2×200 мл) и высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухости. Полученный сироп использовали для следующей реакции. Выход: 80,0 г (87,4%), Чистота: 97-99%.
Этап-2: Получение (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил хлорида
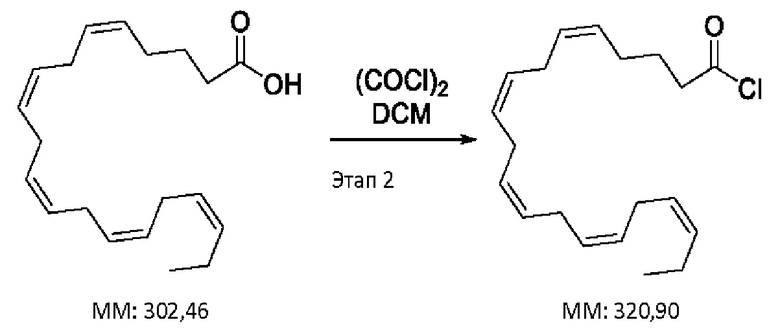
К раствору (5Z,8Z,11Z,14Z,17Z)-5,8,11,14,17-икозапентаеновой кислоты 100,0 г (0,33 моль, 1,0 экв.) и диметил формамида 2,0 мл (0,02 об.) в DCM (400 мл, 4,0 об.) добавляли оксалил хлорид 42,4 мл (0,49 моль, 1,5 экв.) при 0°С. Затем реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции смесь концентрировали в атмосфере азота. Полученный (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил хлорид использовали на следующем этапе без дополнительной очистки. Выход: 106,0 г (100,0%).
Этап-3: Получение 2-гидрокси-5-(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидобензойной кислоты
К раствору 5-аминосалициловой кислоты 100,0 г (0,653 моль, 1,0 экв.) в дихлорметане 800,0 мл (8,0 об.), добавляли триэтиламин 91,0 мл (0,653 моль, 1,0 экв.) при 25°С. (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил хлорид 209,5 г (0,653 моль, 1,0 экв.) растворяли в дихлорметане 200,0 мл (2,0 об.) и полученный раствор добавляли к указанной выше реакционной массе при 0°С. Реакционную массу перемешивали в течение 2 ч при 25°С. После завершения реакции реакционную массу концентрировали и растворяли в метаноле (1500,0 мл) и охлаждали до 10-15°С. Добавляли водный раствор гидроксида натрия (600,0 мл) и реакционную массу перемешивали в течение 2 ч при 25°С. После завершения реакции реакционную массу подкисляли 2N HCl и экстрагировали этилацетатом, слой этилацетата высушивали над безводным сульфатом натрия, фильтровали и концентрировали до сухого состояния. Очистка методом перекристаллизации в н-гептане позволяла получить 2-гидрокси-5-(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидобензойную кислоту. Выход: 185,25 г (65,0%).
Этап-4: Получение октаноил хлорида
К раствору октановой кислоты 100,0 г (0,693 моль, 1,0 экв.) и диметил формамида 2,0 мл (0,02 об.) в дихлорметане 600,0 мл (6,0 об.) добавляли оксалил хлорид 90,0 мл (1,049 моль, 1,5 экв.) при 0°С. Затем реакционную смесь перемешивали в течение 2 ч при комнатной температуре. После завершения реакции смесь концентрировали в атмосфере азота. Полученный (5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил хлорид использовали на следующем этапе без дополнительной очистки. Выход: 112,8 г (100,0%).
Этап-5: Получение 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(октаноилокси)бензойной кислоты
К раствору 2-гидрокси-5-(5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидобензойной кислоты 3,0 г (0,007 моль, 1,0 экв.) в этилацетате 30,0 мл (10,0 об.), добавляли триэтиламин 1,8 мл (0,012 моль, 1,9 экв.) при 25°С. Медленно добавляли октаноил хлорид 1,33 г (0,008 моль, 1,2 экв.) при 0°С. Реакционную массу перемешивали в течение 16 ч при 25°С. После завершения реакции реакционную массу концентрировали и очищали методом колоночной хроматографии с использованием 0-2% метанола в дихлорметане. Выход: 2,1 г (54,0%).
ЭКВИВАЛЕНТЫ
[00139] В настоящем изобретении помимо прочего предложены композиции и способы для лечения синдрома раздраженного кишечника (СРК) и его осложнений. Хотя были описаны конкретные варианты реализации заявленного изобретения, указанное выше описание является иллюстративным, а не ограничивающим. Многие варианты систем и способов согласно настоящему описанию будут очевидны для специалиста в данной области техники после ознакомления с настоящим описанием. Полный объем заявленных систем и способов должен быть определен посредством ссылки на формулу изобретения, наряду с полным объемом эквивалентов, и на указанное описание, наряду с такими вариациями.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00140] Все публикации и патенты, упомянутые в настоящей заявке, включая перечисленные выше статьи, полностью включены в настоящую заявку посредством ссылки как если бы каждая отдельная публикация или патент была напрямую или косвенно указана для включения посредством ссылки. В случае разногласий, настоящая заявка, включая любые определения из настоящего описания, будет иметь преимущественную силу.

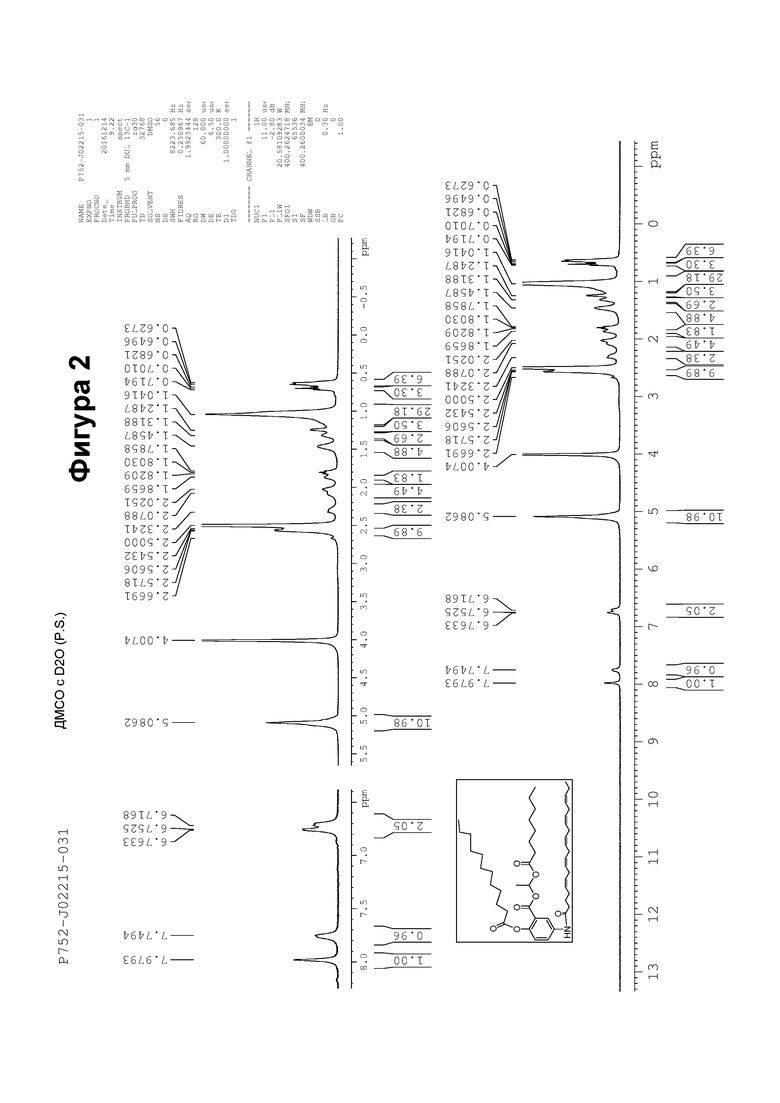
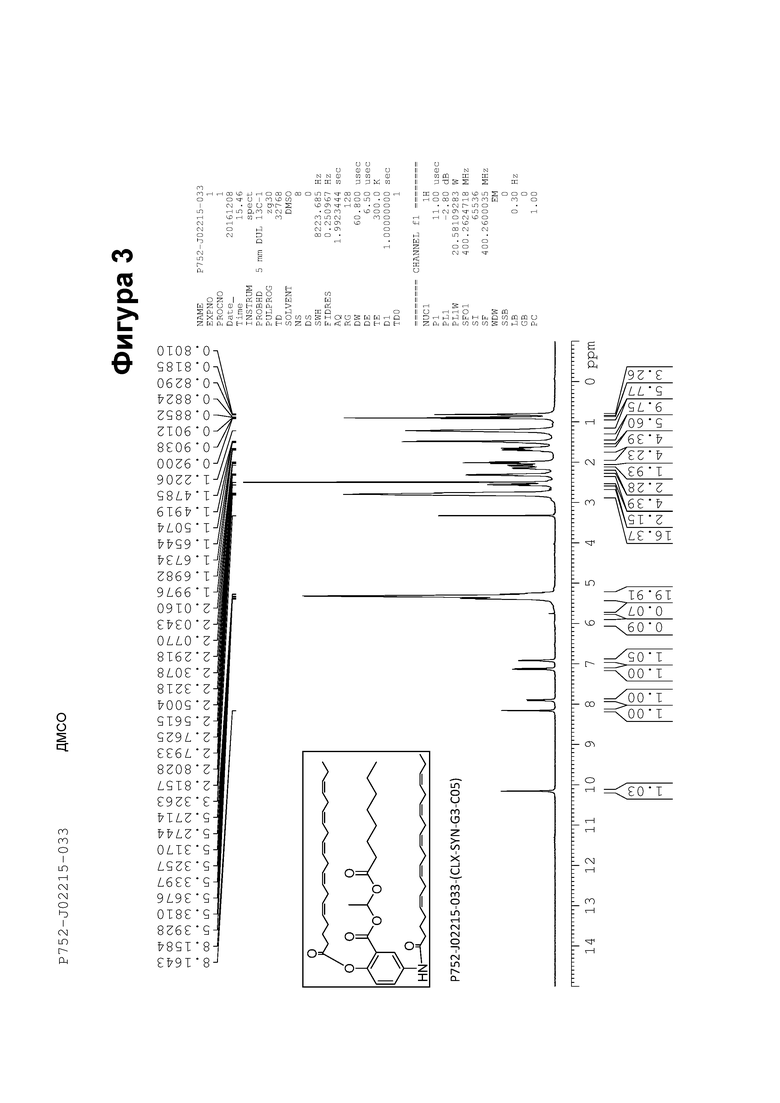
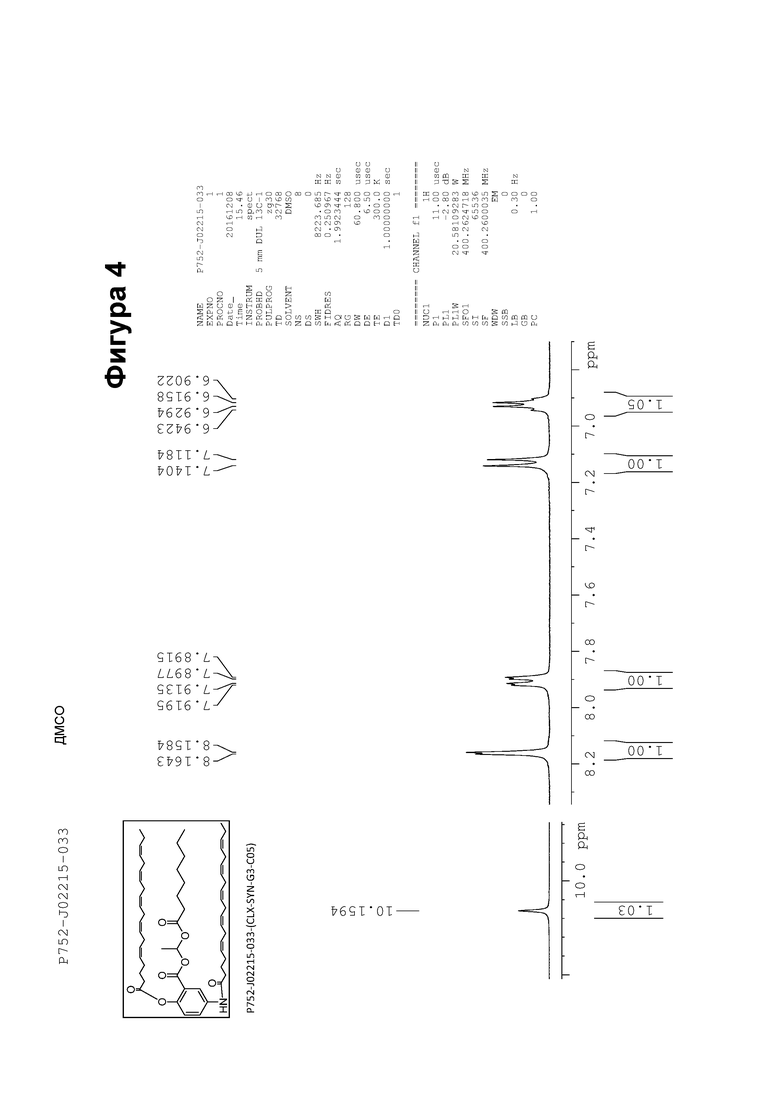
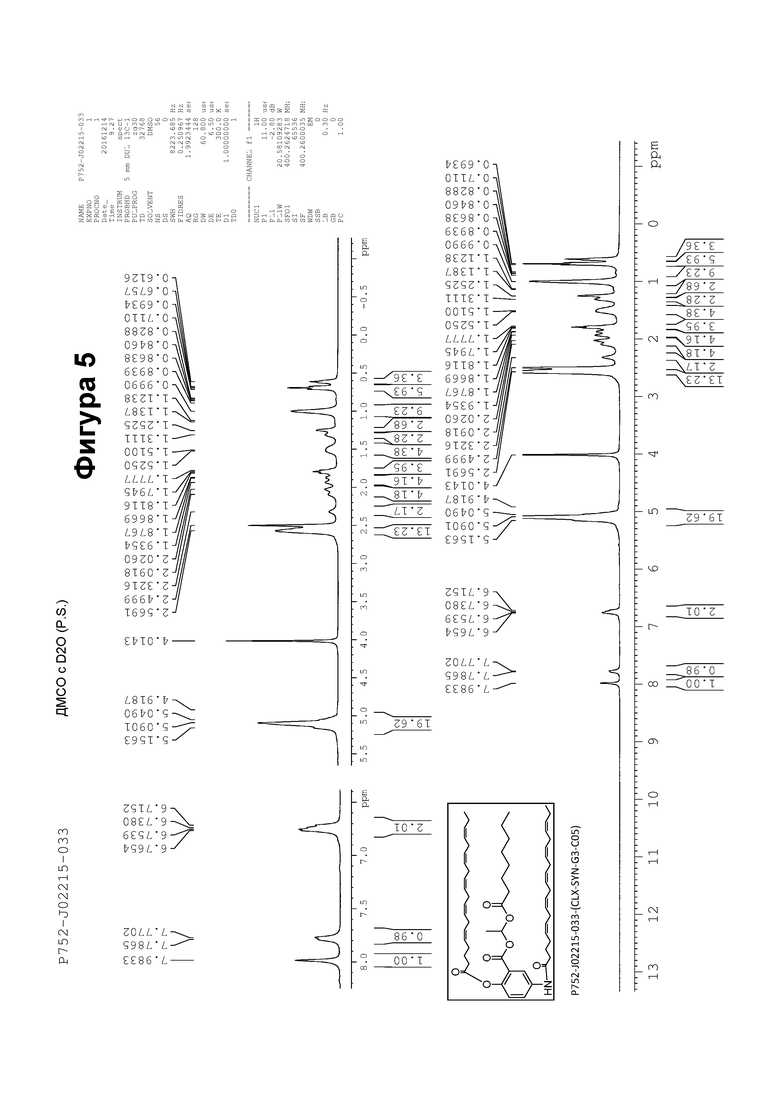
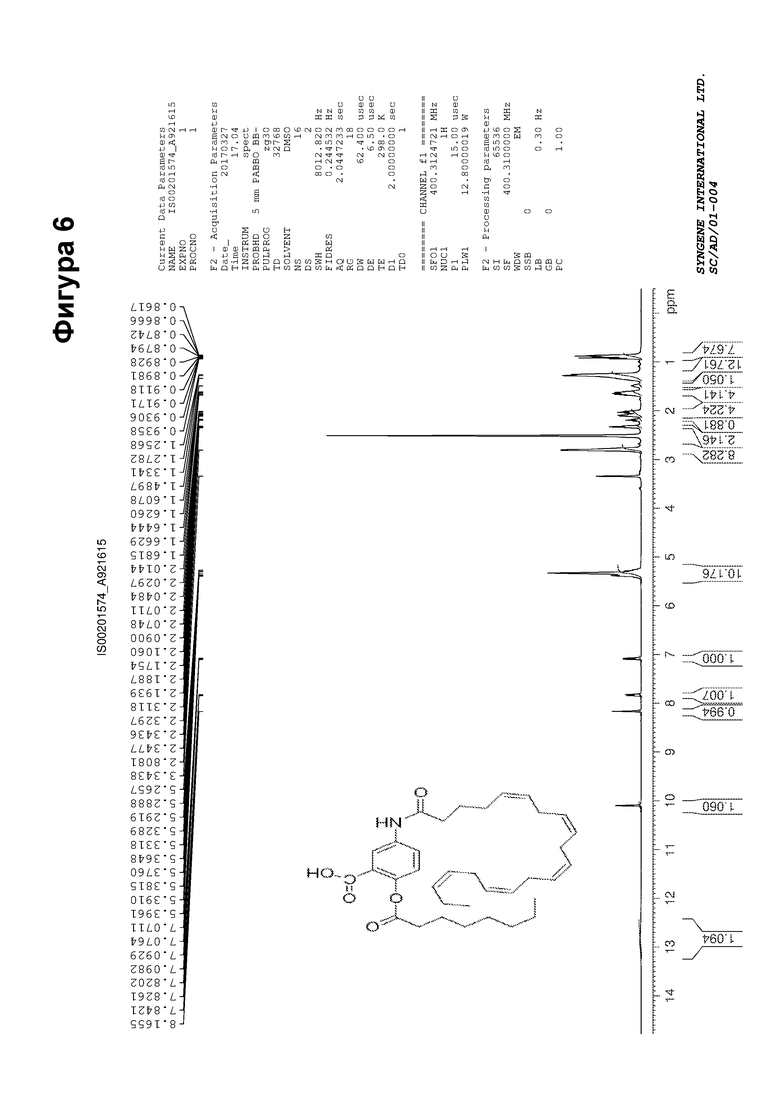
Изобретение относится к соединениям формулы I, которые могут найти применение для предотвращения или лечения воспалительного заболевания кишечника. В формуле I R1 и R5 отсутствуют, R3 представляет собой 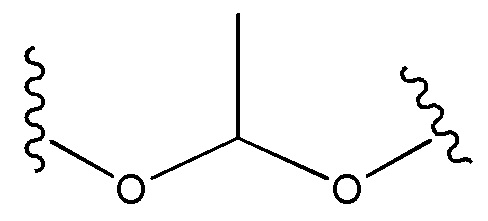 , каждый из R2, R4, R6 независимо представляет собой одно из значений, указанных ниже. Изобретение относится также к фармацевтической композиции и способу лечения воспалительного заболевания. 3 н. и 2 з.п. ф-лы, 6 ил., 1 пр.
, каждый из R2, R4, R6 независимо представляет собой одно из значений, указанных ниже. Изобретение относится также к фармацевтической композиции и способу лечения воспалительного заболевания. 3 н. и 2 з.п. ф-лы, 6 ил., 1 пр.
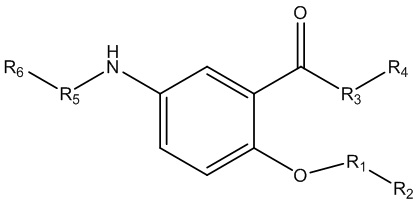
формула I
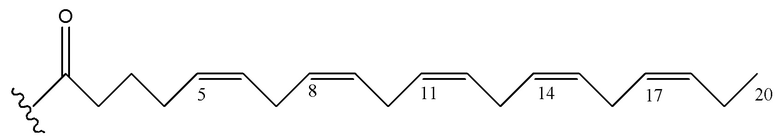
1. Соединение формулы I
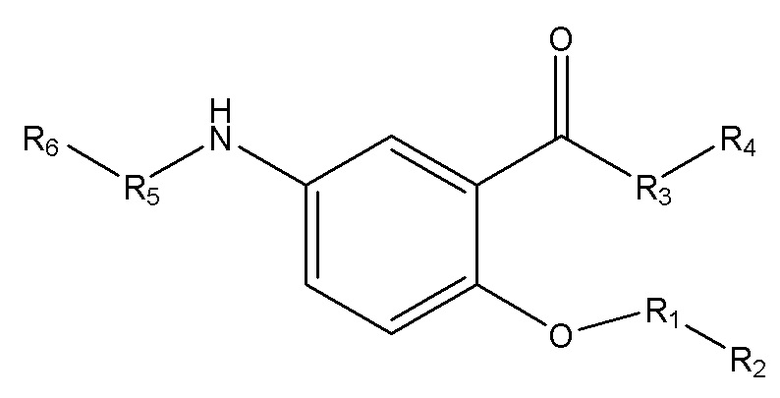
формула I,
где R1 и R5 отсутствуют,
R3 представляет собой
 ,
,
каждый из R2, R4, R6 независимо представляет собой
или
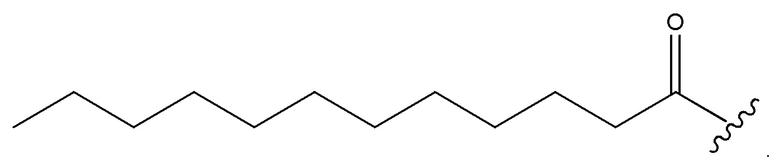
2. Соединение по п. 1, отличающееся тем, что соединение выбрано из
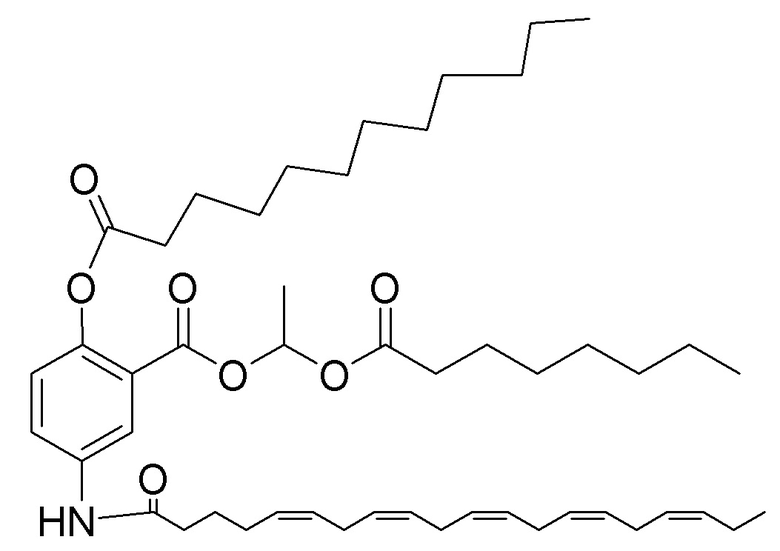
1-(октаноилокси)этил 2-(додеканоилокси)-5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)бензоата
или
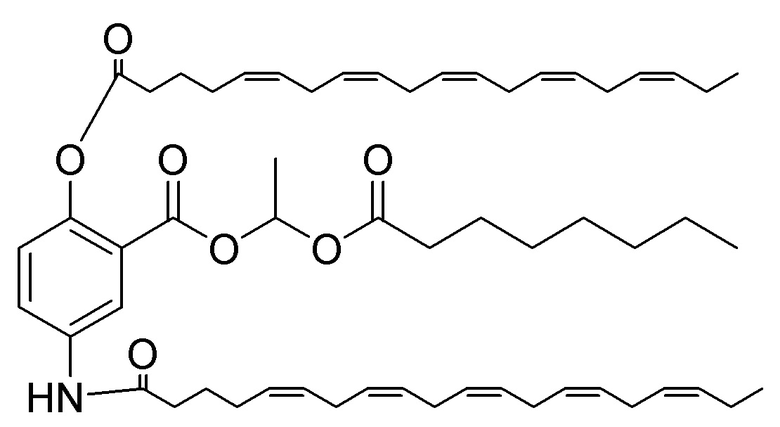
1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоата.
3. Фармацевтическая композиция для предотвращения или лечения воспалительного заболевания кишечника, содержащая эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п. 3, приготовленная для перорального введения, с отсроченным или замедленным высвобождением, для трансмукозального введения, введения в виде сиропа, местного, парентерального введения, инъекции, подкожного введения, введения в виде перорального раствора, ректального введения, буккального введения или трансдермального введения.
5. Способ лечения воспалительного заболевания, включающий введение пациенту, страдающему от воспалительного заболевания кишечника, соединения формулы I, включающего
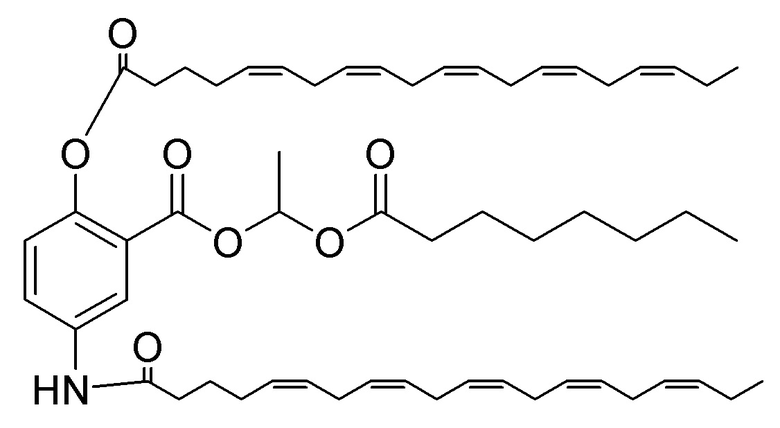
1-(октаноилокси)этил 5-((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаенамидо)-2-(((5Z,8Z,11Z,14Z,17Z)-икоза-5,8,11,14,17-пентаеноил)окси)бензоат.
| Токарный резец | 1924 |
|
SU2016A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| ПРОИЗВОДНЫЕ 4- ИЛИ 5-АМИНОСАЛИЦИЛОВОЙ КИСЛОТЫ | 2006 |
|
RU2414476C2 |
Авторы
Даты
2021-07-16—Публикация
2017-04-19—Подача