Область изобретения
Настоящее изобретение относится к полимерным покрытиям наноматериалов, в частности хелатирующих полимерных наноструктур, включающих парамагнитные ионы марганца (II), а также к способам получения указанных наноматериалов, а также к применению наноматериалов для визуализации или получения изображения биологического материала.
Уровень техники
В уровне техники известно несколько медицинских применений наноматериалов. Некоторые из них, на основе оксида железа, использовались в качестве специфичных в отношении печени контрастных агентов, но больше не присутствуют на рынке из-за низких объемов продаж. Доступен огромный объем литературы по экспериментальному использованию этих материалов (например, Bulte, J. W. М. and Modo, M. M. J. Eds. "Nanoparticles in Biomedical Imaging" Springer, 2008). Общий подход к тому, чтобы сделать наноматериалы биосовместимыми, состоит в нанесении на них покрытия из гибкого гидрофильного полимера. Полиэтиленгликоль (ПЭГ) особенно эффективен при минимизации взаимодействия с иммунной системой и белками (см. "Poly(ethylene glycol), Chemistry and Biological Applications", Eds. Harris and Zalipsky, 1997, ACS). Раньше в некоторой степени диссоциация остатков покрытия из наноматериала in vivo считалась приемлемой, но, на основании документа Европейского медицинского агентства (EMA/CHMP/SWP/620008/2012), отражающего размышления на эту тему, мы считаем, что так больше не будет продолжаться.
Эксперименты (пример 14, опыт А) продемонстрировали, что m-ПЭГ-силаны, связанные с полимерными наноструктурами, как описано в WO 2013041623 А1, склонны к медленному гидролизу в среде от нейтральной до основной. Это основной недостаток при рассмотрении этих материалов для применения в медицинских продуктах, поскольку это будет негативным образом влиять на срок годности продукта.
Целью настоящего изобретения является преодоление указанных проблем.
Сущность изобретения
Согласно первому аспекту настоящего изобретения, указанные выше и другие цели настоящего изобретения достигаются полностью или по меньшей мере частично с помощью химического соединения, указанного в пункте 1 формулы изобретения. Согласно данному пункту, указанная выше цель достигается с помощью химического соединения, содержащего ароматическое ядро или карбоциклическое неароматическое ядро, причем ароматическое ядро представляет собой бензольное кольцо или бифенил; карбоциклическое неароматическое ядро представляет собой 5-7-членное кольцо; при этом ядро имеет ковалентно присоединенные к нему по меньшей мере две якорные группы, где каждая якорная группа содержит активированную силановую группу; при этом якорные группы имеют следующую общую формулу -A-(CH2)nSiY3, в которой А является ковалентной связью или О, "n" является целым числом от 1 до 3, и Y независимо является метоксигруппой или этоксигруппой; и по меньшей мере одну гидрофильную группу, отходящую от ядра, причем гидрофильная группа содержит один или более гидрофильных полимерных остатка. Активированные силановые группы способны ковалентно связываться с поверхностью наноматериала. Остатки гидрофильного полимера имеют молекулярный состав (aO+bN)/(cC+dS+eSi+fP)>0,3 где а, b, с, d, е и f молярные процентные доли кислорода (О), азота (N), углерода (С), серы (S), кремния (Si) и фосфора (Р), соответственно, причем остаток(остатки) гидрофильного полимера выбирают независимо друг от друга, если присутствует более одной гидрофильной группы, из -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и "m" является целым числом от 6 до 25. Полимеры, имеющие такой состав, называются гидрофильными. Число остатков гидрофильного полимера, отходящих от ядра, составляет от одного до числа кольцевых структур в ядре. Если больше остатков гидрофильного полимера отходит от ядра, химическое соединение не применяют для покрытия наноматериалов, так как такие соединения склонные к образованию гелей, которые не используются для данного применения. Если ядро содержит более одного кольца и более одного остатка гидрофильного полимера, гидрофильные остатки могут быть присоединены к разным кольцам.
Авторы настоящего изобретения обнаружили, что, если химические соединения, используемые для покрытия наноструктур, включают по меньшей мере две силановые группы, обладающие способностью закреплять гидрофильный полимер на поверхности наноматериала, продукт становится стабильным в нейтральных условиях. Даже если одна из силановых групп отделяется от поверхности наноматериала, полимерный остаток все еще присоединен к поверхности с помощью другой силановой группы. Повышенная стабильность является основным преимуществом с точки зрения коммерческой ценности продукта и также облегчает процесс одобрения регулирующих органов.
Одним из преимуществ химических структур по настоящему изобретению по сравнению с уровнем техники является способность образовывать надежное покрытие на наноматериале, имеющем гидроксильные группы, обеспечивающая продукту коммерчески приемлемый срок годности (>6 месяцев) путем связывания двух отдельных функциональных групп для образования связи, в то же время обеспечивая гидрофильный и биоинертный по отношению к окружающей среде полимер. Это особенно важно при введении наноструктуры в организм, например, человека, для использования в медицинских целях.
Химическое соединение может содержать ароматическое ядро, где ароматическое ядро представляет собой бензольное кольцо или бифенил; якорные группы имеют следующую общую формулу -A-(CH2)nSiY3, в которой А является ковалентной связью или О, "n" является целым числом от 1 до 3, и Y является метоксигруппой или этоксигруппой, причем по меньшей мере две якорные группы могут быть одинаковыми или разными; при этом остатки гидрофильного полимера выбирают независимо друг от друга, если присутствует более одной гидрофильной группы, из -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и "m" является целым числом от 6 до 25. Такое соединение подходит для образования гидролитически стабильного покрытия из наноматериала или наноструктуры. Кроме того, такое соединение имеет то преимущество, что оно синтетически легко доступно.
Якорные группы могут быть одинаковыми или разными. Якорные группы могут отличаться в отношении "А", целого числа "n" и/или "Y". Три "Y''-группы в каждой якорной группе могут быть одинаковыми или разными.
Согласно другому воплощению, химическое соединение, в котором ароматическое ядро представляет собой бензольное кольцо, имеет общую формулу 1,
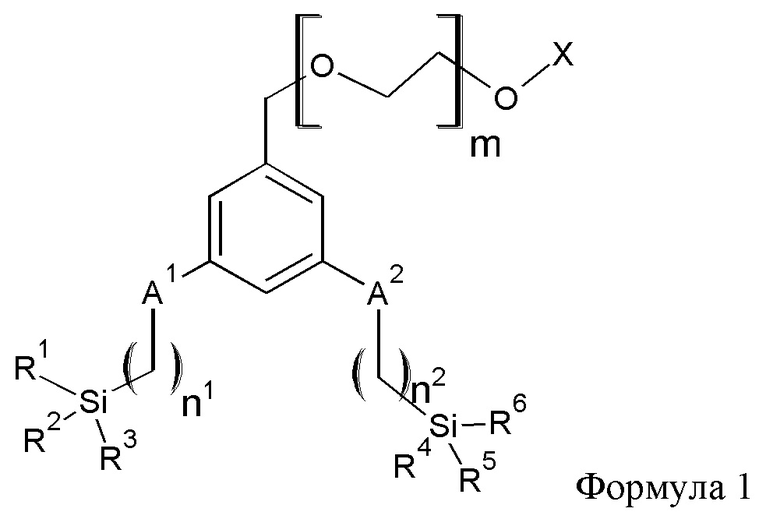
в которой А1 и А2 независимо выбраны из группы, состоящей из ковалентной связи или О; "n1" является целым числом от 1 до 3; "n2" является целым числом от 1 до 3; R1-R6 независимо выбраны из метоксигруппы и этоксигруппы; "m" является целым числом от 6 до 25; и X представляет собой метил. Таким образом, в этом воплощении, три Y группы в одной из якорных групп обозначены R1, R2 и R3, и три Y группы во второй якорной группе обозначены R4, R4 и R6.
Согласно еще одному воплощению, А1 и А2 представляют собой О, "n1" составляет 3, "n2" составляет 3, R1-R6 представляют собой этокси, и X представляет собой метил.
Согласно другому воплощению, химическое соединение, в котором ароматическое ядро представляет собой бензольное кольцо, имеет общую формулу 1,

в которой А1 и А2 представляют собой О; "n1" составляет 3; "n2" составляет 3; R1-R6 независимо выбраны из метоксигруппы и этоксигруппы; "m" является целым числом от 12 до 20; и X представляет собой метил.
Согласно другому воплощению, химическое соединение, в котором ароматическое ядро представляет собой бензольное кольцо, имеет общую формулу 1,
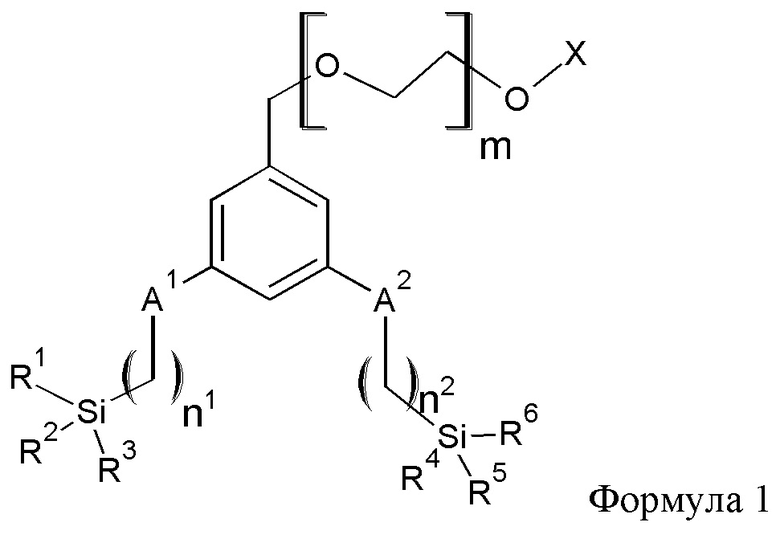
в которой А1 и А2 представляют собой ковалентную связь; "n1" составляет 2; "n2" составляет 2; R1-R6 независимо выбраны из метоксигруппы и этоксигруппы; "m" является целым числом от 12 до 20; и X представляет собой метил.
Химическое соединение может содержать карбоциклическое неароматическое ядро, которое представляет собой 5-7-членное кольцо; активированные силановые группы независимо представляют собой -A-(CH2)nSiY3, где А представляет собой ковалентную связь или О, а "n" является целым числом от 1 до 3 и Y является метоксигруппой или этоксигруппой; и остаток(остатки) гидрофильного полимера независимо представляют -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и "m" является целым числом от 6 до 25. Такое соединение дает очень стабильное покрытие из наноматериалов или наноструктур и доступно из коммерчески доступных исходных материалов.
Согласно второму аспекту настоящего изобретения, предложена композиция, содержащая химическое соединение согласно настоящему изобретению и носитель. Носитель может представлять собой растворитель, например, диоксан или спирт, такой как этиленгликоль.
Согласно одному из воплощений, композиция содержит по меньшей мере два разных химических соединения согласно настоящему изобретению. Разные химические соединения могут иметь отличия в отношении ядра, так что некоторые соединения имеют ароматическое ядро, а другие соединения в композиции имеют карбоциклическое неароматическое ядро. Разные химические соединения могут также или альтернативно иметь отличия в отношении длины полимерной цепи, то есть может меняться целое число "m". Другими признаками, которые могут варьироваться, являются А, X, Y и R, а также целые числа "n1" и "n2". Композиция, содержащая смесь химических соединений, может обладать тем преимуществом, что производится дешевле.
Согласно другому воплощению, композиция содержит соединения, в которых А1 и А2 представляют собой О, "n1" составляет 3, "n2" составляет 3, R1-R6 представляют собой этокси, и X представляет собой метил.
Согласно третьему аспекту настоящего изобретения, предложена наноструктура с покрытием, содержащая остатки химических соединений согласно настоящему изобретению или химического соединения, содержащего ароматическое ядро или карбоциклическое неароматическое ядро, при этом ядро имеет ковалентно присоединенные к нему: по меньшей мере две якорные группы, причем каждая якорная группа содержит активированную силановую группу; и по меньшей мере одну гидрофильную группу, отходящую от ядра, где гидрофильная группа содержит один или более остатков гидрофильного полимера молекулярного состава (aO+bN)/(cC+dS+eSi+fP)>0,3, где а, b, с, d, е и f представляют молярные процентные доли кислорода (О), азота (N), углерода (С), серы (S), кремния (Si) и фосфора (Р), соответственно; при этом число гидрофильных групп, отходящих от ядра, составляет от одной до числа кольцевых структур в ядре; при условии, что один или оба активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры. Такая наноструктура, когда в ее состав входит ферромагнитный ион, такой как ион марганца (II) или гадолиния (III), обладает свойствами высокой релаксивности и низкой токсичности, что имеет особые преимущества, поскольку обладает свойствами, сопоставимыми с селективным в отношении опухолей МРТ контрастным агентом.
Таким образом, предложена наноструктура с покрытием, содержащая остатки химических соединений согласно настоящему изобретению, в которой один или оба активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры. Такая наноструктура, когда в ее состав входит ферромагнитный ион, такой как ион марганца (II) или гадолиния (III), обладает свойствами высокой релаксивности и низкой токсичности, что имеет особые преимущества, поскольку обладает свойствами, сопоставимыми с селективным в отношении опухолей МРТ контрастным агентом.
Таким образом, предложена наноструктура с покрытием, содержащая фрагменты химического соединения, содержащего ароматическое ядро или карбоциклическое неароматическое ядро, и при этом ядро имеет ковалентно присоединенные к нему: по меньшей мере две якорные группы, причем каждая якорная группа содержит активированную силановую группу; и по меньшей мере одну гидрофильную группу, отходящую от ядра, причем гидрофильная группа содержит один или более остатков гидрофильного полимера, имеющего молекулярный состав (aO+bN)/(cC+dS+eSi+fP)>0,3, где а, b, с, d, е и f представляют молярные процентные доли кислорода (О), азота (N), углерода (С), серы (S), кремния (Si) и фосфора (Р), соответственно; причем число гидрофильных групп, отходящих от ядра, составляет от одной до числа кольцевых структур в ядре; причем один или оба активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры. Такая наноструктура обладает, когда в ее состав входит ферромагнитный ион, такой как ион марганца (II) или гадолиния (III), свойствами высокой релаксивности и низкой токсичности, что имеет особые преимущества, поскольку она обладает свойствами, сопоставимыми с селективным в отношении опухолей МРТ контрастным агентом.
Наноструктуры имеют покрытия для снижения их взаимодействия с, например, белками и/или ионами кальция в биологической среде, а также их взаимодействия друг с другом. Таким образом, количество покрытия является важным. Когда соединения с более длинными остатками гидрофильного полимера используют для нанесения покрытия на наноструктуры, для снижения указанных выше взаимодействий необходимо меньшее количество химического соединения(й) согласно настоящему изобретению. Таким образом, важна общая плотность (О-СН2-СН2).
Согласно одному из воплощений, наноструктура с покрытием содержит полимерный остов, содержащий или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп, имеющих общую формулу -P=O(OR11)(OR12), где R11 и R12 независимо выбраны из отрицательного заряда, Н, алкильной группы и арильной группы, причем полимерный остов дополнительно содержит мономерные остатки, содержащие геминальную бисфосфонатную группу и две органические оксисилановые группы. Такие наноструктуры обладают тем преимуществом, что характеризуются сильной склонностью к образованию хелатных соединений с двух- или трехвалентными катионами, имея, таким образом, потенциал для формирования основы контрастного агента или агента для визуализации.
Согласно другому воплощению, наноструктура с покрытием имеет гидродинамический диаметр от 4 до 8 нм. Гидродинамический диаметр определяют методом ДРС (динамического рассеяния света). Одним преимуществом таких наноструктур с покрытием является то, что наноструктуры могут выводиться из организма через почки.
Важными преимуществами наноструктур с покрытием по настоящему изобретению по сравнению с уровнем техники являются сочетание хорошей стабильности продукта с релаксивностью, значительно более высокой, чем у материалов, имеющихся на рынке в настоящее время, в сочетании с размером, подходящим для селективного накопления в тканях опухоли, и хорошей биологической переносимостью. Это способствует тому, что наноструктуры по настоящему изобретению подходят для применения в качестве контрастного агента для, например, МРТ (магнитно-резонансной томографии), ПЭТ (позитронной эмиссионной томографии) и/или SPECT (однофотонной эмиссионной компьютерной томографии), и, в частности, для визуализации опухолей. При использовании в качестве контрастного агента наноструктура содержит парамагнитный ион (для МРТ визуализации) или радиоактивный изотоп (для ПЭТ и/или SPECT визуализации), комплексованный в виде хелата с полимерным остовом. Особое преимущество наноструктур с покрытием согласно настоящему изобретению состоит в том, что покрытие может предотвращать агрегацию, индуцированную ионами кальция, когда полимерный остов наноструктуры образует хелатный комплекс с двух- или трехвалентными катионами (пример 14, предшественник покрытия 6 (из примера 1)). Другое преимущество наноструктур с покрытием по настоящему изобретению состоит в том, что они устойчивы к более интенсивным условиям способа, которые необходимы для достижения оптимальной хелатирующей способности (Пример 14, предшественник покрытия 6 (из примера 1) показывает хороший результат; Пример 18 показывает плохой результат из-за того, что соединение не входит в объем настоящего изобретения).
Согласно еще одному воплощению, наноструктура с покрытием дополнительно содержит парамагнитный ион. Парамагнитный ион может представлять собой ион марганца или гадолиния. Такие наноструктуры с покрытием можно использовать в качестве МРТ контрастных агентов.
Согласно еще одному воплощению, наноструктура с покрытием дополнительно содержит ион марганца (II) или гадолиния (III). Такие наноструктуры с покрытием можно использовать в качестве МРТ контрастных агентов. Преимущества применения этих наноструктур с покрытием в качестве МРТ контрастных агентов по сравнению с обычными контрастными агентами состоят в их очень высокой релаксивности и низкой токсичности.
Кроме того, применение марганца вместо гадолиния в качестве парамагнитного компонента позволяет обойти проблемы с токсичностью (Thomsen, H.S., Morcos, S. K., Almen, Т. et al. Eur Radiol (2013) 23: 307. doi:10.1007/s00330-012-2597-9 "Nephrogenic systemic fibrosis and gadolinium-based contrast media: updated ESUR Contrast Medium Safety Comittee guidelines") и текущие проблемы, связанные с гадолинием (Kanda, Т. et al. Radiology 2014; 270:834-841 "High Signal Intensity in the Dentate Nucleus and Globus Pallidus on Unenhanced T1-weighted MR Images: Relationship with Increasing Cumulative Dose of a Gadolinium based Contrast Material"). Наноструктуры с покрытием, содержащие парамагнитные ионы магния, предпочтительно используют в случае людей, поскольку такие наноструктуры имеют более низкую токсичность, чем наноструктуры, содержащие ионы гадолиния. Однако, поскольку наноструктуры с покрытием, содержащие парамагнитные ионы гадолиния, имеют более высокую интенсивность сигнала, что позволяет получать изображения с более высоким разрешением, такие наноструктуры можно использовать в научно-исследовательских целях или в ветеринарных целях.
Применение распространенного марганца вместо относительно редкого гадолиния имеет также экономические преимущества при производстве материала.
Когда наноструктура с покрытием содержит бисфосфонатные группы, парамагнитный ион предположительно образует хелатный комплекс с фосфонатными группами.
Согласно одному из воплощений, наноструктура с покрытием дополнительно содержит радионуклид для визуализации и/или радиотерапии. Такие наноструктуры с покрытием можно использовать в качестве ПЭТ и/или SPECT контрастного агента. Преимущества применения этих наноструктур с покрытием в качестве ПЭТ и/или SPECT контрастного агента по сравнению с обычными контрастными агентами состоят в том, что они локализуются в опухолях по механизму расширенного проникновения-удержания.
Согласно четвертому аспекту настоящего изобретения, предложена наноструктура с покрытием, дополнительно содержащая ион парамагнитного марганца или парамагнитного гадолиния, или композиция, содержащая наноструктуру с покрытием, дополнительно содержащую ион марганца (II) или гадолиния (III), для применения в качестве контрастного агента для МРТ.
Согласно другому аспекту настоящего изобретения, предложена наноструктура с покрытием, дополнительно содержащая радионуклид для визуализации и/или радиотерапии, или композиция, содержащая наноструктуру с покрытием, дополнительно содержащая радионуклид для визуализации, для применения в ПЭТ и/или SPECT визуализации или радиотерапии.
Согласно одному из аспектов настоящего изобретения, предложена композиция, содержащая наноструктуры с покрытием согласно настоящему изобретению и носитель. Носитель может представлять собой растворитель, такой как полярный растворитель. В частности, растворитель может быть водой. Композиция может вводиться парентеральным путем, например, внутривенно или внутриартериально. В некоторых случаях, композицию вводят перорально.
Согласно другому аспекту настоящего изобретения, предложен способ получения химических соединений согласно настоящему изобретению. Способ включает в виде последней химической стадии гидросилилирование двух концевых двойных связей. Это имеет то преимущество, что наиболее чувствительная группа вводится на последней стадии.
Согласно другому аспекту настоящего изобретения, предложен способ получения наноструктуры с покрытием согласно настоящему изобретению. Способ включает стадии обеспечения ядра наноструктуры из полимерного остова, содержащего геминальные бисфосфонатные группы; и приведения указанного ядра наноструктуры в контакт с по меньшей мере одним из химических соединений согласно настоящему изобретению в растворителе, предпочтительно водном растворителе.
Согласно одному из воплощений, способ осуществляют в присутствии мочевины при концентрации 0,1-1 М. Это имеет то преимущество, что выход наноструктур с покрытием существенно возрастает.
Согласно другому аспекту настоящего изобретения, предложена наноструктура, получаемая по способу согласно настоящему изобретению.
Определение терминов
Термин "активированный силан", используемый в данной заявке, относится к силану следующего вида RSi(Y)3, где Y независимо представляет собой алкоксигруппу, арилоксигруппу, галоген, диалкиламиногруппу, азотсодержащий гетероцикл или ацилоксигруппу.
Термин "остаток гидрофильного полимера", используемый в данной заявке, относится к органическому остатку, который способствует растворимости в водных растворителях, и в настоящем изобретении предполагается, что они являются биоинертными, что исключает полипептиды и сложные углеводы. Примеры подходящих гидрофильных органических остатков представляют собой любые группы, содержащие углерод с молекулярным составом (aO+bN)/(cC+dS+eSi+fP)>0,3, где а, b, с, d, е и f представляют молярные процентные доли кислорода (О), азота (N), углерода (С), серы (S), кремния (Si) и фосфора (Р), соответственно. Упоминаемые гидрофильные полимерные остатки часто представляют собой остатки гидрофильных полимеров, присоединенных к наноматериалам.
Термин "остаток" используют для описания фрагмента более крупной молекулы, которая находится в связанном состоянии, то есть представляет собой остаток молекулы-предшественника, в том же смысле, что, как говорят, белки состоят из остатков аминокислот, поскольку ковалентные связи между ними превращают функциональную амино группу и кислотную функциональную группу в амиды. Как правило, говорят, что полимерная цепь состоит из остатков мономера, а полимер, ковалентно связанный с поверхностью, является полимерным остатком.
Термин "гидрофильный полимер", используемый в данной заявке, относится к неприсоединенному полимеру, который будет способствовать растворимости в водных растворителях, когда находится в соединении с наноструктурой, и в настоящем изобретении предполагают, что такой полимер является биоинертным, что исключает полипептиды и сложные углеводы. Примеры подходящих гидрофильных полимеров представляют собой полимеры, состоящие из любой группы, содержащей атомы углерода, и с молекулярным составом (aO+bN)/(cC+dS+eSi+fP)>0,3, где а, b, с, d, е и f представляют молярные процентные доли кислорода (О), азота (N), углерода (С), серы (S), кремния (Si) и фосфора (Р), соответственно.
Термин "наноматериал", используемый в данной заявке, относится к объекту, в котором по меньшей мере одно измерение меньше, чем 100 нм, например, частицам, сферам, оболочкам, хлопьям, стружкам, кольцам, трубкам и лентам.
Термин "наноструктура", используемый в данной заявке, относится к объекту с суммарным диаметром 1-100 нм по существу шаровидной формы, то есть исключая оболочки, хлопья, стружки, кольца, трубки и ленты.
Термин "шаровидный", используемый в данной заявке, используют для обозначения наноструктур с такой формой, что малая ось составляет не менее половины большей оси, то есть самая длинная ось, проходящая через центр (центр масс) структуры, не более чем в два раза длиннее самой короткой оси, проходящей через ту же точку.
Термин "полимерный остов", используемый в данной заявке, относится к ковалентно связанной группе атомов, образующих либо полиразветвленную древовидную структуру, либо сетчатую структуру с многочисленными перекрестьями. Это составляет скелет или каркас наноструктуры. Специалисту понятно, что случайная природа процесса полимеризации вызывает то, что материал представляет собой смесь множества аналогичных, но неидентичных разветвленных структур, мест перекрестий и молекулярных масс.
"m-ПЭГ" относится к структурам СН3-(ОСН2СН2)n-ОН, где n зависит от обстоятельств. Термин m-ПЭГх-у относится к материалу, содержащему смесь цепей разной длины, где основные компоненты смеси имеют n=х-у, где х и у целые числа, причем у>х. Типичные значения в настоящем изобретении составляют n=6-9 или n=12-20. Если химическое название соединения, содержащего полидисперсный m-ПЭГ заместитель, приведено в данном описании, по выбору авторов для указанного заместителя используют название ω-метил-(этиленокси)х-у, где ω указывает на то, что метильная группа расположена на конце структуры, а х и у являются таким, как указано выше.
Термин "геминальная бисфосфонатная группа" относится к двум фосфонатным группам, разделенным одним атомом углерода, то есть фосфонатные группы связаны с одним и тем же атомом углерода. Соединения, содержащие такую геминальную бисфосфонатную группу, часто обозначают как 1,1-бисфосфонаты (или 1,1-дифосфонаты). Фосфонатные группы в геминальной бисфосфонатной группе могут быть замещены. В некоторых воплощениях каждая фосфонатная группа имеет формулу -P=O(OR1)(OR2), где R1 и R2 независимо выбраны из группы, состоящей из отрицательного заряда, Н, алкила и арила.
Термин "биоинертный", используемый в данной заявке, относится к материалу, который является биосовместимым, то есть безвредным для живого организма и в то же время по существу устойчивым к разложению in vivo.
Термин "ДРС", используемый в данной заявке, является аббревиатурой метода динамического рассеяния света, способа определения размера частиц, и может также называться методом фотонной корреляционной спектроскопии или квазиупругого рассеяния света Размеры, полученные методом ДРС, указанные в тексте описания и формулы изобретения, если не указано иное, относятся к положению максимума пика среднего объема для образца, измеренного при 25°С в нейтральном водном растворе с ионной силой, соответствующей 150 мМ NaCl. Гидродинамический диаметр представляет собой диаметр эквивалентной твердой сферы, вычисленной через коэффициент диффузии по уравнению Стокса-Эйнштейна. Коэффициент диффузии, в свою очередь, вычисляют на основе данных зависимости рассеяния света от времени, полученных методом ДРС. В зависимости от того, используют ли среднечисленные значения, усредненные значения объема или средние значения интенсивности рассеяния, значения могут отличаться. Усредненное значение объема обычно наиболее употребительно, так как оно показывает, какой размер частиц имеет основная масса материала. Средние диаметры, упомянутые в данном описании, относятся к усредненным объемам.
Термины "углеводород" и "углеводородная цепь" используют в данной заявке для обозначения органического остатка, состоящего из водорода и углерода. Углеводород может быть полностью насыщенным или может содержать один или более ненасыщенных фрагментов. Углеводород может содержать любое число атомов углерода от 1 до 50.
Термин "алкил", используемый в данной заявке, относится к прямой или разветвленной углеводородной цепи, полностью насыщенной (без двойных или тройных связей). Алкильная группа может в данном описании иметь от 1 до 15 атомов углерода. Алкильная группа соединений может быть обозначена "C1-15 алкил" или аналогичным образом. Типичные алкильные группы включают, никак не ограничиваясь указанным, метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил и т.п..
Термин "низший алкил", используемый в данной заявке, относится к алкилу, имеющему 1-8 атомов углерода.
Каждый раз, когда используется, если не указано иное, численный диапазон, например, "от 1 до 8" или "1-8" относится к каждому целому числу в заданном диапазоне; например, "от 1 до 8 атомов углерода" означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до и включая 8 атомов углерода. Есть, однако, некоторые исключения, которые понятны специалистам в данной области техники. В частности, всякий раз, когда в данном описании задается диапазон для молярного соотношения, например, молярного соотношения P/N или молярного соотношения Si/P в наноструктурах, для диаметра или размера, для рН, для временного промежутка, для концентрации, для осмоляльности или для температуры, такой диапазон включает также все десятичные дроби, попадающие в указанный диапазон.
Используемый в данной заявке термин "алкокси" относится к формуле -OR, в которой R представляет собой С1-8 алкил, например, метокси, этокси, н-пропокси, 1-метилэтокси (изопропокси), н-бутокси, изобутокси, втор-бутокси, трет-бутокси, амилокси, изоамилокси и т.п.. Алкокси может быть необязательно замещена.
Используемый в данной заявке термин "арилокси" относится к RO-, в которой R представляет собой арил, где "арил" относится к карбоциклическому (все углероды) кольцу или двум или более конденсированных колец (кольца, в которых два соседних атома углерода являются общими), которые имеют полностью делокализованную пи-электронную систему. Арильное кольцо может представлять собой 4-20-членное кольцо. Примеры арильных групп включают, не ограничиваясь указанным, бензол, нафталин, антрацен, фенантрен и азулен. Арильная группа может быть возможно замещена, например, фенокси, нафталенилокси, азуленилокси, антраценилокси, нафталенилтио, фенилтио и т.п. Арилокси может быть возможно замещена.
Используемый в данной заявке термин "ацил" относится к карбонильной группе, присоединенной к алкильной или арильной группе, то есть -C(=O)-R, где R представляет собой алкил или арил.
Используемый в данной заявке термин "ацилокси" относится к атому кислорода, связанному через ацильную группу, то есть RC(=O)-O-, где R такой же, как указан выше.
Используемый в данной заявке термин "гетероцикл" относится к стабильной 3-18-членной кольцевой структуре, которая состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. Гетероцикл может быть моноциклическим, бициклическим или трициклическим.
Термин "сильное основание", используемый в данной заявке, относится к основаниям, которые сильнее, чем гидроксид, и не совместимы с водными средами.
Термин "гидродинамический диаметр", используемый в данной заявке, относится к диаметру гипотетической твердой сферы, которая рассеивает с той же скоростью, что и частица. В свойства сферы включены степень гидратации и форма. Термин также известен как "диаметр Стокса" или "диаметр Стокса-Эйнштейна".
Термин "сопряженный", используемый в данной заявке, относится к молекулярной структуре, которая представляет собой флуоресцентный маркер, краситель, спин-метку, радиоактивный маркер, лиганд для биологического рецептора, хелат, пептид, ингибитор фермента, субстрат фермента, антитело или родственную антителу структуру. Смотри, например, "Bioconjugate Techniques", Greg Т. Hermanson second edition, Elsevier 2008, ISBN 978-0-12-370501-3 для получения информации по этому вопросу.
Оба термины "место для сопряжения" и "место присоединения" относятся к бифункциональной молекуле, которая может связываться с полимерной сетью или включаться в полимерную сеть, но сохраняет одну реакционноспособную группу, которая может, как указано выше, присоединяться к сопряженному фрагменту. Типичным, но не исключительным примером является (EtO)3SiCH2CH2CH2NH2.
Термин "покрытие" используют для описания слоя молекул, ковалентно присоединенных к поверхности или внешнему слою наноматериала или наноструктуры. В этом смысле исключаются физически сорбированные или нековалентно связанные полимеры.
Термины "наноматериал с покрытием" или "наноструктура с покрытием" описывает наноматериалы с покрытием, описанные выше. Для описания части наноматериала с покрытием или наноструктуры с покрытием, которые не являются частью покрытия, используют термин ядро наноматериала или ядро наноструктуры. Эти последние термины используют также для описания наноматериалов или наноструктур, которые не имеют покрытия.
Термин "плотность покрытия" используют для описания того, насколько близко молекулы покрытия упакованы на поверхности наноматериала или наноструктуры. В настоящей заявке предпочтительно используют единицу измерения молекул/нм2, но в литературе также принято использовать мкммоль/м2. Эту численную величину можно получить путем умножения значения, выраженного в молекул/нм2, на 1,6.
Термин "поверхность" наноструктур менее очевиден, чем для макроскопических объектов, и в данной заявке используется для описания тех наружных частей наноматериала или наноструктуры, которые доступны для химической модификации с помощью полимеров.
Обозначение "Ms" означает мезилат.
Термин "радионуклид" относится к нестабильной форме химического элемента, который радиоактивно распадается, что приводит к излучению а, (3 и/или у радиации.
В данной заявке выражение "радионуклид для визуализации и/или радиотерапии" относится к актинию-225 (225Ас); меди-62 (62Cu); меди-64 (64Cu); меди-67 (67Cu); галию-67 (67Ga); галию-68 (68Ga); гольмию-166 (166Но); индию-111 (111In); свинцу-212 (212Pb); лютецию-177 (177Lu); радию-223 (223 Ra); рению-186 (186Re); рению-188 (188Re); рубидию-82 (82Rb); самарию-153 (153Sm); стронцию-89 (89Sr); технецию-99m (99mTc3+); талию-201 (201Tl); торию-227 (227Th); иттрию-86 (86Y); иттрию-90 (90Y) и цирконию-89 (89Zr). Выражение "радионуклид для визуализации и/или радиотерапии" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для визуализации" относится к меди-62 (62Cu); меди-67 (67Cu); галию-67 (67Ga); галию-68 (68Ga); индию-111 (111In); лютецию-177 (177Lu); рению-186 (186Re); рубидию-82 (82Rb): технецию-99m (99mTc3+); талию-201 (201Tl); иттрию-86 (86Y) и цирконию-89 (89Zr). Выражение "радионуклид для визуализации" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для ПЭТ визуализации" относится к меди-62 (62Cu); галлию-68 (68Ga); рубидию-82 (82Rb); иттрию-86 (86Y) и цирконию-89 (89Zr). Выражение "радионуклид для ПЭТ визуализации" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для SPECT визуализации" относится к галию-67 (67Ga); индию-111 (111In); технецию-99m (99mTc3+) и талию-201 (201Tl). Выражение " радионуклид для SPECT визуализации" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для радиотерапии" относится к актинию-225 (225Ас); меди-64 (64Cu); меди-67 (67Cu); гольмию-166 (166Но); свинцу-212 (212Pb); лютецию-177 (177Lu); радию-223 (223Ra); рению-186 (186Re); рению-188 (188Re); самарию-153 (153Sm); стронцию-89 (89Sr); торию-227 (227Th) и иттрию-90 (90Y). Выражение "радионуклид для радиотерапии" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для ПЭТ визуализации и радиотерапии" относится к актинию-225 (225Ac); меди-62 (62Cu); меди-64 (64Cu); меди-67 (67Cu); галию-68 (68Ga); гольмию-166 (166Но); свинцу-212 (212Pb); лютецию-177 (177Lu); радию-223 (223Ra); рению-186 (186Re); рению-188 (188Re); рубидию-82 (82Rb); самарию-153 (153Sm); стронцию-89 (89Sr); торию-227 (227Th); иттрию-90 (90Y) и цирконию-89 (89Zr). Выражение "радионуклид для ПЭТ визуализации и радиотерапии" включает также сочетания двух или более указанных выше радионуклидов.
В данной заявке выражение "радионуклид для SPECT визуализации и радиотерапии" относится к актинию-225 (225Ас); меди-64 (64Cu); меди-67 (Cu); галию-67 (67Ga); гольмию-166 (166Но); индию-111 (111In); свинцу-212 (212Pb); лютецию-177 (177Lu); радию-223 (223Ra); рению-186 (186Re); рению-188 (188Re); самарию-153 (153Sm); стронцию-89 (89Sr); технецию-99m (99mTc3+); талию-201 (201Tl); торию-227 (227Th) и иттрию-90 (90Y). Выражение "радионуклид для SPECT визуализации и радиотерапии" включает также сочетания двух или более указанных выше радионуклидов.
ИСП-ОЭС означает оптическую эмиссионную спектроскопию с индуктивно связанной плазмой, способ элементного анализа.
ИСП в данной заявке означает ИСП-ОЭС.
Описание фигур
На Фиг. 1 схематически представлено химическое соединение по настоящему изобретению, в котором 1 представляет ядро, 2 представляет остаток гидрофильного полимера и 3 представляет активированный силан.
На Фиг. 2 приведен схематический рисунок части наноматериала, к которому присоединены химические соединения по настоящему изобретению.
На Фиг. 3 приведены результаты гель-фильтрационной хроматографии (ГФС) двух проб, А и В, взятых во время введения марганца в наноструктуры, покрытые N,N-бис(3-триметоксисилилпроп-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамидом (Пример 18 ниже).
Подробное описание
Данное описание относится к химическим соединениям, содержащим структуру ядра, несущего по меньшей мере три группы заместителей, две из которых содержат группу (3) активированного силана и одна или более содержат остаток или остатки (2) гидрофильного полимера (см. Фиг. 1). Остаток (2) гидрофильного полимера во многих случаях представляет собой смесь цепей разной длины, так что конкретное химическое соединение обычно находится в смеси химических соединений, которые являются идентичными в отношении частей ядра и частей активированного силана, но разными по числу мономерных остатков, образующих полимерную часть. Применение смеси имеет то преимущество, что смесь существенно дешевле, чем материалы со специфическим числом мономерных остатков, образующих полимерную часть.
Можно, конечно, иметь больше двух групп (3) активированного силана для закрепления соединений на поверхности, как показано в примере 14, см. предшественник 41 покрытия, но, оказалось, что это менее привлекательно из-за плохой растворимости наноструктур с покрытием. Некоторыми неограничивающими примерами остатков (2) гидрофильного полимера на Фиг. 1 являются полиэтиленгликоль (называемый также ПЭГ, полиэтиленоксид (РЕО), или (полиоксиэтилен (РОЕ)), m-ПЭГ (метоксиполиэтиленгликоль), поливинилпирролидон, акрилаты и метакрилаты с различными полярными боковыми цепями, поли(глицидилметиловый простой эфир) или поли(глицидиловый спирт).
Некоторыми неограничивающими примерами ядра (1) на Фиг. 1 являются ароматические углеводороды, такие как бензол, или нафталин, или бифенил; или связанные ароматические углеводороды, такие как дифениловый простой эфир или дифенилметан; или конденсированные кольцевые системы, такие как антрахинон; или гетероциклические соединения, такие как пиридин, или пиридазин, или пиримидин, или пиразин, или пиррол, или имидазол, или бензимидазол, пиперидин, пирролидин, или карбоциклические соединения, такие как циклопентан, циклогексан и циклогептан. Они могут быть введены различными путями, некоторые из которых показаны на Схеме 1а. Некоторые, например, связанные кольцевые структуры бифенил, дифениловый простой эфир, дифенилметан или антрахинон, обеспечивают введение больше одного, например, двух, полимерных остатков. Специалист в данной области может представить себе еще несколько структур для ядра, например, большего размера алифатические кольца, полициклические алифатические кольцевые системы или большие полициклические ароматические или сложные гетероциклические системы.
В некоторых воплощениях ядро представляет собой карбоциклическое неароматическое 5-7-членное кольцо, и/или остаток (остатки) гидрофильного полимера представляет собой (независимо представляют собой) -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н и "m" является целым числом от 6 до 25; и/или активированный силан представляет собой -A-(CH2)nSi(OY)3, где А представляет собой кислород или ковалентную связь, и "n" является целым числом от 1 до 3, и Y представляет собой метил или этил.
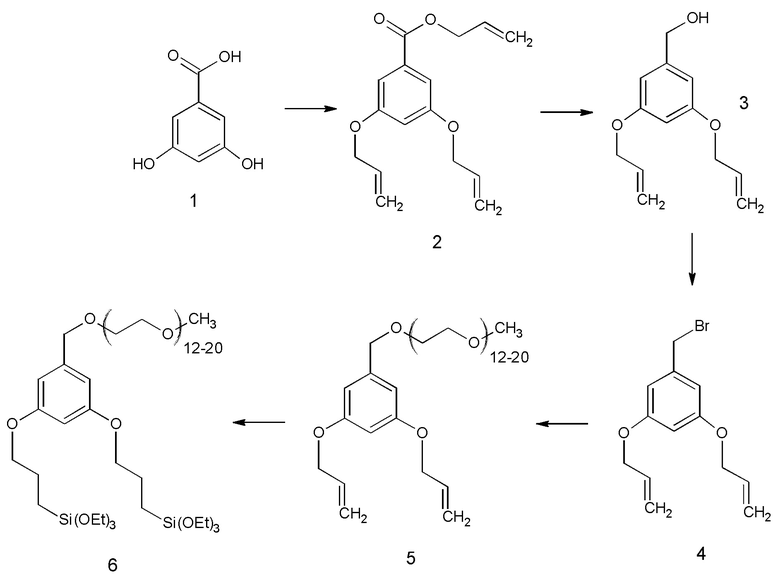
Авторы настоящего изобретения обнаружили, что соединения, в которых ядро представляет собой одно кольцо с двумя активированными силанами и двумя гидрофильными полимерами, не применимы для нанесения покрытия на наноматериалы, а скорее образуют гели. Таким образом, структуры с более чем одной полимерной цепью на одну кольцевую структуру ядра исключаются из настоящего изобретения (см. пример 14, предшественник 20 покрытия). Число остатков гидрофильного полимера, отходящих от ядра, предпочтительно должно составлять от одного до числа кольцевых структур в ядре. В примере 14, предшественник 14 покрытия показан в качестве примера с двумя кольцами в ядре и двумя гидрофильными полимерными остатками.
В некоторых воплощениях ядро является ароматическим, таким как бензольное кольцо или бифенил; и/или остаток (остатки) гидрофильного полимера представляет собой (независимо представляют собой) -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и m=6-25; и/или активированный силан представляет собой -A-(CH2)nSi(OY)3, где А представляет собой кислород или ковалентную связь, и n является целым числом от 1 до 3, и Y представляет собой метил или этил.

Остаток гидрофильного полимера может быть соединен с ядром несколькими способами, очевидными для специалиста в данной области техники, но связи, которые являются устойчивыми к гидролизу, в частности катализируемому кислотой гидролизу, являются предпочтительными, как показано с помощью разницы в стабильности наноструктур, имеющих покрытия с предшественником 54 покрытия (см. примеры 11b и 18) и предшественником 6 покрытия (см. примеры 14, предшественник 6 покрытия). Указанное первым, которое выходит за рамки настоящего изобретения, значительно разрушается в условиях нанесения покрытия, а последнее, попадающее в объем настоящего изобретения, является высокопрочным. Некоторыми неограничивающими примерами таких связей, устойчивых к гидролизу, являются простоэфирные связи или углерод-углерод связи, показанные на Схеме 1с, где бензольное кольцо нужно считать структурообразующим ядром.

Химические структуры по настоящему изобретению можно синтезировать из коммерчески доступных соединений. Далее приведены некоторые неограничивающие примеры стратегий синтеза, которые подходят для получения некоторых соединений со Схем 2-15. Как понятно специалисту в данной области техники, есть много альтернативных способов получения тех же целевых соединений. Таким образом, эти способы следует рассматривать только в качестве примера возможных способов.
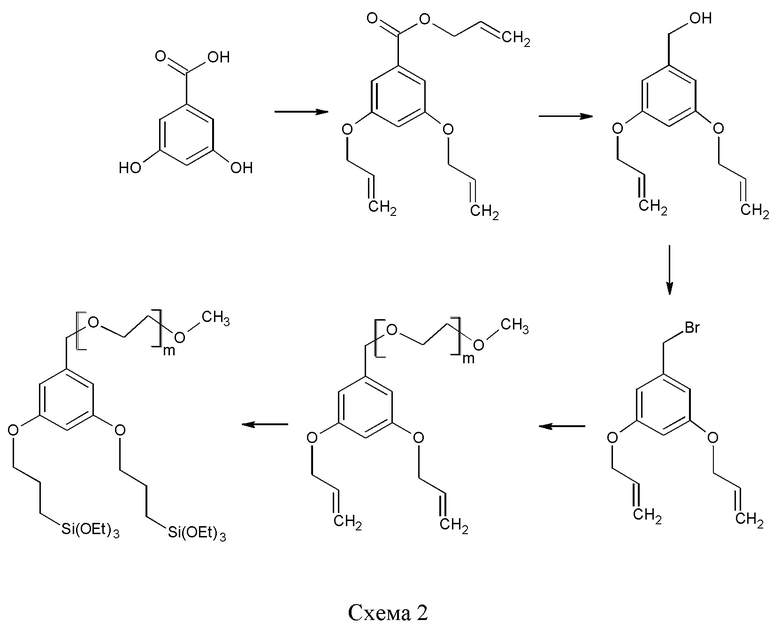
Как показано на Схеме 2 и в примере 1, тройное аллилирование 3,5-дигидроксибензойной кислоты с последующим восстановлением с помощью LAH (алюмогидрида лития) было адаптировано из литературы (Пример 78 из 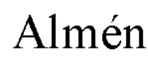 et. al. US 6310243), а бромирование осуществляли по реакции полученного спирта с PBr3. После замещения брома на анион m-ПЭГ12-20-ОН проводили гидросилилирование с помощью HSi(OEt)3, катализируемое катализатором Карштедта (Karstedt).
et. al. US 6310243), а бромирование осуществляли по реакции полученного спирта с PBr3. После замещения брома на анион m-ПЭГ12-20-ОН проводили гидросилилирование с помощью HSi(OEt)3, катализируемое катализатором Карштедта (Karstedt).
Как показано на Схеме 3, соединение 3d можно синтезировать путем винилирования 3,4-дибромопиррола (3а) по реакции кросс-сочетания, такой как сочетание по реакции Стилла (Stille), с последующим депротонированием азота сильным основанием, таким как NaH, и полученный анион может сочетаться с гидрофильным полимером, несущим подходящую уходящую группу, такую как m-ПЭГ12-20-OMs (56). Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
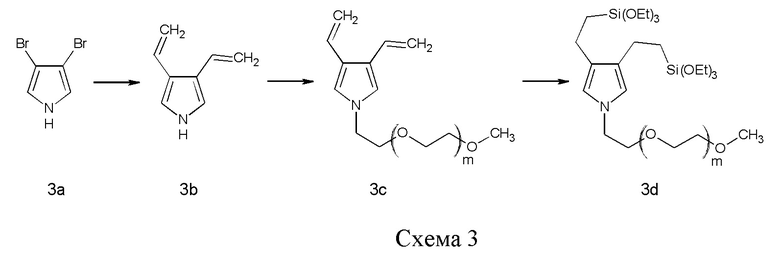
Соединение 4d можно синтезировать путем винилирования 4,5-дибромоимидазола (4а) по реакции кросс-сочетания, такой как сочетание по реакции Стилла (Stille), с последующим депротонированием азота сильным основанием, таким как NaH, и полученный анион может сочетаться с гидрофильным полимером, несущим подходящую уходящую группу, такую как m-ПЭГ12-20-OMs (56). Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).

Соединение 5е можно синтезировать путем винилирования метил-2,6-дибромизоникотината (5а) по реакции кросс-сочетания, такой как сочетание по реакции Стилла (Stille), с последующим селективным восстановлением сложного эфира с помощью подходящего источника гидрида. Полученный спирт можно депротонировать сильным основанием, таким как NaH, и полученный анион можно сочетать с гидрофильным полимером, несущим подходящую уходящую группу, такую как m-ПЭГ12-20-OMs (56). Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
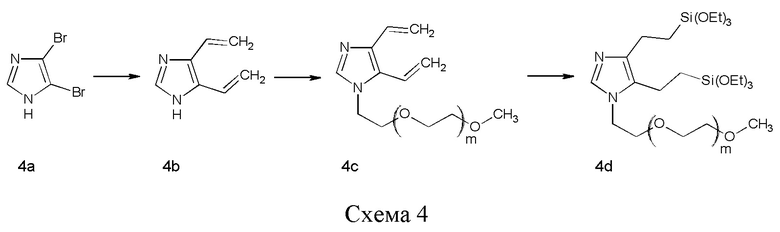
Соединение 6f можно синтезировать по реакции кросс-сочетания, такой как сочетание Сузуки (Suzuki), между метил-2,6-дибромизоникотинатом (6а) и 3-винилфенилбороновой кислотой (6b) с последующим селективным восстановлением сложного эфира с помощью подходящего источника гидрида. Полученный спирт можно депротонировать сильным основанием, таким как NaH, и затем сочетать с гидрофильным полимером, несущим подходящую уходящую группу, таким как m-ПЭГ12-20-OMs (56). Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
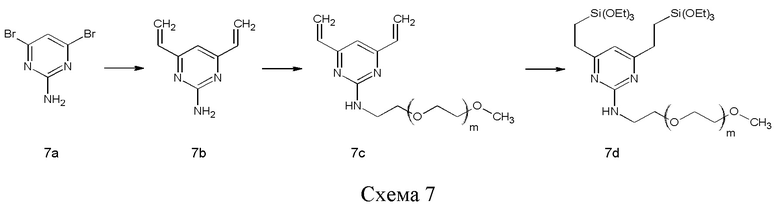
Соединение 7c можно синтезировать путем винилирования 2-амино-4,6-дибромпиримидина (7а) по реакции кросс-сочетания, например, сочетания по реакции Стилла (Stille), с последующим пэгилированием с помощью m-ПЭГ, несущего подходящую уходящую группу на одном конце, такого как m-ПЭГ12-20-OMs (56). Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
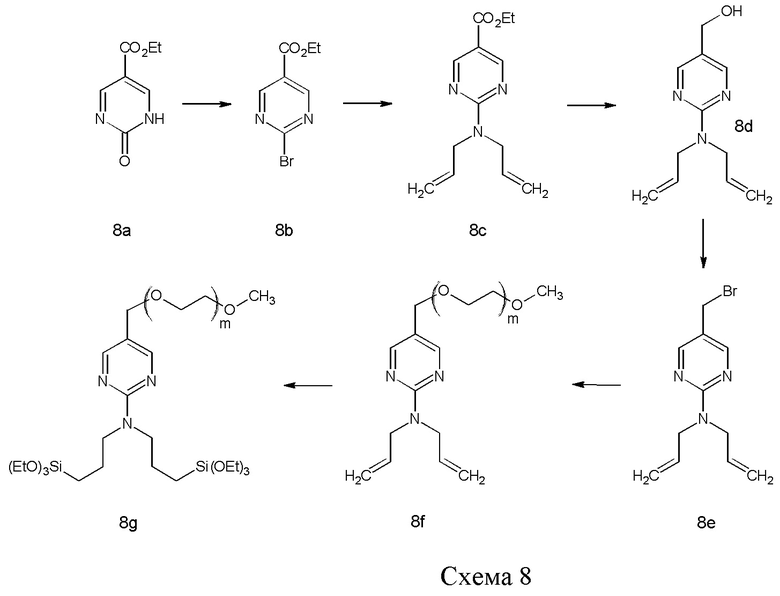
Соединение 8b можно синтезировать из этил-2-оксо-1,2-дигидропиримидин-5-карбоксилата (8а) путем галогенирования с помощью галогенирующего реагента, такого как POCl3 или POBr3, с последующим нуклеофильным замещением галогена на диаллиламин. Сложный эфир можно селективно восстановить с помощью подходящего источника гидрида и полученную спиртовую группу 8d превратить в уходящую группу, такую как галоген, с помощью подходящего реагента, такого как галогенирующий реагент, например, как PBr3. Гидрофильный полимер с подходящей функциональной группой, такой как спиртовая, на одном конце, такой как m-ПЭГ12-20-OH, можно депротонировать сильным основанием, таким как NaH, и затем провести нуклеофильное замещение по бензильному положению. Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, так как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
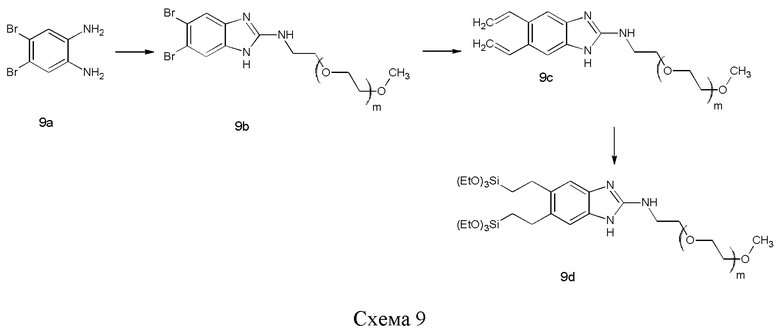
Соединение 9b можно синтезировать из 4,5-дибромо-1,2-диаминобензола (9а), сначала путем образования имидазольного кольца с последующим галогенированием в положении С2 с помощью галогенирующего реагента, такого как HBr и Br2. Введенный таким образом галоген может быть замещен гидрофильным полимером, несущим подходящую функциональную группу, такую как амин, в частности первичный амин. Пример такого соединения представляет собой m-ПЭГ12-20-NH2 (2-(ω-метил-этиленокси12-20)эт-1-иламин). Оставшиеся два ароматических бромида можно подвергнуть винилированию с помощью реакции кросс-сочетания, такой как реакция Стилла (Stille), для получения дивинильного соединения 9 с, которое можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
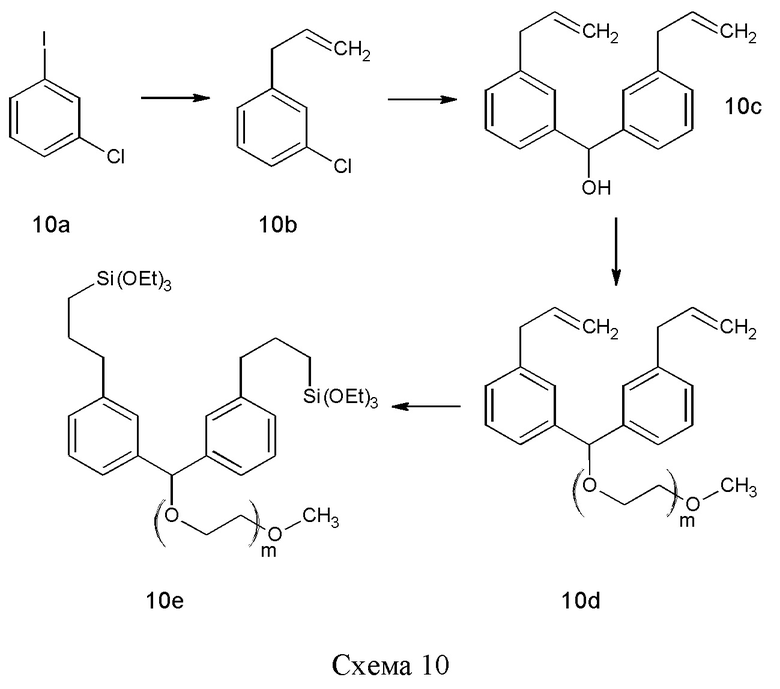
Соединение 10b можно синтезировать, начиная с аллилирования метил-3-хлоройодобензола по реакции кросс-сочетания, например, сочетания по реакции Стилла (Stille). Хлорид в 10b можно обменять на металл, например, Mg, и затем металлорганическое соединение может реагировать с этилформиатом, давая бензиловый спирт 10 с, который можно депротонировать с помощью сильного основания, например, NaH, и затем сочетать с гидрофильным полимером, несущим подходящую уходящую группу, таким как m-ПЭГ12-20-OMs (56). Наконец, две двойные связи в 10d можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
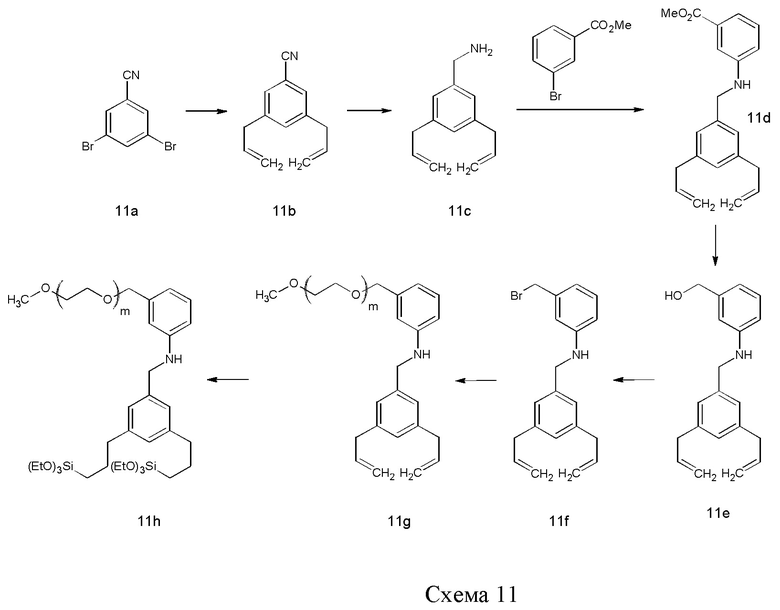
Соединение 11h можно синтезировать, начиная с аллилирования 3,5-дибромобензонитрила (11а) по реакции кросс-сочетания, такой как сочетание по реакции Стилла (Stille). Цианогруппу можно селективно восстановить с помощью подходящего источника гидрида. Полученный амин 11 с можно сочетать с метил-3-бромобензоатом по реакции кросс-сочетания, такой как кросс-сочетание, катализируемое металлом, например, реакция, катализируемая медью, или реакция на основе палладия, такая как кросс-сочетание по Бухвальду (Buchwald), с последующим восстановлением сложного эфира с помощью подходящего источника гидрида. Полученную спиртовую группу в Не можно затем превратить в уходящую группу, такую как галоген, такой как бромид, с помощью подходящего реагента, такого как галогенирующий реагент, как, например, бромирующий реагент, такой как PBr3. Гидрофильный полимер с подходящей функциональной группой, такой как спиртовая, на одном конце, такой как m-ПЭГ12-20-OH, можно депротонировать с помощью сильного основания, такого как NaH, и затем провести нуклеофильное замещение по бензильному положению с образованием 11g. Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt).
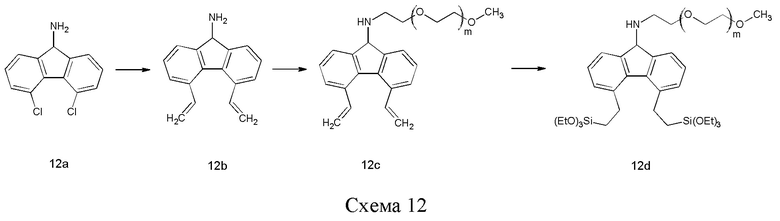
Соединение 12d можно синтезировать, начиная с винилирования 4,5-дихлоро-9Н-флуорен-9-амина (12а) по реакции кросс-сочетания, например, реакции Стилла (Stille) или реакции Сузуки (Suzuki), с последующим сочетанием с гидрофильным полимером, несущим подходящую уходящую группу, таким как m-ПЭГ12-20-OMs (56). Наконец, две двойные связи можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt), с получением 12d.
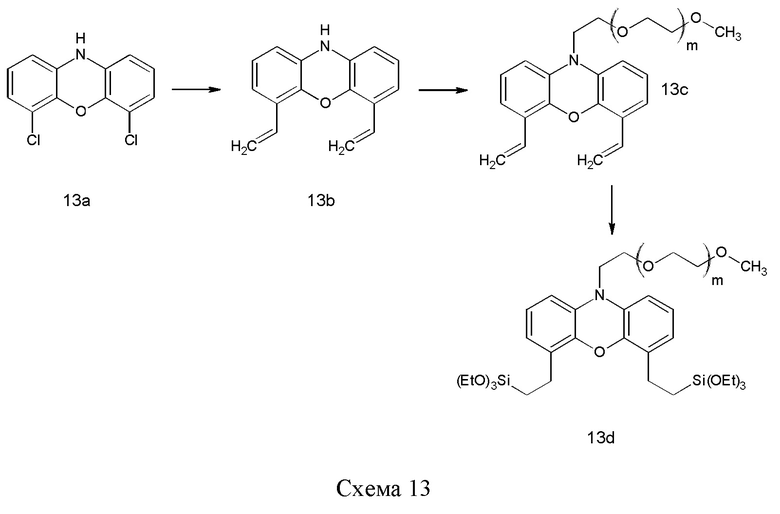
Соединение 13d можно синтезировать, начиная с аллилирования 4,6-дихлорофеноксазина (13а) по реакции кросс-сочетания, например, реакции Стилла (Stille), с последующим пэгилированием с помощью m-ПЭГ, несущего подходящую уходящую группу на одном конце, такого как m-ПЭГ12-20-OMs (56). Наконец две винильные группы в 13 с можно подвергнуть гидросилилированию, например, с помощью (EtO)3SiH и катализатора, такого как платиновый катализатор, например, катализатора Карштедта (Karstedt), с получением 13d.
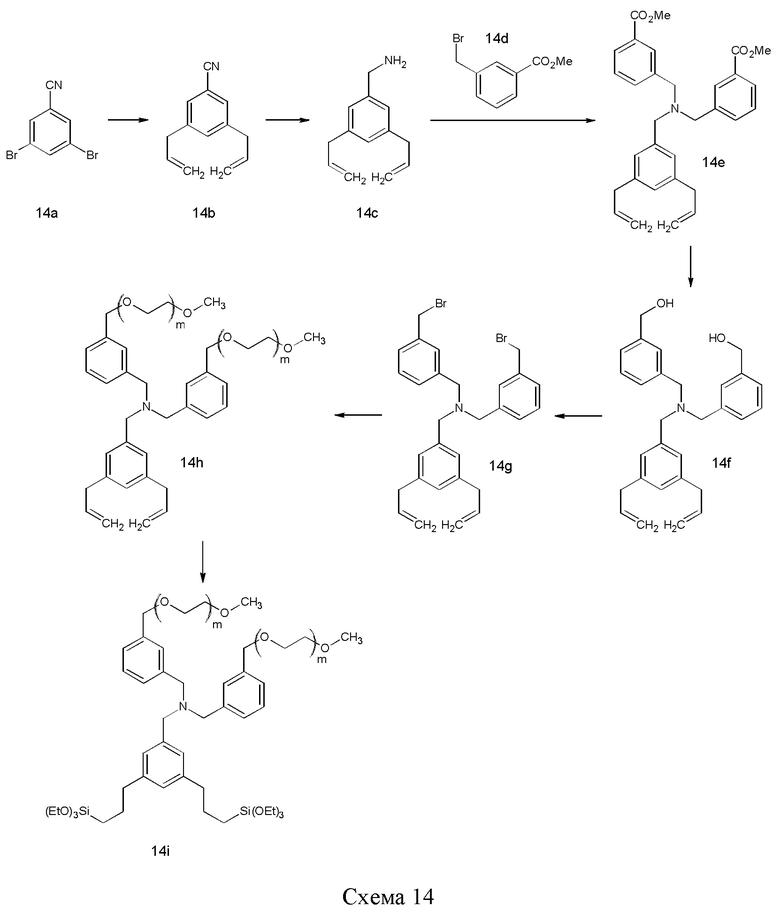
Соединение 14b можно синтезировать путем аллилирования 3,5-дибромобензонитрила (14а) по реакции кросс-сочетания, такой как сочетание по реакции Стилла (Stille). Цианогруппу можно селективно восстановить с помощью подходящего источника гидрида. Полученный амин 14 с можно алкилировать двумя эквивалентами метил-3-метоксикарбонилбензилбромида (14d), с последующим восстановлением сложного эфира с помощью подходящего источника гидрида, например, LAH. Полученную спиртовую группу в 14f можно превратить в уходящую группу, такую как галоген, бромид, с помощью подходящего реагента, такого как галогенирующий реагент, например, РВг3. Гидрофильный полимер с подходящей функциональной группой, такой как спиртовая, на одном конце, такой как m-ПЭГ12-20-OH, можно депротонировать с помощью сильного основания, такого как NaH, и затем провести нуклеофильное замещение по бензильному положению с получением 14h. Наконец, две винильные группы можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt), с получением силана 14i.
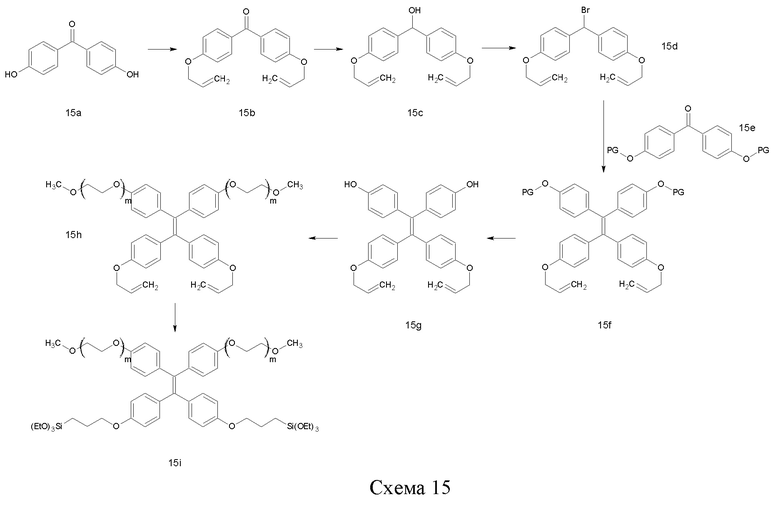
Соединение 15b можно синтезировать путем аллилирования 4,4'-дигидроксибензо-фенона (15а) с помощью нуклеофильного замещения аллилирующего агента, такого как аллилбромид. Карбонильную группу можно восстановить с помощью донора гидридов, с последующим галогенированием с помощью галогенирующего реагента, такого как PBr3. Сочетание с соединением 15е, защищенным по спиртовым функциональным группам с помощью устойчивой с основной среде защитной группы (PG), выбранной из групп, указанных в "Greene's Protective Groups in Organic Synthesis", 5th Edition, P. G. M. Wuts, Wiley, 2014, такой как тетрагидропиранильная группа (ТНР), и фосфония илидом, полученным по реакции 15d с, например, фосфорным реагентом, таким как Ph3P, с последующей обработкой сильным основанием, например, NaH, может обеспечить 15f. После депротонирования с удалением обеих защитных групп на спиртовых группах можно проводить сочетание с гидрофильным полимером, несущим подходящую уходящую группу, таким как m-ПЭГ12-20-OMs (56). Наконец, две двойные связи в 15h можно подвергнуть гидросилилированию с помощью силана, такого как (EtO)3SiH, и катализатора, такого как соединение платины, например, катализатора Карштедта (Karstedt), с получением 15i.
В некоторых воплощениях химическая структура (Формула 1) представляет собой такую, как показана на Схеме 16, где X представляет собой метил или низший алкил, то есть C1-8, R1-R6 независимо выбраны из группы, состоящей из алкокси, арилокси, галогена, диалкиламино, азотсодержащего гетероцикла или ацилоксигруппы, А1 и А2 независимо выбраны из группы, состоящей из СН2, О или S, m является целым числом от 6 до 25, n1 является целым числом от 1 до 3, n является целым числом от 1 до 3.
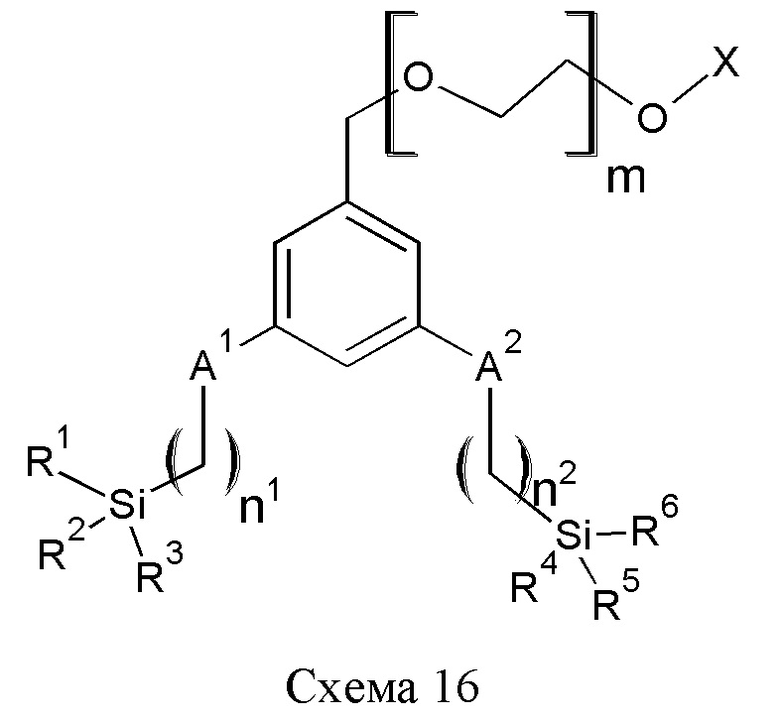
В некоторых воплощениях химическая структура представляет собой такую, как показана на Схеме 16, где X представляет собой метил, R1-R6 представляют собой метокси или этокси, m является целым числом от 12 до 20, n1 и n2 оба составляют 3 и А1 и А2 представляют собой О.
В некоторых воплощениях химическая структура представляет собой такую, как показана на Схеме 16, где X представляет собой метил, R1-R6 представляют собой метокси или этокси, m является целым числом от 12 до 20, n1 и n2 оба составляют 1 и А1 и А2 представляют собой СН2.
Кроме того, настоящее изобретение относится к наноматериалам с покрытием, содержащим остатки гидрофильного полимера указанных химических соединений со Схем 1-16, где один или оба активированных силана, до некоторой степени, образовали ковалентные связи с поверхностью не имеющего покрытия наноматериала, например, 1, 2 или более связей, как показано на Фиг. 2, где X представляет собой ОН, О- или ковалентную связь со связанным с поверхностью кислородом.
Химические соединения по настоящему изобретению могут образовывать биоинертные покрытия наноматериалов. Наноматериалы могут иметь подходящие реакционноспособные группы на своих поверхностях. Пример такой реакционноспособной группы представляет гидроксильная группа. Не ограничиваясь каким-либо образом, такая подходящая группа, в частности, представляет собой походящую Si-OH группу, а также Fe-OH, Hf-OH, Zr-OH, Та-ОН и Ti-OH.
В некоторых воплощениях по настоящему изобретению указанный наноматериал представляет собой наноструктуру.
Часто предпочтительно иметь на поверхности высокую плотность покрытия, такую как более 0,1 остатков покрытия/нм2 или более 0,2 остатков покрытия/нм2, или более 0,5 остатков покрытия/нм2 или более 1 остатка покрытия/нм2, как было получено в настоящем изобретении (пример 12). В частности, устойчивость к взаимодействию с белками зависит от достижения указанной высокой плотности покрытия.
В некоторых воплощениях наноматериал на Фиг. 2 содержит атомы кремния.
В некоторых воплощениях наноматериал на Фиг. 2 содержит атомы фосфора.
В некоторых воплощениях наноматериал на Фиг. 2 содержит атомы кремния и фосфора.
В некоторых воплощениях наноматериал на Фиг. 2 содержит атомы железа, гафния, циркония, тантала, гадолиния, тербия, европия или титана.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие полимерный остов или каркас, содержащий хелатирующие группы.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие полимерный остов или каркас, содержащий или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп -P=O(OR1)(OR2), в которых R1 и R2 независимо выбраны из отрицательного заряда, Н, алкила и арила.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие ионы парамагнитного марганца, включенные в наноструктуры на основе полимерного остова или каркаса, содержащего хелатирующие группы.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие ионы парамагнитного марганца, включенные в наноструктуры на основе полимерного остова или каркаса, содержащего или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп -P=O(OR1)(OR2), в которых R1 и R2 независимо выбраны из отрицательного заряда, Н, алкила и арила.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие ионы парамагнитного марганца, включенные в наноструктуры на основе полимерного остова или каркаса, содержащего или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп -P=O(OR1)(OR2), в которых R1 и R2 независимо выбраны из отрицательного заряда, Н, алкила и арила, и где покрытие содержит ковалентно связанные химические структуры со Схемы 16, где X представляет собой метил, один или более из R1-R3 и/или один или более из R4-R6 представляет собой ковалентную связь с кислородом на поверхности наноструктуры, причем оставшиеся R1-R3 и R4-R6 представляют собой метокси, этокси, ОН или О-; m является целым числом от 6 до 25; n1 и n2 составляют 3; и А1 и А2 представляют собой О.
В некоторых воплощениях наноматериалы на Фиг. 2 представляют собой наноструктуры, содержащие ионы парамагнитного марганца, включенные в наноструктуры на основе полимерного остова или каркаса, содержащего или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных
групп -P=O(OR11)(OR12), в которых R11 и R12 независимо выбраны из отрицательного заряда, Н, алкила и арила, и где покрытие содержит ковалентно связанные химические структуры со Схемы 16, где X представляет собой метил, один или более из R1-R3 и/или один или более из R4-R6 представляет собой ковалентную связь с кислородом на поверхности наноструктуры, причем оставшиеся R1-R3 и R4-R6 представляют собой метокси, этокси, ОН или О-; m является целым числом от 12 до 20; n1 и n2 составляют 3; и А1 и А2 представляют собой О.
В некоторых воплощениях наноматериалы или наноструктуры с покрытием содержат одно или более мест для сопряжения.
В некоторых воплощениях наноматериалы или наноструктуры с покрытием содержат одно или более сопряжений.
В некоторых воплощениях наноматериалы или наноструктуры с покрытием содержат один или более пептидов в качестве сопряжений.
Настоящее изобретение относится также к композициям, таким как фармацевтические композиции, содержащие множество наноструктур с покрытием согласно настоящему изобретению, а также к применению таких композиций наноструктур с покрытием в качестве контрастных агентов или агентов для визуализации для применения в клинической практике, в частности, для применения в качестве контрастных агентов для МРТ.
Наноструктуры с покрытием согласно настоящему изобретению, в форме с введенным марганцем или гадолинием, характеризуются низкой токсичности, допустимой дозой 400 мкммоль/кг для мышей и высокой релаксивностью (25/ммоль/с), что позволяет их использовать в качестве контрастных агентов для МРТ исследований организмов (или частей организмов), в частности млекопитающего, такого как человек.
Сочетание свойств высокой релаксивности и подходящего размера для тех воплощений изобретения, где гидродинамический диаметр, по данным измерений методом ДРС, составляет больше 3 нм, или больше 4 нм, или больше 5 нм, делает композиции, содержащие наноструктуры с покрытием по настоящему изобретению подходящими для визуализации опухолей, в частности твердых опухолей, методом МРТ. Высокая релаксивность и хорошая контрастность, обеспечиваемые в настоящем изобретении, также позволяют использовать указанные наноструктуры с покрытием в качестве контрастных агентов для общей анатомической визуализации, например, ангиографии тонких коронарных артерий сердца, сонных артерий, почечных артерий или аорты.
В некоторых воплощениях по настоящему изобретению раствор, такой как фармацевтически приемлемая композиция наноструктур с покрытием вводится субъекту, такому как человек, парентеральным путем, например, внутривенно, и субъект подвергается исследованию методом МРТ.
Визуализация структур в голове, внутренних органах, таких как печень, поджелудочная железа и кишечник, или конечностях также представляет интерес.Визуализацию толстой кишки также можно получить с помощью внутривенного введения. Для визуализации желудка, печени и верхних отделов кишечника можно вводить контрастное вещество перорально.
Поскольку наноструктуры с покрытием по настоящему изобретению обладают свойствами высокой релаксивности и низкой токсичности, их можно применять для мечения клеток. В этом случае, клетки, например, стволовые клетки или макрофаги, загружают совместно с наноструктурами с покрытием вне организма млекопитающего, например, тела человека, и затем вводят в указанное млекопитающее и генерируют изображение путем МРТ сканирования. Затем можно проследить, как клетки проходят через организм.
Для применения наноструктур с покрытием по настоящем изобретению in-vivo необходимо, чтобы они были получены в виде смесей фармацевтически приемлемым способом в соответствии с наилучшей практикой, хорошо известной специалистам в данной области техники. Предпочтительным способом введения является парентеральный, в частности, внутривенный способ является преимущественным. Однако при определенных обстоятельствах преимущественным может быть внутриартериальное введение, например, когда желателен высокий локальный контраст. Для парентерального введения часто требуется жидкая композиция. Вода является предпочтительным растворителем для введения наноструктур с покрытием по настоящему изобретению в раствор, но один или более со-растворителей или добавок может быть добавлено в количестве 0,1-10% (об./об.) для улучшения стабильности раствора. Подходящими со-растворителями являются спирты, такие как этанол или глицерин; биосовместимые полимеры, такие как полиэтиленгликоль или поливиниловый спирт; диметилсульфоксид; или N-метилпирролидинон. Преимущественным может быть также добавление одного или более регуляторов осмотического давления, таких как хлорид натрия, маннитол, сорбитол, лактоза, глюкоза или другие сахара или сахароспирты. Желательно, чтобы композиция была изоосмотической или в некоторой степени гиперосмотической по отношению к жидкостям организма. Предпочтительно, раствор для внутривенного применения имеет осмоляльность 270-2000 мОсм, или от 280 до 1000 мОсм, или от 280 до 500 мОсм. Многие из указанных добавок могут также выполнять функцию криопротекторов, улучшая эффективность воссоздания после лиофильной сушки. Также может быть преимуществом добавление электролитов для снижения физиологического воздействия при введении раствора. Предпочтительные электролиты представляют собой комбинацию нетоксичных солей натрия, кальция и/или магния. Регулирование рН вводимого раствора является предпочтительным и можно выбрать любой буфер, подходящий для введения. Предпочтительным буфером является Tris-HCl. Антиокислители, такие как, не ограничиваясь указанными, сульфит, дитионит и/или тиосульфат, также можно добавлять для улучшения срока годности композиции.
Концентрацию наноструктур можно описать многими различными способами, но два наиболее подходящих представляют собой массовую концентрацию, выраженную в виде г/л раствора, и концентрацию марганца в ммоль/л раствора. Диапазоны концентрации марганца в композициях, которые подходят для введения в качестве контрастного агента, варьируют в диапазоне 1-500 мМ, или 10-300 мМ, или 10-200 мМ, или 10-100 мМ или 20-80 мМ. Если выражены в виде массовой концентрации и при условии, что отношение фосфора к марганцу составляет около 10, массовые концентрации, которые подходят для композиции контрастного агента, находятся в диапазоне 0,5-300 г/л, или 25-300 г/л, или от 50 до 300 г/л, или 100-300 г/л.
Одно из воплощений настоящего изобретения относится к фармацевтически приемлемой композиции из множества наноструктур согласно настоящему изобретению для внутривенного введения с концентрацией марганца от 10 до 100 мМ и молярным отношением фосфора к марганцу 7-20.
Одно из воплощений настоящего изобретения относится к фармацевтически приемлемой композиции из множества наноструктур согласно настоящему изобретению для внутривенного введения с концентрацией марганца от 40 до 80 мМ и молярным отношением фосфора к марганцу 7-15.
Некоторые воплощения настоящего изобретения относятся к композициям, содержащим множество наноструктур с покрытием согласно настоящему изобретению.
В некоторых воплощениях по настоящему изобретению наноматериалы с покрытием или наноструктуры с покрытием содержат диагностически применимый радиоактивный изотоп, такой как гамма-излучающий изотоп, подходящий для SPECT визуализации, такой как 99Тс, или позитрон-излучающий изотоп, подходящий для ПЭТ визуализации, такой как 68Ga.
Настоящее изобретение также относится к способу получения указанного покрытия из химических соединений согласно настоящему изобретению. Существует много вариантов, доступных специалисту в данной области техники, для производства указанных химических структур, однако, из-за чувствительной природы активированных силанов, их следует вводить позже, в конце способа, например, на последней стадии.
Химические структуры по настоящему изобретению можно получить способом, который в качестве последней химической стадии включает гидросилилирование.
Согласно одному из воплощений настоящего изобретения, способ получения химических соединений согласно настоящему изобретению включает стадию экстракционного разделения на предпоследней химической стадии.
Согласно другому воплощению, способ может включать последовательность операций, включающих экстракцию углеводородом, добавление неорганической соли и экстракцию полярным, не смешиваемым с водой, растворителем, таким как этилацетат, на предпоследней химической стадии.
Кроме того, настоящее изобретение относится к способу производства наноматериалов или наноструктур с покрытием согласно настоящему изобретению. В целом, он включает обеспечение не имеющих покрытия наноматериала или наноструктуры в подходящем растворителе, таком как полярный растворитель, такой как растворитель, содержащий воду или спирт, такой как этиленгликоль, или апротонный полярный растворитель, такой как диметилформамид или диметилсульфоксид, в виде суспензии или раствора. На второй стадии химическое соединение согласно настоящему изобретению (предшественник покрытия) приводят в контакт с указанным раствором или суспензией и, возможно, в присутствии добавки или при регулировании рН, отличающегося от нейтрального, с последующим нагреванием полученной смеси в течение заданного периода времени. Когда целью является производство МРТ контрастного агента, вводят стадию добавления источника марганца, например, соли марганца (II), например, хлорида марганца (II). Авторы настоящего изобретения обнаружили, см. пример 19, что заметно более хороший выход наноструктур с покрытием можно получить, если использовать мочевину, карбонат аммония или аммиак в качестве добавки во время процесса нанесения покрытия. Самые высокие выходы получают в присутствии мочевины. Улучшение может составлять до 20 раз. Авторы настоящего изобретения также обнаружили, что выход наноструктур с покрытием улучшается, когда предшественник покрытия добавляют медленно, например, в течение нескольких часов, например, от 5 до 20 часов. Авторы настоящего изобретения обнаружили, что для получения наилучшей хелатирующей способности марганца в конечных наноструктурах с покрытием реакционную смесь нужно нагревать в течение длительного периода времени, например, 24-168 ч, или 48-120 ч, или 80-110 ч, при температуре 80-120°С или 90-100°С.
Способ нанесения покрытия на наноструктуры можно осуществлять при использовании в качестве добавки мочевины.
Способ нанесения покрытия на наноструктуры можно осуществлять при использовании в качестве добавки мочевины с концентрацией от 0,1 до 1 М.
Способ нанесения покрытия на наноструктуры можно осуществлять при использовании в качестве добавки мочевины с концентрацией от 0,4 до 0,6 М.
Способ нанесения покрытия на наноструктуры можно осуществлять при использовании в качестве добавки карбоната аммония или аммиака с концентрацией от 0,1 до 1 М.
Способ нанесения покрытия на наноструктуры можно осуществлять при использовании в качестве растворителя смеси воды и этиленгликоля.
Способ нанесения покрытия на наноструктуры можно осуществлять так, что предшественник покрытия добавляют в течение нескольких часов.
Способ нанесения покрытия на наноструктуры можно осуществлять так, что предшественник покрытия добавляют в течение 5-20 часов.
Способ нанесения покрытия на наноструктуры можно осуществлять так, что предшественник покрытия добавляют в течение 8-12 часов.
Способ нанесения покрытия на наноструктуры можно осуществлять так, что предшественник покрытия добавляют при температуре от 80 до 100°С.
Способ нанесения покрытия на наноструктуры можно осуществлять так, что после добавления предшественника покрытия температуру поддерживают от 90 до 110°С в течение от 80 до 120 ч.
Наноструктуры можно очищать путем фильтрации, например, тангенциальной фильтрации с продольным потоком.
Наноструктуры можно очищать путем тангенциальной фильтрации с продольным потоком, сначала через фильтр с большими порами для удаления нежелательно больших примесей и затем сбора в виде раствора фильтрата на фильтре с небольшими порами, где удаляются остатки растворителя и примеси небольших молекул.
Наноструктуры можно очищать путем тангенциальной фильтрации с продольным потоком, сначала через фильтр с номинальным пределом отсечения от 50 до 100 кДа для удаления нежелательно больших примесей и затем сбора в виде раствора фильтрата на фильтре с номинальной пределом отсечения 10 кДа или меньше, где удаляются остатки растворителя и примеси небольших молекул.
Конкретные воплощения
1. Химическое соединение, содержащее ядро, по меньшей мере один остаток гидрофильного полимера и по меньшей мере две якорные группы, где каждая якорная группа содержит группу активированного силана.
2. Химическое соединение согласно воплощению 1, в котором ядро является ароматическим ядром.
3. Химическое соединение согласно воплощению 1, в котором ядро является карбоциклическим неароматическим ядром.
4. Химическое соединение согласно воплощению 3, в котором ядро является гетероциклом.
5. Химическое соединение согласно любому из воплощений 1-4, в котором якорные группы включают якорные группы со следующей общей формулой A-(CH2)nSiY3, где А представляет собой ковалентную связь, СН2 или О, "n" является целым числом от 1 до 3, и Y независимо выбран из группы, состоящей из алкоксигруппы, арилоксигруппы, галогена, диалкиламиногруппы, азотсодержащего гетероцикла и ацилоксигруппы, где по меньшей мере две якорные группы могут быть одинаковыми или разными.
6. Химическое соединение согласно любому из воплощений 1-5, в котором остаток гидрофильного полимера представляет собой ПЭГ (полиэтиленгликоль).
7. Химическое соединение согласно любому из воплощений 1-5, в котором остаток гидрофильного полимера представляет собой m-ПЭГ (метилированный на конце полиэтиленгликоль).
8. Химическое соединение согласно воплощению 6 или 7, в котором остаток гидрофильного полимера имеет длину цепи 10-500 остатков этиленгликоля.
9. Химическое соединение согласно воплощению 6 или 7, в котором остаток гидрофильного полимера имеет длину цепи 10-50 остатков этиленгликоля.
10. Смесь химического соединения согласно воплощению 6 или 7, в котором длина цепи остатков гидрофильного полимера составляет от 6 до 25 остатков этиленгликоля, причем 16 является наиболее распространенным.
11. Наноструктура с покрытием, содержащая остатки химических соединений согласно любому из воплощений 1-9, в которой один или оба активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры.
12. Наноструктура с покрытием, содержащая смесь согласно воплощению 10, в которой один или оба активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры.
13. Наноструктура с покрытием согласно воплощению 11 или 12, которая содержит полимерный остов, содержащий или в который дополнительно введены остатки мономера, содержащие геминальную бисфосфонатную группу и две органические оксисилановые группы.
14. Наноструктура с покрытием согласно воплощению 11 или 12, которая содержит полимерный остов, содержащий или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп, имеющих общую формулу -P=O(OR11)(OR12), в которой R11 и R12 независимо выбраны из отрицательного заряда, Н, алкильной группы и арильной группы, причем в полимерный остов дополнительно введены остатки мономера, содержащие геминальную бисфосфонатную группу и две органические оксисилановые группы.
15. Наноструктура с покрытием согласно любому из воплощений 11-14, в которой гидродинамический диаметр наноструктуры с покрытием составляет 2-50 нм.
16. Наноструктура с покрытием согласно любому из воплощений 11-14, в которой гидродинамический диаметр наноструктуры с покрытием составляет 3-10 нм.
17. Наноструктура с покрытием согласно любому из воплощений 11 - 14, в которой гидродинамический диаметр наноструктуры с покрытием составляет 3-7 нм.
18. Наноструктура с покрытием согласно любому из воплощений 11 - 14, в которой гидродинамический диаметр наноструктуры с покрытием составляет 10-50 нм.
19. Наноструктура с покрытием согласно любому из воплощений 11-14, в которой гидродинамический диаметр наноструктуры с покрытием составляет 10-20 нм.
20. Наноструктура с покрытием согласно любому из воплощений 11-19, которая дополнительно содержит ион марганца (II) или гадолиния (III).
21. Наноструктура с покрытием согласно воплощению 20, в которой молярное отношение Р/Mn составляет 5-20.
22. Наноструктура с покрытием согласно воплощению 20 или 21, в которой молярное отношение Si/Mn составляет 4-20.
23. Наноструктура с покрытием по любому из воплощений 20-22, которая содержит полимерный остов, содержащий или в который дополнительно введены остатки мономера, содержащие геминальную бисфосфонатную группу, и в которой ионы марганца координированы фосфонатными группами.
24. Наноструктура с покрытием согласно любому из воплощений 11-19, дополнительно содержащая радионуклид для визуализации и/или радиотерапии.
25. Способ получения наноструктуры с покрытием согласно любому из воплощений 11-19, включающий стадии:
- обеспечения наноструктуры и
- приведения указанной наноструктуры в контакт с по меньшей мере одним из химических соединений согласно любому из воплощений 1-9 или со смесью согласно воплощению 10.
26. Способ получения наноструктуры с покрытием согласно любому из воплощений 20-23, включающий стадии:
- обеспечения наноструктуры, содержащей полимерный остов, содержащий или в который дополнительно введены остатки мономера, содержащие геминальную бисфосфонатную группу;
- приведения указанной наноструктуры в контакт с по меньшей мере одним из химических соединений согласно любому из воплощений 1-9 или со смесью согласно воплощению 10; и
- приведения указанной наноструктуры в контакт с ионами марганца или ионами гадолиния.
27. Способ согласно воплощению 25 или 26, дополнительно включающий стадию, на которой наноструктуры очищают путем ультрафильтрации.
29. Способ получения наноструктуры с покрытием согласно воплощению 24, включающий стадии:
- обеспечения наноструктуры, содержащей геминальные бисфосфонатные группы;
- приведения указанной наноструктуры в контакт с по меньшей мере одним из химических соединений согласно любому из воплощений 1-9 или со смесью согласно воплощению 10; и
- приведения указанных наноструктур в контакт с радионуклидом для визуализации и/или радиотерапии.
30. Способ согласно воплощению 29, дополнительно включающий стадию, на которой наноструктуры очищают путем ультрафильтрации.
31. Композиция, содержащая наноструктуру с покрытием согласно любому из воплощений 11-19.
32. Композиция, содержащая наноструктуру с покрытием согласно любому из воплощений 20-23.
33. Композиция, содержащая наноструктуру с покрытием согласно воплощению 24.
34. Применение наноструктуры с покрытием по любому из воплощений 20-23 или композиции согласно воплощению 32 в качестве контрастного агента для МРТ.
35. Применение наноструктуры с покрытием согласно воплощению 24 или композиции согласно воплощению 33 в качестве агента для визуализации методом ПЭТ и/или SPECT.
36. Применение наноструктуры с покрытием согласно воплощению 24 или композиции согласно воплощению 33 в радиотерапии.
37. Наноструктура с покрытием по любому из воплощений 20-23 или композиция согласно воплощению 32 для применения в качестве контрастного агента для МРТ.
38. Наноструктура с покрытием согласно воплощению 24 или композиция согласно воплощению 33 для применения для визуализации методом ПЭТ и/или SPECT.
39. Наноструктура с покрытием согласно воплощению 24 или композиция согласно воплощению 33 для применения в радиотерапии.
Примеры
Общие детали эксперимента
SIR-200 приобретали у Resintech, USA (resintech.com) и активировали с помощью Na2S, осторожно промывали и сушили перед использованием.
Сокращения: диметилформамид (ДМФА), тетрагидрофуран (ТГФ), дихлорометан (ДХМ), политетрафторэтилен (ПТФЭ), этилацетат (EtOAc), метанол (МеОН), этанол (EtOH), ацетат калия (KOAc), ацетонитрил (MeCN), алюмогидрид лития (LAH).
Пример 1: Синтез соединения 6, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол
m=12-20, наиболее предпочтительно 16.
Пример 1а: Соединение 2, 3,5-диаллилоксиаллилбензоат.3,5-дигидроксибензойную кислоту (1) (100 г, 0,65 моль) растворяли в ДМФА (500 мл), под азотом, перемешивали в 2-л реакторе мешалкой с 4 лопастями из нержавеющей стали. Карбонат калия (345 г, 2,5 моль, Fw=138,2 г/моль) добавляли ложкой, стараясь избегать образования осадка. Температура возрастала от 22 до 34°С и смесь становилась густой. Реактор соединяли со змеевиковым конденсатором и температуру рубашки устанавливали на 50°С. Аллилбромид (344 г, 246 мл, 2,85 моль, d=1,40 г/мл, Mw=121 г/моль) заливали в уравновешенную по давлению капельную воронку на 250 мл и подсоединяли к реактору. Когда внутренняя температур достигала 47°С, начинали добавление порциями по 25 мл для первых 150 мл и затем порциями по 50 мл. Внутреннюю температуру доводили до пиковой (от 50 до 57°С) и понижали на градус или до 55°С перед следующим добавлением. Общее время добавление составляло 2 ч 15 мин. Реакционную смесь оставляли при перемешивании при температуре рубашки 50°С до следующего дня. Суспензию удаляли через нижний кран (промывали 60 мл ДМФА) и собирали в бутыли объемом 1 л и пропускали через фильтр из стекловолокна на воронке Бюхнера (Buchner).
Осадок промывали 3×60 мл ДМФА. Реактор очищали водой и повторно вводили раствор ДМФА. Реактор оснащали насадкой для перегонки с эффективным змеевиковым конденсатором. Давление в реакторе понижали (вакуумная линия, около 20 мбар) и ДМФА быстро отгоняли при постепенном возрастании температуры рубашки от 70 до 85°С, температурой жидкости 53-75°С и температурой паров 50-53°С. Побочный продукт аллилкарбонат калия осаждался в виде масла после удаления ДМФА. Остаток сливали через нижний кран, пока он еще теплый, и собирали в круглодонную колбу объемом 500 мл. Аллилкарбонат затвердевал в виде комков после стояния в холодильнике в течение ночи. Масло/твердые вещества переносили в 4 центрифужные пробирки по 50 мл и центрифугировали. Продукт в виде надосадочной жидкости декантировали. Выход 142 г, 518 ммоль, 80%. 1H ЯМР (400 МГц, CDCl3): δ=7,23 (с, 2Н), 6,70 (с, 2Н), 6,05 (м, 3Н), 5,42 (м, 3Н), 5,30 (м, 3Н), 4,81 (д, J=5,58 Гц, 2Н), 4,55 (д, J=5,20 Гц, 4Н).
Пример 1b: Соединение 3, 3,5-диаллилоксибензиловый спирт. 2-х литровый реактор с рубашкой снабжали эффективным холодильником и мешалкой с двумя лопастями, покрытыми ПТФЭ. Охлаждающую спираль холодильника соединяли с независимым температурным регулятором на основе силиконового масла. Систему сушили под вакуумом при установленной температуре рубашки 130°С в течение нескольких часов и затем систему заполняли азотом и давали охладиться. Сухой метил-трет-бутиловый простой эфир (МТВЕ, 1,5 l) добавляли в реактор с помощью мензурки через силиконовую мембрану. Добавляли гранулы алюмогидрида лития (20 г, 0,158 моль, Fw=37,95), сначала только для проверки того, что уровень влажности в системе минимальный, а затем остальное. Температура возрастала примерно на один градус.Гранулы не растворялись. Сложный эфир из примера 1а (210 г, 0,766 моль) растворяли в сухом МТВЕ (500 мл) под азотом в капельной воронке. Капельную воронку присоединяли к реактору. Температуру рубашки устанавливали на 28°С и температуру холодильника устанавливали на 5°С. Когда внутренняя температура достигала 25°С, небольшими порциями через капельную воронку добавляли исходный материал. Реакция является высоко экзотермичной, и поэтому температура возрастает сразу после каждого добавления. Как только температура достигала максимума, можно добавлять следующую небольшую порцию. Добавление занимало 2 ч, и максимальная температура составляла 34°С. Через 1 ч перемешивания температуру рубашки устанавливали на 0°С и, когда внутренняя температура достигала 5°С, очень осторожно добавляли воду (20 мл) (3×0,1, 0,2, 0,2, 0,3, 0,3, 0,4, 0,4, 0,5, 0,5, 4×0,6, 3×1, 1,5, 5, 5 мл). При добавлении первых капель реакция была очень бурной. Температуре давали снижаться до 5°С после каждой порции. Общее время добавления составило 1 ч 10 минут. Перед тем как двигаться дальше, LiAlH4 гранулы не были видны. Добавляли 20 мл 15% (масс/об.) водного NaOH, а затем еще 60 мл воды. Суспензию перемешивали в течение 15 мин и затем температуру устанавливали на 20°С и перемешивали смесь в течение еще 20 минут. Образовывался белый гранулированный осадок. Добавляли безводный MgSO4 (150 г) и полученную смесь перемешивали еще в течение часа. Суспензию сливали через нижний кран и отфильтровывали на фильтре из стекловолокна (GF/A). Осадок дважды промывали 300 мл МТВЕ и объединенные фильтраты упаривали на роторном испарителе. Выход 161,7 г, 96%. 1Н ЯМР (400 МГц, CDCl3): δ=6,54 (шир. с, 2Н), 6,43 (с, 1H), 6,05 (м, 2Н), 5,42 (д, J=17,69 Гц, 2Н), 5,29 (д, J=9,65 Гц, 2Н), 4,62 (с, 2Н), 4,52 (д, J=5,15 Гц, 4Н).
Пример 1 с: Соединение 4, 3,5-диаллилоксибензилбромид. 2-л реактор с рубашкой с регулятором температуры снабжали мембраной и мешалкой с двумя лопастями, покрытыми ПТФЭ. Систему заполняли азотом и диаллилоксибензиловым спиртом 3 из примера 1b (42,2 г, 0,192 моль) в ДХМ (500 мл) вводили в реактор. Регулятор температуры устанавливали на 0°С и, когда внутренняя температура достигала 2°С, порциями при перемешивании через мембрану добавляли PBr3 (22,3 мл, 64,3 г, 0,238 моль, 1,24 eq, Mw=270,69). Реакция умеренно экзотермическая, но температура не должна подниматься выше 5°С. Общее время добавления составило 30 минут. Через 5 минут реакцию гасили путем добавления твердого NaHCO3 (36 г, 0,43 моль Fw: 84,01). Температура возрастала от 1 до 12С с медленным началом. Через 30 минут добавляли 22 г безводного MgSO4 и затем 90 г диоксида кремния. Смесь откачивали (диоксид кремния, если используется, разрушает нижний кран) и отфильтровывали через фильтр из стекловолокна. Отфильтрованный осадок промывали 2×100 мл ДХМ и упаривали с помощью бани при температуре 20°С. Продукт был чувствителен к температуре, хранили в холодильнике или морозильнике. Продукт получали в виде коричневого масла (50 г, 0,177 моль, 92% выход). 1Н ЯМР (400 МГц, CDCl3): δ=6,56 (д, J=2,29 Гц, 2Н), 6,44 (т, J=2,05 Гц, 1H), 6,05 (м, 2Н), 5,42 (дк, J=17,10, 0,95 Гц, 2Н), 5,30 (дк, J=10,13, 1,90 Гц, 2Н), 4,52 (дт, J=5,13, 1,71 Гц, 4Н), 4,41 (с, 2Н).
Пример 1d: Соединение 5, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис[(проп-2-ен-1-ил)окси]бензол. Для получения, m-ПЭГ12-20-ОН (полидисперсный) сушили путем нагревания до 40°С под вакуумом в течение ночи в круглодонной колбе. Реактор сушили под вакуумом при установленной температуре рубашки 130°С в течение 1 ч и затем систему заполняли азотом и давали охладиться. NaH (10,1 г, 0,25 моль, 60% в минеральном масле, 1,1 экв.) загружали в реактор, а затем ТГФ (230 мл, безводный), который переносили из бутыли с герметичным уплотнением в реактор через иглу с двумя концами. Регулятор температуры устанавливали на 0°С. Когда внутренняя температура была ниже 2°С, раствор m-ПЭГ12-20-ОН (173,9 г, 0,23 моль, 1,0 экв.) в ТГФ (115 мл, безводный) добавляли по каплям в течение 15 минут при росте температуры до 7°С. Перемешивание продолжали в течение еще 1 ч и затем регулятор температуры устанавливали на 10°С. Раствор диаллилоксибензилбромида из примера 1 с (65 г, 0,23 моль) в ТГФ (45 мл, безводный) заполняли в капельную воронку. Капельную воронку присоединяли к реактору и раствор добавляли в течение 15 минут. Внутренняя температура возрастала до 17°С. Регулятор температуры устанавливали на 18°С и перемешивание продолжали в течение еще 2 часов. После этого реакционную смесь охлаждали до 5°С и реакцию гасили путем добавления по каплям 0,1 М HCl раствора (230 мл), достигая рН 5,5. Смеси давали нагреться до комнатной температуры с последующим упариванием органического растворителя. Твердый остаток разбавляли водой до объема 800 мл. Добавляли твердый NaCl (32,5 г), а затем добавляли гептан (200 мл) и толуол (30 мл) и полученную смесь перемешивали в течение 15 минут.Органическую фазу удаляли и процедуру экстракции повторяли еще 3 раза. Водную фазу затем экстрагировали EtOAc (200 мл×3). Объединенные EtOAc фазы сушили с помощью MgSO4, отфильтровывали и упаривали, получая соединение 5 (170 г, 78% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ=6,52 (д, J=1,98 Гц, 2Н), 6,42 (с, 1H), 5,41 (д, J=17,13 Гц, 2Н), 5,28 (д, J=10,28 Гц, 2Н), 4,51 (м, 6Н), 3,71-3,58 (м, 54Н), 3,55 (м, 2Н), 3,38 (с, 3Н).
Пример 1е: Соединение 6, 1-[ω-метил-(этиленокси)12-20 метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол. 2-л реактор с рубашкой с регулятором температуры снабжали мембраной и мешалкой с двумя лопастями, покрытыми ПТФЭ. Систему заполняли азотом и добавляли 3,5-диаллилоксибензилокси ПЭГ 5 из примера 1d (170,0 г, 178,3 ммоль) и сухой толуол (700 мл, перенос с помощью иглы) и триэтоксисилан (136,9 мл, 121,9 г, 0,713 моль, 4,0 экв.). Температуру бани устанавливали на 40°С. Катализатор Карштедта (Karstedt) (5 мл, 2% в ксиленах). Максимум температуры составлял 59°С. Когда температура возвращалась до 40°С, добавляли еще раствора катализатор (1,0 мл) и не наблюдали роста температуры. Оставляли в течение ночи при комнатной температуре. 1Н ЯМР неочищенного остатка показал отсутствие олефиновых компонентов и присутствие триэтоксисилильной группы в молекуле. Растворитель упаривали и избыток силана удаляли путем упаривания с безводным толуолом (60 мл). Продукт растворяли в толуоле (400 мл), дегазированном с помощью 3 циклов вакуум/азот и перемешивали с активированным SIR-200 (180 г) в течение 4 дней. Фильтрация и упаривание давали 190,0 г (148,7 ммоль, выход 83%) соединения 6 в виде слабоокрашенного масла (выход 99%), которое использовали непосредственно для экспериментов по нанесению покрытий.
Пример 2: Синтез соединения 14, 5,5'-бис[ω-метил-(этиленокси)12-20метил]-3,3'-бис[(проп-3-триэтоксисилил-1 -ил)окси]-1,1'-бифенил.
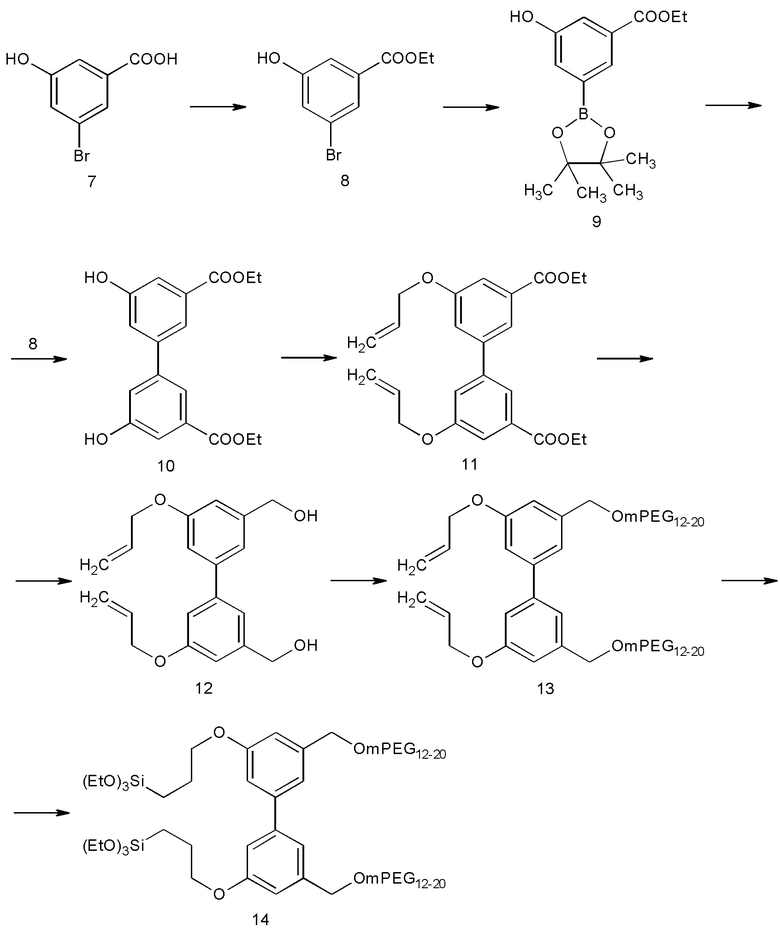
Пример 2а: Соединение 8, этиловый эфир 3-бромо-5-гидроксибензойной кислоты. В раствор соединения 7 (1,00 г, 4,38 ммоль) в EtOH (9 мл) по каплям при 0°С добавляли SOCl2 (1,08 г, 0,80 мл, 8,76 ммоль, 2,0 экв.). По окончании добавления реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Затем удаляли растворитель при пониженном давлении и желтый остаток пропускали через короткую колонку диоксида кремния (гептан: EtOAc=20: 1) с получением целевого продукта 8 в виде белых кристаллов (1,06 г, 4,32 ммоль, выход 99%). 1Н и 13С ЯМР согласовывались с литературными данными [Tetrahedron 2016, 72, 3567-3578].
Пример 2b: Соединение 9, этиловый эфир 3-гидрокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты. В высушенную пламенем колбу Шленка (Schlenk) загружали соединение 8 (1,68 г, 6,88 ммоль), бис(пинаколато)диборон (1,94 г, 7,57 ммоль, 1,1 экв.), PdCl2(dppf) в. ДХМ (281,1 мг, 0,34 ммоль, 0,05 экв.) и КОАс (2,05 г, 20,65 ммоль, 3,0 экв.) под атмосферой азота, а затем сухой и дегазированный диоксан (35 мл). Полученную смесь нагревали до 80°С в течение 20 ч. После ее охлаждения до комнатной температуры ее отфильтровывали через колонку цеолита с помощью EtOAc и полученный остаток очищали с помощью флеш-хроматографии на короткой колонке (гептан: EtOAc=4:1) с получением целевого продукта 9 с количественным выходом в виде желтоватого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ=8,04 (с, 2Н), 7,63 (с, 2Н), 7,46 (с, 1H), 4,38 (к, J=7,07 Гц, 2Н), 1,40 (т, J=7,07 Гц, 3Н), 1,36 (с, 12Н).
Пример 2 с: Соединение 10, 3,3'-диэтоксикарбонил-5,5'-дигидрокси-1,1'-бифенил. В высушенной пламенем колбе Шленка (Schlenk) соединение 9 (2,01 г, 6,88 ммоль) растворяли в безводном ТГФ (30 мл), и соединение 8 (1,83 г, 7,48 ммоль, 1,1 экв.) добавляли в раствор. После этого добавляли туда Pd(PPh3)4 (0,803 г, 0,69 ммоль, 0,1 экв.) и водный дегазированный 2 М раствор K2CO3 (13,8 мл, 27,5 ммоль) и кипятили смесь с обратным холодильником в течение 48 ч. Добавляли ДХМ (15 мл) и водный слой дважды экстрагировали ДХМ. После сушки с помощью MgSO4 продукт очищали с помощью флеш-хроматографии (гептан: EtOAc=3:2) с получением соединения 10 (1,92 г, 5,81 ммоль, выход 84%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6): δ=10,05 (с, 2Н), 7,58 (с, 2Н), 7,38 (с, 2Н), 7,25 (с, 2Н), 4,33 (к, J=7,25 Гц, 4Н), 1,33 (т, J=7,07 Гц, 6Н).
Пример 2d: Соединение 11, 3,3'-диаллилокси-5,5'-диэтоксикарбонил-1,1'-бифенил. В суспензию диола 10 (630,0 мг, 1,91 ммоль) и K2CO3 (1,33 г, 9,54 ммоль, 5,0 экв.) в сухом MeCN (7 мл) добавляли аллилбромид (0,67 мл, 7,63 ммоль, 4,0 экв.) и полученный раствор кипятили с обратным холодильником в течение 20 ч и затем отфильтровывали через цеолит, промывали EtOAc. После упаривания растворителя остаток пропускали через короткую колонку диоксида кремния (гептан: EtOAc=3:2) с получением соединения 12 (767,0 мг, 1,87 ммоль, выход 98%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3): δ=7,89 (с, 2Н), 7,60 (с, 2Н), 7,36 (с, 2Н), 6,15-6,05 (м, 2Н), 5,48 (д, J=17,15 Гц, 2Н), 5,35 (д, J=10,61 Гц, 2Н), 4,66 (д, J=5,30 Гц, 4Н), 4,42 (к, J=7,07 Гц, 4Н), 1,43 (т, J=7,25 Гц, 6Н).
Пример 2е: Соединение 12, 3,3'-диаллилокси-5,5'-дигидроксиметил-1,1'-бифенил. В раствор соединения 11 (500,0 мг, 1,22 ммоль) в толуоле (15 мл) добавляли Red-Al (1,59 мл, 4,87 ммоль, 4,0 экв.) при 0°С под атмосферой азота. После перемешивания в течение 1 ч реакцию останавливали в соответствии с обработкой Физера (Fieser) (J. Org. Chem. 1953, 75, 1190). Собранный фильтрат пропускали на короткой колонке диоксида кремния (гептан: EtOAc=1:1→1:4) с получением 12 (332,0 мг, 1,02 ммоль, выход 83%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ=7,18 (с, 2Н), 7,07 (с, 2Н), 6,95 (с, 2Н), 6,14-6,05 (м, 2Н), 5,45 (д, J=17,2 Гц, 2Н), 5,32 (д, J=10,6 Гц, 2Н) (к, J=7,07 Гц, 2Н), 4,74 (с, 4Н), 4,61 (д, J=4,5 Гц, 4Н).
Пример 2f: Соединение 13, 5,5'-бис[ω-метил(этиленокси)12-20метил]-3,3'-[(пропоен-1-ил)окси]-1,1'-бифенил. В раствор соединения 12 (70,0 мг, 0,214 ммоль) в ТГФ (1,0 мл) добавляли NaH (21,4 мг, 0,536 ммоль, 2,5 экв.) при 0°С и полученную суспензию перемешивали в течение 30 минут, после чего раствор соединения 56 из примера 16 (340,8 мг, 0,407 ммоль, 1,9 экв.) в ТГФ (1,0 мл) добавляли при той же температуре. Реакционной смеси давали после этого нагреться до комнатной температуры и перемешивали в течение ночи. Затем суспензию гасили с помощью Н2О (0,1 мл) и упаривали растворитель. Полученное масло очищали с помощью флеш-хроматографии (ДХМ→ДХМ: МеОН=95:5) с получением соединения 13 в виде оранжевого масла (222,3 мг, 58% выход). 1Н ЯМР (400 МГц, CDCl3): δ=7,13 (с, 2Н), 7,05 (с, 2Н), 6,93 (с, 2Н), 6,09 (м, 2Н), 5,45 (д, J=18,81 Гц, 2Н), 5,30 (д, J=10,45 Гц, 2Н), 4,59 (м, 8Н), 3,78-3,59 (м, 65Н), 3,55 (м, 2Н), 3,39 (с, 3Н).
Пример 2g: Соединение 14, 5,5'-бис[ω-метил-(этиленокси)12-20 метил]-3,3'-бис[(проп-3-триэтоксисилил-1-ил)окси]-1,1'-бифенил. В раствор соединения 13 (222,3 мг, 0,124 ммоль) и триэтоксисилана (84,8 мг, 95,3 мкл, 0,497 ммоль, 4,0 экв.) в толуоле (1,5 мл) добавляли катализатор Карштедта (16,6 мкл, 2,1-2,3 моль % в ксилене) и полученный раствор нагревали до 40°С в течение ночи. Реакцию контролировали методом 1Н ЯМР по исчезновению олефиновых компонентов и появлению триэтоксисилильной группы в молекуле. Полученный оранжевый раствор охлаждали до комнатной температуры и упаривали растворитель при пониженном давлении. Для удаления оставшихся следовых количеств непрореагировавшего триэтоксисилана, добавляли толуол (3,0 мл×3) и снова упаривали при пониженном давлении с получением соединения 14 (262,6 мг) в виде оранжевого масла (выход 99%), которое непосредственно использовали для экспериментов по нанесению покрытия.
Пример 3: Синтез соединения 20, 1,3-бис[ω-метил-(этиленокси)12-20метил]-4,6-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол.
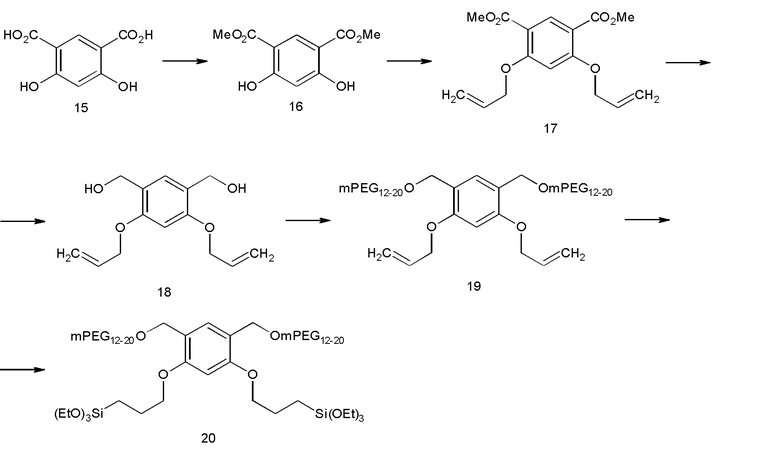
Пример 3а: Соединение 16, диметиловый эфир 4,6-дигидроксиизофталевой кислоты. В раствор соединения 15 (700,0 мг, 3,36 ммоль) в МеОН (18 мл) по каплям при 0°С добавляли SOCl2 (1,63 г, 1,22 мл, 13,43 ммоль, 4,0 экв.). По завершении добавления реакционную смесь кипятили с обратным холодильником в течение ночи. Полученную суспензию охлаждали до 0°С и затем отфильтровывали, промывая холодным метанолом, с получением соединения 16 в виде белых кристаллов (506,2 мг, 2,24 ммоль, выход 67%). 1Н и 13С ЯМР соответствовали литературным данным [Eur. J. Org. Chem. 2013, 36, 8135-8144].
Пример 3b: Соединение 17, диметиловый эфир 4,6-диаллилоксиизофталевой кислоты. Ту же процедуру, как для синтеза соединения 11, применяли для синтеза соединения 17. Выход=79%. 1Н ЯМР (400 МГц, CDCl3): δ=8,49 (с, 1H), 6,49 (с, 1H), 6,12-6,02 (м, 2Н), 5,56 (д, J=17,33 Гц, 2Н), 5,36 (д, J=10,61 Гц, 2Н), 4,68 (д, J=4,77 Гц, 4Н), 3,88 (с, 6Н).
Пример 3с: Соединение 18, 1,3-бис(гидроксиметил)-4,6-диаллилоксибензол. Ту же процедуру, как для синтеза соединения 12, применяли для синтеза соединения 18. Выход=99%. 1Н ЯМР (400 МГц, CDCl3): δ=7,20 (с, 1H), 6,47 (с, 1H), 6,11-6,01 (м, 2Н), 5,42 (д, J=17,15 Гц, 2Н), 5,31 (д, J=10,61 Гц, 2Н), 4,64 (с, 4Н), 4,58 (д, J=5,13 Гц, 4Н).
Пример 3d: Соединение 19, 1,3-бис[ω-метил(этиленокси)12-20метил]-4,6-[(проп-2-ен-1-ил)окси]бензол. В раствор диола 18 (50,0 мг, 0,20 ммоль) в ДХМ (3,0 мл) добавляли при 0°С PBr3 (0,499 мл, 1 М в ДХМ, 0,50 ммоль, 2,5 экв.). Через 20 минут добавляли раствор насыщенного NaHCO3 и органический слой отделяли. Водную фазу экстрагировали ДХМ (3×3 мл) и объединенные органические фазы сушили над MgSO4, отфильтровывали и упаривали растворитель при пониженном давлении с получением дибромированного промежуточного соединения в виде желтого твердого вещества. В другую колбу Шленка, загруженную раствором m-ПЭГ12-20-ОН (327,1 мг, 0,43 ммоль) в диоксане (0,5 мл), добавляли при 12°С NaH (21,6 мг, 0,54 ммоль, 60% дисперсия в минеральном масле) и полученную суспензию перемешивали в течение 30 минут, после чего раствор предварительно приготовленного бромированного промежуточного соединения в диоксане (0,5 мл) добавляли при той же температуре. Затем реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 40 ч. Затем суспензию гасили с помощью Н2О (0,1 мл) и растворитель упаривали. Полученное масло очищали с помощью флеш-хроматографии (ДХМ→ДХМ: МеОН=96:4) с получением соединения 19 (301,1 мг, 0,176 ммоль, выход 89%) в виде желтоватого масла. 1Н ЯМР (400 МГц, CDCl3): δ=7,32 (с, 1H), 6,42 (с, 1H), 6,04 (м, 2Н), 5,41 (д, J=16,71 Гц, 2Н), 5,27 (д, J=10,59 Гц, 2Н), 4,54 (м, 6Н), 3,75-3,58 (м, 60Н), 3,55 (м, 2Н), 3,38 (с, 3Н).
Пример 3е: Соединение 20,1,3-бис[ω-метил-(этиленокси)12-20метил]-4,6-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 20 (выход=99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 4: Синтез соединения 26, 1-(ω-метил-(этиленокси)12-20метил)-3,5-бис[(бут-4-триэтоксисилил-1-ил)окси]бензол.
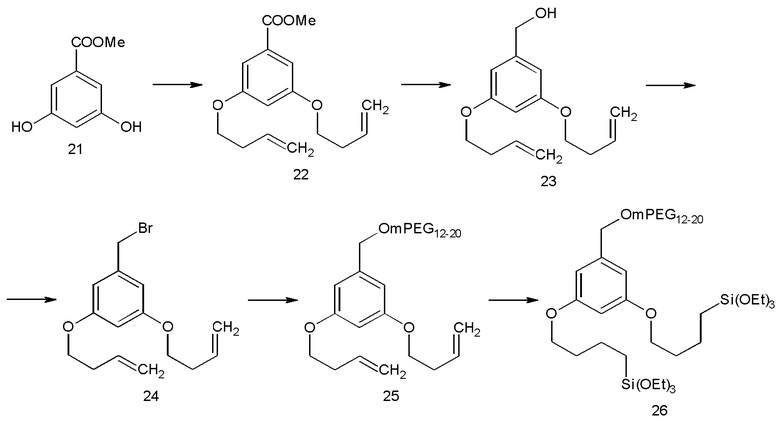
Пример 4a: Соединение 22, метиловый эфир 3,5-бис[(бут-3-ен-1-ил)окси]бензойной кислоты. Ту же процедуру, как для синтеза соединения 11, применяли для синтеза соединения 21. Выход=78%. 1Н ЯМР (400 МГц, CDCl3): δ=7,18 (д, J=2,48 Гц, 2Н) 6,66 (т, J=2,30 Гц, 1H), 5,96-5,85 (м, 2Н), 5,18 (дк, J=17,15, 1,59 Гц, 2Н), 5,12 (дк, J=10,26, 1,24 Гц, 2Н), 4,04 (т, J=6,72 Гц, 4Н), 3,91 (с, 3Н), 2,55 (тк, J=6,72, 1,41 Гц, 4Н).
Пример 4b: Соединение 23, 3,5-бис[(бут-3-ен-1-ил)окси]бензиловый спирт.В раствор соединения 22 (250,0 мг, 0,91 ммоль) в ТГФ (4 мл), добавляли при 0°С под атмосферой азота LAH (72,3 мг, 1,81 ммоль, 2,0 экв.). Реакцию контролировали методом ТСХ до полного превращения соединения 22 в соединение 23, затем ее перемешивали в течение еще часа и гасили в соответствии с обработкой Физера (Fieser) (J. Org. Chem. 1953, 18, 1190). Собранный фильтрат пропускали через короткую колонку диоксида кремния (гептан: EtOAc=2: 1, Rf=0,35) с получением соединения 23 (208,0 мг, 0,84 ммоль, 93% выход) в виде бесцветного масла, которое использовали на следующей стадии.
Пример 4 с: Соединение 24, 3,5-бис[(бут-3-ен-1-ил)окси]бензилбромид. В раствор соединения 23 (208,0 мг, 0,20 ммоль) в ДХМ (3,0 мл), добавляли при 0°С PBr3 (0,499 мл, 1 М в ДХМ, 0,50 ммоль, 2,5 экв.). Через 20 минут добавляли раствор насыщенного NaHCO3 и органический слой отделяли. Водную фазу экстрагировали ДХМ (3×3 мл) и собранную органическую фазу сушили над MgSO4, отфильтровывали и упаривали растворитель при пониженном давлении. Полученное оранжевое масло пропускали через короткую колонку диоксида кремния (гептан: EtOAc=2:1) с получением соединения 24 (120,7 мг, 0,39 ммоль, выход 46%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDC13): δ=6,54 (д, J=2,12 Гц, 2Н), 6,40 (т, J=2,30 Гц, 1H), 5,96-5,84 (м, 2Н), 5,18 (дд, J=17,15, 1,41 Гц, 2Н), 5,12 (дд, J=10,26, 1,24 Гц, 2Н), 4,41 (с, 2Н), 4,00 (т, J=6,72 Гц, 4Н), 2,54 (к, J=6,54 Гц, 4Н).
Пример 4 с: Соединение 25, 1-[ω-метил-(этиленокси)12-20 метил]-3,5-бис[(бут-3-ен-1-ил)окси]бензол. В колбу Шленка в раствор m-ПЭГ12-20-ОН (364,0 мг, 0,43 ммоль) в диоксане (0,5 мл) добавляли при 0°С NaH (21,6 мг, 0,54 ммоль) и полученную суспензию перемешивали в течение 30 минут, после чего раствор предварительно полученного бромированного интермедиата 24 в диоксане (0,5 мл) добавляли при той же температуре. Затем реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 40 ч. Затем суспензию гасили Н2О (0,1 мл) и растворитель упаривали. Полученное масло очищали с помощью флеш-хроматографии (ДХМ→ДХМ: МеОН=96:4) с получением соединения 25 (301,1 мг, 0,176 ммоль, выход 89%) в виде желтоватого масла. 1Н ЯМР (400 МГц, CDCl3): δ=6,50 (с, 2Н), 6,38 (с, 1H), 5,90 (м, 2Н), 5,17 (д, J=17,15 Гц, 2Н), 5,10 (д, J=10,33 Гц, 2Н), 4,49 (с, 2Н), 3,99 (т, J=5,94 Гц, 4Н), 3,72-3,59 (м, 53Н), 3,55 (м, 2Н), 3,38 (с, 3Н), 2,53 (к, J=7,03 Гц, 4Н).
Пример 4d: Соединение 26, 1-[ω-метил-(этиленокси)12-20 метил]-3,5-бис[(бут-4-триэтоксисилил-1-ил)окси]бензол. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 26 (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 5: Синтез соединения 33, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис(эт-2-триэтоксисилил-1-ил)бензол.
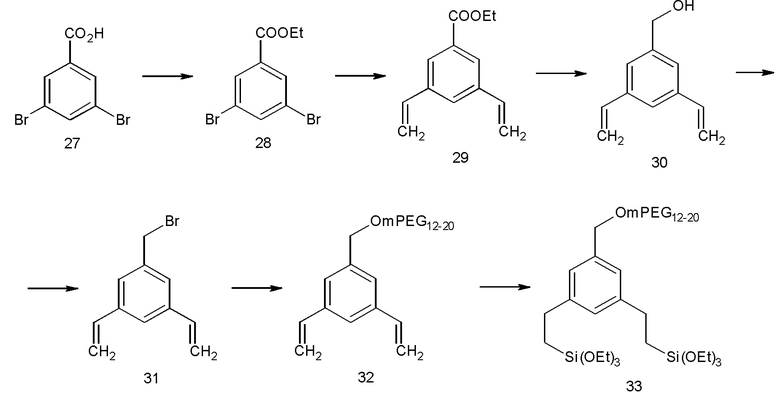
Пример 5а: Соединение 28, этиловый эфир 3,5-дибромобензойной кислоты. Ту же процедуру, как для синтеза соединения 8, применяли для синтеза соединения 28. Выход = 90%. 1Н и 13С ЯМР соответствовали литературным данным (Eur. J. Org. Chem. 2009, 18, 2953-2955).
Пример 5b: Соединение 29, этиловый эфир 3,5-дивинилбензойной кислоты. В высушенную пламенем колбу Шленка (Schlenk) в раствор соединения 28 (1,50 г, 4,87 ммоль) и (Ph3P)4Pd (142,1 мг, 0,12 ммоль, 0,03 экв.) в толуоле (15 мл) добавляли трибутилвинилолово (3,90 г, 3,60 мл, 11,69 ммоль, 2,4 экв.) при комнатной температуре под атмосферой азота. Полученную реакционную смесь нагревали до 80°С в течение ночи. Затем реакционную смесь промывали насыщенным раствором соли и затем перемешивали с 10% раствором NaF в течение 2 ч. Фазы разделяли и водную фазу экстрагировали Et2O (3×25 мл). Полученное желтое масло очищали с помощью флеш-хроматографии (гептан: EtOAc=50:1) с получением соединения 29 (985,1 г, 3,79 ммоль, выход 78%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3): δ=7,98 (д, J=1,77 Гц, 2Н), 7,61 (т, J=1,77 Гц, 1H), 6,76 (дд, J=17,50, 10,96 Гц, 2Н), 5,85 (дд, J=17,68, 0,53 Гц, 2Н), 5,35 (д, J=10,96 Гц, 2Н), 4,41 (к, J=7,25 Гц, 2Н), 1,42 (т, J=7,25 Гц, 3Н).
Пример 5 с: Соединение 30, 3,5-дивинилбензиловый спирт. Ту же процедуру, как для синтеза соединения 23, применяли для синтеза соединения 30. Выход=93%. 1Н ЯМР (400 МГц, CDCl3): δ=7,37 (с, 1H), 7,33 (с, 2Н), 6,73 (дд, J=17,51, 10,79 Гц, 2Н), 5,80 (д, J=17,50 Гц, 2Н), 6,29 (д, J=10,96 Гц, 2Н), 4,71 (с, 2Н).
Пример 5d: Соединение 31, 3,5-дивинилбензилбромид. Ту же процедуру, как для синтеза соединения 24, применяли для синтеза соединения 31. Выход = 42%. 1Н ЯМР (400 МГц, CDCl3): δ=7,37 (с, 1H), 7,34 (с, 2Н), 6,71 (дд, J=17,68, 10,96 Гц, 2Н), 5,80 (д, J=17,50 Гц, 2Н), 6,32 (д, J=10,79 Гц, 2Н), 4,50 (с, 2Н).
Пример 5е: Соединение 32, 1-[ω-метил-(этиленокси)12-20метил]-3,5-дивинилбензол. Ту же процедуру, как для синтеза соединения 25, применяли для синтеза соединения 32. Выход=68%. 1Н ЯМР (400 МГц, CDCl3): δ=7,35 (с, 1H), 7,30 (с, 2Н), 6,72 (дд, J=18,48, 11,55 Гц, 2Н), 5,78 (д, J=17,51 Гц, 2Н), 5,27 (д, J=10,91 Гц, 2Н), 4,57 (с, 2Н), 3,72-3,61 (м, 59Н), 3,56 (м, 2Н), 3,39 (с, 3Н).
Пример 5f: Соединение 33, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис(эт-2-триэтоксисилил-1-ил)бензол. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 33 (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 6: Синтез соединения 38, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис(проп-3-триэтоксисилил-1-ил)бензола
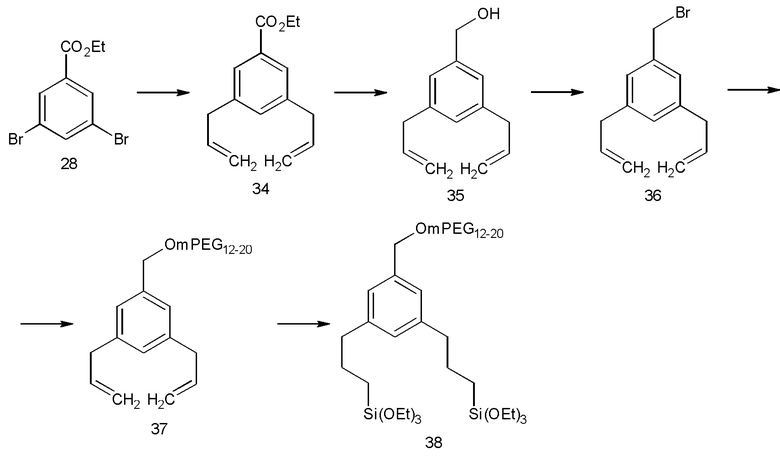
Пример 6a: Соединение 34, этиловый эфир 3,5-диаллилбензойной кислоты. Ту же процедуру, как для синтеза соединения 29, применяли для синтеза соединения 34, но вместо трибутилвинилолова использовали аллилтрибутилолово. Выход=73%. 1Н ЯМР (400 МГц, CDCl3): δ=7,73 (с, 2Н), 7,21 (s, 1H), 6,02-5,92 (м, 2Н), 5,10 (д, J=13,44 Гц, 4Н), 4,38 (к, J=7,07 Гц, 2Н), 3,42 (д, J=6,72 Гц, 4Н), 1,40 (т, J=7,07 Гц, 3Н).
Пример 6b: Соединение 35, 3,5-диаллилбензиловый спирт. Ту же процедуру, как для синтеза соединения 23, применяли для синтеза соединения 35 (выход 98%), которое непосредственно использовали на следующей стадии.
Пример 6 с: Соединение 36, 3,5-диаллилбензилбромид. Ту же процедуру, как для синтеза соединения 24, применяли для синтеза соединения 36. Выход=58%. 1Н ЯМР (400 МГц, CDCl3): δ=7,08 (с, 2Н), 6,97 (с, 1H), 6,02-5,92 (м, 2Н), 5,11 (м, 4Н), 4,47 (с, 2Н), 3,38 (д, J=6,72 Гц, 4Н).
Пример 6d: Соединение 37, 1-[ω-метил-(этиленокси)12-20метил]-3,5-диаллилбензол. Ту же процедуру, как для синтеза соединения 25, применяли для синтеза соединения 37. Выход=68%. 1Н ЯМР (400 МГц, CDCl3): δ=7,00 (с, 2Н), 6,92 (с, 2Н), 5,94 (м, 2Н), 5,06 (м, 4Н), 4,50 (с, 2Н), 3,75-3,57 (м, 50Н), 3,54 (м, 2Н), 3,36 (м, 5Н).
Пример 6е: Соединение 38, 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис(проп-3-триэтоксисилил-1-ил)бензол. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 38 (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 7: Синтез соединения 41, 1,7-бис(триэтоксисилил)-4-(проп-3-триэтоксисилил-1-ил)-4-[ω-метил-(этиленокси)12-20]гептан.
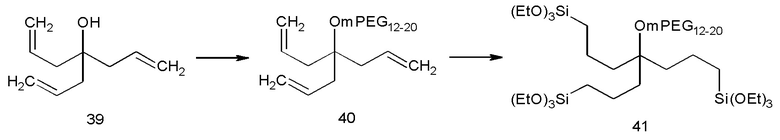
Пример 7а: Соединение 40, 4-аллил-4-[ω-метил-(этиленокси)12-20]гепта-1,6-диен. Ту же процедуру, как для синтеза соединения 13, применяли для синтеза соединения 40, используя 0,6 экв. вместо 1,9 экв. соединения 56 и ДМФА в качестве растворителя. Выход=30%. 1Н ЯМР (400 МГц, CDCl3): δ=5,81 (м, 3Н), 5,06 (м, 6Н), 3,72-3,52 (м, 66Н), 3,38 (с, 3Н), 2,25 (д, J=7,24 Гц, 6Н).
Пример 7b: Соединение 41, 1,7-бис(триэтоксисилил)-4-(проп-3-триэтоксисилил-1-ил)-4-[ω-метил-(этиленокси)12-20]гептан. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 41 (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 8: Синтез соединения 44, 1,7-бис(триэтоксисилил)-4-[ω-метил-(этиленокси)12-20]гептан.
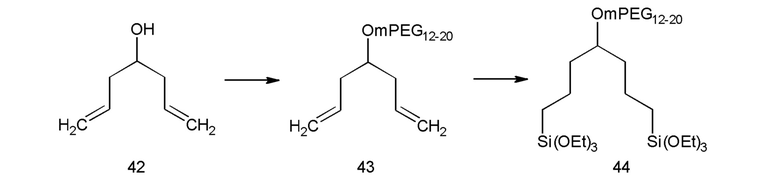
Пример 8а: Соединение 43, 4-[ω-метил-(этиленокси)12-20]гепта-1,6-диен. Ту же процедуру, как для синтеза соединения 40, применяли для синтеза соединения 43. Выход=45%. 1Н ЯМР (400 МГц, CDCl3): δ=5,82 (м, 2Н), 5,05 (м, 4Н), 3,75-3,57 (м, 64Н), 3,55 (м, 2Н), 3,38 (с, 3Н), 2,26 (т, J=5,53 Гц, 4Н).
Пример 8b: Соединение 44, 1,7-бис(триэтоксисилил)-4-[ω-метил-(этиленокси)12-20]гептан. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 44, (99% выход), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 9, Синтез соединения 49, 1-[ω-метил-(этиленокси)12-20метил]-2,4-бис(эт-2-триэтоксисилил-1-ил)циклопентан
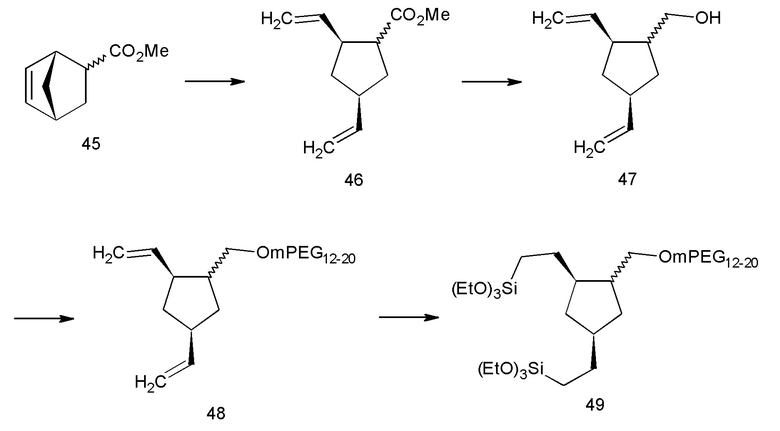
Пример 9а: Соединение 46, метиловый эфир 2,4-дивинилциклопентанкарбоновой кислоты. В высушенную пламенем колбу Шленка (Schlenk) в раствор метил-5-норборнен-2-карбоксилата (45) (1,06 г, 1,00 мл, 6,69 ммоль) в дегазированном ДХМ (150 мл) добавляли раствор бензилиден-бис(трициклогексилфосфин)дихлорорутения (170,0 мг, 0,20 ммоль, 0,03 экв.) в дегазированном ДХМ (3 мл). Колбу вакуумировали и снова заполняли этиленом (3 раза) и полученный раствор перемешивали в течение ночи при комнатной температуре. Затем растворитель упаривали при пониженном давлении и неочищенное темное масло очищали методом флеш-хроматографии (гептан: EtOAc=9: 1) с получением соединения 46 (840,2 мг, 4,66 ммоль, 70%) в виде смеси диастереоизомеров в виде темного масла. 1Н ЯМР (смесь диастереоизомеров) (400 МГц, CDCl3): δ=5,79 (м, 3,5Н), 5,12-4,88 (м, 6,5Н), 3,69 (с, 3Н), 3,63 (с, 2Н), 3,07-2,46 (м, 5Н), 2,18-1,91 (м, 4Н), 1,91-1,70 (м, 2Н), 1,52 (м, 1H), 1,32 (м, 1H).
Пример 9b: Соединение 47, 1-гидроксиметил-2,4-дивинилциклопентан. Ту же процедуру, как для синтеза соединения 23, применяли для синтеза соединения 47. Реакцию контролировали методом ТСХ до полного превращения соединения 46 (Rf=0,88, гептан: EtOAc=2:1) в соединение 47 (Rf=0,49, гептан: EtOAc=2:1). Выход=89%.
Пример 9 с: Соединение 48, 1-[ω-метил-(этиленокси)12-20 метил]-2,4-дивинилциклопентан. Ту же процедуру, как для синтеза соединения 40, применяли для синтеза соединения 48. Реакцию контролировали методом ТСХ до полного превращения соединения 47 в соединение 48 (Rf=0,29-0,59, ДХМ: МеОН=96:4). Выход=88%.
Пример 9d: Соединение 49, 1-[ω-метил-(этиленокси)12-20 метил]-2,4-бис(эт-2-триэтоксисилил-1-ил)циклопентан. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 49, (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 10: Синтез соединения 51, 1-[ω-метил-(этиленокси)9-12метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол.
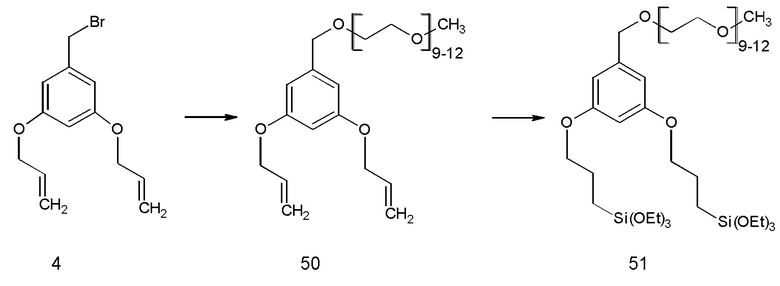
Пример 10а: Соединение 50, 1-[ω-метил-(этиленокси)9-12метил]-3,5-бис[(проп-2-ен-1-ил)окси]бензол. Ту же процедуру, как для синтеза соединения 29, применяли для синтеза соединения 50. Выход=88%. 1Н ЯМР (400 МГц, CDCl3): δ=6,52 (с, 2Н), 6,42 (с, 1H), 6,05 (м, 2Н), 5,41 (д, J=17,17 Гц, 2Н), 5,28 (д, J=10,81 Гц, 2Н), 4,51 (м, 6Н), 3,75-3,59 (м, 40Н), 3,55 (м, 2Н), 3,39 (с, 3Н).
Пример 10b: Соединение 51, 1-[ω-метил-(этиленокси)9-12 метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензол. Ту же процедуру, как для синтеза соединения 14, применяли для синтеза соединения 51, (выход 99%), которое затем непосредственно использовали для экспериментов для нанесения покрытия.
Пример 11: Синтез соединения 54, N,N-бис(проп-3-триметоксисилил-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамид.
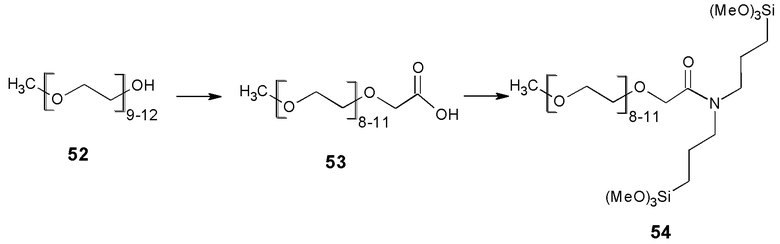
Пример 11а: Соединение 53, 2-[ω-метил-(этиленокси)8-11]уксусная кислота. Соединение 52 (5 г, 10 ммоль) растворяли в 1 М водном NaOH. По каплям добавляли раствор перманганата калия (3,48 г в 110 мл HrO). По завершении добавления реакционную смесь оставляли перемешиваться в течение ночи. Оксид марганца отфильтровывали и рН прозрачного раствора доводили до 4 путем добавления 1 М водного HCl. Воду упаривали и добавляли две небольшие порции толуола и упаривали для удаления влаги. Продукт растворяли/суспендировали в ДХМ (100 мл), отфильтровывали и упаривали досуха. Выход 3,8 г, 75%. 1Н ЯМР (400 МГц, CDCl3): δ=4,19 (с, 2Н), 3,67 (м, 33Н), 3,39 (с, 3Н).
Пример 11b: Соединение 54, N,N-бис(проп-3-триметоксисилил-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамид. Раствор соединения 53 (3,8 г, 7,5 ммоль) и карбонилдиимидазола (1,22 г, 7,5 ммоль) в ТГФ (50 мл) кипятили с обратным холодильником в течение двух часов. Реакционной смеси давали охладиться и затем добавляли бис(3-триметоксисилилпроп-1-ил)амин (2,27 мл, 2,36 г, 7 ммоль) и оставляли при перемешивании в течение ночи. Растворитель упаривали и методом ЯМР выявляли целевой продукт 54 плюс ожидаемый свободный имидазол. Смесь напрямую использовали для нанесения покрытия наноструктур, так же, как в примере 12b.
Пример 12: а) Синтез не имеющих покрытия наноструктур путем полимеризации 1,1-бис(проп-3-триметоксисилил-1-ил)-1,1-бис(диметилфосфонато)метана. 5-л реактор в мешалкой, покрытой ПТФЭ, заполняли азотом с помощью трех циклов вакуум/азот и стерилизовали путем установки температуры рубашки до 130°С в течение 2 ч. Температуру рубашки устанавливали на 25 градусах и добавляли этиленгликоль (4 л) и 1,1-бис(3-трэтоксисилилпроп-1-ил)-1,1-бис(диметилфосфонато)метан (165 г, 257 ммоль, Mw=640,8 г/моль). Во время перемешивания добавляли воду (1,0 л). Реакционную смесь дегазировали с помощью трех циклов вакуум/азот.Температуру повышали до 137°С в течение 2 ч, поддерживали при 137°С в течение 6 ч и затем снова понижали до 25°С в течение 2 ч. Реакционную смесь кипятили с обратным холодильником при внутренней температуре 123°С. Перистальтический насос использовали для циркуляции реакционного раствора через линейный фильтр (предел отсечения 0,2 мкм) в течение 3 ч для того, чтобы сделать реакционную смесь прозрачной. Для характеристики не имеющих покрытия наноструктур отбирали образец и промывали от остатков растворителя с помощью повторных циклов растворения-фильтрации на центробежном фильтре 10 кДа.
b) нанесение покрытия с 1-[ω-метил-(этиленокси)12-20метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензолом. В реакционную смесь из примера 12а добавляли мочевину (155 г) и температуру рубашки устанавливали на 92°С. Соединение 6 из примера 1 (98 г, 76 ммоль, Mw=1283 г/моль) добавляли по каплям в течение 10 ч с помощью шприца. В 50 мл колбе MnCl2⋅4H2O (7,84 г, 39,6 ммоль, Fw=197,84) растворяли в воде (25 мл). Этот раствор добавляли в реактор за одну порцию. Температуру рубашки увеличивали до 105°С и поддерживали в течение 96 ч.
c) Фильтрация. Наноструктуру с покрытием из примера 12b сначала пропускали через встроенный фильтр (предел отсечения 0,2 мкм) с получением прозрачного раствора. Предварительно отфильтрованный раствор затем разбавляли в 20 раз с помощью 0,9% NaCl (водн.) или водой Milli-Q. Затем проводили ультрафильтрацию с помощью фильтра с тангенциальным потоком с пределом отсечения 50 кДа или 100 кДа (кассета Pall Centramate T-Series или Sartorius Vivaflow 200) и собирали на кассете 10 кДа (кассета Pall Centramate T-Series или Sartorius Vivaflow 200). Диафильтрация с помощью фильтра 10 кДа включала добавление воды Milli-Q (10×объем раствора наноструктуры с покрытием) для замены растворителя раствора наноструктуры водой.
d) Характеристика. Анализировали следующие физические и химические свойства очищенного раствора наноструктуры: (i) химический состав методом ИСП-ОЭС; типичный состав представляет собой Р/Mn=7,6 и Si/P=1,4; (ii) распределение по размерам методами ГПХ и ДРС; типичное значение составляет 5 нм; (iii) стабильность в отношении EDTA - путем добавления эквивалентного количества EDTA к количеству Mn, присутствующего в наноструктуре, с последующим проведением 10 кДа фильтрации и сбора и анализа состава фильтрата методом ИСП-ОЭС, типичное значение стабильности составляет 20% EDTA; (iv) релаксивность (r1) наноструктуры в воде с помощью Bruker minispec при 1,5 Т и 37°С: типичное значение составляет 13,5 /с/ммоль Mn.
Плотность покрытия Nпокрытие/Аядра, где Nпокрытия представляет собой число моль молекул покрытия, присоединенных к наноструктуре, и Аядра представляет собой площадь не имеющей покрытия наноструктуры, вычисляют в соответствии с формулой:
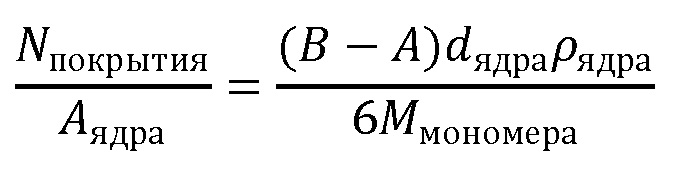
где dядра, представляет собой гидродинамический диаметр не имеющих покрытия наноструктур из примера 12а, измеренный методом ДРС, ρядра представляет собой измеренную плотность ядра (1,7 г/мл=1,7×106 г/м3), А представляет собой измеренное (методом ИСП-ОЭС) Si/P соотношение ядра наноструктур, В представляет собой измеренное (методом ИСП-ОЭС) Si/P соотношение наноструктур с покрытием и Ммономера - молекулярная масс мономера после полимеризации и частичного гидролиза. Элементный анализ высушенного образца ядра соответствует композиции C8H20O9P2Si2 с молекулярной массой остатков мономера 378 г/моль. Для данного примера А в соответствии с измерениями составляет 1,0 и В составляет 1,67, так что плотность покрытия вычислена как (1,67-1,0)×5×10-9м×1,7×106г/м3 /(6×378 г/моль)=2,5×10-6 моль/м2 или 1,6 молекул покрытия/нм2.
Пример 13: Синтез наноструктур с покрытием с а) 1-[ω-метил-(этиленокси)9-12метил]-3,5-бис(проп-3-триэтоксисилил-1-ил)окси]бензолом, b) N,N-бис(проп-3-триметоксисилил-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамидом.
a) Аналогично, как в Примере 11, но при замене соединения 6 на соединение 51, синтезировали наноструктуры с покрытием с 1-[ω-метил-(этиленокси)9-12метил]-3,5-бис[(проп-3-триэтоксисилил-1-ил)окси]бензолом.
b) Аналогично, как в Примере 11, но при замене соединения 6 на соединение 54, синтезировали наноструктуры с покрытием с N,N-бис(проп-3-триметоксисилил-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамидом.
Пример 14: Синтез и характеристика наноструктур с покрытием с рядом силанов. Небольшое количество не имеющих покрытия наноструктур, аналогичных струткурам из примера 12а, получали путем смешивания во флаконе 1,15 г 1,1-бис(проп-3-триэтоксисилил-1-ил)-1,1-бис(диметилфосфонато)метана, этиленгликоля (25,5 мл), воды (8 мл) и раствора MnCl2⋅4H2O (2,77 мл раствора 890 мг MnCl2⋅4H2O в 2,9 мл этиленгликоля). Флакон укупоривали и нагревали до 92°С в течение 24 ч.
В ряд флаконов по 4 мл добавляли 0,1 ммоль, соответственно, предшественников покрытия из таблицы 1, растворенных в 0,8 мл этиленгликоля, и 2 мл указанного выше раствора не имеющих покрытия наноструктур. Флаконы продували азотом, укупоривали и нагревали в нагревателе/шейкере в течение 20 ч.
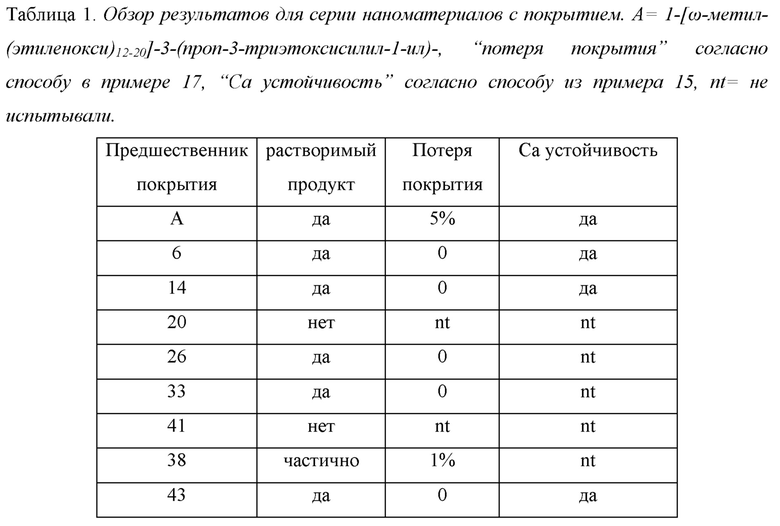
Пример 15. Индуцированная кальцием агрегация наноструктур с покрытием. Объемы наноструктур добавляли в 1 мл проб, состоящих из 10 мМ Tris-HCl 150 ммоль NaCl рН 7,4, содержащих 0, 0,5, 1, 2, 4 и 8 ммоль CaCl2 в пробирках для микроцентрифуги, так что конечная концентрация фосфора составляла 0,5 моль. Образцы встряхивали, выдерживали при комнатной температуре в течение 1 ч и центрифугировали в течение 10 мин при 12000 xg. Надосадочные жидкости (700 мкл) удаляли и анализировали методом ИСП на концентрацию фосфора. Концентрацию фосфора нормализовывали до концентрации в соответствующих образцах без CaCl2 и представляли графически в виде '% оставшегося в растворе' от концентрации CaCl2 в реакционной смеси. Когда 90% или более остается в растворе, материал считается высокопрочным против индуцированной кальцием агрегации.
Пример 16: Синтез соединения 56, m-ПЭГ12-20-OMs.
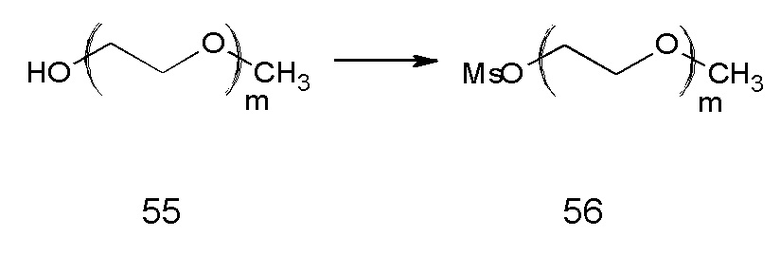
В трехгорлую круглодонную колбу в раствор m-ПЭГ12-20-ОН (55) (5,0 г, 6,47 ммоль) добавляли по каплям при 0°С диизопропилэтиламин (1,71 мл, 1,27 г, 9,70 ммоль, 1,5 экв.) в ДХМ (65 мл), мезилхлорид (0,61 мл, 0,91 г, 7,76 ммоль, 1,2 экв.). Смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Затем добавляли диэтиловый эфир (50 мл) и осадок отфильтровывали. Фильтрат упаривали с получением желтого масла, которое очищали с помощью флеш-хроматографии (ДХМ: МеОН=15:1) с получением соединения 56 (4,51 г, 5,45 ммоль, выход 84%) в виде бесцветного масла.
Пример 17: Термообработка. Образец перемещали в 20 мл колбу и дегазировали с помощью трех циклов N2-вакуум и затем выдерживали под N2. Образец нагревали в бане из силиконового масла при 80°С в течение 30 минут и затем охлаждали до комнатной температуры. Отбирали пробу сравнения (А). Оставшийся образец промывали четыре раза milliQ water на 10 кДа центрифужном фильтре Vivaspin 6 (Sartorious). Пробу сравнения (В) отбирали из фильтрата. Пробы сравнения А и В анализировали методом ИСП-ОЭС. Стабильный образец демонстрирует неизменное Si/P соотношение в пробе В в сравнении с пробой А, а образец, который теряет покрытие, будет иметь Si/P отношение ниже.
Пример 18: Введение марганца в наноструктуры с покрытием с N,N-бис(3-триметоксисилилпроп-1-ил)-2-[ω-метил-(этиленокси)8-11]ацетамидом. 200 мл неочищенного раствора наноструктур с покрытием из примера 13b добавляли а раствор 0,256 г MnCl2 4Н2О, растворенного в 2,56 мл этиленгликоля. рН доводили до 4,07 с помощью 1 М NaOH. Раствор марганца добавляли в реакцию. Отбирали пробу А. Реакционную смесь нагревали при 100°С в течение 25 ч 30 мин, после чего температура понижалась до комнатной температуры. Отбирали пробу В. Пробы А и В анализировали с помощью ГФХ (см. Фиг. 3), где показано, что наноструктуры с покрытием с введенным марганцем (проба В) приводили к резкому снижению времени удерживания, что соответствует увеличению размера наноматериала вследствие агрегации.
Пример 19 Испытание ряда добавок для способа нанесения покрытия. Ядра наноструктур синтезировали, как описано в первой части примера 14. Пробы по 4 мл этого раствора добавляли в ряд из шести флаконов. Их продували азотом и помещали в шейкер при нагревании при 90°С. В каждый флакон вносили добавку в соответствии с Таблицей 2 и затем 26 мг соединения 6, каждые два часа, три раза, всего 78 мг в каждый. Через 12 ч 1 мл 26,7 мМ раствора MnCl2 в смеси этиленгликоль : вода 80:20. Флаконы нагревали до 100°С в течение 5 дней. Образцы отфильтровывали через 50 кДа центрифужный фильтр и затем собирали на 10 кДа центрифужном фильтре и промывали 5 порциями воды и определяли выход методом ИСП анализа, а Mn стабильность путем измерения релаксивности в присутствии увеличенного количества EDTA.
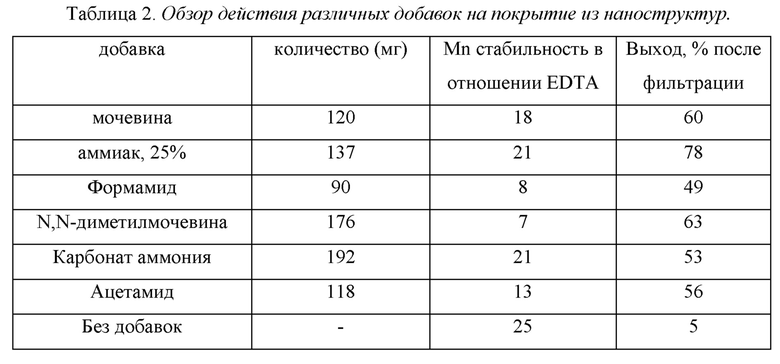
| название | год | авторы | номер документа |
|---|---|---|---|
| Новые марганецсодержащие наноструктуры | 2012 |
|
RU2638535C2 |
| НАЦЕЛИВАЮЩИЕ АМИНОКИСЛОТНЫЕ ЛИПИДЫ | 2013 |
|
RU2654210C2 |
| ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ 4-(АЦЕТИЛАМИНО)-3-[(4-ХЛОРФЕНИЛ)ТИО]-2-МЕТИЛ-1Н-ИНДОЛ-1-УКСУСНОЙ КИСЛОТЫ | 2010 |
|
RU2551852C2 |
| Наноструктуры и их применения | 2015 |
|
RU2684777C2 |
| Соединение диарилтиогидантоина в качестве антагониста андрогенового рецептора | 2018 |
|
RU2804108C9 |
| Модификатор, модифицированный полимер на основе сопряженного диена, содержащий этот модификатор, и способ получения полимера | 2020 |
|
RU2812593C1 |
| УСОВЕРШЕНСТВОВАННЫЕ КОНЪЮГАТЫ N4 ХЕЛАТООБРАЗУЮЩИХ АГЕНТОВ | 2005 |
|
RU2360701C2 |
| ИНГИБИТОР ФОСФОДИЭСТЕРАЗЫ 5 ТИПА, ВЫСВОБОЖДАЮЩИЙ ОКСИД АЗОТА | 2019 |
|
RU2785776C2 |
| КОМПЛЕКСЫ ТЕХНЕЦИЯ И РЕНИЯ С БИС(ГЕТЕРОАРИЛАМИ) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2539584C2 |
| СЕЛЕКТИВНЫЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2012 |
|
RU2612972C2 |
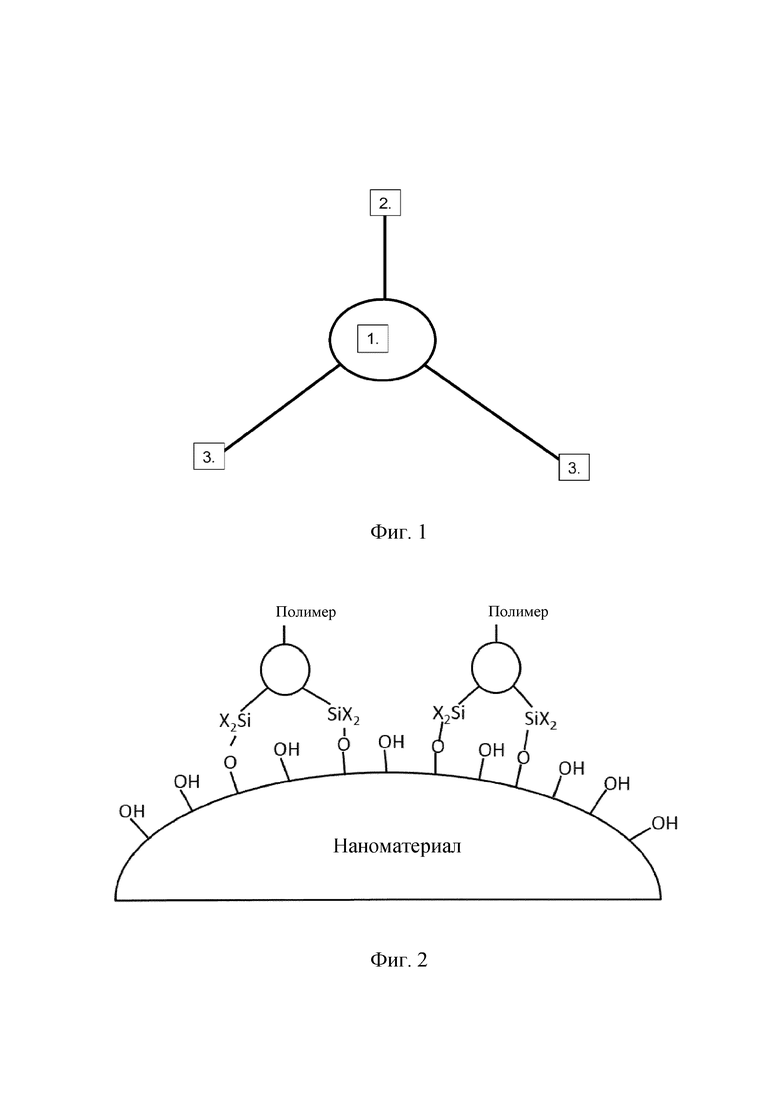
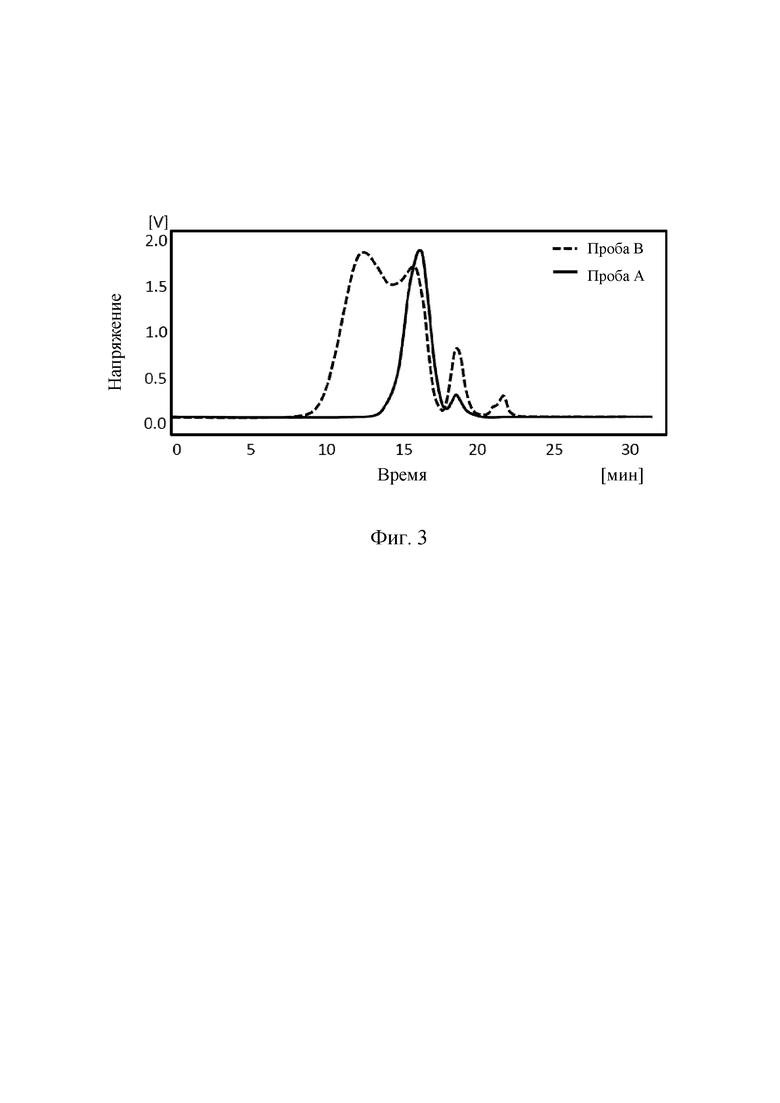
Изобретение относится к полимерным покрытиям наноматериалов. Предложено химическое соединение, содержащее ароматическое ядро или карбоциклическое неароматическое ядро, причем ароматическое ядро представляет собой бензольное кольцо или бифенил; карбоциклическое неароматическое ядро представляет собой 5-7-членное кольцо. Ядро имеет ковалентно присоединенные к нему по меньшей мере две якорные группы, где каждая якорная группа содержит активированную силановую группу; при этом якорные группы имеют общую формулу -A-(CH2)nSiY3, в которой А является ковалентной связью или О, "n" является целым числом от 1 до 3, и Y независимо является метоксигруппой или этоксигруппой; и по меньшей мере одну гидрофильную группу, отходящую от ядра, причем гидрофильный полимерный остаток (остатки) выбирают независимо друг от друга, если присутствует более одной гидрофильной группы, из -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и "m" является целым числом от 6 до 25; при этом число гидрофильных групп, отходящих от ядра, составляет от одной до числа кольцевых структур в ядре. Предложены также композиции, содержащие предложенное химическое соединение, и наноструктуры с покрытием, содержащим остатки заявленного химического соединения, а также к применению таких наноструктур. Также предложен способ получения наноструктуры с покрытием. Технический результат – предложенное соединение позволяет получать покрытие на наноструктурах с улучшенными характеристиками, что позволяет использовать полученные наноструктуры с покрытием для получения контрастного агента или визуализирующего агента. 5 н. и 11 з.п. ф-лы, 3 ил., 2 табл., 19 пр.
1. Химическое соединение, содержащее ароматическое ядро или карбоциклическое неароматическое ядро, причем ароматическое ядро представляет собой бензольное кольцо или бифенил; карбоциклическое неароматическое ядро представляет собой 5-7-членное кольцо; при этом ядро имеет ковалентно присоединенные к нему:
- по меньшей мере две якорные группы, где каждая якорная группа содержит активированную силановую группу; при этом якорные группы имеют следующую общую формулу -A-(CH2)nSiY3, в которой А является ковалентной связью или О, "n" является целым числом от 1 до 3, и Y независимо является метоксигруппой или этоксигруппой; и
- по меньшей мере одну гидрофильную группу, отходящую от ядра, причем гидрофильная группа содержит один или более гидрофильных полимерных остатков; причем гидрофильный полимерный остаток(остатки) выбирают независимо друг от друга, если присутствует более одной гидрофильной группы, из -(O-СН2-СН2)m-ОХ, где X представляет собой СН3 или Н, и "m" является целым числом от 6 до 25;
- причем число гидрофильных групп, отходящих от ядра, составляет от одной до числа кольцевых структур в ядре.
2. Химическое соединение по п. 1, в котором ароматическое ядро представляет собой бензольное кольцо, имеющее общую формулу 1
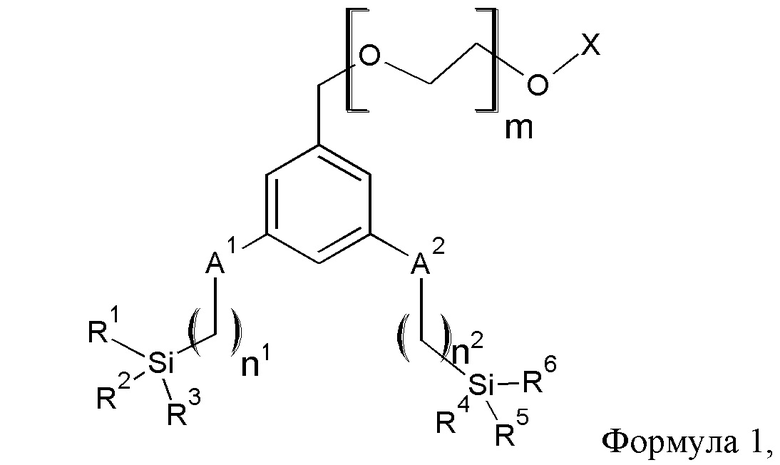
в которой
- А1 и А2 независимо выбраны из группы, состоящей из ковалентной связи или О;
- "n1" является целым числом от 1 до 3;
- "n2" является целым числом от 1 до 3;
- R1-R6 независимо выбраны из метоксигруппы и этоксигруппы;
- "m" является целым числом от 6 до 25; и
- X представляет собой метил.
3. Химическое соединение по п. 2, в котором А1 и А2 представляют собой О, "n1" составляет 3, "n2" составляет 3, R1-R6 представляют собой этокси, и X представляет собой метил.
4. Химическое соединение по п. 1 или 2, в котором ароматическое ядро представляет собой бензольное кольцо, имеющее общую формулу 1
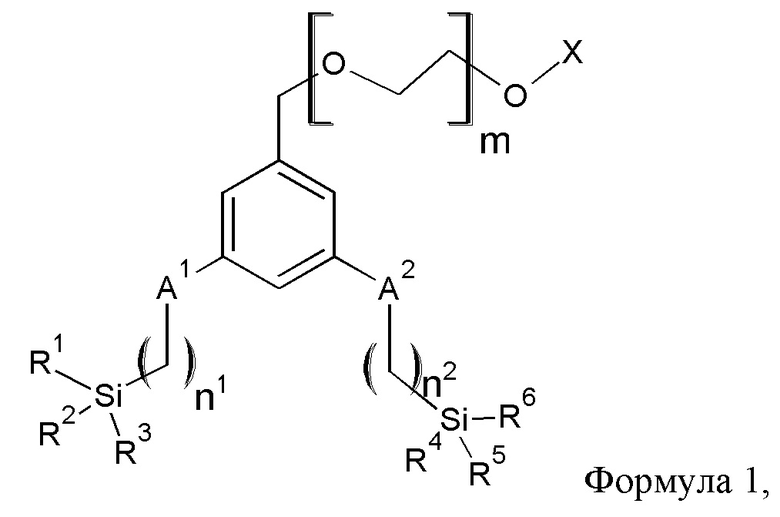
в которой
- А1 и А2 представляют собой О;
- "n1" составляет 3;
- "n2" составляет 3;
- R1-R6 независимо выбраны из метоксигруппы и этоксигруппы;
- "m" является целым числом от 12 до 20; и
- X представляет собой метил.
5. Химическое соединение по п. 1 или 2, в котором ароматическое ядро представляет собой бензольное кольцо имеющее общую формулу 1
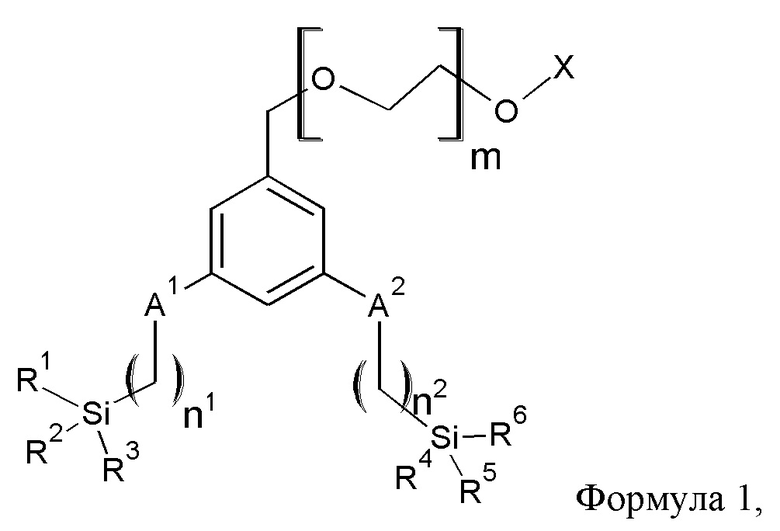
в которой
- А1 и А2 представляют собой ковалентную связь;
- "n1" составляет 2;
- "n2" составляет 2;
- R1-R6 независимо выбраны из метоксигруппы и этоксигруппы;
- "m" является целым числом от 12 до 20; и
- X представляет собой метил.
6. Композиция для получения покрытия наноструктуры с покрытием, содержащая химическое соединение по любому из пп. 1-5 и носитель, представляющий собой растворитель.
7. Наноструктура с покрытием для получения контрастного агента или визуализирующего агента, содержащая остатки химических соединений по любому из пп. 1-5;
в которой один или более активированных силана в каждом из химических соединений ковалентно связаны с поверхностью ядра наноструктуры, и
при этом наноструктура содержит на своей поверхности реакционные группы, где реакционные группы представляют собой гидроксильные группы, и при этом реакционные группы выбраны из группы, состоящей из Si-OH, Fe-OH, Hf-OH, Zr-OH, Ta-OH и Ti-OH, и
при этом наноструктура содержит полимерный остов или каркас, содержащий хелатирующие группы.
8. Наноструктура с покрытием по п. 7, которая содержит полимерный остов, содержащий или в который дополнительно введены по меньшей мере пять геминальных бисфосфонатных групп, имеющих общую формулу -P=O(OR11)(OR12), в которой R11 и R12 независимо выбраны из отрицательного заряда, Н, алкильной группы и арильной группы, при этом полимерный остов дополнительно содержит мономерные остатки, содержащие геминальную бисфосфонатную группу и две органические оксисилановые группы.
9. Наноструктура с покрытием по п. 7 или 8, которая имеет гидродинамический диаметр от 4 до 8 нм.
10. Наноструктура с покрытием по любому из пп. 7-9, дополнительно содержащая ион марганца (II) или гадолиния (III).
11. Наноструктура с покрытием по любому из пп. 7-9, дополнительно содержащая радионуклид для визуализации и/или радиотерапии.
12. Наноструктура с покрытием по п. 10 или композиция, содержащая наноструктуру с покрытием по п. 10, для применения в качестве контрастного агента для МРТ.
13. Наноструктура с покрытием по п. 11 или композиция, содержащая наноструктуру с покрытием по п. 11, для применения в ПЭТ и/или SPECT визуализации или радиотерапии.
14. Композиция для применения в качестве контрастного агента или визуализирующего агента, содержащая наноструктуры по любому из пп. 7-11 и носитель, представляющий собой воду.
15. Способ получения наноструктуры с покрытием по любому из пп. 7-11, включающий стадии:
- обеспечения ядра наноструктуры из полимерного остова, содержащего геминальные бисфосфонатные группы, и
- приведения указанного ядра наноструктуры в контакт с по меньшей мере одним из химических соединений по любому из пп. 1-5 в растворителе, предпочтительно водном растворителе.
16. Способ по п. 15, который осуществляют в присутствии мочевины с концентрацией 0,1-1 М.
| Chavez Anton D | |||
| et al | |||
| Discrete, Hexagonal Boronate Ester-Linked Macrocycles Related to Two-Dimensional Covalent Organic Frameworks | |||
| Chemistry of Materials, 2016, vol.28, No.14, pp.4884-4888 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЛИЦИДИЛОКСИАЛКИЛТРИАЛКОКСИСИЛАНОВ | 2007 |
|
RU2473552C2 |
| RU 2014111802 A, 27.10.2015 | |||
| WO 2016050210 A1, 07.04.2016 | |||
| US 2010098654 A1, 22.04.2010. | |||
Авторы
Даты
2021-10-22—Публикация
2018-01-16—Подача