Область техники, к которой относится изобретение
Настоящее изобретение относится к транс-изомерным гетероциклическим соединениям, например, пиперидинам, и способу получения стереоспецифичных изомеров.
Уровень техники
Некоторые гетероциклические соединения, например, пиперидины, обладают фармацевтической активностью. Сообщалось, что их фармацевтическая активность, а также безопасность, варьируется в зависимости от стереохимической конфигурации заместителей в пиперидиновом кольце. См., например, Pharmacia, 1989, 25 (4), 311-336. Таким образом, эффективный синтез пиперидинов с высокой стереоселективностью имеет большое значение.
Способы получения цис/транс смесей пиперидинов, например пиперидин-3-карбоксамида, хорошо известны в данной области техники. См., например, DeNinno et al., Bioorganic and Medicinal Letters, 2011, 21, 3095-3098, и Gancia et al., WO 2015/091584. Тем не менее общепринятыми способами получают или нестереоселективные изомеры, или главным образом цис-изомеры.
Существует необходимость в разработке нового способа получения транс-изомерных пиперидинов.
Сущность изобретения
В одном аспекте настоящее изобретение относится к способу получения транс-изомерного соединения Формулы (I), представленной ниже, или его фармацевтически приемлемой соли:
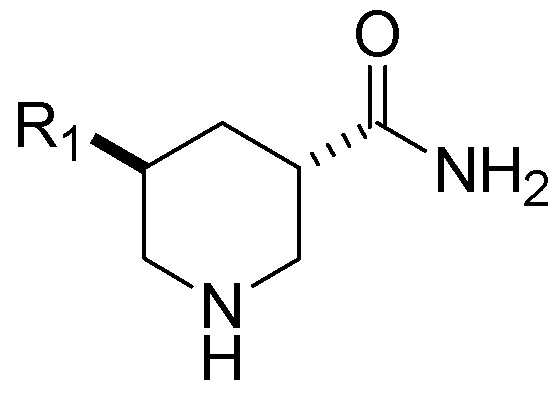 (I).
(I).
Данный способ неожиданно приводит к получению транс-изомерных пиперидинов с высоким выходом и высокой стереоселективностью, и включает в себя этап гидрирования химического соединения Формулы (II), представленной ниже, или его фармацевтически приемлемой соли:
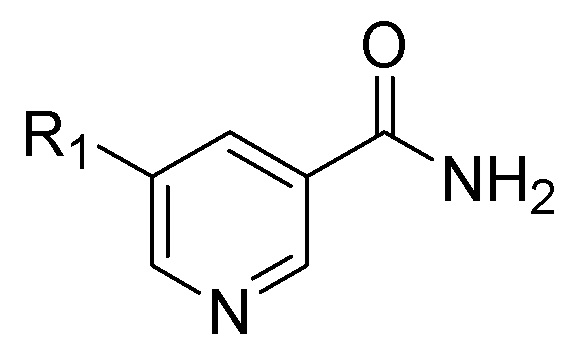 (II),
(II),
В присутствии палладиевого катализатора и инертного растворителя для получения транс-изомерного химического соединения формулы (I), имеющего отношение транс:цис форм, по меньшей мере, 70:30 (до 99,9:0,1), или его фармацевтически приемлемой соли, где R1 в Формулах (I) и (II) представляет собой C1-C5 алкил или C3-C5 циклоалкил.
Вышеописанный способ может дополнительно включать этап разделения, который выполняется посредством оптического разделения транс-изомерного соединения с помощью кислотного разделяющего агента. Этот процесс может обеспечить получение оптически обогащенного энантиомера транс-изомерного химического соединения Формулы (I) или его фармацевтически приемлемой соли. Кислотный разделяющий агент может быть в R-форме или S-форме. При необходимости, полученный таким образом энантиомер может быть перекристаллизован с использованием растворителя для перекристаллизации.
В другом аспекте настоящее изобретение относится к транс-изомерному химическому соединению Формулы (I), представленной ниже, или его фармацевтически приемлемой соли:
 (I),
(I),
где R1 представляет собой C1-C5 алкил или C3-C5 циклоалкил, и транс-изомерное химическое соединение в смеси изомерных соединений имеет отношение транс:цис форм, по меньшей мере, 70:30. В одном варианте осуществления изобретения R1 представляет собой C1-C5 алкил, например, метил.
Транс-изомерное химическое соединение Формулы (I) может находиться в форме (3S, 5S)-конфигурации, то есть иметь Формулу (Ia), показанную ниже, или (3R, 5R)-конфигурации, то есть иметь Формулу (Ib) также показанную ниже:
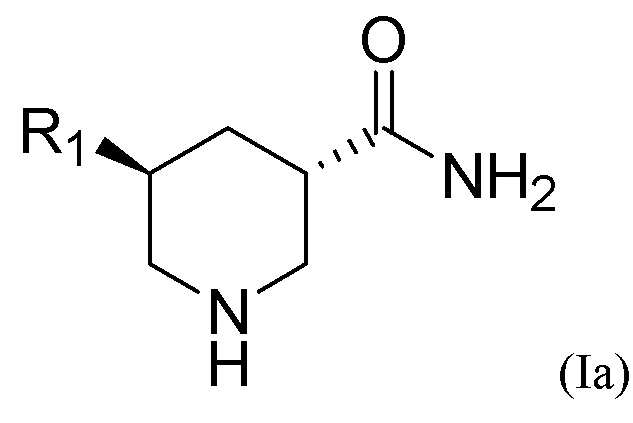

Используемый здесь термин «C1-C5 алкил» относится к углеводородному радикалу с прямой или разветвленной цепью, содержащему от 1 до 5 атомов углерода. Примеры C1-C5 алкила включают в себя без ограничений метил, этил, пропил и изопропил. Термин «C3-C5 циклоалкил» относится к насыщенной циклической углеводородной молекуле, содержащей от 3 до 5 атомов углерода. Примеры C3-C5 циклоалкила включают без ограничений циклопропил, циклобутил и циклопентил. Алкил и циклоалкил, упомянутые здесь, включают как замещенные, так и незамещенные молекулы, если не указано иное. Возможные заместители в алкиле и циклоалкиле включают без ограничений амино, гидроксил, галоген, тио, ациламино, аминоацил, аминотиоацил, амидино, гуанидин, уреидо, циано, нитро, нитрозо, азидо, ацил, тиоацил, ацилокси, карбоксил и сложный эфир карбоновой кислоты.
В другом аспекте настоящее изобретение относится к транс-изомерному химическому соединению Формулы (I), полученному способом, описанным выше.
Подробное раскрытие приводится ниже в описании. Другие признаки и объекты настоящего изобретения будут очевидны из следующего подробного описания нескольких вариантов осуществления изобретения, а также из прилагаемой формулы изобретения.
Подробное описание изобретения
Первым приводится подробное описание транс-изомерного химического соединения Формулы (I), воспроизведенной ниже, или его фармацевтически приемлемой соли:
 (I)
(I)
В этой формуле R1 представляет собой C1-C5 алкил или C3-C5 циклоалкил. В некоторых вариантах осуществления изобретения R1 представляет собой C1-C5 алкил, например, метил, этил и изопропил. В некоторых вариантах осуществления изобретения транс-изомерное химическое соединение имеет отношение транс:цис форм, по меньшей мере, 70:30, например, 80:20, 90:10 и 99:1.
Транс-изомерное соединение может находиться в виде чистого энантиомера. Примером энантиомера является форма (3S, 5S)-конфигурации Формулы (Ia), показанной в приведенном выше разделе «Сущность изобретения», или ее фармацевтически приемлемая соль, или форма (3R, 5R)-конфигурации Формулы (Ib) также показанной в приведенном выше разделе «Сущность изобретения», или ее фармацевтически приемлемая соль.
Термин «фармацевтически приемлемая соль» относится к кислотной или основной соли химического соединения настоящего изобретения. В некоторых вариантах осуществления изобретения фармацевтически приемлемые соли включают кислотно-аддитивные соли присоединения кислоты, которые могут быть образованы путем взаимодействия соединения с фармацевтически приемлемой кислотой, такой как соляная кислота, бромистоводородная кислота, фтористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, пикриновая кислота, метансульфоновая кислота, бензолсульфоновая кислота, аспарагиновая кислота и глутаминовая кислота.
Вышеописанные химические соединения включают в себя сами соединения, а также их соли, пролекарства, полиморфы, стереоизомеры и сольваты, если это применимо. Например, соль может образовываться между анионом и положительно заряженной группой (например, амино) в химическом соединении, имеющем одну из приведенных выше формул. Подходящие анионы включают в себя хлорид, бромид, йодид, сульфат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, ацетат, малат, тозилат, тартрат, фумурат, глутамат, глюкуронат, лактат, глутарат и малеат. Аналогично, соль может также образовываться между катионом и отрицательно заряженной группой (например, карбоксилатом) на соединении, имеющем одну из приведенных выше формул. Подходящие катионы включают в себя ион натрия, ион калия, ион магния, ион кальция и аммоний-катион, такой как ион тетраметиламмония. Соединения также включают в себя соли, содержащие четвертичные атомы азота. Для простоты расчета, если не указано иное, термин «молекулярная масса» упомянутого здесь химического соединения относится к массе формы свободного основания настоящего химического соединения. Примеры пролекарств включают в себя сложные эфиры и другие фармацевтически приемлемые производные, которые при введении субъекту способны образовывать активные соединения. Термин «сольват» относится к комплексу, образованному между активным химическим соединением и фармацевтически приемлемым растворителем. Примеры фармацевтически приемлемых растворителей включают в себя воду, этанол, изопропанол, этилацетат, уксусную кислоту и этаноламин.
Также в объем настоящего изобретения включен способ получения транс-изомерного химического соединения Формулы (I) или его фармацевтически приемлемой соли.
В качестве повторения, данный способ включает в себя гидрирование химического соединения Формулы (II), приведенной выше в разделе «Сущность изобретения», в присутствии палладиевого катализатора в присутствии инертного растворителя для стереоселективного получения транс-изомерного химического соединения Формулы (I), имеющего отношение транс:цис форм не менее 70:30, или его фармацевтически приемлемой соли.
Стереоселективное гидрирование химического соединения Формулы (II) проводят в присутствии палладиевого катализатора при подходящем давлении с использованием различных растворителей. Отношение транс:цис форм определяются с помощью спектроскопии ядерного магнитного резонанса (ЯМР).
Палладиевый катализатор включает в себя одно или несколько соединений палладия, таких как Pd(OH)2/C, Pd/C, Pd(OAc)2, Pd/Al2O3, или их комбинацию. В других вариантах осуществления изобретения он может содержать другой катализатор на основе переходного металла, например Pt/C и Rh/C. Содержание палладия в палладиевом катализаторе может составлять от примерно 0,01 мас.% до примерно 30 мас.%, или от примерно 0,1 мас.% до примерно 25 мас.%, или от примерно 1 мас.% до примерно 20 мас.%, или от примерно 2 мас.% до примерно 20 мас.%, или от примерно 5 мас.% до примерно 20 мас.%.
Примеры инертного растворителя включают без ограничений H2O, C1-C10 сложный эфир (например, этилацетат и метилацетат), C3-C10 циклоалкан (например, циклопропан, циклобутан, циклопентан и циклогексан), тетрагидрофуран (ТГФ), диметилформамид (ДМФА), ацетонитрил, C1-C10 спирт (например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, трет-бутанол, этиленгликоль, пропиленгликоль и бутиленгликоль), моноалкиловый эфир алкиленгликоля (например, монометиловый эфир пропиленгликоля, моноэтиловый эфир пропиленгликоля и монопропиловый эфир пропиленгликоля), карбоксилат моноалкилового эфира алкиленгликоля (например, ацетат монометилового эфира пропиленгликоля, ацетат моноэтилового эфира пропиленгликоля и ацетат монопропилового эфира пропиленгликоля), растворитель на основе амида (например, N,N-диметилацетамид и N,N-диметилформамид), органическую кислоту (например, C1-C10 карбоновая кислоту и C1-C10 сульфокислоту) и их комбинации. В одном варианте осуществления изобретения инертный растворитель может содержать два или более C1-C10 сложных эфиров, два или более C3-C10 циклоалканов и тому подобное. В других вариантах осуществления изобретения инертный растворитель может содержать одну или несколько неорганических кислот (например, соляную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту).
В одном варианте осуществления изобретения инертный растворитель представляет собой H2O, C1-C5 сложный эфир, C3-C6 циклоалкан, ТГФ, ДМФА, ацетонитрил, C1-C5 спирт, монометиловый эфир пропиленгликоля, ацетат монометилового эфира пропиленгликоля, N,N-диметилацетамид, C1-C5 карбоновую кислоту (например, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, изомасляную кислоту, дифторуксусную кислоту, трифторуксусную кислоту и их комбинации), C1-C5 сульфоновую кислоту (например, метансульфоновую кислоту), или их комбинации, и в других вариантах осуществления изобретения, содержит одну или несколько неорганических кислот, выбранных из соляной кислоты, серной кислоты, фосфорной кислоты и азотной кислоты. В другом варианте осуществления изобретения инертный растворитель представляет собой H2O, C1-C5 сложный эфир, C3-C6 циклоалкан, ТГФ, ДМФА, C1-C5 спирт, монометиловый эфир пропиленгликоля, ацетат монометилового эфира пропиленгликоля, N,N-диметилацетамид, C1-C5 карбоновую кислоту, C1-C5 сульфоновую кислоту или их комбинацию, и в других вариантах осуществления изобретения содержит соляную кислоту. В еще других вариантах осуществления изобретения инертными растворителями являются H2O, метанол (MeOH), этанол (EtOH), изопропанол (i-PrOH), этилацетат, муравьиная кислота, уксусная кислота, метансульфокислота и их комбинация, а в некоторых вариантах осуществления изобретения они содержат соляную кислоту.
Неожиданно инертный растворитель, содержащий неорганическую кислоту (например, соляную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту), оказалось способен обеспечить чрезвычайно высокую стереоселективность транс-изомерных пиперидинов. В качестве примеров, инертный растворитель представляет собой органическую кислоту или комбинацию органической кислоты с одним или несколькими из следующих растворителей: H2O, C1-C10 сложный эфир, C3-C10 циклоалкан, ТГФ, ДМФА, ацетонитрил, моноалкиловый эфир алкиленгликоля, карбоксилат моноалкилового эфира алкиленгликоля, растворитель на основе амида, C1-C10 спирт и неорганическую кислоту. В одном варианте осуществления изобретения инертный растворитель представляет собой С1-С5 карбоновую кислоту, С1-С5 сульфоновую кислоту или их комбинацию или дополнительно объединен с одним или несколькими из следующих растворителей: Н2О, С1-С10 сложный эфир, С3-С10 циклоалкан, ТГФ, ДМФА, ацетонитрил, моноалкиловый эфир алкиленгликоля, карбоксилат моноалкилового эфира алкиленгликоля, растворитель на основе амида, С1-С10 спирт и неорганическая кислота. В другом варианте осуществления изобретения инертный растворитель представляет собой муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, изомасляную кислоту или их комбинацию или дополнительно объединен с одним или несколькими из следующих растворителей: Н2О, С1-С10 сложный эфир, С3-С10 циклоалкан, ТГФ, ДМФА, ацетонитрил, моноалкиловый эфир алкиленгликоля, карбоксилат моноалкилового эфира алкиленгликоля, растворитель на основе амида, С1-С10 сульфокислота, С1-С10 спирт и неорганическая кислота.
Также неожиданно инертный растворитель, содержащий органическую кислоту (например, C1-C5 карбоновую кислоту и C1-C5 сульфоновую кислоту), может обеспечивать чрезвычайно высокую стереоселективность транс-изомерных пиперидинов. В качестве примеров, инертный растворитель представляет собой C1-C5 сложный эфир, C3-C6 циклоалкан, ТГФ, ДМФА, ацетонитрил, C1-C5 спирт, монометиловый эфир пропиленгликоля, ацетат монометилового эфира пропиленгликоля, N,N-диметилацетамид, C1-C5 карбоновую кислоту, C1-C5 сульфоновую кислоту или их комбинацию или дополнительно объединен с H2O.
В одном варианте осуществления изобретения реакцию гидрирования проводят при температуре 10-100°С, например, 15-80°С, 20-70°С, 20-60°С, 20-50°С и 25-45°С. В качестве примеров, ее проводят при температуре 25°С, 30°С, 35°С, 40°С, 45°С, 50°С, 55°С или 60°С.
Реакцию гидрирования можно проводить при давлении водорода 1-60 бар, 5-50 бар, 10-40 бар, 15-30 бар или 15-25 бар (1бар=0,987 атм).
Время реакции гидрирования варьируется в широком диапазоне, например, 1-80 часов, в зависимости от палладиевого катализатора, давления водорода, температуры реакции и используемого оборудования для гидрирования. Завершение реакции гидрирования может быть подтверждено ЯМР. После завершения очистку можно проводить путем фильтрации, концентрирования при пониженном давлении и перегонки. В одном варианте осуществления изобретения транс-изомерный пиперидин, полученный, таким образом, при необходимости может быть преобразован в форму соли.
В примере способа реакцию гидрирования проводят при температуре 25-45°С при давлении водорода 15-25 бар.
В некоторых вариантах осуществления изобретения при осуществлении данного способа транс-изомерный пиперидин получают с отношением транс:цис форм от 70:30 до 99,9:0,1 (например, от 70:30 до 99:1, от 70:30 до 95:5, от 70:30 до 90:10, от 75:25 до 99,9:0,1, от 75:25 до 95:5, от 75:25 до 90:10, от 80:20 до 99,9:0,1, от 80:20 до 99:1, от 80:20 до 95:5, от 80:20 до 90:10, от 85:15 до 99,9:0,1, от 85:15 до 99:1, от 85:15 до 95:5 и от 85:15 до 90:10).
Описанный выше способ получения может дополнительно включать этап разделения, который выполняется посредством оптического разделения полученного, таким образом, транс-изомерного пиперидина, с помощью кислотного разделяющего агента. На этом этапе получают оптически обогащенный энантиомер транс-изомерного соединения Формулы (I), то есть энантиомер (3S, 5S)- или (3R, 5R)-конфигурации, или его фармацевтически приемлемой соли с высоким выходом и высокой чистотой. Кислотный разделяющий агент может быть в R-форме или S-форме. Полученный, таким образом, энантиомер может быть в дальнейшем перекристаллизован с использованием растворителя для перекристаллизации.
Термин «кислотный разделяющий агент» относится к кислотному химическому соединению, которое может привести к осаждению диастереомера, содержащего подходящий энантиомер, с высокими химическими и оптическими выходами.
Ниже показана реакция оптического разрешения:
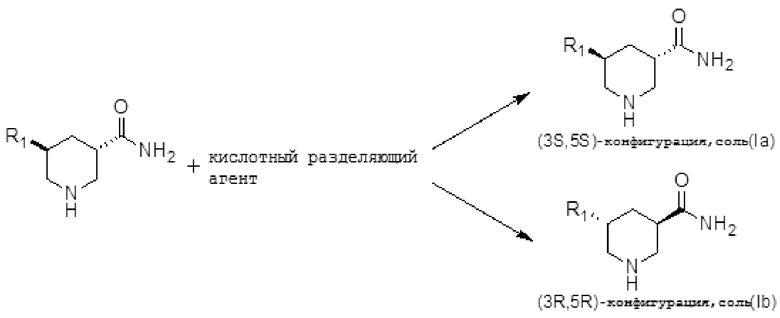
где R1 представляет собой C1-C5 алкил или C3-C5 циклоалкил. Две солевые формы оптических изомеров, содержащие (3S, 5S)-конфигурацию Ia и (3R, 5R)-конфигурацию Ib, могут быть получены путем оптического разделения транс-изомерного химического соединения Формулы (I) с помощью кислотного разделяющего агента.
Значение энантиомерного избытка (то есть «значение ее») одного энантиомера ((3S, 5S)-конфигурации Ia или (3R, 5R)-конфигурации Ib) составляет 70-100%, 80-100%, 90-100%, 95-100%, 99-100%, 70-99,9%, 80-99,9%, 85-99,9%, 90-99,9%, 95-99,9% или 99-99,9%. Как правило, термин «значение ее» обозначает разницу между количествами каждого из энантиомеров, присутствующего в смеси, относительно общего количества соединения в смеси, выраженную в процентах (×100%).
Кислотным разделяющим агентом может быть дезоксихолевая кислота,(-)-2,3:4,6-ди-о-изопропилиден-2-кето-L-гулоновая кислота моногидрат, D-(-)-хинная кислота, L-пироглутаминовая кислота, (-)-монометилсукцинат, N-ацетил-D-(+)-лейцин, N-ацетил-L-метионин, (R)-(+)-N-(1-фенилэтил)сукцинаминовая кислота, (S)-(+)-5-оксo-2-тетрагидрофуранкарбоновая кислота, (R)-(+)-N-(1-фенилэтил)фталаминовая кислота, (-)-моно-(1R)-метилфталат, (-)-ментилоксиуксусная кислота, (S)-(+)-миндальная кислота, L-(+)-винная кислота, D-(+)-камфорная кислота, ангидрид (-)-дибензоил-L-винной кислоты, (-)-дибензоил-L-винная кислота моногидрат, моно (диметиламид) (-)-O,O'-дибензоил-L-винной кислоты, D-(+)-10-камфорсульфоновая кислота, L-(+)-молочная кислота, L-(-)-яблочная кислота, (-)-O,O'-ди-п-толуоил-L-винная кислота, (R)-(-)-напроксен или (S)-ибупрофен.
Следует отметить, что как R-форма, так и S-форма кислотного разделяющего агента, например (R)-(-)-напроксен и (S)-(+)-напроксен, могут использоваться для получения высокого значения «ee».
В одном варианте осуществления изобретения кислотным разделяющим агентом является дезоксихолевая кислота, D-(-)-хинная кислота, (-)-монометилсукцинат, N-ацетил-D-(+)-лейцин, N-ацетил-L-метионин, (-)-моно(1R)-метилфталат, ангидрид (-)-дибензоил-L-винной кислоты безводная, моно (диметиламид) (-)-O,O'-дибензоил-L-винной кислоты, D-(+)-10-камфорсульфоновая кислота, L-(+)- молочная кислота или (R)-(-)-напроксен.
Оптическое разделение может быть выполнено в присутствии инертного растворителя. Использование инертного растворителя хорошо известно в данной области техники и варьируется в зависимости от типа исходного рацемического транс-изомера пиперидинового соединения и используемого разделяющего агента.
Инертный растворитель для оптического разделения может представлять собой H2O, C1-C10 сложный эфир (например, этилацетат и метилацетат), C3-C10 циклоалкан (например, циклогексан), ТГФ, ДМФА, ацетонитрил, C1-C10 спирт (например, MeOH, EtOH, n-PrOH, i-PrOH, n-BuOH и i-BuOH), моноалкиловый эфир алкиленгликоля (например, монометиловый эфир пропиленгликоля, моноэтиловый эфир пропиленгликоля и монопропиловый эфир пропиленгликоля), карбоксилат моноалкилового эфира алкиленгликоля (например, ацетат монометилового эфира пропиленгликоля, ацетат моноэтилового эфира пропиленгликоля и ацетат монопропилового эфира пропиленгликоля), растворитель на основе амида (например, N,N-диметилацетамид и N,N-диметилформамид) или их комбинацию.
В одном варианте осуществления изобретения инертный растворитель представляет собой H2O, ацетонитрил, этилацетат, C1-C3 спирт или их комбинацию. В другом варианте осуществления изобретения инертный растворитель представляет собой ацетонитрил.
В одном варианте осуществления изобретения отношение инертного растворителя к реакционному субстрату конкретно не ограничивается. Например, растворитель можно использовать в количестве кратном от 0,5 до 100 раз относительно массы субстрата.
Температура для оптического разделения выбирается в зависимости от типа исходного материала, разделяющего агента и используемого растворителя. Например, реакцию проводят при температуре 20-60°С (например, 30-50°С).
Оптическое разделение, описанное выше, может дополнительно включать в себя этап перекристаллизации (3S, 5S)-конфигурации (Ia) или (3R, 5R)-конфигурации (Ib) с использованием растворителя для перекристаллизации с образованием продукта с высокой оптической чистотой.
Растворитель для перекристаллизации может представлять собой H2O, C1-C10 сложный эфир (например, этилацетат и метилацетат), C3-C10 циклоалкан (например, циклогексан), ТГФ, ДМФА, ацетонитрил, C1-C10 спирт (например, MeOH, EtOH , n-PrOH, i-PrOH, n-BuOH и i-BuOH), моноалкиловый эфир алкиленгликоля (например, монометиловый эфир пропиленгликоля, моноэтиловый эфир пропиленгликоля и монопропиловый эфир пропиленгликоля), карбоксилат моноалкилового эфира алкиленгликоля (например, ацетат монометилового эфира пропиленгликоля, ацетат моноэтилового эфира пропиленгликоля и ацетат монопропилового эфира пропиленгликоля), растворитель на основе амида (например, N,N-диметилацетамид и N,N-диметилформамид) или их комбинацию. В одном варианте осуществления изобретения во время перекристаллизации также может быть применяться анти-растворитель. Используемый здесь термин «анти-растворитель» относится к растворителю, в котором кристаллическое соединение имеет ограниченную или плохую растворимость. Примеры анти-растворителя включают в себя без ограничений этилацетат, ацетон, метилэтилкетон, толуол, изопропилацетат и трет-бутилметиловый эфир.
Без дальнейшего уточнения авторы настоящего изобретения полагают, что специалист в данной области техники может, основываясь на приведенном выше описании, использовать настоящее раскрытие в полной мере. Следовательно, следующие примеры следует истолковывать как просто иллюстративные и никоим образом не ограничивающие остальную часть раскрытия. Публикации, цитируемые в данном описании, полностью включены в настоящее изобретение путем ссылки.
Пример 1: Стереоселективное гидрирование 5-метилникотинамида
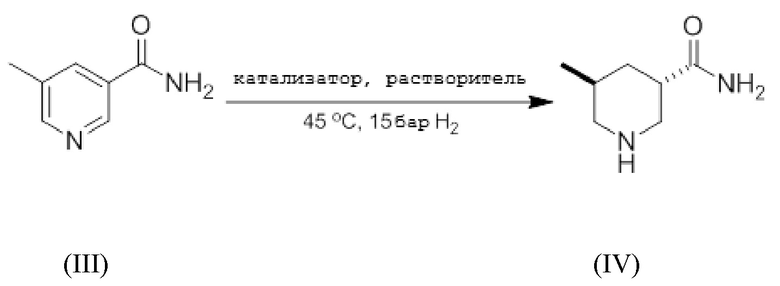
Таблица 1
Как показано в приведенной выше реакции и в Таблице 1, в автоклав с магнитным перемешиванием загружали 5-метилникотинамид, то есть химическое соединение (III), различные инертные растворители и катализаторы на основе переходных металлов, с получением транс-изомерного химического соединения (IV). В автоклаве создавали давление Н2 15 бар и перемешивали при температуре 45°С. После этого образец содержимого автоклава анализировали методом ЯМР.
В Таблице 1 показано, что использование не содержащего палладий катализатора, то есть Rh/C или Pt/C, приводило к отношению транс:цис форм от 46:54 до 53:47 (группы C1 и C2). Другими словами, не наблюдалось значительной селективности диастереоизомеров. Неожиданно, применение палладиевого катализатора при гидрировании химического соединения (III)способствует стереоселективному получению соединения (IV) с образованием транс-изомера с отношением транс:цис форм от 73:27 до 78:22 (группы E1-E6 ).
Эти результаты указывают на то, что гидрирование с использованием палладиевого катализатора способствует образованию транс-изомерных пиперидинов.
Пример 2: Стереоселективное гидрирование 5-метилникотинамида в присутствии муравьиной кислоты и Pd(OH)2/C
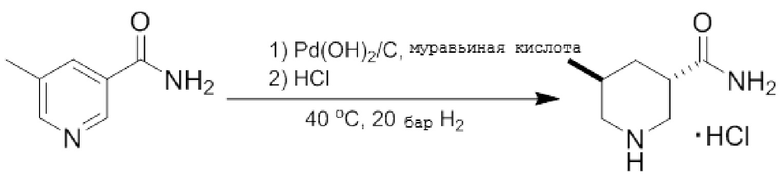
В автоклав загружали 5-метилникотинамид (200 г), Pd(OH)2/C (20 мас.%, 55 г) и 2 л муравьиной кислоты в условиях слабого потока азота. Автоклав закрывали и продували 3 раза азотом и 2 раза водородом при постоянном перемешивании. Реакцию гидрирования, проводимую при температуре 40°С и давлении H2 20 бар, перемешивали до завершения. Затем реакционную смесь фильтровали и концентрировали, получая 520 г неочищенного продукта. Было определено, что отношение транс:цис форм неочищенного продукта составляло 85:15.
Неочищенный продукт растворяли в 3 л 2-пропанола и обрабатывали по каплям 1М раствором соляной кислоты в диэтиловом эфире. Была получена и выделена хлоргидратная соль. Результаты ЯМР-анализа указанной соли были следующими:
1H-ЯМР (ДМСО-d6, 400 МГц) м.д.: 8,61 (br s, 2H), 7,74 (br s, 1H), 7,25 (br s, 1H), 3,23, 3,03 (ABq, J = 11,0 Гц, 2H), 2,85 (d, J = 11,6 Гц, 1H), 2,75-2,77 (m, 1H), 2,53-2,56 (m, 1H), 1,85-1,92 (m, 2H), 1,48-1,55 (m, 1H), 0,91 (d, J = 6,3 Гц, 3H); 13C-ЯМР (ДМСО-d6, 75 МГц) м.д.: 175,27, 48,30, 43,62, 35,11, 32,84, 25,02, 18,05; МС (ИЭР): m/z = 165,1 (М + Na+).
Пример 3: Стереоселективное гидрирование 5-метилникотинамида в присутствии HCl, H2O/MeOH и Pd/C

В автоклав загружали 5-метилникотинамид (15,6 г), соляную кислоту (1,0 эквивалент), H2O (40 мл), MeOH (56 мл) и Pd/C (10 мас.% на C, 0,5 г) под небольшим потоком азота. Автоклав закрывали и продували 3 раза азотом и 2 раза водородом при постоянном перемешивании. Реакцию гидрирования проводили при температуре 25°С и давлении H2 20 бар и постоянном перемешивании. Затем реакционную смесь фильтровали и промывали смесью H2O/MeOH. Фильтрат концентрировали и сушили в вакууме, получая транс-изомерный пиперидин с отношением транс:цис форм 89:11.
Пример 4: Оптическое разделение с (S)-(+)-напроксеном
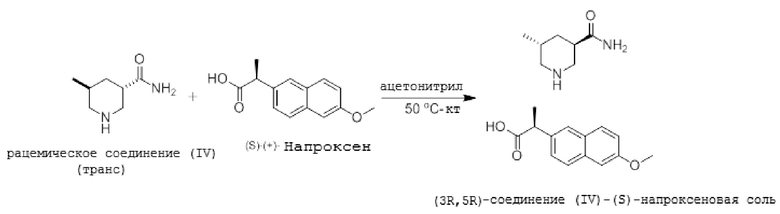
Описывая приведенную выше реакцию, 115 мг (S)-(+)-напроксена и 142 мг рацемического транс-изомерного химического соединения (IV) растворяли в 3 мл ацетонитрила при нагревании до температуры 50°С. Раствор оставляли на ночь при комнатной температуре (кт). Полученную смесь фильтровали и промывали ацетонитрилом, получая белые кристаллы (3R, 5R)-конфигурации (S)-напроксеновой соли соединения (IV) (выход 43%; значение ее составляет 90%).
Пример 5: Оптическое разделение с (R)-(-)-напроксеном
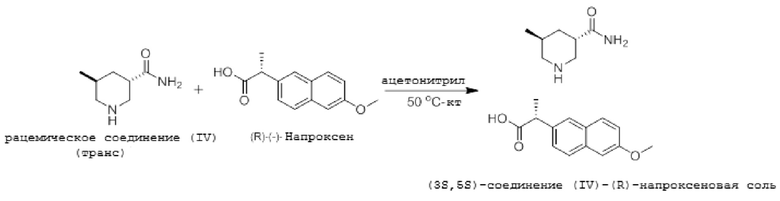
Описывая приведенную выше реакцию, 1,26 г (R)-(-)-напроксена и 1,56 г рацемического транс-изомерного соединения (IV) растворяли в 22 мл ацетонитрила при нагревании до температуры 50°С. Полученный таким образом раствор оставляли на ночь при комнатной температуре (кт). Полученную смесь фильтровали и промывали ацетонитрилом, получая кристаллы (3S,5S)-конфигурации (R)-напроксеновой соли соединения (IV) (выход 42%; ее значение 96,8%). Кристаллы также перекристаллизовывали из ацетонитрила и изопропанола (выход 66,7%; значение ее 99,9%). Результаты ЯМР-анализа данной соли: 1H-ЯМР (метанол-d4, 300 МГц) м.д.: 7,61 (d, J = 2,7 Гц, 1H), 7,58 (d, J = 2,7 Гц, 1H), 7,41 (m, 0,5H), 7,38 (m, 0,5H), 7,08 (m, 1H), 7,00 (d, J = 2,4 Гц, 0,5H), 6,97 (d, J = 2,4 Гц, 0,5H), 3,78 (s, 3H), 3,62 (q, J = 7,2 Гц, 1H), 3,21-3,24 (m, 2H), 2,95-3,00 (m, 1H), 2,67-2,73 (m, 2H), 2,30 (t, J = 12,0 Гц, 1H), 1,79-1,88 (m, 2H), 1,36 (d, J = 7,5 Гц, 3H), 1,34-1,35 (m, 1H), 0,78 (d, J = 6,6 Гц, 3H); 13C-ЯМР (метанол-d4, 75 МГц) м.д. 20,01, 18,75; МС (ИЭР): m/z = 165,1 (М++Na).
Другие варианты осуществления изобретения
Все признаки, раскрытые в настоящем описании, могут быть объединены в любой комбинации. Каждый признак, раскрытый в данном описании, может быть заменен альтернативным признаком, служащим той же, эквивалентной или аналогичной цели. Таким образом, если прямо не указано иное, каждый раскрытый признак является лишь примером серии эквивалентных или сходных признаков.
Из приведенного выше описания специалист в данной области техники может легко установить характеристики настоящего изобретения и, не отступая от его сущности и объема, может внести различные изменения и модификации в настоящее изобретение, чтобы адаптировать его к различным применениям и условиям. Таким образом, другие варианты осуществления изобретения также находятся в пределах объема следующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505540C2 |
| АНТИВИРУСНЫЕ СОЕДИНЕНИЯ | 2009 |
|
RU2505539C2 |
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ Rho-КИНАЗЫ | 2006 |
|
RU2443688C2 |
| СОЕДИНЕНИЯ С СУЛЬФАМОИЛЬНОЙ И АМИДИНОГРУППОЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1994 |
|
RU2126382C1 |
| ПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ АНТАГОНИСТА ПЕРИФЕРИЧЕСКОГО ДЕЙСТВИЯ ОПИОИДОВ | 1992 |
|
RU2076863C1 |
| N1-(4-(5-(ЦИКЛОПРОПИЛМЕТИЛ)-1-МЕТИЛ-1H-ПИРАЗОЛ-4-ИЛ)ПИРИДИН-2-ИЛ)ЦИКЛОГЕКСАН-1,4-ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ СK1 И/ИЛИ IRAK1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2761457C2 |
| АЦИЛИРОВАННЫЕ АРИЛЦИКЛОАКИЛАМИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2337094C2 |
| [(БЕНЗОДИОКСАН, БЕНЗОФУРАН ИЛИ БЕНЗОПИРАН)-АЛКИЛАМИНО]-АЛКИЛ-ЗАМЕЩЕННЫЕ ГУАНИДИНЫ В КАЧЕСТВЕ СЕЛЕКТИВНЫХ СОСУДОСУЖИВАЮЩИХ СРЕДСТВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНОЕ ДЛЯ НИХ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2121999C1 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ 1β-ДРЕНЕРГИЧЕСКОГО РЕЦЕПТОРА | 2006 |
|
RU2415855C2 |
| ПРОИЗВОДНЫЕ ГЛИЦИНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2130923C1 |
Настоящее изобретение относится к способу получения смеси, содержащей транс-изомерное соединение Формулы (I), приведенной ниже, или его фармацевтически приемлемую соль:
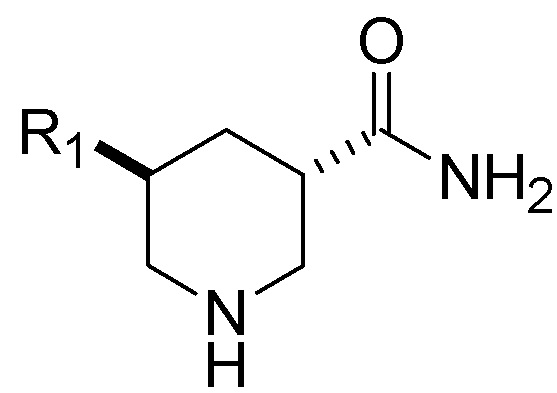 (I).
(I).
Способ включает гидрирование соединения Формулы (II), приведенной ниже, или его фармацевтически приемлемой соли:
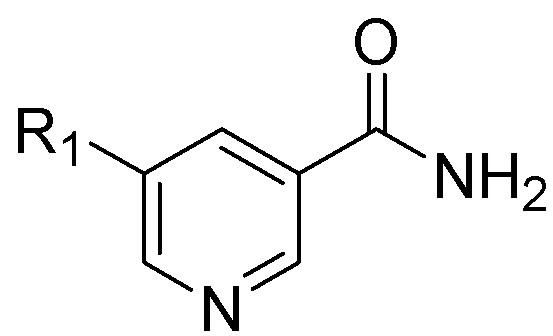 (II),
(II),
в присутствии палладиевого катализатора в среде инертного растворителя для получения смеси, содержащей транс-изомерное соединение формулы (I), имеющей отношение транс:цис форм, по меньшей мере, 70:30, или его фармацевтически приемлемой соли, где R1 в Формулах (I) и (II) представляет собой метил, и где инертный растворитель представляет собой Н2О, С1-С10 сложный эфир, С1-С10 спирт или органическую кислоту или их комбинацию. Изобретение позволяет получить транс-изомерные пиперидины с высоким выходом и высокой стереоселективностью. 13 з.п. ф-лы, 1 табл., 5 пр.
1. Способ получения смеси, содержащей транс-изомерное соединение Формулы (I), приведенной ниже, или его фармацевтически приемлемой соли:
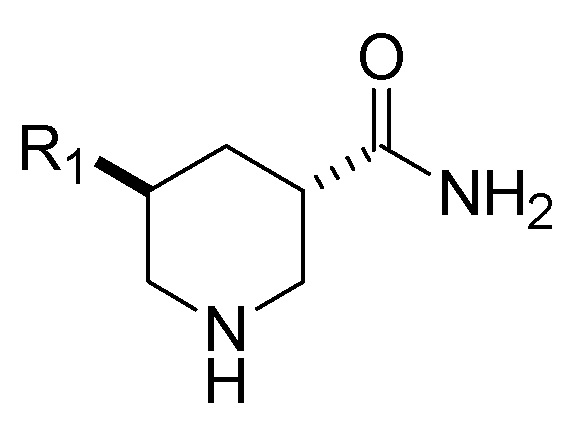 (I),
(I),
способ, включающий гидрирование соединения Формулы (II), приведенной ниже, или его фармацевтически приемлемой соли:
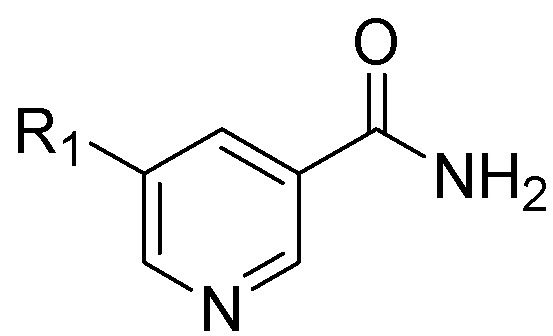 (II),
(II),
в присутствии палладиевого катализатора в среде инертного растворителя для получения смеси, содержащей транс-изомерное соединение формулы (I), имеющей отношение транс:цис форм, по меньшей мере, 70:30, или его фармацевтически приемлемой соли, где R1 в Формулах (I) и (II) представляет собой метил, и где инертный растворитель представляет собой Н2О, С1-С10 сложный эфир, С1-С10 спирт или органическую кислоту или их комбинацию.
2. Способ по п.1, дополнительно включающий разделение транс-изомерного соединения или его фармацевтически приемлемой соли с помощью кислотного разделяющего агента для получения энантиомера транс-изомерного соединения или его фармацевтически приемлемой соли, где энантиомер находится в форме (3S, 5S)-конфигурации Формулы (Ia), приведенной ниже, или (3R, 5R)-конфигурации Формулы (Ib), приведенной ниже:
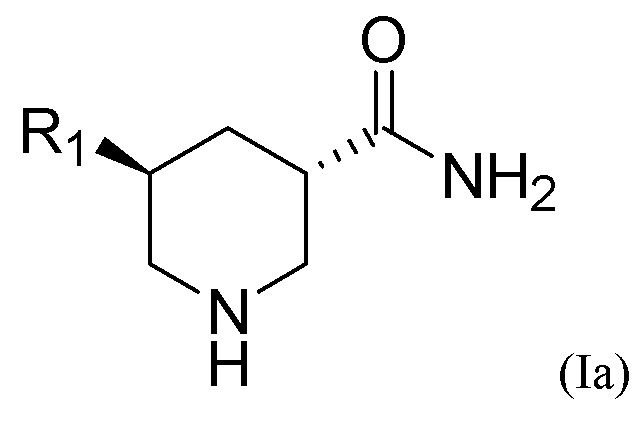
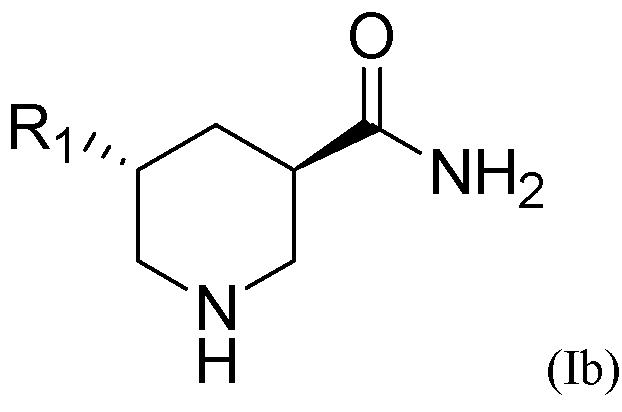
3. Способ по п.1, в котором палладиевый катализатор представляет собой Pd(OH)2/C, Pd/C, Pd(OAc)2, Pd/Al2O3, или их комбинацию, и содержание палладия в палладиевом катализаторе составляет от 0,01 мас.% до 30 мас.%.
4. Способ по п.3, дополнительно обеспечивающий дополнительный катализатор на основе переходного металла.
5. Способ по п.4, в котором дополнительный катализатор на основе переходного металла представляет собой Pt/C или Rh/C.
6. Способ по п.1, в котором инертный растворитель объединен с одной или несколькими неорганическими кислотами.
7. Способ по п.1, в котором инертный растворитель представляет собой H2O, C1-C5 сложный эфир, C1-C5 спирт, C1-C5 карбоновую кислоту, C1-C5 сульфоновую кислоту или их комбинацию.
8. Способ по п.7, где инертный растворитель представляет собой H2O, метанол, этанол, изопропанол, муравьиную кислоту, уксусную кислоту, этилацетат, метансульфокислоту или их комбинацию.
9. Способ по п.8, в котором инертный растворитель объединен с соляной кислотой.
10. Способ по п.1, где инертный растворитель представляет собой органическую кислоту или комбинацию органической кислоты с одним или несколькими растворителями, выбранными из группы, состоящей из H2O, C1-C10 сложного эфира, C1-C10 спирта и неорганической кислоты.
11. Способ по п.10, в котором органическая кислота представляет собой муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную кислоту, изомасляную кислоту или их комбинацию.
12. Способ по п.2, в котором кислотный разделяющий агент представляет собой дезоксихолевую кислоту, (-)-2,3:4,6-ди-о-изопропилиден-2-кето-L-гулоновую кислоту моногидрат, D-(-)-хинную кислоту, L-пироглутаминовую кислоту, (-)-монометилсукцинат, N-ацетил-D-(+)-лейцин, N-ацетил-L-метионин, (R)-(+)-N-(1-фенилэтил)сукцинаминовую кислоту, (S)-(+)-5-оксо-2-тетрагидрофуранкарбоновую кислоту, (R)-(+)-N-(1-фенилэтил)фталаминовую кислоту, (-)-моно-(1R)-метилфталат, (-)-ментилоксиуксусную кислоту, (S)-(+)-миндальную кислоту, L-(+)-винную кислоту, D-(+)-камфорную кислоту, ангидрид (-)-дибензоил-L-винной кислоты, (-)-дибензоил-L-винную кислоту моногидрат, моно(диметиламид) (-)-O,O'-дибензоил-L-винной кислоты, D-(+)-10-камфорсульфоновую кислоту, L-(+)-молочную кислоту, L-(-)-яблочную кислоту, (-)-O,O'-ди-п-толуоил-L-винную кислоту, (R)-(-)-напроксен или (S)-ибупрофен, или их R-форму или S-форму.
13. Способ по п.2, дополнительно включающий перекристаллизацию энантиомера (3S, 5S)-конфигурации или энантиомера (3R, 5R)-конфигурации в растворителе для перекристаллизации.
14. Способ по п.13, в котором растворитель для перекристаллизации представляет собой H2O, C1-C10 сложный эфир, C3-C10 циклоалкан, ТГФ, ДМФА, ацетонитрил, C1-C10 спирт или их комбинацию.
| US 2012123128 A1, 17.05.2012 | |||
| Chemical Abstract Compound, STN express RN 1478706-59-0, 22.11.2013 | |||
| Chemical Abstract Compound, STN express RN 1784142-67-1, 19.06.2015 | |||
| Chemical Abstract Compound, STN express RN 1784143-15-2, 19.06.2015 | |||
| Chemical Abstract Compound, STN express RN 1784142-88-6, 19.06.2015 | |||
| Chemical Abstract Compound, STN express RN |
Авторы
Даты
2021-11-12—Публикация
2018-08-10—Подача