Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к средству для профилактики или лечения атрофии головного мозга, включающему 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол или его соль в качестве активного ингредиента.
Предпосылки создания изобретения
[0002]
Деменция представляет собой нейродегенеративное заболевание со значительно сниженной когнитивной функцией, вызванное, например, атрофией головного мозга и/или цереброваскулярным расстройством. Деменция подразделяется на несколько типов в зависимости от причины этого заболевания, и от 60 до 80% пациентов с деменцией страдают от болезни Альцгеймера (AD) (Непатентная литература 1). Патогенез AD сложен, и причиной считается образование сенильных бляшек вследствие коагуляции амилоидного β–белка (Aβ) или нейрофибриллярные изменения, вызванные коагуляцией фосфорилированного Тау–белка (p–Tau) (Непатентная литература 2). Число пациентов с AD в Японии, по оценкам, составляет более 1160000 человек. Заболеваемость выше в пожилом возрасте, и, следовательно, по мере старения общества ожидается быстрое увеличение числа пациентов, что приведет к увеличению нагрузки на семьи пациентов и резкому росту расходов на медицинское обслуживание и уход в будущем (Непатентная литература 3, 4). Таким образом, лечение AD важно не только для предотвращения снижения качества жизни пациентов и для последующего снижения нагрузки на их семьи, но и для снижения медицинских расходов в будущем стареющем обществе.
Симптомы деменции включают основные симптомы когнитивных нарушений и периферические симптомы, такие как проблемное поведение, наблюдаемое, когда пациенты с когнитивными нарушениями взаимодействуют с окружающими их людьми (Непатентная литература 5). В настоящее время в Японии в качестве средства для лечения AD используют четыре средства: донепезила гидрохлорид, галантамина гидробромид и ривастигмин, которые являются ингибиторами ацетилхолинэстеразы, и мемантина гидрохлорид, который является антагонистом рецептора N–метил–D–аспартата. Все они способны уменьшить основные симптомы или периферические симптомы. Однако эти лекарственные средства являются симптоматическими лекарственными средствами, которые улучшают основные симптомы или периферические симптомы в течение определенного периода времени, а не подавляют нейродегенерацию при AD. Хотя эти лекарственные средства временно эффективны для улучшения когнитивной функции в начале их применения, примерно через 48 недель или более когнитивная функция обычно становится хуже, чем когнитивная функция до лечения (Непатентная литература 6).
[0003]
Известно, что 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол (именуемый далее "Соединение A") или его соль обладает нейропротекторным, стимулирующим регенерацию нервов и рост нейритов действием и является полезным в качестве терапевтического средства при заболеваниях центральной и периферической нервной системы (Патентная литература 1). Кроме того, публикация раскрывает, что обычно лекарственное средство можно вводить взрослому человеку в дозе или раздельными дозами от 0,01 до 500 мг в день (Патентная литература 2).
Литература предшествующего уровня техники
Патентная литература
[0004]
Патентная литература 1: Международная публикация WO 2003/035647
Патентная литература 2: Международная публикация WO 2003/105830
Непатентная литература
[0005]
Непатентная литература 1: 2012 Alzheimer’s Disease Facts and Figures.
(http://www.alz.org/downloads/facts_figures_2012.pdf)
Непатентная литература 2: YAKUGAKU ZASSHI, 2010, Vol. 130, No. 4, pp. 521–526
Непатентная литература 3: Japanese Journal of Clinical Medicine, 2008, Vol. 66 (Extra ed. 1), pp. 23–27
Непатентная литература 4: Press Release by Seed Planning (December 28, 2010)
(http://www.seedplanning.co.jp/press/2010/2010122801.html)
Непатентная литература 5: Japanese Journal of Clinical Psychopharmacology, 2011, Vol. 14, No. 7, pp. 1123–1129
Непатентная литература 6: Japanese Journal of Clinical Psychopharmacology, 2012, Vol. 15, No. 3, pp. 311–321
Сущность изобретения
Задача, решаемая настоящим изобретением
[0006]
Лекарственные средства, которые предотвращают прогрессирование AD путем ингибирования нейродегенерации, необходимо разрабатывать заблаговременно. Целью настоящего изобретения является обеспечение лекарственного средства, которое предотвращает прогрессирование AD, и способа предотвращения прогрессирования AD.
Средства решения задачи
[0007]
При таких обстоятельствах авторы настоящего изобретения обнаружили, что Соединение A или его соль обладает эффектом подавления атрофии головного мозга, и завершили настоящее изобретение.
[0008]
Настоящее изобретение обеспечивает следующее.
(1) Средство для профилактики или лечения атрофии головного мозга, включающее Соединение A или его соль в качестве активного ингредиента.
(2) Средство для профилактики или лечения атрофии головного мозга по пункту (1), где средство вводят перорально в дозе от 100 мг до 400 мг в пересчете на Соединение A один раз в день.
(3) Средство для профилактики или лечения атрофии головного мозга по пункту (1), где средство вводят перорально в дозе от 160 мг или 320 мг в пересчете на Соединение A один раз в день.
(4) Средство для профилактики или лечения атрофии головного мозга по любому одному из пунктов (1) – (3), где средство предназначено для введения пациенту с нейродегенеративным заболеванием.
(5) Средство для профилактики или лечения атрофии головного мозга по любому одному из пунктов 1–3, где средство предназначено для введения пациенту с AD, вероятной AD, подозрением на AD, доклинической AD, продромальным периодом болезни Альцгеймера, легким когнитивным нарушением вследствие болезни Альцгеймера (MCI вследствие AD) или легким когнитивным нарушением (MCI).
(6) Средство для профилактики или лечения атрофии головного мозга по любому одному из пунктов (1) – (3), где средство предназначено для введения пациенту с AD, MCI вследствие AD или MCI.
(7) Средство для профилактики или лечения атрофии головного мозга по любому одному из пунктов (1) – (3), где средство предназначено для введения пациенту с AD.
(8) Средство для профилактики или лечения атрофии головного мозга по любому одному из пунктов (1) – (3), где средство предназначено для введения пациенту с MCI вследствие AD.
[0009]
Настоящее изобретение также обеспечивает следующее.
(a) Фармацевтическая композиция для профилактики или лечения атрофии головного мозга, включающая Соединение A или его соль в качестве активного ингредиента.
(b) Соединение A или его соль для применения в профилактике или лечении атрофии головного мозга.
(c) Способ профилактики или лечения атрофии головного мозга, включающий введение пациенту Соединения A или его соли.
(d) Применение Соединения А или его соли для получения средства для профилактики или лечения атрофии головного мозга.
(e) Средство для подавления атрофии головного мозга, включающее Соединение A или его соль в качестве активного ингредиента.
(f) Соединение A или его соль для применения для подавления атрофии головного мозга.
(g) Способ подавления атрофии головного мозга, включающий введение пациенту Соединения A или его соли.
(h) Применение Соединения А или его соли для получения средства для подавления атрофии головного мозга.
Полезные эффекты изобретения
[0010]
Атрофию головного мозга, наблюдаемую при старении или нейродегенеративных заболеваниях, таких как AD, прогрессирующий супрануклеарный паралич и лобно–височная деменция, можно предотвратить или лечить путем введения Соединения A или его соли.
Краткое описание чертежей
[0011]
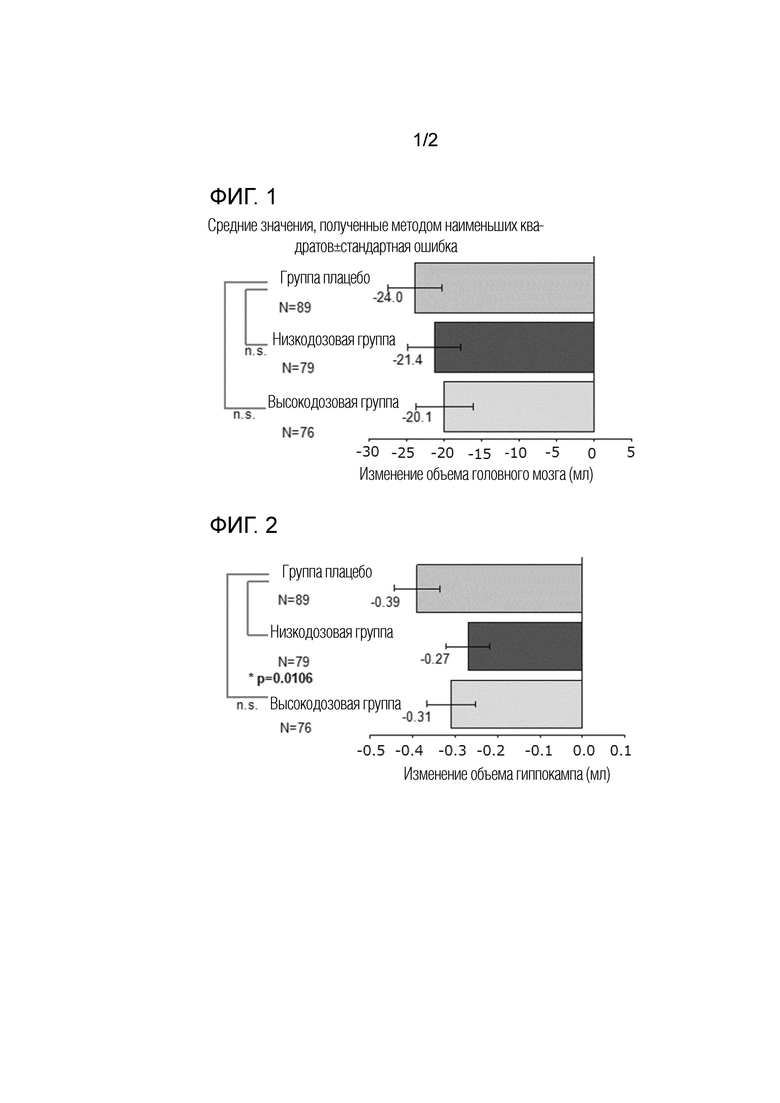
Фиг. 1 представляет график, показывающий изменение объема головного мозга (всего мозга) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 1. "n.s." означает, что не было статистически значимой разницы.
Фиг. 2 представляет график, показывающий изменение объема головного мозга (гиппокампа) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 1. "n.s." означает, что не было статистически значимой разницы.
Фиг. 3 представляет график, показывающий изменение объема головного мозга (всего мозга) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 2.
Фиг. 4 представляет график, показывающий изменение объема головного мозга (гиппокампа) на неделе 52 по сравнению с объемом при скрининге в Примере испытания 2.
Варианты осуществления изобретения
[0012]
Далее настоящее изобретение будет описано подробно.
В настоящем описании соответствующие термины имеют следующее значение, если не указано иное.
[0013]
В настоящем описании числовой диапазон, показанный с помощью "до", представляет диапазон, включающий значение перед и после "до" в качестве минимального и максимального значения, соответственно.
[0014]
Соединение A представляет собой 1–(3–(2–(1–бензотиофен–5–ил)этокси)пропил)азетидин–3–ол.
[0015]
Примеры солей Соединения А включают известные соли основной группы, такой как аминогруппа, или кислотной группы, такой как гидроксильная группа или карбоксильная группа.
Примеры солей основной группы включают соли с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли с органической карбоновой кислотой, такой как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота, аспарагиновая кислота, трихлоруксусная кислота и трифторуксусная кислота; и соли с сульфоновой кислотой, такой как метансульфоновая кислота, бензолсульфоновая кислота, п–толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталинсульфоновая кислота.
[0016]
Примеры солей кислотной группы включают соли с щелочным металлом, таким как натрий и калий; соли с щелочноземельным металлом, таким как кальций и магний; соли аммония; и соли с азот–содержащим органическим основанием, таким как триметиламин, триэтиламин, трибутиламин, пиридин, N, N–диметиланилин, N–метилпиперидин, N–метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N–бензил–β–фенетиламин, 1–эфенамин и N, N’–дибензилэтилендиамин.
[0017]
Из вышеуказанных солей предпочтительными являются фармакологически приемлемые соли, а соли с малеиновой кислотой являются более предпочтительными.
[0018]
В случае, когда соединение A или его соль имеет изомеры (например, оптические изомеры, геометрические изомеры и таутомеры), настоящее изобретение включает все эти изомеры, а также включает гидраты, сольваты и их любые кристаллические формы.
[0019]
Профилактика означает предотвращение возникновения конкретного заболевания или по меньшей мере одного симптома, вызываемого заболеванием.
Лечение означает уменьшение или улучшение по меньшей мере одного симптома, вызванного конкретным заболеванием, которым страдает субъект, и замедление развития заболевания.
В одном варианте осуществления настоящего изобретения профилактика означает ингибирование или задержку начала или прогрессирования атрофии головного мозга у пациента с заболеванием, таким как нейродегенеративное заболевание. Лечение означает подавление или задержку прогрессирования атрофии головного мозга.
[0020]
Болезнь Альцгеймера от легкой до средней степени тяжести может быть клинически диагностирована как "вероятная AD" в соответствии с критериями диагностики, установленными the National Institute of Neurological and Communicative Disorders and Stroke/the Alzheimer's Disease and Related Disorders Associations (Национальным институтом неврологических и коммуникативных расстройств и инсульта/Ассоциацией болезни Альцгеймера и родственных нарушений)(NINCDS–ADRDA).
Обычный врач может обоснованно поставить клинический диагноз "болезнь Альцгеймера от легкой до средней степени тяжести" используя стандартные критерии. Например, на основании оценки в баллах по стандартизированной Краткой шкале оценки психического статуса (MMSE, баллы от 0 до 30) ставится клинический диагноз от легкой до средней степени, средней степени или от средней до тяжелой степени AD. MMSE (Folstein, Folstein and McHugh, 1975) представляет собой простой метод оценки когнитивной функции, включающий интервью с пациентами. Оценивают ориентацию, память, счет и внимание, языковые навыки и другие функции. Суммарный балл составляет 30. Чем ниже балл, тем выше уровень нарушения когнитивной функции.
В Примерах испытаний настоящего изобретения пациентов с оценкой MMSE от 12 до 22 в начале испытания (скрининг) определяли как страдающих от легкой до средней степени AD. Следует отметить, что MMSE не единственный, хотя и удобный, способ клинического определения степени AD.
[0021]
Аполипопротеин E (ApoE), один из аполипопротеинов, входит в состав липопротеина и участвует в распознавании метаболизма липопротеинов и липидов. ApoE имеет 3 изоформы ApoE2, ApoE3 и ApoE4. В докладе показано, что ApoE4 генотип, кодирующий ApoE4, коррелирует с количеством отложения амилоидного β–белка в головном мозге, и генотип ApoE4 является геном риска болезни Альцгеймера.
[0022]
Наблюдаемые структурные изменения в головном мозге также наблюдаются при нормальном старении, и они ускоряются с развитием нейродегенеративного заболевания. В одном варианте осуществления настоящего изобретения примеры нейродегенеративного заболевания включают AD, вероятную AD, подозрение на AD, доклиническую AD, продромальный период AD, MCI вследствие AD, MCI, прогрессирующий супрануклеарный паралич и лобно–височную деменцию; предпочтительно AD, вероятную AD, подозрение на AD, доклиническую AD, продромальный период AD, MCI вследствие AD и MCI; более предпочтительно AD и MCI вследствие AD и MCI; и наиболее предпочтительно AD и MCI вследствие AD. Диагноз вероятной AD, подозрения на AD, доклинической AD, продромального периода AD и MCI вследствие AD описан в Alzheimer's Dement., May 2011, Vol. 7, No. 3, pp. 263–292.
Атрофия головного мозга при AD вызывается потерей нейронов и синапсов, инициированной в энторинальной коре. Затем поражение распространяется на всю височную область лимбической системы, включая гиппокампальную формацию, и потеря и атрофия нейронов наблюдаются во всех неокортикальных областях, включая височную долю, теменную долю и лобную долю.
Волюметрическая МРТ (вМРТ) позволяет оценить объем структуры мозга in vivo, предлагая шкалы оценки атрофии. Результаты вМРТ исследований позволяют предположить, что паттерны атрофии головного мозга, отражающие патологическое развитие AD, безусловно можно обнаруживать и отслеживать с течением времени (Atiya et al. 2003). Атрофия медиальной височной доли, включая гиппокамп и энторинальную кору, уже давно была описана в исследованиях вМРТ при AD (Jack et al. 1997). Объем гиппокампа на основе вМРТ коррелирует с гистологическим объемом гиппокампа, потерей нейронов и уровнем AD (Jack et al. 2002). Изменение толщины энторинальной коры является ранним показателем нейродегенерации, связанной с AD, и показателем предрасположенности к ней. Продольное вМРТ измерение изменения объема областей и общего объема головного мозга дополняет оценку когнитивных способностей, поскольку на это измерение не влияет временное улучшение симптомов, и служит ранним индикатором эффективности лекарственного средства в отношении атрофии, связанной с AD.
[0023]
Соединение А или его соль, используемое в настоящем изобретении, может быть получено способом, известным per se, или объединением таких способов, или способом, раскрытым в Патентной литературе 1.
[0024]
Соединение А или его соль, используемое в настоящем изобретении, можно смешивать с различными фармацевтическими добавками, такими как эксципиент, связующее, разрыхлитель, ингибитор дезинтеграции, агент для предотвращения уплотнения/адгезии, смазывающее вещество, абсорбирующий/адсорбирующий носитель, растворитель, наполнитель, изотонический агент, солюбилизатор, эмульгатор, суспендирующий агент, загуститель, агент покрытия, усилитель абсорбции, гелеобразующий/прокоагулянтный агент, светостабилизатор, консервант, осушитель, стабилизатор эмульсии/суспензии/дисперсии, цветозащитный агент, деоксидант/антиоксидант, ароматизатор, краситель, пенообразователь, противовспенивающее вещество, смягчающий агент, антистатик, буфер и/или регулятор рН, для получения фармацевтического препарата, такого как пероральный препарат (например, таблетки, капсулы, порошки, гранулы, мелкие гранулы, пилюли, суспензии, эмульсии, жидкости и сиропы), инъекции, глазные капли, назальные спреи и трансдермальные средства. Таблетки являются предпочтительными в качестве пероральной лекарственной формы для пациентов с AD.
Вышеуказанные вещества формулируют в композицию обычным способом.
[0025]
Способ введения Соединения А, который конкретно не ограничивается, определяют соответственно на основании формы препарата, возраста, пола и других параметров пациента и уровня симптомов у пациента.
Дозу Соединения А, соответственно, выбирают на основании введения, возраста, пола, типа заболевания и других параметров пациента.
Средство можно вводить взрослому человеку в дозе или раздельными дозами обычно от 40 до 500 мг в пересчете на Соединение A в день. Средство вводят в дозе или раздельными дозами предпочтительно от 100 до 400 мг в пересчете на Соединение A в день, и наиболее предпочтительно вводят в дозе 160 мг или 320 мг в пересчете на Соединение A в день.
[0026]
Введение Соединения А или его соли в настоящем изобретении также может включать профилактику или лечение путем введения ингибиторов ацетилхолинэстеразы (AChEI). Примеры AchEI включают донепезила гидрохлорид, галантамина гидрохлорид, ривастигмина тартрат и такрина гидрохлорид.
В настоящем изобретении субъект может принимать AChEI для профилактики или лечения в течение по меньшей мере 6 месяцев перед введением Соединения A или его соли.
[0027]
Далее настоящее изобретение будет описано со ссылкой на Примеры испытаний и Примеры получения, но настоящее изобретение не ограничивается ими.
В качестве испытываемого соединения использовали малеат Соединения А.
[0028]
Пример испытания 1 Многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование фазы II для оценки эффективности и безопасности Соединения A у пациентов с легкой до средней степени AD
Субъект (критерии выбора): Осуществляли скрининг пациентов в период от 42 дней до распределения в группы лечения до момента распределения на основании следующих критериев выбора.
Пациенты с вероятной AD и возраста 55 лет или старше и 85 лет или младше на момент получения согласия на скрининг.
Пациенты с оценкой по MMSE от 12 до 22 на дату скрининга
Пациенты с оценкой 4 или менее по модифицированной ишемической шкале Хачинского
Пациенты, которых лечили донепезил гидрохлоридом или ривастигмином с использованием трансдермальной системы введения в течение по меньшей мере 4 месяцев до момента включения в исследование и путем введения стабильной дозы такого средства в течение 3 месяцев до момента включения в исследование.
В случае пациентов, которые получали мемантин в дополнение к лечению донепезил гидрохлоридом или ривастигмином, вводимым при помощи трансдермальной системы, пациенты, которые получали мемантин в течение по меньшей мере 4 месяцев до момента включения в исследование и его стабильную дозу в течение 3 месяцев до момента включения в исследование.
Пациенты, у которых результаты МРТ или КТ головного мозга соответствуют AD на момент скрининга
Организация групп: Отобранных пациентов (484 пациента) случайным образом разделяли на следующие 3 группы и начинали исследование.
(1) Высокодозовая группа: 224 мг испытываемого соединения (160 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 4 недель и затем 448 мг испытываемого соединения (320 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 48 недель (158 пациентов)
(2) Низкодозовая группа: 224 мг испытываемого соединения (160 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 52 недель (166 пациентов)
(3) Группа плацебо: плацебо вводили перорально один раз в день в течение 52 недель (158 пациентов)
Метод оценки:
Волюметрическая МРТ
Объем мозга субъектов измеряли при помощи вМРТ–сканирования во время скрининга и через 52 недели и количественное изменение объема мозга в целом и гиппокампа у субъектов осуществляли для оценки атрофии головного мозга на основании изменения с момента скрининга.
Кроме того, изменение объема мозга в целом и 101 области (полученной путем разделения областей, существующих как в левом, так и в правом полушариях мозга полей Бродмана (от 1 до 52) на 101 область) у каждого субъекта определяли количественно для оценки атрофии головного мозга на основании изменения с момента скрининга.
Статистический анализ:
Изменения объема мозга в целом и гиппокампа через 52 недели от исходного уровня сравнивали между высокодозовой группой и группой плацебо, а также между низкодозовой группой и группой плацебо на основании моделей со смешанными эффектами. Для моделей группы лечения были включены в качестве фиксированного эффекта, возраст, базовый уровень соответствующих объемов мозга (мозг в целом или гиппокамп), базовый уровень MMSE и генотип ApoE4 (положительный/отрицательный) были включены в качестве ковариат, а исследовательские центры были включены в качестве случайного эффекта.
Кроме того, изменения соответствующих объемов мозга в целом и 101 области через 52 недели от исходного уровня сравнивали между высокодозовой группой и группой плацебо, а также между низкодозовой группой и группой плацебо.
Результаты: показаны ниже
[0029]
Изменение объема головного мозга, определенное при помощи вМРТ–сканирования на неделе 52, от исходного уровня показано в Таблице 1, Фиг. 1 и Фиг. 2.
[0030]
[0031]
Что касается изменения объема мозга в целом и гиппокампа на неделе 52 по сравнению с исходным уровнем, уменьшение объема, как правило, меньше в группе введения Соединения А, чем в группе плацебо. Разница в эффектах на изменение объема гиппокампа между группой введения низкой дозы Соединения А и группой плацебо была статистически значимой.
[0032]
Что касается изменения объема головного мозга, определенного при помощи вМРТ–сканирования на неделе 52 от исходного уровня, в Таблице 2 показаны результаты для областей, в которых была обнаружена статистически значимая разница (p–значение ˂0,05) при сравнении между группой введения низкой дозы испытываемого соединения и группой плацебо.
[0033]
[0034]
Результаты анализа мозга в целом и 101 области также показывают, что уменьшение объема мозга в целом и гиппокампа, как правило, подавлялось в группе с низкой дозой Соединения A по сравнению с группой плацебо (№№ 6 и 14 в Таблице 2).
Ту же тенденцию, что и в группе с низкой дозой, наблюдали в группе с высокой дозой Соединения А.
[0035]
Пример испытания 2 Многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование ранней фазы II для оценки эффективности и безопасности Соединения A у пациентов с легкой до средней степени AD
Осуществляли скрининг пациентов в период от 28 дней до распределения в группы лечения до момента распределения на основании следующих критериев отбора. Отобранных пациентов (373 пациента) случайным образом разделяли на следующие 2 группы и начинали исследование.
Субъект (критерии выбора):
Пациенты с вероятной AD и возраста 50 лет или старше и 90 лет или младше на момент получения согласия на скрининг.
Пациенты с оценкой по MMSE от 15 до 24 во время скрининга
Пациенты с оценкой 4 или менее по модифицированной ишемической шкале Хачинского
Пациенты, которые получали донепезила гидрохлорид в течение по меньшей мере 6 месяцев до момента включения в исследование и его стабильную дозу в течение 3 месяцев до момента включения в исследование.
Пациенты, у которых результаты МРТ или КТ головного мозга соответствуют AD на момент скрининга
Организация групп:
(1) Группа активного лекарственного средства: 224 мг испытываемого соединения (160 мг в пересчете на Соединение A) вводили перорально один раз в день в течение 52 недель (176 пациентов)
(2) Группа плацебо: плацебо вводили перорально один раз в день в течение 52 недель (178 пациентов)
Метод оценки:
Волюметрическая МРТ
Объем мозга субъектов измеряли при помощи вМРТ–сканирования во время скрининга и через 52 недели и количественное изменение объема мозга в целом и гиппокампа у субъектов осуществляли для оценки атрофии головного мозга на основании изменения с момента скрининга.
Статистический анализ:
Рассчитывали среднее значение изменения объема мозга в целом и гиппокампа через 52 недели от исходного уровня, стандартное отклонение и разницу по сравнению с группой плацебо.
Результаты: показаны ниже
[0036]
Изменение объема головного мозга, определенное при помощи вМРТ–сканирования на неделе 52, от исходного уровня показано в Таблице 3, Фиг. 3 и Фиг. 4.
[0037]
[0038]
Что касается изменения объема мозга в целом и гиппокампа на неделе 52 по сравнению с исходным уровнем, уменьшение объема, как правило, было меньше в группе введения Соединения А, чем в группе плацебо.
[0039]
Пример получения 1
0,9726 г Стеарата магния (стеарат магния, Merck) добавляли к 174,03 г малеата Соединения A и смесь перемешивали в течение 30 минут. Смешанный порошок формовали под давлением при помощи роликового уплотнителя (TF–LABO (давление прокатки 3 МПа), Freund Corporation) и твердое вещество, полученное формованием, гранулировали. 49,51 г Лактозы (FlowLac 90, Meggle Japan), 16,50 г кристаллической целлюлозы (CEOLUS PH302, Asahi Kasei Chemicals) и 6,67 г натрий кроскармеллозы (Primellose, DMV Japan) просеивали через сито с отверстием 850 мкм и добавляли к 60,0 г полученного гранулированного порошка и смесь перемешивали в течение 10 минут. 0,6667 г Стеарата магния добавляли к смешанному порошку и смесь перемешивали в течение 30 минут. Смешанный порошок таблетировали при помощи таблеточной машины (HT–P18A, Hata Tekkosho) при давлении таблетирования около 12 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 250 мг. На таблетки без покрытия наносили 8 мг покрывающего агента на таблетку с использованием устройства для нанесения пленочного покрытия DRC–200 (Powrex), а затем добавляли небольшое количество карнаубского воска (Polishing Wax–105, Nippon Wax) с получением таблеток с пленочным покрытием.
[0040]
Пример получения 2
60,90 г Маннита (Parteck M200, Merck) и 3,60 г натрий кроскармеллозы добавляли к 53,70 г малеата Соединения A и смесь перемешивали в течение 10 минут. К смешанному порошку добавляли 1,80 г стеарата магния и смесь перемешивали в течение 30 минут. Смешанный порошок таблетировали при давлении таблетирования около 10 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 250 мг. На таблетки без покрытия наносили 8 мг покрывающего агента (Opadry 03F44057, 00F440000 (гипромеллоза 2910: 71,5%, Макрогол 6000: 14,166%, тальк: 7,167%, оксид титана: 7,067%, сесквиоксид железа: 0,1%), Colorcon Japan LLC) на таблетку, а затем добавляли небольшое количество карнаубского воска с получением таблеток с пленочным покрытием.
[0041]
Пример получения 3
11,11 г Стеарата магния добавляли к 1988,89 г малеата Соединения A и смесь перемешивали в течение 30 минут. Смешанный порошок формовали под давлением при помощи роликового уплотнителя и твердое вещество, полученное формованием, гранулировали. К 107,13 г полученного гранулированного порошка добавляли 26,21 г маннита, 7,50 г этилцеллюлозы (ETHOCEL 100FP Premium, The Dow Chemical Compаny), 3,75 г кристаллической целлюлозы (CEOLUS KG–1000, Asahi Kasei Chemicals), 3,75 г кросповидона (Kollidon CL–SF, BASF) и 0,75 г натрий кроскармеллозы и смесь перемешивали в течение 30 минут. К смешанному порошку добавляли 0,90 г стеарата магния и смесь перемешивали в течение 5 минут. Смешанный порошок таблетировали при давлении таблетирования около 7 кН, используя пестик с двойной закругленной поверхностью, с диаметром таблеток 8,5 мм с получением круглых таблеток без покрытия, каждая из которых имела массу 315 мг. На таблетки без покрытия наносили 9 мг покрывающего агента на таблетку, а затем добавляли небольшое количество карнаубского воска с получением таблеток с пленочным покрытием.

Изобретение относится к применению фармакологически приемлемой соли 1-(3-(2-(1-бензотиофен-5-ил)этокси)пропил)азетидин-3-ола в качестве активного ингредиента в средстве для профилактики или лечения атрофии головного мозга, где средство вводят пациенту с болезнью Альцгеймера легкой или средней степени тяжести, доклинической болезнью Альцгеймера, продромальным периодом болезни Альцгеймера или легким когнитивным нарушением, вызванным болезнью Альцгеймера (MCI вследствие AD), один раз в день в дозе от 100 мг до 400 мг в пересчете на дозу 1-(3-(2-(1-бензотиофен-5-ил)этокси)пропил) азетидин-3-ола на введение. 2 з.п. ф-лы, 4 ил., 3 табл., 3 пр.
1. Применение фармакологически приемлемой соли 1-(3-(2-(1-бензотиофен-5-ил)этокси)пропил)азетидин-3-ола в качестве активного ингредиента в средстве для профилактики или лечения атрофии головного мозга, где средство вводят пациенту с болезнью Альцгеймера легкой или средней степени тяжести, доклинической болезнью Альцгеймера, продромальным периодом болезни Альцгеймера или легким когнитивным нарушением, вызванным болезнью Альцгеймера (MCI вследствие AD), один раз в день в дозе от 100 мг до 400 мг в пересчете на дозу 1-(3-(2-(1-бензотиофен-5-ил)этокси)пропил) азетидин-3-ола на введение.
2. Применение по п.1, где средство вводят перорально.
3. Применение по п.1, где средство вводят перорально один раз в день в дозе 160 или 320 мг в пересчете на 1-(3-(2-(1-бензотиофен-5)-ил)этокси)пропил)азетидин-3-ол на введение.
| Tatsuo Kimura et al | |||
| Механический колок для струнных инструментов | 1923 |
|
SU817A1 |
| with amyloid-β peptide | |||
| British Journal of Pharmacology, 2009, vol.157, pp | |||
| ИГРУШКА С ПЛАВАЮЩЕЙ ФИГУРОЙ | 1922 |
|
SU451A1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ОКСИМА ХОЛЕСТ-4-ЕН-3-ОНА, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ, И СПОСОБ ПОЛУЧЕНИЯ | 2009 |
|
RU2496784C2 |
| WO 2003105830 A1, 24.12.2003 | |||
| WO 2003035647 A1, 01.05.2003. | |||
Авторы
Даты
2021-11-17—Публикация
2018-06-01—Подача