Область техники
По настоящей заявке испрашивается приоритет патентной заявки Кореи № 10-2018-0050215, поданной 30 апреля 2018 года, содержание которой включено в настоящее описание посредством ссылки в полном объеме.
Настоящее изобретение относится к новому соединению для прямого ингибирования активности ASM, представляющему собой производное 2-амино-2-(1,2,3-триазол-4-ил)пропан-1,3-диола, и к его применению, и, более конкретно, к соединению химической формулы 1 и к его применению для предупреждения, улучшения или лечения нейродегенеративных заболеваний или депрессии, как описано в настоящем описании.
Уровень техники
Метаболизм сфинголипидов регулирует нормальную клеточную передачу сигнала, и аномальные изменения метаболизма сфинголипидов влияют на различные нейродегенеративные заболевания, включая болезнь Альцгеймера. Между тем, кислая сфингомиелиназа (ASM), которая является ферментом, регулирующим метаболизм сфинголипидов, является белком, экспрессирующимся практически во всех типах клеток, и играет важную роль в метаболизме сфинголипидов и обновлении клеточных мембран.
Было описано, что в головном мозге пациентов с нейродегенеративными заболеваниями, включая болезнь Альцгеймера, экспрессия ASM значительно увеличена по сравнению с ее экспрессией в головном мозге здоровых людей, и при ингибировании экспрессии сверхэкспрессированной ASM или ингибировании активности ASM ингибируется накопление амилоида-β (Aβ) и происходит улучшение способности к обучению и памяти, демонстрируя эффект при нейродегенеративных заболеваниях (патент Кореи с регистрационным номером № 10-1521117). Кроме того, недавно было описано, что активность ASM увеличивается при неврологических заболеваниях, таких как депрессия, и ингибирование ASM имеет эффект смягчения депрессии (Nature medicine. 2013 Jul 19(7):934-938, PLoS One. 2016 Sep 6;11(9):e0162498). Таким образом, разработка ингибитора ASM, т.е. вещества, способного ингибировать экспрессию или активность ASM, является перспективной в качестве приемлемого способа лечения различных заболеваний, вызываемых повышением уровня ASM, включая нейродегенеративные заболевания и депрессию.
Между тем, на настоящий момент еще не разработан прямой ингибитор ASM, но идентифицировано несколько ингибиторов, способных непрямо ингибировать ASM. В первую очередь, трициклические антидепрессанты (например, амитриптилин (AMI), дезипрамин, имипрамин и т.д.), которые наиболее широко используются в качестве непрямых ингибиторов ASM, в настоящее время используют в клинике в качестве антидепрессантов. Хотя они были разработаны изначально не в качестве ингибиторов ASM, результаты различных исследований продемонстрировали, что эти лекарственные средства демонстрируют эффекты ингибирования ASM. Основным способом действия трициклических антидепрессантов является повышение активности нейротрансмиттеров посредством ингибирования обратного захвата нейротрансмиттеров в нейронах, и они демонстрируют эффект ингибирования ASM в качестве побочного эффекта. Однако, поскольку трициклические антидепрессанты действуют на нервную систему и нейроны, вызывая побочные эффекты, такие как заторможенность, повышение чувствительности к свету и рвота, необходимо разработать новые лекарственные средства, способные прямо ингибировать активность ASM.
Описание
Техническая проблема
Таким образом, авторы настоящего изобретения приложили усилия для разработки нового ингибитора ASM и обнаружили, что производное 2-амино-2-(1,2,3-триазол-4-ил)пропан-1,3-диола, имеющее структуру, соответствующую химической формуле 1, имело примечательный эффект прямого ингибирования активности ASM, демонстрируя превосходный эффект при лечении нейродегенеративных заболеваний и депрессии, и осуществили настоящее изобретение.
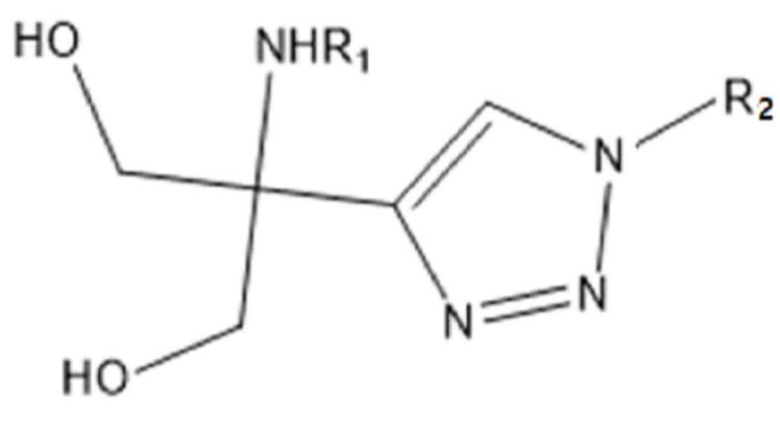
Таким образом, задачей настоящего изобретения является предоставление соединения химической формулы 1 ниже или его соли:
[Химическая формула 1]
где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Другой задачей настоящего изобретения является предоставление фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, содержащей соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, состоящей из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, по существу состоящей из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Другой задачей настоящего изобретения является предоставление пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии, содержащей соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии, состоящей из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии, по существу состоящей из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Еще одной задачей настоящего изобретения является предоставление композиции для диагностики нейродегенеративных заболеваний или депрессии, содержащей соединение химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению композиции для диагностики нейродегенеративных заболеваний или депрессии, состоящей из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к предоставлению композиции для диагностики нейродегенеративных заболеваний или депрессии, по существу состоящей из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Еще одной задачей настоящего изобретения является предоставление применения соединения химической формулы 1 ниже или его фармацевтически приемлемой соли для получения средства для предупреждения или лечения нейродегенеративных заболеваний или депрессии.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Еще одной задачей настоящего изобретения является предоставление способа предупреждения или лечения нейродегенеративных заболеваний или депрессии, характеризующегося введением эффективной дозы композиции, содержащей соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму, нуждающемуся в этом.
Еще одной задачей настоящего изобретения является обеспечение применения соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли для получения средства для диагностики нейродегенеративных заболеваний или депрессии.
[Химическая формула 1]
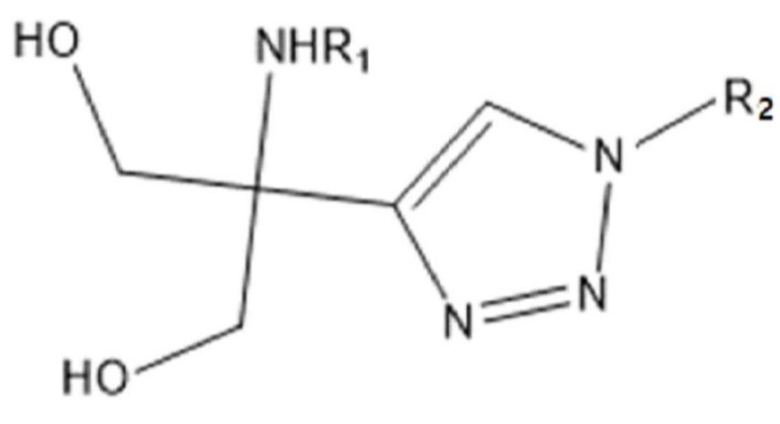
где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Еще одной задачей настоящего изобретения является предоставление способа диагностики нейродегенеративных заболеваний или депрессии, включающего введение эффективной дозы композиции, содержащей соединение химической формулы 1 выше, с которой связано диагностическое средство или агент детекции, или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму с подозрением на нейродегенеративные заболевания или депрессию.
Техническое решение
Для достижения указанных выше задач, настоящее изобретение предоставляет соединение химической формулы 1 ниже или его соль:
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Для достижения другой задачи настоящего изобретения, настоящее изобретение предоставляет фармацевтическую композицию для предупреждения или лечения нейродегенеративного заболевания или депрессии, содержащую соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение предоставляет фармацевтическую композицию для предупреждения или лечения нейродегенеративных заболеваний или депрессии, состоящую из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение предоставляет фармацевтическую композицию для предупреждения или лечения нейродегенеративных заболеваний или депрессии, по существу состоящую из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Для достижения еще одной задачи настоящего изобретения настоящее изобретение предоставляет пищевую композицию для улучшения при нейродегенеративных заболеваниях или депрессии, содержащую соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение предоставляет пищевую композицию для улучшения при нейродегенеративных заболеваниях или депрессии, состоящую из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение предоставляет пищевую композицию для улучшения при нейродегенеративных заболеваниях или депрессии, по существу состоящую из соединения химической формулы 1 выше или его фармацевтически приемлемой соли в качестве активного ингредиента.
Для достижения еще одной задачи настоящего изобретения настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, содержащей соединение химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, состоящей из соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, по существу состоящей из соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли в качестве активного ингредиента.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Для достижения еще одной задачи настоящего изобретения настоящее изобретение относится к применению соединения химической формулы 1 ниже или его фармацевтически приемлемой соли для получения средства для предупреждения или лечения нейродегенеративных заболеваний или депрессии.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Для достижения еще одной задачи настоящего изобретения, настоящее изобретение относится к способу предупреждения или лечения нейродегенеративных заболеваний или депрессии, характеризующемуся введением эффективной дозы композиции, содержащей соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму, нуждающемуся в этом.
Для достижения еще одной задачи настоящего изобретения настоящее изобретение относится к применению соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли для получения средства для предупреждения или лечения нейродегенеративных заболеваний или депрессии:
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Для достижения еще одной задачи настоящего изобретения настоящее изобретение относится к способу диагностики нейродегенеративных заболеваний или депрессии, включающему введение эффективной дозы композиции, содержащей соединение химической формулы 1 выше, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемую соль, индивидууму с подозрением на нейродегенеративное заболевание или депрессию.
Далее настоящее изобретение описано более подробно.
Настоящее изобретение относится к соединению химической формулы 1 ниже или его соли:
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
В рамках настоящего изобретения "алкил" относится к линейному или разветвленному углеводороду из 1-10 атомов углерода. Репрезентативные примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил и н-децил, но не ограничиваясь ими.
Термин "карбонил", используемый в рамках настоящего изобретения, относится к группе -C(O)-.
В рамках настоящего изобретения "алкилкарбонил" относится к алкильной группе, связанной с родительским молекулярным остатком через карбонильную группу, как определено выше. Репрезентативные примеры алкилкарбонила включают ацетил, 1-оксопропил, 2,2-диметил-1-оксопропил, 1-оксобутил и 1-оксопентил, но не ограничиваясь ими.
В рамках настоящего изобретения, когда алкилкарбонил представляет собой "замещенный" алкилкарбонил, алкилкарбонил может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из гидрокси, галогена, циано, нитро и амино.
В рамках настоящего изобретения "алкенил" относится к линейному или разветвленному углеводороду из 2-10 атомов углерода, содержащему по меньшей мере одну углерод-углеродную двойную связь, образованную удалением двух атомов водорода. Репрезентативные примеры алкенила включают этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил и 3-деценил, но не ограничиваясь ими.
В рамках настоящего изобретения "алкинил" относится к линейной или разветвленной углеводородной группе из 2-10 атомов углерода, включающей одну или несколько тройных углерод-углеродных связей. Репрезентативные примеры алкинила включают ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил, но не ограничиваясь ими.
Предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород или ацетил, и R2 может представлять собой алкил из 1-10 атомов углерода. Более предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород, и R2 может представлять собой алкил из 4-10 атомов углерода. Значительно более предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород, и R2 может представлять собой алкил из 6-9 атомов углерода. Наиболее предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород, и R2 может представлять собой алкил их 9 атомов углерода.
Кроме того, настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, содержащей соединение химической формулы 1 ниже или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, состоящей из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента
Кроме того, настоящее изобретение относится к фармацевтической композиции для предупреждения или лечения нейродегенеративных заболеваний или депрессии, по существу состоящей из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Было описано, что в головном мозге пациентов с нейродегенеративными заболеваниями, включая болезнь Альцгеймера, экспрессия ASM значительно увеличена по сравнению с ее экспрессией в головном мозге нормальных людей, и при ингибировании экспрессии сверхэкспрессированной ASM или ингибировании активности ASM ингибируется накопление амилоида-β (Aβ) и происходит улучшение способности к обучению и памяти, демонстрируя эффект при нейродегенеративных заболеваниях (патент Кореи с регистрационным номером № 10-1521117). Кроме того, недавно было описано, что активность ASM увеличивается при неврологических заболеваниях, таких как депрессия, и ингибирование ASM имеет эффект смягчения депрессии (Nature medicine. 2013 Jul 19(7):934-938, PLoS One. 2016 Sep 6;11(9):e0162498). Таким образом, может быть разработано вещество, способное ингибировать экспрессию или активность ASM, в качестве пригодного терапевтического средства от заболеваний, включающих нейродегенеративные заболевания и депрессию.
Согласно одному варианту осуществления настоящего изобретения, было подтверждено, что соединение химической формулы 1 выше обладает превосходным эффектом ингибирования активности ASM и имеет эффекты уменьшения бляшек Aβ в головном мозге при болезни Альцгеймера, смягчая нейровоспаление и т.д., и, таким образом, его можно использовать в качестве средства для предупреждения или лечения нейродегенеративных заболеваний, включающих болезнь Альцгеймера или депрессию.
Согласно другому варианту осуществления настоящего изобретения, было подтверждено, что соединение химической формулы 1 выше может прямо ингибировать активность ASM посредством связывания с активным центром ASM в фибробластах пациентов с болезнью Альцгеймера. С другой стороны, было подтверждено, что соединение химической формулы 1 выше не демонстрировало эффекта ингибирования сфингозин-1-фосфата (S1P) и рецептора 1 сфингозин-1-фосфата (S1PR1), но было прямым ингибитором, способным специфически ингибировать ASM.
В соединении химической формулы 1 выше, включенном в фармацевтическую композицию по настоящему изобретению, R1 предпочтительно представляет собой водород или ацетил, и R2 может представлять собой алкил из 1-10 атомов углерода. Более предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород, и R2 может представлять собой алкил из 4-10 атомов углерода. Наиболее предпочтительно, в рамках настоящего изобретения R1 может представлять собой водород, и R2 может представлять собой алкил из 6-9 атомов углерода.
Согласно одному варианту осуществления настоящего изобретения, было подтверждено, что, когда R2 в химической формуле 1 выше представляет собой алкил из более чем 10 атомов углерода по сравнению с алкилом из 10 или менее атомов углерода, не только распределение соединения в головной мозг значительно снижается, но также быстро возрастет метаболизм, осуществляемый микросомами печени человека. При разработке терапевтического средства для лечения заболеваний головного мозга, таких как нейродегенеративные заболевания, учитывая, что является очень важным, чтобы лекарственное средство демонстрировало высокое распределение в область головного мозга посредством прохождения через гематоэнцефалический барьер, и что метаболическая стабильность в печени является очень важным фактором, который может влиять на распределение перорально вводимого лекарственного средства в организме ввиду эффекта первого прохождения лекарственного средства при пероральном введении, не является предпочтительным, чтобы R2 в химической формуле 1 выше имел более 10 атомов углерода.
Согласно другому варианту осуществления настоящего изобретения, было подтверждено, что, когда R2 в химической формуле 1 выше представляет собой алкил из более чем 10 атомов углерода по сравнению с 10 или менее атомами углерода, происходит снижение эффекта ингибирования активности ASM, эффекта снижения отложения бляшек Aβ в головном мозге, эффекта улучшения памяти, снижения тревожности и депрессии в модели болезни Альцгеймера на животных, и эффекта снижения нейровоспаления в головном мозге. Таким образом, с точки зрения фармакологической активности, не является предпочтительным, чтобы R2 в химической формуле 1 выше имел более 10 атомов углерода.
Настоящее изобретение относится не только к соединению, соответствующему химической формуле 1 выше, но также к его фармацевтически приемлемой соли, и сольватам, гидратам, рацематам или стереоизомерам, которым могут быть получены из него.
В качестве фармацевтически приемлемой соли соединения по настоящему изобретению, соответствующего химической формуле 1, является пригодной кислотно-аддитивная соль, образованная с фармацевтически приемлемой свободной кислотой. Кислотно-аддитивную соль получают из неорганических кислот, таких как хлористоводородная кислота, азотная кислота, фосфорная кислота, серная кислота, бромистоводородная кислота, йодистоводородная кислота, азотистая кислота, фосфорная кислота и т.д., нетоксичные органические кислоты, такие как алифатические моно- и дикарбоксилаты, фенил-замещенные алканоаты, гидроксиалканоаты и алкандиоаты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты и т.д., и органические кислоты, такие как уксусная кислота, бензойная кислота, лимонная кислота, молочная кислота, малеиновая кислота, глюконовая кислота, метансульфоновая кислота, 4-толуолсульфоновая кислота, виннокаменная кислота, фумаровая кислота и т.д. Типы этих фармацевтически нетоксичных солей могут включать сульфат, пиросульфат, бисульфат, сульфит, бисульфит, нитрат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, фторид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капринат, гептаноат, пропиолят, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексан-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат, бензолсульфонат, толуолсульфонат, хлорбензолсульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, β-гидроксибутират, гликолят, малат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, миндалят и т.д.
Кислотно-аддитивную соль в соответствии с настоящим изобретением можно получать общепринятым способом, например, путем растворения соединения, соответствующего химической формуле 1 выше, в избыточном количестве водного раствора кислоты, и преципитации соли с использованием смешивающегося с водой органического растворителя, например, метанола, этанола, ацетона или ацетонитрила. Кроме того, смесь можно сушить путем выпаривания растворителя или избытка кислоты, или преципитированную соль можно фильтровать при пониженном давлении с получением кислотно-аддитивной соли.
Кроме того, фармацевтически приемлемую соль металла можно получать с использованием основания. Соль щелочного металла или соль щелочноземельного металла можно получать, например, путем растворения соединения в избыточном количестве раствора гидроксида щелочного металла или гидроксида щелочноземельного металла, отфильтровывания нерастворенной соли соединения, а затем упаривания и сушки фильтрата. При этом является фармацевтически приемлемым получение соли натрия, калия или кальция. Кроме того, соответствующую соль серебра можно получать путем реакции соли щелочного металла или соли щелочноземельного металла с соответствующей солью серебра (например, нитратом серебра).
В рамках настоящего изобретения тип нейродегенеративного заболевания конкретно не ограничен при условии, что нейродегенеративное заболевание представляет собой неврологическое заболевание, при котором метаболическая аномалия сфинголипидов и/или повышение активности или экспрессии ASM выступает в качестве причины заболевания. Нейродегенеративное заболевание может быть выбрано из группы, состоящей из, например, болезни Альцгеймера, болезни Паркинсона, прогрессирующего надъядерного паралича, мультисистемной атрофии, оливопонтоцеребеллярной атрофии (OPCA), синдрома Шая-Дрейджера, стриатонигральной дегенерации, болезни Гентингтона, бокового амиотрофического склероза (ALS), эссенциального тремора, кортикобазальной дегенерации, болезни диффузных телец Леви, комплекса болезни Паркинсона-ALS-деменции, болезни Пика, церебральной ишемии и церебрального инфаркта, но не ограничиваясь ими.
В рамках настоящего изобретения депрессия, т.е. депрессивное расстройство, относится к заболеванию, которое вызывает различные когнитивные, психические и физические симптомы со снижением мотивации и депрессией в качестве основных симптомов, что приводит к ухудшению повседневных функций. Конкретный тип депрессии по настоящему изобретению конкретно не ограничен при условии, что депрессия представляет собой известное в данной области депрессивное расстройство. Например, депрессия включает большое депрессивное расстройство (MDD), депрессию на фоне сосудистой деменции, биполярное расстройство, униполярное расстройство, сезонное аффективное расстройство (SAD), легкую депрессию, дистимию, депрессию, ассоциированную с нейродегенеративным заболеванием, и т.п. Предпочтительно, депрессия может представлять собой депрессию вследствие аномального повышения активности (гиперактивности) ASM.
Фармацевтическая композиция в соответствии с настоящим изобретением может содержать соединение химической формулы 1 выше или его фармацевтически приемлемую соль отдельно, или она может быть оставлена в подходящей форме с фармацевтически приемлемым носителем, и, кроме того, может содержать эксципиент или разбавитель. "Фармацевтически приемлемый", главным образом, относится к нетоксичной композиции, не вызывающей аллергической реакции, такой как желудочно-кишечное расстройство и головокружение, или сходной с ними реакции, которая является физиологически приемлемой и вводится человеку.
Кроме того, фармацевтически приемлемый носитель может включать, например, носитель для перорального введения или носитель для парентерального введения. Носитель для перорального введения может включать лактозу, крахмал, производные целлюлозы, стеарат магния, стеариновую кислоту и т.д. Кроме того, носитель для перорального введения может включать различные вещества для доставки лекарственных средств для применения для перорального введения пептидных препаратов. Кроме того, носитель для парентерального введения может включать воду, подходящее масло, солевой раствор, водный раствор глюкозы, гликоль и т.д., и, кроме того, может включать стабилизатор и консервант. Подходящий стабилизатор включает антиоксиданты, такие как гидросульфит натрия, сульфит натрия или аскорбиновая кислота. Подходящий консервант включает хлорид бензалкония, метил- или пропил-парабен и хлорбутанол. Фармацевтическая композиция по настоящему изобретению, кроме того, может включать смазывающее вещество, смачивающее вещество, подсластитель, вкусовую добавку, эмульгатор, суспендирующее вещество и т.п. в дополнение к указанным выше ингредиентам. Другие фармацевтически приемлемые носители и препараты могут представлять собой носители и препараты, известные в данной области.
Композицию по настоящему изобретению можно вводить млекопитающим, включая человека, любым способом. Например, композицию можно вводить перорально или парентерально. Способ парентерального введения не ограничен, и может представлять собой внутривенное, внутримышечное, интраартериальное, интрамедуллярное, интратекальное, интракардиальное, трансдермальное, подкожное, внутрибрюшинное, интраназальное, внутрикишечное, локальное, сублингвальное или ректальное введение.
Согласно одному варианту осуществления настоящего изобретения, было подтверждено, что соединение химической формулы 1 выше по настоящему изобретению не только обладает превосходной биодоступностью, но также обладает метаболической стабильностью в отношении микросом печени человека, которая значительно улучшена по сравнению с ранее описанным ингибитором ASM. Таким образом, предпочтительно, фармацевтическая композиция по настоящему изобретению может представлять собой фармацевтическую композицию для перорального введения.
Фармацевтическая композиция по настоящему изобретению может быть составлена в качестве препарата для перорального введения или парентерального введения путем введения, описанным выше. В случае препарата для перорального введения, композиция по настоящему изобретению может быть составлена в качестве порошков, гранул, таблеток, пилюль, покрытых сахарной оболочкой пилюль, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.д. с использованием способов, известных в данной области. Например, препарат для перорального введения можно получать в качестве таблеток или покрытых сахарной оболочкой пилюль путем смешения активного ингредиента с твердым эксципиентом, растирания смеси, а затем добавления подходящего адъюванта для переработки в гранулярную смесь. Подходящие примеры эксципиента могут включать наполнители, такие как сахара, включая лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит и т.д., крахмалы, включая кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал и т.д., целлюлозы, включая целлюлозу, метилцеллюлозу, натрий карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и т.д., желатин и поливинилпирролидон. Кроме того, в некоторых случаях можно добавлять сшитый поливинилпирролидон, агар, альгиновую кислоту, альгинат натрия и т.п. в качестве разрыхлителя. Кроме того, фармацевтическая композиция по настоящему изобретению, кроме того, может включать антикоагулянт, смазывающее вещество, смачивающее вещество, ароматизирующую добавку, эмульгатор и консервант.
Препарат для парентерального введения может быть составлен способами, известными в данной области, в форме инъекций, кремов, лосьонов, мазей для наружного применения, масел, увлажняющих средств, гелей, аэрозолей и средств для назальной ингаляции. Эти составы, как правило, известны всем фармацевтам.
Общую эффективную дозу композиции по настоящему изобретению можно вводить пациентам в качестве однократной дозы, или ее можно вводить многократно в течение длительно периода времени посредством протокола фракционированного лечения. В фармацевтической композиции по настоящему изобретению содержание активных ингредиентов может варьироваться в зависимости от степени заболевания. Предпочтительно, предпочтительная общая доза фармацевтической композиции по настоящему изобретению может составлять приблизительно от 0,01 мкг до 10000 мг, наиболее предпочтительно от 0,1 мкг до 100 мг на 1 кг массы тела пациента в сутки. Однако эффективная доза фармацевтической композиции для пациентов определяется с учетом различных факторов, таких как возраст, масса тела, состояние здоровья и пол пациента, тяжесть заболевания, режим питания и скорость выведения, а также способ составления, путь введения и количество раз введения. Таким образом, с учетом таких аспектов специалисты в данной области могут определить подходящую эффективную дозу композиции по настоящему изобретению. Фармацевтическая композиция в соответствии с настоящим изобретением конкретно не ограничивается составами, путями введения и способами введения, при условии, что она демонстрирует эффекты настоящего изобретения.
Кроме того, настоящее изобретение относится к пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии, содержащей соединение химической формулы 1 ниже или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии состоящий из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к пищевой композиции для улучшения при нейродегенеративных заболеваниях или депрессии, по существу состоящей из соединения химической формулы 1 ниже или его фармацевтически приемлемой соли в качестве активного ингредиента.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Пищевая композиция в соответствии с настоящим изобретением включает все типы функциональных продуктов питания, биологически активных добавок, диетических продуктов питания и пищевых добавок. Эти типы можно получать в различных формах в соответствии с основными способами, известными в данной области.
Например, в качестве диетических продуктов питания сама пищевая композиция по настоящему изобретению может быть получена и выпита в форме чая, сока и напитка, или может быть гранулирована, инкапсулирована и преобразована в порошок для приема внутрь. Кроме того, пищевая композиция по настоящему изобретению может быть смешана с веществами или активными ингредиентами, известными тем, что они обладают эффектом предупреждения, улучшения или лечения нейродегенеративных заболеваний или депрессии, для получения в форме композиции.
Кроме того, функциональные продукты питания можно получать добавлением пищевой композиции по настоящему изобретению к напиткам (в том числе к алкогольным напиткам), фруктам и их переработанным продуктам (например, фруктовые консервы, консервированные фрукты, джемы, мармелад и т.д.), рыбе, мясу и их переработанным продуктам (например, ветчина, сосиски, солонина и т.д..), хлебу и макаронным изделиям (например, удон, гречневая лапша, рамен, спагетти, макароны и т.д.), соку, различным напиткам, печеньям, сиропу, молочным продуктам (например, масло, сыр, и т.д.), пищевым растительным маслам, маргарину, растительным белкам, продуктам питания в реторт-пакетах, замороженным продуктам питания, различным приправам (например, соевая паста, соевый соус, соусы и т.д.) и т.д.
Предпочтительное содержание пищевой композиции в соответствии с настоящим изобретением не ограничено, однако предпочтительно составляет от 0,01 до 50 масс.% от общей массы конечного продукта питания. Для применения пищевой композиции по настоящему изобретению в форме пищевых добавок, пищевую композицию можно получать и применять в форме порошков и концентратов.
Кроме того, настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, содержащей соединение химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемую соль в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, состоящей из соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли в качестве активного ингредиента.
Кроме того, настоящее изобретение относится к композиции для диагностики нейродегенеративных заболеваний или депрессии, по существу состоящей из соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли в качестве активного ингредиента.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Медицинские визуализирующие тесты вносят значительный вклад в диагностику и лечение пациентов. Недавно с введением технологии репортерных генов привлекла внимание молекулярная визуализация, способная визуализировать изменения на молекулярных и клеточных уровнях in vivo. Молекулярная визуализация представляет собой неинвазивный способ визуализации явлений жизни в клеточных или молекулярных элементах живых организмов, и может помочь диагностировать заболевания путем визуализации незначительных функциональных различий на начальном этапе, когда не возникло анатомических изменений вследствие заболевания. Таким образом, молекулярная визуализация предназначена для раннего обнаружения и лечения состояний предзаболевания, представляет собой новую возможность для разработки терапевтических средств, и осуществляет раннюю оценку ответа после лечения для проведения соответствующего адаптированного лечения для каждого пациента при минимизации токсичности лечения.
В качестве способа тестирования для получения такого изображения диагностическую композицию по настоящему изобретению можно использовать в качестве зонда в визуализации, такой как однофотонная эмиссионная компьютерная томография (SPECT) и позитронная эмиссионная томография (PET) с использованием радиоактивных элементов. Молекулярная визуализация с использованием способов ядерной медицины, таких как SPECT и PET, развивается очень быстро в отношении оценки функций центральной нервной системы и фактически является технологией, пригодной для основных медицинских исследований и клинической практики. В частности, активно проводятся исследования для разработки радиоактивного зонда для PET для визуализации этиологического фактора нейродегенеративных заболеваний, таких как болезнь Альцгеймера.
Согласно одному варианту осуществления настоящего изобретения, было подтверждено, что соединение химической формулы 1 выше обладает превосходной активностью специфического и прямого связывания с белком ASM (Neurobiology of Aging 31 (2010) 398-408, SCIENTIFIC REPORT(2018) 8:3071), о котором известно, что его экспрессия повышена в головном мозге пациентов с нейродегенеративными заболеваниями, такими как болезнь Альцгеймера и рассеянный склероз.
Таким образом, соединение, соответствующее химической формуле 1 выше, с которым связано диагностическое средство или средство детекции, прямо вводят in vivo, или им обрабатывают биологический образец ткани, плазму или жидкость организма в качестве биологического вещества in vitro, и, таким образом, оно может быть полезным в качестве диагностического вещества для отслеживания и количественного определения белка ASM, и, более того, может быть полезным в качестве диагностического вещества для диагностики нейродегенеративных заболеваний, вызываемых сверхэкспрессией ASM.
В рамках настоящего изобретения неограничивающие примеры диагностического средства/агента детекции включают радиоизотопы, красители (например, комплекс биотин-стрептавидин), контрастные вещества, флуоресцентные соединения или флуоресцентные белки, и усилители контраста для магнитно-резонансной томографии (MRI) (парамагнитные ионы). Предпочтительно, диагностическое средство включает радиоизотопы, усилители контраста для магнитно-резонансной томографии (MRI), и флуоресцентные соединения. Для нагрузки соединения химической формулы 1 выше по настоящему изобретению радиоактивным металлом или парамагнитным ионом, также может быть необходимой реакция с реагентом, имеющим множество дехелатирующих групп и присоединенную длинную хвостовую часть. Хвостовая часть может представлять собой индуцированную или индуцируемую цепь, имеющую выступающую группу, способную связываться с полимером, таким как полилизин и полисахарид, или хелатирующую группу, такую как этилендиаминтетрауксусная кислота (EDTA), диэтилентриаминпентауксусная кислота (DTPA), порфирин, полиамин, краун-эфир, бис-тиосемикарабзон и полиоксимы, и имеющую группу, известную тем, что она пригодна для перечисленных выше целей. Хелат может быть связан с соединением химической формулы 1 выше с использованием стандартной химии. Хелат обычно может быть связан с соединением химической формулы 1 выше посредством группы, способной образовывать связь с молекулой с минимальной утратой иммунореактивности и минимальной агрегацией и/или внутренним сшиванием.
Флуоресцентное вещество для диагностики и детекции может представлять собой флуоресцентные соединения, такие как родамин, производные Alexa, производные цианина, FAM, TAMRA, FITC, PE, PerCP, APC, и кумарин или его производные, или флуоресцентные белки, такие как GFP, eGFP, CFP, eCFP, YFP, RFP и т.д., но не ограничиваясь ими. Предпочтительно, флуоресцентное вещество может представлять собой производные цианина, такие как Cy3, Cy3.5, Cy5, Cy5.5 и Cy7. Флуоресцентное вещество может связываться с соединением химической формулы 1 выше по настоящему изобретению прямо или через линкер.
В частности, пригодные комбинации металл-хелат включают диагностические изотопы и 2-бензил-DTPA, и их его монометильные и циклогексильные аналоги, используемые в обычном диапазоне энергий от 60 до 4000 кэВ. Например, радиоизотопы, используемые в качестве визуализирующего средства и/или терапевтического средства, включают 125I, 131I, 123I, 124I, 62Cu, 64Cu, 67Cu, 186Re, 188Re, 82Rb, 177Lu, 18F, 153Sm, 213Bi, 111In, 67Ga, 68Ga, 89Sr, 169Er, 192Ir, 111In, 90Y, 99mTc, 94 mTc, 11C, 13N, 15O, 76Br и т.д. Репрезентативными ионами переходных металлов, таких как марганец (Mn), железо (Fe) и гадолиний (Gd) среди нерадиоактивных металлов являются парамагнитные материалы, и они пригодны для MRI. Однако, поскольку сами по себе ионы и радиоактивные изотопы являются в высокой степени токсичными, ионы и радиоактивные изотопы можно использовать в комбинации с хелатирующим агентом и т.п. Хелатирующий агент можно комбинировать с макроциклическим хелатирующим агентом, таким как DTPA, NOTA, DOTA, MS325, HPDO3A, EDTA, NTA и TETA, в зависимости от типа металла, и комплекс можно использовать посредством связывания с соединением химической формулы 1 выше по настоящему изобретению. Предпочтительно, хелатирующий агент можно использовать с радионуклидами галлия, иттрия и меди, соответственно, и очень стабильный комплекс металл-хелат можно получать путем подбора размера кольца к заданному металлу. Также в объем настоящего изобретения могут входить циклические хелаты, такие как макроциклические простые полиэфиры, пригодные для стабильного связывания с нуклидами, такими как 223Ra, используемыми в технологии облучения и визуализации (RAIT).
С другой стороны, когда диагностическое средство или агент детекции не связаны с соединением химической формулы 1 выше по настоящему изобретению, радиоактивным изотопом может быть атом углерода алкила, алкенила, алкинила или алкилкарбонила [11C].
Настоящее изобретение относится к применению соединения химической формулы 1 ниже или его фармацевтически приемлемой соли для получения средства для предупреждения или лечения нейродегенеративных заболеваний или депрессии.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода, и
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода.
Кроме того, настоящее изобретение относится к способу предупреждения или лечения нейродегенеративных заболеваний или депрессии, включающему введение эффективной дозы композиции, содержащей соединение химической формулы 1 выше или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму, нуждающемуся в этом.
Настоящее изобретение относится к применению соединения химической формулы 1 ниже, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемой соли для получения средства для диагностики нейродегенеративных заболеваний или депрессии.
[Химическая формула 1]

где
R1 представляет собой водород; алкил из 1-10 атомов углерода; или замещенный или незамещенный алкилкарбонил из 1-5 атомов углерода,
R2 представляет собой водород; или алкил из 1-10 атомов углерода, алкенил из 2-10 атомов углерода, или алкинил из 2-10 атомов углерода, и
каждый из указанного алкила, алкенила, алкинила или алкилкарбонила содержит или не содержит радиоактивные изотопы.
Кроме того, настоящее изобретение относится к способу для диагностики нейродегенеративных заболеваний или депрессии, включающему введение эффективной дозы композиции, содержащей соединение химической формулы 1 выше, с которым связано диагностическое средство или агент детекции, или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму с подозрением на нейродегенеративное заболевание или депрессию.
Термин "эффективная доза" по настоящему изобретению относится к количеству, которое демонстрирует эффекты улучшения, лечения, предупреждения, детекции и диагностики нейродегенеративных заболеваний или депрессии, или эффект ингибирования или смягчения нейродегенеративных заболеваний или депрессии при введении индивидууму. "Индивидуумом" могут быть животные, предпочтительно, млекопитающие, в частности, животные, включающие человека, а также могут быть клетки, ткани и органы, происходящие из животных. Индивидуумом может быть пациент, которому необходимы данные эффекты.
Термин "лечение" по настоящему изобретению относится к всестороннему улучшению при нейродегенеративных заболеваниях или депрессии, или улучшению симптомов нейродегенеративных заболеваний или депрессии, и он может включать лечение или по существу предупреждение нейродегенеративных заболеваний или депрессии, или улучшение состояния при них, и он включает облегчение, лечение или предупреждение симптома или большинства симптомов нейродегенеративных заболеваний или депрессии, но не ограничиваясь этим.
Термин "включающий" по настоящему изобретению используют в том же значении, что и "содержащий" или "характеризующийся", и не исключает дополнительных ингредиентов или стадий способа, которые не упоминаются для композиции или способа. Термин "состоящий из" означает не включающий дополнительные элементы, стадии или ингредиенты и т.д., которые отдельно не упомянуты. Термин "по существу состоящий из" означает включающий ингредиенты или стадии, которые по существу не влияют на основные свойства, в дополнение к описанным ингредиентам или стадиям, входящим в объем композиции или способа.
Преимущественные эффекты
Ингибирующее ASM соединение химической формулы 1 по настоящему изобретению прямо связывается с белком ASM, демонстрируя превосходный эффект ингибирования ASM и терапевтические эффекты, такие как сокращение бляшек Aβ в головном мозге при болезни Альцгеймера, облегчение нейровоспаления, улучшение памяти, снижение тревожности и т.д. Кроме того, ингибирующее ASM соединение обладает очень высоким распределением в головной мозг и превосходной метаболической стабильностью в микросомах печени. Таким образом, ингибирующее ASM соединение химической формулы 1 по настоящему изобретению может быть очень полезным для разработки средства для предупреждения или лечения нейродегенеративных заболеваний, включающих болезнь Альцгеймера, и композиции для диагностики нейродегенеративных заболеваний. Кроме того, поскольку ранее описано, что ингибирование ASM является эффективным для лечения депрессии, новое соединение по настоящему изобретению, ингибирующее ASM, имеющее химическую формулу 1, может использоваться в качестве средства для предупреждения или лечения неврологических заболеваний, включая депрессию.
Описание чертежей
На фиг.1 проиллюстрированы структурные формулы ингибирующих ASM соединений, название вещества и соединения для из них является следующим:
Название вещества SCNPA501, название соединения 2-амино-2-(1-гексил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Название вещества SCNPA401, название соединения 2-амино-2-(1-гептил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Название вещества SCNPA301, название соединения 2-амино-2-(1-октил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Название вещества SCNPA201, название соединения 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Название вещества SCNPA101, название соединения 2-амино-2-(1-додецил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол.
На фиг.2a и 2b представлены диаграммы, иллюстрирующие изменение активности ASM, показанное после обработки ингибирующими ASM соединениями и FTY720 фибробластов PS1 пациента с болезнью Альцгеймера (фиг.2a), и количества церамида, который является продуктом ASM (фиг.2b) (n=6/группа).
На фиг.3a и 3b представлена диаграмма вычисления концентраций, при которых ингибирующие ASM соединения могут ингибировать активность ASM на 50% (фиг.3a), и диаграмма прямого связывания с активным центром ASM и вычисления энергии связывания с ним (фиг.3b).
На фиг.4a-4c представлены диаграммы, подтверждающие ингибирование ингибирующими соединениями ASM активности Sphk (фиг.4a) и S1P (фиг.4b), и индукцию снижения экспрессии рецептора 1 S1P (S1PR1) (фиг.4c) (n=3-5/группа).
На фиг.5a и 5b представлены диаграммы для анализа посредством фармакокинетического теста ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101.
На фиг.5a представлен график, демонстрирующий концентрации в крови ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 после перорального (п/о 10 мг/кг) или внутривенного введения (в/в 1 мг/кг) нормальным мышам в каждый период времени (n=3/группа).
На фиг.5b проиллюстрирован результат анализа посредством фармакокинетического теста в крови ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 после перорального (п/о 10 мг/кг) или внутривенного введения (в/в 1 мг/кг) нормальным мышам (n=3/группа).
На фиг.6a и 6b представлены результаты анализа посредством фармакокинетического теста распределения в головной мозг после инъекции in vivo ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 (n=3/группа).
На фиг.6a проиллюстрирован результат (слева), демонстрирующий остаточные концентрации в головном мозге ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 после перорального введения (п/о 10 мг/кг) для каждого периода времени и результат (справа), демонстрирующий остаточные концентрации в головном мозге, печени, почках и сердце через 24 часа у нормальных мышей (n=3/группа).
На фиг.6b проиллюстрирован результат анализа посредством фармакокинетического теста распределения в головной мозг после инъекции in vivo ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 (n=3/группа).
На фиг.7a и 7b представлены диаграммы, иллюстрирующие стабильность ингибирующих ASM соединений SCNPA501, SCNPA201 и SCNPA101 в микросомах печени человека или мыши.
На фиг.7a представлена диаграмма, иллюстрирующая проценты остаточных количеств для каждого периода времени после обработки ингибирующими ASM соединениями SCNPA501, SCNPA201 и SCNPA101 в микросомах печени человека или мыши (n=3/группа).
На фиг.7b проиллюстрирован результат, демонстрирующий проценты остаточных количеств через 30 минут и время полужизни после обработки ингибирующими ASM соединениями SCNPA501, SCNPA201 и SCNPA101 в микросомах печени человека или мыши (n=3/группа).
На фиг.8 представлена диаграмма, иллюстрирующая схему теста, проведенного для подтверждения эффекта ингибирования ASM на болезнь Альцгеймера путем инъекции ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY720.
На фиг.9a и 9b представлены диаграммы, иллюстрирующие изменения концентрации ASM в сыворотке (фиг. 9a) и ткани головного мозга (фиг.9b) мышей после введения ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY72 в моделях болезни Альцгеймера на животных (n=4-6/группа) (WT: дикий тип, APP/PS1: модель болезни Альцгеймера на животных).
На фиг.10 проиллюстрированы результаты иммунофлуоресцентного окрашивания тиофлавина S (ThioS, бляшки протофибрилл амилоида-бета) и количественного определения площадей, занимаемых бляшками протофибрилл амилоида-бета в продолговатом мозге и гиппокампе в модели болезни Альцгеймера на животных с ингибирующим ASM соединением SCNPA201, SCNPA101 или FTY72 (n=3-4/группа) (WT: дикий тип, APP/PS1: модель болезни Альцгеймера на животных).
На фиг.11a и 11b проиллюстрированы результаты иммунофлуоресцентного окрашивания накопления Aβ40 (фиг.11a) или Aβ42 (фиг.11b) и количественного определения накопления в продолговатом мозге и гиппокампе в модели болезни Альцгеймера на животных с введением ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY72 (n=3-4/группа) (WT: дикий тип, APP/PS1: модель болезни Альцгеймера на животных).
На фиг.12a-12c проиллюстрированы результаты, указывающие на степень восстановления обучения и когнитивных функций в модели болезни Альцгеймера на животных после введения ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY72 (мышь дикого типа (n=8), мышь APP/PS1, которой с водой предоставлялось ингибирующее ASM соединение SCNPA201 (n=7), мышь APP/PS1, которой с водой предоставлялось ингибирующее ASM соединение SCNPA101 (n=8), мышь APP/PS1, которой с водой предоставлялось FTY720 (n=7) или мышь APP/PS1 без предоставления (n=8)).
На фиг.12a представлены результаты оценки обучения и памяти с использованием водного лабиринта Морриса у мышей дикого типа, мышей APP/PS1, которым предоставлялась вода с ингибирующим ASM соединением SCNPA201, у мышей APP/PS1, которым предоставлялась вода с ингибирующим ASM соединением SCNPA101, у мышей APP/PS1, которым предоставлялась вода с FTY720, или у мышей APP/PS1 без предоставления.
На фиг.12b проиллюстрирован результат, демонстрирующий время, проведенное на заданной платформе на 11 сутки теста.
На фиг.12c проиллюстрировано количество вхождений в заданную область заданной платформы на 11 сутки теста.
На фиг.13a и 13b проиллюстрированы результаты, указывающие на улучшение активности и снижение тревожности в модели болезни Альцгеймера после введения ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY72 (мышь дикого типа (n=8), мышь APP/PS1, которой с водой предоставлялось ингибирующее ASM соединение SCNPA201 (n=7), мышь APP/PS1, которой с водой предоставлялось ингибирующее ASM соединение SCNPA101 (n=8), мышь APP/PS1, которой с водой предоставлялось FTY720 (n=7) или мышь APP/PS1 без предоставления (n=8))
На фиг.13a проиллюстрирован результат, демонстрирующий время, затраченное на область стенки и центральную область мышью и доля в центральной области в ходе теста на открытом пространстве.
На фиг.13b проиллюстрирован результат измерения времени, затраченного в темноте и на свету мышью в тесте темноты и света и результат измерения количества перемещений между темными и светлыми местами мышью и первое время перехода из темного места на светлое место мышью в ходе теста.
На фиг.14a и 14b проиллюстрированы результаты, подтверждающие, что увеличенное нейровоспаление снижается посредством ингибирующего ASM соединения SCNPA201 в модели болезни Альцгеймера на животных (WT: дикий тип, AD: модель болезни Альцгеймера на животных (мышь APP/PS1)).
На фиг.14a проиллюстрирован результат количественного определения процентов астроцитов (GFAP) в продолговатом мозге мышей дикого типа и в модели болезни Альцгеймера на животных после введения ингибирующего ASM соединения SCNPA201, SCNPA101 или FTY720 (n=3-4/группа).
На фиг.14b проиллюстрированы результаты оценки уровней экспрессии мРНК маркеров воспаления TNF-α, IL-1β и IL-6 в продолговатом мозге в модели болезни Альцгеймера на животных, которым вводили ингибирующее ASM соединение SCNPA201, SCNPA101 или FTY720 (n=3-4/группа).
[Способы осуществления изобретение]
Далее настоящее изобретение описано подробно.
Однако приведенные ниже примеры только иллюстрируют настоящее изобретение и настоящее изобретение не ограничивается следующими примерами.
Материалы тестирования и способы тестирования
0. Синтез соединений
Вещество с названием SCNPA501, название соединения 2-амино-2-(1-гексил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Вещество с названием SCNPA401, название соединения 2-амино-2-(1-гептил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Вещество с названием SCNPA301, название соединения 2-амино-2-(1-октил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол,
Вещество с названием SCNPA201, название соединения 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, и
Вещество с названием SCNPA101, название соединения 2-амино-2-(1-додецил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол
получали посредством следующей серии процессов. Например, детальный процесс получения вещества с названием SCNPA201, название соединения 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, был следующим.
0-1. Схема реакции 1, синтез 1-азидононана
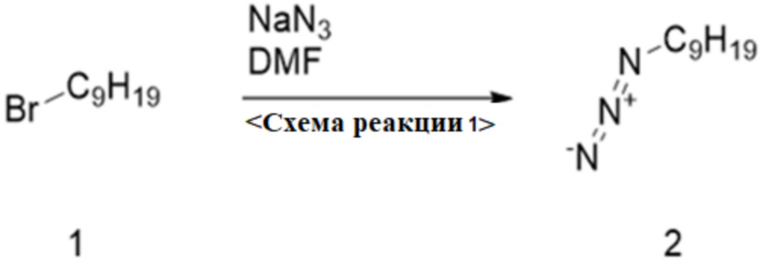
<Схема реакции 1>
Для синтеза 1-азидононана по схеме реакции 1, азид натрия (12,6 г, 190 ммоль, 2 экв.) добавляли к раствору 1-бромнонана (20 г, 96 ммоль) согласно химической формуле 1 в DMF (200 мл). Смесь перемешивали при комнатной температуре в течение 3 суток и разбавляли смесью EA (30 мл)/н-гексан (100 мл). Смесь промывали H2O (600 мл×2), сушили над MgSO4 и концентрировали с получением 1-азидононана согласно химической формуле 2 (16 г, 98%).
1H-ЯМР (400 МГц, CDCl3): δ 3,25 (т, 2H), 1,59 (пентет, 2H,), 1,37-1,24 (м, 15H), 0,88 (т, 3H)
0-2. Схема реакции 2, синтез 2-амино-2-(гидроксиметил)пропан-1,3-диола

<Схема реакции 2>
Для синтеза 2-амино-2-(гидроксиметил)пропан-1,3-диола по схеме реакции 2, Boc2O (49,5 г, 1,1 экв.) добавляли к суспензии трис(гидроксиметил)аминометана (25,0 г, 0,206 моль) согласно химической формуле 3 в DMF (500 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, а затем добавляли 2,2-диметоксипропан (30,4 мл, 1,2 экв.) и p-TsOH. H2O (2,0 г, 0,05 экв.). Смесь перемешивали при комнатной температуре в течение 18 часов и разбавляли Et2O (500 мл). Органический слой промывали насыщенным раствором NaHCO3 (300 мл) и рассолом (200 мл). Органический слой сушили над MgSO4 и концентрировали. Остаток кристаллизовали с н-гексаном с получением трет-бутил-5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-илкарбамата согласно химической формуле 4 в виде белого твердого вещества (32,0 г, 59,4%).
1H-ЯМР (600 МГц, CDCl3): δ 5,32 (с, 1H), 3,86-3,80 (м, 4H), 3,73 (с, 2H), 3,68 (с, 1H), 1,46-1,44 (м, 15H).
0-3. Схема реакции 3, синтез трет-бутил-5-формил-2,2-диметил-1,3-диоксан-5-илкарбамата

<Схема реакции 3>
Для синтеза трет-бутил-5-формил-2,2-диметил-1,3-диоксан-5-илкарбамата по схеме реакции 3, сначала DMSO (43,7 мл, 5 экв.) смешивали с раствором оксалилхлорида (33,4 мл, 3,17 экв.) в сухом MC (340 мл) при -78°C. Смесь перемешивали в течение 15 минут, а затем смешивали с трет-бутил-5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-илкарбаматом (32,0 г, 0,123 моль) мл) согласно химической формуле 4 в безводном MC (340 мл). Смесь перемешивали в течение 2 часов, а затем добавляли Et3N (171 мл, 10 экв.). Смесь перемешивали в течение 10 минут, а затем охлаждающую емкость удаляли и смесь оставляли при комнатной температуре. Светло-коричневую суспензию разбавляли EA (300 мл) и промывали 10% NH4OH (1500 мл). Органический слой концентрировали и наносили на хроматографическую колонку с SiO2, элюируя остаток смесью EA/н-гексан=1/10 с получением трет-бутил-5-формил-2,2-диметил-1,3-диоксан-5-илкарбамата (15,0 г, 47,2%) согласно химической формуле 5 в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 9,64 (с, 1H), 5,56 (с, 1H), 4,07 (д, 2H, J=12,0 Гц), 3,95 (д, 2H, J=12,0 Гц), 1,47 (с, 15H).
0-4. Схема реакции 4, синтез трет-бутил-5-этинил-2,2-диметил-1,3-диоксан-5-илкарбамата
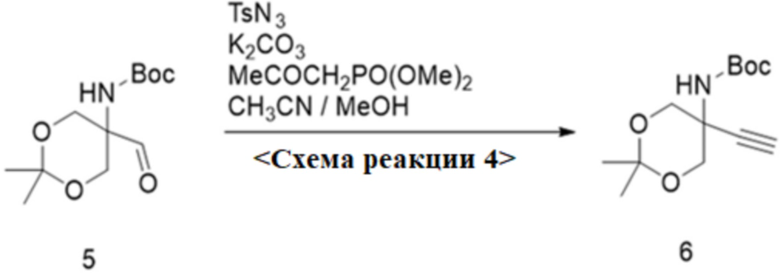
<Схема реакции 4>
Для синтеза трет-бутил-5-этинил-2,2-диметил-1,3-диоксан-5-илкарбамата по схеме реакции 4 диметил-2-оксопропилфосфонат (1,6 г, 1,02 экв.) мл) добавляли к суспензии в ацетонитриле (50 мл), содержавшей K2CO3 (3,0 г, 2,25 экв.) и п-толуолсульфонилазид (14% раствор в толуоле, 15,8 мл, 1,05 экв.), и смесь энергично перемешивали при комнатной температуре в течение 2,5 часов. К первой реакционной смеси добавляли раствор трет-бутил-5-формил-2,2-диметил-1,3-диоксан-5-илкарбамата (2,5 г, 9,64 ммоль) формулы 5 в метаноле (40 мл). После добавления K2CO3 (2,7 г, 2,06 экв.) смесь перемешивали в течение 1,5 часов, концентрировали при пониженном давлении, и остаток разбавляли MC (200 мл) и H2O (200 мл). Органический слой промывали H2O (200 мл), сушили над MgSO4 и концентрировали при пониженном давлении. Органический слой подвергали колоночной хроматографии на SiO2, элюируя остаток смесью EA/н-гексан=1/9 с получением трет-бутил-5-этинил-2,2-диметил-1,3-диоксан-5-илкарбамата (2,3 г, 93,4%) согласно химической формуле 6 в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 5,15 (с, 1H), 4,05-3,95 (м, 4H), 2,43 (с, 1H), 1,48-1,38 (м, 15H)
0-5. Схема реакции 5, синтез трет-бутил-5-(1-нонанил-1H-1,2,3-триазол-4-ил)-2,2-диметил-1,3-диоксан-5-илкарбамата
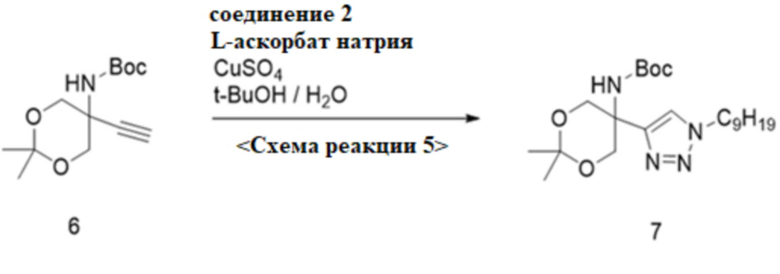
<Схема реакции 5>
Для синтеза трет-бутил-5-(1-нонанил-1H-1,2,3-триазол-4-ил)-2,2-диметил-1,3-диоксан-5-илкарбамата согласно химической формуле 5, CuSO4. 5H2O (2,62 г, 10 ммоль) добавляли к раствору трет-бутил-5-этинил-2,2-диметил-1,3-диоксан-5-илкарбамата (6,7 г, 26 ммоль) согласно химической формуле 6, 1-азидононана (4,89 г, 29 ммоль) согласно схеме реакции 1, натрия L (6,76 г, 34 ммоль), t-BuOH (100 мл) и H2O (214 мл). Двухфазный раствор перемешивали на воздухе при комнатной температуре в течение 18 часов и разбавляли H2O (300 мл) и MC (100 мл). Органический слой сушили над MgSO4 и концентрировали при пониженном давлении. Остаток кристаллизовали с н-гексаном с получением трет-бутил-5-(1-нонанил-1H-1,2,3-триазол-4-ил)-2,2-диметил-1,3-диоксан-5-илкарбамата (9,7 г, 87,8%) согласно химической формуле 7 в виде белого твердого вещества.
1H-ЯМР (600 МГц, CDCl3): δ 7,64 (с, 1H), 5,64 (с, 1H), 4,37 (ушир., 2H), 4,32 (т, 2H), 4,13 (д, 2H), 1,9 (м, 2 H), 1,55 (с, 3H), 1,51 (с, 3H), 1,43 (с, 9H), 1,32-1,25 (м, 12H ), 0,88 (т, 3H)
0-6. Схема реакции 6, синтез гидрохлорида 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диола
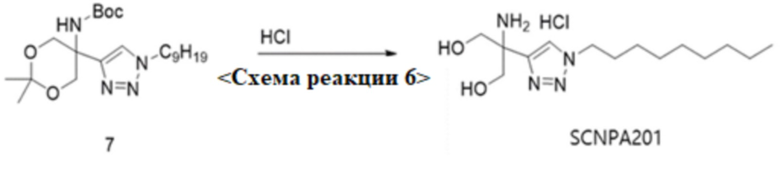
<Схема реакции 6>
Для синтеза 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диола SCNPA201 согласно схеме реакции 6, трет-бутил-5-(1-нонанил-1H-1,2,3-триазол-4-ил)-2,2-диметил-1,3-диоксан-5-илкарбамат (9,7 г, 20 ммоль) согласно химической формуле 7 смешивали с сильной HCL (37,9 мл) и этанолом (380 мл), перемешивали при 40°C в течение 6 часов, а затем концентрировали при пониженном давлении. Остаток перекристаллизовывали в ацетоне с получением 2-амино-2-(1-нонанил-1H-1,2,3-триазол-4-ил)пропан-1,3-диола в виде белого твердого вещества (5 г , 71,2%). Полученный SCNPA201 имел структурную формулу, как показано на фиг.1, и имел молекулярную массу 284,4.
1H-ЯМР (400 МГц, метанол-d4): δ 8,05 (с, 1H), 4,41 (т, 2H), 3,95 (с, 4H), 1,91 (м, 2H), 1,33-1,21 (м, 12H), 0,91 (т, 3H)
0-7. Синтез вещества под названием SCNPA501, название соединения 2-амино-2-(1-гексил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, вещества под названием SCNPA401, название соединения 2-амино-2-(1-гептил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, вещества под названием SCNPA301, название соединения 2-амино-2-(1-октил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, и вещества под названием SCNPA101, название соединения 2-амино-2-(1-додецил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол.
На схеме реакции 1 выше 1-бромгексан, 1-бромгептан, 1-бромоктан и 1-бромдодекан использовали в качестве исходных материалов, а затем получали соединения, имеющие структурные формулы, показанные на фиг.1 и молекулярные массы SCNPA501=242,32, SCNPA401=257,35, SCNPA301=270,38, и SCNPA101=362,94, аналогично тому, как на схемах реакции 2-6 выше, соответственно.
1. Клеточная культура
Линии фибробластов человека (нормальные и PS1) получали от Coriell Institute и культивировали в DMEM, содержавшей 15% FBS, при 37°C и 5% CO2, и использовали. После этого клеточные линии обрабатывали 10 мкМ каждого из синтезированных ингибирующих ASM соединений и FTY720 (Cayman), а затем определяли изменения активности ASM, церамида, S1P и S1PR1.
2. Мышь
Тест на мышах был одобрен Institutional Animal Care and Use Committee (IACUC) Kyungpook National University. На основе мышей C57BL/6 (Charles River, Великобритания), использовали трансгенную линию мышей, сверхэкспрессирующих APPswe (hAPP695swe) или PS1 (пресенилин-1M146V) [далее мышь APP: мышь, сверхэкспрессирующая APPswe, мышь PS1: мышь, сверхэкспрессирующая пресенилин-1M146V; GlaxoSmithKline]
Для подтверждения терапевтического эффекта ингибирования ASM синтезированное ингибирующее ASM соединение SCNPA201 (100 мг/кг/сутки), SCNPA101 (100 мг/кг/сутки) или FTY720 (1 мг/кг/сутки) предоставляли мышам в возрасте 7 месяцев с водой. После предоставления с водой в течение 1 месяца проводили поведенческий анализ и после поведенческого анализа проводили взятие тканей головного мозга мышей (фиг.8).
3. Измерение уровня ASM, активности Sphk, уровня церамида и S1P
Уровень концентрации ASM определяли следующим образом. В частности, 3 мкл образцов сыворотки, ткани головного и фибробластов мышей смешивали с микролитром буфера для определения активности ASM и хранили при 37°C. Добавляли 114 мкл этанола, и смесь центрифугировали после завершения реакции гидролиза. После переноса 30 мкл супернатанта в стеклянную емкость, 5 мкл супернатанта добавляли в систему UPLC. Уровень концентрации ASM количественно определяли путем сравнения аминоацетальдегида (Bodipy), связанного со сфингомиелином и церамидом. Для измерения уровня концентрации Sphk, 3 мкл образца фибробластов смешивали с буфером для определения активности Sphk и хранили при 37°C. Затем добавляли 54 мкл этанола, и смесь центрифугировали после завершения реакции гидролиза. После переноса 30 мкл супернатанта в стеклянную емкость 5 мкл супернатанта загружали в систему UPLC. Каждый уровень концентрации Sphk количественно определяли с использованием системы UPLC путем сравнения уровня концентрации Sphk с NBD, связанным со сфингозином и S1P. Для экстракции и количественного определения церамида и S1P, липиды экстрагировали из образцов известным способом, и высушенный липидный экстракт ресуспендировали в 25 мкл 0,2% Igepal CA-630 (Sigma-Aldrich), и уровни концентрации церамида и S1P количественно определяли с использованием системы UPLC.
4. Тест прямого ингибирования ASM
Для определения IC50 в отношении ASM для синтезированных ингибирующих ASM соединений каждое из ингибирующих ASM соединений разбавляли до различных концентраций (0-200 мкМ), а затем к ним добавляли ASM и Bodipy-Sphigomyelin в качестве субстрата ASM и подвергали реакции при 37°C в течение 10 минут. Через 10 минут добавляли этанол и смесь центрифугировали после завершения реакции гидролиза. После переноса 30 мкл супернатанта в стеклянный флакон 5 мкл супернатанта загружали в систему UPLC. Уровень концентрации ASM количественно определяли путем сравнения Bodipy, связанного со сфингомиелином и церамидом. Для сравнения энергии прямого связывания с ASM каждого из ингибирующих ASM соединений энергию прямого связывания с ASM количественно определяли с использованием программы Discovery studio.
5. Иммунофлуоресценция
После иммобилизации полушарий головного мозга и гиппокампа мышей, 0,5% тиофлавин S (Sigma-Aldrich), антитело 20G10 против Aβ42 (мыши, 1:1000), антитело G30 против Aβ40 (кролик, 1:1000), и антитело против GFAP (кролика, 1:500, DAKO) инкубировали вместе. Участки анализировали с использованием конфокального лазерного сканирующего микроскопа или микроскопа Olympus BX51, оборудованного программным обеспечением для визуализации Fluoview SV1000 (Olympus FV1000, Япония). Процентную площадь окрашенных областей к площади всех тканей количественно определяли и анализировали с использованием программного обеспечения Metamorph (Molecular Devices).
6. Вестерн-блоттинг
Экспрессию белка S1PR1 анализировали с использованием вестерн-блоттинга. Сначала использовали антитела против S1PR1 (abcam) и β-актина (Santa Cruz) и проводили денситометрическое количественное определение с использованием программного обеспечения ImageJ (US National Institutes of Health).
7. Количественная ПЦР в реальном времени
Способ количественной ПЦР в реальном времени использовали для определения уровней экспрессии связанных с воспалительным ответом цитокинов (TNF-a, IL-1b и IL-6). Тотальную РНК экстрагировали из ткани головного мозга с использованием набора RNeasy Plus mini kit (Qiagen, Korea, Ltd), и кДНК синтезировали с 5 мкг тотальной РНК с использованием набора от Clontech Co., Ltd. (Mountain View, CA). Кроме того, с использованием устройства для ПЦР в реальном времени Corbett research RG-6000 проводили количественную ПЦР в реальном времени путем установки на 95°C, 10 мин; 95°C, 10 с; 58°C, 15 с; 72°C, 20 с в качестве одного цикла и повторения 40 циклов.
Праймеры, использованные в количественной ПЦР в реальном времени, представлены в таблице 1.
[Таблица 1]
8. Поведенческий тест
Для подтверждения потенциального эффекта на обучение и память проводили тест в водном лабиринте Морриса (MWM). В MWM мышь обучали выполнять задачу 4 раза в сутки на протяжении 10 суток, платформу удаляли на 11 сутки и проводили испытание с зондом. Для оценки активности и тревожности проводили испытание на открытом пространстве и тест в темноте и на свету. В тесте на открытом пространстве мышь помещали в четырехугольную коробку на 10 минут, а затем определяли общую активность и время, затраченное на движение вокруг стенки и в центре. В тесте в темноте и на свету мышь помещали в четырехугольную коробку, состоящую из темной коробки и светлой коробки, на 10 минут, и определяли время нахождения в каждой коробке, количество перемещений между коробками и время до первого вхождения в светлую коробку.
9. Статистический анализ
Для сравнения двух групп использовали T-критерий Стьюдента, в то время для сравнения множественных групп проводили анализ повторяющихся измерений с использованием критерия Тьюки HSD, и дисперсионный критерий использовали в соответствии со статистическим пакетом SAS (выпуск 9.1; SAS Institute Inc., Cary, NC). Значимыми считали *p < 0,05, **p < 0,01 и *** p < 0,001.
Результаты испытания
1. Подтверждение изменений активности ASM и церамида после обработки ингибирующими ASM соединениями в фибробластах пациента с болезнью Альцгеймера
Для подтверждения эффекта смягчения очагов повреждения при болезни Альцгеймера посредством ингибирования ASM in vitro, ингибирующими ASM соединениями SCNPA501, SCNPA401, SCNPA301, SCNPA 201 и FTY720 в концентрациях 10 мкМ обрабатывали фибробласты, происходящие от пациентов с болезнью Альцгеймера, а затем сразу измеряли изменения активности ASM.
FTY720 не был первоначально разработан в качестве ингибитора ASM, но различные результаты исследований показали, что он обладает эффектом ингибирования ASM, и, следовательно, его использовали в качестве положительного контроля для сравнения эффектов настоящего изобретения (Biochem Biophys Res Commun. 2011 Jan 7;404( 1):321-323).
В результате теста активность ASM значительно возрастала в фибробластах PS1 по сравнению с нормальными фибробластами человека, но значительно снижалась в результате обработки ингибирующими ASM соединениями SCNPA501, SCNPA201, SCNPA301 и SCNPA 201 (фиг.2a), и уровень церамида, продукта, образующегося в результате активности ASM, также значительно снижался посредством обработки ингибирующими ASM соединениями (фиг.2b).
2. Подтверждение эффекта прямого ингибирования активности ASM посредством ингибирующих ASM соединений
Для подтверждения того, могут ли ингибирующие ASM соединения по настоящему изобретению прямо ингибировать активность ASM, в результате подтверждения концентрации, способной ингибировать активность ASM на 50% путем реакции фермента ASM и сфингомиелина в качестве субстрата фермента ASM с ингибирующими ASM соединениями при различных концентрациях, было подтверждено, что все соединения могут ингибировать активность ASM в низких концентрациях (SCNPA501=1,86 мкМ, SCNPA401=1,82 мкМ, SCNPA301=1,75 мкМ, SCNPA 201=1,14 мкМ) (фиг.3a).
Кроме того, для подтверждения прямого связывания ингибирующих ASM соединений с ASM для ингибирования активности, проводили имитацию связывания. Для подтверждения того, связываются ли ингибирующие ASM соединения с активными центрами ASM, проводили сравнение связывающих центров ASM и фосфохолина сфингомиелина в качестве субстрата. В результате было подтверждено, что соседние аминокислоты (D206, D278, H319, N318 и т.д.), вовлеченные в связывание ASM и фосфохолина сфингомиелина, были по большей части сходными с аминокислотами, вовлеченными в связывание соединений, ингибирующих активность ASM, по настоящему изобретению и ASM (фиг.3b).
Иными словами, можно видеть, что ингибирующие ASM соединения по настоящему изобретению прямо связываются с активными участками ASM, т.е. участками, с которыми связывается фосфохолин сфингомиелина в качестве субстрата.
Между тем, согласно общепринятым испытаниям, было описано, что уровень экспрессии белка ASM был повышен в головном мозге пациентов с болезнью Альцгеймера (Neurobiology of Aging 31 (2010) 398-408), и уровень экспрессии белка ASM также был повышен даже в головном мозге пациентов с рассеянным склерозом, одним из нейродегенеративных заболеваний (SCIENTIFIC REPORT (2018) 8:3071).
Однако, ссылаясь на результаты, приведенные на фиг.3b, поскольку ингибирующие ASM соединения в соответствии с настоящим изобретением демонстрируют активность прямого связывания с белком ASM, если диагностическое вещество, такое как флуоресцентное вещество, является меченным, уровень экспрессии белка ASM можно количественно определять у индивидуума или в биологическом образце, полученном от индивидуума.
Таким образом, можно быть определено, что ингибирующие ASM соединения в соответствии с настоящим изобретением можно использовать для диагностики или прогнозирования нейродегенеративных заболеваний посредством количественного определения уровня экспрессии белка ASM у индивидуума или в биологическом образце, полученном от индивидуума.
3. Подтверждение изменений S1P и S1PR1 посредством ингибирующих ASM соединений
В случае FTY720, известно, что FTY720 реагирует с ферментом Sphk вместо сфингозина, ингибируя активность Sphk, и конвертируется в фосфорилированный фосфо-FTY720, снижая экспрессию S1P который является продуктом сфингозина. Кроме того, известно, что фосфорилированный фосфо-FTY720 связывается с рецептором S1P1 (S1PR1), снижая экспрессию рецептора S1P1.
Для подтверждения того, демонстрируют ли ингибирующие ASM соединения по настоящему изобретению такой эффект, ингибирующими ASM соединениями SCNPA501, SCNPA401, SCNPA301, SCNPA 201 и FTY720 обрабатывали нормальные фибробласты и фибробласты, происходящие от пациентов с болезнью Альцгеймера, в концентрациях 10 мкМ, а затем сначала измеряли изменение активности Sphk, уровни S1P и S1PR1.
В результате было подтверждено, что FTY720 снижал активность Sphk и экспрессию S1P и S1PR1, в то время как ингибирующие ASM соединения не демонстрировали этих эффектов (фиг.4a и 4b). В качестве этих результатов, было подтверждено, что ингибирующие ASM соединения по настоящему изобретению могут специфически ингибировать только активность ASM, и демонстрируют фармакологический механизм, отличный от FTY720.
4. Фармакокинетическая оценка ингибирующих ASM соединений
Для сравнения фармакокинетических свойств ингибирующих ASM соединений проводили сравнение и анализ фармакокинетических тестов SCNPA501, SCNPA201 и SCNPA101.
SCNPA101 представлял собой соединение, для которого авторы настоящего изобретения ранее подтвердили, что оно обладает активностью ингибирования ASM, и его использовали в тесте для сравнения с ингибирующими ASM соединениями SCNPA201 и SCNPA501 в соответствии с настоящим изобретением.
После инъекции SCNPA501, SCNPA201 и SCNPA101 нормальным мышам пероральным путем (10 мг/кг) или через хвостовую вену (1 мг/кг), соответственно, проводили взятие крови через 5 минут, 15 минут, 30 минут, 1 час, 2 часа, 4 часа, 8 часов и 24 часа, соответственно, и измеряли концентрацию каждого соединения в крови (фиг.5a). В результате анализа фармакокинетических параметров было обнаружено, что SCNPA501 (72,26%) и SCNPA201 (50,33%) имели более высокую процентную биодоступность (BA), чем SCNPA101 (19,64%) и, таким образом, были более эффективными в качестве препарата для перорального введения (фиг. 5b).
5. Подтверждение распределения ингибирующих ASM соединений в головной мозг
Для применение ингибирующих ASM соединений по настоящему изобретению для дегенеративных заболеваний головного мозга важно, чтобы ингибирующие ASM соединения были введены, а затем хорошо распределялись в головном мозге с повышенной ASM. Для подтверждения этого SCNPA501, SCNPA201 и SCNPA101 перорально вводили (10 мг/кг), а затем извлекали головной мозг для каждого периода времени для определения концентраций, и через 24 часа извлекали головной мозг, печень, почки и сердце для определения концентраций. В результате было подтверждено, что концентрация SCNPA201 в головном мозге была довольно высокой (фиг.6a).
С другой стороны, в результате подтверждения фармакокинетических параметров в головном мозге, были подтверждены величины распределения в головном мозге для SCNPA501 (1,41), SCNPA201 (3,64) и SCNPA101 (3,61) (фиг.6b).
Из приведенных выше результатов можно видеть, что с точки зрения фармакокинетики SCNPA201 демонстрирует более идеальное распределение в головной мозг, чем SNCPA101, и, таким образом, он является более пригодным для разработки терапевтических средств против заболеваний головного мозга, таких как нейродегенеративные заболевания.
6. Подтверждение стабильности в микросомах печени ингибирующих ASM соединений
Для подтверждения метаболической стабильности ингибирующих ASM соединений остаточное количество каждого соединения проверяли через 30 минут после введения SCNPA501, SCNPA201 или SCNPA101 в микросомах печени человека или мыши.
В результате, было подтверждено, что стабильность была более высокой для SCNPA501 (98,21%), SCNPA201 (95,66%) и SCNPA101 (86,36%) в микросомах печени мыши, и та же тенденция была показана для микросом печени человека. В частности, было подтверждено, что в микросомах печени человека стабильность SCNPA101 была очень низкой порядка 7,8% по сравнению с SCNPA201 и SCNPA501 (фиг.7a и 7b).
В качестве этих результатов можно видеть, что SCNPA101 имеет очень низкую метаболическую стабильность в микросомах печени человека, в то время как ингибирующие ASM соединения SCNPA501 и SCNPA201 по настоящему изобретению имели высокую метаболическую стабильность.
В частности, в случае SCNPA101, метаболическая стабильность в микросомах печени мыши не была в значительной степени низкой, а метаболическая стабильность в микросомах печени человека была совсем низкой, и, таким образом, результаты испытаний с использованием мышей и клинические результаты при применении фактически в отношении человека могут полностью отличаться друг от друга. Было подтверждено, что эти метаболические характеристики могут быть большим ограничением при разработке средств для перорального введения, которые могут подвергаться эффекту первого прохождения в печени. Следовательно, в результатах испытаний по "фармакокинетической оценке", показана биодоступность SCNPA101 у мышей 19,64%, однако при применении у человека, можно ожидать, что SCNPA101 в значительной степени метаболизируется печенью после перорального введения, и биодоступность SCNPA101 является более низкой, чем биодоступность у мыши.
Напротив, считается, что ингибирующие ASM соединения по настоящему изобретению обладают лучшей метаболической стабильностью в микросомах печени человека по сравнению с SCNPA101, и, таким образом, можно ожидать, что фармакологический эффект и длительность эффективности при введении непосредственно индивидуумам будут значительно лучшими, чем у SCNPA101.
7. Подтверждение изменений активности ASM в модели болезни Альцгеймера на животных, которым вводили ингибирующие ASM соединения
Для подтверждения эффекта смягчения очагов повреждения при болезни Альцгеймера посредством ингибирования активности ASM in vivo, терапевтический эффект SCNPA201, который представлял собой ингибирующее ASM соединение, сравнивали с терапевтическим эффектом SCNPA101 и FTY720 с использованием модели болезни Альцгеймера на животных (AD: мышь APP/ mouse). Для сравнения терапевтического эффекта при болезни Альцгеймера SCNPA201 (100 мг/кг/сутки), SCNPA101 (100 мг/кг/сутки) или FTY720 (1 мг/кг/сутки) предоставляли мышам в модели болезни Альцгеймера в возрасте 7 месяцев с водой (фиг.8).
Сначала для проверки того, ингибировалась ли активность ASM, плазму и ткань головного мозга каждого модельного животного с болезнью Альцгеймера извлекали для подтверждения активности ASM. В результате было подтверждено, что уровни концентрации ASM в плазме (фиг.9a) и в ткани головного мозга (фиг.9b) в модели болезни Альцгеймера на животных при введении SCNPA201 были наиболее низкими.
8. Подтверждение отложения амилоида-β в модели болезни Альцгеймера на животных, которым вводили ингибирующие ASM соединения
Для подтверждения того, имеет ли ингибирование активности ASM посредством введения ингибирующих ASM соединений эффект на очаги повреждения при болезни Альцгеймера, сначала области полушарий головного мозга и гиппокампа мышей окрашивали тиофлавином S (ТиоS) в соответствии с известным способом для подтверждения отложения протофибрилл амилоида-β. Кроме того, проводили иммунофлуоресцентное окрашивание Aβ40 и Aβ42 для подтверждения отложения амилоида-β.
В результате теста было подтверждено, что отложение протофибрилл Aβ (фиг.10) и отложение Aβ40 и Aβ42 было наиболее низким у мышей APP/PS1, которым вводили SCNPA201, по сравнению с мышами APP/PS1 (фиг.11a и 11b). Этот эффект продемонстрировал лучший эффект, чем мыши APP/PS1, которым инъецировали SCNPA101 или FTY720.
9. Подтверждение улучшения памяти в модели болезни Альцгеймера на животных, которым вводили ингибирующие ASM соединения
Для подтверждения того, демонстрирует ли ингибирование ASM посредством введения ингибирующих ASM соединений потенциальный эффект на память в модели болезни Альцгеймера на животных, проводили тест в водном лабиринте Морриса (MWM).
Как проиллюстрировано на фиг.12a-12c, было подтверждено, что мыши APP/PS1 продемонстрировали серьезное ухудшение когнитивной способности, но в случае мышей, которым вводили SCNPA201, эффект улучшения когнитивной способности был более заметным по сравнению с SCNPA101 или FTY720.
Кроме того, проводили тест в открытом пространстве и тест в темноте и на свету для подтверждения эффекта ингибирующих ASM соединений на активность и тревожность.
Как проиллюстрировано на фиг.13a и 13b, было подтверждено, что происходило улучшение активности и тревожности у мышей APP/PS1, которым вводили SCNPA201 или SCNPA101, по сравнению с мышами APP/PS1. В частности, было подтверждено, что SCNPA201 обладает более выраженным эффектом улучшения активности и тревожности, чем SCNPA101. С другой стороны, было подтверждено, что этот эффект не был показан у мышей APP/PS1, которым вводили FTY720.
10. Подтверждение изменений нейровоспаления в модели болезни Альцгеймера на животных, которым вводили ингибирующие ASM соединения
В модели болезни Альцгеймера на животных для подтверждения эффекта ингибирования ASM посредством инъекции ингибирующих ASM соединений в отношении изменений нейровоспаления, наблюдали изменения астроцитов в головном мозге. По сравнению с мышами APP/PS1, было подтверждено, что активность астроцитов значительно снижалась у мышей APP/PS1, которым вводили SCNPA201 или SCNPA101 (фиг.14a). В частности, активность астроцитов снижалась в наибольшей степени в головном мозге мышей APP/PS1, которым вводили SCNPA201, по сравнению с мышами APP/PS1, которым вводили SCNPA101. С другой стороны, было подтверждено, что этот эффект не был показан у мышей APP/PS1, которым вводили FTY720.
Кроме того, у мышей APP/PS1 экспрессия генов воспалительных цитокинов TNF-a, IL-1b и IL-6 значительно повышалась по сравнению с мышами дикого типа, однако у мышей APP/PS1, которым вводили SCNPA201 или SCNPA101, было подтверждено, что экспрессия воспалительных цитокинов восстанавливалась до нормального уровня (фиг.14b). В частности, было подтверждено, что экспрессия этих воспалительных цитокинов была значительно снижена в головном мозге мышей APP/PS1, которым вводили SCNPA201, по сравнению с мышами APP/PS1, которым вводили SCNPA101, и этот эффект не был показан у мышей APP/PS1, которым вводили FTY720.
Обобщая приведенные выше результаты, можно видеть, что ингибирующие ASM соединения SCNPA501, SCNPA401, SCNPA301 и SCNPA201 могут значительно ингибировать активность ASM в фибробластах пациентов с болезнью Альцгеймера, и также связываться с активными центрами ASM, прямо ингибируя активность ASM. С другой стороны, можно видеть, что, поскольку ингибирующие ASM соединения не демонстрируют эффекта ингибирования активности Sphk, S1P и S1PR1, ингибирующие ASM соединения были прямыми ингибиторами, способными специфически ингибировать ASM. Кроме того, вновь было подтверждено, что ингибирующие ASM соединения по настоящему изобретению могут прямо связываться с активными центрами ASM для применения для диагностики заболеваний головного мозга, при которых уровень ASM повышен.
Кроме того, согласно результатам фармакокинетических тестов и распределения в головной мозг, можно видеть, что ингибирующие ASM соединения по настоящему изобретению демонстрируют лучший эффект, чем существующий ингибитор активности ASM SCNPA101, разработанный авторами настоящего изобретения. В частности, можно видеть, что в микросомах печени человека метаболическая стабильность SCNPA101 является очень низкой, в то время как ингибирующие ASM соединения по настоящему изобретению обладают высокой метаболической стабильностью для превосходной возможности разработки в качестве лекарственного состава.
Аналогично, в отношении терапевтического эффекта в модели болезни Альцгеймера на животных, ингибирующие ASM соединения по настоящему изобретению демонстрируют лучший терапевтический эффект ингибирования активности ASM в головном мозге, снижая уровень бляшек Aβ, обеспечивая улучшение памяти и улучшение при депрессии, смягчая нейровоспаление и т.д., относительно SCNPA101 или FTY720. Таким образом, можно видеть, что ингибирующие ASM соединения по настоящему изобретению можно использовать в качестве средств для предупреждения или лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера и депрессия.
[Промышленная применимость]
Ингибирующее ASM соединение химической формулы 1 по настоящему изобретению обладает превосходным эффектом ингибирования ASM посредством прямого связывания с белком ASM, обладает терапевтическими эффектами, такими как сокращение бляшек Aβ, улучшение памяти и тревожности, и смягчение нейровоспаления в головном мозге при болезни Альцгеймера, обладает очень высоким распределением в головной мозг, и обладает превосходной метаболической стабильностью в микросомах печени, и, таким образом, может быть полезным для разработки средства для предупреждения или лечения нейродегенеративных заболеваний, включающих болезнь Альцгеймера, и композиции для диагностики нейродегенеративных заболеваний. Кроме того, поскольку ранее описано, что ингибирование ASM является эффективным в отношении облегчения депрессии, новое соединение, ингибирующее ASM, согласно химической формуле 1 по настоящему изобретению может быть полезным в качестве средства для предупреждения или лечения неврологических заболеваний, включая депрессию. Таким образом, настоящее изобретение обладает превосходной промышленной применимостью.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2799454C2 |
| НОВАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНОГО РАССТРОЙСТВА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2791317C2 |
| СОЕДИНЕНИЯ АЛЬФА-АМИНОАМИДНЫХ ПРОИЗВОДНЫХ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2015 |
|
RU2673622C2 |
| НАТРИЕВАЯ СОЛЬ ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784326C1 |
| АММОНИЕВАЯ СОЛЬ ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784249C1 |
| МАГНИЕВЫЙ КОМПЛЕКС ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784746C1 |
| ИНГИБИТОРЫ GSK-3 | 2006 |
|
RU2449998C2 |
| КАЛЬЦИЕВЫЙ КОМПЛЕКС ПЕПТИДА ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2785354C1 |
| МЕДНЫЙ КОМПЛЕКС ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784732C1 |
| КАЛИЕВАЯ СОЛЬ ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784425C1 |
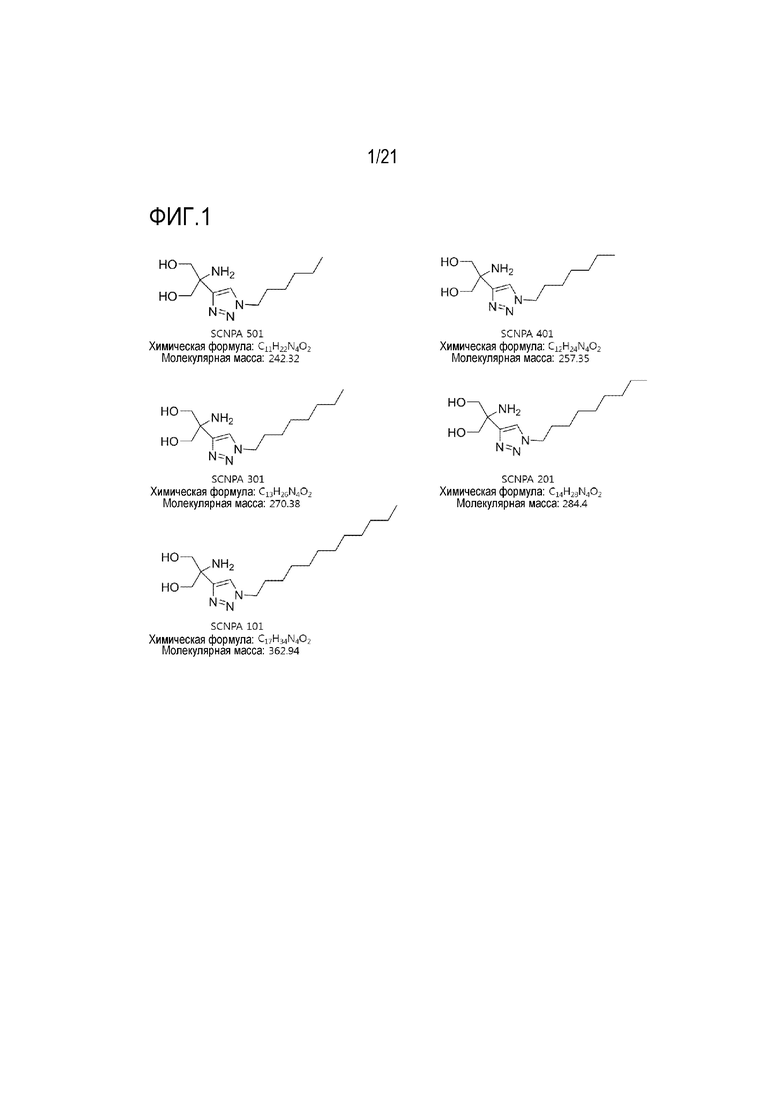
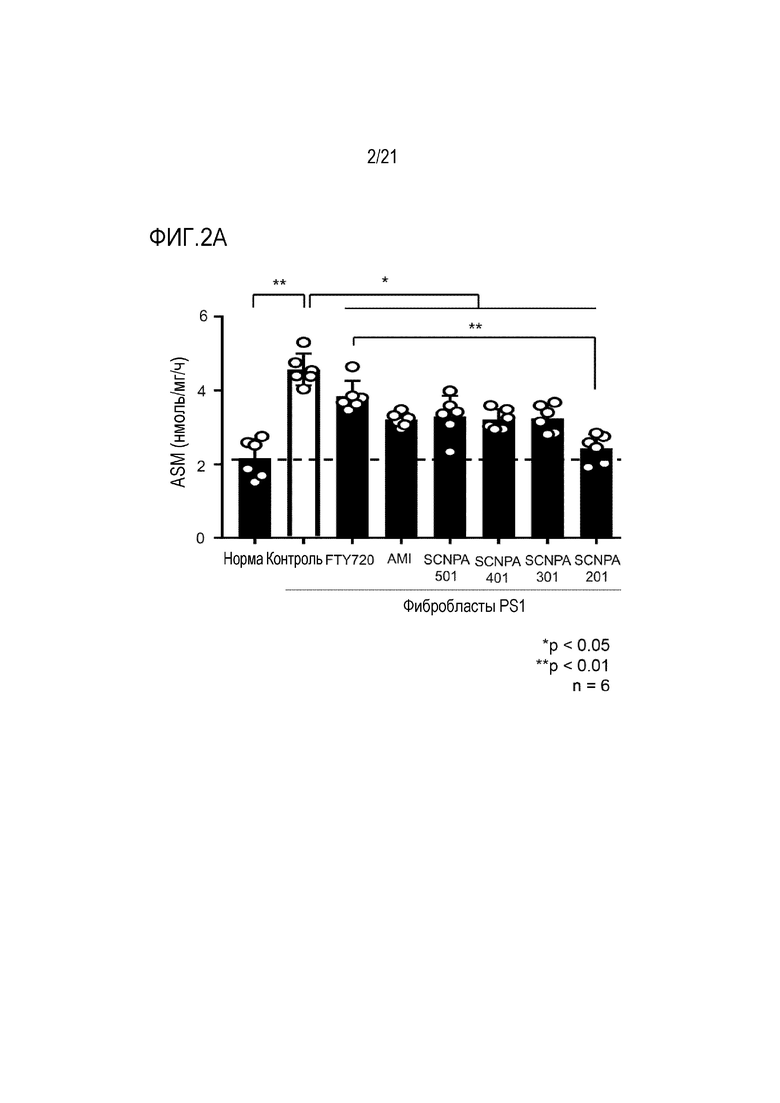
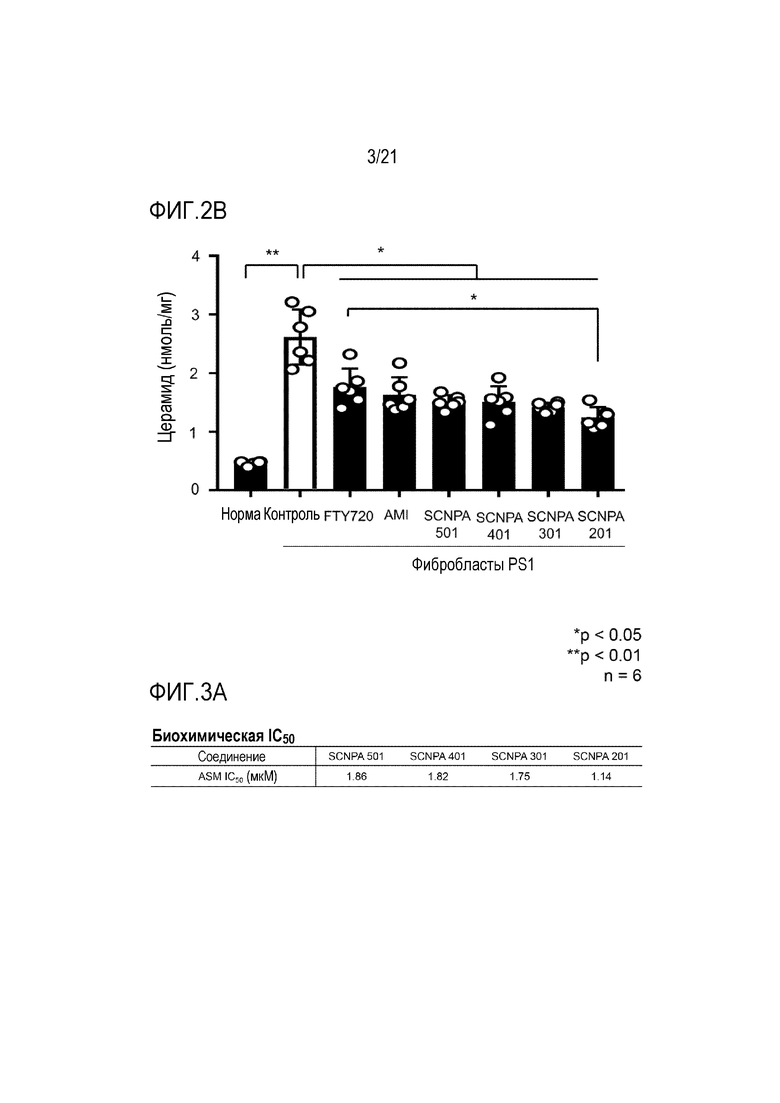
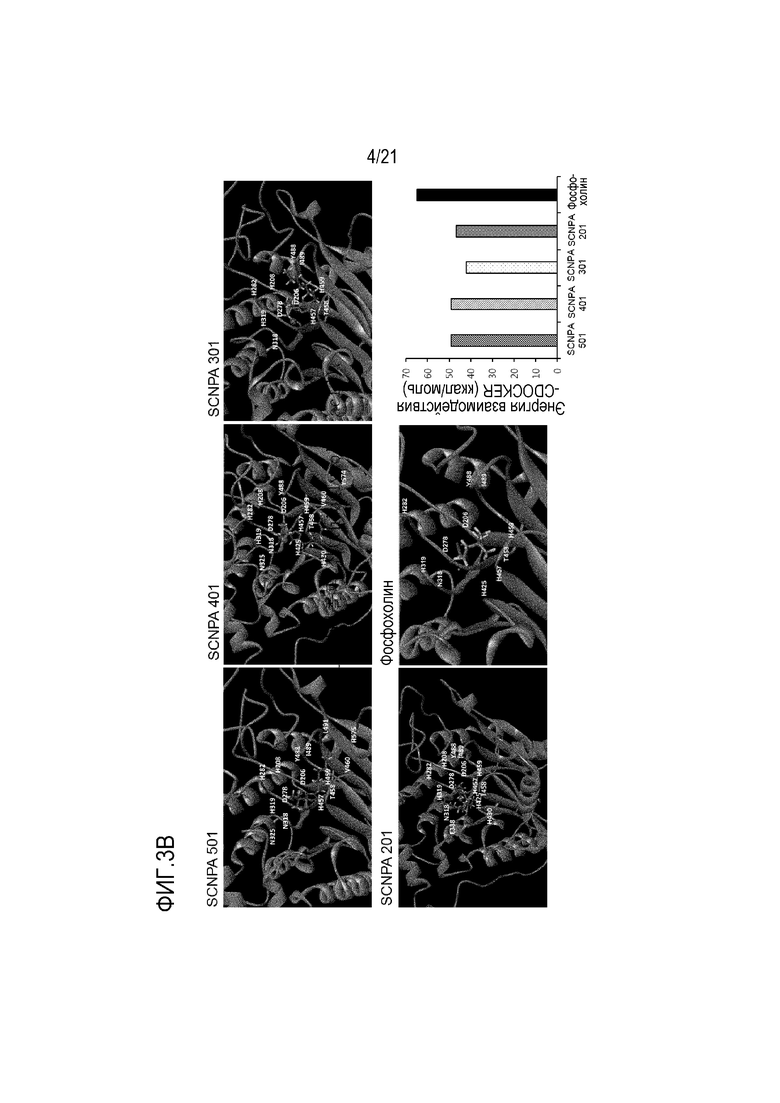
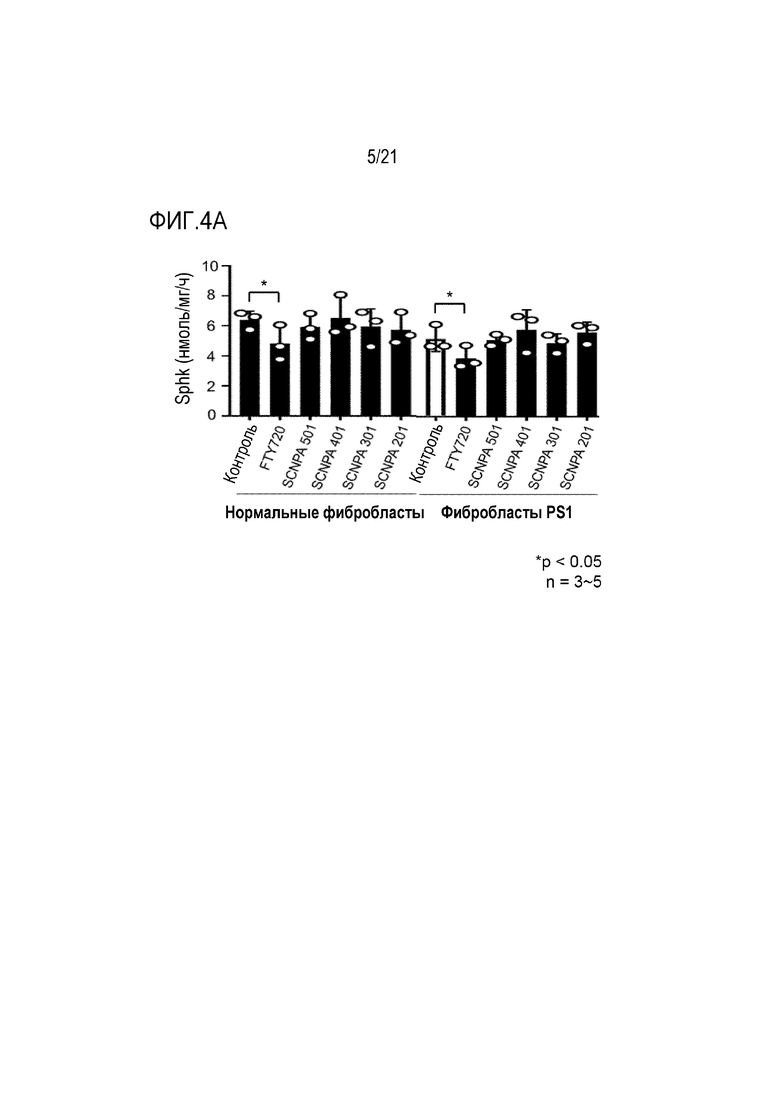
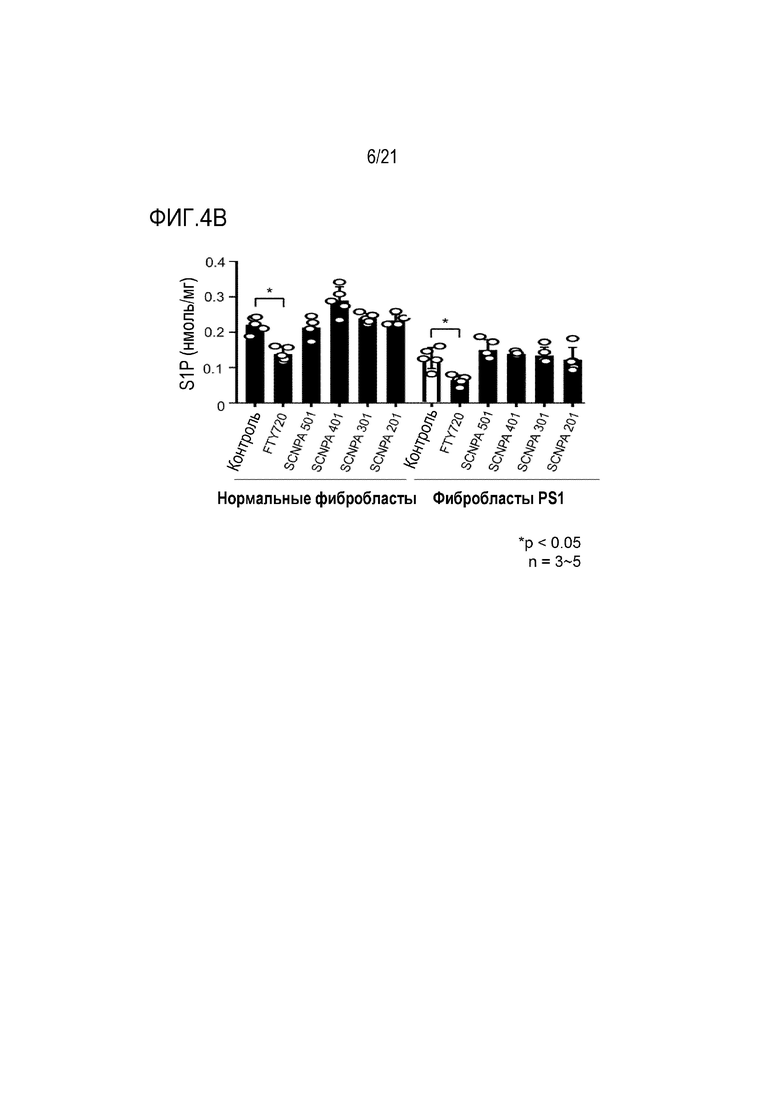
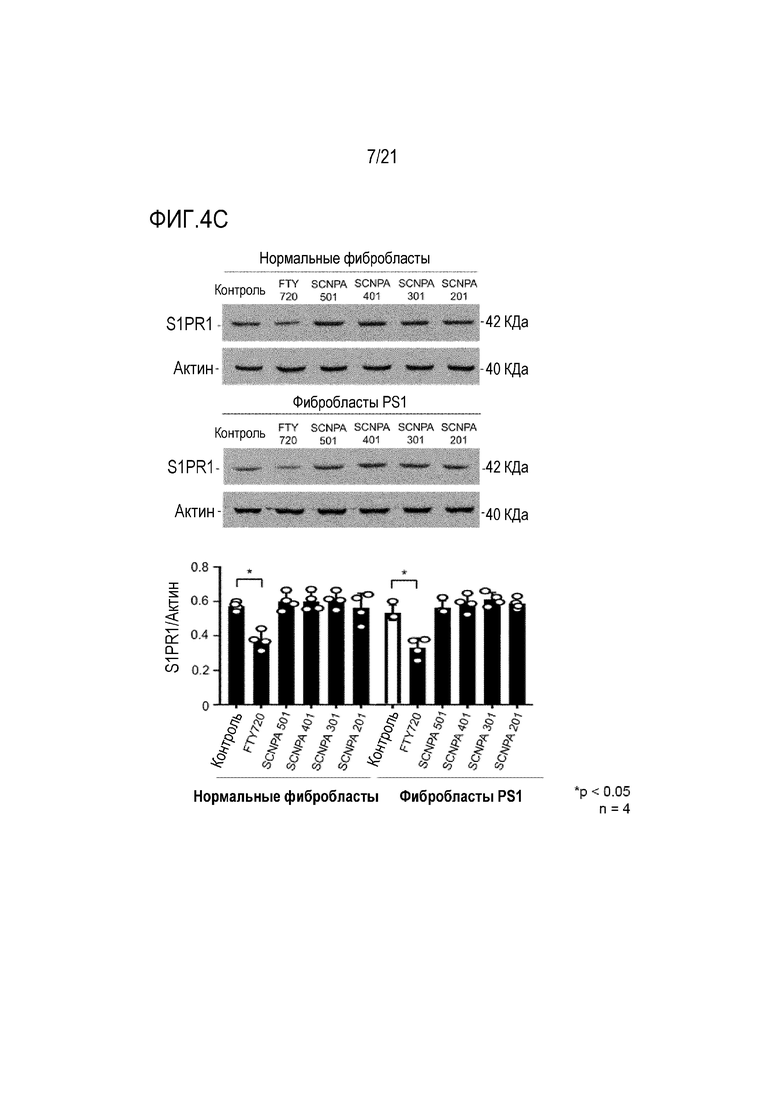
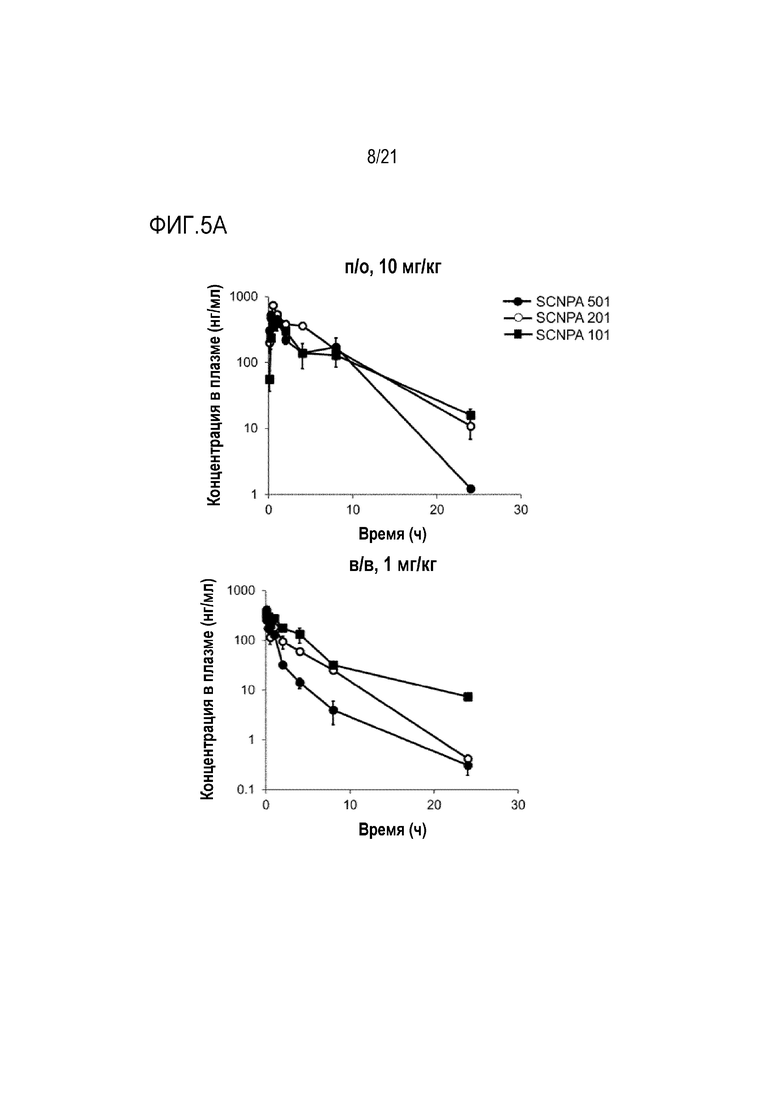

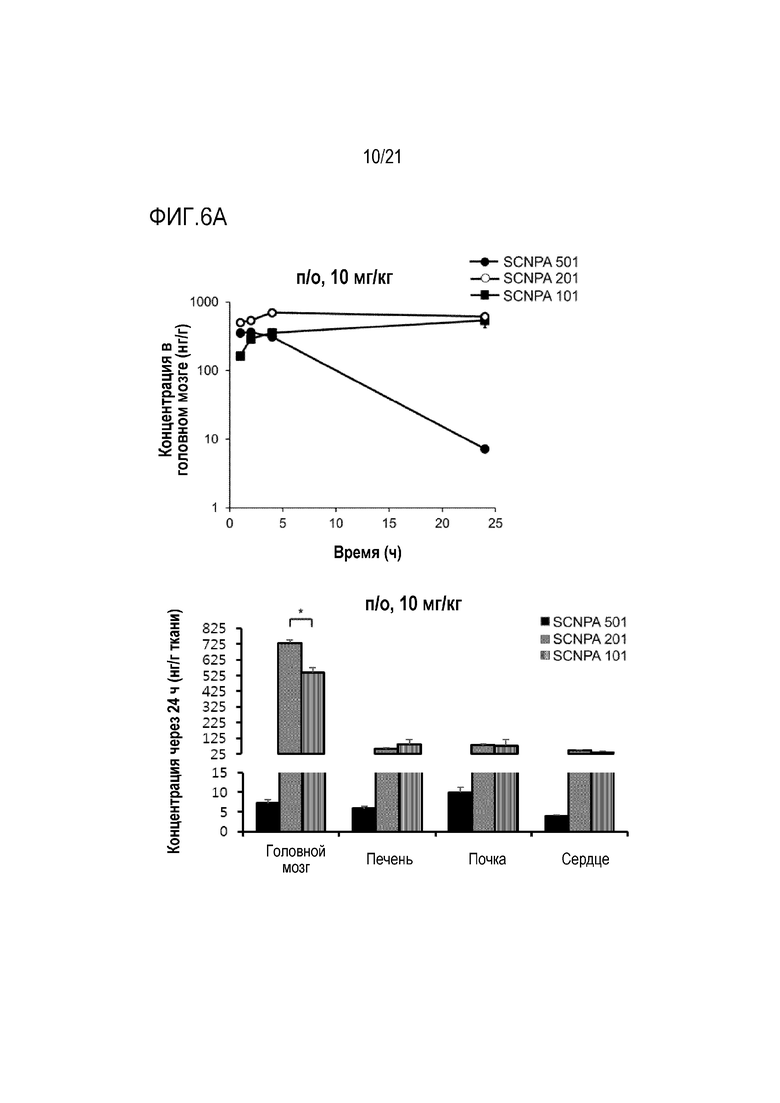
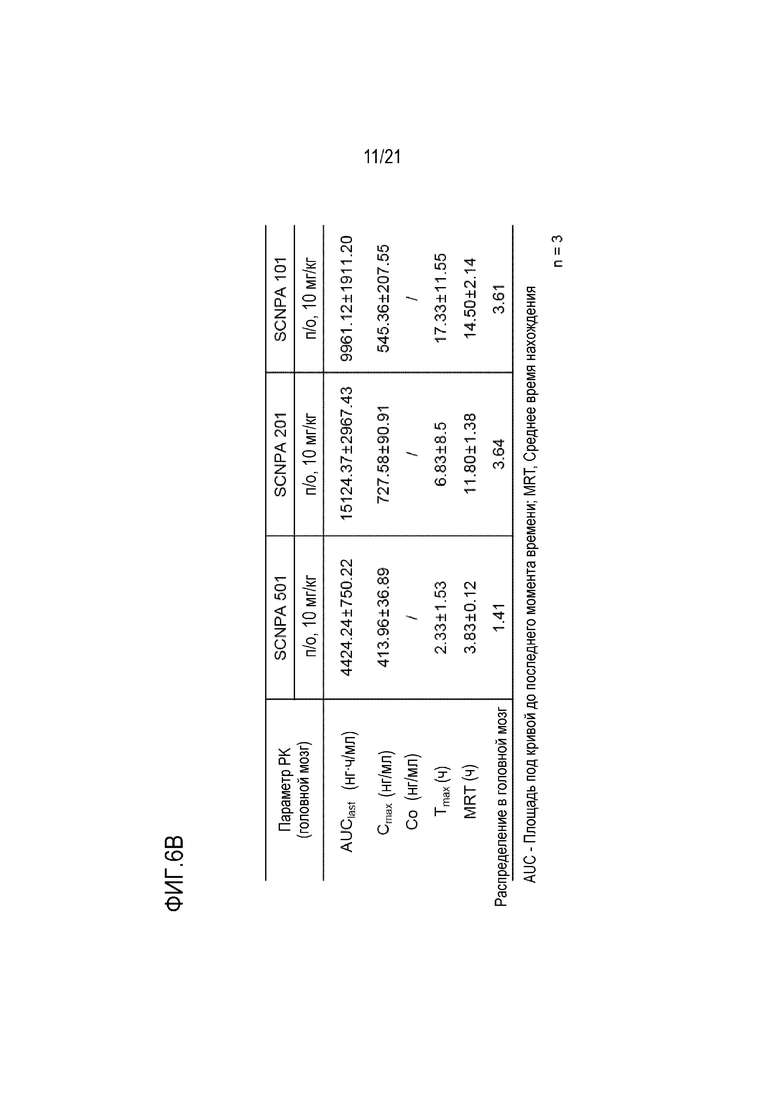
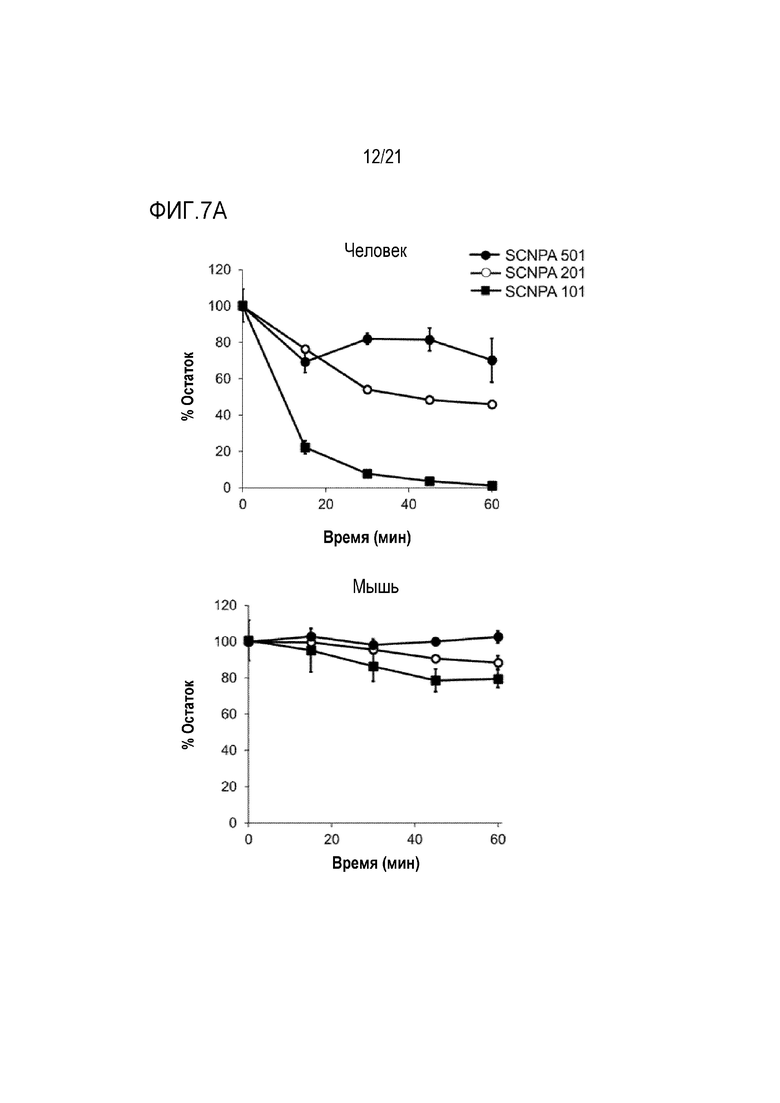
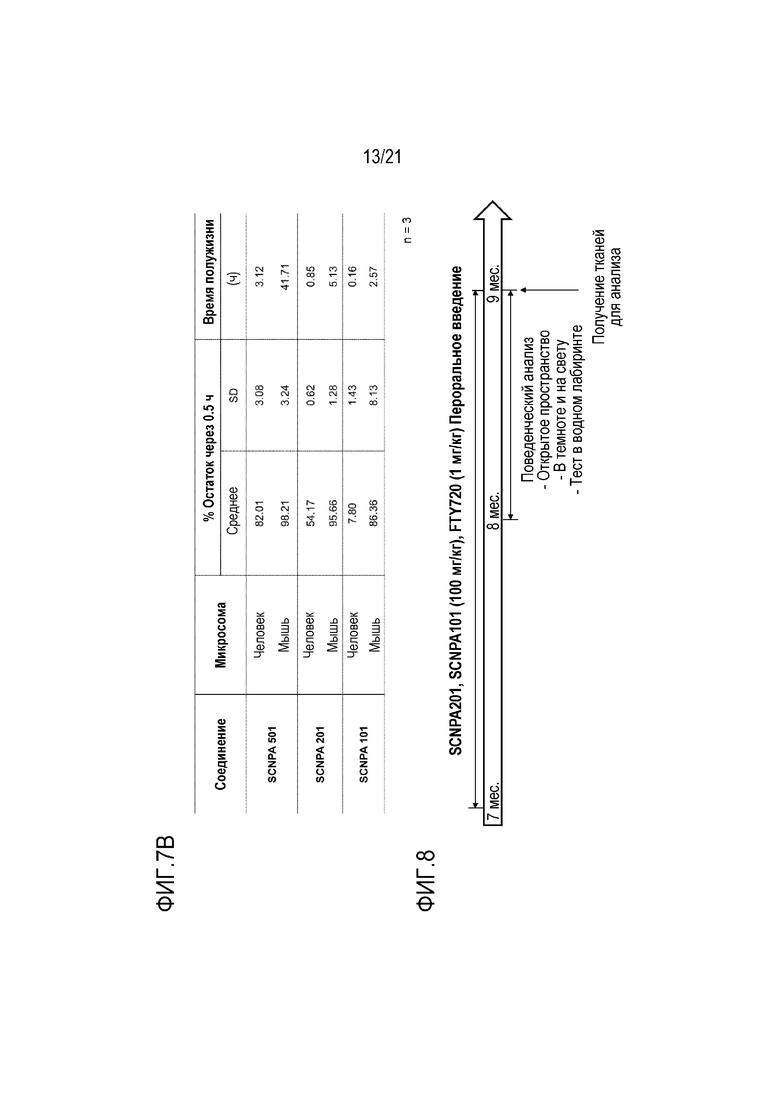
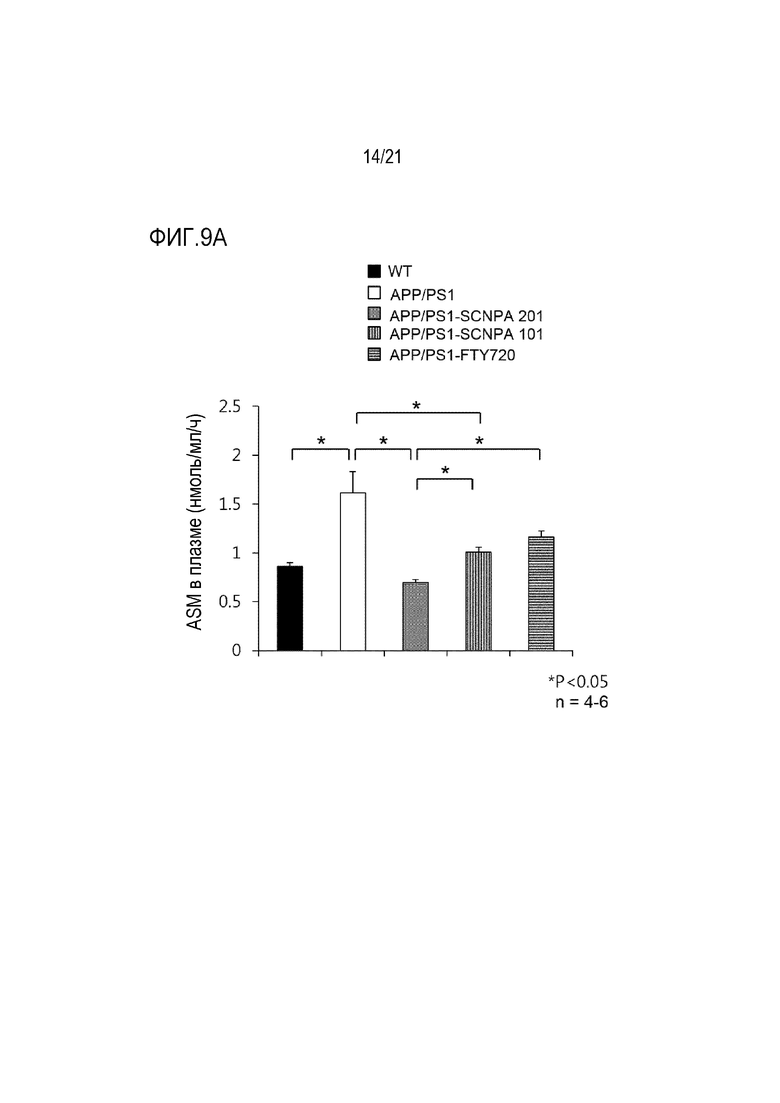
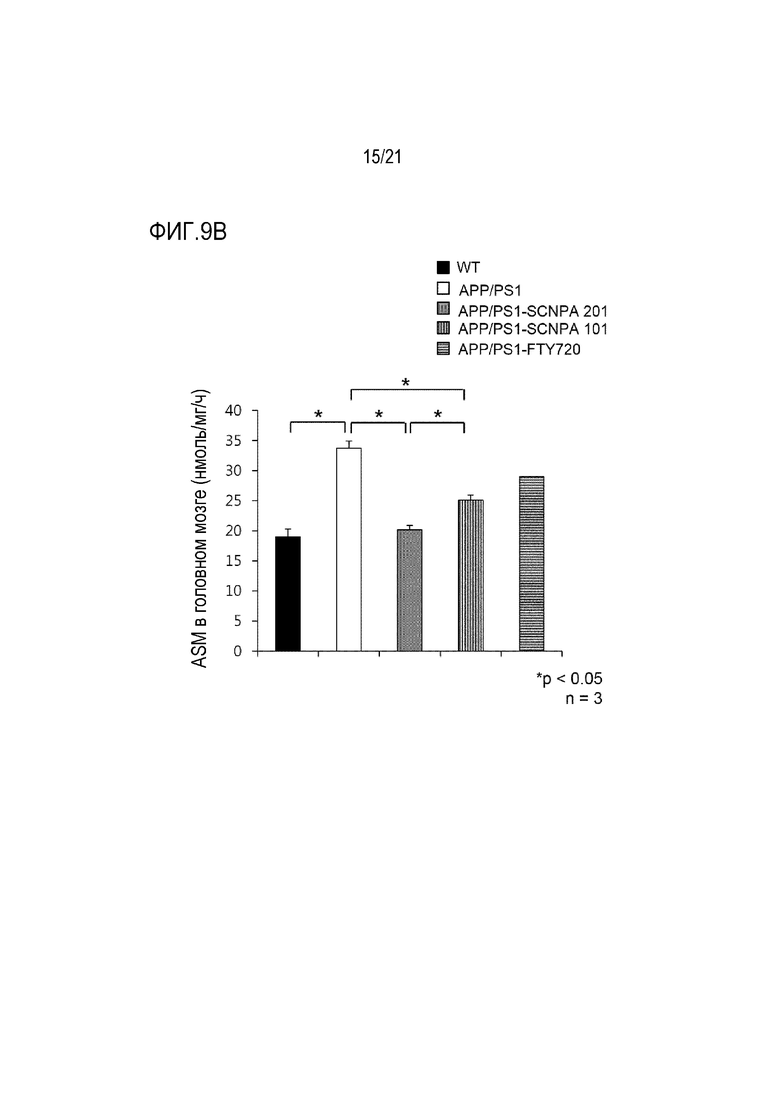
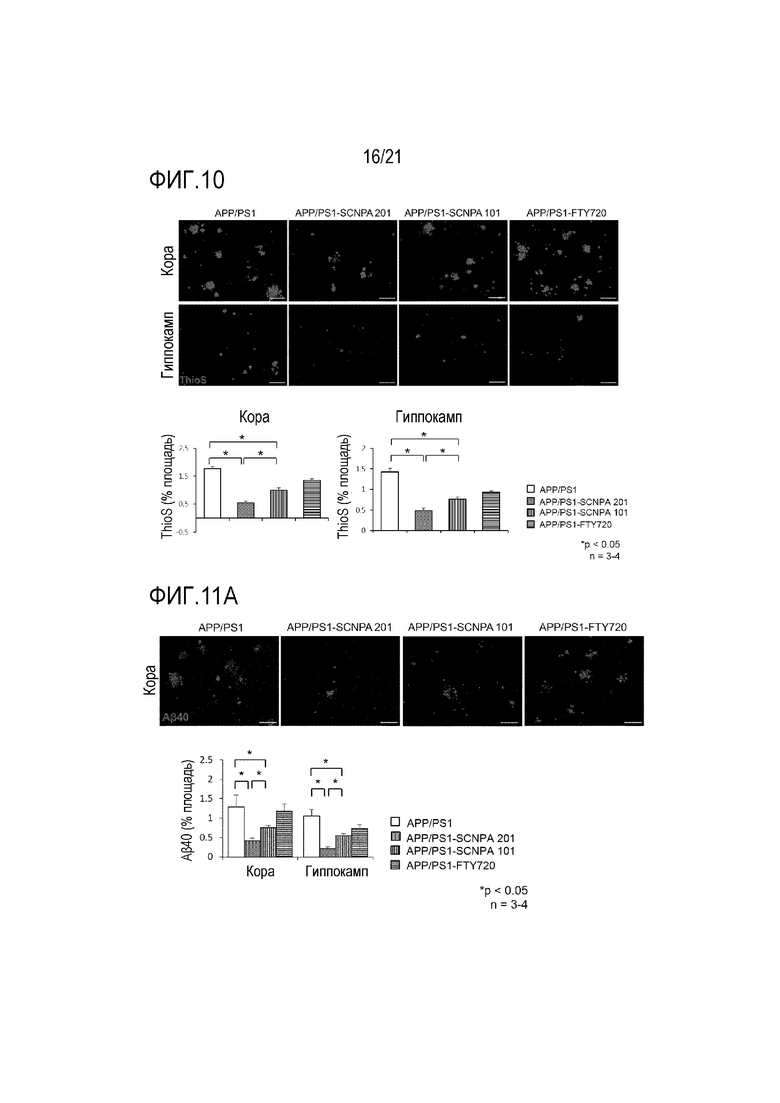
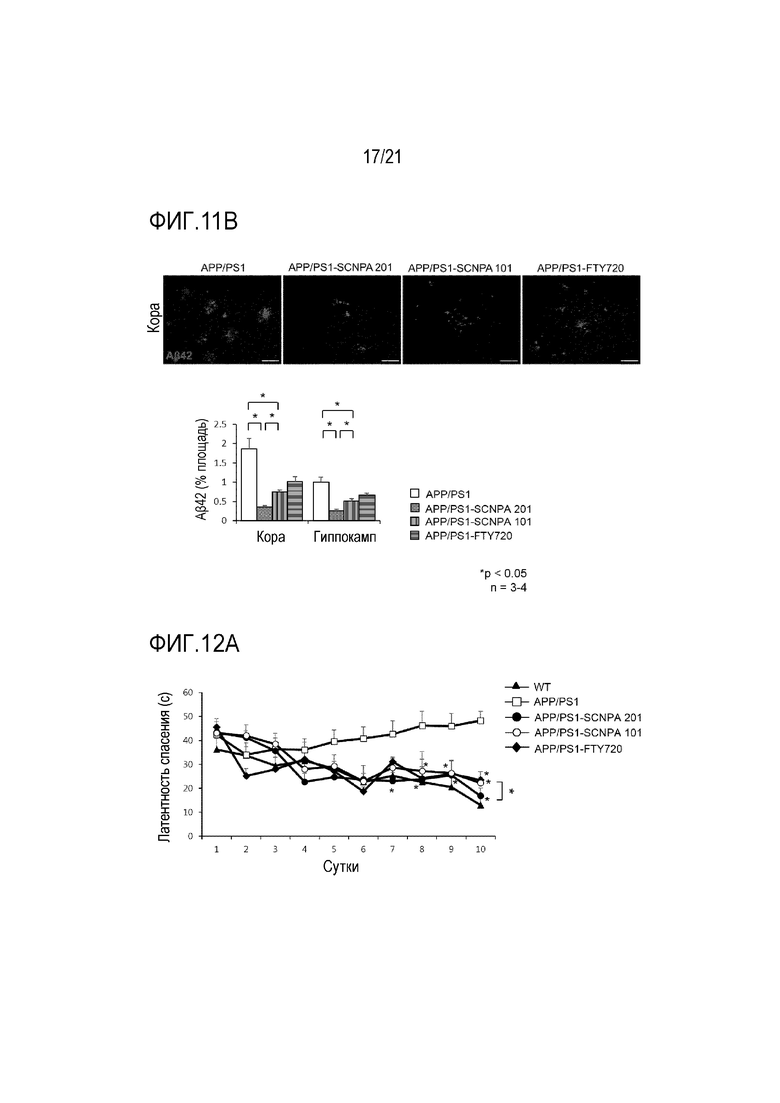
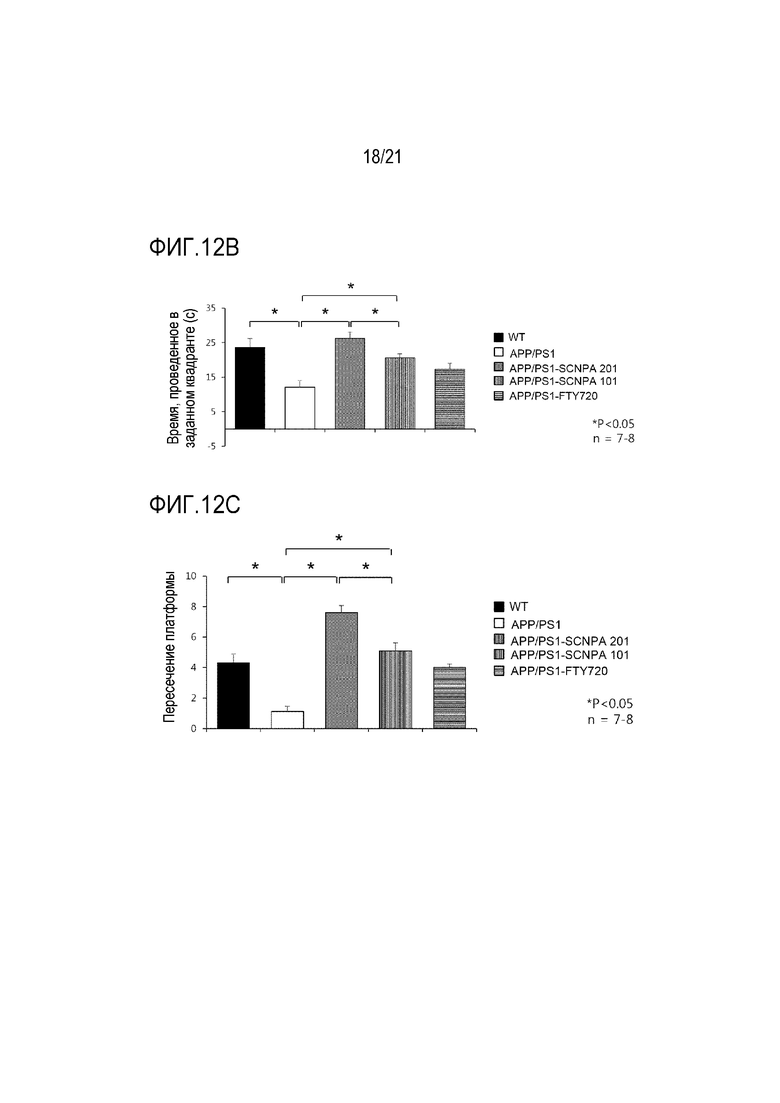
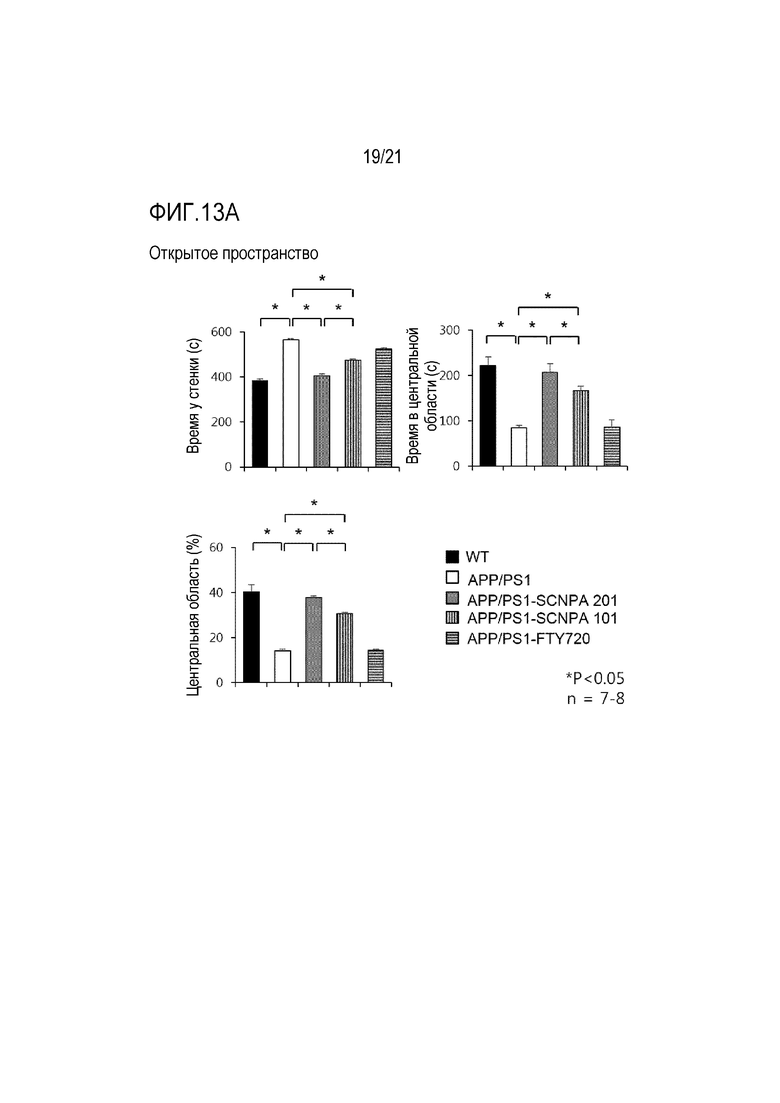
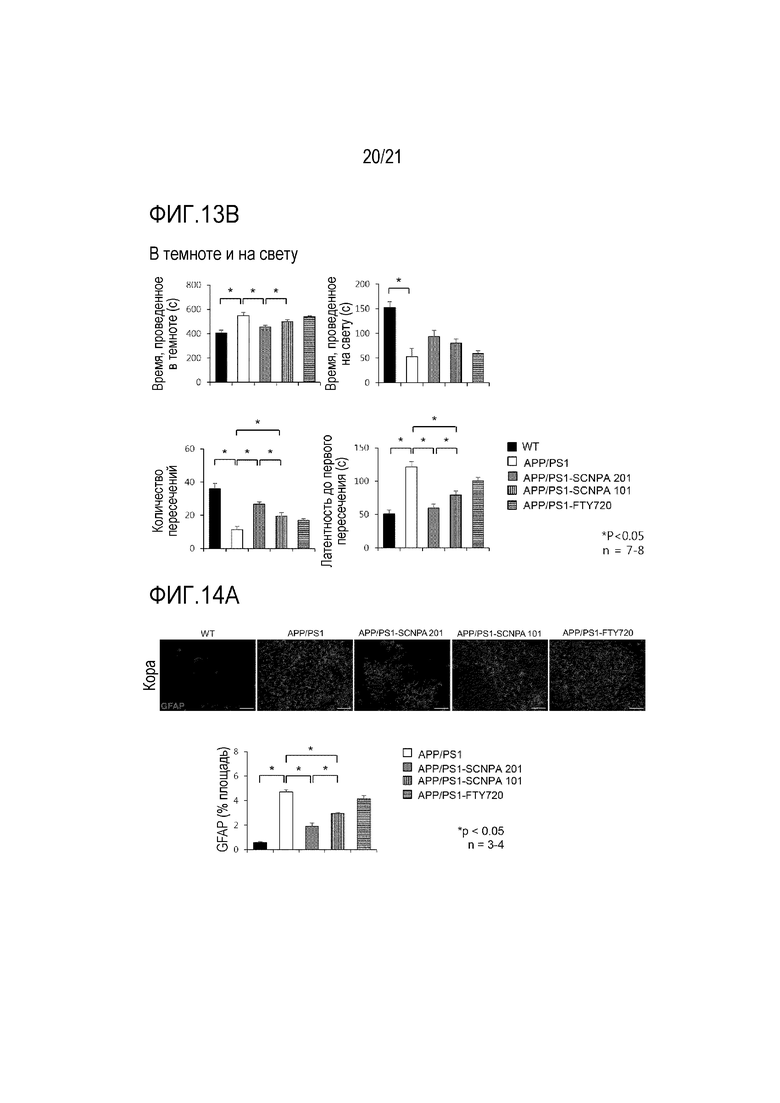

Группа изобретений относится к области фармакологии и медицины, а именно, описано новое соединение, представленное химической формулы 1 или его фармацевтически приемлемая соль: где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода. Кроме того, описано применение соединения химической формулы 1 для получения средства для предупреждения или лечения нейродегенеративного заболевания или депрессии, фармацевтическая и пищевая композиции на основе соединения формулы 1 для предупреждения или лечения нейродегенеративного заболевания или депрессии. Также описан способ предупреждения или лечения нейродегенеративного заболевания или депрессии, включающий введение эффективного количества композиции, содержащей соединение химической формулы 1, и способ диагностики нейродегенеративного заболевания или депрессии, включающий введение эффективного количества композиции, содержащей соединение химической формулы 1 или его фармацевтически приемлемую соль, с которыми связано диагностическое средство или агент детекции, в качестве активного ингредиента, индивидууму с подозрением на нейродегенеративные заболевания или депрессию. Технический результат: получено и описано новое соединение, обладающее эффектом прямого ингибирования активности ASM, демонстрируя превосходный эффект при лечении нейродегенеративных заболеваний и депрессии. 8 н. и 3 з.п. ф-лы, 21 ил., 1 табл.
Формула 1
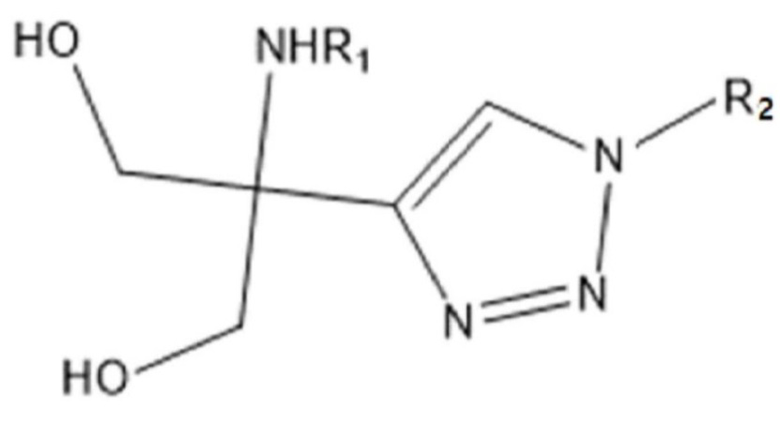
1. Соединение химической формулы 1 или его фармацевтически приемлемая соль:
[Химическая формула 1]
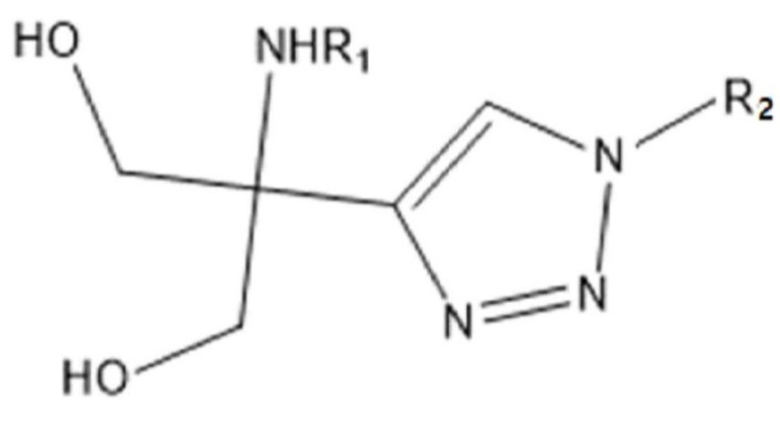
где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода.
2. Фармацевтическая композиция для предупреждения или лечения нейродегенеративного заболевания или депрессии, содержащая эффективное количество соединения химической формулы 1 или его фармацевтически приемлемой соли в качестве активного ингредиента:
[Химическая формула 1]

где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
3. Фармацевтическая композиция по п.2, где соединение химической формулы 1 представляет собой 2-амино-2-(1-гексил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, 2-амино-2-(1-гептил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол, 2-амино-2-(1-октил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол или 2-амино-2-(1-нонил-1H-1,2,3-триазол-4-ил)пропан-1,3-диол.
4. Фармацевтическая композиция по п.2, где соединение химической формулы 1 демонстрирует эффект ингибирования активности кислой сфингомиелиназы (ASM).
5. Фармацевтическая композиция по п.2, где композицию вводят перорально.
6. Пищевая композиция для улучшения при нейродегенеративном заболевании или депрессии, содержащая эффективное количество соединения химической формулы 1 или его фармацевтически приемлемой соли в качестве активного ингредиента:
[Химическая формула 1]

где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
7. Композиция для диагностики нейродегенеративных заболеваний или депрессии, содержащая эффективное количество соединения химической формулы 1 или его фармацевтически приемлемой соли, с которыми связано диагностическое средство или агент детекции, в качестве активного ингредиента:
[Химическая формула 1]

где R1 представляет собой водород, R2 представляет собой алкил из 6-9 атомов углерода, и указанный алкил содержит или не содержит радиоактивный изотоп,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
8. Применение соединения химической формулы 1 или его фармацевтически приемлемой соли для получения средства для предупреждения или лечения нейродегенеративного заболевания или депрессии:
[Химическая формула 1]

где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
9. Способ предупреждения или лечения нейродегенеративного заболевания или депрессии, причем способ включает введение эффективного количества композиции, содержащей соединение химической формулы 1 или его фармацевтически приемлемую соль в качестве активного ингредиента, индивидууму, нуждающемуся в этом:
[Химическая формула 1]

где R1 представляет собой водород, и R2 представляет собой алкил из 6-9 атомов углерода,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
10. Применение соединения химической формулы 1 или его фармацевтически приемлемой соли, с которыми связано диагностическое средство или агент детекции, для получения средства для диагностики нейродегенеративного заболевания или депрессии:
[Химическая формула 1]

где R1 представляет собой водород, R2 представляет собой алкил из 6-9 атомов углерода, и указанный алкил содержит или не содержит радиоактивный изотоп,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
11. Способ диагностики нейродегенеративного заболевания или депрессии, включающий введение эффективного количества композиции, содержащей соединение химической формулы 1 или его фармацевтически приемлемую соль, с которыми связано диагностическое средство или агент детекции, в качестве активного ингредиента, индивидууму с подозрением на нейродегенеративные заболевания или депрессию:
[Химическая формула 1]

где R1 представляет собой водород, R2 представляет собой алкил из 6-9 атомов углерода, и указанный алкил содержит или не содержит радиоактивный изотоп,
где нейродегенеративное заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, болезни Гентингтона, бокового амиотрофического склероза (ALS) и церебральной ишемии.
| EP 3301090 A1, 04.04.2018 | |||
| KR 101811436 B1, 21.12.2017 | |||
| KR 1020170087813 A, 31.07.2017 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| EA 201070588, 29.10.2010.. | |||
Авторы
Даты
2021-11-18—Публикация
2019-04-25—Подача