Область техники
Настоящее изобретение относится к фармацевтической области, а именно, к новым терапевтическим препаратам, применяемых при лечении нейродегенеративных заболеваний.
Уровень техники
Нейродегенеративные заболевания относятся к общей группе заболеваний, вызванных хронической прогрессирующей нейродегенерацией центральной нервной ткани. К таким заболеваниям относятся Болезнь Паркинсона (БП), болезнь Альцгеймера (БА), болезнь Хантингтона (БГ), боковой амиотрофический склероз (БАС) и др.
Болезнь Альцгеймера, также известная как пресенильная деменция, является хроническим прогрессирующим нейродегенеративным заболеванием, характеризующимся прогрессирующим снижением способности к запоминанию, когнитивной дисфункцией и потерей способности к самостоятельному уходу за собой. Из года в год с увеличением числа стареющего населения заболеваемость БА растет, и среди вопросов здравоохранения БА стала самой важной проблемой для беспокойства в обществе.
Патология БА в первую очередь характеризуется наличием амилоидных бляшек и нейрофибриллярных клубков. Амилоидные бляшки являются характерными признаками патологических изменений при болезни Альцгеймера и в основном образуются в результате внеклеточного накопления бета-амилоидного белка (Аβ), который вырабатывается в клетках в аномально большом количестве. В настоящее время существует ряд теорий, которые пытаются объяснить патогенетический механизм амилоидных бляшек. "Гипотеза Аβ", предложенная Харди и Селко, является широко принятой теорией. Эта теория предполагает, что под длительным воздействием сложных генетических и экологических факторов нервные клетки продуцируют аномально большое количество Аβ, которое накапливается с образованием олигомеров и амилоидных бляшек. Через серию каскадных реакций (включая реакцию свободных радикалов, митохондриальное окислительное повреждение, воспалительную реакцию и т.д.), Аβ (в частности, олигомеризованные Аβ) прямо или косвенно воздействуют на нейроны и глиальные клетки, приводя к синаптической дисфункции и повреждению нейронов, а также активируя клетки микроглии и астроцитов, что ускоряет образование нейрофибриллярных клубков и впоследствии приводит к когнитивным нарушениям. В последнее время большое количество исследований предоставляют различные доказательства в поддержку “гипотезы Аβ”, предполагающей центральную роль Аβ в патогенезе болезни Альцгеймера.
Болезнь Паркинсона - это распространенное нейродегенеративное заболевание. Клинически оно в основном проявляется такими симптомами как: замедленная реакция, тремор, скованность тела и дальнейший дисбаланс. Исследования на мозговой ткани пациентов с БП показали, что у пациентов с этим заболеванием наблюдалась утрата дофаминергических нейронов в черной субстанции головного мозга. Тельца Леви являются одним из опознавательных признаков дегенерации нейронов при болезни Паркинсона. Исследования показали, что тела Леви образуются в тканях головного мозга пациентов с различными нейродегенеративными заболеваниями, в том числе болезнью Альцгеймера, болезнью Паркинсона, ДЛБ-болезнью (деменцией с тельцами Леви) и др. Кроме того, некоторые результаты исследований подтверждают, что трансплантация нервных стволовых клеток может способствовать лечению болезни Хантингтона и бокового амиотрофического склероза.
В головном мозге млекопитающих пролиферация и самообновление нервных стволовых клеток (нейральных клеток-предшественников, NPC) продолжаются на протяжении всей жизни, это необходимо для нейрогенеза. В условиях старения, длительного стресса и заболеваний нервной системы, таких как болезнь Альцгеймера (БА), способность нейронных стволовых клеток к пролиферации и самообновлению снижается, что приводит к нарушению когнитивных функций. Стимулирование нейрорегенерации считается потенциальным методом лечения нейродегенеративных заболеваний связанных со старением. Поэтому одним из возможных решений является трансплантация эмбриональных нейронных стволовых клеток или нейронных стволовых клеток, индуцированных in vitro, для клеточной заместительной терапии. Однако до сих пор существуют некоторые разногласия по поводу этой новой сложной технологии, особенно по вопросам безопасности, источникам этих клеток и т.д. Другим решением для достижения цели при лечении нейродегенеративного заболевания является активация эндогенных нервных стволовых клеток с помощью фармакологических средств. Фармакологические средства просты в эксплуатации и могут специфически воздействовать на определенные функции нервных стволовых клеток, и поэтому активация эндогенных нервных стволовых клеток является не только целесообразным подходом к лечению, но и может быть использована в качестве профилактического подхода. Однако специалистам в этой области все еще необходимо найти подходящее лекарственное средство, которое может лучше преодолевать барьеры in-vivo для эффективной активации эндогенных нервных стволовых клеток, чтобы добиться эффективного лечения.
Область настоящего изобретения
Задача настоящего изобретения заключается в обеспечении новых терапевтических препаратов для лечения нейродегенеративных заболеваний и их применении.
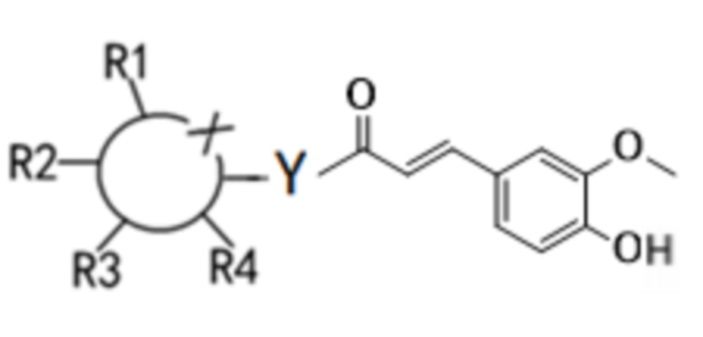
Согласно первому аспекту настоящего изобретения предложено соединение формулы (I) или его изомер, сольват или предшественник, или их фармацевтически приемлемые соли,
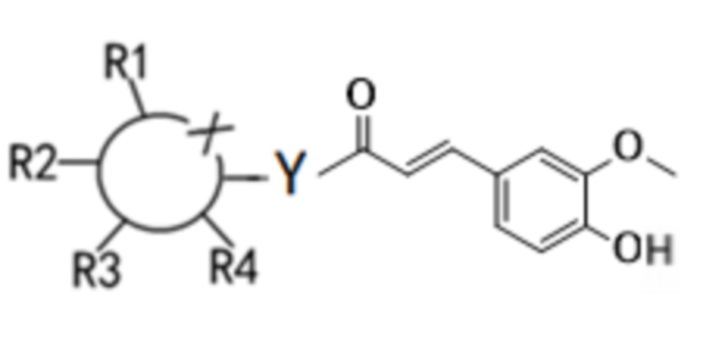
(I)
где  - шестичленное гетероциклическое кольцо, и X представляет собой O;
- шестичленное гетероциклическое кольцо, и X представляет собой O;
Y независимо выбирают из O и N;
когда Y представляет собой O, соединение находится в конфигурации β или представляет собой смесь конфигураций α и β в любом соотношении; и когда Y представляет N, соединение находится в конфигурации α, конфигурации β или представляет собой смесь конфигураций α и β в любом соотношении.
Каждый из R1-R4 независимо выбирают из водорода, гидроксила, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила и галогена, или из две смежные группы из R1-R4 связаны друг с другом с образованием кольцевой структуры совместно с основным кольцом.
В предпочтительном варианте осуществления в соединении формулы (I) или его изомере, сольвате или предшественнике или их фармацевтически приемлемых солях каждый из R1-R4 независимо выбирают из водорода, гидроксила и алкила C1-C2.
В другом предпочтительном варианте осуществления соединение представляет собой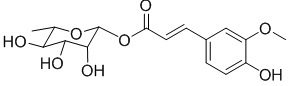 .
.
В другом предпочтительном варианте осуществления соединение представляет собой 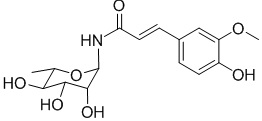 .
.
В другом предпочтительном варианте осуществления соединение представляет собой 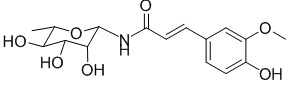 .
.
В другом предпочтительном варианте осуществления соединение не представляет собой 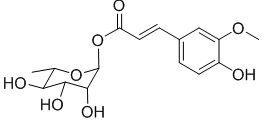 .
.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или изомера, сольвата или его предшественника, или их фармацевтически приемлемых солей для получения лекарственного средства или лекарственного средства в виде набора для профилактики, облегчения или лечения нейродегенеративных заболеваний, депрессии или инсульта.
В предпочтительном варианте осуществления нейродегенеративными заболеваниями являются:
нейродегенеративные заболевания, характеризующиеся возникновением нейровоспаления в головном мозге; или
нейродегенеративные заболевания, характеризующиеся значительным увеличением синтезируемого Аβ; или
нейродегенеративные заболевания, характеризующиеся значительным снижением способности к обучению и запоминанию; или
нейродегенеративные заболевания, характеризующиеся снижением функционирования нервных стволовых клеток; или
нейродегенеративные заболевания, характеризующиеся снижением координационной способности движений; или
нейродегенеративные заболевания, характеризующиеся снижением количества дофаминергических нейронов в черной субстанции; или
нейродегенеративные заболевания характеризуются снижением уровня стриатальных дофаминергических нервных волокон.
В другом предпочтительном варианте осуществления возникновение нейровоспаления в головном мозге характеризуется значительным повышением экспрессии воспалительных факторов; воспалительными факторами являются, например, TNF-α и IL-1β.
В другом предпочтительном варианте осуществления, нейродегенеративные заболевания включают болезнь Альцгеймера, Болезнь Паркинсона, деменцию с тельцами Леви (DLB), болезнь Хантингтона и боковой амиотрофический склероз.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или изомера, сольвата или его предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для ингибирования нейровоспаления.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для улучшения функционирования нервных стволовых клеток.
В другом аспекте настоящее изобретение относится применению соединения формулы (I) или изомера, сольвата или его предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для снижения синтеза Aβ.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или изомера, сольвата или его предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для увеличения числа дофаминергических нейронов в черной субстанции.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для повышения уровня стриатальных дофаминергических нервных волокон.
В другом предпочтительном варианте осуществления соединение представляет собой:
 , также известный как PL201;
, также известный как PL201;
 , также известный как PL202;
, также известный как PL202;
 , также известный как PL172; и
, также известный как PL172; и
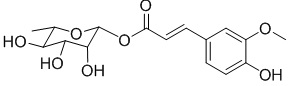
 , также известный как PL171.
, также известный как PL171.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей: соединение формулы (I) или его изомер, сольват или предшественник, или их фармацевтически приемлемые соли; и фармацевтически приемлемый носитель.
В предпочтительном варианте осуществления соединение формулы (I) или изомер, сольват или его предшественник, или их фармацевтически приемлемые соли находятся в эффективном количестве в фармацевтической композиции; предпочтительно, эффективное количество составляет 0,01% -50% по массе, например, но не ограничиваясь этим, 0,01%-5%, 0,03%-3%, 0,05%-1%, 20%-30%, и 40%-50% по массе; особенно предпочтительно 0,03%-30% по массе; в частности, 0,05%-10% по массе.
В другом аспекте настоящего изобретения лекарственная форма указанной фармацевтической композиции представляет собой порошок, пульву, таблетку, капсулу, препарат замедленного высвобождения, препарат контролируемого высвобождения, инъекцию, инфузионную жидкость и суспензию.
В другом аспекте настоящее изобретение относится к лекарственному средству в виде набора, содержащего: соединение формулы (I) или его изомер, сольват или предшественник, или их фармацевтически приемлемые соли; или фармацевтическую композицию.
В другом аспекте настоящее изобретение относится к способу профилактики, облегчения или лечения нейродегенеративных заболеваний, депрессии или инсульта, включающему введение нуждающемуся субъекту эффективного количества соединения формулы (I) или его изомера, сольвата или предшественника или их фармацевтически приемлемых солей.
В другом аспекте настоящее изобретение относится к способу получения соединения формулы III, IV или V, включающему стадию: взаимодействия β-рамнозида, α-1-аминорамнозида или β - 1-аминорамнозида с тетрабутиламмонийфторидом соответственно для получения соединений формул III - V имеющих следующие структуры:



В другом предпочтительном варианте осуществления β-рамнозид получают взаимодействием 2,3,4-O-триацетилрамнозы с ацилхлоридом (4-О-трет-бутилдиметилсилил) - феруловой кислоты.
В другом предпочтительном варианте осуществления α-1-аминорамнозид и/или β-1-аминорамнозид получают взаимодействием 2,3,4-о-триацетил-1-аминорамнозы с ацилхлоридом (4-О-трет-бутилдиметилсилил)-феруловой кислоты.
Другие аспекты настоящего изобретения будут очевидны для специалистов данной области техники с учетом настоящего раскрытия.
Краткое описание чертежей
Фиг. 1. PL201 улучшает показатель теста мыши с БА в водном лабиринте Морриса.
Фиг. 2. PL201 способствует нейрогенезу in vivo.
Фиг. 3. PL201 облегчает ингибирование Aβ при пролиферации нервных стволовых клеток in vitro.
Фиг. 4. PL201 ингибирует нейровоспаления.
Фиг. 5. PL201 уменьшает количество Аβ-бляшек in vivo.
Фиг. 6. PL201 снижает синтез Аβ in vitro.
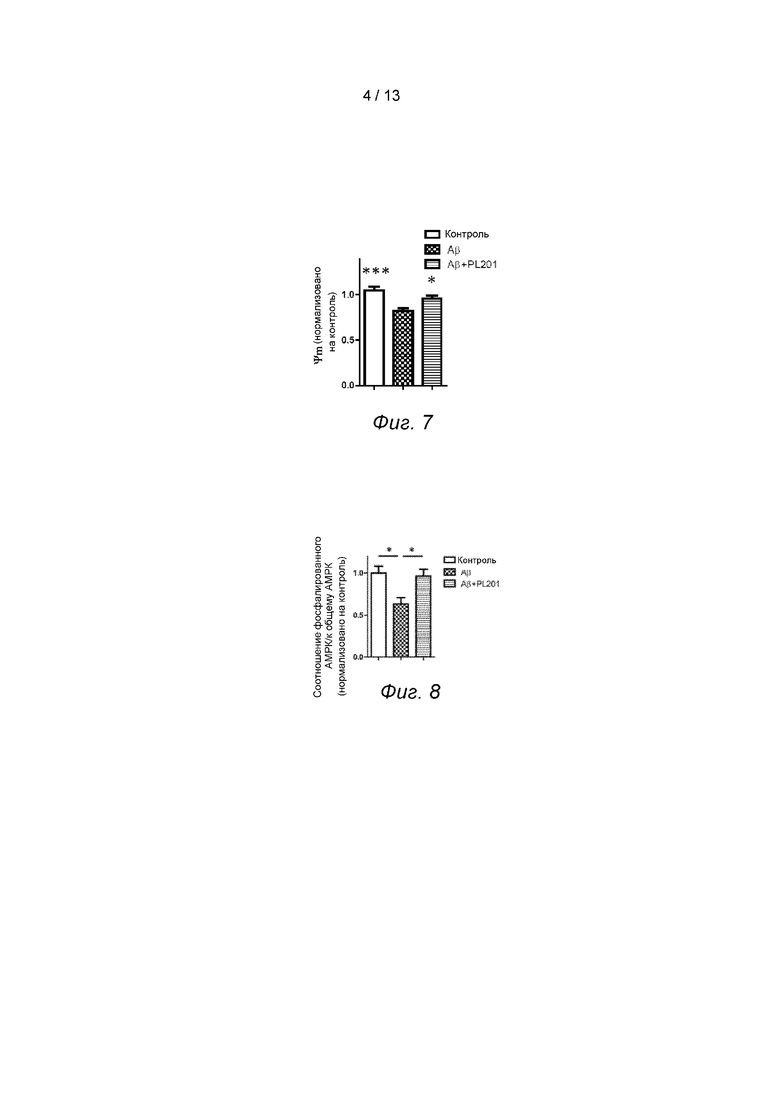
Фиг. 7. PL201 увеличивает потенциал митохондриальной мембраны.
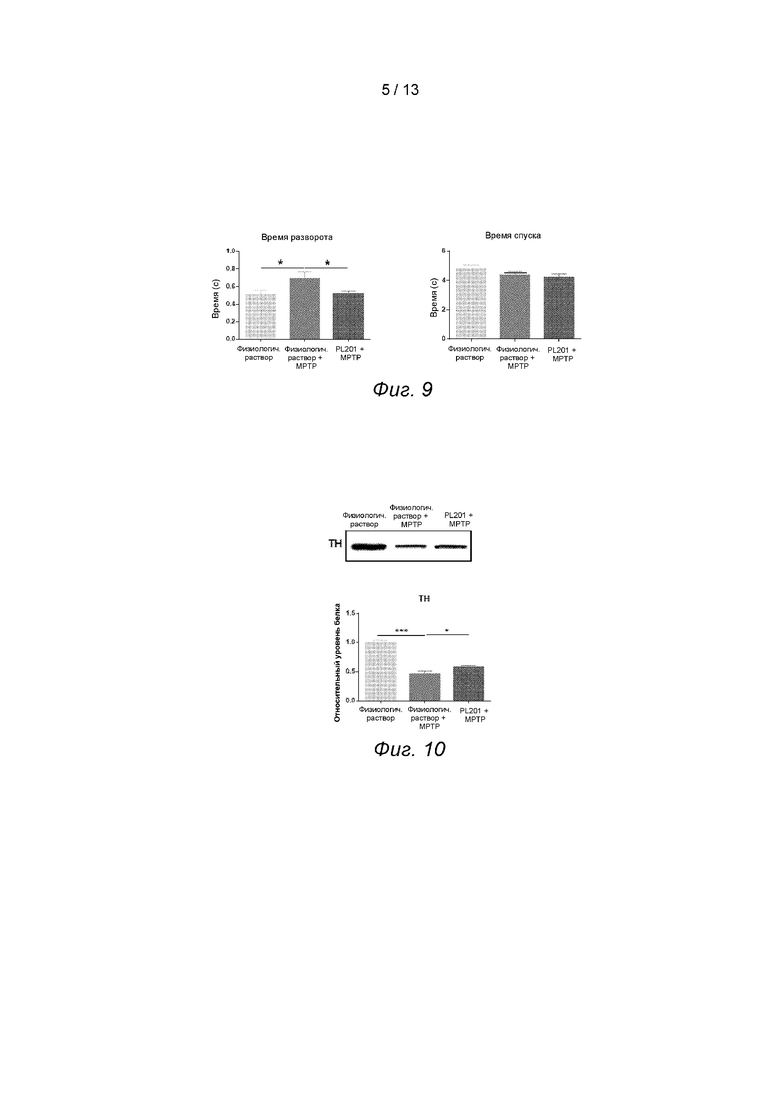
Фиг. 8. PL201 улучшает уровень фосфорилирования AMPK.
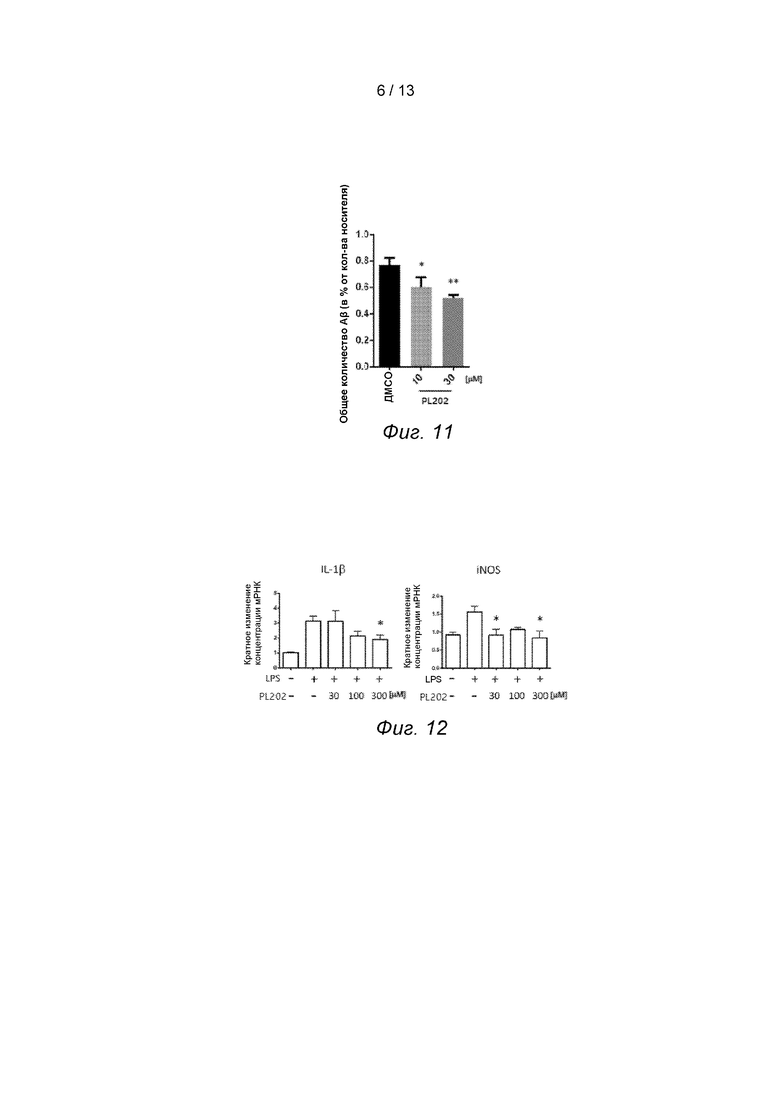
Фиг. 9. PL201 улучшает исполнение мышей в тесте при восхождении на шест.
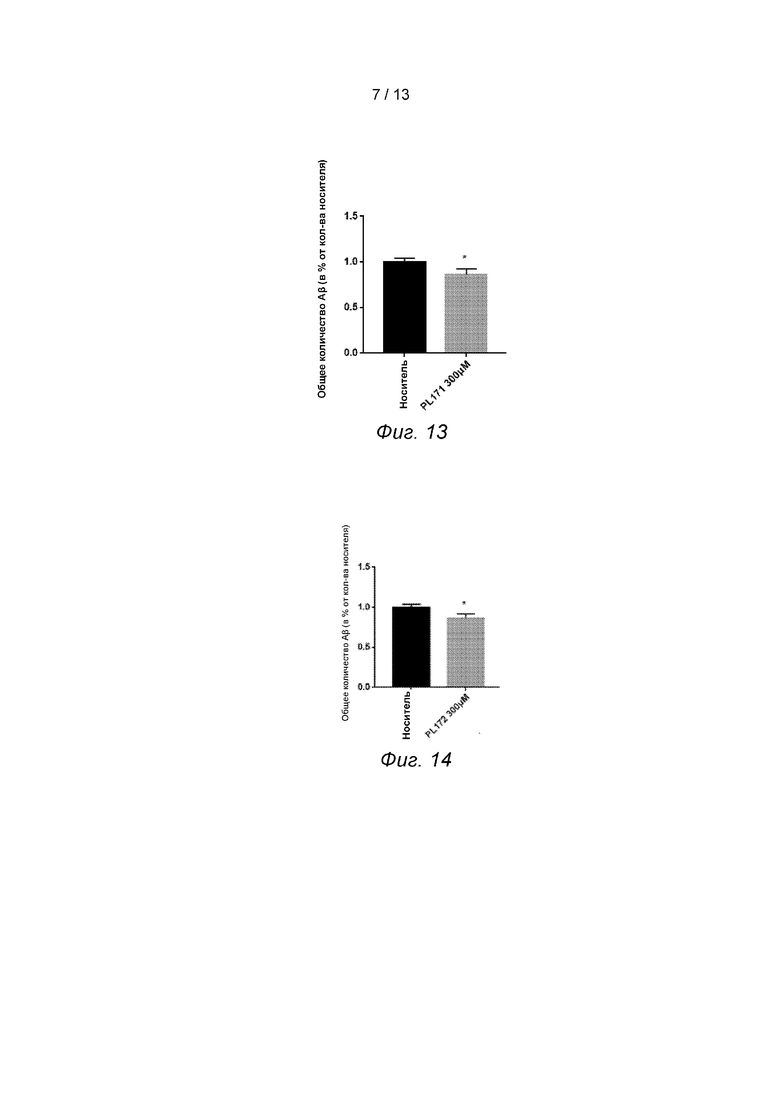
Фиг. 10. PL201 повышает уровень стриатальных дофаминергических нервных волокон.
Фиг. 11. PL202 снижает синтез Аβ.
Фиг. 12. PL202 снижает экспрессию воспалительных факторов IL-1β и iNOS.
Фиг. 13. PL171 снижает синтез Аβ.
Фиг. 14. PL172 снижает синтез Аβ.
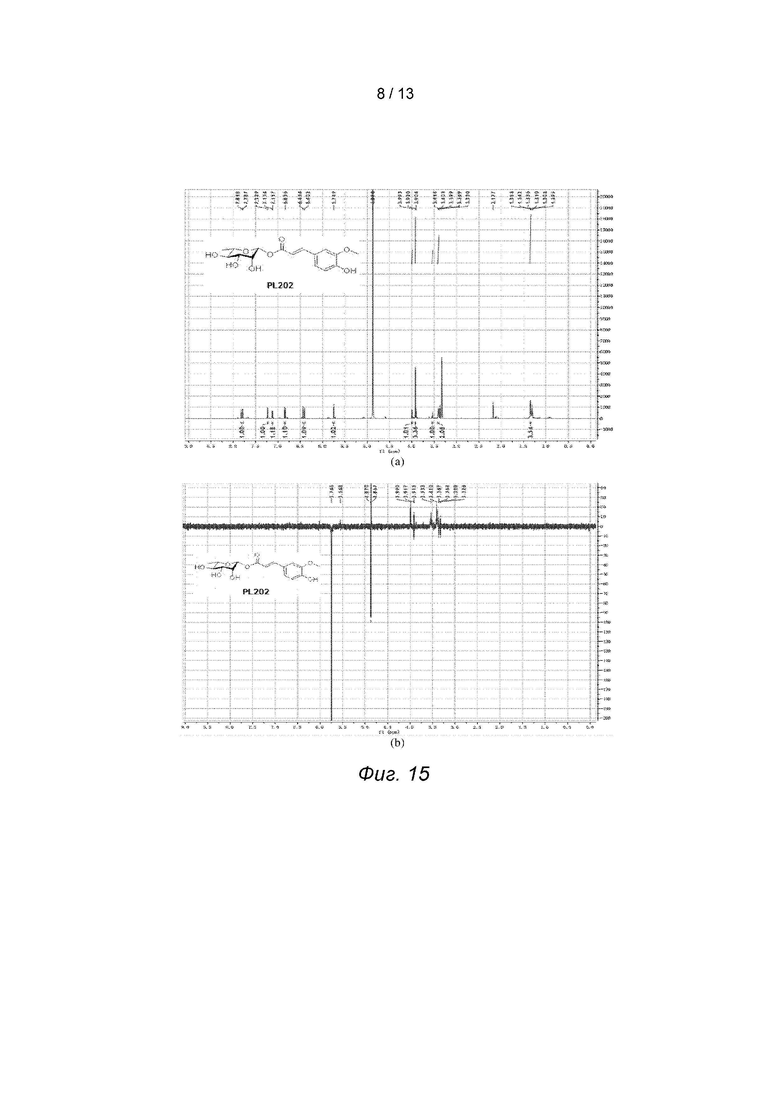
Фиг. 15 иллюстрируют спектры ядерного магнитного резонанса и 1D NOE для PL202, где на фиг. (а) показан спектр ядерного магнитного резонанса и фиг (б) спектра 1D NOE.
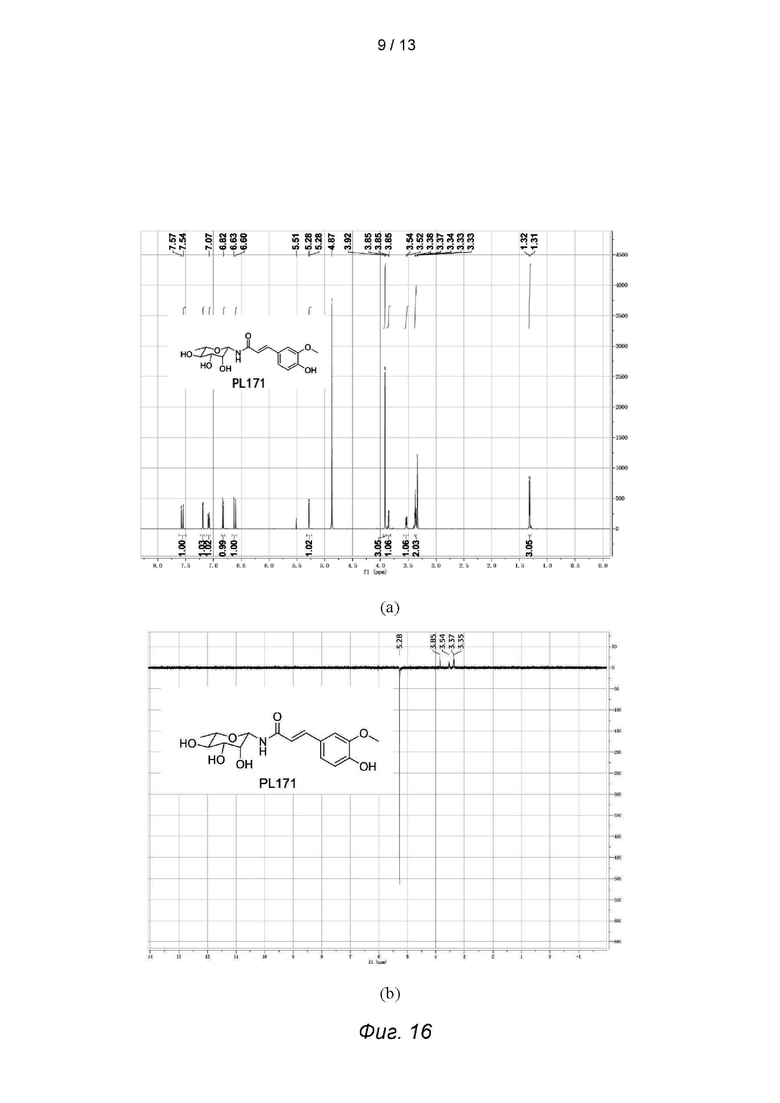
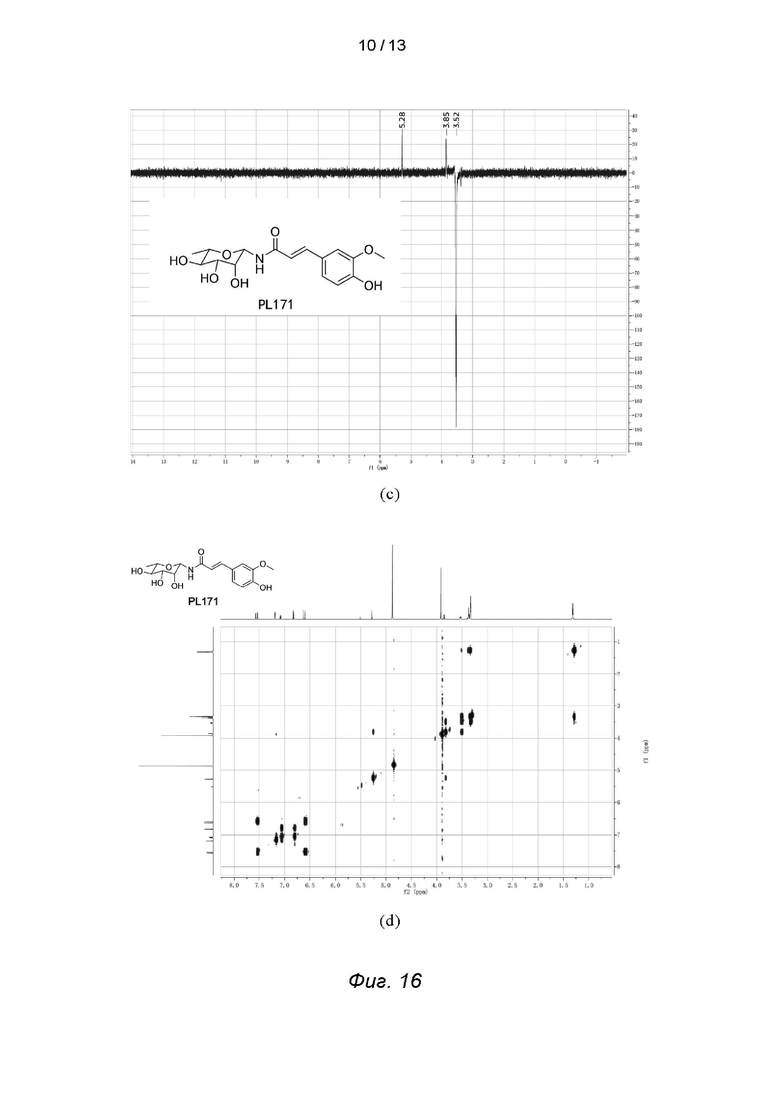
Фиг. 16 - иллюстрирует спектр ядерного магнитного резонанса, 1D NOE спектр и 1h-1H COSY спектр PL171, где на фиг. (а) представлен спектр ядерного магнитного резонанса, на фиг. (б) и (в) - спектры 1D NOE, а на фиг. (г) - спектр 1H-1H COSY.
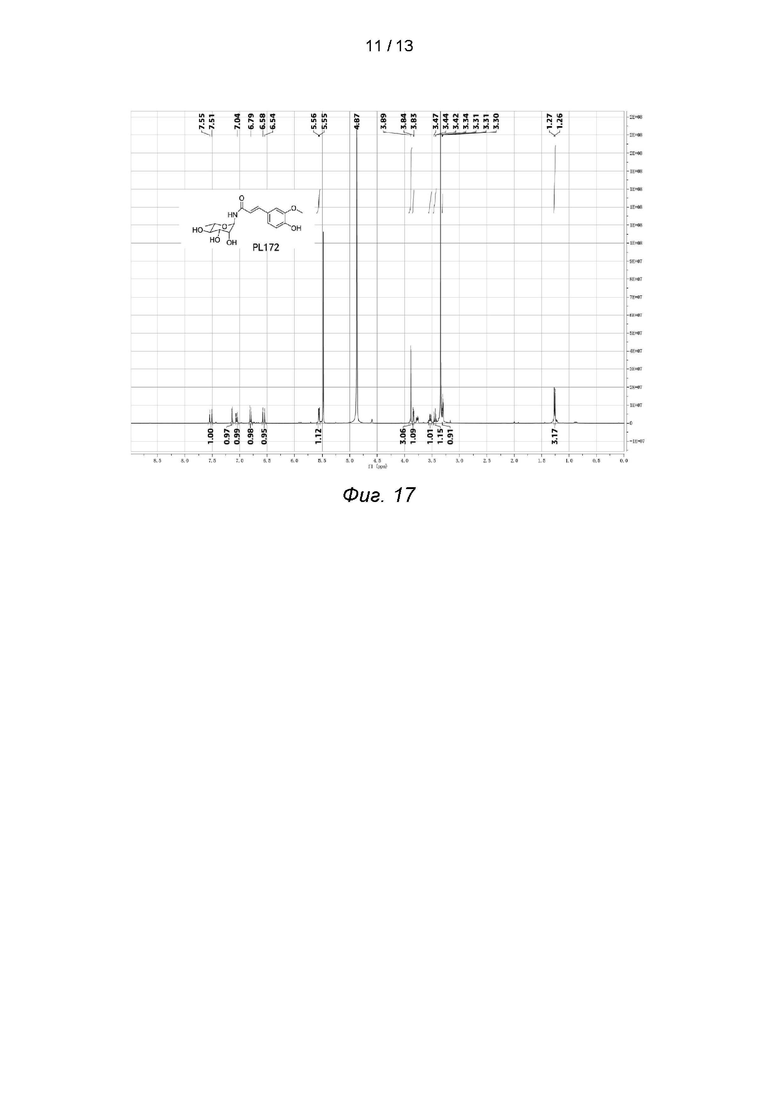
Фиг. 17 иллюстрирует спектр ядерного магнитного резонанса PL172.
Фиг. 18 - иллюстрирует TH диаграмму окрашивания черной субстанции, фиг. (а) - для H2O + NS, фиг. (б) - для PL201 + NS, фиг. (в) - для H2O + MPTP и фиг. (г) - для PL201 + MPTP.
Подробное описание предпочтительного варианта реализации изобретения
В результате проведения широких исследований авторы настоящего изобретения обнаружили, что соединение формулы (I) может существенно облегчить симптомы нейродегенеративных заболеваний. Как в экспериментах in vitro, так и в in vivo соединение формулы (I) может эффективно усиливать функционирование нервных стволовых клеток. Соединение формулы (I) может не только предотвратить заболевание, но также может быть применено в рамках лечебного подхода для улучшения нейрорегенерации для борьбы с когнитивным упадком, связанным с процессами старения или нейродегенеративным заболеванием.
Термины
В настоящей заявке термин "алкил", используемый здесь, относится к линейным или разветвленным, насыщенным алифатическим углеводородным группам, содержащим от 1 до 4 атомов углерода (предпочтительно от 1 до 2 атомов углерода). Например, алкил помимо прочих включает метил, этил, n-пропил, изопропил, n-бутил, изобутил и Т-бутил.
Термин "алкенил", используемый здесь, включает линейные или разветвленные углеводородные группы, содержащие по меньшей мере одну углерод-углеродную двойную связь и 2-4 атома углерода (предпочтительно 2-3 атома углерода).
Термин "алкинил", используемый здесь, включает линейные или разветвленные углеводородные группы, содержащие по меньшей мере одну тройную связь углерод-углерод и 2-4 атома углерода (предпочтительно 2-3 атома углерода).
Термин " галоген”, используемый здесь, относится к F, Cl, Br или I.
Термин "изомер", используемый здесь, включает геометрический изомер, энантиомеры и диастереомеры (такие как цис-транс-изомер и конформационный изомер).
Используемый здесь способ выражения “ ” хорошо известен специалисту в данной области, он представляет собой один гетероцикл, имеющий атом X. В предпочтительном варианте осуществления настоящего изобретения “
” хорошо известен специалисту в данной области, он представляет собой один гетероцикл, имеющий атом X. В предпочтительном варианте осуществления настоящего изобретения “ ” представляет собой шестичленное гетероциклическое кольцо.
” представляет собой шестичленное гетероциклическое кольцо.
Специалисту в данной области хорошо известен используемый здесь способ выражения “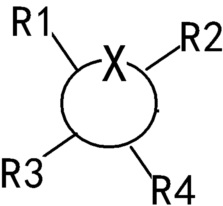 "или”
"или” 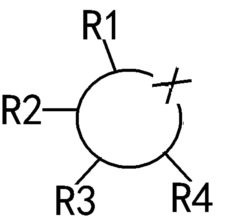 ", который представляет кольцо с любым одним или несколькими положениями, которые могут быть замещены необязательными заместителями R1-R4. Более того, замещение может быть разным в разных позициях замещения.
", который представляет кольцо с любым одним или несколькими положениями, которые могут быть замещены необязательными заместителями R1-R4. Более того, замещение может быть разным в разных позициях замещения.
Термин "сольват", в настоящей заявке, представляет собой соединение, несущее молекулу растворителя, например, сольват может быть гидратом.
В настоящем изобретении термин "содержит/содержащий/содержащийся" означает, что различные ингредиенты могут быть включены совместно в смесь или композицию согласно настоящему изобретению. Поэтому термины "по существу состоит из” и “состоит из ”охватываются термином "содержит".
В настоящем изобретении “фармацевтически приемлемым" компонентом является вещество, пригодное для человека и/или животного без чрезмерных побочных эффектов (таких как токсичность, раздражение и аллергия), т.е. с разумным соотношением польза/риск.
В настоящем изобретении “фармацевтически приемлемым носителем" является фармацевтический или пищевой приемлемый растворитель, суспендирующий агент или эксципиент, используемый для доставки соединения формулы (I), его изомера, сольвата, предшественника или их фармацевтически приемлемых солей животным или людям. Носитель может быть жидким или твердым.
Соединение
Настоящее изобретение, во-первых, относится к соединению, соответствующему структурной формуле (I):
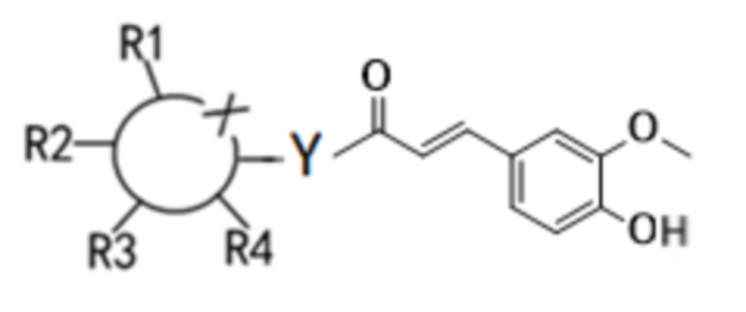
(I)
Следует понимать, что положение заместителя X в формуле (I) является иллюстративным положением, которое не ограничивается взаимным расположением по отношению к R1 в указанной формуле (положение между R1 и  ), и может также находится между заместителями R1 и R2, между R2 и R3, между R3 и R4, а также между R4 и
), и может также находится между заместителями R1 и R2, между R2 и R3, между R3 и R4, а также между R4 и  , например, соединение также может представлять собой:
, например, соединение также может представлять собой:
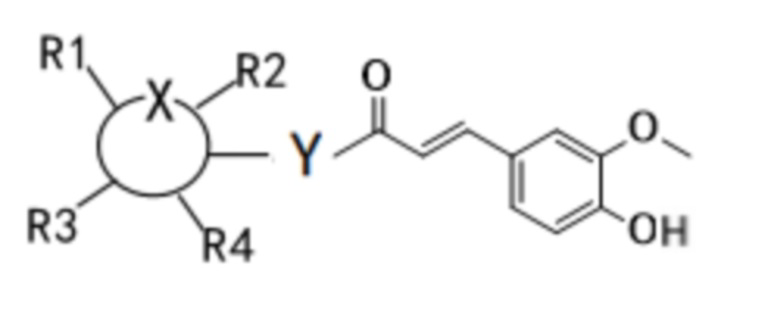
Где  представляет собой шестичленное гетероциклическое кольцо, и X представляет собой O; Y независимо выбирают из O и N; когда Y представляет собой O, соединение находится в β-конфигурации или представляет собой смесь α-конфигурации и β-конфигурации в любом соотношении; и когда Y представляет собой N, соединение находится в α-конфигурации, β-конфигурации или представляет собой смесь α-конфигурации и β-конфигурации в любом соотношении; R1-R4 независимо выбирают из водорода, гидроксила, С1-С4 алкила, С2-С4 алкенила, С2-С4 алкинила, галогена или две смежные группы в R1-R4 соединены друг с другом с образованием кольцевой структуры (которая может быть кольцевой структурой, содержащей О) совместно с основным кольцом.
представляет собой шестичленное гетероциклическое кольцо, и X представляет собой O; Y независимо выбирают из O и N; когда Y представляет собой O, соединение находится в β-конфигурации или представляет собой смесь α-конфигурации и β-конфигурации в любом соотношении; и когда Y представляет собой N, соединение находится в α-конфигурации, β-конфигурации или представляет собой смесь α-конфигурации и β-конфигурации в любом соотношении; R1-R4 независимо выбирают из водорода, гидроксила, С1-С4 алкила, С2-С4 алкенила, С2-С4 алкинила, галогена или две смежные группы в R1-R4 соединены друг с другом с образованием кольцевой структуры (которая может быть кольцевой структурой, содержащей О) совместно с основным кольцом.
В качестве предпочтительного варианта осуществления настоящего изобретения каждый из R1 - R4 независимо выбирают из водорода, гидроксила и алкила C1-C2.
Настоящее изобретение дополнительно включает изомер, сольват, предшественник вышеуказанного соединения формулы (I) или их фармацевтически приемлемые соли, если они имеют ту же или по существу ту же функцию, что и соединение формулы (I). "Фармацевтически приемлемые соли" относятся к солям, полученным в результате реакции соединения с неорганической кислотой, органической кислотой, щелочным металлом или щелочноземельным металлом. Эти соли включают, но не ограничиваются ими: (1) соли, образованные неорганическими кислотами, такими как соляная кислота, серная кислота, азотная кислота и фосфорная кислота; (2) соли, образованные органическими кислотами, такими как уксусная кислота, щавелевая кислота, янтарная кислота, винная кислота, метансульфоновая кислота, малеиновая кислота и аргинин. Другие соли включают: соли, образованные щелочными металлами или щелочноземельными металлами (такими как натрий, калий, кальций или магний) в форме сложных эфиров, карбаматов или других обычных “лекарственных форм". Соединения имеют один или несколько асимметричных центров. Поэтому эти соединения могут существовать в виде рацемических смесей, отдельных энантиомеров, отдельных диастереомеров, смесей диастереомеров или цис- или транс-изомеров.
"Предшественник соединения" относится к соединению, которое после введения пациенту соответствующим способом подвергается метаболическим или химическим реакциям в организме пациента, до дальнейшего преобразования в соединение структурной формулы (I) или соль или раствор, состоящий из соединения структурной формулы (I).
В качестве предпочтительного варианта осуществления настоящего изобретения соединение относится к соединениям формулы II (PL201), формулы III (PL202), формулы IV (PL172) и Формулы V (PL171). Соединения формулы III и формулы V особенно предпочтительны.




Соединение формулы II представляет собой (α-L-рамнопиранозил) сложный эфир феруловой кислоты, включая помимо прочих
 ;
;
Соединение формулы III представляет собой (β-L-рамнопиранозил) сложный эфир феруловой кислоты, включая помимо прочих,
 ;
;
соединение формулы IV представляет собой (1-амино-α-L-рамнопиранозил) феруламид, но не ограниченный этим,
 ; и
; и
соединение формулы ⅳ представляет собой (1-амино-β-L-рамнопиранозил) феруламид, но не ограниченный этим,
 .
.
В варианте осуществления настоящего изобретения способ получения соединения формулы III включает следующие стадии:
Стадия 1: 2,3,4-о-триацетилрамнозу и ацилхлорид (4-О-трет-бутилдиметилсилил) -феруловой кислоты смешивали для получения реакции с выходом продукта β-гликозилирования, имеющего структуру формулы VI;
Стадия 2: продукт β-гликозилирования, имеющий структуру формулы VI, и фторид тетрабутиламмония смешивали для получения продукта, не защищенного трет-бутилдиметилсилилом (TBS); и
Стадия 3, продукт не защищенный трет-бутилдиметилсилилом (TBS) гидролизовали с получением соединения формулы III
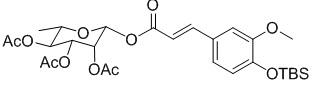 .
.
В одном варианте осуществления настоящего изобретения на стадии 1, описанной выше, 2,3,4-о-триацетилрамнозу в ледяной ванне по каплям добавляли в ацилхлорид (4-О-трет-бутилдиметилсилил) -феруловой кислоты.
В варианте осуществления настоящего изобретения вышеуказанную реакцию стадии 1 проводили при комнатной температуре. Комнатная температура составляет 10°C-40°C, предпочтительно 15°C-30°C, в частности 20°C-25°C.
В одном варианте осуществления настоящего изобретения вышеуказанная стадия 1 дополнительно включает операции получения продуктов α- и β-гликозилирования соответственно с помощью колоночной хроматографии.
Согласно одному варианту осуществления настоящего изобретения на вышеуказанной стадии 2, смешивание осуществляли путем капельного добавления фторида тетрабутиламмония в продукт β-гликозилирования при комнатной температуре.
В одном варианте осуществления настоящего изобретения способ получения соединения формулы III включает следующие стадии:
на стадии 1: 2,3,4-о-триацетилрамнозу и ацилхлорид (4-О-трет-бутилдиметилсилил)-феруловой кислоты смешивали для проведения реакции с получением продукта β-гликозилирования, имеющего структуру формулы VI; на стадии 2: продукт β-гликозилирования, имеющий структуру формулы VIII и фторид тетрабутиламмония смешивали для получения не защищенного трет-бутилдиметилсилилом (ТБС) продукта; и
на стадии 3, не защищенный трет-бутилдиметилсилилом (TBS) продукт гидролизовали с получением соединения формулыⅣ
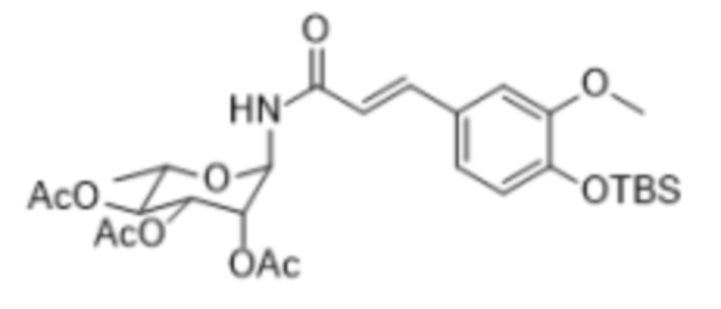 .
.
В одном варианте осуществления настоящего изобретения на стадии 1, описанной выше, к 1 амино-2,3,4-о-триацетилрамнозу в ледяной ванне по каплям добавляли в ацилхлорид (4-О-трет-бутилдиметилсилил) -феруловой кислоты.
В одном варианте осуществления настоящего изобретения вышеуказанную реакцию стадии 1 проводили при комнатной температуре. Комнатная температура составляет 10°C-40°C, предпочтительно 15°C-30°C, в частности 20°C-25°C.
Согласно одному варианту осуществления настоящего изобретения вышеуказанная стадия 1 дополнительно включает этап получения продукта α-гликозилирования с помощью колоночной хроматографии.
Согласно одному варианту осуществления настоящего изобретения на вышеуказанной стадии 2, смешивание осуществляли путем капельного добавления фторида тетрабутиламмония в продукт α-гликозилирования при комнатной температуре.
Согласно одному варианту осуществления настоящего изобретения способ получения соединения формулы Ⅴ включает следующие стадии:
на стадии 1, 1-амино-2,3,4-о-триацетилрамнозу и ацилхлорид (4-О-трет-бутилдиметилсилил) - феруловой кислоты смешивают для проведения реакции с получением продукта β-гликозилирования, имеющего структуру формулы IX;
на стадии 2, продукт β-гликозилирования, имеющий структуру формулы IX, и фторид тетрабутиламмония смешивают для получения не защищенного β-трет-бутилдиметилсилилом (TBS) продукта; и
на стадии 3, не защищенный β-трет-бутилдиметилсилилом (TBS) продукт гидролизовали с получением соединения формулы V.
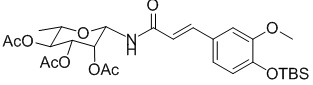 .
.
В одном варианте осуществления настоящего изобретения на стадии 1, описанной выше, к 1-амино-2,3,4-О-триацетилрамнозу в ледяной ванне по каплям добавляли в ацилхлорид (4-О-трет-бутилдиметилсилил)-феруловой кислоты.
В одном варианте осуществления настоящего изобретения вышеуказанную реакцию стадии 1 проводили при комнатной температуре. Комнатная температура составляет 10°C-40°C, предпочтительно 15°C-30°C, в частности 20°C-25°C.
Согласно варианту осуществления настоящего изобретения вышеуказанная стадия 1 дополнительно включает операцию получения продукта β-гликозилирования с помощью колоночной хроматографии.
На вышеуказанной стадии 2, осуществления настоящего изобретения смешивание осуществляли путем капельного добавления фторида тетрабутиламмония к продукту β-гликозилирования при комнатной температуре.
Специалисту в данной области техники должно быть понятно, что с учетом структур полученных соединений согласно настоящему изобретению, что соединения согласно настоящему изобретению могут быть получены различными способами, хорошо известными в данной области с использованием хорошо известных исходных реагентов, включая способы химического синтеза или экстракции из организмов (животных или растений), и указанные способы включены в объем настоящего изобретения.
Синтезированное соединение может быть дополнительно очищено методом колоночной хроматографии, высокоэффективной жидкостной хроматографии и др.
Применение
В ходе исследований авторы настоящего изобретения обнаружили, что соединение формулы (I) настоящего изобретения может существенно облегчить симптомы нейродегенеративных заболеваний. Соединение настоящего изобретения может ингибировать нейровоспаление, снижать продукцию Аβ и усиливать функции нервных стволовых клеток и дофаминергических нейронов. После экспериментальной демонстрации соединение согласно настоящему изобретению значительно улучшило способности животных к обучаемости и запоминанию. Согласно механизму действия соединения согласно настоящему изобретению, соединение может усиливать функцию нервных стволовых клеток, и поэтому эффективно при болезни Хантингтона и боковом амиотрофическом склерозе. Согласно механизму действия соединения согласно настоящему изобретению, соединение также эффективно при депрессии и инсульте. Во время начала депрессии или инсульта также происходит возникновение нейровоспалений в головном мозге, что, в свою очередь, приводит к уменьшению количества нервных стволовых клеток и изменению нервной функции. Соединение формулы (I) настоящего изобретения может усиливать функцию нервных стволовых клеток, из чего можно понять, что соединение эффективно при депрессии и инсульте.
На основе новых данных полученных авторами настоящего изобретения, настоящее изобретение относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения лекарственного средства или лекарственного средства в виде набора для профилактики, облегчения или лечения нейродегенеративных заболеваний, депрессии или инсульта.
Настоящее изобретение также относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для ингибирования нейровоспаления.
Настоящее изобретение также относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для стимулирования выработки нервных стволовых клеток.
Настоящее изобретение также относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для снижения синтеза Аβ.
Настоящее изобретение также относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для увеличения числа дофаминергических нейронов в черной субстанции.
Настоящее изобретение также относится к применению соединения формулы (I) или его изомера, сольвата или предшественника, или их фармацевтически приемлемых солей для получения композиции, набора или лекарственного средства в виде набора для повышения уровня стриатальных дофаминергических нервных волокон.
Соединение формулы (II) (PL201), соединение формулы (Ⅲ) (PL202), соединение формулы (Ⅳ) (PL172) и соединение формулы (Ⅴ) (PL172), согласно настоящему изобретению обладают превосходными эффектами в вышеуказанных применениях, причем соединения формулы (III) и формулы (V) являются особенно эффективными.
Фармацевтическая композиция
Настоящее изобретение также относится к фармацевтической композиции, содержащей (а) эффективное количество соединения формулы (I) или его изомер, сольват, предшественник или их фармацевтически приемлемые соли; и (Б) фармацевтически приемлемый носитель или эксципиент.
В фармацевтической композиции согласно настоящему изобретению соединение формулы (I) или его изомер, сольват или предшественник, или их фармацевтически приемлемые соли находятся в эффективном количестве. Например, соединение формулы (I) или его фармацевтически приемлемая соль может содержаться в массовом отношении 0,001-50%. Фармацевтическая композиция содержит соединение формулы (I) или его фармацевтически приемлемую соль предпочтительно в массовом отношении 0,01% -20%.
Лекарственная форма фармацевтической композиции настоящего изобретения может быть различной до тех пор, пока она может эффективно доставлять активный ингредиент в организм млекопитающего. Например, она может быть выбрана из порошка, пульвы, таблетки, капсулы, препарата с замедленным высвобождением, препарата с контролируемым высвобождением, инъекции, инфузионной жидкости и суспензии. В соответствии с типами заболеваний подлежащих лечению соединением согласно настоящему изобретению, специалист в данной области может подобрать удобные для применения лекарственные формы.
С точки зрения простоты приготовления и хранения, предпочтительной фармацевтической композицией является твердая композиция, в частности таблетка, заполненная твердым веществом, или капсула, заполненная жидкостью. Предпочтительной фармацевтической композицией, с точки зрения размера и простоты введения, является пероральный препарат. Соединение согласно настоящему изобретению или его фармацевтическая композиция также могут храниться в стерильном устройстве, пригодном для инъекций или инфузий.
Эффективная дозировка введения соединения формулы (I) в качестве активного ингредиента может варьироваться в зависимости от способа введения и тяжести заболевания, подлежащего лечению. Тем не менее, как правило, соединение настоящего изобретения может показывать удовлетворительные результаты при введении в дозе около 0,01-100 мг/кг массы животного ежедневно, предпочтительно вводится в 1-3 разделенных дозах ежедневно или вводится в форме пролонгированного высвобождения. Режим дозирования может быть скорректирован таким образом, чтобы обеспечить наилучший терапевтический ответ. Например, в зависимости от срочной ситуативной потребности в лечении, несколько разделенных доз могут быть введены ежедневно, или доза также может быть уменьшена пропорционально.
Дополнительно настоящее изобретение описано ниже, в сочетании с конкретными примерами. Следует понимать, приведенные ниже примеры являются исключительно иллюстративными и не ограничивают настоящее изобретение каким-либо образом. В следующих примерах экспериментальные методы без указания конкретных условий обычно выполняют в обычных условиях, например, описанных в J. Sambr°°k et al., M°lecular Cl°ning: A Lab°rat°ry Manual, the third editi°n, Science Press, 2002, или в условиях рекомендованных производителем.
Статистический анализ данных
Все экспериментальные данные выражены в виде среднего значения «±стандартная ошибка». Т-тест использовался для сравнения между различными лечебными группами. Для анализа результатов нескольких групп использовали однофакторный дисперсионный анализ (one way ANOVA). После испытаний проводили тест наименьшей значимой разности Фишера или тест Бонферрони, или Т-тест, или двусторонний дисперсионный анализ (two way ANOVA), который также был использован для анализа после испытаний с использованием апостериорного теста Тьюки. При р<0,05 наблюдалась достоверная разница между группами.
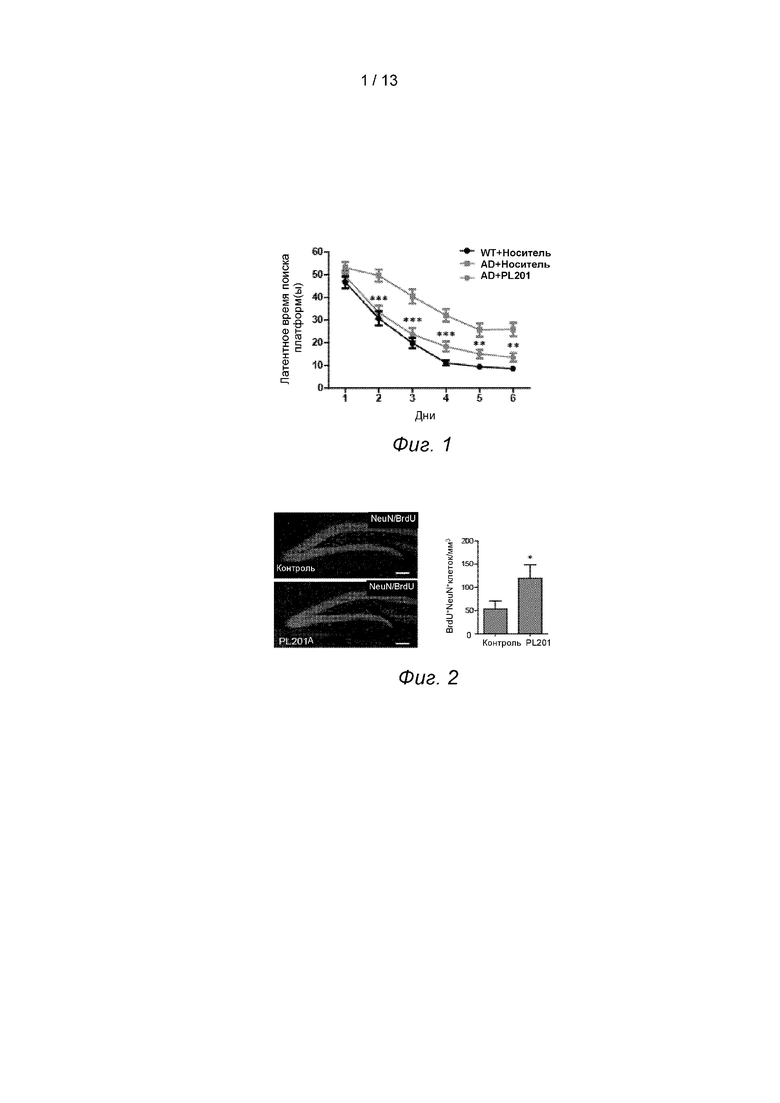
Пример 1. PL201 улучшает обучаемость и память мышей с БА
Тест "Водный лабиринт Морриса"
В возрасте двадцати 5-6 месяцев были отобраны самцы трансгенных мышей APP/PS1 (мыши с БА), которые были разделены на модельную группу и группу введения полисахаридов случайным образом с использованием метода таблицы случайных чисел. Соединение PL201 вводили внутрижелудочно ежедневно (10 мг/кг массы тела мыши), в то время как 10 нетрансгенных мышей использовали в качестве отрицательной контрольной группы (без введения PL201). После 90 дней последовательного введения использовали тест водного лабиринта Морриса для выявления влияния PL201 на обучение и когнитивные функции мышей APP/PS1.
В тесте использовалась классическая процедура испытания водного лабиринта Морриса, которая включает в себя две части: задачу навигации по месту и задачу пространственного зондирования. Тест длился 7 дней, и на 4-й и 7-й день была добавлена задача пространственного зондирования.
Из результатов испытаний представленных на фиг. 1? видно, что в задаче навигации по месту после 3 дней обучения латентное время спасения было сокращено у всех трех групп животных, иллюстрируя, что мыши в каждой группе могли успешно выполнить задачу пространственного обучения водного лабиринта. Латентное время спасения использовалось в качестве тестового индикатора.
Результаты показали, что мыши в отрицательной контрольной группе быстро реагировали и могли быстро найти платформу после входа в воду. С увеличением времени обучения время задержки поиска платформы сокращалось. Мыши в эталонной группе реагировали медленно, после входа в воду у них наблюдалось зацикленное поведение вдоль стенки бочки, но не было никаких проявлений поведения спасения. После вспомогательного вывода мышей на платформу вручную, они снова прыгали в воду. После многократных тренировок они, наконец, находили платформу, но время задержки поиска платформы было значительно увеличено. С увеличением времени обучения способность поиска платформы мышей в тестовых группах непрерывно улучшалась. Все мыши в вышеперечисленных трех группах обладали определенной способностью к пространственной памяти, причем мыши в эталонной группе имели худшие показатели латентного времени спасения, чем мыши в контрольной группе, что позволяет предположить, что способность к обучению и запоминанию мышей в эталонной группе были снижены, а расстройство обучения и памяти при БА было хорошо смоделировано в эталонной группе мышей. По сравнению с эталонной группой латентность мышей в группе введения была значительно иной. Видно, что способность к обучению и запоминанию у мышей AD после введения PL201 была значительно улучшена.
Пример 2. PL201 стимулирует нейрогенез in vivo
Аномальный нейрогенез, нейровоспаление и отложение Аβ-бляшек тесно связаны со снижением когнитивных способностей при БА. Таким образом, в этом примере дополнительно исследуется, влияет ли PL201 на нейрогенез.
Авторы настоящего изобретения провели эксперименты по введению PL201 на мышах c БА (были отобраны мыши с БА в возрасте 5-6 месяцев). Каждой мыши внутрижелудочно вводили 100 мкл PL201, дозировка составляла 10 мг/кг массы тела мыши. Кроме того, мышам контрольной группы вводили 100 мкл воды один раз в день в течение 90 дней, а с 60-го дня внутрибрюшинно вводили 5-бром-2’-дезоксиуридин (БрдУ) в дозе 50 мг/кг массы тела мыши один раз в день в течение 7 дней. После 90 дней введения мышам анестезии их перфузировали с ПФД, и весь мозг брали для дальнейших экспериментов.
Для полученного цельного мозга был обнаружен зрелый нейронный маркер NeuN в гиппокампе мышей: мозг мыши, который был перфузирован ПФД, затем фиксировали в 4% ПФД в течение 24 часов, а затем выдерживали в течение 72 часов в 30% сахарозе для криопротекции. После завершения лечения область мозжечка удаляли, а обонятельную луковицу помещали вертикально на фильтровальную бумагу и замораживали при температуре -80°C не менее 24 часов. Резка производилось в замороженном состоянии вертикально и продольно толщиной 30 мкм. В общей сложности 8×9=72 среза (2,16 мм), включая часть DG, были разрезаны и расположены в порядке нарезки. Из каждых 8 срезов выбирался один и затем объединялся в группу срезов мозга для окрашивания. Нарезанные срезы мозга помещали в раствор защищающий ткани (30% сахарозы, 30% этиленгликоля, 0,1M PB), полученные таким образом срезы мозга можно было хранить при температуре -20°C не менее полугода. Во время окрашивания группу срезов мозга брали и блокировали в блокирующем растворе (10% ослиная сыворотка, 0,3% TritonX-100, PBS) в течение 45 минут при комнатной температуре, а затем добавляли первичные антитела и инкубировали в течение ночи при 4°C (соотношение разведения первичных антител составляло: крысиный анти-BrdU, 1 : 2000; кроличий анти-Ki67, 1:1000; козий анти-Dcx, 1 : 200; мышиный анти-NeuN, 1 : 200; и козий анти-SOx2, 1 : 60), а затем инкубировали с подходящее флуоресцентное вторичное антитело в течение 1 часа при комнатной температуре. Ядерное окрашивание проводили с помощью DAPI. Затем изображения окрашенных срезов мозга снимались с помощью °Olympus FV100i или Leica SP-8. Количество одиночных или двойных положительных клеток анализировалось с помощью программного обеспечения Image Pro Plus. Для извлечения антигена срезы мозга обрабатывали в растворе для извлечения антигена (10 мм цитрата натрия, рН 6,5)при 95°C в течение 20 минут перед тем как происходила бы блокировка сывороткой. Для окрашивания BrdU перед тем как происходила бы блокировка сывороткой срезы мозга обрабатывали 2 м соляной кислотой при 37°C в течение 30 минут, а затем промывали 0,1 м буфером борной кислоты (рН 8,5).
Авторы настоящего изобретения обнаружили, что по сравнению с мышами контрольной группы гиппокамп у мышей, которым вводили PL201, имел больше двойноположительных новорожденных нейронов BrdU/NeuN, см. фиг. 2.
Приведенные выше результаты показали, что PL201 может значительно способствовать нейрогенезу у мышей.
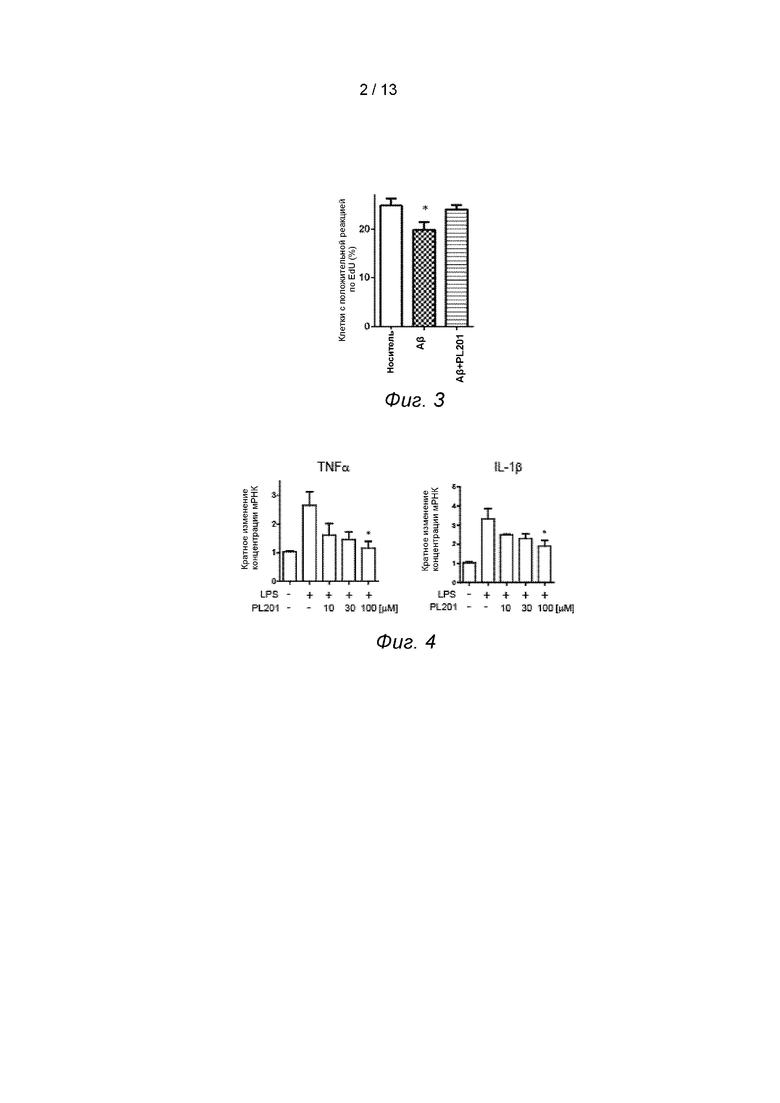
Пример 3. PL201 облегчает ингибирование Aβ на пролиферацию нервных стволовых клеток in vitr°.
Являясь основным патогенным белком БА, Аβ ингибирует пролиферацию нервных стволовых клеток. В этом примере изобретатели определили уровни пролиферации нервных стволовых клеток человека путем инкорпорации EdU и проверили, может ли PL201 ослабить ингибирующий эффект aβ на пролиферацию нервных стволовых клеток.
Нервные стволовые клетки человека (3L) культивировали в DMEM/F12 (содержащем N2/B27 и 10 нг/мл bFGF), покрывали 96-луночными пластинами и инкубировали в течение 24 часов, затем добавляли Aβ (5 мкм) для предварительной обработки клеток в течение 30 минут, а затем добавляли PL201 (30 мкм). После совместной инкубации в течение 72 часов уровень пролиферации нервных стволовых клеток определялся методом окрашивания EdU.
Результаты показали, что лечение Аβ ингибирует пролиферацию нервных стволовых клеток, тогда как добавление PL201 может значительно ослабить ингибирующее действие Аβ на пролиферацию нервных стволовых клеток, см. Фиг. 3.
Пример 4. PL201 ингибирует нейровоспаления.
Нейровоспаление в головном мозге при БА является одной из причин снижения когнитивных функций. Микроглиальные клетки являются ключевыми клетками, которые опосредуют нейровоспаление. В этом примере изобретатели исследовали, обладает ли PL201 эффектом ингибирования нейровоспаления путем обнаружения экспрессии воспалительных факторов на клеточной линии мыши BV-2.
Клетки BV-2 культивировали в DMEM, наносили на 24 луночные пластины и культивировали в течение 24 часов, затем добавляли PL201 (0, 10, 30 и 100 мкм) и LPS (300 нг/мл). После совместной инкубации в течение 24 часов для извлечения РНК использовали Тризол, а экспрессию родственных воспалительных факторов определяли методом QPCR.
Результаты показали, что лечение PL201 может значительно ингибировать экспрессию воспалительных факторов TNFa и IL-1β и даже оказывать очевидный эффект при более низкой дозировке, см. Фиг. 4.
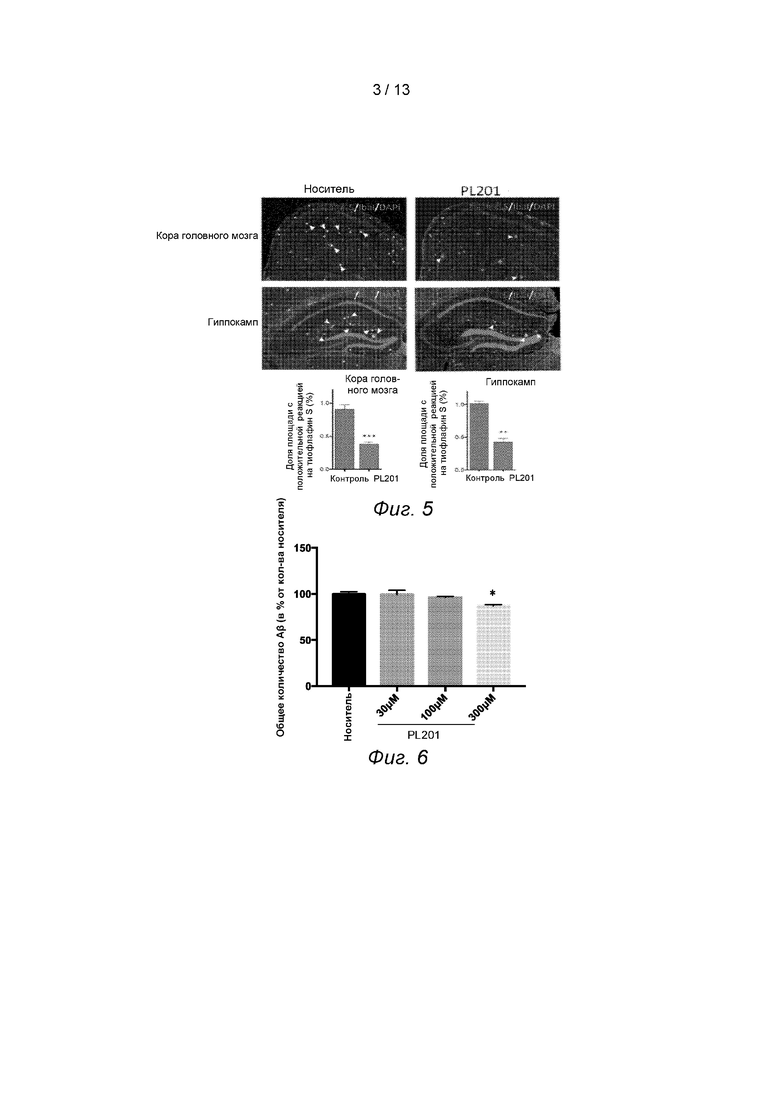
Пример 5. PL201 уменьшает количество Аβ-бляшек in vivo.
Отложение Аβ-бляшек в головном мозге является одной из ключевых причин повреждения нервов, что, в свою очередь, приводит к снижению когнитивных способностей. Поэтому в этом варианте осуществления дополнительно исследуется, влияет ли PL201 на количество Аβ-бляшек в головном мозге.
Авторы настоящего изобретения выполнили коронарное замороженное срезание толщиной в 30 мкм на всем образце мозга мышей с БА после введения в Примере 2, и срезы были окрашены тиофлавином S и DAPI. Затем изображения окрашенных срезов мозга снимались с помощью Olympus FV100i или Leica SP-8.
Авторы настоящего изобретения обнаружили, что по сравнению с контрольной группой мозг мышей, которым вводили PL201, имел меньше Аβ-бляшек, см. Фиг. 5.
Вышеприведенные результаты показали, что PL201 значительно уменьшает количество Аβ-бляшек у мышей.
Пример 6. PL172 снижает синтез Аβ.
Аβ является основным патогенным белком БА. В этом примере авторы настоящего изобретения исследовали, снижает ли PL201 синтез Aβ путем обнаружения уровня Aβ на клетках нейробластомы SK-N-SH.
Культура клеток нейробластомы SK-N-SH и обнаружение Aβ: клетки SK-N-SH культивировали в DMEM, покрывали 24-луночными пластинами и культивировали в течение 24 часов, затем добавляли PL201 (0, 30, 100 и 300 мкм). После совместной инкубации в течение 24 часов уровень белка общего Аβ в супернатанте определяли методом ИФА.
Результаты показали, что обработка PL201 значительно ингибирует синтез aβ, см. Фиг. 6.
Пример 7. PL201 увеличивает мембранный потенциал митохондрий
Мембранный потенциал митохондрий является основным параметром митохондриальной функции, а митохондриальная дисфункция является характерной чертой БА головного мозга. В этом примере изобретатели исследовали, улучшает ли PL201 функции митохондрий путем определения уровня клеточного мембранного потенциала митохондрий нервных стволовых клеток человека.
Митохондрии окрашивали с JC-1 в течение 20 мин и промывали промывочным буфером, затем проводили иммунофлуоресцентный анализ.
Результаты показали, что при лечении Аβ снижается мембранный потенциал митохондрий, в то время как PL201 лечение смягчает отрицательное действие Аβ, см. Фиг. 7.
Пример 8. PL201 улучшает уровень фосфорилирования AMPK
Изменения функций митохондрий тесно связаны с регуляцией обмена сигнальных веществ, включая АМПК, который также считается тесно связанным с патогенезом БА. В этом примере изобретатели исследовали, влияет ли PL201 на метаболизм сигнальных веществ, обнаруживая уровень фосфорилирования AMPK в нервных стволовых клетках человека с помощью вестерн-блота.
Нервные стволовые клетки человека (3L) культивировали в DMEM/F12 (содержащем N2/B27 и 10 нг/мл bFGF), покрывали 12-луночными пластинами и инкубировали в течение 24 часов, затем добавляли Aβ (5 мкм) для предварительной обработки клеток в течение 30 минут, а затем добавляли PL201 (30 мкм). После совместной инкубации в течение 72 часов клетки промывали PBS и лизировали буфером для образцов Laemmli, затем проводили электрофорез SDS PAGE для выявления ассоциированных белковых полос с кроличьим антифосфо-АМПК и общим антителом к АМПК.
Результаты показали, что лечение Аβ снижает уровень фосфорилирования АМПК, в то время как лечение PL201 уменьшает степень этого снижения, см. Фиг. 8.
Пример 9. PL201 улучшает координацию мышей в тесте при восхождении на шест
MPTP избирательно оказывает разрушающее действие на дофаминергические нейроны в черной субстанции головного мозга. MPTP-индуцированный паркинсонизм является наиболее классической животной моделью, которая воспроизводит большинство клинических и патологических признаков болезни Паркинсона. В основном БП проявляется такими симптомами, как тремор покоя, гипертония и гипомоторность. Время, чтобы развернуться и время, чтобы спуститься вниз в тесте восхождения на шест, может представлять общую двигательную координационную способность мышей.
Мыши случайным образом были разделены на 4 группы: Группа, в которой мышам вводили нормальный физиологический раствор (ФР), модельная группа MPTP, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (ФР+ MPTP), группа, в которой мышам внутрижелудочно вводили 50 мг соединения PL201 (PL201), и модельная группа MPTP, в которой мышам внутрижелудочно вводили соединение PL201 (PL201 + MPTP).
11 животных были объединены в группу, в которой мышам вводили нормальный физиологический раствор (ФР), 14 животных объединили в МФТП-модель группы, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (фр + МФТП), 4 животным в группе вводили внутрижелудочно одновременно 50 мг комплекса PL201 (PL201), и 15 животных объединили в группу и установили в МФТП-модели, в которой мышам внутрижелудочно вводили соединение PL201 (PL201+МФТП).
Введение начинали в день группирования животных: мышам в группе ФР и ФР+MPTP внутрижелудочно вводили нормальный физиологический раствор, а мышам в двух других группах вводили соединение PL201 один раз в день в течение 7 последовательных дней. Начиная с 7-го дня мышам в группе ФР и PL201 внутрибрюшинно вводили 5 мл/кг нормального физиологического раствора, в то время как мышам в группе ФР + MPTP и PL201 + MPTP внутрибрюшинно вводили 25 мг/кг MPTP один раз в день в общей сложности в течение 5 дней.
На 3-й день эксперимента для оценки моторно-координационной способности мышей был проведен тест на восхождение на шест. Мышку осторожно положили головой вверх на верхушку шеста с шероховатой поверхностью (1 см в диаметре и 50 см в высоту). Время, затраченное мышами на то, чтобы полностью повернуться от положения головы вверх к голове вниз, было записано как время разворота, а время, затраченное мышами от движения вниз до достижения всеми конечностями дна шеста, было записано как время спускания вниз. Время, превышающее 30 секунд, было записано как 30 секунд. Каждая мышь тестировалась 5 раз, а затем взято среднее значение.
Результаты показали, что на 3-й день эксперимента мыши в группе ФР + MPTP тратили больше времени на разворот и спуск вниз, чем мыши в группе с нормальным физиологическим раствором (ФР). A введение PL201 сокращало время разворота и спуска в PL201 + МФТП группе по сравнению с ФР + МФТП группе.
Результаты показали, что соединение PL201 оказывает благоприятное влияние на инициацию движения и координационную способность МФТП модели мышей, см. Фиг. 9.
Пример 10. PL201 повышает уровень стриатальных дофаминергических нервных волокон
Потеря дофаминергических нейронов в черной субстанции и стриатальных дофаминергических нервных волокон является основной патологической особенностью болезни Паркинсона. Вестерн-Блот может быть использован для обнаружения потери стриатальных дофаминергических нервных волокон для изучения влияния PL201 на уровень стриатальных дофаминергических нервных волокон.
Мыши случайным образом были разделены на 4 группы: Группа, в которой мышам вводили нормальный физиологический раствор (ФР), модельная группа MPTP, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (ФР+MPTP), группа, в которой мышам внутрижелудочно вводили 50 мг соединения PL201 (PL201), и модельная группа MPTP, в которой мышам внутрижелудочно вводили соединение PL201 (PL201+MPTP).
11 животных были объединены в группу, в которой мышам вводили нормальный физиологический раствор (ФР), 14 животных объединили в МФТП-модель группы, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (ФР+МФТП), 4 животным в группе вводили внутрижелудочно одновременно 50 мг комплекса PL201 (PL201), и 15 животных объединили в группу и установили в МФТП-модели, в которой мышам внутрижелудочно вводили соединение PL201 (PL201+МФТП).
Введение начинали в день группирования животных: мышам в группе ФР и ФР+MPTP внутрижелудочно вводили нормальный физиологический раствор, а мышам в двух других группах вводили соединение PL201 один раз в день в течение 7 последовательных дней. Начиная с 7-го дня мышам в группе ФР и PL201 внутрибрюшинно вводили 5 мл/кг нормального физиологического раствора, в то время как мышам в группе ФР+MPTP и PL201+MPTP внутрибрюшинно вводили 25 мг/кг MPTP один раз в день в общей сложности в течение 5 дней.
На 7-й день после моделирования МПТП животных каждая группа подвергалась анестезированию с 10%-ным хлоралгидратом. После перфузии стриатум выделяли из ткани головного мозга и помещали в пробирки объемом 1,5 мл ЭП, добавляли 250 мкл лизисного буфера RIPA (Thermo Fisher) для проведения ультразвукового разрушения ткани, а супернатант собирали для определения концентрации белка. Концентрацию белка доводили до 2 мкг/мкл и добавляли 5-кратный загрузочный буфер (восстановительный), проводили кипячение для денатурации белка. Образец добавляли к 10%-ному электрофорезу SDS-полиакриламидного геля и переносили на активированную метанолом PVDF мембрану при 100 V. ТБСТ, содержащий 5% обезжиренного молока для блокирования при комнатной температуре в течение 1 ч, и добавляли первичное антитело TH (1:1000), затем инкубировали в течение ночи при 4°С. Неспецифическое связывание первичного антитела смывали буфером ТБСТ, а затем добавляли козье анти-мышиное/кроличье флуоресцентное вторичное антитело (LI-COR). После инкубации при комнатной температуре в течение 1 ч троекратно промывали буфером ТБСТ. Флуоресцентным сканером был обнаружен флуоресцентный сигнал инфракрасного диапазона Odyssey и составлена статистика.
Результаты показали, что по сравнению с группой ФР+MPTP уровень стриатальных дофаминергических нервных волокон был достоверно повышен в группе PL201+MPTP после 7 дней моделирования MPTP. Соединение PL201 повышало уровень стриатальных дофаминергических нервных волокон у мышей, предполагается, что оно может защитить стриатальные дофаминергические нервные волокна от повреждения, вызванного MPTP, см. Фиг. 10. Результаты показали, что соединение PL201 способствует улучшению патогенеза болезни Паркинсона.
Пример 11. PL201 увеличивает количество дофаминергических нейронов в черной субстанции и уровень стриатальных дофаминергических нервных волокон
Потеря дофаминергических нейронов в черной субстанции и стриатальных дофаминергических нервных волокон является основной патологической особенностью болезни Паркинсона. Иммуногистохимия тирозингидроксилазы (тг) может быть использована для обнаружения потери стриатальных дофаминергических нервных волокон, для исследования оказывает ли PL201 эффект увеличения числа дофаминергических нейронов в черной субстанции.
Мыши случайным образом были разделены на 4 группы: Группа, в которой мышам вводили нормальный физиологический раствор (ФР), модельная группа MPTP, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (ФР+ MPTP), группа, в которой мышам внутрижелудочно вводили 50 мг соединения PL201 (PL201), и модельная группа MPTP, в которой мышам внутрижелудочно вводили соединение PL201 (PL201 + MPTP).
11 животных были объединены в группу, в которой мышам вводили нормальный физиологический раствор (ФР), 14 животных объединили в МФТП-модель группы, в которой мышам внутрижелудочно вводили нормальный физиологический раствор (ФР+МФТП), 4 животным в группе вводили внутрижелудочно одновременно 50 мг комплекса PL201 (PL201), и 15 животных объединили в группу и установили в МФТП-модели, в которой мышам внутрижелудочно вводили соединение PL201 (PL201+МФТП).
Введение начинали в день группирования животных: мышам в группе ФР и ФР+MPTP внутрижелудочно вводили нормальный физиологический раствор, а мышам в двух других группах вводили соединение PL201 один раз в день в течение 7 последовательных дней. Начиная с 7-го дня мышам в группе ФР и PL201 внутрибрюшинно вводили 5 мл/кг нормального физиологического раствора, в то время как мышам в группе ФР+MPTP и PL201+MPTP внутрибрюшинно вводили 25 мг/кг MPTP один раз в день в общей сложности в течение 5 дней.
На 7-й день после моделирования МПТП животных каждая группа подвергалась анестезированию с 10%-ным хлоралгидратом. После перфузии 4% параформальдегидом брали мозг. После фиксации в течение 24 часов 4% параформальдегидом образцы переносили в 30% раствор сахарозы до тех пор, пока они не обезвоживались (опускались на дно). Коронарные срезы среднего мозга и стриатума были сделаны в замораживающем микротоме при температуре -20°c. Толщина срезов мозга мыши составляла 30 мкм. Первичным антителом было моноклональное мышиное анти-TH (1:1000, кроличье анти-мышиное антитело). Первичное антитело использовали для инкубации при комнатной температуре в течение 2,5 часов и промывали раствором ТБСТ (8 г хлорида натрия, 0,2 г хлорида калия и 3 г Трис-основания, доводили объем до 1 л дистиллированной водой, доводили до рН 7,4 соляной кислотой) трижды, а затем вторичное антитело (козье анти-кроличье антитело), меченное пероксидазой хрена (ГПР), использовали для инкубации при комнатной температуре в течение 1 часа. Diaminobenzidine (даб) был использован для визуализации ПХ сигналов, этанол использовался для градиента обезвоживание, ксилол использовался для ткани оптического просветления, а нейтральная резинка использовалась для монтажа. Для анализа окрашенных срезов использовалось программное обеспечение Image-pro plus. Общая плотность TH-позитивных клеток в черной субстанции рассматривалась как дофаминергические нейроны в черной субстанции, а средняя оптическая плотность TH-позитивного окрашивания в стриатуме использовалась в качестве меры плотности стриатальных дофаминергических нервных волокон.
Результаты показали, что по сравнению с группой ФР+MPTP количество дофаминергических нейронов в черной субстанции и уровень стриатальных дофаминергических нервных волокон были значительно увеличены в группе PL20+MPTP. Соединение PL201 повышало уровень дофаминергических нейронов в черной субстанции и стриатальных дофаминергических нервных волокнах мышей, также предполагается? что оно может защищать дофаминергические нейроны в черной субстанции и стриатальные дофаминергические нервные волокна. Результаты показали, что соединение PL201 способствует улучшению патогенеза болезни Паркинсона, см. Фиг. 18.
Пример 12. PL202 снижает синтез Aβ
Аβ является основным патогенным белком БА. В этом примере изобретатели исследовали, оказывает ли изомер PL202 из PL201 эффект ингибирования и снижения синтеза Аβ путем обнаружения уровня Аβ на клетках нейробластомы SK-N-SH.
Культура клеток нейробластомы SK-N-SH и обнаружение Aβ: клетки SK-N-SH культивировали в DMEM, покрывали 24-луночными пластинами и культивировали в течение 24 часов, затем добавляли PL201 (0, 30, 100 и 300 мкм). После совместной инкубации в течение 24 часов уровень общего белка Аβ в супернатанте определяли методом ИФА. Результаты показали, что обработка PL202 значительно ингибирует синтез Аβ, см. Фиг. 11.
Пример 13. PL202 ингибирует нейровоспаления
Нейровоспаление в головном мозге при БА является одной из причин снижения когнитивных функций. Микроглиальные клетки являются ключевыми клетками, которые опосредуют нейровоспаление. В этом примере изобретатели исследовали, обладает ли PL202 эффектом ингибирования нейровоспаления путем обнаружения экспрессии воспалительных факторов на клеточной линии мыши BV-2.
Клетки BV-2 культивировали в DMEM, наносили на 24 луночные пластины и культивировали в течение 24 часов, затем добавляли PL202 (0, 30, 100, и 300 мкм) и LPS (300 нг/мл). После совместной инкубации в течение 24 часов для извлечения РНК использовали Тризол, а экспрессию родственных воспалительных факторов определяли методом QPCR.
Результаты показали, что лечение PL202 значительно ингибирует экспрессию воспалительных факторов IL-1β и iNOS, см. Фиг. 12.
Пример 14. PL171 снижает синтез Аβ
Аβ является основным патогенным белком БА. В этом примере изобретатели исследовали, эффект снижения или ингибирования веществом PL171 синтез Aβ путем обнаружения уровня Aβ на клетках нейробластомы SK-N-SH.
Культура клеток нейробластомы SK-N-SH и обнаружение Aβ: клетки SK-N-SH культивировали в DMEM, покрывали 24-луночными пластинами и культивировали в течение 24 часов, затем добавляли PL171 (300 мкм). После совместной инкубации в течение 24 часов уровень общего белка Аβ в супернатанте определяли методом ИФА.
Результаты показали, что обработка PL171 значительно ингибирует синтез aβ, см. Фиг. 13.
Пример 15. PL172 снижает синтез Аβ
Аβ является основным патогенным белком БА. В этом примере изобретатели исследовали, оказывает ли изомер PL172 из PL171 эффект ингибирования и снижения синтеза Аβ путем обнаружения уровня Аβ на клетках нейробластомы SK-N-SH.
Культура клеток нейробластомы SK-N-SH и обнаружение Aβ: клетки SK-N-SH культивировали в DMEM, покрывали 24-луночными пластинами и культивировали в течение 24 часов, затем добавляли PL172 (300 мкм). После совместной инкубации в течение 24 часов уровень общего белка Аβ в супернатанте определяли методом ИФА.
Результаты показали, что обработка PL172 значительно ингибирует синтез aβ, см. Фиг. 14.
Пример 16. Синтез PL202
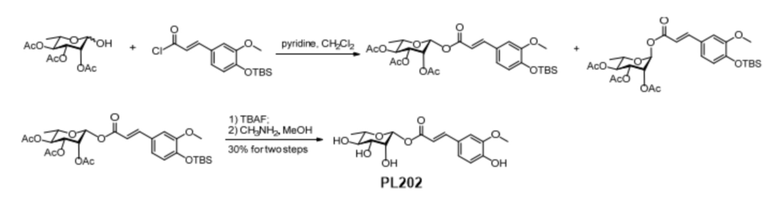
2,3,4-о-триацетилрамнозу (5,8 г, 20 ммоль) растворяли в 100 мл безводного дихлорметана, а ацилхлорид (4-О-TBS) -феруловой кислоты (6,52 г, 20 ммоль) (Free Radical Res. 2015, 102) - в 50 мл безводного раствора дихлорметана и затем по каплям добавляли 1,0 мл безводного пиридина под ледяной баней. После перемешивания реакцию останавливали в течение 2 часов при комнатной температуре. Для разбавления добавляли 200 мл дихлорметана, затем промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали. Продукт α-гликозилирования (9,12 г, 79%) и продукт β-гликозилирования (1,1 г, 9%) были получены соответственно методом колоночной хроматографии (петролейный эфир: этилацетат = 3:1). Продукт β-гликозилирования (490 мг, 0,85 ммоль) растворяли в высушенном ТГФ (8,0 мл), реакцию проводили под действием TBAF, разбавляли, промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали до получения 275 мг TBS-депротекторного продукта. 270 мг (0,58 ммоль) полученного продукта растворяли в 3,0 мл метанола, 0,5 мл 33% CH3NH2 в раствор метанола добавляли по каплям при 0°С и оставляли для реагирования в течение 1 часа при 0°С. 59 мг (0,17 ммоль) PL202 получали быстрым концентрированием при пониженном давлении и методом колоночного хроматографического разделения (этилацетат: метанол = 6:1). ESI (+)-MS: 341.3 [M + 1]+ ; 1H-ЯМР (CD3OD, 400 МГц) δ 7.80 (d, J = 12 Гц, 1H), 7.23 (d, J = 1 Гц, 1H), 7.12 (dd, J1 = 8 Гц, J2 = 1 Гц, 1H), 6.84 (d, J = 6 Гц, 1H), 6.42 (d, J = 13 Гц, 1H), 5.75 (d, J = 1 Гц, 1H), 3,99 (D, J = 2 Гц, 1 ч), 3,92 (S, 3 ч), 3,55-3,53 (M, 1 ч), 3,41-3,37 (m, 2 ч), 1,34 (D, J = 4 Гц, 3 ч).
Для проверки конфигурации PL202 был проведен эксперимент 1D NOE для получения спектра 1D N°E PL202, который доказал, что полученный PL202 находится в β-конфигурации, см. Фиг. 15.
Пример 17. Синтез PL171
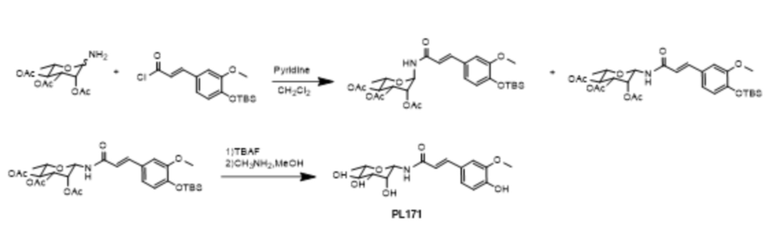
1-амино-2,3,4-о-триацетилрамнозу (5,86 г, 19 ммоль) растворяли в 100 мл безводного дихлорметана, а (4-О-TBS) -ацилхлорид феруловой кислоты (6,5 г, 20 ммоль) (Free Radical Res. 2015, 102) в безводный раствор дихлорметана и по каплям добавляли 1,0 мл безводного пиридина под ледяной баней. После перемешивания реакцию останавливали в течение 2 часов при комнатной температуре. Для разбавления добавляли 200 мл дихлорметана, затем промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали. Продукт β-гликозилирования (8,22 г, 70%) и продукт α-гликозилирования (1,2 г, 10%) были получены соответственно методом колоночной хроматографии (петролейный эфир: этилацетат = 10:1-2:1). Продукт гликозилирования β (500 мг, 0,86 ммоль) растворяли в высушенном ТГФ (8,0 мл), реакцию проводили под действием TBAF, разбавляли, промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали до получения 300 мг TBS-депротекторного продукта. 300 мг (0,65 ммоль) полученного продукта растворяли в 3,0 мл дихлорметана, по каплям добавляли 0,5 мл 33%-ного раствора CH3NH2 в метаноле при 0°С и реагировали в течение 1 часа при 0°С. 70 мг (0,21 ммоль) PL171 получали быстрым концентрированием при пониженном давлении методом колоночного хроматографического разделения (дихлорметан: метанол = 20: 1-6: 1). ESI (+)-MS: 340.3 [M + 1]+; 1H-ЯМР (CD3°D, 400 МГц) δ 7.56 (d, J = 12 Гц, 1H) 7.19 (d, J = 4 Гц, 1H), 7.07 (dd, J1 = 6 Гц, J2 = 1 Гц, 1H), 6.82 (d, J = 4 Гц, 1H), 6.62 (d, J = 12 Гц, 1H), 5.28 (d, J = 1 Гц, 1H), 3,92 (S, 3H),3,85 (D, J = 4 Гц, 1H), 3,54-3,52 (M, 1h), 3,38-3,34 (M, 2H), 1,32 (D, J = 4 Гц, 3H).
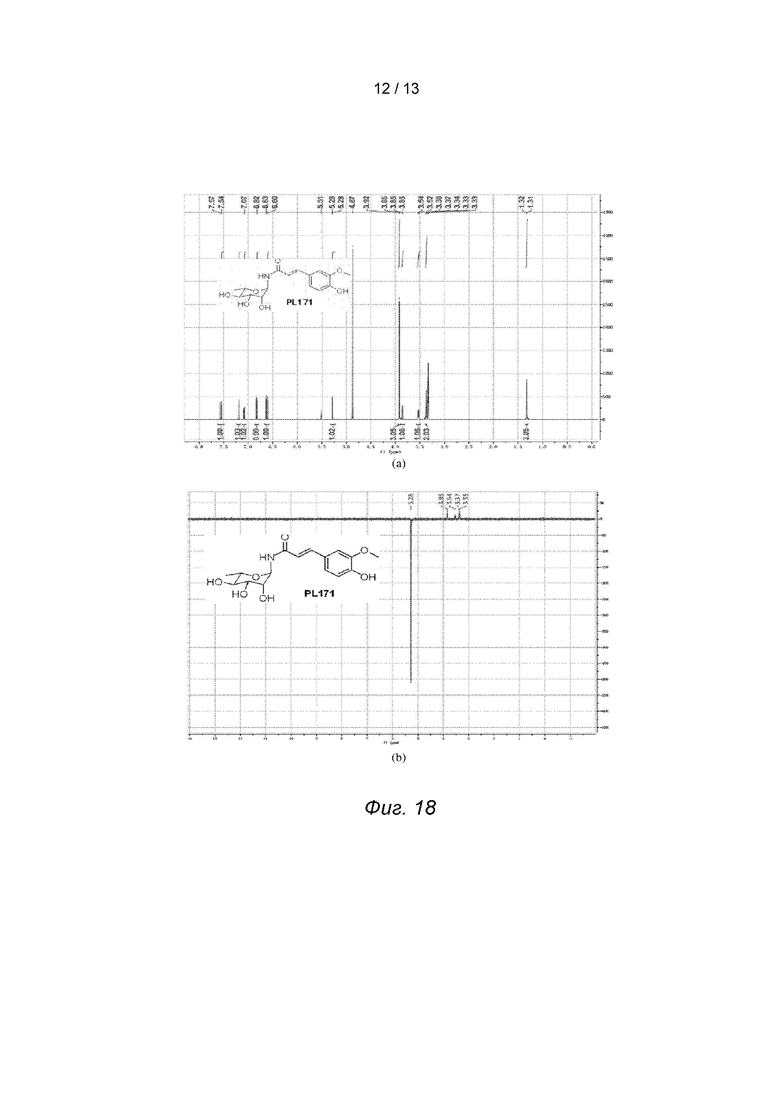
Для проверки конфигурации PL171 были проведены эксперимент 1D NOE и эксперимент 1H-1H COSY (коррелированная спектроскопия) для получения спектров 1D NOE PL171, которые доказали, что полученный PL171 находится в конфигурации β, см. Фиг. 16.
Пример 18. Синтез PL172
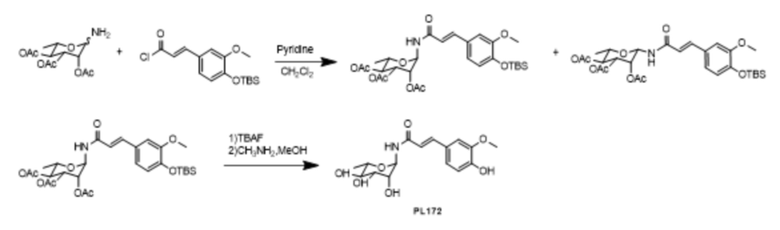
1-амино-2,3,4-о-триацетилрамнозу (5,86 г, 19 ммоль) растворяли в 100 мл безводного дихлорметана, а (4-О-TBS)-ацилхлорид феруловой кислоты (6,5 г, 20 ммоль) (Free Radical Res. 2015, 102) в безводный раствор дихлорметана и по каплям добавляли 1,0 мл безводного пиридина под ледяной баней. После перемешивания реакцию останавливали в течение 2 часов при комнатной температуре. Для разбавления добавляли 200 мл дихлорметана, затем промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали. Продукт β-гликозилирования (8,22 г, 70%) и продукт α-гликозилирования (1,2 г, 10%) были получены соответственно методом колоночной хроматографии (петролейный эфир:этилацетат = 10:1-2:1). Продукт β-гликозилирования (500 мг, 0,86 ммоль) растворяли в высушенном ТГФ (8,0 мл), реакцию проводили под действием TBAF, разбавляли, промывали насыщенным хлоридом натрия, сушили над MgSO4 и концентрировали до получения 250 мг TBS-депротекторного продукта. 300 мг (0,54 ммоль) полученного продукта растворяли в 3,0 мл дихлорметана, по каплям добавляли 0,5 мл 33%-ного раствора CH3NH2 в метаноле при 0°С и реагировали в течение 1 часа при 0°С. 45 мг (0,13 ммоль) PL172 получали быстрым концентрированием при пониженном давлении методом колоночного хроматографического разделения (дихлорметан: метанол = 20: 1-6: 1). ESI (+)-MS: 340.3 [M + 1]+; 1H-ЯМР (CD3OD, 400 МГц) δ 7.53 (d, J = 16 Гц, 1H) 7.14 (d, J = 41 Гц, 1H), 7.05 (dd, J1 = 8 Гц, J2 = 1 Гц, 1H), 6.80 (d, J = 8 Гц, 1H), 6.56 (d, J = 16 Гц, 1H), 5.56 (d, J = 4 Гц, 1H), 3,89 (S, 3H),3,85-3,83 (M,1H), 3,54-3,52 (M, 1H), 3,44 (T, J = 12 Гц, 1h), 3,31-3,3 (m, 1H) 1,27 (D, J = 4 Гц, 3h).
Все документы, указанные в этой заявке, включены сюда посредством ссылок так, как если бы каждый документ был индивидуально включен посредством ссылки. Кроме того, следует понимать, что после прочтения вышеприведенного раскрытия специалисты в данной области техники могут вносить различные изменения или модификации в изобретение, и эти эквивалентные формы также попадают под объем притязаний, определенный прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНОГО РАССТРОЙСТВА И ЕЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2791317C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АПОПТОЗА НЕЙРОНОВ ИЛИ НЕЙРОДЕГЕНЕРАЦИИ | 2011 |
|
RU2586772C2 |
| СОЕДИНЕНИЯ АЛЬФА-АМИНОАМИДНЫХ ПРОИЗВОДНЫХ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2015 |
|
RU2673622C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АПОПТОЗА НЕЙРОНОВ ИЛИ НЕЙРОДЕГЕНЕРАЦИИ | 2011 |
|
RU2722018C2 |
| N-(2-ТИАЗОЛИЛ)АМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ GSK-3 | 2007 |
|
RU2450000C2 |
| N-(2-ТИАЗОЛИЛ)АМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ GSK-3 | 2007 |
|
RU2429237C2 |
| АНАЛОГИ ЦИСТАМИНА, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2012 |
|
RU2630583C2 |
| ДИКЕТОНЫ И ГИДРОКСИКЕТОНЫ В КАЧЕСТВЕ АКТИВАТОРА СИГНАЛЬНОГО ПУТИ КАТЕНИНА | 2011 |
|
RU2592694C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ АМИЛОИДОЗОВ | 2009 |
|
RU2491953C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ БЕТА-АМИЛОИДНЫХ ЗАБОЛЕВАНИЙ И СИНУКЛЕИНОПАТИЙ | 2009 |
|
RU2501792C2 |

Группа изобретений относится к области фармацевтики, а именно к новым терапевтическим препаратам для лечения нейродегенеративных заболеваний, их получению и применению. Предложено соединение формулы I, а также применение соединения формулы I для получения лекарственного средства для профилактики, облегчения или лечения нейродегенеративных заболеваний или депрессии, и фармацевтическая композиция, содержащая указанное соединение и фармацевтически приемлемый носитель. Предложен также способ профилактики, облегчения или лечения нейродегенеративных заболеваний или депрессии, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы I или его фармацевтически приемлемой соли, в частности, соединения II, III, IV или V. Предложены также способы получения соединений III, IV или V. Показано, что соединение формулы I может эффективно усиливать функционирование нервных стволовых клеток как в in vivo, так и in vitro экспериментах, и может быть применено в рамках лечебного подхода для ускорения нейрорегенерации для борьбы с когнитивным упадком, связанным с процессами старения или нейродегенеративным заболеванием. 7 н. и 11 з.п. ф-лы, 18 ил., 18 пр.
1. Соединение формулы (I) или его фармацевтически приемлемая соль,
(I)
где  представляет собой шестичленное гетероциклическое кольцо, где X представляет собой O;
представляет собой шестичленное гетероциклическое кольцо, где X представляет собой O;
Y выбирают из O или N; и
R1 представляет собой С1-С4 алкил; R2–R4 представляют собой гидроксил;
причем когда Y представляет собой O, соединение находится в конфигурации β.
2. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 1, где
R1 представляет собой С1-С2-алкил;
R2–R4 представляют собой гидроксил.
3. Соединение формулы (I) или его фармацевтически приемлемая соль по п. 1, отличающееся тем, что соединение представлено формулами III, IV или V
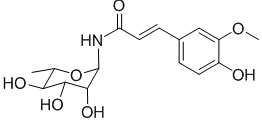
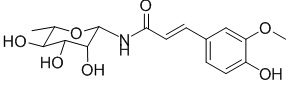 .
.
4. Применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для профилактики, облегчения или лечения нейродегенеративных заболеваний или депрессии;

(I)
где  представляет собой шестичленное гетероциклическое кольцо, и где X представляет собой O;
представляет собой шестичленное гетероциклическое кольцо, и где X представляет собой O;
Y выбирают из O или N; и
R1 представляет собой С1–С4 алкил; R2–R4 представляют собой гидроксил.
5. Применение по п. 4, где R1 представляет собой C1–C2 алкил.
6. Применение по п. 4, в котором нейродегенеративные заболевания представляют собой
нейродегенеративные заболевания, характеризующиеся возникновением нейровоспаления в головном мозге; или
нейродегенеративные заболевания, характеризующиеся значительным увеличением синтеза Aβ; или
нейродегенеративные заболевания, характеризующиеся значительным снижением способности к обучению и запоминанию; или
нейродегенеративные заболевания, характеризующиеся снижением функционирования нервных стволовых клеток; или
нейродегенеративные заболевания, характеризующиеся снижением координационной способности движений; или
нейродегенеративные заболевания, характеризующиеся снижением количества дофаминергических нейронов в черной субстанции; или
нейродегенеративные заболевания, характеризующиеся снижением уровня стриатальных дофаминергических нервных волокон.
7. Применение по п. 6, где нейродегенеративные заболевания включают болезнь Альцгеймера, болезнь Паркинсона, деменцию с тельцами Леви, болезнь Хантингтона и боковой амиотрофический склероз.
8. Применение по п. 4, где указанное соединение представлено формулами II, III, IV или V
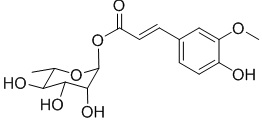


 .
.
9. Фармацевтическая композиция для профилактики, облегчения или лечения нейродегенеративных заболеваний или депрессии, содержащая
соединение формулы (I) или его фармацевтически приемлемую соль, охарактеризованные в любом из пп. 4, 5 и 8; и
фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п. 9, в которой лекарственная форма фармацевтической композиции включает порошок, таблетку, пилюлю, капсулу, препарат замедленного высвобождения, препарат контролируемого высвобождения, инъекцию, инфузионный раствор и суспензию.
11. Способ профилактики, облегчения или лечения нейродегенеративных заболеваний или депрессии, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, охарактеризованных в любом из пп. 4, 5 и 8.
12. Способ по п. 11, в котором нейродегенеративные заболевания представляют собой
нейродегенеративные заболевания, характеризующиеся возникновением нейровоспаления в головном мозге; или
нейродегенеративные заболевания, характеризующиеся значительным увеличением синтеза Aβ; или
нейродегенеративные заболевания, характеризующиеся значительным снижением способности к обучению и запоминанию; или
нейродегенеративные заболевания, характеризующиеся снижением функционирования нервных стволовых клеток; или
нейродегенеративные заболевания, характеризующиеся снижением координационной способности движений; или
нейродегенеративные заболевания, характеризующиеся снижением количества дофаминергических нейронов в черной субстанции; или
нейродегенеративные заболевания, характеризующиеся снижением уровня стриатальных дофаминергических нервных волокон.
13. Способ по п. 11, где нейродегенеративные заболевания включают болезнь Альцгеймера, болезнь Паркинсона, деменцию с тельцами Леви, болезнь Хантингтона и боковой амиотрофический склероз.
14. Способ получения соединения формулы III, указанного в п. 3, включающий стадию взаимодействия β-рамнопиранозида с тетрабутиламмонийфторидом с получением соединения формулы III, имеющего следующую структуру:
 .
.
15. Способ по п. 14, в котором β-рамнопиранозид получают взаимодействием 2,3,4-O-триацетилрамнозы с ацилхлоридом (4-О-трет-бутилдиметилсилил)-феруловой кислоты.
16. Способ получения соединения формулы IV, указанного в п. 3, включающий стадию взаимодействия α-1-аминорамнозида с тетрабутиламмонийфторидом с получением соединения формулы IV, имеющего следующую структуру:
 .
.
17. Способ получения соединения формулы V, указанного в п. 3, включающий стадию взаимодействия β-1-аминорамнозида с тетрабутиламмонийфторидом с получением соединения формулы V, имеющего следующую структуру:
 .
.
18. Способ по п. 16 или 17, в котором α-1-аминорамнозид и/или β-1-аминорамнозид получают взаимодействием 2,3,4-о-триацетил-1-аминорамнозы с ацилхлоридом (4-О-трет-бутилдиметилсилил)-феруловой кислоты.
| GROND S | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| European Journal of Organic Chemistry, 2000, V | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ укрепления лопаток цепного движителя | 1922 |
|
SU1841A1 |
| Найдено из | |||
Авторы
Даты
2023-07-05—Публикация
2019-01-29—Подача