Изобретение относится к медицине, конкретно к эндокринной хирургии и лучевой диагностике и может быть использовано в лечении больных опухолями надпочечников (НП) при планировании доступа для адреналэктомии (АЭ).
Анатомические особенности расположения НП на границе брюшной полости, грудной полости и забрюшинного пространства являются предрасполагающими факторами развития осложнений как интра-, так и послеоперационного периода АЭ, с которыми сталкиваются многие хирурги, несмотря на достижения в области малоинвазивных оперативных вмешательств, совершенствование физических методов диссекции и коагуляции, а также накопленный с годами опыт работы в данной сфере. При выборе хирургического доступа для АЭ не всеми хирургами учитываются особенности топографо-анатомического расположения НП, изменяющиеся в условиях опухолевого роста [1, 4]. Вариабельность сосудистой архитектоники НП, почек, селезенки зачастую удаются диагностировать лишь во время интраоперационной ревизии органов [3]. Наряду с этим появились сведения о возможностях мультиспиральной компьютерной томографии (МСКТ) на дооперационном этапе осуществить проектирование хирургического доступа к НП с опухолью для АЭ [2, 7, 8, 9].
Программы трехмерной визуализации обладают дополнительными возможностями в создании объемного изображения целого комплекса анатомических структур за минимальное количество затраченного на данный процесс времени, не предъявляя высоких требований к техническому оснащению специалиста в области эндокринной хирургии.
Существующие программы реконструкции изображений, такие как SSD (Shaded Surface Display) и VRT (Volume Rendering Technique), основанные на принципе изотропности изображения и способны моделировать пространственное топографо-анатомическое расположение органа, в случае новообразований НП остаются до сих пор недостаточно изученными, с точки зрения, хирургии НП [6].
В литературе практически отсутствуют данные о возможностях компьютерной томографии (КТ) и программ постобработки изображений в проектировании безопасного хирургического доступа к НП до операции, что особенно актуально в эру минимально инвазивных эндовидеохирургических технологий.
По результатам отечественных авторов, которые приводят данные о 20 клинических наблюдениях, дооперационное проектирование хирургического доступа к образованиям НП с использованием трехмерной КТ позволило визуализировать центральную вену НП в 65,2% случаев, при этом центральная вена левого НП прослеживалась чаще (74,7%), чем правого. Нижнюю надпочечниковую артерию удалось визуализировать только в 32,8% случаев (левую - в 38,3%, правую - в 17,9%). Помимо небольшой выборки больных, недостатком данного исследования явилось и неудовлетворительное качество изображения (исследование выполнялось на 8-срезовом компьютерном томографе). На этот недостаток авторы статьи акцентировали внимание при сравнении данных лучевой визуализации с данными, полученными интраоперационно: В 4 случаях на КТ не удалось обнаружить плотного прилегания опухоли НП к нижней полой вене (НПВ), в 6 случаях - к почечным сосудам, в 2 - к диафрагме, в 3 - к селезенке и в 1 случае - к петле ободочной кишки. Попытки цветового кодирования зоны интереса и отдельных ее анатомических элементов при помощи специального программного обеспечения потребовали проведения полуавтоматической текстурной сегментации и последующей ее коррекции специалистом лучевой диагностики. Очевидно, что данный метод мало применим в широкой клинической практике хирурга, в виду значительных затрат времени и технических ресурсов на выполнение одного исследования [2].
Таким образом, на сегодняшний день, спектр задач эндокринного хирурга значительно расширился и включает: знание методики и протоколов МСКТ; сопоставление комплекса клинико-лабораторных данных с результатами лучевого исследования; умение анализировать не статичные КТ-снимки, а многоплоскостные срезы; выполнение постобработки изображений с применением программ трехмерной реконструкции, позволяющие создавать виртуально-образное восприятие о топографии и синтопии НП с опухолью на дооперационном этапе. Совместная, тщательно спланированная и реализованная по оптимальному алгоритму работа специалиста лучевой диагностики и клинициста в оценке КТ-данных - залог верно поставленного предоперационного диагноза и выбранной стратегии ведения больных опухолями НП.
Отсутствие единых взглядов среди хирургов и специалистов лучевой диагностики о целесообразности КТ в дифференциальной диагностике образований НП и использовании ее возможностей в навигации рационального хирургического доступа для АЭ диктует необходимость обосновать место КТ в хирургии НП.
Нами поставлена задача разработать способ проектирования доступа для АЭ с использованием возможностей КТ, постпроцессорной обработки изображений и 3D-принтера, позволяющих спрогнозировать и избежать развития технических трудностей и осложнений во время оперативного вмешательства, тем самым сократив продолжительность АЭ и, как следствие, сроки реабилитации пациентов.
В результате решения данной задачи способ позволит исключить развитие интра- и послеоперационных осложнений, сократить продолжительность хирургического вмешательства, минимизировать операционную травму и длительность нахождения больного в стационаре за счет создания персональной трехмерной модели образования НП с ближайшими органами и сосудистыми структурами.
Решение поставленной задачи обеспечивается тем, что в способе проектирования хирургического доступа для адреналэктомии, включающем в себя выполнение мультиспиральной компьютерной томографии с внутривенным контрастированием, проводят постпроцессорную обработку изображений в аксиальной, фронтальной, сагиттальной плоскостях, при этом для правого надпочечника при трехмерной визуализации угол зрения выбирают таким образом, чтобы он соответствовал положению эндоскопа при лапароскопическом правостороннем, заднем ретроперитонеоскопическом, торакофренотомическом, доступах к надпочечнику;
затем выявляют критерии риска
- для правого надпочечника: ИМТ, больший или равный 30 кг/м; диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в воротах почки, относительно нижней полой вены в ретрокавальной позиции, а также нижней правой печеночной вены; короткая центральная вена надпочечника и ее впадение в заднюю стенку нижней полой вены; наличие добавочных вен надпочечника; наличие признаков сосудистой инвазии;
- для левого надпочечника: ИМТ, больший или равный 30 кг/м2, диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в области ворот почки, аорторенального сосудистого треугольника, вблизи сосудов селезенки, а также признаки сосудистой инвазии опухоли;
наличие каждого критерия оценивают в 1 балл и баллы суммируют;
- при количестве менее 3 баллов для левого и менее 4 баллов для правого надпочечника предпочтительным считают ретроперитонеоскопический или лапароскопический доступы,
- при количестве более 3 баллов для левого и более 4 баллов для правого справа предпочтительным считают открытую адреналэктомию;
при количестве 3 баллов для левого надпочечника и 4 баллов для правого надпочечника дополнительно проводят полуавтоматическую компьютерно-томографическую сегментацию при помощи программного обеспечения Slicer 4.10.1, получают персонализированную 3D-модель надпочечника с опухолью и выбирают вариант доступа для адреналэктомии: ретроперитонеоскопический, лапароскопический, торакофренотомический и открытый.
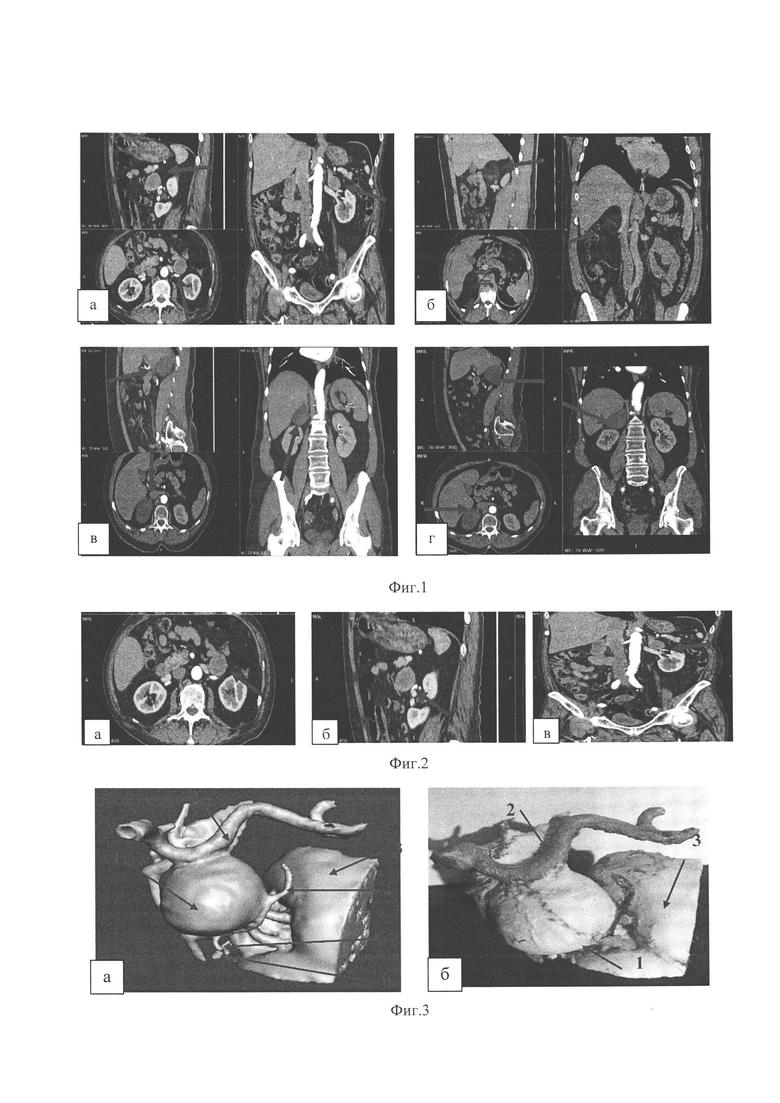
Изобретение поясняется фиг. 1, на которой показаны компьютерные томограммы больных опухолями НП и проектирование доступа для АЭ (стрелками указано направление доступов): а - левосторонний ретроперитонеоскопический; 6 - правосторонний ретроперитонеоскопический; в - правосторонний лапароскопический; г - правосторонний торакофренотомический. На фиг. 2 показаны компьютерные томограммы феохромоцитомы левого НП больного Я. в аксиальной (а), сагиттальной (б) и фронтальной (в) плоскостях. На фиг. 3 приведена объемная модель феохромоцитомы левого НП больного Я.: а - компьютерная (вид со стороны левого бокового канала живота); б - полимерная (вид со стороны передней брюшной стенки). На фиг. 4 приведено интраоперационное фото больного Я.: выделены левая почечная вена, центральная вена левого НП (на синей лигатуре) и нижняя диафрагмальная вена.
Способ осуществляется следующим образом.
Компьютерную томографию выполняли на 64-срезовом компьютерном томографе «Aquilion 64» («Toshiba», Япония) со спиральным сканированием и построением реконструкций изображений в различных режимах (MPR, SSD, MIP, VRT). Изучали рентгеновскую плотность и структуру образований НП, а также изменение этих показателей после внутривенного введения неионного рентгеноконтрастного средства с концентрацией йода 350 мг/мл. Постобработку изображений с построением многоплоскостных и VRT реконструкций проводили с использованием программного комплекса «Vitrea» («Vital», США) [5]. Трехмерную реконструкцию производили средствами рабочей станции, подключенной к спиральному компьютерному томографу. Первоначально сканирование выполняли в сосудистую фазу контрастирования после внутривенного введения 150 мл контрастного вещества со скоростью 4 мл/с, затем получали изображения в фазу контрастирования почечной паренхимы после 60 секунды введения контрастного вещества и через 15 минут после вымывания контрастного препарата (отсроченная фаза). Все изображения были получены при следующих технических условиях: 120 kV, толщина среза - 2,5 мм, толщина среза при реконструкции - 1,0 мм, шаг реконструкции - 2,5 мм. По трехмерным данным оценивали размеры, положение и взаимоотношение образования НП с окружающими органами, а также выявляли признаки компрессии соседних структур или прорастания. С правой стороны оценивали связь опухоли НП с нижней полой веной (НПВ), правой почкой, почечными сосудами (ворота почки) и печенью, при левосторонних поражениях - с аортой, левой почкой, почечными сосудами, поджелудочной железой, селезенкой, селезеночной веной и артерией, желудком и ободочной кишкой.
При правосторонних поражениях по данным трехмерной реконструкции наиболее часто выявляли прилегание образования НП к печени и НПВ, реже - к почечным сосудам. При трехмерной визуализации угол зрения выбирали таким образом, чтобы он соответствовал положению эндоскопа при различных доступах к НП: трансперитонеальном, заднем ретроперитонеальном и трансдиафрагмальном ретроперитонеальном (фиг. 1).
Детальный анализ интраоперационных сведений в сопоставлении с КТ-данными позволил выделить причинные факторы, удлиняющие время выполнения оперативного вмешательства в условиях ограниченного объема забрюшинного пространства. К ним достоверно относятся, при доступе к правому НП: ИМТ≥30 кг/м2; диаметр образования НП ≥8 см; расположение НП с опухолью в воротах почки, относительно нижней полой вены (ретрокавальная позиция), а также нижней правой печеночной вены (НППВ); короткая центральная вена (ЦВ) НП и ее впадение в заднюю стенку НПВ; наличие добавочных вен НП; наличие признаков сосудистой инвазии (р≤0,05).
Факторами, удлиняющими выполнение доступа к левому НП, являются: ИМТ ≥30 кг/м2, диаметр образования НП ≥8 см; расположение НП с опухолью в области ворот почки, аорторенального сосудистого треугольника, вблизи сосудов селезенки, а также признаки сосудистой инвазии опухоли (р≤0,05). Средняя продолжительность оперативных вмешательств у пациентов, имеющих данные факторы, составила 158,2±35,0 мин, средняя продолжительность оперативных вмешательств при их отсутствии - 129,4±7,8 мин. Проведенное исследование свидетельствует о наличии прямой пропорциональной связи между количеством критериев риска технических трудностей выполнения АЭ и продолжительностью оперативного времени.
Далее критерии риска развития технических трудностей, имеющиеся у конкретного больного, суммировали. Установлено, что при наличии 4 и более критериев риска развития технических трудностей у пациента с правосторонней локализацией опухоли НП (3 и более при левосторонней локализации), предпочтении следует отдавать АЭ из открытого доступа. При меньшем суммарном количестве признаков (менее 4 - для правого и менее 3 - для левого) наиболее безопасным доступом следует считать эндовидеохирургический.
У больных с пограничным количеством критериев риска развития технических трудностей (с правосторонней локализацией опухоли НП - 4 критерия, с левосторонней локализацией - 3 критерия) можно столкнуться со сложностями при выборе оптимального хирургического доступа для АЭ. Эти сложности, прежде всего, вызваны большими размерами гормонально-активных образований НП, а также высоким риском повреждения во время оперативного вмешательства сосудистых структур. С целью создания объемного представления о расположении НП с опухолью и выбора рационального хирургического доступа для АЭ проводили КТ-сегментацию изображений с последующим созданием 3D-модели органа, позволившую аргументированно определиться с доступом. На основании цифровых данных, полученных при проведении КТ-исследования с внутривенным контрастированием и применением специализированного программного обеспечения Slicer формируется трехмерная модель зоны интереса (органокомплекс НП с опухолью, воротами почки, центральной веной НП и другими сосудистыми структурами). Полученную виртуальную модель из цифровых данных преобразовывают в набор управляемых команд для 3D-принтера и создают твердотельный объект, соответствующий разработанным геометрическим характеристикам.
Предложенным способом выбор доступа осуществлен 3 больным, во всех случаях удалось добиться абсолютно точной визуализации органов и структур в условиях опухолевого роста с учетом индивидуальных особенностей каждого конкретного пациента. Технических трудностей, которые могли бы привести к удлинению оперативного вмешательства или развитию осложнений как во время, так и после хирургического лечения, не отмечено.
Клинический пример 1. Пациент Я., 71 года, госпитализирован 16.05.2019 г. в клинику факультетской хирургии им. СП. Федорова ВМедА с диагнозом основного заболевания «Феохромоцитома левого надпочечника». Диагноз был установлен на основании жалоб больного на повышение артериального давления (АД) до 180-190/100-110 мм рт.ст., данных лабораторной диагностики (повышение в плазме крови уровней метанефрина до 493 пг/мл и норметанефрина до 1018 пг/мл) и КТ с в/в контрастированием (образование левого надпочечника диаметром 5,0 см с четкими ровными контурами неоднородной структуры за счет наличия очагов некроза размерами 0,5×0,5 см, плотностью в нативную фазу сканирования 30 HU, накапливающее контрастный препарат в паренхиматозную фазу сканирования до 70 HU, в отсроченную фазу сканирования вымывающее контрастный препарат до 38HU; показатели АВК - 80%, ОВК - 45,7%).
При объективной оценке обращала на себя внимание выраженная сопутствующая патология пациента: «ИБС. Аритмический вариант. Атеросклероз аорты, коронарных артерий. Атеросклеротический кардиосклероз с нарушением ритма по типу постоянной формы фибрилляции-трепетания предсердий, тахисистолический вариант, асимптомная (I класс по EHRA), риск тромбоэмболических осложнений по CHA2DS2-VASC - 3 балла. Атеросклеротический комбинированный порок митрального клапана 1 ст.Гипертоническая болезнь III стадии. Артериальная гипертензия 3 степени, риск 4. ХСНП А стадии. ФК I». Физический статус больного соответствовал IV баллам по классификации ASA. После комплексной предоперационной подготовки, в том числе с применением альфа-адреноблокатора доксазозин в суточной дозировке 4 мг/сут, удалось повысить физический статус больного до III балла.
При оценке антропометрических данных ИМТ больного - 25,4 кг/м2.
Комплексное изучение топографо-анатомического расположения опухоли левого надпочечника и ее размеров, моделирования и проектирования варианта доступа для АЭ при помощи многоплоскостных срезов КТ не позволило определиться с рациональным вариантом оперативного доступа (фиг. 2). С целью создания виртуально-образной модели НП с опухолью, а также выбора безопасного варианта хирургического доступа для АЭ с учетом модифицированного алгоритма при помощи метода сегментации КТ-изображений была воссоздана реальная модель органа в условиях опухолевого роста. На основании цифровых данных, полученных при проведении КТ с в/в контрастированием с применением специализированного программного обеспечения Slicer была сформирована трехмерная модель зоны интереса (органокомплекс левого НП с феохромоцитомой, левой почкой, центральной веной левого НП, а также нижней диафрагмальной веной, артерией и веной селезенки). Полученную виртуальную модель из цифровых данных преобразовали в набор управляемых команд для 3D-принтера и создали твердотельный объект, соответствующий разработанным геометрическим характеристикам (фиг. 3). Стрелками указаны: 1 - феохромоцитома; 2 -селезеночная артерия; 3 - левая почка; 4 - нижняя диафрагмальная вена; 5 -центральная вена надпочечника; 6 - левая почечная вена.
На основании проведенного обследования и выполненного моделирования НП с опухолью было установлено, что у пациента имеется 3 КТ-критерия прогнозируемых технических трудностей во время операции (расположение феохромоцитомы левого НП с опухолью в воротах почки - 1 балл; вблизи селезеночной артерии и селезеночной вены - 1 балл; вблизи ворот левой почки - 1 балл). Кроме того, выраженная сопутствующая патология больного являлась противопоказанием к созданию карбоксиретроперитонеума и, соответственно, выполнению АЭ из ретроперитонеоскопического доступа. Использование персонализированной 3D-модели расположения левого НП с опухолью обеспечило виртуально-образное восприятие и целесообразность выполнения АЭ из лапаротомного доступа.
Больному в условиях общей анестезии с интубацией трахеи и ИВЛ в положении лежа на спине была выполнена срединная лапаротомия. После отведения петель тонкой кишки в сторону правого бокового канала и рассечения заднего листка брюшины ниже связки Трейца слева от аорты в забрюшинной клетчатке выявлена опухоль синюшнего цвета мягко-эластичной консистенции размерами 5,0×4,0×4,0 см в капсуле, на которой распластана кора левого НП. Визуализирована центральная вена левого НП, нижняя диафрагмальная вена и место их впадения в левую почечную вену (фиг. 4). Центральная вена левого НП выделена, лигирована и пересечена. Выполнена мобилизация левого НП с опухолью при помощи электрохирургического биполярного энергетического устройства. Выполнено удаление левого НП с опухолью. Забрюшинное пространство санировано и дренировано широким полихлорвиниловым дренажом. Дефект в париетальной брюшине ушит непрерывным швом. Продолжительность оперативного вмешательства составила 138 минут.
Результаты проведенного гистологического исследования свидетельствовали о наличии в исследуемом материале феохромоцитомы альвеолярного варианта строения.
Послеоперационный диагноз: феохромоцитома левого надпочечника.
Послеоперационный период протекал без особенностей и осложнений.
Достигнуто целевое АД 140/90 мм рт.ст. Учитывая наличие гипертонической болезни II стадии, совместно с кардиологом была подобрана гипотензивная терапия (Физиотенз 200 мг по 1 таб. 2 р/д, Бисопролол 5 мг 1 р/д, Арифон ретард 1,5 мг 1 р/д). Непосредственные результаты лечения: дренаж из забрюшинного пространства слева удален на следующие сутки после операции, восстановление перистальтики - на 3-е сутки, длительность приема НПВС - 5 суток, выписка больного после заживления ран первичным натяжением - на 7-е сутки.
При контрольном обследовании пациента через 7 месяцев после операции состояние удовлетворительное, жалоб не предъявляет. Эпизодов повышения АД на фоне приема гипотензивных препаратов пациент не отмечает. По данным оценки гормонального статуса (адренокортикотропный гормон, кортизол) признаков надпочечниковой недостаточности нет.
Источники информации:
1. Высоцкий, В.Ф. Дифференциальная диагностика и хирургическая тактика при новообразованиях надпочечников: Автореф. дис… канд.мед.наук. / В.Ф. Высоцкий. - Иркутск, 2012. - 22 с.
2. Емельянов, С.И. Использование трехмерной компьютерной томографии в планировании лапароскопической адреналэктомии / С.И. Емельянов, В.А. Вередченко, А.Е. Митичкин // Вестник экспериментальной и клинической хирургии. - 2008. - Т. 1, №1. - С. 13-16.
3. Кривошеев, А.В. Лапароскопическая адреналэктомия в хирургическом лечении адренокортикального рака / А.В. Кривошеев, Т.А. Бритвин, М.Е. Белошицкий // Вестник Российской военно-медицинской академии. - 2019. - Т. 1, №1. - С. 75-78.
4. Курганов, И.А. Малоинвазивные оперативные вмешательства в эндокринной хирургии: Автореф. дис… докт.мед.наук / И.А. Курганов. - Москва, 2019. - 49 с.
5. Прокоп, М. Спиральная и многослойная компьютерная томография / М. Прокоп, М. Галански // Учебное пособие, в двух томах, 3-е издание. Пер. с англ. - М.: «МЕДпресс-информ». - 2011. - Т. 2. - С. 436-438.
6. Blake, М.А. Distinguishing benign from malignant adrenal masses: multi-detector row CT protocol with 10-minute delay / M.A. Blake, M.K. Kalra, A.T. Sweeney [et al.] // Radiology. - 2006. - Vol. 238, №2. - P. 578-585.
7. Chen, L. Evolution of a large adrenal carcinoma with 3D reconstruction of computer tomography images: a case report and literature review / L. Chen, X. Zeng, S. Li [et al.] // Journal of X-Ray Science and Technology. - 2016. - Vol.24, №12.-P. 665-671.
8. Rowe, S.P. What the radiologist needs to know: the role of preoperative computed tomography in selection of operative approach for adrenalectomy and review of operative techniques / S.P. Rowe, C. Lugo-Fagundo, H. Ahn [et al.] // Abdom. Radiol. (NY). - 2019. - Vol.44, №1. - P. 1 - 14.
9. Walz, M.K. Minimal-invasive Nebennierenchirurgie. Transperitonealer oder retroperitonealer Zugang? Minimally invasive adrenal gland surgery. Transperitoneal or retroperitoneal approach // Der Chirurg. - Berlin: Springer-Verlag. - 2012. - Bd. 83, Heft 6. - P. 536 - 545.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ забрюшинной задней эндоскопической адреналэктомии опухолей больших размеров | 2022 |
|
RU2797271C1 |
| СПОСОБ ВЫПОЛНЕНИЯ ЗАДНЕЙ ЗАБРЮШИННОЙ АДРЕНАЛЭКТОМИИ | 2016 |
|
RU2614218C1 |
| ХИРУРГИЧЕСКИЙ ДОСТУП К НАДПОЧЕЧНИКАМ | 2004 |
|
RU2266062C1 |
| Способ предоперационного моделирования лапароскопического доступа при операциях на почках | 2022 |
|
RU2802124C1 |
| СПОСОБ ЭНДОХИРУРГИЧЕСКОЙ АДРЕНАЛЭКТОМИИ ПРИ ФЕОХРОМОЦИТОМЕ | 2002 |
|
RU2245105C2 |
| Способ предоперационного планирования лапароскопических адреналэктомий | 2023 |
|
RU2829892C1 |
| СПОСОБ ОЦЕНКИ ВЕРОЯТНОСТИ НАЛИЧИЯ ТЯЖИСТОЙ ПАРАНЕФРАЛЬНОЙ ЖИРОВОЙ КЛЕТЧАТКИ, СПАЯННОЙ С КАПСУЛОЙ ПОЧКИ, ПРИ ПЛАНИРОВАНИИ ОРГАНОСОХРАНЯЮЩИХ ОПЕРАЦИЙ НА ПОЧКЕ | 2020 |
|
RU2736908C1 |
| СПОСОБ ДОСТУПА К НАДПОЧЕЧНИКАМ | 1999 |
|
RU2165740C1 |
| СПОСОБ УДАЛЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ ЛЕВОГО НАДПОЧЕЧНИКА | 2012 |
|
RU2502477C1 |
| СПОСОБ ЭНДОХИРУРГИЧЕСКОЙ АДРЕНАЛЭКТОМИИ | 2001 |
|
RU2181987C1 |

Изобретение относится к медицине, а именно к эндокринной хирургии и лучевой диагностике и может быть использовано в лечении больных опухолями надпочечников при планировании доступа для адреналэктомии. Проводят постпроцессорную обработку изображений в аксиальной, фронтальной, сагиттальной плоскостях, при этом для правого надпочечника при трехмерной визуализации угол зрения выбирают таким образом, чтобы он соответствовал положению эндоскопа при лапароскопическом правостороннем, заднем ретроперитонеоскопическом, торакофренотомическом доступах к надпочечнику. Выявляют критерии риска. Для правого надпочечника: ИМТ, больший или равный 30 кг/м2; диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в воротах почки, относительно нижней полой вены в ретрокавальной позиции, а также нижней правой печеночной вены; короткая центральная вена надпочечника и ее впадение в заднюю стенку нижней полой вены; наличие добавочных вен надпочечника; наличие признаков сосудистой инвазии. Для левого надпочечника: ИМТ, больший или равный 30 кг/м2, диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в области ворот почки, аорторенального сосудистого треугольника, вблизи сосудов селезенки, а также признаки сосудистой инвазии опухоли. Наличие каждого критерия оценивают в 1 балл и баллы суммируют. При количестве менее 3 баллов для левого и менее 4 баллов для правого надпочечника предпочтительным считают ретроперитонеоскопический или лапароскопический доступы. При количестве более 3 баллов для левого и более 4 баллов для правого справа предпочтительным считают открытую адреналэктомию. Способ обеспечивает исключение развития интра- и послеоперационных осложнений, сокращение продолжительности хирургического вмешательства, минимизацию операционной травмы и длительности нахождения больного в стационаре за счет создания персональной трехмерной модели образования НП с ближайшими органами и сосудистыми структурами. 4 ил., 1 пр.
Способ проектирования хирургического доступа для адреналэктомии, включающий в себя выполнение мультиспиральной компьютерной томографии с внутривенным контрастированием, отличающийся тем, что проводят постпроцессорную обработку изображений в аксиальной, фронтальной, сагиттальной плоскостях, при этом для правого надпочечника при трехмерной визуализации угол зрения выбирают таким образом, чтобы он соответствовал положению эндоскопа при лапароскопическом правостороннем, заднем ретроперитонеоскопическом, торакофренотомическом доступах к надпочечнику;
затем выявляют критерии риска
- для правого надпочечника: ИМТ, больший или равный 30 кг/м2; диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в воротах почки, относительно нижней полой вены в ретрокавальной позиции, а также нижней правой печеночной вены; короткая центральная вена надпочечника и ее впадение в заднюю стенку нижней полой вены; наличие добавочных вен надпочечника; наличие признаков сосудистой инвазии;
- для левого надпочечника: ИМТ, больший или равный 30 кг/м2, диаметр образования, больший или равный 8 см; расположение надпочечника с опухолью в области ворот почки, аорторенального сосудистого треугольника, вблизи сосудов селезенки, а также признаки сосудистой инвазии опухоли;
наличие каждого критерия оценивают в 1 балл и баллы суммируют;
- при количестве менее 3 баллов для левого и менее 4 баллов для правого надпочечника предпочтительным считают ретроперитонеоскопический или лапароскопический доступы,
- при количестве более 3 баллов для левого и более 4 баллов для правого справа предпочтительным считают открытую адреналэктомию;
при количестве 3 баллов для левого надпочечника и 4 баллов для правого надпочечника дополнительно проводят полуавтоматическую компьютерно-томографическую сегментацию при помощи программного обеспечения Slicer 4.10.1, получают персонализированную 3D-модель надпочечника с опухолью и выбирают вариант доступа для адреналэктомии: ретроперитонеоскопический, лапароскопический, торакофренотомический и открытый.
| Емельянов С | |||
| И., Вередченко В | |||
| А., Митичкин А | |||
| Е | |||
| Использование трёхмерной компьютерной томографии в планировании лапароскопической адреналэктомии | |||
| Вестник экспериментальной и клинической хирургии | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭТАПНОСТИ ОПЕРАЦИЙ У БОЛЬНЫХ С РЕЗИСТЕНТНОЙ СИМПТОМАТИЧЕСКОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ ПРИ СОЧЕТАННОМ ПОРАЖЕНИИ НАДПОЧЕЧНИКОВ И СОННЫХ АРТЕРИЙ | 2018 |
|
RU2689883C1 |
| RU 99112163 A, 20.04.2001 | |||
| Ромащенко П.Н | |||
| и др., КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКОЕ ПРОЕКТИРОВАНИЕ ДОСТУПА ДЛЯ | |||
Авторы
Даты
2022-03-18—Публикация
2020-12-15—Подача