Изобретение относится к биотехнологии и может быть использовано в промышленности при изготовлении фильтров, обладающих антибактериальным действием, для очистки сточных вод.
Фицин (КФ 3.4.22.3) - протеолитический фермент, выделенный из латекса растений рода Ficus. Энзим относится к сульфгидрильным протеиназам, имеет довольно широкую субстратную специфичность. Фицин проявляет высокую активность в диапазоне значений рН среды 6.5-9.5, инактивируется при 80°С [Мосолов В.В. Протеолитические ферменты / В.В. Мосолов - М.: Наука, 1971. - 404 с].
Фицин нашел широкое применение в разных отраслях промышленности, в частности, в качестве пищевой добавки для улучшения качества муки и хлеба, стабилизатора, усилителя вкуса и аромата. Фермент используется в косметологии благодаря его ярко выраженным свойствам смягчать и восстанавливать кожу, прекращая шелушение. Фицин обладает антигельминтным, антибактериальным, кровоостанавливающим действиями.
Применение ферментов в растворе имеет ряд проблем, которые возможно решить с помощью их иммобилизации на нерастворимых носителях. Благодаря иммобилизации энзимы приобретают свойства гетерогенных биокатализаторов, становится возможным применять их повторно. Кроме того, повышается их стабильность, т.к. энзимы защищены от внешних воздействий и более устойчивы к неблагоприятным условиям, например, иммобилизация может защитить не только от действия высоких температур или экстремальных значений рН среды, но и от УФ-излучения. [Ficin: A protease extract with relevance in biotechnology and biocatalysis / R. Morellon-Sterling [et al.] // International Journal of Biological Macromolecules. - 2020. - V. 162. - P. 394-104].
Ионообменные смолы - высокомолекулярные синтетические соединения с трехмерной гелевой или макропористой структурой, которые содержат функциональные группы кислотной или основной природы, способные к реакциям ионного обмена.
Ионообменные смолы делятся на три основные группы - катиониты, аниониты и амфотерные иониты (полиамфолиты). Катиониты способны поглощать из растворов электролитов положительно заряженные ионы (катионы), проявляя свойства кислоты, а аниониты, наоборот, притягивают отрицательно заряженные ионы (анионы) из растворов и обменивают их на другие анионы, проявляя свойства оснований. Амфотерные иониты в своем составе одновременно содержат кислотные и основные ионогенные группы, и в зависимости от условий проявляют себя как катиониты или аниониты.
Использование ионообменных смол решает ряд практических задач: водоподготовка, умягчение или полная деионизация воды; очистка сточных вод от загрязнений; концентрация ионов и органических веществ в гидрометаллургии цветных и благородных металлов; улавливание химически активных примесей, содержащихся в газах промышленного производства; улучшение ионного обмена в почвах и внесение микроэлементов и удобрений, необходимых для роста растений [N.A. Bektenov, L.K. Ybraimzhanova Synthesis of ion-exchange resin and their application // ВестникКазНПУ им. Абая, серия «Естественно-географические науки». - 2019. - 1(59). - С.48-54].
В качестве прототипа служил способ получения гетерогенного ферментного препарата на основе фицина, обладающего ранозаживляющими и регенерирующими свойствами [Патент RU 2677858 С2, МПК A61K 31/74, A61K 38/46, А61Р 17/02, C12N 11/08, опубл. 10.01.2019, Бюл. №1], включающий иммобилизацию фицина в буферном растворе на матрицу ионообменных волокон ВИОН КН-1 в соотношении 20 мл буферного раствора фицина в концентрации 1 мг/мл на 1 г волокон, при этом в качестве буферного раствора используют 0.05 М трис-HCl буфер с рН 7.0; инкубирование в течение 24 часов при комнатной температуре с периодическим перемешиванием; промывание образовавшегося осадка 0.05 М трис-HCl буфером с рН 7.0 до отсутствия в промывных водах фицина.
Заявляемое изобретение предназначено для расширения числа носителей, используемых для получения иммобилизованного фицина. Применение с этой целью ионообменных смол КУ-2, КУ-2-8чС, IMAC-HP111, АВ-16-ГС, АВ-17-2П, PUROLITE А100, ЭДЭ-10П позволит получить биокатализатор с большей активностью и упростить процесс сорбции. Способ прост в исполнении, не требует предварительной активации носителя, а иммобилизованный фицин сохраняет высокую активность и стабильность. В отличие от прототипа в заявляемом изобретении используются ионообменные смолы, что позволяет повысить протеазную активность образцов до 147 ед/мл против 69 ед./мл в прототипе. Кроме того, время сорбции сокращается с 24 до 2 часов, т.е. в 12 раз.
Технический результат заявленного изобретения заключается в разработке простого в исполнении, не требующего предварительной активации носителя, способа получения гетерогенного биокатализатора на основе фицина, иммобилизованного на ионообменных смолах, позволяющего повысить протеазную активность до 147 ед/мл при сокращении времени сорбционной иммобилизации до 2 часов, а также проводить ферментативные реакции с высокими скоростями и в условиях среды, отличающихся от физиологических, в том числе в так называемых «агрессивных» условиях.
В своей работе мы оптимизировали условия для иммобилизации фицина адсорбционным методом на матрицах ионообменных смол с использованием различных буферов. После адсорбционной иммобилизации фермент более стабилен при варьировании значений рН среды и температуры, обладает пролонгированным действием.
Технический результат достигается тем что, в способе получения гетерогенного биокатализатора на основе фицина, иммобилизованного на ионообменных смолах, включающем адсорбционную иммобилизацию фицина в буферном растворе на матрицу ионообменной смолы, инкубацию при комнатной температуре с периодическим перемешиванием, промывку образовавшегося осадка буфером до отсутствия в промывных водах белка, согласно изобретению, иммобилизацию ведут в соотношении 20 мл раствора фицина в концентрации 2 мг/мл на 1 г воздушно-сухого носителя; при этом иммобилизацию проводят на матрицу ионообменной смолы АВ-17-2П или АВ-16-ГС, в качестве буферного раствора для иммобилизации используют соответственно 0.05 М фосфатный буфер для ионообменной смолы АВ-17-2П, рН 11.0 или 0.05 М NaOH-KCl буфер для АВ-16-ГС, рН 12.0, инкубацию осуществляют в течение 2 часов, промывку образовавшегося осадка проводят 0.05 М трис-HCl буфером, рН 7.5.
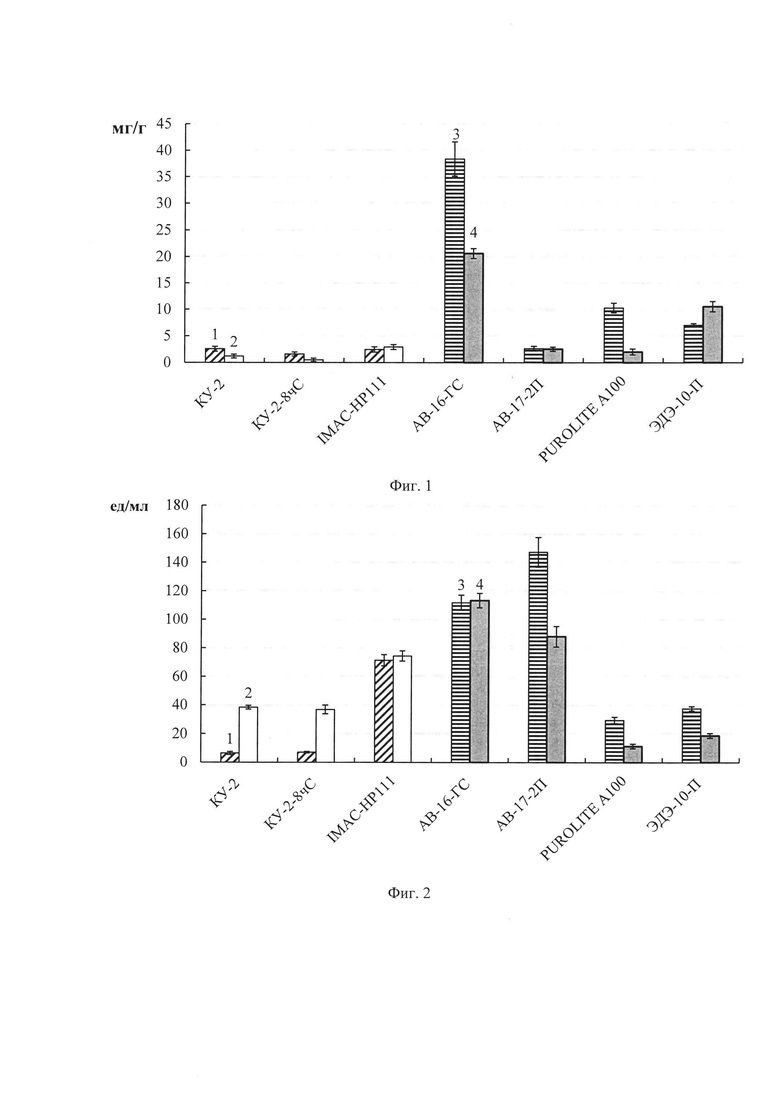
Фиг. 1. Содержание белка (мг/г носителя) в препаратах фицина, иммобилизованного адсорбционным методом на ионообменных смолах с использованием следующих буферов: 1 - 0.05 М фосфатный с рН 6.5; 2 - 0.05 М глициновый с рН 9.0; 3 - 0.05 М фосфатный с рН 11.0; 4 - 0.05 М NaOH-KCL с рН 12.0.
Фиг. 2. Протеазная активность (ед/мл раствора) в препаратах фицина, иммобилизованного адсорбционным методом на ионообменных смолах с использованием следующих буферов: 1 - 0.05 М фосфатный с рН 6.5; 2 - 0.05 М глициновый с рН 9.0; 3 - 0.05 М фосфатный с рН 11.0; 4 - 0.05 М NaOH-KCL с рН 12.0.
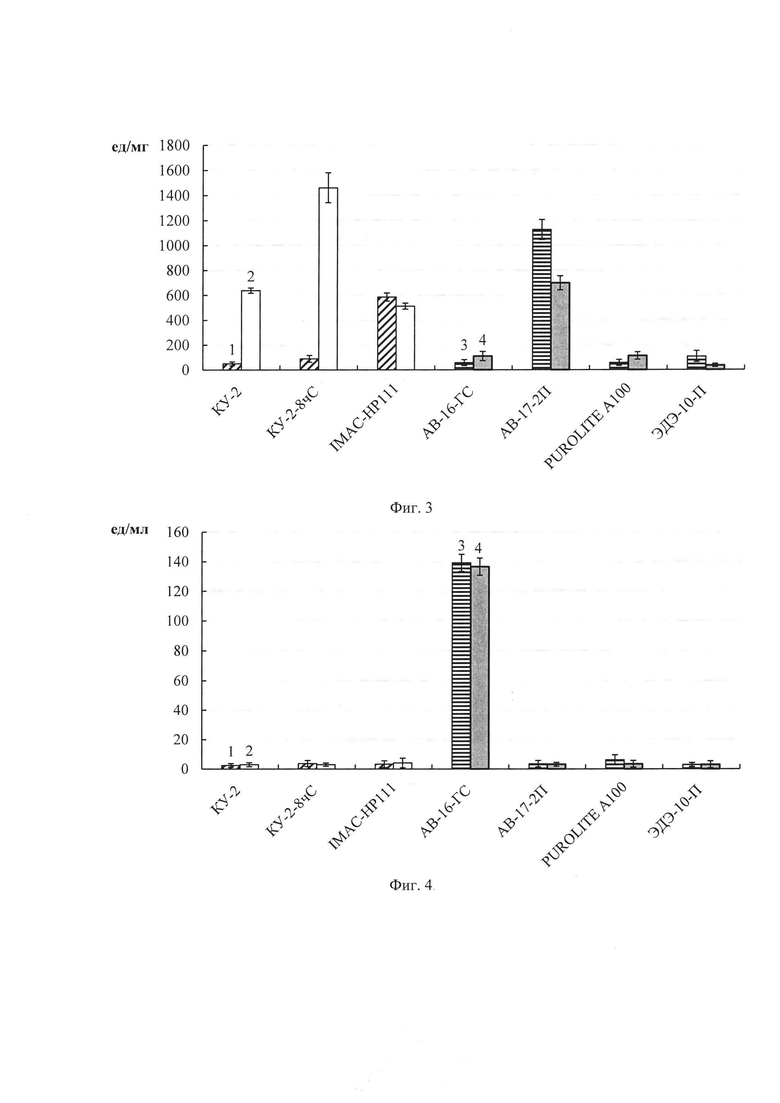
Фиг. 3. Удельная протеазная активность (ед/мг белка) в препаратах фицина, иммобилизованного адсорбционным методом на ионообменных смолах с использованием следующих буферов: 1 - 0.05 М фосфатный с рН 6.5; 2 - 0.05 М глициновый с рН 9.0; 3 - 0.05 М фосфатный с рН 11.0; 4 - 0.05 М NaOH-KCL с рН 12.0.
Фиг. 4. Эстеразная активность (ед/мл раствора) в препаратах фицина, иммобилизованного адсорбционным методом на ионообменных смолах с использованием следующих буферов: 1 - 0.05М фосфатный с рН 6.5; 2 - 0.05 М глициновый с рН 9.0; 3 - 0.05 М фосфатный с рН 11.0; 4 - 0.05 М NaOH-KCL с рН 12.0.
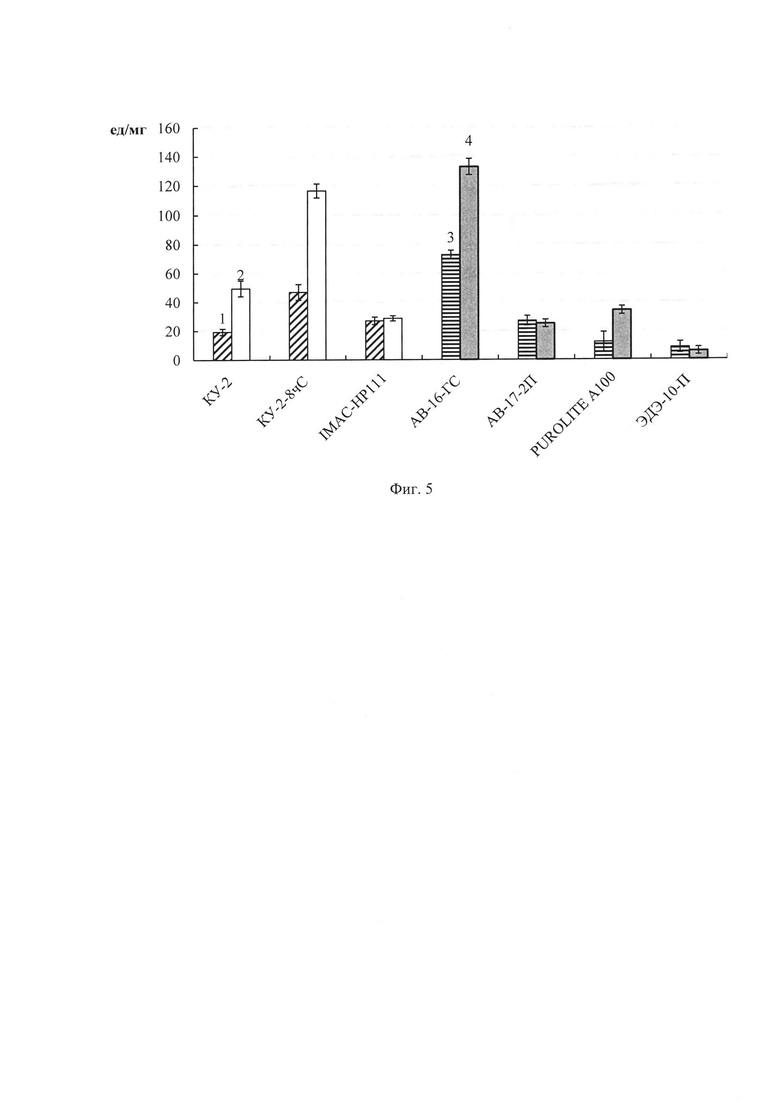
Фиг.5. Удельная эстеразная активность (ед/мг белка) в препаратах фицина, иммобилизованного адсорбционным методом на ионообменных смолах с использованием следующих буферов: 1 - 0.05 М фосфатный с рН 6.5; 2 - 0.05 М глициновый с рН 9.0; 3 - 0.05 М фосфатный с рН 11.0; 4 - 0.05 М NaOH-KCL с рН 12.0.
Пример реализации способа.
В качестве объекта исследования был выбран фицин (Sigma, США), субстратами для гидролиза служили азоказеин и N-α-бензоил-DL-аргинин-n-нитроанилид (BAPNA) (Sigma, США), носителями для иммобилизации - ионообменные смолы КУ-2, КУ-2-8 чС, IMAC-HP111, АВ-16-ГС, АВ-17-2П, PUROLITE А100, ЭДЭ-10П (Уральская химическая компания, Россия).
Перед проведением иммобилизации исследуемые образцы ионообменных смол помещали в насыщенный раствор NaCl на 3-4 ч для предотвращения растрескивания гранул, далее сорбент переносили в колонку и промывали дистиллированной водой. Для удаления минеральных примесей ионит сначала обрабатывали растворами HCl в количестве 5 объемов на 1 объем смолы в нарастающей концентрации (0.5-3.0 М) до отсутствия ионов железа в промывных водах, а затем обработку соляной кислотой повторяли при соответствующем уменьшении концентрации кислоты и отмывали смолу дистиллированной водой до нейтральной реакции. Следующей стадией подготовки ионитов-носителей была обработка растворами гидроксида натрия в нарастающей концентрации 0.1-0.25 М, после которой смолы отмывали дистиллированной водой. Для более полного удаления примесей кислотно-щелочную обработку проводили троекратно. После очистки ионит переводили в требуемую ионную форму в той же колонке: для перевода катионита в Н+- форму использовали раствор 0.5 М HCl, для перевода анионита в ОН" - форму - раствор 0.1 М NaOH в количестве 5 объемов раствора на 1 объем смолы [Горбунов Н.В. О кондиционировании катионитов / Н.В. Горбунов, Н.Г. Полянский. // Журнал физической химии. - 1978. - Т. 52, №5. - С. 1259-1262; Полянский Н.Г. Методы исследования ионитов / Н.Г. Полянский, Н.В. Горбунов, Н.Л. Полянская. - М.: Химия, 1976. - 208 с.]. Подготовленный таким образом носитель высушивали при комнатной температуре и хранили в емкости с плотно притертой крышкой [Создание гетерогенного ферментного препарата на основе иммобилизованной инулиназы из Helianthus tuberosus. Холявка М.Г. [и др.] // Биотехнология. - 2012. - №6. - С. 31-42.].
Иммобилизацию фицина на матрице ионообменной смолы осуществляли адсорбционным методом в буферном растворе. К 1 г воздушно-сухой ионообменной смолы добавляли 20 мл буферного раствора фермента в концентрации 2 мг фицина/мл, инкубировали в течение 2 часов. После окончания инкубации образовавшийся осадок промывали 0.05 М трис-HCl буфером, рН 7.5 до отсутствия в промывных водах белка (контроль осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
Содержание белка в иммобилизованных препаратах фицина определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275.].
Измерение протеазной активности фицина проводили на субстрате азоказеине (Sigma, США) [Sabirova A.R., Rudakova N.L., Balaban N.P., Ilyinskaya O.N., Demidyuk I.V., Kostrov S.V., Rudenskaya G.N., Sharipova M.R. A novel secreted metzincin metalloproteinase from Bacillus intermedins II FEBS Lett. - 2010 - V. 584 (21), P. 4419-4425]. К 50 мг иммобилизованного образца добавляли 200 мкл 0.05 М трис-HCl буфера с рН 7.5, 800 мкл азоказеина (0.5% в 0.05 М трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл трихлоруксусной кислоты (ТХУ) (5%), инкубировали 10 минут при 4°С, затем центрифугировали в течение 3 мин при 13 тыс об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 10 мм кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл буфера (иммобилизованный фермент в контрольную пробу вносили последним, остальные операции для нее делали аналогично опытным пробам).
Единицей протеазной активности служило количество фицина, которое в условиях эксперимента гидролизует 1 мкМ азоказеина за 1 мин. Удельную протеазную активность рассчитывали по формуле:
ПА=D*1000/120/200/С,
где ПА - протеазная активность препарата, мкМ/мин на 1 мг белка,
D - оптическая плотность раствора при 410 нм,
С - концентрация белка в пробе, мг/мл, измеренная по методу Лоури,
120 - время инкубации в минутах,
200 - объем пробы, мкл,
1000 - коэффициент для пересчета в мкМ.
Определение эстеразной активности фицина проводили на субстрате N-α-бензоил-DL-аргинин-n-нитроанилиде (BAPNA) [Erlanger D.F., Kokowski N., Cohen W. The preparation and properties of two new chromogenic substrates of trypsin // Arch. Biochem. Biophys. - 1961. - V. 95. - P. 271.]. К 50 мг образца добавляли 400 мкл BAPNA (1 мг/мл) и 400 мкл 0.2 М фосфатного буфера с рН 7.4, содержащего 0.04 М раствор цистеина. Инкубировали раствор 2 часа при 37°С, останавливали, реакцию 800 мкл 1 М HCl. Измеряли оптическую плотность образцов при длине волны 410 нм. Контрольная проба содержала 400 мкл BAPNA, 400 мкл 1 М HCl, 50 мг образца и 400 мкл буфера (иммобилизованный фермент в контрольную пробу вносили последним, остальные операции для нее делали аналогично опытным пробам).
Единицей эстеразной активности служило количество фицина, которое в условиях эксперимента гидролизует 1 мкМ N-α-бензоил-DL-аргинин-n-нитроанилида за 1 минуту. Удельную эстеразную активность рассчитывали по формуле:
ЭА=D*l 000/120/400/С,
где ЭА - эстеразная активность препарата, мкМ/мин на 1 мг белка,
D - оптическая плотность раствора при 410 нм,
С - концентрация белка в пробе, мг/мл, измеренная по методу Лоури,
120 - время инкубации в минутах,
400 - объем пробы, мкл,
1000 - коэффициент для пересчета в мкМ.
Все экспериментальные исследования осуществляли минимум в 8-кратной повторности. Статистическая обработка полученных результатов проводилась при уровне значимости 5% с использованием t-критерия Стьюдента.
При иммобилизации фицина на ионообменных материалах необходимо учитывать такие важные показатели, как заряды носителя и фермента. Значение pI фицина составляет 9.0 [Холявка М.Г. Практикум по биотехнологии: иммобилизованные биологические объекты в системе лабораторных работ / М.Г. Холявка, М.А. Наквасина, В.Г. Артюхов - Воронеж: Издательский дом ВГУ, 2017. - 161 с.], поэтому в качестве иммобилизационной среды для его адсорбции на катионитах КУ-2, КУ-2-8 чС и IMAC-НР111 мы использовали 0.05М фосфатный буфер с рН 6.5 и 0.05М глициновый буфер с рН 9.0, а для иммобилизации на анионитах АВ-17-2П, АВ-16-ГС, ЭДЭ-10П и PUROLITE А100 применяли 0.05М фосфатный буфер с рН 11.0 и 0.05М NaOH-KCL буфер с рН 12.0. Результаты отражены на фиг. 1-5.
Наибольшее количество белка в гетерогенных препаратах (в мг на г носителя) наблюдалось при иммобилизации фицина адсорбционным методом на матрице АВ-16-ГС с фосфатным буфером с рН 11.0 (фиг.1). Высокие значения общей протеазной активности фицина (в ед на мл раствора) были зарегистрированы при его иммобилизации на матрицах АВ-16-ГС с фосфатным буфером, рН 11.0 и NaOH-KCl буфером, рН 12.0, АВ-17-2П с фосфатным буфером, рН 11.0 (фиг. 2). Наибольшую удельную протеазную активность показали препараты фицина, иммобилизованного с помощью адсорбционного метода на матрицах КУ-2-8 чС с глициновым буфером, рН 9.0, АВ-17-2П с фосфатным буфером, рН 11.0 (фиг. 3).
При создании гетерогенных препаратов фицина адсорбционным методом наибольшая эстеразная активность (в ед на мл раствора) проявлялась при использовании носителя АВ-16-ГС с фосфатным буфером, рН 11.0 и NaOH-KCl буфером, рН 12.0 (фиг. 4). Наибольшую удельную эстеразную активность показали препараты фицина, иммобилизованного с помощью адсорбционного метода на матрицах КУ-2-8 чС с глициновым буфером рН 9.0, АВ-16-ГС с NaOH-KCl буфером с рН 12.0 (фиг. 5).
Адсорбционная иммобилизация фицина имеет ряд преимуществ над другими способами связывания фермента с матрицей носителя. Благодаря такому методу иммобилизации фермент не прикреплен к носителю ковалентно, следовательно, минимизированы стерические препятствия, препарат защищен от многих неблагоприятных факторов среды, в т.ч. от инактивации вследствие бактериального заражения. Мы сравнили полученные результаты по определению содержания белка, протеазной и эстеразной активности для препаратов фицина, иммобилизованных на матрицах ионообменных смол: КУ-2, КУ-2-8 чС, ГМАС-НР111, АВ-16-ГС, АВ-17-2П, PUROLITE А100, ЭДЭ-10П.
Оптимальное соотношение содержания белка (мг на г носителя), общей протеазной активности (в ед на мл раствора) и удельной протеазной активности (в ед на мг белка) выявлено при иммобилизации фицина на анионите АВ-17-2П с фосфатным буфером, рН 11.0. Оптимальное соотношение содержания белка (мг на г носителя), общей эстеразной активности (в ед на мл раствора) и удельной эстеразной активности (в ед на мг белка) выявлено при иммобилизации фицина на анионите АВ-16-ГС с NaOH-KCl буфером, рН 12.0.
Из вышеизложенного материала следует, что среди апробированных нами вариантов иммобилизации для создания гетерогенных препаратов на основе фицина и ионообменных смол наиболее перспективным является адсорбция на анионитах АВ-17-2П с фосфатным буфером, рН 11.0 и АВ-16-ГС с NaOH-KCl буфером, рН 12.0.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО БИОКАТАЛИЗАТОРА НА ОСНОВЕ ПАПАИНА, ИММОБИЛИЗОВАННОГО НА ИОНООБМЕННЫХ СМОЛАХ | 2021 |
|
RU2768742C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ПРЕПАРАТА НА ОСНОВЕ БРОМЕЛАЙНА, ИММОБИЛИЗОВАННОГО НА ИОНООБМЕННЫХ СМОЛАХ | 2021 |
|
RU2770208C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ФИЦИНА И N-МАЛЕОИЛХИТОЗАНА В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792784C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ФИЦИНА И АЦЕТАТА ХИТОЗАНА В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2792783C1 |
| Способ получения гибридного препарата фицина и аскорбата хитозана в виде густого раствора | 2023 |
|
RU2822735C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ФИЦИНА В ГЕЛЕ НА ОСНОВЕ КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ | 2021 |
|
RU2771183C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА ПАПАИНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2795425C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО ПРЕПАРАТА БРОМЕЛАЙНА И КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788454C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИОННОГО ПРЕПАРАТА ПАПАИНА И АЛЬГИНАТА НАТРИЯ В ВИДЕ ГУСТОГО РАСТВОРА | 2022 |
|
RU2788455C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО ФЕРМЕНТНОГО ПРЕПАРАТА НА ОСНОВЕ ФИЦИНА И НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2021 |
|
RU2769243C1 |
Изобретение относится к биотехнологии и представляет собой способ получения гетерогенного биокатализатора на основе фицина, иммобилизованного на ионообменных смолах, включающий адсорбционную иммобилизацию фицина в буферном растворе на матрицу ионообменной смолы, инкубацию при комнатной температуре, промывку образовавшегося осадка буфером, при этом иммобилизацию проводят на матрицу воздушно-сухой ионообменной смолы АВ-17-2П или АВ-16-ГС, а в качестве буферного раствора для иммобилизации используют 0,05 М фосфатный буфер для ионообменной смолы АВ-17-2П, рН 11,0 или 0,05 М NaOH-KCl буфер для АВ-16-ГС. 5 ил., 1 пр.
Способ получения гетерогенного биокатализатора на основе фицина, иммобилизованного на ионообменных смолах, включающий адсорбционную иммобилизацию фицина в буферном растворе на матрицу ионообменной смолы, инкубацию при комнатной температуре с периодическим перемешиванием, промывку образовавшегося осадка буфером до отсутствия в промывных водах белка, отличающийся тем, что иммобилизацию ведут в соотношении 20 мл раствора фицина в концентрации 2 мг/мл на 1 г сухого носителя; при этом иммобилизацию проводят на матрицу ионообменной смолы АВ-17-2П или АВ-16-ГС, а в качестве буферного раствора для иммобилизации используют соответственно 0,05 М фосфатный буфер для ионообменной смолы АВ-17-2П, рН 11,0 или 0,05 М NaOH-KCl буфер для АВ-16-ГС, рН 12,0, инкубацию осуществляют в течение 2 часов, промывку образовавшегося осадка проводят 0,05 М трис-HCl буфером, рН 7,5.
| КОРОЛЕВА В.А | |||
| и др | |||
| Физико-химические свойства фицина и папаина, свободных и иммобилизованных на матрице хитозана, Актуальные вопросы биологической физики и химии, 2018, т.3, н.2, стр | |||
| Способ отковки в штампах заготовок для спиральных сверл | 1921 |
|
SU367A1 |
| КОВАЛЕВА Т.А | |||
| и др | |||
| Исследование условий иммобилизации некоторых гидролитических ферментов на ионообменных смолах, Сорбционные и хроматографические | |||
Авторы
Даты
2022-04-05—Публикация
2021-05-26—Подача