Изобретение относится к химико-фармацевтической промышленности и медицине и касается новой жидкой лекарственной формы для лечения и профилактики гриппа и ОРВИ, содержащей 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в эффективном количестве и вспомогательные вещества.
Острые респираторные вирусные инфекции (ОРВИ) - группа инфекционных заболеваний вирусной этиологии, характеризующихся поражением респираторного тракта, преимущественно верхних отделов, и общностью клинических симптомов. Успехи, достигнутые медициной в области инфекционной патологии, способствовали развитию и совершенствованию методов профилактики и лечения заболеваний, но ОРВИ продолжают оставаться серьезной проблемой здравоохранения для большинства стран мира из-за чрезвычайно высокого уровня заболеваемости, обычно носящей характер сезонных эпидемий.
В России ежегодно регистрируется 30-40 млн случаев инфекционных заболеваний, в структуре которых 70% (в некоторые годы 90%) приходится на грипп и острые инфекции респираторного тракта вирусной и неуточненной этиологии [Селькова Е.П. Профилактика и лечение острых респираторных вирусных инфекций. Применение амиксина. Пособие для врачей. М., 2004]. Причинами такой высокой заболеваемости считают скученность населения в больших городах, плохую экологию, большую мобильность населения, неполный охват вакцинацией, низкую гигиеническую культуру людей, неполноценное питание [Жаркова Н.Е. Симптоматическое лечение ОРВИ: будущее за комбинированными препаратами. Рус. мед. журн., 2007, 22: 1636].
ОРВИ занимают одно из лидирующих положений по обращаемости за врачебной помощью детского и взрослого населения, временной утрате трудоспособности, количеству потребляемых лекарств за период болезни. Высокая заболеваемость ОРВИ ассоциируется со значительными экономическими потерями, в первую очередь за счет косвенных издержек, связанных с потерей трудоспособности. В наибольшей степени сезонной заболеваемости подвержены дети, пожилые люди, лица с сопутствующими заболеваниями (различные иммунодефицитные состояния, заболевания легких, сердечно-сосудистой системы, печени, почек, сахарный диабет и пр.).
ОРВИ - полиэтиологичные заболевания. В настоящее время известно более 200 возбудителей, однако преимущественное значение имеют риновирусы (30-50%) и вирусы гриппа (5-15%), обусловливающие высокую вспышечную заболеваемость в осенне-зимний период, значительно реже заболевания вызывают аденовирусы, вирусы парагриппа, респираторно-синцитиальный вирус [Селькова Е.П. Профилактика и лечение острых респираторных вирусных инфекций. Применение амиксина. Пособие для врачей. М., 2004].
Наибольшее эпидемическое значение имеют вирусы гриппа А и В, вызывающие ежегодные эпидемии, экономический ущерб от которых исчисляется миллиардами долларов США. В России ежегодный суммарный экономический ущерб от гриппа оценивается экспертами в сумму, достигающую 40 миллиардов руб. В мире каждый год от гриппа погибают 250-500 тысяч человек. В многочисленных исследованиях показана последовательная связь между гриппом и острым инфарктом миокарда [Кузнецова О.Ю., Плешанова Ж.В. Место современных комбинированных препаратов в лечении острых респираторновирусных инфекций в амбулаторной практике. Consilium medicum, 2012, 3: 74-83].
Смертность от некоторых форм гриппа, даже при высокотехнологичных методах лечения, составляет более 50%. При этом заболевание характеризуется, как правило, острым началом и тяжелым течением: высокой (40°C и более) температурой и длительной лихорадкой с симптомами интоксикации - головной болью, бессонницей, болевыми ощущениями в мышцах и суставах, менингеальными симптомами. Одно из неблагоприятных течений - это молниеносная форма, т.е. быстрое развитие геморрагического токсического отека легких и летальный исход от дыхательной и сердечно-сосудистой недостаточности [Int. J. Tuberc. Lung Dis. // 2007 - V.11. – N 7. - С. 710-721].
В ряде случаев вирусная инфекция предрасполагает к развитию осложнений, наиболее частыми из которых являются отит (чаще всего у детей), синусит (у взрослых), обострение хронического бронхита/ХОБЛ или бронхиальной астмы.
ОРВИ негриппозной этиологии чаще характеризуются более легким непродолжительным течением. Это связано с тем, что риновирусы поражают преимущественно эпителий верхних дыхательных путей, в то время как вирусы гриппа обладают тропностью к эпителию нижних отделов респираторного тракта и могут вызывать развитие острого трахеобронхита, бронхиолита. Пневмония является редким осложнением риновирусной инфекции, но развивается у 5-30% пациентов с гриппом А и у 10% пациентов с гриппом В [Зайцев А.А. Направления фармакотерапии и профилактики острых респираторных вирусных инфекций. Рус. Мед. журн, 2009, 17(23):1525].
Самым эффективным способом контроля за сезонной заболеваемостью гриппом до настоящего времени остается вакцинация. Вакцины, эффективной против риновирусной инфекции, не существует. Вакцины против гриппа в зависимости от технологии изготовления делятся на два класса: живые и инактивированные. Живые вакцины вводятся интраназально, традиционный путь введения инактивированных вакцин - подкожно или внутримышечно. Несмотря на перспективный неинвазивный путь введения и низкую стоимость живых вакцин, их применение ограничено из-за высокой реактогенности (развитие симптомов инфекции - головная боль, повышение температуры тела, недомогание), аллергенности и целого ряда противопоказаний (возраст старше 50 лет, острые заболевания, заболевания внутренних органов, иммуносупрессия и другие). В этой связи, для массовой профилактики гриппа рекомендованы инактивированные вакцины. Самым важным требованием к применяемым вакцинам является соответствие антигенного состава штаммам вируса гриппа, актуальным в данном эпидемиологическом сезоне [Зайцев А.А. Направления фармакотерапии и профилактики острых респираторных вирусных инфекций. Рус. Мед. журн, 2009, 17(23):1525].
Главный недостаток вакцинации и специфической противовирусной профилактики состоит в том, что их действие ограничено только вирусами гриппа, защита против других возбудителей ОРВИ отсутствует. Перспективным направлением профилактики является использование средств для активизации неспецифической резистентности организма. При этом для отечественного здравоохранения характерно нередкое использование препаратов с ограниченной доказательной базой [Зайцев А.А. Направления фармакотерапии и профилактики острых респираторных вирусных инфекций. Рус. Мед. журн, 2009, 17(23):1525]. Препараты эхинацеи обладают слабым интерфероногенным действием, а серьезные исследования различных адаптогенов (женьшень, элеутерококк, аралия и пр.) для профилактики респираторных инфекций не проводились [Melchart D, Linde K, Fischer P, Kaesmayr J. Echinacea for the prevention and treatment of the common cold. Cochrane Review, latest version 16 November 1998, In: The Cochrane Library, Oxford].
Лечение и профилактика противовирусными препаратами показана в следующих случаях [Зайцев А.А. Направления фармакотерапии и профилактики острых респираторных вирусных инфекций. Рус. Мед. журн, 2009, 17(23):1525]: 1) как дополнение к поздней вакцинации у лиц из групп риска в первые 2 недели после вакцинации (на период выработки антител); 2) для детей, которые вакцинируются впервые: прием препаратов показан в течение 6 недель после первой вакцинации (окончательная выработка антител заканчивается к 2 неделям после второй вакцинации); 3) для лиц с иммунодефицитом, которые на вакцинацию могут дать недостаточный иммунный ответ; 4) для лиц, которым вакцинация противопоказана (например, при аллергических реакциях на куриный белок); 5) у пожилых лиц, для которых эффективность вакцинации снижается и достигает 50-70%, как дополнение к вакцинации; 6) для невакцинированных лиц, находящихся в контакте с заболевшими родственниками и соседями; 7) когда имеется угроза пандемии; 8) при несоответствии антигенного состава используемой вакцины эпидемической ситуации.
Учитывая, что невозможно предсказать антигенную структуру будущего эпидемического (пандемического) вируса гриппа A, заблаговременное конструирование эффективных гриппозных вакцин затруднительно, поэтому важно иметь в арсенале химиотерапевтические средства профилактики и лечения заболеваний, вызываемых высокопатогенными штаммами вирусов.
Средства, обладающие прямым действием на вирус гриппа (блокаторы М2-каналов амантадин и римантадин, и ингибиторы нейраминидазы осельтамивир и занамивир) применяют для экстренного лечения и профилактики гриппа.
Блокаторы М2-каналов активны в отношении вируса гриппа А. В терапии гриппа широко использовались и до сих пор используются препараты амантадин и римантадин, которые являются противовирусными в отношении штаммов вируса гриппа [Am. J. Med. - 1997. - V.102(ЗA) - N17. - P.55-60], [Watts J. «Asian nations step up action to curb spread of avian influenza» // Lancet. - 2004. - V.363 - N9406. - P.373]. В Российской Федерации получил распространение противовирусный препарат римантадин. Его применяют для лечения и профилактики инфекции, вызванной вирусами гриппа типа A. Его профилактическая эффективность в периоды сезонных вспышек гриппа достигает 70-90% [Кузин В.Б., Ловцова Л.В., Барсук А.Л. Исследование клинической эффективности и переносимости препарата Антигриппин-Максимум при лечении ОРВИ (гриппа). Справочник поликлинического врача, 2010, 1: 3-7]. Кроме того, по данным исследований, применение римантадина также характеризуется снижением случаев гриппоподобных инфекций на 25% [Jefferson T, Demicheli V, Rivetti D, Jones M, Di Pietrantonj C, Rivetti A. Antivirals for influenza in healthy adults: systematic review. Lancet, 2006, 367(9507): 303-13].
Выраженный терапевтический эффект римантадин показал в отношении вируса гриппа подтипа H3N2. Механизм воздействия на вирус связан с блокировкой функции вирусного М2-белка. Ингибирование вирусной активности наступает на этапах рецептор-опосредованного эндоцитоза, декапсидации в фаголизосоме, а также сборки и почкования вирусных частиц [Вестник РАМН // 1993. - N 3. - Р. 10-15]. Однако у римантадина как представителя группы адамантанов имеются ограничения в применении. При высоких дозах возникают побочные эффекты со стороны ЦНС, в частности, препарат может вызывать судорожные явления. Он также оказывает неблагоприятное влияние на печень, почки, что делает маловероятным его применение у людей с заболеваниями данных органов.
Недостатком препаратов данной группы является быстро развивающаяся резистентность вируса к ним и ряд возможных нежелательных явлений (тошнота, снижение аппетита, головокружение, бессонница; в числе противопоказаний - острые заболевания печени, почек). В связи с этим применение римантадина не должно быть длительным (для профилактики его рекомендуют применять по 50 мг 1 раз в сутки в течение 10-15 дней). Важно, что на фоне остальных противовирусных средств римантадин наиболее выгоден экономически.
В настоящее время широко используют ингибиторы нейраминидазы вирусов гриппа A и B - осельтамивир фосфат (оseltamivir) и занамивир (zanamivir), которые, соединяясь с гидрофобным участком активного участка нейраминидазы вируса гриппа, блокируют способность последнего отщеплять остатки сиаловой кислоты с поверхности инфицированной клетки, тем самым подавляя выход из нее новых сформировавшихся вирионов.
Ингибиторы нейраминидазы (осельтамивир, занамивир) действуют на вирусы гриппа А и В. Осельтамивир доступен в виде капсул. Профилактический прием разрешен с 12-летнего возраста: по 75 мг ежедневно 1 раз в сутки в течение не менее 10 дней. Препарат обладает приемлемым для рецептурного отпуска профилем безопасности, наблюдаемые нежелательные явления (головные боли, тошнота, диарея и прочие) чаще всего не требуют его отмены. Занамивир доступен только в ингаляционной форме, поэтому для профилактики не применяется.
Широкое использование ингибиторов нейраминидазы ограничивает их высокая стоимость. Кроме того, в различных регионах мира сообщается о растущей резистентности вирусов гриппа к этим препаратам [Зайцев А.А. Направления фармакотерапии и профилактики острых респираторных вирусных инфекций. Рус. Мед. журн, 2009, 17(23):1525].
В настоящее время отмечаются случаи возникновения устойчивости к осельтамивиру и занамивиру [Menno D. de Jong, Tran Tan Thanh, Truong Huu Khanh et al. Oseltamivir Resistance during Treatment of Influenza A (H5N1) Infection // N. Engi. J. Med. - 2005. - N353. - P.2667-2572], [Smee D.F., Wong M.H., Bailey K.W., et al. Activities of oseltamivir and ribavirin used alone and in combination against infections in mice with recent isolates of influenza A (H1N1) and В viruses // Antivir Chem Chemother. - 2006. - V.17, N4. - P.185-192]. Это связано с мутациями в гене нейраминидазы, которые делают вирус устойчивым к этому классу соединений [Li K.S., Guan Y., Wang J., et al. Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia // Nature. - 2004. - V.430, N6996. - P.209-213], [Hui-Ling Y., Ilyshina N.A., Salomon R. et al. Neuraminidase ingibitor-resistant recombinant A/Vietnam/1203/04 (H5N1) influenza viruses retain their replication efficiency and pathogenicity in vitro and vivo // J. Virol. - 2007. - Vol.81. - P.12418-12426; Le Q.M., Kiso M., Someya K. et al. Avian flu: isolation of drug-resistant H5N1 virus // 30 Nature. - 2005. - Vol. 437. - P.1108]. Мутации, по некоторым данным, возникают примерно в 30% случаев. Ингибиторы нейраминидазы обладают также выраженными побочными эффектами в отношении ЦНС.
В последнее время большое количество штаммов вируса гриппа A подтипа H5N1 приобрели устойчивость к осельтамивиру за счет замены одной аминокислоты в нейраминидазе (H274Y и N294S) (Hui-Ling Y., Ilyshina N.A., Salomon R. et al. Neuraminidase inhibitor-resistant recombinant A/Vietnam/1203/04 (H5N1) influenza viruses retain their replication efficiency and pathogenicity in vitro and vivo // J. Virol. - 2007. - Vol. 81. - P. 12418-12426; Le Q.M., Kiso M., Someya K. et al. Avian flu: isolation of drug-resistant H5N1 virus // Nature. - 2005. - Vol. 437. - P. 1108).
Препараты, обычно используемые против штаммов «сезонного» гриппа, могут оказаться неэффективными в отношении высокопатогенных штаммов.
В настоящее время широко обсуждается возможность использования для лечения и профилактики вирусных инфекций препаратов интерферонов (ИФН). Известно, что система ИФН является естественной защитной системой организма, основная роль которой - ингибирование репликации вирусов. Выделяют три основных типа интерферонов - интерфероны I типа, к которым относятся ИФН-α, ИФН-β, ИФН-τ и ИФН-ω, интерфероны II типа, к которым относится ИФН-γ, и интерфероны III типа, к которым относится ИФН-λ. Каждый из них в той или иной степени обладает противовирусным, иммуномодулирующим, противоопухолевым и антипролиферативным эффектами, но наиболее выраженное противовирусное действие оказывает ИФН-α [Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР-Медиа, 2005]. Ранее была широко распространена практика профилактического интраназального использования человеческого лейкоцитарного интерферона-α (ИФН). Однако высокая частота нежелательных явлений (кровянистых выделений из носа, гриппоподобных симптомов, сонливости, аллергических реакций и др.) снижала ценность данного метода. Сейчас в арсенале врача появились рекомбинантные формы ИФН, характеризующиеся хорошим профилем безопасности. Профилактическая эффективность интраназального применения ИФН доказана в целом ряде исследований и подтверждена результатами метаанализа [Jefferson TO, Tyrrell D. Antivirals for the common cold. The Cochrane Database of Systematic Reviews 2005 Issue 3]. К недостаткам данного подхода можно отнести побочные эффекты интерферонов.
Следовательно, существует потребность в разработке новых средств и доступных терапевтических форм для лечения и профилактики гриппа и ОРВИ.
Известно применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты (глутарилгистамина), который обладает выраженной противовирусной активностью против широкого спектра вирусных возбудителей, в том числе вируса гриппа [Патент РФ № 2141483, 20.11.1999 г.].
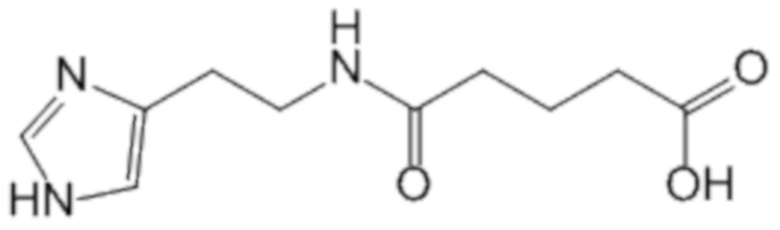
2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты
Известно применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или его фармацевтически приемлемой соли для лечения и/или профилактики таких высокопатогенных инфекционных заболеваний как высокопатогенный грипп A, вызванный вирусами, имеющими индекс патогенности более чем 1,2, и тяжелый острый респираторный синдром (ТОРС), обусловленный коронавирусом IV типа [EA020283, 30.10.2014 г.].
Известно также применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты для лечения вирусного гепатита C. Данное средство может также вводиться в комбинации с пэгилированным интерфероном и рибавирином. Известна также фармацевтическая композиция 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты для лечения вирусного гепатита C, обладающая выраженным противовирусным действием и эффективная в лечении вирусного гепатита C, позволяющая существенно снизить частоту побочных эффектов противовирусной терапии [Патент РФ № 2496512, 27.10.2013 г.].
Известно также применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или ее фармацевтически приемлемых солей для предотвращения или лечения заболеваний, вызванных (+)РНК-содержащими вирусами, принадлежащими к роду энтеровирусов или роду флавивирусов, [WO2014035297, 29.08.2013 г.].
Известно также применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или его фармацевтически приемлемой соли в качестве средства для профилактики и/или лечения заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, за счет восстановления или увеличения плотности интерфероновых рецепторов для преодоления резистентности к терапии интерферонами [Патент РФ № 2595862, 27.08.2016 г., Патент РФ № 2668538, 01.10.2018 г.].
В связи с его выраженной противовирусной и противовоспалительной активностью, 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты нашел широкое применение в медицине в качестве средства для лечения и профилактики гриппа А и В и других острых респираторных вирусных инфекций (аденовирусная инфекция, парагрипп, респираторно-синцитиальная инфекция) и был зарегистрирован в качестве лекарственного средства под торговым названием Ингавирин®. Известное лекарственное средство Ингавирин® представлено в виде капсул.
Известна также фармацевтическая композиция 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в твердой лекарственной форме в виде таблеток или капсул, обладающей вирусотропной и иммуногенной активностью, характеризующаяся тем, что она включает в качестве активного начала 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, в качестве вспомогательных веществ лактозы моногидрат, целлюлозу микрокристаллическую, кроскармеллозу натрия, кремния диоксид коллоидный (аэросил 300) и кальция стеарат [Патент РФ № 2546002, 20.01.2014 г., WO 2015108440, 23.07.2015 г.].
Известен структурный аналог Ингавирина®, 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион, а также его применение для лечения хронических заболеваний верхних дыхательных путей, в частности, риносинусита [Патент РФ № RU2562773], который представляет собой частое осложнение при острой респираторной вирусной инфекции.
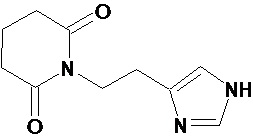
1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион
Риносинусит (PC) представляет собой воспаление слизистой оболочки полости носа и околоносовых пазух (ОНП), проблема которого в настоящее время является одной из самых актуальных в оториноларингологии (Fokkens W.J., Lund V.J., Mullol J. et al., European Position Paper on Rhinosinusitis and Nasal Polyps, Rhinology, 2007; 45; 20: 1-139). Причиной риносинусита практически всегда является застой секрета, блок естественных соустий ОНП и нарушение их аэрации, когда страдает механизм мукоцилиарного клиренса, который является важным первичным врожденным механизмом, защищающим дыхательные пути от повреждающего действия вдыхаемых загрязняющих веществ, аллергенов и возбудителей.
При этом из уровня техники не известны жидкие лекарственные формы 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-диона, а также - их совместное применение в одной лекарственной форме для лечения и профилактики гриппа и ОРВИ.
Жидкие лекарственные формы, в том числе сиропы, составляют значительную часть ассортимента аптек. Их широкое применение обусловлено целым рядом преимуществ перед другими лекарственными формами:
в их составе возможно снижение раздражающего действия некоторых лекарственных веществ;
данная лекарственная форма проста и удобна для применения;
c использованием жидких лекарственных форм возможна маскировка неприятного вкуса и запаха лекарственных веществ, а также возможность точного дозирования в широком диапазоне доз, что особенно важно в детской практике.
Но, вместе с тем, имеются и недостатки, основными из которых являются неустойчивость при хранении и подверженность микробиологическому загрязнению, а также то, что далеко не все биологически активные вещества эффективны в такой лекарственной форме.
Ранее авторами неоднократно предпринимались попытки создания жидкой лекарственной формы 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты. Несмотря на то, что жидкая лекарственная форма 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты может иметь большое количество преимуществ, включая большее удобство приема для пациентов и легкость ее дозирования, задача ее создания является очень сложной, так как в растворе, в отличие от твердых лекарственных форм, происходят химические реакции действующего вещества с растворителем, и реакции действующего вещества и вспомогательных веществ происходят гораздо быстрее. Несмотря на все усилия, авторам долгое время не удавалось разработать достаточно стабильную жидкую лекарственную форму 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты, приемлемую для фармацевтического применения, вследствие гидролиза действующего вещества по внутримолекулярной амидной связи и образования примесей в процессе хранения такой формы. Продуктами гидролиза являются гистамин и глутаровая кислота. Как известно из уровня техники, свободный гистамин обладает высокой активностью: он вызывает спазм гладких мышц (включая мышцы бронхов), расширение капилляров и понижение артериального давления; застой крови в капиллярах и увеличение проницаемости их стенок; вызывает отек окружающих тканей и сгущение крови. Таким образом, присутствие этого продукта гидролиза в жидкой лекарственной форме является крайне нежелательным. Как показано ниже, авторам впервые удалось разработать стабильные жидкие лекарственные формы 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты, подобрав условия, при которых в готовой лекарственной форме в ходе хранения уровень гистамина контролируется на очень низком, приемлемом для фармацевтического применения уровне.
Авторы неожиданно обнаружили, что стабильность жидкой лекарственной формы 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты и подавление образования нежелательных примесей в результате гидролиза можно обеспечить, контролируя pH жидкой лекарственной формы в определенном диапазоне. При этом при поддержании pH в данном диапазоне не только удается поддерживать уровень гистамина на очень низком уровне, но и не происходит образование иных примесей в количествах, превышающих нормативные ограничения на уровень примесей в готовых лекарственных формах.
Также авторы неожиданно обнаружили, что уровень гистамина в жидкой лекарственной форме 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты можно контролировать на приемлемом очень низком уровне при наличии в жидкой лекарственной форме некоторых количеств 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-диона.
Не желая быть связанными какой-либо теорией, авторы предполагают, что 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион в растворе может реагировать с образующимся в ходе гидролиза 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты гистамином с образованием нетоксичного фармацевтически приемлемого соединения формулы:
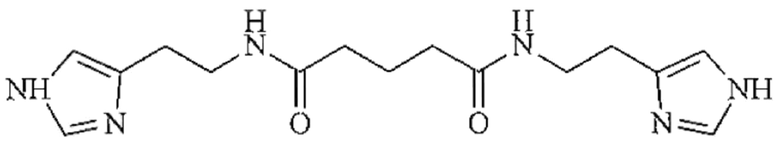
Таким образом, задачей настоящего изобретения является создание новой стабильной и пригодной для применения в фармацевтике лекарственной формы 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты, обеспечивающей высокую противовирусную активность, оптимальную скорость наступления терапевтического эффекта и повышение удобства применения, а также расширение арсенала лекарственных средств, обладающих противовирусным действием.
Поставленная задача решается, а результат достигается созданием стабильной жидкой лекарственной формы для перорального введения для лечения и профилактики гриппа и ОРВИ, содержащей 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль в эффективном количестве и вспомогательные вещества.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что pH жидкой лекарственной формы составляет 3-8, более предпочтительно, 4-8, еще более предпочтительно, 5-8, еще более предпочтительно, 5-7, еще более предпочтительно, 6-7, еще более предпочтительно, 6,3-6,7, наиболее предпочтительно, 6,5.
Поставленная задача решается, а результат достигается также созданием новой жидкой лекарственной формы для перорального введения для лечения и профилактики гриппа и ОРВИ, содержащей 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль в эффективном количестве, а также 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион или его фармацевтически приемлемую соль, и вспомогательные вещества.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что массовое соотношение 2-(имидазол-4-ил)этанамида пентандиовой-1,5 кислоты или его фармацевтически приемлемой соли к 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-диону или его фармацевтически приемлемой соли составляет от 10000:1 до 1:2, предпочтительно, от 10000:1 до 20:1, еще более предпочтительно, от 10000:1 до 200:1, еще более предпочтительно, от 10000:1 до 2000:1, еще более предпочтительно, от 10000:1 до 1000:1.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион или его фармацевтически приемлемая соль содержится в количестве не более 50 масс.% от содержания 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты, предпочтительно, не более 10 масс.%, еще более предпочтительно, не более 5 масс.%, еще более предпочтительно, не более 1 масс.%, еще более предпочтительно, не более 0,2 масс.%, еще более предпочтительно, 0,1-0,01 масс.%.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что дополнительно содержит кислоту.
Кислота может представлять собой органическую или неорганическую кислоту. Неорганическая кислота может быть выбрана из группы, включающей соляную, фосфорную и серную.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что кислота представляет собой органическую кислоту.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что органическая кислота выбрана из группы, включающей яблочную, аскорбиновую, лимонную, уксусную, янтарную, винную, фумаровую, молочную, аспарагиновую, глутаровую, глутаминовую, сорбиновую кислоты.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что вспомогательные вещества выбраны из стабилизатора, консерванта, загустителя, подсластителя, ароматизатора и воды.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что стабилизатор представляет собой камеди, хитозан, жирные кислоты и их соли, глицерин, пропиленгликоль и трагакант.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что консервант выбран из группы, включающей бензиловый спирт, уротропин, этилендиаминтетрауксусную кислоту, бензойную кислоту, сорбиновую кислоту, парабены, алкилпиридиний, бензетоний и их фармацевтически приемлемые соли.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что загуститель выбран из группы, включающей камеди, пектин, альгиновую кислоту, гуммиарабик, агар-агар, метилцеллюлозу, карбоксиметилцеллюлозу и их фармацевтически приемлемые соли.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что подсластитель выбран из группы, включающей мальтитол, изомальтит, сукралозу, глюкозу, сахарозу, фруктозу, сахарин, цикламат, аспартам, сорбитол, ксилит, стевиозид, маннит, ацесульфам, неотам, лактитол и их фармацевтически приемлемые соли.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что ароматизатор представляет собой малиновый, клубничный, апельсиновый, ягодный, абрикосовый, грушевый, дынный, манговый, лимонадный или сливовый ароматизатор как в сухом, так и в жидком виде.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что концентрация 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты составляет от 1 до 50 мг/мл, предпочтительно, от 5 до 30 мг/мл, от 5 до 25 мг/мл, от 5 до 10 мг/мл, еще более предпочтительно, 6 мг/мл.
Более предпочтительной является жидкая лекарственная форма, отличающаяся тем, что вспомогательные вещества содержатся в количестве, г:
мальтитол жидкий 20,0-50,0;
глицерин 0,0-40,0;
кислота лимонная 0,01-1,0;
ксантановая камедь 0,1-5,0;
метилпарагидроксибензоат натрия 0,1-5,0;
вода очищенная до 100 мл.
Предметом настоящего изобретения также является способ лечения или профилактики гриппа и ОРВИ, согласно которому субъекту вводят жидкую лекарственную форму по настоящему изобретению перорально.
Предметом настоящего изобретения также является применение 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в виде жидкой лекарственной формы для лечения или профилактики гриппа и ОРВИ.
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль в эффективном количестве и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных веществ, средств доставки, таких как консерванты, стабилизаторы, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, выбор и соотношение которых зависит от природы и способа введения и дозировки. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами стабилизаторов являются камеди (например, ксантановая, геллановая, конжаковая), жирные кислоты и их соли, пектин и трагакант. Примерами консервантов являются бензиловый спирт, уротропин, этилендиаминтетрауксусная кислота, бензойная кислота, парабены, алкилпиридиний, бензетоний и их фармацевтически приемлемые соли. Примерами загустителей являются глицерин, альгиновая кислота, гуммиарабик, глюкоза, сахароза, фруктоза, агар-агар, метилцеллюлоза и их фармацевтически приемлемые соли. Примерами подсластителей являются мальтитол, изомальтит, сукралоза, сахарин, цикламат, аспартам, сорбитол, ксилит, стевиозид, маннит, ацесульфам, неотам, лактитол и их фармацевтически приемлемые соли. Примерами распределяющих средств являются крахмал, альгиновая кислота и ее соли. Фармацевтическая композиция для перорального, местного введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как пероральные растворы или суспензии, сиропы, сублингвальные, трансбуккальные и местные формы введения.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с действующим веществом по настоящему изобретению или его фармацевтически приемлемой солью может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями. Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, например, в пероральных формах используются дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, корригенты вкуса, антисептические агенты.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или получены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., «Pharmaceutical Salts» J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
Термин «терапевтически эффективное количество» означает количество действующего вещества, которое (1) лечит или предупреждает конкретное заболевание, состояние или расстройство, (2) ослабляет, улучшает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (3) предупреждает или задерживает наступление одного или более симптомов конкретного заболевания, состояния или расстройства, изложенного в данном описании.
Термин «фармацевтически приемлемый» означает, что данное вещество или композиция, в отношении которых применяется этот термин, должны быть совместимы с точки зрения химии и/или токсикологии с другими ингредиентами, входящими в состав препарата, и безопасны для того, кого лечат этим веществом или композицией.
Термины «содержащий», «содержит» означает, что указанные комбинации, композиции и наборы включают перечисленные компоненты, но не исключают включение других компонентов.
Термин «сироп» в настоящем изобретении подразумевает любую жидкую лекарственную форму, раствор или эликсир, предназначенные для приема внутрь, предпочтительно, но не обязательно, содержащую загуститель, включающую действующие и вспомогательные вещества. В зависимости от состава и физико-химических свойств действующих и вспомогательных веществ, сироп может иметь опалесценцию или представлять собой гетерогенную дисперсную систему (чаще всего суспензию). Дополнительные жидкие лекарственные формы для перорального введения могут представлять собой растворы для распыления в полости рта.
Далее приводятся примеры осуществления изобретения, которые иллюстрируют, но не охватывают все возможные варианты осуществления изобретения и не ограничивают изобретение.
Пример 1. Получение сиропа, содержащего 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты
Порошки 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты, а также твердых вспомогательных веществ (метилпарагидроксибензоат натрия, ксантановая камедь) просеивали через сито с размером ячеек 250 мкм. Просеянные порошки, а также жидкие вспомогательные вещества (глицерин, мальтитол жидкий), а также воду очищенную в соответствии с расчетом взвешивали на калиброванных поверенных весах в индивидуальные промаркированные емкости.
Получение раствора лимонной кислоты
Кислоту лимонную моногидрат просеивали через сито с размером ячеек 800 мкм. К просеянной лимонной кислоте добавляли воду, очищенную для приготовления 20,0% водного раствора лимонной кислоты. Полученный раствор фильтровали через металлическое сито с размером отверстий 200 мкм в чистую индивидуальную промаркированную емкость.
Получение раствора ксантановой камеди
Глицерин помещали в производственную емкость. С помощью верхнеприводной мешалки без нагрева при перемешивании к глицерину порциями добавляли просеянную ксантановую камедь. Перемешивание продолжали с повышением оборотов мешалки при комнатной температуре от 20 до 45 минут.
Затем в подготовленный реактор с мешалкой загружали воду очищенную, включали перемешивающее устройство и порционно вносили просеянный метилпарагидроксибензоат натрия, визуально контролируя его растворение.
По окончании растворения метилпарагидроксибензоата натрия из технологической емкости в реактор порционно вносили просеянный 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, визуально контролируя растворение.
По окончании растворения 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в реактор порционно вносили отвешенный мальтитол.
По окончании растворения мальтитола в реактор порционно вносили раствор ксантановой камеди.
Затем в реактор вносили отфильтрованный 20% водный раствор лимонной кислоты. Затем в реактор порционно вносили ароматизатор.
После внесения всех компонентов обороты мешалки снижали и давали раствору выстоять от 1 до 3 часов, за это время происходила гидратация ксантановой камеди в сиропе. pH сиропа доводили до 6,4 добавлением 20% водного раствора кислоты лимонной.
По окончании времени выдержки нефильтрованного раствора полупродукт передавали на стадию получения фильтрованного раствора с помощью фильтра с размером пор не более 1,2 мкм в герметичную производственную емкость.
Наполнение проводили во флаконы. Препарат дозировали по объему. Объем дозы наполнения контролировали по массе на соответствие требованиям ГФ XIII (ОФС.1.4.2.0007.15). Для этого использовали весы. Флаконы с препаратом укупоривали.
Согласно указанной методике получали составы, приведенные в Таблице 1.
Таблица 1. Получение сиропов, содержащих в качестве активного вещества 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты
Пример 2. Исследование влияния pH сиропа на стабильность готовой лекарственной формы при хранении
Аналогично Примеру 1 дополнительно получали сиропы следующего состава, г:
2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 0,6
мальтитол жидкий 34,35;
глицерин 20,61;
ксантановая камедь 0,252;
метилпарагидроксибензоат натрия 0,177;
вода очищенная до 100 мл.
pH сиропа доводили до pH=3, 5, 8 и 9 добавлением 20% водного раствора кислоты лимонной или 1 М водного раствора гидроксида натрия при перемешивании.
Стабильность сиропа оценивали по содержанию действующего вещества 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты при 4-х различных значениях pH методом ускоренного старения.
Все образцы хранили в стеклянных или пластиковых флаконах в климатической камере в условиях ускоренных испытаний. Содержание действующего вещества определяли методом ВЭЖХ с использованием стандартов.
Метод «ускоренного старения» заключается в выдерживании испытуемого лекарственного средства при температурах и влажности, превышающих температуру и влажность его хранения в процессе обращения. При повышенных температурах, как правило, ускоряются протекающие в лекарственных средствах физико-химические процессы, приводящие со временем к нежелательным изменениям качества. Таким образом, при повышенной температуре промежуток времени, в течение которого контролируемые показатели качества лекарственного средства сохраняются в допустимых пределах (экспериментальный срок годности), искусственно сокращается в сравнении со сроком годности при температуре хранения. Это позволяет значительно сократить время, необходимое для установления срока годности.
По результатам, полученным в процессе «ускоренного старения» лекарственного средства, можно решить также обратную задачу, т.е. установить температуру хранения, обеспечивающую какой-либо заданный срок годности.
Срок годности (С) при температуре хранения (tхр) связан с экспериментальным сроком годности (СЭ) при повышенной температуре экспериментального хранения (tэ) следующей зависимостью:
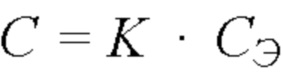 ,
,
где коэффициент соответствия 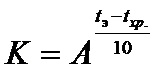 .
.
Температурный коэффициент скорости химической реакции (A) принят равным 2,5. Приведенная зависимость основана на правиле Вант-Гоффа о 2-4-кратном росте скоростей химических реакций при увеличении температуры на 10°С.
В соответствии с ОФС.1.1.0009.15 значение коэффициента соответствия (K) в зависимости от выбранного температурного интервала (tэ-tхр), равного 30°С, составляет 15,6. Срок экспериментального хранения при выбранном сроке годности 3 года составляет 71 сутки.
Статистическую обработку результатов исследования проводят с помощью статистического пакета SPSS Statistics 19.0.
Установлено, что после 71 суток хранения в условиях метода ускоренного старения новой жидкая лекарственная форма в виде сиропа по настоящему изобретению остается стабильной и химически чистой при значениях pH до 8,0. При повышении pH сироп остается химически чистым в течение менее 10 суток, далее содержание действующего вещества значительно уменьшается и увеличивается содержание примесей, что обуславливает выбор значений pH нового сиропа по настоящему изобретению для достижения более высокой стабильности при хранении (см. Таблицу 2).
Таблица 2. Оценка стабильности полученных лекарственных форм методом ускоренного старения
*состав 1 из Примера 1
Пример 3. Получение сиропов с различными рН и концентрациями активного вещества
В соответствии с методикой, приведенной в Примере 1, аналогичным образом получали сиропы с различными составами вспомогательных веществ, имеющие различный pH и дозировку активного вещества.
Примеры составов сиропов, полученных по настоящему изобретению, приведены в Таблицах 3-30.
Таблица 3. Получение сиропа с рН 4,0 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 4. Получение сиропа с рН 3,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 5. Получение сиропа с рН 5,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 6. Получение сиропа с рН 7,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 7. Получение сиропа с рН 5,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 8. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 9. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 10. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 11. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 12. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 13. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 14. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 15. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 3,5 мг/мл
мг/мл
% (масс.)
Таблица 16. Получение сиропа с рН 5,0 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 17. Получение сиропа с рН 5,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 18. Получение сиропа с рН 6,0 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 19. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 20. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 21. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 22. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 23. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 24. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 25. Получение сиропа с рН 5,8 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 17,5 мг/мл
мг/мл
% (масс.)
Таблица 26. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 7,0 мг/мл
мг/мл
% (масс.)
Таблица 27. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 7,0 мг/мл
мг/мл
% (масс.)
Таблица 28. Получение сиропа с рН 6,5 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 7,0 мг/мл
мг/мл
% (масс.)
Таблица 29. Получение сиропа с рН 6,4 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 6,0 мг/мл
мг/мл
% (масс.)
Таблица 30. Получение сиропа с рН 6,4 и концентрацией 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 6,0 мг/мл
мг/мл
% (масс.)
Все полученные составы сиропов тестируют на стабильность методом ВЭЖХ. Составы показывают высокую стабильность.
Пример 4. Получение сиропов различного состава
В соответствии с методикой, приведенной в Примере 1, аналогичным образом получали сиропы с различными составами вспомогательных веществ, имеющие pH в диапазоне 3-8.
Примеры составов сиропов, полученных по настоящему изобретению, приведены в Таблице 31.
Таблица 31. Получение сиропов с различным составом вспомогательных веществ
pH каждого сиропа доводили до pH=3, 5, 8 титрованием растворами гидроксида натрия и соответствующей кислотой при перемешивании.
Все полученные составы сиропов тестировали на стабильность методом ВЭЖХ. Составы показывают высокую стабильность, что свидетельствует о том, что стабильность жидкой лекарственной формы 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты обусловлена, главным образом, значением pH, а не составом конкретных вспомогательных веществ, которые сильно варьировали по химической природе для составов, приведенных в Таблице 3.
Таким образом, было неожиданно установлено, что наибольшая стабильность 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в жидкой лекарственной форме достигается при доведении pH жидкой лекарственной формы до значений 3-8.
Пример 5. Получение сиропа, содержащего 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион
Составы сиропов, содержащих совместно 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион получали аналогично методике из Примера 1, с тем отличием, что после стадии растворения 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в реактор порционно вносили рассчитанное количество просеянного 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-диона, визуально контролируя растворение последнего (см. Таблицу 32).
Таблица 32. Составы сиропов, содержащих 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион
Пример 6. Исследование влияния pH сиропа на стабильность готовой лекарственной формы, содержащей 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион, при хранении
Аналогично Примеру 5 дополнительно получали сиропы следующего состава, г:
2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты 0,600;
1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион 0,012;
мальтитол жидкий 34,338;
глицерин 20,610;
ксантановая камедь 0,252;
метилпарагидроксибензоат натрия 0,177;
вода очищенная до 100 мл.
в которых pH сиропа доводили до pH=3; 5; 6; 8; и 9 добавлением 20% водного раствора кислоты лимонной или 1 М водного раствора гидроксида натрия при перемешивании.
Стабильность сиропа оценивали по содержанию примести гистамина при 5-и различных значениях pH методом ускоренного старения согласно Примеру 2. Содержание гистамина определяли методом ВЭЖХ с использованием стандартного раствора гистамина дигидрохлорида.
Таблица 33. Оценка уровня продуктов гидролиза в полученных лекарственных формах в условиях ускоренного старения
Установлено, что при хранении в условиях ускоренного старения в жидкой лекарственной форме по настоящему изобретению, содержащей 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и 1-[2-(1H-имидазол-4-ил)этил]пиперидин-2,6-дион, уровень гистамина удается поддерживать на относительно низком допустимом уровне даже при щелочном pH.
Изобретение может быть использовано в медицине, фармакологии, химико-фармацевтической промышленности.
Группа изобретений относится к химико-фармацевтической промышленности, а именно к жидкой лекарственной форме для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ. Жидкая лекарственная форма для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ, содержащая 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль в эффективном количестве и фармацевтически приемлемые вспомогательные вещества, где указанные вспомогательные вещества выбраны из группы, включающей стабилизатор, консервант, загуститель, подсластитель, ароматизатор и воду в следующих количествах, мас.%: стабилизатор 12,6-40,0; консервант 0-5,0; загуститель 0-5,0; подсластитель 0-50,0; вода qs, при этом рН жидкой лекарственной формы составляет от 3 до 8. Жидкая лекарственная форма для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ, содержащая следующие вещества, г на 100 мл: 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты 0,600; глицерин 20,610; ксантановая камедь 0,252; мальтитол 34,350; метилпарагидроксибензоат натрия 0,177; кислота лимонная моногидрат 0,037; ароматизатор 0,115; вода очищенная до 100 мл. Применение жидкой лекарственной формы для лечения и/или профилактики гриппа и/или ОРВИ. Вышеописанная жидкая лекарственная форма для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ обладает высокой стабильностью. 3 н. и 17 з.п. ф-лы, 33 табл., 6 пр.
1. Жидкая лекарственная форма для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ, содержащая 2-(имидазол-4-ил)этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль в эффективном количестве и фармацевтически приемлемые вспомогательные вещества, где указанные вспомогательные вещества выбраны из группы, включающей стабилизатор, консервант, загуститель, подсластитель, ароматизатор и воду в следующих количествах, мас. %:
при этом рН жидкой лекарственной формы составляет от 3 до 8.
2. Лекарственная форма по п. 1, дополнительно содержащая модификатор pH.
3. Лекарственная форма по п. 2, где модификатор pH представляет собой фармацевтически приемлемую кислоту.
4. Лекарственная форма по п. 3, где кислота представляет собой фармацевтически приемлемую органическую кислоту.
5. Лекарственная форма по п. 4, где органическая кислота выбрана из группы, включающей яблочную, аскорбиновую, лимонную, уксусную, янтарную, винную, фумаровую, молочную, аспарагиновую, глутаровую, глутаминовую, сорбиновую кислоты.
6. Лекарственная форма по п. 5, где органическая кислота представляет собой лимонную кислоту.
7. Лекарственная форма по п. 1, где стабилизатор выбран из группы, включающей камеди, хитозан, жирные кислоты и их фармацевтически приемлемые соли, глицерин, пропиленгликоль и трагакант.
8. Лекарственная форма по п. 7, где стабилизатор представляет собой глицерин.
9. Лекарственная форма по п. 1, где консервант выбран из группы, включающей бензиловый спирт, уротропин, этилендиаминтетрауксусную кислоту, бензойную кислоту, сорбиновую кислоту, парабены, алкилпиридиний, бензетоний и их фармацевтически приемлемые соли.
10. Лекарственная форма по п. 9, где консервант представляет собой метилпарагидроксибензоат натрия.
11. Лекарственная форма по п. 1, где загуститель выбран из группы, включающей камеди, пектин, альгиновую кислоту, гуммиарабик, агар-агар, метилцеллюлозу, карбоксиметилцеллюлозу и их фармацевтически приемлемые соли.
12. Лекарственная форма по п. 11, где загуститель представляет собой ксантановую камедь.
13. Лекарственная форма по п. 1, где подсластитель выбран из группы, включающей мальтитол, изомальтит, сукралозу, глюкозу, сахарозу, фруктозу, сахарин, цикламат, аспартам, сорбитол, ксилит, стевиозид, маннит, ацесульфам, неотам, лактитол и их фармацевтически приемлемые соли.
14. Лекарственная форма по п. 13, где подсластитель представляет собой мальтитол жидкий.
15. Лекарственная форма по п. 1, дополнительно содержащая ароматизатор.
16. Лекарственная форма по п. 15, где ароматизатор представляет собой малиновый, клубничный, апельсиновый, ягодный, абрикосовый, грушевый, дынный, манговый, лимонадный или сливовый ароматизатор.
17. Лекарственная форма по п. 1, отличающаяся тем, что концентрация 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты составляет от 1 до 50 мг/мл.
18. Лекарственная форма по п. 2, содержащая:
мальтитол жидкий,
глицерин,
кислоту лимонную,
ксантановую камедь,
метилпарагидроксибензоат натрия,
ароматизатор, и
воду очищенную.
19. Жидкая лекарственная форма для перорального введения для лечения и/или профилактики гриппа и/или ОРВИ, содержащая следующие вещества, г на 100 мл:
20. Применение жидкой лекарственной формы по любому из пп. 1-19 для лечения и/или профилактики гриппа и/или ОРВИ.
| Кухня типа "Примус" | 1929 |
|
SU20283A1 |
| Приспособление для одновременного обслуживания двух давильных станков | 1932 |
|
SU29461A1 |
| ПРОИЗВОДНОЕ ГЛУТАРИМИДОВ, ЕГО ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2610275C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТКИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2546002C1 |
| ПРОИЗВОДНЫЕ ГЛУТАРИМИДОВ, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2562773C2 |
| WO 2014035297 А1, 06.03.2014. | |||
Авторы
Даты
2022-04-18—Публикация
2020-02-11—Подача