Изобретение относится к области медицины, фармакологии и химико-фармацевтической промышленности, а именно к новым составам для лечения и/или профилактики вирусных заболеваний, содержащим 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты или его фармацевтически приемлемую соль и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 1,5-ди[2-(4-имидазолил)этиламид]пентадионовой кислоты и его оптические изомеры и фармацевтически приемлемые соли, фармацевтической композиции на основе упомянутых составов, лекарственному средству на основе упомянутых составов или упомянутой фармацевтической композиции и готовой лекарственной форме на основе упомянутых составов, упомянутой фармацевтической композиции или упомянутого лекарственного средства.
Инфекционные заболевания занимают третье место среди причин смертности людей по всему миру, среди которых большая часть приходится на вирусные заболевания. Среди вирусных инфекций одно из ведущих мест занимают герпесвирусы из-за повсеместного распространения. По данным ВОЗ около 90% населения земного шара имеют проявления герпетической инфекции, а смертность от этих инфекций находится на втором месте после вирусного гепатита, поэтому проблема герпетических заболеваний на сегодня особенно актуальна. На сегодня науке известно более 100 видов вируса герпеса, из них 8 антигенных разновидностей вызывают заболевания у человека (вирусы простого герпеса (Herpes simplex) 1-го и 2-го типа, ветряной оспы и опоясывающего герпеса (Varicella zoster), цитомегаловирус, вирус Эпштейна-Барр, вирусы герпеса человека 6-го, 7-го и 8-го типа). Вирусы герпеса способны пожизненно находиться в организме человека и вызывать заболевания с разнообразными проявлениями от бессимптомного носительства до тяжелых форм с развитием герпетического энцефалита, менингита, заканчивающихся летальным исходом. Локализация герпетических высыпаний различна — кожа, слизистые оболочки ротовой полости и половых органов, роговица, внутренние органы. Для лечения и предотвращения рецидивов герпетической инфекции существует большой выбор препаратов с выраженным противовирусным действием, однако эти средства имеют ряд побочных эффектов, в том числе снижение устойчивости организма к вирусам [1].
Многие вирусы поражают дыхательные пути, носовые ходы, горло, бронхи, легкие, в связи с чем такие вирусные инфекции собраны в группу острых респираторных вирусных инфекций (ОРВИ), поскольку обладают также и общностью клинических симптомов. Вирусы гриппа также относятся к группе ОРВИ, однако выделены в отдельную группу в связи с тем, что воздействуют системно на весь организм. Причиной ОРВИ могут быть более 200 различных вирусов, представителей 4 семейств РНК-содержащих вирусов (ортомиксовирусы, парамиксовирусы, коронавирусы и пикорнавирусы) и 2 семейств ДНК-содержащих вирусов (аденовирусы и герпесвирусы) [1, 5]. По частоте инфицирования грипп составляет около 15% (тип А – 12%, В – 3%), парагрипп и риновирусы до 50%, аденовирус до 5%, респираторно-синцитиальный вирус (РС) – 4%, микоплазма – около 2%, энтеровирусы – около 1%, смешанные инфекции – около 23% случаев. К группе высокого риска относятся дети, у которых заболевания респираторного тракта составляют до 90% всей инфекционной патологии и 65% от всех регистрируемых заболеваний [1-2].
Для всех ОРВИ характерны симптомы общей интоксикации (головная боль, слабость, мышечные боли, потеря аппетита), повышенная температура, катаральные явления (заложенность носа, насморк, кашель, боль в горле). Локализация очага поражения во многом зависит от вида возбудителя. Так, риновирусные заболевания характеризуются преобладанием ринита, аденовирусные инфекции – ринофарингита, для парагриппа характерен фарингит, а для гриппа – трахеит, респираторно-синцитиальный вирус поражает бронхи. Возможны и другие симптомы, например, аденовирусы могут вызывать конъюнктивиты и кератиты. Обычно симптомы ОРВИ сохраняются в течение 3-7 дней (кашель может наблюдаться более длительное время), возможная длительность гриппа 1-2 недели. Среди осложнений выделяют ларингит, тонзиллит, фарингит и трахеит бактериальной природы, различные формы синуситов (гайморит, этмоидит, фронтит), а также отит, евстахиит, возможно развитие бронхита и пневмонии. Основные причины осложнений – нарушения иммунной защиты, приводящие к длительно протекающим иммунодефицитам, сочетающимся с резким снижением антибактериальной резистентности организма. При правильно выбранной тактике лечения ОРВИ риск развития осложнений заметно снижается [1, 3-5].
Несмотря на успехи, достигнутые в медицине за последние десятилетия, в частности в лечении инфекционных заболеваний, ОРВИ и вирусы гриппа продолжают оставаться серьезной проблемой здравоохранения для большинства стран мира из-за чрезвычайно высокого уровня заболеваемости, обычно носящего характер сезонных эпидемий. ОРВИ и грипп занимают лидирующие положения по обращаемости за врачебной помощью детского и взрослого населения, временной утрате трудоспособности, количеству потребляемых лекарств за период болезни. В наибольшей степени сезонной заболеваемости подвержены дети, пожилые люди, лица с сопутствующими заболеваниями (различные иммунодефицитные состояния, заболевания легких, сердечно-сосудистой системы, печени, почек, сахарный диабет и пр.). Так, в России ежегодно регистрируется 30-40 млн случаев инфекционных заболеваний, от 70% до 90% из которых приходится на грипп и острые инфекции респираторного тракта вирусной и неуточненной этиологии [2]. Причинами такой высокой заболеваемости считаются высокая плотность населения в больших городах, плохая экология, большая мобильность населения, неполный охват возбудителей посредством вакцинаций или отказ от вакцинаций, низкая гигиеническая культура людей, наличие большого количества стрессов, недостаточное количество времени, отводимого на сон и отдых, курение, злоупотребление алкоголем, а также неправильное и неполноценное питание [6].
Наибольшее эпидемическое значение имеют вирусы гриппа А и В, вызывающие ежегодные эпидемии, экономический ущерб от которых исчисляется миллиардами долларов США. В России ежегодный суммарный экономический ущерб от гриппа оценивается экспертами в сумму, достигающую 40 миллиардов рублей. В мире каждый год от гриппа погибают 250-500 тысяч человек. В многочисленных исследованиях показана последовательная связь между гриппом и острым инфарктом миокарда [7].
Смертность от некоторых форм гриппа, даже при высокотехнологичных методах лечения, составляет более 50%. При этом заболевание, впрочем, как и другие формы гриппа иной этиологии, характеризуется острым началом и тяжелым течением: высокой (40°C и более) температурой и длительной лихорадкой с симптомами интоксикации – головной болью, бессонницей, болевыми ощущениями в мышцах и суставах, менингеальными симптомами. Одно из неблагоприятных течений – это молниеносная форма, т.е. быстрое развитие геморрагического токсического отека легких и летальный исход от дыхательной и сердечно-сосудистой недостаточности [8].
В ряде случаев вирусная инфекция предрасполагает к развитию осложнений, наиболее частыми из которых являются отит (чаще всего у детей), синусит (у взрослых), обострение хронического бронхита/ХОБЛ или бронхиальной астмы.
ОРВИ негриппозной этиологии чаще характеризуются более легким непродолжительным течением. Это связано с тем, что риновирусы поражают преимущественно эпителий верхних дыхательных путей, в то время как вирусы гриппа обладают тропностью к эпителию нижних отделов респираторного тракта и могут вызывать развитие острого трахеобронхита, бронхиолита. Пневмония является редким осложнением риновирусной инфекции, но развивается у 5-30% пациентов с гриппом А и у 10% пациентов с гриппом В [9].
Риносинусит (PC) представляет собой воспаление слизистой оболочки полости носа и околоносовых пазух (ОНП), проблема которого в настоящее время является одной из самых актуальных в оториноларингологии [10]. Причиной риносинусита практически всегда является застой секрета, блок естественных соустий ОНП и нарушение их аэрации, когда страдает механизм мукоцилиарного клиренса, который является важным первичным врожденным механизмом, защищающим дыхательные пути от повреждающего действия вдыхаемых загрязняющих веществ, аллергенов и возбудителей.
Самым эффективным способом контроля за сезонной заболеваемостью гриппом до настоящего времени остается вакцинация. Однако, вакцины, эффективной против риновирусной инфекции, не существует. Вакцины против гриппа в зависимости от технологии изготовления делятся на два класса: живые и инактивированные. Живые вакцины вводятся интраназально, традиционный путь введения инактивированных вакцин – подкожно или внутримышечно. Несмотря на перспективный неинвазивный путь введения и низкую стоимость живых вакцин их применение ограничено из-за высокой реактогенности (развитие симптомов инфекции – головная боль, повышение температуры тела, недомогание), аллергенности и целого ряда противопоказаний (возраст старше 50 лет, острые заболевания, заболевания внутренних органов, иммуносупрессия и другие). В этой связи для массовой профилактики гриппа рекомендованы инактивированные вакцины. Самым важным требованием к применяемым вакцинам является соответствие антигенного состава штаммам вируса гриппа, актуальным в данном эпидемиологическом сезоне [9].
Главный недостаток вакцинации и специфической противовирусной профилактики состоит в том, что их действие ограничено только вирусами гриппа, защита против других возбудителей ОРВИ отсутствует. Перспективным направлением профилактики является использование средств для активизации неспецифической резистентности организма [9]. Профилактическая эффективность противовирусных средств в период вспышки заболевания является высокой и достигает 70-80%. При этом, профилактику противовирусными средствами можно проводить как для иммунизированных лиц, так и для лиц, не прошедших вакцинацию.
Лечение и профилактика противовирусными препаратами показана в следующих случаях [9]: 1) как дополнение к поздней вакцинации у лиц из групп риска в первые 2 недели после вакцинации (на период выработки антител); 2) для детей, которые вакцинируются впервые: прием препаратов показан в течение 6 недель после первой вакцинации (окончательная выработка антител заканчивается к 2 неделям после второй вакцинации); 3) для лиц с иммунодефицитом, которые на вакцинацию могут дать недостаточный иммунный ответ; 4) для лиц, которым вакцинация противопоказана (например, при аллергических реакциях на куриный белок); 5) у пожилых лиц, для которых эффективность вакцинации снижается и достигает 50-70%, как дополнение к вакцинации; 6) для невакцинированных лиц, находящихся в контакте с заболевшими родственниками и соседями; 7) когда имеется угроза пандемии; 8) при несоответствии антигенного состава используемой вакцины эпидемической ситуации.
Учитывая, что невозможно предсказать антигенную структуру будущего эпидемического (пандемического) вируса гриппа A, заблаговременное конструирование эффективных гриппозных вакцин затруднительно, поэтому важно иметь в арсенале лекарственные средства для профилактики и лечения заболеваний, вызываемых высокопатогенными штаммами вирусов.
Среди лекарственных средств, применяемых при гриппе и ОРВИ, приоритет принадлежит этиотропным препаратам, обладающим прямым противовирусным действием, нарушающим различные фазы репликативного цикла вирусов.
Средства, обладающие прямым действием на вирус гриппа (блокаторы М2-каналов амантадин и римантадин и ингибиторы нейраминидазы осельтамивир и занамивир) применяют для экстренного лечения и профилактики гриппа. Блокаторы М2-каналов активны в отношении вируса гриппа А. В терапии гриппа широко использовались и до сих пор используются препараты амантадин и римантадин, которые являются противовирусными в отношении штаммов вируса гриппа А [11, 12]. В Российской Федерации получил распространение противовирусный препарат римантадин. Его применяют для лечения и профилактики инфекции, вызванной вирусами гриппа типа A [13]. Однако у римантадина как представителя группы адамантанов имеются ограничения в применении. При высоких дозах возникают побочные эффекты со стороны ЦНС, в частности, препарат может вызывать судорожные явления. Он также оказывает неблагоприятное влияние на печень, почки, в связи с чем его применение у людей с заболеваниями данных органов может быть нежелательным. Недостатком препаратов данной группы является быстро развивающаяся резистентность вируса к ним и ряд возможных нежелательных явлений (тошнота, снижение аппетита, головокружение, бессонница; в числе противопоказаний – острые заболевания печени, почек). В связи с этим применение римантадина не должно быть длительным (для профилактики его рекомендуют применять по 50 мг 1 раз в сутки в течение 10-15 дней). В настоящее время широко используют ингибиторы нейраминидазы вирусов гриппа A и B – осельтамивир фосфат (оseltamivir) и занамивир (zanamivir), которые, соединяясь с гидрофобным участком активного участка нейраминидазы вируса гриппа, блокируют способность последнего отщеплять остатки сиаловой кислоты с поверхности инфицированной клетки, тем самым подавляя выход из нее новых сформировавшихся вирионов. Ингибиторы нейраминидазы (осельтамивир, занамивир) действуют на вирусы гриппа А и В и обладают также выраженными побочными эффектами в отношении ЦНС. Занамивир доступен только в ингаляционной форме, поэтому для профилактики не применяется. Широкое использование ингибиторов нейраминидазы ограничивает их высокая стоимость. Кроме того, в различных регионах мира сообщается о растущей резистентности вирусов гриппа к этим препаратам [9, 14-15]. Это связано с мутациями в гене нейраминидазы, которые делают вирус устойчивым к этому классу соединений [16-18]. Мутации, по некоторым данным, возникают примерно в 30% случаев. Так, в последнее время большое количество штаммов вируса гриппа A подтипа H5N1 приобрели устойчивость к осельтамивиру за счет замены одной аминокислоты в нейраминидазе (H274Y и N294S) [17-18].
Следовательно, существует потребность в разработке новых средств и доступных терапевтических форм для лечения и профилактики гриппа и ОРВИ.
Известно применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты, который обладает выраженной противовирусной активностью против широкого спектра вирусных возбудителей, в том числе вируса гриппа [20].
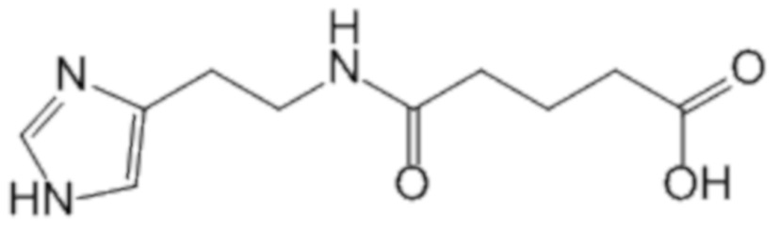
2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты
Известно применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или её фармацевтически приемлемой соли для лечения и/или профилактики таких высокопатогенных инфекционных заболеваний как высокопатогенный грипп A, вызванный вирусами, имеющими индекс патогенности более чем 1,2, и тяжелый острый респираторный синдром (ТОРС), обусловленный коронавирусом IV типа [21].
Известно также применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты для лечения вирусного гепатита C. Данное средство может также вводиться в комбинации с пэгилированным интерфероном и рибавирином. Известна также фармацевтическая композиция 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты для лечения вирусного гепатита C, обладающая выраженным противовирусным действием и эффективная в лечении вирусного гепатита C, позволяющая существенно снизить частоту побочных эффектов противовирусной терапии [22].
Известно также применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты или его фармацевтически приемлемой соли в качестве средства для профилактики и/или лечения заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, за счет восстановления или увеличения плотности интерфероновых рецепторов для преодоления резистентности к терапии интерферонами [23-25].
В связи с его выраженной противовирусной и противовоспалительной активностью 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты нашел широкое применение в медицине в качестве средства для лечения и профилактики гриппа А и В и других острых респираторных вирусных инфекций (аденовирусная инфекция, парагрипп, респираторно-синцитиальная инфекция) и был зарегистрирован в качестве лекарственного средства под торговым названием Ингавирин®. Известное лекарственное средство Ингавирин® представлено в виде капсул.
Известна также фармацевтическая композиция 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в твердой лекарственной форме в виде таблеток или капсул, обладающей вирусотропной и иммуногенной активностью, характеризующаяся тем, что она включает в качестве активного начала 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, в качестве вспомогательных веществ лактозу моногидрат, целлюлозу микрокристаллическую, кроскармеллозу натрия, кремния диоксид коллоидный (аэросил 300) и кальция стеарат [26-27].
Известен также структурный аналог Ингавирина®, N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, а также его применение для лечения хронических заболеваний верхних дыхательных путей, в частности, риносинусита [28], который представляет собой частое осложнение при острой респираторной вирусной инфекции.
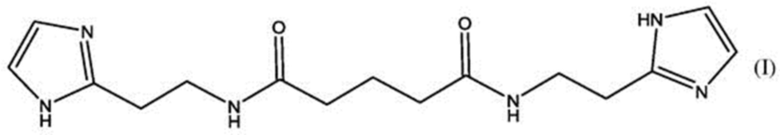
N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид
Одним из недостатков многих лекарственных препаратов является недостаточная стабильность действующего вещества в течение срока хранения. Однако стабильность в твердом состоянии и срок хранения активных компонентов являются очень важными факторами. Лекарственное средство и фармацевтические композиции должны обладать способностью храниться в течение значительных периодов времени, не проявляя значимого изменения физико-химических свойств активного компонента (например, его химического состава, плотности, гигроскопичности и растворимости).
2-(имидазол-4-ил)-этанамид пентандиовая-1,5 кислота в присутствии воды может подвергаться гидролизу по внутримолекулярной амидной связи с образованием гистамина и глутаровой кислоты. Кроме того, при производстве 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в состав могут попадать в следовых количествах примеси переходных металлов (например, ионы железа (II), железа (III), Ni (0), Zn (II) и др.). Из уровня техники известно, что металлы с конфигурацией d8 и d10 являются катализаторами окисления органических веществ кислородом воздуха, и даже небольшое их количество способно инициировать реакцию окисления [29], что может негативно влиять на стабильность лекарственного средства при хранении.
Таким образом, задачей настоящего изобретения являлась разработка стабильного при хранении, экономически целесообразного, промышленно реализуемого препаративного состава 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты для лечения и профилактики заболеваний дыхательных путей, в частности, гриппа и ОРВИ, обеспечивающего высокую противовирусную активность, а также расширение арсенала лекарственных средств, обладающих противовирусным действием.
Авторами настоящего изобретения было неожиданно обнаружено, что применение 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты в комбинации с N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамидом в значительной степени повышает стабильность 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, которая используется в фармацевтической промышленности в настоящее время, в течение всего срока хранения.
Техническими результатами заявленного изобретения являются:
- повышение стабильности 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты;
- расширение арсенала противовирусных средств и средств для лечения и/или профилактики заболеваний дыхательных путей.
Поставленная задача решается, а результат достигается созданием стабильного состава для перорального введения для лечения и/или профилактики заболеваний дыхательных путей, обладающего противовирусной активностью, содержащего 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, или их фармацевтически приемлемые соли в эффективном количестве и, необязательно, вспомогательные вещества.
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Лекарственное начало» (лекарственная субстанция, лекарственное вещество) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя новый состав 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в комбинации с N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамидом и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, дезинтегранты, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от их природы, способа введения композиции и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также иные фармацевтически приемлемые поверхностно-активные вещества, и смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как бензиловый спирт, уротропин, этилендиаминтетрауксусная кислота, бензойная кислота, хлорбутанол, сорбиновая кислота, парабены, алкилпиридиний, бензетоний и их фармацевтически приемлемые соли и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, таких как гидрофильные полимерные замедлители высвобождения, например, производные целлюлозы, полиэтиленоксид, желатин, поливиниловый спирт, поливинилпирролидон, альгинаты, карбомеры, гидрофобные замедлители высвобождения, такие как глицерилбегенат, моностеарат алюминия. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, буферные растворы, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Для регулирования pH могут быть использованы различные органические и неорганические кислоты, такие как яблочная, аскорбиновая, лимонная, уксусная, янтарная, винная, фумаровая, молочная, аспарагиновая, глутаровая, глутаминовая, сорбиновая кислоты. Примерами диспергирующих агентов и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, коллоидный диоксид кремния, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы, эликсиры или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или получены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные [30]. Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты – лизин, орнитин и аргинин.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с действующим веществом по настоящему изобретению или его фармацевтически приемлемой солью может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
Термин «терапевтически эффективное количество» означает количество действующего вещества, которое (1) лечит или предупреждает конкретное заболевание, состояние или расстройство, (2) ослабляет, улучшает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (3) предупреждает или задерживает наступление одного или более симптомов конкретного заболевания, состояния или расстройства, изложенного в данном описании.
Термин «фармацевтически приемлемый» означает, что данное вещество или композиция, в отношении которых применяется этот термин, должны быть совместимы с точки зрения химии и/или токсикологии с другими ингредиентами, входящими в состав препарата, и безопасны для того, кого лечат этим веществом или композицией.
Термины «содержащий», «содержит» означает, что указанные комбинации, композиции и наборы включают перечисленные компоненты, но не исключают включение других компонентов.
Поставленная задача решается, а технический результат достигается созданием состава для лечения и/или профилактики заболеваний дыхательных путей, обладающего противовирусной активностью, включающего 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и/или их фармацевтически приемлемые соли, причем упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,0001% до 10,00% масс.
Поставленная задача также осуществляется, а технический результат достигается созданием фармацевтической композиции для лечения и/или профилактики заболеваний дыхательных путей, причем упомянутая композиция содержит в терапевтически эффективном количестве любой вышеупомянутый состав и по меньшей мере один фармацевтически приемлемый носитель.
Поставленная задача также осуществляется, а технический результат достигается созданием лекарственного средства для лечения и/или профилактики заболеваний дыхательных путей, в виде таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, причем упомянутое средство содержит в терапевтически эффективном количестве любой вышеупомянутый состав или вышеупомянутую фармацевтическую композицию.
Предметом настоящего изобретения является состав для лечения и/или профилактики вирусных заболеваний, включающий 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и/или их фармацевтически приемлемые соли.
Более предпочтительным является состав, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, его оптические изомеры и/или фармацевтически приемлемые соли в количестве не более 10,00% масс.
Более предпочтительным является состав, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, его оптические изомеры и/или фармацевтически приемлемые соли в количестве от 0,0001% до 10,00% масс.
Более предпочтительным является состав, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, его оптические изомеры и/или фармацевтически приемлемые соли в количестве от 0,0001 до 1,00% масс.
Более предпочтительным является состав, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,05 до 1,00% масс.
Более предпочтительным является состав, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,10 до 0,30 % масс.
Более предпочтительным является состав, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,10 до 0,20% масс.
Более предпочтительным является состав, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве не более 0,15 % масс.
Более предпочтительным является состав, характеризующийся тем, что упомянутый состав содержит 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в количестве более 96,00% масс.
Более предпочтительным является состав, характеризующийся тем, что заболевания представляют собой заболевания верхних дыхательных путей.
Более предпочтительным является состав, характеризующийся тем, что заболевания выбраны из группы, состоящей из ОРВИ и гриппа.
Более предпочтительным является состав, характеризующийся тем, что заболевания дыхательных путей вызваны вирусной инфекцией.
Более предпочтительным является состав, характеризующийся тем, что предназначен для профилактики осложнений заболеваний дыхательных путей, вызванных вирусной инфекцией.
Более предпочтительным является состав, характеризующийся тем, что предназначен для профилактики сопутствующих заболеваний при поражении дыхательных путей вирусной инфекцией.
Более предпочтительным является состав, характеризующийся тем, что заболевания выбраны из группы, состоящей из ринита, синусита, риносинусита, фарингита, назофарингита, тонзиллита, болезней голосовых складок и гортани, вазомоторного и аллергического ринита, бронхита, бронхиолита, пневмонии, бронхиальной астмы, хронической обструктивной болезни легких, муковисцидоза.
Более предпочтительным является состав, характеризующийся тем, что заболевания вызваны вирусом, выбранным из группы, состоящей из риновируса, респираторно-синцитиального вируса, вируса парагриппа, вируса гриппа, аденовируса, метапневмовируса, коронавируса, вируса Коксаки, энтеровируса, ротавируса, вируса герпеса.
Также предметом настоящего изобретения является фармацевтическая композиция для лечения и/или профилактики заболеваний дыхательных путей, которая содержит терапевтически эффективное количество упомянутого состава, включающего 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и фармацевтически приемлемые соли, и по меньшей мере, один фармацевтически приемлемый носитель.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с составом, включающим 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и фармацевтически приемлемые соли, по настоящему изобретению может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в частности, в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом настоящего изобретения также является лекарственное средство для лечения и/или профилактики заболеваний дыхательных путей, в виде таблеток, капсул или раствора для инъекций, помещенных в фармацевтически приемлемую упаковку, содержащее в терапевтически эффективном количестве состав, включающий 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и фармацевтически приемлемые соли, или фармацевтическую композицию по настоящему изобретению.
Предметом настоящего изобретения также является готовая лекарственная форма для лечения и/или профилактики заболеваний дыхательных путей, в виде таблеток, капсул, раствора или суспензии, сиропа, раствора для инъекций, помещенных в фармацевтически приемлемую упаковку, содержащая в терапевтически эффективном количестве состав, включающий 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид и/или их оптические изомеры и фармацевтически приемлемые соли, фармацевтическую композицию по настоящему изобретению или лекарственное средство по настоящему изобретению.
Предметом настоящего изобретения также является применение состава по настоящему изобретению для лечения и/или профилактики заболеваний дыхательных путей.
Предметом настоящего изобретения также является применение фармацевтической композиции по настоящему изобретению, лекарственного средства по настоящему изобретению или готовой лекарственной формы по настоящему изобретению для лечения и/или профилактики заболеваний дыхательных путей.
Предметом настоящего изобретения также является способ лечения и/или профилактики заболеваний дыхательных путей, включающий прием пациентом, имеющим вирусное заболевание или риск заразиться вирусным заболеванием, фармацевтической композиции по настоящему изобретению, лекарственного средства по настоящему изобретению или готовой лекарственной формы по настоящему изобретению.
Представленные ниже примеры иллюстрируют, но не охватывают все возможные варианты осуществления изобретения и не ограничивают изобретение.
Пример 1. Получение 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты.
К раствору 0.366 г (3.3 ммоль) гистамина в 5 мл DMF прибавляли 0.376 г (3.3 ммоль) глутарового ангидрида. Реакционную смесь перемешивали в течение 3 ч. и оставляли на 20 ч. при 20°C. Полноту протекания реакции контролировали методом ТСХ. Белый осадок отделяли, сушили в вакууме, перекристаллизовывали.
Выход 0.510 г (70,0%). Rf 0.36, 0.34 (4). Т.пл. 187-189°C.
ВЭЖХ: индивидуальный пик, время удерживания 14.36 мин.
Спектр 1H-ЯМР (D2O), д, м. д. : (м, 2H, в- CH2), 2.18 (м, 4H, б,г- CH2), 2.85 (т, 2H, в- CH2-HA), 3.5 (т, 2H, б- CH2-HA), 7.25 (с, 1H, CH-4-Im), 8.5 (с, 1H, CH-2-Im).
Масс-спектр, m/z: [М+1H]+ 226.1.
Полученное соединение проверяли методом ТСХ на пластинках “Kieselgel 60 F254” (фирмы “Merck”, Германия) в системе растворителей: хлороформ-метанол-25% водный амииак 5:3:0,5.
Хроматограммы и электрофореграммы проявляли хлор-тетраметилбензидиновым реактивом и реактивом Паули.
Температуру плавления определяли на приборе ПТП (завод лаб. приборов, Россия, г. Клин).
Спектры 1Н-ЯМР регистрировали на приборе АМХ-400 (Германия), Bruker DPX-400 (Германия).
Масс-спектрометрию для определения 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты осуществляли на приборе МСБХ (Украина, г. Сумы) методом плазменно-десорбционной ионизации осколками ядер калифорния 252.
Аналитическую обращенно-фазовую ВЭЖХ для 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты проводили в условиях: колонка МПС 300 C18T (4.0 х 250 мм), 10 мкм, элюция градиентом от 0% до 18% ацетонитрила в 0.1% TFA за 20 мин.
Чистота 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, полученной данным способом, составляет 99,3%.
Пример 2. Получение N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида.
К 5 г (0,031 моль) диметилового эфира глутаровой кислоты прибавляли 8 г (0,072 моль) гистамина и нагревали при 170єС в течение 3,5-4 ч. до прекращения выделения паров метилового спирта. Полноту протекания реакции контролировали методом ТСХ. Затем реакционную массу суспендировали в изопропиловом спирте и оставляли на 24 ч. при 4єС. Продукт отделяли, промывали изопропиловым спиртом, сушили.
Выход 6,8 г (69%). Rf 0,42. Т.пл. 166-168єС.
ВЭЖХ: индивидуальный пик, время удерживания 5,58 мин.
Спектр 1H-ЯМР (400,13 МГц, ДМСО-d6, д, м.д., J/Гц): 1,70 (пент., 2H, CH2CH2CH2, J=7,3 Гц), 2,03 (т, 4H, CH2CH2CH2, J=7,3 Гц), 2,61 (т, 4H, CCH2CH2N, J=7,5 Гц), 3,26 (кв., 4H, CCH2CH2N, J=7,5 Гц), 6,76 (шир.с, 2H, CCH ), 7,50 (с, 2H, NCHN ), 7,94 (шир.т, 2H, NH ).
Масс-спектр, m/z: [М+1H]+ 319.
Полученное соединение проверяли методом ТСХ на пластинках “Kieselgel 60 F254” (фирмы “Merck”, Германия) в системе растворителей: пиридин-уксусная кислота-вода (20:6:11) - система А, А:этилацетат 3:1.
Хроматограммы и электрофореграммы проявляли хлор-тетраметилбензидиновым реактивом и реактивом Паули.
Температуру плавления определяли на приборе ПТП (завод лаб. приборов, Россия, г. Клин).
Спектры 1Н-ЯМР регистрировали на приборе АМХ-400 (Германия), Bruker DPX-400 (Германия).
Масс-спектры высокого разрешения для определения N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида получали на времяпролетном масс-спектрометре методом матриксной лазерно-десорбционной ионизации с использованием в качестве матрицы 2,5-дигидроксибензойной кислоты, на приборе Ultraflex (“Bruker”, Германия).
Аналитическую обращенно-фазовую ВЭЖХ для бис-1,5-(Nв-гистаминил) глутаровой кислоты проводили на приборе: хроматограф HPLC Shimadzu в условиях: колонка Luna C18 (2) 100 A, 250Ч4,6 мм (сер.599779-23), градиент элюирования в системе фосфатный буферный раствор рН 3,0:метанол.
Чистота N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида, полученного описанным выше способом, составляет 99,5%.
Пример 3. Получение новых составов 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида.
Составы 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты с содержанием N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида 0,0001%, 0,001%, 0,01%, 0,05%, 0,10%, 0,15%, 0,20%, 0,30%, 1,0% и 10,0% мас. согласно настоящему изобретению были получены из образца 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, приготовленного согласно примеру 1, путем добавления к нему соответствующего расчетного количества N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида, приготовленного согласно примеру 2, и тщательного перемешивания полученного состава.
Пример 4. Получение лекарственного средства в форме капсул.
Смешивали 900 г лактозы моногидрата, 900 г состава, полученного в примере 3, 356 г крахмала картофельного, 22 г магния стеарата и 22 г кремния диоксида коллоидного. Полученную смесь рассыпали по капсулам подходящего размера. Масса смеси внутри одной капсулы составляла 220 мг.
Пример 5. Исследование стабильности при хранении нового состава 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты.
Стабильность новых составов 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты оценивали по содержанию 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и сравнивали со стабильностью прототипа (2-(имидазол-4-ил)-этанамид пентандиовая-1,5 кислота без содержания N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида) методом ускоренного старения.
Все образцы хранили в стеклянных флаконах, укупоренных резиновыми пробками с алюминиевыми колпачками, в климатической камере в условиях ускоренных испытаний. Содержание действующего вещества определяли методом ВЭЖХ с использованием стандартов.
Метод «ускоренного старения» заключается в выдерживании испытуемого лекарственного средства при температурах и влажности, превышающих температуру и влажность его хранения в процессе обращения. При повышенных температурах, как правило, ускоряются протекающие в лекарственных средствах физико-химические процессы, приводящие со временем к нежелательным изменениям качества. Таким образом, при повышенной температуре промежуток времени, в течение которого контролируемые показатели качества лекарственного средства сохраняются в допустимых пределах (экспериментальный срок годности), искусственно сокращается в сравнении со сроком годности при температуре хранения. Это позволяет значительно сократить время, необходимое для установления срока годности.
По результатам, полученным в процессе «ускоренного старения» лекарственного средства, можно решить также обратную задачу, т.е. установить температуру хранения, обеспечивающую какой-либо заданный срок годности.
Срок годности (С) при температуре хранения (tхр) связан с экспериментальным сроком годности (СЭ) при повышенной температуре экспериментального хранения (tэ) следующей зависимостью:
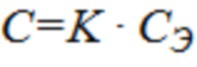 ,
,
где коэффициент соответствия 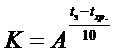 .
.
Температурный коэффициент скорости химической реакции (A) принят равным 2,5. Приведенная зависимость основана на правиле Вант-Гоффа о 2-4-кратном росте скоростей химических реакций при увеличении температуры на 10°С. Значение коэффициента соответствия (K) в зависимости от выбранного температурного интервала (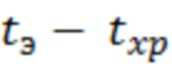 ), равного 35°C, составляет 24,7. Срок экспериментального хранения при выбранном сроке годности 3 года составляет 45 суток.
), равного 35°C, составляет 24,7. Срок экспериментального хранения при выбранном сроке годности 3 года составляет 45 суток.
В результате исследований было обнаружено, что составы, полученные согласно примеру 3, включающие 2-(имидазол-4-ил)-этанамид пентандиовую-1,5 кислоту с содержанием 0,01 мас. %, 0,05 мас. %, 0,10 мас. %, 0,15 мас. %, 0,20 мас. %, 0,30 мас. %, 1,0 мас. % и 10,0 мас. % N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида (составы 1, 2, 3, 4, 5, 6, 7, 8, соответственно), обладают увеличенной стабильностью при хранении по сравнению с прототипом (2-(имидазол-4-ил)-этанамид пентандиовая-1,5 кислота, не содержащая N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид). Результаты представлены в таблице 1.
Таблица 1. Оценка стабильности новых составов 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, методом ускоренного старения в сравнении с прототипом.
Было выявлено, что после 45 суток хранения в условиях метода ускоренного старения новые составы 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты по настоящему изобретению обладали статистически достоверно увеличенной стабильностью по сравнению с прототипом (статистический уровень значимости р<0,05). Субстанция прототипа оставалась стабильной в течение 15 суток, далее содержание 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты уменьшалось более чем на 4 %.
Авторы предполагают, что повышение стабильности комбинации является результатом химических свойств N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида. Одним из таких свойств является способность к комплексообразованию или хелатированию ионов металлов. Данное соединение имеет несколько функциональных групп, способных выступать в роли доноров электронов при комплексообразовании, например, карбоксильная группа, имидо-, амидогруппы, и представляет собой лиганд, специфически взаимодействующий с ионами металлов, например, с ионами цинка, меди, железа, магния. Это подтверждается высокими значениями lgK1≥5 по отношению к ионам переходных металлов [31].
Благодаря высокой способности к комплексообразованию, N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид способен связывать примеси ионов металлов, тем самым уменьшая их способность катализировать реакции окисления 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты.
К тому же, в структуре N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида присутствуют имидазольные кольца. Они включают в себя два типа атомов азота, обладающие разными свойствами. Один атом азота проявляет основные свойства, второй – кислотные, за счет наличия связи с водородом. За счет наличия водорода на этих атомах азота N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид способен образовывать ассоциаты с водой посредством водородных связей, тем самым связывая остаточную влагу, которая может оставаться при высушивании субстрата, что предотвращает реакции гидролиза 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты [32].
Пример 6. Противовирусное действие новых составов 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты согласно настоящему изобретению, дополнительно содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид.
Исследовали противовирусное действие новых составов для лечения и профилактики вирусных заболеваний, включающих 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты с содержанием 0,01%, 0,05%, 0,10%, 0,15%, 0,20%, 0,30%, 1,0% и 10,0% N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида (составы 1, 2, 3, 4, 5, 6, 7, 8, соответственно). Прототип содержал 2-(имидазол-4-ил)-этанамид пентандиовую-1,5 кислоту (без содержания N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида). Составы были приготовлены согласно примеру 3.
Противовирусное действие новых составов согласно настоящему изобретению в отношении адаптированного к мышам респираторно-синцитиального вируса человека.
Эксперимент проводили на белых беспородных мышах обоих полов массой 8-10 г, которых рандомизированно делили на 10 групп, в каждой группе по 10 животных: состав 1, состав 2, состав 3, состав 4, состав 5, состав 6, состав 7, состав 8, прототип и группа контроля, получавшая плацебо. Животных содержали по пять особей в терморегулируемых боксах (с температурой в среднем 21°С) при 12-часовом цикле дня и ночи и с достаточным количеством воды и пищи. Для проведения исследований был использован респираторно-синцитиальный вирус человека (РС вирус), предварительно адаптированный к росту в легких мышей. Мышей, предварительно наркотизированных эфиром, инфицировали РС вирусом интраназально в дозе 5,0 logTCID50, в объеме 0,05 мл для каждой мыши. О противовирусной эффективности новых составов согласно настоящему изобретению, содержащих 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, судили посредством измерения вирусного титра в легких мышей экспериментальных групп по сравнению с группой контроля на 5-е и 7-е сутки инфицирования посредством титрования выделенной 10%-ой суспензии легочной ткани мышей в культуре клеток Heр-2 по цитопатическому эффекту или действию (ЦПД). Животные получали лечение составами перорально при помощи зонда в дозе 30 мг в пересчете на человека, один раз в сутки в течение 7 дней, аналогичным образом, животные контрольной группы получали плацебо. Лечение начинали через сутки после инфицирования [28].
Таблица 2. Противовирусное действие новых составов 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты согласно настоящему изобретению, содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, в модели экспериментальной респираторно-синцитиальной вирусной инфекции у мышей.
* достоверное отличие инфекционного титра вируса в легких мышей экспериментальных групп (составы 1-8 и прототип) от инфекционного титра вируса в легких мышей контрольной группы, получавшей плацебо (р<0,05).
Представленные данные свидетельствуют о том, что новые составы согласно настоящему изобретению, содержащие N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, обладают противовирусной активностью, что подтверждается снижением титров вирусов в легких мышей по сравнению с мышами контрольной группы, получавшими плацебо (статистический уровень значимости р<0,05), причем в присутствии N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида наблюдается тенденция к увеличению противовирусной активности по сравнению с прототипом.
Противовирусное действие новых составов согласно настоящему изобретению в отношении вируса гриппа.
Эксперимент проводили на белых беспородных мышах обоих полов массой 8-10 г, которых рандомизированно делили на 10 групп, в каждой группе по 10 животных: состав 1, состав 2, состав 3, состав 4, состав 5, состав 6, состав 7, состав 8, прототип и группа контроля, получавшая плацебо. Животных содержали по пять особей в терморегулируемых боксах (с температурой в среднем 21°С) при 12-часовом цикле дня и ночи и с достаточным количеством воды и пищи. Для проведения исследований был использован вирус гриппа человека, тип A, штамм Aichi (аллантоисная жидкость), предварительно титрованный на мышах. Мышей, предварительно наркотизированных эфиром, инфицировали риновирусом интраназально в дозе 100 LD50, в объеме 0,05 мл для каждой мыши. О противовирусной эффективности новых составов согласно настоящему изобретению, содержащих 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, судили по изменению средней продолжительности жизни (СПЖ) мышей, выживаемости мышей и степени защиты от смертельной дозы вирусной инфекции, обеспечиваемой препаратом. Степень защиты, обеспечиваемой препаратом, вычислялась как разница между количеством выживших животных (в процентах) в экспериментальной группе, получавшей лечение препаратом, содержащим 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты, и количеством выживших животных (в процентах) в контрольной группе, получавшей плацебо. Животные получали лечение составами перорально при помощи зонда в дозе 60 мг в пересчете на человека, один раз в сутки в течение 3 дней до заражения и 10 дней после заражения, аналогичным образом, животные контрольной группы получали плацебо [20, 33].
Таблица 3. Противовирусное действие новых составов 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты согласно настоящему изобретению, содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, в модели экспериментальной гриппозной инфекции у мышей.
* достоверное отличие средней продолжительности жизни и выживаемости у мышей экспериментальных групп (составы 1-8 и прототип) от аналогичных показателей у мышей контрольной группы, получавшей плацебо (р<0,05).
Представленные данные свидетельствуют о том, что новые составы согласно настоящему изобретению, содержащие N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, обладают противовирусной активностью, что подтверждается увеличением СПЖ и выживаемости мышей экспериментальных групп по сравнению с мышами контрольной группы, получавшими плацебо (статистический уровень значимости р<0,05), причем в присутствии N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида наблюдается тенденция к незначительному увеличению СПЖ, выживаемости и степени защиты по сравнению с прототипом, притом наилучшие результаты показали составы с содержанием N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида в пределах 0,15 % масс.
Противовирусное действие новых составов согласно настоящему изобретению в отношении риновируса.
Эксперимент проводили на белых беспородных мышах обоих полов массой 8-10 г, которых рандомизированно делили на 10 групп, в каждой группе по 10 животных: состав 1, состав 2, состав 3, состав 4, состав 5, состав 6, состав 7, состав 8, прототип и группа контроля, получавшая плацебо. Животных содержали по пять особей в терморегулируемых боксах (с температурой в среднем 21°С) при 12-часовом цикле дня и ночи и с достаточным количеством воды и пищи. Для проведения исследований был использован риновирус человека, штамм HRV-1 (депонированный в ГКВ2730), предварительно титрованный на мышах. Мышей, предварительно наркотизированных эфиром, инфицировали риновирусом интраназально в дозе 5,0 lgTCID50, в объеме 0,05 мл для каждой мыши. Для оценки противовирусной эффективности новых составов согласно настоящему изобретению, содержащих 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, проводили измерения вирусного титра в легких мышей экспериментальных групп по сравнению с группой контроля на 2-е и 3-е сутки после инфицирования посредством титрования выделенной легочной суспензии мышей в культуре клеток HeLa по цитопатическому эффекту или действию (ЦПД). Животные получали лечение составами перорально при помощи зонда в дозе 30 мг в пересчете на человека один раз в сутки в течение 5 дней, аналогичным образом, животные контрольной группы получали плацебо. Лечение начинали через сутки после инфицирования [28].
Таблица 4. Противовирусное действие новых составов 2-(имидазол-4-ил)-этанамида пентандиовой-1,5 кислоты согласно настоящему изобретению, содержащих N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, по сравнению с прототипом в модели экспериментальной риновирусной инфекции у мышей.
* достоверное отличие инфекционного титра вируса в легких мышей экспериментальных групп (составы 1-8 и прототип) от инфекционного титра вируса в легких мышей контрольной группы, получавшей плацебо (р<0,05).
Представленные данные свидетельствуют о том, что новые составы согласно настоящему изобретению, содержащие N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, обладают противовирусной активностью, что подтверждается снижением титров вирусов в легких мышей по сравнению с мышами контрольной группы, получавшими плацебо (статистический уровень значимости р<0,05), причем в присутствии N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамида наблюдается тенденция к незначительному увеличению противовирусной активности по сравнению с прототипом.
Изобретение может быть использовано в медицине, химии, фармацевтической промышленности.
Список литературы
1. Рублева О.В.: «К вопросу о терапии и профилактике вирусных инфекций» // Русский медицинский журнал, Т. 20, № 11, 2012, С. 571-574;
2. Селькова Е.П.: «Профилактика и лечение острых респираторных вирусных инфекций. Применение амиксина» // Пособие для врачей, М., 2004;
3. Беляков К.В.: «Профилактика и лечение ОРВИ в современных городских условиях» // Consilium Provisorum, Т.04, № 5, 2006;
4. Гендон Ю.З.: «Этиология острых респираторных заболеваний» // Вакцинация, № 5(17), 2001, С. 4-5;
5. Ершов Ф.И., Гаращенко Т.И.: «Возможен ли контроль острых респираторных заболеваний у детей? (Новый взгляд на старую проблему)» // Актуальные вопросы оториноларингологии детского возраста и фармакотерапия болезней ЛОР-органов. Юбилейный сборник научных трудов, Москва, 2001;
6. Жаркова Н.Е.: «Симптоматическое лечение ОРВИ: будущее за комбинированными препаратами» // Русский Медицинский Журнал, 2007, № 22, 2007, С. 1636-1638;
7. Кузнецова О.Ю., Плешанова Ж.В.» «Место современных комбинированных препаратов в лечении острых респираторновирусных инфекций в амбулаторной практике» // Consilium medicum, Т. 12, № 3, 2012, С. 74-83;
8. Ho P.L., Becker M., Chan-Yeung M.M.: «Emerging occupational lung infections» // The International Journal of Tuberculosis and Lung Disease, V. 11, № 7, 2007, Р. 710-721;
9. Зайцев А.А.: «Направления фармакотерапии и профилактики острых респираторных вирусных инфекций» // Русский Медицинский Журнал, Т. 17, № 23, 2009, С. 1525;
10. Fokkens W., Lund V., Mullol J.: «European Position Paper on Rhinosinusitis and Nasal Polyps group» // Rhinology, V. 45, Suppl. 20, 2007, Р. 1-139;
11. Hayden F.G.: «Prevention and treatment of influenza in immunocompromised patients» // The American Journal of Medicine, V. 102(ЗA), № 17, 1997, P. 55-60;
12. Watts J.: «Asian nations step up action to curb spread of avian influenza» // The Lancet, V. 363, № 9406, 2004, P. 373;
13. Jefferson T., Demicheli V., Rivetti D., Jones M., Di Pietrantonj C., Rivetti A.: «Antivirals for influenza in healthy adults: systematic review» // The Lancet, V. 367, № 9507, 2006, Р. 303-313;
14. de Jong M.D., Tran T.T., Truong H.K., Vo M.H., Smith G.J., Nguyen V.C., Bach V.C., Phan T.Q., Do Q.H., Guan Y., Peiris J.S., Tran T.H., Farrar J.: «Oseltamivir Resistance during Treatment of Influenza A (H5N1) Infection» // The New England Journal of Medicine, V. 353, № 25, 2005, P. 2667-2572;
15. Smee D.F., Wong M.H., Bailey K.W., Sidwell R.W.: « Activities of oseltamivir and ribavirin used alone and in combination against infections in mice with recent isolates of influenza A (H1N1) and B viruses» // Antiviral Chemistry and Chemotherapy, V. 17, № 4, 2006, P. 185-192;
16. Li K.S., Guan Y., Wang J., Smith G.J., Xu K.M., Duan L., Rahardjo A.P., Puthavathana P., Buranathai C., Nguyen T.D., Estoepangestie A.T., Chaisingh A., Auewarakul P., Long H.T., Hanh N.T., Webby R.J., Poon L.L., Chen H., Shortridge K.F., Yuen K.Y., Webster R.G., Peiris J.S.: «Genesis of a highly pathogenic and potentially pandemic H5N1 influenza virus in eastern Asia» // Nature, V.430, № 6996, 2004, P. 209-213;
17. Yen H.L., Ilyushina N.A., Salomon R., Hoffmann E., Webster R.G., Govorkova E.A.: «Neuraminidase inhibitor-resistant recombinant A/Vietnam/1203/04 (H5N1) influenza viruses retain their replication efficiency and pathogenicity in vitro and in vivo» // Journal of Virology, Vol. 81, № 22, 2007, P.12418-12426;
18. Le Q.M., Kiso M., Someya K., Sakai Y.T., Nguyen T.H., Nguyen K.H., Pham N.D., Ngyen H.H., Yamada S., Muramoto Y., Horimoto T., Takada A., Goto H., Suzuki T., Suzuki Y., Kawaoka Y.: «Avian flu: isolation of drug-resistant H5N1 virus» // Nature, V. 437, № 7062, 2005, P. 1108;
19. Ершов Ф.И., Киселев О.И.: «Интерфероны и их индукторы (от молекул до лекарств)» // М.: ГЭОТАР-Медиа, 2005;
20. Патент РФ № 2141483, 20.11.1999;
21. Патент EA № 020283, 30.10.2014;
22. Патент РФ № 2496512, 27.10.2013;
23. Патент РФ № 2595862, 27.08.2016;
24. Заявка WO 2014035297, 06.03.2014;
25. Заявка WO 2013055258, 18.04.2013;
26. Патент РФ № 2546002, 20.01.2014,
27. Заявка WO № 2015108440, 23.07.2015;
28. Патент РФ № 2562773, 10.09.2015;
29. Бочнев П.Р.: «Комплексообразование и каталитическая активность» // Издательство «Мир», М., С.151-153;
30. Berge S.M., Bighley L.D., Monkhouse D.C.: «Pharmaceutical Salts» // Journal of Pharmaceutical Sciences, V. 66, № 1, 1977, P. 1-19;
31. Патент РФ № 2665688, 12.04.2013;
32. Антонова М.И., Берлянд А.С.: «Биоорганическая химия, ч. VI, Гетероциклические соединения» // М., МГМСУ, 2010, 63 С.;
33. Гублер Е.В.: «Вычислительные методы анализа и распознавание патологических процессов» // М., Наука, 1978, 365 С.
Группа изобретений относится к области медицины, фармакологии и химико-фармацевтической промышленности. Предложены: состав для лечения и профилактики заболеваний дыхательных путей, содержащий 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, и/или их оптические изомеры, и/или их фармацевтически приемлемые соли, фармацевтическая композиция на основе упомянутых составов, лекарственное средство на основе упомянутых состава или композиции, готовая лекарственная форма на их основе, применение упомянутых состава, фармацевтической композиции, лекарственного средства или готовой лекарственной формы для лечения и профилактики заболеваний дыхательных путей (варианты). Технический результат: N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид повышал стабильность 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в условиях ускоренного старения в течение 45 суток. 6 н. и 12 з.п. ф-лы, 4 табл.
1. Состав для лечения и/или профилактики заболеваний дыхательных путей, включающий 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты и N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, и/или их оптические изомеры, и/или их фармацевтически приемлемые соли.
2. Состав по п. 1, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве менее 10,00 масс.%.
3. Состав по п. 2, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,0001 до 10,00 масс.%.
4. Состав по п. 3, характеризующийся тем, что содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид, его оптические изомеры и/или фармацевтически приемлемые соли в количестве от 0,0001 до 1,00 % масс.
5. Состав по п. 4, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,05 до 1,00 % масс.
6. Состав по п. 5, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,10 до 0,30 % масс.
7. Состав по п. 6, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве от 0,10 до 0,20 % масс.
8. Состав по п. 2, характеризующийся тем, что упомянутый состав содержит N,N'-бис-[2-(1Н-имидазол-4-ил)этил]пентандиамид в количестве не более 0,15 % масс.
9. Состав по п. 1, характеризующийся тем, что упомянутый состав содержит 2-(имидазол-4-ил)-этанамид пентандиовой-1,5 кислоты в количестве более 96,00 % масс.
10. Состав по любому из пп. 1-9, характеризующийся тем, что заболевания представляют собой заболевания верхних дыхательных путей.
11. Состав по любому из пп. 1-10, характеризующийся тем, что заболевания выбраны из группы, состоящей из ОРВИ и гриппа.
12. Состав по любому из пп. 1-11, характеризующийся тем, что заболевания выбраны из группы, состоящей из ринита, синусита, риносинусита, фарингита, назофарингита, тонзиллита, болезней голосовых складок и гортани, вазомоторного и аллергического ринита, бронхита, бронхиолита, пневмонии, бронхиальной астмы, хронической обструктивной болезни легких, муковисцидоза.
13. Состав по любому из пп. 1-12, характеризующийся тем, что заболевания вызваны вирусом, выбранным из группы, состоящей из риновируса, респираторно-синцитиального вируса, вируса парагриппа, вируса гриппа, аденовируса, метапневмовируса, коронавируса, вируса Коксаки, энтеровируса, ротавируса, вируса герпеса.
14. Фармацевтическая композиция для лечения и/или профилактики заболеваний дыхательных путей, причем упомянутая композиция содержит в терапевтически эффективном количестве состав по любому из пп. 1-13 и по меньшей мере один фармацевтически приемлемый носитель.
15. Лекарственное средство для лечения и/или профилактики заболеваний дыхательных путей в виде таблеток, капсул или сиропа, помещенных в фармацевтически приемлемую упаковку, причем упомянутое средство содержит в терапевтически эффективном количестве состав по любому из пп. 1-13 или фармацевтическую композицию по п. 14.
16. Готовая лекарственная форма для лечения и/или профилактики заболеваний дыхательных путей в виде таблеток, капсул или сиропа, помещенных в фармацевтически приемлемую упаковку, причем упомянутое средство содержит в терапевтически эффективном количестве состав по любому из пп. 1-13, фармацевтическую композицию по п. 14 или лекарственное средство по п. 15.
17. Применение состава по п. 1 для лечения и/или профилактики заболеваний дыхательных путей.
18. Применение фармацевтической композиции по п. 14, лекарственного средства по п. 15 или готовой лекарственной формы по п. 16 для лечения и/или профилактики заболеваний дыхательных путей.
| СТАБИЛЬНАЯ ЖИДКАЯ КОМПОЗИЦИЯ ЭТАНЕРЦЕПТА | 2012 |
|
RU2575619C2 |
| ПРОИЗВОДНЫЕ ПЕПТИДОВ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2141483C1 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ N,N'-БИС[2-(1Н-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ]МАЛОНАМИДА | 2018 |
|
RU2679636C1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ПРОИЗВОДНЫЕ ГЛУТАРИМИДОВ, ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2562773C2 |
| ТЕНЗОМЕТРИЧЕСКИЙ ДАТЧИК ПЕРЕМЕЩЕНИЯ | 1997 |
|
RU2126954C1 |
| АШАХЕР Т | |||
| и др | |||
| Влияние препарата ингавирин (имидазолэтанамида пентадиовой кислоты) на интерфероновый статус клеток в условиях вирусной инфекции | |||
| Эпидемиология и инфекционные болезни | |||
Авторы
Даты
2021-03-22—Публикация
2019-09-12—Подача