В соответствии с 119(e) раздела 35 Кодекса США (35 U.S.C.) по настоящей заявке испрашивается приоритет на основании предварительной патентной заявки с серийным номером 62/299755, поданной 25 февраля 2016 г., полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к композициям и способам для улучшения состояния и усиления фильтрующей способности эпителиальных и слизистых оболочек за счет повышения целостности их естественных защитных секретов. В частности, изобретение относится к композициям и способам для защиты эпителиальных и слизистых оболочек субъекта от инфекции, вызываемой присутствующими в воздухе патогенами, такими как вирусы, бактерии и грибки, а также от раздражения, вызываемого нежелательными присутствующими в воздухе частицами, такими как аллергены, раздражители или пахучие вещества. Изобретение также относится к композициям, предназначенным для использования в дыхательных путях (например, для нанесения на слизистую оболочку носовой и ротовой полости) человека с целью профилактики микробных и вирусных инфекций, в частности, инфекций, вызываемых человеческим риновирусом (HRV) и человеческим вирусом гриппа.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Респираторные инфекции, как правило, возникают, когда присутствующие в воздухе патогены вступают в контакт со слизистыми оболочками (например, оболочками носовой полости, волосами в носовой полости, оболочками пищевода и тому подобным) через вдыхаемые или проглатываемые капли жидкости или аэрозоля. Вдыхание или проглатывание патогенов, поступающих через нос или рот, является основной причиной респираторного заболевания и также может вызывать системное заболевание, такое как полиомиелит или ящур. Присутствующие в воздухе патогены после вдыхания или проглатывания могут попадать в легкие, или они могут связываться с рецепторами, находящимися на оболочках носовой полости, а также других оболочках на всем протяжении верхних и нижних дыхательных путей, которые служат воротами, через которые патогены, аллергены или раздражители могут попадать в кровоток и вызывать респираторные, а также другие виды инфекции или аллергическую реакцию. К сожалению, не существует удобного, эффективного пути минимизировать, или предотвращать, инфекцию или аллергию, вызываемую вдыхаемыми или проглатываемыми микроорганизмами. Вследствие этого, существует острая необходимость в разработке новых композиций и способов для защиты от присутствующих в воздухе патогенов, аллергенов и раздражителей, и, в частности, от вирусов, особенно человеческого риновируса (HRV), человеческого вируса гриппа, или обоих вирусов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с вышеизложенными и другими стоящими задачами, по настоящему изобретению предложены композиции, такие как назальные спреи, пероральные спреи, полоскания для рта, пастилки, и тому подобное, а также соответствующие способы использования таких композиций для усиления способности эпителиальных оболочек фильтровать определенные присутствующие в воздухе патогены. В частности, изобретение относится к противомикробным композициям для предотвращения и лечения респираторных инфекций и аллергии, которые вызывают раздражители, аллергены, бактерии, грибки и вирусы. В предпочтительных вариантах осуществления композиции защищают субъекта от вирусных инфекций, в частности, вызываемых человеческим риновирусом и/или человеческим вирусом гриппа.
Один аспект изобретения относится к композиции для профилактики или лечения субъекта-человека, страдающего от, или который потенциально может страдать от, респираторной инфекции. Композиция может содержать одно или более противомикробных, либо противовирусных соединений, диспергированных в носителе, как правило, но необязательно, жидком носителе. В идеале, но необязательно, жидкий носитель с соответствующими реологическими свойствами будет распыляться в виде аэрозоля или мелкодисперсного тумана. Композиция может содержать один или более ингредиентов, выбранных из группы, состоящей из смягчающего средства, окклюзивного средства, увлажняющего средства, носителя, эксципиента, эмульгатора и эфирного масла. В некоторых вариантах осуществления композиция для профилактики или лечения респираторной инфекции может содержать активный ингредиент, который борется с вызывающими инфекцию вирусами, связывающими молекулу межклеточной адгезии 1 (ICAM-1), и/или вирусами, связывающими сиаловую кислоту (или ее внеклеточные фрагменты). Один вариант осуществления относится к композиции для профилактики или лечения субъекта-человека, страдающего от, или который потенциально может страдать от, инфекции дыхательных путей, вызываемой человеческим риновирусом (HRV), содержащей в соответствующем жидком носителе: (i) растворимую ICAM-1 («рICAM-1») и/или ингибитор ICAM-1; (ii) лизоцим и (iii) лактоферрин (например, аполактоферрин). Другой вариант осуществления относится к композиции для профилактики или лечения субъекта-человека, страдающего от, или который потенциально может страдать от, инфекции дыхательных путей, вызываемой человеческим вирусом гриппа, содержащей в соответствующем жидком носителе: (i) сиаловую кислоту (например, сиалиллактозу); (ii) лизоцим; (iii) лактоферрин и (iv) необязательно, ингибитор нейраминидазы, такой как, например, кверцетин. Другой вариант осуществления относится к композиции для профилактики или лечения субъекта-человека, страдающего от, или который потенциально может страдать от, инфекции дыхательных путей, вызываемой человеческим риновирусом (HRV) и человеческим вирусом гриппа, содержащей в соответствующем жидком носителе: (i) растворимую ICAM-1 (рICAM-1) и/или ингибитор ICAM-1; (ii) лизоцим; (iii) лактоферрин, (iv) сиаловую кислоту и/или ее производное (например, сиалиллактозу) и (v) необязательно, ингибитор нейраминидазы. Любая из композиций по данным вариантам осуществления может дополнительно содержать одно или более из пероксида цинка, меди и серебра. Любая из композиций по данным вариантам осуществления может дополнительно содержать каррагинан. Любая из композиций по данным вариантам осуществления может дополнительно содержать одно или более из IgA, IgG и IgM. Композиции могут дополнительно содержать один или более ингредиентов, выбранных из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры плодов цитрусовых, экстракта меда, экстракта розмарина, экстракта мирры, экстракта бессмертника, экстракта маранты, масла семян маргозы, витамина C, витамина E и экстракта семян грейпфрута. Носитель может быть водным, и может содержать один или более фармацевтически приемлемых эксципиентов, включая, без ограничения, разбавители, буферные средства, регуляторы pH (например, лимонную кислоту и так далее), загустители и суспендирующие средства (например, гуммиарабик, ксантановую камедь, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, натрий-карбоксиметилцеллюлозу и так далее), модификаторы реологических свойств, консерванты (например, фенетиловый спирт, бензалкония хлорид, натрий ЭДТА и так далее), регуляторы изотоничности (например, хлорид натрия, полиолы, сахарозу и так далее), увлажняющие средства (например, глицерин), сурфактанты (например, полисорбаты, такие как полисорбат 80, сахарозы пальмитат, глицерил стеарат, глицерил стеарат цитрат, ацетилированный гидрогенизированный растительный глицерид и так далее) и модификаторы вкуса, например. Любые эксципиенты должны быть совместимы с человеческой слизистой оболочкой и эпителием, и не должны вызывать излишней сухости или раздражения в слизистой оболочке или эпителии. При использовании эксципиентов следует также учитывать тот факт, что вода будет испаряться при температуре тела, и, следовательно, можно включать вторичный растворитель для обеспечения поддержания растворимых компонентов в растворе. Носитель может включать полиол, например, C2-C8 полиол, в том числе, без ограничения, глицерин, пропиленгликоль, 1,3-пропандиол, бутиленгликоль, 1,4-бутандиол, эритрит, трейтол, арабит, ксилит, маннит, сорбит, пентиленгликоль, гексиленгликоль, каприлилгликоль, гидрогенизированный гидролизат крахмала, изомальт, мальтит и тому подобное. Композиции могут содержать некоторое количество спирта, такого как этанол, при условии, что он будет присутствовать в количестве, которое не приводит к раздражению или сухости слизистой оболочки. В некоторых вариантах осуществления композиции не содержат этанол. В одном варианте осуществления носитель представляет собой водный носитель, содержащий примерно 1-95% или примерно 5-50%, или примерно 10-40%, или примерно 15-35%, или примерно 20-30% 1,3-пропандиола, в соотношении по объему (об/об), (масс/об) или по массе (масс/масс). В некоторых вариантах осуществления композиция может иметь кинематическую вязкость в диапазоне примерно 1-1500 или примерно 5-1000, или примерно 10-750, или примерно 20-500 сантистоксов (мм2/с). Композиции могут иметь реологические свойства ньютоновской или неньютоновской жидкости. Композиции могут быть, например, псевдопластичными и/или тиксотропными, так что они легко протекают через распылительное сопло и образуют туман из капель подходящего размера при гидродинамической фрагментации, но сгущаются in situ, образуя пленку на слизистой оболочке, которая противостоит удалению из носовой или ротовой полости, так что активное вещество остается на слизистой оболочке в течение времени, достаточного для нейтрализации патогенов, контактирующих со слизистой оболочкой. Как правило, композиция будет иметь достаточную вязкость, чтобы обеспечивать время удержания на слизистой оболочке носовой или ротовой полости, составляющее по меньшей мере 1 минуту, более предпочтительно, по меньшей мере 5, 10, 15, 20, 25 или 30 минут после нанесения. Композиция должна быть полупроницаемой, чтобы вирионы и другие патогены могли проникать в пленку и вступать в контакт с активными ингредиентами, но при этом обладать достаточной барьерной функцией, чтобы препятствовать испарению воды и летучих растворителей, обеспечивая поддержание активных компонентов в растворе.
В некоторых вариантах осуществления композиция может содержать:
(i) примерно 0,00000001%-10% по массе ICAM-1 (например, растворимой ICAM-1);
(ii) от 0% (или от примерно 0,00000001%) до примерно 10% по массе ингибитора нейраминидазы;
(iii) от примерно 0,00000001% до примерно 10% по массе сиаловой кислоты (например, сиалиллактозы, 2,3'-сиалиллактозы, и/или 2,6'-сиалиллактозы);
(iv) от примерно 0,00000001% до примерно 10% по массе лизоцима; и
(v) от примерно 0,00000001% до примерно 10% по массе лактоферрина (например, аполактоферрина);
фармацевтически приемлемый носитель и, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция может содержать:
(i) примерно 0,000001%-1% (или до примерно 0,1%) по массе ICAM-1 (например, растворимой ICAM-1); и/или
(ii) от 0% (или от примерно 0,000001%) до примерно 1% (или до примерно 0,1%) по массе ингибитора нейраминидазы; и/или
(iii) от примерно 0,000001% до примерно 0,001% (или до примерно 0,01%) по массе сиаловой кислоты (например, сиалиллактозы, 2,3'-сиалиллактозы и/или 2,6'-сиалиллактозы); и/или
(iv) от примерно 0,0001% до примерно 5% (или до примерно 1%) по массе лизоцима; и/или
(v) от примерно 0,00005% до примерно 5% (или до примерно 0,5%) по массе лактоферрина (например, аполактоферрина);
фармацевтически приемлемый носитель и, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция может содержать:
(i) примерно 0,0005%-0,05% по массе ICAM-1 (например, растворимой ICAM-1); и/или
(ii) от 0% (или от примерно 0,005%) до примерно 0,05% по массе ингибитора нейраминидазы; и/или
(iii) от примерно 0,000005% до примерно 0,05% по массе сиаловой кислоты (например, сиалиллактозы, 2,3'-сиалиллактозы и/или 2,6'-сиалиллактозы); и/или
(iv) от примерно 0,0025% до примерно 0,25% по массе лизоцима; и/или
(v) от примерно 0,00005% до примерно 0,1% по массе лактоферрина (например, аполактоферрина);
фармацевтически приемлемый носитель и, необязательно, один или более эксципиентов.
Фармацевтическая композиция может быть использована в способе предотвращения или лечения респираторной инфекции. Респираторная инфекция может быть вызвана человеческим риновирусом и/или человеческим вирусом гриппа. В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим риновирусом (HRV), может содержать:
(i) от примерно 0,00000001% до примерно 10% по массе растворимой ICAM-1;
(ii) от примерно 0,000005% до примерно 10% по массе лизоцима; и
(iii) от примерно 0,00000025% до примерно 10% по массе лактоферрина;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим риновирусом (HRV), может содержать:
(i) примерно 0,000001%-1% (или до примерно 0,1%) по массе растворимой ICAM-1;
(ii) от примерно 0,0001% до примерно 5% (или до примерно 1%) по массе лизоцима; и
(iii) от примерно 0,00005% до примерно 5% (или до примерно 0,5%) по массе лактоферрина;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим риновирусом (HRV), может содержать:
(i) примерно 0,0005%-0,05% по массе растворимой ICAM-1; и/или
(ii) от примерно 0,0025% до примерно 0,25% по массе лизоцима; и/или
(iii) от примерно 0,00005% до примерно 0,1% по массе лактоферрина;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим вирусом гриппа, может содержать:
(i) от примерно 0,0000001% до примерно 10% по массе указанной сиаловой кислоты (например, сиалиллактозы);
(ii) от примерно 0,00000001% до примерно 10% по массе указанного лизоцима;
(iii) от примерно 0,00000001% до примерно 10% по массе указанного лактоферрина; и
(i) от 0% (или от примерно 0,00000001%) до примерно 10% по массе ингибитора нейраминидазы;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим вирусом гриппа, может содержать:
(i) от примерно 0,000005% до примерно 0,05% по массе указанной сиаловой кислоты (например, сиалиллактозы);
(ii) от примерно 0,0001% до примерно 5% (или до примерно 1%) по массе указанного лизоцима;
(iii) от примерно 0,00005% до примерно 5% (или до примерно 0,5%) по массе указанного лактоферрина; и
(ii) от 0% (или от примерно 0,01%) до примерно 10% по массе ингибитора нейраминидазы;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиция для предотвращения или лечения респираторной инфекции, вызываемой человеческим вирусом гриппа, может содержать:
(i) от примерно 0,000005% до примерно 0,05% по массе указанной сиаловой кислоты (например, сиалиллактозы); и/или
(ii) от примерно 0,0025% до примерно 0,25% по массе указанного лизоцима; и/или
(iii) от примерно 0,00005% до примерно 0,1% по массе указанного лактоферрина; и/или
(iii) от 0% (или от примерно 0,000001%) до примерно 1% (или до примерно 0,1%) по массе ингибитора нейраминидазы;
и фармацевтически приемлемый носитель, а также, необязательно, один или более эксципиентов.
В некоторых вариантах осуществления композиции по изобретению будут представлять собой водные растворы или суспензии, содержащие примерно 0,5-5000 мкг/мл (или примерно 1-1000 мкг/мл, или примерно 5-500 мкг/мл) лактоферрина (например, аполактоферрина). В некоторых вариантах осуществления композиции по изобретению будут представлять собой водные растворы или суспензии, содержащие примерно 0,25-10000 мкг/мл (или примерно 1-5000 мкг/мл, или примерно 25-2500 мкг/мл) лизоцима. В некоторых вариантах осуществления композиции по изобретению будут представлять собой водные растворы или суспензии, содержащие примерно 0,01-500 мкг/мл (или примерно 0,1-100 мкг/мл, или примерно 0,5-50 мкг/мл) ICAM-1 (например, растворимой ICAM-1). В некоторых вариантах осуществления композиции по изобретению будут представлять собой водные растворы или суспензии, содержащие примерно 0,01-2000 мкг/мл (или примерно 0,1-1000 мкг/мл, или примерно 0,5-750 мкг/мл) сиаловой кислоты (например, сиалиллактозы). В некоторых вариантах осуществления композиции по изобретению будут представлять собой водные растворы или суспензии, содержащие примерно 0,005-1000 мкг/мл (или примерно 0,5-500 мкг/мл, или примерно 0,25-375 мкг/мл) 3'-сиалиллактозы и/или примерно 0,005-1000 мкг/мл (или примерно 0,5-500 мкг/мл, или примерно 0,25-375 мкг/мл) 6'-сиалиллактозы.
Фармацевтические композиции по изобретению могут иметь форму назального спрея, назальных капель, перорального спрея, полоскания для рта или пастилки. Носитель фармацевтической композиции может быть выбран так, чтобы обеспечивать время удержания композиции на слизистой оболочке носовой и/или ротовой полости, составляющее по меньшей мере 1 минуту или по меньшей мере 5 минут, или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут после нанесения. В некоторых вариантах осуществления композиция для нанесения на слизистую оболочку носовой или ротовой полости содержит одно или более противовирусных и/или противомикробных средств, диспергированных в жидком носителе, содержащем примерно 1-99% (об/об) воды или примерно 60-90% (об/об) воды и примерно 10-40% (или 20-30%) (об/об) полиола. В некоторых вариантах осуществления фармацевтически приемлемый носитель представляет собой водный раствор, содержащий примерно 5-50% (об/об) или примерно 10-40% (об/об), или примерно 15-35% (об/об), или примерно 20-30% (об/об) 1,3-пропандиола. Композиция может быть распылена или нанесена при глотании на слизистую оболочку и способна оставаться на слизистой оболочке в течение по меньшей мере 5 минут (или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут) после нанесения, без существенного раздражения или высушивания слизистой оболочки.
Предложены способы профилактики и/или лечения различных вирусных инфекций. В некоторых вариантах осуществления способ профилактики и/или лечения инфекции, вызываемой человеческим риновирусом, включает нанесение любой из композиций, описанных в настоящем документе, на слизистую оболочку носовой и/или ротовой полости индивидуума, который нуждается в этом. В некоторых вариантах осуществления слизистая оболочка носовой и/или ротовой полости индивидуумов, которые нуждаются в этом, находится в контакте с человеческим риновирусом.
В одном аспекте изобретение относится к фармацевтической композиции для предотвращения или лечения субъектов, страдающих от, или которые потенциально могут страдать от, респираторной инфекции, содержащей: одно или более противомикробных или противовирусных соединений и базовую смесь, содержащую один или более ингредиентов, выбранных из группы, состоящей из носителя, смягчающего средства, окклюзивного средства, увлажняющего средства, полиола, эмульгатора, консерванта, загустителя или суспендирующего вещества, сурфактанта, регулятора pH, регулятора изотоничности и эфирного масла. В одном из вариантов осуществления противомикробное или противовирусное соединение представляет собой одно или более соединений, выбранных из группы, состоящей из антитела, такого как IgA, IgG или IgM, растворимой ICAM-1, ингибитора ICAM-1, сиаловой кислоты, ингибитора нейраминидазы, лактоферрина, лизоцима, цинка, соединений цинка, серебра, соединений серебра, меди, соединений меди, а также их сочетаний. В одном из вариантов осуществления ингибитор нейраминидазы выбирают из группы, состоящей из кверцетина, озельтамивира, занамивира, ланинамивира и перамивира. В одном из вариантов осуществления ингибитор ICAM-1 выбирают из группы, состоящей из анти-ICAM-1 антитела, цитокина, CD11a, эзрина (EZR), CD18, глицирретиновой кислоты, пирролидиндитиокарбамата, ингибитора активации NFkB, гетероциклического тиазола, липоевой кислоты, эфализумаба, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамида, силибинина, стилбенов, (+)-эпигаллокатехина галлата [(+)-EGCG], а также их сочетаний. В одном из вариантов осуществления одно или более противомикробных, или противовирусных, соединений включают растворимую ICAM-1 и сиаловую кислоту (например, сиалиллактозу, 3'-сиалиллактозу и/или 6'-сиалиллактозу). В одном из вариантов осуществления одно или более противомикробных, или противовирусных, соединений включают лактоферрин, лизоцим, ингибитор нейраминидазы, IgA, IgG, IgM, пероксид цинка (ZnO2), медь и серебро. В одном из вариантов осуществления респираторную инфекцию выбирают из группы, состоящей из инфекции, вызываемой риновирусом, инфекции, вызываемой вирусом гриппа, грибковой инфекции и бактериальной инфекции. В одном из вариантов осуществления один или более ингредиентов выбирают из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры плодов цитрусовых, экстрактов меда, экстрактов розмарина, экстракта мирры, экстракта бессмертника, экстракта маранты, масла семян маргозы, арганового масла, витамина C, витамина E, экстракта семян грейпфрута, а также их сочетаний.
В одном аспекте изобретение относится к способу профилактики или лечения респираторной инфекции у субъектов, страдающих от, или которые потенциально могут страдать от, респираторной инфекции, включающему: определение того, что субъект страдает от, или потенциально может страдать от, респираторной инфекции; и введение композиции по изобретению, содержащей одно или более противомикробных, или противовирусных, соединений и базовую смесь, содержащую один или более ингредиентов, выбранных из группы, состоящей из носителя, смягчающего средства, окклюзивного средства, увлажняющего средства, эмульгатора и эфирного масла. В одном из вариантов осуществления одно или более противомикробных, или противовирусных, соединений включают растворимую ICAM-1. В одном из вариантов осуществления одно или более противомикробных, или противовирусных, соединений включают сиаловую кислоту или ее производное (например, сиалиллактозу). В одном варианте осуществления одно или более противомикробных, или противовирусных, соединений включают лактоферрин (например, аполактоферрин). В одном варианте осуществления одно или более противомикробных, или противовирусных, соединений включают лизоцим. В одном варианте осуществления одно или более противомикробных, или противовирусных, соединений включают ингибитор нейраминидазы. В одном варианте осуществления одно или более противомикробных, или противовирусных, соединений включают IgA, IgG и/или IgM. В одном варианте осуществления одно или более противомикробных, или противовирусных, соединений включают пероксид цинка (ZnO2), медь и/или серебро. Композиции можно вводить любым подходящим путем введения, включая пероральный, топический, назальный, а также их сочетания. В одном из вариантов осуществления композицию наносят на оболочки носовой полости. В одном из вариантов осуществления композицию вводят с использованием устройства, выбранного из группы, состоящей из распылителя, ингалятора, небулайзера, аэрозольного флакона и пульверизатора. Композиция может содержать пропеллент или может не содержать пропелленты.
Эти и другие аспекты изобретения могут быть более понятны из следующего далее подробного описания и прилагаемой формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фиг. 1 показывает эффект воздействия аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на целостность ткани, инфицированной риновирусом A16. ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 2 показывает эффект воздействия лизоцима в концентрации 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3) на целостность ткани, инфицированной риновирусом A16. ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 3 показывает эффект воздействия растворимой ICAM-1 в концентрации 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3) на целостность ткани, инфицированной риновирусом A16. ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 4 показывает эффект воздействия сочетания аполактоферрина, лизоцима и растворимой ICAM-1 в трех разных дозах, приведенных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3), на целостность ткани, инфицированной риновирусом A16. ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 5 показывает эффект воздействия аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на высвобождение ЛДГ из клеток, инфицированных риновирусом A16. Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 6 показывает эффект воздействия лизоцима в концентрации 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3) на высвобождение ЛДГ из клеток, инфицированных риновирусом A16. Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 7 показывает эффект воздействия растворимой ICAM-1 в концентрации 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3) на высвобождение ЛДГ из клеток, инфицированных риновирусом A16. Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 8 показывает эффект воздействия сочетания аполактоферрина, лизоцима и растворимой ICAM-1 в трех разных дозах, приведенных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3), на высвобождение ЛДГ из клеток, инфицированных риновирусом A16. Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 9 показывает эффект воздействия аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на колебание ресничек. Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 10 показывает эффект инфицирования риновирусом A16 на частоту колебания ресничек эпителиальных клеток при воздействии лизоцима в концентрации 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 11 показывает эффект инфицирования риновирусом A16 на частоту колебания ресничек эпителиальных клеток при воздействии растворимой ICAM-1 в концентрации 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 12 показывает эффект инфицирования риновирусом A16 на частоту колебания ресничек эпителиальных клеток при воздействии сочетания аполактоферрина, лизоцима и растворимой ICAM-1 в трех разных дозах, приведенных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 13 показывает эффект инфицирования риновирусом A16 на мукоцилиарный клиренс эпителиальных клеток при воздействиях HRV. Мукоцилиарный клиренс контролировали через 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 14 показывает число геномных копий инфекционного риновируса A16 при воздействии аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 15 показывает число геномных копий инфекционного риновируса A16 при воздействии лизоцима в концентрации 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 16 показывает число геномных копий инфекционного риновируса A16 при воздействии растворимой ICAM-1 в концентрации 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 17 показывает число геномных копий инфекционного риновируса A16 при воздействии сочетания аполактоферрина, лизоцима и растворимой ICAM-1 в трех разных дозах, приведенных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 18 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3), и инфицировании риновирусом A16, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 19 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3), и инфицировании риновирусом A16, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 20 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии растворимой ICAM-1 в концентрации 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3), и инфицировании риновирусом A16, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 21 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии аполактоферрина в концентрации 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3), и инфицировании риновирусом A16, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 22 показывает эффект инфицирования вирусом гриппа A H1N1 на целостность ткани при воздействии аполактоферрина в концентрации 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2), и 5 мкг/мл (IAV1-3). ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 23 показывает эффект инфицирования вирусом гриппа A H1N1 на целостность ткани при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 24 показывает эффект инфицирования вирусом гриппа A H1N1 на целостность ткани при воздействии сочетания 3'-сиалиллактозы и 6'-сиалиллактозы, каждой из них в концентрации 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 25 показывает эффект инфицирования вирусом гриппа A H1N1 на целостность ткани при воздействии сочетания аполактоферрина, лизоцима и сиалиллактоз в трех разных дозах, приведенных в Таблице 5 (IAV4-1, IAV4-2 и IAV4-3). ТЭЭС контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 26 показывает эффект инфицирования вирусом гриппа A H1N1 на высвобождение ЛДГ из эпителиальных клеток при воздействии аполактоферрина в концентрации 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 27 показывает эффект инфицирования вирусом гриппа A H1N1 на высвобождение ЛДГ из эпителиальных клеток при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 28 показывает эффект инфицирования вирусом гриппа A H1N1 на высвобождение ЛДГ из эпителиальных клеток при воздействии сочетания 3'-сиалиллактозы и 6'-сиалиллактозы, каждой из них в концентрации 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 29 показывает эффект инфицирования вирусом гриппа A H1N1 на высвобождение ЛДГ из эпителиальных клеток при воздействии сочетания аполактоферрина, лизоцима и сиалиллактоз в трех разных дозах, приведенных в Таблице 5 (IAV4-1, IAV4-2 и IAV4-3). Цитотоксичность контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 30 показывает эффект инфицирования вирусом гриппа A H1N1 на частоту колебания ресничек эпителиальных клеток при воздействии аполактоферрина в концентрации 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 31 показывает эффект инфицирования вирусом гриппа A H1N1 на частоту колебания ресничек эпителиальных клеток при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 32 показывает эффект инфицирования вирусом гриппа A H1N1 на частоту колебания ресничек эпителиальных клеток при воздействии сочетания 3'-сиалиллактозы и 6'-сиалиллактозы, каждой из них в концентрации 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 33 показывает эффект инфицирования вирусом гриппа A H1N1 на частоту колебания ресничек эпителиальных клеток при воздействии сочетания аполактоферрина, лизоцима и сиалиллактоз в трех разных дозах, приведенных в Таблице 5 (IAV4-1, IAV4-2 и IAV4-3). Частоту колебания ресничек контролировали через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 34 показывает эффект инфицирования вирусом гриппа A H1N1 на мукоцилиарный клиренс эпителиальных клеток при воздействии IAV. Мукоцилиарный клиренс контролировали через 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 35 показывает число геномных копий инфекционного вируса гриппа A H1N1 при воздействии аполактоферрина в концентрации 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 36 показывает число геномных копий инфекционного вируса гриппа A H1N1 при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). Вирусную нагрузку определяли через 3,5, 24, и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 37 показывает число геномных копий инфекционного вируса гриппа A H1N1 при воздействии сочетанием 3'-сиалиллактозы и 6'-сиалиллактозы, каждой из них в концентрации 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 38 показывает число геномных копий инфекционного вируса гриппа A H1N1 при воздействии сочетания аполактоферрина, лизоцима и сиалиллактоз в трех разных дозах, приведенных в Таблице 5 (IAV4-1, IAV4-2 и IAV4-3). Вирусную нагрузку определяли через 3,5, 24 и 48 часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 39 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии аполактоферрина в концентрации 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3), и инфицировании вирусом гриппа A H1N1, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 40 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии лизоцима в концентрации 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3), и инфицировании вирусом гриппа A H1N1, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 41 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии сочетания 3'-сиалиллактозы и 6'-сиалиллактозы, каждой из них в концентрации 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3), и инфицировании вирусом гриппа A H1N1, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
Фиг. 42 показывает количество муцина, измеренное в анализе ELLA, из апикальной среды при воздействии сочетания аполактоферрина, лизоцима и сиалиллактоз в трех разных дозах, приведенных в Таблице 5 (IAV4-1, IAV4-2 и IAV4-3), и инфицировании вирусом гриппа A H1N1, через 24 (D1) и 48 (D2) часов после инокуляции на трехмерной среде MucilAir™.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение может быть более понятным из следующего далее подробного описания и включенных в него примеров. Прежде чем настоящие способы и методики будут раскрыты и описаны, следует упомянуть, что специалистам в данной области должно быть понятно, что данное изобретение не ограничено конкретными методами анализа и синтеза, описанными в настоящем документе. Также следует понимать, что терминология, используемая в настоящем документе, предназначена лишь для описания конкретных вариантов осуществления и не должна быть ограничивающей. Если нет иных указаний, все технические и научные термины, используемые в настоящем документе, имеют то значение, которое им обычно придают специалисты в области, к которой относится данное изобретение.
Термин «средство» или «терапевтическое средство» означает любое низкомолекулярное химическое соединение, антитело, молекулу нуклеиновой кислоты или полипептид, либо их фрагменты. «Терапевтическое средство» означает любую из композиций, предназначенных для предотвращения или лечения респираторных инфекций, описанных в настоящем документе.
Термин «облегчать» означает уменьшать, подавлять, ослаблять, понижать, останавливать или стабилизировать развитие, или прогрессирование, респираторного заболевания или его симптома.
Термин «аналог» означает молекулу, которая не является идентичной, но обладает аналогичными функциональными или структурными особенностями. Например, аналог полипептида сохраняет биологическую активность соответствующего природного полипептида, но в то же время имеет определенные биохимические модификации, которые приводят к усилению функции аналога в сравнении с функцией природного полипептида. Такие биохимические модификации могут приводить к увеличению у аналога устойчивости к протеазам, способности проникать через мембрану или времени полураспада, без изменения, например, способности к связыванию лиганда. Аналог может содержать неприродную аминокислоту.
Используемый в настоящем документе термин «профилактика» означает предотвращение, уменьшение степени тяжести или замедление темпов распространения инфекции (например, вирусной инфекции и так далее).
Используемый в настоящем документе термин «интерферирующая РНК» означает любую последовательность двухцепочечной или одноцепочечной РНК, способную прямо или косвенно (то есть, при превращении) ингибировать или подавлять экспрессию гена, опосредуя РНК-интерференцию. Интерферирующая РНК включает, но без ограничения, короткую интерферирующую РНК («киРНК») и короткую шпилечную РНК («кшРНК»). «РНК-интерференция» означает избирательное расщепление транскрипта матричной РНК, совместимого с последовательностью.
Используемый в настоящем документе термин «кшРНК» (короткая шпилечная РНК) означает молекулу РНК, содержащую антисмысловую область, петлевой фрагмент и смысловую область, при этом смысловая область имеет комплементарные нуклеотиды, которые спариваются с нуклеотидами антисмысловой области, образуя дуплексный стебель.
После посттранскрипционного процессинга короткая шпилечная РНК превращается в короткую интерферирующую РНК в процессе расщепления, катализируемого ферментом дайсер, который является представителем семейства РНКаз III.
Используемый в настоящем документе термин «РНКи» (РНК-интерференция) означает механизм посттранскрипционного сайленсинга, запускаемый короткими двухцепочечными молекулами РНК, которые подавляют экспрессию генов с гомологией последовательности.
Используемый в настоящем документе термин «измененный в сравнении с контролем» образец, или субъект, относится к образцу, или субъекту, имеющему уровень какого-либо определяемого аналитического или диагностического, или терапевтического показателя, который статистически достоверно отличается от уровня, характерного для нормального, не подвергнутого воздействию или контрольного образца, или субъекта. Контрольные образцы включают, например, клетки в культуре, одно или более лабораторных экспериментальных животных, или одного или более субъектов-людей. Способы выбора и тестирования контрольных образцов находятся в пределах компетенции специалистов в данной области. Аналитическое вещество может быть природным веществом, которое характерным образом экспрессируется или продуцируется клеткой или организмом (например, антитела, патогенные пептиды или частицы, и тому подобное), или веществом, продуцируемым репортерным конструктом (например, β-галактозидаза или люцифераза). Количество и степень изменений могут варьироваться в зависимости от используемого метода обнаружения. Определение статистической значимости находится в пределах компетенции специалистов в данной области.
Используемые в настоящем документе термины «совместное введение» или «одновременное введение», и тому подобные, означают введение двух или более средств (например, противомикробного средства и противовирусного средства), соединений, препаратов, или тому подобного, в одно, или примерно в одно, и то же время. Порядок, или последовательность, введения разных средств по изобретению, например, антибиотиков, противовирусных средств, противогрибковых средств или иммунотерапевтических средств, может варьироваться и не имеет конкретных ограничений. «Совместное введение» также может относиться к ситуации, когда два или более средств вводят в разные области тела или разными способами доставки, например, когда первое средство вводят интраназально, а второе средство вводят системно, или наоборот. «Совместное введение» также может относиться к ситуации, когда два или более средств вводят одинаковыми способами доставки, например, когда первое средство вводят интраназально и второе средство вводят интраназально.
Используемые в настоящем документе термины «включает», «включающий», «содержащий», «имеющий» и тому подобные являются открытыми в соответствии с патентным законодательством США и могут означать «включает», «включая» и тому подобное. Аналогично, термины «состоящий по существу из» или «по существу состоит» имеют значение в соответствии с патентным законодательством США и являются открытыми, допускающими присутствие большего количества компонентов, чем те, которые перечислены, при условии, что базовые, или новые, характеристики перечисленных компонентов не изменяются вследствие присутствия большего количества компонентов, чем те, которые перечислены, за исключением вариантов осуществления предшествующего уровня техники.
Используемый в настоящем документе термин «создание контакта с клеткой» означает доставку средства к клетке (например, клетке оболочки носовой полости) таким образом, что средство может взаимодействовать с клеткой (например, клеткой оболочки носовой полости, подлежащей лечению) и/или быть поглощено клеткой и оказывать свое действие на клетку. Средство (например, противомикробное или противовирусное средство) может быть доставлено к клетке напрямую (например, путем добавления средства в гелевый или аэрозольный препарат для назальной доставки. Специалист в данной области понимает, что введение терапевтического средства субъекту включает создание контакта терапевтического средства с клеткой или тканью субъекта.
Используемый в настоящем документе термин «связанные» применительно к двум или более средствам, «связанным» вместе, означает наличие ковалентной или иной стабильной связи между двумя или более средствами. Например, терапевтическое средство может быть связано с противомикробным средством ковалентной связью, через ковалентно связанный фрагмент линкера, либо не ковалентно за счет ионных взаимодействий или водородных связей. Одно или более средств, которые связаны вместе, по существу, сохраняют свои независимые функции и характеристики. Например, терапевтическое средство, связанное с другим средством, может сохранять такую же активность, как если бы оно оставалось свободным.
Термины «цикл» или «лекарственный цикл» означают введение повторных доз в течение определенного периода времени, который может находиться в диапазоне от нескольких минут до нескольких часов, дней, недель или даже лет.
Термин «цитокин» означает гормон, который действует локально и который модулирует иммунный ответ индивидуума.
Используемые в настоящем документе термины «обнаружение», «детекция», и тому подобные, должны включать анализ, проводимый для определения одной или более характеристик образца, например, определения присутствия, отсутствия или количества подлежащего обнаружению аналита. Например, обнаружение может включать идентификацию конкретного аналита в образце или активность средства в образце. Обнаружение может включать определение присутствия нуклеиновой кислоты или белка (например, антитела, цитокина и тому подобного) методами ПЦР, иммуноферментного анализа (например, ELISA, ELLA и так далее), микроскопии, провокационной пробы с патогеном, и тому подобными методами. Количество или активность аналита, обнаруживаемого в образце, могут быть нулевыми или находиться ниже уровня чувствительности анализа или способа.
Термин «заболевание» означает любое состояние или нарушение, которое приводит к повреждению или нарушению нормальной функции клетки, ткани или органа. Иллюстративным заболеванием является респираторная инфекция.
Используемые в настоящем документе термины «эффективное количество», «терапевтически эффективное количество» или «фармацевтически эффективное количество» означают количество средства или соединения, которое является достаточным для предотвращения или лечения заболевания, например, рака. В некоторых вариантах осуществления результатом является уменьшение и/или ослабление признаков, симптомов или причин заболевания, либо любое другое желательное изменение биологической системы. Например, «эффективное количество» терапевтического средства может представлять собой количество композиции, содержащей соединение, раскрытое в настоящем документе, которое необходимо для обеспечения клинически значимого ослабления заболевания/нарушения (например, респираторной инфекции). «Эффективное количество» или «терапевтически эффективное количество» средства или сочетания средств по изобретению также может представлять собой количество, или дозу, которое эффективно для значительного ослабления или устранения инфекции, либо предотвращения ее возникновения. Соответствующее «эффективное» количество в каждом отдельном случае определяют с использованием любого подходящего метода (например, в исследовании с эскалацией дозы), и оно будет зависеть от решения практикующего врача. Однако подходящие диапазоны доз может с легкостью определять специалист в данной области.
Для обеспечения эффективной дозы может потребоваться более одной дозы. Понятно, что эффективная доза для одной популяции может быть, или не быть, достаточной для всех популяций. Таким образом, применительно к введению терапевтического средства, терапевтическое средство может быть «эффективным против» заболевания или состояния, когда его введение соответствующим клиническим образом приводит к полезному эффекту у по меньшей мере статистически значимой группы субъектов, такому как предотвращение начала заболевания, ослабление симптомов, исцеление, уменьшение признаков или симптомов заболевания, продление жизни, повышение качества жизни, либо другому эффекту, который врачи, знакомые с лечением конкретного типа заболевания или состояния, обычно считают положительным.
«Увеличение» означает изменение в большую сторону на по меньшей мере 10%, 25%, 50%, 75%, 100% или любое промежуточное значение.
Используемый в настоящем документе термин «иммуноферментный анализ» означает метод обнаружения, основанный на специфическом связывании по меньшей мере одного антитела с антигеном, например, ELISA, ELLA, RIA, вестерн-блоттинг, и тому подобное.
Используемые в настоящем документе термины «иммуноген» «иммуногенный», и тому подобные, относятся к веществам, которые способны вызывать иммунный ответ, например, ответ в виде выработки антител или клеточный иммунный ответ, у по меньшей мере одного организма.
«Иммуногенная композиция» означает композицию, содержащую молекулу, способную индуцировать или модулировать иммунный ответ у субъекта. Такой иммунный ответ может представлять собой профилактический или терапевтический иммунный ответ.
Используемый в настоящем документе термин «иммунотерапевтическое средство» означает любое средство, соединение или биологическое средство, которое способно модулировать функцию иммунной системы хозяина. Например, иммунотерапевтическое средство способно вызывать стимуляцию иммунной системы для борьбы с респираторной инфекцией.
Используемый в настоящем документе термин «индукция иммунитета» относится к любому иммунному ответу, развивающемуся против антигена. В вариантах осуществления иммунитет опосредован антителами против инфекционного агента, вырабатываемыми позвоночным (например, человеком), что позволяет предотвращать или ослаблять инфекцию, или уменьшать по меньшей мере один ее симптом. Иммуногенные композиции по изобретению могут стимулировать продуцирование антител, которые, например, нейтрализуют присутствующие в воздухе патогены/инфекционные агенты, препятствуют проникновению инфекционных агентов в клетки, блокируют репликацию инфекционных агентов и/или защищают клетки-хозяева от инфекции и гибели. Термин также может относиться к возникающему у позвоночного (например, человека) иммунному ответу против инфекционного агента, опосредованному T-лимфоцитами и/или другими белыми клетками крови, который позволяет предотвращать или ослаблять инфекцию, или уменьшать по меньшей мере один ее симптом.
Используемый в настоящем документе термин «выделенные» относится к любой композиции, молекуле или смеси, которые были подвергнуты лабораторной процедуре очистки, включая, но без ограничения, экстрагирование, центрифугирование, хроматографическое разделение (то есть, например, методом тонкослойной хроматографии или высокоэффективной жидкостной хроматографии). Как правило, такая процедура очистки обеспечивает получение выделенной композиции, молекулы или смеси на основании физических, химических свойств или электрического потенциала. В зависимости от выбора метода выделенная композиция, молекула или смесь может содержать другие композиции, соединения или смеси, имеющие аналогичные химические свойства. Например, выделенная композиция, молекула или смесь может содержать 1-20%, 1-10% или 1-5% композиций или смесей, имеющих аналогичные химические свойства.
Используемые в настоящем документе термины «локальное» или «локально», например, локальное введение или совместное введение одного или более терапевтических средств, означают доставку терапевтического средства в участок тела (например, оболочку носовой полости), который расположен вблизи или рядом с зоной инфекции, прилегает или находится в непосредственной близости от зоны инфекции, на периметре зоны контакта или непосредственно в контакте с инфекцией, либо в, или внутри, инфицированной ткани. Локальное введение, как правило, исключает системные пути введения.
Используемый в настоящем документе термин «нуклеиновая кислота», например, нуклеиновая кислота для доставки в клетку, имеет свое обычное в данной области значение, а именно, полинуклеотид или олигонуклеотид, представляющий собой цепь из по меньшей мере двух соединений, включающих сочетание основание-сахар-фосфат. Нуклеотиды являются мономерными единицами полимеров нуклеиновых кислот. Термин включает дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК) в форме олигонуклеотидной матричной РНК, антисмысловой, плазмидной ДНК, фрагментов плазмидной ДНК, генетического материала, полученного из вируса, и тому подобного. Полинуклеотиды включают нуклеиновые кислоты из по меньшей мере двух мономеров. Антисмысловые полинуклеотиды представляют собой нуклеиновые кислоты, которые препятствуют функции ДНК или РНК. Молекула киРНК или кшРНК представляет собой двухцепочечную РНК, которая ингибирует, или нарушает, активность или трансляцию, например, за счет стимулирования нарушения модифицирующего сплайсинга или процессинга клеточной нуклеиновой кислоты, например, мРНК, микроРНК, и тому подобного, которые являются ее мишенью. Описанные в настоящем документе киРНК и кшРНК включают любую молекулу двухцепочечной РНК, которая способна модулировать стабильность, трансляцию или сплайсинг РНК, с которой гибридизуется по меньшей мере одна цепь двухцепочечной нуклеиновой кислоты. РНК хорошо известны в данной области, смотри, например, патентные публикации WO/2002/044321, WO/2003/099298, US 20050277610, US 20050244858; и патенты США №№ 7297786, 7560438 и 7056704, содержание всех из которых включено в настоящий документ посредством ссылки. Описанная в настоящем документе нуклеиновая кислота должна включать те, которые содержат неприродные (не существующие в природе) нуклеотиды, например, производное природных нуклеотидов, такое как фосфотионаты, или пептидо-нуклеиновые кислоты (такие, как те, которые описаны в патентах и патентных заявках, указанных выше). Нуклеиновую кислоту можно доставлять в клетку для создания изменения в клетке, которое является терапевтическим или профилактическим. Нуклеиновая кислота может экспрессировать белок или полипептид, например, белок, который отсутствует или является нефункциональным в клетке или у субъекта. Нуклеиновая кислота может быть одно- или двухцепочечной, может быть смысловой или антисмысловой, и может быть доставлена в клетку в виде «голой» ДНК, в сочетании со средствами, стимулирующими поглощение нуклеиновой кислоты клеткой (например, реагентами для трансфекции), в контексте вирусного вектора, и тому подобное. Нуклеиновая кислота может быть нацелена на нуклеиновую кислоту, которая является эндогенной для клетки (мРНК или микроРНК), или на гетерологичную нуклеиновую кислоту (например, нуклеиновую кислоту из патогена, например, вирусный ген). Доставка нуклеиновой кислоты означает перенос нуклеиновой кислоты извне через наружную клеточную мембрану внутрь клетки субъекта.
В настоящем документе «получение» означает производство, приобретение, синтезирование, выделение, очистку или иной способ, приводящий к обладанию.
Используемый в настоящем документе термин «фармацевтически приемлемый» относится к материалу (например, носителю или разбавителю), который не сказывается отрицательно на биологической активности или свойствах соединений, описанных в настоящем документе, и является относительно нетоксичным (то есть, при введении индивидууму материал не вызывает нежелательные биологические эффекты или не взаимодействует неблагоприятным образом с каким-либо из компонентов композиции, в которой он содержится).
Выражение «фармацевтически приемлемый носитель, эксципиент или разбавитель» является признанным в данной области и включает фармацевтически приемлемый материал, композицию или растворитель, подходящие для введения соединений по настоящему изобретению млекопитающим. Используемый в настоящем документе термин «фармацевтически приемлемый» означает, что материал одобрен регламентирующим органом федерального правительства или правительства штата, либо упомянут в фармакопее США, Европейской фармакопее или других общепризнанных фармакопеях для использования применительно к млекопитающим, например, людям.
Используемый в настоящем документе термин «фармацевтически эффективный режим» означает систематический план для введения одного или более терапевтических средств, который включает такие аспекты, как вид терапевтического средства, концентрации терапевтического средства, а также любые их изменения, произведенные во время курса введения терапевтического средства, которое при введении является эффективным для лечения и/или предотвращения инфекции. Такие соображения зависят от решения практикующего врача и могут быть с легкостью определены специалистом в данной области.
Используемые в настоящем документе термины «полипептид» или «пептид» означают две или более независимо выбранных природных или неприродных аминокислот, связанных ковалентной связью (например, пептидной связью). Пептид может включать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, или более, природных или неприродных аминокислот, связанных пептидными связями. Полипептиды, описанные в настоящем документе, включают полноразмерные белки (например, полностью процессированные белки), а также более короткие аминокислотные последовательности (например, фрагменты природных белков или синтетические полипептидные фрагменты).
Представленные в настоящем документе диапазоны следует понимать, как сокращение для всех значений в пределах диапазона, включая границы диапазона. Например, диапазон от 1 до 50 следует понимать, как включающий любое число, сочетание чисел или поддиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50, а также все промежуточные десятичные значения между вышеуказанными целыми числами, такие как, например, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8 и 1,9. Что касается поддиапазонов, специально предусмотрены «вложенные поддиапазоны», которые простираются от любой конечной точки диапазона. Например, вложенный поддиапазон иллюстративного диапазона от 1 до 50 может включать 1-10, 1-20, 1-30 и 1-40 в одном направлении, или 50-40, 50-30, 50-20 и 50-10 в другом направлении.
«Уменьшение» означает изменение в меньшую сторону на по меньшей мере 10%, 25%, 50%, 75%, 100% или любое промежуточное значение.
«Эталон» означает стандартное или контрольное состояние.
Используемый в настоящем документе термин «режим» относится к различным параметрам, которые определяют, каким образом лекарственное средство или средство вводят, включая уровень доз, время введения и итерации, а также соотношение между разными лекарственными средствами или средствами. Термин «фармацевтически эффективный режим» означает конкретный режим, который обеспечивает достижение желательного терапевтического результата или эффекта. Термин «итерация» означает общую концепцию повторяющихся введений одного или более средств. Например, сочетание лекарственного средства X и лекарственного средства Y может быть доставлено (введено совместно в одно, или примерно в одно, и то же время и в любом порядке) пациенту в первый день в дозе Z. Затем лекарственные средства X и Y могут быть введены (введены совместно в одно, или примерно в одно, и то же время и в любом порядке) вновь в дозе Z, или другой дозе, во второй день. Интервал между первым и вторым днями может составлять 1 день или до нескольких дней, или неделю, или несколько недель, или несколько месяцев. Итеративные введения также могут происходить в один и тот же день, с интервалом в определенное количество минут (например, 10 минут, 20 минут, 30 минут или более) или часов (например, 1 час, 2 часа, 4 часа, 6 часов, 12 часов). Эффективный режим введения доз может определять специалист в данной области, например, назначающий лечение врач, с использованием стандартной практики.
Используемый в настоящем документе термин «образец» означает биологический материал, выделенный из его окружения (например, кровь или ткань от животного, клетки или кондиционированная среда от культуры ткани). В вариантах осуществления образец предположительно содержит, или известно, что содержит, аналит, например, интересующий инфекционный агент или белок (например, антитело, цитокин и тому подобное). Образец также может представлять собой частично очищенную фракцию из ткани или жидкости тела. Эталонный образец может представлять собой «нормальный» образец от донора, не имеющего заболевание или состояние, либо образец из нормальной ткани субъекта, имеющего заболевание или состояние, либо образец от не подвергнутого воздействию субъекта (например, субъекта, не получавшего вакцину). Эталонный образец также может быть получен «в нулевой момент времени» до создания контакта клетки, или субъекта, со средством, или до проведения терапевтического вмешательства, подлежащего тестированию.
Используемый в настоящем документе термин «избирательно» означает тенденцию к присутствию с более высокой частотой в одной популяции, чем в другой популяции.
Термин «специфическое связывание» означает узнавание и связывание мишени (например, полипептида, клетки и тому подобного), при этом практически полное отсутствие узнавания и/или связывания других молекул в образце, например, биологическом образце.
Используемый в настоящем документе термин «субъект» означает любой организм, подверженный респираторной инфекции. Такие организмы включают, но не ограничиваются ими, человека, собаку, кошку, лошадь, корову, овцу, козу, мышь, крысу, морскую свинку, обезьяну, примата, не являющегося человеком примата, птицу, рептилию и так далее.
Субъект «страдающий от, или предположительно страдающий от» конкретного заболевания, состояния или синдрома (например, респираторной инфекции) имеет достаточное число факторов риска или проявляет достаточное количество, или сочетание, признаков или симптомов заболевания, состояния или синдрома, так что компетентный специалист может диагностировать или подозревать, что субъект страдает от заболевания, состояния или синдрома. Способы определения субъектов, страдающих от, или предположительно страдающих от, респираторной инфекции, находятся в пределах компетенции специалистов в данной области. Субъекты, страдающие от, и предположительно страдающие от, конкретного заболевания, состояния или синдрома, не обязательно являются двумя разными группами.
Используемые в настоящем документе термины «подверженный» или «склонный», или «предрасположенный» к конкретному заболеванию или состоянию, и тому подобные, относятся к индивидууму, у которого, с учетом генетических, экологических факторов, состояния здоровья и/или других факторов риска, с большей вероятностью разовьется заболевание или состояние, чем у популяции в целом. Вероятность развития заболевания может возрастать на примерно 10%, 20%, 50%, 100%, 150%, 200% или более.
Используемые в настоящем документе термины «лечение», «терапия», и тому подобные, означают достижение желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим, что означает полное или частичное предотвращение заболевания или его симптома, и/или может быть терапевтическим, что означает частичное или полное избавление от заболевания и/или неблагоприятных эффектов, связанных с заболеванием.
Используемый в настоящем документе термин «гликолипиды» означает любую молекулу с по меньшей мере одной углеводной цепью, связанной с церамидом, цепью жирной кислоты или любым другим липидом. Альтернативно, гликолипид может быть назван гликосфинголипидом.
В настоящем документе и в прилагаемой формуле изобретения форма единственного числа существительных включает соответствующую форму множественного числа, если из контекста явно не следует иное. Таким образом, например, ссылка на «ген» является ссылкой на один или более генов и включает их эквиваленты, известные специалистам в данной области, и так далее.
Если специально не указано иначе, или это не следует из контекста, используемый в настоящем документе термин «или» следует понимать, как включающий.
Если специально не указано иначе, или это не следует из контекста, используемый в настоящем документе термин «примерно» следует понимать, как значение, находящееся в диапазоне допустимой погрешности, признанном в данной области, например, в пределах 2 стандартных отклонений от среднего значения. «Примерно» следует понимать, как значение, находящееся в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01% от указанного значения. Если иное явно не следует из контекста, все числовые значения, приведенные в настоящем документе, могут быть модифицированы с помощью термина «примерно».
Если нет иных указаний, все ссылки на концентрации включают указанные количества, выраженные в виде отношения по массе, отношения массы к объему или отношения по объему. Любое упоминание процентной концентрации следует понимать, как отношение масс/масс, масс/об или об/об. Хотя некоторые варианты осуществления могут быть описаны с указанием концентрации в виде масс/масс или масс/об, следует понимать, что для таких композиций указан тот же % на основании масс/масс или масс/об. Плотность любых форм по изобретению может составлять от 0,8 г/мл до 1,2 г/мл, например, от 0,9 г/мл до 1,1 г/мл или от 0,95 г/мл до 1,05 г/мл.
В настоящем документе перечисление списка химических групп в любом определении переменной включает определения данной переменной в виде любой одной группы или сочетания перечисленных групп. В настоящем документе перечисление вариантов осуществления для переменной или аспекта включает данный вариант осуществления в виде отдельного варианта осуществления или в сочетании с любыми другими вариантами осуществления или их частями.
Другие определения станут понятны в контексте всего данного описания.
Любые терапевтические средства, композиции или способы, предложенные в настоящем документе, могут быть скомбинированы с одним или более из любых других терапевтических средств, композиций и способов, предложенных в настоящем документе.
Настоящее изобретение относится к композициям и способам для предотвращения и лечения респираторных инфекций. Настоящее изобретение относится к способам и композициям для усиления фильтрующей способности оболочек носовой полости и защиты от присутствующих в воздухе патогенов за счет улучшения состояния оболочек носовой полости и усиления фильтрующей способности слизистой оболочки носовой полости. В частности, изобретение относится к противомикробным, противовирусным и противогрибковым композициям для предотвращения и лечения респираторных инфекций, вызываемых бактериями, вирусами и грибками, включая вирусы гриппа и риновирусы (например, вирусы, которые вызывают грипп и обычную простуду, соответственно). Настоящее изобретение основано, по меньшей мере частично, на том открытии, что композиции, содержащие противомикробные, противовирусные и/или противогрибковые активные компоненты, могут быть использованы для улучшения состояния и усиления фильтрующей способности оболочек носовой полости, а также для защиты от присутствующих в воздухе патогенов. При этом они также должны поддерживать физиологически здоровое состояние оболочек, например, за счет поддержания характерного для здорового состояния Ph и осмолярности, а также стимуляции размножения здоровой микрофлоры. В конкретном иллюстративном варианте осуществления настоящее изобретение относится к противомикробной и противогрибковой фильтрующей композиции, сформулированной для топического нанесения на проксимальную часть ноздрей или внутреннюю переднюю оболочку носовой полости, где она также может покрывать носовые волоски и усиливать фильтрующую способность носа. Предпочтительно, настоящее изобретение, описанное в настоящем документе, относится к топически наносимой фильтрующей композиции для применения в носовой и/или ротовой полости, не оказывающей неблагоприятного воздействия на химические свойства оболочек дыхательных путей или слизистую оболочку (и усиливающей ее естественную фильтрующую способность) и специфически направленной на защиту от нескольких болезнетворных микроорганизмов.
Настоящее изобретение также относится к способам усиления естественной фильтрующей способности оболочек дыхательных путей и уменьшения количества микроорганизмов, аллергенов и пахучих веществ, проникающих в тело через нос или размножающихся на оболочках дыхательных путей. В некоторых вариантах осуществления данный способ включает нанесение топического или вдыхаемого, или проглатываемого раствора противомикробной, противовирусной, противогрибковой и/или нейтрализующей запах композиции в ротовую полость, горло, отверстия ноздрей, назальный эпителий в ноздрях и/или носовые волоски. Противомикробный, противовирусный и противогрибковый раствор может иметь форму геля, лосьона, пастилки, пара или аэрозоля и может содержать сочетание активных ингредиентов, предназначенных для поддержания естественной фильтрующей способности носа, в базовой среде, которая способствует хорошей переносимости активных ингредиентов, в их активной форме, в то же время предотвращая проявление их нежелательных эффектов. Композиции по настоящему изобретению также могут имитировать химические свойства естественной здоровой слизистой оболочки или слюны, такие как, например, pH и осмолярность. Ингредиенты могут быть сбалансированы для создания синергетического эффекта, более сильного, чем эффект любого из ингредиентов в отдельности, и также могут быть сбалансированы для поддержания характерных для здорового состояния pH и осмолярности в оболочках дыхательных путей, поскольку, как было показано, эти параметры влияют на вероятность возникновения заболевания и аллергической реакции. Активные ингредиенты могут включать, но без ограничения, рекомбинантный, природный или очищенный лактоферрин, лизоцим, ICAM, катионные пептиды, гликозилированные пептиды, сиаловую кислоту, кверцетин или другие биофлавоноиды, в дополнение к любому растительному экстракту, обладающему противомикробными свойствами (включая, но без ограничения, экстракты фруктовой кожуры и каррагинаны), микрочастицам серебра, меди или цинка, а также лауриновой кислоте, которая обладает доказанными противомикробными свойствами. Различные варианты осуществления также могут включать одно или более из следующих ингредиентов: бикарбонат натрия, активированный уголь, масло какао, масло ши, пчелиный воск, растительные масла, глицерин, мед, альгинаты или растительный клей и консервант, такой как витамин C, витамин E или розмариновая кислота. Разные варианты осуществления могут включать ингредиенты, которые при смешивании с вышеуказанными активными ингредиентами образуют препарат, который хорошо переносится при нанесении в отверстия ноздрей, на назальный эпителий в ноздрях или носовые волоски, и который позволяет активным ингредиентам удерживаться в областях нанесения в течение периода времени, достаточного для предотвращения инфекции или аллергии, до повторного нанесения.
Респираторная функция
В настоящее время респираторные инфекции являются одним из наиболее распространенных видов инфекционных заболеваний во всем мире. Почти ежегодно новые и потенциально смертельные заболевания, такие как ближневосточный респираторный синдром (MERS), а также птичий и свиной грипп, вызывают внимание и беспокойство в мировом сообществе. Постоянно появляются новые и необычные штаммы вируса гриппа, способные за несколько месяцев вызывать эпидемии мирового масштаба. Кроме того, современное состояние технологии производства вакцин и противовирусных препаратов не позволяет своевременно принимать адекватные меры при таких вспышках заболеваний. В лучшем случае, вакцина, специфически направленная на новый вирусный штамм, становится доступной спустя срок от шести месяцев до года, в это время уже может начаться эпидемия.
Ежедневно примерно 12000 литров воздуха, в среднем, фильтруется через нос. В носовых ходах из воздуха отфильтровывается 95% частиц с диаметром более 15 мкм. Они обычно захватываются слизистой оболочкой, а затем проглатываются. Микроорганизмы и аллергены, как правило, имеют размер на несколько порядков меньше этого порога и в процессе эволюции приобрели способность избегать или преодолевать естественную защиту, создаваемую слизистой оболочкой в носовой полости, проникать через оболочки носовой полости и/или проникать в нижние дыхательные пути через рот или горло. При использовании методик, описанных в настоящем документе, укрепление оболочек дыхательных путей и слизистой оболочки с помощью противомикробных и фильтрующих средств может позволить предотвращать значительное количество респираторных инфекций и аллергических реакций легким, простым и удобным путем. Кроме того, многие из нежелательных частиц, попадающих в нос, являются пахучими веществами, которые могут быть неприятными, и которые могут быть отфильтрованы или нейтрализованы с помощью определенных веществ, таких как, но без ограничения, активированный уголь или бикарбонат натрия, суспендированных в носителе, прежде чем они смогут связаться с обонятельными рецепторами.
Настоящее изобретение относится к противомикробным, противовирусным, противогрибковым, нейтрализующим запах топическим препаратам, которые имитируют некоторые химические свойства слизистой оболочки носовой полости, не вредят здоровому состоянию или целостности оболочек носовой полости, не влияют негативно на полезную микрофлору, а также служат в качестве фильтра, предотвращая проникновение присутствующих в воздухе раздражителей и патогенов в оболочки носовой полости и/или их проникновение в нижние дыхательные пути. При этом композиции по настоящему изобретению предотвращают инфекцию дыхательных путей, в то же время предотвращая раздражение и/или аллергические реакции.
Кроме того, композиции по настоящему изобретению могут быть изотоническими для назального эпителия и слизистых оболочек и содержат соединения с укрепляющими здоровье свойствами. Показано, что полезная микрофлора и некоторые свойства оболочки носовой полости, такие как осмолярность и pH, влияют на вероятность развития инфекции. Установлено, что некоторые лекарственные препараты и санитарно-гигиенические условия делают людей более подверженными респираторной инфекции. Например, больные диабетом часто имеют сухие оболочки носовой полости и страдают от грибкового синусита. Также известно, что пероральные контрацептивы, устройства, предупреждающие апноэ сна, и аллергия способствуют тому, что оболочки носовой полости становятся более сухими и более подверженными инфекции.
Композиции по настоящему изобретению могут содержать конкретные активные ингредиенты с доказанными противомикробными свойствами, включая, но без ограничения, ICAM-1, ингибиторы ICAM-1, сиаловую кислоту, ингибитор нейраминидазы, лизоцим, лактоферрин, экстракты или производные масел цитрусовых, растительный клей, пептиды, гликопептиды, аминокислоты, противомикробные масла, противомикробные растительные экстракты или дефензины. Композиция может содержать нейтрализующие запахи соединения, такие как, но без ограничения, активированный уголь или бикарбонат натрия. Композиция может обладать адгезивными свойствами и быть специально сформулирована для удерживания активных ингредиентов и противомикробных/противовирусных средств на поверхности назального эпителия в течение длительного периода времени. Для этого композиции по настоящему изобретению могут содержать вещества с низкой летучестью, или окклюзивные средства, такие как, например, полиолы, масло ши или другие растительные масла, кокосовое масло, пчелиный воск, а также биоадгезивные вещества, такие как растительные клейкие вещества или альгинаты.
Назальные препараты, описанные в настоящем документе, и их активные ингредиенты должны хорошо переноситься, благоприятно влиять на функцию ресничек, обладать хорошей способностью к распылению, высокой степенью клейкости и способствовать сохранению химических свойств слизистой оболочки. В некоторых вариантах осуществления ингредиенты подобраны для создания синергетических эффектов.
В соответствии со способами по настоящему изобретению, один или более из активных ингредиентов могут быть специфически нацелены на нежелательные микроорганизмы и вирусы. Многие присутствующие в воздухе патогены, такие как риновирусы и вирусы гриппа, получают доступ в клетки назального эпителия, слизистую оболочку или клетки нижних дыхательных путей через специфические мишени на клеточной поверхности. Десятки лет исследований позволили идентифицировать ICAM-1 (молекулу межклеточной адгезии 1) как одну такую мишень для большинства риновирусов и другую для вируса гриппа (Abraham and Colonno 1984). ICAM-1 представляет собой молекулу межклеточной адгезии, экспрессируемую на клеточной поверхности клеток назального эпителия, а также клеток нижних дыхательных путей. N-концевой домен ICAM-1 узнается рецепторами на некоторых риновирусных капсидах. После связывания ICAM-1 вирус сбрасывает свой капсид и переносится в клетку, где он инициирует инфекцию и воспалительный ответ у хозяина. Вирусы гриппа обладают аналогичным механизмом инфицирования: у человека, гемагглютинин (HA) на вирусной поверхности связывает сиаловую кислоту, связанную с галактозой (например, альфа-2,6 связью (6'-сиалиллактоза) или альфа-2,3 связью (3'-сиалиллактоза)), на мембране эритроцитов и клеток верхних дыхательных путей хозяина.
В документах предшествующего уровня техники, например, патенте США № 8211448, патенте США № 8940339 и патенте США № 8211448, раскрыты способы захвата присутствующих в воздухе частиц при помощи синтетических полимеров или соединений. В отличие от этих способов предшествующего уровня техники, настоящее изобретение приводит к тому, что присутствующие в воздухе частицы становятся инертными и повышается способность самих оболочек носовой полости элиминировать вызывающие заболевание или аллергию микроорганизмы и другие нежелательные частицы. Настоящее изобретение также отличается от предшествующего уровня техники использованием более одного активного ингредиента, так что способы по настоящему изобретению могут обеспечивать защиту от более, чем одного, патогена или раздражителя в одно и то же время и более эффективным образом. В этом заключается отличие от способов предшествующего уровня техники, которые были направлены против только одного типа патогенов и лишь со слабой или умеренной эффективностью (например, патент США № 7132395, патент США № 6514936, патент США № 6051231, патент США № 6649592, Turner et al. JAMA 281 (19), 1797-1804. (1999)). Это является важным, поскольку конкретный вид вызывающего заболевание или аллергию микроорганизма часто неизвестен в момент заражения субъекта. Задача настоящего изобретения не заключается в доставке лекарственных средств к оболочкам носовой полости или в исполнении роли биоадгезива, как описано в некоторых документах предшествующего уровня техники (например, патент США № 6391452, патентная публикация США № 2001/0053359, патент США № 8679484, патент США № 645626, патент США № 7087245). Настоящее изобретение также отличается от предшествующего уровня техники тем, что создается защитный слой с универсальными противомикробными свойствами (например, патентная публикация США № 2007/0135377, патент США № 7166435, патент США № 8658775, патент США № 8658775, патент США № 7083814, патент США № 7807656, патент США № 9045855, патент США № 6649592, патент США № 9029351), поскольку в способах, раскрытых в настоящем документе, используют специфически направленные противомикробные средства, которые действуют синергетически с другими ингредиентами, поддерживая определенные физиологические и химические свойства оболочек носовой полости или слизистой оболочки, такие как, например, их pH и осмолярность. Аналогично, в соответствии с настоящим изобретением на оболочки носовой полости не наносят неспецифические, не дискриминирующие противомикробные средства, которые могут содержать спирт, пероксид или другие раздражающие ингредиенты, изменяющие pH или осмолярность оболочек носовой полости, или отрицательно влиять на микрофлору, в отличие от способов предшествующего уровня техники (например, патент США № 8999406, патент США № 8778415, патент США № 7638147).
Противомикробные композиции
Противомикробные композиции по настоящему изобретению могут содержать одно или более противомикробных и противовирусных активных ингредиентов в базовой смеси, содержащей одно или более из воды, полиолов, смягчающих средств, окклюзивных средств, увлажняющих средств, эмульгаторов, консервантов, загустителей и суспендирующих средств, регуляторов pH, изотонических средств и эфирных масел, за счет чего они могут оставаться на участке, или рядом с участком, нанесения в течение по меньшей мере 30 минут (например, 30-60 минут, 1-2 часов, 2-4 часов, 4-8 часов, 8-12 часов, 12-24 часов, 1-2 дней, 2-7 дней, недели или более) до того, как будут абсорбированы, и в то же время они имеют pH и осмолярность, аналогичные таковым у слизистой оболочки, при этом не закупоривая поры. Время, необходимое для абсорбции противомикробной композиции, может быть определено при помощи сахаринового теста или других аналогичных тестов. В одном варианте осуществления активный ингредиент может представлять собой растворимую ICAM-1, содержащую только внеклеточный домен, или другой домен ICAM-1, рекомбинантно экспрессированный в бактериях. В других вариантах осуществления активный ингредиент может представлять собой растворимую ICAM-1, рекомбинантно экспрессированную в Chlamydomonas reinhardtii. В других вариантах осуществления активный ингредиент может представлять собой растворимую ICAM-1, рекомбинантно экспрессированную в других видах водорослей, или другой живой системе.
В другом варианте осуществления активный ингредиент представляет собой сиаловую кислоту (например, нейраминовую кислоту, связанную с молекулой сахара в одной из нескольких возможных конформаций). Сиаловая кислота может быть очищена из природного источника или получена путем ферментации и с использованием рекомбинантных методов. В другом варианте осуществления активный ингредиент может представлять собой ингибитор нейраминидазы, такой как кверцетин, который представляет собой биофлаваноид, выделенный из кожуры цитрусовых или других природных источников. В другом варианте осуществления активный ингредиент представляет собой лактоферрин, рекомбинантно экспрессированный в бактериях. В других вариантах осуществления активный ингредиент представляет собой лактоферрин, рекомбинантно экспрессированный в Chlamydomonas reinhardti или другой подходящей экспрессионной системе, например, водорослях, дрожжах или бактериях, либо очищенный из природного источника. В другом варианте осуществления активный ингредиент может представлять собой лизоцим, рекомбинантно экспрессированный в Chlamydomonas reinhardti или другой подходящей экспрессионной системе, например, водорослях, либо очищенный из природного источника. Как описано в настоящем документе, в композиции по изобретению могут быть использованы дополнительные противомикробные активные ингредиенты, либо отдельно, либо в сочетании.
В другом варианте осуществления активный ингредиент представляет собой природное или рекомбинантное антитело, такое как IgA, IgG или IgM, либо любой из их доменов в одной из нескольких возможных конформаций. Антитело может быть очищено из природного источника или получено рекомбинантными методами в любой подходящей и экономически целесообразной экспрессионной системе, такой как Chlamydomonas reinhardti или другие водоросли, бактерии, дрожжи или клетки млекопитающих, либо оно может быть очищено из природного источника. В другом варианте осуществления активный ингредиент может представлять собой ингибитор нейраминидазы, такой как кверцетин, который представляет собой биофлаваноид, выделенный из кожуры цитрусовых или других природных источников.
Водоросли или другие растения являются предпочтительными экспрессионными системами, поскольку генетически модифицированные водоросли экономически гораздо более выгодно выращивать и собирать, чем клетки млекопитающих или бактерии. Водоросли выращивают для использования их в качестве пищевых добавок и их также используют для биоинженерного производства некоторых представляющих коммерческий интерес питательных соединений, таких как омега-3 жирные кислоты и каротиноиды (Gimpel JA, Henriquez V, and Mayfield SP. Frontiers in Microbiology 2015). Большинство стратегий метаболической инженерии были направлены на увеличение коммерческого производства этих соединений, а также на использование водорослей в качестве биотоплива. Водоросли могут быть успешно оптимизированы для эффективного продуцирования ряда различных метаболитов, обладающих определенными характеристиками. Экспрессия активных ингредиентов может быть оптимизирована.
Было показано, что трансгенные водоросли поддерживают экспрессию рекомбинантного белка как с хлоропластного, так и с ядерного, геномов (Rasal BA et al., Plant Biotechnology J 2010). Исходно, были использованы только ядерные геномы, однако разработка методов, необходимых для экспрессии рекомбинантных белков в хлоропластном геноме, добавила данной платформе универсальности и создала возможности либо для экспрессии белков, которые не могут быть экспрессированы в ядерном геноме, либо для экспрессии белков с большей эффективностью. Большинство рекомбинантных белков, продуцируемых в настоящее время, продуцируются в основном в бактериях, дрожжах (S. cervisiae) или культурах клеток млекопитающих. Другие системы, разрабатываемые для крупномасштабного производства, включают дрожжи P. pastoris, клетки насекомых, а также других животных и растений. Можно использовать любую подходящую растительную или животную экспрессионную систему, но в первую очередь следует изучать и искать те, которые, вероятно, будут наиболее экономичными, например, такие рекомбинантные экспрессионные системы, для которых не потребуется высокая степень очистки. В этом случае варианты осуществления можно будет продавать без рецепта, и не будет необходимости в клинических испытаниях. Если потребуется, можно будет использовать другие рекомбинантные экспрессионные системы, которые могут нуждаться в большей степени очистки.
Как показано в Таблице 1, компоненты композиции могут присутствовать в следующих процентных долях в расчете на массу композиции:
Таблица 1.
(% по массе)
Приведенный в Таблице 1 ингибитор нейраминидазы является необязательным, однако в некоторых вариантах осуществления может быть желательным, в частности, когда композиция предназначена для профилактики или лечения инфекции, вызываемой человеческим вирусом гриппа. Сиаловая кислота может присутствовать в форме свободной сиаловой кислоты, или может представлять собой конъюгат или аддукт сиаловой кислоты с сахаридом, таким как галактоза, лактоза и так далее. Сиаловая кислота может представлять собой любую сиаловую кислоту, например, кислоты в семействе сиаловых кислот, которое включает по меньшей мере 43 производных конъюгата или аддукта девятиуглеродного сахара нейраминовой кислоты. Важно, чтобы сиаловая кислота, в любой форме, была способна связывать вирионы вируса гриппа. Кроме того, лактоферрин, приведенный в Таблице 1, может представлять собой любую форму лактоферрина, включая лактоферрины без хелатированного железа (аполактоферрин), лактоферрины, обогащенные железом (гололактоферрин) или их сочетания. Используемый в настоящем документе термин «ICAM-1» охватывает любую форму ICAM-1, включая, без ограничения, фрагменты внеклеточного домена ICAM-1 и, в частности, растворимую ICAM-1 («рICAM-1»). Следует понимать, что в любую из композиций по изобретению, где требуется ICAM-1, может быть, соответственно, включена растворимая ICAM-1.
Как показано в Таблице 1, ингредиенты могут присутствовать в процентных долях по массе от массы композиции. ICAM-1 (включая растворимую ICAM-1) может присутствовать в количестве от примерно 0,00000001% до 10% по массе от массы композиции. Чаще, ICAM-1 (включая растворимую ICAM-1) может присутствовать в количестве от 0,0000001% до 0,1% по массе от массы композиции. Чаще, ICAM-1 (включая растворимую ICAM-1) может присутствовать в количестве от 0,000001% до 0,01% по массе от массы композиции. ICAM-1 может присутствовать в количестве примерно 0,00000001%, 0,0000001%, 0,000001%, 0,00001%, 0,0001%, 0,001%, 0,01%, 0,05%, 1%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В некоторых вариантах осуществления ICAM-1 может присутствовать в количестве от 0,2% до 1,0% по массе от массы композиции. В некоторых вариантах осуществления ICAM-1 может присутствовать в количестве от примерно 0,000005% до 0,05% по массе от массы композиции. В предпочтительных вариантах осуществления ICAM-1 может присутствовать в количестве от примерно 0,00005% до 0,005% по массе от массы композиции.
Ингибитор нейраминидазы (например, кверцетин и так далее) может присутствовать в количестве от примерно 0,00000001% до 10% по массе от массы композиции. Чаще, ингибитор нейраминидазы может присутствовать в количестве от 0,0000001% до 0,1% по массе от массы композиции. Чаще, ингибитор нейраминидазы может присутствовать в количестве от 0,000001% до 0,01% по массе от массы композиции. Ингибитор нейраминидазы может присутствовать в количестве примерно 0,00000001%, 0,0000001%, 0,000001%, 0,00001%, 0,0001%, 0,001%, 0,01%, 0,05%, 1%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В некоторых вариантах осуществления ингибитор нейраминидазы может присутствовать в количестве от 0,2% до 1,0% по массе от массы композиции. В некоторых вариантах осуществления ингибитор нейраминидазы может присутствовать в количестве от примерно 0,000005% до 0,05% по массе от массы композиции. В предпочтительных вариантах осуществления ингибитор нейраминидазы может присутствовать в количестве от примерно 0,00005% до 0,005% по массе от массы композиции.
Лактоферрин может присутствовать в количестве от 0,0000001% до 10,0% по массе от массы композиции. Лактоферрин может присутствовать в количестве 0,00000025%, 0,0000003%, 0,0000004%, 0,0000005%, 0,0000006%, 0,0000007%, 0,00000075%, 0,0000008%, 0,0000009%, 0,000001%, 0,000002%, 0,000003%, 0,000004%, 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В предпочтительных вариантах осуществления лактоферрин может присутствовать в количестве 0,0000001-1,0% по массе от массы композиции.
Лизоцим может присутствовать в количестве от 0,000001% до 10,0% по массе от массы композиции. Лизоцим может присутствовать в количестве 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В предпочтительных вариантах осуществления лизоцим может присутствовать в количестве 0,000001-1,0% по массе от массы композиции.
Сиаловая кислота может присутствовать в количестве от 0,000000001% до 10,0% по массе от массы композиции. Сиаловая кислота может присутствовать в количестве 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В предпочтительных вариантах осуществления сиаловая кислота может присутствовать в количестве 0,000001-1,0% по массе от массы композиции. Сиаловая кислота может быть в форме сиалиллактозы (например, 3'-сиалиллактозы, 6'-сиалиллактозы или их сочетаний).
В другом варианте осуществления формула может включать ингредиенты, приведенные в Таблице 2.
Таблица 2.
Каррагинан может присутствовать в количестве от 0,0000005% до 10,0% по массе от массы композиции. Каррагинан может присутствовать в количестве 0,0000005%, 0,0000006%, 0,0000007%, 0,0000008%, 0,0000009%, 0,000001%, 0,000002%, 0,000003%, 0,000004%, 0,000005%, 0,000006%, 0,000007%, 0,000008%,0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008%, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% по массе от массы композиции. В предпочтительных вариантах осуществления каррагинан может присутствовать в количестве 0,000001-4,0% по массе от массы композиции.
Цинк (например, пероксид цинка) может присутствовать в количестве от 0,0000001 до 5% по массе от массы композиции. Цинк может присутствовать в количестве 0,01%, 0,015%, 0,02%, 0,025%, 0,03%, 0,035%, 0,04%, 0,045%, 0,05%, 0,055%, 0,060%, 0,065%, 0,070%, 0,075%, 0,080%, 0,085%, 0,090%, 0,095%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%, 15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0%, 18,5%, 19,0%, 19,5% и 20,0% по массе от массы композиции. В предпочтительных вариантах осуществления пероксид цинка (ZnO2) может присутствовать в количестве от 0,000001% до 5,0% по массе от массы композиции.
Медь может присутствовать в количестве от 0,00000001% до 5% по массе от массы композиции. Медь может присутствовать в количестве 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%, 15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0%, 18,5%, 19,0%, 19,5% и 20,0% по массе от массы композиции. В предпочтительных вариантах осуществления медь может присутствовать в количестве 0,00001-5,0% по массе от массы композиции.
Серебро может присутствовать в количестве от 0,00000001% до 5% по массе от массы композиции. Серебро может присутствовать в количестве 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%, 15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0%, 18,5%, 19,0%, 19,5% и 20,0% по массе от массы композиции. В предпочтительных вариантах осуществления серебро может присутствовать в количестве 0,00001-5,0% по массе от массы композиции.
Композиция также может содержать нейтрализующие запах соединения, такие как активированный уголь или бикарбонат натрия, отдельно или в сочетании. Другие нейтрализующие запах соединения также предусмотрены для включения в композицию.
Как показано в Таблице 3, иллюстративная противомикробная композиция также может содержать следующие дополнительные ингредиенты, отдельно или в сочетании: экстракт алтея, экстракт календулы, экстракт кожуры плодов цитрусовых, мед, экстракты розмарина, экстракт мирры, экстракт бессмертника, экстракт маранты, масло семян маргозы, витамин C, витамин E и экстракт семян грейпфрута. Эти дополнительные ингредиенты могут присутствовать в следующих количествах в расчете на массу композиции. Для использования в противомикробной композиции экстракционные растворители и методы экстракции будут оптимизированы с точки зрения максимальной эффективности и переносимости.
Таблица 3: Дополнительные ингредиенты.
Как показано в Таблице 4, иллюстративная противомикробная композиция также может содержать следующие дополнительные базовые ингредиенты, отдельно или в сочетании: полиол, увлажняющее средство (такое как, но без ограничения, глицерин, алоэ или бутиленгликоль), смягчающее средство (такое как, но без ограничения, масло ши, касторовое масло, кокосовое масло, каприловая кислота, бутилстеарат или триглицерид), окклюзивное средство (такое как, но без ограничения, вазелиновое масло, диметикон, ланолин, масло какао, масло ши, пчелиный воск, растительные масла или карнаубский воск). Добавление и точные концентрации данных ингредиентов можно оптимизировать для создания барьера, который не закупоривает поры, позволяет активным ингредиентам сохранять свои биологически активные конформации, остается на месте в течение по меньшей мере 30 минут, поддерживает осмолярность и pH, аналогичные таковым у естественной слизистой оболочки, хорошо переносится и эффективен при нанесении.
Таблица 4: Дополнительные базовые ингредиенты.
Если нет иных указаний, любой эксципиент или добавку можно включать в количестве, достаточном для выполнения их функции, без повреждения или раздражения тканей дыхательных путей. Если нет иных указаний, все эксципиенты могут присутствовать в количестве от примерно 0,000001% или 0,01% до примерно 1, 5, 10, или 25% по массе от массы композиции. Носитель может представлять собой любой фармацевтически приемлемый разбавитель и может быть твердым при комнатной температуре или жидким при комнатной температуре. Подходящие носители включают воду, спирт (этанол), пропиленгликоль, изопропанол, пропандиол, глицерин, бензиловый спирт, изостеарил изостеарат, каприловый/каприновый триглицерид, олеил олеат, токоферол ацетат, децил кокоат, сквален, спан 40, кококаприлат/капрат, спан 80, токоферол, стеариновую кислоту, олеил эрукат, спан 20, глицерил изостеарат и каприловый/каприновый триглицерид. Носитель может, например, иметь форму водного раствора, эмульсии типа вода-в-масле или эмульсии типа масло-в-воде. Эмульсионный носитель, как правило, будет содержать от 0,0001% до примерно 10% по массе эмульгатора, подходящего для стабилизации эмульсии. В одном варианте осуществления композиция предназначена для перорального применения и может содержать один или более из следующих ингредиентов: глюкозный сироп, соевый лецитин, альгинаты, сукралозу, кукурузный сироп, желатин, эритрит, лецитин, растительные муцины, каррагинан, экстракт корня цикория, мальтит и стевию. Следует отметить, что, как в пероральных, так и в назальных, препаратах эксципиенты не должны препятствовать проявлению биологической активности активных ингредиентов и должны быть совместимы в растворе с активными ингредиентами. Эксципиенты также не должны проникать в эпителий (оболочек дыхательных путей). Соответственно, желательно иметь более высокую растворимость активных ингредиентов в базовой композиции для поддержания их в растворе и предотвращения проникновения активных ингредиентов в эпителий. В назальных препаратах эксципиенты должны обеспечивать поддержание увлажненности слизистой оболочки и пленки из композиции на ней, чтобы активные ингредиенты не осаждались из раствора. В некоторых вариантах осуществления носитель будет содержать воду, а также вторичный растворитель с более низкой летучестью, чем вода, в котором активные ингредиенты также растворимы. В идеале, носитель и эксципиенты выбирают так, чтобы они имели полярность, которая ближе к полярности активных ингредиентов, чем к полярности эпителия. Вторичный растворитель может служить для поддержания активных ингредиентов в растворенном состоянии после испарения воды. В пероральных препаратах потеря влаги менее важна, и может быть желательно выбирать эксципиенты так, чтобы они замедляли растворение композиции в слюне.
Полученные соединения очищают общепринятыми методами для получения соединений, не содержащих примеси. Полученные соединения имеют чистоту >75%, >80%, >85%, >90%, >95%, >96%, >97%, >98%, >99%, >99,5%. Необязательно, предпочтительные соединения имеют чистоту >99%.
Молекула межклеточной адгезии (ICAM-1)
ICAM-1 является представителем иммуноглобулинового суперсемейства молекул адгезии. Она представляет собой встроенный в мембрану белок длиной 505 аминокислот и имеет: i) пять иммуноглобулиноподобных внеклеточных доменов на амино-конце (внеклеточном), ii) гидрофобный трансмембранный домен (454-477); и iii) короткий цитоплазматический домен на карбоксильном конце (478-505). Большинство риновирусов используют ICAM-1, экспрессированную на эпителии оболочек носовой полости, для получения доступа в клетки. Существует три основных типа риновирусов (HRV A, B и C). HRV A и B могут быть дополнительно подразделены на примерно 100 подтипов. 85% HRVA и 100% HRVB используют ICAM-1 для проникновения в клетки. HRV C редко вызывает заметное недомогание. В соответствии со способами по настоящему изобретению, добавление частично или полностью очищенных растворимых форм ICAM-1, либо любого из ее полученных рекомбинантными методами доменов, в композиции по изобретению может позволить сохранять молекулу в стабильной форме, при этом она может конкурентно ингибировать взаимодействие риновирусных частиц с эндогенной ICAM-1 на клеточных мембранах, таким образом, предотвращая первый этап инфицирования.
В некоторых вариантах осуществления противомикробные/противовирусные композиции могут состоять из ингибиторов ICAM-1. Ингибиторы ICAM-1, используемые в противомикробных композициях, включают, но без ограничения, анти-ICAM-1 антитело, цитокин, CD11a, эзрин (EZR), CD18, глицирретиновую кислоту, пирролидиндитиокарбамат, ингибитор активации NFkB, гетероциклический тиазол, липоевую кислоту, эфализумаб, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамид, силибинин, стилбены, (+)-эпигаллокатехина галлат [(+)-EGCG], экстракты Piper sarmentosum, а также их сочетания. В некоторых вариантах осуществления анти-ICAM-1 антитело представляет собой эфализумаб (раптива).
Сиаловая кислота и ингибиторы нейраминидазы
Богатые сиаловой кислотой олигосахариды на клетках верхних дыхательных путей обычно помогают удерживать воду на поверхности и создают отрицательный заряд. Сиаловая кислота является общим названием для N- или O-замещенных производных нейраминовой кислоты, моносахарида с остовом из девяти атомов углерода. Такое же название имеет и наиболее распространенный член этой группы, N-ацетилнейраминовая кислота (Neu5Ac или NANA). Известно, что вирусы гриппа или другие вирусы связывают остатки сиаловой кислоты через гемагглютининовый (HA) рецептор на их поверхности, после чего они начинают реплицироваться. После завершения репликации вирусный фермент, нейраминидаза, расщепляет вирусные частицы, в результате чего они высвобождаются для связывания и инфицирования других клеток. В соответствии со способами по настоящему изобретению, можно добавлять частично или полностью очищенную сиаловую кислоту, такую как, например, N-ацетилнейраминовая кислота (Neu5Ac) или любое другое производное нейраминовой кислоты, либо любой из их полученных рекомбинантными методами доменов, для сохранения молекулы в стабильной форме, в которой она может конкурентно ингибировать взаимодействие частиц вируса гриппа с сиаловой кислотой на клетках дыхательных путей или эритроцитах. Семейство сиаловых кислот включает 43 производных нейраминовой кислоты, имеющей остов из девяти атомов углерода. В природе они, как правило, встречаются в виде компонентов олигосахаридных цепей муцинов, гликопротеинов и гликолипидов. Считается, что различные биологические виды, подверженные заражению гриппом, имеют небольшие различия в их связях сиаловой кислоты-галактозы. Считается, что вирусы гриппа, которые инфицируют конкретные биологические виды, имеют специфическую аффинность для сиаловой кислоты, связанной с галактозой в этой специфической для вида конформации. Например, на эпителиальных клетках дыхательных путей человека сиаловая кислота преимущественно связана с галактозой альфа-2,6 связью, так что вирусы гриппа, инфицирующие людей, как правило, специфически нацелены на такую конформацию сиаловой кислоты. Человеческие эпителиальные клетки также имеют другие, менее распространенные виды связей сиаловой кислоты-галактозы, такие как альфа-2,3 связь; такая конформация может быть преобладающей у других биологических видов, например, свиней. В силу этого, одна из теорий о том, каким образом вирус гриппа может передаваться от одного биологического вида другому, заключается в том, что он обладает специфичностью в отношении конформации, которая встречается у более, чем одного биологического вида, или мутирует, становясь специфичным для другой конформации.
Носовая слизь и другие экзокринные секреты содержат сиаловую кислоту в растворимой форме, которая может выполнять защитную функцию, связывая вирусы гриппа и другие микроорганизмы и иммобилизуя их. У вирусов гриппа в процессе эволюции выработался способ отщепления от растворимой сиаловой кислоты при помощи фермента, называемого нейраминидазой. Некоторые противовирусные лекарственные средства, такие как тамифлу, служат ингибиторами нейраминидазы. В этом случае они поддерживают вирус иммобилизованным и неспособным инфицировать эпителиальные клетки. Ранее не были предприняты попытки использовать ингибиторы нейраминидазы в топических растворах, наносимых в ноздри, для предотвращения инфекции. Их преимущественно вводили системно для лечения инфекции. Кверцетин, биофлавоноид, находящийся в кожуре цитрусовых, а также многих других фруктах и растениях, является примером природных ингибиторов нейраминидазы.
В некоторых вариантах осуществления противомикробные композиции содержат ингибиторы нейраминидазы. Ингибиторы нейраминидазы включают, но без ограничения, кверцетин, озельтамивир, занамивир, ланинамивир, амантадин, перамивир, а также любые их аналоги.
Противовирусные средства
Противовирусные средства по настоящему изобретению могут быть получены естественным путем (например, путем индукции у животного, растения, грибков, бактерий и так далее, продуцирования аналога ICAM-1, или путем индукции у животного продуцирования поликлональных или моноклональных анти-ICAM-1 антиидиотипических антител); методами синтеза (например, с использованием метода Меррифилда для синтеза полипептидов функциональных производных ICAM-1 и так далее); с помощью рекомбинантных технологий (например, для получения противовирусных функциональных производных ICAM-1 в разных хозяевах (например, дрожжах, бактериях, грибках, культивируемых клетках млекопитающих и так далее), при помощи рекомбинантных плазмид или вирусных векторов, или путем протеолиза. Выбор используемого способа зависит от таких факторов, как удобство, желательный выход и так далее. Для получения конкретного противовирусного средства не обязательно использовать лишь один из вышеописанных способов, методов или технологий; для получения конкретного противовирусного средства вышеописанные способы, методы и технологии можно комбинировать. Ингредиенты подбирают для создания синергетических эффектов.
Лактоферрин
Лактоферрин обычно присутствует в экзокринных секретах, включая носовую слизь, и выполняет функцию защиты от микроорганизмов. Он представляет собой высококатионное антибактериальное, противовирусное и противогрибковое средство. В слезах он присутствует в диапазоне концентраций 1-3 мг/мл, составляя 15-30% общего белка. Его концентрация в человеческом молоке составляет 1 мг/мл, а в содержимом бронхов он составляет 11,5% от общего белка. Концентрации в слизи находятся в диапазоне от 1 мкг/мл до 8 мкг/мл при инфицировании, и он составляет примерно 1-3% от общего белка (Raphael et al. 1989). Считается, что уровни лактоферрина в секретах слизистых оболочек снижаются с возрастом, что делает пожилых людей более восприимчивыми к респираторной инфекции.
Лактоферрин существует в мономерной и тетрамерной формах, и имеет тенденцию к полимеризации при высоких концентрациях. Он представляет собой гликопротеин из примерно 703 аминокислот с молекулярной массой примерно 80 кДа. Несмотря на гомологию 69% между человеческим лактоферрином и бычьим лактоферрином, в некоторых исследованиях было показано, что для оказания противомикробного эффекта бычий лактоферрин необходим в концентрации, составляющей 1/10 от концентрации человеческого лактоферрина. Некоторые виды лактоферрина могут быть более полезными в случае некоторых мутаций или типов инфекционных микроорганизмов, чем другие, и их можно тестировать для оптимизации в случае ожидаемых эпидемий. В исследованиях инфекции, вызываемой вирусом простого герпеса (при топическом нанесении) и вирусом гепатита C, лактоферрин проявлял защитный эффект до контакта с вирусом, но не после, что делает его применение в зоне инфицирования (таком как оболочки носовой полости) более оправданным, чем системное применение.
Лизоцим
Лизоцим, как и лактоферрин, обычно присутствует в экзокринных секретах. Он также представляет собой высококатионное антибактериальное, противовирусное и противогрибковое средство. Согласно результатам одного исследования (Atsushi et al., 1998), его средняя концентрация в слизи составляет 20-30 мкг/мл. В слезах концентрация лизоцима составляет примерно 103 мг/мл, как описано в статье Raphael et al., 1989. Считается, что уровни лизоцима в слизи также снижаются с возрастом.
Антитела слизи
Секреты носовой полости содержат иммуноглобулины, что обеспечивает опосредуемую антителами защиту, и исследования показывают, что большинство из них представляют собой секреторную форму IgA (сIgA) (Kirkeby et al., 2000). Антитела сIgA предотвращают прикрепление микробов и абсорбцию молекулярных антигенов, включая потенциальные аллергены. Некоторые бактерии продуцируют IgA протеазы, эти ферменты, расщепляя IgA, могут нарушать барьерную функцию этих антител. Исследования показывают, что расщепление IgA может приводить к атопическому заболеванию. Другими антителами, которые наиболее часто встречаются в секретах носовой полости и которые могут выполнять защитные функции, являются IgG и IgM (Kirkeby et al., 2000). За счет повышения количества данных антител настоящее изобретение может обеспечивать защиту от нежелательных раздражителей или патогенов.
Рекомбинантные методы
Существует несколько возможных источников вышеуказанных биологических соединений, например, человеческие или бычьи экзокринные секреты. Однако их количество может быть ограничено и их использование может быть небезопасным. Рекомбинантное биологическое производство является другим возможным источником данных соединений. В биологическом производстве могут быть использованы генетически модифицированные микроорганизмы, такие как бактерии, грибки, клетки животных, дрожжи или растения (включая водоросли). Экспрессия в линейных клетках млекопитающих, бактериях и дрожжах часто связана с высокими затратами. Одной из причин этого является необходимость в очистке. Использование водорослей имеет ряд преимуществ перед другими способами в том, что часто не требуется высокая степень очистки. По оценкам, продуцирование белка в растениях может быть на четыре порядка менее дорогостоящим, чем продуцирование в культуре клеток животных, в расчете на грамм неочищенного белка. Кроме того, растительный материал, такой как водоросли, как правило, «в целом считается безопасным», как и его генетически модифицированные аналоги. Коммерческое производство представляется целесообразным, поскольку биореакторы, в которых используют рекомбинантные водоросли для производства некоторых обычно дорогостоящих биологических молекул, показали многообещающие результаты (смотри Rasala et al., Plant Biotech. 2010).
Способы лечения
В настоящем документе описаны новые способы и композиции для усиления фильтрующей способности оболочек дыхательных путей и защиты от присутствующих в воздухе патогенов. Способы доставки по настоящему изобретению обеспечивают максимальную экспозицию дыхательных путей для противомикробных/противовирусных композиций с целью защиты от присутствующих в воздухе патогенов. Новые терапевтические способы также могут включать введение противомикробной композиции в качестве терапевтического средства.
В любом из вышеуказанных аспектов или вариантов осуществления способ может приводить к уменьшению развития респираторной инфекции, уменьшению масштаба инфекции или устранению инфекции. В связанных вариантах осуществления масштаб инфекции сокращается на 5%, 10%, 25%, 50%, 75%, 85%, 90%, 95% или 99% или более по сравнению с ее обычным масштабом.
В любом из вышеуказанных аспектов или вариантов осуществления способы могут включать введение терапевтического средства несколько раз в сутки. В других связанных вариантах осуществления способы могут включать введение терапевтического средства в первый день и повторное введение в один или более последующих дней. В других связанных вариантах осуществления первый день и один или более последующих дней разделены интервалами от 1 дня до примерно 3 недель. В связанных вариантах осуществления терапевтическое средство и другое средство вводят совместно. В связанных вариантах осуществления терапевтическое средство и другое средство вводят в соотношении примерно 1:2, 1:4, 1:10, 1:20, 1:25, 1:50, 1:100, 1:200, или любом промежуточном соотношении (соотношение по массе терапевтического средства и другого средства). По изобретению также предусмотрено, что терапевтическое средство можно вводить на протяжении одного или более циклов. В любом из вышеуказанных аспектов или вариантов осуществления терапевтическое средство и другое средство можно доставлять одновременно.
В любом из вышеуказанных аспектов или вариантов осуществления терапевтическое средство может представлять собой любую противомикробную композицию, описанную в настоящем документе, которую используют для предотвращения или лечения респираторного заболевания или нарушения. В связанных вариантах осуществления респираторное заболевание или нарушение вызвано присутствующими в воздухе патогенами. В конкретных вариантах осуществления терапевтическое средство представляет собой противомикробное/противовирусное средство.
Противомикробное средство может представлять собой любое средство, хорошо известное в данной области, включая, но без ограничения, те, которые описаны в настоящем документе.
В других вариантах осуществления терапевтическое средство может представлять собой терапевтическое антитело. Терапевтическое антитело может представлять собой любое терапевтическое антитело, хорошо известное в данной области, включая, но без ограничения, те, которые описаны в настоящем документе.
В некоторых вариантах осуществления терапевтическое средство может представлять собой терапевтическую молекулу нуклеиновой кислоты. Терапевтическая молекула нуклеиновой кислоты может представлять собой любую терапевтическую молекулу нуклеиновой кислоты, хорошо известную в данной области.
В некоторых вариантах осуществления терапевтическое средство может представлять собой радиоизотоп. Радиоизотоп может представлять собой любой радиоизотоп, хорошо известный в данной области.
В других вариантах осуществления терапевтическое средство может представлять собой сочетание двух или более лекарственных соединений.
В любом из вышеуказанных аспектов или вариантов осуществления способы включают введение терапевтически эффективного количества иммунотерапевтического средства. Иммунотерапевтическое средство может представлять собой любое подходящее средство для инициации дополнительного иммунного ответа, направленного на разрушение инфицированных клеток.
В некоторых вариантах осуществления иммунотерапевтическое средство усиливает иммуномодулирующие эффекты терапевтического средства. В связанных вариантах осуществления иммунотерапевтическое средство дополнительно уменьшает развитие инфекции или дополнительно уменьшает масштаб инфекции.
Иммунотерапевтическое средство можно вводить до, в процессе или после введения терапевтического средства. В некоторых вариантах осуществления иммунотерапевтическое средство вводят до первого введения терапевтического средства. В некоторых вариантах осуществления иммунотерапевтическое средство вводят одновременно с первым введением терапевтического средства.
В любом из вышеуказанных аспектов или вариантов осуществления терапевтическое средство и иммунотерапевтическое средство можно вводить в соотношении примерно 1:2, 1:4, 1:10, 1:25, 1:50, 1:100, 1:200 или любом промежуточном соотношении (соотношение по массе терапевтического средства и иммунотерапевтического средства).
В любом из вышеуказанных аспектов или вариантов осуществления иммунотерапевтическое средство можно вводить интраназально, локально, регионально или системно (например, внутривенно).
В любом из вышеуказанных аспектов или вариантов осуществления терапевтическое средство и иммунотерапевтическое средство можно связывать между собой.
Терапевтические средства
По настоящему изобретению предусмотрено любое терапевтическое средство, подходящее для использования в способах, описанных в настоящем документе (например, любой вид противомикробного/противовирусного средства для лечения респираторного заболевания). Подходящие терапевтические средства включают, но без ограничения, фармацевтические терапевтические средства или соединения (то есть, низкомолекулярные терапевтические средства), терапевтические антитела, терапевтические белки или биологические средства (например, гормональные терапевтические средства), а также молекулы нуклеиновой кислоты (например, киРНК).
В некоторых вариантах осуществления терапевтическое средство представляет собой средство, которое, как показано, обладает противомикробными свойствами в отношении инфекционных микроорганизмов. В связанных вариантах осуществления терапевтическое средство представляет собой одобренное для продажи фармацевтическое терапевтическое средство или другую одобренную для продажи композицию, предназначенную для лечения инфекции с использованием общепринятого подхода.
В некоторых вариантах осуществления терапевтическое средство представляет собой противомикробную композицию, описанную в настоящем документе. В некоторых вариантах осуществления противомикробные композиции включают композиции с антибактериальными, противовирусными и/или противогрибковыми свойствами. Противомикробные композиции включают, но не ограничиваются ими: антитело, такое как IgA, IgG или IgM, растворимую ICAM-1, ингибитор ICAM-1, сиаловую кислоту, ингибитор нейраминидазы, лактоферрин, лизоцим, соединение цинка, серебро, соединения серебра, медь, соединения меди, а также их сочетания. Ингибиторы нейраминидазы включают, но не ограничиваются ими: кверцетин, озельтамивир, занамивир, ланинамивир и перамивир. Ингибиторы ICAM-1 включают, но не ограничиваются ими: растворимую ICAM-1, анти-ICAM-1 антитело, цитокин, CD11a, эзрин (EZR), CD18, глицирретиновую кислоту, пирролидиндитиокарбамат, ингибитор активации NFkB, гетероциклический тиазол, липоевую кислоту, эфализумаб, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамид, силибинин, стилбены, (+)-эпигаллокатехина галлат [(+)-EGCG], а также их сочетания. В некоторых вариантах осуществления анти-ICAM-1 антитело представляет собой эфализумаб (раптива).
По изобретению также предусмотрена любая производная форма вышеуказанных фармацевтических средств и терапевтических средств. Обычная дериватизация может включать, например, добавление химического фрагмента для повышения растворимости и/или стабильности, либо нацеливающего фрагмента, который позволяет более специфически нацеливать молекулу на конкретную клетку или область тела. Фармацевтические средства также могут быть сформулированы в любых подходящих сочетаниях, при этом терапевтические средства могут быть либо смешаны в индивидуальной форме, либо связаны вместе таким образом, что при этом сохраняются функциональные свойства каждого терапевтического средства. Терапевтические средства также могут быть дериватизированы для содержания радиоизотопа или другого уничтожающего клетки фрагмента, чтобы придать молекуле больше эффективности в уничтожении клеток. Кроме того, терапевтические средства, или их фрагменты, могут быть модифицированы флуоресцентным соединением или другими детектируемыми метками, которые могут позволить отслеживать терапевтическое средство или другое средство в организме или внутри опухоли. Фармацевтическое терапевтическое средство или любое другое из вышеуказанных терапевтических средств может быть предоставлено в форме предшественника, чтобы терапевтическое средство приобретало свою активность или функцию после определенного процессинга, например, метаболизации клеткой.
Терапевтические антитела, предусмотренные по настоящему изобретению, могут включать любой изотип (IgA, IgG, IgE, IgM или IgD) противомикробного или противовирусного антитела, либо его иммунологически активный фрагмент или производное. Такие фрагменты могут включать, например, одноцепочечные вариабельные фрагменты (scFv), антигенсвязывающие фрагменты (Fab), кристаллизующийся фрагмент (Fc), модифицированный для содержания антиген- или эпитоп-связывающей области, и доменные антитела. Дериватизированные терапевтические антитела могут включать, например, диатела, нанотела, биспецифические антитела, а также практически любую полученную из антитела структуру, которая содержит, или модифицирована для содержания соответствующего и эффективного антигенсвязывающего сайта.
Примеры противомикробных терапевтических средств на основе антител, которые могут быть использованы по изобретению, могут включать, например, антитело, специфичное для ICAM-1. В некоторых вариантах осуществления анти-ICAM-1 антитело представляет собой эфализумаб (раптива).
По изобретению также предусмотрено, что предотвращение или лечение респираторного заболевания можно осуществлять с использованием молекулы нуклеиновой кислоты, которая нацелена на конкретный «ген-мишень», играющий определенную роль в инфекции. Эффект молекулы нуклеиновой кислоты на ген-мишень может включать выключение гена, разрушение мРНК или ингибирование транскрипции, или тому подобное, так, что уровень экспрессии и/или превращения гена-мишени в функциональный закодированный полипептид в значительной степени изменяется (в большую или меньшую сторону), в результате чего средство ингибирует и/или уничтожает рак. Термин «ген-мишень» означает последовательности нуклеиновой кислоты (например, геномные ДНК или мРНК), кодирующие целевой белок, пептид или полипептид, либо кодирующие, или представляющие собой, регуляторные нуклеиновые кислоты (например, «ген-мишень» для целей настоящего изобретения также может представлять собой микроРНК или кодирующую микроРНК генную последовательность), играющие определенную роль в инфекции. В конкретных вариантах осуществления термин «ген-мишень» также должен включать изоформы, мутанты, полиморфизмы и сплайс-варианты генов-мишеней.
Любое средство на основе нуклеиновой кислоты, хорошо известное в данной области, может быть подходящим для использования по настоящему изобретению. Иллюстративные виды средств на основе нуклеиновых кислот включают, но без ограничения, средства на основе одноцепочечных рибонуклеиновых кислот (например, микроРНК), средства на основе антисмысловых олигонуклеотидов, средства на основе двухцепочечных рибонуклеиновых кислот, и тому подобное.
Способы конструирования терапевтических нуклеиновых кислот хорошо известны в данной области. Например, интерферирующая РНК может быть собрана из двух отдельных олигонуклеотидов, из которых одна цепь представляет собой смысловую цепь, а другая представляет собой антисмысловую цепь, при этом антисмысловая и смысловая цепи являются взаимокомплементарными (то есть, каждая цепь содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в другой цепи; в результате чего антисмысловая цепь и смысловая цепь образуют дуплекс или двухцепочечную структуру); антисмысловая цепь содержит нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности в целевой молекуле нуклеиновой кислоты или ее части, и смысловая цепь содержит нуклеотидную последовательность, соответствующую последовательности целевой нуклеиновой кислоты или ее части.
Альтернативно, интерферирующая РНК может быть собрана из одного олигонуклеотида, в котором взаимокомплементарные смысловая и антисмысловая области связаны при помощи линкера(ов) на основе, или не на основе, нуклеиновых кислот. Интерферирующая РНК может представлять собой полинуклеотид со вторичной структурой дуплекса, асимметричного дуплекса, шпильки или асимметричной шпильки, имеющий взаимокомплементарные смысловую и антисмысловую области, при этом антисмысловая область содержит нуклеотидную последовательность, комплементарную нуклеотидной последовательности в отдельной целевой молекуле нуклеиновой кислоты или ее части, а смысловая область содержит нуклеотидную последовательность, соответствующую последовательности целевой нуклеиновой кислоты или ее части. Интерферирующая РНК может представлять собой кольцевой одноцепочечный полинуклеотид, имеющий две или более петлевых структур и стебель, включающий взаимокомплементарные смысловую и антисмысловую области, при этом антисмысловая область содержит нуклеотидную последовательность, комплементарную нуклеотидной последовательности в целевой молекуле нуклеиновой кислоты или ее части, а смысловая область содержит нуклеотидную последовательность, соответствующую последовательности целевой нуклеиновой кислоты или ее части, и при этом кольцевой полинуклеотид может быть процессирован либо in vivo, либо in vitro, с получением активной молекулы киРНК, способной опосредовать РНК-интерференцию.
Способы введения/доставки терапевтических нуклеиновых кислот хорошо известны в данной области. Например, молекулы терапевтических нуклеиновых кислот могут быть доставлены в носителе для доставки, таком как липидные везикулы или другой полимерный материал носителя, известный в данной области. Неограничивающие примеры дополнительных систем носителей на основе липидов (которые могут быть получены с использованием по меньшей мере одного модифицированного катионного липида по изобретению), подходящих для использования п настоящему изобретению, включают липоплексы (смотри, например, публикацию патента США № 20030203865 и Zhang et al., J. Control Release, 100:165-180 (2004)), pH-чувствительные липоплексы (смотри, например, публикацию патента США № 2002/0192275), обратимо маскированные липоплексы (смотри, например, публикацию патента США № 2003/0180950), композиции на основе катионных липидов (смотри, например, патент США № 6756054 и публикацию патента США № 2005/0234232), катионные липосомы (смотри, например, публикации патентов США №№ 2003/0229040, 2002/0160038 и 2002/0012998; патент США № 5908635 и PCT публикацию № WO 01/72283), анионные липосомы (смотри, например, публикацию патента США № 2003/0026831), pH-чувствительные липосомы (смотри, например, публикацию патента США № 2002/0192274 и AU 2003/210303), покрытые антителами липосомы (смотри, например, публикацию патента США № 2003/0108597 и PCT публикацию № WO 00/50008), специфичные для типа клеток липосомы (смотри, например, публикацию патента США № 2003/0198664), липосомы, содержащие нуклеиновые кислоты и пептиды (смотри, например, патент США № 6207456), липосомы, содержащие липиды, дериватизированные высвобождаемыми гидрофильным полимерами (смотри, например, публикацию патента США № 2003/0031704), заключенные в липиды нуклеиновые кислоты (смотри, например, PCT публикации №№ WO 03/057190 и WO 03/059322), инкапсулированные в липиды нуклеиновые кислоты (смотри, например, публикацию патента США № 2003/0129221 и патента США № 5756122), другие липосомные композиции (смотри, например, публикации патентов США №№ 2003/0035829 и 2003/0072794, и патент США № 6200599), стабилизированные смеси липосом и эмульсий (смотри, например, EP1304160), эмульсионные композиции (смотри, например, патент США № 6747014) и микроэмульсии нуклеиновых кислот (смотри, например, публикацию патента США № 2005/0037086).
При необходимости, любое из средств по изобретению, включая фармацевтические терапевтические средства, биологические средства и терапевтические антитела, также могут быть доставлены с помощью вышеописанных систем носителей. Все системы носителей могут быть дополнительно модифицированы нацеливающим фрагментом, или тому подобным, для облегчения доставки композиции в зону инфекции в дыхательных путях.
Следует понимать, что общепринятые способы доставки активных средств часто сильно ограничены биологическими, химическими и физическими барьерами. Как правило, эти барьеры налагаются окружающей средой, через которую осуществляется доставка, окружением мишени для доставки или самой мишенью. Биологически или химически активные средства особенно чувствительны к таким барьерам. При доставке в организм животных биологически активных или химически активных фармакологических и терапевтических средств физические и химические барьеры налагаются организмом. Примерами физических барьеров являются кожа и оболочки различных органов, через которые средство должно пройти, чтобы достичь мишени, и примеры химических барьеров включают, но без ограничения, различия в pH, липидные бислои и разрушающие ферменты. Клеточная мембрана также представляет собой важный барьер, оказывающий большое влияние на эффективность доставки терапевтического средства.
Иммунотерапевтические средства
В другом аспекте изобретение относится к одному или более иммунотерапевтическим средствам, которые могут дополнительно усиливать эффект избавления от респираторной инфекции, возникающий при использовании противомикробного/противовирусного терапевтического средства. Например, иммунотерапевтическое средство может быть доставлено после проявления эффектов противомикробного средства, однако изобретение не ограничено данной концепцией. По изобретению предусмотрен любой режим введения с использованием нескольких средств, при условии, что будут иметь место терапевтические полезные эффекты каждого средства. По изобретению также предусмотрено, что введенные одно или более иммунотерапевтических средств могут проявлять иммуностимулирующую активность, которая обеспечит профилактику против повторного возникновения инфекции. Данный иммуностимулирующий эффект может быть достигнут, когда средство вводят интраназально или системно.
Специалисты в данной области понимают, что иммунотерапевтическое средство представляет собой средство, которое используют, чтобы заставить собственную иммунную систему индивидуума бороться с инфекцией или заболеванием. Это можно осуществлять путем стимуляции собственной иммунной системы индивидуума или путем предоставления вспомогательных компонентов, без которых иммунная система является дефектной или недостаточной.
Иммунотерапия представляет собой форму биологической терапии, которая может быть использована по настоящему изобретению для дополнения и/или усиления эффектов лечения терапевтическим средством. В целом, существуют две признанные формы иммунотерапии, которые называют активной иммунотерапией и пассивной иммунотерапией. Активная иммунотерапия стимулирует собственную иммунную систему организма для борьбы с заболеванием. При пассивной иммунотерапии используют компоненты иммунной системы, такие как антитела, полученные вне организма, для повышения уровня иммунного ответа организма. Иммунотерапевтические средства также могут действовать путем нацеливания на определенные типы клеток или антигены (специфические иммунотерапевтические средства), или их действие может носить более общий характер, стимулируя иммунную систему (неспецифические иммунотерапевтические средства, иногда называемые адъювантами). Некоторые примеры иммунотерапевтических средств, предусмотренных по настоящему изобретению, включают моноклональные антитела, неспецифические иммунотерапевтические средства и адъюванты (вещества, которые стимулируют иммунный ответ, такие как интерлейкин-2 и интерферон-альфа), иммуномодулирующие терапевтические средства (такие как талидомид и леналидомид) и вакцины.
Соответственно, иммунотерапевтические средства, которые также могут быть названы «иммуномодуляторы», могут включать, например, интерлейкины (например, IL-2, IL-7 или IL-12), некоторые другие цитокины (например, интерфероны, колониестимулирующий фактор (G-CSF), имиквимод), хемокины и другие виды средств, которые могут включать антигены, эпитопы, антитела, моноклональные антитела, или даже среду доставки для доставки одного или более из этих соединений, и даже могут включать рекомбинантные клетки иммунной системы. Такие иммунотерапевтические средства могут включать рекомбинантные формы, синтетические формы и природные препараты (смотри D'Alessandro, N. et al., Cancer Therapy: Differentiation, Immunomodulation and Angiogenesis, New York: Springer-Verlag, 1993).
В другом варианте осуществления иммунотерапевтическое средство использует естественную иммунную систему организма и при введении проявляет эффект инициации врожденного иммунитета против нежелательных патогенов.
Введение иммунотерапевтических средств по изобретению можно осуществлять с использованием любого приемлемого подхода, включая локальное или региональное введение средства в зону, или рядом с зоной, респираторной инфекции. Средство также может быть доставлено, где это возможно, методами генной терапии. Например, вызывающий выработку антител антиген может быть доставлен путем инъекции или иного способа прямого введения генетического вектора или иной молекулы нуклеиновой кислоты, способной экспрессировать нужный антиген. Сами антигены также можно напрямую вводить в целевую инфицированную ткань.
Целевые респираторные заболевания
По настоящему изобретению предусмотрено лечение широкого спектра респираторных заболеваний, включая инфекции всех видов, локализаций, масштабов и характеристик. Способы по изобретению подходят для лечения, например, синусита, гриппа и риновирусной инфекции (обычной простуды).
В других вариантах осуществления практически любой вид инфекции дыхательных путей можно лечить способами по настоящему изобретению, включая, но без ограничения, следующие респираторные инфекции: тонзиллит, фарингит, ларингит, синусит, средний отит, некоторые виды гриппа, бронхит, пневмонию и обычную простуду.
Предусмотрено, что композиции по изобретению подходят для профилактики и/или лечения инфекции, вызываемой любым серотипом человеческого риновируса (HRV). HRV может включать, без ограничения, виды риновируса A (включая серотипы HRV-A1, HRV-A2, HRV-A7, HRV-A8, HRV-A9, HRV-A10, HRV-A11, HRV-A12, HRV-A13, HRV-A15, HRV-A16, HRV-A18, HRV-A19, HRV-A20, HRV-A21, HRV-A22, HRV-A23, HRV-A24, HRV-A25, HRV-A28, HRV-A29, HRV-A30, HRV-A31, HRV-A32, HRV-A33, HRV-A34, HRV-A36, HRV-A38, HRV-A39, HRV-A40, HRV-A41, HRV-A43, HRV-A44, HRV-A45, HRV-A46, HRV-A47, HRV-A49, HRV-A50, HRV-A51, HRV-A53, HRV-A54, HRV-A55, HRV-A56, HRV-A57, HRV-A58, HRV-A59, HRV-A60, HRV-A61, HRV-A62, HRV-A63, HRV-A64, HRV-A65, HRV-A66, HRV-A67, HRV-A68, HRV-A71, HRV-A73, HRV-A74, HRV-A75, HRV-A76, HRV-A77, HRV-A78, HRV-A80, HRV-A81, HRV-A82, HRV-A85,HRV-A88, HRV-A89, HRV-A90, HRV-A94, HRV-A95, HRV-A96, HRV-A98, HRV-A100, HRV-A101, HRV-A102 и HRV-A103), риновируса B (включая серотипы HRV-B3, HRV-B4, HRV-B5, HRV-B6, HRV-B14, HRV-B17, HRV-B26, HRV-B27, HRV-B35, HRV-B37, HRV-B42, HRV-B48, HRV-B52, HRV-B69, HRV-B70, HRV-B72, HRV-B79, HRV-B83, HRV-B84, HRV-B86, HRV-B91, HRV-B92, HRV-B93, HRV-B97 и HRV-B99) и риновируса C (включая, без ограничения, серотипы HRV-C1, HRV-C2, HRV-C3, HRV-C4, HRV-C5, HRV-C6, HRV-C7, HRV-C8, HRV-C9, HRV-C10, HRV-C11, HRV-C12, HRV-C13, HRV-C14, HRV-C15, HRV-C16, HRV-C17, HRV-C18, HRV-C19, HRV-C20, HRV-C21, HRV-C22, HRV-C23, HRV-C24, HRV-C25, HRV-C26, HRV-C27, HRV-C28, HRV-C29, HRV-C30, HRV-C31, HRV-C32, HRV-C33, HRV-C34, HRV-C35, HRV-C36, HRV-C37, HRV-C38, HRV-C39, HRV-C40, HRV-C41, HRV-C42, HRV-C43, HRV-C44, HRV-C45, HRV-C46, HRV-C47, HRV-C48, HRV-C49, HRV-C50 и HRV-C51). В некоторых вариантах осуществления предусмотрено, что композиции по изобретению полезны для профилактики или лечения вирусной инфекции, вызываемой любым риновирусом или энтеровирусом, и, в частности, любым вирусом, который связывает молекулу межклеточной адгезии 1 (ICAM-1). Также предусмотрено, что композиции по изобретению подходят для профилактики и/или лечения инфекции, вызываемой любым серотипом человеческого вируса гриппа, включая, без ограничения, представителей вирусов гриппа рода A, вирусов гриппа рода B и вирусов гриппа рода C, включая виды вируса гриппа A (в том числе, без ограничения, серотипы H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3, H10N7 и H7N9, например), вируса гриппа B и вируса гриппа C. В некоторых вариантах осуществления предусмотрено, что композиции по изобретению полезны для профилактики или лечения вирусной инфекции, вызываемой любым связывающим сиаловую кислоту вирусом, включая вирус гриппа, реовирус, аденовирус и/или ротавирус. При распылении в носовой и/или ротовой полости композиции по изобретению оседают на слизистой оболочке, в идеале, оставаясь в течение долгого времени (например, по меньшей мере 1 минуты, по меньшей мере 5 минут, по меньшей мере 10 минут, по меньшей мере 15 минут, по меньшей мере 20 минут, по меньшей мере 25 минут, или по меньшей мере 30 минут) на слизистой оболочке, но, желательно, не вызывая излишней сухости или раздражения слизистой оболочки. Предпочтительные композиции по изобретению наносят на слизистую оболочку носовой и/или ротовой полости для профилактики или лечения инфекции, вызываемой человеческим риновирусом и человеческим вирусом гриппа.
Настоящее изобретение, в целом, может быть использовано для лечения и/или предотвращения всех форм вышеуказанных инфекций. Например, способ по изобретению предпочтительно можно использовать для лечения или предотвращения инфекций, возникающих в любой части дыхательных путей, включая, но без ограничения, верхние дыхательные пути (нос, пазухи, гортань и глотка) и нижних дыхательных путей (трахея, первичные бронхи, бронхи, бронхиолы и легкие).
Уменьшение инфекции означает поддающееся измерению уменьшение распространенности инфекции. Например, и без ограничения, инфекция может быть уменьшена по меньшей мере примерно в 10 раз (например, в 100, 1000 раз или более) или уменьшена на по меньшей мере примерно 10% (например, по меньшей мере примерно 20, 30, 40, 50, 60, 70, 80, 90, 95, 99 или 100%) по сравнению с распространенностью, измеренной с течением времени до применения лечения, описанного в настоящем документе. Степень уменьшения инфекции по изобретению, в идеале, является статистически значимой, в сравнении с идентичными инфицированными тканями в отсутствие активных ингредиентов, содержащихся в композиции по изобретению.
Полная ликвидация инфекции также может быть достигнута при использовании способов по изобретению. Ликвидация означает устранение инфекции и инфекционных микроорганизмов. Считается, что инфекция устранена, когда она не поддается обнаружению с использованием методов обнаружения, известных в данной области.
Фармацевтические композиции
Изобретение относится к фармацевтическим композициям, предназначенным для использования в любом из способов, описанных в настоящем документе. Фармацевтические композиции могут содержать противомикробное/противовирусное терапевтическое средство и, необязательно, иммунотерапевтическое средство.
В некоторых вариантах осуществления фармацевтические композиции содержат фармацевтически приемлемый носитель. Используемый в настоящем документе термин «фармацевтически приемлемый» означает, что материал одобрен регламентирующим органом федерального правительства или правительства штата, либо упомянут в фармакопее США, Европейской фармакопее или других общепризнанных фармакопеях, для использования применительно к животным и, более конкретно, к человеку. Термин «носитель» означает разбавитель, адъювант, наполнитель или среду, с которыми вводят терапевтическое средство. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая полученные из нефти, животные, растительные или синтетические масла, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло, оливковое масло, гель (например, гидрогель), касторовое масло и тому подобное. Солевой раствор является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Солевые растворы, а также водные растворы декстрозы и растворы глицерина, также можно использовать в качестве жидких носителей, в частности, для инъекционных растворов.
Фармацевтически приемлемый носитель можно выбирать таким образом, чтобы он обеспечивал определенное время удержания на слизистой оболочке субъекта. В некоторых вариантах осуществления «время удержания» композиций по изобретению на слизистой оболочке представляет собой среднее время удержания в исследованиях, включающих несколько нанесений (интраназальных и/или пероральных), с использованием образцов от нескольких индивидуумов, достаточных для аппроксимации на популяцию в целом. В некоторых вариантах осуществления по меньшей мере 25% (и предпочтительно по меньшей мере 30% или по меньшей мере 40%, или по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%, или по меньшей мере 90%) по массе изначально нанесенных активных ингредиентов остаются на слизистой оболочке после определенного периода времени. В некоторых вариантах осуществления фармацевтически приемлемый носитель при 25°C имеет следующие параметры растворимости Хансена: энергию от дисперсии (δd), энергию от биполярной межмолекулярной силы между молекулами (δp), энергию от водородных связей (δh), составляющие от примерно 15 до примерно 18, от примерно 12 до примерно 15, от примерно 21 до примерно 25, соответственно.
Фармацевтически приемлемый носитель может быть водным. В некоторых вариантах осуществления фармацевтически приемлемый носитель не содержит ртутные консерванты. Растворитель может представлять собой 1,2-пропандиол, 1,3-пропандиол, и могут быть использованы различные водные носители, например, забуференная вода, 0,9-процентный солевой раствор, забуференные водно-этанольные растворы и тому подобное. Сочетания любых из этих носителей входят в объем изобретения. Данные композиции можно стерилизовать обычными, хорошо известными методами стерилизации, или можно стерилизовать фильтрованием. Полученные растворы можно упаковывать для использования, как есть, или использовать в качестве адъюванта в смеси с другим лекарственным препаратом. Композиция может содержать фармацевтически приемлемые вспомогательные вещества, по мере необходимости, для приближения к физиологическим условиям, такие как регуляторы pH и буферные средства, регулирующие тоничность средства, модификаторы вкуса, подсластители, увлажняющие средства и тому подобное, например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитан монолаурат, триэтаноламин олеат и так далее. В некоторых вариантах осуществления фармацевтически приемлемый носитель представляет собой смесь воды и полиола. В некоторых вариантах осуществления фармацевтически приемлемый носитель представляет собой смесь воды и пропандиола (например, 1,2-пропандиола, 1,3-пропандиола). В некоторых вариантах осуществления фармацевтическая композиция представляет собой смесь воды и глицерина. Фармацевтически приемлемый носитель может представлять собой примерно 1% - 35% (например, примерно 5% - 30% и так далее) водный раствор пропандиола или глицерина, по массе от массы водного носителя. Некоторые фармацевтически приемлемые носители включают 20% водный раствор 1,3-пропандиола, 20% водный раствор глицерина, 10% водный раствор 1,3-пропандиола, 10% водный раствор глицерина, 20% водный раствор 1,3-пропандиола с 1% подсолнечного масла и 5% полисорбата 80, 20% водный раствор глицерина с 1% подсолнечного масла и 5% полисорбата 80, 10% водный раствор 1,3-пропандиола с 1% подсолнечного масла и 5% полисорбата 80, 10% водный раствор глицерина с 1% подсолнечного масла и 5% полисорбата 80, полимерную эмульгирующую систему Versaflex V-175 (то есть, сахарозы пальмитат, глицерил стеарат, глицерил стеарат цитрат, сахароза, маннан и ксантановая камедь), полимерную эмульгирующую систему Versaflex V-175 с 3% подсолнечного масла, полимерную эмульгирующую систему Versaflex V-175 с 3% подсолнечного масла и примерно 5-30% пропандиола или глицерина, эмульгирующую систему Versaflex V-175 с 3% ацетилированного моноглицерида и эмульгирующую систему Versaflex V-175 с 3% ацетилированного моноглицерида и примерно 5-30% пропандиола или глицерина.
Подходящие фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль, воду, этанол и тому подобное. Композиция, при необходимости, также может содержать незначительные количества увлажнителей или эмульгаторов, или регулирующих pH буферных средств. Такие композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, препаратов с замедленным высвобождением и тому подобного. Пероральные препараты могут содержать стандартные носители, такие как фармацевтической категории маннит, лактоза, крахмал, стеарат магния, сахаринат натрия, целлюлоза, карбонат магния и так далее. Примеры подходящих фармацевтических носителей описаны в «Remington's Pharmaceutical Sciences» автора E. W. Martin, полное содержание публикации включено в настоящий документ посредством ссылки. Такие композиции, как правило, будут содержать терапевтически эффективное количество терапевтического средства и/или иммунотерапевтического средства в очищенной форме, наряду с соответствующим количеством носителя для обеспечения надлежащего введения формы пациенту. Препарат должен соответствовать способу введения.
В некоторых вариантах осуществления терапевтическое средство и/или иммунотерапевтическое средство вводят локально в виде композиции с немедленным высвобождением или контролируемым высвобождением, например, контролируемым растворением и/или диффузией активного вещества. Высвобождение, контролируемое за счет растворения или диффузии, может быть достигнуто путем заключения активного вещества в соответствующую матрицу. Матрица с контролируемым высвобождением может содержать одно или более из шеллака, пчелиного воска, гликовоска, касторового воска, карнаубского воска, стеарилового спирта, глицерил моностеарата, глицерил дистеарата, глицерин пальмитостеарата, этилцеллюлозы, акриловых смол, dl-полимолочной кислоты, ацетобутирата целлюлозы, поливинилхлорида, поливинилацетата, винилпирролидона, полиэтилена, полиметакрилата, метилметакрилата, 2-гидроксиметакрилата, метакрилатных гидрогелей, 1,3-бутиленгликоля, метакрилата этиленгликоля и/или полиэтиленгликолей. В препарате, содержащем матрицу с контролируемым высвобождением, материал матрицы также может включать, например, гидратированную метилцеллюлозу, карнаубский воск и стеариловый спирт, карбопол 934, силикон, глицерил тристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галогенированный фторуглерод.
В связанных вариантах осуществления матрица с контролируемым высвобождением представляет собой гидрогель. Гидрогель представляет собой трехмерную гидрофильную или амфифильную полимерную сеть, способную поглощать большое количество воды. Сети состоят из гомополимеров или сополимеров, которые являются нерастворимыми вследствие наличия ковалентных химических или физических (например, ионных, гидрофобных взаимодействий, переплетений) сшивок. Сшивки обеспечивают структуру и физическую целостность сети. Гидрогели термодинамически совместимы с водой, что позволяет им набухать в водной среде. Цепи сети связаны таким образом, что образуются поры, и значительная часть этих пор имеет размеры от 1 нм до 1000 нм.
Гидрогели можно получать путем сшивки гидрофильных биополимеров или синтетических полимеров. Примеры гидрогелей, полученных путем физических или химических сшивок гидрофильных биополимеров, включают, но не ограничиваются ими, гиалуронаны, хитозаны, альгинаты, коллаген, декстран, пектин, каррагинан, полилизин, желатин, агарозу, (мет)акрилат-олиголактид-PEO-олиголактид-(мет)акрилат, поли(этиленгликоль) (PEO), поли(пропиленгликоль) (PPO), сополимеры PEO-PPO-PEO (плюроники), поли(фосфазен), поли(метакрилаты), поли(N-винилпирролидон), сополимеры PL(G)A-PEO-PL(G)A, поли(этиленимин) и тому подобное. Смотри Hennink and van Nostrum, Adv. Drug Del. Rev. 54:13-36 (2002); Hoffman, Adv. Drug Del. Rev. 43:3-12 (2002); Cadee et al., J Control. Release 78:1-13 (2002); Surini et al., J. Control. Release 90:291-301 (2003); и патент США № 7968085, полное содержание всех из которых включено в настоящий документ посредством ссылки. Эти материалы состоят из высокомолекулярных каркасных цепей, выполненных из линейных, или разветвленных, полисахаридов или полипептидов.
Количество фармацевтической композиции по изобретению, которое будет эффективным для лечения или предотвращения респираторной инфекции или аллергии, может зависеть от природы патогена и может быть определено стандартными клиническими методами, включая анализ крови и/или методы визуализации. Кроме того, можно использовать, необязательно, in vitro анализы для облегчения определения оптимальных диапазонов доз. Точная используемая доза препарата также может зависеть от пути введения и серьезности инфекции, и должна быть определена на основании решения практикующего врача и обстоятельств каждого пациента. Эффективные дозы можно экстраполировать из кривых зависимости ответа от дозы, полученных в тест-системах in vitro или в животных моделях.
Дозы и режимы введения
Терапевтические средства, иммунотерапевтические средства или композиции, содержащие эти средства, вводят способом, совместимым с препаратом лекарственного средства, и в таком количестве, которое может быть терапевтически эффективным, защитным и иммуногенным.
Средства и/или композиции можно вводить разными путями введения, включая, но без ограничения, назальный, аэрозольный, топический, трансбуккальный и подъязычный, пероральный, внутрикожный, подкожный и парентеральный. Используемый в настоящем документе термин «парентеральный» включает, например, внутриглазную, подкожную, внутрибрюшинную, внутрикожную, внутривенную, внутримышечную, внутрисуставную, внутриартериальную, интрасиновиальную, интрастернальную, интратекальную, внутриочаговую и интракраниальную инъекцию, или другие методы инфузии.
В некоторых вариантах осуществления вводимые терапевтические средства доставляют локально или регионально (например, интраназально). В некоторых вариантах осуществления используют устройство для доставки противомикробной композиции в дыхательные пути. Композицию можно доставлять с использованием ингалятора, распылителя, небулайзера, аэрозольного флакона, пульверизатора, вентилятора, баллона со сжатым воздухом, опрыскивателя и носовой канюли. Композицию можно доставлять путем инсуффляции, ингаляции, проглатывания, рассасывания под языком, а также любыми сочетаниями этих способов.
В некоторых вариантах осуществления средства и/или композиции, сформулированные в соответствии с настоящим изобретением, формулируют и доставляют таким образом, чтобы вызывать системный иммунный ответ. Таким образом, в некоторых вариантах осуществления препараты готовят путем однородного и тщательного объединения активных ингредиентов с жидкими носителями. Препараты, подходящие для введения, включают водные и неводные стерильные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические средства и растворенные вещества, придающие препарату изотоничность с кровью предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут содержать суспендирующие средства и загустители. Препараты могут находиться в однодозовых и многодозовых контейнерах, например, герметичных ампулах и флаконах, и их можно хранить в сублимированном (лиофилизированном) состоянии, к ним необходимо лишь добавлять стерильный жидкий носитель, например, воду, непосредственно перед использованием. Приготовленные для немедленного использования растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток, как известно специалистам в данной области.
Средства и/или композиции можно вводить в разных формах, включая, но без ограничения, газы, растворы, эмульсии и суспензии, гели, пены, спреи, аэрозоли, лосьоны, микросферы, частицы, микрочастицы, наночастицы, липосомы и тому подобное.
Средства и/или композиции вводят способом, совместимым с препаратом лекарственного средства, и в таком количестве, которое может быть терапевтически эффективным, иммуногенным и защитным. Вводимое количество зависит от субъекта, подлежащего лечению, включая, например, масштаб инфекции и способности иммунной системы индивидуума синтезировать антитела и/или обеспечивать клеточный иммунный ответ. Точные количества активных ингредиентов, которые необходимо вводить, зависят от решения практикующего врача. Однако подходящие диапазоны доз может с легкостью определять специалист в данной области, и они могут находиться в диапазоне от микрограммов до миллиграммов активного ингредиента(ов) на дозу. Доза также может зависеть от пути введения и может варьироваться в зависимости от массы тела реципиента.
Средства и/или композиции следует вводить субъекту в количестве, эффективном для стимуляции защитного иммунного ответа у субъекта. Конкретные дозы и режимы лечения для каждого конкретного субъекта могут зависеть от разных факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету субъекта, время введения, скорость выведения, сочетание лекарственных средств, степень тяжести и течение инфекции, состояния или симптомов, предрасположенность субъекта к заболеванию, состоянию или симптомам, способ введения и решение лечащего врача. Фактические дозы может с легкостью определять специалист в данной области.
Иллюстративные стандартные лекарственные препараты представляют собой препараты, содержащие дозу или единицу дозы, или ее соответствующую часть, вводимого ингредиента. Следует понимать, что в дополнение к ингредиентам, упомянутым в настоящем документе, препараты по настоящему изобретению могут содержать другие средства, обычно используемые специалистами в данной области.
Как правило, для обычных системно вводимых терапевтических препаратов терапевтически эффективная доза должна обеспечивать сывороточную концентрацию соединения от примерно 0,1 нг/мл до примерно 50-100 мкг/мл. Фармацевтические композиции, как правило, обеспечивают дозу от примерно 0,001 мг до примерно 2000 мг соединения на килограмм массы тела в сутки. Например, дозы для введения пациенту-человеку могут находиться в диапазоне 1-10 мкг/кг, 20-80 мкг/кг, 5-50 мкг/кг, 75-150 мкг/кг, 100-500 мкг/кг, 250-750 мкг/кг, 500-1000 мкг/кг, 1-10 мг/кг, 5-50 мг/кг, 25-75 мг/кг, 50-100 мг/кг, 100-250 мг/кг, 50-100 мг/кг, 250-500 мг/кг, 500-750 мг/кг, 750-1000 мг/кг, 1000-1500 мг/кг, 1500-2000 мг/кг, 5 мг/кг, 20 мг/кг, 50 мг/кг, 100 мг/кг, 500 мг/кг, 1000 мг/кг, 1500 мг/кг или 2000 мг/кг. Фармацевтические стандартные лекарственные формы готовят для содержания от примерно 1 мг до примерно 5000 мг, например, от примерно 100 до примерно 2500 мг соединения или сочетания необходимых ингредиентов на стандартную лекарственную форму.
Как правило, терапевтически эффективное количество настоящих соединений в лекарственной форме находится в диапазоне от немного менее, чем примерно 0,025 мг/кг/сутки, до примерно 2,5 г/кг/сутки, предпочтительно от примерно 0,1 мг/кг/сутки до примерно 100 мг/кг/сутки для пациента или значительно больше, в зависимости от используемого соединения, подвергаемого лечению состояния, или инфекции, и пути введения, хотя по настоящему изобретению могут быть предусмотрены исключения из этого диапазона доз. В иллюстративном варианте осуществления противомикробные/противовирусные композиции по настоящему изобретению можно вводить интраназально в диапазоне количеств от примерно 0,5 мг/мл вводимого раствора до примерно 50 мг/мл. В другом иллюстративном варианте осуществления противомикробные композиции по настоящему изобретению можно вводить интраназально в диапазоне количеств от примерно 10 мг/мл до примерно 30 мг/мл. Доза противомикробной композиции(й) может зависеть от типа инфекции, подвергаемой лечению, конкретного используемого соединения, терапевтического средства, а также других клинических факторов и состояния здоровья пациента. Следует понимать, что настоящее изобретение может быть использовано как в области медицины, так и в области ветеринарии.
Средства и/или композиции можно вводить в одной или более дозах, по мере необходимости, для достижения желаемого эффекта. Таким образом, средства и/или композиции можно вводить в 1, 2, 3, 4, 5 или более дозах. Кроме того, дозы можно вводить через любые интервалы времени, например, несколько часов, дней, недель, месяцев и лет.
Средства и/или композиции могут быть сформулированы в виде жидкостей или сухих порошков, или в форме микросфер.
Средства и/или композиции можно хранить при температурах от примерно -100°C до примерно 25°C, в зависимости от продолжительности хранения. Средства и/или композиции также можно хранить в лиофилизированном состоянии при разных температурах, включая комнатную температуру. Средства и/или композиции можно стерилизовать общепринятыми методами, известными специалистам в данной области. Такие методы включают, но без ограничения, фильтрование.
Количество активного ингредиента, который можно объединять с материалом носителя для получения стандартной лекарственной формы, может варьироваться в зависимости от получающего лечение пациента и конкретного способа введения. В некоторых вариантах осуществления препарат может содержать от примерно 0,1% до примерно 95% активного соединения (по массе), от примерно 20% до примерно 80% активного соединения или любое промежуточное количество в процентах.
В некоторых вариантах осуществления pH препарата можно регулировать при помощи фармацевтически приемлемых кислот, оснований или буферов для повышения стабильности сформулированного соединения или его доставляемой формы.
В некоторых вариантах осуществления фармацевтические носители могут иметь форму стерильного жидкого препарата, например, стерильной водной или масляной суспензии.
Приемлемые среды и растворители, которые можно использовать, включают маннит, воду, раствор Рингера и изотонический раствор хлорида натрия.
Кроме того, в качестве растворителя или суспензионной среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, могут быть использованы для получения инъекционных растворов, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии также могут содержать длинноцепочечный спирт в качестве разбавителя или диспергирующего средства, либо карбоксиметилцеллюлозу или аналогичные диспергирующие средства, которые обычно используют для создания фармацевтически приемлемых лекарственных форм, таких как эмульсии и/или суспензии.
Другие обычно используемые сурфактанты, такие как твин® или спан®, и/или другие аналогичные эмульгаторы или усилители биодоступности, которые обычно используют в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, также могут быть использованы для формулирования.
В некоторых вариантах осуществления средства и/или композиции можно доставлять в экзосомальной системе доставки. Экзосомы представляют собой небольшие мембранные везикулы, которые высвобождаются во внеклеточное окружение в процессе слияния мультивезикулярных тел с плазматической мембраной. Экзосомы секретируются клетками разных типов, включая гемопоэтические клетки, нормальные эпителиальные клетки и даже некоторые опухолевые клетки. Известно, что экзосомы несут молекулы MHC класса I, различные костимулирующие молекулы и некоторые тетраспанины. Недавние исследования продемонстрировали возможность использования природных экзосом в качестве иммунных стимуляторов.
По настоящему изобретению также предусмотрена доставка средств и/или композиций при помощи наночастиц. Например, средства и/или композиции, предложенные в настоящем документе, могут содержать наночастицы, с которыми связаны по меньшей мере одно или более средств, например, связаны с поверхностью наночастицы. Композиция, как правило, содержит множество наночастиц, при этом с каждой наночастицей связаны по меньшей мере одно или более средств. Наночастицы могут представлять собой коллоидные металлы. Коллоидный металл включает любую нерастворимую в воде металлическую частицу или металлическое соединение, диспергированные в жидкой воде. Как правило, коллоидный металл представляет собой суспензию металлических частиц в водном растворе. Можно использовать любой металл, который может иметь коллоидную форму, включая золото, серебро, медь, никель, алюминий, цинк, кальций, платину, палладий и железо. В некоторых случаях используют наночастицы золота, например, полученные из HAuCl4. Наночастицы могут иметь любую форму и могут иметь размер в диапазоне от примерно 1 нм до примерно 10 нм, например, от примерно 2 нм до примерно 8 нм, от примерно 4 до примерно 6 нм, или примерно 5 нм. Способы получения коллоидных металлических наночастиц, включая золотые коллоидные наночастицы из HAuCl4, известны специалистам в данной области. Например, способы, описанные в настоящем документе, а также способы, описанные в других документах (например, патентных публикациях США №№ 2001/005581, 2003/0118657 и 2003/0053983, которые включены в настоящий документ посредством ссылки) могут быть использованы для получения наночастиц.
В некоторых случаях наночастица может иметь два, три, четыре, пять, шесть или более активных средств, связанных с ее поверхностью. Как правило, множество молекул активных средств связаны с поверхностью наночастицы во многих участках. Соответственно, когда наночастицу описывают, как имеющую, например, два активных средства, связанных с ней, наночастица имеет два активных средства, каждое из которых имеет собственную уникальную структуру, связанных с ее поверхностью. В некоторых случаях одна молекула активного средства может быть связана с наночастицей в одном участке связывания или в нескольких участках связывания. Активное средство может быть связано с поверхностью наночастицы напрямую или опосредовано. Например, активное средство может быть связано непосредственно с поверхностью наночастицы или опосредованно через промежуточный линкер.
В качестве линкера можно использовать молекулу любого типа. Например, линкер может представлять собой алифатическую цепь, содержащую по меньшей мере два атома углерода (например, 3, 4, 5, 6, 7, 8, 9, 10 или более атомов углерода), которая может быть замещенной одной или более функциональными группами, включая кетон, эфир, сложный эфир, амид, спирт, амин, мочевину, тиомочевину, сульфоксид, сульфон, сульфонамид и дисульфид в качестве функциональных групп. В случаях, когда наночастица содержит золото, линкер может представлять собой любую тиол-содержащую молекулу. Реакция тиоловой группы с золотом приводит к образованию ковалентной сульфидной (-S-) связи. Дизайн и синтез линкеров хорошо известны в данной области.
В некоторых вариантах осуществления наночастица связана с нацеливающим средством/фрагментом. Нацеливающий функциональный фрагмент может позволять наночастицам накапливаться на мишени (например, оболочке носовой полости) в более высоких концентрациях, чем в других тканях. Как правило, нацеливающая молекула может представлять собой один член связывающейся пары, который обладает аффинностью и специфичностью в отношении второго члена связывающейся пары. Например, терапевтическое средство на основе антитела или фрагмента антитела может направлять наночастицу к конкретной области или молекуле тела (например, области или молекуле, в отношении которой антитело специфично), при этом также выполняя терапевтическую функцию. В некоторых случаях рецептор или фрагмент рецептора может направлять наночастицу к конкретной области, например, где находится его партнер по связыванию. Другие терапевтические средства, такие как малые молекулы, могут аналогичным образом направлять наночастицу к рецептору, белку или другому сайту связывания, имеющему аффинность для терапевтического средства.
Когда композиции по данному изобретению содержат одно или более дополнительных терапевтических, или профилактических, средств, терапевтическое/усиливающее/иммунотерапевтическое средство и дополнительное средство должны присутствовать на уровнях доз от примерно 0,1 до 100%, или примерно 5-95% от доз, обычно вводимых в режиме монотерапии. Дополнительные средства можно вводить отдельно от средств по данному изобретению, в виде части многодозового режима лечения. Альтернативно, эти дополнительные средства могут быть частью одной лекарственной формы, смешанные со средствами по данному изобретению в одной композиции.
Введение средств и/или композиций по изобретению вызывает иммунный ответ против патогена. Как правило, дозу можно корректировать в указанном диапазоне в зависимости, например, от возраста субъекта, состояния здоровья и физического состояния субъекта, способности иммунной системы субъекта продуцировать иммунный ответ, массы тела субъекта, пола субъекта, диеты, времени введения, степени желательной защиты и других клинических факторов. Специалисты в данной области могут учитывать такие параметры, как биологическое время полураспада, биодоступность, путь введения и токсичность, при формулировании средств и/или композиций по изобретению.
Следующие далее примеры дополнительно иллюстрируют некоторые варианты осуществления данного изобретения. Хотя примеры иллюстрируют изобретение, они не должны ограничивать его объем.
ПРИМЕРЫ
Структуры, материалы, композиции и способы, описанные в настоящем документе, должны представлять собой репрезентативные примеры по изобретению, и следует понимать, что объем изобретения не ограничен объемом примеров. Специалисты в данной области понимают, что изобретение может быть осуществлено на практике с вариациями описанных структур, материалов, композиций и способов, и такие вариации следует считать входящими в объем данного изобретения.
Пример 1: Введение противомикробных композиций субъектам, не являющимся людьми, для предотвращения инфекции
Противомикробные композиции в различных концентрациях, содержащие ингредиенты из Таблицы 1, вводят интраназально группе здоровых, неинфицированных мышей, подобранных по возрасту, полу и массе тела. После периода времени, достаточного для того, чтобы композиции могли проявить свой эффект, мышам инокулируют в нос различные дозы патогенов дыхательных путей (вирус гриппа, риновирус, бактерии и грибы). Затем в разных временных точках от мышей собирают образцы и анализируют на микробную инфекцию. Отсутствие инфекции указывает на то, что противомикробная композиция предотвращает инфицирование мышей присутствующими в воздухе патогенами. Противомикробная композиция усиливает фильтрующую способность оболочки носовой полости и защищает от присутствующих в воздухе патогенов.
Пример 2: Введение противомикробных композиций субъектам, не являющимся людьми, для лечения инфекции
Группе здоровых, неинфицированных мышей, подобранных по возрасту, полу и массе тела, инокулируют в нос различные дозы патогенов дыхательных путей (вирус гриппа, риновирус, бактерии и грибы). После периода времени, достаточного для того, чтобы патогены инфицировали мышей, инфицированным мышам интраназально вводят противомикробные композиции в различных концентрациях, содержащие ингредиенты из Таблицы 1 (как в примере 1). После периода времени, достаточного для того, чтобы композиции могли проявить свой эффект, от мышей собирают образцы и анализируют на наличие микробной инфекции. Отсутствие инфекции указывает на то, что противомикробная композиция лечит респираторные инфекции у мышей. Противомикробная композиция усиливает фильтрующую способность оболочки носовой полости и лечит инфекцию, вызываемую присутствующими в воздухе патогенами.
Пример 3: Введение противомикробных композиций субъектам-людям для лечения инфекции
Группу субъектов-людей, не имеющих текущую инфекцию, вызываемую вирусом гриппа или риновирусом, выбирают для лечения, и у них собирают исходные образцы крови для скрининга на маркеры респираторной инфекции. Противомикробные композиции, содержащие ингредиенты из Таблицы 1 (как в примерах 1 и 2) вводят интраназально субъектам. После периода времени, достаточного для того, чтобы композиции могли проявить свой эффект, субъектов подвергают воздействию присутствующих в воздухе риновирусов или вирусов гриппа. После периода времени, достаточного для определения того, были ли субъекты инфицированы, у них вновь собирают образцы крови и проводят скрининг на системные маркеры респираторной инфекции, а также субъектов опрашивают и осматривают на наличие видимых признаков респираторной инфекции. Отсутствие инфекции указывает на то, что противомикробная композиция предотвращает респираторные инфекции. Противомикробная композиция усиливает фильтрующую способность оболочки носовой полости и предотвращает респираторную инфекцию, вызываемую вирусами.
Пример 4: Определение эффекта композиций на полностью дифференцированную трехмерную клеточную модель человеческого эпителия дыхательных путей, инокулированного риновирусом A16
Различные композиции тестировали на их способность оказывать защитный эффект в трехмерной модели человеческого эпителия дыхательных путей, состоящей из первичных человеческих эпителиальных клеток, свежевыделенных из назальных, трахеальных или бронхиальных образцов, полученных при биопсии (MucilAir™). MucilAir™ состоит из базальных клеток, реснитчатых клеток и слизистых клеток из дыхательных путей. Пропорция этих разных типов клеток сохранена в сравнении с той, которая имеет место in vivo (Huang et al., Drug Discovery and Development-Present and Future, 8, 201). Более того, эпителий начинает развиваться из дедифференцированных клеток. Эпителий (MucilAir™-пул) восстанавливали с использованием смеси клеток, полученных от 14 разных нормальных доноров носовых клеток, и культивировали в течение 41 дня. Эпителиальные клетки непосредственно перед использованием выделяли из образцов, полученных при биопсии (носа и бронхов), затем высевали на малопористую мембрану (Costar Transwell, размер пор 0,4 мкм). Через примерно 45 дней культивирования на границе раздела воздух-жидкость эпителий был полностью дифференцирован, как морфологически, так и функционально. Через 45 дней культивирования эпителий являлся полностью реснитчатым, секретировал слизь и не пропускал электрический ток (ТЭЭС >200 Ω⋅см2). Активность основных эпителиальных ионных каналов, таких как CFTR, EnaC, Na/K АТФаза, была сохранена, и было показано, что эпителий отвечает регулируемым и векторным образом на провоспалительный стимул, TNF-α (Huang et al., 2011 и Huang et al., 3R-Info-Bulletin No. 41, October 2009).
Композиции с разными активными ингредиентами готовили, как показано в Таблице 5. Каждую композицию готовили в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). В настоящем документе «HRV1» обозначает композиции, содержащие аполактоферрин (то есть, HRV1-1, HRV1-2 и HRV1-3) в качестве единственного активного ингредиента, «HRV2» обозначает композиции, содержащие лизоцим (то есть, HRV2-1, HRV2-2 и HRV2-3) в качестве единственного активного ингредиента и «HRV3» обозначает композиции, содержащие растворимую ICAM-1 (рICAM) (то есть, HRV3-1, HRV3-2 и HRV2-3) в качестве единственного активного ингредиента. «HRV4» обозначает композиции, содержащие сочетание аполактоферрина, лизоцима и растворимой ICAM-1.
Таблица 5
лизоцим (2500 мкг/мл)
растворимая ICAM-1 (50 мкг/мл)
лизоцим (250 мкг/мл)
растворимая ICAM-1 (5 мкг/мл)
лизоцим (25 мкг/мл)
растворимая ICAM-1 (0,5 мкг/мл)
20 мкл каждого препарата наносили апикально на отдельные MucilAir™-пулы непосредственно перед инокуляцией (время=0) человеческого риновируса A16. 20 мкл каждого из препаратов также наносили через 3,5 и 24 часа после инокуляции («п/и»). Инокуляцию человеческого риновируса A16 осуществляли путем нанесения 50 мкл 2×106/мл частиц человеческого риновируса A16 (клинический штамм: QCHRV.16) на апикальную сторону трехмерной модели на 3 ч в условиях 34°C, 5% CO2. Исходный вирусный материал получали в культурах MucilAir™ и разбавляли в культуральной среде без очистки или концентрирования.
После инокуляции (время=0) эпителий дважды промывали культуральной средой MucilAir™ для очистки от инокулята. Не содержащие клетки апикальные смывы (20 минут), полученные с использованием 200 мкл культуральной среды MucilAir™, собирали через 3,5 часа после инокуляции, а затем через 24 и 48 часов п/и, и хранили при -80°C.
Вирусную РНК экстрагировали из апикальных смывов с использованием набора QIAamp® для выделения вирусной РНК (Qiagen). Количественное определение вирусной РНК проводили методом количественной ОТ-ПЦР (QuantiTect Probe RT-PCR, Qiagen) с TaqMan ABI 7000. Используя известную концентрацию соответствующей вирусной РНК для построения стандартной кривой, определяли абсолютное количество. На графиках, показывающих результаты вирусной репликации, данные представлены в виде числа геномных копий/мл, если нет иных указаний. Эксперименты и данные, отмеченные знаком «(+)», являются экспериментами, проведенными на инокулированной среде, и эксперименты и данные, отмеченные знаком «(-)», являются экспериментами, проведенными на среде, не инокулированной вирусом. Для сравнения двух наборов данных использовали непарный критерий Стьюдента. Для сравнения средних значений для трех или более образцов, выполняли однофакторный дисперсионный анализ (ANOVA) с критериями Даннета для множественных сравнений (***=p<0,001, **=p<0,01, *=p<0,05). В качестве отрицательного контроля использовали не инфицированные и не обработанные культуры (базовый контроль).
Для сравнения потенциальных эффектов соединений HRV были включены положительные контроли. Для токсического эффекта культуры обрабатывали 20 мкл 10% раствора Triton X-100 в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). Для эффекта против риновируса 20 мкл 5 мкМ раствора рупинтривира добавляли к базовой среде. Маточный 2 мМ раствор рупинтривира (Santa Cruz Biotechnologies) в ДМСО (-20°C) разбавляли до концентрации 5 мкМ в среде MucilAir™ (конечная концентрация ДМСО 0,25%).
Планки погрешностей на любой фигуре соответствуют стандартной ошибке среднего (SEM). Все сравнения были проведены с данными, полученными при использовании растворителя для инфицированных клеток (без активного средства), и все данные представлены, как один результат для трех отдельных заложенных культур (n=3). Все приведенные результаты являются статистически значимыми.
Измерения ТЭЭС
Целостность ткани контролировали путем определения трансэпителиального электрического сопротивления («ТЭЭС»). ТЭЭС представляет собой отражающий состояние эпителия динамический параметр, на который могут оказывать влияние несколько факторов. Например, в случае наличия отверстий или нарушения контакта между клетками значения ТЭЭС, как правило, будут ниже 100 Ω⋅см2. Напротив, когда эпителий не поврежден, значения ТЭЭС, как правило, превышают 200 Ω⋅см2. Заметное снижение значений ТЭЭС (но >100 Ω⋅см2), как правило, отражает активацию ионных каналов. Резкое увеличение значений ТЭЭС отражает блокирование активности ионных каналов или разрушение реснитчатых клеток. Когда эпителий поврежден, снижение ТЭЭС будет связано с увеличением высвобождения ЛДГ или снижением жизнеспособности клеток. Мониторинг ТЭЭС проводили через 24 (D1) и 48 (D2) часов после инокуляции. При использовании Triton X-100 в качестве контроля значение ТЭЭС уменьшалось (<100 Ω⋅см²) после повреждения клеток. После добавления 200 мкл среды MucilAir™ в апикальный компартмент культур MucilAir™ сопротивление измеряли вольтомметром EVOMX (World Precision Instruments UK, Stevenage) для каждого состояния. Измеренные значения сопротивления (Ω) переводили в ТЭЭС (Ω⋅см2), с сопротивлением мембраны (100 Ω), соединенной последовательно с эпителием. Эпителий имел общую площадь поверхности 0,33 см2. ТЭЭС можно рассчитывать по следующей формуле:
ТЭЭС (Ω⋅см2)=(значение сопротивления (Ω) - 100(Ω)) x 0,33 (см2)
Результаты измерений ТЭЭС приведены на Фигурах 1-4. Как можно видеть, никакого существенного изменения ТЭЭС не наблюдается через 24 (D1) часа п/и или через 48 (D2) часов п/и в случае любого из препаратов HRV.
Высвобождение лактатдегидрогеназы
Лактатдегидрогеназа («ЛДГ») представляет собой стабильный цитоплазматический фермент, который быстро высвобождается в культуральную среду при разрыве плазматической мембраны. 100 мкл базолатеральной среды, собранной в каждой временной точке, инкубировали с реакционной смесью из набора для определения цитотоксичности Cytotoxicity Detection Kit PLUS, в соответствии с инструкциями производителя (Sigma, Roche, 11644793001). Затем количество высвободившейся ЛДГ количественно определяли, измеряя поглощение каждого образца при 490 нм на микропланшетном ридере. Для определения процента цитотоксичности разницу между значениями поглощения экспериментального образца (Aэкс) и низкого контроля делили на разницу между значениями поглощения высокого контроля (Aвыс) и низкого контроля (Aниз), с использованием следующей формулы:
Цитотоксичность (%)=(Aэксп - Aниз)/(Aвыс - Aниз)
Величина ниже 5% является показателем физиологического высвобождения ЛДГ в среду. Измерения ЛДГ проводили через 24 и 48 часов п/и. Результаты приведены на Фигурах 5-8. Как можно видеть, препараты терапевтического средства не приводили к увеличению высвобождения ЛДГ в трехмерных моделях.
Частота колебания ресничек
Частоту колебания ресничек («ЧКР») измеряли с использованием экспериментальной системы, состоящей из трех частей: камеры (Sony XCD V60 Firewire), карты PCI и специального пакета программ. Было получено 256 изображений с высокой частотой (125 кадров в секунду) при комнатной температуре, и затем частоту колебания ресничек рассчитывали при помощи программы Epithelix. Значения ЧКР могут быть подвержены флуктуациям в зависимости от таких параметров, как температура, вязкость слизи или жидкость (например, буферный солевой раствор), нанесенная на апикальную поверхность трехмерной модели эпителия MucilAir™. Вследствие этого, результаты считают значимыми, когда достигнута разница >20% между инфицированными клетками с контрольным растворителем и с композицией лекарственного средства. Фигуры 9-12 демонстрируют результаты измерений частоты колебания ресничек, проведенных через 24 и 48 часов п/и. Как можно видеть, лекарственные препараты HRV не влияют существенным образом на частоту колебания ресничек.
Мукоцилиарный клиренс
Мукоцилиарный клиренс («МЦК») контролировали с использованием камеры Sony XCD-U100CR, соединенной с микроскопом Olympus BX51 с 5x объективом. Полистирольные микрогранулы с диаметром 30 мкм (Sigma, 84135) добавляли на апикальную поверхность MucilAir™. Движение микрогранул записывали на видео со скоростью 2 кадра в секунду, получая 30 изображений, при комнатной температуре. Проводили по три съемки для каждой заложенной культуры. Среднюю скорость движения гранул (мкм/сек) рассчитывали при помощи программы ImageProPlus 6.0. Значения мукоцилиарного клиренса менее 10 мкм/с считали патологическими. На Фигуре 13 показан эффект инфекции, вызванной риновирусом A16, на МЦК при воздействии каждого из активных компонентов в отдельности и в сочетании, измеренный через 48 часов п/и. Как можно видеть, комбинированное воздействие приводит к более выраженной и постоянной реакции при всех протестированных дозах, в сравнении с другими тестируемыми препаратами. МЦК был снижен при использовании более низких концентраций препаратов HRV1 и препарата HRV3-3. Однако эти отрицательные эффекты отсутствовали при использовании препаратов HRV4 в любой концентрации. Удивительно, что, хотя аполактоферрин, используемый отдельно, в некоторых дозах ингибировал движение ресничек (смотри, например, HRV1-1 и HRV1-2), этот эффект был значительно ослаблен в случае использования сочетания HRV в каждой дозе.
Апикальная репликация риновируса
Из 200 мкл апикальных смывов 20 мкл использовали для экстрагирования вирусной РНК с использованием набора QIAamp® для выделения вирусной РНК (Qiagen), получая объем 60 мкл элюированной РНК. Количество вирусной РНК определяли методом количественной ОТ-ПЦР (QuantiTect Probe RT-PCR, Qiagen), используя 5 мкл вирусной РНК, Mastermix, два праймера, специфических для семейства Picornaviridae и пан-Picornaviridae, и зонд для Picornaviridae с репортерным гасителем-красителем FAM-TAMRA. Были включены четыре разведения известной концентрации риновируса A16, а также контроли для экстрагирования РНК и ОТ-ПЦР, и планшеты анализировали на приборе TaqMan ABI 7000 от компании Applied Biosystems. На основании полученных данных - импульсов («имп») строили стандартную кривую, выполняли коррекцию на разбавление, данные представляли в виде числа геномных копий/мл. На Фигурах 14-17 показаны результаты анализа репликации риновируса A16. Как можно видеть, имела место значительная репликация риновируса, которую ингибировал рупинтривир. Использование препаратов HRV1 и HRV2 не приводило к существенному ингибированию репликации риновируса. Применение препаратов HRV3 имело зависимый от дозы эффект, аналогичный таковому у рупинтривира. Препараты HRV4 имели зависимый от дозы эффект на репликацию риновируса A16 в гораздо большей степени, чем воздействие рупинтривира.
Иммуноферментный анализ лектина
Секрецию муцина количественно определяли с использованием протокола для иммуноферментного анализа лектина («ELLA»), позволяющего определять углеводные группы собранной слизи. Лунки 96-луночных планшетов покрывали лектином из Triticum vulgaris (пшеница) (Sigma, L0636) с концентрацией 6 мкг/мл в фосфатном буферном растворе («PBS») с pH, доведенным до 6,8, и инкубировали в течение 1 часа при 37°C. После этапов промывания фосфатно-солевым буфером (PBS) с высоким содержанием соли (0,5 M NaCl, 0,1% твин-20 в PBS) образцы и стандарты (муцин II типа из свиного желудка, Sigma, M2378) инкубировали в течение 30 минут при 37°C. После промывания планшеты инкубировали в течение 30 минут при 37°C с обнаруживающим раствором, содержащим конъюгированный с пероксидазой лектин из Glycine max (соя) (Sigma, L2650) с концентрацией 1 мкг/мл в 0,1% БСА-PBS, pH 7,4. После завершающих этапов промывания добавляли реагент субстрата (TMB) и инкубировали 10 минут в темноте при комнатной температуре. Реакцию останавливали 2Н H2SO4, и показания с планшетов снимали при 450 нм. На Фигурах 18-21 показано количество муцина из апикальной среды через 24 и 48 часов. Как можно видеть, тестируемые препараты HRV существенно не влияли на секрецию муцина.
Пример 5: Определение эффекта композиций на полностью дифференцированную трехмерную клеточную модель человеческого эпителия дыхательных путей, инокулированного вирусом гриппа A H1N1
Эпителий (MucilAir™-пул) восстанавливали с использованием смеси клеток, полученных от 14 разных нормальных доноров носовых клеток, и культивировали в течение 41 дня. Композиции с разными активными ингредиентами готовили, как показано в Таблице 6. Каждую композицию готовили в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). В настоящем документе «IAV1» обозначает композиции, содержащие аполактоферрин (то есть, IAV1-1, IAV 1-2 и IAV 1-3), «IAV2» обозначает композиции, содержащие лизоцим (то есть, IAV 2-1, IAV 2-2 и IAV 2-3) и «IAV3» обозначает композиции, содержащие растворимую ICAM-1 (то есть, IAV 3-1, IAV 3-2 и IAV 2-3). «IAV4» обозначает иллюстративные композиции, содержащие сочетание аполактоферрина, лизоцима, 3'-сиалиллактозы и 6'-сиалиллактозы. Эти различные тестируемые препараты приведены ниже в Таблице 6.
Таблица 6
6'-сиалиллактоза (327 мкг/мл)
6'-сиалиллактоза (3,27 мкг/мл)
6'-сиалиллактоза (0,327 мкг/мл)
лизоцим (2500 мкг/мл)
3'-сиалиллактоза (327 мкг/мл)
6'-сиалиллактоза (327 мкг/мл)
лизоцим (250 мкг/мл)
3'-сиалиллактоза (3,27 мкг/мл)
6'-сиалиллактоза (3,27 мкг/мл)
лизоцим (25 мкг/мл)
3'-сиалиллактоза (0,327 мкг/мл)
6'-сиалиллактоза (0,327 мкг/мл))
20 мкл каждого препарата наносили апикально на отдельные MucilAir™-пулы непосредственно перед инокуляцией вируса гриппа A H1N1. 20 мкл каждого из препаратов также наносили через 3,5 и 24 часа после инокуляции. Инокуляцию вируса гриппа A H1N1 (t=0) осуществляли путем нанесения 50 мкл 2×106/мл частиц H1N1 (клинический штамм: A/California/7/09) на апикальную сторону ткани MucilAir™ на 3 ч в условиях 34°C, 5% CO2. Исходный вирусный материал получали в культурах MucilAir™ и разбавляли в культуральной среде без очистки или концентрирования. Измерения ТЭЭС, высвобождения ЛДГ, ЧКР, МЦК и секреции муцина выполняли аналогично тому, как описано выше, за исключением того, что 10 мкМ озельтамивир использовали вместо рупинтривира в качестве препарата с противовирусным эффектом. Для получения противовирусного эффекта 10 мкМ озельтамивир добавляли к базовой среде. Маточный раствор кислоты озельтамивира (Carbosynth) с концентрацией 4 мМ в ДМСО (-20°C) разбавляли до концентрации 10 мкМ в базолатеральной среде MucilAir™ (конечная концентрация ДМСО 0,25%).
Измерения ТЭЭС
На Фигурах 22-25 представлены результаты измерений ТЭЭС в экспериментах с вирусом гриппа A H1N1. Как можно видеть, цитопатический эффект вируса гриппа вызывал снижение значений сопротивления ТЭЭС. Тестируемые препараты IAV3 и IAV4, как представляется, ограничивают уменьшение ТЭЭС через 48 часов (D2) п/и, при этом уменьшение потери сопротивления наиболее выражено в случае препаратов, содержащих активные ингредиенты в более высоких концентрациях (то есть, IAV4-2 и IAV4-1).
Высвобождение лактатдегидрогеназы
На Фигурах 26-29 представлены результаты измерений высвобождения ЛДГ из эпителиальных клеток. Как можно видеть, при использовании любого из препаратов IAV цитотоксический эффект отсутствует.
Частота колебания ресничек
На Фигурах 30-33 показаны эффекты различных препаратов на ЧКР эпителиальных клеток при инфицировании вирусом гриппа H1N1. Как можно видеть, IAV4 не оказывает существенного влияния на ЧКР.
Мукоцилиарный клиренс
На Фигуре 34 представлены результаты измерений мукоцилиарного клиренса после обработки конкретными тестируемыми препаратами. Как можно видеть, препараты IAV не оказывают существенного влияния на мукоцилиарный клиренс.
Апикальная репликация вируса гриппа
Из 200 мкл апикальных смывов 20 мкл использовали для экстрагирования вирусной РНК с использованием набора QIAamp® для выделения вирусной РНК (Qiagen), получая объем 60 мкл элюированной РНК. Количество вирусной РНК определяли методом количественной ОТ-ПЦР (QuantiTect Probe RT-PCR, Qiagen), используя 5 мкл вирусной РНК, Mastermix, два праймера, специфических для вируса гриппа A, и зонд, специфичный для вируса гриппа A, с репортерным гасителем-красителем FAM-TAMRA. Были включены четыре разведения известной концентрации H1N1, а также контроли для экстрагирования РНК и ОТ-ПЦР, и планшеты анализировали на приборе TaqMan ABI 7000 от компании Applied Biosystems. На основании полученных данных - импульсов строили стандартную кривую, выполняли коррекцию на разбавление, данные представляли в виде числа геномных копий/мл. На Фигурах 35-38 показаны результаты анализа репликации вируса гриппа A HIN1 в присутствии указанного тестируемого препарата. Как можно видеть, имела место значительная репликация вируса гриппа, которую ингибировал озельтамивир. При использовании препаратов IAV отсутствовало значительное изменение репликации вируса гриппа A H1N1.
Иммуноферментный анализ лектина
На Фигурах 39-42 показано количество муцина из апикальной среды через 24 (D1) и 48 (D2) часов п/и. Как можно видеть, IAV4 оказывал зависимый от дозы эффект на секрецию муцина.
Как показали измерения ТЭЭС, инфекция, вызываемая H1N1, приводит к потере целостности ткани эпителия дыхательных путей человека, результатом чего является нарушение барьерной функции дыхательных путей. Это приводит к дальнейшей инфекции и воспалению. Снижение ТЭЭС представляет собой самый ранний и наиболее чувствительный параметр, на который влияет инфицирование H1N1. Комбинированные препараты IAV3 и IAV4 приводят к частичному уменьшению этого нарушения целостности ткани. Кроме того, данные препараты предотвращают любые отрицательные эффекты на ЧКР, которые видны в случае использования препаратов IAV1 и IAV2.
При том, что подробно описан ряд предпочтительных вариантов осуществления настоящего изобретения, следует понимать, что изобретение, раскрытое в приведенных выше параграфах, не ограничивается конкретными подробностями, изложенными в вышеприведенном описании, поскольку множество очевидных вариаций возможны без отклонения от сущности и объема настоящего изобретения.
Все документы, цитированные или приведенные посредством ссылки в настоящем документе, а также все документы, цитированные или приведенные посредством ссылки в цитированных в настоящем документе литературных источниках, наряду с любыми инструкциями производителей, описаниями, спецификациями продуктов и инструкциями к продуктам для любых продуктов, упомянутых в настоящем документе или любом документе, включенным в него посредством ссылки, включены в настоящий документ посредством ссылки и могут быть использованы при осуществлении на практике настоящего изобретения.
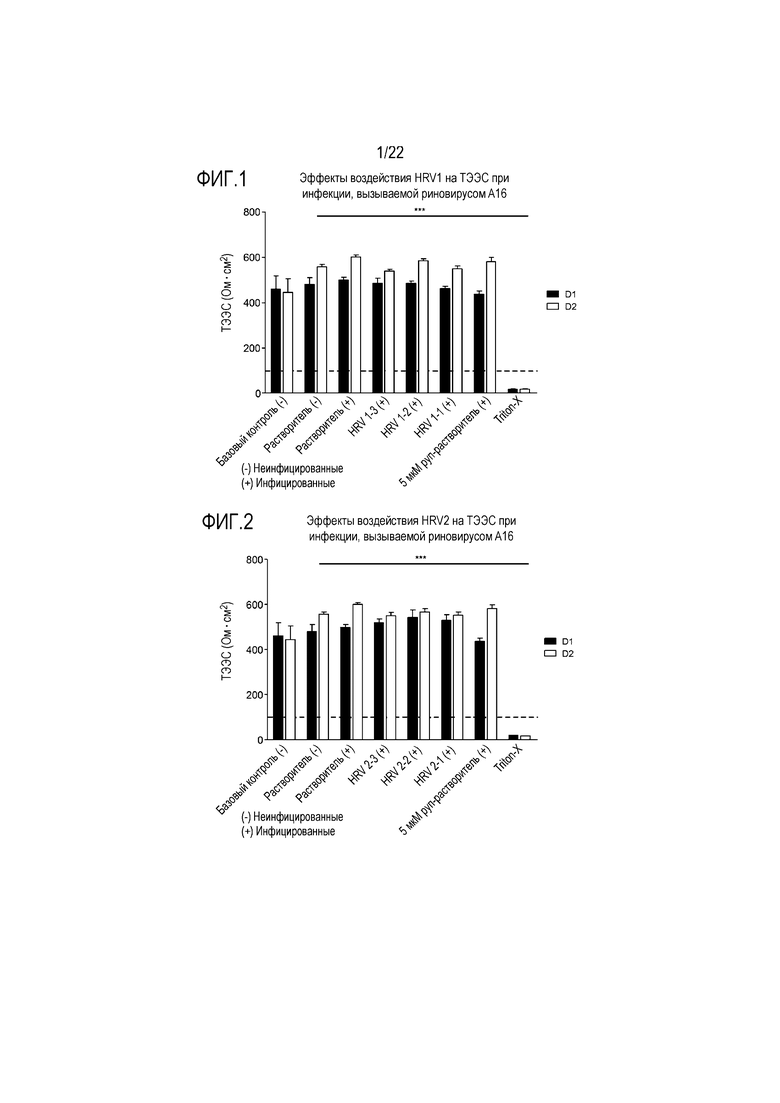
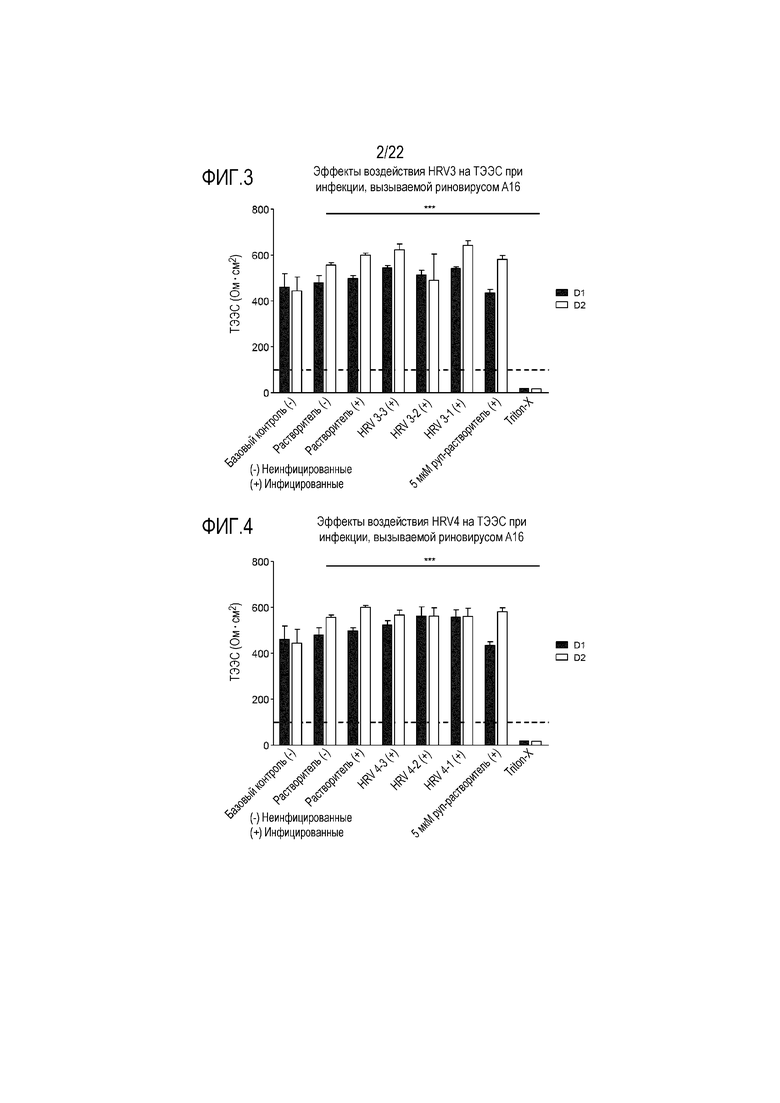

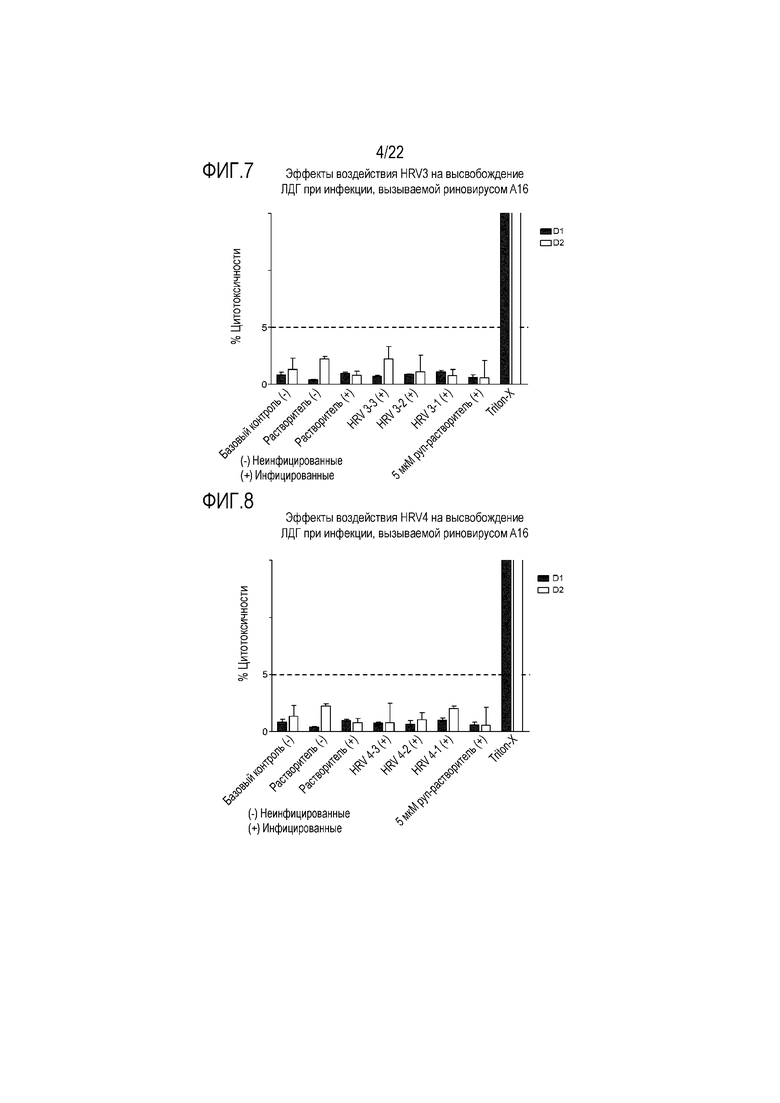
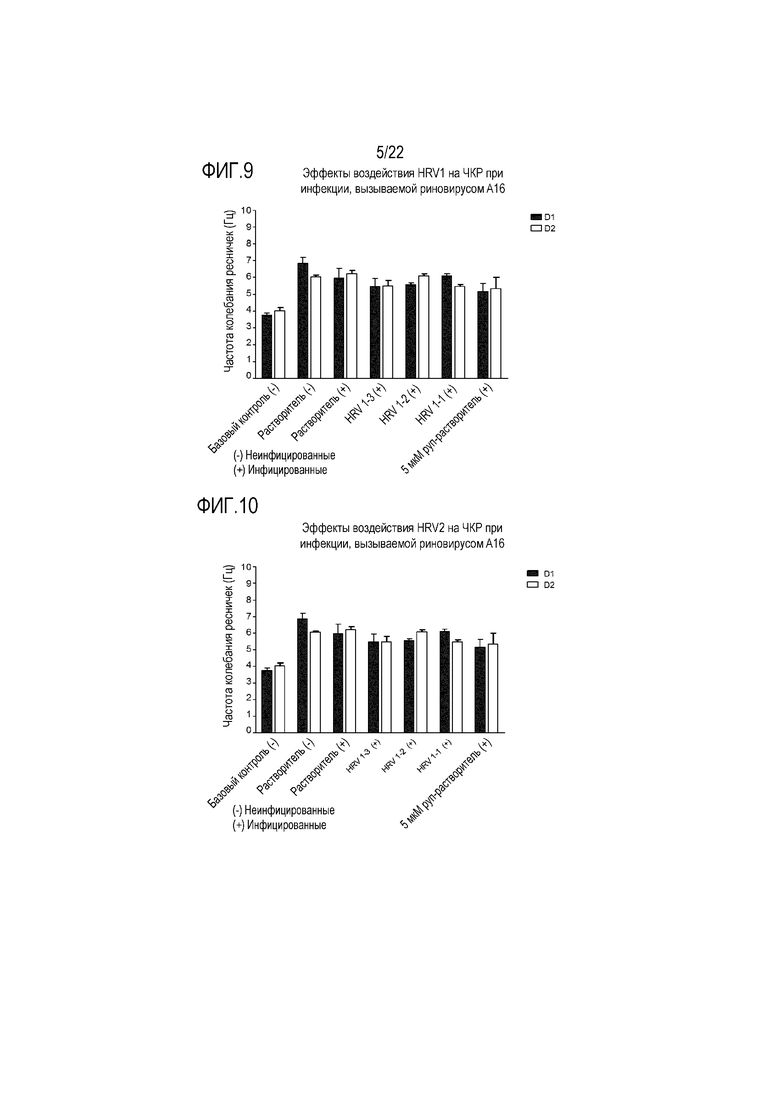
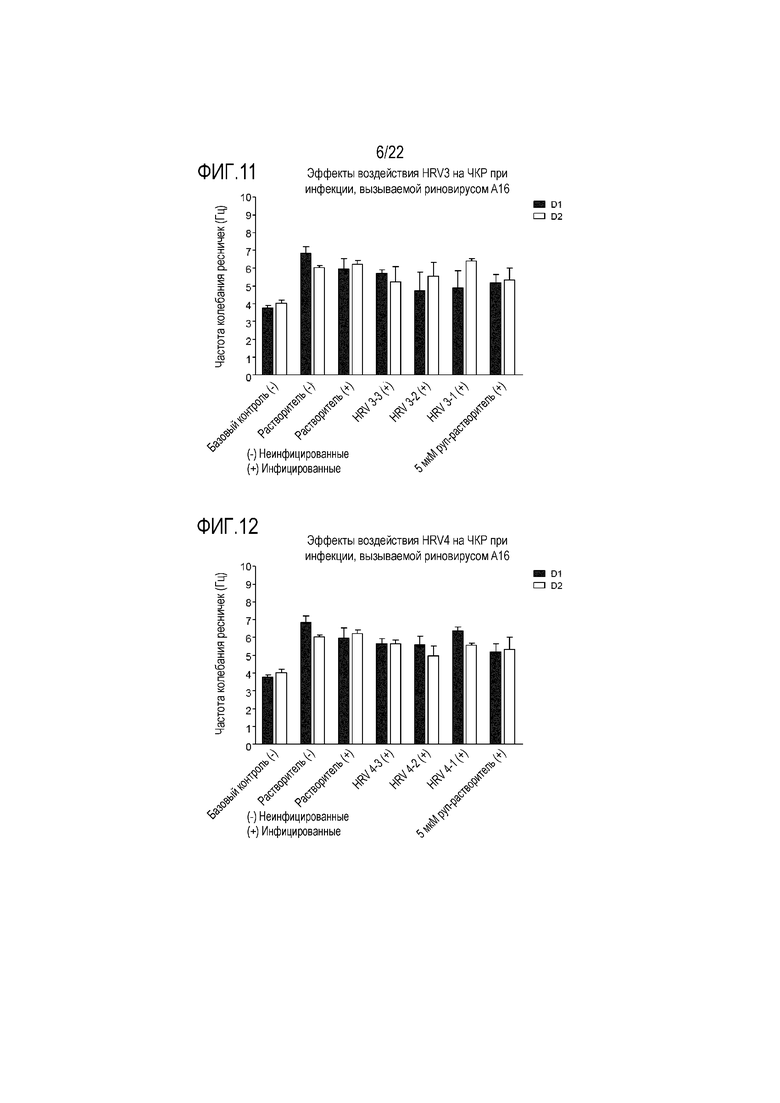
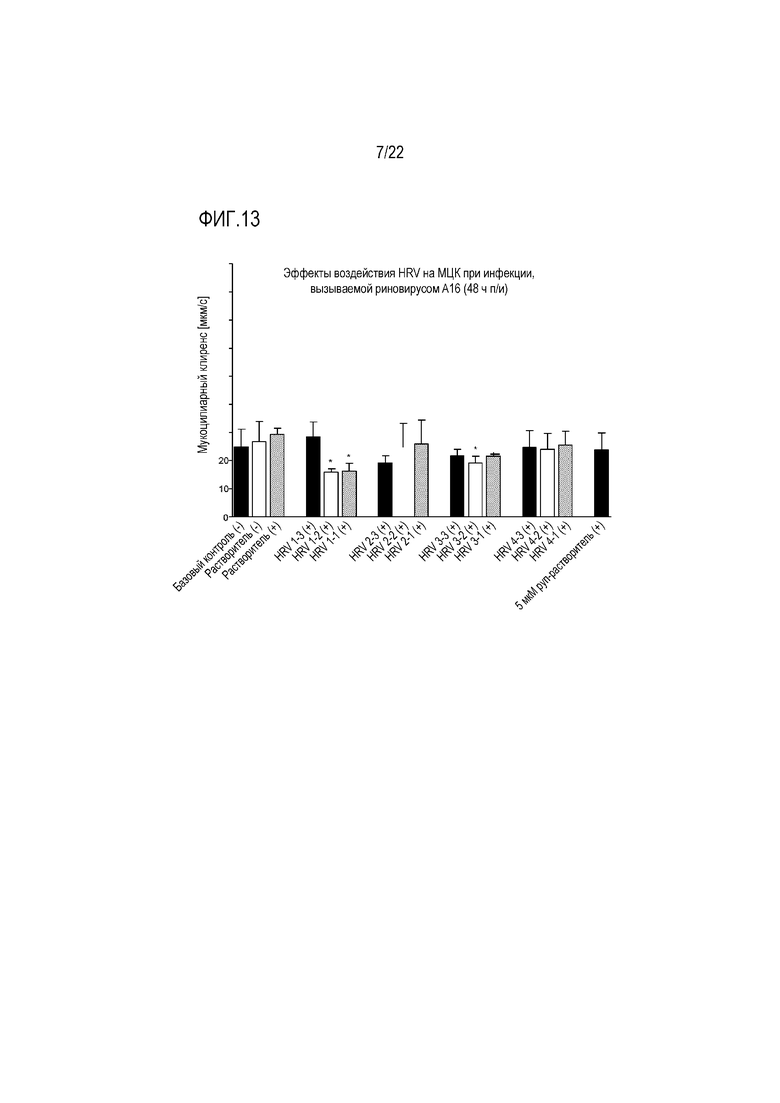

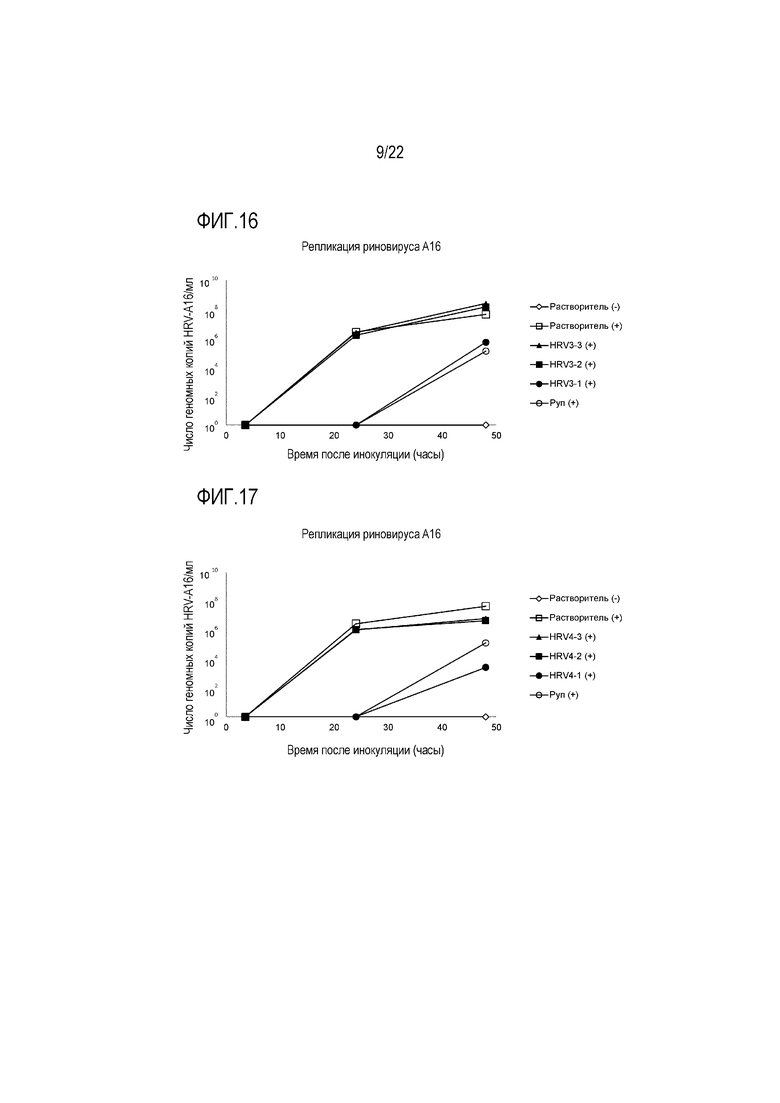
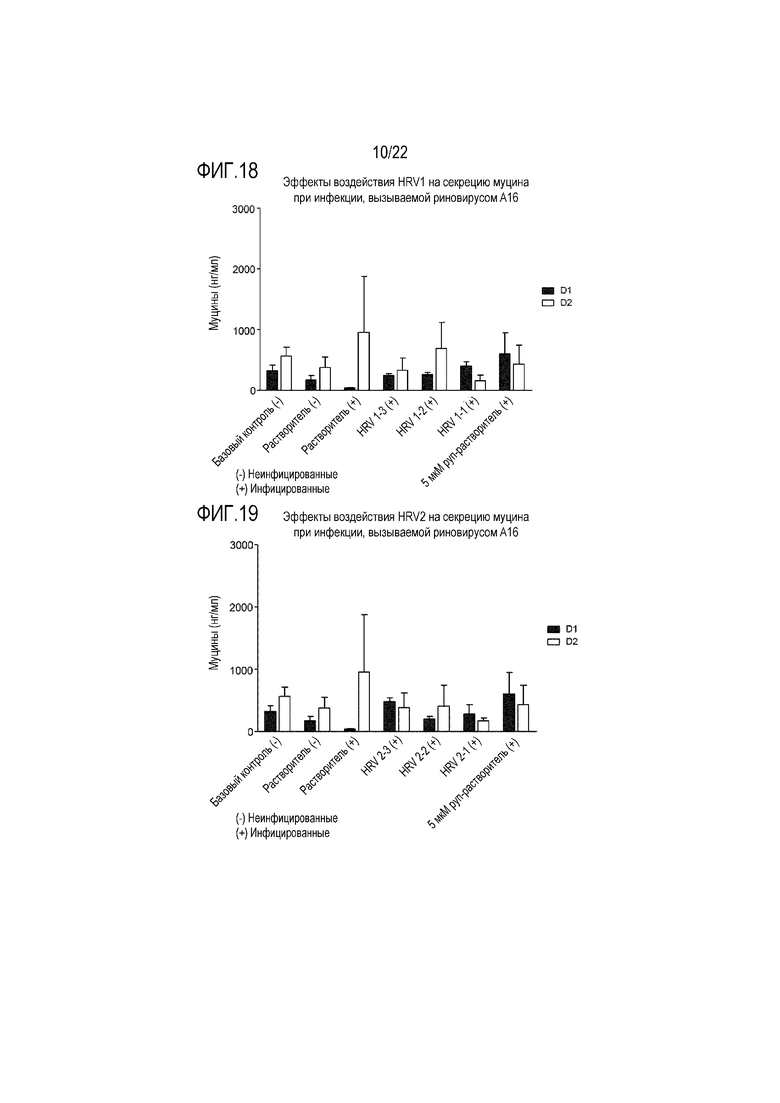
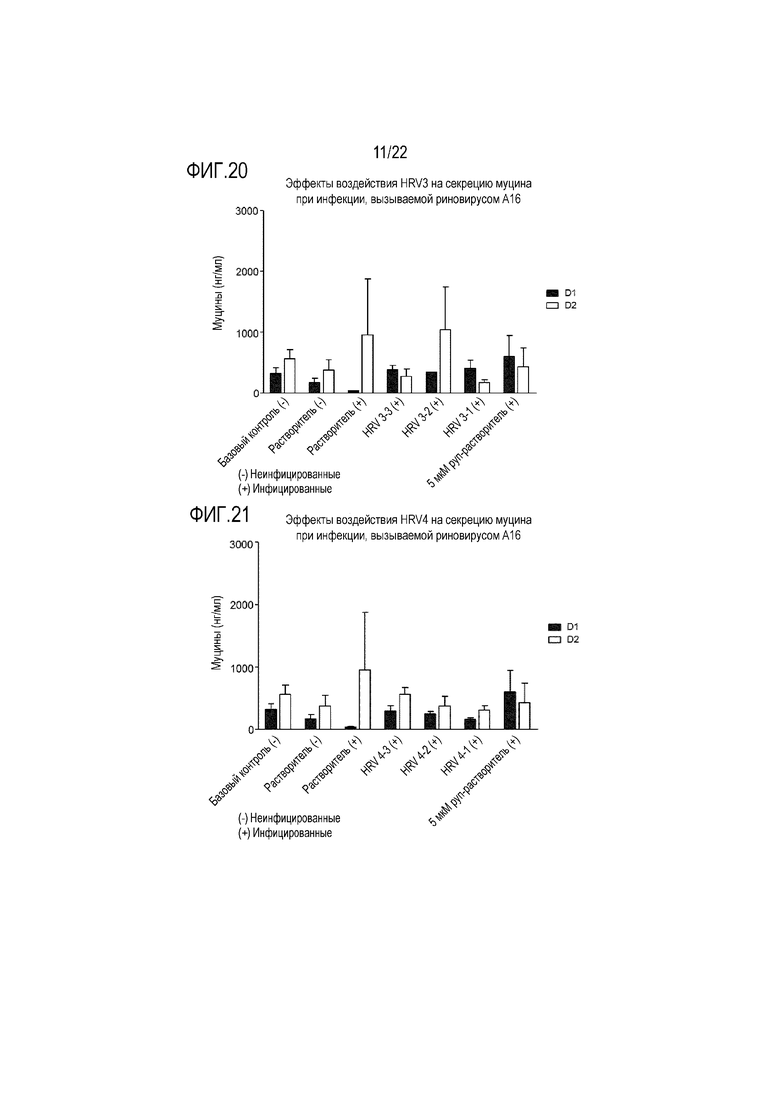
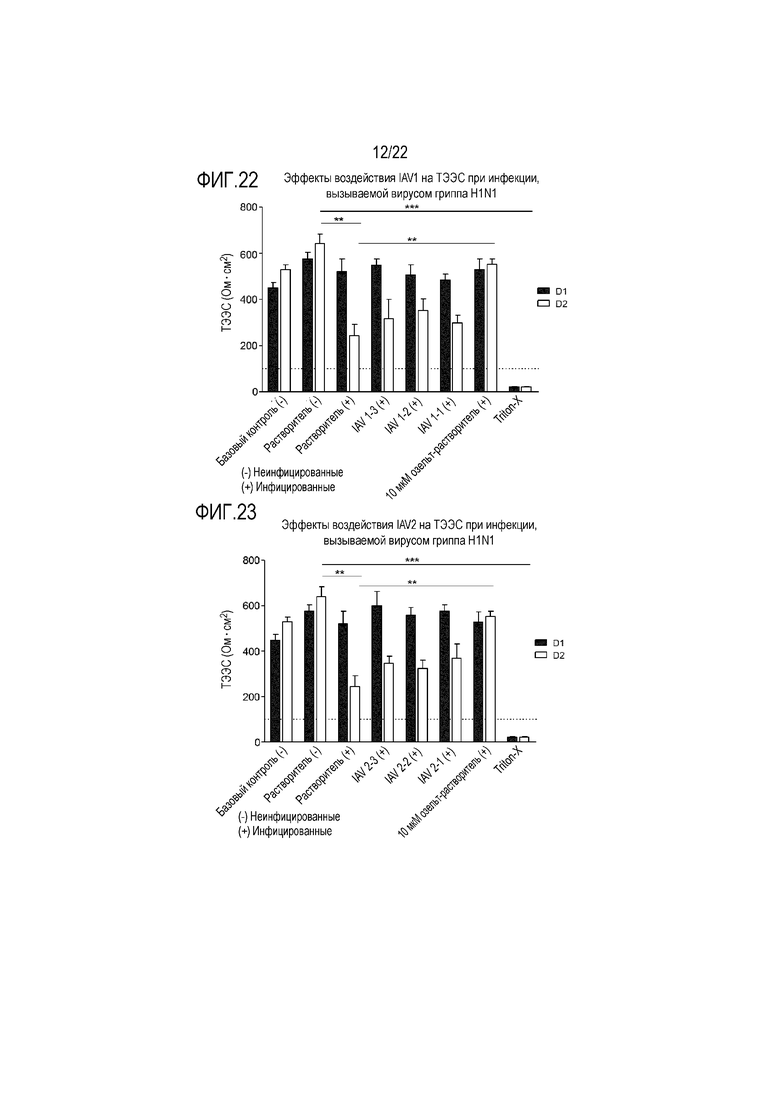
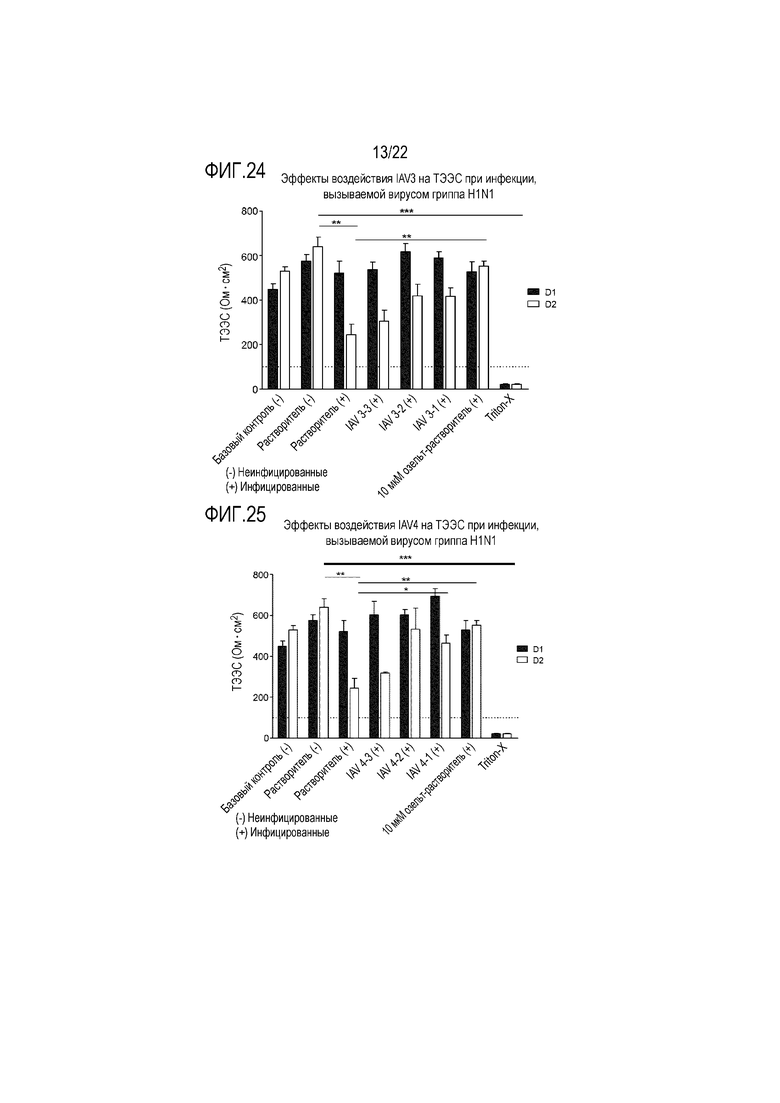
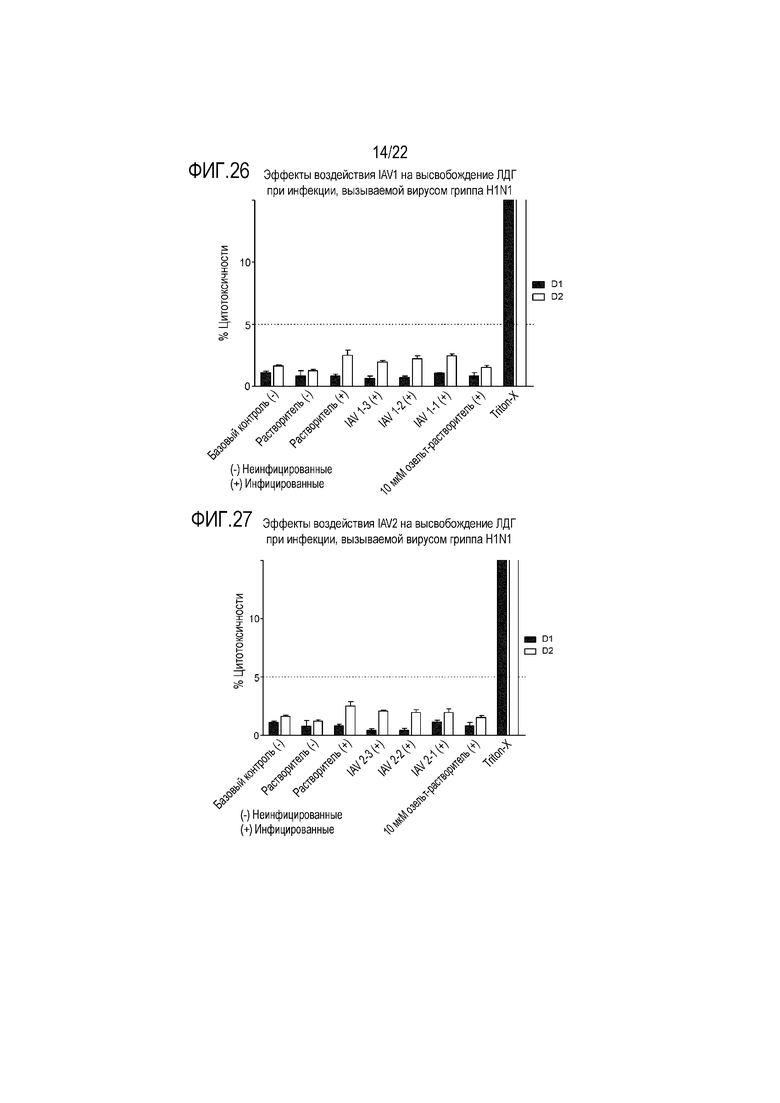
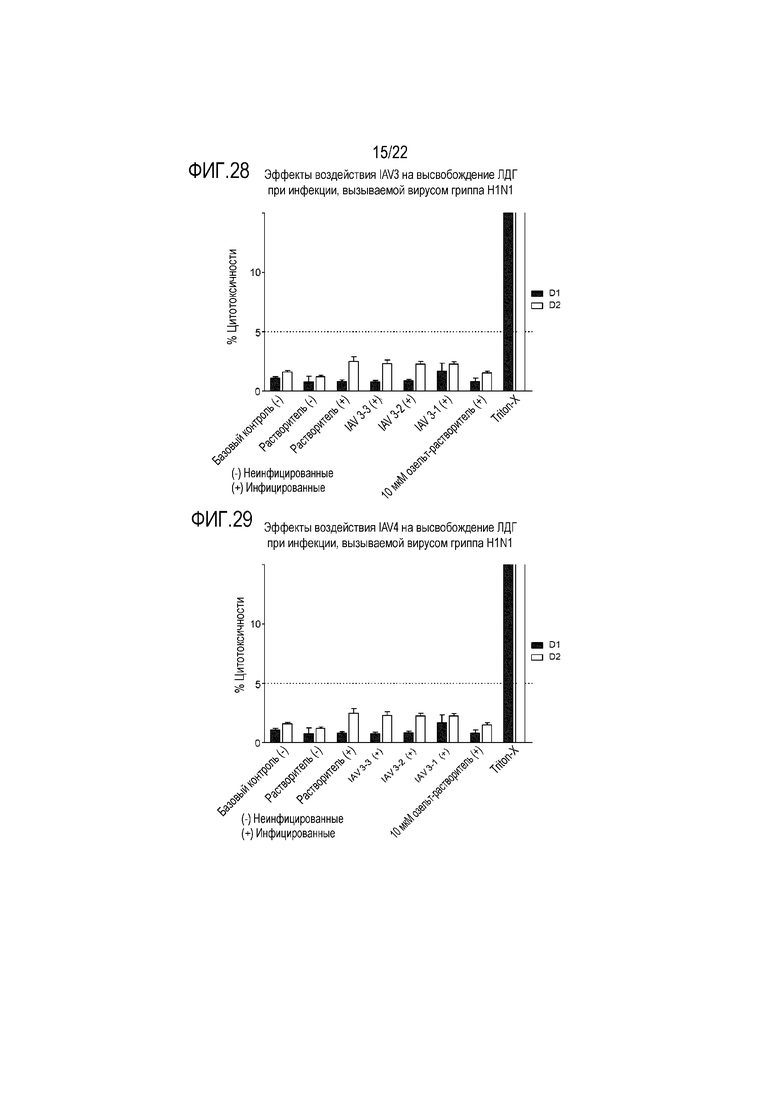
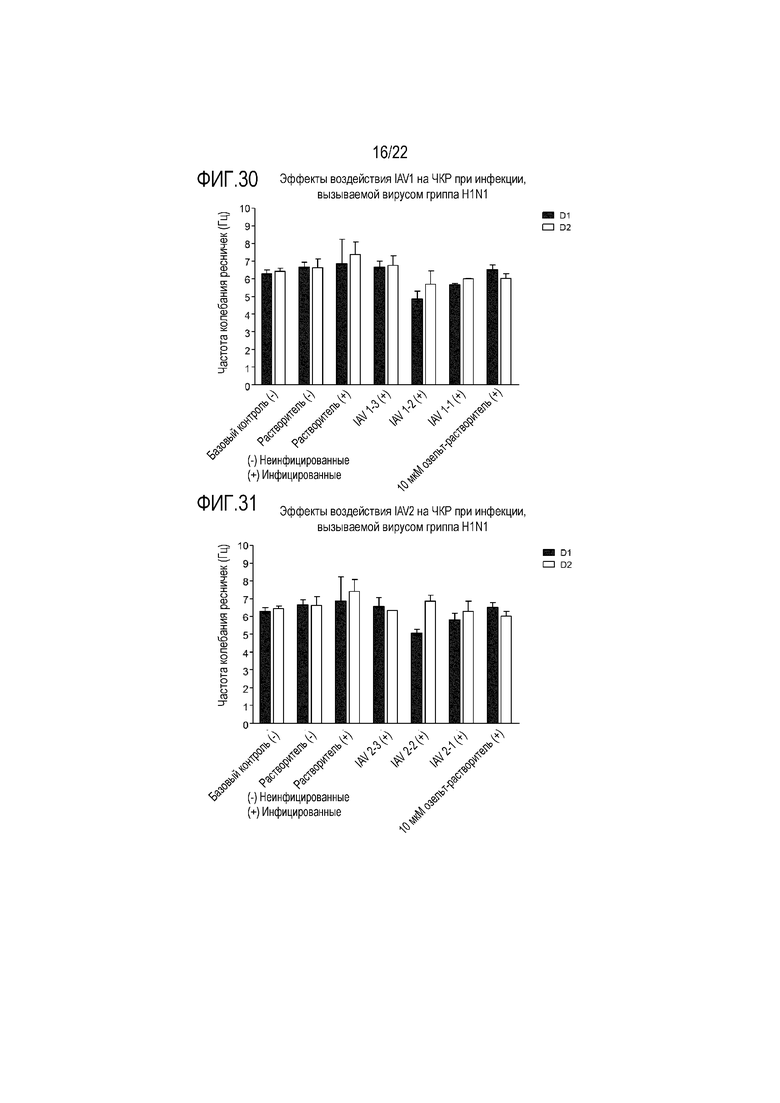
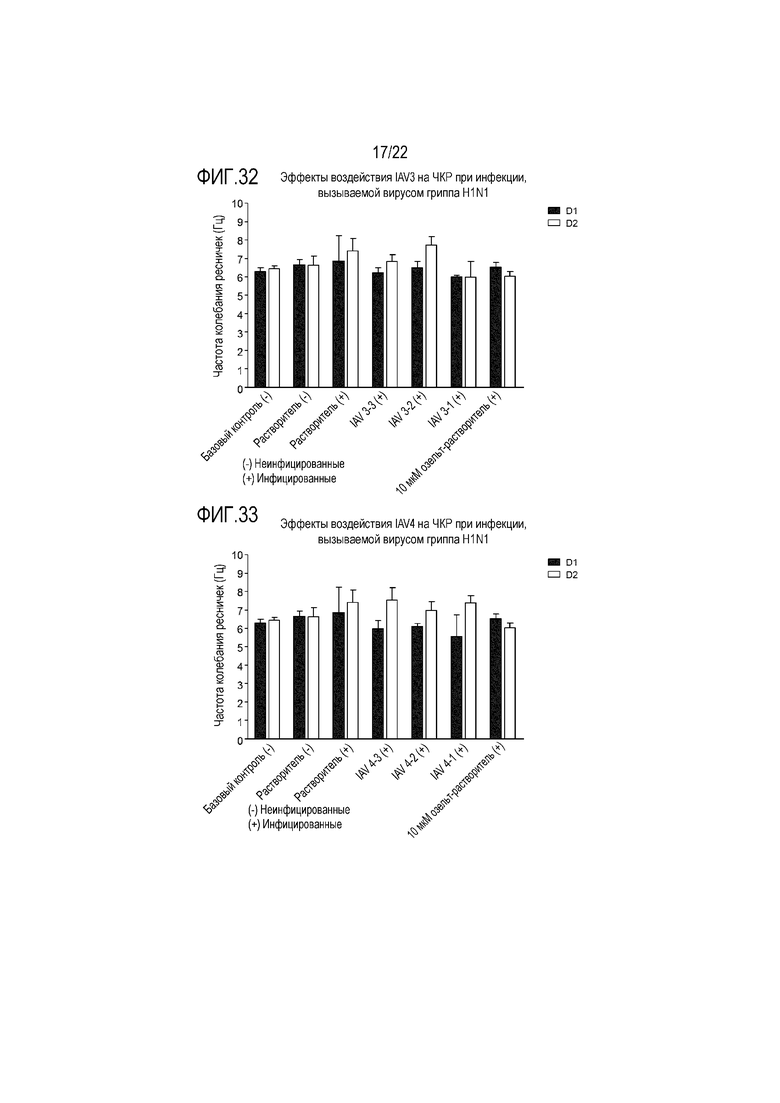
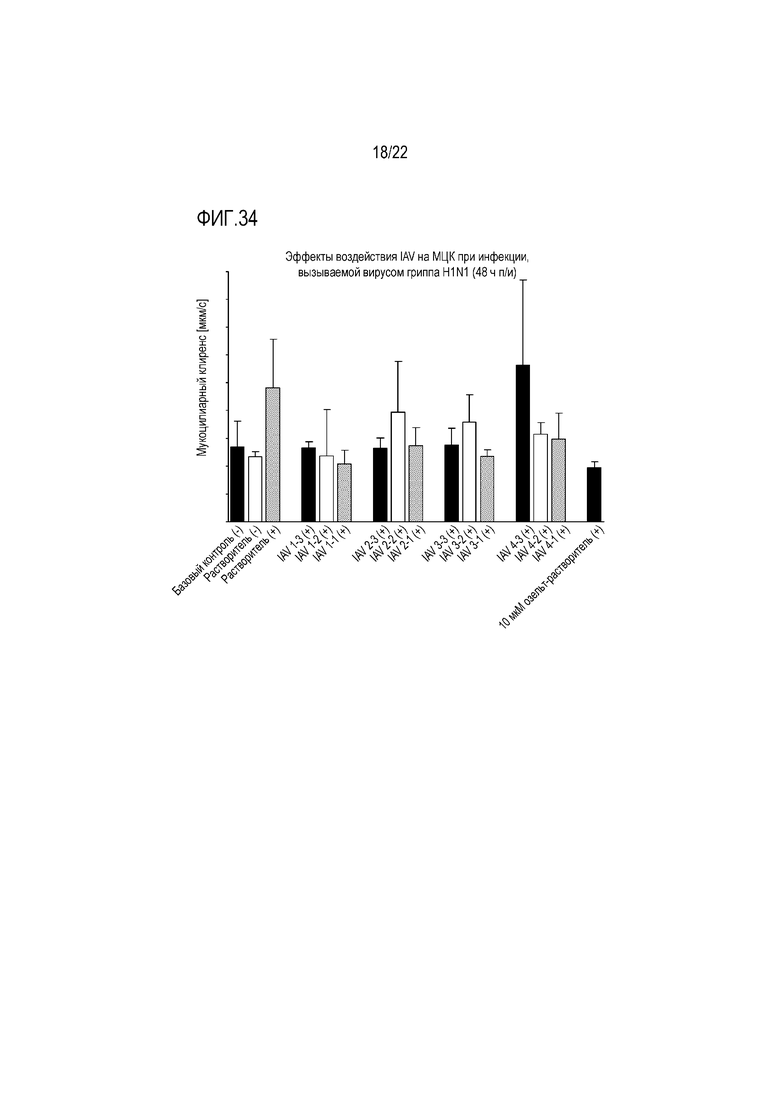

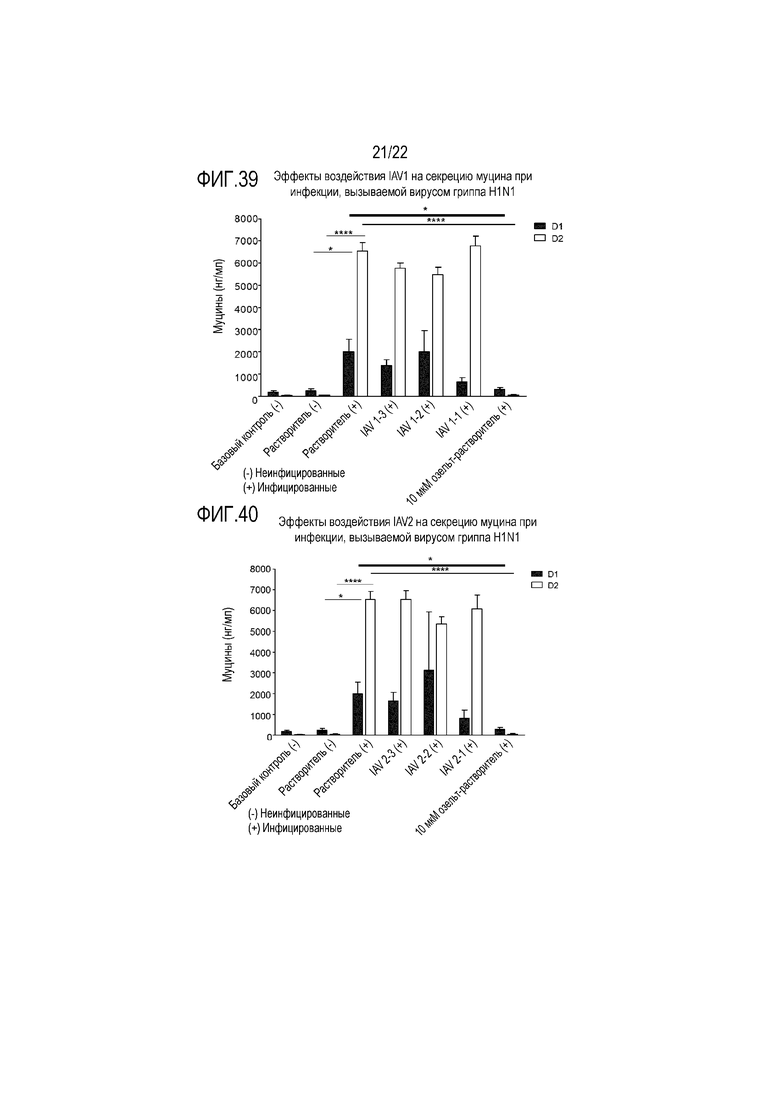

Настоящее изобретение относится к фармацевтическим композициям и способам для предотвращения респираторной инфекции, вызываемой человеческим риновирусом (HRV) и человеческим вирусом гриппа. В частности предложена фармацевтическая композиция для предотвращения инфекции у человека, вызванной риновирусом, содержащая: (i) растворимую ICAM-1, (ii) лизоцим, (iii) лактоферрин, а также фармацевтически приемлемый носитель. Изобретение позволяет усилить способность оболочек дыхательных путей фильтровать присутствующие в воздухе патогены и защищать субъекта от респираторной инфекции, возникающей в результате вдыхания таких патогенов. 4 н. и 16 з.п. ф-лы, 42 ил., 6 табл., 5 пр.
1. Фармацевтическая композиция для предотвращения инфекции у человека, вызванной риновирусом, содержащая:
(i) растворимую ICAM-1;
(ii) лизоцим; и
(iii) лактоферрин; а также
фармацевтически приемлемый носитель.
2. Фармацевтическая композиция по п. 1, имеющая форму назального спрея, назальных капель, перорального спрея, полоскания для рта или пастилки.
3. Фармацевтическая композиция по любому из пп. 1, 2, дополнительно содержащая одно или более из пероксида цинка, меди и серебра.
4. Фармацевтическая композиция по любому из пп. 1-3, дополнительно содержащая ингибитор нейраминидазы и/или каррагинан.
5. Фармацевтическая композиция по любому из пп. 1-4, дополнительно содержащая одно или более из IgA, IgG и IgM.
6. Композиция по любому из пп. 1-5, дополнительно содержащая один или более ингредиентов, выбранных из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры плодов цитрусовых, экстракта меда, экстракта розмарина, экстракта мирры, экстракта бессмертника, экстракта маранты, масла семян маргозы, витамина C, витамина E и экстракта семян грейпфрута.
7. Фармацевтическая композиция по любому из пп. 1-6, отличающаяся тем, что ингибитор нейраминидазы выбирают из группы, состоящей из кверцетина, озельтамивира, занамивира, ланинамивира и перамивира.
8. Композиция по любому из пп. 1-6, сформированная в виде микросфер.
9. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанный носитель адаптирован для обеспечения времени удержания указанной композиции на слизистой оболочке носовой и/или ротовой полости, составляющего по меньшей мере 1 минуту, или по меньшей мере 5 минут, или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут.
10. Фармацевтическая композиция по п. 1, отличающаяся тем, что указанный фармацевтически приемлемый носитель представляет собой водный раствор, содержащий примерно 5-50% (об./об.) или примерно 10-40% (об./об.), или примерно 15-35% (об./об.), или примерно 20-30% (об./об.) 1,3-пропандиола.
11. Композиция по п. 1, в которой компоненты (i)-(iii) диспергированы в жидком носителе, содержащем примерно 60-90% (об./об.) воды и примерно 10-40% (или 20-30%) (об./об.) полиола, при этом указанная композиция может быть распылена на слизистую оболочку и способна оставаться на слизистой оболочке в течение по меньшей мере 5 минут (или по меньшей мере 10 минут, или по меньшей мере 15 минут, или по меньшей мере 20 минут, или по меньшей мере 25 минут, или по меньшей мере 30 минут) после нанесения, без существенного раздражения или высушивания слизистой оболочки.
12. Композиция по п. 11, отличающаяся тем, что указанный полиол представляет собой 1,3-пропандиол.
13. Способ предотвращения инфекции у человека, вызванной риновирусом, включающий:
введение на слизистую оболочку носовой или ротовой полости человека композиции, содержащей:
(i) растворимую ICAM-1 или ингибитор ICAM-1 и/или сиаловую кислоту (например, сиалиллактозу);
(ii) лизоцим;
(iii) лактоферрин; а также
фармацевтически приемлемый носитель.
14. Способ по п. 13, отличающийся тем, что указанная композиция имеет форму назального спрея, назальных капель, перорального спрея, полоскания для рта или пастилки.
15. Способ по п. 13 или 14, отличающийся тем, что указанная композиция дополнительно содержит одно или более из пероксида цинка, меди и серебра.
16. Способ по любому из пп. 13-15, отличающийся тем, что указанная композиция дополнительно содержит одно или более из IgA, IgG, и IgM.
17. Способ по любому из пп. 13-16, при этом ингибитор нейраминидазы выбирают из группы, состоящей из кверцетина, озельтамивира, занамивира, ланинамивира и перамивира.
18. Способ по любому из пп. 13-17, дополнительно включающий использование одного или более ингредиентов, выбранных из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры плодов цитрусовых, экстракта меда, экстракта розмарина, экстракта мирры, экстракта бессмертника, экстракта маранты, масла семян маргозы, витамина C, витамина E и экстракта семян грейпфрута.
19. Фармацевтическая композиция для предотвращения инфекции у человека, вызванной вирусом гриппа, содержащая:
(i) сиаловую кислоту (например, сиалиллактозу);
(ii) лизоцим; и
(iii) лактоферрин; а также
фармацевтически приемлемый носитель.
20. Способ предотвращения инфекции у человека, вызванной вирусом гриппа, включающий:
введение на слизистую оболочку носовой или ротовой полости человека композиции, содержащей:
(i) сиаловую кислоту (например, сиалиллактозу);
(ii) лизоцим;
(iii) лактоферрин; а также
фармацевтически приемлемый носитель.
| CN 100493605 C, 03.07.2009 | |||
| KR 101119538 B1, 22.02.2012 | |||
| US 20130034542 A1, 07.02.2013 | |||
| MARLIN S.D | |||
| et al., A soluble form of intercellular adhesion molecule-1 inhibits rhinovirus infection, NATURE, 1990, v | |||
| Способ получения жидкой протравы для основных красителей | 1923 |
|
SU344A1 |
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| АНАЛИЗАТОР ЗЕРНОВЫХ СМЕСЕЙ | 2008 |
|
RU2374008C1 |
| EP 2845606 A1, 11.03.2015 | |||
| ЮЛИШ Е.И., Факторы местного иммунитета при респираторных инфекциях и | |||
Авторы
Даты
2022-05-31—Публикация
2017-02-24—Подача