Область техники
Настоящее изобретение относится к области профилактики или лечения обострений хронических болезней легких, таких как хроническая обструктивная болезнь легких и бронхоэктаз без кистозного фиброза, путем введения поликлонального иммуноглобулина в дыхательные пути, а в частности, путем прямого нанесения аэрозольной композиции, содержащей поликлональный иммуноглобулин.
Предшествующий уровень техники
Хронические болезни легких, а особенно болезни, которые вызывают обострения, в том случае, когда основным инициирующим фактором являются инфекции, характеризуются тем, что индивидууму трудно полностью выдыхать воздух из легких. Из-за затрудненного выдоха всего воздуха из легких, у пациентов с такой хронической болезнью легких возникает одышка. Из-за повреждения легких или сужения дыхательных путей внутри легких, выдыхаемый воздух выходит медленнее, чем обычно. В конце полного выдоха, в легких все еще может оставаться аномально большое количество воздуха. Хроническая обструктивная болезнь легких (ХОБЛ) и бронхоэктаз без кистозного фиброза (БЭБКФ) являются примерами таких хронических болезней легких. ХОБЛ характеризуется постоянным ограничением воздушного потока, которое обычно прогрессирует и ассоциируется с усилением хронической воспалительной реакции дыхательных путей и легких на вредные частицы или газы. Обострения и сопутствующие заболевания влияют на общую тяжесть состояния отдельных пациентов [1]. БЭБКФ характеризуется патологическим расширением дыхательных путей, что клинически может быть идентифицировано с помощью рентгенографии расширения дыхательных путей (то есть, с помощью компьютерной томографии) [2]. Обострения рассматриваются как ключевые события при прогрессировании БЭБКФ [3].
Обострения респираторных симптомов часто возникают у пациентов с хроническими болезнями легких, такими как ХОБЛ и БЭБКФ. Эти обострения могут быть спровоцированы бактериальной или вирусной инфекцией (которые могут присутствовать одновременно). Во время обострений наблюдается обострение воспаления, чрезмерное расширение легкого и чрезмерный захват газов, а также снижение выдыхаемого потока и усиление одышки. Другие заболевания, такие как пневмония, могут усугублять обострение, например, ХОБЛ.
Обострение ХОБЛ определяется с самого начала хронической обструктивной болезни легких (ХОБЛ) как резкое обострение респираторных симптомов пациента, выходящее за рамки обычных повседневных колебаний, что приводит к необходимости проведения дополнительного медикаментозного лечения [4]. Частота обострений сильно варьируется у разных пациентов. Хронический характер обострений у пациентов с ХОБЛ приводит к ремоделированию тканей дыхательных путей и обострению заболевания. Такие обострения коррелируют с высокой степенью системного воспаления и активации иммунной системы. По мере усиления тяжести ХОБЛ, частота обострений увеличивается. В свою очередь, обострения, вероятно, способствуют прогрессированию ХОБЛ, и кроме того, вероятно, что воспалительное состояние, вызванное обострениями, увеличивает предрасположенность к дополнительным рецидивирующим обострениям. Это вызывает порочный круг, ведущий к прогрессированию ХОБЛ.
Обострение БЭБКФ может быть определено как обострение одного или более симптомов БЭБКФ, выходящих за пределы обычных ежедневных колебаний, например, при котором возникает потребность в антибиотиках при наличии одного или нескольких симптомов, таких как усиление кашля, увеличение объема мокроты, или увеличение гнойности мокроты. Тяжелое обострение может быть определено как состояние, требующее внеплановой госпитализации или обращения в отделение неотложной помощи [3].
Пациенты с хроническими болезнями легких, такими как ХОБЛ или БЭБКФ, могут иметь рецидивирующие инфекции дыхательных путей, которые могут вызвать обострение. Наиболее частыми причинами обострений ХОБЛ являются вирусные инфекции верхних дыхательных путей и трахеобронхиального дерева. Наиболее распространенными вирусами, обнаруживаемыми во время обострений ХОБЛ, являются риновирусы человека (ВСР) [5], которые ассоциируются с разрастанием бактериального микробиома дыхательных путей [6]. Бактериальная флора при ХОБЛ обычно сильно варьируется. ХОБЛ ассоциируется с множеством различных бактерий. Однако, к наиболее патогенным бактериям относятся Haemophilus influenza, Streptococcus pneumonia, Moraxella catarrhalis, Haemophilus parainfluenzae и Staphylococcus aureus. Кроме того, Pseudomonas aeruginosa (PA) была описана как одна из наиболее опасных бактерий, обнаруживаемых у пациентов с очень тяжелой обструкцией дыхательных путей при стабильной ХОБЛ и во время обострений [7].
Лечение ХОБЛ основано на использовании ингаляционных кортикостероидов (ИКС), ингаляционных бронходилататоров, включая бета-2-агонисты длительного действия, и антихолинергических средств, включая антагонисты мускариновых рецепторов длительного действия, а также их комбинации. Так, например, ХОБЛ в тяжелой форме и с высоким риском обострений обычно подвергают лечению комбинацией лекарственных средств всех трех классов. Эти методы лечения снижают обострения, но пациенты, получающие максимальную ингаляционную терапию, продолжают испытывать обострения, а поэтому необходимо разработать новые терапевтические подходы. Действительно, ИКС-терапия связана с побочными эффектами, включая высокий риск пневмонии, кандидоз полости рта, охрипший голос и появление гематом на коже. Другие побочные эффекты включают повышенный риск первичного диабета, прогрессирования диабета, катаракты и туберкулеза. Длительное применение кортикостероидов также связано с повышенным риском переломов костей у пациентов с ХОБЛ [8]. В частности, ИКС-терапия лишь незначительно снижает частоту обострений, а в клинических испытаниях сообщалось о повышенном риске пневмонии при использовании ИКС при ХОБЛ. Это может быть связано с тем, что ИКС, по-видимому, снижают противовирусный иммунитет, что приводит к гиперсекреции слизи и к увеличению бактериальной нагрузки на легкие [9].
У пациентов с ХОБЛ, страдающих хроническим бронхитом, к выбранному курсу лечения можно добавить ингибитор фермента фосфодиэстеразы-4 (например, рофлумиласт). Рофлумиласт представляет собой нестероидное противовоспалительное активное вещество, предназначенное для борьбы как с системным, так и с легочным воспалением, связанным с ХОБЛ. Он показан для поддерживающего лечения ХОБЛ в тяжелой форме, связанной с хроническим бронхитом, у взрослых пациентов, в анамнезе которых имеются частые обострения, в качестве дополнительной терапии к лечению бронходилататорами.
В настоящее время, обострения ХОБЛ лечат фармакологическими препаратами, включая бронходилататоры, ИКС и антибиотики. Как обсуждалось выше, ИКС-терапия связана с побочными эффектами. Антибиотики используются для лечения бактериальных инфекций дыхательных путей в целях уменьшения частоты и тяжести обострений. Макролиды также обладают противовоспалительным действием и могут применяться для лечения пациентов с тяжелой формой ХОБЛ и частыми обострениями в анамнезе. Однако, длительная терапия макролидами связана с риском вырабатывания резистентности к микробам и возникновения побочных эффектов со стороны сердечно-сосудистой системы. В настоящее время не существует каких-либо средств для лечения вирусных инфекций, таких как риновирусные инфекции при ХОБЛ.
Не существует также и доступного лечения БЭБКФ. Обострения БЭБКФ обычно лечат антибиотиками для устранения основной инфекции дыхательных путей. Некоторые пациенты с БЭБКФ получают профилактическую терапию антибиотиками для предотвращения обострений, однако, эффективность такой терапии пока не доказана.
Целью настоящего изобретения является разработка дополнительных и усовершенствованных способов лечения хронических болезней легких, а в частности, заболеваний с обострениями, связанными с инфекцией, таких как ХОБЛ и БЭБКФ, в частности, для профилактики или лечения обострений.
Раскрытие изобретения
В отличие от уже существующих способов профилактики или лечения обострений, которые основаны на применении антибиотиков, необязательно в комбинации с кортикостероидами, бета2-агонистами и/или антихолинергическими бронходилататорами согласно изобретению, обострения могут быть предотвращены или излечены путем введения композиции, содержащей поликлональный иммуноглобулин, в дыхательные пути человека.
Таким образом, настоящее изобретение относится к композиции, содержащей поликлональный иммуноглобулин, для ее применения в целях профилактики или лечения обострения у человека с хронической болезнью легких, где такую композицию вводят в дыхательные пути индивидуума.
Настоящее изобретение также относится к способу профилактики или лечения обострения у человека с хронической болезнью легких путем введения композиции, содержащей поликлональный иммуноглобулин, в дыхательные пути индивидуума.
Настоящее изобретение также относится к применению поликлонального иммуноглобулина в целях приготовления лекарственного средства для профилактики или лечения обострения у человека с хронической болезнью легких, где такое лекарственное средство вводят в дыхательные пути индивидуума.
Удивительно то, что нанесение иммуноглобулина на эпителий слизистой оболочки дыхательных путей может снижать воспаление, стимулировать иммунное исключение потенциально патогенных микробов (например, бактерий и/или вирусов), присутствующих в слое слизистой оболочки, и предотвращать прямое повреждение эпителия, например, бактериальным экзоферментами и токсинами и/или вирусной репликацией (высвобождением). Эти эффекты могут оказаться благоприятными для предотвращения или лечения обострения, которое может быть вызвано инфекциями дыхательных путей, например, бактериями и/или вирусами.
Коммерчески доступные композиции иммуноглобулинов вводят внутривенно или подкожно, то есть, путем системного введения. Прямое местное введение в дыхательные пути-мишени, например, путем аэрозольной ингаляции, может обеспечивать такое же воздействие иммуноглобулина на дыхательные пути, но, в этом случае, требуется меньшая общая доза, чем при системном введении (например, внутривенном). Такое локальное введение непосредственно в ткань дыхательных путей-мишеней позволяет таким образом избежать системных побочных эффектов. Кроме того, введение в дыхательные пути позволяет достичь более высокой локальной концентрации, чем это может быть достигнуто при системном введении, поскольку лишь часть системно вводимого иммуноглобулина достигает дыхательных путей.
Кроме того, внутривенная или подкожная терапия иммуноглобулином является дорогостоящей. Целенаправленное локализованное введение непосредственно в дыхательные пути позволяет вводить меньшую дозу для достижения такого же эффекта иммуноглобулина, например IgG, в дыхательных путях, как и при системном введении. В результате, прямое введение в дыхательные пути может быть более рентабельным, поскольку для достижения того же самого терапевтического эффекта в дыхательных путях требуется меньшее количество композиции.
Кроме того, внутривенная или подкожная терапия иммуноглобулином обычно должна находиться под наблюдением медицинского персонала. Так, например, внутривенное введение должно проводиться медсестрой или врачом и обычно осуществляется в клинике. Вдыхание аэрозольного иммуноглобулина может не требовать наблюдения со стороны медицинского персонала, а поэтому, может быть подходящим для самостоятельного введения в домашних условиях. Следовательно, прямое введение в дыхательные пути может быть более практичным для индивидуума, а поэтому, индивидуум с большей вероятностью будет соблюдать режим лечения. Более четкое соблюдение режима лечения позволит снизить неэффективность лечения, которая может приводить, например, к обострениям и к госпитализации.
Обострения
Настоящее изобретение включает профилактику или лечение обострения у человека с хронической болезнью легких, а обычно ХОБЛ или БЭБКФ.
Обострение представляет собой острое событие, характеризующееся ухудшением респираторных симптомов у пациента, которое выходит за рамки обычных повседневных колебаний и требует дополнительной терапии. Такие обострения могут иметь разные степени тяжести.
У индивидуума с ХОБЛ, легкое обострение представляет собой событие, которое требует замены лекарственных средств для индивидуума, а в частности, такому индивидууму вводят бронходилататор непродолжительного действия (SABD). Умеренное обострение требует медицинского вмешательства, а в частности, лечения SABD плюс антибиотиком и/или кортикостероидом для перорального введения. Тяжелое обострение требует госпитализации или обращения в отделение неотложной помощи. У индивидуума согласно изобретению может наблюдаться легкое, умеренное или тяжелое обострение. Обычно, у индивидуума наблюдается обострение в умеренной или тяжелой степени.
У индивидуума с БЭБКФ, обострение характеризуется ухудшением локальных симптомов (появлением кашеля, увеличением объема мокроты или изменением ее вязкости, увеличением гнойности мокроты с усилением хрипов или без них, одышкой, кровохарканьем) и/или системным расстройством [10]. Тяжелое обострение может быть охарактеризовано как обострение, требующее внеплановой госпитализации или обращение в отделение неотложной помощи [3].
В одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики обострения, то есть, для профилактической терапии. В конкретном варианте осуществления изобретения, композиция согласно изобретению предназначена для ее использования в целях профилактики обострения, где такая композиция позволяет предотвращать и/или устранять инфекцию, развивающуюся в дыхательных путях индивидуума. Эта профилактическая терапия может быть особенно эффективной, поскольку она может предотвращать вирусные инфекции, а также бактериальные инфекции и является эффективной против бактерий, резистентных к одному или более антибиотикам.
В соответствии с этим, в одном варианте осуществления изобретения, композиция согласно изобретению предназначена для ее использования в целях профилактики обострения, а в частности, для лечения и/или профилактики основной инфекции дыхательных путей. Для этой цели особенно подходит поликлональный иммуноглобулин, поскольку он может быть использован для лечения как вирусных, так и бактериальных инфекций, и является эффективным против бактерий, резистентных к одному или более антибиотикам.
В другом варианте осуществления изобретения, композиция согласно изобретению используется для лечения обострения. Обычно, обострение вызывается вирусной или бактериальной инфекцией дыхательных путей. Поликлональный иммуноглобулин распознает широкий спектр потенциально патогенных микробов (обычно бактерий и вирусов) в дыхательных путях. Распознавание бактерий широкого спектра означает, что иммуноглобулин является эффективным для лечения бактериальной инфекции дыхательных путей, например, путем иммунного исключения. Распознавание вирусов широкого спектра означает, что иммуноглобулин является эффективным для лечения вирусной инфекции дыхательных путей, например, путем предотвращения связывания вируса с клеткой-хозяином и тем самым предотвращения репликации вируса и его высвобождения. Иммуноглобулин может быть также эффективно использован без необходимости проведения диагностических тестов для выявления конкретной бактериальной или вирусной инфекции, которая может вызывать или вызывает обострение, что означает, что такая композиция может быть введена предварительно.
Лечение обострения может предотвратить его ухудшение. Так, например, лечение легкого обострения может предотвратить его прогрессирование в тяжелое обострение.
Композиция согласно изобретению предназначена для лечения или профилактики обострения. Для такого лечения или профилактики обострений, композиция согласно изобретению может быть обогащена антителом, распознающим конкретный патоген. В одном варианте осуществления изобретения, индивидуума с острым осложнением обследуют на наличие патогена (например, бактерии и/или вируса), вызывающего инфекцию, лежащую в основе обострения, и композицию согласно изобретению обогащают антителом, специфичным к идентифицированному патогену. В одном варианте осуществления изобретения, композицию согласно изобретению обогащают путем добавления в эту композицию моноклонального антитела, специфичного к идентифицированному патогену. В другом варианте осуществления изобретения, композицию согласно изобретению обогащают путем добавления в нее моноклонального антитела, специфичного к патогену, который был идентифицирован в дыхательных путях индивидуума. Кроме того или альтернативно, композиция может быть обогащена поликлональным иммуноглобулином, который является специфичным к некоторым патоганам, и который может быть получен, например, путем иммунизации трансгенного животного, созданного для получения человеческих иммуноглобулинов, или путем скрининга библиотеки репертуара человеческих антител на антитела, специфичные к нужному(ым) патогену(aм) с последующим рекомбинантным продуцированием идентифицированных антител.
В конкретном варианте осуществления изобретения, композиция предназначена для профилактики или лечения суперинфекции в дыхательных путях индивидуума. Суперинфекция представляет собой вторичную инфекцию, которая возникает в дыхательных путях во время первичного инфицирования дыхательных путей. В частности, суперинфекция дыхательных путей может возникать при заражении вторым инфекционным агентом, который является резистентным к лечению, применяемому против первого инфекционного агента. В одном варианте осуществления изобретения, обе инфекции представляют собой бактериальные инфекции дыхательных путей. В другом варианте осуществления изобретения, инфекции включают одну бактериальную инфекцию дыхательных путей и одну вирусную инфекцию дыхательных путей.
В одном варианте осуществления изобретения, у индивидуума имеется инфекция дыхательных путей, вызванная бактериями, резистентными по меньшей мере к одному антибиотику. В частности, бактерии могут быть резистентными ко многим антибиотикам (множественная резистентность). Композиция согласно изобретению является эффективной против этих резистентных бактерий, включая бактерии с множественной резистентностью, поскольку поликлональный иммуноглобулин распознает многие эпитопы на бактериях, включая эпитопы, не ассоциированные с механизмами активности и резистентности к антибиотикам.
В одном варианте осуществления изобретения, индивидуум согласно изобретению страдает инфекцией дыхательных путей, вызванной вирусом. Композиция согласно изобретению распознает вирус и позволяет лечить вирусную инфекцию. В частности, поликлональный иммуноглобулин связывается с вирусом и предотвращает связывание вируса с его клеткой-хозяином, например, с эпителиальной клеткой. Поликлональный иммуноглобулин предотвращает проникновение вируса в клетку-хозяина, репликацию вируса и высвобождение вируса. Такое лечение может быть особенно эффективным, поскольку пока не существует эффективных противовирусных агентов для лечения инфекций дыхательных путей.
История болезни пациента
Индивидуумом согласно изобретению может быть пациент с хронической болезнью легких, у которого в анамнезе имеются обострения.
Частота обострений у разных пациентов может быть разной. У индивидуума согласно изобретению могут наблюдаться частые обострения, например, два и более обострений в год. Одним из лучших прогностических факторов частых обострений у индивидуума является наличие в анамнезе ранее вылеченных обострений. Таким образом, композиция согласно изобретению является особенно подходящей для лечения индивидуума с риском частых обострений, на что указывает наличие в анамнезе индивидуума этих обострений. Следовательно, в одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики или лечения обострения у индивидуума, у которого за 12 месяцев до профилактики или лечения наблюдались одно или несколько обострений. Предпочтительно, чтобы у индивидуума наблюдалось два или более обострений за 12 месяцев до профилактики или лечения. В частности, предпочтительно, чтобы у индивидуума наблюдалось три или более обострений за 12 месяцев до профилактики или лечения.
Поддерживающая терапия (обсуждаемая ниже) является особенно подходящей для индивидуумов, у которых в анамнезе имеются обострения. Таким образом, в конкретном варианте осуществления изобретения, у индивидуума согласно изобретению наблюдалось по меньшей мере одно обострение за 12 месяцев до терапии, и этот индивидуум проходил лечение композицией в течение по меньшей мере 12 месяцев.
В частности, при ХОБЛ, одним из самых эффективных прогностических факторов частых обострений у пациента в будущем является количество обострений, имевших место в предыдущем году [4]. В частности, у пациента с ХОБЛ, у которого в прошлом году было два или более обострений, существует вероятность частых обострений. Следовательно, в конкретном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики обострения у индивидуума с ХОБЛ, где профилактика представляет собой поддерживающую терапию у индивидуума с ХОБЛ, и где у такого индивидуума наблюдалось два или более обострений за 12 месяцев до начала поддерживающей терапии, и такая поддерживающая терапия проводится по меньшей мере 12 месяцев.
В частности, при БЭБКФ, одним из самых надежных прогностических факторов частых обострений у пациента в будущем является количество обострений, имевших место в предыдущем году [3]. В частности, индивидуум с БЭБКФ, который имел три или более обострений в предыдущем году, вероятно, будет иметь частые обострения. Следовательно, в конкретном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики обострения у индивидуума с БЭБКФ, где профилактика представляет собой поддерживающую терапию у индивидуума с БЭБКФ, и где индивидуум имел три или более обострений за 12 месяцев до начала поддерживающей терапии, и такую поддерживающую терапию проводят по меньшей мере 12 месяцев.
Хроническая болезнь легких
Настоящее изобретение включает профилактику или лечение обострения у индивидуума с хронической болезнью легких, а в частности, с хронической болезнью легких, при которой инфекции являются основным фактором такого обострения, а обычно, ХОБЛ и/или БЭБКФ.
ХОБЛ
Индивидуум с ХОБЛ обычно имеет отношение ФОВ1 (форсированного объема выдоха за 1 сек.)/ФЖЕЛ (форсированной жизненной емкости легких) после введения бронходилататора, равное менее 0,7. ФОВ1 и ФЖЕЛ могут быть измерены посредством спирометрии с применением стандартных методов, описанных в литературе [11]. Так, например, для спирометрических измерений после введения бронходилататора, спирометрия может быть осуществлена: (i) через 10-15 минут после введения бета2-агониста непродолжительного действия (400 мкг); (ii) через 30-45 минут после введения антихолинергического средства непродолжительного действия (160 мкг); или (iii) через 30-45 минут после введения комбинации лекарственных средств двух классов.
Настоящее изобретение является особенно подходящим для профилактики или лечения обострения у индивидуума с ХОБЛ от умеренной до очень тяжелой формы, то есть, умеренной ХОБЛ, тяжелой ХОБЛ или очень тяжелой ХОБЛ. Обычно, у пациента наблюдается тяжелая или очень тяжелая форма ХОБЛ.
Такая классификация степени тяжести ХОБЛ объясняется в работе [1] и основана на тяжести ограничения воздушного потока у индивидуума. Вкратце, у индивидуума с отношением ФОВ1/ФЖЕЛ <0,7, степень тяжести ограничения воздушного потока определяется на основе измеренного ФОВ1 после введения бронходилататора, а также на сравнении этой измеренной величины с прогнозируемой величиной для здорового индивидуума. Индивидуум с легкой формой ХОБЛ имеет ФОВ1 по меньшей мере 80% от прогнозируемого. Индивидуум с умеренной ХОБЛ имеет ФОВ1 от 50% до 80% от прогнозируемого. Индивидуум с тяжелой формой ХОБЛ имеет ФОВ1 от 30% до 50% от прогнозируемого. Индивидуум с очень тяжелой формой ХОБЛ имеет ФОВ1 менее 30% от прогнозируемого.
Прогнозируемый ФОВ1 для здорового человека рассчитывается по формуле [12]:
ФОВ1 у мужчин {литры} = 4,30 × рост {метры} - 0,029 × возраст {годы} - 2,49
ФОВ1 у женщин {литры} = 3,95 × рост {метры} - 0,025 × возраст {годы} - 2,60
Так, например, мужчина в возрасте 50 лет и ростом 1,8 м будет иметь прогнозируемый ФОВ1 3,8 л (4,3 × 1,8-0,029 × 50-2,49). Если бы у этого индивидуумы были затем проведены спирометрические измерения, и если ФОВ1 после введения бронходилататора составлял 2,09 л, то это значение составляло бы 55% от прогнозируемого ФОВ1 (3,8 л), и, таким образом, индивидуум рассматривался бы как индивидуум с умеренной ХОБЛ.
ХОБЛ средней и очень тяжелой степени трудно поддается лечению, и даже тройная терапия (кортикостероидом/бета2-агонистом/антихолинергическим бронходилататором, вводимыми путем ингаляции) не всегда является эффективной. Предполагается, что поликлональный иммуноглобулин согласно изобретению предотвращает или устраняет обострение ХОБЛ у индивидуума по механизмам (включая профилактику инфекции дыхательных путей и уменьшение воспаления дыхательных путей), которые отличаются от механизмов существующих методов лечения и, таким образом, обеспечивают дополнительную и сопутствующую терапию.
В другом аспекте изобретения, композиция согласно изобретению предназначена для лечения ХОБЛ у индивидуума, где такую композицию вводят в дыхательные пути индивидуума. Обострения способствуют развитию патологии ХОБЛ и могут вызывать порочный круг между воспалением и дальнейшими инфекциями. Таким образом, профилактика обострения представляет собой способ лечения ХОБЛ. Поддерживающая терапия с использованием композиции согласно изобретению (как обсуждается ниже) у индивидуума с ХОБЛ является особенно подходящей для лечения ХОБЛ, поскольку она предотвращает обострение (включая снижение частоты обострений и/или уменьшение их тяжести). По аналогичным причинам, сезонное введение композиции согласно изобретению является особенно подходящим для лечения ХОБЛ.
Бронхоэктаз без кистозного фиброза
Настоящее изобретение включает лечение обострения у индивидуума с хронической болезнью легких, а в частности, с хронической болезнью легких, при котором инфекции являются основной причиной обострений, а обычно БЭБКФ. БЭБКФ имеет разнообразную этиологию и может иметь широкий спектр признаков. Для этого заболевания характерно патологическое расширение дыхательных путей. В частности, это заболевание определяется как постоянное увеличение дыхательных путей [2], которое может быть продемонстрировано рентгенографическими методами, например с помощью компьютерной томографии (КТ). Признаки БЭБКФ включают незначительное расширение и кистозные изменения дыхательных путей. Такие заболевания у пациентов могут протекать бессимптомно (и неожиданно обнаруживается расширение дыхательных путей), или у пациентов может наблюдаться ряд симптомов, таких как кашель и/или выделение мокроты, с периодическими обострениями.
Настоящее изобретение является особенно подходящим для профилактики или лечения обострения у индивидуума с БЭБКФ. В одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики или лечения обострения у индивидуума с БЭБКФ. Композиция является особенно подходящей для профилактики тяжелого обострения у индивидуума с БЭБКФ. В другом аспекте изобретения, композиция согласно изобретению предназначена для лечения БЭБКФ у индивидуума, где такую композицию вводят в дыхательные пути индивидуума. Обострения способствуют развитию патологии БЭБКФ и могут создавать порочный круг между воспалением и дальнейшими инфекциями. Таким образом, профилактика обострения представляет собой способ лечения БЭБКФ. Поддерживающая терапия с использованием композиции согласно изобретению (как обсуждается ниже) у индивидуума с БЭБКФ является особенно подходящей для лечения БЭБКФ, поскольку она предотвращает обострение (включая снижение частоты обострений и/или уменьшение их тяжести). По аналогичным причинам, сезонное введение композиции согласно изобретению является особенно подходящим для лечения БЭБКФ.
Индивидуум может иметь ХОБЛ и БЭБКФ как сопутствующие заболевания. Действительно, БЭБКФ ассоциируется с ХОБЛ на более поздних стадиях [2]. Следовательно, в другом варианте осуществления изобретения, композиция согласно изобретению является особенно подходящей для профилактики или лечении обострения у индивидуума с ХОБЛ и БЭБКФ.
Низкий уровень IgG
Индивидуум согласно изобретению может иметь более низкий уровень иммуноглобулина G (IgG), чем здоровый взрослый человек с нормальным диапазоном уровней иммуноглобулина. У этих индивидуумов имеется повышенный риск развития ХОБЛ, повышение тяжести ХОБЛ и/или повышенный риск обострений ХОБЛ. БЭБКФ также является обычным проявлением у индивидуумов с иммунодефицитом, включая низкий уровень IgG.
IgG в дыхательных путях, а в частности, в легких, поступает из двух источников: локально продуцируется плазматическими клетками, расположенными в слизистой оболочке бронхов, и выделяется из плазмы посредством транссудации. В соответствии с этим, у индивидуума согласно изобретению может наблюдаться низкий уровень IgG в дыхательных путях, например, из-за низкого системного уровня IgG и/или низкого локального продуцирования IgG.
В одном из вариантов осуществления изобретения, у индивидуума имеется низкий уровень IgG в плазме. Как указано в работе [13], нормальный диапазон общих IgG в плазме у взрослых здоровых людей составляет 639-1349 мг/дл, а в среднем 994 мг/дл. Низкий уровень IgG в плазме у взрослого человека может составлять менее 700 мг/дл. Более низкий общий уровень IgG в плазме у взрослого человека можно классифицировать как слабый-умеренный (300-600 мг/дл), значительный (100-300 мг/дл) или сильно сниженный (менее, чем приблизительно 100 мг/дл). В конкретном варианте осуществления изобретения, индивидуум имеет уровень IgG в плазме менее, чем приблизительно 700 мг/дл, менее, чем приблизительно 600 мг/дл, менее, чем приблизительно 300 мг/дл или менее, чем приблизительно 100 мг/дл. В некоторых вариантах осуществления изобретения, индивидуум имеет уровень IgG в плазме в диапазоне приблизительно от 100 до приблизительно 600 мг/дл (включая диапазоны приблизительно от 300 до приблизительно 600 мг/дл или приблизительно от 100 до приблизительно 300 мг/дл).
Специалистам в данной области известны различные методы определения общей концентрации IgG в плазме, например, скоростная нефелометрия и/или радиальная иммунодиффузия [14]. Сывороточный IgG также может быть количественно определен с помощью ELISA, например, в соответствии с протоколом, описанным ниже в способах осуществления изобретения.
Обострения, которые могут быть предотвращены или излечены с помощью настоящего изобретения, проявляются в дыхательных путях, а поэтому локальная концентрация IgG в дыхательных путях является важным фактором при определении риска инфекций дыхательных путей и, следовательно, также обострений. Индивидуум с более низким уровнем IgG в дыхательных путях, чем у здорового взрослого человека, подвергается большему риску инфекции дыхательных путей и обострений. Следовательно, в одном варианте осуществления изобретения, индивидуум согласно изобретению имеет более низкий уровень IgG в дыхательных путях, чем здоровый взрослый человек.
Уровень IgG в дыхательных путях может быть измерен путем анализа мокроты, взятой у индивидуума. Мокрота представляет собой смесь слюны и слизи, откашливаемой из дыхательных путей, обычно, в результате инфекции или другого заболевания, такого как ХОБЛ или БЭБКФ. Мокроту часто исследуют под микроскопом для облегчения диагностики. Она может быть также проанализирована на содержание биологических молекул, включая иммуноглобулины (например, IgG, IgA и/или IgM) и цитокины (например, IL-1β, IL-6 и/или IL-8). Специалистам в данной области известны различные методы определения концентрации иммуноглобулина в мокроте, например, скоростная нефелометрия и/или радиальная иммунодиффузия [15]. Иммуноглобулин мокроты может быть также количественно определен с помощью ELISA, например, в соответствии с протоколом, описанным ниже в способах осуществления изобретения.
Терапевтические эффекты согласно изобретению
Профилактика и/или лечение инфекции дыхательных путей
Инфекция дыхательных путей может быть одной из причин обострения, а поэтому профилактика или лечение инфекции дыхательных путей являются особенно полезными для профилактики или лечения обострения. В одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики обострения, где поликлональный иммуноглобулин вызывает иммунное исключение одного или более потенциально патогенных микробов (например, бактерий и/или вирусов) в дыхательных путях. Поликлональный иммуноглобулин может вызывать иммунное исключение посредством связывания с потенциально патогенными микробами в дыхательных путях, например, поликлональный иммуноглобулин связывается с потенциально патогенными микробами и предотвращает их прилипание к эпителию слизистой оболочки дыхательных путей.
В другом варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики или лечения обострения, где поликлональный иммуноглобулин вызывает агрегацию одного или нескольких потенциально патогенных микробов (например, бактерий и/или вирусов) в дыхательных путях. Агрегация микробов также известна как агглютинация.
В другом варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики или лечении обострения, где поликлональный иммуноглобулин осуществляет рекрутинг иммунных клеток для уничтожения микробов, например, по механизму, называемому антителозависимой клеточной цитотоксичностью (ADCC).
Профилактика и/или снижение степени повреждения, вызываемого инфекцией дыхательных путей.
Активность микробов в дыхательных путях индивидуума может иметь патогенные эффекты. Следовательно, в одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики или лечения обострения, где поликлональный иммуноглобулин снижает повреждение дыхательных путей, вызываемое патогенами (например, бактериями и/или вирусами). Так, например, поликлональный иммуноглобулин может ингибировать активность экзоферментов. Такие экзоферменты представляют собой ферменты, секретируемые в слизистую оболочку, например, бактериями, и включают, например, ферменты, которые обладают активностью, разрушающей ткань, такие как протеазы. Блокирование активности таких экзоферментов защищает эпителий дыхательных путей индивидуума от повреждения. В конкретном варианте осуществления изобретения, композиция согласно изобретению предотвращает нарушение целостности эпителиального барьера и предотвращает прохождение патогенов через эпителий. В конкретном варианте осуществления изобретения, патоген представляет собой вирус, а поликлональный иммуноглобулин связывается с вирусом и предотвращает прямое связывание вируса с клеткой-хозяином в дыхательных путях индивидуума. Таким образом, иммуноглобулин предотвращает проникновение, репликацию и высвобождение вируса в дыхательные пути индивидуума.
Снижение воспаления
Хроническое воспаление вызывает структурные изменения и сужение небольших дыхательных путей, что способствует появлению признаков ХОБЛ, а также повреждение и ремоделирование дыхательных путей, что приводит к необратимому расширению бронхов при БЭБКФ. Усиление воспаления и связанное с ним повреждение могут повышать риск обострения. Композиция согласно изобретению может снижать воспаление у индивидуума, а поэтому, она является особенно подходящей для профилактики или лечения обострения, обычно у индивидуума с ХОБЛ или БЭБКФ.
В одном варианте осуществления изобретения, композиция согласно изобретению снижает воспаление у индивидуума, а обычно локальное воспаление, например, воспаление дыхательных путей. В частности, композиция снижает воспаление, вызываемое патогеном, а особенно, воспаление, вызываемое патогеном, в дыхательных путях индивидуума.
Воспаление может быть охарактеризовано по повышению уровня одного или более провоспалительных цитокинов, таких как IL-1β и/или IL-6, и/или IL-8. Следовательно, в конкретном варианте осуществления изобретения, композиция согласно изобретению снижает уровень IL-1β и/или IL-6, и/или IL-8, в частности, в слое слизи дыхательных путей.
Уровень одного или более цитокинов (например, уровень IL-1β и/или IL-6, и/или IL-8) в слое слизи дыхательных путей может быть количественно определен путем анализа уровня этих цитокинов в мокроте у индивидуума. Концентрации цитокинов в мокроте могут быть количественно определены стандартными методами, например, с помощью скоростной нефелометрии [14] или с помощью ELISA (например, в способах согласно изобретению, описанных ниже).
Поликлональный иммуноглобулин
Настоящее изобретение включает применение поликлональных иммуноглобулинов для профилактики или лечения обострения у индивидуума с хронической болезнью легких. Такие поликлональные иммуноглобулины успешно используются для лечения инфекционных заболеваний в качестве заместительной терапии у индивидуумов с первичными иммунодефицитными расстройствами, а также для профилактики и лечения различных воспалительных и аутоиммунных состояний и некоторых нервных расстройств.
Эти препараты поликлонального иммуноглобулина были разработаны для системного введения и, в основном, содержат IgG. В настоящее время, эти препараты получают из плазмы, собранной у нескольких тысяч здоровых доноров (от 1000 до 60000 доноров), и эти препараты содержат как специфические, так и природные антитела, отражающие совокупное присутствие антигенов у группы доноров. Этот широкий спектр специфических и природных антител может распознавать широкий спектр антигенов (например, патогены, чужеродные антигены и собственные антигены/аутоантигены).
Обычно, поликлональные иммуноглобулины вводят внутривенно или подкожно. Для этих способов введения обычно используют несколько коммерчески доступных препаратов.
Композиция согласно изобретению включает поликлональный иммуноглобулин, который также называют Ig. Обычно, поликлональный иммуноглобулин получают из плазмы человека-донора. Предпочтительно, плазму от нескольких доноров объединяют в целях максимизации разнообразия специфичностей к антигену-мишени, например, от более, чем 100 доноров, предпочтительно, от более, чем 500 доноров, а еще более предпочтительно, от более, чем 1000 доноров.
Обычно, пулы плазмы подвергают фракционированию этанолом с последующим проведением нескольких стадий очистки, таких как дополнительные стадии осаждения и/или стадии колоночной хроматографии, а также стадии инактивации и удаления вирусных и других патогенов, такие как нанофильтрация или обработка растворителем/детергентом, например, с применением метода, описанного в публикации 16.
Альтернативно, поликлональный иммуноглобулин может быть получен рекомбинантно, например из библиотек, составляющих иммунный репертуар человека.
Обычно, поликлональный иммуноглобулин представляет собой поликлональный IgG, поликлональный мономерный IgA, поликлональный димерный IgA, поликлональный IgM или их комбинации. В конкретных вариантах осуществления изобретения, композиция содержит поликлональный IgG. Поликлональный иммуноглобулин может также включать IgA и/или IgM, содержащие J-цепь в комбинации с секреторным компонентом, как описано в WO2013/132052.
IgG
Настоящее изобретение относится к композициям, содержащим поликлональный иммуноглобулин, для их применения в целях профилактики или лечения обострения у индивидуума с хронической болезнью легких, а обычно с ХОБЛ и/или БЭБКФ. Авторами настоящего изобретения было неожиданно обнаружено, что крупные иммунные комплексы образуются между IgG и Pseudomonas aeruginosa. Связывание антигена с иммуноглобулином в значительной степени зависит от домена (Fab), связывающегося с антигеном-мишенью. Поскольку IgG является лишь двухвалентным по отношению к домену Fab, то образование таких агрегатов (иммунных комплексов) между Pseudomonas aeruginosa и IgG было неожиданным. Следовательно, в одном варианте осуществления изобретения, композиция согласно изобретению содержит поликлональные IgG плазмы человека. Поликлональный иммуноглобулин содержит по меньшей мере 95% IgG, а предпочтительно по меньшей мере 98% IgG. Поликлональный IgG является особенно подходящим для его использования в целях профилактики или лечения обострения у индивидуума с хронической болезнью легких, обычно ХОБЛ и/или БЭБКФ, а именно, лечения и/или профилактики одной или нескольких инфекций дыхательных путей.
Одним из объяснений неожиданного образования иммунных комплексов IgG и Pseudomonas aeruginosa является то, что IgG может дополнительно связываться с Pseudomonas aeruginosa за пределами Fab-областей, возможно, посредством его сахаров. Таким образом, IgG может оказаться неожиданно более активным в передаче сигналов Pseudomonas aeruginosa иммунной системе, чем это ожидалось. Следовательно, в конкретном варианте осуществления изобретения, композиция согласно изобретению, содержащая IgG, используется для профилактики или лечения обострения у индивидуума с хронической болезнью легких, обычно с ХОБЛ и/или БЭБКФ, где индивидуум имеет сопутствующую инфекцию Pseudomonas aeruginosa. В другом варианте осуществления изобретения, композицию согласно изобретению, содержащую IgG, вводят индивидууму для предотвращения инфекции дыхательных путей, вызываемой Pseudomonas aeruginosa. Таким образом, в предпочтительном варианте осуществления изобретения, композицию согласно изобретению, содержащую IgG, используют для профилактики обострения, где указанную композицию вводят в качестве поддерживающей терапии. Эта композиция является особенно подходящей для поддерживающей терапии у индивидуума с хронической болезнью легких, а обычно, с ХОБЛ и/или БЭБКФ, поскольку Pseudomonas aeruginosa является условно-патогенным микроорганизмом, который может поражать индивидуумов с нарушенной защитой легких, таких как пациенты с ХОБЛ или БЭБКФ. В частности, было указано, что такая бактерия является одной из самых опасных бактерий, обнаруживаемых у пациентов с ХОБЛ и во время обострений ХОБЛ [7].
Обычный человеческий IgG может быть получен с чистотой по меньшей мере 95%, что означает, что 95% поликлонального Ig составляет IgG. Таким образом, в одном варианте осуществления изобретения, IgG, содержащийся в композиции согласно изобретению, обычно имеет чистоту по меньшей мере 95% IgG, предпочтительно по меньшей мере 96% IgG, более предпочтительно по меньшей мере 98% IgG, например, по меньшей мере 99% IgG.
Введение композиции, содержащей IgA, индивидууму с селективным дефицитом IgA, может приводить к анафилаксии у индивидуума. Анафилаксия представляет собой серьезную аллергическую реакцию, которая часто начинается довольно быстро и может привести к смерти пациента. В соответствии с этим, в некоторых вариантах осуществления изобретения, композиция согласно изобретению содержит лишь незначительное количество IgA, например, менее 200 мкг/мл IgA, а предпочтительно менее 25 мкг/мл IgA. Эти композиции являются особенно подходящими для введения индивидууму, у которого имеется селективный дефицит IgA. Более того, селективный дефицит IgA не дает тяжелых симптомов, а поэтому индивидуум согласно изобретению может не знать, что он имеет селективный дефицит IgA. Соответственно, эти композиции являются особенно подходящими для введения индивидууму, который не знает, имеется ли у него селективный дефицит IgA или нет.
Таким образом, в предпочтительном варианте осуществления изобретения, композиция согласно изобретению включает поликлональный иммуноглобулин, который содержит по меньшей мере 98% IgG и менее, чем 25 мкг/мл IgA.
В конкретном варианте осуществления изобретения, композиция для ее применения в настоящем изобретении представляет собой Privigen™. Коммерчески доступные препараты иммуноглобулинов, которые могут быть также использованы в соответствии с настоящим изобретением, включают: Bivigam™, Clairyg™, Flebogam™ 5%, Flebogamma™ DIF 5%, Gammagard™ в виде 10% жидкости, Gammaplex™, Gamunex™ 10%, IG Vena™ N., Intratect™, Kiovig™, Nanogam™, Octagam™, Octagam™ 10%, Polyglobin™ N10%, Sandoglobulin™ NF в виде жидкости, Vigam™ и IQYMUNE™.
Поликлональный иммуноглобулин, обогащенный специфическим антителом
Настоящее изобретение относится к композиции для ее применения в целях профилактики и/или лечения обострения у индивидуума с хронической болезнью легких, а обычно, с ХОБЛ и/или БЭБКФ. Как описано выше, обострение может быть вызвано инфекцией дыхательных путей у индивидуума. В одном варианте осуществления изобретения, композиция согласно изобретению обогащена одним или более антителами, специфичными к одному или более конкретным патогенам (например, бактериям и/или вирусам) или потенциально патогенным микробам (например, бактериям и/или вирусам). Такая композиция может быть особенно подходящей, поскольку она дает эффект увеличения эффективной дозы иммуноглобулина, который обладает активностью против микроба или патогена, что, следовательно, будет давать больший терапевтический эффект или может обеспечивать эквивалентный терапевтический эффект при более низкой общей дозе вводимой композиции. В одном варианте осуществления изобретения, композицию согласно изобретению обогащают антителом, специфичным к патогену, путем добавления в композицию моноклональных антител, специфичных к этому патогену.
В одном варианте осуществления изобретения, композицию согласно изобретению обогащают антителом, специфичным к одному или более патогенам, таким как: риновирус, вирус гриппа A, человеческий метапневмовирус, RSV, коронавирус, вирус гриппа B, аденовирус, Pseudomonas aeruginosa, Haemophilus influenza, Streptococcus pneumonia, Moraxella catarrhalis, Haemophilus parainfluenzae и/или Staphylococcus aureus. Такая композиция может быть особенно подходящей, поскольку эти патогены являются наиболее частой причиной обострения у индивидуума с хронической обструктивной болезнью дыхательных путей, а обычно с ХОБЛ и/или БЭБКФ. Предпочтительно, композицию согласно изобретению обогащают антителом, специфичным к Pseudomonas aeruginosa, которая, как было описано, является одной из наиболее опасных бактерий, обнаруживаемых у индивидуумов с ХОБЛ и во время обострений ХОБЛ [7]. Предпочтительно, композицию согласно изобретению обогащают антителом, специфичным к риновирусу человека, который является наиболее распространенной вирусной инфекцией, вызывающей обострение ХОБЛ.
В одном варианте осуществления изобретения, композиция согласно изобретению, которая была обогащена антителами, специфичными к конкретным патогенам, может быть получена путем добавления в композицию, содержащую поликлональный иммуноглобулин, моноклональных Ab или смеси двух или более моноклональных антител, специфичных к одному или более патогенам, выбранным из риновируса, вируса гриппа A, метапневмовируса человека, RSV, коронавируса, вируса гриппа B, аденовируса, Pseudomonas aeruginosa, Haemophilus influenza, Streptococcus pneumonia, Moraxella catarrhalis, Haemophilus parainfluenzae и/или Staphylococcus aureus.
В одном варианте осуществления изобретения, композиция согласно изобретению, которая была обогащена антителами, специфичными к конкретным патогенам, может быть получена путем добавления в композицию, содержащую поликлональный иммуноглобулин, поликлональных иммуноглобулинов, полученных от трансгенного животного, созданного для экспрессии человеческих иммуноглобулинов после иммунизации конкретным патогеном.
В одном варианте осуществления изобретения, композиция согласно изобретению, которая была обогащена антителами, специфичными к конкретным патогенам, может быть получена путем добавления в композицию, содержащую поликлональный иммуноглобулин, нескольких специфических иммуноглобулинов, полученных путем скрининга библиотеки сайтов связывания человеческого антигена с использованием конкретного патогена или антигенов, происходящих от конкретного патогена, и рекомбинантного продуцирования патоген-специфических иммуноглобулинов с этими антигенсвязывающими сайтами.
IgA и IgM
В одном варианте осуществления изобретения, композиция согласно изобретению содержит IgA и/или IgM. В конкретном варианте осуществления изобретения, по меньшей мере 95% по массе поликлонального иммуноглобулина составляют IgA и/или IgM. IgA и/или IgM могут быть собраны в секреторные антитела путем их объединения с рекомбинантным секреторным компонентом. В конкретном варианте осуществления изобретения, композиция содержит IgA и IgM в массовом отношении приблизительно 2:1.
Предпочтительно, IgA и/или IgM получают из плазмы, как подробно описано, например, в WO 2013/132053.
Композиция, предпочтительно используемая в настоящем изобретении, может быть получена как подробно описано в WO2013/132052. Предпочтительно, препараты, полученные из плазмы и содержащие IgA и/или IgM, комбинируют in vitro с SC, что позволяет не проводить предварительную очистку димерного/полимерного IgA/IgM, содержащего J-цепь. Такое вещество называется секреторно-подобным IgA или секреторно-подобным IgM, или сокращенно SCIgA или SCIgM. Однако, это вещество обладает свойством, очень похожим на свойство секреторного IgA (обычно сокращенно обозначаемого SIgA) и продуцируемого in vivo секреторного IgM (обычно сокращенно обозначаемого SIgM).
В одном варианте осуществления изобретения, композиция содержит поликлональные полимерные IgA и IgM, выделенные из плазмы человека. В предпочтительном варианте осуществления изобретения, IgA и IgM подвергают сборке в секреторные антитела путем объединения с рекомбинантным секреторным компонентом (SC). Предпочтительно, композиция содержит IgA и IgM в массовом отношении 2:1.
В другом конкретном варианте осуществления изобретения, композиция содержит IgA с чистотой по меньшей мере 90%, предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 94%, еще более предпочтительно по меньшей мере 96%, а наиболее предпочтительно по меньшей мере 98%. Предпочтительно IgA очищают из плазмы человека, однако, могут быть также использованы и другие источники IgA, такие как молоко, слюна или другие физиологические жидкости, содержащие IgA. В другом конкретном варианте осуществления изобретения, IgA представляет собой мономерный IgA. В еще одном конкретном варианте осуществления изобретения, IgA обогащен димерным IgA, который также включает J-цепь; при этом, предпочтительно, по меньшей мере 20% IgA, более предпочтительно, по меньшей мере 30%, еще более предпочтительно, по меньшей мере 40%, а наиболее предпочтительно, по меньшей мере 50% находится в димерной форме. Композиция IgA может дополнительно содержать, но необязательно, секреторный компонент (SC), а предпочтительно секреторный компонент, продуцируемый рекомбинантно. Так, например, могут быть использованы композиции, раскрытые в WO2013/132052, которая в полном объеме включена в настоящее описание посредством ссылки.
В еще одном конкретном варианте осуществления изобретения, композиция содержит IgM. В одном варианте осуществления изобретения, композиция содержит IgM и IgA. В предпочтительном варианте осуществления изобретения, композиция содержит IgM и димерный IgA, который также содержит J-цепь. Такая композиция может также содержать, но необязательно, секреторный компонент, а предпочтительно, секреторный компонент, продуцируемый рекомбинантно. В еще одном варианте осуществления изобретения, композиция содержит IgM, IgA и IgG. В конкретном варианте осуществления изобретения, такая композиция может содержать 76% IgG, 12% IgA и 12% IgM.
IgA и/или IgM получают из плазмы человека. Предпочтительно, IgA и/или IgM объединяют in vitro с секреторным компонентом (SC). Более предпочтительно, SC представляет собой человеческий секреторный компонент. Еще более предпочтительно, SC представляет собой рекомбинантный SC, экспрессируемый в клеточной линии млекопитающих.
Предпочтительно, по меньшей мере, 10% белка в композиции представляет собой SCIgA (IgA в комбинации с SC), более предпочтительно, по меньшей мере 15%, 18%, 20% или 25%, еще более предпочтительно, по меньшей мере 30%, 40% или 50% белка в композиции представляют собой SCIgA. Предпочтительно, по меньшей мере 10% белка в композиции представляет собой SCIgM (IgM в комбинации с SC), более предпочтительно, по меньшей мере 15%, 18%, 20% или 25%, еще более предпочтительно, по меньшей мере 30%, 40% или 50% белка в композиции представляют собой SCIgM.
Предпочтительно, по меньшей мере 10% белка в композиции представляет собой SCIgA, и по меньшей мере 10% белка в композиции представляет собой SCIgM, более предпочтительно, по меньшей мере 15% представляет собой SCIgA, и по меньшей мере 15% представляет собой SCIgM, а еще более предпочтительно, по меньшей мере 20% представляют собой SCIgA и по меньшей мере 20% представляют собой SCIgM.
Аэрозоли
Настоящее изобретение относится к композиции, содержащей поликлональный иммуноглобулин для применения в целях лечения или профилактики обострений у пациента с хронической болезнью легких, а в частности, с ХОБЛ и/или БЭБКФ, где композицию вводят в дыхательные пути индивидуума. Обычно, композицию согласно изобретению вводят в дыхательные пути индивидуума в виде аэрозоля. Аэрозоль может быть получен путем распыления жидкой водной композиции, содержащей поликлональный иммуноглобулин. Альтернативно, аэрозоль может представлять собой сухой аэрозольный порошок, например, полученный с помощью системы ингаляции сухого порошка [17]. Альтернативно, могут быть использованы ингалятор с мягким туманом, ингалятор с водными каплями или ингалятор с отмеренной дозой под давлением или любое другое устройство, подходящее для доставки иммуноглобулина в дыхательные пути пациента.
Жидкие водные композиции
Жидкие водные композиции являются особенно подходящими для распыления с образованием аэрозоля для введения в дыхательные пути индивидуума. Следовательно, композиция согласно изобретению обычно присутствует в жидкой водной форме. Жидкие водные композиции представляют собой жидкие системы, где жидкий носитель или растворитель состоит преимущественно или полностью из воды. В определенных случаях, жидкий носитель может содержать небольшие фракции одной или более жидкостей, которые по меньшей мере частично смешиваются с водой.
Настоящее изобретение относится к введению композиции согласно изобретению в дыхательные пути индивидуума. Для такого введения в дыхательные пути предпочтительно использовать поликлональный иммуноглобулин в высоких концентрациях. Обычно, высокие дозы поликлонального иммуноглобулина являются подходящими для повышения эффективности, но они также являются особенно подходящими для минимизации вводимого объема, насколько это возможно, например, при введении с помощью распылителя, так, чтобы время распыления было как можно короче. Сведение к минимуму времени распыления явяется особенно предпочтительным для соблюдения пациентом схемы лечения. Таким образом, в одном варианте осуществления изобретения, композиция согласно изобретению имеет высокую концентрацию поликлонального иммуноглобулина, например, приблизительно от 20 до приблизительно 200 мг/мл. Концентрация поликлонального иммуноглобулина может составлять в пределах от 20 до 190 мг/мл, от 20 до 180 мг/мл, от 20 до 170 мг/мл, от 20 до 160 мг/мл, от 20 до 150 мг/мл, от 30 до 200 мг/мл, от 30 до 190 мг/мл, от 30 до 180 мг/мл, от 30 до 170 мг/мл, от 30 до 160 мг/мл, от 30 до 150 мг/мл, от 40 до 200 мг/мл, от 40 до 190 мг/мл, от 40 до 180 мг/мл, от 40 до 170 мг/мл, от 40 до 160 мг/мл, от 40 до 150 мг/мл. Концентрации поликлональных иммуноглобулинов, которые являются подходящими для композиции согласно изобретению, составляют в пределах от 20 до 140 мг/мл, от 20 до 130 мг/мл, от 20 до 120 мг/мл, от 30 до 140 мг/мл, от 30 до 130 мг/мл, от 30 до 120 мг/мл, от 40 до 140 мг/мл, от 40 до 130 мг/мл, от 40 до 120 мг/мл, от 50 до 140 мг/мл, от 50 до 130 мг/мл или от 50 до 120 мг/мл; а в частности, концентрация поликлонального иммуноглобулина составляет приблизительно 50 мг/мл, приблизительно 60 мг/мл, приблизительно 70 мг/мл, приблизительно 80 мг/мл, приблизительно 90 мг/мл, приблизительно 100 мг/мл, приблизительно 110 мг/мл или приблизительно 120 мг/мл.
Относительно высокие концентрации играют важную роль для обеспечения малых объемов заполнения и короткого времени распыления и, таким образом, для обеспечения терапевтической эффективности лечения. В конкретном предпочтительном варианте осуществления изобретения, композиция содержит поликлональный IgG в концентрации приблизительно от 50 мг/мл до приблизительно 100 мг/мл. Наиболее предпочтительно, композиция содержит поликлональный IgG в концентрации приблизительно 100 мг/мл.
Обычно, жидкая водная композиция согласно изобретению содержит один или более стабилизаторов. Часто встречающаяся проблема при составлении жидких составов иммуноглобулинов заключается в том, что иммуноглобулины имеют тенденцию к агрегации и образованию осадка, если они недостаточно стабилизированы соответствующими добавками. В соответствии с этим, в одном варианте осуществления изобретения, композиция согласно изобретению содержит стабилизатор, например, аминокислоту, такую как пролин, глицин и гистидин, или сахарид, или спирт ряда сахаров, или белок, такой как альбумин, или их комбинацию. Каждая из этих добавок, как известно, стабилизирует иммуноглобулины в жидких водных композициях и может быть использована в жидкой водной композиции согласно изобретению. В конкретном варианте осуществления изобретения, композиция согласно изобретению включает стабилизатор, где стабилизатор представляет собой пролин, глицин или гистидин, а предпочтительно пролин.
Увеличение концентрации иммуноглобулина в жидкой водной композиции приводит к нелинейному увеличению вязкости. Было обнаружено, что во избежание проблем распыления, вызванных высокой вязкостью, пролин является особенно подходящим в качестве стабилизатора, поскольку относительно низкая вязкость композиции согласно изобретению может быть достигнута даже при высокой концентрации поликлонального иммуноглобулина, как описано в WO2011/095543. Пролин обеспечивает, с одной стороны, желаемую стабильность поликлонального иммуноглобулина в жидкой водной композиции, а с другой стороны, он снижает вязкость композиции, что, тем самым, позволяет распылять небольшой объем жидкости с высокой концентрацией поликлонального иммуноглобулина, что будет обеспечивать быстрое и эффективное лечение посредством распыления. В соответствии с этим, в конкретном варианте осуществления изобретения, композиция согласно изобретению содержит пролин, а особенно, если композиция согласно изобретению присутствует в жидкой водной форме.
L-пролин являются особенно подходящим для использования в композиции согласно изобретению, поскольку он обычно присутствует в организме человека и имеет очень низкий профиль токсичности. Безопасность L-пролина былп изучена в исследованиях на токсичность при повторных дозах, в исследованиях репродуктивной токсичности, в исследованиях мутагенности и в исследованиях фармакологической безопасности, при этом никаких побочных эффектов отмечено не было. Следовательно, в предпочтительном варианте осуществления изобретения, композиция согласно изобретению содержит L-пролин. Обычно, композиция согласно изобретению содержит пролин, а предпочтительно L-пролин, в пределах приблизительно от 10 до приблизительно 1000 ммоль/л, например, приблизительно от 100 до приблизительно 500 ммоль/л, а в частности, приблизительно 250 ммоль/л.
В предпочтительном варианте осуществления изобретения, композиция согласно изобретению содержит приблизительно 210-290 ммоль/л L-пролина, а в частности, 250 ммоль/л L-пролина. В конкретном варианте осуществления изобретения, композиция содержит поликлональный IgG и приблизительно 250 ммоль/л L-пролина.
В одном варианте осуществления изобретения, вязкость жидкой водной композиции согласно изобретению, содержащей поликлональный иммуноглобулин и пролин, составляет в пределах от 1 мПа/с до 17 мПа/с (при температуре 20,0°C ± 0,1°С). В конкретном варианте осуществления изобретения, вязкость композиции, содержащей 100 мг/мл поликлонального IgG и 250 ммоль/л L-пролина, составляет приблизительно 3 мПа/с при температуре 20,0°C ± 0,1°С.
Обычно, композиция согласно изобретению, включающая поликлональный IgG и пролин, имеет pH от 4,2 до 5,4, предпочтительно от 4,6 до 5,0, а наиболее предпочтительно приблизительно 4,8, что дополнительно способствует высокой стабильности препарата.
Использование пролина позволяет получить композицию, в которой стабильность композиции будет повышена, а вязкость композиции будет снижена, с помощью одного единственного агента. В результате может быть получена композиция, которая будет особенно подходящей для ее применения в способах получения аэрозоля с помощью сетчатого распылителя.
Композиция согласно изобретению обычно включает компоненты в дополнение к поликлональному иммуноглобулину, например, она обычно включает один или более дополнительных фармацевтических носителей и/или наполнителей. Обсуждение таких компонентов можно найти в публикации 18.
В одном варианте осуществления изобретения, композиция согласно изобретению также содержит фармацевтически приемлемые наполнители, которые служат для оптимизации свойств композиции и/или свойств аэрозоля. Примерами таких наполнителей являются наполнители для регуляции или забуферивания pH, наполнители для регуляции осмомоляльности; антиоксиданты; поверхностно-активные вещества; наполнители для замедленного высвобождения или длительного локального удерживания; агенты, маскирующие вкус; подсластители и ароматизаторы. Эти наполнители используют для достижения оптимальных величин pH, осмомоляльности, вязкости, поверхностного натяжения и соответствующего вкуса, и эти наполнители поддерживают стабильность композиции, способность к распылению, переносимость пациентом и/или эффективность композиции при ингаляции.
Жидкие водные композиции согласно изобретению обычно имеют поверхностное натяжение приблизительно от 60 до 75 млМ/м, предпочтительно приблизительно от 64 до 71 млМ/м. В композицию согласно изобретению могут быть добавлены поверхностно-активные вещества. Эти поверхностно-активные вещества могут обеспечивать регуляцию скорости агрегации поликлонального иммуноглобулина в композиции (то есть, во время хранения и в резервуаре) и во время распыления (то есть, во время и после прохождения через сетку распылителя), что, тем самым будет оказывать влияние на активность поликлонального иммуноглобулина в аэрозоле. Следовательно, в одном варианте осуществления изобретения, композиция согласно изобретению представляет собой жидкую водную композицию, содержащую поверхностно-активное вещество, например, полисорбат, такой как полисорбат 80.
Распыление
Настоящее изобретение включает введение композиции в дыхательные пути индивидуума. Композиция согласно изобретению может быть введена в дыхательные пути индивидуума в виде аэрозоля, полученного распылением жидкой водной композиции согласно изобретению с использованием распылителя.
Распылитель представляет собой устройство, способное превращать жидкое вещество в дисперсную жидкую фазу в виде аэрозоля. Аэрозоль представляет собой систему, содержащую непрерывную газовую фазу и диспергированную в ней прерывистую или дисперсионную фазу твердых или жидких частиц, а обычно жидких частиц, если они образуются в результате распыления жидкой водной композиции.
Жидкую водную композицию согласно изобретению можно распылять с помощью сетчатого распылителя, ультразвукового распылителя или струйного распылителя или любого другого устройства, способного распылять композицию согласно изобретению. В одном варианте осуществления изобретения может быть использован сетчатый распылитель для получения аэрозоля, вводимого индивидууму. Так, например, могут быть использованы сетчатые распылители и генерируемые аэрозоли, как описано в заявке WO 2015/150510, которая в полном объеме включена в настоящее описание посредством ссылки.
Дисперсная жидкая фаза (аэрозоль) по существу состоит из жидких капелек. Капельки дисперсной фазы содержат поликлональные Ig, например IgG, IgA, IgM или их комбинации в жидкой среде. Жидкая среда, в основном, представляет собой водную фазу с дополнительными наполнителями или без них, как описано ниже. Специалисту в данной области будет очевидно, что особенности и предпочтения в отношении жидкой композиции, раскрытые в настоящей заявке, могут быть также применены и к дисперсной фазе аэрозоля, полученного из этой композиции, и наоборот.
Две величины, которые могут быть определены экспериментально и могут оказаться полезными для описания размера частиц или размера капелек генерируемого аэрозоля, представляют собой среднемассовый диаметр (MMD) и среднемассовый аэродинамический диаметр (MMAD). Разница между этими двумя величинами заключается в том, что MMAD нормализован на плотность воды (эквивалентная аэродинамика).
MMAD может быть измерен с помощью сепаратора частиц, например, каскадного сепаратора Андерсена (ACI) или сепаратора следующего поколения (NGI). В качестве альтернативы, для измерения MMD могут быть применены методы лазерной дифракции, например, Malvern MasterSizer X™.
Дисперсная фаза аэрозоля, генерируемого способом согласно изобретению, имеет частицы размер, которых, например, MMD составляет предпочтительно менее 10 мкм, предпочтительно приблизительно от 1 до приблизительно 6 мкм, более предпочтительно приблизительно от 1,5 до приблизительно 5 мкм, а еще более предпочтительно приблизительно от 2 до приблизительно 4,5 мкм. Альтернативно, частицы могут иметь MMAD предпочтительно менее 10 мкм, предпочтительно приблизительно от 1 до приблизительно 6 мкм, более предпочтительно приблизительно от 1,5 до приблизительно 5 мкм, а еще более предпочтительно приблизительно от 2 до приблизительно 4,5 мкм. Другим параметром, описывающим дисперсную фазу аэрозоля, является гранулометрический состав аэрозольных жидких частиц или капелек. Стандартное геометрическое отклонение (GSD) является часто используемым параметром для определения ширины распределения генерируемых аэрозольных частиц или капелек по размеру. При выборе точного MMD в пределах описанного выше диапазона следует учитывать область-мишень или ткань для осаждения аэрозоля. Так, например, оптимальный диаметр капелек будет отличаться в зависимости от того, осуществляют ли ингаляцию через рот, нос или трахею, а также от того, осуществляется ли доставка через верхние и/или нижние дыхательные пути (например, в ротоглотку, горло, трахею, бронхи, альвеолы, легкие, нос и/или придаточные пазухи носа). Кроме того, анатомическая геометрия, зависящая от возраста (например, геометрия носа, рта или дыхательных путей), а также респираторное заболевание и состояние индивидуума и характер его дыхания относятся к важным факторам, определяющим оптимальный размер частиц (например, MMD и GSD) для доставки лекарственного средства в нижние или верхние дыхательные пути.
Обычно, небольшие дыхательные пути с внутренним диаметром менее 2 мм составляют почти 99% объема легких, а поэтому играют важную роль в их функции. Альвеолы представляют собой участки в глубоких легких, где кислород и диоксид углерода обмениваются с кровью. Воспаление альвеол, вызываемое некоторыми вирусами или бактериями, приводит к секреции жидкости в определенном участке и непосредственно влияет на поглощение кислорода легкими. Терапевтическое нацеливание на глубокие легочные дыхательные пути с помощью аэрозолей требует, чтобы аэрозоли имели MMD ниже 5,0 мкм, предпочтительно ниже 4,0 мкм, более предпочтительно ниже 3,5 мкм, а еще более предпочтительно ниже 3,0 мкм. Поэтому такие значения MMD рассматриваются как подходящие для их использования в настоящем изобретении.
Для доставки аэрозоля в дыхательные пути, аэрозоль должен иметь MMD ниже 10,0 мкм, предпочтительно ниже 5,0 мкм, более предпочтительно ниже 3,3 мкм, а еще более предпочтительно ниже 2,0 мкм. Предпочтительно, MMD (размер капелек) составляет в пределах приблизительно от 1,0 до приблизительно 5,0 мкм, а распределение по размерам имеет GSD менее 2,2, предпочтительно менее 2,0, более предпочтительно менее 1,8 или даже более предпочтительно, менее 1,6. Такие параметры размера частиц и гранулометрического состава являются особенно подходящими для достижения высокой локальной концентрации лекарственного средства в дыхательных путях (например, в легких) человека, включая бронхи и бронхиолы, а особенно, количество лекарственного средства, которое находится в аэрозольной форме. В этом контексте необходимо учитывать, что для отложения глубоко в легких требуются меньший MMD, чем для осаждения в центральных дыхательных путях взрослых и детей, а для младенцев и детей младшего возраста, более предпочтительными являются капельки даже еще меньшего размера (MMD) в пределах приблизительно от 1,0 до приблизительно 3,3 мкм, а еще более предпочтительным является интервал менее 2,0 мкм. Таким образом, в аэрозольной терапии обычно оценивают фракцию капелек размером менее 5 мкм (представляющую собой фракцию, которую вдыхает взрослый человек) и менее 3,3 мкм (представляющую собой фракцию, которую вдыхает ребенок, или которая откладывается в более глубоких слоях легких взрослого человека). Кроме того, часто оценивают фракцию капелек размером менее 2 мкм, поскольку она представляет собой фракцию аэрозоля, которая может оптимально достигать терминального отдела бронхиол и альвеол у взрослых и детей и может проникать в легкие младенцев и детей младшего возраста.
В настоящем изобретении, доля капелек, имеющих размер частиц менее 5 мкм, предпочтительно, составляет более 65%, более предпочтительно, более 70%, а еще более предпочтительно, более 80%. Доля капелек, имеющих размер частиц менее 3,3 мкм, предпочтительно, составляет более 25%, более предпочтительно, более 30%, еще более предпочтительно, более 35%, а наиболее предпочтительно, более 40%. Доля капелек, имеющих размер частиц менее 2 мкм, предпочтительно составляет более 4%, более предпочтительно, более 6%, а еще более предпочтительно, более 8%.
Аэрозоль может быть также охарактеризован по его доставляемой дозе (DD), как было определено в экспериментах по моделированию дыхания. Доставленная доза может быть использована для расчета вдыхаемой дозы (RD), например, на основе вдыхаемой фракции (RF), измеренной с помощью лазерной дифракции (например, Malvern MasterSizer X™) или с использованием сепаратора частиц (например, каскадного сепаратора Андерсена - ACI или сепаратора следующего поколения - NGI). При применении способа согласно изобретению в эксперименте по моделированию дыхания (например, с использованием имитатора дыхания, такого как BRS3000 от Copley или Compass II™ от PARI) с учетом особенности дыхания взрослого человека (синусоидальный поток, дыхательный объем 500 мл, 15 вдохов/минуту), и при заполнении 2 мл композиции (например, 200 мг Ig, 200 мг IgG, 200 мг IgA, 200 мг IgM или их комбинации) в сетчатом распалителе, доставленная доза (DD) предпочтительно превышает 40% (80 мг Ig, например, IgG, IgA, IgM или их комбинации), более предпочтительно выше 45% (90 мг Ig, например, IgG, IgA, IgM или их комбинации) и даже более предпочтительно выше 50% (100 мг Ig, например IgG, IgA, IgM или их комбинации).
Для лечения верхних дыхательных путей, а в частности, носа, слизистой оболочки носа и/или придаточных пазух носа, остеомеатального комплекса и околоносовых полостей, особенно подходящим MMD является MMD приблизительно менее 5,0 мкм, или приблизительно менее 4,5 мкм, или приблизительно менее 4,0 мкм, или приблизительно менее 3,3, или приблизительно менее 3,0 мкм.
Эффективность полученного аэрозоля для нанесения на верхние дыхательные пути может быть оценена на моделях назальной ингаляции, таких как модель, смоделированная в виде носа человека, как описано в WO2009/027095. Для доставки аэрозоля в нос, например, существует устройство Sinus™ (струйный распылитель) от PARI, а также сетчатый распылитель (прототипы технологии Vibrent™).
Распылитель, используемый в настоящем изобретении, может представлять собой сетчатый распылитель. Предпочтительно, сетчатый распылитель представляет собой распылитель с вибрирующей мембраной. Распылители последнего типа содержат резервуар, в который наливают жидкость для распыления. При работе распылителя, жидкость подается на сетку, которая может колебаться, то есть, вибрировать (например, с помощью пьезоэлектрического элемента). Таким образом, жидкость, присутствующая на одной стороне вибрирующей сетки, переносится через отверстия в вибрирующей сетке (также называемые «порами» или «отверстиями») и принимает форму аэрозоля на другой стороне вибрирующей сетки (например, eFlow Rapid и eRapid от PARI, HL100 от Health and Life, а также AeronebGo и AeronebSolo от Aerogen). Такие распылители могут называться «активными мембранными распылителями».
В других подходящих сетчатых распылителях, композиция может распыляться посредством вибрации жидкости, а не мембраны. Такой распылитель с вибрирующей сеткой для текучей среды содержит резервуар, в который заливают распыляемую жидкость. При работе такого распылителя, жидкость подается на мембрану через систему подачи жидкости, которая будет колебаться (то есть, вибрировать, например, с помощью пьезоэлектрического элемента). Эта система подачи жидкости может представлять собой вибрирующую заднюю стенку резервуара (например, AerovectRx™ Technology, Pfeifer Technology) или вибрирующий скользящий механизм для подачи жидкости (например, устройство I-Neb™ от Respironics или устройство U22™ от Omron). Эти распылители могут называться «пассивными сетчатыми распылителями».
Для распыления жидкостей сетчатым распылителем существуют мембраны различных типов. Эти мембраны характеризуются различными размерами пор, которые генерируют аэрозоли с различными размерами капелек (MMD и GSD). В зависимости от свойств композиции и желаемых свойств аэрозоля могут использоваться мембраны различных типов (то есть, различные модифицированные сетчатые распылители или генераторы аэрозолей). В настоящем изобретении предпочтительно использовать такие типы мембран, которые генерируют аэрозоль с MMD в пределах от 2,0 мкм до 5,0 мкм, предпочтительно, в пределах от 3,0 мкм до 4,9 мкм, а более предпочтительно, в пределах от 3,4 мкм до 4,5 мкм. В другом варианте осуществления изобретения, предпочтительно использовать мембраны определенного типа, то есть, мембраны, встроенные в устройства для генерирования аэрозолей, например, изотонических физиологических растворов (NaCl, 0,9%) с MMD в пределах от 2,8 мкм до 5,5 мкм, предпочтительно, в пределах от 3,3 мкм до 5,0 мкм, а более предпочтительно, в пределах от 3,3 мкм до 4,4 мкм. В другом варианте осуществления изобретения, предпочтительно использовать мембраны определенного типа, то есть, мембраны, встроенные в устройства для генерирования аэрозолей, например, изотонических физиологических растворов с MMD в пределах от 2,8 мкм до 5,5 мкм, предпочтительно, в пределах от 2,9 мкм до 5,0 мкм, а более предпочтительно, в пределах от 3,8 мкм до 5,0 мкм.
Если лечение направлено на нижние дыхательные пути, такие как бронхи или глубокие легкие, то особенно предпочтительно, чтобы для продуцирования аэрозоля был выбран пьезоэлектрический распылитель перфорированного сетчатого типа. Примерами подходящих распылителей являются пассивный сетчатый распылитель, такой как I-Neb™, U22™, U1™, Micro Air™, ультразвуковой распылитель, например Multisonic™, и/или активный сетчатый распылитель, такой как HL100™, Respimate™, распылители eFlow™ Technology, устройства AeroNeb™, AeroNeb Pro™, AeronebGo™ и AeroDose™, а также прототипы устройств Pfeifer, Chrysalis (Philip Morris) или AerovectRx™. Особенно предпочтительным распылителем для доставки лекарственного средства в нижние дыхательные пути является распылитель с вибрирующей перфорированной мембраной или так называемый активный сетчатый распылитель, такой как, например, распылитель eFlow™ (электронный распылитель с вибрирующей мембраной, поставляемый PARI, Germany). Альтернативно, может быть использован пассивный сетчатый распылитель, например, U22™ или U1™ от Omron или распылитель, созданный на основе технологии Telemaq.fr или Ing. Erich Pfeiffer GmbH.
Предпочтительным сетчатым распылителем для нацеливания на верхние дыхательные пути является распылитель, который генерирует аэрозоль посредством перфорированной вибрирующей мембраны, а именно, модифицированный экспериментальный мембранный распылитель, созданный по технологии eFlow™, где такой распылитель также способен испускать пульсирующий поток воздуха, так, чтобы генерируемое аэрозольное облако пульсировало (то есть, подвергалось колебаниям давления) в желаемом участке или во время переноса аэрозольного облака в желаемый участок (например, в придаточные пазухи носа или в околоносовые пазухи носа). Распылитель этого типа имеет носовую часть для направления потока, переносящего облако аэрозоля в нос. Аэрозоли, доставляемые таким модифицированным электронным распылителем, могут достигать придаточных пазух носа или околоносовых пазух намного лучше, чем если бы аэрозоль доставлялся в непрерывном (непульсирующем) режиме. Пульсирующие волны давления обеспечивают более интенсивную вентиляцию носовых пазух, а поэтому, сопутствующий аэрозоль лучше распределяется и осаждается в этих полостях.
Более конкретно, предпочтительный распылитель для доставки в верхние дыхательные пути индивидуума представляет собой распылитель, адаптированный для генерирования аэрозоля с эффективной скоростью потока приблизительно менее, чем 5 литров/минуту, и одновременно, для работы устройства, создающего колебания давления аэрозоля при частоте в пределах приблизительно от 10 до приблизительно 90 Гц, где эффективная скорость потока представляет собой скорость потока аэрозоля, когда он попадает в дыхательную систему индивидуума. Примеры таких электронных распылительных устройств раскрыты в WO2009/027095.
В предпочтительном варианте осуществления изобретения, распылитель для доставки в верхние дыхательные пути представляет собой распылитель, где используется воздушный поток, который может прерываться, когда облако аэрозоля достигает нужного участка, после чего запускается пульсация облака аэрозоля, например, в переменном режиме. Подробное описание приводится в WO2010/097119 и WO2011/134940.
Независимо от того, адаптирован ли распылитель для доставки через легкие или носовые пазухи, предпочтительно выбирать или адаптировать его так, чтобы он был способен распылять унифицированную дозу с предпочтительной скоростью на выходе. Унифицированная доза определяется здесь как объем жидкой водной композиции, содержащей эффективное количество активного соединения, то есть, Ig, IgG, IgA, IgM или их комбинаций, предназначенных для однократного введения. Предпочтительно, распылитель может доставлять такую унифицированную дозу со скоростью по меньшей мере 0,1 мл/минуту или, если относительная плотность композиции будет составлять приблизительно 1, то со скоростью по меньшей мере 100 мг/минуту. Более предпочтительно, чтобы распылитель мог создавать скорость на выходе по меньшей мере 0,4 мл/минуту или 400 мг/минуту, соответственно. В дополнительных вариантах осуществления изобретения, скорость выхода жидкости из распылителя или из генератора аэрозоля составляет по меньшей мере 0,50 мл/минуту, предпочтительно, по меньшей мере 0,55 мл/минуту, более предпочтительно, по меньшей мере 0,60 мл/минуту, даже более предпочтительно по меньшей мере 0,65 мл/минуту, а наиболее предпочтительно, по меньшей мере 0,7 мл/минуту, и такие устройства называются генератором аэрозолей с высокой производительностью или высокой скоростью выхода. Предпочтительно, скорость выхода жидкости составляет в пределах приблизительно от 0,35 до приблизительно 1,0 мл/минуту или приблизительно от 350 до приблизительно 1000 мг/минуту; а предпочтительно скорость выхода жидкости составляет в пределах приблизительно от 0,5 до приблизительно 0,90 мл/минуту или приблизительно от 500 до приблизительно 800 мг/минуту. Скорость выхода жидкости означает количество жидкой композиции, распыляемой за единицу времени. Жидкость может содержать активное соединение, лекарственное средство, Ig, IgG, IgA, IgM или их комбинации и/или заменитель, такой как 0,9% хлорид натрия.
Производительность распылителя обычно должна быть выбрана так, чтобы она обеспечивала короткое время распыления жидкой композиции. Очевидно, что время распыления будет зависеть от объема композиции, которая должна распыляться, и от скорости выхода. Предпочтительно, чтобы распылитель был выбран или адаптирован для распыления объема жидкой композиции, содержащей эффективную дозу поликлонального Ig, например, IgG, IgA, IgM или их комбинации в течение не более, чем 20 минут. Более предпочтительно, чтобы время распыления на единицу дозы составляло не более 15 минут. В другом варианте осуществления изобретения, распылитель выбирают или адаптируют так, чтобы время распыления на единицу дозы составляло не более 10 минут, более предпочтительно не более 6 минут, а еще более предпочтительно не более 3 минут. В настоящее время наиболее предпочтительным является время распыления в пределах от 0,5 до 5 минут.
Объем распыляемой композиции согласно изобретению, предпочтительно должен быть низким, то есть, чтобы обеспечить короткое время распыления. Объем, также называемый объемом дозы или объемом унифицированной дозы, или объемом стандартной дозы, следует понимать как объем, который предназначен для однократного введения или сеанса терапии с использованием распылителя. В частности, такой объем может составлять в пределах от 0,3 мл до 6,0 мл, предпочтительно от 0,5 мл до 4,0 мл, или более предпочтительно, от 1,0 мл до приблизительно 3,0 мл, или даже более предпочтительно, приблизительно 2,0 мл. В случае, если остаточный объем является желательным или полезным, то этот остаточный объем должен составлять менее, чем 1,0 мл, более предпочтительно, менее, чем 0,5 мл, а наиболее предпочтительно, менее, чем 0,3 мл. Следовательно, эффективный объем распыления предпочтительно будет составлять в пределах от 0,2 до 3,0 мл или от 0,5 до 2,5 мл, или более предпочтительно, в пределах от 0,75 до 2,5 мл или от 1,0 до 2,5 мл.
Предпочтительно, распылитель должен быть адаптирован для генерирования аэрозоля, где основная часть загруженной дозы жидкой композиции доставляется в виде аэрозоля, то есть, он должен иметь высокую производительность. Более конкретно, распылитель должен быть адаптирован для генерирования аэрозоля, содержащего по меньшей мере 50% дозы Ig, например, IgG, IgA, IgM или их комбинации в композиции, или, другими словами, он должен выделять по меньшей мере 50% жидкой композиции, заполненной в резервуар. В частности, по сравнению с моноклональными антителами, дозы которых не должны быть такими высокими из-за их специфичности, важно выбрать такой распылитель, который мог бы генерировать такой высокий выход поликлонального Ig, например IgG, IgA, IgM или их комбинации. Было обнаружено, что сетчатый распылитель, используемый в способе согласно изобретению, способен генерировать аэрозоль поликлонального Ig, например, IgG, IgA, IgM или их комбинации, то есть, композицию с очень высоким выходом.
Ингаляция сухого порошка
Композиция согласно изобретению может также представлять собой сухой порошок. Существуют различные формы ингаляторов сухого порошка, такие как капсульные ингаляторы сухого порошка и ингаляторы сухого порошка для многократного приема; однократные лекарственные формы, такие как роторный ингалятор; ингаляторы для многократного приема, такие как Accuhaler; и дисковые ингаляторы. Ингаляторы сухого порошка могут быть предпочтительными, поскольку они обеспечивают простую в использовании и быструю систему ингаляции, подходящую для более частого использования.
Введение доз
Композиция согласно изобретению предназначена для профилактики или лечения обострения.
В одном варианте осуществления изобретения, композиция согласно изобретению предназначена для профилактики обострения у индивидуума с хронической болезнью легких (обычно ХОБЛ или БЭБКФ), где такую композицию вводят в качестве поддерживающей терапии. Поддерживающая терапия означает терапию, которую проводят индивидууму после начальной терапии и продолжают в течение длительного периода времени. Так, например, терапия может продолжаться в течение по меньшей мере шести месяцев. Обычно, терапия может продолжаться в течение по меньшей мере одного года.
Композицию согласно изобретению вводят в дыхательные пути индивидуума, обычно в виде аэрозоля. В частности, аэрозоль может быть получен из жидкой водной композиции с использованием распылителя. Подходящие жидкие водные композиции описаны выше. В предпочтительном варианте осуществления изобретения, жидкая водная композиция имеет концентрацию поликлонального иммуноглобулина (например, IgG, IgA, IgM или их комбинации) приблизительно от 50 мг/мл до приблизительно 150 мг/мл, например, приблизительно 100 мг/мл.
Для введения в дыхательные пути индивидууму согласно изобретению, жидкая водная композиция, используемая для образования аэрозоля, может быть введена в объеме 2-10 мл.
Для применения в целях лечения или профилактики обострений (а обычно, профилактики), например, обострений ХОБЛ или БЭБКФ, композиция может быть введена один раз через каждые 48 часов, один раз через каждые 24 часа или один раз через каждые 12 часов во время терапии. В конкретном варианте осуществления изобретения, композицию согласно изобретению вводят один раз через каждые 12 часов. В конкретном варианте осуществления изобретения, композицию согласно изобретению вводят через каждые 24 часа. В конкретном варианте осуществления изобретения, композицию согласно изобретению вводят через каждые 48 часов.
Доза, используемая в целях профилактики или лечения обострений (обычно профилактики), например обострений ХОБЛ или БЭБКФ, составляет приблизительно от 0,01 г до приблизительно 1,5 г поликлонального иммуноглобулина. Особенно подходящая доза композиции согласно изобретению составляет приблизительно от 0,1 г до приблизительно 1,5 г поликлонального иммуноглобулина, например, такая доза составляет приблизительно от 0,2 г до приблизительно 1 г, а в частности, приблизительно 0,2 г. В конкретном варианте осуществления изобретения, дозу приблизительно 0,2 г вводят один раз в день.
Такие дозы могут быть скорректированы в зависимости от факторов, которые могут увеличить риск обострений, например, риск инфекции дыхательных путей. Так, например, доза и/или частота введения согласно изобретению могут быть увеличены в осенние и зимние месяцы, а особенно в зимние месяцы.
В другом варианте осуществления изобретения, аэрозоль может быть получен из сухой композиции с использованием ингалятора сухого порошка. Обычно, доза, доставлемая за одно введение, может быть относительно низкой, например, она мжет составлять приблизительно 0,5 мг, однако, индивидуум может делать несколько ингаляций в день, например, от одной до приблизительно двадцати, предпочтительно от двух до приблизительно пятнадцати ингаляций в течение дня.
Сезонное введение
Терапия (профилактика или лечение) согласно изобретению является особенно подходящей в более холодную погоду, что связано с увеличением частоты инфекций дыхательных путей и обострений у индивидуумов с хроническими болезнями легких, а обычно с ХОБЛ и/или БЭБКФ. В одном варианте осуществления изобретения, композицию вводят в осенние и/или зимние месяцы. В частности, композицию вводят в зимние месяцы. Частота обострений ХОБЛ подвержена сезонным колебаниям с более высокими показателями в осенние и зимние месяцы [19]. Такое увеличение числа обострений может быть вызвано увеличением случаев инфекций дыхательных путей, например, риновирусных инфекций. Соответственно, введение композиции в осенние и зимние месяцы обеспечивает защиту от таких инфекций в период повышенного риска.
Считается, что такие сезонные изменения влияют на всех индивидуумов с ХОБЛ, а поэтому такое сезонное введение, например, в осенние и зимние месяцы, а в частности в зимние месяцы, полезно для любого индивидуума с охарактеризованной здесь ХОБЛ. Сходство между ХОБЛ и БЭБКФ, а в частности, что касается обострений, которые могут быть вызваны инфекциями дыхательных путей, позволяет предположить, что такое сезонно изменяющееся введение, как и ожидается, будет полезным для индивидуума с БЭБКФ.
Используемый здесь термин «осенние месяцы» относится к месяцам, которые обычно приходятся на непогоду или осень. В северном полушарии, такими месяцами являются сентябрь, октябрь и ноябрь. В южном полушарии, такими месяцами являются март, апрель и май.
Используемый здесь термин «зимние месяцы» означает месяцы, которые обычно приходятся на зиму. В северном полушарии, такими месяцами являются октябрь, ноябрь, декабрь, январь и февраль. В южном полушарии, такими месяцами являются апрель, май, июнь, июль и август.
Комбинированная терапия с использованием антибиотиков
Поликлональный иммуноглобулин согласно изобретению является особенно подходящим для его введения в комбинации с антибиотиком, например, для профилактики или лечения бактериальной инфекции дыхательных путей у индивидуума с хронической болезнью легких, а обычно с ХОБЛ и/или БЭБКФ.
В одном варианте осуществления изобретения, композицию согласно изобретению вводят вместе с антибиотиком во время острой фазы бактериальной инфекции, когда индивидуум проходит терапию антибиотиками, то есть, композицию вводят в течение первых двух дней, а в частности, в течение первых трех дней, в течение в первые четырех дней или в течение первых пяти дней заражения в дополнение к стандартной терапии антибиотиками.
Общие определения
Термин «содержащий» охватывает «включающий», а также «состоящий», например композиция, «содержащая» X, может состоять исключительно из X или может включать дополнительные компоненты, например, X+Y. Слово «по существу» не исключает понятия «полностью», например, композиция, которая «по существу не содержит» Y, может полностью не содержать Y. При необходимости, слово «по существу» может быть опущено из определения изобретения.
Термин «приблизительно», если он относится к числовому значению x, необязательно является точным и означает, например, x ± 10%. Композиция согласно изобретению представляет собой композицию, содержащую поликлональный иммуноглобулин. Если это не оговорено особо, то эффект, приписываемый композиции, опосредуется поликлональным иммуноглобулином, а не каким-либо дополнительным компонентом.
Если это не оговорено особо, то способ, включающий стадию смешивания двух или более компонентов, не требует какого-либо конкретного порядка смешивания. Таким образом, компоненты можно смешивать в любом порядке. Если есть три компонента, то два компонента могут быть объединены друг с другом, а затем эта комбинация может быть объединена с третьим компонентом и т.п.
Краткое описание чертежей
Настоящее изобретение проиллюстрировано на нижеследующих неограничивающих примерах со ссылкой на следующие чертежи:
Фигура 1. Композиции Ab, полученных из плазмы, взаимодействуют с Pseudomonas aeruginosa (PA). Связывание возрастающих концентраций Ab плазмы или секреторных IgA/M с нанесенными PA, как было определено с помощью ELISA.
Фигура 2. Связывание композиции IgG, полученного из плазмы, с PA, стимулирует агглютинацию. Полученные с помощью лазерной сканирующей конфокальной микроскопии изображения иммунных комплексов PA, связанных с IgG, выделенным из плазмы. Бактерии метили CFSE и IgG с использованием красителя Cy3. Изображения представляют одно наблюдаемое поле, полученное после 5-10 наблюдений на двух независимых предметных стеклах.
Фигура 3. Композиция иммуноглобулина, полученного из плазмы, стимулирует PA-индуцированное высвобождение LDH из ткани. Повреждение тканей оценивали путем измерения уровня высвобождения LDH в базолатеральной среде MucilAir™. Неинфицированные транслунки, в которые вводили только носитель или препараты иммуноглобулина, полученного из плазмы, служили в качестве контроля. PA-инфицированные транслунки служили в качестве позитивного контроля. Данные представлены для 3 независимых экспериментов.
Фигура 4. Композиция IgG, полученного из плазмы, предотвращает потерю трансэпителиального электрического сопротивления в зависимости от дозы. Целостность ткани оценивали путем измерения трансэпителиального электрического сопротивления. Неинфицированные и обработанные пролином транслунки служили в качестве негативного контроля, а PA-инфицированные транслунки служили в качестве позитивного контроля для оценки повреждения ткани. Данные представлены для 3 независимых экспериментов.
Фигура 5. Композиция IgG, полученного из плазмы, предотвращает PA-индуцированные повреждения тканей в зависимости от дозы. Полученные с помощью лазерной сканирующей конфокальной микроскопии изображения фиксированных в парафине срезов MucilAir™ анализировали на экспрессию цитокератина и бета-тубулина. Неинфицированные транслунки, содержащие только носитель или композиции IgG, служили в качестве контроля. PA-инфицированные транслунки, обработанные носителем, служили в качестве позитивного контроля. Данные представлены для 3 независимых экспериментов.
Фигура 6. Композиция иммуноглобулина, полученного из плазмы, снижает PA-индуцированное высвобождение IL-8 эпителиальными клетками. IL-8 оценивали в базолатеральной среде MucilAir™. Неинфицированные транслунки, в которые вводили только носитель или препараты иммуноглобулина, служили в качестве контроля. PA-инфицированные транслунки, обработанные пролином, служили в качестве позитивного контроля. Данные представлены для 3 независимых экспериментов.
Фигура 7. Композиция IgG, полученного из плазмы, снижает PA-индуцированное высвобождение IL-8 эпителиальными клетками в зависимости от дозы. Относительные концентрации секретированного IL-8 вычисляли по отношению к IL-8, секретируемому MucilAir™ при обработке 10 КОЕ PA в течение 24 часов. Неинфицированные транслунки, в которые вводили только носитель или препараты иммуноглобулина, служили в качестве контроля. PA-инфицированные транслунки, обработанные пролином, служили в качестве позитивного контроля. Данные представлены для одного эксперимента, проводимого с использованием MucilAir™, для 3 разных доноров на каждое состояние.
Фигура 8. Композиция Ab, полученного из плазмы, снижает PA-индуцированное высвобождение IL-6 эпителиальными клетками. IL-6 оценивали в базолатеральной среде MucilAir™. Неинфицированные транслунки, в которые вводили только носитель или препараты иммуноглобулина, служили в качестве контроля. PA-инфицированные транслунки, обработанные носителем, служили в качестве позитивного контроля. Данные представлены для 3 независимых экспериментов.
Фигура 9. Композиции Ab, полученных из плазмы, взаимодействуют с человеческим риновирусом С15. Связывание возрастающих концентраций Ab плазмы или секреторных IgA/M с оболочечным HRV C15, как было определено с помощью ELISA.
Фигура 10. Ab, полученные из плазмы, снижают высвобождение HRV. Число копий генома HRV-C15 оценивали в верхних промывках с помощью кол.ПЦР. Транслунки, инфицированные HRV и обработанные пролином, служили в качестве позитивного контроля для оценки инфекции. Для оценки эффективности, транслунки, обработанные рупинтривиром, служили в качестве позитивного контроля.
Фигура 11. Ab, полученные из плазмы, снижают повреждение тканей, вызванное HRV. Целостность тканей оценивали путем измерения трансэпителиального электрического сопротивления. Неинфицированные транслунки, обработанные пролином, служили в качестве негативного контроля. Транслунки, инфицированные HRV и обработанные пролином, служили в качестве позитивного контроля для оценки инфекции. Для оценки эффективности, транслунки, обработанные рупинтривиром, служили в качестве позитивного контроля.
Фигура 12. Ab, полученные из плазмы, предотвращают HRV-индуцированное снижение мукоцилиарного клиренса. Мукоцилиарный клиренс оценивали путем измерения скорости высвобождения полистироловых микросфер диаметром 30 мкм, добавленных на верхнюю поверхность MucilAir™. Неинфицированные транслунки, обработанные пролином, служили в качестве негативного контроля. Транслунки, инфицированные HRV и обработанные пролином, служили в качестве позитивного контроля для оценки инфекции. Для оценки эффективности, транслунки, обработанные рупинтривиром, служили в качестве позитивного контроля.
Фигура 13. Композиции иммуноглобулинов, полученных из плазмы, ингибируют пролиферацию HRV в зависимости от дозы. Число копий генома HRV-C15 оценивали в верхних промывках с помощью кол.ПЦР после обработки 4 мкг/лунку, 20 мкг/лунку, 100 мкг/лунку и 500 мкг/лунку различных композиций иммуноглобулинов. Транслунки, инфицированные HRV и обработанные пролином, служили в качестве позитивного контроля для оценки инфекции. Для оценки эффективности, транслунки, обработанные рупинтривиром, служили в качестве позитивного контроля.
Фигура 14. Композиции иммуноглобулинов, полученных из плазмы, ингибируют пролиферацию вируса гриппа в зависимости от дозы. Число копий генома вируса гриппа оценивали в верхних промывках с помощью кол.ПЦР после обработки 4 мкг/лунку, 20 мкг/лунку, 100 мкг/лунку и 500 мкг/лунку различных композиций иммуноглобулинов. Транслунки, инфицированные вирусом гриппа и обработанные пролином, служили в качестве позитивного контроля для оценки инфекции. Для оценки эффективности, транслунки, обработанные оселтамивиром, служили в качестве позитивного контроля.
Способы осуществления изобретения
Нижеследующие неограничивающие примеры приводятся для иллюстрации настоящего изобретения.
Исследования, представленные в приведенных ниже примерах, показали, что иммуноглобулин, доставляемый в ткань дыхательных путей, может оказывать комбинированное противомикробное (иммунное исключение) и противовоспалительное действие, и, следовательно, является привлекательным вариантом для эффективного лечения или профилактики обострения, а в частности, обострения, ассоциированного с инфекцией, у индивидуумов, страдающих хроническими болезнями легких, такими как ХОБЛ и БЭБКФ. В частности, иммуноглобулин является подходящим для поддерживающей терапии у индивидуумов с этими заболеваниями для профилактики хронических инфекций и обострений.
Защита слизистых оболочек от колонизации и возможного проникновения и инвазии микробов обеспечивается комбинацией конститутивных, неспецифических веществ (слизи, лизоцима и дефензинов), а также специфическими иммунными механизмами, включая секреторные Ig (SIg) на гуморальном уровне [20;21]. In vivo, экспериментальная и клиническая резистентность к инфекции может коррелировать со специфическими секреторными антителами IgA (SIgA) (Ab), служащими иммунологическим барьером на поверхности слизистых оболочек [22;23]. Считается, что агрегация, иммобилизация и нейтрализация патогенов на поверхностях слизистой облегчается благодаря поливалентности SIgA [24;25]. SIgM, служащий в качестве суррогата SIgA у индивидуумов с дефицитом IgA, по-видимому, действует по аналогичному защитному механизму [26].
Для некоторых патогенов, таких как полиовирус, сальмонелла или вирус гриппа, защита от инфекции слизистой оболочки может быть индуцирована благодаря активной иммунизации слизистой оболочки лицензированными вакцинами. Однако, для большинства патогенов слизистых оболочек пока не существует активных вакцин. В качестве альтернативы, защитные уровни Ab могут быть обеспечены непосредственно на поверхности слизистой путем пассивной иммунизации. В природе, это происходит физиологически у многих видов млекопитающих посредством передачи материнских антител их потомству через молоко [27]. Исследования, проводимые с участием человека и животных путем пассивной иммунизации слизистой, продемонстрировали, что молекулы антител pIgA и SIgA, вводимые перорально, интраназально, внутриматочно или в легкие, могут предотвращать, снижать или удалять бактериальные и вирусные инфекции [28]. Однако, секреторная форма IgA, наблюдаемая в природе на поверхности слизистых, использовалась редко, и на сегодняшний день, крупномасштабное производство SIgA невозможно. Создание SIgA с применением биотехнологических методов является сложной задачей, но такие молекулы могут иметь важное клиническое применение [29]. То же самое относится и к IgM, содержащим секреторный компонент.
Иммуноглобулины, полученные из плазмы, использовались в течение многих десятилетий для защиты пациентов с иммунодефицитом от потенциально смертельных инфекций [30]. Иммуноглобулины, полученные из плазмы, обычно имеют высокую степень чистоты в отношении IgG. Однако, существует несколько продуктов IgG, обогащенных IgM (например, ПентаглобинTM). Доставку иммуноглобулинов плазмы осуществляют внутривенно или подкожно, что обеспечивает системное распределение иммуноглобулинов по всему организму. Хотя было показано, что заместительная Ig-терапия снижает заболеваемость пневмонией у пациентов с иммунодефицитом, однако, похоже, что она оказывает ограниченное влияние на инфекции верхних дыхательных путей, а также инфекции бронхов. Местное применение иммуноглобулинов плазмы может поддерживать более высокое содержание Ig на поверхности слизистой оболочки без необходимости увеличения системной доставки Ig.
HRV и PA были выбраны для проверки эффективности иммуноглобулинов плазмы с точки зрения профилактики инфицирования эпителиальной ткани из-за их основной роли в обострениях ХОБЛ и БЭБКФ. Для лучшей имитации ситуации у человека была использована модель дыхательных путей на основе человеческих первичных клеток, MucilAir™ (Epithelix Sàrl, Geneva). MucilAir™ представляет собой клеточнуюя модель эпителия дыхательных путей человека, воссозданную in vitro. MucilAir™-Pool состоит из смеси назальных или бронхиальных клеток, полученных от 14 различных или уникальных доноров соответственно. Модель, культивированная на границе раздела воздух-жидкость, демонстрирует высокое трансэпителиальное электрическое сопротивление, ресничное биение, а также образование слизи, что указывает на полную функциональность эпителиальной ткани, как если бы она существовала in vivo. Высвобождение цитокинов (например, IL-8 и IL-6), а также высвобождение лактатдегидрогеназы (LDH) может быть детектировано во время инфицирования, что отражает связь такой инфекции с воспалением и повреждением тканей в этой модели.
Материалы и методы
Инфицирование дыхательных путей начинается с осаждения патогенных бактерий и вирусов на верхней стороне эпителия дыхательных путей. Чтобы добраться до ткани, вирусы заражают эпителиальные клетки, в то время как бактерии, обычно повреждают клетки посредством выделения экзотоксинов. Модель инфицирования Pseudomonas aeruginosa использовали для проверки эффективности иммуноглобулинов плазмы с точки зрения профилактики повреждения тканей.
Бактериальный штамм
Pseudomonas aeruginosa (PA), используемая для этой модели, представляет собой клинический изолят, полученный из Института Инфекционных Заболеваний (Бернский университет, Швейцария). PA представляет собой патогенный микроорганизм, вызывающий заболевание у человека и ответственный за легочные инфекции. PA культивировали на чашках Петри с кровяным агаром. Затем отбирали колонию и культивировали в среде с сердечно-мозговым бульоном (BHI) в течение 24 часов при 37°C и при 400 оборотах в минуту (RPM). На следующий день, культуру разводили 1:10 свежей средой BHI и помещали еще на один час при 37°C и при 400 оборотах в минуту. Затем измеряли OD и оценивали количество бактерий по кривой OD/бактериальная нагрузка, которая была построена для множества культур в предыдущем эксперименте. Аликвоту собирали для дальнейшего разведния перед дозированием, а вторую аликвоту собирали для дальнейшего посева на чашки с кровяным агаром для точной проверки бактериальной нагрузки.
Вирусные штаммы
Риновирус C15 представляет собой клинический изолят (название S07-09-08-U), полученный из клиники в Женеве. Исходные вирусы получали в культурах MucilAir™ и разводили в культуральной среде, но их не очищали и не концентрировали.
Для исследований на зависимость «доза-ответ», риновирус C15 (2009) и вирус гриппа A/Switzerland/7717739/2013 (H1N1) были нанесены непосредственно на MucilAir™ из клинических образцов, как описано в [31]. Штаммы вирусов для этих экспериментов получали на MucilAir™, а затем собирали верхние промывеи с культуральной средой. Продукты, полученные за несколько дней, объединяли и количественно оценивали с помощью кол.ПЦР, после чего разделяли на аликвоты и хранили при −80°C.
Ткань
MucilAir™ (Epithelix Sàrl, Geneva) использовали для имитации тканей бронхов человека. Для каждой исследуемой группы использовали 3 транслунки MucilAir™, где каждая транслунка имела образец, взятый либо от одного конкретного донора, либо из смеси образцов от 14 доноров, участвующих в исследованиях на зависимость «доза-ответ». Культивирование в MucilAir™ проводили на границе раздела воздух-жидкость. Средой, используемой на базолатеральной стороне, является культуральная среда MucilAir™ (Epithelix Sàrl, Geneva), которая содержала факторы роста и феноловый красный. Эта среда не содержала сыворотку.
Модель инфицирования Pseudomonas aeruginosa и лечение
Модель PA-заражения была получена на основе осаждения по меньшей мере 10 колониеобразующих единиц (КОЕ) PA на верхней стороне одной транслунки MucilAir™ в объеме 10 мкл. За 24 часа, PA достигала >109 КОЕ/транслунку. Инфекция приводила к высвобождению лактатдегидрогеназы (LDH) (ассоциированому с повреждением тканей) и провоспалительных молекул, таких как IL-8 и IL-6. О повреждении ткани также свидетельствует появление в ней отверстий и потеря трансэпителиального электрического сопротивления.
В некоторых экспериментах, иммуноглобулины осаждали за 10 минут до инфицирования бактериями или одновременно. Иммуноглобулины наносили в конечном объеме 10 мкл. Эффекты иммуноглобулинов сравнивали с эффектами раствора-носителя (25 мМ пролина).
Модель инфицирования человеческим риновирусом C15 и вирусом гриппа H1N1 и лечение
При t=0, 15 мкл исходного раствора 3,8 × 107 копий генома/мл HRV C15 (клинический штамм: S07-09-08-U) в эксперименте по подтверждению концепции (фигура 10) и 10 мкл 1,0 × 108 копий генома/мл для HRV и вируса гриппа H1N1 в исследованиях на зависимость «доза-ответ» (фигуры 13 и 14) наносили на верхнюю сторону MucilAir™ и оставляли на 3 часа при 34°С и 5% CO2. Иммуноглобулины наносили одновременно с вирусами в объеме 5 мкл на верхнюю поверхность MucilAir™ и обновляли через 3,5 и 24 часа. Эффекты иммуноглобулинов сравнивали с эффектами раствора носителя (25 мМ пролина). Через три часа после инокуляции, эпителий три раза промывали PBS (с Ca2+/Mg2+) для очистки инокулята.
Бесклеточные верхние промывки (20 минут) с 200 мкл культуральной среды MucilAir™ собирали через 3,5 часа после инокуляции, а затем через 24 и 48 часов и хранили при −80°C. Иммуноглобулины
Препараты IgG, полученных из человеческой плазмы (IgPro10, Privigen), приготавливали как описано в литературе [32]. Препараты, содержащие IgA и IgM, получали из боковой фракции после проведения ионообменной хроматографии, используемой в крупномасштабном продуцировании IgG из плазмы человека. Фракцию элюата, содержащую IgA и IgM, концентрировали и повторно забуферивали до 50 г/л белка в PBS путем фильтрации в тангенциальном потоке (TFF; Pellicon XL Biomax 30, Merck Millipore). Полученный раствор IgA/M, который содержал IgA и IgM в массовом отношении 2:1, был дополнительно обработан SCIgA/M путем объединения in vitro IgA/M с рекомбинантным человеческим SC [33].
ELISA
Высвобождение провоспалительных цитокинов бронхиальной тканью человека при инфицировании оценивали в аликвоте базолатеральной среды, собранной через 24 часа после инфицирования. В частности, оценивали IL-8 (RnD Systems; DY208) и IL-6 (RnD Systems; DY206). Измерения проводили в соответствии с инструкцией для пользователя.
Для ELISA-анализа на PA, PA культивировали в течение ночи при 37°C в среде с бульоном Тодда Хьюита BBL. PA осаждали центрифугированием (3220× g) в течение 10 минут. Супернатант удаляли, и осадок два раза промывали 0,1 М карбонатным буфером (pH 9,6). Осадок ресуспендировали в карбонатном буфере, и на планшет с полисорбатом добавляли 50 мкл/лунку 4 × 106 бактерий. Покрытие проводили в течение ночи при 2-8°С. На следующий день, лунки 3 раза промывали PBS/Твином (0,05%) и блокировали PBS/FCS (2,5%) в течение 1,5 часа при комнатной температуре. Затем лунки 3 раза промывали PBS/Твином (0,05%). Препараты Ig (0,7 мкг/мл-500 мкг/мл) добавляли в лунки на 2 часа при комнатной температуре. После двукратной промывки PBS/Твином (0,05%), «второе» антитело, то есть, ПХ-конъюгированное козье антитело против человеческого IgG/A/M (1 мг/мл, 1:2000 в блокирующем буфере), инкубировали на образцах в течение 2 часов при комнатной температуре. Конечные промывки PBS/Твином (0,05%) проводили 3 раза перед использованием субстрата пероксидазы TMB. Образование синего осадка было прямо пропорционально количеству фермента в каждой лунке. Ферментативную реакцию прекращали добавлением 50 мкл/лунку 1M HCl. Поглощение измеряли на 450 нм (эталонная длина волны 620 нм). Среднее контрольное поглощение для каждого из трех повторностей вычитали из поглощения, оцениваемого в планшетах, покрытых бактериями.
Для ELISA-анализа на риновирус, на планшет Maxisorp (Nunc) наносили покрытие в течение ночи путем обработки исходным очищенным риновирусом C (3 × 106/мл; клиническое название: S07-09-09-U) (2-4°C) в 0,1 М карбонатном буфере. На второй планшет Maxisorp наносили покрытие путем обработки 5% BSA в 0,1 М карбонатном буфере, и этот планшет служил в качестве контроля. На следующий день, лунки промывали 3 раза PBS/Твином (0,05%) и блокировали PBS/FCS (2,5%) в течение 1,5 часа при комнатной температуре. Затем лунки 3 раза промывали PBS/Твином (0,05%). Препараты Ig (0,7 мкг/мл-500 мкг/мл) добавляли в лунки на 2 часа при комнатной температуре. После двукратной промывки PBS/Твином (0,05%), «второе» антитело, то есть, ПХ-конъюгированное козье антитело против человеческого IgG/A/M (1 мг/мл, 1:2000 в блокирующем буфере), инкубировали на образцах в течение 2 часов при комнатной температуре. Конечные промывки PBS/Твином (0,05%) проводили 3 раза перед использованием субстрата пероксидазы TMB. Образование синего осадка было прямо пропорционально количеству фермента в каждой лунке. Ферментативную реакцию прекращали добавлением 50 мкл/лунку 1M HCl. Поглощение измеряли на 450 нм (эталонная длина волны 620 нм). Среднее контрольное поглощение для каждого из трех повторностей вычитали из поглощения, оцениваемого в планшетах, покрытых вирусом.
Иммуногистология
Повреждение тканей оценивали с помощью лазерной сканирующей конфокальной микроскопии. Ткани приготавливали следующим образом. Транслунки MucilAir™ один раз промывали PBS и фиксировали в течение ночи при 4°C в 4% параформальдегиде. На следующий день, транслунки 3 раза промывали PBS, и ткани обрабатывали охлажденным льдом метанолом в течение 30 минут при -20°C. Затем, ткани 3 раза промывали PBS, и проводили стадию блокирования в течение ночи при 4°C с использованием 3% козьей сыворотки в PBS. После проведения еще одной стадии промывки PBS (3 раза), окрашивание ткани проводили в течение 48-72 часов при 4°C с использованием антитела против цитокератина (Abcam; ab192643) (1/200), антитела против бета-тубулина (Abcam; ab11309) (1/200) и DAPI (Sigma D9542) (1/2000), где все эти реагенты были разведены в PBS. Затем, ткани 3 раза промывали в PBS и отделяли от транслунок. Затем ткани помещали на предметные стекла, покрытые средой для заливки и покровным стеклом. Предметные стекла выдерживали в течение 24 часов при комнатной температуре, чтобы дать им высохнуть, а затем их визуализировали на конфокальном микроскопе Zeiss LSM800.
Трансэпителиальное электрическое сопротивление (TEER)
TEER представляет собой динамический параметр, отражающий состояние эпителия. Однако, на него может влиять несколько факторов. Так, например, при наличии отверстий или при потере плотной клеточной стыковки, величины TEER будут достигать значений ниже 100 Ом/см2. И наоборот, если эпителий является неповрежденным, то величина TEER обычно превышает 200 Ом/см2.
Необработанные образцы, а также образцы, обработанные носителем без вирусов или бактерий, служили в качестве негативного контроля, тогда как 10% Тритон X-100 использовали в качестве позитивного контроля.
Для измерения величины TEER, в верхний отдел культур MucilAir™ добавляли 200 мкл среды MucilAir™ и измеряли сопротивление с помощью вольтомметра EVOMX (World Precision Instruments UK, Stevenage) для каждого условия. Величины сопротивления (Ом) были преобразованы в TEER (Ом/см2) по следующей формуле:
TEER (Ом/см2) = (сопротивление (Ом) - 100 (Ом)) × 0,33 (см2),
где 100 Ом - сопротивление мембраны, а 0,33 см2 - общая поверхность эпителия.
Анализ на лактатдегидрогеназу (LDH)
Лактатдегидрогеназа представляет собой стабильный цитоплазматический фермент, который быстро высвобождается в культуральную среду при разрыве плазматической мембраны. 100 мкл базолатеральной среды собирали в каждый момент времени и инкубировали с реакционной смесью KitPLUS для детектирования цитотоксичности в соответствии с инструкциями производителя (Sigma, Roche, 11644793001). Затем, количество высвобожденного LDH определяли путем измерения оптической плотности каждого образца на 490 нм с помощью микропланшет-ридера. Необработанный образец и носитель (без вируса или бактерий) служили в качестве негативного контроля и соответствовали физиологическому высвобождению LDH (≤5%). 10% Тритон X-100 был использован в качестве негативного контроля и соответствовал значительному высвобождению LDH (что соответствует 100% цитотоксичности). Процент цитотоксичности вычисляли по следующему уравнению (A=величины оптической плотности):
Цитотоксичность (%) = (A (экспериментальная величина) - A (низкий контроль)/A (высокий контроль) - A (низкий контроль)) × 100. Высвобождение вирусов
В каждый момент исследования брали верхние промывки с 200 мкл культуральной среды MucilAir™. 20 мкл дополнительно использовали для экстракции вирусной РНК (с помощью набора для экстракции вирусной РНК QIAamp® (Qiagen)) до достижения объема элюирования РНК 60 мкл. Вирусную РНК количественно оценивали с помощью количественной ОТ-ПЦР (с помощью ОТ-ПЦР с использованием зонда QuantiTect, Qiagen) с использованием 5 мкл вирусной РНК. Также использовали праймеры и зонды, специфичные для пикорнавирусов двух семейств, праймеры, специфичные для всех пикорнавирусов, а также праймеры и зонды, специфичные для вирусов гриппа A, в присутствии репортера-гасящего красителя FAM-TAMRA.
Были включены четыре разведения с известной концентрацией РНК HRV-A16 или H3N2, а также контроль для ОТ-ПЦР, и планшеты обрабатывали либо на TaqMan ABI 7000 от Applied Biosystems, либо на системе ПЦР-детектирования Chromo4 от Bio-Rad. Данные Ct были представлены на стандартной кривой, скорректированы с учетом коэффициента разведения и представлены в виде числа копий генома на мл на графиках.
Мукоцилиарный клиренс
Мониторинг мукоцилиарного клиренса проводили с помощью камеры Sony XCD-U100CR, подключенной к микроскопу Olympus BX51 с объективом 5×. На верхнюю поверхность MucilAir™ добавляли полистироловые микросферы диаметром 30 мкм (Sigma, 84135). Движение микросфер отслеживали на видео со скоростью 2 кадра в секунду для 30 изображений при комнатной температуре. На каждый кадр было снято три видеоизображения. Среднюю скорость движения сфер (мкм/сек) вычисляли с помощью программного обеспечения ImageProPlus 6.0. Данные представлены как среднее значение ± ср.кв.ош. (n=3 кадра).
Пример 1. Иммуноглобулины, полученные из плазмы и взаимодействующие с Pseudomonas aeruginosa
PA ассоциируется со многими инфекциями дыхательных путей, например, у индивидуумов с муковисцидозом или тяжелой формой ХОБЛ. Существует множество различных штаммов. Клинический изолят использовали благодаря его соответствию клиническим условиям. Коммерчески доступные иммуноглобулины, полученные из плазмы, в основном, состоят из в высокой степени очищенных IgG, полученных путем фракционирования пулов плазмы, собранных у тысяч здоровых взрослых доноров. Выделенные иммуноглобулины, благодаря тому, что они были взяты у множества доноров, обладают не только поливалентностью и поликлональностью, но также имеют более высокие титры против определенных патогенов при вакцинации. Из фракции отходов могут быть выделены мономерный IgA и смесь пентамерного IgM и мономерного/димерного IgA. Авторами настоящего изобретения было ранее установлено, что полиреактивные сывороточные полимерные IgA, IgM и смесь двух изотипов (IgA/M) могут быть собраны в секреторные Ab при их объединении с рекомбинантным секреторным компонентом (SC) [34]. В подтверждение их использования для местной пассивной иммунизации, молекулы продемонстрировали высокую стабильность in vitro после их обработки кишечными промывками, богатыми протеазами [35].
На фигуре 1 проиллюстрировано связывание иммуноглобулинов плазмы с PA в анализе ELISA. Важно отметить, что все иммуноглобулины плазмы способны связываться с клиническим изолятом PA в этом анализе (см. Раздел «Материалы и методы»). Связывание с PA было дозозависимым, при этом, количество иммуноглобулинов варьировалось от 0,7 мкг/мл до 500 мкг/мл. Сравнение композиций иммуноглобулинов показало различия в способности связываться с PA. Так, например, смеси IgA и IgM в комбинации с SC или без него показали самое высокую аффинность к PA, а за ними следуют IgG и IgA.
Пример 2: Иммуноглобулин IgG, полученный из плазмы, образует крупные агрегаты с PA
Иммуноглобулины могут выполнять несколько функций на поверхности слизистой оболочки. Они могут служить в качестве опсонинов, что приводит к повышению распознавания фагоцитов или к стимуляции отложения комплемента и к последующему лизису. Они могут связывать, а следовательно, и метить инфицированные клетки с их последующим разрушением по механизму, называемому антителозависимой клеточно-опосредованной цитотоксичностью (ADCC). Иммуноглобулины могут нейтрализовать патоген посредством его связывания с поверхностными антигенами и подавлять его продуцирование. Они может также служить покрытием для патогена и предотвращать его прилипание к эпителию слизистой оболочки по механизму, называемому иммунным исключением. И наконец, иммуноглобулины, поскольку они обладают двух- или поливалентными связывающими свойствами, могут агглютинировать микробы в более крупные кластеры, что позволяет иммунной системе более эффективно распознавать эти микробы и осуществлять их механический клиренс из организма-хозяина [36]. Секреторные IgA и IgM, присутствующие на участках слизистой оболочки, имеют 4 валентности и от 10 до 12 валентностей, соответственно. В противоположность этому, IgG имеет только 2 валентности. IgA и IgM обладают большей предрасположенностью к агглютинации микробов, чем IgG [37;38].
На фигуре 2 показан анализ иммунных комплексов, образованных между IgG и PA, с помощью конфокальной микроскопии. При использовании PA, меченного CFSE, и IgG плазмы, меченных Cy3, было неожиданно обнаружено, что они могут детектировать крупные иммунные комплексы IgG-PA. Связывание антигенов с иммуноглобулинами во многом зависит от их антигенсвязывающего Fab-фрагмента. Поскольку IgG является только двухвалентным, то не ожидается появления таких агрегатов. Этот результат может указывать на то, что IgG может дополнительно связывать PA за пределами Fab-области, возможно, посредством его сахаров. Следовательно, IgG может быть более активным в передаче сигналов PA в иммунную систему, как и ожидалось.
Пример 3: Иммуноглобулины, полученные из плазмы, предотвращают повреждение тканей, вызванное PA
PA представляет собой патогенный организм, который, как известно, участвует в формировании биопленок, а также обладает резистентностью ко многим антибиотикам [39]. PA имеет множество факторов вирулентности. Некоторые из них представляют собой экзоферменты, такие как эластаза A и B, протеаза IV, экзотоксин A, экзофермент S или гемолизин. Экзоферменты служат для защиты PA от компонентов иммунной системы, а также участвуют в развитии токсичности и связанном с ней повреждении тканей.
Для того, чтобы оценить насколько PA вызывает повреждение ткани в полученной авторами модели инфекции, авторами настоящего изобретения было оценено высвобождение лактатдегидрогеназы (LDH), которая ассоциируется с разрывом плазматической мембраны. Эксперимент проводили в полученной авторами первичной системе культивирования клеток 3D, и LDH оценивали в образцах, собранных через 24 часа после заражения. Были протестированы все композиции иммуноглобулинов (например, IgG, IgA, IgAM и sIgAM) и пролин (носитель). На фигуре 3 продемонстрировано, что инфекция PA вызывает высвобождение LDH на уровне, превышающем нормальный уровень LDH, обнаруживаемый в среде в устойчивом состоянии. Важно отметить, что если иммуноглобулины вводились вместе с PA, то, как было показано, все композиции иммуноглобулинов способны предотвращать высвобождение LDH, а следовательно, предотвращать повреждение тканей.
Другой способ оценки повреждения ткани представляет собой способ измерения трансэпителиального электрического сопротивления (TEER) ткани in vitro. Действительно, этот параметр отражает динамику целостности плотных контактов в моделях клеточных культур монослойного или многослойного эпителия [40]. Как следствие, при нарушении целостности ткани, TEER уменьшается. Чтобы понять, как инфекция PA влияет на барьер, который представляет собой первичную эпителиальную ткань, измеряли TEER до инфицирования и через 24 часа после инфицирования. На фигуре 4 показано, как инфекция влияет на целостность ткани, и какую роль играют IgG в предотвращении такой инфекции. Максимальная доза IgG и пролина не влияла на TEER, если бактерии отсутствовали на верхней стороне транслунки. При инфицировании PA не только высвобождается LDH, как показано на фигуре 3, но также и снижается TEER (образец c пролином). Этот результат указывает на потерю целостности ткани MucilAir™ при добавлении PA. В этом контексте, для оценки активности IgG использовали возрастающие дозы IgG в комбинации с PA (доза варьировалась от 5 до 500 мкг). Самая низкая доза IgG не показала хорошей защиты от повреждения тканей, тогда как увеличение дозы (от 50 до 500 мкг) показало хорошую защиту ткани с лучшим эффектом для 2 самых высоких доз.
В дополнение к оценке высвобождения LDH и измерению TEER, ткань MucilAir™ исследовали под микроскопом для оценки повреждений, возникающих во время инфицированияи PA. Поскольку MucilAir™ представляет собой многослойную эпителиальную ткань, то была проведена конфокальная микроскопия. При этом использовалось такое же устройство, как показано на фигуре 4. Через 24 часа после инфицирования, ткани фиксировали, разрезали и помещали на предметные стекла для окрашивания и анализа. На фигуре 5 продемонстрирована эффективность IgG в предотвращении повреждения ткани, вызванного PA. Здоровые ткани (контроль) представлены в виде срезов в нижнем ряду, на самом дальнем правом конце. После инфицирования PA, в ткани появляются большие отверстия (транслунка, обработанная пролином; верхний ряд слева). Для PA применялись возрастающие дозы IgG (от 5 до 500 мкг). При этом наблюдался дозозависимый эффект IgG в отношении предотвращения повреждения тканей. Самая низкая доза IgG не предотвращала повреждение тканей, но, по-видимому, давала эффект в виде образования отверстий с меньшей поверхностью. Увеличение доз IgG не приводило к образованию отверстий. Однако, при дозах от 50 до 250 мкг, повреждения тканей все еще наблюдались. Доза 500 мкг IgG давала лучший результат, то есть, ткань выглядела так же хорошо, как и в контрольных лунках.
В целом, все препараты иммуноглобулинов плазмы способны предотвращать высвобождение LDH. После детального изучения механизма действия, лежащего в основе этого результата, с использованием IgG, было показано, что иммуноглобулин может предотвращать потерю целостности ткани, а также повреждение ткани.
Пример 4: Иммуноглобулины, полученные из плазмы, предотвращают высвобождение провоспалительных цитокинов тканями, инфицированными Pseudomonas aeruginosa.
Эпителиальные ткани слизистой оболочки функционируют как барьеры для внешнего окружения, что физически препятствует проникновению микробов в ткани. Однако, после повреждения ткани, микробы могут свободно проникать вовнутрь. Следовательно, чтобы передавать сигнал о потенциальной инфекции и повреждении этих барьеров, эпителиальные ткани взаимодействуют с иммунной системой посредством секреции «опасных» сигналов или цитокинов и тем самым предупреждают клеточные компоненты иммунной системы о миграции в ткань и обеспечении второго слоя защиты.
IL-6 и IL-8 представляют собой провоспалительные цитокины, которые могут секретироваться эпителиальными тканями, когда эти ткани повреждаются. В следующей серии экспериментов, иммуноглобулины плазмы оценивали с точки зрения предотвращения высвобождения провоспалительных цитокинов при инфицировании PA. На фигуре 6 показано высвобождение IL-8 MucilAir™ через 24 часа после инфицирования PA. Все композиции иммуноглобулинов (например, IgG, IgA, IgAM и sIgAM) были протестированы вместе с пролином (носителем). На фигуре 6 показано, что секреция IL-8 сильно увеличивается во время инфицирования PA, достигая почти 3-кратного увеличения. Ни одна из композиций иммуноглобулинов не оказывала значительного влияния на высвобождение IL-8 тканью в стабильном состоянии. Однако, при применении вместе с PA, все композиции иммуноглобулинов могли предотвращать PA-индуцированную секрецию IL-8.
Для иллюстрации эффекта IgG в предотвращении PA-индуцированного высвобождения IL-8 были протестированы возрастающие дозы IgG (от 5 до 500 мкг) в комбинации с PA. На фигуре 7 подробно описана секреция IL-8 в ответ IgG в зависимости от дозы. Эксперимент проводили на MucilAir™, полученном от 3 различных доноров. Чтобы учесть вариабольность от донора к донору, секреция IL-8 после инфицирования была установлена в комбинации с пролином как условие 100% высвобождения. Дополнительные условия были рассчитаны по отношению к 100% высвобождению. Как показано на Фигуре 7, максимальная доза IgG и пролина не влияла на высвобождение IL-8. Интересно отметить, что IgG существенно снижал PA-индуцированную секрецию IL-8 дозозависимым образом с наилучшим эффектом, полученным при максимальной дозе (500 мкг).
Аналогичным образом было проведено исследование на секрецию IL-6 после инфицирования PA. На Фигуре 8 показано высвобождение IL-6 MucilAir™ через 24 часа после инфицирования PA. Все композиции иммуноглобулинов (например, IgG, IgA, IgAM и sIgAM) были протестированы вместе с пролином (носителем). На фигуре 8 показано, что секреция IL-6 сильно увеличивается во время инфицирования PA, достигая почти 6-кратного увеличения. Ни одна из композиций иммуноглобулинов не оказывала значительного влияния на высвобождение IL-6 тканью в стабильном состоянии. Однако, при применении вместе с PA, все композиции иммуноглобулинов могли предотвращать PA-индуцированную секрецию IL-6.
В целом, этот набор данных показал, что все композиции иммуноглобулинов предотвращают высвобождение провоспалительных цитокинов, таких как IL-6 и IL-8, и потенциально могут уменьшить местное воспаление у пациентов, инфицированных PA, которые получали иммуноглобулины путем их местного введения в качестве профилактики. Предотвращение секреции IL-8 и IL-6 при инфицировании PA может фактически означать предотвращение повреждения тканей путем местного применения иммуноглобулинов против PA. Иммуноглобулины, полученные из плазмы, могут действовать посредством иммунного исключения против PA, а также посредством ингибирования активности экзоферментов.
Пример 5: Иммуноглобулины, полученные из плазмы, взаимодействуют с риновирусами человека
Известно, что HRV ответственны за более чем половину случаев простудных заболеваний [41]. Однако, они также участвуют в развитии обострений хронической обструктивной болезни легких (ХОБЛ) и астмы. Существует более 100 серотипов такого вируса. Чтобы оценить, могут ли распыляемые иммуноглобулины, полученные из плазмы, защитить человека от инфекций HRV, было протестировано связывание клинического изолята HRV с различными иммуноглобулинами, полученными из плазмы. На фигуре 9 показано, что все композиции иммуноглобулинов были способны связываться с HRV в анализе ELISA (см. раздел «Материалы и методы») дозозависимым образом с дозой в пределах от 0,7 мкг/мл до 500 мкг/мл. Однако, такое связывание отличалось для каждой композиции иммуноглобулина. IgG обладал меньшей активностью связывания, тогда как IgAM и IgA показали хорошее связывание. Добавление SC к IgAM, по-видимому, снижает способность IgAM связываться с HRV. Это может указывать на то, что в некоторых случаях связывание не зависит от Fab.
Пример 6: Иммуноглобулины, полученные из плазмы, предотвращают высвобождение вирусов и повреждение тканей, вызванное риновирусами человека
Как и другие вирусы, HRV инфицируют клетки и тем самым реплицируются в них. На следующей стадии, вирионы подвергаются сборке и упаковываются перед удалением/высвобождением из клеток посредством лизиса. На фигуре 10 показано действие иммуноглобулинов плазмы в отношении предотвращения высвобождения HRV после инфицирования MucilAir™. При использовании контроля- носителя (пролина), на верхней стороне MucilAir™ было обнаружен высокий уровень высвобождения PA (~109 геномных копий HRV C15/мл). В качестве позитивного контроля использовали рупинтривир, то есть, ингибитор протеазы риновируса 3С против человеческого риновируса. Как было замечено, применение рупинтривира эффективно снижало высвобождение HRV на 3 логарифмических величины. Удивительно то, что применение иммуноглобулинов плазмы во время инфицирования полностью предотвращало высвобождение HRV до уровня, который не мог быть обнаружен с помощью разработанного авторами анализа. Все композиции иммуноглобулинов, кроме IgAM, могли давать такой эффект. Однако, что немаловажно, IgAM все еще может снижать уровень высвобождения HRV по меньшей мере на 4 логарифмических величины.
Таким образом, полученные из плазмы иммуноглобулины были способны предотвращать проникновение HRV в эпителий, и следовательно, его последующую репликацию и распространение.
Во время репликации, HRV может приводить к лизису клеток. В случае эпителия, авторами был проведен анализ для того, чтобы определить, могут ли иммуноглобулины, полученные из плазмы, защищать эпителиальные клетки от повреждения тканей, вызванного HRV. Чтобы это определить, параметр TEER использовался как средство для оценки целостности ткани после инфицирования HRV (фигура 11). В стабильном состоянии (в отсутствии инфекции), значение TEER составляло приблизительно 260 Ом/см2 после обработки носителем (негативный контроль). После инфицирования HRV и нанесения носителя на ткани (позитивный контроль), TEER снижался почти в 5 раз, что указывает на потерю целостности ткани после инфекции. Как показано на фигуре 11, рупинтривир оказывал положительное действие, заключающееся в предотвращении повреждения тканей, вызываемого HRV. Все композиции, полученные из плазмы, были способны предотвращать потерю целостности ткани при введении вместе с HRV. Иммунное исключение HRV иммуноглобулинами плазмы оказалось достаточным для защиты легочных тканей от инвазии PA, а также от повреждения клеток, вызываемого PA.
Пример 7. Иммуноглобулины, полученные из плазмы, снижают потерю мукоцилиарного клиренса, вызываемую человеческими риновирусами
Мукоцилиарный клиренс представляет собой ключевую функцию бронхиальной ткани. Патогены, попавшие в слизь, выводятся из легких и откашливаются, что позволяет предотвратить застаивание патогенов в тканях легких и их размножение. На мукоцилиарный клиренс могут влиять различные механизмы, одним из которых является повреждение тканей.
Поскольку HRV-инфекция связана с повреждением тканей, то была проведена оценка влияния иммуноглобулинов плазмы на мукоцилиарный клиренс через 48 часов после инфицирования HRV (фигура 12). В стабильном состоянии (в отсутствии инфекции), мукоцилиарный клиренс составлял ~40 мм/с после обработки носителем (негативный контроль). При инфицировании HRV и нанесении носителя на ткани (позитивный контроль), мукоцилиарный клиренс уменьшался в 2 раза. Как показано на фигуре 12, рупинтривир давал положительный эффект, а именно, предотвращал вызываемое HRV снижение мукоцилиарного клиренса. Все композиции, полученные из плазмы, были способны предотвращать снижение мукоцилиарного клиренса с лучшим эффектом, полученным для IgA и IgM, для которых не наблюдалось потери мукоцилиарного клиренса.
Пример 8: Дозозависимое влияние композиций иммуноглобулинов, полученных из плазмы человека, на инфицирование человеческим риновирусом
Затем было проведено исследование для того, чтобы определить, являются ли наблюдаемые эффекты дозозависимыми. Композиции иммуноглобулинов добавляли в количестве 4, 20, 100 и 500 мкг/лунку, и их влияние на увеличение уровня HRV оценивали путем определения числа копий генома HRV. На фигуре 13 показано, что препараты человеческого иммуноглобулина, полученные из плазмы, способны ингибировать увеличение HRV дозозависимым образом.
Было также проведено исследование влияния на TEER как описано выше. Композиции иммуноглобулинов замедляли вызываемое HRV снижение TEER при 4 мкг/лунку, 20 мкг/лунку и 100 мкг/лунку. При дозе 500 мкг/лунку, снижение TEER было полностью предотвращено.
Кроме того, влияние различных доз композиций иммуноглобулинов на частоту биения ресничек и на мукоцилиарный клиренс оценивали с использованием тех же доз, которые были указаны выше. И в этом случае, дозозависимый эффект наблюдался в отношении частоты биений ресничек и мукоцилиарного клиренса, причем, были протестированы все композиции иммуноглобулинов.
Вызываемая HRV секреция IL-8 на 2 день после инфицирования также ингибировалась препаратами иммуноглобулинов, полученными из плазмы; при этом, даже в концентрации 4 мкг/лунку, IgAM и SIgAM достигали полного ингибирования; IgG и IgA достигли очень значительного снижения при 4 мкг/лунку, а все композиции иммуноглобулинов достигали полного ингибирования при более высоких дозах. HRV-индуцированное продуцирование RANTES также значительно подавлялось самой низкой дозой используемых иммуноглобулинов (4 мкг/мл) и полностью подавлялось более высокими дозами всех композиций иммуноглобулинов на 2-й день.
В целом, иммуноглобулины, полученные из плазмы, были способны защищать легочные ткани in vitro от HRV-инфекции и связанного с ней повреждения тканей. Профилактическое применение иммуноглобулинов, полученных из плазмы, путем местного введения в легкие индивидуумов, подверженных риску легочных инфекций, будет обеспечивать защиту индивидуумов от микробов вирусного или бактериального происхождения.
Пример 9: Влияние композиций иммуноглобулинов, полученных из плазмы человека, на инфицирование вирусом гриппа.
Эксперименты проводили в соответствии с таким же протоколом, как и для риновирусной инфекции культур MucilAirTM, с использованием штамма вируса гриппа H1N1. Оселтамивир использовали в качестве позитивного контроля в дозе 10 мкг/лунку. Было показано, что все композиции иммуноглобулинов снижали распространение вируса гриппа дозозависимым образом, как показано на Фигуре 14.
Нарушение TEER вирусом гриппа также было уменьшено каждой из композиций иммуноглобулинов в дозе 4 мкг/лунку и 20 мкг/лунку и было полностью предотвращено в дозе 100 мкг/лунку и 500 мкг/лунку.
Снижение частоты биений ресничек, индуцированное вирусом гриппа, наблюдалось на 4-й день после инфицирования. IgG показал лучший протективный эффект в отношении частоты биений ресничек, при этом, полное восстановление наблюдалось уже при 4 мкг/лунку. Композиции IgA, IgAM и sIgAM были также способны снижать частоту биений ресничек, хотя только при концентрации 20 мкг/лунку и при более высоких концентрациях. Композиции Ig были также способны восстанавливать мукоцилиарный клиренс, снижать секрецию IL-8, индуцированную вирусом гриппа и секрецию RANTES, индуцированную вирусом гриппа.
Пример 10: Профилактика обострений, вызываемых инфекцией дыхательных путей у индивидуумов с хронической обструктивной болезнью легких (ХОБЛ) и/или с бронхоэктазом без кистозного фиброза (БЭБКФ) с использованием распыляемых иммуноглобулинов, полученных из плазмы.
Индивидуумы с ХОБЛ и/или БЭБКФ подвержены хроническим инфекциям дыхательных путей, которые могут участвовать в развитии обострений таких заболеваний. Хронический характер этих инфекций приводит к ремоделированию тканей, что повышает тяжесть заболевания.
Как показано выше в примерах, вводимые местно иммуноглобулины, полученные из плазмы, предотвращают адгезию и инвазию бактерий и вирусов в первичные ткани дыхательных путей человека in vitro. Иммунное исключение этих микробов предотвращает повреждение тканей и, косвенно, высвобождение провоспалительных цитокинов, а также потерю мукоцилиарного клиренса.
Для предотвращения перехода этих инфекций в хроническое состояние, индивидуумам с БЭБКФ или ХОБЛ в форме от легкой до тяжелой, потенциально связанной с БЭБКФ, проводят лечение путем введения распыляемых иммуноглобулинов плазмы один или два раза в день. Полученные из плазмы иммуноглобулины, приготовленные в виде раствора в концентрации от 50 мг/мл до 150 мг/мл, распыляют с использованием активного вибрирующего сетчатого распылителя. 2-10 мл препарата иммуноглобулина, полученного из плазмы, наносят утром и/или вечером ежедневно.
Уменьшение обострений, вызываемых инфекцией, будет снижать местное воспаление у индивидуумов с ХОБЛ и БЭБКФ и замедлять прогрессирование заболевания.
Следует отметить, что настоящее изобретение было описано только в качестве примеров, и в него могут быть внесены модификации, не выходящие за рамки существа и объема изобретения.
Ссылки
[1] Vestbo et al. (2013) Am J Respir Crit Care Med 187(4):347-65.
[2] Flume et al. (2018) Lancet 392(10150):880-90.
[3] Chalmers et al. (2018) Am J Respir Crit Care Med 197(11):1410-20.
[4] Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease, 2018 report; Global initiative for chronic obstructive lung disease (GOLD).
[5] Mohan A et al. (2010) Respirology 15(3):536-42.
[6] Molyneaux et al. (2013) Am J Respir Crit Care Med 188(10):1224-31.
[7] Hassett et al. (2014) J Microbiol 52(3):211-26.
[8] Miravitlles et al. (2017) Respiratory Research 18:198.
[9] Singanayagam et al. (2018) Nature Communications 9(1):2229.
[10] British Thoracic Society: Guideline for non-CF Bronchiectasis (2010) Thorax vol. 65, Supp. 1.
[11] Spirometry for health care providers (June 2010). Published by the Global Initiative for Chronic Obstructive Lung Disease (GOLD).
[12] Published by the Association for Respiratory Technology and Physiology (www.artp.org.uk).
[13] Agarwal and Cunningham-Rundles (2007) Ann Allergy Asthma Immunol. 99(3):281-3.
[14] Normansell (1982) CRC critical reviews in clinical laboratory sciences 17(2):103-66.
[15] Hill et al. (1998) Thorax 53:463-8.
[16] Stucki et al. (2008) Biologicals 36(4):239-47.
[17] WO/2012/030664.
[18] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
[19] Donaldson and Wedzicha (2014) Int J of COPD 9:1101-10.
[20] Chairatana and Nolan (2016) Crit. Rev. Biochem. Mol. Biol. 113:1-12.
[21] Mantis et al. (2011) Mucosal Immunol. 4:603-11.
[22] Corthésy (2013) Autoimmun. Rev. 12:661-5.
[23] Strugnell and Wijburg (2011) Nat. Rev. Microbiol. 8:656-67.
[24] Mathias et al. (2013) Infect. Immun. 81:3027-34.
[25] Levinson et al. (2015) Infect. Immun. 83:1674-83.
[26] Brandtzaeg (2009) Scand. J. Immunol. 70:505-15.
[27] Brandtzaeg (2003) Vaccine 21:3382-88.
[28] Corthésy (2003) Curr. Pharm. Biotechnol. 4:51-67.
[29] Corthésy (2002) Trends Biotechnol. 20:65-71.
[30] Lucas et al. (2010) J Allergy Clin Immunol. 125(6):1354-60.
[31] Essaidi-Laziosi et al. (2018) J. Allergy Clin Immunol. 141(6):2074-2084
[32] Cramer et al. (2009) Vox Sang. 96:219-25.
[33] Phalipon et al. (2002) Immunity 17:107-15.
[34] Longet et al. (2013) J. Biol. Chem. 288:4085-94.
[35] Crottet and Corthésy (1998) J. Immunol. 161:5445-53.
[36] Roche et al. (2015) mucosal immunology 8(1):176-85.
[37] Bioley et al. (2017) Front Immunol. 8:1043.
[38] Longet et al. (2014) JBC 289(31):21617-26.
[39] Azham et al. (2018) Drug Discov Today S1359-6446(18):30235-6.
[40] Srinivasan et al. (2015) J Lab Autom 20(2):107-26.
[41] Jacobs et al. (2013) Clinical Microbiology Reviews 26(1):135-62.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЗАЩИТЫ ОТ ПРИСУТСТВУЮЩИХ В ВОЗДУХЕ ПАТОГЕНОВ И РАЗДРАЖИТЕЛЕЙ | 2017 |
|
RU2773149C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЗАЩИТЫ ОТ ВЗВЕШЕННЫХ В ВОЗДУХЕ ПАТОГЕНОВ И РАЗДРАЖАЮЩИХ ВЕЩЕСТВ | 2018 |
|
RU2790223C2 |
| РАСПЫЛЕНИЕ ИММУНОГЛОБУЛИНА | 2015 |
|
RU2729546C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВ | 2011 |
|
RU2612899C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ИММУНОГЛОБУЛИНОВ | 2011 |
|
RU2765738C2 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2749732C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СЕКРЕТОРНОПОДОБНЫЕ ИММУНОГЛОБУЛИНЫ | 2013 |
|
RU2644240C2 |
| СПОСОБ ПРОФИЛАКТИКИ ОБОСТРЕНИЯ БРОНХИАЛЬНОЙ АСТМЫ И ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНИ ЛЕГКИХ | 2016 |
|
RU2625744C1 |
| ПРЕПАРАТЫ АНТИТЕЛ | 2011 |
|
RU2617532C2 |
| АНТИПНЕВМОКОККОВЫЙ ГИПЕРИММУННЫЙ ГЛОБУЛИН ДЛЯ ЛЕЧЕНИЯ И ПРЕДОТВРАЩЕНИЯ ПНЕВМОКОККОВОЙ ИНФЕКЦИИ | 2018 |
|
RU2795769C1 |
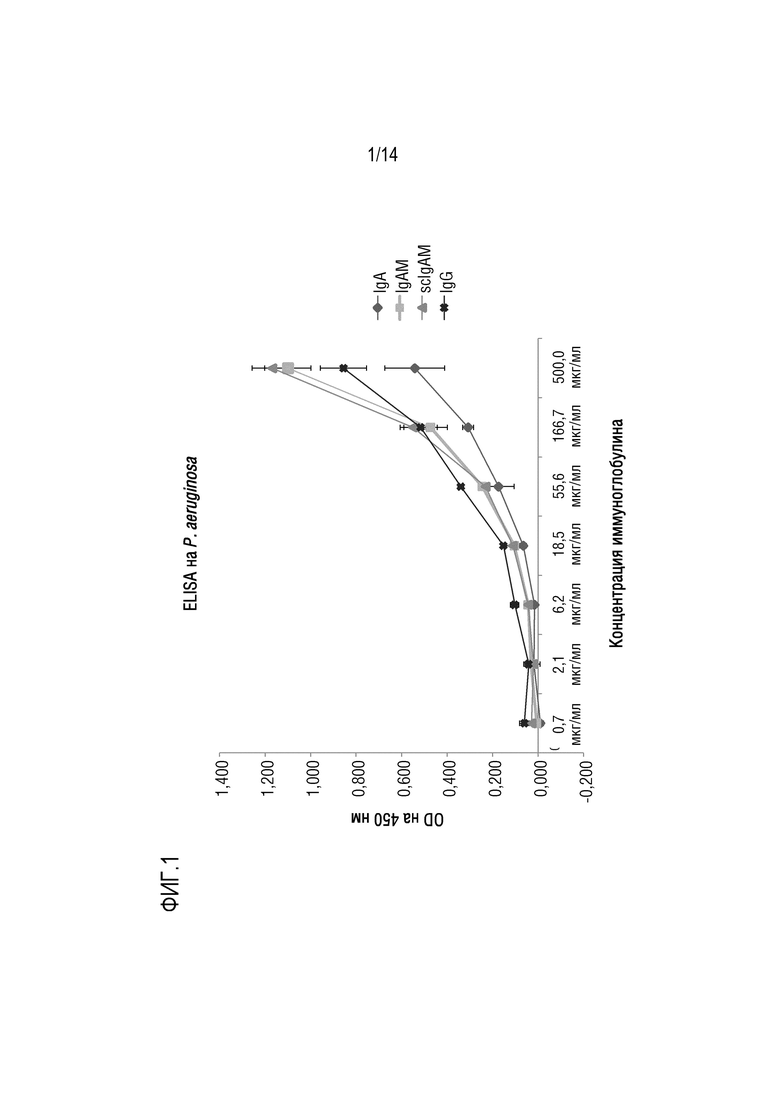
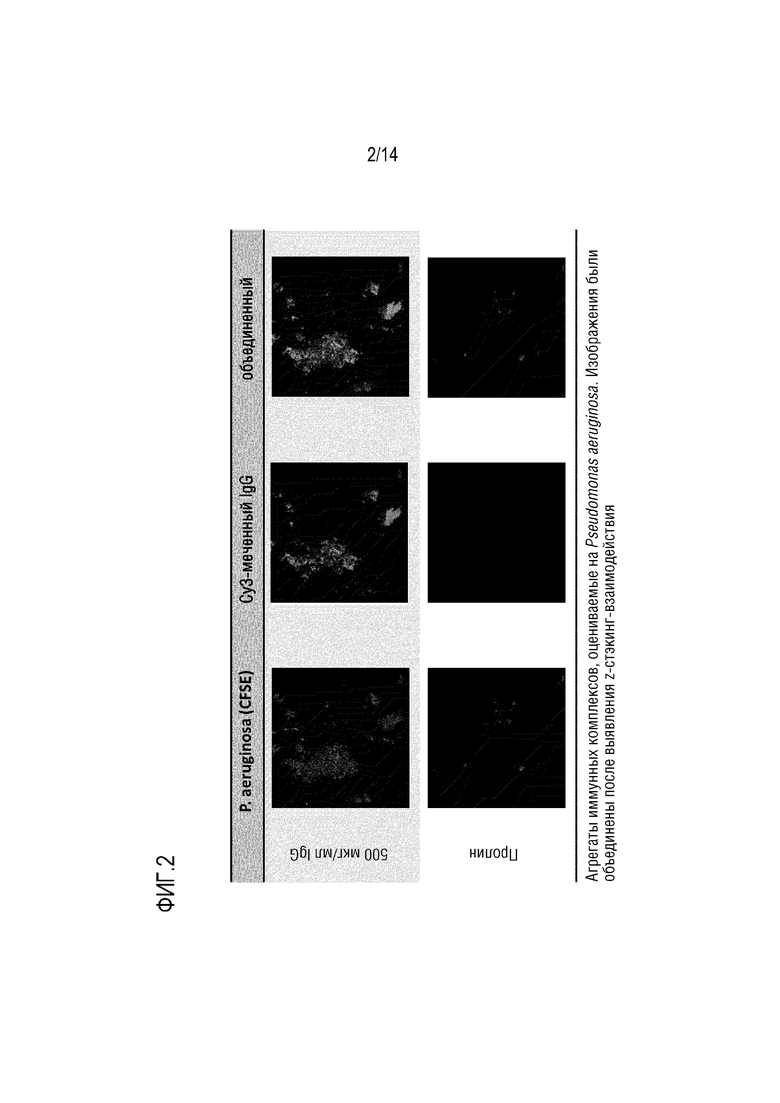
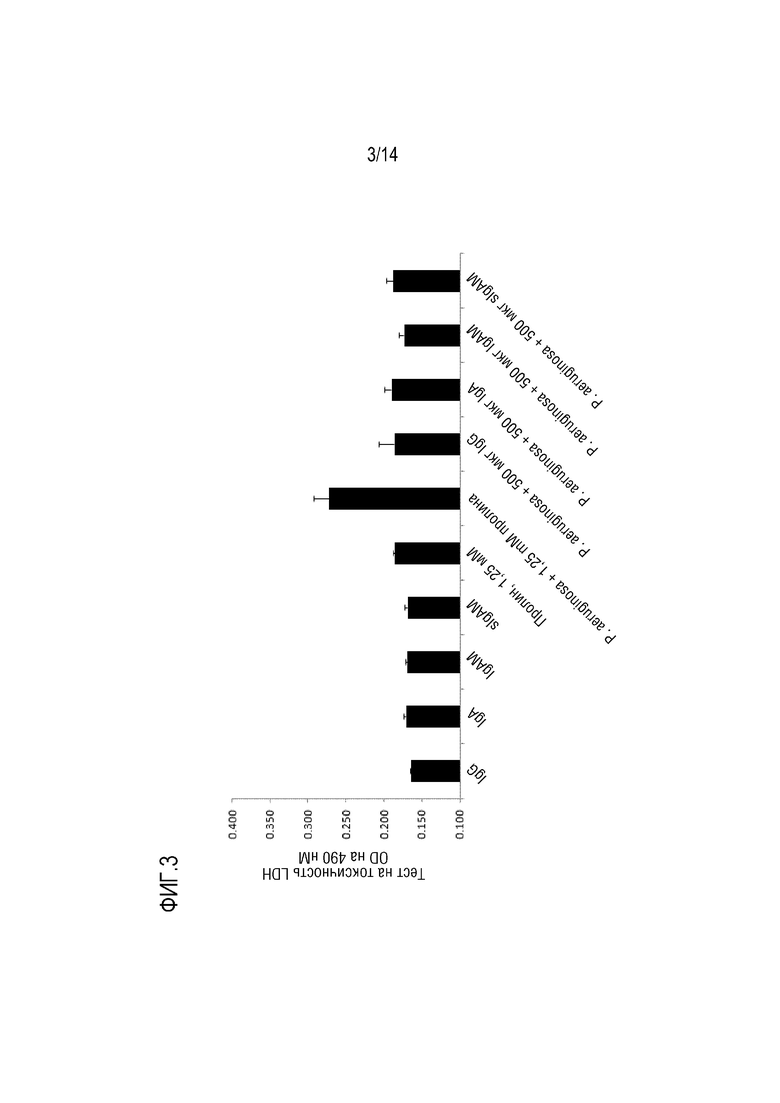
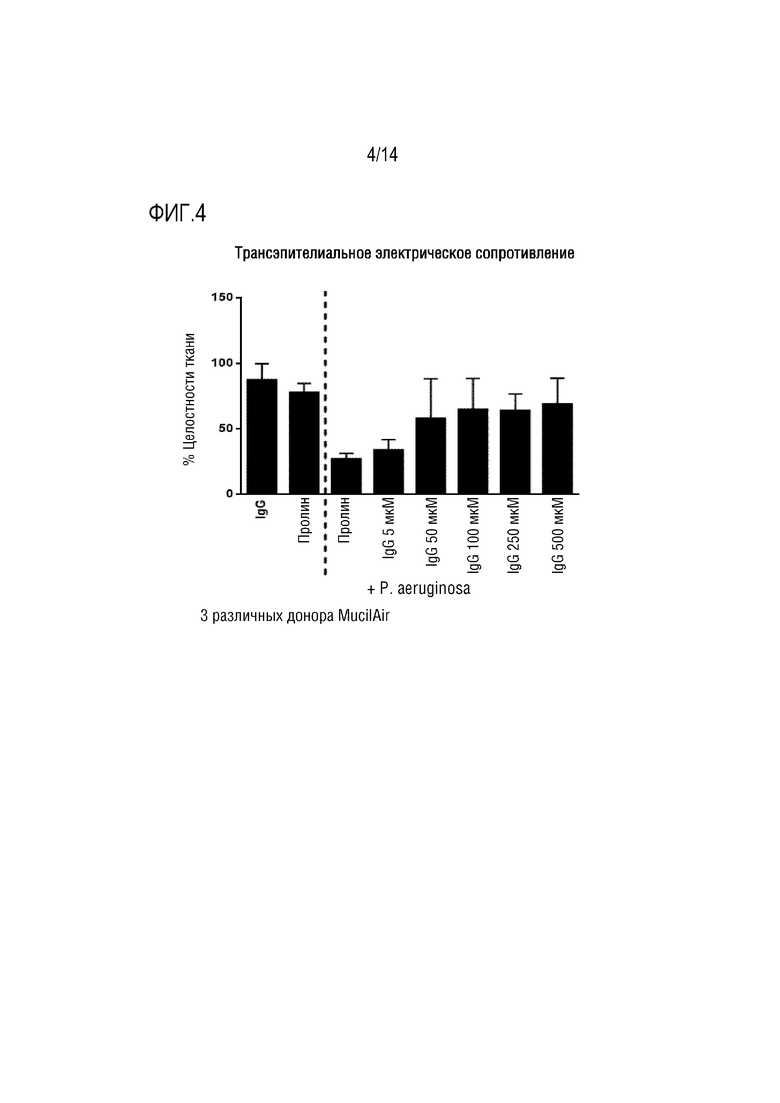
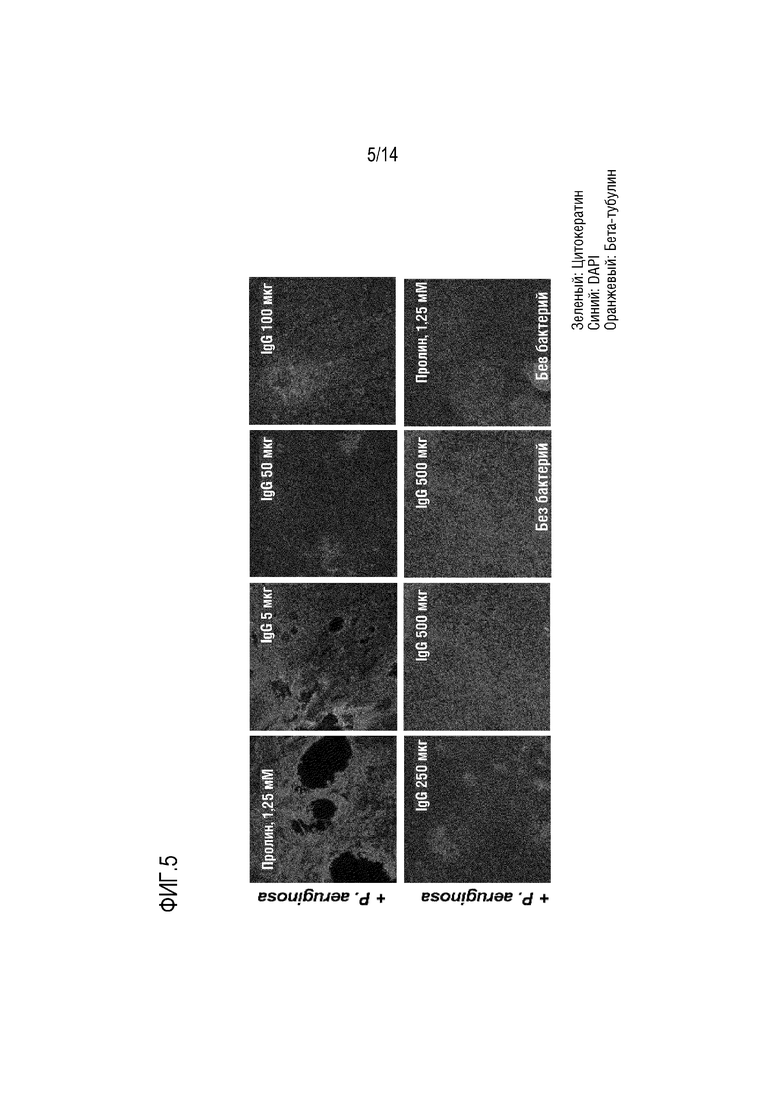
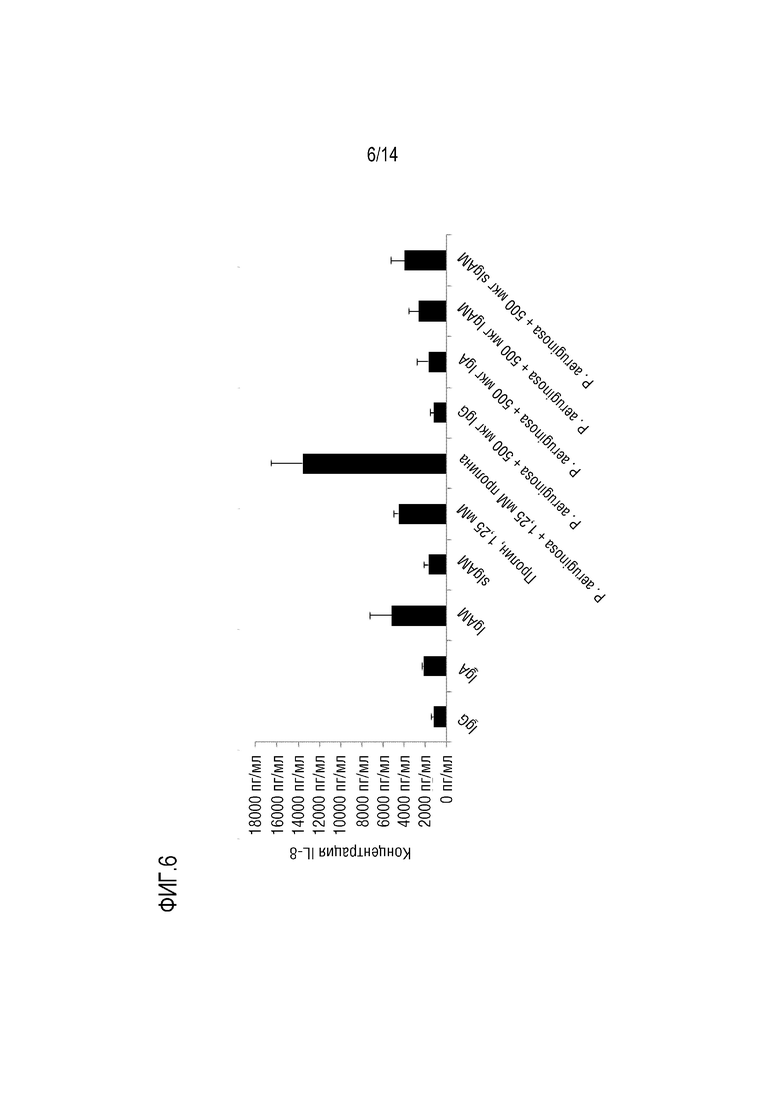
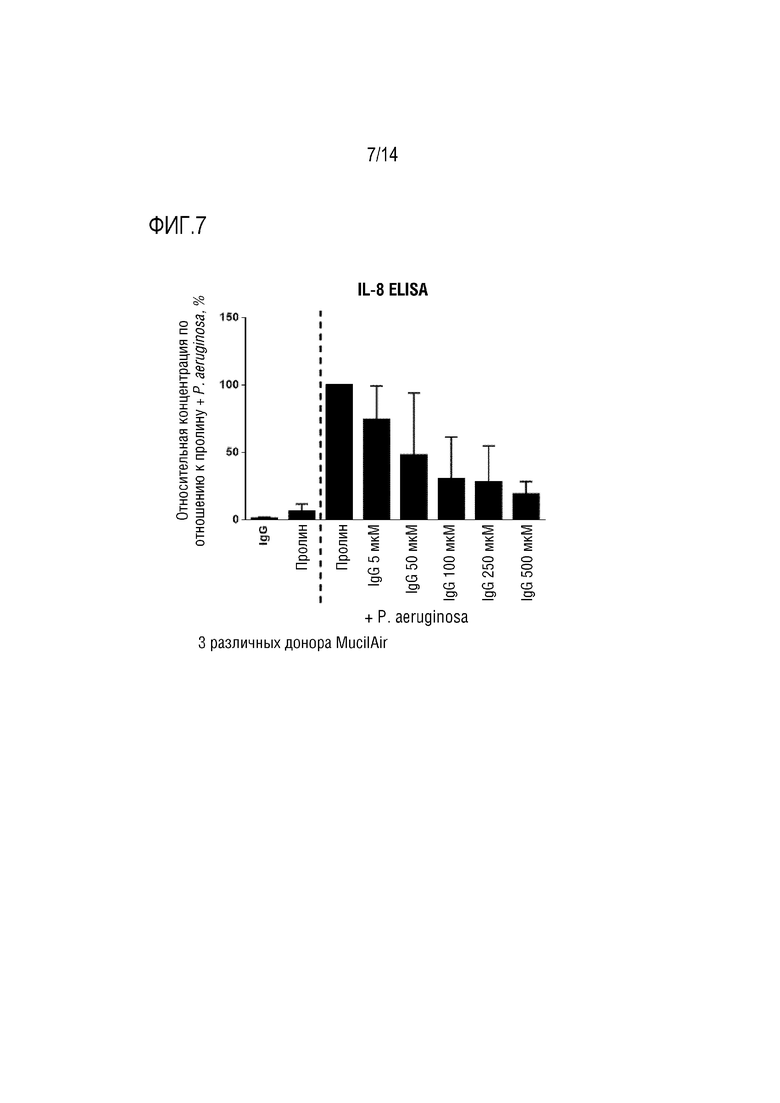
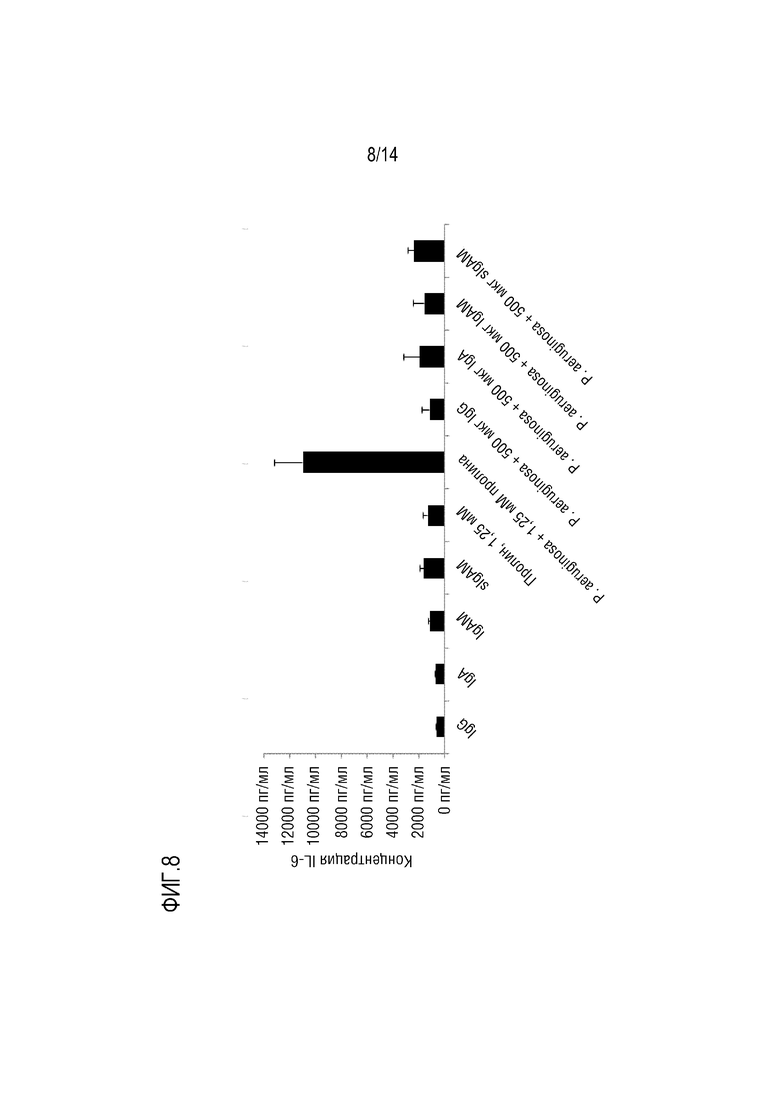
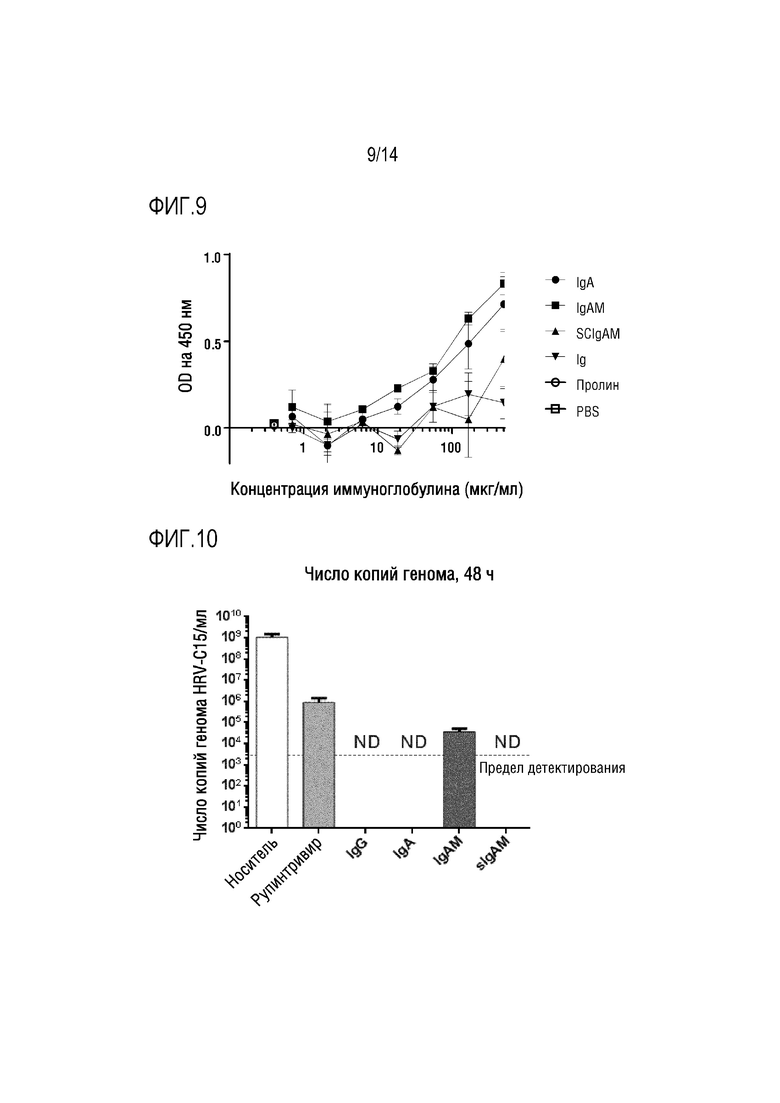
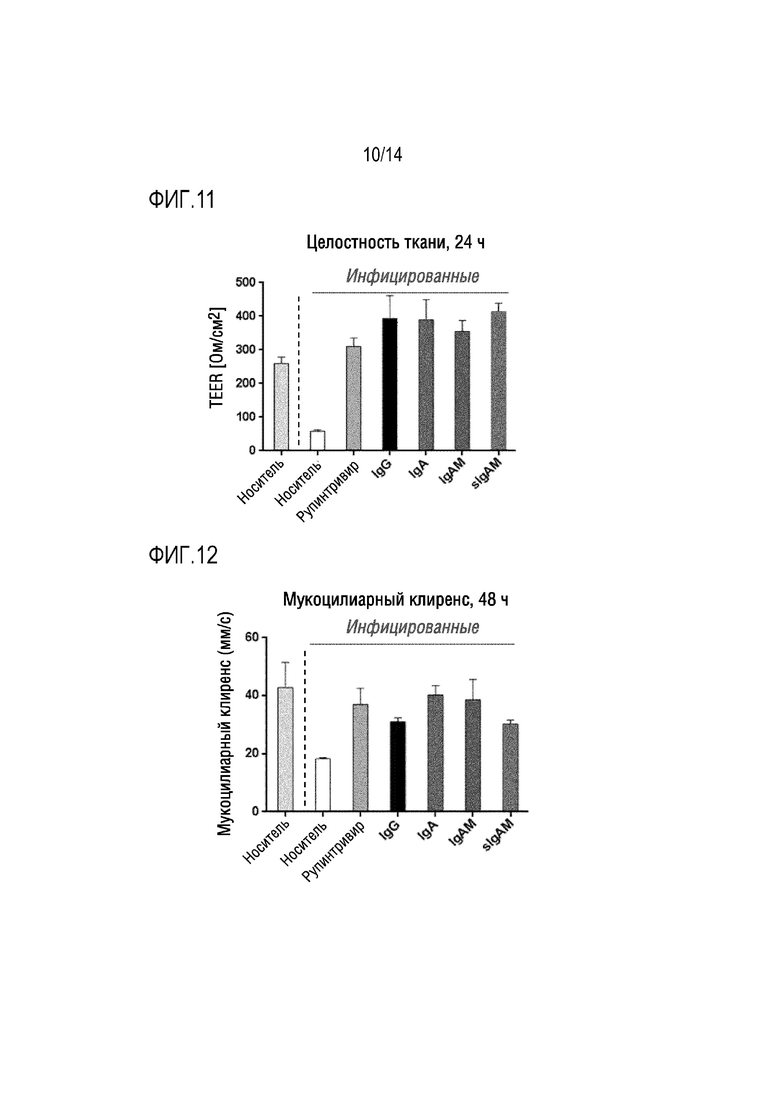
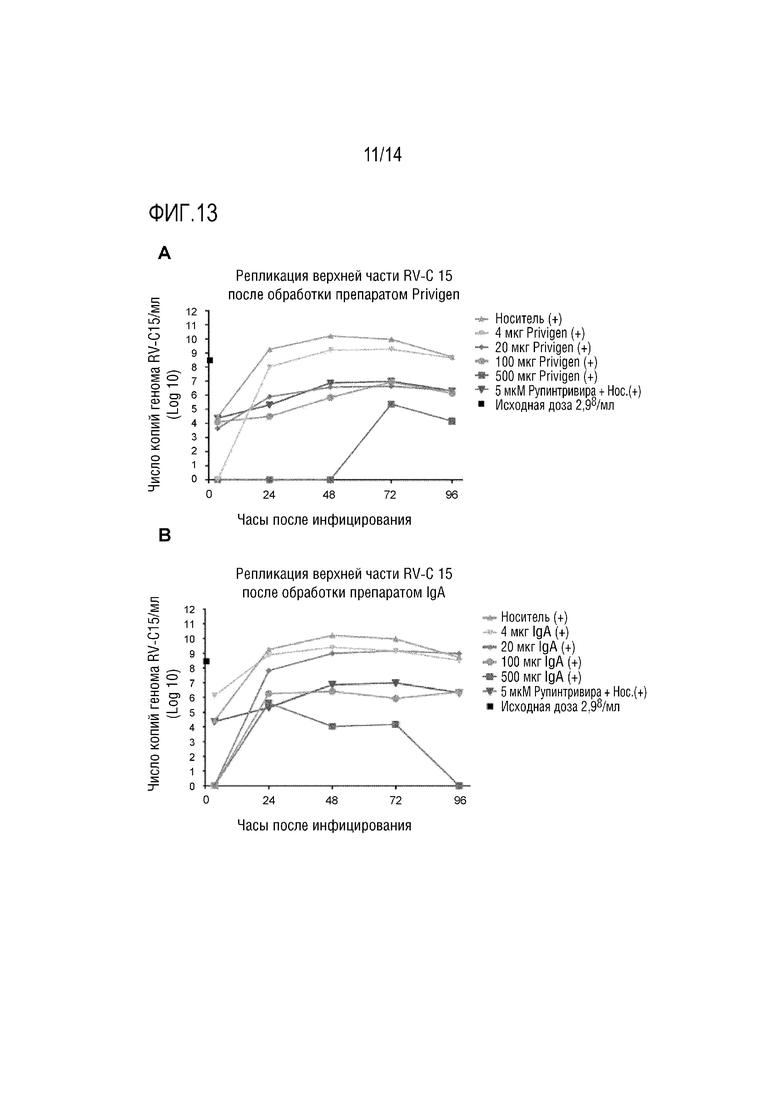
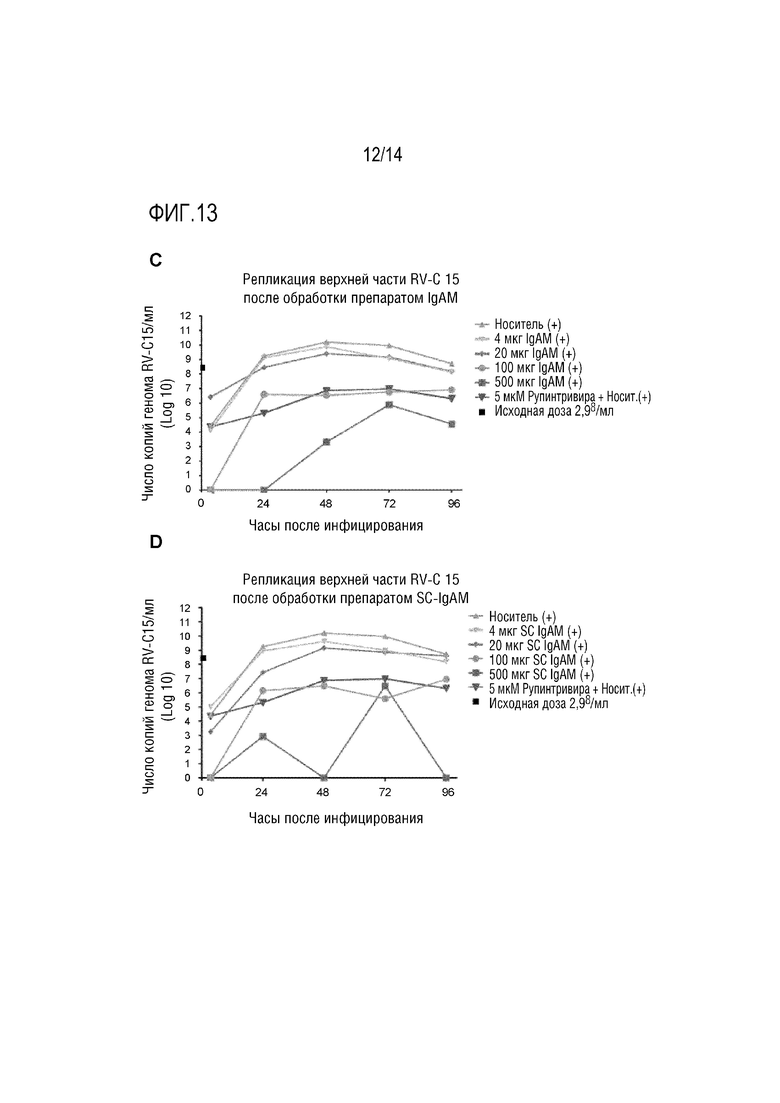
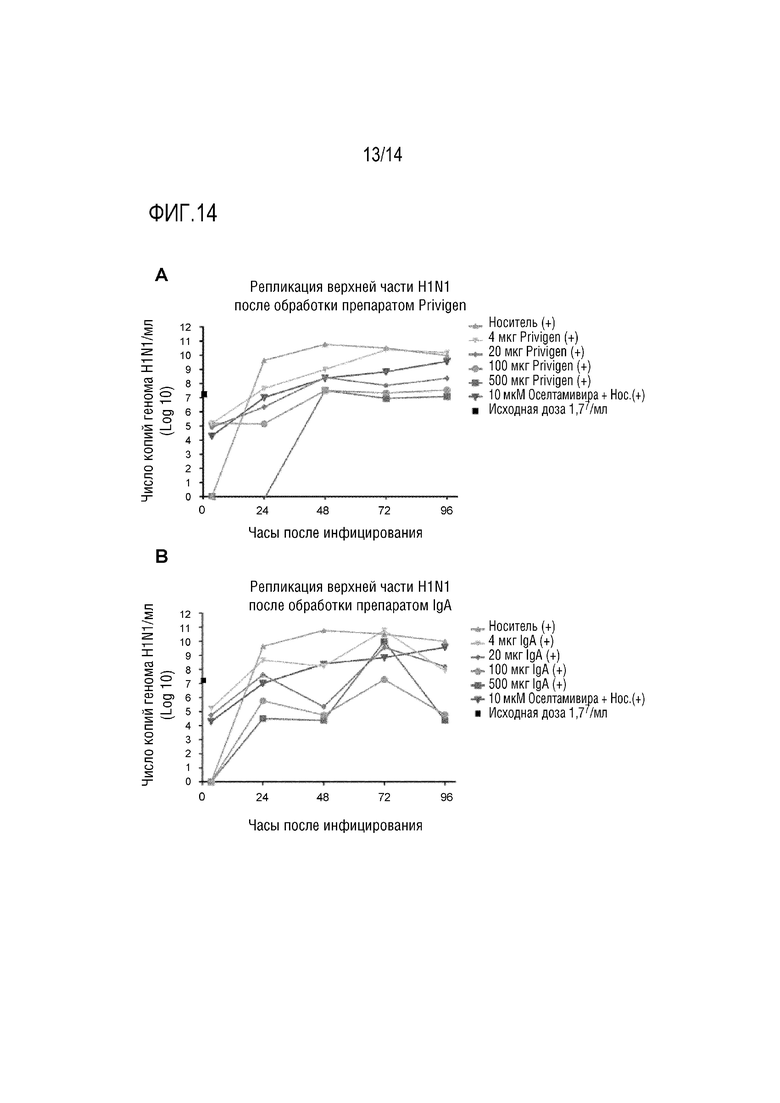
Изобретение относится к области фармацевтики и медицины, а именно к применению композиции, содержащей поликлональный иммуноглобулин, в профилактике или лечении обострения у человека с хронической болезнью легких, где указанная композиция предназначена для введения в дыхательные пути индивидуума и где хроническая болезнь легких представляет собой хроническую обструктивную болезнь легких (ХОБЛ) или где хроническая болезнь легких представляет собой бронхоэктаз без кистозного фиброза (БЭБКФ). Технический результат заключается в снижении воспаления, стимулировании иммунного исключения потенциально патогенных микробов (бактерий и/или вирусов), присутствующих в слое слизистой оболочки, и предотвращении прямого повреждения эпителия, например, бактериальным экзоферментами и токсинами и/или вирусной репликацией (высвобождением) при нанесении иммуноглобулина на эпителий слизистой оболочки дыхательных путей, предотвращении или лечении обострения, которое может быть вызвано инфекциями дыхательных путей, например бактериями и/или вирусами, у человека с хронической болезнью легких. 22 з.п. ф-лы, 14 ил., 10 пр.
1. Применение композиции, содержащей поликлональный иммуноглобулин, в профилактике или лечении обострения у человека с хронической болезнью легких, где указанная композиция предназначена для введения в дыхательные пути индивидуума и где хроническая болезнь легких представляет собой хроническую обструктивную болезнь легких (ХОБЛ) или где хроническая болезнь легких представляет собой бронхоэктаз без кистозного фиброза (БЭБКФ).
2. Применение по п. 1, где ХОБЛ представляет собой ХОБЛ от умеренной до тяжелой степени.
3. Применение по п. 1 или 2, которое предназначено для профилактики обострения ХОБЛ и/или БЭБКФ.
4. Применение по любому из предшествующих пунктов, где индивидуум имеет более низкий уровень IgG, чем нормальный уровень у здорового индивидуума, в частности уровень IgG в плазме менее 700 мг/дл.
5. Применение по любому из предшествующих пунктов, где индивидуум имеет более низкий уровень IgG в мокроте, чем нормальный уровень у здорового индивидуума.
6. Применение по любому из предшествующих пунктов, где индивидуум имеет одно или более обострений за 12 месяцев до начала профилактики или лечения.
7. Применение по любому из предшествующих пунктов, где индивидуум имеет один или более детектируемых провоспалительных цитокинов, таких как IL-1β, и/или IL-6, и/или IL-8 в мокроте.
8. Применение по любому из предшествующих пунктов, где индивидуум страдает пневмонией.
9. Применение по любому из предшествующих пунктов, где индивидуум страдает вирусной инфекцией дыхательных путей, в частности, риновирусной инфекцией.
10. Применение по любому из предшествующих пунктов, где индивидуум страдает бактериальной инфекцией дыхательных путей, в частности инфекцией Pseudomonas aeruginosa.
11. Применение по любому из предшествующих пунктов, где указанное применение снижает воспаление в дыхательных путях индивидуума.
12. Применение по любому из предшествующих пунктов, где указанное применение снижает уровень одного или более провоспалительных цитокинов в дыхательных путях индивидуума, в частности IL-1β, и/или IL-6, и/или IL-8.
13. Применение по любому из предшествующих пунктов, где указанное применение вызывает иммунное исключение по меньшей мере одного потенциально патогенного микроба, инфицирующего дыхательные пути индивидуума.
14. Применение по любому из пп. 8-10 или 13, где указанное применение снижает прямое повреждение эпителиальной ткани у индивидуума, вызванное по меньшей мере одним патогеном, в частности, указанное применение снижает активность экзоферментов, снижает потерю целостности эпителиального барьера и/или уменьшает высвобождение вирусов.
15. Применение по любому из предшествующих пунктов, где композиция содержит IgG плазмы человека, в частности, где композиция содержит по меньшей мере 95%, более конкретно – по меньшей мере 98% IgG.
16. Применение по п. 15, где композиция дополнительно содержит пролин, в частности, приблизительно от 210 до приблизительно 290 ммоль/л L-пролина, предпочтительно, приблизительно 250 ммоль/л L-пролина.
17. Применение по любому из предшествующих пунктов, где композиция представляет собой аэрозоль.
18. Применение по любому из предшествующих пунктов, где композиция представляет собой водный раствор, имеющий концентрацию поликлонального иммуноглобулина от 50 до 150 мг/мл, в частности, приблизительно 100 мг/мл.
19. Применение по любому из предшествующих пунктов, где композиция предназначена для введения в количестве 2-10 мл.
20. Применение по любому из предшествующих пунктов, где композиция предназначена для введения один раз через каждые 48 часов, или один раз через каждые 24 часа, или один раз через каждые 12 часов во время лечения.
21. Применение по любому из предшествующих пунктов, где композиция предназначена для введения в осенние и зимние месяцы.
22. Применение по любому из предшествующих пунктов, где композиция предназначена для введения путем комбинированной терапии с одним или более из антибиотиков, кортикостероидов, бета2-агонистов и антихолинергических бронходилататоров.
23. Применение по п. 17, где композиция представляет собой сухой порошок.
| US 2017021114 A1, 26.01.2017 | |||
| WO 2018178594 A1, 04.10.2018 | |||
| EP 3254671 A1, 13.12.2017 | |||
| US 2005180967 A1, 18.08.2005 | |||
| LYNCH III J | |||
| P | |||
| INFLUENZA AND VIRAL RESPIRATORY INFECTIONS // Pharmacology and Therapeutics | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| - P | |||
| ЭЛЕКТРИЧЕСКИЙ ПЕРЕНОСНЫЙ ФОНАРЬ | 1924 |
|
SU1063A1 |
Авторы
Даты
2023-11-01—Публикация
2019-12-02—Подача