[0001] Настоящая заявка испрашивает приоритет заявки на патент США № 15/691648, поданной 30 августа 2017 года, полное содержание которой тем самым включается в качестве ссылки. Заявка на патент США № 15/691648 представляет собой частичное продолжение заявки на патент США № 15/442604, поданной 24 февраля 2017 года, которая испрашивает приоритет Временной заявки на патент США, серийный № 62/299755, поданной 25 февраля 2016 года, полные содержание каждой заявки тем самым включается в качестве ссылки во всей своей полноте.
Область техники, к которой относится изобретения
[0002] Настоящее изобретение относится к композициям и к способам укрепления здоровье и способности к фильтрованию у эпителиальных и слизистых мембран верхних дыхательных путей. В частности, настоящее изобретение относится к композициям и способам защиты эпителиальных и слизистых мембран субъекта от инфицирования взвешенными в воздухе патогенами, такими как вирусы, бактерии и грибки, и от раздражения от нежелательных взвешенных в воздухе частиц, таких как аллергены, раздражающие вещества или одоранты. Кроме того, изобретение относится к композициям для нанесения в респираторном тракте (например, на слизистые носовой и ротовой полости, и тому подобное) человека для профилактики микробных и вирусных инфекций, в частности, инфекции риновируса человека (HRV) и вируса гриппа человека.
Уровень техники
[0003] Респираторные инфекции, как правило, возникают когда взвешенные в воздухе патогены вступают в контакт со слизистыми мембранами (например, мембранами носовой полости, волосками в носу, мембранами пищевода, и тому подобное) посредством вдыхания или заглатывания жидкости или капель аэрозоля. Вдыхание патогенов через нос или заглатывание через рот является главной причиной респираторного заболевания и может также вызвать системное заболевание, такое как полиомиелит или заболевание стоп и рта. Взвешенные в воздухе патогены могут попадать в легкие после вдыхания или заглатывания, или они могут связывать рецепторы, находящиеся на носовых и других мембранах верхних и нижних дыхательных путях, которые служат как точки входа, с помощью которых патогены, аллергены или раздражающие вещества могут поступать в кровоток и вызывать респираторные, а также другие типы инфекции или аллергической реакции. К сожалению, не существует удобного, эффективного пути для сведения к минимуму или предотвращения инфекции, или аллергии от вдыхаемых или заглатываемых микроорганизмов. Следовательно, имеется острая необходимость в разработке новых композиций и способов защиты против взвешенных в воздухе патогенов, аллергенов и раздражающих веществ, и, в особенности, против вирусов, в частности, против риновируса человека (HRV), вируса гриппа человека, или как того, так и другого.
Сущность изобретения
[0004] В соответствии с указанными выше и другими целями, настоящее изобретение определяет композиции, такие как назальные спреи, пероральные спреи, пероральные полоскания, пастилки, и тому подобное, и соответствующие способы использования таких композиций для усиления способности эпителиальных мембран к фильтрованию определенных взвешенных в воздухе патогенов. В частности, изобретение предлагает антимикробные композиции, которые предотвращают и лечат респираторные инфекции и аллергии, вызываемые раздражающими веществами, аллергенами, бактериями, грибками и вирусами. В предпочтительных воплощениях, композиции защищают субъекта от вирусных инфекций, в частности, от риновируса человека и/или вируса гриппа человека.
[0005] В одном из аспектов настоящего изобретения, предлагается композиция для профилактики или лечения субъекта человека, страдающего или имеющего риск пострадать от респираторной инфекции. Композиция может содержать одно или более антимикробных или противовирусных соединений, диспергированных в носителе, как правило, но, не обязательно, в жидком носителе. Жидкий носитель, в идеале, но, не обязательно имеет соответствующую реологию для распыления как аэрозоль или мелкодисперсный туман. Композиция может содержать один или более ингредиентов, выбранных из группы, состоящей из смягчающего вещества, окклюзивного агента, увлажнителя, носителя, наполнителя, эмульгатора и эфирного масла. В некоторых вариантах осуществления, композиция для профилактики или лечения респираторной инфекции может содержать активный ингредиент, который борется с вирусной инфекцией, который связывает фактор межклеточной адгезии 1 (ICAM-1), и/или с вирусами, которые связывают сиаловую кислоту (или ее внеклеточные части). В некоторых вариантах осуществления, фармацевтическая композиция для предотвращения или лечения респираторной инфекции может содержать фармацевтически приемлемый носитель и, по меньшей мере, два (например, два, три, четыре) активных (например, антимикробных и/или противовирусных, и тому подобное) агентов, выбранных из лактоферрина (например, аполактоферрина, и тому подобное), лизозима, ICAM-1 (например, растворимого ICAM-1, и тому подобное), сиаловой кислоты (например, сиалиллактозы, и тому подобное) и ингибитора нейраминидазы (например, кверцетина, и тому подобное). В одном из воплощений, предлагается композиция для профилактики или лечения субъекта человека, страдающего или имеющего риск пострадать от инфицирования респираторного тракта риновирусом человека (HRV), содержащая, в соответствующем жидком носителе: (i) ингибитор растворимого ICAM-1 (“sICAM-1”) и/или ICAM-1; (ii) лизозим; и (iii) лактоферрин (например, аполактоферрин, и тому подобное). В других вариантах осуществления, предлагается композиция для профилактики или лечения субъекта человека, страдающего или имеющего риск пострадать от инфицирования респираторного тракта вирусом гриппа человека, содержащая, в соответствующем жидком носителе: (i) сиаловую кислоту (например, сиалиллактозу, и тому подобное); (ii) лизозим; (iii) лактоферрин; и (iv) необязательно, ингибитор нейраминидазы, такой, например, как кверцетин. Еще в одном воплощении, предлагается композиция для профилактики или лечения субъекта человека, страдающего или имеющего риск пострадать от инфицирования респираторного тракта риновирусом человека (HRV) и вирусом гриппа человека, содержащая, в соответствующем жидком носителе: (i) ингибитор растворимого ICAM-1 (sICAM-1) и/или ICAM-1; (ii) лизозим; (iii) лактоферрин, (iv) сиаловую кислоту и/или ее дериват (производное), (например, сиалиллактозу, и тому подобное); и (v) необязательно, ингибитор нейраминидазы. Любая из композиций согласно этим вариантам осуществления может дополнительно содержать одно или более веществ из пероксида цинка, меди и серебра. Любая из композиций согласно этим вариантам осуществления может дополнительно содержать каррагенан. Любая из композиций согласно этим вариантам осуществления может дополнительно содержать один или более белков из IgA, IgG и IgM. Кроме того, композиции могут содержать один или более ингредиентов, выбранных из группы, состоящей из экстракта алтея, экстракта Calendula, экстракта кожуры цитрусовых, медового экстракта, экстракта розмарина, экстракта мирры, экстракта Helichrysum, экстракта арроурута, масла семян маргозы, витамина C, витамина E и экстракта грейпфрутовых косточек. Носитель может быть водным и может содержать один или более фармацевтически приемлемых наполнителей, включая, без ограничения, разбавители, буферные агенты, регуляторы pH (например, лимонную кислоту, и тому подобное), загущающие и суспендирующие агенты (например, аравийскую камедь, ксантановую смолу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, натрий карбоксиметилцеллюлозу, и тому подобное), модификаторы реологии, консерванты (например, фенэтиловый спирт, бензалконийхлорид, натрий EDTA, и тому подобное), регуляторы изотоничности (например, хлорид натрия, полиолы, сахарозу, и тому подобное), увлажнители (например, глицерин, и тому подобное), поверхностно-активные вещества (например, полисорбаты, такие как полисорбат 80, пальмитат сахарозы, глицерил стеарат, глицерил стеарат-цитрат, ацетилированный гидрированный растительный глицерид, и тому подобное), и модификаторы вкуса, чтобы не перечислять все. Любые наполнители должны быть совместимыми со слизистыми и эпителием человека и не должны вызывать избыточную сухость или раздражение слизистой или эпителия. Наполнители также должны учитывать тот факт, что вода имеет тенденцию к испарению при температуре тела, так что может вводиться вторичный растворитель чтобы помочь в удерживании растворимых компонентов в растворе. Носитель может включать полиол, такой как C2-C8 полиол, включая без ограничения, глицерин, пропиленгликоль, 1,3-пропандиол, бутиленгликоль, 1,4-бутандиол, эритритол, треитол, арабитол, ксилитол, маннитол, сорбитол, полиэтиленгликоль, гексиленгликоль, каприлилгликоль, гидрированные гидролизаты крахмала, изомальтол, мальтитол, и тому подобное. Композиции могут содержать некоторое количество спирта, такого как этанол, при условии, что это такое количество, которое не раздражает или не сушит слизистую. В некоторых вариантах осуществления, композиции не содержат этанола. В одном из вариантов осуществления, носитель представляет собой водный носитель, содержащий примерно от 1-95% или примерно от 5-50% или примерно от 10-40% или примерно от 15-35% или примерно от 20-30% 1,3-пропандиола, как отношение (объем/объем), (масс/объем) или (масс/масс). В некоторых вариантах осуществления, композиция может иметь кинематическую вязкость в пределах примерно от 1-1500 или примерно от 5-1000 или примерно от 10-750 или примерно от 20-500 сантистоксов (мм2/сек). Композиции могут иметь ньютоновскую или неньютоновскую реологию. Композиции могут, например, быть разжижающимися после сдвига и/или тиксотропными, так что они легко протекают через распылительное сопло и образуют туман с соответствующими размерами капель при сдвиге, но сгущаются in situ с образованием пленки на слизистой, которая является стойкой к удалению из носовой или ротовой полости, так что активное вещество остается на слизистой в течение времени достаточного для нейтрализации патогенов в контакте со слизистой. Как правило, композиция будет иметь соответствующую вязкость, чтобы время пребывания на слизистой носовой или ротовой полости составляло, по меньшей мере, 1 минуту, более предпочтительно, по меньшей мере, 5, 10, 15, 20, 25 или 30 минут после нанесения. Композиция должна быть полупроницаемой, чтобы дать возможность вирионам и другим патогенам для проникновения в пленку и вступления в контакт с активными ингредиентами, и в то же время обладать достаточной барьерной функцией для замедления испарения воды и летучих растворителей для удерживания активных веществ в растворе.
[0006] Фармацевтическая композиция может содержать лактоферрин и растворимый ICAM-1. В некоторых вариантах осуществления, лактоферрин и растворимый ICAM-1 являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и растворимый ICAM-1 может присутствовать в количестве примерно от 0,01-2000 мкг/мл. В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки риновируса.
[0007] Фармацевтическая композиция может содержать лизозим и растворимый ICAM-1. В некоторых вариантах осуществления, лизозим и растворимый ICAM-1 являются единственными активными агентами. Лизозим может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и растворимый ICAM-1 может присутствовать в количестве примерно от 0,25-20000 мкг/мл. В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки риновируса.
[0008] Фармацевтическая композиция может содержать лактоферрин (например, аполактоферрин, и тому подобное), лизозим и растворимый ICAM-1. В некоторых вариантах осуществления, лактоферрин, лизозим и растворимый ICAM-1 являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, лизозим может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и растворимый ICAM-1 может присутствовать в количестве примерно от 0,25-20000 мкг/мл. В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки риновируса.
[0009] Фармацевтическая композиция может содержать лактоферрин (например, аполактоферрин, и тому подобное) и лизозим. В некоторых вариантах осуществления, лизозим и лактоферрин являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и лизозим может присутствовать в количестве примерно от 0,5-5000 мкг/мл. В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки гриппа.
[0010] Фармацевтическая композиция может содержать лактоферрин (например, аполактоферрин, и тому подобное) и сиаловую кислоту. В некоторых вариантах осуществления, лизозим и лактоферрин являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и сиаловая кислота может присутствовать в количестве примерно от 0,01-2000 мкг/мл (или примерно от 0,1-1000 мкг/мл или примерно от 0,5-750 мкг/мл) сиаловой кислоты (например, сиалиллактозы, 6’-сиалиллактозы, 3-сиалиллактозы, 6’-сиалиллактозы и 3’-сиалиллактозы, и тому подобное). В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки гриппа.
[0011] Фармацевтическая композиция может содержать лактоферрин (например, аполактоферрин, и тому подобное), лизозим и сиаловую кислоту. В некоторых вариантах осуществления, лизозим и лактоферрин являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, лизозим может присутствовать в количестве примерно от 0,5-5000 мкг/мл, и сиаловая кислота может присутствовать в количестве примерно от 0,01-2000 мкг/мл (или примерно от 0,1-1000 мкг/мл или примерно от 0,5-750 мкг/мл) сиаловой кислоты (например, сиалиллактозы, 6’-сиалиллактозы, 3-сиалиллактозы, 6’-сиалиллактозы и 3’-сиалиллактозы, и тому подобное). В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки гриппа.
[0012] Фармацевтическая композиция может содержать лактоферрин (например, аполактоферрин, и тому подобное), лизозим, ингибитор нейраминидазы (например, кверцетин и их изоформы, изокверцетин, и тому подобное) и сиаловую кислоту. В некоторых вариантах осуществления, лизозим, ингибитор нейраминидазы и лактоферрин являются единственными активными агентами. Лактоферрин (например, аполактоферрин, и тому подобное) может присутствовать в количестве примерно от 0,5-5000 мкг/мл, лизозим может присутствовать в количестве примерно от 0,5-5000 мкг/мл, ингибитор нейраминидазы может присутствовать в количестве примерно от 0,1-20 мкМ (или от 0,1-20 мкМ или примерно от 0,1-5 мкМ или примерно от 0,2-3 мкМ), ингибитор нейраминидазы и сиаловая кислота могут присутствовать в количестве примерно от 0,01-2000 мкг/мл (или примерно от 0,-1000 мкг/мл или примерно от 0,5-750 мкг/мл) сиаловой кислоты (например, сиалиллактозы, 6’-сиалиллактозы, 3-сиалиллактозы, 6’-сиалиллактозы и 3’-сиалиллактозы, и тому подобное). В некоторых вариантах осуществления, лактоферрин и сиаловая кислота и лизозим присутствуют в таком количестве, что цитотоксичность слизистой мембраны, пораженной гриппом (например, как измерено по высвобождению LDH, и тому подобное), не увеличивается, когда композиция наносится на слизистую мембрану. В некоторых вариантах осуществления, фармацевтическая композиция уменьшает цитотоксичность слизистой мембраны, на которую наносится фармацевтическая композиция, по сравнению с идентичной в остальном композицией, не содержащей сиаловой кислоты и/или лактоферрина, и/или лизозима. В предпочтительных вариантах осуществления, фармацевтическая композиция содержит носитель, который представляет собой примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола (например, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция может использоваться для обработки или профилактики респираторного заболевания. В предпочтительных вариантах осуществления, композиция может использоваться для обработки гриппа. Как правило ингибитор нейраминидазы представляет собой изокверцетин.
[0013] В некоторых вариантах осуществления, композиция может содержать:
(i) примерно 0,00000001%-10% масс ICAM-1 (например, растворимого ICAM-1, и тому подобное);
(ii) от 0% (или примерно от 0,00000001%) примерно до 10% масс ингибитора нейраминидазы;
(iii) примерно от 0,00000001% примерно до 10% масс сиаловой кислоты (например, сиалиллактозы, 2,3’-сиалиллактозы и/или 2,6’ сиалиллактозы, и тому подобное);
(iv) примерно от 0,00000001% примерно до 10% масс лизозима; и
(v) примерно 0,00000001% примерно до 10% масс лактоферрина (например, аполактоферрина, и тому подобное);
фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0014] В некоторых вариантах осуществления, композиция может содержать:
(i) примерно 0,000001%-1% (или примерно до 0,1%) масс ICAM-1 (например, растворимого ICAM-1, и тому подобное); и/или
(ii) от 0% (или примерно от 0,000001%) примерно до 1% (или примерно до 0,1%) масс ингибитора нейраминидазы; и/или
(iii) примерно от 0,000001% примерно до 0,001% (или примерно до 0,01%) масс сиаловой кислоты (например, сиалиллактозы, 2,3’-сиалиллактозы и/или 2,6’ сиалиллактозы); и/или
(iv) примерно от 0,0001% примерно до 5% (или примерно до 1%) масс лизозима; и/или
(v) примерно от 0,00005% примерно до 5% (или примерно до 0,5%) масс лактоферрина (например, аполактоферрина, и тому подобное);
фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0015] В некоторых вариантах осуществления, композиция может содержать:
(i) примерно 0,0005%-0,05% масс ICAM-1 (например, растворимого ICAM-1, и тому подобное); и/или
(ii) от 0% (или примерно от 0,005%) примерно до 0,05% масс ингибитора нейраминидазы; и/или
(iii) примерно от 0,000005% примерно до 0,05% масс сиаловой кислоты (например, сиалиллактозы, 2,3’-сиалиллактозы и/или 2,6’ сиалиллактозы); и/или
(iv) примерно от 0,0025% примерно до 0,25% масс лизозима; и/или
(v) примерно от 0,00005% примерно до 0,1% масс лактоферрина (например, аполактоферрина, и тому подобное);
фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0016] Фармацевтическая композиция может использоваться в способе предотвращения или лечения респираторной инфекции. Респираторная инфекция может вызываться риновирусом человека и/или вирусом гриппа человека. В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции риновируса человека (HRV) может содержать:
(i) примерно от 0,00000001% примерно до 10% масс растворимого ICAM-1;
(ii) примерно от 0,000005% примерно до 10% масс лизозима; и
(iii) примерно от 0,00000025% примерно до 10% масс лактоферрина
и фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0017] В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции риновируса человека (HRV) может содержать:
(i) примерно 0,000001%-1% (или примерно до 0,1%) масс растворимого ICAM-1; (ii) примерно от 0,0001% примерно до 5% (или примерно до 1%) масс лизозима; и
(iii) примерно от 0,00005% примерно до 5% (или примерно до 0,5%) масс лактоферрина
и фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0018] В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции риновируса человека (HRV) может содержать:
(i) примерно 0,0005%-0,05% масс растворимого ICAM-1; и/или
(ii) примерно от 0,0025% примерно до 0,25% масс лизозима; и/или
(iii) примерно от 0,00005% примерно до 0,1% масс лактоферрина
и фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0019] В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции вируса гриппа человека может содержать:
(i) примерно от 0,0000001% примерно до 10% масс указанной сиаловой кислоты (например, сиалиллактозы, и тому подобное);
(ii) примерно от 0,00000001% примерно до 10% масс указанного лизозима;
(iii) примерно от 0,00000001% примерно до 10% масс указанного лактоферрина; и
(iv) от 0% (или примерно от 0,00000001%) примерно до 10% масс ингибитора нейраминидазы
и фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0020] В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции вируса гриппа человека может содержать:
(i) примерно от 0,000005% примерно до 0,05% масс указанной сиаловой кислоты (например, сиалиллактозы, и тому подобное);
(ii) примерно от 0,0001% примерно до 5% (или примерно до 1%) масс указанного лизозима;
(iii) примерно от 0,00005% примерно до 5% (или примерно до 0,5%) масс указанного лактоферрина и
(iv) от 0% (или примерно от 0,01%) примерно до 10% масс ингибитора нейраминидазы;
и фармацевтически приемлемый носитель и, необязательно, один или более наполнителей.
[0021] В некоторых вариантах осуществления, композиция для предотвращения или лечения респираторной инфекции вируса гриппа человека может содержать:
(i) примерно от 0,000005% примерно до 0,05% масс указанной сиаловой кислоты (например, сиалиллактозы, и тому подобное); и/или
(ii) примерно от 0,0025% примерно до 0,25% масс указанного лизозима; и/или
(iii) примерно от 0,00005% примерно до 0,1% масс указанного лактоферрина и/или
(iv) от 0% (или примерно от 0,000001%) примерно до 1% (или примерно до 0,1%) масс ингибитора нейраминидазы;
и фармацевтически приемлемый носитель и, необязательно, одно или более наполнители.
[0022] В некоторых вариантах осуществления, композиции по настоящему изобретению будут представлять собой водные растворы или суспензии, содержащие примерно от 0,5-5000 мкг/мл (или примерно от 1-1000 мкг/мл или примерно от 5-500 мкг/мл) лактоферрина (например, аполактоферрин, и тому подобное). В некоторых вариантах осуществления, композиции по настоящему изобретению будут представлять собой водные растворы или суспензии, содержащие примерно от 0,25-20000 мкг/мл (или примерно от 0,25-10000 мкг/мл, или примерно от 1-5000 мкг/мл, или примерно от 25-2500 мкг/мл, или примерно от 1000-12000 мкг/мл) лизозима. В некоторых вариантах осуществления, композиции по настоящему изобретению будут представлять собой водные растворы или суспензии, содержащие примерно от 0,01-2000 мкг/мл (или примерно от 0,01-1000 мкг/мл или примерно от 0,1-600 мкг/мл или примерно от 0,1-100 мкг/мл или примерно от 0,5-50 мкг/мл) ICAM-1 (например, растворимого ICAM-1, и тому подобное). В некоторых вариантах осуществления, композиции по настоящему изобретению будут представлять собой водные растворы или суспензии, содержащие примерно от 0,01-2000 мкг/мл (или примерно от 0,1-1000 мкг/мл или примерно от 0,5-750 мкг/мл) сиаловой кислоты (например, сиалиллактозы, и тому подобное). В некоторых вариантах осуществления композиция содержит концентрацию 6’-сиалиллактозы примерно 0,01-2000 мкг/мл (или примерно от 0,1-1000 мкг/мл или примерно от 0,5-750 мкг/мл) и концентрацию 3’-сиалиллактозы примерно 0,01-2000 мкг/мл (или примерно от 0,1-1000 мкг/мл или примерно от 0,5-750 мкг/мл). В некоторых вариантах осуществления, композиции по настоящему изобретению будут представлять собой водные растворы или суспензии, содержащие примерно от 0,005-1000 мкг/мл (или примерно от 0,5-500 мкг/мл или примерно от 0,25-375 мкг/мл) 3’-сиалиллактозы и/или примерно от 0,005-1000 мкг/мл (или примерно от 0,5-500 мкг/мл или примерно от 0,25-375 мкг/мл) 6’-сиалиллактозы. В некоторых вариантах осуществления, композиции будет содержать примерно от 0,1-20 мкМ (или от 0,1-20 мкМ или примерно от 0,1-5 мкМ или примерно от 0,2-3 мкМ) ингибитор нейраминидазы. В некоторых вариантах осуществления, композиции будет содержать примерно от 0,1-20 мкМ (или от 0,1-20 мкМ или примерно от 0,1-5 мкМ или примерно от 0,2-3 мкМ) кверцетина.
[0023] Фармацевтические композиции по настоящему изобретению могут находиться в форме назального спрея, назальных капель, перорального спрея, перорального полоскания или пастилок. Носитель фармацевтической композиции может выбираться для обеспечения времени пребывания композиции на слизистой носовой и/или ротовой полости, по меньшей мере, 1 минута, или по меньшей мере, 5 минут или, по меньшей мере, 10 минут или, по меньшей мере, 15 минут или, по меньшей мере, 20 минут или, по меньшей мере, 25 минут или, по меньшей мере, 30 минут после нанесения. В некоторых вариантах осуществления, композиция для нанесения на слизистые носовой или ротовой полости содержит один или более противовирусных и/или антимикробных агентов, диспергированных в жидком носителе, содержащем примерно от 1-99% (объем/объем) воды или примерно от 60-90% (объем/объем) воды и примерно от 10-40% (или от 20-30%) (объем/объем) полиола. В некоторых вариантах осуществления, фармацевтически приемлемый носитель представляет собой водный раствор, содержащий примерно от 5-50% (объем/объем), или примерно от 10-40% (объем/объем), или примерно от 15-35% (объем/объем), или примерно от 20-30% (объем/объем) 1,3-пропандиола. Композиция может распыляться или заглатываться на слизистой и адаптируется для удерживания на слизистой в течение, по меньшей мере, 5 минут (или по меньшей мере, 10 минут, или, по меньшей мере, 15 минут, или, по меньшей мере, 20 минут, или, по меньшей мере, 25 минут, или, по меньшей мере, 30 минут) после нанесения, по существу, без раздражения или высыхания слизистой.
[0024] Предлагаются способы профилактики и/или лечения различных вирусных инфекций. В некоторых вариантах осуществления, способ профилактики и/или лечения инфекции риновируса человека, включает нанесение любой композиции, описанной в настоящем документе, на слизистую носовой и/или ротовой полости индивидуума, нуждающегося в этом. В некоторых вариантах осуществления, слизистые носовой и/или ротовой полости индивидуумов, нуждающихся в лечении, содержат риновирус человека в контакте с ними.
[0025] В одном из аспектов, настоящее изобретение предлагает фармацевтическую композицию для предотвращения или лечения субъектов, страдающих или имеющих риск пострадать от респираторной инфекции, содержащую: одно или более антимикробных или противовирусных соединений; и базовую смесь, содержащую один или более ингредиентов, выбранных из группы, состоящей из носителя, смягчающего вещества, окклюзивного агента, увлажнителя, полиола, эмульгатора, консерванта, загущающего или суспендирующего агента, поверхностно-активного вещества, регулятора pH, изотонического агента и эфирного масла. В одном из вариантов осуществления, антимикробное или противовирусное соединение представляет собой одно или более веществ, выбранных из группы, состоящей из антитела, такого как IgA, IgG или IgM, растворимого ICAM-1, ингибитора ICAM-1, сиаловой кислоты, ингибитора нейраминидазы, лактоферрина, лизозима, цинка, соединений цинка, серебра, соединений серебра, меди, соединений меди и их сочетаний. В одном из вариантов осуществления, ингибитор нейраминидазы выбирается из группы, состоящей из кверцетина, озельтамивира, занамивира, ланинамивира и перамивира. В одном из вариантов осуществления, ингибитор ICAM-1 выбирается из группы, состоящей из антитела анти-ICAM-1, цитокина, CD11a, езрина (EZR), CD18, глицирретиновой кислоты, пирролидиндитиокарбамата, ингибитора активирования NFkB, гетероциклического тиазола, липоевой кислоты, эфализумаба, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамида, силибинина, стильбенов, галлата (+)-эпигаллоилкатехина [(+)-EGCG] и их сочетаний. В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений включают растворимый ICAM-1 и сиаловую кислоту (например, сиалиллактозу, 3’ сиалиллактозу и/или 6’ сиалиллактозу, и тому подобное). В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений включают лактоферрин, лизозим, ингибитор нейраминидазы, IgA, IgG, IgM, пероксид цинка (ZnO2), медь и серебро. В одном из вариантов осуществления, респираторная инфекция выбирается из группы, состоящей из инфекции риновируса, инфекции вируса гриппа, грибковой инфекции и бактериальной инфекции. В одном из вариантов осуществления, один или более ингредиентов выбирают из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры цитрусовых, медовых экстрактов, экстрактов розмарина, экстракта мирры, экстракта Helichrysum, экстракта арроурута, масла семян маргозы, масла аргана, витамина C, витамина E, экстракта грейпфрутовых косточек и их сочетаний.
[0026] В одном из аспектов, настоящее изобретение предлагает способ профилактики или лечения респираторной инфекции у субъектов, страдающих или имеющих риск пострадать от респираторной инфекции, включающий: определение того, что субъект страдает или имеет риск пострадать от респираторной инфекции; и введение композиции по настоящему изобретению, содержащей одно или более антимикробных или противовирусных соединений и базовую смесь, содержащую один или более ингредиентов, выбранных из группы, состоящей из носителя, смягчающего вещество, окклюзивного агента, увлажнителя, эмульгатора и эфирного масла. В одном из вариантов осуществления, одно или более антимикробных, или противовирусных соединений содержит растворимый ICAM-1. В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений содержит сиаловую кислоту или ее производное (например, сиалиллактозу, и тому подобное). В одном из вариантов осуществления, одно или более антимикробных, или противовирусных соединений содержит лактоферрин (например, аполактоферрин, и тому подобное). В одном из вариантов осуществления, одно или более антимикробных, или противовирусных соединений содержит лизозим. В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений содержит ингибитор нейраминидазы. В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений содержит IgA, IgG и/или IgM. В одном из вариантов осуществления, одно или более антимикробных или противовирусных соединений содержит пероксид цинка (ZnO2), медь и/или серебро. Композиции могут вводиться посредством любого пригодного для использования способа, в том числе перорально, местным образом, назально, и как их сочетания. В одном из вариантов осуществления, композиция вводится на мембраны носовой полости. В одном из вариантов осуществления, композиция вводится с использованием устройства, выбранного из группы, состоящей из атомайзера, ингалятора, небулайзера, флакона с распылителем и распылительного насоса. Композиция может содержать пропеллент или может не содержать пропеллентов.
[0027] Эти и другие аспекты настоящего изобретения будут лучше поняты со ссылками на следующие далее Подробное описание и прилагаемую Формулу изобретения.
Краткое описание фигур
[0028] Фиг.1 иллюстрирует воздействие лечения аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на целостность тканей, инфицированных риновирусом A16. TEER отслеживают через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0029] Фиг.2 иллюстрирует воздействие лечения лизозимом при 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2), и 25 мкг/мл (HRV2-3) на целостность тканей, инфицированных риновирусом A16. TEER отслеживают через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0030] Фиг.3 иллюстрирует воздействие лечения растворимым ICAM-1 при 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3) на целостность тканей, инфицированных риновирусом A16. TEER отслеживают через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0031] Фиг.4 иллюстрирует воздействие лечения сочетанием аполактоферрина, лизозима и растворимого ICAM-1 при трех различных дозах, показанных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3), на целостность тканей, инфицированных риновирусом A16. TEER отслеживают через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0032] Фиг.5 иллюстрирует воздействие лечения аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на высвобождение LDH клетками, инфицированными риновирусом A16. Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0033] Фиг.6 иллюстрирует воздействие лечения лизозимом при 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3) на высвобождение LDH клетками, инфицированными риновирусом A16. Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0034] Фиг.7 иллюстрирует воздействие лечения растворимым ICAM-1 при 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3) на высвобождение LDH клетками, инфицированными риновирусом A16. Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0035] Фиг.8 иллюстрирует воздействие сочетания аполактоферрина, лизозима и растворимого ICAM-1 при трех различных дозах показанных в Таблице 5 (HRV4-1, HRV4-2 и HRV4-3) на высвобождение LDH клетками, инфицированными риновирусом A16. Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0036] Фиг.9 иллюстрирует воздействие лечения аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) на биение ресничек. Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0037] Фиг.10 иллюстрирует воздействие инфекции риновируса A16 на частоту биения ресничек эпителиальных клеток для обработки лизозимом при 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0038] Фиг.11 иллюстрирует воздействие инфекции риновируса A16 на частоту биения ресничек эпителиальных клеток для обработки растворимым ICAM-1 при 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0039] Фиг.12 иллюстрирует воздействие инфекции риновируса A16 на частоту биения ресничек эпителиальных клеток для обработки аполактоферрином, лизозимом и растворимым ICAM-1 при трех различных дозах показанных в Таблице 5 (HRV4-1, HRV4-2, и HRV4-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0040] Фиг.13 иллюстрирует воздействие инфекции риновируса A16 на мукоцилиарный клиренс эпителиальных клеток для обработки HRV. Мукоцилиарный клиренс отслеживают через 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0041] Фиг.14 иллюстрирует количество копий генома инфекции риновируса A16 для обработки аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0042] Фиг.15 иллюстрирует количество копий генома инфекции риновируса A16 для обработки лизозимом при 2500 мкг/мл (HRV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0043] Фиг.16 иллюстрирует количество копий генома инфекции риновируса A16 для обработки растворимым ICAM-1 при 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0044] Фиг.17A иллюстрирует количество копий генома инфекции риновируса A16 для обработки сочетанием аполактоферринома, лизозима и растворим ICAM-1 при трех различных дозах, показанных в Таблице 5 (HRV4-1, HRV4-2, и HRV4-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™. Фигуры 17B и 17C показывают количество копий генома (Log10) инфекции риновируса A16 для препарата HRV4, содержащего сочетания активных веществ, как приведено в Таблице 5, через 24 час pi и через 48 час pi, соответственно. Статистическую значимость измеряют относительно контроля (Vehicle (+)): *: p <0,05; **: p <0,01; ***: p <0,001.
[0045] Фиг.18 иллюстрирует количество муцина,, как измерено с помощью анализа ELLA, из апикальной среды, для обработки аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) и для инфекции риновируса A16 через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0046] Фиг.19 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (HRV2-2) и 25 мкг/мл (HRV2-3) и для инфекции риновируса A16 через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0047] Фиг.20 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки растворимым ICAM-1 при 50 мкг/мл (HRV3-1), 5 мкг/мл (HRV3-2) и 0,5 мкг/мл (HRV3-3) и для инфекции риновируса A16 через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0048] Фиг.21 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки аполактоферрином при 500 мкг/мл (HRV1-1), 50 мкг/мл (HRV1-2) и 5 мкг/мл (HRV1-3) и для инфекции риновируса A16 через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0049] Фиг.22 иллюстрирует воздействие инфекции гриппа A H1N1 на целостность тканей для обработки аполактоферрином при 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). TEER отслеживают через 24 (D1) и 48 часов (D2) после инокуляции на 3D среде MucilAir™.
[0050] Фиг.23 иллюстрирует воздействие инфекции гриппа A H1N1 на целостность тканей для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2), и 25 мкг/мл (IAV2-3). TEER отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0051] Фиг.24 иллюстрирует воздействие инфекции гриппа A H1N1 на целостность тканей для обработки сочетанием 3’-сиалиллактозы и 6’сиалиллактозы, каждое, при 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). TEER отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0052] Фиг.25 иллюстрирует воздействие инфекции гриппа A H1N1 на целостность тканей для обработки сочетанием аполактоферринома, лизозима и сиалиллактоз при трех различных дозах, показанных в Таблице 5 (IAV4-1, IAV4-2, и IAV4-3). TEER отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0053] Фиг.26 иллюстрирует воздействие инфекции гриппа A H1N1 на высвобождение LDH из эпителиальных клеток для обработки аполактоферрином при 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0054] Фиг.27 иллюстрирует воздействие инфекции гриппа A H1N1 на высвобождение LDH из эпителиальных клеток для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2), и 25 мкг/мл (IAV2-3). Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0055] Фиг.28 иллюстрирует воздействие инфекции гриппа A H1N1 на высвобождение LDH из эпителиальных клеток для обработки сочетанием 3’-сиалиллактозы и 6’-сиалиллактозы, каждое, при 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2), и 0,327 мкг/мл (IAV3-3). Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0056] Фиг.29 иллюстрирует воздействие инфекции гриппа A H1N1 на высвобождение LDH из эпителиальных клеток для обработки сочетанием аполактоферринома, лизозима и сиалиллактозы при трех различных дозах, показанных в Таблице 5 (IAV4-1, IAV4-2, и IAV4-3). Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0057] Фиг.30 иллюстрирует воздействие инфекции гриппа A H1N1 на частоту биения ресничек эпителиальных клеток для обработки аполактоферрином при 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0058] Фиг.31 иллюстрирует воздействие инфекции гриппа A H1N1 на частоту биения ресничек эпителиальных клеток для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0059] Фиг.32 иллюстрирует воздействие инфекции гриппа A H1N1 на частоту биения ресничек эпителиальных клеток для обработки сочетанием 3’-сиалиллактозы и 6’-сиалиллактоз, каждое, при 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0060] Фиг.33 иллюстрирует воздействие инфекции гриппа A H1N1 на частоту биения ресничек эпителиальных клеток для обработки сочетанием аполактоферрина, лизозима и сиалиллактозы при трех различных дозах, показанных в Таблице 5 (IAV4-1, IAV4-2, и IAV4-3). Частоту биения ресничек отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0061] Фиг.34 иллюстрирует воздействие инфекции гриппа A H1N1 на мукоцилиарный клиренс эпителиальных клеток для обработки IAV. Мукоцилиарный клиренс отслеживают 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0062] Фиг.35 иллюстрирует количество копий генома инфекции гриппа A H1N1 для обработки аполактоферрином при 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2) и 5 мкг/мл (IAV1-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0063] Фиг.36 иллюстрирует количество копий генома инфекции гриппа A H1N1 для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0064] Фиг.37 иллюстрирует количество копий генома инфекции гриппа A H1N1 для обработки сочетанием 3’-сиалиллактозы и 6’-сиалиллактозы, каждое, при 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0065] Фиг.38 иллюстрирует количество копий генома инфекции гриппа A H1N1 для обработки сочетанием аполактоферринома, лизозима и сиалиллактозы при трех различных дозах, показанных в Таблице 5 (IAV4-1, IAV4-2, и IAV4-3). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0066] Фиг.39 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки аполактоферрином при 500 мкг/мл (IAV1-1), 50 мкг/мл (IAV1-2), и 5 мкг/мл (IAV1-3) и для инфекции гриппа A H1N1 через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0067] Фиг.40 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки лизозимом при 2500 мкг/мл (IAV2-1), 250 мкг/мл (IAV2-2) и 25 мкг/мл (IAV2-3) и для инфекции гриппа A H1N1 через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0068] Фиг.41 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки сочетанием 3’-сиалиллактозы и 6’сиалиллактозы, каждое, при 327 мкг/мл (IAV3-1), 3,27 мкг/мл (IAV3-2) и 0,327 мкг/мл (IAV3-3) и для инфекции гриппа A H1N1 через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0069] Фиг.42 иллюстрирует количество муцина, как измерено с помощью анализа ELLA, из апикальной среды для обработки сочетанием аполактоферринома, лизозима и сиалиллактозы при трех различных дозах, показанных в Таблице 5 (IAV4-1, IAV4-2, и IAV4-3) и для инфекции гриппа A H1N1 через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
[0070] Фиг.43 иллюстрирует количество копий генома инфекции риновируса A16 для обработки аполактоферрином (R1H и R1L), лизозимом (R2H и R2L) и растворимым ICAM-1 (R3 и R4). Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0071] Фиг.44 иллюстрирует количество копий генома инфекции риновируса A16 для препаратов, содержащих сочетания активных веществ, показанных на Фиг.43. Вирусную нагрузку измеряют через 3,5, 24 и 48 часов после инокуляции на 3D среде MucilAir™.
[0072] Фиг.45 показывает количество копий генома (Log10) инфекции риновируса A16 для препаратов, содержащих сочетания активных веществ, как приведено в Таблице 7, через 24 час pi (“D1”). Статистическую значимость измеряют относительно контроля (Vehicle(+)): *: p<0,05; **: p<0,01; ***: p<0,001.
[0073] Фиг.46 показывает количество копий генома (Log10) инфекции риновируса A16 для препаратов, содержащих сочетания активных веществ как приведено в Таблице 7, через 48 час pi (“D1”). Статистическую значимость измеряют относительно контроля (Vehicle(+)): *: p<0,05; **: p<0,01; ***: p<0,001.
[0074] Фиг.47A показывает анализ трекинга шариков на среде для Vehicle(-), используемый для определения воздействия инфекции риновируса A16 на мукоцилиарный клиренс через 48 час после инфицирования (“D2”). Фиг.47B показывает анализ трекинга для препарата аполактоферрина, лизозима и растворимого ICAM-1 (R1L+R2L+R4) в D2. Масштабная линейка представляет 100 мкм, кружки представляют отдельные шарики и линии представляют траекторию каждого измеряемого шарика.
[0075] Фиг.48 иллюстрирует результаты измерений MCC для каждого конкретного препарата в D2. Точечная линия представляет значение для инфицированной лекарственной среды, для сравнения.
[0076] Фиг.49 иллюстрирует высвобождение LDH для инокулированной среды, для каждого конкретного препарата, в D1 и D2. Точечная линия представляет цитотоксичный порог.
[0077] Фиг.50 иллюстрирует количество копий генома (линейных) инфекции H1N1 как процент изменения по сравнению с количеством копий генома Vehicle(+) в D1 и D2. Измерения осуществляют на апикальных промывках сред в D1 и D2. Препараты, содержащие сочетания активных веществ, как подробно описано в Таблице 8, наносят на инокулированные среды. Статистическую значимость измеряют относительно контроля (Vehicle(+)) в указанный день: *: p<0,05; **: p<0,01; ***: p<0,001.
[0078] Фиг.51 иллюстрирует количество копий генома (линейных) инфекции H1N1 как процент изменения по сравнению с количеством копий генома Vehicle(+) в D1 и D2. Измерения осуществляют на собранных базальных средах в D1 и D2. Препараты, содержащие сочетания активных веществ, как приведено в Таблице 8, наносят на инокулированные среды. Статистическую значимость измеряют относительно контроля (Vehicle(+)) в указанный день: *: p<0,05; **: p<0,01; ***: p<0,001.
[0079] Фиг.52 иллюстрирует воздействие инфекции гриппа A H1N1 на целостность тканей для различных сочетаний аполактоферрина, лизозима, сиалиллактозы и кверцетина при дозах, показанных в Таблице 8. TEER отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™. Точечная линия представляет Vehicle(+) для сравнения.
[0080] Фиг.53 иллюстрирует воздействие инфекции гриппа A H1N1 на высвобождение LDH из эпителиальных клеток для различных сочетаний аполактоферрина, лизозима, сиалиллактозы и кверцетина, как показано в Таблице 8. Цитотоксичность отслеживают через 24 (D1) и 48 (D2) часов после инокуляции на 3D среде MucilAir™.
Подробное описание изобретения
[0081] Настоящее изобретение может быть понято легче со ссылками на следующее далее подробное описание и Примеры, включенные в него. До объяснения и описания настоящих способов и технологий специалисту в данной области необходимо понять, что настоящее изобретение не ограничивается конкретными способами анализа или синтеза, описанными настоящем документе. Необходимо понять также, что терминология, используемая в настоящем документе, предназначена для цели описания только конкретных вариантов осуществления и не рассматривается как ограничивающая. Если не определено иного, все технические и научные термины, используемые в настоящем документе, имеют значения, обычно понимаемые специалистами в той области, к которой относится настоящее изобретение.
[0082] Под “агентом” или “терапевтическим агентом” подразумевается любое низкомолекулярное химическое соединение, антитело, молекула нуклеиновой кислоты или полипептид, или их фрагменты. Под “терапевтическим агентом” подразумевается любая композиция, предназначенная для предотвращения или лечения респираторных инфекций, описанных в настоящем документе.
[0083] Под “облегчением” подразумевается уменьшение, подавление, ослабление, ограничение, приостановка или стабилизация развития или прогрессирования респираторного заболевания или его симптома.
[0084] Под “аналогом” подразумевается молекула, которая не является идентичной данной, но имеет аналогичные функциональные или структурные особенности. Например, полипептидный аналог сохраняет биологическую активность соответствующего встречающегося в природе полипептида, хотя имеет определенные биохимические модификации, которые усиливают функцию аналога по сравнению с встречающимся в природе полипептидом. Такие биохимические модификации могли бы повысить стойкость аналога к протеазам, проницаемость мембран для них или половинное время жизни, без изменения, например, связывания лигандов. Аналог может содержать искусственную аминокислоту.
[0085] Как используется в настоящем документе “интерферирующая РНК” относится к любой двухцепочечной или одноцепочечной последовательности РНК, способной либо прямо или опосредованно (то есть, при преобразовании) ингибировать или даун-регулировать экспрессирование гена посредством медиирования РНК-интерференции. Интерферирующая РНК включает, но, не ограничиваясь этим, малую интерферирующую РНК (“siRNA”) и малую шпилечную РНК (“shRNA”). “РНК-интерференция” относится к селективной деградации последовательность-совместимого транскрипта матричной РНК.
[0086] Как используется в настоящем документе, “shRNA” (малая шпилечная РНК) относится к молекуле РНК, содержащей антисмысловую область, петлевую часть и смысловую область, где смысловая область содержит комплементарные нуклеотиды, которые образуют пары оснований с антисмысловой областью с формированием дуплексного ствола.
После пост-транскрипционного процессинга, малая шпилечная РНК преобразуется в малую интерферирующую РНК посредством события расщепления, опосредуемого ферментом Dicer, который представляет собой член семейства РНКазы III.
[0087] Как используется в настоящем документе “RNAi” (РНК-интерференция) относится к пост-транскрипционному механизму сайленсинга, инициируемому малыми двухцепочечными молекулами РНК, которые подавляют экспрессирование генов с гомологией последовательностей.
[0088] Как используется в настоящем документе, “изменение по сравнению с контрольным” образцом или субъектом понимается как наличие такого уровня аналитического, диагностического или терапевтического индикатора, который должен детектироваться на уровне, который статистически отличается от образца от нормального, нелеченого или контрольного образца или субъекта. Контрольные образцы включают, например, клетки в культуре, одно или более исследуемых лабораторных животных, или одного или нескольких субъектов людей. Способы выбора и исследования контрольных образцов известны специалистам в данной области. Аналитическое вещество может представлять собой встречающееся в природе вещество, которое характеристически экспрессируется или продуцируется клеткой или организмом (например, антитела, патогенные пептиды или частицы, и тому подобное), или вещество, продуцируемое репортерным конструктом (например, β-галактозидаза или люцифераза, и тому подобное). В зависимости от используемого способа детектирования, количество и измерение изменения может варьироваться. Определение статистической значимости известно специалистам в данной области.
[0089] Как используется в настоящем документе, термин “совместно вводимый” или “совместное введение”, и тому подобное, относится к акту введения двух или более агентов (например, антимикробного агента и противовирусного агента, и тому подобное), соединений, видов терапии или чего-либо подобного, в одно и то же или примерно в одно и то же время. Порядок или последовательность введения различных агентов по настоящему изобретению, например, антибиотиков, противовирусных препаратов, антигрибковых препаратов, или иммунотерапевтических агентов, может изменяться, и оно, не ограничивается какой-либо конкретной последовательностью. Совместное введение может также относится к ситуации, где два или более агентов вводятся в различных частях тела или с помощью различных схем доставки, например, когда первый агент вводится интраназально, а второй агент вводится системно, или наоборот. Совместное введение может также относится к двум или более агентам, вводимым с помощью одной и той же схемы доставки, например, когда первый агент вводится интраназально и второй агент вводится интраназально.
[0090] Как используется в настоящем документе, термины “содержит”, “содержащий”, “имеет” и “имеющий”, и подобные им являются открытыми, как определено патентным законодательством США и могут означать “включает”, “включающий”, и тому подобное. Термины “состоящий в основном из” или “состоит в основном из”, подобным же образом, имеют значение, приписываемое им патентным законодательством США, и являются открытыми, давая возможность для присутствия чего-то большего, чем то, что перечисляется, постольку поскольку базовые или новые характеристики того, что упоминается, не изменяются в присутствии дополнений к тому, что упоминается, но исключает варианты осуществления, известные из литературы.
[0091] “Вступление в контакт с клеткой” понимается в настоящем документе как доставка агента к клетке (например, клетке назальной мембраны, и тому подобное), так что агент может взаимодействовать с клеткой (например, с клеткой назальной мембраны, которая должна лечиться, и тому подобное) и/или поглощаться клеткой и оказывать воздействие на клетку. Агент (например, антимикробный или противовирусный агент, и тому подобное) может доставляться в клетку прямо (например, посредством добавления агента в препарат геля или аэрозоля для назальной доставки, и тому подобное). Специалист в данной области легко поймет, что введение терапевтического агента субъекту включает приведение в контакт терапевтического агента с клеткой или тканью субъекта.
[0092] Как используется в настоящем документе, термин “связанный”, как при упоминании двух или более агентов, “связанных” вместе, относится к ковалентной или иной стабильной ассоциации двух или более агентов. Например, терапевтический агент может связываться с антимикробным агентом с помощью ковалентной связи, ковалентно связанного линкерного остатка, или нековалентно, с помощью ионных взаимодействий или водородных связей. Один или более агентов, которые связаны вместе, сохраняют по существу свои независимые функции и характеристики. Например, терапевтический агент, когда связан с другим агентом, может сохранять такую же активность, как если бы они были независимыми.
[0093] Под “циклом” или “лекарственным циклом” подразумевается введение повторяющихся доз в течение определенного периода времени, который может находиться в пределах от минут до часов, дней, недель, месяцев или даже лет.
[0094] Под “цитокином” подразумевается гормон, который действует местным образом и который модулирует иммунную реакцию индивидуума.
[0095] Как используется в настоящем документе “детектирование”, “обнаружение”, и тому подобное, как понимается, включают анализ, осуществляемый для определения одной или нескольких характеристик образца, например, идентификацию присутствия, отсутствия или количества анализируемого вещества, которое должно детектироваться. Например, детектирование может включать идентификацию конкретного анализируемого вещества в образце или активности агента в образце. Детектирование может включать определение присутствия нуклеиновой кислоты или белка (например, антитела, цитокина, и тому подобное) посредством PCR, иммунного анализа (например, ELISA, ELLA, и тому подобное), микроскопии, патогенного провоцирования, и тому подобное. Количество анализируемого вещества или активности, детектируемой в образце, может отсутствовать или быть ниже уровня детектирования анализа или метода.
[0096] Под “заболеванием” подразумевается любое состояние или расстройство, которое повреждает или отрицательно влияет на нормальную функцию клетки, ткани или органа. Иллюстративное заболевание представляет собой респираторную инфекцию.
[0097] Термины “эффективное количество”, “терапевтически эффективное количество” или “фармацевтически эффективное количество”, как используется в настоящем документе, относится к количеству агента или соединения, которое является достаточным для предотвращения или лечения расстройства (например, респираторной инфекции, вирусной инфекции, и тому подобное). В некоторых вариантах осуществления, результат представляет собой уменьшение и/или облегчение признаков, симптомов или причин расстройства, или любое другое желательное изменение биологической системы. Например, “эффективное количество” терапевтического агента может представлять собой количество композиции, содержащей соединение, как описано в настоящем документе, необходимое для обеспечения клинически значимого уменьшения заболевания/расстройства (например, респираторной инфекции, и тому подобное). “Эффективное количество” или терапевтически эффективное количество агента или сочетания агентов по настоящему изобретению может также представлять собой количество или дозу, которая является эффективной для существенного уменьшения или устранения инфекции, или для предотвращения ее появления. Соответствующее “эффективное” количество в каждом индивидуальном случае определяется с использованием любой соответствующей методики (например, исследования с повышением дозы, и тому подобное) и будет зависеть от суждения практикующего врача. Однако, соответствующие диапазоны дозирования легко определяются специалистом в данной области.
[0098] Могут потребоваться более доз для получения эффективной дозы. Понятно, что эффективная доза для одной популяции может быть или не быть достаточной для всех популяций. Таким образом, в связи с введением терапевтического агента, терапевтический агент может быть “эффективным против” заболевания или состояния, когда введение клинически обоснованным образом дает в результате полезное воздействие, по меньшей мере, для статистически значимой доли субъектов, такое как предотвращение появления заболевания, улучшение симптомов, излечение, уменьшение признаков или симптомов заболевания, увеличение продолжительности жизни, улучшение качества жизни или другое воздействие, определяемое в целом как положительное, врачами, имеющими опыт лечения конкретного типа заболевания или состояния.
[0099] Под “улучшением” подразумевается положительное изменение, по меньшей мере, на 10%, 25%, 50%, 75%, 100% или на любое число в этих пределах.
[00100] Как используется в настоящем документе, “иммунный анализ” представляет собой способ детектирования на основе специфичного связывания, по меньшей мере, одного антитела с антигеном, например, ELISA, ELLA, RIA, вестерн блот, и тому подобное.
[00101] Как используется в настоящем документе “ иммуноген”, “иммуногенный”, и тому подобное, относится к веществам, которые вызывают иммунную реакцию, например, иммунную реакцию на основе антитела или иммунную реакцию, медиируемую клетками, по меньшей мере, в одном организме.
[00102] Под “иммуногенной композицией” подразумевается композиция, содержащая молекулу, которая может индуцировать или модулировать иммунную реакцию у субъекта. Такая иммунная реакция может представлять собой профилактическую или терапевтическую иммунную реакцию.
[00103] Как используется в настоящем документе, термин “иммунотерапевтический агент” относится к любому агенту, соединению или биологическому веществу, которое может модулировать иммунную систему хозяина. Например, иммунотерапевтический агент может вызывать стимулирование иммунной системы против респираторной инфекции.
[00104] Как используется в настоящем документе “вызывать иммунитет” как подразумевается, относится к любой иммунной реакции, генерируемой против антигена. В вариантах осуществления, иммунитет медиируется антителами против инфекционного агента, который демонстрируется позвоночными (например, людьми, и тому подобное), который предотвращает или облегчает инфекцию, или уменьшает, по меньшей мере, один ее симптом. Иммуногенные композиции по настоящему изобретению могут стимулировать продуцирование антител, которые, например, нейтрализуют взвешенные в воздухе патогены/инфекционные агенты, блокируют попадание инфекционных агентов в клетки, блокируют репликацию инфекционных агентов и/или защищают клетки хозяева от инфекции и разрушения. Термин может также относится к иммунной реакции, которая медиируется T-лимфоцитами и/или другими лейкоцитами против инфекционного агента, демонстрируемой позвоночным (например, человеком, и тому подобное), которая предотвращает или облегчает инфекцию, или уменьшает, по меньшей мере, один ее симптом.
[00105] Термин “выделенный”, как используется в настоящем документе, относится к любой композиции, молекуле или смеси, которая подвергается воздействию лабораторной процедуры очистки, включая, но, не ограничиваясь этим, экстракцию, центрифугирование, хроматографическое разделение (то есть, например, тонкослойную хроматографию или высокоэффективную жидкостную хроматографию). Обычно такая процедура очистки дает выделенную композицию, молекулу или смесь на основе физических, химических свойств или свойств электрического потенциала. В зависимости от выбора процедуры, выделенная композиция, молекула или смесь может содержать другие композиции, соединения или смеси, имеющие сходные химические свойства. Например, выделенная композиция, молекула или смесь может содержать в пределах 1-20%, 1-10%, или 1-5% композиций или смесей, имеющих сходные химические свойства.
[00106] Как используется в настоящем документе, термин “местный” или “местным образом”, как при местном введении или совместном введении одного или нескольких терапевтических средств, относится к доставке терапевтического агента в область организма (например, в мембрану носовой полости, и тому подобное), которая находится вблизи или рядом с областью инфекции, недалеко или непосредственно рядом с местом инфекции, на периметре инфекции или в контакте с инфекцией, или в инфицированной ткани или внутри нее. Местное введение, как правило, исключает системные способы введения.
[00107] Как используется в настоящем документе, “нуклеиновая кислота” как для нуклеиновой кислоты для доставки в клетку, понимается как ее обычное значение в данной области, как полинуклеотид или олигонуклеотид, которое относится к нити, по меньшей мере, двух сочетаний фосфатов основных сахаров. Нуклеотиды представляют собой мономерные единицы полимеров нуклеиновых кислот. Термин включает дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК) в форме олигонуклеотидной матричной РНК, антисмысловой ДНК, ДНК плазмиды, частей ДНК плазмиды, генетического материала, полученного из вируса, и тому подобное. Полинуклеотиды включают нуклеиновые кислоты, по меньшей мере, из двух мономеров. Антисмысловые полинуклеотиды представляют собой нуклеиновые кислоты, которые отрицательно влияют на функцию ДНК или РНК. siRNA или shRNA представляют собой двухцепочечную РНК, которая ингибирует или разрушает активность или трансляцию, например, посредством ускорения деградации модифицирующего сплайсирования или процессинга клеточной нуклеиновой кислоты, например, mRNA, microRNA, и тому подобное, на которую она нацелен. Как используется в настоящем документе, siRNA и shRNA включают любую двухцепочечную молекулу РНК, которая может модулировать стабильность, трансляцию или сплайсирование РНК, с которой гибридизируется, по меньшей мере, одна цепочка двухцепочечной нуклеиновой кислоты. РНК хорошо известны в данной области, смотри, например, публикации патентов WO/2002/044321, WO/2003/099298, US 20050277610, US 20050244858; и патенты США №№ 7297786, 7560438 и 7056704, все они включаются в настоящий документ в качестве ссылок. Нуклеиновая кислота, как используется в настоящем документе, как понимается, включает искусственные нуклеотиды (не существующие в природе), например: производные природных нуклеотидов, такие как фосфотионаты или пептидные нуклеиновые кислоты (такие как те, которые описаны в патентах и заявках, цитируемых непосредственно выше). Нуклеиновая кислота может доставляться в клетку для осуществления клеточного изменения, которое является терапевтическим или профилактическим. Нуклеиновая кислота может экспрессировать белок или полипептид, например, белок, который отсутствует или является нефункциональным в клетке или субъекте. Нуклеиновая кислота может быть одно- или двухцепочечной, может быть смысловой или антисмысловой и может доставляться в клетку как голая ДНК, в сочетании с агентами, облегчающими поступление нуклеиновой кислоты в клетку (например, с реагентами трансфицирования, и тому подобное), в контексте вирусного вектора, и тому подобное. Нуклеиновая кислота может нацеливаться на нуклеиновую кислоту, которая является эндогенной для клетки (mRNA или microRNA), или представлять собой гетерологичную нуклеиновую кислоту (например, нуклеиновую кислоту патогена, такого как вирусный ген, и тому подобное). Доставка нуклеиновой кислоты означает перенос нуклеиновой кислоты извне субъекту, внутрь наружной клеточной мембраны клетки субъекта.
[00108] “Получение” понимается в настоящем документе как изготовление, покупка, синтез, выделение, очистка или приобретение иным образом.
[00109] Термин “фармацевтически приемлемый”, как используется в настоящем документе, относится к материалу (например, носителю или разбавителю, и тому подобное), который не нарушает биологической активности или свойств соединений, описанных в настоящем документе, и является относительно нетоксичным (то есть, материал вводится индивидууму не вызывая нежелательных биологических воздействий или не взаимодействуя вредным образом с любыми компонентами композиции, в которой он содержится).
[00110] Фраза “фармацевтически приемлемый носитель, наполнитель или разбавитель” используется в данной области и включает фармацевтически приемлемый материал, композицию или лекарственную среду, пригодные для введения соединений по настоящему изобретению млекопитающим. Как используется в настоящем документе, термин “фармацевтически приемлемый” означает одобренный директивным органом Федерального правительства или правительства штата, или описанный в U.S. Pharmacopia, European Pharmacopia или в другой, широко известной фармакопее, для использования на млекопитающих, например, людях.
[0111] Как используется в настоящем документе, термин “фармацевтически эффективный режим” относится к систематическому плану введения одного или нескольких терапевтических агентов, который включает такие аспекты, как тип терапевтического агента, концентрации терапевтического агента и любые изменения в них, происходящие в ходе курса введения лекарственного средства, которое при введении является эффективным при лечении и/или предотвращении инфекции. Такие соображения зависят от суждения практикующего врача и легко определяются специалистом в данной области.
[0112] “Полипептид” или “пептид”, как используется в настоящем документе, понимается как две или более независимо выбранных природных или искусственных аминокислот, соединенных ковалентной связью (например, пептидной связью, и тому подобное). Пептид может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более природных или искусственных аминокислот, соединенных пептидной связью. Полипептиды, как описано в настоящем документе, включают полноразмерные белки (например, полностью процессированные белки, и тому подобное), а также более короткие последовательности аминокислот (например, фрагменты встречающихся в природе белков или фрагменты синтетических полипептидов, и тому подобное).
[0113] Диапазоны, приведенные в настоящем документе, как понимается, представляют собой краткое обозначение для всех значений в этом диапазоне, включая пределы диапазона. Например, диапазон от 1 до 50, как понимается, включает любое число, сочетание чисел, или поддиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50, а также все промежуточные десятичные значения после запятой между рассмотренными выше целыми числами, такие, например, как 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8 и 1,9. Относительно поддиапазонов, “вложенные поддиапазоны”, которые простираются от любой конечной точки диапазона, предполагаются конкретно. Например, вложенный поддиапазон иллюстративного диапазона от 1 до 50 может включать 1-10, 1-20, 1-30 и 1-40 в одном направлении, или 50-40, 50-30, 50-20 и 50-10 в другом направлении.
[0114] Под “уменьшением” подразумевается отрицательное изменение, по меньшей мере, на 10%, 25%, 50%, 75%, 100%, или на любое число между ними.
[0115] Под “эталонным” подразумевается стандартное или контрольное состояние.
[0116] Как используется в настоящем документе, термин “режим” относится к различным параметрам, которые характеризуют то, как вводится лекарственное средство или агент, включая уровень дозирования, временной график и повторения, а также отношение различных лекарственных средств или агентов друг к другу. Термин “фармацевтически эффективный режим” относится к конкретному режиму, который обеспечивает желаемый терапевтический результат или воздействие. Термин “повторения” относится к общей концепции повторяющихся сочетаний введения одного или нескольких агентов. Например, сочетание лекарственного средства X и лекарственного средства Y может вводиться (совместно вводится или вводиться примерно в одно и то же время и в любом порядке) пациенту в первый день при дозе Z. Лекарственные средства X и Y могут затем вводиться (совместно вводиться или вводиться примерно в одно и то же время и в любом порядке) снова при дозе Z или при другой дозе, на второй день. Временной график между первым и вторым днем может составлять 1 день или где-то до нескольких дней, или неделю, или более недель или месяцев. Повторяющиеся введения могут также осуществляться в один и тот же день, разделенные указанным количеством минут (например, 10 минутами, 20 минутами, 30 минутами или более) или часами (например, 1 часом, 2 часами, 4 часами, 6 часами, 12 часами, и тому подобное). Эффективный режим дозирования может определяться специалистом в данной области, например, лечащим врачом, с использованием обычной практики.
[0117] “Образец”, как используется в настоящем документе, относится к биологическому материалу, который выделяется из своей окружающей среды (например, из крови или ткани животного, клеток или из кондиционированных сред из культуры тканей). В вариантах осуществления, образец, как ожидается, содержит или, как известно, содержит анализируемое вещество, такое как инфекционный агент или белок, представляющий интерес (например, антитело, цитокин, и тому подобное). Образец может также представлять собой частично очищенную фракцию ткани или телесной жидкости. Эталонный образец может представлять собой “нормальный” образец текучей среды от донора, не имеющего заболевания или состояния, или из нормальной ткани субъекта, имеющего заболевание или состояние, или нелеченого субъекта (например, субъекта не леченого вакциной, и тому подобное). Эталонный образец может также отбираться в “нулевой момент времени” перед приведением в контакт клетки или субъекта с агентом или терапевтическим вмешательством, которое должно исследоваться.
[0118] Как используется в настоящем документе, термин “селективно” означает тенденцию к осуществлению с более высокой частотой в одной популяции чем в другой популяции.
[0119] Под “специфичным связыванием” подразумевается распознавание и связывание с мишенью (например, полипептидом, клеткой, и тому подобное), при отсутствии, по существу, распознавания и/или связывания с другими молекулами в образце, например, в биологическом образце.
[0120] Термин “субъект”, как используется в настоящем документе, относится к любому организму, который может испытывать респираторную инфекцию. Такие организмы включают, но, не ограничиваясь этим, людей, собак, кошек, лошадей, коров, овец, коз, мышей, крыс, морских свинок, обезьян, приматов, приматов отличных от человека, птиц, рептилий, и тому подобное.
[0121] Субъект “страдающий или, как ожидается, будет страдать от” конкретного заболевания, состояния или синдрома (например, от респираторной инфекции, и тому подобное), имеет достаточное количество факторов риска или существует с достаточным количеством или сочетанием признаков или симптомов заболевания, состояния или синдрома, так что компетентный специалист диагностировал бы или ожидал бы, что субъект страдает от заболевания, состояния или синдрома. Способы идентификации субъектов, страдающих или, как ожидается, которые будут страдать от респираторной инфекции, известны специалистам в данной области. Субъекты, страдающие, и как ожидается, которые будут страдать от конкретного заболевания, состояния или синдрома, не обязательно представляют собой две различных группы. Фраза “индивидуум, нуждающийся в этом” или “пациент, нуждающийся в этом” или “субъект, нуждающийся в этом”, означает индивидуума, имеющего заболевание или состояние (например, респираторную инфекцию, и тому подобное). В некоторых вариантах осуществления, индивидуум, нуждающийся в лечении, представляет собой пациента, который имеет вирус гриппа или риновирус.
[0122] Термин “предотвращение” или “профилактика”, как используется в настоящем документе, включает предотвращение, уменьшение степени, или замедление наступления или прогрессирования заболевания или физиологического проявления заболевания. “Профилактика” или “предотвращение” может относиться к предотвращению, уменьшению степени или уменьшению скорости инфицирования (например, вирусной инфекции, и тому подобное). Термин “лечение” включает убывание, уменьшение, устранение, облегчение, предупреждение, замедление прогрессирования и/или замедление наступления данного заболевания или его физиологического проявления. Неограничивающие примеры включают людей, других млекопитающих, жвачных животных, крыс, мышей, собак, обезьян, коз, овец, коров, оленей и других животных, отличных от млекопитающих, включая птиц. В некоторых вариантах осуществления, пациент представляет собой человека.
[0123] Как используется в настоящем документе, “чувствительный к” или “склонный к”, или “предрасположенный к” конкретному заболеванию или состоянию, и тому подобное, относится к индивидууму, который на основе генетических факторов риска, факторов риска, связанных с окружающей средой, здоровья и/или других факторов риска с большей вероятностью разовьет заболевание или состояние, чем популяция в целом. Увеличение вероятности развития заболевания может представлять собой увеличение примерно на 10%, 20%, 50%, 100%, 150%, 200% или больше.
[0124] Как используется в настоящем документе, термины “лечение”, “лечащий”, и тому подобное, относятся к получению желаемого фармакологического и/или физиологического воздействия. Воздействие может являться профилактическим с точки зрения полного или частичного предотвращения заболевания или его симптома, и/или может быть терапевтическим с точки зрения частичного или полного излечения заболевания и/или отрицательного воздействия, приписываемого заболеванию.
[0125] Термин “гликолипиды”, как используется в настоящем документе, относится к любой молекуле, по меньшей мере, с одной углеводной цепью, связанной с церамидом, цепью жирной кислоты или любым другим липидом. Альтернативно, гликолипид может упоминаться как гликосфинголипид.
[0126] Как используется в настоящем документе и в прилагаемой формуле изобретения, формы единственного числа включают ссылку на множественное число, если только контекст не диктует четко иного. Так, например, упоминание гена как “ген” представляет собой упоминание одного или нескольких генов и включает их эквиваленты известные специалистам в данной области, и так далее.
[0127] Если это конкретно не упоминается или не является очевидным из контекста, как используется в настоящем документе, термин “или” как понимается является инклюзивным.
[0128] Если это конкретно не упоминается или не является очевидным из контекста, как используется в настоящем документе, термин “примерно” понимается как нахождение в пределах нормального допуска в данной области, например, в пределах 2 стандартных отклонений от среднего. Примерно может пониматься как в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05% или 0,01% от сформулированного значения. Если из контекста не очевидно иное, все численные значения, приведенные в настоящем документе, могут модифицироваться термином примерно.
[0129] Если не указано иного, все упоминания концентраций включают указанные количества как масс/масс, масс/объем или объем/объем. Любая упоминание процентной концентрации, как будет понятно, относится к масс/масс, масс/объем или масс/объем. Хотя определенные варианты осуществления могут описываться с помощью концентрации как масс/масс или масс/объем, необходимо понимать, что такие композиции описывают одинаковый % как масс/масс или масс/объем. Плотность в любых формах по настоящему изобретению может быть в пределах между 0,8 г/мл и 1,2 г/мл, например, между 0,9 г/мл и 1,1 г/мл или между 0,95 г/мл и 1,05 г/мл.
[0130] Упоминание списка химических групп в любом определении переменных в настоящем документе включает определения этой переменной как любой отдельной группы или сочетания приведенных групп. Упоминание варианта осуществления переменной или аспекта в настоящем документе включает этот вариант осуществления как любой отдельный вариант осуществления или сочетания с любыми другими вариантами осуществления или их частями.
[0131] Другие определения появляются в контексте в настоящем описании.
[0132] Любые терапевтические агенты, композиции или способы, предлагаемые в настоящем документе, можно объединять с одним или несколькими любыми другими терапевтическими агентами, композициями и способами, предлагаемыми в настоящем документе. Буде понятно, что рассматриваются производные, такие как сложные эфиры, и пролекарства, которые сохраняют функциональность основного соединения.
[0133] Настоящее изобретение предлагает композиции и способы предотвращения и лечения респираторных инфекций. Настоящее изобретение определяет способы и композиции для усиления способности фильтрования у мембран носовой полости и защиты от взвешенных в воздухе патогенов посредством улучшения здоровья мембран носовой полости и способности фильтрования у назальной слизистой. В частности, изобретение определяет антимикробные, противовирусные и антимикробные композиции, которые предотвращают и лечат респираторные инфекции, вызываемые бактериями, вирусами и грибками, включая вирусы гриппа и риновирусы (например, вирусы, которые вызывают грипп и простуду, соответственно). Настоящее изобретение основано, по меньшей мере, частично, на том открытии, что композиции, содержащие антимикробные, противовирусные и/или антимикробные функциональные группы, можно использовать для улучшения здоровья и способности фильтрования у мембран носовой полости и защиты от взвешенных в воздухе патогенов. При этом, они должны также поддерживать физиологическое здоровье мембран, например, поддерживая здоровый pH и осмолярность и способствуя размножению здоровой микрофлоры. В конкретном иллюстративном варианте осуществления, настоящее изобретение относится к антимикробной и противогрибковой фильтровальной композиции, приготовленной для местного нанесения на передние части ноздрей или на внутреннюю ближнюю мембрану носовой полости, где она может также покрывать волоски в носу и улучшать способности фильтрования у носа. Преимущественно, настоящее изобретение, как описано в настоящем документе, предлагает наносимую местным образом фильтровальную композицию для назального и/или перорального нанесения, которая не воздействует отрицательно на химические свойства респираторных мембран или слизистых (и улучшает их природные способности фильтрования) и которая конкретно нацелена на более микроорганизмов, вызывающих заболевание и защищает от них.
[0134] Настоящее изобретение также предлагает способы улучшения природных свойств фильтрования респираторных мембран и уменьшения количества микроорганизмов, аллергенов и одорантов, поступающих в организм через нос или пролиферирующих на респираторных мембранах. В некоторых вариантах осуществления, этот способ включает нанесение местным образом, или вдыхания или заглатывания раствора антимикробной, противовирусной, противогрибкоой, и/или нейтрализующей запахи композиции в рот, глотку, носовые отверстия, на назальный эпителий в ноздрях и/или на волоски в носу. Антимикробный, противовирусный и противогрибковый раствор может иметь форму геля, лосьона, пастилки, паров или аэрозоля и может содержать сочетание активных ингредиентов, предназначенных для укрепления природных способностей фильтрования у носа, в основной среде, которая дает возможность активным ингредиентам быть хорошо переносимыми в их активных формах, в то же время предотвращая их нежелательные воздействия. Композиции в настоящем документе могут также воспроизводить химические свойства природной здоровой слизистой или слюны, такие, например, как pH и осмолярность. Ингредиенты могут балансироваться для создания синергического воздействия более сильного, чем у любого из отдельных ингредиентов, и могут также балансироваться для поддержания здорового pH и осмолярности в респираторных мембранах, поскольку эти параметры, как известно, влияют на вероятность передачи заболевания и аллергической реакции. Активные ингредиенты могут включать, но, не ограничиваясь этим, рекомбинантный, полученный в природе или очищенный лактоферрин, лизозим, ICAM, катионные пептиды, гликозилированные пептиды, сиаловую кислоту, кверцетин или другие биофлавоноиды, в дополнение к любому растительному экстракту, имеющему антимикробные свойства (включая, но, не ограничиваясь этим, экстракты кожуры фруктов и каррагинаны), микрочастицы серебра, меди или цинка и лауриновую кислоту, которые, как показано, имеют антимикробные свойства. Различные варианты осуществления могут также содержать один или более из следующих ингредиентов: бикарбонат натрия, активированный древесный уголь, масло какао, масло из семян ши, пчелиный воск, растительное масло, глицерин, мед, альгинаты или растительный клей, и консервант, такой как витамин C, витамин E, или розмариновая кислота. Различные варианты осуществления могут включать ингредиенты, которые, при смешивании с рассмотренными выше активными ингредиентами, создают препарат, который хорошо переносится при нанесении на носовые отверстия, на назальный эпителий внутри ноздрей, или на волоски в носу, и это дает возможность для удерживания активных ингредиентов в областях нанесения в течение периода времени достаточного для предотвращения инфекции или аллергии до следующего нанесения.
Респираторная функция
[0135] Респираторные инфекции представляют собой один из наиболее распространенных типов передающихся заболеваний в сегодняшнем мире. Почти каждый год новые и потенциально смертельные заболевания, такие как Ближневосточный респираторный синдром (MERS) и птичий и свиной грипп, привлекают внимание и заботу всего мира. Новые и необычные штаммы вируса гриппа постоянно сливаются и способны создавать пандемии в течение месяцев. Кроме того, современное состояние противовирусной технологии и технологии вакцин не очень хорошо приспособлено для работы с этими статистическими выбросами своевременным образом. В лучшем случае, вакцина, нацеленная на новый штамм вируса, становится доступной через шесть месяцев - год, за это время эпидемия может в значительной степени затихнуть.
[0136] Каждый день, примерно 12000 литров воздуха фильтруется через средний нос. Носовые проходы фильтруют 95% частиц больших, чем 15 мкм в диаметре из воздуха. Они обычно захватываются слизистыми, а затем заглатываются. Микроорганизмы и аллергены обычно на более порядков величины меньше, чем этот порог, и они проскальзывают или преодолевают природную слизистую защиту в носу, преодолевают мембраны носовой полости и/или попадают в нижние дыхательные пути через рот или глотку. Согласно методикам настоящего документа, усиление респираторных мембран и слизистых с помощью антимикробных и фильтрующих агентов может сделать возможным предотвращение значительного количества респираторных инфекций и аллергий простым и ненавязчивым, и удобным образом. В дополнение к этому, многие нежелательные частицы, попадающие в нос, представляют собой одоранты, которые могут быть нежелательными и которые могут фильтроваться или нейтрализоваться с помощью определенных веществ, таких как, но, не ограничиваясь этим, активированный уголь или бикарбонат натрия, суспендированный в носителе, до того, как они смогут связаться с рецепторами одоранта.
[0137] Настоящее изобретение направлено на антимикробное, противовирусное, противогрибковое, нейтрализующее запах местное нанесение, которое стимулирует определенные химические свойства слизистых носа, не ухудшает здоровье или целостность мембран носовой полости или не влияет отрицательно на полезную микрофлору, а также служит в качестве фильтра для предотвращения проникновения взвешенных в воздухе раздражающих веществ и патогенов через мембраны носовой полости и/или попадания в нижние дыхательные пути. При этом, композиции настоящего документа предотвращают инфекции респираторного тракта, в то время предотвращая также раздражение и/или аллергические реакции.
[0138] В дополнение к этому, композиции настоящего документа могут быть изотоничными относительно назального эпителия и слизистых мембран и содержать соединения с оздоравливающими свойствами. Полезная микрофлора и определенные свойства мембран носовой полости, такие как осмолярность и pH, как показано, влияют на вероятность инфекции. Идентифицированы более медицинских средств и состояний здоровья, которые делают людей более чувствительными к респираторной инфекции. Например, диабетики с большей вероятностью имеют сухие мембраны носовой полости и страдают от грибкового синусита. Пероарльные контрацептивы, устройства, применяемые при синдроме остановок дыхания во сне и аллергии, также, как известно, делают мембраны носовой полости более сухими и более чувствительными к инфекции.
[0139] Композиции по настоящему изобретению могут содержать конкретные активные ингредиенты с доказанными антимикробными свойствами, включая, но, не ограничиваясь этим, ICAM-1, ингибиторы ICAM-1, сиаловую кислоту, ингибиторы нейраминидазы, лизозим, лактоферрин, цитрусовые масла, экстракты или производные, растительный клей, пептиды, гликопептиды, аминокислоты, антимикробные масла, антимикробные растительные экстракты или дефензины. Композиция может содержать нейтрализующие запахи соединения, такие как, но, не ограничиваясь этим, активированный уголь или бикарбонат натрия. Композиция может иметь свойства адгезива и конкретно приготавливаться для удерживания активных ингредиентов и противомикробных/противовирусных агентов на поверхности назального эпителия в течение продолжительного периода времени. Для достижения этого, композиции настоящего документа могут содержать вещества с низкой летучестью, или окклюзивные вещества, такие, например, как полиолы, масло из семян ши или другие растительные масла, кокосовое масло, пчелиный воск, и биоадгезивные вещества, такие как клей, или альгинаты.
[0140] Назальные препараты, описанные в настоящем документе, и их активные ингредиенты, как предполагается, являются хорошо переносимыми, оказывающими полезное воздействие на цилиарную функцию, имеющими хорошие свойства при распределении, высокую степень адгезии, и они сохраняют химические свойства слизистых. В некоторых вариантах осуществления, ингредиенты балансируются для создания синергических воздействий.
[0141] Согласно технологиям настоящего документа, один или более активных ингредиентов могут нацеливаться конкретно на нежелательные микроорганизмы и вирусы. Множество взвешенных в воздухе патогенов, таких как риновирусы и грипп, получают доступ в назальные эпителиальные клетки, назальные слизистые или клетки нижних дыхательных путей через конкретные мишени на поверхности клетки. Десятилетия исследований идентифицировали ICAM-1 (фактор межклеточной адгезии 1) как одну из таких мишеней для большинства риновирусов, а кроме того - для гриппа (Abraham and Colonno 1984). ICAM-1 представляет собой фактор межклеточной адгезии, экспрессируемый на клеточной поверхности назальных эпителиальных клеток, а также клеток нижних дыхательных путей. N-конечный домен ICAM-1 распознается рецепторами на определенных капсидах риновируса. При связывании ICAM-1, вирус разрушает его капсиду и переносится внутрь клетки, где он инициирует инфицирование и воспалительную реакцию хозяина. Вирус гриппа демонстрирует сходный механизм инфицирования: у людей, гемагглютинин (HA) на поверхностях вируса связывает сиаловую кислоту, связанную с галактозой (например, с помощью связи альфа 2,6 (6’-сиалиллактоза) или с помощью связи альфа 2,3 (3’-сиалиллактоза), и тому подобное), на мембранах клеток хозяев, эритроцитов и клеток верхних дыхательных путем.
[0142] Литература, такая, например, как патент США № 8211448, патент США № 8940339, и патент США № 8211448, описывает способы улавливания взвешенных в воздухе частиц с использованием промышленных полимеров или соединений. В противоположность этим способам известным из литературы, настоящее изобретение делает взвешенные в воздухе частицы инертными и усиливает способность мембран носовой полости к устранению заболевания или аллергии, вызываемой микроорганизмами и другими нежелательными частицами. Кроме того, варианты осуществления, использующие более активных ингредиентов, могут защитить от нескольких патогенов или раздражающих веществ одновременно и сильнее, чем прежде. Это отличается от способов, известных из литературы, которые могут нацеливаться только на один тип патогена, только слабо или умеренно (например, патент США № 7132395; патент США № 6514936; патент США № 6051231; патент США № 6649592; Turner et al. JAMA 281 (19). 1797-1804. (1999)). Это является важным, поскольку конкретная идентичность микроорганизма, вызывающего заболевание или аллергию, часто неизвестна во время начального экспонирования для субъекта. В некоторых вариантах осуществления настоящего изобретения, лекарственные средства могут доставляться на поверхность мембран носовой полости без поглощения в мембране и без биоадгезивного прикрепления на ней (например, патент США № 6391452; публикация патента США № 2001/0053359; патент США № 8679484; патент США № 645626; патент США № 7087245). В некоторых вариантах осуществления, фармацевтические композиции могут не придавать защитному слою антимикробные свойства на широкой основе, как описано в публикации патента США № 2007/0135377, патенте США № 7166435, патенте США № 8658775, патенте США № 8658775, патенте США № 7083814, патенте США № 7807656, патенте США № 9045855, патенте США № 6649592 и патенте США № 9029351.
[0143] Как правило, технологии, описанные в настоящем документе, вводят нацеленные противомикробные вещества в фармацевтические композиции, которые также сохраняют конкретные физиологические и химические свойства мембран носовой полости или слизистых, такие, например, как их pH и осмолярность. В некоторых вариантах осуществления, способы лечения респираторной инфекции, описанные в настоящем документе, не включают не нацеленных, неселективных противомикробных веществ для мембран носовой полости, которые могут содержать спирт, пероксид, или другие острые ингредиенты. Как правило при использовании в препаратах (например, патент США № 8999406; патент США № 8778415; патент США № 7638147), эти острые ингредиенты изменяют pH или осмолярность мембраны носовой полости и отрицательно влияют на микрофлору. В некоторых вариантах осуществления, фармацевтическая композиция содержит меньше 10% масс острых ингредиентов (например, спирта, пероксида, и тому подобное) от композиции или меньше 5% масс острых ингредиентов от композиции, или меньше 1% масс острых ингредиентов от композиции, или меньше 0,1% масс острых ингредиентов от композиции, или меньше 0,01% масс острых ингредиентов от композиции. Как правило, нанесение фармацевтической композиции на мембрану носовой полости будет изменять pH мембраны и/или слизистой меньше, чем на 20% или меньше, чем на 10%, или меньше, чем на 5%, или меньше, чем на 1%, или меньше, чем на 0,1% от pH до нанесения. В некоторых вариантах осуществления, нанесение фармацевтической композиции на мембрану носовой полости будет изменять осмолярность мембраны и/или слизистой меньше, чем на 20% или меньше, чем на 10% или меньше, чем на 5%, или меньше, чем на 1%, или меньше, чем на 0,1%.
Антимикробные композиции
[0144] Антимикробные композиции настоящего документа могут содержать один или более антимикробных и противовирусных активных ингредиентов в основной смеси, содержащей одно или более веществ из воды, полиолов, смягчающих веществ, окклюзивных агентов, увлажнителей, эмульгаторов, консервантов, загустителей и суспендирующих агентов, регуляторов pH, изотонических агентов и эфирных масел, что позволяет им удерживаться в месте нанесения или вблизи него в течение, по меньшей мере, 30 минут (например, 30-60 минут, 1-2 часов, 2-4 часов, 4-8 часов, 8-12 часов, 12-24 часов, 1-2 дней, 2-7 дней, недели или более) до поглощения, и они имеют pH и осмолярность сходную со слизистой, и они не забивают поры. Время необходимое для поглощения антимикробной композиции можно определить с помощью сахаринового теста или других сходных тестов. В одном из вариантов осуществления, активный ингредиент может представлять собой растворимый ICAM-1, содержащий только внеклеточный домен или другой домен ICAM-1, рекомбинантно экспрессируемого в бактериях. В других вариантах осуществления, активный ингредиент может представлять собой растворимый ICAM-1, рекомбинантно экспрессируемый в Chlamydomonas reinhardtii. В других вариантах осуществления, активный ингредиент может представлять собой растворимый ICAM-1, рекомбинантно экспрессируемый в других видах водорослей или в другой живой системе.
[0145] В другом варианте осуществления, активный ингредиент представляет собой сиаловую кислоту (например, нейраминовую кислоту, связанную с молекулой сахара в одной из нескольких возможных конформаций, и тому подобное). Сиаловая кислота может очищаться из природного источника или получаться с помощью ферментации и рекомбинантной генной инженерии. В другом варианте осуществления, активный ингредиент может представлять собой ингибитор нейраминидазы, такой как кверцетин, который представляет собой биофлаваноид, выделенный кожуры цитрусовых или из других природных источников. В другом варианте осуществления, активный ингредиент представляет собой лактоферрин, рекомбинантно экспрессируемый в бактериях. В других вариантах осуществления, активный ингредиент представляет собой лактоферрин, рекомбинантно экспрессируемый в Chlamydomonas reinhardtii или в другой соответствующей системе экспрессирования, например, водорослях, дрожжах или бактериях или очищенный из природного источника. В другом варианте осуществления, активный ингредиент может представлять собой лизозим, рекомбинантно экспрессируемый в Chlamydomonas reinhardtii или в другой соответствующей системе экспрессирования, например, в водорослях, или очищенный из природного источника. Как описано в настоящем документе, дополнительные антимикробные активные ингредиенты можно использовать в композициях по настоящему изобретению, либо по отдельности, либо в сочетании.
[0146] В другом варианте осуществления, активный ингредиент представляет собой встречающееся в природе или генно-инженерное антитело, такое как IgA, IgG, или IgM, или любой из их доменов в одной из нескольких возможных конформаций. Антитело может быть очищенным из природного источника или полученным посредством рекомбинантной генной инженерии в любой соответствующей и экономически жизнеспособной системе экспрессирования, такой как Chlamydomonas reinhardtii или другие водоросли, бактерии, дрожжи или клетка млекопитающего, или его можно очистить из природного источника. В другом варианте осуществления, активный ингредиент может представлять собой ингибитор нейраминидазы, такой как кверцетин, который представляет собой биофлаваноид, выделенный из кожуры цитрусовых или из других природных источников.
[0147] Водоросли или другие растения представляют собой предпочтительную систему экспрессирования, поскольку рекомбинантные генно-инженерные водоросли являются гораздо более экономичными для выращивания и сбора, чем клетки млекопитающих или бактерии. Водоросли выращиваются для использования в качестве питательных добавок сами по себе, а также используются для генной биоинженерии определенных питательных соединений для промышленного производства, например, омега-3 жирных кислот и каротеноидов (Gimpel JA, Henriquez V, and Mayfield SP Frontiers in Microbiology 2015). Большинство метаболических стратегий генной инженерии относятся к увеличению промышленного производства этих соединений, а также к использованию водорослей в качестве биотоплива. Преимущественно, водоросли можно оптимизировать для продуцирования набора различных метаболитов, которые имеют определенные характеристики, эффективным образом. Экспрессирование активных ингредиентов можно оптимизировать.
[0148] Трансгенные водоросли, как показано, поддерживают экспрессирование рекомбинантных белков как из хлоропластов, так и из ядерных геномов (Rasal BA et al., Plant Biotechnology J 2010). Исходно, использовались только ядерные геномы, но развитие технологий необходимых для экспрессирования рекомбинантных белков в геноме хлоропласта добавило универсальности платформе и сделала возможным либо экспрессирование белков, которые нельзя экспрессировать в ядерном геноме, либо более эффективное экспрессирование белков. Главная часть рекомбинантных белков, производимых сегодня, производится в основном в бактериях, дрожжах (S. cervisiae), либо в культуре клеток млекопитающих. Другие системы, разрабатываемые для крупномасштабного получения, включают дрожжи P. pastoris, клетки насекомых и другие животные и растения. Можно использовать любую жизнеспособную растительную или животную систему экспрессирования, но сначала будут исследоваться и рассматриваться те, которые, вероятно, являются наиболее экономически эффективными, такие как системы рекомбинантного экспрессирования, которые не потребуют высокой степени очистки. Это сделает возможной продажу варианта осуществления в розницу без рецепта, без необходимости в клинических исследованиях. При необходимости, будут использоваться другие системы рекомбинантного экспрессирования, которые могут потребовать более высокой степени очистки.
[0149] Как приведено в Таблице 1, агенты композиции могут присутствовать согласно следующим далее процентам массовым от композиции:
Таблица 1.
(% масс)
[0150] Как показано в Таблице 1, ингибитор нейраминидазы является необязательным, но может быть желательным в некоторых вариантах осуществления, в частности, когда композиция предназначена для профилактики или лечения вирусной инфекции гриппа у человека. Сиаловая кислота может иметь форму свободной сиаловой кислоты, или она может представлять собой конъюгат или аддукт сиаловой кислоты и сахарида, такого как галактоза, лактоза, и тому подобное. Сиаловая кислота может представлять собой любую сиаловую кислоту, например, кислоты из семейства сиаловых кислот, которое включает, по меньшей мере, 43 производных, конъюгатов или аддуктов нейраминовой кислоты с девятиуглеродным сахаром. Важно, чтобы сиаловая кислота в любой форме могла связывать вирус гриппа. Кроме того, лактоферрин, показанный в Таблице 1, может представлять собой любую форму лактоферрина, включая лактоферрины, не образующие хелатов с железом (аполактоферрин), лактоферрины, обогащенные железом (хололактоферрин), или их сочетания. Как используется в настоящем документе, “ICAM-1” включает любую форму ICAM-1 включая, без ограничения, части внеклеточного домена ICAM-1 и, в частности, растворимый ICAM-1 (“sICAM-1”). Будет понятно, что в любые композиции по настоящему изобретению, которые требуют ICAM-1, растворимый ICAM-1 может включаться соответствующим образом.
[0151] Как показано в Таблице 1, ингредиенты могут присутствовать в некотором диапазоне процентов массовых от композиции. ICAM-1 (включая растворимый ICAM-1) может присутствовать в количестве примерно от 0,00000001% до 10% масс от композиции. Чаще, ICAM-1 (включая растворимый ICAM-1) может присутствовать в количестве от 0,0000001% до 0,1% масс от композиции. Чаще, ICAM-1 (включая растворимый ICAM-1) может присутствовать в количестве от 0,000001% до 0,01% масс композиции. ICAM-1 может присутствовать в количестве примерно 0,00000001%, 0,0000001%, 0,000001%, 0,00001%, 0,0001%, 0,001%, 0,01%, 0,05%, 1%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В некоторых вариантах осуществления, ICAM-1 может составлять от 0,2% до 1,0% масс от композиции. В некоторых вариантах осуществления, ICAM-1 может составлять примерно от 0,000005% до 0,05% масс от композиции. В предпочтительных вариантах осуществления, ICAM-1 может составлять примерно от 0,00005% до 0,005% масс от композиции.
[0152] Ингибитор нейраминидазы (например, кверцетин, изоформы кверцетина, включая изокверцетин, и тому подобное) может присутствовать в количестве примерно от 0,00000001% до 10% масс от композиции. Чаще, ингибитор нейраминидазы может присутствовать в количестве от 0,0000001% до 0,1% масс от композиции. Чаще, ингибитор нейраминидазы может присутствовать в количестве от 0,000001% до 0,01% масс от композиции. Ингибитор нейраминидазы может присутствовать в количестве примерно 0,00000001%, 0,0000001%, 0,000001%, 0,00001%, 0,0001%, 0,001%, 0,01%, 0,05%, 1%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В некоторых вариантах осуществления, ингибитор нейраминидазы может составлять от 0,2% до 1,0% масс от композиции. В некоторых вариантах осуществления, ингибитор нейраминидазы может составлять примерно от 0,000005% до 0,05% масс от композиции. В предпочтительных вариантах осуществления, ингибитор нейраминидазы может составлять примерно от 0,00005% до 0,005% масс от композиции.
[0153] Лактоферрин может составлять 0,0000001% - 10,0% масс от композиции. Лактоферрин может составлять 0,00000025%, 0,0000003%, 0,0000004%, 0,0000005%, 0,0000006%, 0,0000007%, 0,00000075%, 0,0000008%, 0,0000009%, 0,000001%, 0,000002%, 0,000003%, 0,000004%, 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В предпочтительных вариантах осуществления, лактоферрин может составлять 0,0000001-1,0% масс от композиции.
[0154] Лизозим может составлять 0,000001% - 10,0% масс от композиции. Лизозим может составлять 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В предпочтительных вариантах осуществления, лизозим может составлять 0,000001-1,0% масс от композиции.
[0155] Сиаловая кислота может составлять 0,000000001% - 10,0% масс композиции. Сиаловая кислота может составлять 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В предпочтительных вариантах осуществления, сиаловая кислота может составлять 0,000001-1,0% масс от композиции. Сиаловая кислота может иметь форму сиалиллактозы (например, 3’-сиалиллактозы и/или 6’-сиалиллактозы, и тому подобное).
[0156] В другом варианте осуществления, препарат может содержать ингредиенты, как показано в Таблице 2.
Таблица 2.
(% масс от композиции)
[0157] Каррагенан может составлять 0,0000005% - 10,0% масс от композиции. Лизозим может составлять 0,0000005%, 0,0000006%, 0,0000007%, 0,0000008%, 0,0000009%, 0,000001%,0,000002%, 0,000003%, 0,000004%, 0,000005%, 0,000006%, 0,000007%, 0,000008%,0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008%, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%,0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5% и 10,0% масс от композиции. В предпочтительных вариантах осуществления, каррагенан может составлять 0,000001-4,0% масс от композиции.
[0158] Цинк (например, пероксид цинка, и тому подобное) может составлять 0,0000001-5% масс от композиции. Цинк может составлять 0,01%, 0,015%, 0,02%, 0,025%, 0,03%, 0,035%, 0,04%, 0,045%, 0,05%, 0,055%, 0,060%, 0,065%, 0,070%, 0,075%, 0,080%, 0,085%, 0,090%, 0,095%, 0,1%, 0,15%, 0,2%, 0,25%, 0,3%, 0,35%, 0,4%, 0,45%, 0,5%, 0,55%, 0,6%, 0,65%, 0,7%, 0,75%, 0,8%, 0,85%, 0,9%, 0,95%, 1,0%, 1,05%, 1,1%, 1,15%, 1,2%, 1,25%, 1,3%, 1,35%, 1,4%, 1,45%, 1,5%, 1,55%, 1,6%, 1,65%, 1,7%, 1,76%, 1,8%, 1,85%, 1,9%, 1,95%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%, 15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0%, 18,5%, 19,0%, 19,5% и 20,0% масс от композиции. В предпочтительных вариантах осуществления, пероксид цинка (ZnO2) может составлять от 0,000001%% до 5,0% масс от композиции.
[0159] Медь может составлять 0,00000001% - 5% масс от композиции. Медь может составлять 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%,0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%,0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%,0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%,1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%,8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%,15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0% 18,5%, 19,0%, 19,5% и 20,0% масс от композиции. В предпочтительных вариантах осуществления, медь может составлять 0,00001-5,0% масс от композиции.
[0160] Серебро может составлять 0,00000001% - 5% масс от композиции. Серебро может составлять 0,000005%, 0,000006%, 0,000007%, 0,000008%, 0,000009%, 0,00001%, 0,00002%, 0,00003%, 0,00004%, 0,00005%, 0,00006%, 0,00007%, 0,00008%, 0,00009%, 0,0001%, 0,0002%, 0,0003%, 0,0004%, 0,0005%, 0,0006%, 0,0007%, 0,0008, 0,0009%, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1,0%, 1,5%, 2,0%, 2,5%, 3,0%, 3,5%, 4,0%, 4,5%, 5,0%, 5,5%, 6,0%, 6,5%, 7,0%, 7,5%, 8,0%, 8,5%, 9,0%, 9,5%, 10,0%, 10,5%, 11,0%, 11,5%, 12,0%, 12,5%, 13,0%, 13,5%, 14,0%, 14,5%, 15,0%, 15,5%, 16,0%, 16,5%, 17,0%, 17,5%, 18,0% 18,5%, 19,0%, 19,5% и 20,0% масс от композиции. В предпочтительных вариантах осуществления, серебро может составлять 0,00001-5,0% масс от композиции.
[0161] Композиция может также содержать нейтрализующие запахи соединения, такие как активированный древесный уголь или бикарбонат натрия, сами по себе или в сочетании. Другие нейтрализующие запахи соединения также рассматриваются для включения в композицию.
[0162] Как показано в Таблице 3, иллюстративная антимикробная композиция может дополнительно содержать следующие дополнительные ингредиенты, либо по отдельности, либо в сочетании: экстракт алтея, экстракт календулы, экстракт кожуры цитрусовых, мед, экстракты розмарина, экстракт мирры, экстракт Helichrysum, экстракт арроурута, масло семян маргозы, витамин C, витамин E и экстракт грейпфрутовых косточек. Эти дополнительные ингредиенты могут присутствовать согласно следующих далее % масс от композиции. Экстракционные растворители и процессы экстракции для антимикробной композиции будут оптимизироваться, чтобы она была наиболее эффективной и переносимой.
Таблица 3: Дополнительные ингредиенты.
(% масс от композиции)
[0163] Как показано в Таблице 4, иллюстративная антимикробная композиция может дополнительно содержать следующие дополнительные ингредиенты основы, либо по отдельности либо в сочетании: полиол, увлажнитель (такой как, но, не ограничиваясь этим, глицерин, алоэ вера или бутиленгликоль), смягчающее вещество (такое как, но, не ограничиваясь этим, масло из семян ши, касторовое масло, кокосовое масло, каприловую кислоту, бутилстеарат или триглицерид), окклюзивный агент (такой как, но, не ограничиваясь этим, вазелиновое масло, диметикон, ланолин, масло какао, масло из семян ши, пчелиный воск, растительное масло или карнаубский воск). Добавление и конкретные концентрации этих ингредиентов можно оптимизировать для достижения барьерной функции, при которой композиция не забивает поры, сохраняет активные ингредиенты в их биоактивных конформациях и удерживается на месте в течение, по меньшей мере, 30 минут, поддерживает осмолярность и pH сходные с физиологическими слизистыми, является переносимой и эффективной при нанесении.
Таблица 4: Дополнительные ингредиенты основы.
(% масс от композиции)
[0164] Если не указано иного, любой наполнитель или добавка может вводиться в количестве достаточном, чтобы служить своей предполагаемой функциональной цели без повреждения или раздражения респираторных тканей. Если не указано иного, все наполнители могут присутствовать в количестве примерно от 0,000001% или 0,01% примерно до 1, 5, 10, или 25% масс от композиции. Носитель может представлять собой любой фармацевтически приемлемый разбавитель и может быть твердым при комнатной температуре или жидким при комнатной температуре. Пригодные для использования носители включают воду, спирт (этанол), пропиленгликоль, изопропанол, пропандиол, глицерин, бензиловый спирт, изостеарилизостеарат, каприловый/каприновый триглицерид, олеилолеат, токоферолацетат, децилкокоат, сквален, span 40, кококаприлат/капрат, span 80, токоферол, стеариновую кислоту, олеилэрукат, span 20, глицерилизостеарат и каприловый/каприновый триглицерид. Носитель может, например, иметь форму водного раствора, эмульсии типа вода в масле или эмульсии типа масло в воде. Носитель эмульсии будет, как правило, содержать от 0,0001% примерно до 10% масс эмульгатора пригодного для стабилизации эмульсии. В одном из вариантов осуществления, композиция предназначена для перорального использования и может содержать один или более из следующих ингредиентов: крахмальную патоку, лецитин сои, альгинаты, сукралозу, кукурузный сироп, желатин, эритритол, лецитин, растительные муцины, каррагенан, экстракт корней цикория, мальтитол и стевию. Как в пероральных, так и в назальных препаратах, как необходимо отметить, наполнители не должны отрицательно влиять на биологическую активность активных веществ и должны быть совместимыми в растворе с активными веществами. Наполнители не должны также проникать в эпителий (респираторные мембраны). Соответственно, желательно иметь более высокую растворимость активных веществ в композиции основы для сохранения их в растворе и предотвращения проникновения активных веществ в эпителий. В назальных препаратах, наполнители должны служить для поддержания влажности в слизистой и в пленке композиции на ней, чтобы активные ингредиенты не преципитировали из раствора. В некоторых вариантах осуществления, носитель будет содержать воду и вторичный растворитель с более низкой летучестью, чем у воды, в котором активные вещества также растворяются. В идеале, носитель и наполнители выбираются таким образом, что они имеют полярность, которая ближе к полярности активных ингредиентов, чем к полярности эпителия. Вторичный растворитель может служить для поддержания растворимости активных веществ после того, как вода испаряется. В пероральных препаратах потеря влажности менее важна, и может быть желательным выбирать наполнители таким образом, чтобы замедлить растворение композиции в слюне.
[0165] Полученные соединения очищают с использованием обычных способов для получения соединений, не содержащих примесей. Полученные соединения имеют чистоту >75%, >80%, >85%, >90%, >95%, >96%, >97%, >98%, >99%, >99,5%. Необязательно, предпочтительные соединения имеют чистоту >99%.
Фактор межклеточной адгезии (ICAM-1)
[0166] ICAM-1 представляет собой член суперсемейства молекул адгезии иммуноглобулинов. Он представляет собой встроенный мембранный белок длиной 505 аминокислот и имеет: i) пять иммуноглобулиноподобных внеклеточных доменов на амино-конечном (внеклеточном) краю, ii) гидрофобный трансмембранный домен (454-477) и iii) короткий цитоплазматический домен на карбокси-конечном краю (478-505). Большинство риновирусов используют ICAM-1, экспрессируемый на назальных эпителиальных мембранах, для получения доступа в клетки. Имеется три главных типа риновирусов (HRV A, B и C). HRV A и B могут дополнительно подразделяться примерно на 100 подтипов. 85% HRVA и 100% HRVB используют ICAM-1 для поступления в клетки. HRV C редко вызывает заметное заболевание. Согласно технологиям настоящего документа, добавление частично или полностью очищенных растворимых форм ICAM-1, или любых из его рекомбинантных генно-инженерных доменов, в композиции по настоящему изобретению может поддерживать молекулу в стабильной форме, при этом она может конкурентно ингибировать взаимодействие частиц риновируса с эндогенным ICAM-1 на клеточных мембранах, предотвращая таким образом первую стадию инфицирования.
[0167] В некоторых вариантах осуществления, антимикробные/противовирусные композиции могут состоять из ингибиторов ICAM-1. Ингибиторы ICAM-1, используемые в антимикробных композициях, включают, но, не ограничиваясь этим, антитело анти-ICAM-1, цитокин, CD11a, езрин (EZR), CD18, глицирретиновую кислоту, пирролидиндитиокарбамат, ингибитор активирования NFkB, гетероциклический тиазол, липоевую кислоту, эфализумаб, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамид, силибинин, стильбены, галлат (+)-эпигаллоилкатехина [(+)-EGCG], экстракты Piper sarmentosum и их сочетания. В некоторых вариантах осуществления, антитело анти-ICAM-1 представляет собой эфализумаб (RAPTIVA).
Сиаловая кислота и ингибиторы нейраминидазы
[0168] Олигосахариды, обогащенные сиаловой кислотой, на клетках верхних дыхательных путей обычно помогают сохранять воду на поверхности и создавать отрицательный заряд. Сиаловая кислота представляет собой общий термин для N- или O-замещенных производных нейраминовой кислоты и моносахарида с девятиуглеродной основной цепью. Это также представляет собой наименование самого распространенного элемента этой группы N-ацетилнейраминовой кислоты (Neu5Ac или NANA). грипп или другие вирусы, как известно, связывают остатки сиаловой кислоты с помощью рецептора гемагглютинина (HA) на их поверхности, после этого они начинают реплицироваться. Когда репликация завершается, вирусный фермент, нейраминидаза, расщепляет вирусные частицы так, что они могут свободно связываться и инфицировать другие клетки. Согласно технологиям настоящего документа, частично или полностью очищенную сиаловую кислоту, такую, например, как N-ацетилнейраминовая кислота (Neu5Ac), или любое другое производное нейраминовой кислоты, или любые из их рекомбинантных генно-инженерных доменов можно добавлять для поддержания молекулы в стабильной форме, в которой она может конкурентно ингибировать взаимодействие частиц вируса гриппа с сиаловой кислотой на респираторных клетках или эритроцитах. Семейство сиаловых кислот включает 43 производных нейраминовой кислоты и девятиуглеродного сахара. В природе, они обычно встречаются как компоненты олигосахаридных цепей муцинов, гликопротеинов и гликолипидов. Различные виды чувствительные к гриппу, как считается, имеют небольшие вариации в их связях сиаловая кислота-галактоза. Вирусы гриппа, которые инфицируют конкретные виды, как считается, имеют специфичную аффинность к сиаловой кислоте, связанной с галактозой, в этой специфичной для вида конформации. Например, на респираторных эпителиальных клетках человека сиаловая кислота в основном соединяется с галактозой посредством связи альфа 2,6, так что вирусы гриппа, которые инфицируют людей, обычно специфично нацелены на эту конформацию сиаловой кислоты. Эпителиальные клетки человека также имеют другие, менее преобладающие типы связей сиаловая кислота-галактоза, такие как связь альфа 2,3, которая может представлять собой преобладающую конформацию для других видов, таких как свиньи. Одна из теорий того, как грипп может передаваться от одного вида другому, заключается в том, что он имеет специфичность к конформации, которая обнаруживается в нескольких видах или мутирует, становясь специфичным для другого вида.
[0169] Выделения назальных слизистых и другие экзокринные выделения содержат сиаловую кислоту в растворимой форме, которая может служить для защитной функции, связывая вирусы гриппа и другие микроорганизмы и иммобилизуя их. Вирусы гриппа выделяют способ отщепления их от растворимой сиаловой кислоты с использованием фермента, называемого нейраминидазой. Более противовирусных лекарственных средств, таких как Tamiflu служат в качестве ингибиторов нейраминидазы. В этой связи, они поддерживают вирус иммобилизованным и неспособным инфицировать эпителиальные клетки. В литературе нет попыток использования ингибиторов нейраминидазы в растворе для местного применения, наносимом на ноздри, для предотвращения инфекции. Он в основном вводится системно для излечения инфекции. Кверцетин, биофлаваноид, находящийся в кожуре цитрусовых и во многих других фруктах и растениях, представляет собой пример встречающегося в природе ингибитора нейраминидазы.
[0170] В некоторых вариантах осуществления, антимикробные композиции содержат ингибиторы нейраминидазы. Ингибиторы нейраминидазы включают, но, не ограничиваясь этим, кверцетин, озельтамивир, занамивир, ланинамивир, амантадин, перамивир, и любые из их аналогов.
Противовирусные агенты
[0171] Противовирусные агенты по настоящему изобретению можно получить с помощью естественных процессов (например, индуцируя животное, растение, грибок, бактерии, и тому подобное, для продуцирования аналога ICAM-1, или индуцируя животное для продуцирования поликлонального или моноклонального антиидиотипического антитела анти-ICAM-1, и тому подобное); синтетических способов (например, с использованием способа Merrifield синтеза полипептидов функциональных производных ICAM-1, и тому подобное); рекомбинантной технологии (например, продуцирования противовирусных функциональных производных ICAM-1 в различных хозяевах (например, дрожжах, бактериях, грибках, культивируемых клетках млекопитающих, и тому подобное), рекомбинантных плазмид или вирусных векторов или протеолиза. Выбор способа для использования зависит от таких факторов, как удобство, желаемый выход, и тому подобное. Нет необходимости использовать только один из описанных выше способов, процессов или технологий для продуцирования конкретного противовирусного агента; описанные выше процессы, способы и технологии можно объединять для получения конкретного противовирусного агента. Ингредиенты балансируются для получения синергических воздействий.
Лактоферрин
[0172] Лактоферрин присутствует в природе в экзокринных выделениях, включая назальные слизистые, и осуществляет защитную функцию против микроорганизмов. Он является сильно катионным, антибактериальным, противовирусным и противогрибковым. В слезах, концентрации находятся в пределах 1-3 мг/мл, при содержании белка в целом 15-30%. Грудное молоко содержит 1 мг/мл, и бронхиальные выделения могут содержать до 11,5% белка в целом. Концентрации в слизистых находятся в пределах от 1 мкг/мл до 8 мкг/мл при провоцировании и примерно от 1-3% белка в целом (Raphael et al 1989). Уровни лактоферрина в слизистых выделениях, как считается, уменьшаются с возрастом, это могло бы сделать пожилых людей более чувствительными к респираторной инфекции.
[0173] Лактоферрин существует в мономерной и тетрамерной формах и имеет тенденцию к полимеризации при высоких концентрациях. Он представляет собой гликопротеин приблизительно из 703 аминокислот и с массой приблизительно 80 кД. Несмотря на 69% гомологию между лактоферрином человека и бычьим лактоферрином, в некоторых исследованиях, бычий лактоферрин требуется при 1/10 от концентрации лактоферрина человека для антимикробного воздействия. Различные типы лактоферрина могут быть выгоднее при определенных мутациях или типах инфицирующих организмов, чем другие, и их можно исследовать для оптимизации в случае ожидаемой эпидемии. В исследованиях вируса простого герпеса (местное нанесение) и инфекции гепатита C, лактоферрин защищает до контакта с вирусом, но не после его, делая нанесение на место инфицирования (такое как мембраны носовой полости) более релевантным, чем системное введение.
Лизозим
[0174] Лизозим, подобно лактоферрину, обычно присутствует в экзокринных выделениях. Он также является сильно катионным, антибактериальным, противовирусным и противогрибковым. Согласно одному из исследований (Atsushi et al 1998), средняя концентрация в слизистых составляет 20-30 мкг/мл. В слезах, концентрация лизозима равно примерно 103 мг/мл согласно Raphael et al 1989. Уровни лизозима в слизистых также, как считается, понижаются с возрастом.
Антитела слизистых
[0175] Назальные выделения содержат иммуноглобулины, предлагающие защиту медиируемую антителом, и исследование показывает, что большинство из них представляет собой секреторную форму IgA (sIgA) (Kirkeby et al., 2000). Антитела S-IgA предотвращают присоединение микробов и поглощение молекулярных антигенов, включая потенциальные аллергены. Определенные бактерии продуцируют протеазы IgA, расщепляя IgA, эти ферменты могут отрицательно влиять на барьерную функцию этих антител. Исследование показывает, что расщепление IgA может давать в результате атопическое заболевание. Другие антитела, которые обычно находятся в назальных выделениях и которые могут выполнять защитные функции, представляют собой IgG и IgM (Kirkeby et al 2000). Увеличивая количества этих антител, настоящее изобретение может защитить против нежелательных раздражающих веществ или патогенов.
Рекомбинантная генная инженерия
[0176] Существует более возможных источников рассмотренных выше биологических соединений, таких как человеческие или бычьи экзокринные выделения. Однако они могут иметь ограниченную доступность и создают риски относительно безопасности. Рекомбинантное биополучение представляет собой другой возможный источник соединений. Биополучение может использовать генно-инженерные микроорганизмы подобные бактериям, грибкам, клеткам животных, дрожжам или растениям (включая водоросли). Экспрессирование в линиях клеток млекопитающих, бактериях и дрожжах часто является дорогостоящим. Одна из причин этого - необходимость в очистке. Водоросли дают более преимуществ перед другими способами, поскольку часто не требуется очень высоких уровней очистки. Согласно оценкам, получение белка в растениях может быть на четыре порядка величины дешевле чем получение в культуре клеток млекопитающих на один грамм неочищенного белка. В дополнение к этому, растительный материал, такой как водоросли, является по большей части “в целом считающимися безопасным”, как и его генетически модифицированные аналоги. Производство в промышленном масштабе выглядит возможным, поскольку рекомбинантные водорослевые биореакторы для нескольких классических дорогостоящих биологических молекул, как показано, являются перспективными (смотри, Rasala et al Plant Biotech. 2010).
Способы лечения
[0177] В настоящем документе описываются новые способы и композиции для улучшения способности фильтрования у респираторных мембран и защиты от взвешенных в воздухе патогенов. Способы доставки по настоящему изобретению доводят до максимума экспонирование дыхательных путей для антимикробных/противовирусных композиций, для защиты от взвешенных в воздухе патогенов. Новые терапевтические способы могут также включать введение антимикробной композиции в качестве терапевтического агента.
[0178] В любом из рассмотренных выше аспектов или вариантов осуществления, способ может уменьшать рост респираторной инфекции, уменьшать инфекцию или устранять инфекцию. В родственных вариантах осуществления, инфекция уменьшается на 5%, 10%, 25%, 50%, 75%, 85%, 90%, 95%, или 99% или более по сравнению с ее исходным размером.
[0179] В любом из рассмотренных выше аспектов или вариантов осуществления, способы могут включать введение терапевтического агента множество раз в день. В других родственных вариантах осуществления, способы могут включать введение терапевтического агента в первый день и повторение введения в один или более последующих дней. В других родственных вариантах осуществления, первый день и один или более последующих дней разделены временем в пределах между 1 днем и примерно 3 неделями. В родственных вариантах осуществления, терапевтический агент и другой агент вводятся совместно. В родственных вариантах осуществления, терапевтический агент и другие агенты вводятся при отношении примерно 1:2, 1:4, 1:10, 1:20, 1:25, 1:50, 1:100, 1:200 или при любом отношении в этих пределах (массово отношение терапевтический агент : агент). Кроме того, в рамках настоящего изобретения предполагается, что терапевтический агент может вводиться в течение курса из одного или нескольких циклов. В любом из рассмотренных выше аспектов или вариантов осуществления, терапевтический агент и другой агент могут доставляться одновременно.
[0180] В любом из рассмотренных выше аспектов или вариантов осуществления, терапевтический агент может представлять собой любую антимикробную композицию, как описано в настоящем документе, которая используется для предотвращения или лечения респираторного заболевания или расстройства. В родственных вариантах осуществления, респираторное заболевание или расстройство вызывается взвешенными в воздухе патогенами. В определенных вариантах осуществления, терапевтический агент представляет собой антимикробный/противовирусный агент.
[0181] Антимикробный агент может представлять собой любой агент хорошо известный в данной области, включая, но, не ограничиваясь этим, агенты, описанные в настоящем документе.
[0182] В других вариантах осуществления, терапевтический агент может представлять собой терапевтическое антитело. Терапевтическое антитело может представлять собой любое терапевтическое антитело хорошо известное в данной области, включая, но, не ограничиваясь этим, антитела, описанные в настоящем документе.
[0183] В вариантах осуществления, терапевтический агент может представлять собой терапевтическую молекулу нуклеиновой кислоты. Терапевтическая молекула нуклеиновой кислоты может представлять собой любую терапевтическую молекулу нуклеиновой кислоты хорошо известную в данной области.
[0184] В вариантах осуществления, терапевтический агент может представлять собой радиоизотоп. Радиоизотоп может представлять собой любой радиоизотоп хорошо известный в данной области.
[0185] В других вариантах осуществления, терапевтический агент может представлять собой сочетание двух или более лекарственных соединений.
[0186] В любом из рассмотренных выше аспектов или вариантов осуществления, способы включают введение терапевтически эффективного количества иммунотерапевтического агента. Иммунотерапевтический агент может представляет собой любые соответствующие средства, с помощью которых включается дополнительная иммунная реакция, которая нацелена на разрушение клеток инфекции.
[0187] В вариантах осуществления, иммунотерапевтический агент усиливает иммунномодуляторные воздействия терапевтического агента. В родственных вариантах осуществления, иммунотерапевтический агент дополнительно уменьшает рост инфекции или дополнительно уменьшает инфекцию.
[0188] Иммунотерапевтический агент может вводиться до, в ходе или после введения терапевтического агента. В вариантах осуществления, иммунотерапевтический агент вводится до первого введения терапевтического агента. В вариантах осуществления, иммунотерапевтический агент вводится одновременно с первым введением терапевтического агента.
[0189] В любом из рассмотренных выше аспектов или вариантов осуществления, терапевтический агент и иммунотерапевтический агент могут вводиться при отношении примерно 1:2, 1:4, 1:10, 1:25, 1:50, 1:100, 1:200 или при любом отношении в этих пределах (массовое отношение терапевтический агент: иммунотерапевтический агент).
[0190] В любом из рассмотренных выше аспектов или вариантов осуществления, иммунотерапевтический агент может вводиться интраназально, местным образом, регионарно или системно (например, внутривенно, и тому подобное).
[0191] В любом из рассмотренных выше аспектов или вариантов осуществления, терапевтический агент и иммунотерапевтический агент могут объединяться.
Терапевтические агенты
[0192] Настоящее изобретение предполагает любой терапевтический агент пригодный для использования в способах, описанных в настоящем документе (например, любой тип антимикробного/противовирусного агента для лечения респираторного заболевания, и тому подобное). Пригодные для использования терапевтические агенты включают, но, не ограничиваясь этим, фармацевтические лекарственные средства или соединения (то есть, низкомолекулярные лекарственные средства), терапевтические антитела, терапевтические белки или биологические вещества (например, гормональную терапию, и тому подобное), и молекулы нуклеиновых кислот (например, siRNA, и тому подобное).
[0193] В некоторых вариантах осуществления, терапевтический агент представляет собой агент, который как показано, имеет антимикробные свойства против инфекционных организмов. В родственных вариантах осуществления, терапевтический агент представляет собой существующее одобренное для продажи фармацевтическое лекарственное средство или другую одобренную для продажи композицию для лечения инфекции с использованием обычного подхода.
[0194] В некоторых вариантах осуществления, терапевтический агент представляет собой антимикробную композицию, как описано в настоящем документе. В некоторых вариантах осуществления, антимикробные композиции включают композиции с антибактериальными, противовирусными и/или противогрибковыми свойствами. Антимикробные композиции содержат, но, не ограничиваясь этим: антитело, такое как IgA, IgG или IgM, растворимый ICAM-1, ингибитор ICAM-1, сиаловую кислоту, ингибитор нейраминидазы, лактоферрин, лизозим, соединения цинка, серебро, соединения серебра, медь, соединения меди и их сочетания. Ингибиторы нейраминидазы включают, но, не ограничиваясь этим: кверцетин, озельтамивир, занамивир, ланинамивир и перамивир. Ингибиторы ICAM-1 включают, но, не ограничиваясь этим: растворимый ICAM-1, антитело анти-ICAM-1, цитокин, CD11a, езрин (EZR), CD18, глицирретиновую кислоту, пирролидиндитиокарбамат, ингибитор активирования NFkB, гетероциклический тиазол, липоевую кислоту, эфализумаб, 4-[(4-метилфенил)тио]тиено[2,3-c]пиридин-2-карбоксамид, силибинин, стильбены, галлат (+)-эпигаллоилкатехина [(+)-EGCG], и их сочетания. В некоторых вариантах осуществления, антитело анти-ICAM- 1 представляет собой эфализумаб (RAPTIVA).
[0195] Настоящее изобретение также предполагает любую производную форму рассмотренных выше фармацевтических агентов и терапевтических агентов. Обычные способы дериватизации могут включать, например, добавление химического остатка для улучшения растворимости и/или стабильности или нацеливающего остатка, который делает возможным более специфичное нацеливание молекулы на конкретную клетку или область организма. Фармацевтические агенты могут также приготавливаться в любых пригодных для использования сочетаниях, где лекарственные средства могут либо смешиваться в индивидуальной форме, либо связываться вместе таким способом, который сохраняет функциональность каждого лекарственного средства. Лекарственные средства могут также дериватизироваться для введения радиоизотопа или другого уничтожающего клетки остатка, чтобы сделать молекулу еще более эффективной при уничтожении клетки. В дополнение к этому, лекарственные средства или их части могут модифицироваться с помощью флуоресцентного соединения или других детектируемых меток, которые могут сделать возможным отслеживание положения лекарственного средства или агента в организме или в опухоли. Фармацевтическое лекарственное средство или любой другой из рассмотренных выше терапевтических агентов может быть получен в форме пролекарства, так что лекарственное средство приобретает свою активность или функцию после некоторой обработки, например, метаболизируясь в клетке.
[0196] Терапевтические антитела, предлагаемые в настоящем изобретении, могут включать любой изотип (IgA, IgG, IgE, IgM, или IgD) антимикробного или противовирусного антитела или их иммунноактивный фрагмент или производное. Такие фрагменты могут включать, например, одноцепочечные вариабельные фрагменты (scFv), антиген-связывающий фрагмент (Fab), кристаллизуемый фрагмент (Fc), модифицируемый для содержания антиген- или эпитоп-связывающей области, и доменные антитела. Дериватизированные версии терапевтических антител могут включать, например, диатела, нанотела, биспецифичные антитела и, по существу, любую полученную из антитела структуру, которая содержит или получается с помощью генной инженерии, содержащую соответствующий и эффективный сайт связывания антигена.
[0197] Примеры антимикробной терапии на основе антитела, которые можно использовать по настоящему изобретению, могут включать, например, антитело специфичное к ICAM-1. В некоторых вариантах осуществления, антитело анти-ICAM-1 представляет собой эфализумаб (RAPTIVA).
[0198] Настоящее изобретение также предполагает, что предотвращение или лечение респираторного заболевания может осуществляться с использованием молекулы нуклеиновой кислоты, которая нацелена на указанный “целевой ген”, который играет некоторую роль при инфекции. Воздействие молекулы нуклеиновой кислоты на целевой ген может включать сайленсинг гена, разрушение mRNA или ингибирование транскрипции, или что-либо подобное, так что уровень экспрессирования и/или преобразования целевого гена в рабочий колируемый полипептид подвергается достаточному воздействию (ап- или даун-), так что раковое заболевание замедляется и/или разрушается под действием агента. Термин “целевой ген” относится к последовательностям нуклеиновых кислот (например, геномным ДНК или mRNA, и тому подобное), кодирующим целевой белок, пептид или полипептид, или таким, которые кодируют или представляют собой регуляторные нуклеиновые кислоты (например, “целевой ген” для целей настоящего изобретения может также представлять собой miRNA или последовательность гена, кодирующего miRNA, и тому подобное), которые играют роль при инфекции. В определенных вариантах осуществления, термин “целевой ген” также, как подразумевается, включает изоформы, мутанты, полиморфизмы и сплайсированные варианты целевых генов.
[0199] Любой агент на основе нуклеиновой кислоты хорошо известный в данной области может быть пригодным для использования по настоящему изобретению. Иллюстративные типы агентов на основе нуклеиновых кислот включают, но, не ограничиваясь этим, агенты на основе одноцепочечных рибонуклеиновых кислот (например, microRNA, и тому подобное), олигонуклеотидные агенты антисмыслового типа, агенты на основе двухцепочечных рибонуклеиновых кислот, и тому подобное.
[0200] Способы конструирования терапевтических нуклеиновых кислот хорошо известны в данной области. Например, интерферирующая РНК может собираться из двух отдельных олигонуклеотидов, где одна цепочка представляет собой смысловую цепочку, а другая представляет собой антисмысловую цепочку, где антисмысловая и смысловая цепочки являются взаимно комплементарными (то есть, каждая цепочка содержит последовательность нуклеотидов, которая является комплементарной последовательности нуклеотидов в другой цепочке; например, когда антисмысловая цепочка и смысловая цепочка образуют дуплексную или двухцепочечную структуру); антисмысловая цепочка содержит последовательность нуклеотидов, которая является комплементарной последовательности нуклеотидов целевой молекулы нуклеиновой кислоты или ее части, и смысловая цепочка содержит последовательность нуклеотидов, соответствующую целевой последовательности нуклеиновых кислот или ее части.
[0201] Альтернативно, интерферирующая РНК может собираться из единственного олигонуклеотида, где взаимно комплементарные смысловая и антисмысловая области соединены посредством линкера (линкеров) на основе нуклеиновой кислоты или не на основе нуклеиновой кислоты. Интерферирующая РНК может представлять собой полинуклеотид с дуплексной, асимметричной дуплексной, шпилечной или асимметричной шпилечной вторичной структурой, содержащей взаимно комплементарные смысловые и антисмысловые области, где антисмысловая область содержит последовательность нуклеотидов, которая является комплементарной последовательности нуклеотидов в отдельной целевой молекуле нуклеиновой кислоты или ее части, и смысловая область, имеет последовательность нуклеотидов соответствующую целевой последовательности нуклеиновой кислоты или ее части. Интерферирующая РНК может представлять собой круговой одноцепочечный полинуклеотид, имеющий две или более петлевых структуры и ствол, содержащий взаимно комплементарные смысловые и антисмысловые области, где антисмысловая область содержит последовательность нуклеотидов, которая является комплементарной последовательности нуклеотидов в целевой молекуле нуклеиновой кислоты или ее части, а смысловая область имеет последовательность нуклеотидов, соответствующую последовательности целевой нуклеиновой кислоты или ее части, и где круговой полинуклеотид может процессироваться либо in vivo, либо in vitro с генерированием активной молекулы siRNA способной медиировать РНК-интерференцию.
[0202] Способы введения/доставки терапевтических нуклеиновых кислот хорошо известны в данной области. Например, терапевтические молекулы нуклеиновых кислот могут доставляться в носителе доставки, таком как липидная везикула или другой полимерный материал носителя, известный в данной области. Неограничивающие примеры дополнительных систем носителей на основе липидов (которые можно приготовить с помощью, по меньшей мере, одного модифицированного катионного липида по настоящему изобретению) пригодного для использования по настоящему изобретению включают липоплексы (смотри, например, публикацию патента США № 20030203865; и Zhang et al., J. Control Release, 100:165-180 (2004)), pH-чувствительные липоплексы (смотри, например, публикацию патента США № 2002/0192275), обратимо замаскированные липоплексы (смотри, например, публикацию патента США №№ 2003/0180950), композиции на основе катионных липидов (смотри, например, патент США № 6756054; и публикацию патента США № 2005/0234232), катионные липосомы (смотри, например, публикации патентов США №№ 2003/0229040, 2002/0160038 и 2002/0012998; патент США № 5908635 и публикацию PCT № WO 01/72283), анионные липосомы (смотри, например, публикацию патента США № 2003/0026831), pH-чувствительные липосомы (смотри, например, публикацию патента США № 2002/0192274; и AU 2003/210303), липосомы покрытые антителом (смотри, например, публикацию патента США № 2003/0108597 и публикацию PCT № WO 00/50008), тип клеток специфичный к липосомам (смотри, например, публикацию патента США № 2003/0198664), липосомы, содержащие нуклеиновую кислоту и пептиды (смотри, например, патент США № 6207456), липосомы, содержащие липиды, дериватизированные с помощью высвобождаемых гидрофильных полимеров (смотри, например, публикацию патента США № 2003/0031704), нуклеиновую кислоту, захваченную липидами (смотри, например, публикации PCT №№ WO 03/057190 и WO 03/059322), инкапсулированную в липидах нуклеиновую кислоту (смотри, например, публикацию патента США № 2003/0129221; и патент США № 5756122), другие липосомальные композиции (смотри, например, публикации патентов США №№ 2003/0035829 и 2003/0072794; и патент США № 6200599), стабилизированные смеси липосом и эмульсий (смотри, например, EP1304160), композиции эмульсий (смотри, например, патент США № 6747014) и микроэмульсии нуклеиновых кислот (смотри, например, публикацию патента США № 2005/0037086).
[0203] Если это удобно, любой из агентов по настоящему изобретению, включая фармацевтические лекарственные средства, биологические вещества и терапевтические антитела, могут также доставляться с помощью описанных выше систем носителей. Все системы носителей могут дополнительно модифицироваться с помощью нацеливающего остатка или чего-либо подобного для облегчения доставки композиции в место инфекции в дыхательных путях.
[0204] Будет очевидно, что обычные средства доставки активных агентов часто жестко ограничены биологическими, химическими и физическими барьерами. Как правило, эти барьеры накладываются окружающей средой, через которую осуществляется доставка, окружающей средой мишени для доставки или самой мишенью. Биологически или химически активные агенты являются особенно чувствительными к таким барьерам. При доставке животным биологически активных или химически активных фармакологических и терапевтических агентов, физические и химические барьеры накладываются организмом. Примеры физических барьеров представляют собой кожу и мембраны различных органов, которые проходятся до достижения мишени, и примеры химических барьеров, включая, но, не ограничиваясь этим, изменения pH, липидные бислои и деградирующие ферменты. Клеточная мембрана также представляет собой важный барьер, оказывающий значительное воздействие на эффективность доставки лекарственного средства.
Иммунотерапевтические агенты
[0205] В другом аспекте, настоящее изобретение использует один или более иммунотерапевтических агентов, которые могут дополнительно усилить воздействия устранения респираторной инфекции, оказываемые при использовании антимикробного/противовирусного терапевтического агента. Например, иммунотерапевтический агент может доставляться после осуществления воздействий антимикробного агента, но изобретение не ограничивается этой концепцией. Настоящее изобретение предполагает любой режим введения, включающий множество агентов, постольку поскольку могут осуществляться терапевтические преимущества, приписываемые любому из агентов. В рамках настоящего изобретения также предполагается, что введение одного или нескольких иммунотерапевтических агентов может вызывать иммуностимуляторную активность, которая обеспечивает профилактику дальнейшего возобновления инфекции. Это иммуностимуляторное воздействие может достигаться, когда агент вводится интраназально или системно.
[0206] Специалисты в данной области заметят, что иммунотерапевтический агент представляет собой лечение, которое имеет целью использование собственной иммунной системы индивидуума для борьбы с инфекцией или заболеванием. Это может достигаться посредством активирования собственной иммунной системы индивидуума или создания дополнительных частей дефектной или дефицитной в ином случае иммунной системы.
[0207] Иммунотерапия представляет собой форму биологической терапии, которую можно использовать по настоящему изобретению для дополнения и/или усиления воздействий лечения с помощью терапевтического агента. В целом, имеется две признанных формы иммунотерапии, которые упоминаются как активная иммунотерапия и пассивная иммунотерапия. Активная иммунотерапия стимулирует собственную иммунную систему организма для борьбы с заболеванием. Пассивная иммунотерапия использует компоненты иммунной системы, такие как антитела, приготовленные вне организма, для повышения уровня иммунной реакции организма. Иммунотерапия может также работать посредством нацеливания определенных типов клеток или антигенов (специфичная иммунотерапия), или они может работать посредством более общего стимулирования иммунной системы (неспецифичная иммунотерапия, иногда упоминаемая как адъюванты). Некоторые примеры иммунотерапии, рассматриваемые в настоящем изобретении, включают терапию моноклональными антителами, неспецифичную иммунотерапию и адъюванты (вещества, которые активируют иммунную реакцию, такие как интерлейкин-2 и интерферон-альфа), иммуномодулирующие лекарственные средства (такие как талидомид и леналидомид) и вакцины.
[0208] Соответственно, иммунотерапевтические агенты, которые могут также упоминаться как “иммуномодуляторы”, могут включать, например, интерлейкины (например, IL-2, IL-7, или IL-12, и тому подобное), определенные другие цитокины (например, интерфероны, колониестимулирующий фактор (G-CSF), имиквимод, и тому подобное), хемокины, и другие типы агентов, которые могут включать антигены, эпитопы, антитела, моноклональные антитела или даже носитель доставки для доставки одного или нескольких этих соединений, и могут даже также включать рекомбинантные клетки иммунной системы. Такие иммунотерапевтические агенты могут включать рекомбинантные формы, синтетические формы и природные препараты (смотри D'Alessandro, N. et al., Cancer Therapy: Differentiation, Immunomodulation and Angiogenesis, Нов York: Springer-Verlag, 1993).
[0209] В другом варианте осуществления, иммунотерапевтический агент получает преимущество врожденной иммунной системы организма, и когда вводится, оказывает воздействие запуска врожденной иммунной реакции против нежелательных патогенов.
[0210] Введение иммунотерапевтических агентов по настоящему изобретению может осуществляться с использованием любого пригодного для использования подхода, включая местное или регионарное введение агента в месте респираторной инфекции, вблизи него или внутри него. Агент может также доставляться, когда это удобно, посредством генной терапии. Например, антитело-индуцирующий антиген может вводиться посредством инъекции или иного прямого введения генетического вектора или иной молекулы нуклеиновой кислоты, которая может экспрессировать желаемый антиген. Антигены сами по себе могут также прямо вводиться в целевую инфицированную ткань.
Целевые респираторные заболевания
[0211] Настоящее изобретение предполагает лечение широкого набора респираторных заболеваний, включая инфекции всех типов, локализаций, размеров и характеристик. Например, способы по настоящему изобретению являются пригодными для лечения, например, синусита, гриппа и риновируса (простуды).
[0212] В других вариантах осуществления, по существу любой тип инфекции родственной респираторной инфекции может лечиться по настоящему изобретению, включая, но, не ограничиваясь этим, следующие респираторные инфекции: тонзилит, фарингит, ларингит, синусит, воспаление среднего уха, определенные типы гриппа, бронхит, пневмонию и простуду.
[0213] Композиции по настоящему изобретению как предполагается, являются пригодными для профилактики и/или лечения инфекции любого серотипа риновируса человека (HRV). HRV может включать, без ограничения, виды риновируса A (включая серотипы HRV-A1, HRV-A2, HRV-A7, HRV-A8, HRV-A9, HRV-A10, HRV-A11, HRV-A12, HRV-A13, HRV-A15, HRV-A16, HRV-A18, HRV-A19, HRV-A20, HRV-A21, HRV-A22, HRV-A23, HRV-A24, HRV-A25, HRV-A28, HRV-A29, HRV-A30, HRV-A31, HRV-A32, HRV-A33, HRV-A34, HRV-A36, HRV-A38, HRV-A39, HRV-A40, HRV-A41, HRV-A43, HRV-A44, HRV-A45, HRV-A46, HRV-A47, HRV-A49, HRV-A50, HRV-A51, HRV-A53, HRV-A54, HRV-A55, HRV-A56, HRV-A57, HRV-A58, HRV-A59, HRV-A60, HRV-A61, HRV-A62, HRV-A63, HRV-A64, HRV-A65, HRV-A66, HRV-A67, HRV-A68, HRV-A71, HRV-A73, HRV-A74, HRV-A75, HRV-A76, HRV-A77, HRV-A78, HRV-A80, HRV-A81, HRV-A82, HRV-A85,HRV-A88, HRV-A89, HRV-A90, HRV-A94, HRV-A95, HRV-A96, HRV-A98, HRV-A100, HRV-A101, HRV-A102 и HRV-A103), риновируса B (включая серотипы HRV-B3, HRV-B4, HRV-B5, HRV-B6, HRV-B14, HRV-B17, HRV-B26, HRV-B27, HRV-B35, HRV-B37, HRV-B42, HRV-B48, HRV-B52, HRV-B69, HRV-B70, HRV-B72, HRV-B79, HRV-B83, HRV-B84, HRV-B86, HRV-B91, HRV-B92, HRV-B93, HRV-B97 и HRV-B99) и риновируса C (включая, без ограничения, серотипы HRV-C1, HRV-C2, HRV-C3, HRV-C4, HRV-C5, HRV-C6, HRV-C7, HRV-C8, HRV-C9, HRV-C10, HRV-C11, HRV-C12, HRV-C13, HRV-C14, HRV-C15, HRV-C16, HRV-C17, HRV-C18, HRV-C19, HRV-C20, HRV-C21, HRV-C22, HRV-C23, HRV-C24, HRV-C25, HRV-C26, HRV-C27, HRV-C28, HRV-C29, HRV-C30, HRV-C31, HRV-C32, HRV-C33, HRV-C34, HRV-C35, HRV-C36, HRV-C37, HRV-C38, HRV-C39, HRV-C40, HRV-C41, HRV-C42, HRV-C43, HRV-C44, HRV-C45, HRV-C46, HRV-C47, HRV-C48, HRV-C49, HRV-C50 и HRV-C51). В некоторых вариантах осуществления, композиции по настоящему изобретению, как предполагается, являются полезными при профилактике или лечении вирусной инфекции любого риновируса или энтеровируса, и в частности, любого вируса, который связывает фактор межклеточной адгезии 1 (ICAM-1). Композиции по настоящему изобретению также, как предполагается, являются пригодными для профилактики и/или лечения инфекции любого серотипа вируса гриппа человека, включая без ограничения, вирусы рода Influenzavirus A, Influenzavirus B и Influenzavirus B, включая виды вирусы гриппа A (включая, без ограничения, серотипы H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3, H10N7 и H7N9, называя только более), вируса гриппа B и вируса гриппа C. В некоторых вариантах осуществления, композиции по настоящему изобретению, как предполагается, являются полезными при профилактике или лечении вирусной инфекции любого вируса, связывающего сиаловую кислоту, включая вирус гриппа, реовирус, аденовирус и/или ротавирус. При распылении в носовой полости и/или во рту, композиции по настоящему изобретению образуют осадок на слизистой, в идеале, имеющий большое время пребывания (например, по меньшей мере, 1 минуту, по меньшей мере, 5 минут, по меньшей мере, 10 минут, по меньшей мере, 15 минут, по меньшей мере, 20 минут, по меньшей мере, 25 минут, по меньшей мере, 30 минут, и тому подобное) на слизистой, но, желательно, не вызывающей сухости или раздражения слизистой. Предпочтительные композиции по настоящему изобретению наносятся на слизистую носовой и/или ротовой полости для профилактики или лечения инфекции риновируса человека и вируса гриппа человека.
[0214] Настоящее изобретение может, как правило, лечить и/или предотвращать все формы указанных выше инфекций. Например, способ по настоящему изобретению преимущественно может лечить или предотвращать инфекции, возникающие в любой части респираторного тракта, включая, но, не ограничиваясь этим, верхние дыхательные пути (нос, носовые пазухи, гортань и глотку) и нижние дыхательные пути (трахею, бронхи первого порядка, мелкие бронхи, бронхиолы и легкие).
[0215] Уменьшение инфекции означает измеримое уменьшение роста инфекции. Например, и без ограничения, инфекция может уменьшаться, по меньшей мере, примерно в 10 раз (например, 100, 1000-кратно или больше) или уменьшаться, по меньшей мере, примерно на 10% (например, по меньшей мере, примерно на 20, 30, 40, 50, 60, 70, 80, 90, 95, 99 или 100%) по сравнению с ростом, измеренным за время до лечения, как определено в настоящем документе. Уменьшение инфекции по настоящему изобретению в идеале имеет статистически значимую степень по сравнению с идентичными в остальном инфицированными тканями в отсутствие активных ингредиентов, содержащихся в композиции по настоящему изобретению.
[0216] Полное устранение инфекции может также достигаться с помощью способов по настоящему изобретению. Устранение означает удаление инфекции и инфекционных организмов. Инфекция считается удаленной, когда она больше не детектируется с использованием способов детектирования известных в данной области.
Фармацевтические композиции
[0217] Настоящее изобретение предлагает фармацевтические композиции для использования в любом из способов, описанных в настоящем документе. Фармацевтические композиции могут содержать антимикробный/противовирусный терапевтический агент и, необязательно, иммунотерапевтический агент.
[0218] В вариантах осуществления, фармацевтические композиции содержат фармацевтически приемлемый носитель. Термин “фармацевтически приемлемый” означает одобренный регуляторным органом Федерального правительства или правительства штата или описанный в U.S. Pharmacopeia или в другой фармакопее для использования на животных, а более конкретно, на людях. Термин “носитель” относится к разбавителю, вспомогательными веществу, наполнителю или лекарственной среде, с помощью которых вводится терапевтическое средство. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масло из нефти, масло животного, растительного или синтетического происхождения, такое как арахисовое масло, соевое масло, минеральное масло, кунжутное масло, оливковое масло, гель (например, гидрогель, и тому подобное), касторовое масло, и тому подобное. Солевой раствор представляет собой предпочтительный носитель, когда фармацевтическая композиция вводится внутривенно. Солевые растворы и водные растворы декстрозы, и глицериновые растворы также могут использоваться в качестве жидких носителей, в частности, для растворов для инъекций.
[0219] Фармацевтически приемлемый носитель может выбираться для обеспечения указанного времени пребывания в слизистой субъекта. В некоторых вариантах осуществления, “время пребывания” композиций по настоящему изобретению на слизистой представляет собой среднее время пребывания для исследований, включающих множество нанесений (интраназально и/или перорально) с использованием образца от множества индивидуумов достаточного для того, чтобы считать популяцию большой. В некоторых вариантах осуществления, по меньшей мере, 25% (а предпочтительно, по меньшей мере, 30% или, по меньшей мере, 40% или по меньшей мере, 50% или, по меньшей мере, 60% или, по меньшей мере, 70% или, по меньшей мере, 80% или, по меньшей мере, 90%) массовых от изначально нанесенных активных ингредиентов остается на слизистой через заданный период времени. В некоторых вариантах осуществления, фармацевтически приемлемый носитель при 25°C имеет параметры растворимости Хансена для дисперсионной энергии (δd), энергии дипольных межмолекулярных взаимодействий между молекулами (δp), энергии водородных связей (δh) в пределах примерно между 15 и примерно 18, примерно 12 и примерно 15, примерно 21 и примерно 25, соответственно.
[0220] Фармацевтически приемлемый носитель может быть водным. В некоторых вариантах осуществления, фармацевтически приемлемый носитель не содержит ртутных консервантов. Растворитель может представлять собой 1,2-пропандиол, 1,3-пропандиол, и могут использоваться разнообразные водные носители, например, буферный водный раствор, 0,9-процентный солевой раствор, буферные растворы вода-этанол, и тому подобное. Сочетания любых этих носителей находятся в рамках настоящего изобретения. Эти композиции могут стерилизоваться с помощью обычных, хорошо известных технологий стерилизации, или они могут стерильно фильтроваться. Полученные в результате растворы могут упаковываться для использования как есть или смешиваться как вспомогательное вещество с другим медицинским средством. Композиция может содержать фармацевтически приемлемые вспомогательные вещества, как требуется для воспроизведения физиологических условий, такие как регулирующие pH и буферные агенты, тонические агенты, модификаторы вкуса, подсластители, смачивающие агенты, и тому подобное, например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат, и тому подобное. В некоторых вариантах осуществления, фармацевтически приемлемый носитель представляет собой смесь воды и полиола. В некоторых вариантах осуществления, фармацевтически приемлемый носитель представляет собой смесь воды и пропандиола (например, 1,2-пропендедиола, 1,3-пропандиола, и тому подобное). В некоторых вариантах осуществления, фармацевтическая композиция представляет собой смесь воды и глицерина. Фармацевтически приемлемый носитель может представлять собой примерно 1% - примерно 35% масс, от водного носителя, (например, примерно 5% - примерно 30%, и тому подобное) водный раствор пропандиола или глицерина. Некоторые фармацевтически приемлемые носители содержат 20% водный раствора 1,3-пропандиола, 20% водный раствора глицерина, 10% водный раствор 1,3-пропандиола, 10% водный раствор глицерина, 20% водный раствор 1,3-пропандиола с 1% подсолнечного масла и 5% полисорбата 80, 20% водный раствор глицерина с 1% подсолнечного масла и 5% полисорбата 80, 10% водный раствор 1,3-пропандиола с 1% подсолнечного масла и 5% полисорбата 80, 10% водный раствор глицерина с 1% подсолнечного масла и 5% полисорбата 80, полимерную систему эмульгатора Versaflex V-175 (то есть пальмитат сахарозы, глицерилстеарат, глицерилстеарат-цитрат, сахарозу, маннан и ксантановую смолу), полимерную систему эмульгатора Versaflex V-175 с 3% подсолнечного масла, полимерную систему эмульгатора Versaflex V-175 с 3% подсолнечного масла и примерно 5 - примерно 30% пропандиола или глицерина, систему эмульгатора Versaflex V-175 с 3% ацетилированного моноглицерида и систему эмульгатора Versaflex V-175 с 3% ацетилированного моноглицерида и примерно 5 - примерно 30% пропандиола или глицерина.
[0221] Пригодные для использования фармацевтические наполнители включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, глицеринмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол, и тому подобное. Композиция, при желании, может также содержать малые количества смачивающих или эмульгирующих агентов, или буферных агентов для поддержания pH. Эти композиции могут иметь форму растворов, суспензий, эмульсии, таблеток, пилюль, капсул, порошков, препаратов с замедленным высвобождением, и тому подобное. Пероральный препарат может содержать стандартные носители, такие как фармацевтические сорта маннитола, лактозы, крахмала, стеарата магния, сахарина натрия, целлюлозы, карбоната магния, и тому подобное. Примеры пригодных для использования фармацевтических носителей, описаны в “Remington's Pharmaceutical Sciences”, E. W. Martin, содержание которой тем самым включается в качестве ссылки во всей своей полноте. Такие композиции будут, как правило, содержать терапевтически эффективное количество терапевтического агента и/или иммунотерапевтического агента в очищенной форме вместе с соответствующим количеством носителя, чтобы обеспечить форму для соответствующего введения пациенту. Препарат должен соответствовать способу введения.
[0222] В вариантах осуществления, терапевтический агент и/или иммунотерапевтический агент вводится местным образом как композиция с непосредственным высвобождением или с контролируемым высвобождением, например, посредством контролируемого растворения и/или диффузии активного вещества. Высвобождение, контролируемое растворением или диффузией, может достигаться посредством введения активного вещества в соответствующую матрицу. Матрица с контролируемым высвобождением может включать одно или более веществ из шеллака, пчелиного воска, гликовоска, гидрированного касторового масла, карнаубского воска, стеарилового спирта, глицерилмоностеарата, глицерилдистеарата, глицеринпальмитолстеарата, этилцеллюлозы, акриловых смол, dl-полимолочной кислоты, ацетата- бутирата целлюлозы, поливинилхлорида, поливинилацетата, винилпирролидона, полиэтилена, полиметакрилата, метилметакрилата, 2-гидроксиметакрилата, метакрилатных гидрогелей, 1,3-бутиленгликоля, метакрилата этиленгликоля и/или полиэтиленгликолей. При приготовлении матрицы с контролируемым высвобождением, материал матрицы может также включать, например, гидратированную метилцеллюлозу, карнаубский воск и стеариловый спирт, карбопол 934, силикон, глицерилтристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галогенированный фторуглеводород.
[0223] В родственных вариантах осуществления, матрица с контролируемым высвобождением представляет собой гидрогель. Гидрогель представляет собой трехмерную гидрофильную или амфифильную полимерную сетку, способную удерживать большие количества воды. Сетки состоят из гомополимеров или сополимеров, которые являются нерастворимыми из-за присутствия ковалентных химических или физических (например, ионных, обусловленными гидрофобными взаимодействиями, переплетениями, и тому подобное) поперечных сшивок. Поперечные сшивки обеспечивают структуру и физическую целостность сетки. Гидрогели демонстрируют термодинамическую совместимость с водой, которая позволяет им набухать в водных средах. Цепи сетки соединены таким образом, что существуют поры, и значительная доля этих пор имеет размер в пределах между 1 нм и 1000 нм.
[0224] Гидрогели можно получить посредством поперечной сшивки гидрофильных биополимеров или синтетических полимеров. Примеры гидрогелей, сформированных благодаря физической или химической поперечной сшивке гидрофильных биополимеров, включают, но, не ограничиваясь этим, гиалуроновую кислоту, хитозаны, альгинаты, коллаген, декстран, пектин, каррагенан, полилизин, желатин, агарозу, (мет)акрилат-олиголактид-PEO-олиголактид-(мет)акрилат, поли(этиленгликоль) (PEO), поли(пропиленгликоль) (PPO), сополимеры PEO-PPO-PEO (Pluronics), поли(фосфазен), поли(метакрилаты), поли(N-винилпирролидон), сополимеры PL(G)A-PEO-PL(G)A, поли(этиленимин), и тому подобное. Смотри Hennink and van Nostrum, Adv. Drug Del. Rev. 54:13-36 (2002); Hoffman, Adv. Drug Del. Rev. 43:3-12 (2002); Cadee et al., J Control. Release 78:1-13 (2002); Surini et al., J. Control. Release 90:291-301 (2003); и патент США № 7968085, каждый из них включается в качестве ссылки во всей своей полноте. Эти материалы состоят из высокомолекулярных основных цепей, состоящих из линейных или разветвленных полисахаридов или полипептидов.
[0225] Количество фармацевтической композиции по настоящему изобретению, которое будет эффективным при лечении или предотвращении респираторной инфекции или аллергии, может зависеть от природы патогена и может быть определено с помощью стандартных клинический методик, включая анализы крови и/или методики получения изображений. В дополнение к этому, необязательно могут использоваться анализы in vitro, чтобы помочь идентифицировать оптимальные диапазоны дозирования. Точная доза, которая должна использоваться при приготовлении, может также зависеть от способа введения и от серьезности инфекции, и должна определяться согласно суждениям практикующего врача и обстоятельств каждого пациента. Эффективные дозы могут экстраполироваться по кривым доза-реакция, полученным при анализах in vitro или при анализах систем животных моделей.
Дозировки и режимы введения
[0226] Терапевтические агенты, иммунотерапевтические агенты или композиции, содержащие эти агенты, вводятся способом совместимым с препаратом дозировки и в таком количестве, которое может быть терапевтически эффективным, защищающим и иммуногенным.
[0227] Агенты и/или композиции могут вводиться различными способами, включая, но, не ограничиваясь этим, назальный, аэрозольный, местный, буккальный и сублингвальный, пероральный, интрадермальный, подкожный и парентеральный. Термин парентеральный, как используется в настоящем документе, включает, например, внутриглазную, подкожную, внутрибрюшинную, внутрикожную, внутривенную, внутримышечную, внутрисуставную, интраартериальную, внутрисуставную, внутригрудинную, интратекальную, внутрираневую и интракраниальную иннъекцию или другие методики вливания.
[0228] В некоторых вариантах осуществления, введение терапевтических агентов осуществляют местным или регионарным образом (например, интраназально, и тому подобное). В некоторых вариантах осуществления, используют устройство для доставки антимикробной композиции в респираторный тракт. Композиция может доставляться с использованием ингалятора, атомайзера, небулайзера, флакона для назального спрея, насоса для назального спрея, вентилятора, емкости со сжатым воздухом, аэролайзера и носовой канюли. Композиция может доставляться с помощью инсуффляции, ингаляции, перорального заглатывания, сублингвально, и с помощью любого их сочетания.
[0229] В вариантах осуществления, агенты и/или композиции, приготовленные в соответствии с настоящим изобретением, приготавливаются и доставляются таким способом, чтобы вызвать системную иммунную реакцию. Таким образом, в некоторых вариантах осуществления, препараты приготавливают посредством однородного и мелкодисперсного приведения в ассоциацию активного ингредиента с жидкими носителями. Препараты пригодные для введения включают водные и неводные стерильные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворимые вещества, которые делают препарат изотоническим в крови предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загущающие агенты. Препараты могут присутствовать в однодозовых или многодозовых контейнерах, например, в герметичных ампулах и флаконах, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды, непосредственно перед использованием. Приготовленные для немедленного приема растворы и суспензии могут приготавливаться из стерильных порошков, гранул и таблеток, обычно используемых специалистами в данной области.
[0230] Агенты и/или композиции могут вводиться в различных формах, включая, но, не ограничиваясь этим, газы, растворы, эмульсии и суспензии, гели, пены, спреи, туманы, лосьоны, микросферы, частицы, микрочастицы, наночастицы, липосомы, и тому подобное.
[0231] Агенты и/или композиции вводят способом, совместимым с дозируемым препаратом, и в таком количестве, которое может быть терапевтически эффективным, иммуногенным и защищающим. Количество, которое должно вводиться, зависит от субъекта, которого нужно лечить, включая, например, размер инфекции и способность иммунной системы индивидуума синтезировать антитела и/или продуцировать медиируемую клетками иммунную реакцию. Точные количества активных ингредиентов, которые необходимо ввести, зависят от суждения практикующего врача. Однако соответствующие диапазоны дозировок легко определяются специалистом в данной области, и они могут иметь порядок от микрограмм до миллиграмм активного ингредиента (ингредиентов) на дозу. Дозировка может также зависеть от способа введения и может изменяться вместе с размерами хозяина.
[0232] Агенты и/или композиции должны вводиться субъекту в количестве эффективном для стимулирования у субъекта защитной иммунной реакции. Конкретные режимы дозирования и лечения для любого конкретного субъекта могут зависеть от разнообразных факторов, включая активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, скорость выделения, сочетание лекарственных средств, тяжесть и ход инфекции, состояния или симптомов, предрасположенности субъекта к заболеванию, состоянию или симптомам, от способа введения и от суждения лечащего врача. Реальные дозировки могут легко определяться специалистами в данной области.
[0233] Иллюстративные стандартные дозированные препараты представляют собой препараты, содержащие дозу или единицу, или соответствующую ее долю, вводимого ингредиента. Необходимо понять, что, в дополнение к ингредиентам, рассмотренным в настоящем документе, препараты по настоящему изобретению, могут содержать другие агенты, обычно используемые специалистами в данной области.
[0234] В настоящее время пероральный или назальный спрей или аэрозольный способ (например, посредством ингаляции) чаще всего используют для доставки терапевтических агентов прямо в легкие и в респираторную систему. Однако настоящее изобретение охватывает доставку фармацевтической композиции по настоящему изобретению с помощью любого соответствующего способа, принимая во внимание вероятный прогресс в науке о доставке лекарственных средств.
[0235] В некоторых вариантах осуществления, препараты для ингаляционной или аэрозольной доставки содержит множество частиц. В некоторых вариантах осуществления, такие препараты имеют средний размер 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 микрон. В некоторых вариантах осуществления, препараты для ингаляционной или аэрозольной доставки приготавливают в виде сухого порошка. В некоторых вариантах осуществления, препараты для ингаляционной или аэрозольной доставки приготавливают в виде влажного порошка, например, посредством введения смачивающего агента. В некоторых вариантах осуществления, смачивающий агент выбирают из группы, состоящей из воды, солевого раствора или другой жидкости с физиологическим pH.
[0236] В некоторых вариантах осуществления, композиции по настоящему изобретению вводится как капли в носовую или защечную полость. В некоторых вариантах осуществления, доза может содержать множество капель (например, 1-100, 1-50, 1-20, 1-10, 1-5, и тому подобное).
[0237] Как правило, при обычном системно вводимом лечении, терапевтически эффективная доза должна давать концентрацию соединения в сыворотке примерно от 0,1 г/мл примерно до 50-100 мкг/мл. Фармацевтические композиции, как правило, обеспечивают дозу примерно от 0,001 мг примерно до 2000 мг соединения на килограмм массы тела в день. Например, дозировки для введения пациенту человеку могут находиться в диапазоне 1-10 мкг/кг, 20-80 мкг/кг, 5-50 мкг/кг, 75-150 мкг/кг, 100-500 мкг/кг, 250-750 мкг/кг, 500-1000 мкг/кг, 1-10 мг/кг, 5-50 мг/кг, 25-75 мг/кг, 50-100 мг/кг, 100-250 мг/кг, 50-100 мг/кг, 250-500 мг/кг, 500-750 мг/кг, 750-1000 мг/кг, 1000-1500 мг/кг, 1500-2000 мг/кг, 5 мг/кг, 20 мг/кг, 50 мг/кг, 100 мг/кг, 500 мг/кг, 1000 мг/кг, 1500 мг/кг или 2000 мг/кг. Фармацевтические стандартные дозированные формы приготавливают для получения примерно от 1 мг примерно до 5000 мг, например, примерно от 100 примерно до 2500 мг соединения или сочетания главных ингредиентов на стандартную дозированную форму.
[0238] Как правило, терапевтически эффективное количество настоящих соединений в дозированной форме обычно находится в пределах от чуть меньшего примерно чем 0,025 мг/кг/день примерно до 2,5 г/кг/день, предпочтительно, примерно от 0,1 мг/кг/день примерно до 100 мг/кг/день для пациента, или значительно больше, в зависимости от используемого соединения, состояния или леченой инфекции и способа введения, хотя исключения из этого диапазона дозировок могут рассматриваться в настоящем изобретении. В иллюстративном варианте осуществления, антимикробные/противовирусные композиции по настоящему изобретению могут вводиться интраназально в количествах в пределах примерно от 0,5 мг/мл дозируемого раствора примерно до 50 мг/мл. В другом иллюстративном варианте осуществления, антимикробные композиции по настоящему изобретению могут вводиться интраназально в количествах в пределах примерно от 10 мг/мл примерно до 30 мг/мл. Дозировка антимикробной композиции (композиций) может зависеть от типа инфекции, которая лечится, конкретного используемого соединения, терапевтического агента и других клинических факторов и от состояния пациента. Необходимо понять, что настоящее изобретение находит применение как в медицине, так и в ветеринарии.
[0239] Агенты и/или композиции могут вводиться в одной или нескольких дозах по потребности для достижения желаемого воздействия. Таким образом, агенты и/или композиции могут вводиться в 1, 2, 3, 4, 5 или более дозах. Кроме того, дозирования могут разделяться любым периодом времени, например, часами, днями, неделями, месяцами и годами.
[0240] Агенты и/или композиции могут приготавливаться в виде жидкостей или сухих порошков, или в форме микросфер.
[0241] Агенты и/или композиции можно хранить при температурах примерно от -100°C примерно до 25°C в зависимости от продолжительности хранения. Агенты и/или композиции могут также храниться в лиофилизированном состоянии при различных температурах, включая комнатную температуру. Агенты и/или композиции могут стерилизоваться с помощью обычных средств известных специалистам в данной области. Такие средства включают, но, не ограничиваясь этим, фильтрование.
[0242] Количество активного ингредиента, которое можно объединять с материалами носителей для получения одной дозированной формы, может изменяться в зависимости от того, кого лечат, и от конкретного режима введения. В вариантах осуществления, препарат может содержать примерно от 0,1% примерно до 95% активного соединения (масс/масс), примерно от 20% примерно до 80% активного соединения или любой процент в этих пределах.
[0243] В вариантах осуществления, pH препарата может регулироваться с помощью фармацевтически приемлемых кислот, оснований или буферов для повышения стабильности приготовленного соединения или его доставляемой формы.
[0244] В вариантах осуществления, фармацевтические носители могут находиться в форме стерильного жидкого препарата, например, в виде стерильной водной или масляной суспензии.
[0245] Среди приемлемых лекарственных сред и растворителей, которые можно использовать, имеется маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия.
[0246] В дополнение к этому, стерильные нелетучие масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели, можно использовать любое успокаивающее нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, являются полезными при приготовлении препаратов для инъекций, поскольку являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных версиях. Эти масляные растворы или суспензии могут также содержать длинноцепной спиртовой разбавитель или дисперсант, или карбоксиметилцеллюлозу или подобные диспергирующие агенты, которые обычно используют при приготовлении фармацевтически приемлемых дозированных форм, таких как эмульсии и/или суспензии.
[0247] Другие обычно используемые поверхностно-активные вещества, такие как TWEEN® или SPAN®, и/или другие сходные эмульгирующие агенты или усилители биодоступности, которые обычно используют при приготовлении фармацевтически приемлемых твердых, жидких или других дозированных форм, также можно использовать для целей приготовления.
[0248] В вариантах осуществления, агенты и/или композиции могут доставляться в экзосомальной системе доставки. Эксозомы представляют собой малые мембранные везикулы, которые высвобождаются во внеклеточную окружающую среду в ходе слияния мультивизикулярных масс с плазматической мембраной. Эксозомы выделяются различными типами клеток, включая гематопоэтические клетки, нормальные эпителиальные клетки и даже некоторые клетки опухолей. Эксозомы, как известно, переносят MHC класса I, различные костимуляторные молекулы и некоторые тетраспанины. Недавние исследования показали потенциал использования нативных эксозом в качестве иммунологических стимулянтов.
[0249] Также, в настоящем изобретении рассматривается доставка агентов и/или композиций с использованием наночастиц. Например, агенты и/или композиции, предлагаемые в настоящем документе, могут содержать наночастицы, содержащие, по меньшей мере, один или более агентов, связанных с ними, например, связанные с поверхностью наночастицы. Композиция, как правило, содержит множество наночастиц, при этом каждая наночастица содержит, по меньшей мере, один или более агентов, присоединенных к ней. Наночастицы могут представлять собой коллоидные металлы. Коллоидный металл включает любую водонерастворимую частицу металла или металлического соединения, диспергированную в жидкой воде. Как правило, коллоидный металл представляет собой суспензию частиц металла в водном растворе. Можно использовать любой металл, который может быть получен в коллоидной форме, включая золото, серебро, медь, никель, алюминий, цинк, кальций, платину, палладий и железо. В некоторых случаях, используют наночастицы золота, например, полученные из HAuCl4. Наночастицы могут иметь любую форму и иметь диапазон размеров примерно от 1 нм примерно до 10 нм, например, примерно от 2 нм примерно до 8 нм, примерно от 4 примерно до 6 нм, или примерно 5 нм. Способы приготовления наночастиц коллоидных металлов, включая получение коллоидных наночастиц золота из HAuCl4, известны специалистам в данной области. Например, способы, описанные в настоящем документе, а также описанные в других местах (например, в публикациях патентов США №№ 2001/005581; 2003/0118657 и 2003/0053983, которые тем самым включаются в качестве ссылок), представляют собой полезные инструкции при получении наночастиц.
[0250] В определенных случаях, наночастица может содержать два, три, четыре, пять, шесть или более активных агентов, связанных с ее поверхностью. Как правило, множество молекул активных агентов связаны с поверхностью наночастицы во многих положениях. Соответственно, когда наночастица описывается как содержащая, например, два активных агента, связанных с ней, наночастица содержит два активных агента, каждый из которых имеет свою собственную уникальную молекулярную структуру, связанных с ее поверхностью. В некоторых случаях, одна молекула активного агента может связываться с наночастицей с помощью одного сайта присоединения или с помощью множества сайтов присоединения. Активный агент может связываться прямо или опосредованно с поверхностью наночастицы. Например, активный агент может связываться прямо с поверхностью наночастиц или опосредованно, через промежуточный линкер.
[0251] В качестве линкера можно использовать как любой тип молекулы. Например, линкер может представлять собой алифатическую цепь, содержащую, по меньшей мере, два атома углерода (например, 3, 4, 5, 6, 7, 8, 9, 10 или более атомов углерода), и она может быть замещена одной или несколькими функциональными группами, включая кетон, простой эфир, сложный эфир, амид, спирт, амин, мочевину, тиомочевину, сульфоксид, сульфон, сульфонамид и дисульфид в качестве функциональных групп. В случаях, когда наночастица содержит золото, линкер может представлять собой любую тиолсодержащую молекулу. Реакция тиольной группы с золотом дает в результате ковалентную сульфидную (-S-) связь. Дизайн и синтез линкера хорошо известны в данной области.
[0252] В вариантах осуществления, наночастица связывается с целевым агентом/остатком. Целевая функциональная группа может сделать возможным аккумулирование наночастиц на мишени (например, на мембране носовой полости) при более высоких концентрациях, чем в других тканях. Как правило, нацеливающая молекула может представлять собой один из элементов связывающейся пары, который демонстрирует аффиность и специфичность ко второму элементу связывающейся пары. Например, терапевтический агент на основе антитела или фрагмента антитела может нацеливать наночастицу на конкретную область или молекулу организма (например, на область или молекулу, к которой антитело является специфичным), при этом осуществляя также терапевтическую функцию. В некоторых случаях, рецептор или фрагмент рецептора может нацеливать наночастицу на конкретную область организма, например, на положение его партнера по паре связывания. Другие терапевтические агенты, такие как малые молекулы, могут сходным образом нацеливать наночастицу на рецептор, белок или другой сайт связывания, имеющий аффиность к терапевтическому агенту.
[0253] Когда композиции по настоящему изобретению содержат один или более дополнительных терапевтических или профилактических агентов, терапевтический/усиливающий/иммунотерапевтический агент и дополнительный агент должны присутствовать при уровнях доз в пределах примерно между 0,1 и 100%, или примерно между 5 и 95% от дозы, обычно вводимой в режиме монотерапии. Дополнительные агенты могут вводиться отдельно, как часть многодозового режима, от агентов по настоящему изобретению. Альтернативно, эти дополнительные агенты могут представлять собой часть одной дозированной формы, они смешиваются вместе с агентами по настоящему изобретению в одной композиции.
[0254] Введение агентов и/или композиций по настоящему изобретению вызывает иммунную реакцию против патогена. Как правило, доза может регулироваться в этом диапазоне на основе, например, возраста субъекта, здоровья и физического состояния субъекта, способности иммунной системы субъекта продуцировать иммунную реакцию, массы тела субъекта, пола субъекта, диеты, времени введения, желаемой степени защиты и других клинических факторов. Специалисты в данной области могут также легко найти такие параметры, как биологическое половинное время жизни, биологическая доступность, способ введения и токсичность, при приготовлении агентов и/или композиций по настоящему изобретению.
[0255] Следующие далее примеры дополнительно демонстрируют более вариантов осуществления настоящего изобретения. Хотя примеры иллюстрируют изобретение, они, как предполагается, не ограничивают его.
ПРИМЕРЫ
[0256] Структуры, материалы, композиции и способы, описанные в настоящем документе, как предполагается, представляют собой репрезентативные примеры настоящего изобретения, и будет понятно, что рамки настоящего изобретения не ограничиваются рамками примеров. Специалисты в данной области заметят, что настоящее изобретение может осуществляться с помощью вариантов, описываемых структур, материалов, композиций и способов, и такие варианты, как считается, находятся в границах настоящего изобретения.
Пример 1: Введение антимикробных композиций субъектам, отличающимся от человека, для предотвращения инфекции
[0257] Различные концентрации антимикробных композиций, содержащих ингредиенты из Таблицы 1, вводятся интраназально группе здоровых неинфицированных мышей, отобранных по возрасту, полу и массе. После соответствующего периода времени, чтобы дать композициям возможность для оказания воздействия, мышей инокулируют назально различными дозами респираторных патогенов (гриппом, риновирусом, бактериями и грибками). В различных последующих временных точках, у мышей извлекают образцы и анализируют их на микробную инфекцию. Отсутствие инфекции показывает, что антимикробная композиция предотвращает инфицирование мышей взвешенными в воздухе патогенами. Антимикробная композиция усиливает способности фильтрования у мембран носовой полости и защищает против взвешенных в воздухе патогенов.
Пример 2: Введение антимикробных композиций субъектам, отличающимся от человека, для лечения инфекции
[0258] Группу здоровых неинфицированных мышей, отобранных по возрасту, полу и массе, инокулируют назально различными дозами респираторных патогенов (гриппа, риновируса, бактерий и грибков). После предоставления соответствующего времени патогенам для инфицирования мышей, различные концентрации антимикробных композиций, содержащих ингредиенты из Таблицы 1 (как в Примере 1), вводят инфицированным мышам интраназально. После соответствующего периода, чтобы дать композициям возможность для оказания воздействия, образцы извлекают у мышей и анализируют на микробную инфекцию. Отсутствие инфекции показывает, что антимикробная композиция лечит респираторные инфекции у мышей. Антимикробная композиция усиливает способности фильтрования у мембран носовой полости и лечит инфекцию, вызываемую взвешенными в воздухе патогенами.
Пример 3: Введение антимикробных композиций субъектам людям для лечения инфекции
[0259] Группу субъектов людей, без предшествующих инфекций гриппа или риновируса, выбирают для обработки и отбирают их фоновую кровь для скрининга маркеров респираторной инфекции. Антимикробные композиции, содержащие ингредиенты из Таблицы 1 (как в Примерах 1 и 2), вводят субъектам интраназально. После соответствующего периода времени, чтобы позволить композициям оказать воздействие, субъекты экспонируются для взвешенного в воздухе риновируса или гриппа. После соответствующего периода времени, для определения того, были ли они инфицированы, их кровь опять отбирают и просматривают на системные маркеры респираторной инфекции, и их наблюдают и опрашивают относительно признаков респираторной инфекции. Отсутствие инфекции показывает, что антимикробная композиция предотвращает респираторные инфекции. Антимикробная композиция усиливает способности фильтрования у мембран носовой полости и предотвращает возникновение респираторной инфекции под действием вирусов.
Пример 4: измерения композиций на 3d модели полностью дифференцированных клеток эпителия дыхательных путей человека, инокулированных риновирусом A16
[0260] Различные композиции исследуют относительно их способности защищать 3D модель эпителия дыхательных путей человека, состоящую из первичных эпителиальных клеток человека, свежевыделенных из назальной, трахеальной или бронхиальной биопсии (MucilAir™). MucilAir™ состоит из базальных клеток, ресничных клеток и клеток слизистых из респираторного тракта. Доли этих различных типов клеток соответствует тому, что наблюдают in vivo (Huang et al., Drug Discovery and Development and Development - Present and Future, 8, 201). Кроме того, эпителий начинается с недифференцированных клеток. Эпителий (популяцию MucilAir™) разбавляют смесью клеток, выделенных у 14 различных нормальных назальных доноров, и культивируют в течение 41 дня. Эпителиальные клетки выделяют из свежих биопсий (нос и бронхи), затем высевают на полупористую мембрану (Costar Transwell, размер пор 0,4 мкм). Примерно через 45 дней культивирования на границе раздела воздух-жидкость, эпителий полностью дифференцируется, как морфологически, так и функционально. После 45 дней культивирования эпителий полностью силиируется, выделяет слизь и становится электрически плотным (TEER>200 Ом∙см²). Активность главных эпителиальных ионных каналов, таких как CFTR, EnaC, Na/K ATPазы, сохраняется, и эпителий как показано, реагирует регулируемым и векторным образом на провоспалительный TNF-α (Huang et al., 2011 и Huang et al., 3R-Info-Bulletin No. 41, October 2009).
[0261] Композиции с различны активными ингредиентами приготавливают, как показано в Таблице 5. Каждая композиция приготавливается в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). Как используется в настоящем документе, “HRV1” относится к композициям, содержащим аполактоферрин (то есть, HRV1-1, HRV1-2, и HRV1-3) как единственное активное вещество, “HRV2” относится к композициям, содержащим лизозим (то есть, HRV2-1, HRV2-2 и HRV2-3) как единственное активное вещество, и упоминание “HRV3” относится к композициям, содержащим растворимый ICAM-1 (sICAM) (то есть, HRV3-1, HRV3-2, и HRV2-3) как единственное активное вещество. Упоминание “HRV4” относится к композициям, содержащим сочетание аполактоферрина, лизозима и растворимого ICAM-1.
Таблица 5
Лизозим (2500 мкг/мл)
Растворимый ICAM-1 (50 мкг/мл)
Лизозим (250 мкг/мл)
Растворимый ICAM-1 (5 мкг/мл)
Лизозим (25 мкг/мл)
Растворимый ICAM-1 (0,5 мкг/мл)
[0262] 20 мкл каждого препарата наносят апикально на отдельные популяции MucilAir™ непосредственно перед инокуляцией (время=0) риновирусом человека A16. 20 мкл каждого препарата также наносят через 3,5 и 24 часа после инокуляции (“pi”). Инокуляция риновирусом человека A16 достигается посредством нанесения 50 мкл 2×106/мл риновируса человека A16 (клинический штамм: QCHRV,16) на апикальную сторону 3D модели в течение 3 часов при 34°C, 5% CO2. Исходные растворы вирусов получают в культурах MucilAir™ и разбавляют в культурной среде без очистки или концентрирования.
[0263] После инокуляции (время=0), эпителий промывают дважды культурной средой MucilAir™ для очистки от инокулума. Не содержащие клеток, апикальные промывки (20 минут) с 200 мкл культурных сред MucilAir™ собирают через 3,5 часа после инокуляции, а затем через 24 часа и через 48 часов pi и хранят вместе при -80°C.
[0264] Из апикальных промывок, вирусную РНК извлекают с помощью набора QIAamp® Viral RNA (Qiagen). Вирусную РНК количественно определяют с помощью количественной RT-PCR (QuantiTect Probe RT-PCR, Qiagen) с помощью TaqMan ABI 7000. Используя известную концентрацию соответствующей вирусной РНК для установления стандартной кривой, количественное определение становится абсолютным. Данные представлены как количество копий генома/мл на графиках, иллюстрирующих результаты репликации вируса, если не указано иного. Эксперименты и данные с обозначением “(+)” относятся к экспериментам, осуществляемых на инокулированных средах, а эксперименты и данные с обозначением “(-)” относятся к экспериментам, осуществляемым на средах, не инокулированных вирусом. Для сравнения двух наборов данных, используют непарный t-критерий Стьюдента. Для сравнения средних значений для трех или более образцов, осуществляют односторонний анализ разброса (ANOVA) с тестами множественных сравнений Дюннета (***=p<0,001, **=p<0,01, *=p<0,05). В качестве отрицательного контроля, используют неинфицированные и необработанные культуры (Mock).
[0265] Для сравнения потенциальных воздействий соединений на HRV, включаются положительные контроли. Для токсического воздействия, культуры обрабатывают 20 мкл 10% Triton X-100 в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). Для воздействия против риновируса, в базальную среду добавляют 20 мкл 5 мкМ рупинтривира. Исходный раствор рупинтривира (Santa Cruz Biotechnologies), 2 мМ в DMSO (-20°C) разбавляют до 5 мкМ в среде MucilAir™ (конечная концентрация 0,25% DMSO).
[0266] Столбики ошибок на любой Фигуре относятся к стандартному отклонению от среднего значения (SEM). Все сравнения относятся к данным от инфицированной лекарственной среды (без активного вещества) и все приведенные данные представляют собой одно измерение на трех отдельных вставках (n=3). Все приведенные результаты являются статистически значимыми.
Измерения TEER
[0267] Целостность ткани отслеживают с использованием измерений трансэпителиального электрического сопротивления (“TEER”). TEER представляет собой динамический параметр, который отражает состояние эпителия, на которое может влиять более факторов. Например, если присутствуют дырки или если переходы между клетками разрываются, значения TEER, как правило, ниже 100 Ом∙см². В противоположность этому, когда эпителий не повреждается, значения TEER, как правило выше 200 Ом∙см². Заметное уменьшение значений TEER (но > 100 Ом∙см²), как правило, отражает активирование ионных каналов. Резкое увеличение значения TEER отражает блокировку активности ионных каналов или разрушение ресничных клеток. Когда эпителий повреждается, уменьшение TEER может ассоциироваться с увеличением высвобождения LDH или с уменьшением жизнеспособности клеток. Мониторинг TEER осуществляют через 24 (D1) и 48 (D2) часов после инокуляции. Контроль Triton X-100 соответствует потере TEER (< 100 Ом∙см²) после повреждения клеток. После добавления 200 мкл среды MucilAir™ в апикальный компартмент культур MucilAir™, сопротивление измеряют с помощью вольтомметра EVOMX (World Precision Instruments UK, Stevenage) для каждого состояния. Измеренные значения сопротивления (Ом) преобразуют в TEER (Ом∙см²) с помощью сопротивления мембраны (100 Ом), соединенной последовательно с эпителием. Эпителий имеет общую площадь поверхности 0,33 см2. TEER можно вычислить с помощью следующей формулы:
TEER (Ом∙см²) = (значение сопротивления (Ом) - 100(Ом)) × 0,33 (см2)
Результаты измерений TEER приведены на фигурах 1-4. Как можно увидеть, не наблюдается значительных изменений TEER через 24 часа pi (D1) или при 48 часов pi (D2) для любого из исследуемых препаратов HRV.
Высвобождение лактатдегидрогеназы
[0268] Лактатдегидрогеназа (“LDH”) представляет собой стабильный цитоплазматический фермент, который быстро высвобождается в культурную среду при разрыве цитоплазматической мембраны. 100 мкл базолатеральной среды, собранной в каждой временной точке, инкубируют вместе с реакционной смесью Cytotoxicity Detection KitPLUS, следуя инструкциям производителя (Sigma, Roche, 11644793001). Затем количество высвобожденной LDH количественно определяют посредством измерения поглощения каждого образца на 490 нм с помощью считывающего устройства для микропланшетов. Для определения процента цитотоксичности, разность экспериментального поглощения (Aexp) от низкого контроля сравнивают с разницей между значениями поглощения при низке (Alow) и высоком контроле (Ahigh), с использованием следующего уравнения:
Цитотоксичность (%) = (Aexp - Alow)/ (Ahigh - Alow)
Процент ниже 5% отражает физиологическое высвобождение LDH в среде. Измерения LDH осуществляют через 24 и через 48 часов pi. Результаты показаны на фигурах 5-8. Как можно увидеть, препараты лекарственных средств не увеличивают высвобождение LDH в 3D моделях.
Частота биения ресничек
[0269] Частоту биения ресничек (“CBF”) измеряют с помощью экспериментальной системы, состоящей из трех частей: камеры (Sony XCD V60 Firewire), карты PCI и специального пакета программного обеспечения. 256 изображений регистрируется при высокой частоте (125 fps (фото/секунда)) при комнатной температуре и частоту биения ресничек затем вычисляют с использованием программного обеспечения Epithelix. Значения CBF могут иметь разброс из-за таких параметров, такие как температура, вязкость слизи или жидкость (такая как буферный солевой раствор), наносимый на апикальную поверхность 3D эпителиальной модели MucilAir™. Следовательно, результаты считаются значимыми, когда достигается отношение >20% между контролем инфицированной лекарственной среды и композицией лекарственного средства. Фигуры 9-12 иллюстрируют результаты измерений частоты биения ресничек, полученные через 24 и через 48 часов pi. Как можно увидеть, обработка HRV не показывает значимого воздействия на частоту биения ресничек.
Мукоцилиарный клиренс
[0270] Мукоцилиарный клиренс (“MCC”) отслеживают с использованием камеры Sony XCD-U100CR, соединенной с микроскопом Olympus BX51 с объективом 5x. Полистирольные микрошарики, диаметром 30 мкм (Sigma, 84135) добавляют на апикальную поверхность MucilAir™. Движение микрошариков отслеживают с помощью видео при 2 блоках данных в секунду для 30 изображений при комнатной температуре. Снимают три фильма на одну вставку. Среднюю скорость движения шариков (мкм/сек) вычисляют с помощью программного обеспечения ImageProPlus 6.0. Значения мукоцилиарного клиренса меньше, чем 10 мкм/сек считаются патологическими. Фиг.13 иллюстрирует воздействие инфекции риновируса A16 на MCC при обработке каждым из трех активных веществ отдельно и в сочетании, измеренное через 48 часов pi. Как можно увидеть, сочетанная обработка демонстрирует превосходную и консистентную реакцию для исследуемых доз по сравнению с другими исследуемыми препаратами. MCC уменьшается для более низких концентраций препаратов HRV1 и препарата HRV3-3. Однако эти отрицательные воздействия не наблюдаются для препаратов HRV4 при любой концентрации. Неожиданно, даже если аполактоферрин сам по себе ингибирует цилиарное движение при некоторых дозах (смотри, например, HRV1-1 и HRV1-2), воздействие полностью ослабляется при сочетании HRV в каждой дозе.
Апикальная репликация риновируса
[0271] Из 200 мкл апикальных промывок, используют 20 мкл для извлечения вирусной РНК с помощью набора QIAamp® Viral RNA (Qiagen) с получением в результате объема элюирования РНК 60 мкл. Вирусную РНК количественно определяют с помощью количественной RT-PCR (QuantiTect Probe RT-PCR, Qiagen) с использованием 5 мкл вирусной РНК, праймеров Mastermix, двух праймеров специфичных для семейства Picornaviridae и праймеров Pan-Picornaviridae, и зонда Picornaviridae с репортерно-гасящими красителями FAM-TAMRA. Включаются четыре разбавления известной концентрации риновируса A16, а также контролей извлечения РНК и RT-PCR, и планшеты запускают на TaqMan ABI 7000 от Applied Biosystems. Данные отсчетов (“Ct”) приводят для стандартной кривой, корректируют на разбавления и представляют, как количество копий генома/мл. Фигуры 14-16 и 17A, 17B и 17C иллюстрируют результаты репликации риновируса A16. Как можно увидеть риновирус показывает значительную репликацию, которая ингибируется рупинтривиром. Значительных изменений репликаций риновируса не достигается при использовании препаратов HRV1 и HRV2. Нанесение препаратов HRV3 дает в результате соотношение дозы и реакции схожие с рупинтривиром. Препараты HRV4 показывают зависимую от дозы реакцию на репликацию риновируса A16 до значительно большей степени чем для обработки рупинтривиром.
Анализ с помощью связанных ферментов на лектине
[0272] Выделение муцина количественно определяют с использованием протокола анализа с помощью связанных ферментов на лектине (“ELLA”), детектирующего группы углеводов собранной слизи. 96-луночные планшеты покрывают 6 мкг/мл лектина из Triticum vulgaris (пшеница) (Sigma, L0636) в фосфатном буферном растворе (“PBS”), доводят до pH 6,8 и инкубируют в течение 1 часа при 37°C. После стадии промывки в фосфатном буферном солевом растворе (PBS) с высоким содержанием соли (0,5 M NaCl, 0,1% Tween-20 в PBS), образцы и стандарты (муцин из свиного желудка типа II, Sigma, M2378) инкубируют в течение 30 минут при 37°C. После промывки, планшеты инкубируют 30 минут при 37°C в растворе для детектирования, содержащем 1 мкг/мл лектина из Glycine Max (соевые бобы) конъюгированного с пероксидазой (Sigma, L2650), в 0,1% BSA-PBS доведенном до pH 7,4. После конечных стадий промывки, добавляют субстратный реагент (TMB) и инкубируют в течение 10 минут в темноте при комнатной температуре. Реакцию останавливают с помощью 2 н H2SO4 и планшеты считывают на 450 нм. Фигуры 18-21 иллюстрируют количество муцина из апикальной среды через 24 и 48 часов. Как можно увидеть, исследуемые препараты HRV не оказывают значимого воздействия на выделение муцина.
Пример 5: измерения композиций на 3d модели полностью дифференцированных клеток эпителия дыхательных путей человека, инокулированных гриппом A H1N1
[0273] Эпителий (популяцию MucilAir™) разбавляют смесью клеток, выделенных у 14 различных нормальных назальных доноров, и культивируют в течение 41 дня. Композиции с различными активными ингредиентами приготавливают, как показано в Таблице 6. Каждую композицию приготавливают в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). Как используется в настоящем документе, “IAV1” относится к композициям, содержащим аполактоферрин (то есть, IAV1-1, IAV 1-2 и IAV 1-3), упоминание “IAV2” относится к композициям, содержащим лизозим (то есть, IAV 2-1, IAV 2-2 и IAV 2-3), и упоминание “IAV3” относится к композициям, содержащим растворимый ICAM-1 (то есть, IAV 3-1, IAV 3-2 и IAV 2-3). Упоминание “IAV4” относится к иллюстративным композициям, содержащим сочетание аполактоферрина, лизозима, 3’-сиалиллактозы и 6’-сиалиллактозы. Эти различные исследуемые препараты показаны ниже в Таблице 6.
Таблица 6
6’-сиалиллактоза (327 мкг/мл)
6’-сиалиллактоза (3,27 мкг/мл)
6’-сиалиллактоза (0,327 мкг/мл)
Лизозим (2500 мкг/мл)
3’-сиалиллактоза (327 мкг/мл)
6’-сиалиллактоза (327 мкг/мл)
Лизозим (250 мкг/мл)
3’-сиалиллактоза (3,27 мкг/мл)
6’-сиалиллактоза (3,27 мкг/мл)
Лизозим (25 мкг/мл)
3’-сиалиллактоза (0,327 мкг/мл)
6’-сиалиллактоза (0,327 мкг/мл)
[0274] 20 мкл каждого препарата наносят апикально на отдельные популяции MucilAir™ непосредственно перед инокуляцией гриппом A H1N1. 20 мкл каждого препарата также наносят через 3,5 и 24 часа после инокуляции. Инокуляция гриппом A H1N1 (t=0) достигается посредством нанесения 50 мкл 2×106/мл H1N1 (клинический штамм: A/California/7/09) на апикальную сторону ткани MucilAir™ в течение 3 часов при 34°C, 5% CO2. Исходные растворы вирусов получают в культурах MucilAir™ и разбавляют в культурной среде без очистки или концентрирования. Измерения относительно TEER, высвобождения LDH, CBF, MCC и выделения муцина осуществляют образом идентичным в остальном тому, как описано выше, за исключением того, что используют 10 мкМ озельтамивира вместо руптинивира для препарата с противовирусным воздействием. Для противовирусного воздействия, 10 мкМ озельтамивира добавляют к базальной среде. Исходный раствор кислоты озельтамивира (Carbosynth), 4 мМ в DMSO (-20°C) разбавляют до 10 мкМ в базолатеральной среде MucilAir™ (конечная концентрация 0,25% DMS).
Измерения TEER
[0275] Фигуры 22-25 иллюстрируют результаты измерений TEER для гриппа A H1N1. Как можно увидеть, цитопатологическое воздействие вируса гриппа вызывает уменьшение измеренного сопротивления TEER. Исследуемые препараты IAV3 и IAV4 очевидно ограничивают уменьшение TEER через 48 часов (D2) pi, при этом уменьшение потерь сопротивления выражено сильнее всего в препаратах, содержащих более высокие концентрации активных веществ (то есть, IAV4-2 и IAV4-1).
Высвобождение лактатдегидрогеназы
[0276] Фигуры 26-29 иллюстрируют результаты для высвобождения LDH из эпителиальных клеток. Как можно увидеть, не наблюдается цитотоксического воздействия для любого из препаратов IAV.
Частота биения ресничек
[0277] Фигуры 30-33 иллюстрируют воздействия различных видов обработки на CBF эпителиальных клеток с инфекцией гриппа H1N1. Как можно увидеть, IAV4 не показывает значительного воздействия на CBF.
Мукоцилиарный клиренс
[0278] Фиг.34 иллюстрирует результаты для мукоцилиарного клиренса после обработки указанными исследуемыми препаратами. Как можно увидеть, препараты IAV не показывают значительного воздействия на мукоцилиарный клиренс.
Апикальная репликация гриппа
[0279] Из 200 мкл апикальных промывок, 20 мкл используются для извлечения вирусной РНК с помощью набора QIAamp® Viral RNA (Qiagen) с получением в результате объема элюирования РНК 60 мкл. Вирусную РНК количественно определяют с помощью количественной RT-PCR (QuantiTect Probe RT-PCR, Qiagen) с использованием 5 мкл вирусной РНК, праймеров Mastermix, двух праймеров специфичных к гриппу A и зонда гриппа A с репортерно-гасящими красителями FAM-BHQ1. Включаются четыре разбавления известной концентрации H1N1, а также контроли для извлечения РНК и RT-PCR, и планшеты запускают на TaqMan ABI 7000 от Applied Biosystems. Данные Ct приводятся к стандартной кривой, корректируются на разбавления и представляются как количество копий генома/мл. Фигуры 35-38 иллюстрируют результаты для репликации гриппа A HIN1 в присутствии указанного исследуемого препарата. Как можно увидеть, грипп показывает значительную репликацию, которая ингибируется озельтамивиром. Значительного изменения репликации грипп A H1N1 не достигается при использовании препаратов IAV.
Анализ с помощью связанных ферментов на лектине
[0280] Фигуры 39-42 иллюстрируют количество муцина из апикальной среды через 24 (D1) и 48 (D2) часов pi. Как можно увидеть, IAV4 показывает доза-зависимую реакцию при выделении муцина.
[0281] Как показано с помощью измерений TEER, инфицирование H1N1 дает в результате потерю целостности тканей в эпителии дыхательных путей человека, что приводит в результате к разрушению барьерной функции дыхательных путей. Это дает в результате дальнейшее инфицирование и воспаление. Уменьшение TEER представляет собой самый ранний и наиболее чувствительный параметр, на который влияет инфицирование H1N1. Сочетание препаратов IAV3 и IAV4 дает в результате частичное ослабление этого разрушения целостности тканей. В дополнение к этому, эти препараты предотвращают любые отрицательные воздействия на CBF, которые видны у препаратов IAV1 и IAV2.
Пример 6: измерения композиций на 3d модели полностью дифференцированных клеток эпителия дыхательных путей человека, инокулированнных риновирусом A16
[0282] Эпителий (популяцию MucilAir™) разбавляют смесью клеток, выделенных у 14 различных нормальных назальных доноров, и культивируют в течение 41 дней. Композиции с различными активными ингредиентами приготавливают, как показано в Таблице 7. Каждую композицию приготавливают в буферном солевом растворе (3,6% NaCl, 5,00 мМ CaCl2, 40 мМ HEPES). Как используется в настоящем документе, наименование композиций могут указывать каждый активный ингредиент (они разделены знаками “+”), где каждый индивидуальный активный компонент обозначается как “R1,” “R2,” “R3” или “R4.” Как используется в настоящем документе, обозначения “L” и “H” в наименованиях композиций, когда они присутствуют, относятся к более низким и более высоким концентрациям указанного компонента, соответственно, по сравнению друг с другом (то есть, [R1L] < [R1H]). Например, композиция, указанная как “R1L+R2H”, как предполагается, обозначает композицию, которая содержит активный ингредиент R1 (то есть, аполактоферрин) и активный ингредиент R2 (то есть, лизозим) при указанных концентрациях. Как используется в настоящем документе, “R1” в наименовании композиции относится к композициям, содержащим аполактоферрин (то есть, R1L, R1H, R1H+R2H, R1H+R2L, R1H+R3H, R1L+R2L+R3H, R1L+R2L+R4H), упоминание “R2” относится к композициям, содержащим лизозим (то есть, R2L, R2H, R1H+R2H, R1L+R2L, R1H+R2L, R1L+R2H, R2H+R3H), упоминание “R3” относится к композициям, содержащим растворимый ICAM-1 доступный от RnD Biosystems (то есть, R3, R1H+R3 и R1L+R2L+R3), и упоминание “R4” относится к композициям, содержащим растворимый ICAM-1 доступный от Planet Biotechnology (то есть, R4, R1H+R4 и R1L+R2L+R4). Эти различные исследуемые препараты показаны ниже в Таблице 7.
Таблица 7
Лизозим (5 мг/мл)
Лизозим (2,5 мг/мл)
Лизозим (5 мг/мл)
Растворимый ICAM-1 (0,5 мг/мл)
Лизозим (2,5 мг/мл)
Растворимый ICAM-1 (0,5 мг/мл)
Лизозим (2,5 мг/мл)
Растворимый ICAM-1 (0,5 мг/мл)
[0283] Для сравнения потенциальных воздействий композиций, включаются положительные контроли. Для контроля токсического воздействия (“Vehicle(+)”), культуры вирусов обрабатывают 10% Triton X-100 в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 0 мМ HEPES). Для противовирусного контроля, добавляют 5 мкМ рупинтривира (“Rup”) к базальной среде и лекарственную среду на апикальную сторону. Исходный раствор рупинтривира (Santa Cruz Biotechnologies) 2 мМ в DMSO (-20°C) разбавляют до 5 мкМ в среде MucilAir™ (конечная концентрация 0,25% DMSO).
[0284] 20 мкл каждого препарата наносят апикально на отдельные популяции MucilAir™ непосредственно перед инокуляцией (время=0) риновирусом человека A16. 20 мкл каждого из препаратов также наносят через 3,5 и 24 часов после инокуляции (“pi”), после апикальной промывки среды, в каждой временной точке, как описано ниже. Инокуляция риновирусом человека A16 достигается посредством нанесения 50 мкл 2×106/мл риновируса человека A16 (клинический штамм: QCHRV,16) на апикальную сторону 3D модели в течение 3 часов при 34°C, 5% CO2. Исходные растворы вирусов получают в культурах MucilAir™ и разбавляют в культурной среде без очистки или концентрирования.
[0285] После инокуляция (время=0), эпителий промывают три раза культурной средой MucilAir™ для очистки от инокулума. Эта промывка устраняет все вирусные частицы, которые не процессируются тканями, для устранения любого загрязнения в ходе последующего количественного определения продуцирования активного вируса (следующее измерение через 24 часа). Эффективность промывки может характеризоваться измерением копий генома через 3,5 час (смотри фигуры 43 и 44). Не содержащие клеток апикальные промывки (20 минут) с помощью 200 мкл культурных сред MucilAir™ собирают через 3,5 часа после инокулирования, а затем через 24 и через 48 часов pi и хранят при -80°C для дальнейших измерений.
Апикальная репликация риновируса
[0286] Из 200 мкл апикальных промывок, 20 мкл используются для извлечения вирусной РНК с помощью набора QIAamp® Viral RNA (Qiagen) с получением в результате объема элюирования РНК 60 мкл. Вирусную РНК количественно определяют с помощью количественной RT-PCR (QuantiTect Probe RT-PCR, Qiagen) с использованием 5 мкл вирусной РНК, Mastermix (двух праймеров специфичных к семейству Picornavidridae и праймеров Pan-Picornaviridae, и зонда Picornaviridae с репортерно-гасящими красителями FAM-TAMRA). Включаются четыре разбавления известной концентрации риновируса A16, а также контроли для извлечения РНК и RT-PCR, и планшеты запускают на TaqMan ABI 7000 от Applied Biosystems. Данные Ct приводятся к стандартной кривой, корректируются на разбавления и представляются как количество копий генома/мл. Фигуры 43-46 иллюстрируют результаты для репликации риновируса A16 в присутствии указанного исследуемого препарата. Количественно определенная концентрация инокуляции риновируса A16 составляет 3,73×106/мл (планируется 2×106/мл). Как можно увидеть, риновирус показывает значительную репликацию, которая ингибируется рупинтривиром.
[0287] Через 24 часа pi (“D1”), растворимый ICAM-1 ингибирует репликацию вируса HRV-A16. Однако это воздействие композиций с растворимым ICAM-1 как единственного противовирусного агента (препарат R3 или препарат R4) видимым образом уменьшается через 48 часов (“D2”). Когда растворимый ICAM-1 смешивают с аполактоферрином (препарат R1H+R3), лизозимом (препарат R2H+R3), или аполактоферрином и лизозимом (препарат R1L+R2L+R3), ингибиторное воздействие сохраняется в D2.
Мукоцилиарный клиренс (MCC)
[0288] Мукоцилиарный клиренс отслеживают с использованием камеры MAKO G030B (Allied Vision), соединенной с микроскопом Leica DMIRE2 с объективом 5x. Полистирольные микрошарики диаметром 30 мкм (Sigma, cat. no. 84135) добавляют на апикальную поверхность среды MucilAir™. Движение микрошариков отслеживают с помощью видео при 2 блоках данных в секунду для 30 изображений при 34°C. Репрезентативная коллекция изображений показана на фигурах 47A и 47B. Фиг.47A показывает репрезентативные изображения от отслеживаемого положения (представленного каждой линией) микрошариков для Vehicle(-). Фиг.47B показывает репрезентативные изображения от анализа трекинга для препарата R1L+R2L+R4. Масштабная линейка представляет 100 мкм. Снимают три фильма на одну вставку. Среднюю скорость движения шариков (мкм/сек) вычисляют с помощью программного обеспечения ImageProPlus 6.0. Результаты для каждого препарата показаны на Фиг.48. Как можно увидеть, препараты не обеспечивают значительного изменения измеренного мукоцилиарного клиренса.
Высвобождение лактатдегидрогеназы (LDH)
[0289] Лактатдегидрогеназа представляет собой стабильный цитоплазматический фермент, который быстро высвобождается в культурную среду при разрыве цитоплазматической мембраны. 100 мкл базолатеральной среды собирают через 24 и 48 часов pi и инкубируют вместе с реакционной смесью Cytotoxicity Detection KitPLUS, следуя инструкциям производителя (Sigma, Roche, 11644793001). Количество высвобожденной LDH количественно определяют с использованием поглощения каждого образца на 490 нм с помощью считывающего устройства для микропланшетов. Высокое контрольное значение получают посредством обработки 10% Triton X-100 за 24 часа до анализа, и оно соответствует 100% цитотоксичности. Отрицательные контроли (Mock (-) и Vehicle(-) соответствуют физиологическому высвобождению LDH в MucilAir™. Фиг.49 иллюстрирует результаты для высвобождения LDH из эпителиальных клеток. Как можно увидеть, цитотоксического воздействия не наблюдается для каждого из препаратов.
Пример 7: измерения композиций на 3d модели полностью дифференцированных клеток эпителия дыхательных путей человека, инокулированных гриппом H1N1
[0290] Эпителий (популяцию MucilAir™) разбавляют смесью клеток, выделенных у 14 различных нормальных назальных доноров, и культивируют в течение 41 дня. Композиции приготавливают с различными активными ингредиентами, как показано в Таблице 8. Каждую композицию приготавливают в буферном солевом растворе лекарственной среды (3,6% NaCl, 5,00 мМ CaCl2, 40 мМ HEPES). Как используется в настоящем документе, наименования композиций могут указывать каждый активный ингредиент (они разделены знаками “+”), где каждый индивидуальный активный компонент обозначается как “I1,” “I2,” “I3” или “I4.” Например, композиция, указанная как “I1+I2”, как предполагается, обозначает композицию, которая содержит активный ингредиент I1 (то есть, аполактоферрин) и активный ингредиент I2 (то есть, лизозим) при указанных концентрациях. Как используется в настоящем документе, “I1” в наименовании композиции относится к композициям, содержащим аполактоферрин (то есть, I1, I1+I2, I1+I3, I1+I2+I3, I1+I2+I4, I1+I2+I3+I4), упоминание “I2” относится к композициям, содержащим лизозим (то есть, I2, I1+I2, I2+I3, I1+I2+I3, I1+I2+I4, I1+I2+I3+I4), упоминание “I3” относится к композициям, содержащим сиаловую кислоту (то есть, I3, I1+I3, I2+I3, I1+I2+I3, I1+I3+I4, I2+I3+I4, I3+I4 и I1+I2+I3+I4), и упоминание “I4” относится к композициям, содержащим ингибитор нейраминидазы (то есть, I4, I2+I4, I3+I4, I1+I2+I4, I1+I3+I4, I2+I3+I4, I1+I2+I3+I4). Эти различные исследуемые препараты показаны ниже в Таблице 8.
Таблица 8
3’-сиалиллактоза (0,5 мг/мл)
Лизозим (10 мг/мл)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
Лизозим (10 мг/мл)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Лизозим (10 мг/мл)
Изокверцетин (1 мкМ)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
Лизозим (10 мг/мл)
6’-сиалиллактоза (0,5 мг/мл)
3’-сиалиллактоза (0,5 мг/мл)
Изокверцетин (1 мкМ)
[0291] Для сравнения потенциальных воздействий композиций, включаются положительные контроли. Для контроля токсического воздействия (“Vehicle(+)”), культуры вирусов обрабатывают 10% Triton X-100 в буферном солевом растворе (0,9% NaCl, 1,25 мМ CaCl2, 10 мМ HEPES). Для противовирусного контроля, к базальной среде добавляют 14 мкМ озельтамивира (“Oselt”), и лекарственную среду на апикальную сторону. Исходный раствор кислоты озельтамивира (Carbosynth) 4 мМ в DMSO (-20°C) разбавляют в 10 мкМ в базолатеральной среде MucilAir™ (конечная концентрация DMSO 0,25%).
[0292] 22 мкл каждого препарата наносят апикально на отдельные популяции MucilAir™ непосредственно перед инокуляцией (время=0) гриппом H1N1. 22 мкл каждого из препаратов также наносят через 3,5 и 24 часа после инокуляции (“pi”) после апикальной промывки среды в каждой временной точке, как описано ниже. Инокуляция гриппом H1N1 достигается посредством нанесения 50 мкл 2×106/мл гриппа H1N1 (клинический штамм: A/California/7/09) на апикальную сторону 3D модели в течение 45 минут при 34°C, 5% CO2. Исходные растворы вирусов получают в культурах MucilAir™ и разбавляют в культурной среде без очистки или концентрирования.
[0293] После инокуляция (время=0), эпителий промывают три раза культурной средой MucilAir™ для очистки от инокулума. Эта промывка устраняет все вирусные частицы, которые не процессируются тканями, для устранения любого загрязнения в ходе последующего количественного определения продуцирования активного вируса (следующее измерение через 24 часа). Эффективность промывки может характеризоваться измерением копий генома через 3,5 часа (смотри фигуры 43 и 44). Не содержащие клеток апикальные промывки (20 минут) с 200 мкл культурных сред MucilAir™ собирают через 3,5 часа после инокуляции, а затем через 24 и через 48 часов pi и хранят при -80°C для дальнейших измерений.
Апикальная репликация гриппа
[0294] Из 200 мкл апикальных промывок, 20 мкл используются для извлечения вирусной РНК с помощью набора QIAamp® Viral RNA (Qiagen) с получением в результате объема элюирования РНК 60 мкл. Вирусную РНК количественно определяют с помощью количественной RT-PCR (QuantiTect Probe RT-PCR, Qiagen). Включаются разбавления известной концентрации H1N1, а также контроли для извлечения РНК и RT-PCR, и планшеты запускают на Chromo4 PCR Detection от Bio-Rad. Данные Ct приводятся к стандартной кривой, корректируются на разбавления и представляются как количество копий генома/мл. Количественно определенная концентрация инокуляции риновируса A16 составляет 7,93×105/мл (планируется 2×106/мл). Фиг.50 иллюстрирует репликацию гриппа H1N1 в присутствии указанного исследуемого препарата, как измерено по апикальным промывкам. Фиг.51 иллюстрирует репликацию гриппа H1N1 в присутствии указанного исследуемого препарата, как измерено по базальной среде. На фигурах 50 и 51, статистическая значимость показана по отношению к измерению Vehicle(+) в указанной временной точке. Количественно определенная концентрация инокуляции риновируса A16 составляет 3,73×106/мл (планируется 2×106/мл).
[0295] Как можно увидеть на Фиг.50, препараты I1+I2 (аполактоферрин и лизозим), I1+I2+I3 (аполактоферрин, лизозим и сиаловые кислоты) и I1+I2+I3+I4 (аполактоферрин, лизозим, сиаловые кислоты и изокверцетин) статистически значимо ингибируют репликацию H1N1. Кроме того, эти ингибиторные воздействия не присутствуют в препаратах, содержащих каждый индивидуальный ингредиент отдельно. Однако только из-за очень высокого титра H1N1 в культурах MucilAir™, это ингибиторное воздействие препаратов ослабляется в D2. На Фиг.51, для базальной среды, которая имеет замедленное высвобождение H1N1, видны сходные ингибиторные воздействия этих препаратов.
Измерения TEER
[0296] Фиг.52 иллюстрирует результаты измерений TEER для гриппа A H1N1 и указанных препаратов. Как можно увидеть, цитопатологическое воздействие вируса гриппа не вызывает видимого уменьшения TEER, возможно, из-за продолжительности инокуляции. Однако препараты, содержащие I4 (изокверцетин), показывают небольшое уменьшение сопротивления по сравнению с Vehicle(+) в D2.
Высвобождение лактатдегидрогеназы (LDH)
[0297] Фиг.53 иллюстрирует результаты высвобождения LDH из эпителиальных клеток, экспонируемых для гриппа H1N1 и для указанного препарата. Как можно увидеть, уменьшение TEER для нескольких препаратов с изокверцетином коррелирует с повышением цитотоксичного воздействия в D2. Однако сочетанный препарат I1+I2+I3+I4 (аполактоферрин, лизозим, сиаловые кислоты, изокверцетин) предотвращает повышение цитотоксичности, индуцируемое H1N1 за 5% пороговый предел. Это воздействие не наблюдается в других препаратах, содержащих изокверцетин.
[0298] Имея это описанное подробно некоторое количество предпочтительных вариантов осуществления настоящего изобретения, необходимо понять, что настоящее изобретение, определенное с помощью приведенных абзацев, не должно ограничиваться конкретными деталями, приведенными в описании, выше, поскольку множество очевидных его вариантов возможно без отклонения от духа или рамок настоящего изобретения.
[0299] Все документы, цитируемые или упоминаемые в настоящем документе, и все документы, цитируемые или упоминаемые в документах, цитируемых в настоящем документе, вместе с любыми инструкциями производителя, описаниями, спецификациями продуктов и технологическими картами продуктов для любых продуктов, рассмотренных в настоящем документе или в любом документе, включенном в качестве ссылки в настоящий документ, тем самым включаются в качестве ссылок и могут использоваться при осуществлении настоящего изобретения.
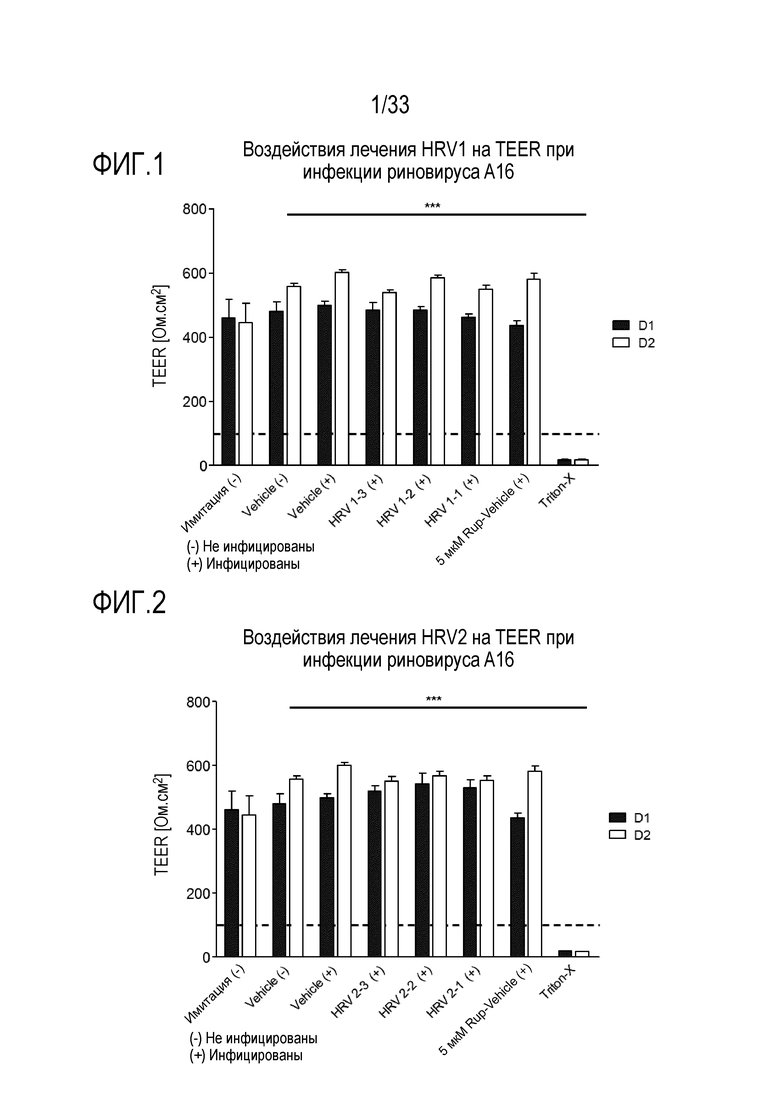
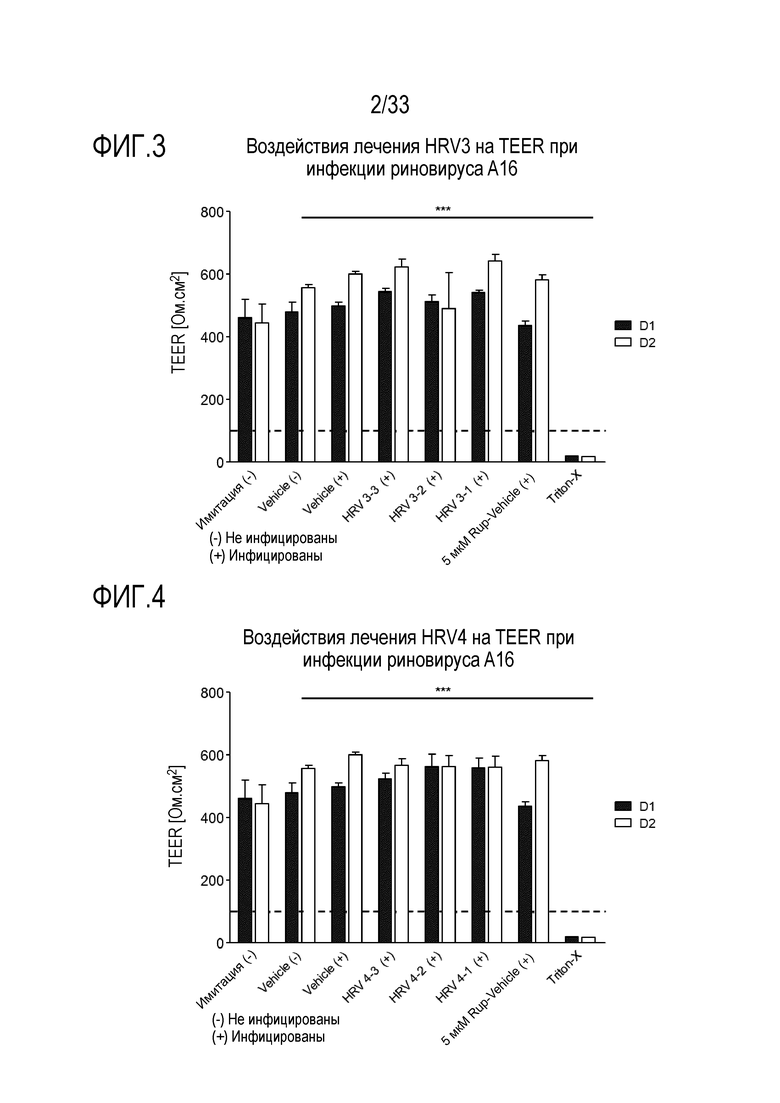
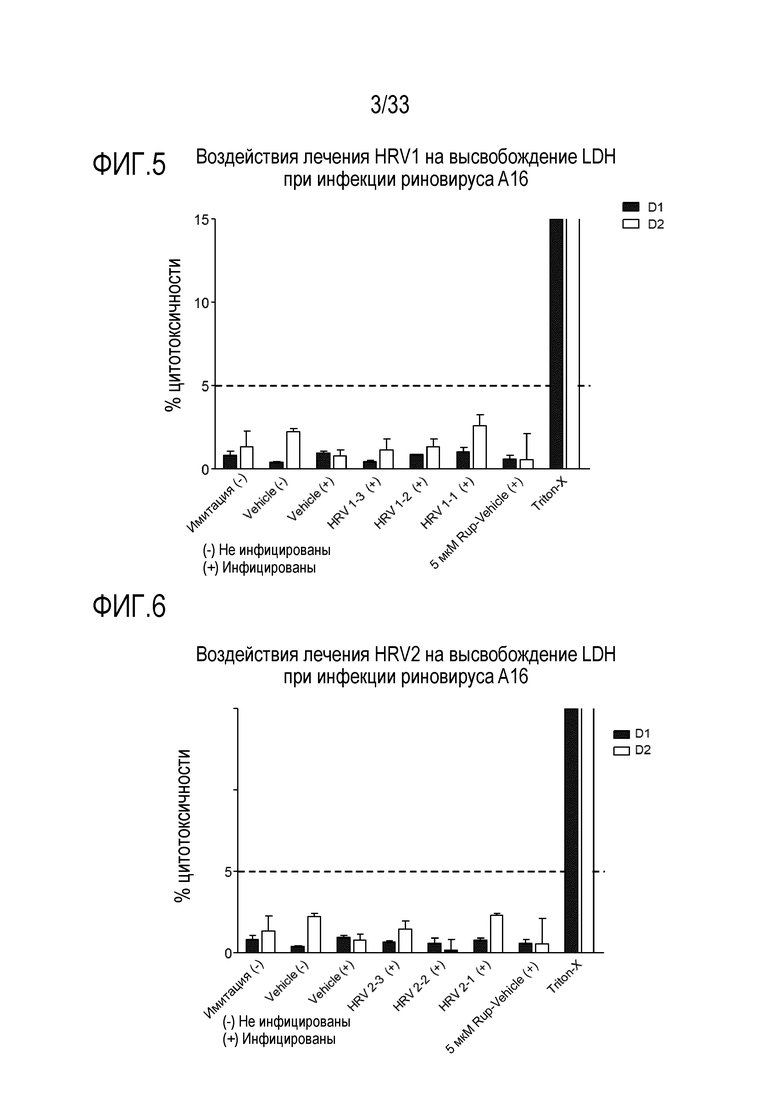
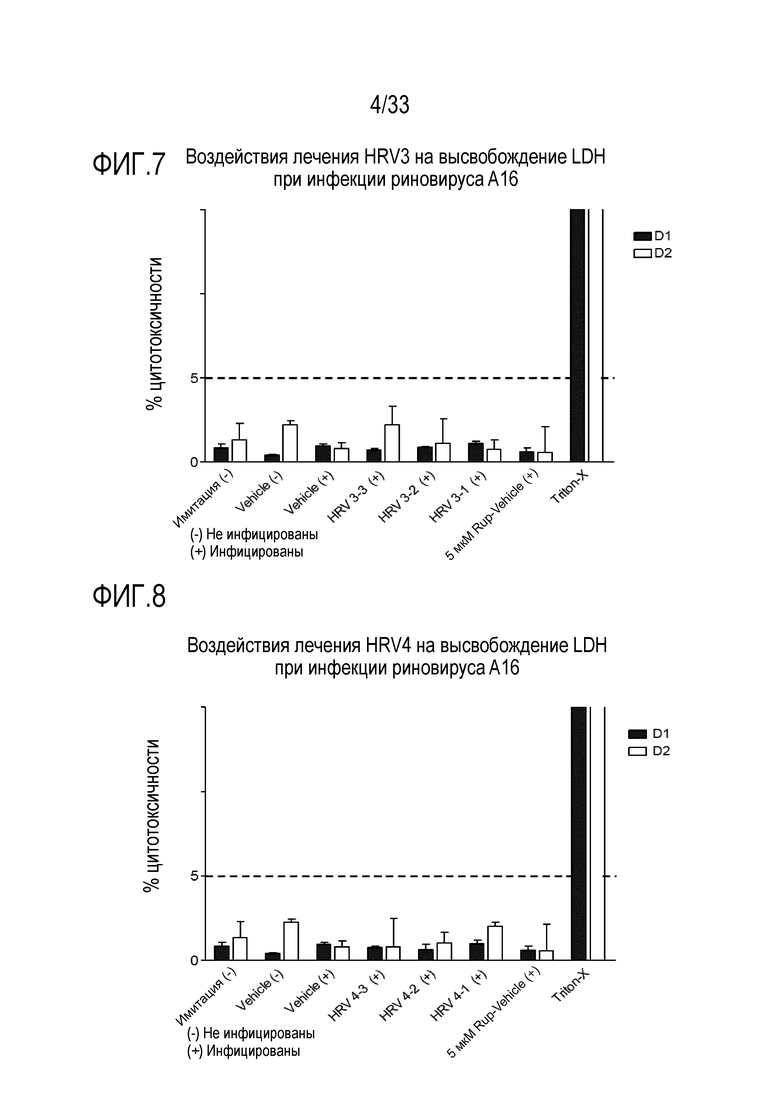
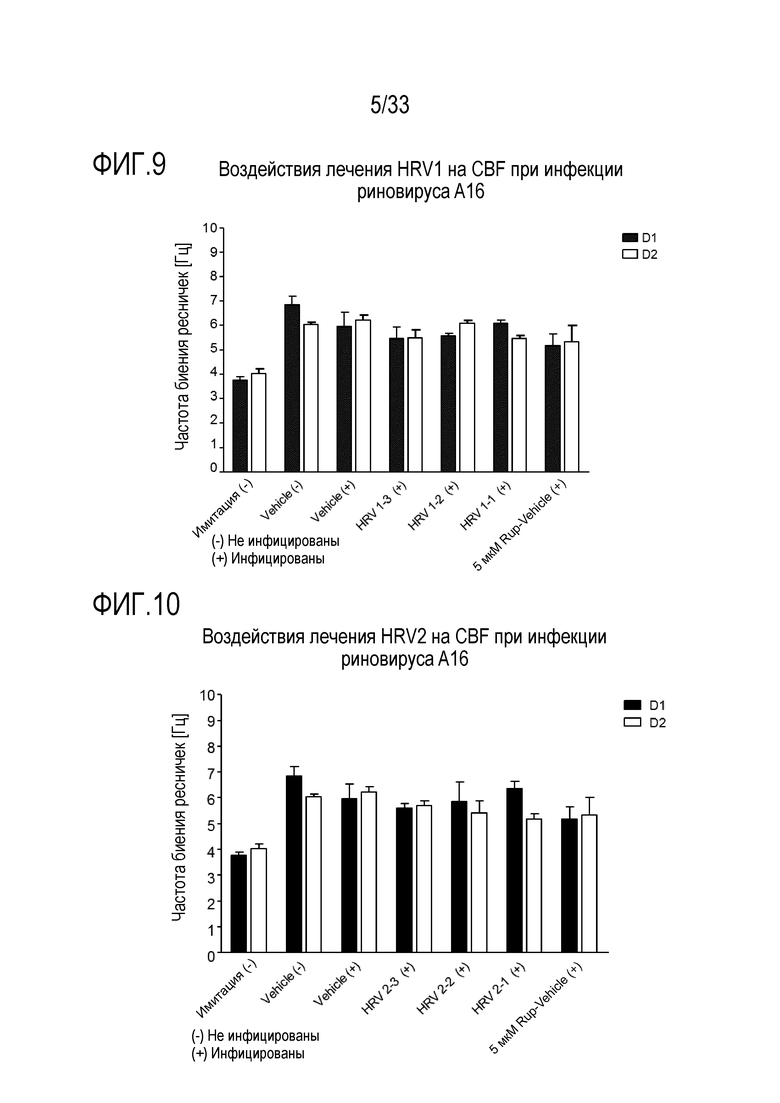
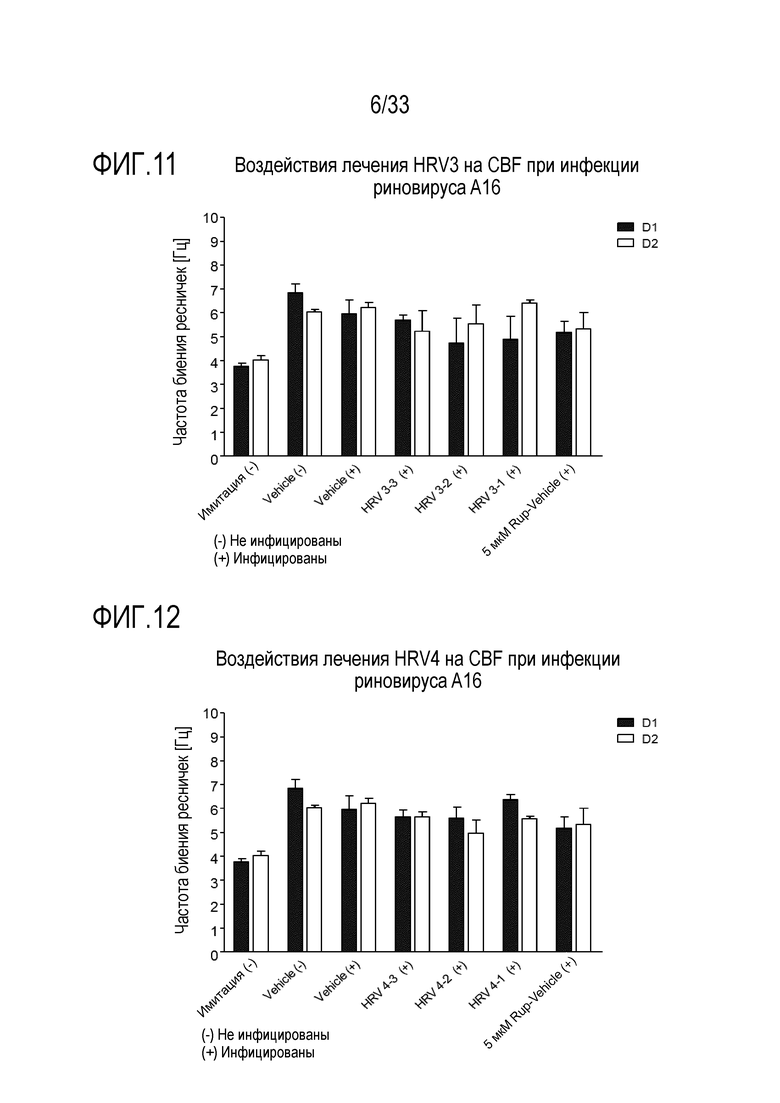
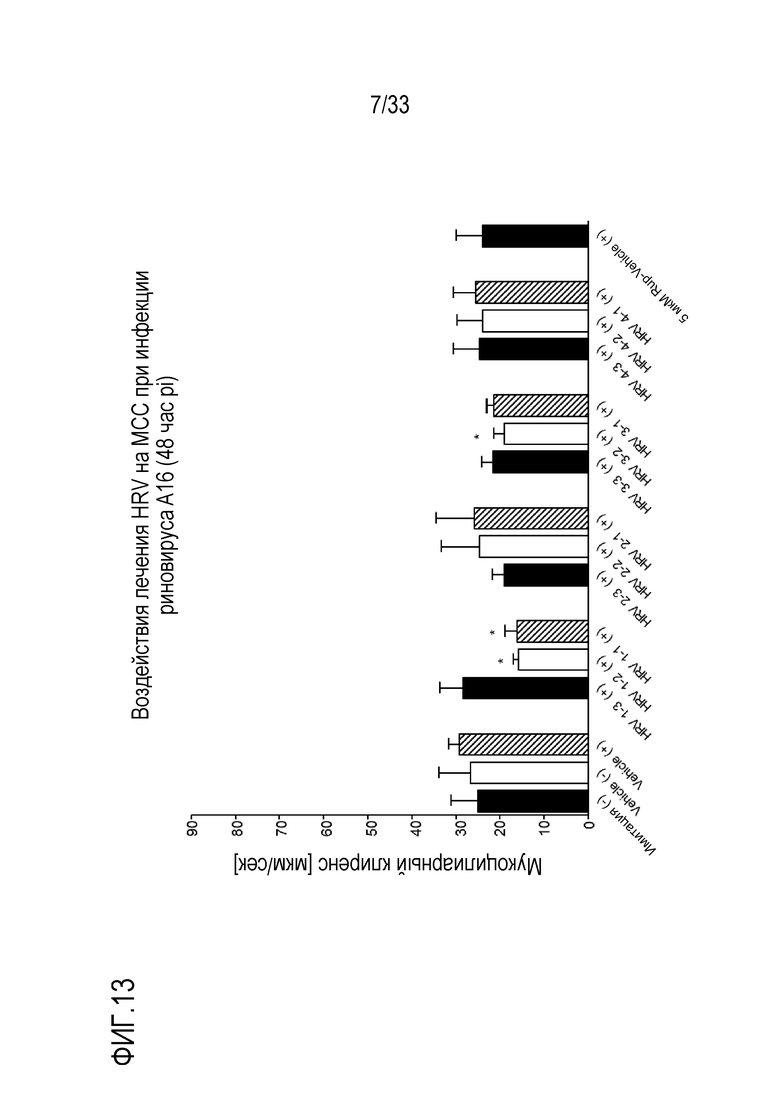
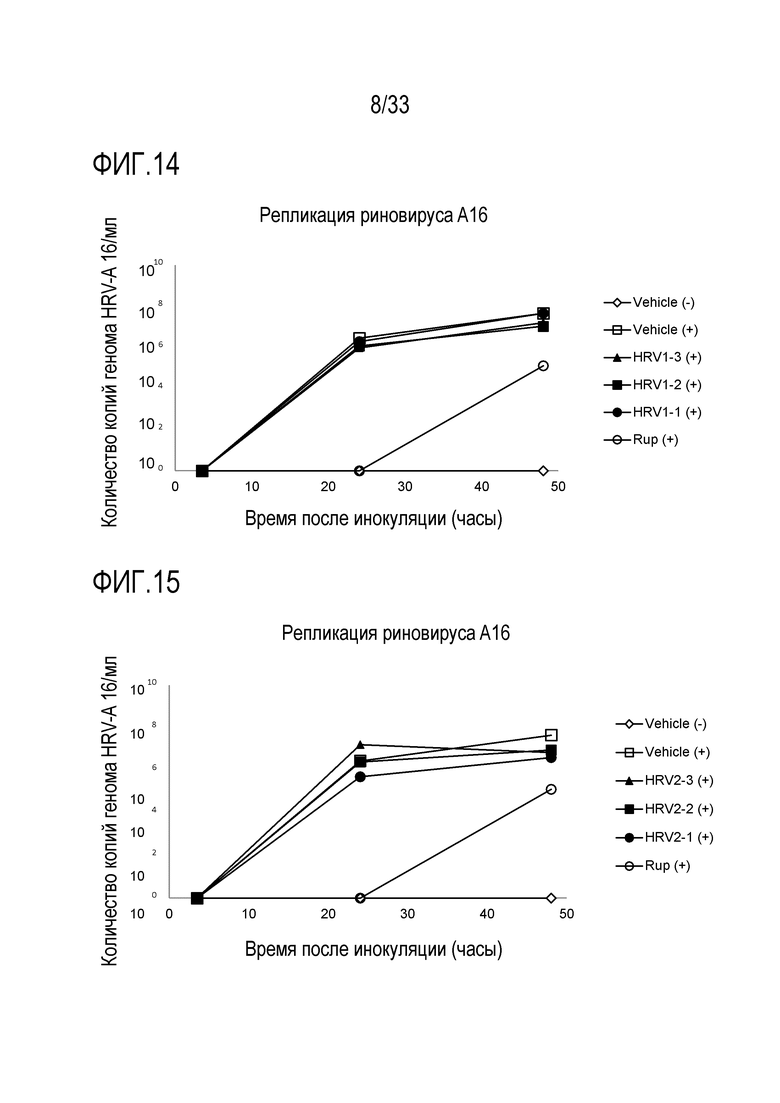
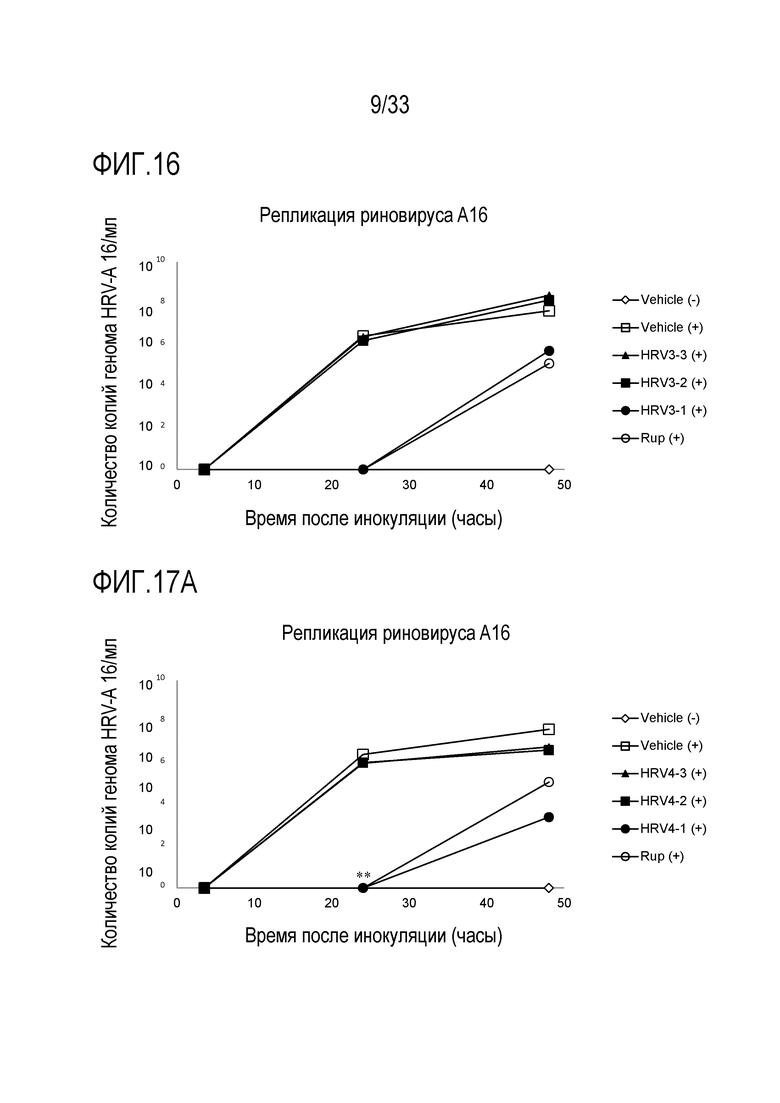
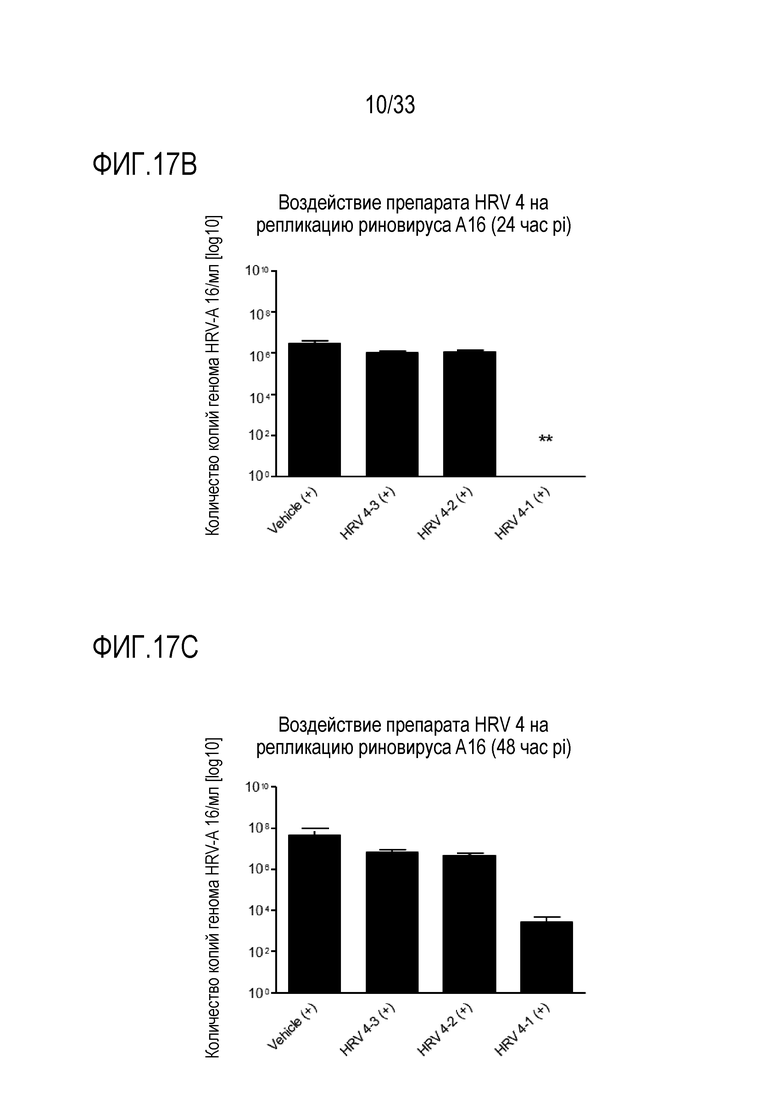
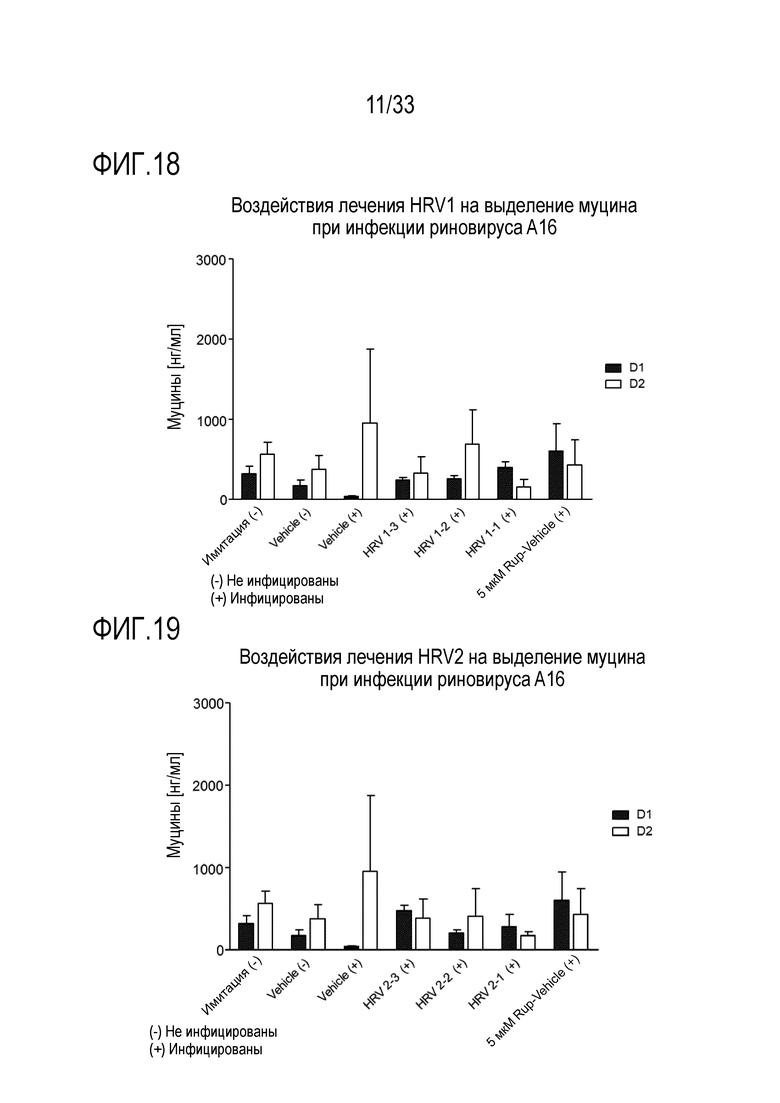
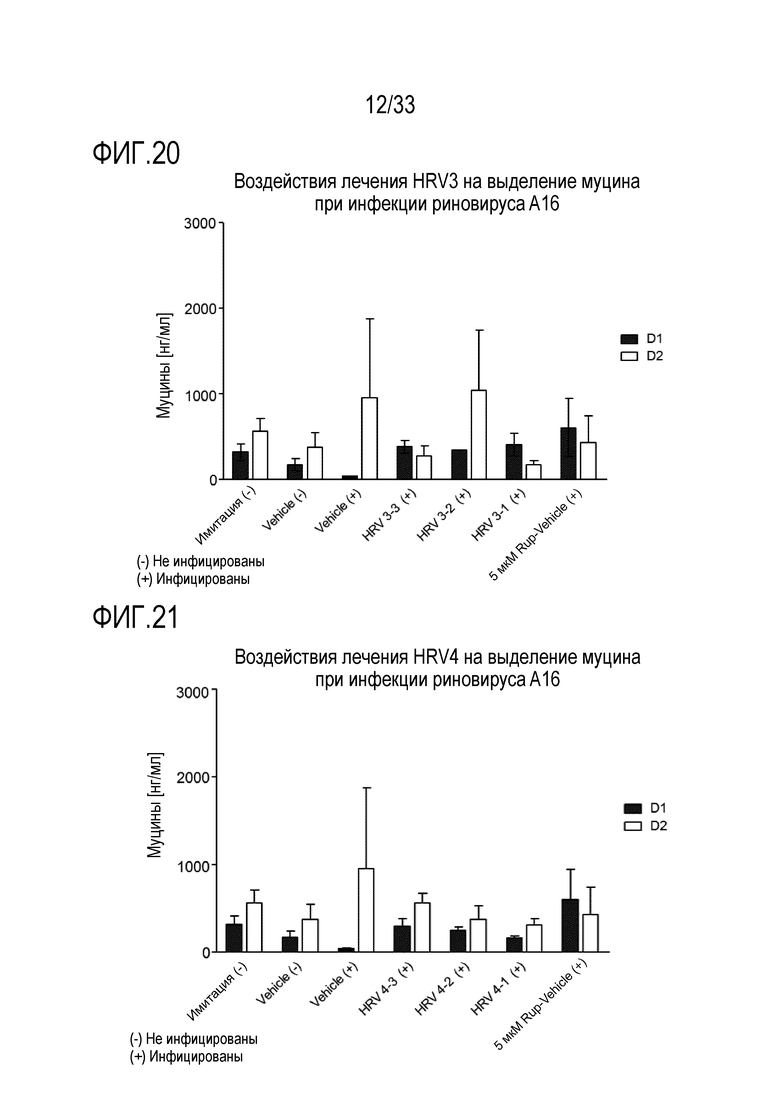
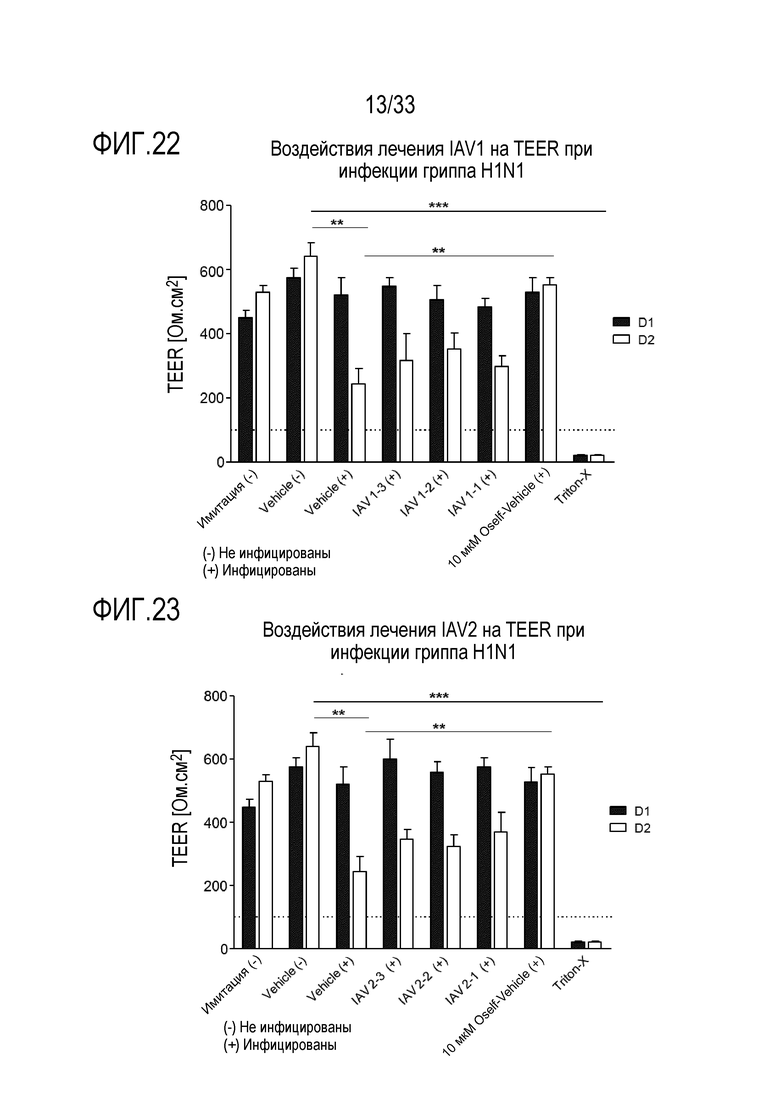
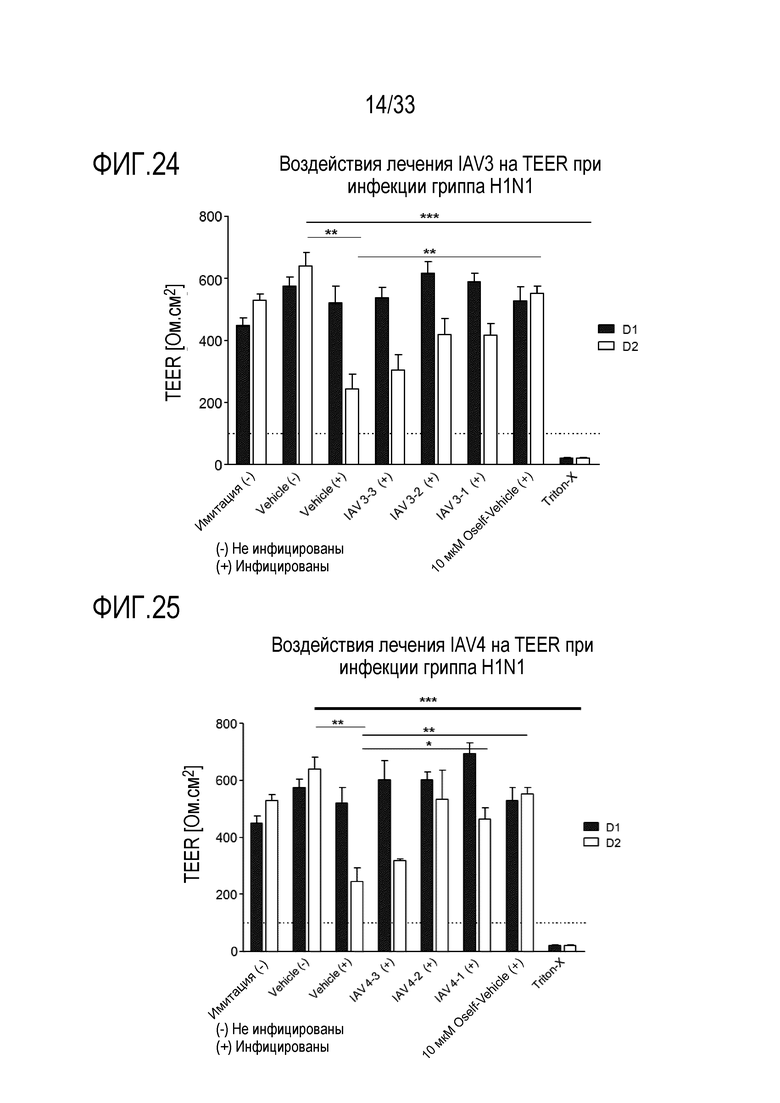
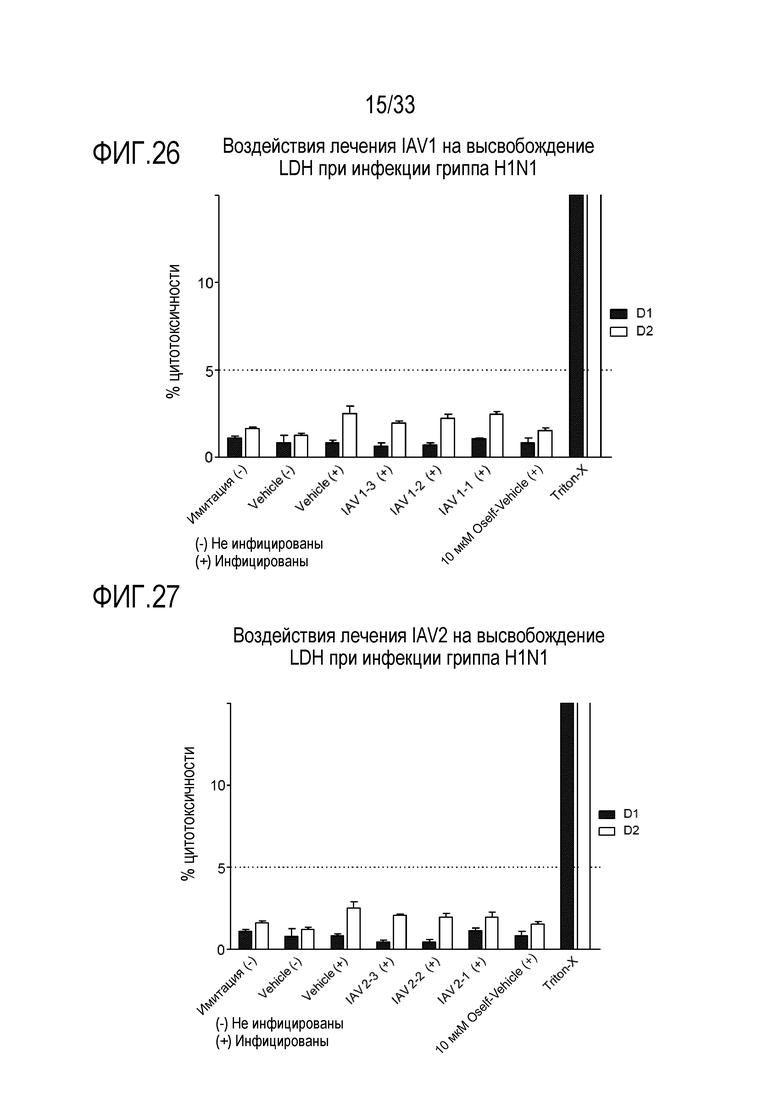
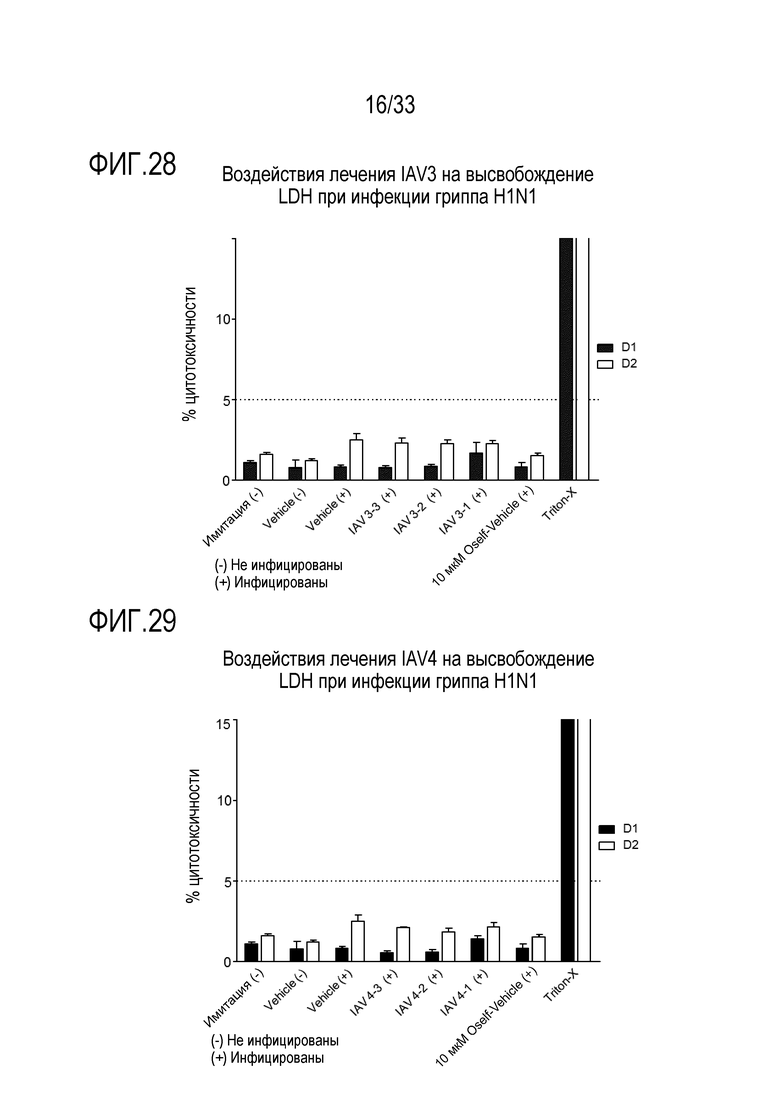
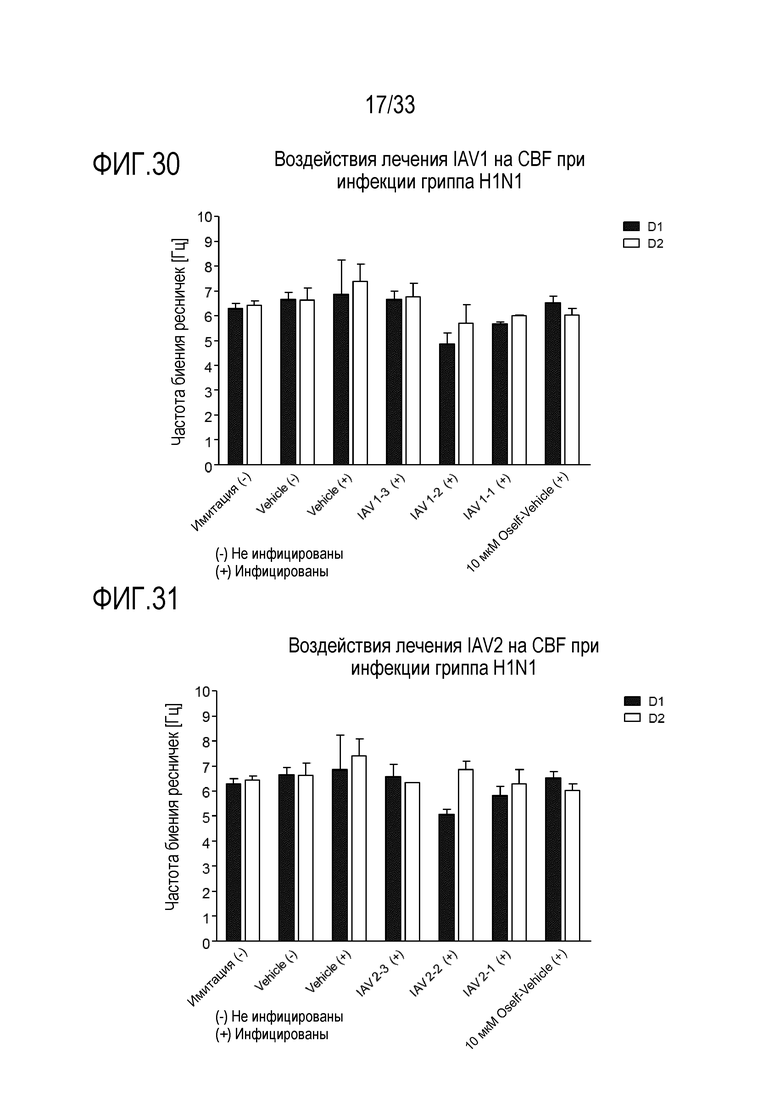
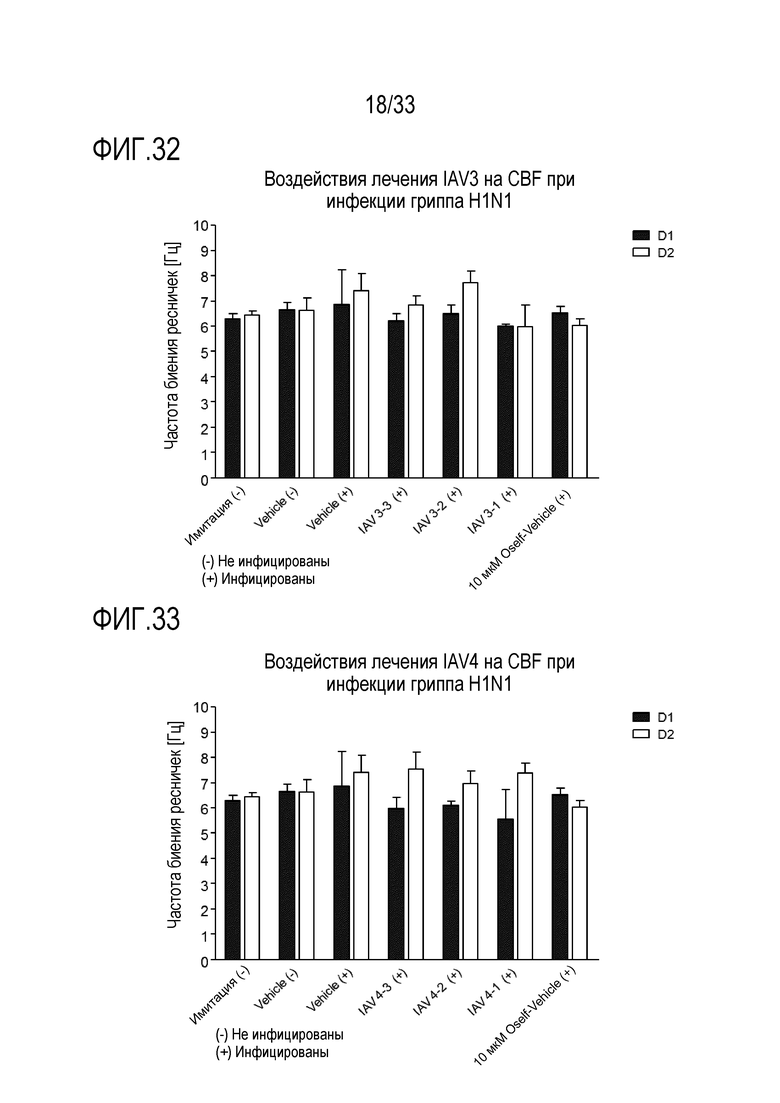
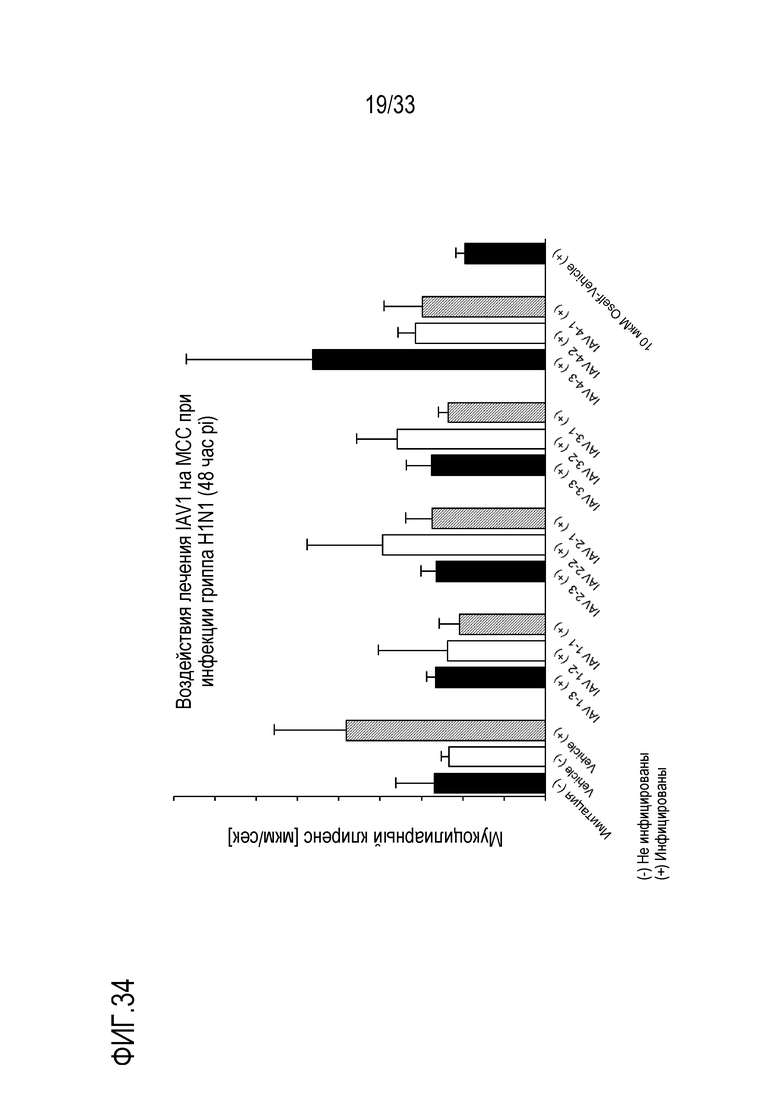
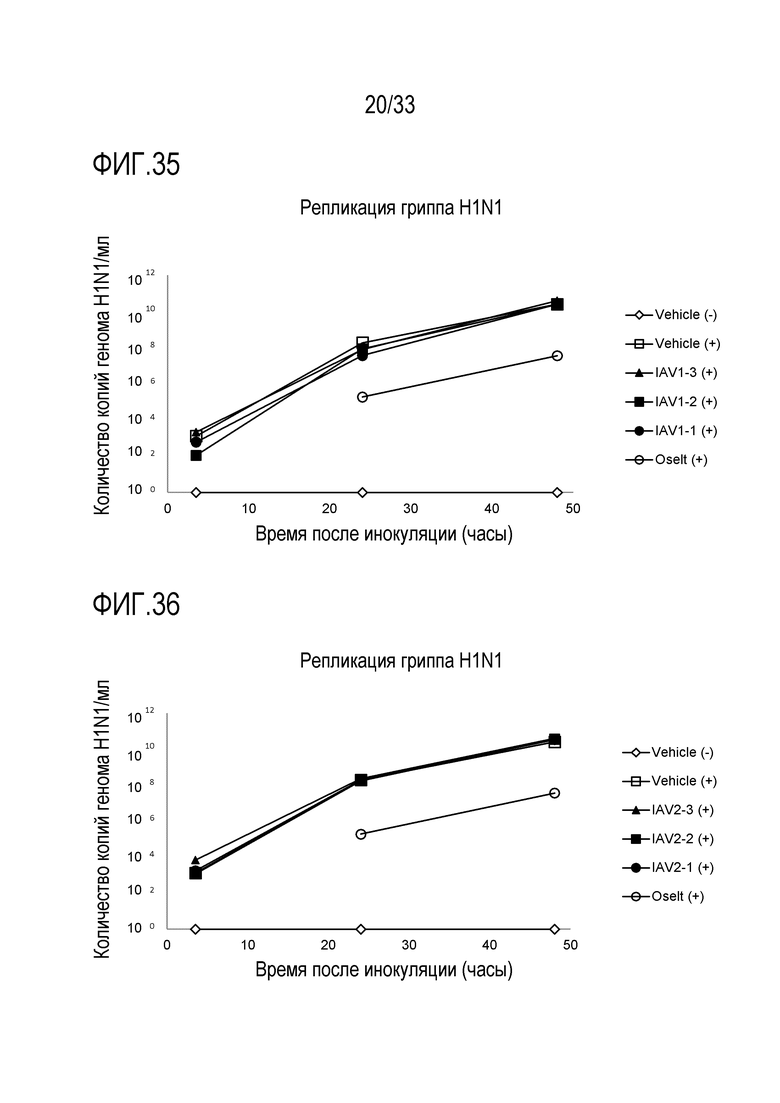
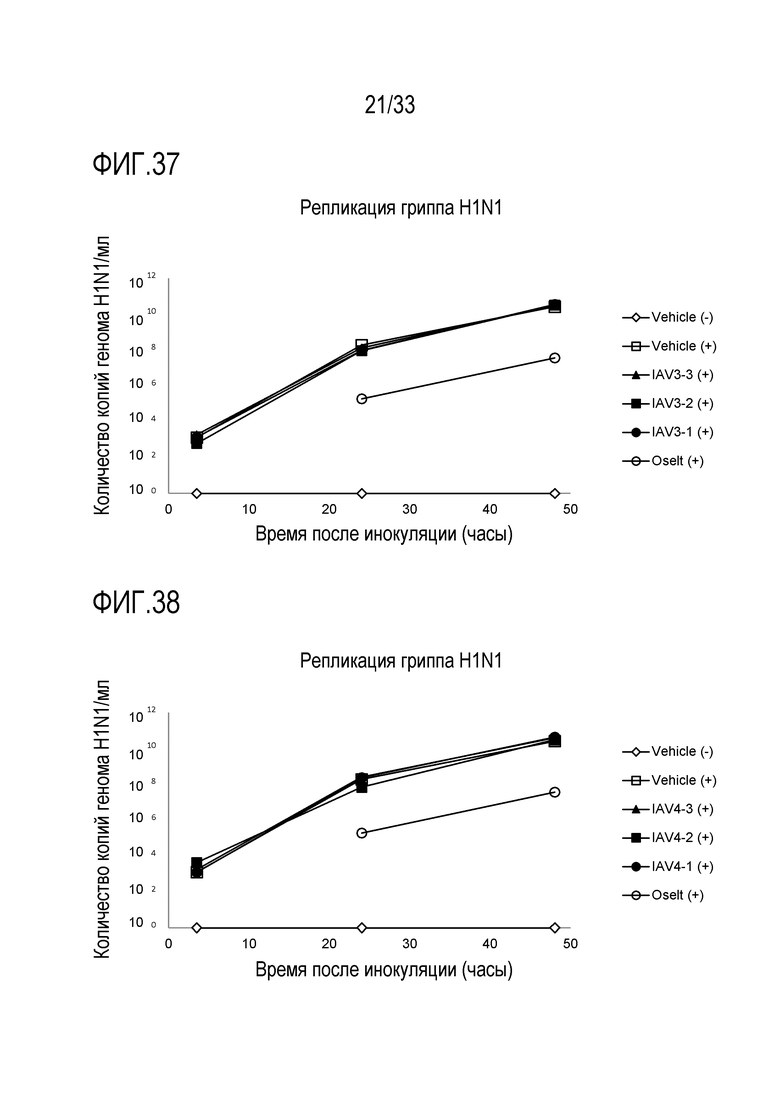
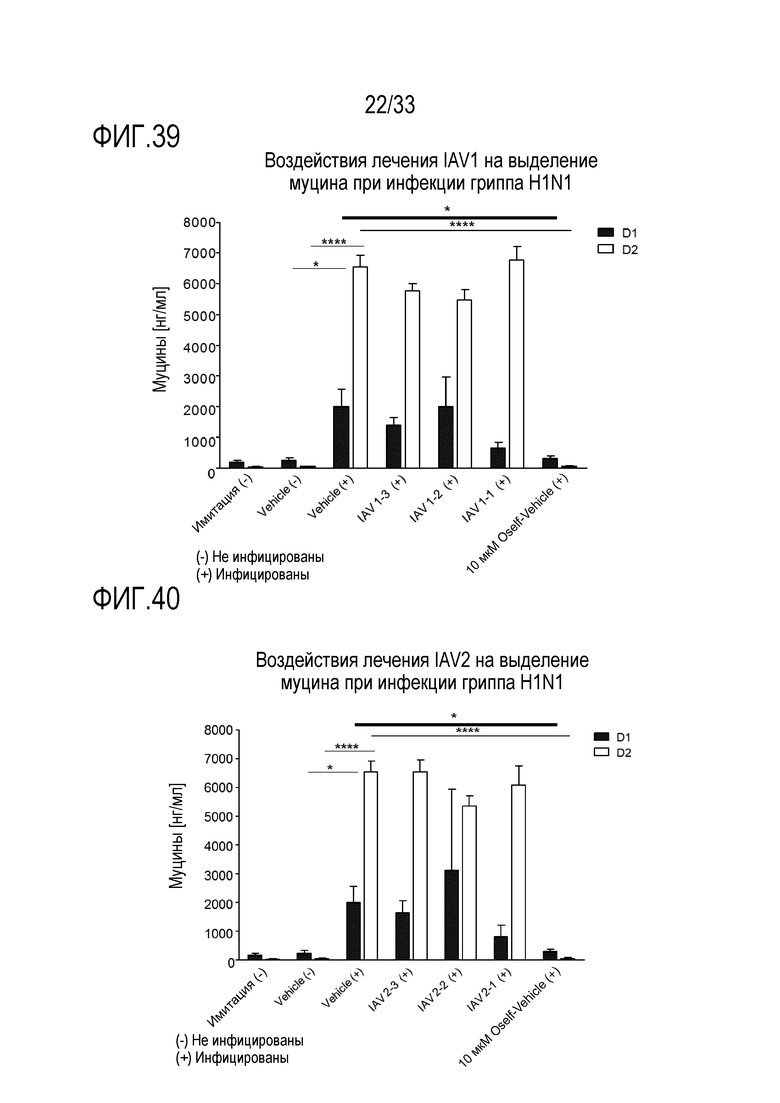
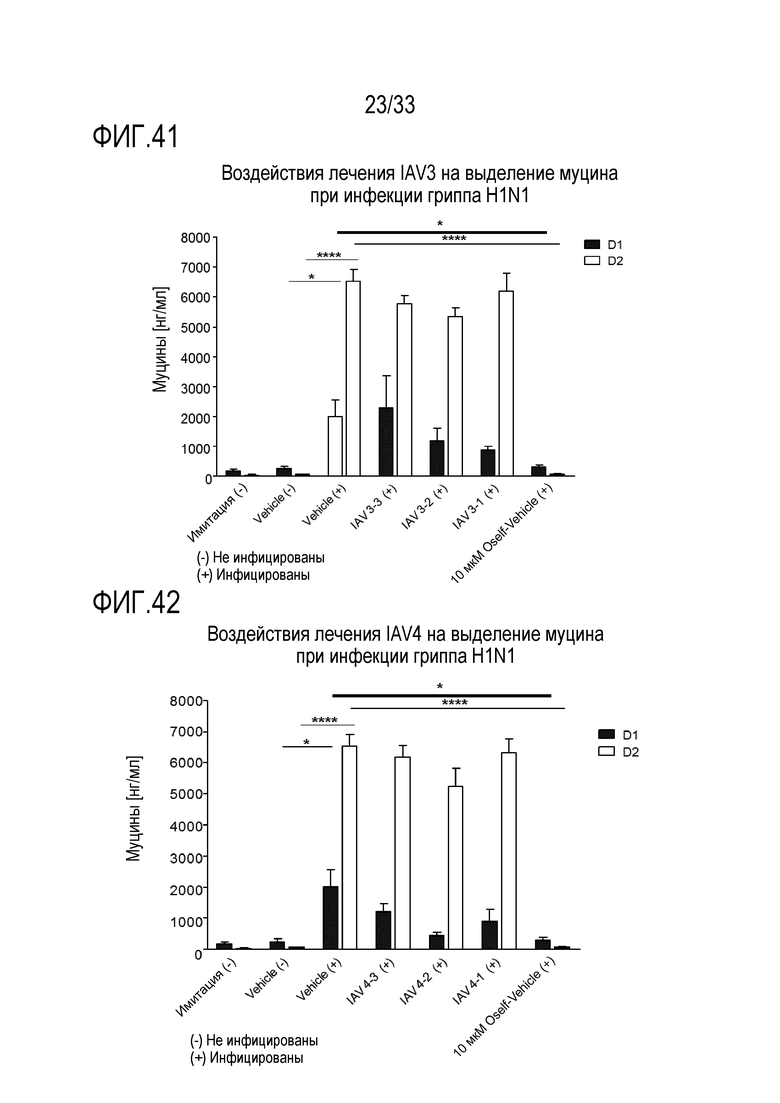
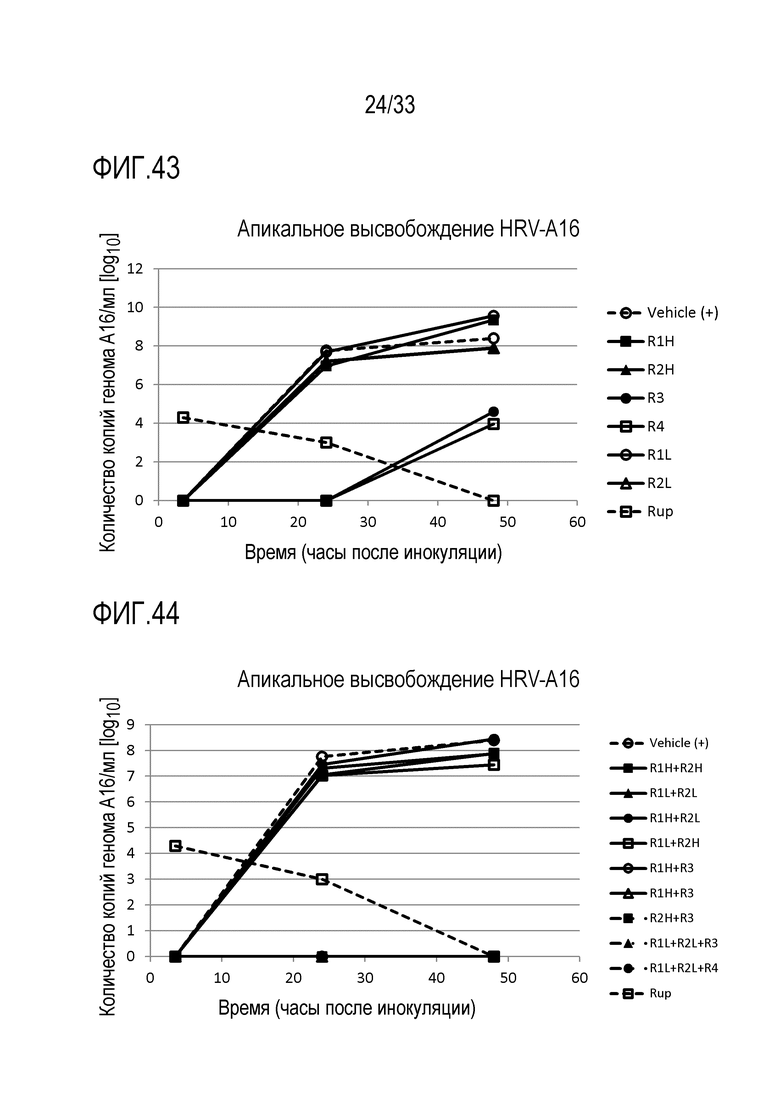

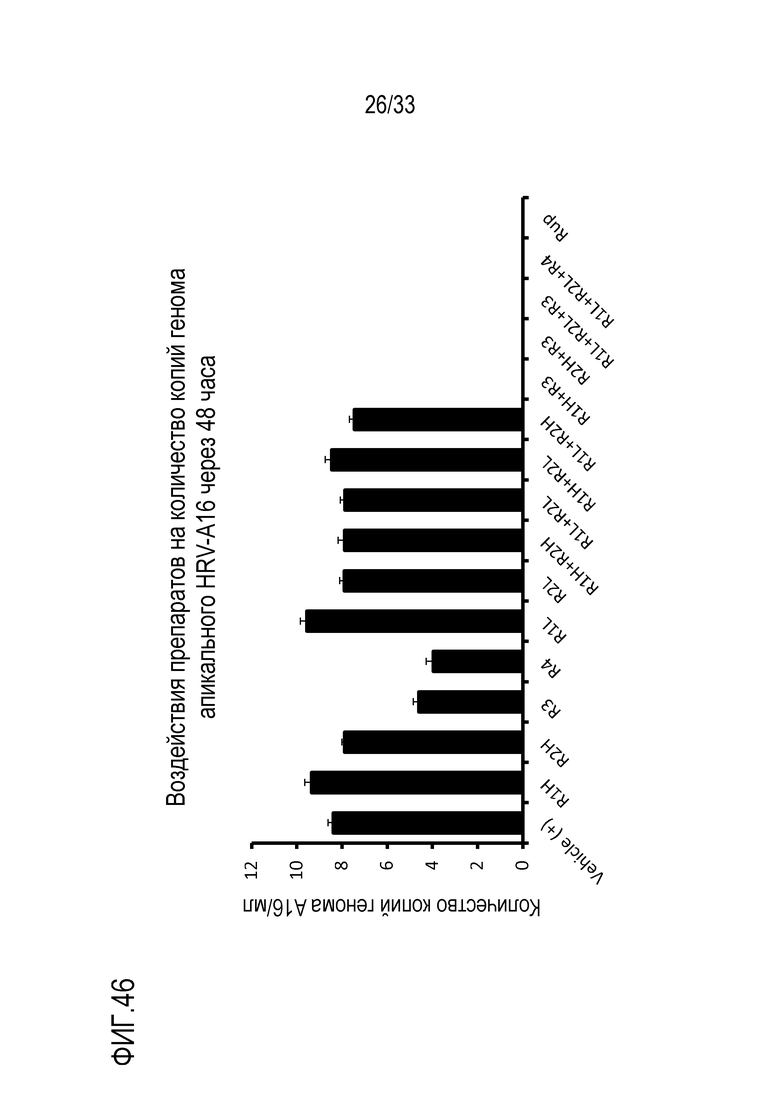
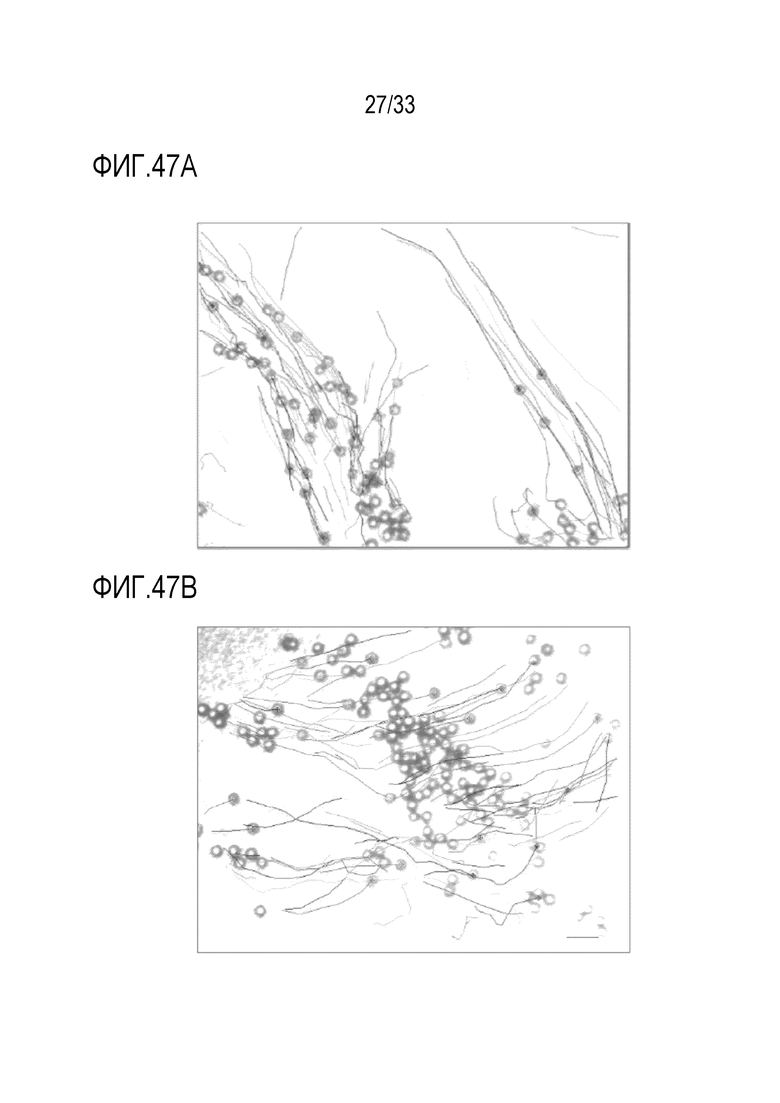
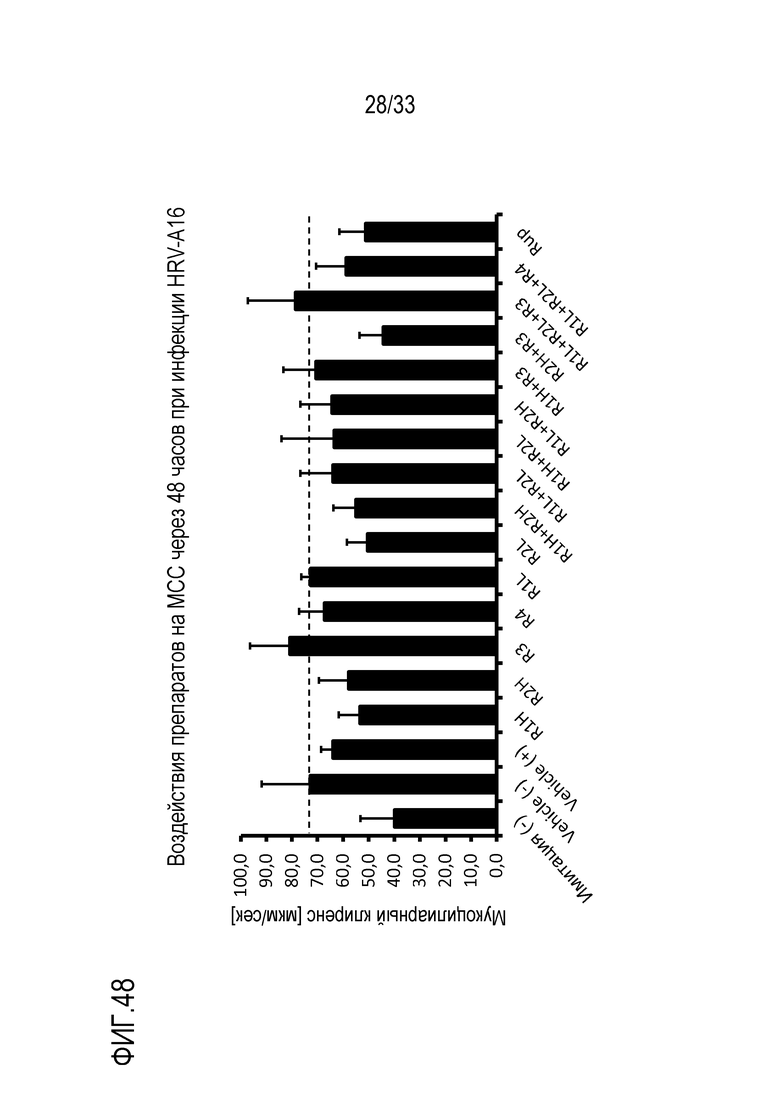
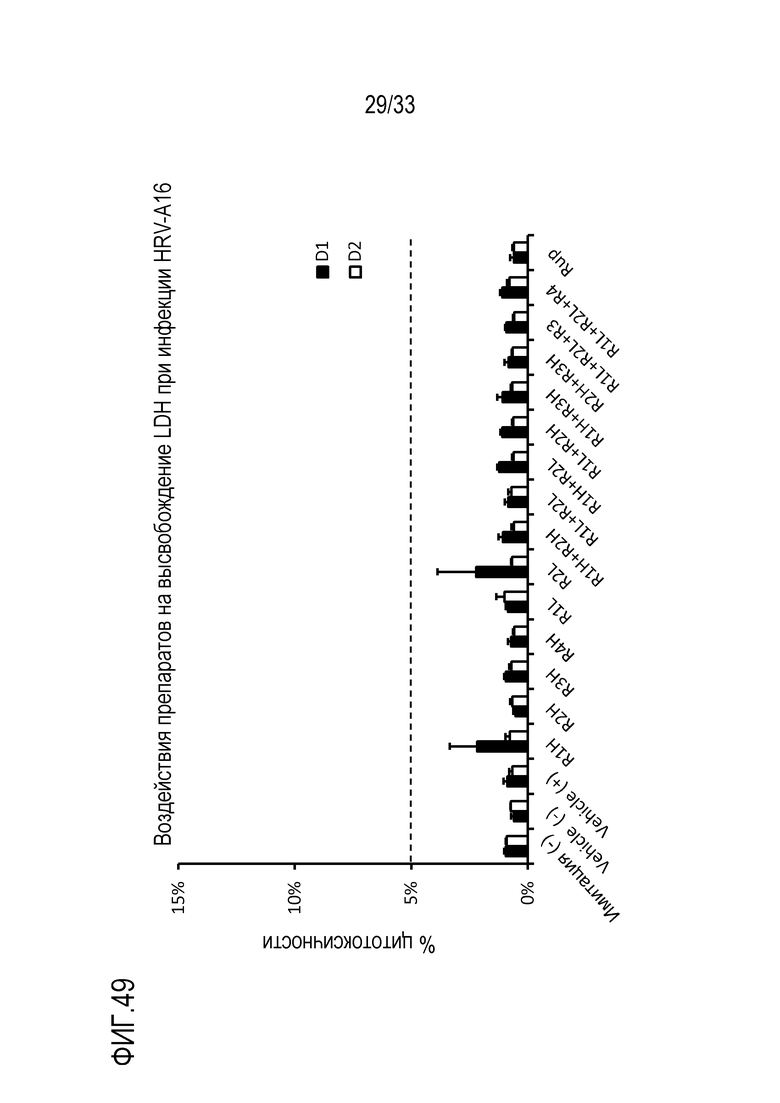
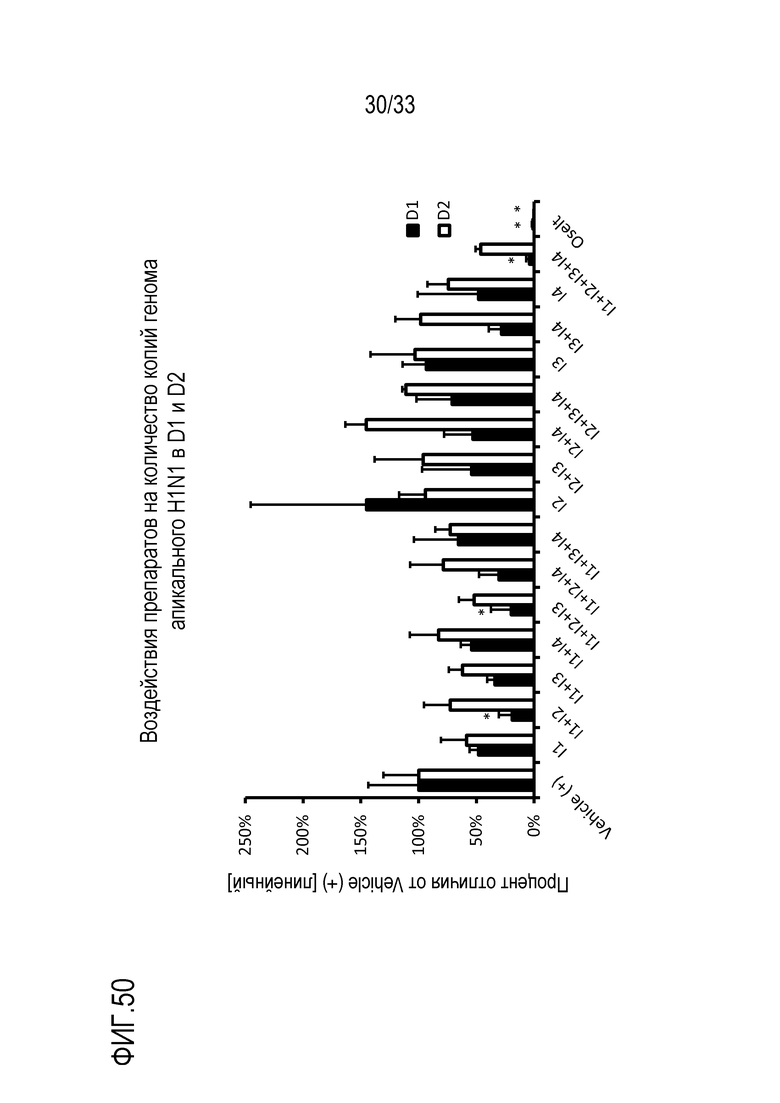
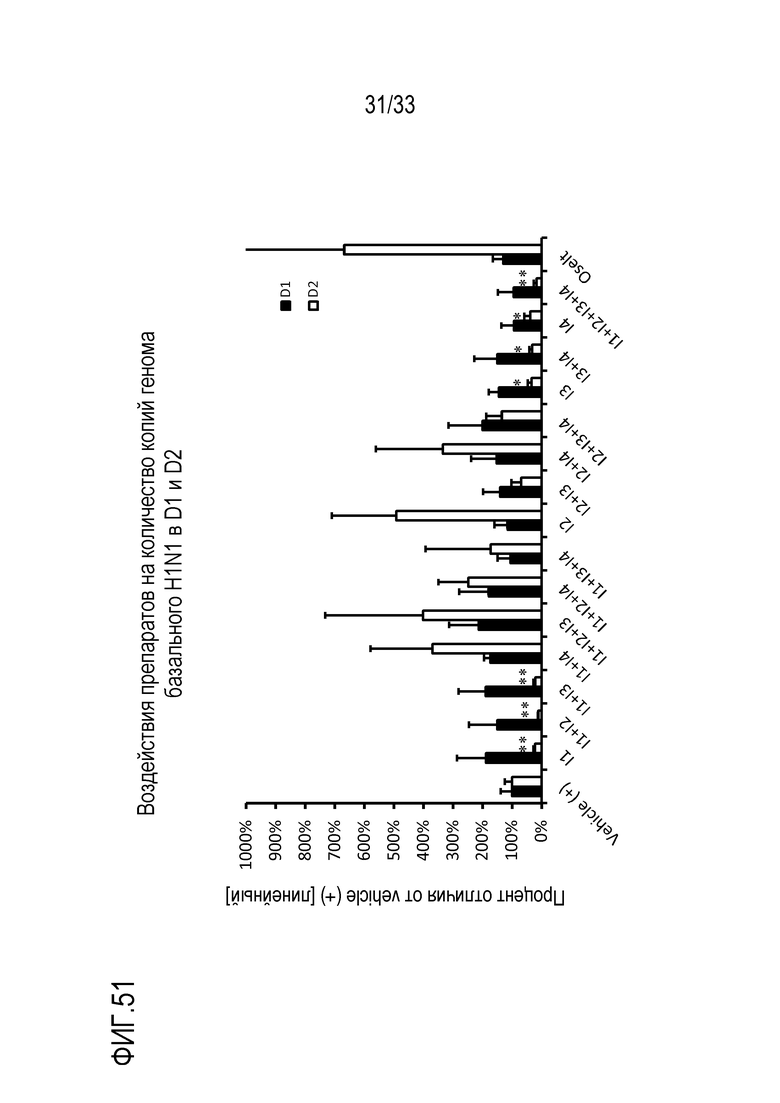
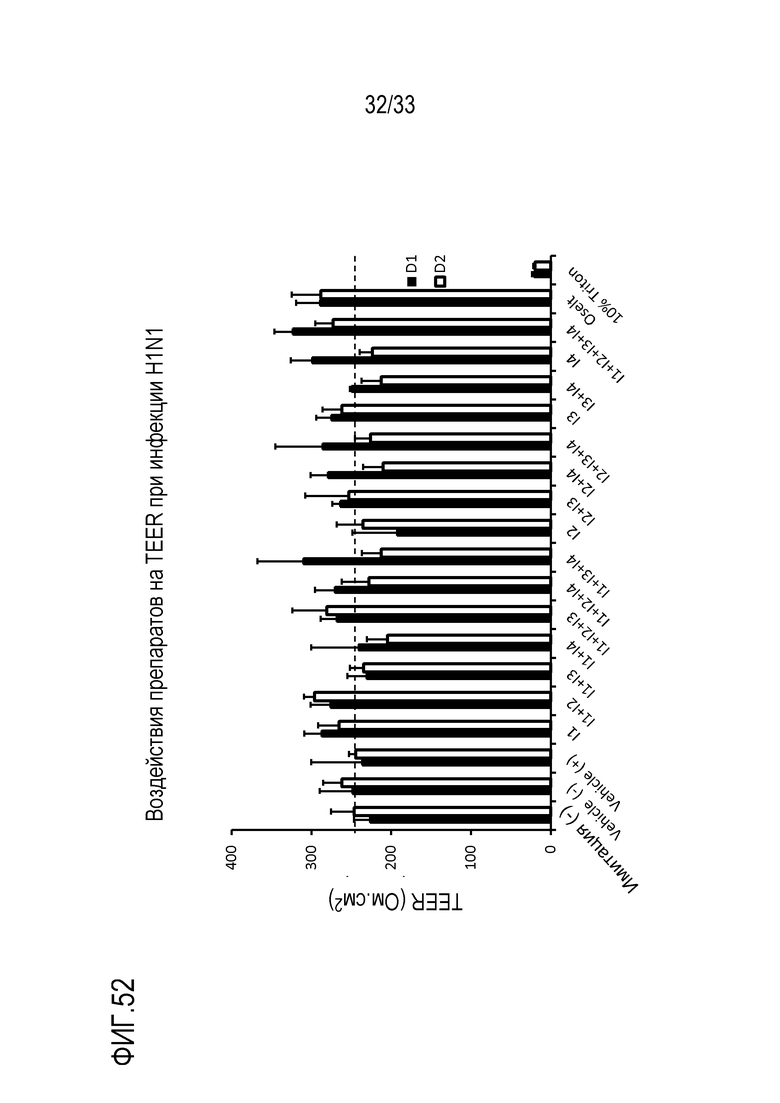
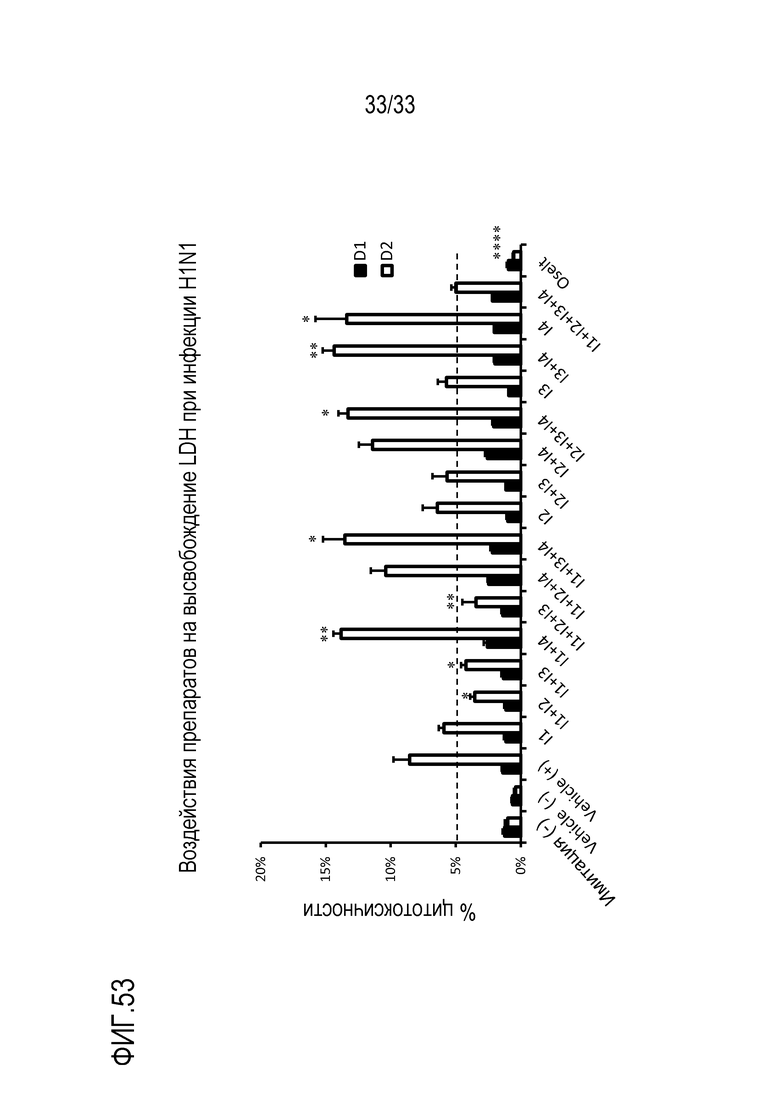
Группа изобретений относится к фармацевтической промышленности, а именно к композиции для предотвращения или лечения инфекции риновируса или гриппа. Фармацевтическая композиция для предотвращения или лечения инфекции риновируса или гриппа, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере двух активных агентов, выбранных из лактоферрина, лизозима, ICAM-1, сиаловой кислоты и ингибитора нейраминидазы. Способ профилактики и/или лечения инфекции риновируса человека, включающий нанесение композиции на слизистые носовой и/или ротовой полости индивидуума, нуждающегося в этом. Способ профилактики и/или лечения инфекции вируса гриппа человека, включающий нанесение композиции на слизистые носовой и/или ротовой полости индивидуума, нуждающегося в этом. Вышеописанная композиция обладает синергетической активностью в отношении предотвращения или лечения инфекции риновируса или гриппа. 3 н. и 19 з.п. ф-лы, 53 ил., 8 табл., 7 пр.
1. Фармацевтическая композиция для предотвращения или лечения инфекции риновируса или гриппа, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество по меньшей мере двух активных агентов, выбранных из лактоферрина, лизозима, ICAM-1, сиаловой кислоты и ингибитора нейраминидазы.
2. Фармацевтическая композиция по п.1, содержащая сиаловую кислоту.
3. Фармацевтическая композиция по п.1, содержащая ингибитор нейраминидазы.
4. Фармацевтическая композиция по п.1, содержащая лактоферрин.
5. Фармацевтическая композиция по п.1, содержащая лактоферрин и растворимый ICAM-1.
6. Фармацевтическая композиция по п.1, содержащая лизозим и растворимый ICAM-1.
7. Фармацевтическая композиция по п.1, содержащая лактоферрин, лизозим и растворимый ICAM-1.
8. Фармацевтическая композиция по п.1, содержащая лактоферрин и лизозим.
9. Фармацевтическая композиция по п.1, содержащая лактоферрин и сиаловую кислоту.
10. Фармацевтическая композиция по п.1, содержащая лактоферрин, лизозим и сиаловую кислоту.
11. Фармацевтическая композиция по п.1, содержащая лактоферрин, лизозим, сиаловую кислоту и ингибитор нейраминидазы.
12. Фармацевтическая композиция по п.1, содержащая сиаловую кислоту и ингибитор нейраминидазы.
13. Фармацевтическая композиция по п.1, где указанная композиция содержит ингибитор нейраминидазы и указанный ингибитор нейраминидазы представляет собой кверцетин или его изоформы.
14. Фармацевтическая композиция по п.1, дополнительно содержащая одно или более веществ из пероксида цинка, меди и серебра.
15. Фармацевтическая композиция по п.1, дополнительно содержащая каррагенан.
16. Фармацевтическая композиция по п.1, дополнительно содержащая один или более ингредиентов, выбранных из группы, состоящей из экстракта алтея, экстракта календулы, экстракта кожуры цитрусовых, медового экстракта, экстракта розмарина, экстракта мирры, экстракта Helichrysum, экстракта арроурута, масла семян маргозы, витамина C, витамина E и экстракта грейпфрутовых косточек.
17. Фармацевтическая композиция по п.1, дополнительно содержащая экстракт кожуры цитрусовых.
18. Фармацевтическая композиция по п.1, где указанная композиция находится в форме назального спрея, назальных капель, перорального спрея, перорального полоскания или пастилки.
19. Способ профилактики и/или лечения инфекции риновируса человека, включающий нанесение композиции по п.1 на слизистые носовой и/или ротовой полости индивидуума, нуждающегося в этом.
20. Способ по п.19, где слизистая носовой и/или ротовой полости указанного индивидуума, нуждающегося в лечении, находится в контакте с риновирусом человека.
21. Способ профилактики и/или лечения инфекции вируса гриппа человека, включающий нанесение композиции по п.1 на слизистые носовой и/или ротовой полости индивидуума, нуждающегося в этом.
22. Способ по п.21, где слизистые носовой и/или ротовой полости указанного индивидуума, нуждающегося в лечении, находятся в контакте с вирусом гриппа человека.
| US 20160022713 A1, 28.01.2016 | |||
| US 20040248825 A1, 09.12.2004 | |||
| US 2012171164 A1, 05.07.2012 | |||
| WO 1995027736 A1, 19.10.1995 | |||
| US 20100209419 A1, 19.08.2010 | |||
| US 2012121730 A1, 17.05.2012 | |||
| HIROYUKI WAKABAYASHI et al | |||
| lactoferrin for prevention of common viral infection //J | |||
| of infection and chemotherapy, 2014. |
Авторы
Даты
2023-02-15—Публикация
2018-08-29—Подача