Изобретение относится к области аналитической химии, а именно к способу определения содержания биологически активного действующего вещества в водорастворимых лекарственных препаратах с помощью спектроскопии гигантского комбинационного рассеяния (ГКР). Изобретение может применяться как в производственных и частных химико-аналитических лабораториях, так и в контрольно-аналитических лабораториях контролирующих организаций. Раскрываемый в изобретении способ определения действующего вещества в водорастворимых фармацевтических композициях может быть использован как способ контроля качества лекарственных препаратов.
Известно, что контроль качества лекарственных препаратов приобретает все большее значение в связи с растущими объемами фальсифицированной и контрафактной продукции. Кроме того, ужесточается внутригосударственная политика в сфере лекарственного обращения, повышаются требования для поставок лекарственной продукции на международные рынки. В связи с этим растут объемы лабораторных исследований лекарственных препаратов и возникают новые требования к соответствующим аналитическим процедурам. Быстрота проведения анализа и его высокая чувствительность выходят на первое место, чем не отличаются многие традиционные способы анализа.
Для качественного анализа лекарственных препаратов широко применяются способы на основе колебательной спектроскопии (инфракрасной и комбинационного рассеяния - далее ИК и КР спектроскопии, соответственно). Не смотря на то, что ИК и КР спектроскопия являются высоко специфичными способами анализа и позволяют идентифицировать в смесях соединения даже с очень близкой структурой, благодаря чему возможно селективное определение отдельных компонентов лекарственных средств, оба способа обладают существенным недостатком - для них характерная низкая чувствительность. ИК и КР спектроскопия позволяет идентифицировать соединение в смеси при его количественном содержании не менее 1%. Такой порог чувствительности не позволяет обнаруживать в лекарственных препаратах следовое присутствие примесных соединений, которое служит признаком недоброкачественности продукта и представляет опасность для конечного потребителя. К тому же низкая чувствительность ИК и КР спектроскопии сильно ограничивает круг подходящих для анализа лекарственных средств, т.к. во многих из них содержание действующего вещества ниже 1% по отношению к вспомогательным компонентам.
Для количественного анализа лекарственных препаратов повсеместно используются способы хроматографии и масс-спектрометрии. Эти способы, как правило, требуют трудоемкой пробоподготовки и длительного времени выполнения.
Одним из современных способов анализа, который способен обеспечить и высокую чувствительность и быстроту исполнения, считается спектроскопия гигантского комбинационного рассеяния, известная за рубежом как surface-enhanced Raman spectroscopy (SERS). В основе спектроскопии ГКР лежит эффект усиления сигнала КР от молекул, находящихся на или вблизи наноструктурированной металлической поверхности, в частности наноструктур из серебра и золота. Считается, что эффект ГКР обусловлен двумя вкладами: 1) электромагнитным (плазмонным) усилением падающего и рассеянного поля; 2) изменением поляризуемости молекулы вследствие ее химического взаимодействия с металлической подложкой. При действии обоих вкладов, коэффициенты усиления сигнала КР могут достигать вплоть до 14 порядков [1]. Подобное усиление оптического сигнала позволяет при определенных условиях идентифицировать даже единичные молекулы [2]. На данный момент уже известны попытки применить спектроскопию ГКР для идентификации биоактивных соединений в их лекарственных формах [3-4]. Помимо поисковых исследований, опубликованных в научной литературе, известен ряд конкретных технических решений, раскрывающих способы анализа лекарственных препаратов с помощью спектроскопии ГКР.
Известен способ анализа с помощью ГКР спектроскопии лекарственных препаратов, содержащих сульфаниламиды [5] по заявке КНР 102353665. Заявленный способ состоит из трех стадий: (1) растворение лекарственного препарата в этаноле и последующее разбавление полученного раствора водой, в результате которого получают готовый для анализа раствор с определенной концентрацией лекарственного препарата; (2) капельное нанесение полученного раствора на ГКР подложку с золотыми наночастицами и его сушка в естественных условиях; (3) регистрация спектров ГКР полученного сухого остатка на подложке при возбуждении лазером с длиной волны 780 нм. В данном способе в качестве усилителя спектров КР используется планарная подложка, требующая капельного нанесения на нее образца с последующей сушкой, что усложняет реализацию способа и приводит к дополнительным погрешностям анализа, связанным с известной не абсолютной воспроизводимостью капельного нанесения раствора и особенно его последующего высыхания. Кроме того, необходимость полного высыхания капли анализируемого раствора на ГКР подложке увеличивает общее время анализа.
В патенте КНР 104897645 раскрывается способ определения биологически активного компонента многих лекарственных препаратов - фолиевой кислоты с использованием спектроскопии КР и биполимера наночастиц золота/серебра [6]. Способ включает первую стадию синтеза золотых и серебряных наночастиц, вторую стадию модификации золотых частиц посредством антител к фолиевой кислоте и модификацию серебряных наночастиц посредством антигена фолиевой кислоты, третью стадию сборки модифицированных золотых и серебряных наночастиц в биполимеры и четвертую стадию регистрации сигналов КР и электронной микроскопии с полученных образцов. Фолиевую кислоту определяют на основании разницы сигналов КР от биполимера наночастиц золота/серебра. Несмотря на то, что указанный способ позволяет с помощью спектроскопии ГКР провести достаточно чувствительное определение биологически активного соединения, он является неоправданно сложным и дорогостоящим. Во-первых, необходимость получения двух разных сортов наночастиц и отдельной модификации каждого из них приводит к чрезмерно время и ресурсозатратной процедуре подготовки плазмонного субстрата. Во-вторых, использование таких реактивов, как антитела и антигены, значительно увеличивает себестоимость аналитической процедуры.
Известен способ [7] по патенту РФ 2675407 на основе спектроскопии ГКР для контроля медикаментов, добавленных в оздоровительные пищевые продукты. Данное изобретение является наиболее близким по достигаемому техническому результату и принято в качестве прототипа. Согласно этому способу для анализируемого объекта получают исходный сигнал КР и сравнивают его с эталонными сигналами КР компонентов медикаментов. В случае, если исходный сигнал КР не совпал с ни с одним из эталонных сигналов КР всех компонентов медикаментов, то регистрируют сигнал ГКР, который затем анализируют аналогичным образом. На основании сравнения сигнала ГКР образца с эталонными сигналами ГКР компонентов медикаментов, определяют, содержит ли подлежащий контролю образец медикаменты.
Этот способ, в своем наиболее чувствительном варианте, состоит из двух стадий измерения сигнала КР, что увеличивает общее время анализа. Кроме того, этот способ не предусматривает использование каких-либо добавок, способствующих увеличению интенсивности сигнала ГКР. В этом случае его чувствительность и точность ограничены оптической активностью усиливающего субстрата, которая на порядок ниже в сравнении с теми, которые содержат активирующую добавку. Наконец, этот способ не предусматривает проведение нормировки на сигнал внутреннего стандарта при анализе данных, что снижает точность определения с помощью спектроскопии ГКР.
Техническая задача, решаемая заявляемым изобретением, состоит в ускорении и повышении чувствительности и точности анализа водорастворимых лекарственных препаратов. Кроме того, обеспечивается упрощение способа анализа лекарственных препаратов с высоким пределом обнаружения при отсутствии трудоемкой пробоподготовки.
Техническая задача решена заявляемым способом анализа водорастворимых лекарственных препаратов на основе спектроскопии ГКР, отличающимся тем, что помимо субстрата, усиливающего КР сигнал, также используется активирующая добавка, значительно повышающая интенсивность спектров ГКР и выполняющая одновременно функцию внутреннего стандарта. Способ анализа водорастворимых лекарственных препаратов состоит из следующих стадий: а) добавление аликвоты анализируемого раствора лекарственного препарата к раствору стабилизированных наночастиц; б) добавление в приготовленный раствор активирующей добавки; в) регистрацию спектров ГКР полученного раствора; г) сравнение полученных спектров со спектром эталонного образца и выявление пиков, нехарактерных для компонентов лекарственного препарата; д) нормировка интенсивности пика от действующего вещества на интенсивность пика от внутреннего стандарта и количественное определение содержания действующего вещества по полученному значению нормированной интенсивности. В качестве активирующей добавки, выполняющей также функцию внутреннего стандарта, используется раствор галогенида щелочного или щелочноземельного металла в метиловом спирте. В качестве плазмонных наночастиц для реализации изобретения могут быть использованы частицы серебра, золота и других благородных металлов любой формы и размера способные существовать в виде золя и обеспечивающие коэффициенты усиления КР не менее чем 4 порядка. В качестве стабилизатора наночастиц могут выступать лимонная кислота или ее соли, аскорбиновая кислота или ее соли, глюкоза, нитраты щелочных или щелочноземельных металлов, цетилтриметиламмония бромид или другое катионное поверхностно-активное вещество класса четвертичных аммониевых соединений, поливинилпирролидон, полиэтиленимин, поли(диаллилдиметиламмоний хлорид) или водорастворимые полимеры класса полиаминов и диаллиламинов, которые создают вокруг металлического ядра оболочку из противоположно заряженных ионов, тем самым препятствуя коагуляции частиц.
Сущность заявленного изобретения поясняется Фиг. 1-Фиг. 3.
На Фиг. 1. представлены спектры ГКР лекарственного препарата «Фолиевая кислота» в растворе стабилизированных ЦТАБ наночастиц серебра до и после добавления активирующей добавки;
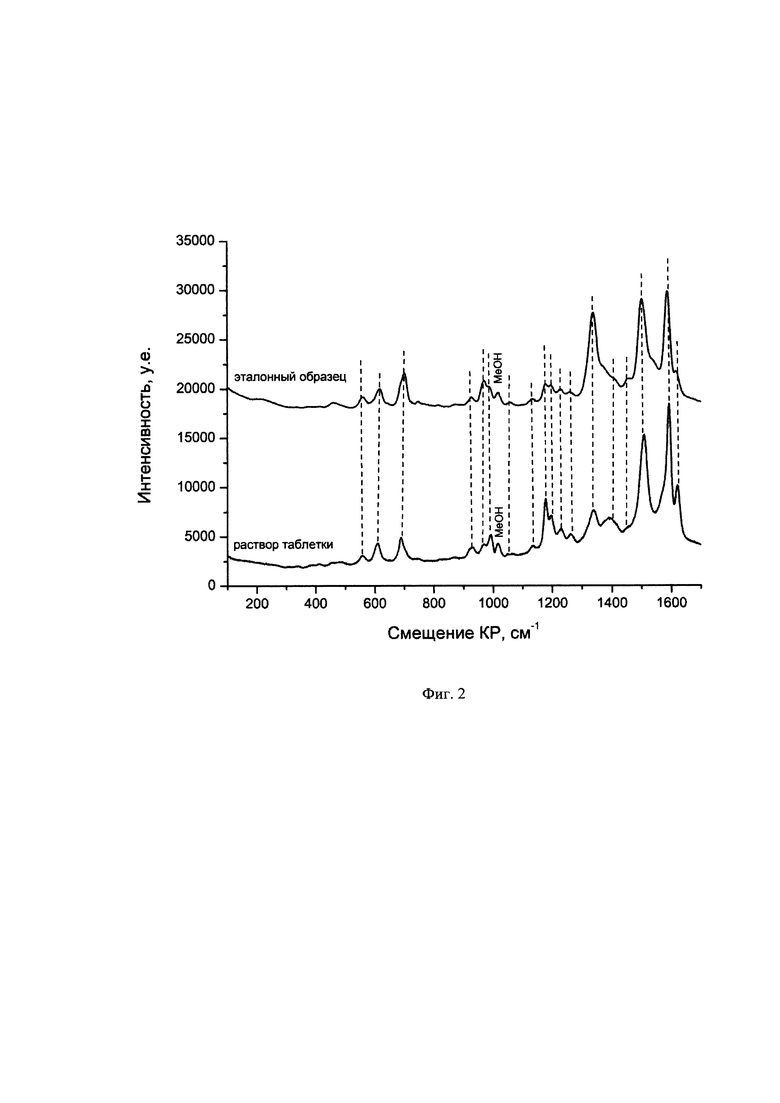
На Фиг. 2. представлено сравнение спектров ГКР лекарственного препарата «Фолиевая кислота» и эталонного образца в растворе наночастиц серебра;
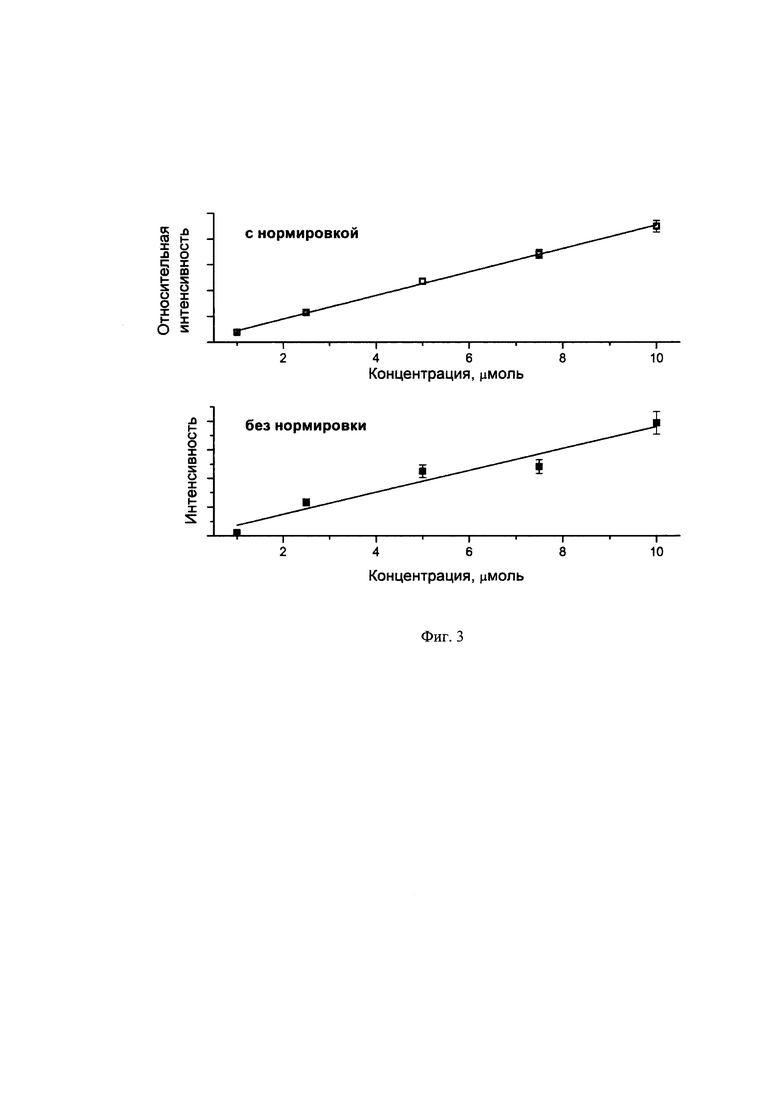
Фиг. 3. представлены градуировочные кривые, полученные из спектров ГКР без и с нормировкой на пик внутреннего стандарта (полоса 1017 см-1 метанола).
Сущность заявляемого изобретения поясняется на конкретном примере его реализации для качественного и количественного определения биологически активного действующего вещества, а именно фолиевой кислоты, в таблетированном противоанемическом лекарственном препарате «Фолиевая кислота» производства ОАО «Борисовский завод медицинских препаратов». Указанный водорастворимый лекарственный препарат имеет следующий состав на одну таблетку: активное вещество - фолиевая кислота, 1 мг; вспомогательные вещества - сахароза, 65 мг, крахмал картофельный, 33 мг, стеариновая кислота, 1 мг. Для осуществления изобретения использовали: i) конкретный раствор наночастиц серебра диаметром 7-12 нм, полученных восстановлением нитрата серебра борогидридом натрия и стабилизированных катионным ПАВ - цетилтриметиламмоний бромидом (ЦТАБ); ii) раствор хлорида калия в метаноле с концентрацией 0.05 моль/л.
Пример реализации заявленного способа.
Анализ таблетированного лекарственного препарата «Фолиевая кислота» проводился следующим образом. Таблетку лекарственного средства с заявленным содержанием фолиевой кислоты 1% (1 мг на 100 мг общей массы) растворили в 1 л воды, затем 0.1 мл полученного раствора добавили к 9.9 мл раствора наночастиц серебра, стабилизированных ЦТАБ. Затем в приготовленный раствор наночастиц серебра и аликвоты лекарственного препарата добавили активирующую добавку (раствор хлорида калия в метаноле 0.05 моль/л) в объемном соотношении 9 к 1. Спектры ГКР регистрировали в кварцевой кювете с длиной оптического пути 10 мм на спектрометре LabRam HR (Horiba Jobin Yvon). Для возбуждения спектров ГКР использовали линию 488 нм аргонового лазера, мощность излучения перед образцом составляла 10 мВт, конфокальное отверстие устанавливалось равным 150 мкм, время и число накоплений регистрации спектров составляло 8 секунд и 2 повтора соответственно.
На Фиг. 1 показаны спектры ГКР, полученные для раствора наночастиц серебра с аликвотой раствора лекарственного препарата до и после добавления активирующей добавки. Очевиден значительный рост интенсивности аналитического сигнала после добавления активирующей добавки. В данном конкретном варианте осуществления изобретения рост интенсивности сигнала составил 5 раз. Рост интенсивности спектров ГКР в присутствии галогенидов щелочных и щелочно-земельных металлов, предположительно, протекает по одному из двух механизмов. Возможно формирование на поверхности наночастиц дополнительных активных центров за счет взаимодействия аниона галогенида с положительно заряженными адатомами металла, также возможна интенсификация адсорбции действующего вещества путем образования ионной пары между его молекулами и анионами галогенида, обладающими высоким сродством к поверхности. Таким образом, добавление галогенидов щелочного или щелочноземельного металла позволяет получить максимально интенсивный спектр от молекул аналита.
Пики в полученном спектре ГКР раствора с аликвотой лекарственного препарата «Фолиевая кислота» производства ОАО «Борисовский завод медицинских препаратов» соотнесли с пиками спектра ГКР эталонного образца фолиевой кислоты (Фиг. 2). Поскольку в спектре не оказалось неотнесенных по отношению к спектру эталонного образца пиков, сделали вывод об отсутствии примесных соединений в анализируемом образце. Как видно, присутствие в растворе сахарозы и крахмала в 100-кратном избытке не помешало прямому анализу фолиевой кислоты. Наблюдение сигнала только от фолиевой кислоты при отсутствии спектральных полос от крахмала и сахарозы возможно вследствие протекания следующих физико-химических процессов. Добавление к раствору плазмонных наночастиц серебра аликвоты раствора лекарственного препарата приводит к возникновению конкурентных адсорбционных равновесий между компонентами лекарственного препарата и стабилизирующей частицу ионной оболочкой. Среди компонентов водорастворимых лекарственных препаратов, как правило, только молекулы действующего вещества, представляющие собой полифункциональные органические молекулы, способны замещать ионы из первого адсорбционного слоя на поверхности плазмонных наночастиц. Широко используемые наполнители (крахмал, целлюлоза и другие полисахариды) и связующие (сахароза, гидроксипропилметилцеллюлоза, желатин) лекарственных препаратов не имеют функциональных групп для ковалентного взаимодействия с поверхностью металла, соответственно их молекулы не способны приближаться к поверхности плазмонных наночастиц на расстояние, достаточное для возникновения для них эффекта ГКР, который имеет экстремально коротко действующую природу.
Количественное определение веществ по спектрам ГКР имеет отдельные трудности в силу поверхностной природы самого эффекта ГКР. Известно, что интенсивность сигнала ГКР, в отличие от традиционной спектроскопии КР, зависит от большего числа параметров, в том числе локальных, которые невозможно контролировать только путем соблюдения постоянства инструментальных настроек и геометрии эксперимента. В частности, из-за непрерывного броуновского движения частиц в жидкости, возникают неоднородности в локальной концентрации плазмонных наночастиц, попадающих под луч лазера, и их ориентации относительно падающего излучения. Как следствие возникают флуктуации интенсивности сигнала ГКР от аналита. В заявляемом изобретении для повышения точности количественного определения аналита по спектрам ГКР предлагается проводить нормировку сигнала от действующего вещества на сигнал от внутреннего стандарта. В качестве внутреннего стандарта использована спектральная полоса от метанола. Согласно предложенному способу ввод внутреннего стандарта проводится совместно с добавлением активирующей добавки путем использования раствора галогенида щелочного или щелочно-земельного металла в метиловом спирте. Объединение этапов добавления активатора и внутреннего стандарта в одну стадию позволяет уменьшить количество манипуляций, вследствие чего повысить точность и сократить общее время анализа в целом.
В описываемом конкретном примере реализации изобретения для оценки количественного содержания фолиевой кислоты провели нормировку и анализ интенсивности характеристичного пика 1592 см-1. Нормировку интенсивности пика 1592 см-1 выполняли на интенсивность пика 1017 см-1 от валентного колебания связи С-O в метаноле. Выбор метилового спирта в качестве внутреннего стандарта для нормировки спектров ГКР является отличительной особенностью заявляемого изобретения и обусловлен накопленными экспериментальными фактами. Во-первых, метанол имеет всего одну интенсивную полосу в диапазоне спектра КР от 800 до 1800 см-1, известном как «область отпечатком пальцев». Поэтому метанол обеспечивает минимальное перекрытие сигнала от анализируемого вещества в сравнении с другими растворителями и/или молекулам, специально вводимыми для целей нормировки. Во-вторых, малый размер молекулы метанола и ее относительно высокая подвижность делают его лабильным и позволяют участвовать в адсорбционных равновесиях вблизи поверхности наночастиц. Поэтому сигнал от метанола коррелирует с возникающими локальными неоднородностями в растворе в области фокусного пространства, которые являются причиной флуктуации сигнала ГКР от аналита.
Содержание фолиевой кислоты оценивали по предварительно построенной градуировочной кривой, полученной путем регистрации спектров ГКР для модельных растворов фолиевой кислоты на фоне 100-кратного общего избытка крахмала и сахарозы, взятых в соотношении 1 к 2, с использованием того же самого раствора стабилизированных наночастиц серебра. Для построения градуировочной кривой использовали модельные растворы с концентрацией фолиевой кислоты 1, 2.5, 5, 7.5 и 10 моль/л. Спектры ГКР модельных растворов фолиевой кислоты регистрировали по аналогичному алгоритму также с добавлением активирующей добавки - раствора хлорида калия в метаноле с концентрацией 0.05 моль/л. Градуировочная кривая была построена в двух вариантах - без и с нормировкой интенсивности пика фолиевой кислоты 1592 см-1 на интенсивность пика 1017 см-1 от метанола. На фиг. 3 показаны обе полученные градуировочные кривые. Очевидно, что использование нормировки ГКР сигнала на внутренний стандарт позволяет значительно улучшить линейность градуировочной кривой, тем самым повысить точность определения аналита. Полученное содержание фолиевой кислоты в анализируемом растворе составило 2.2 моль/л, что соответствует содержанию в растворе после растворения таблетки 0.97 мг/л. Расхождение с заявленным содержанием фолиевой кислоты в таблетированном препарате составило 3%, что не превышает допустимую ошибку определения, установленную для альтернативного метода высокоэффективной жидкостной хроматографии - 4%.
Как показывают результаты проведенного анализа на примере конкретной реализации, заявленное изобретение подтверждает достижение указанного технического результата и наглядно демонстрирует возможность качественного анализа действующего вещества в водорастворимых лекарственных препаратах с чувствительностью, превосходящей, как минимум в 5 раз, за счет использования активирующей добавки традиционные способы анализа на основе спектроскопии ГКР. Кроме того, приведенный конкретный пример реализации изобретения показывает возможность количественного анализа действующего вещества в водорастворимых лекарственных препаратах с точностью, превышающей таковую без нормировки сигнала ГКР на сигнал от внутреннего стандарта. Продемонстрированная возможность прямой идентификации в лекарственном препарате действующего вещества без его предварительного выделения значительно упрощает процедуру анализа и сокращает время его проведения. Изобретение применимо для определения широкого круга действующих компонентов водорастворимых лекарственных препаратов, в структуре которых имеется хотя бы одна из перечисленных функциональная группа, способная обеспечить эффективное взаимодействие молекулы с поверхностью плазмонных наночастиц: первичная, вторичная или третичная аминогруппа, тиольная группа, цианогруппа, гетероатом азота, азидная группа.
Изобретение может быть использовано для определения широкого круга действующих компонентов водорастворимых лекарственных препаратов, в структуре которых имеется хотя бы одна из перечисленных функциональная группа, способная обеспечить эффективное взаимодействие молекулы с поверхностью плазмонных наночастиц: первичная, вторичная или третичная аминогруппа, тиольная группа, цианогруппа, гетероатом азота, азидная группа.
Список использованных источников информации
[1] K. Kneipp Surface-enhanced Raman scattering, Physics Today, 2007, 60(11), 40-46
[2] B. Vlckova, M. Moskovits, I. Pavel, K. Siskova, M. Sladkova, Miroslav Slouf Single-molecule surface-enhanced Raman spectroscopy from a molecularly-bridged silver nanoparticle dimer, Chemical Physics Letters, 2008, 455, 131-134
[3] E.C. Tackman, M.J. Trujillo, T.-L.E. Lockwood, G. Merga, M. Lieberman, J.P. Camden Identification of substandard and falsified antimalarial pharmaceuticals chloroquine, doxycycline, and primaquine using surface-enhanced Raman scattering, Analytical Methods, 2018, 10(38), 4718-4722
[4] E.V. Solovyeva, E. Borisov, Demonstration of Physical and Analytical Features of Surface-Enhanced Raman Scattering by Analysis of Folic Acid in Commercial Tablets, Journal of Chemical Education, 2020, 97(8), 2249-2253
[5] Заявка CN 102353665, A, 15.02.2012
[6] Патент CN 104897645, A, 09.01.2018
[7] Патент RU 2675407, C1, 19.12.2018 (прототип)
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ ДНК С ЗАДАННОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ | 2019 |
|
RU2723160C1 |
| Способ определения белков с помощью гигантского комбинационного рассеяния с использованием криозолей плазмонных наночастиц | 2019 |
|
RU2717160C1 |
| Способ получения усиленного сигнала комбинационного рассеяния света от молекул сывороточного альбумина человека в капле жидкости | 2019 |
|
RU2708546C1 |
| Оптический сенсор с плазмонной структурой для определения химических веществ низких концентраций и способ его получения | 2019 |
|
RU2720075C1 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ГКР-АКТИВНОСТЬЮ ДЛЯ ОПРЕДЕЛЕНИЯ ПОЛИАРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СЕРОСОДЕРЖАЩИХ СОЕДИНЕНИЙ В УГЛЕВОДОРОДНЫХ ПРОДУКТАХ, СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ, ПЛАНАРНЫЙ ТВЕРДОФАЗНЫЙ ОПТИЧЕСКИЙ СЕНСОР НА ЕЕ ОСНОВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ СЕНСОРА ДЛЯ АНАЛИЗА ПОЛИАРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СЕРОСОДЕРЖАЩИХ СОЕДИНЕНИЙ | 2016 |
|
RU2627980C1 |
| ПЛАНАРНЫЙ ТВЕРДОФАЗНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОПРЕДЕЛЕНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ МЕТОДОМ СПЕКТРОСКОПИИ ГИГАНТСКОГО КОМБИНАЦИОННОГО РАССЕЯНИЯ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДЕТЕКТИРОВАНИЯ БЕЛКОВЫХ СОЕДИНЕНИЙ | 2016 |
|
RU2659987C2 |
| СПОСОБ УВЕЛИЧЕНИЯ СООТНОШЕНИЯ СИГНАЛ/ШУМ ПРИ АНАЛИЗЕ ВОДНЫХ РАСТВОРОВ МЕТОДОМ КР-СПЕКТРОСКОПИИ | 2019 |
|
RU2719574C1 |
| ХИМИЧЕСКИ МОДИФИЦИРОВАННЫЙ ПЛАНАРНЫЙ ОПТИЧЕСКИЙ СЕНСОР, СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ И СПОСОБ АНАЛИЗА ПОЛИАРОМАТИЧЕСКИХ ГЕТЕРОЦИКЛИЧЕСКИХ СЕРОСОДЕРЖАЩИХ СОЕДИНЕНИЙ С ЕГО ПОМОЩЬЮ | 2015 |
|
RU2572801C1 |
| СУБСТРАТ ДЛЯ УСИЛЕННОЙ ПОВЕРХНОСТЬЮ СПЕКТРОСКОПИИ КОМБИНАЦИОННОГО РАССЕЯНИЯ СВЕТА | 2021 |
|
RU2763861C1 |
| НАБОР ДЛЯ ДИАГНОСТИКИ РАКА МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ МУТАЦИЙ С228Т И C250T В ПРОМОТОРЕ ГЕНА hTERT И СПОСОБ ЕЕ ОСУЩЕСТВЛЕНИЯ | 2020 |
|
RU2764807C1 |

Изобретение относится к области аналитической химии, в частности к способам качественного и количественного определения действующего вещества в готовых лекарственных формах и к средствам анализа водорастворимых лекарственных препаратов с помощью спектроскопии гигантского комбинационного рассеяния, и может быть использовано для оценки качества лекарственных препаратов. Способ качественного и количественного определения биологически активного действующего вещества в водорастворимых лекарственных препаратах заключается в регистрации спектра ГКР аликвоты раствора лекарственного препарата в растворе стабилизированных наночастиц, сопоставлении полученного спектра со спектром ГКР эталонного образца и дальнейшем определении количественного содержания действующего вещества по предварительно полученной в координатах «относительная интенсивность - концентрация» градуировочной кривой, при этом перед проведением спектральных измерений в анализируемый раствор стабилизированных наночастиц с аликвотой лекарственного препарата дополнительно вводят активирующую добавку для повышения интенсивности спектров ГКР, которую одновременно принимают и используют в качестве внутреннего стандарта при последующем количественном определении действующего вещества. Техническим результатом является возможность определять наличие примесных соединений и содержание действующего вещества в водорастворимых лекарственных препаратах с высокой скоростью и чувствительностью без предварительных стадий разделения и концентрирования. 4 з.п. ф-лы, 3 ил.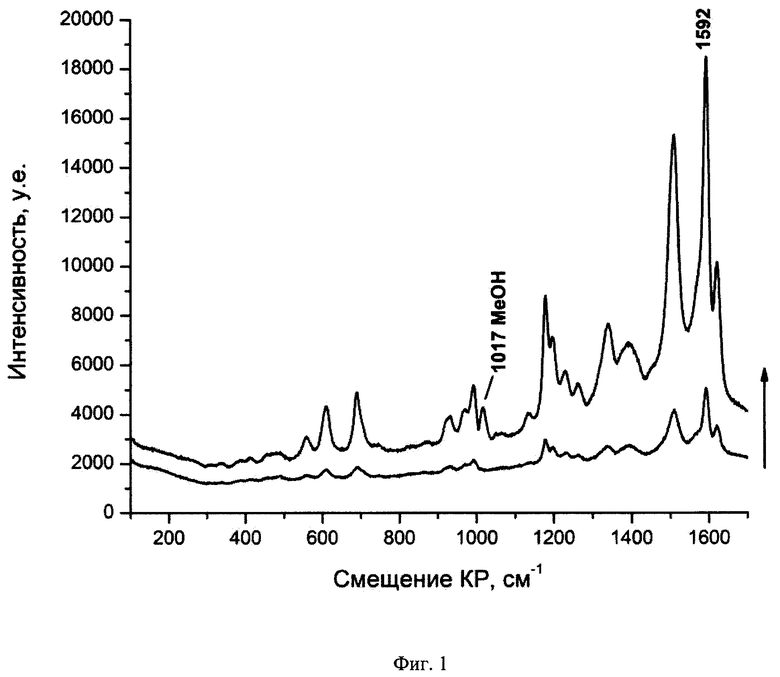
1. Способ качественного и количественного определения биологически активного действующего вещества в водорастворимых лекарственных препаратах, заключающийся в регистрации спектра ГКР аликвоты раствора лекарственного препарата в растворе стабилизированных наночастиц, сопоставлении полученного спектра со спектром ГКР эталонного образца и дальнейшем определении количественного содержания действующего вещества по предварительно полученной в координатах «относительная интенсивность - концентрация» градуировочной кривой, отличающийся тем, что перед проведением спектральных измерений в анализируемый раствор стабилизированных наночастиц с аликвотой лекарственного препарата дополнительно вводят активирующую добавку для повышения интенсивности спектров ГКР, которую одновременно принимают и используют в качестве внутреннего стандарта при последующем количественном определении действующего вещества.
2. Способ по п. 1, в котором используют наночастицы серебра, золота, меди или их сплавов.
3. Способ по п. 2, в котором размер наночастиц составляет 5-100 нм.
4. Способ по п. 1, в котором в качестве активирующей добавки выбирают спиртовой или водно-спиртовой раствор галогенида щелочного или щелочноземельного металла.
5. Способ по любому из пп. 1-4, в котором используют предварительно приготовленные и расфасованные в индивидуальную градуированную тару растворы стабилизированных наночастиц и раствор активирующей добавки.
| СПОСОБ НА ОСНОВЕ РАМАНОВСКОЙ СПЕКТРОСКОПИИ ДЛЯ КОНТРОЛЯ ЗАПАДНЫХ МЕДИКАМЕНТОВ, ДОБАВЛЕННЫХ В ОЗДОРОВИТЕЛЬНЫЕ ПИЩЕВЫЕ ПРОДУКТЫ | 2015 |
|
RU2675407C1 |
| CN 104897645 B, 09.01.2018 | |||
| CN 102353665 A, 15.02.2012 | |||
| CN 104458693 A, 25.03.2015. | |||
Авторы
Даты
2022-06-23—Публикация
2021-05-04—Подача