Область техники
Данное изобретение относится к медицине и касается терапии заболеваний, ассоциированных с аберрантной активностью интерлейкина-6 (IL-6), а также развитием синдрома высвобождения цитокинов или цитокинового шторма. Предпочтительно данное изобретение применимо в терапии коронавирусов и, в частности, коронавируса COVID-19, а также других заболеваний, ассоциированных с аберрантной активностью интерлейкина-6 и развитием синдрома высвобождения цитокинов, посредством применения производного глутаримида. Изобретение обеспечивает создание нового эффективного лекарственного средства для подавления аберрантной активности интерлейкина-6 и, в частности, для терапии COVID-19.
Уровень техники
Цитокины - это группа гормоноподобных белков и пептидов, секретируемых клетками иммунной системы и другими типами клеток, и участвующих в управлении развитием и гомеостазом иммунной системы, контроле за ростом и дифференцировкой клеток крови (системой гемопоэза) и в неспецифических защитных реакциях организма, [Cold Spring Harb Perspect Biol., 2017 Jun 15. pii: a028597, Int Anesthesiol Clin. 2007 Spring;45(2):27-37]. В то же время аберрантная активность цитокинов (синдром выброса цитокинов или цитокиновый шторм) является распространенным патологическим состоянием, лежащим в основе многих патологических процессов, таких как острый респираторный дистресс-синдром (ОРДС), сепсис, болезнь «трансплантат против хозяина», синдром активации макрофагов, первичный и вторичный гемофагоцитарный лимфогистиоцитоз и т.д. [J Autoimmun. 2019 Jun;100:62-74].
Сообщалось, что повышенный уровень цитокинов, в частности интерлейкина-6, может быть маркером резистентного к терапии иммуноглобулинами синдрома Кавасаки [Ying Wang et al, Clinica Chimica Acta, V. 506, 2020, pp.222-227].
Недавно было также сообщено, что синдром высвобождения цитокинов является осложнением иммунотерапии, такой как Т-клеточная терапия химерным рецептором антигена [Nat Rev Clin Oncol. 2018 Jan;15(1):47-62].
Цитокиновый шторм является крайне опасным патологическим состоянием, зачастую приводящим к развитию неконтролируемого воспаления, множественного повреждения органов и, в конечном итоге приводит к смерти пациента. Исследования показали, что у некоторых пациентов с ОРВИ, несмотря на уменьшение вирусной нагрузки, развивается синдром высвобождения цитокинов и последующий острый респираторный дистресс-синдром. Таким образом, именно избыточный иммунный ответ хозяина, а не вирусная нагрузка, часто является причиной развития неконтролируемого воспаления. По этой причине сама по себе антивирусная терапия может не обеспечить должную эффективность терапии данной патологии [Lancet . 2003 May 24;361(9371):1767-72].
Одну из ключевых ролей в патогенезе цитокинового шторма (и в особенности цитокинового шторма, ассоциированного с инфекциями нижних дыхательных путей) играет интерлейкин-6. Для пациентов с инфекциями нижних дыхательных путей характерно повышение уровня интерлейкина-6, которое коррелирует с тяжестью заболевания [Infect Immun . 2004 Aug;72(8):4410-5].
Чрезмерная передача сигналов интерлейкином-6 приводит к множеству биологических эффектов, способствующих повреждению органов, таких как созревание наивных Т-клеток в эффекторные Т-клетки, индукция экспрессии фактора роста эндотелия сосудов (VEGF) в эпителиальных клетках, повышение проницаемости сосудов [Immunotherapy, 2016, Jul;8(8):959-970] и снижение сократимости миокарда [Lancet, 2004 Jan 17; 363(9404):203-209].
В настоящий момент отсутствуют клинические данные по терапии цитокинового шторма путем ингибирования аберрантной активности интерлейкина-6. Однако, в исследованиях на животных было показано, что ингибирование ядерного фактора каппа-B (NF-κB), ключевого фактора транскрипции интерлейкина-6, приводило к снижению продукции интерлейкина-6, предотвращало развитие цитокинового шторма и повышало выживаемость животных [J Virol . 2014 Jan;88(2):913-24]. Более того, для ряда заболеваний, и, в частности, для COVID-19, было показано, что повышенные уровни интерлейкина-6 могут служить прогностическим биомаркером тяжести заболевания и коррелировать с вероятностью развития синдрома высвобождения цитокинов и ОРДС. В ходе ретроспективного когортного исследования на большой группе пациентов было показало, что уровни IL-6 коррелируют со смертностью у пациентов с COVID-19 [Lancet, 2020 Mar 28;395(10229):1054-1062]. Таким образом, терапия, направленная на подавление аберрантной активности IL-6, может быть эффективной стратегией для профилактики и лечения цитокинового шторма у пациентов с инфекциями нижних дыхательных путей и, в частности, у пациентов с COVID-19.
Одним из возможных подходов к подавлению аберрантной активности интерлейкина-6 является применение моноклональных антител к интерлейкину-6 или его рецептору (например тоцилизумаб), а также применение ингибиторов JAK1/JAK2 (например тофацитиниб), участвующих в передаче сигнала, индуцированного IL-6. Следует отметить, что попытка применения моноклональных антител против цитокинов воспаления при COVID-19 диктуется поиском чрезвычайных мер при отсутствии эффективной терапии против новой коронавирусной инфекции SARS-CoV2 (COVID-19). Препараты моноклональных антител относятся к дорогостоящим препаратам, непригодным для массового применения в условиях пандемии, и часто имеют серьезные побочные эффекты (для тоцилизумаба это преимущественно инфекции различного генеза) [J. Med. Virol., 92 (4) (2020) 441-447, Mod Rheumatol., 2019 Mar;29(2):258-267]. Для коррекции гиперцитокинемии при вирусных пневмониях более целесообразно применение препаратов, снижающих выработку IL-6 и других цитокинов воспаления с быстрым периодом выведения из организма для сохранения иммунологического статуса в постинфекционный период.
Таким образом, на текущий момент времени для пациентов с инфекциями дыхательных путей и, в частности, со всеми формами течения COVID-19, сохраняется значительная потребность в наличии препарата с широким спектром противовоспалительной активности при синдроме гиперпродукции цитокинов, способным не замедлять скорость элиминации вируса, с приемлемым профилем польза/риск для назначения на любом этапе заболевания, а также удовлетворяющим основным регуляторным критериями эффективности упреждающей противовоспалительной терапии в соответствии с динамикой клинического ответа (снижение уровня лихорадки, улучшение самочувствия, появление аппетита, уменьшение одышки, повышение сатурации кислородом (SpО2).
Таким образом, на основании литературных данных можно заключить, что в клинической практике существует выраженная потребность в лекарственных препаратах, способных подавлять аберрантную активность интерлейкина-6 и развитие синдрома высвобождения цитокинов или цитокинового шторма. Подавление цитокинового шторма имеет важное значение, в частности, в терапии COVID-19 умеренного и тяжелого течения.
Данное изобретение касается применения производного глутаримида для терапии заболеваний, которые могут сопровождаться развитием синдрома выброса цитокинов или цитокинового шторма, в частности, для терапии COVID-19, а так же других заболеваний, которые могут протекать с развитием синдрома высвобождения цитокинов или цитокинового шторма.
Раскрытие изобретения
Задачей настоящего изобретения является разработка нового лекарственного средства, эффективного для терапии заболеваний, ассоциированных с аберрантной активностью интерлейкина-6, и развитием синдрома выброса цитокинов или цитокинового шторма), предпочтительно для терапии высокопатогенных коронавирусных инфекций и особенно предпочтительно COVID-19.
Техническим результатом данного изобретения является разработка средства, эффективно подавляющего аберрантную активность интерлейкина-6 и/или развитие синдрома выброса цитокинов или цитокинового шторма, для терапии COVID-19, а также других заболеваний.
Указанный технический результат достигается путем предоставления объектов настоящего изобретения.
Одним объектом изобретения является применение соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона
или его соли, гидрата, сольвата в качестве соединения, подавляющего аберрантную активность интерлейкина-6
Другим объектом изобретения является применение соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона

или его соли, гидрата, сольвата в качестве соединения для терапии синдрома высвобождения цитокинов или цитокинового шторма.
Еще одним объектом настоящего изобретения является применение соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона

или его соли, гидрата, сольвата для изготовления лекарственного средства, предназначенного для подавления аберрантной активности интерлейкина-6.
Другим объектом изобретения является применение соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона

или его соли, гидрата, сольвата для изготовления лекарственного средства, предназначенного для терапии синдрома выброса цитокинов или цитокинового шторма.
Следующим объектом изобретения является применение соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона или его соли, гидрата, сольвата для получения фармацевтической композиции для предупреждения и/или лечения расстройства, ассоциированного с аберрантной активностью интерлейкина-6 и/или развитием синдрома высвобождения цитокинов или цитокинового шторама, предпочтительно для терапии COVID-19.
Изобретение также включает способ предупреждения и/или лечения расстройства, ассоциированных с аберрантной активностью интерлейкина-6 и/или развитием синдрома высвобождения цитокинов в организме или цитокинового шторма, включающий введение в указанный организм соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона или его соли, гидрата, сольвата, а также фармацевтической композиции на его основе Такое расстройство, ассоциированное с аберрантной активностью интерлейкина-6 и развитием синдрома выброса цитокинов, в некоторых неограничивающих вариантах воплощения изобретения представляет COVID-19. В частных случаях воплощения изобретения организм представляет собой человека или животного.
Следующим объектом изобретения является фармацевтическая композиция для предупреждения и/или лечения расстройства, ассоциированного с аберрантной активностью интерлейкина-6, содержащая терапевтически эффективное количество соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона или его соли, гидрата, сольвата, и по меньшей мере один фармацевтически приемлемый носитель.
Следующим объектом изобретения является фармацевтическая композиция для предупреждения и/или лечения расстройства, ассоциированного с развитием синдрома высвобождения цитокинов или цитокинового шторма, содержащая терапевтически эффективное количество соединения 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диона или его соли, гидрата, сольвата,, и по меньшей мере один фармацевтически приемлемый носитель.
Данная композиция содержит от 0,01 до 99,9 мас.% соединения 1, предпочтительно от 0,1 до 85 мас%, предпочтительно от 0,1 до 75 мас.%, предпочтительно от 0,1 до 65 мас.%, более предпочтительно от 10 до 3 мас%.
Соединение 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-дион (далее - соединение 1) известно и описано в заявке на изобретение WO 2014/168522 (опубл. 16.10.2014).
Описание чертежей
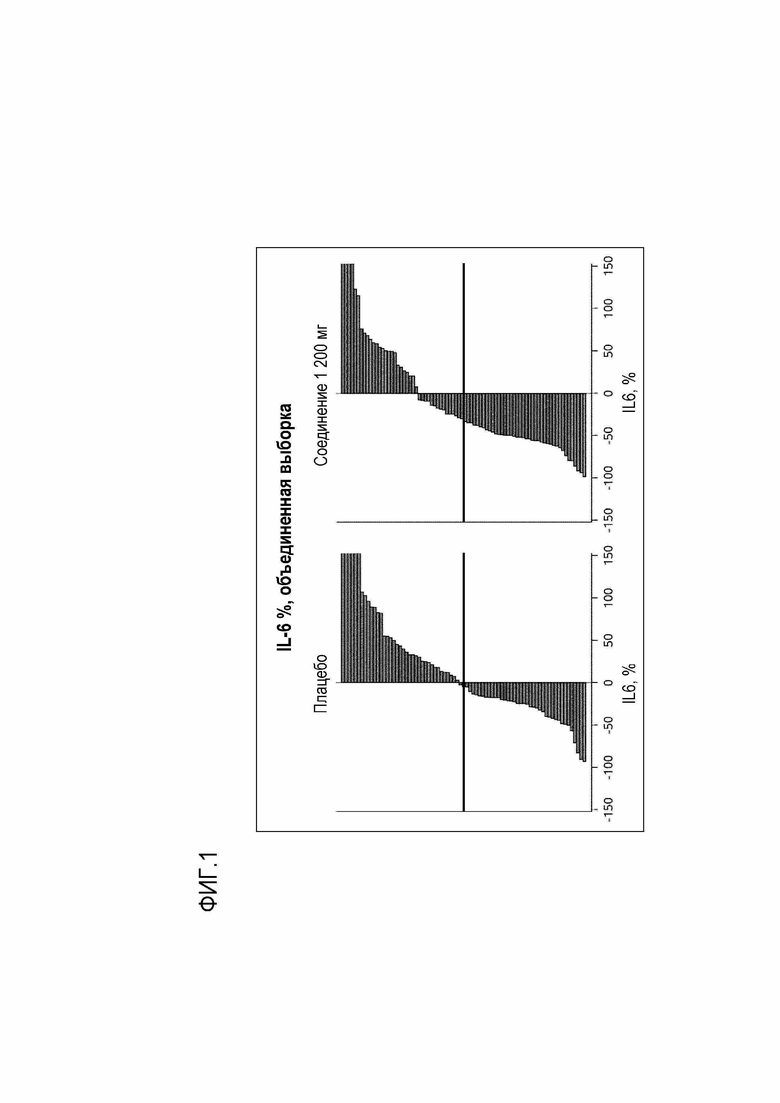
Фигура 1. Изменение уровня интерлейкина-6 на 4 день исследования по сравнению с исходным уровнем, измеренным в 1 день до приема препарата, у пациентов, принимавших Соединение 1 либо плацебо.
Подробное раскрытие изобретения
Получение Соединения 1, как и ряда других химических соединений, описано в заявке на изобретение WO 2014/168522 опубл. 16.10.2014). В указанной патентной заявке описаны производные глутаримидов. Для них исследовано противовирусное действие, более конкретно, их применение для лечения риновирусов и других заболеваний верхних дыхательных путей. Однако уже показано, что большинство ранее известных противовирусных препаратов не обладают терапевтической активностью относительно COVID-19, которая бы позволяла использовать данные препараты в клинической практике. Низкая эффективность существующих противовирусных препаратов для терапии COVID-19 умеренного и тяжелого течения во многом связана с развитием аберрантного иммунного ответа, последующего неконтролируемого воспаления легких и множественного повреждения органов, которые являются основной причиной летального исхода у пациентов с COVID-19 [Lancet Respir Med . 2020 Apr;8(4):420-422].
В заявке WO 2015/072893, опубл. 21.05.2015) описано применение Соединения 1 для лечения заболеваний, ассоциированных с развитием эозинофильного воспаления, включая эозинофильную астму. Важно отметить, что развитие эозинофильного воспаления не характерно для COVID-19, а низкий уровень эозинофилов крови, по видимому, может быть использован в качестве диагностического критерия для предварительной диагностики данного заболевания [Allergy. 2020 May 5. doi: 10.1111/all.14353].
В ходе клинических исследований активности Соединения 1, неожиданно было обнаружено, что терапевтическое применение Соединения 1 эффективно снижает выработку провоспалительного цитокина IL-6. Исследования в in vitro и iv vivo моделях подтвердили ингибирующее влияние Соединения 1 на продукцию и активность интерлейкина-6 и развитие цитокинового шторма. Преодоление аберрантной активности интерлейкина-6 и синдрома высвобождения цитокинов или цитокинового шторма, не может быть предсказано или объяснено ранее описанной эффективностью Соединения 1 в отношении терапии заболеваний верхних дыхательных путей или подавления эозинофильного воспаления.
Таким образом, Соединение 1 имеет ранее неизвестную и не очевидную для специалиста фармакологическую активность, связанную с влиянием на аберрантную активность интерлейкина-6 и синдром высвобождения цитокинов или цитокинового шторма, что свидетельствует о потенциальной применимости Соединения 1 для терапии заболеваний, ассоциированных с аберрантной активностью интерлейкина-6, для терапии синдрома высвобождения цитокина или для подавления развития цитокинового шторма, в частности, терапии COVID-19.
Термины и определения
Термин «аберрантная активность» цитокина в настоящем документе означает активность, существенно отличающуюся от базового уровня активности данного цитокина в организме при отсутствии патологии. Аберрантная активность может быть вызвана избыточной продукцией цитокина, нарушением процессов, связанных с деградацией цитокина, а также другими факторами.
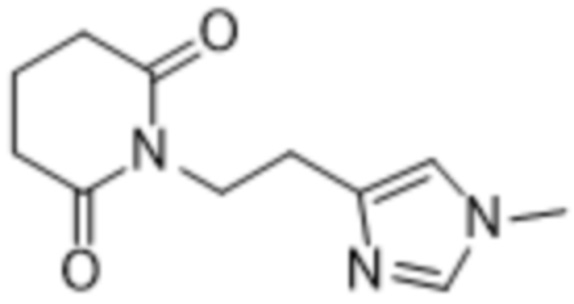
Термин «Соединение 1» относится к соединению 1-(2-(1-метил-1Н-имидазол-4-ил)этил)пиперидин-2,6-диону, представленному структурной формулой:

Термин «сольват» используется для описания молекулярного комплекса, содержащего соединение по изобретению и одну или более молекул фармацевтически приемлемого растворителя, например этанола. Термин «гидрат» используется, когда указанным растворителем является вода.
Термин «фармацевтически приемлемые соли» или «соли» включает соли активных соединений, которые получены с помощью относительно нетоксичных кислот. Примерами фармацевтически приемлемых нетоксичных солей могут служить соли, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная и хлорная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная, лимонная или малоновая кислоты, или полученные другими методами, используемыми в данной области. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат (мезилат), 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, полуфумарат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат (тозилат), ундеканат, валериат и подобные.
Термины «лечение», «терапия» охватывают лечение патологических состояний у млекопитающих, предпочтительно у человека, и включают: а) снижение, б) блокирование (приостановку) течения заболевания, в) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания, г) реверсирование заболевания или состояния, к которому данный термин применяется, или одного или более симптомов данного заболевания или состояния.
Термин «профилактика», «предотвращение» охватывает устранение факторов риска, а также профилактическое лечение субклинических стадий заболевания у млекопитающих, предпочтительно у человека, направленное на уменьшение вероятности возникновения клинических стадий заболевания. Пациенты для профилактической терапии отбираются на основе факторов, которые, на основании известных данных, влекут увеличение риска возникновения клинических стадий заболевания по сравнению с общим населением. К профилактической терапии относится а) первичная профилактика и б) вторичная профилактика. Первичная профилактика определяется как профилактическое лечение у пациентов, клиническая стадия заболевания у которых еще не наступила. Вторичная профилактика - это предотвращение повторного наступления того же или близкого клинического состояния или заболевания.
Соединение 1, перспективно для лечения заболеваний, ассоциированных с аберрантной активностью интерлейкина-6 и развитием синдрома высвобождения цитокинов или цитокинового шторма, предпочтительно для терапии COVID-19.
Термин «подавление аберрантной активности цитокина» обозначает терапию, направленную на регулирование высвобождения цитокина до желаемого уровня или блокировку его высвобождения.
COVID-19 (аббревиатура от англ. COronaVIrus Disease 2019), или коронавирусная инфекция 2019-nCoV - острая респираторная инфекция, вызываемая коронавирусом SARS-CoV-2 (2019-nCoV).
Способ терапевтического применения соединения
Предмет данного изобретения также включает введение субъекту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества Соединения 1, или его гидрата, сольвата или фармацевтически приемлемой соли. Под терапевтически эффективным количеством подразумевается такое количество соединения, вводимого или доставляемого пациенту, при котором у пациента с наибольшей вероятностью проявится желаемая реакция на лечение (профилактику). Точное требуемое количество может меняться от субъекта к субъекту в зависимости от возраста, массы тела и общего состояния пациента, тяжести заболевания, методики введения соединения, комбинированного применения с другими препаратами и т.п.
Соединение 1, его гидрат, сольват, фармацевтически приемлемая соль, или фармацевтическая композиция, содержащая указанное соединение 1 или его гидрат, сольват, фармацевтически приемлемая соль, могут быть введены в организм пациента в любом количестве (предпочтительно, суточная доза действующего вещества составляет до 0,5 г на пациента в сутки, наиболее предпочтительно, суточная доза составляет 60-250 мг/сутки, предпочтительно 100-200 мг/сутки) и любым путем введения (предпочтительно, пероральный путь введения), эффективным для лечения или профилактики заболевания.
После смешения соединения 1 или его гидрата, сольвата, фармацевтически приемлемой соли с конкретным подходящим фармацевтически допустимым носителем в желаемой дозировке, фармацевтические композиции, составляющие суть изобретения, могут быть введены в организм человека или других животных перорально, парентерально, местно и т.п.
Введение может осуществляться как разово, так и несколько раз в день, неделю или две (или любой другой временной интервал), или время от времени. Кроме того, соединение может вводиться в организм пациента ежедневно в течение определенного периода дней (например, 3-14 дней), а затем следует период без приема вещества (например, 1-30 дней).
Применение Соединения 1 в комбинированной терапии
В том случае, когда соединение 1 используется как часть режима комбинированной терапии, доза каждого из компонентов комбинированной терапии вводится в течение требуемого периода лечения. Соединения, составляющие комбинированную терапию, могут вводиться в организм пациента как единовременно, в виде дозировки, содержащей все компоненты, так и в виде индивидуальных дозировок компонентов.
Несмотря на то, что Соединение 1 по данному изобретению может вводиться в качестве индивидуального активного терапевтического агента, его также можно использовать в сочетании с одним или несколькими другими агентами, в частности, другой агент может представлять собой глюкокортикостероид, противовирусное средство, моноклональныое антитело и т.д. При совместном приеме внутрь терапевтические агенты могут представлять собой разные лекарственные формы, которые вводятся одновременно или последовательно в разное время, либо терапевтические агенты могут быть объединены в одну лекарственную форму.
Фраза «комбинированная терапия» в отношении Соединения 1 в сочетании с другими терапевтическими агентами, означает одновременный или последовательный прием всех агентов, который так или иначе обеспечит благоприятное воздействие сочетания терапевтических агентов. Совместное введение подразумевает, в частности, совместную доставку, например, в одной таблетке, капсуле, инъекции или в другой форме, имеющий фиксированное соотношение терапевтических агентов, также как и одновременную доставку в нескольких, отдельных лекарственных формах для каждого терапевтического агента соответственно.
Таким образом, введение Соединения 1 может быть осуществлено в сочетании с дополнительными методами лечения, известными специалистам в области профилактики и лечения соответствующих заболеваний, включающими применение антибактериальных и противовирусных препаратов, препаратов для подавления симптомов или побочных эффектов одного из терапевтических агентов.
Если выбранная для терапии лекарственная форма представляет собой фиксированную дозу, такая комбинация использует соединение 1 в приемлемом дозовом диапазоне. Соединение 1 по данному изобретению также может быть введено в организм пациента последовательно с другими агентами, в том случае, когда комбинация этих препаратов в одной дозе невозможна. Изобретение не ограничено последовательностью введения; соединение данного изобретения может быть введено в организм пациента совместно, до или после введения другого препарата.
Примеры
Получение соединения 1
Получение Соединения 1, как и ряда других химических соединений, описано в заявке на изобретение WO 2014/168522 опубл. 16.10.2014).
Характеристика биологической активности Соединения 1
Биологическая активность Соединения 1, была изучена в ходе in vitro исследований, а так же в ходе многоцентровых двойных-слепых рандомизированных плацебо-контролируемых клинических исследований II Фаз у пациентов с неосложненным гриппом или другими ОРВИ. Было показано, что терапевтическое применение Соединения 1 вызывает статистически значимое снижение уровня интерлейкина-6 на 4 день после начала лечения. Снижение уровня интерлейкина-6 не может быть предсказано или объяснено ранее описанной способностью Соединения 1 оказывать противовирусное действие в отношении риновирусов или подавлять эозинофильное воспаление.
In vitro исследования фармакологической активности Соединения 1 позволили установить, что применение Соединения 1 оказывает ингибирующее действие на продукцию интерлейкина-6.
Таким образом, было показано, что Соединение 1 подавляет аберрантную активность интерлейкина-6 и подавляет развитие синдрома высвобождения цитокинов. Снижение аберрантной активности цитокинов может применяться в терапии целого ряда заболеваний и, в частности, для терапии COVID-19.
Исследование влияния Соединения 1 на продукцию (высвобождение) интерлейкина-6 in vitro
Влияние Соединения 1 на продукцию интерлейкина-6 было изучено с использованием клеток A549 (линия эпителиальных клеток аденокарциномы легких), инфицированных респираторно-синцитиальным вирусом человека (РСВ). Исследование включало оценку влияния соединения Соединения 1 на жизнеспособность клеток A549, репродукцию РСВ в клетках A549, а также на спонтанную и индуцированную РСВ продукцию интерлейкина-6 в клетках A549.
Для анализа влияния Соединения 1 на репродукцию вируса и выработку интерлейкина-6 in vitro в РСВ-инфицированных клетках A549 в лунки с монослоем клеток A549, отмытых от культуральной среды, добавляли Соединение 1 в концентрациях 1 нг/мл, 10 нг/мл, 100 нг/мл, 1000 нг/мл и 3000 нг/мл, затем добавляли вирусосодержащую среду с MOI 0,01 (100 мкл/лунку) и доводили общий объем до 500 мкл внесением необходимого количества полной культуральной среды. Для контроля репродукции вируса в лунки с монослоем клеток A549 добавляли вирусосодержащую среду с MOI 0,01 (100 мкл/лунку) в отсутствии Соединения 1. Неинфицированные клетки с добавлением Соединения 1 использовались для оценки влияния Соединения 1 на спонтанное высвобождениентерлейкина-6 и одновременно служили отрицательным контролем для оценки репродукции вируса. Планшеты инкубировали в СО2-инкубаторе при 37 °С в течение 24 часов, затем в соответствующие лунки повторно вносили Соединение 1 в концентрациях 1 нг/мл, 10 нг/мл, 100 нг/мл, 1000 нг/мл и 3000 нг/мл и инкубировали в течении 24 часов. Через 48 ч после начала эксперимента среду из лунок использовали для определения содержания интерлейкина-6 с помощью твердофазного ИФА (ELISA).
В результате эксперимента было установлено, что Соединение 1
не оказывает цитотоксического действия на клетки A549;
не влияет на репродукцию РСВ в культуре клеток A549 и спонтанное высвобождение IL-6 клетками A549;
существенно (в среднем в 2,3-8,5 раза в зависимости от концентрации) подавляет аберрантное высвобождение IL-6 в культуре клеток A549.
Исследование активности Соединения 1 в ходе клинических исследований
Эффективность и безопасность Соединения 1 у человека была изучена в трех двойных слепых, рандомизированных, плацебо-контролируемых клинических исследованиях I и II фаз, проведенных в Российской Федерации (см. Таблицу 1).
Перечень клинических исследований препарата на основе Соединения 1.
(Соединение 1/
плацебо)
(Длительность лечения)
(24/8)
(Однократный прием, затем ежедневно в течение 5 дней)
(81/39)
(Ежедневно в течение 3 дней)
(60/60)
(Ежедневно в течение 3 дней)
В ходе многоцентрового двойного-слепого рандомизированного клинического исследования IIa фазы в параллельных группах по оценке эффективности и безопасности различных доз препарата на основе Соединения 1 по сравнению с плацебо было неожиданно обнаружено, что терапевтическое применение препарата на основе Соединения 1 оказывало ингибирующее действие на высвобождение интерлейкина-6.
На этапе исследуемой терапии пациенты один раз в сутки перорально получали препарат на основе Соединения 1 или плацебо в течение 3 дней. Концентрация интерлейкина-6 в сыворотке крови оценивалась до введения препарата (день 1), после трех дней терапии (день 4), а также спустя 3 дня после окончания терапии (день 6).
Сравнение результатов, полученных на 4 день исследования, и исходными данными, полученными до начала терапии, показало увеличение концентрации интерлейкина-6 в группе плацебо, и статистически значимое снижение концентрации интерлейкина-6 в группе, получавшей препарат на основе Соединения 1. Сравнение различий в медианном процентном изменении концентрации IL-6 в группах, получавших Соединение 1, и плацебоподтвердило статистически значимое снижение концентрации интерлейкина-6 в группе Соединения 1 (-с использованием критерия Манна-Уитни)
Кроме того, в группах лечения, получавших препарат на основе Соединения 1 в дозах 100 мг в день и 200 мг в день, также анализировали медианные значения межгрупповой разницы в процентном изменении концентрации интерлейкина-6 в дни 4 и 6 по сравнению с исходными данными. Было показано, что введение препарата на основе Соединения 1 вызывает снижение концентрации интерлейкина-6 в дни 4 и 6 по сравнению с исходными данными: -18,72% для группы 100 мг (95% ДИ: -47,91; 4,58) и -30,24% для группы 200 мг (95% ДИ: -54,78; -0,77).
Ингибирующее действие Соединения 1 на высвобождение интерлейкина-6 было подтверждено в ходе многоцентрового двойного-слепого рандомизированного клинического исследования IIb фазы по оценке эффективности и безопасности препарата на основе Соединения 1 по сравнению с плацебо.
Кроме того, с целью выявления общих закономерностей действия Соединения 1, был проведен дополнительный статистический анализ объединенных данных двух клинических исследований (соответствующих фазам IIa и IIb Таблицы 1). В качестве основного показателя изменения уровня интерлейкина-6 была использована медиана процентного изменения уровня цитокина на 4 день исследования, по сравнению с исходным уровнем, измеренным до начала приема препарата (день 1). Было проведено сравнение уровня интерлейкина-6 среди пациентов с ОРВИ и гриппом, получавших препарат на основе Соединения 1 в дозе 200 мг в сутки и пациентов с ОРВИ и гриппом, получавших плацебо, в объединенной выборке по указанным двум исследованиям. Для объединенной выборки показан статистически значимо более низкий уровень интерлейкина-6 на 4 день исследования у пациентов, принимавших препарат на основе Соединения 1, чем у пациентов, принимавших плацебо (попарное сравнение, критерий Манна-Уитни).
Процентное изменение концентрации интерлейкина-6 в крови на 4 день исследования по сравнению с исходным уровнем, измеренным до приема препарата.
Соотношение изменения уровня интерлейкина-6 на 4 день исследования по сравнению с исходным уровнем, измеренным до приема препарата, у пациентов, принимавших препарат на основе Соединения 1 либо плацебо, представлено графически на фигуре 1. На ней продемонстрировано изменение уровня интерлейкина-6 на 4 день исследования по сравнению с исходным уровнем, измеренным за 1 день до приема препарата, у пациентов, принимавших Соединение 1 (n=80) либо плацебо (n=77). В объединенной выборке фаз IIa и IIb. Горизонтальная линия указывает на медианное значение процентного изменения концентрации интерлейкина-6 на 4 день исследования по сравнению с исходным уровнем, измеренным в 1 день до приема препарата.
По результатам проведенного анализа объединенной выборки, описанной выше, у пациентов с ОРВИ и гриппом прием Соединения 1 в дозе 200 мг вызывает статистически значимое снижение уровня интерлейкина-6 на 4 день после начала лечения по сравнению с соответствующим уровнем интерлейкина-6 у пациентов без лечения, принимавших плацебо.
Таким образом, Соединение 1 в клинических исследованиях вызывает достоверное снижение концентрации интерлейкина-6 и может использоваться для терапии заболеваний, ассоциированных с аберрантной активностью интерлейкина-6 и терапии развития синдрома высвобождения цитокинов или цитокинового шторма.
Пример состава фармацевтической композиции
Качественный и количественный состав на единицу лекарственного препарата на основе Соединения 1 представлен в таблице 3:
Таблица 3
Изобретение относится к применению соединения 1-(2-(1-метилимидазол-4-ил)этил)пиперидин-2,6-диона формулы (I) или его фармацевтически приемлемой соли, гидрата или сольвата для изготовления фармацевтической композиции для предупреждения и/или лечения COVID-19, а также к способу предупреждения и/или лечения COVID-19, включающему введение нуждающемуся субьекту фармацевтической композиции, содержащей от 0,01 до 99,99 мас.%. Технический результат: лечение COVID-19. 2 н. и 1 з.п. ф-лы, 1 ил., 3 табл., 1 пр.
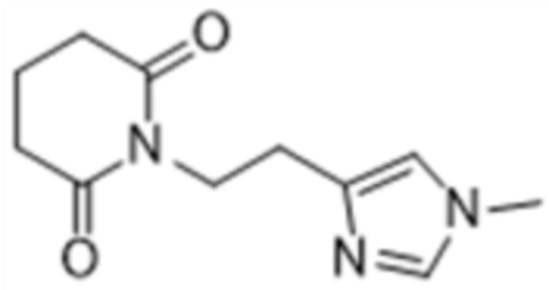 (I)
(I)
1. Применение соединения 1-(2-(1-метилимидазол-4-ил)этил)пиперидин-2,6-диона формулы 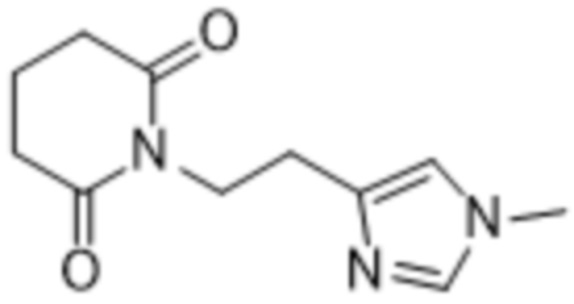 или его фармацевтически приемлемой соли, гидрата или сольвата для изготовления фармацевтической композиции для предупреждения и/или лечения COVID-19.
или его фармацевтически приемлемой соли, гидрата или сольвата для изготовления фармацевтической композиции для предупреждения и/или лечения COVID-19.
2. Способ предупреждения и/или лечения COVID-19, включающий введение нуждающемуся субъекту фармацевтической композиции, содержащей от 0,01 до 99,99 мас.% соединения 1-(2-(1-метил имидазол-4-ил)этил)пиперидин-2,6-диона формулы

или его фармацевтически приемлемой соли, и по меньшей мере один фармацевтически приемлемый носитель в количестве 100-200 мг в сутки.
3. Способ по п. 2 , где композиция содержит соединение в количестве от 30 до 500 мг.
| US 20160184330 A, 30.06.2016 | |||
| WO 2014168522 A1, 16.10.2014 | |||
| Jennifer R | |||
| Tisoncik et al " Into the Eye of the Cytokine Storm", Microbiology and Molecular Biology Reviews, 2012 Volume 76 Number 1, p | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Shailza Shreshtha et al "Cytokine Release Syndrome: An Overview on its Features and Management", Journal of Pure and Applied Microbiology, | |||
Авторы
Даты
2022-06-27—Публикация
2020-06-26—Подача