Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическому препарату для лечения или предупреждения глаукомы или глазной гипертензии, содержащему омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, где фармацевтический препарат вводят пациенту, для которого недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
Уровень техники
Глаукома является трудноизлечимым глазным заболеванием, при котором внутриглазное давление повышается по разным патологическим причинам и разрушаются внутренние ткани глазного яблока (такие как сетчатка и зрительный нерв), что может привести к слепоте. Обычным способом лечения глаукомы является снижающая внутриглазное давление терапия и ее типичные примеры включают лекарственную терапию, лазерную терапию и хирургию.
Лекарственные средства, использующиеся при лекарственной терапии, включают симпатомиметики (неселективные стимуляторы, такие как дипивефрин и агонисты α2-рецептора, такие как бримонидин), симпатолитики (блокаторы β-рецептора, такие как тимолол, бефунолол, картеолол, нипрадилол, бетаксолол, левобунолол и метипранолол, и блокаторы α1-рецептора, такие как буназозингидрохлорид), парасимпатомиметики (такие как пилокарпин), ингибиторы карбоангидразы (такие как ацетазоламид), простагландины (такие как изопропил унопростон, латанопрост, травопрост и биматопрост), ингибиторы киназы Rho (рипасудил) и т. п.
Из этих лекарственных средств содержащие латанопрост глазные капли широко использовались в разных странах мира с момента их первого появления на мировом рынке в 1996 г. вследствие высокой эффективности при снижении внутриглазное давление и хорошей переносимости. Однако известно, что имется целый ряд пациентов, для которых воздействие латанопроста недостаточно эффективно.
Кроме того, омиденепаг является соединением, описанным как одна из многочисленных пиридиламиноуксусных кислот в Патентной литературе 1 и Патентной литературе 2. Указано, что эти пиридиламиноуксусные кислоты обладают агонистической активностью по отношению к EP2 (Патентная литература 2) и, таким образом, предполагается, что они эффективны для снижения внутриглазного давления и могут представлять собой средство лечения глаукомы (Патентная литература 1).
Кроме того, в Патентной литературе 3 и 4 указано, что эффективность снижения внутриглазного давления увеличивается при объединении омиденепага с другим средством лечения глаукомы, таким как тимолол, в Патентной литературе 5 указано, что омиденепаг при определенном содержании обладает особенно высокой эффективностью для снижения внутриглазного давления и в Патентной литературе 6 указано, что омиденепаг применим в качестве средства лечения заболеваний, сопровождающихся значительно повышенным внутриглазным давлением.
Кроме того, в Патентной литературе 7-9 описаны конкретные препараты, содержащие омиденепаг в качестве активного ингредиента.
Следует отметить, что все содержание Патентной литературы 1-9 и другой литературы, описанной в настоящей заявке, включено в настоящую заявку в качестве раскрытия.
Однако ни в одной из описанных ссылок не описана эффективность воздействия омиденепага, его сложного эфира или его соли на пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии и не имеется другой литературы или описаний исследований о такой эффективности.
Список литературы
Патентная литература
Патентная литература 1: Unites States Patent Application Publication No. 2012/0190852
Патентная литература 2: Unites States Patent Application Publication No. 2011/0054172
Патентная литература 3: Unites States Patent Application Publication No. 2014/0018396
Патентная литература 4: Unites States Patent Application Publication No. 2014/0018350
Патентная литература 5: Unites States Patent Application Publication No. 2015/0196541
Патентная литература 6: International Publication No. WO2017/006985
Патентная литература 7: Unites States Patent Application Publication No. 2016/0317512
Патентная литература 8: Unites States Patent Application Publication No. 2016/0317664
Патентная литература 9: International Publication No. WO2017/002941
Сущность изобретения
Весьма привлекательна задача поиска фармацевтического препарата, который лечит или предупреждает глаукому или глазную гипертензию и является эффективным для пациентов, для которых недостаточно эффективны средства лечения глаукомы или глазной гипертензии.
Средства решения задач
С учетом указанного выше авторы настоящего изобретения провели тщательное исследование и в результате установили, что омиденепаг, его сложный эфир или его соль обладает превосходной способностью снижать внутриглазное давление у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии. Таким образом было завершено настоящее изобретение. Точнее, настоящее изобретение относится к следующему.
[1]
Фармацевтический препарат для лечения или предупреждения глаукомы или глазной гипертензии, включающий: омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, где фармацевтический препарат вводят пациенту, для которого недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
[2]
Фармацевтический препарат по параграфу [1], описанный выше, где лечение или предупреждение глаукомы или глазной гипертензии включает лечение или предупреждение глаукомы или глазной гипертензии другими средствами лечения глаукомы или глазной гипертензии и последующее лечение или предупреждение глаукомы или глазной гипертензии путем снижения внутриглазного давления с помощью активного ингредиента.
[3]
Фармацевтический препарат по параграфу [1] или [2], описанный выше, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является производное простагландина F2α.
[4]
Фармацевтический препарат по любому из параграфов [ [1] - [3], описанный выше, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является латанопрост.
[5]
Фармацевтический препарат по любому из параграфов [ [1] - [4], описанный выше, в котором содержание омиденепага, его сложного эфира или его соли равно от 0,001 до 0,003% (мас./об.).
[6]
Фармацевтический препарат по любому из параграфов [ [1] - [5], описанный выше, в котором содержание омиденепага, его сложного эфира или его соли равно 0,002% (мас./об.).
[7]
Фармацевтический препарат по любому из параграфов [ [1] - [6], описанный выше, в котором омиденепаг, его сложный эфир или его соль представляет собой омиденепаг изопропил.
[8]
Фармацевтический препарат по любому из параграфов [ [1] - [7], описанный выше, который представляет собой глазные капли.
[9]
Фармацевтический препарат, который лечит или предупреждает глаукому или глазную гипертензию, включающий: омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, где глаукома представляет собой глаукому, устойчивую к лечению глаукомы другими активными ингредиентами, не представляющими собой омиденепаг, его сложный эфир или его соль, и где глазная гипертензия представляет собой глазную гипертензию, устойчивую к лечению глазной гипертензии другими активными ингредиентами.
[10]
Способ лечения или предупреждения глаукомы или глазной гипертензии, включающий: введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, где пациентом является пациент, для которого недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
[11]
Способ по параграфу [10], описанный выше, где лечение или предупреждение глаукомы или глазной гипертензии включает лечение или предупреждение глаукомы или глазной гипертензии другими средствами лечения глаукомы или глазной гипертензии и последующее лечение или предупреждение глаукомы или глазной гипертензии путем снижения внутриглазного давления с помощью активного ингредиента.
[12]
Способ по параграфу [10] или [11], описанный выше, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является производное простагландина F2α.
[13]
Способ по любому из параграфов [10] - [12], описанный выше, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является латанопрост.
[14]
Способ по любому из параграфов [10] - [13], описанный выше, в котором содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате равно от 0,001 до 0,003% (мас./об.).
[15]
Способ по любому из параграфов [10] - [14], описанный выше, в котором содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате равно 0,002% (мас./об.).
[16]
Способ по любому из параграфов [10] - [15], описанный выше, в котором омиденепаг, его сложный эфир или его соль представляет собой омиденепаг изопропил.
[17]
Способ по любому из параграфов [10] - [16], описанный выше, в котором введением является введение в глаза.
[18]
Способ лечения или предупреждения глаукомы или глазной гипертензии, включающий: введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, где глаукома представляет собой глаукому, устойчивую к лечению глаукомы другими активными ингредиентами, не представляющими собой омиденепаг, его сложный эфир или его соль, и где глазная гипертензия представляет собой глазную гипертензию, устойчивую к лечению глазной гипертензии другими активными ингредиентами.
[19]
Способ лечения или предупреждения глаукомы или глазной гипертензии, включающий введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, способ включает следующие стадии:
(1) первую стадию введения пациенту другого средства лечения глаукомы или глазной гипертензии, не представляющего собой омиденепаг, его сложный эфир или его соль;
(2) стадию установления того, является ли первая стадия лечения недостаточной для лечения или недостаточной для обеспечения предупреждения; и
(3) вторую стадию лечения, включающую дополнительное введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, если первая стадия лечения является недостаточной для лечения или недостаточной для обеспечения предупреждения.
[20]
Применение фармацевтического препарата по любому из параграфов [1] - [9], описанного выше, для приготовления лекарственного средства, которое лечит или предупреждает глаукому или глазную гипертензию.
Следует отметить, что два или большее количество указанных положений [1] - [20] необязательно можно выбрать и объединить.
Как подробно описано в приведенных ниже в примерах, установлено, что омиденепаг, его сложный эфир или его соль обладает превосходной способностью снижать внутриглазное давление у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии. Поэтому омиденепаг, его сложный эфир или его соль применим в качестве фармацевтического препарата, который лечит или предупреждает глаукому или глазную гипертензию даже у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
Краткое описание чертежей
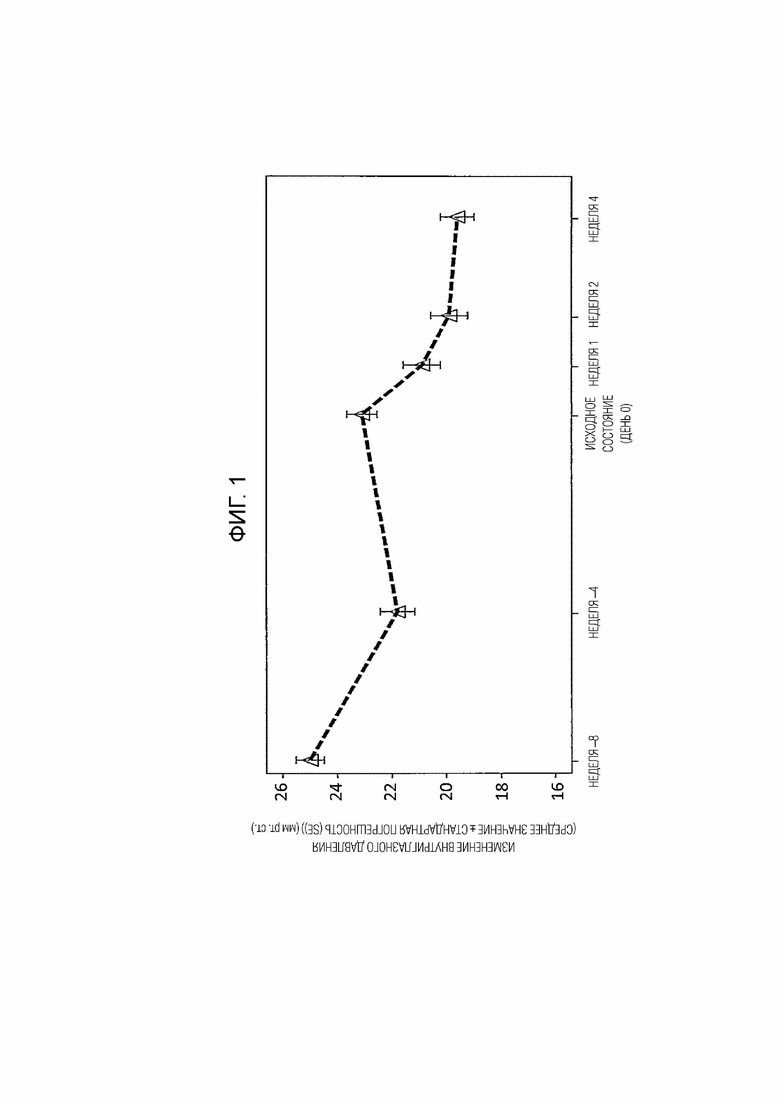
На фиг. 1 представлена полученная в клиническом исследовании зависимость изменения внутриглазного давления от времени.
Описание вариантов осуществления
Ниже подробно описаны варианты осуществления настоящего изобретения.
[Фармацевтический препарат]
Омиденепаг, содержащийся в фармацевтическом препарате, предлагаемом в настоящем изобретении, является соединением, описывающимся приведенной ниже формулой (1) (CAS registration number; 1187451-41-7):
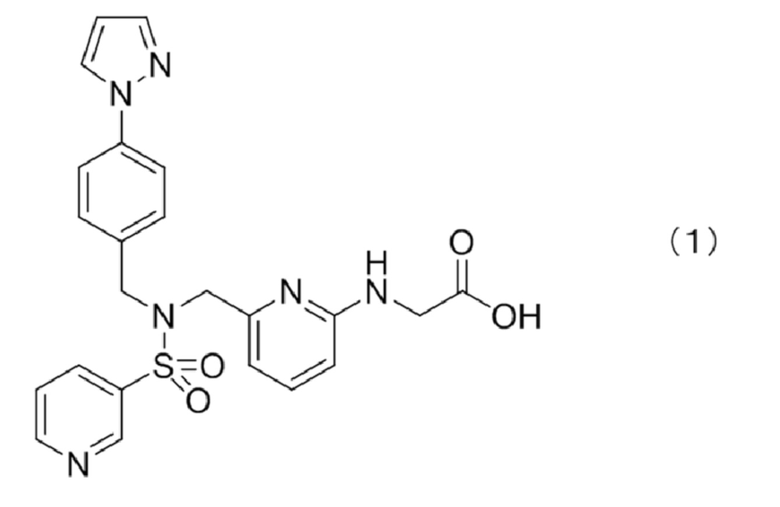
и также называется (6-{[4-(пиразол-1-ил)бензил](пиридин-3-илсульфонил)аминометил}пиридин-2-иламино)уксусной кислотой.
Сложный эфир омиденепага, содержащийся в фармацевтическом препарате, предлагаемом в настоящем изобретении, предпочтительно представляет собой сложный эфир, полученный дегидратирующей конденсацией карбоксигруппы омиденепага одноатомным спиртом, содержащим от 1 до 6 атомов углерода и предпочтительно представляет собой сложный эфир, полученный дегидратирующей конденсацией карбоксигруппы омиденепага одноатомным спиртом, более предпочтительно содержащим от 2 до 5 атомов углерода и более предпочтительно содержащим 3 или 4 атома углерода. Конкретные сложные эфиры включают метиловые сложные эфиры, этиловые сложные эфиры, н-пропиловые сложные эфиры, изопропиловые сложные эфиры, н-бутиловые сложные эфиры, изобутиловые сложные эфиры, втор-бутиловые сложные эфиры, трет-бутиловые сложные эфиры, н-пентиловые сложные эфиры и н-гексиловые сложные эфиры, более предпочтительно этиловые сложные эфиры, н-пропиловые сложные эфиры, изопропиловые сложные эфиры и более предпочтительно изопропиловые сложные эфиры. Конкретный изопропиловый эфир омиденепага является соединением, описывающимся приведенной ниже формулой (2) (CAS registration number; 1187451-19-9):
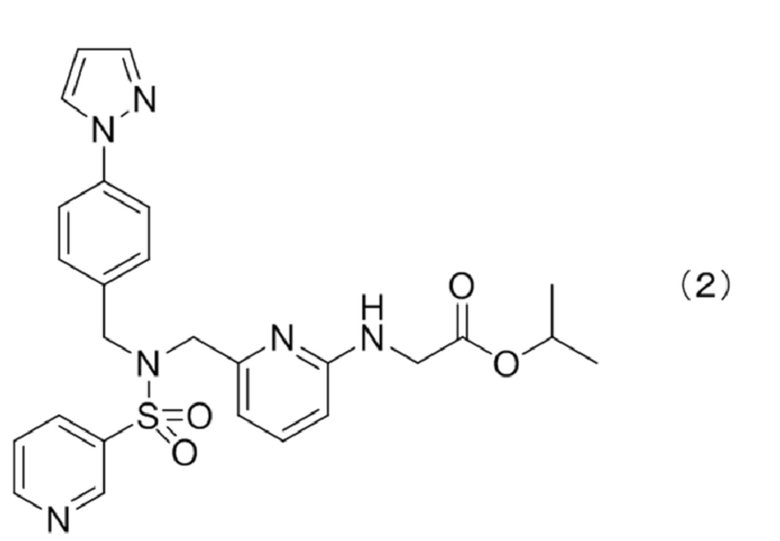
и также называется, как омиденепаг изопропил или изопропил-(6-{[4-(пиразол-1-ил)бензил](пиридин-3-илсульфонил)аминометил}пиридин-2-иламино)ацетат.
На соль омиденепага или соль сложного эфира омиденепага, содержащуюся в фармацевтическом препарате, предлагаемом в настоящем изобретении, не налагаются особые ограничения, если он представляет собой фармакологически приемлемую соль. Конкретные примеры включают соли неорганических кислот, такие как гидрохлориды, гидробромиды, гидройодиды, нитраты, сульфаты и фосфаты; соли органических кислот, такие как ацетаты, трифторацетаты, бензоаты, оксалаты, малонаты, сукцинаты, малеаты, фумараты, тартраты, цитраты, метансульфонаты, этансульфонаты, трифторметансульфонаты, бензолсульфонаты, п-толуолсульфонаты, глутаматы и аспартаты; соли металлов, такие как натриевые соли, калиевые соли, кальциевые соли и магниевые соли; неорганические соли, такие как соли аммония; и соли органических аминов, такие как соли триэтиламина или соли гуанидина, и предпочтительно включают гидрохлориды и трифторацетаты.
Омиденепаг, его сложный эфир или его соль, содержащаяся в фармацевтическом препарате, предлагаемом в настоящем изобретении, можно получить, например, по обычной методике, использующейся в данной области техники, и по методикам, описанным в Публикации патента США № 2012/0190852 (Патентная литература 1) и в Публикации заявки на патент США № 2011/0054172 (Патентная литература 2). В методиках получения содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате, предлагаемом в настоящем изобретении, тип и количество добавки, путь введения и т. п. могут быть такими, как описано в указанной выше литературе. Следует отметить, что термин "омиденепаг, его сложный эфир или его соль", использующийся в настоящей заявке, включает (1) омиденепаг, (2) сложный эфир омиденепага, (3) соль омиденепага и (4) соль сложного эфира омиденепага.
На содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате, предлагаемом в настоящем изобретении, не налагаются особые ограничения и оно зависит от пути введения, и его нижнее предельное значение составляет, например, 0,000001% (мас./об.), предпочтительно 0,00001% (мас./об.), более предпочтительно 0,00003% (мас./об.), 0,0001% (мас./об.), 0,001 (мас./об.), 0,01% (мас./об.), 0,1% (мас./об.) или 1% (мас./об.). Верхнее предельное значение указанного выше содержания может составлять, например, 30% (мас./об.), 25% (мас./об.), 20% (мас./об.), 15% (мас./об.) или 12% (мас./об.), или 0,03% (мас./об.), 0,01% (мас./об.), 0,005% (мас./об.), 0,003% (мас./об.) или 0,0027% (мас./об.). Более предпочтительно, если указанное выше содержание может находиться в диапазоне, образованном путем объединения любых из указанных выше нижних предельных значений и верхних предельных значений и составляет, например, от 0,000001 до 30% (мас./об.), предпочтительно от 0,00001 до 25% (мас./об.), более предпочтительно от 0,00003 до 20% (мас./об.), более предпочтительно от 0,0001 до 15% (мас./об.), еще более предпочтительно от 0,0013 до 12% (мас./об.) и особенно предпочтительно от 0,0015 до 10% (мас./об.). Выражение "% (мас./об.)" в настоящем изобретении означает массу (г) активного ингредиента (омиденепага, его сложного эфира или его соли) или добавки (такой как поверхностно-активное вещество) в 100 мл фармацевтического препарата. Например, омиденепаг при содержании 0,01% (мас./об.) означает, что содержание омиденепага в 100 мл фармацевтического препарата равно 0,01 г.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, представляет собой глазные капли, нижнее предельное значение содержания омиденепага, его сложного эфира или его соли в фармацевтическом препарате, предлагаемом в настоящем изобретении, предпочтительно составляет 0,0003% (мас./об.), более предпочтительно 0,001% (мас./об.), более предпочтительно 0,0013% (мас./об.) и еще более предпочтительно 0,0015% (мас./об.). Кроме того, верхнее предельное значение указанного выше содержания предпочтительно составляет 0,03% (мас./об.), более предпочтительно 0,01% (мас./об.), более предпочтительно 0,005% (мас./об.), еще более предпочтительно 0,003% (мас./об.) и особенно предпочтительно 0,0027% (мас./об.). Более предпочтительно, если указанное выше содержание может находиться в диапазоне, образованном путем объединения любых нижних предельных значений и верхних предельных значений и предпочтительно составляет от 0,0003 до 0,03% (мас./об.), более предпочтительно от 0,001 до 0,01% (мас./об.), более предпочтительно от 0,001 до 0,005% (мас./об.), еще более предпочтительно от 0,001 до 0,003% (мас./об.), особенно предпочтительно от 0,0013 до 0,003% (мас./об.) и еще более предпочтительно от 0,0015 до 0,0027% (мас./об.). Особенно предпочтительными являются 0,0010% (мас./об.), 0,0011% (мас./об.), 0,0012% (мас./об.), 0,0013% (мас./об.), 0,0014% (мас./об.), 0,0015% (мас./об.), 0,0016% (мас./об.), 0,0017% (мас./об.), 0,0018% (мас./об.), 0,0019% (мас./об.), 0,0020% (мас./об.), 0,0021% (мас./об.), 0,0022% (мас./об.), 0,0023% (мас./об.), 0,0024% (мас./об.), 0,0025% (мас./об.), 0,0026% (мас./об.), 0,0027% (мас./об.), 0,0028% (мас./об.), 0,0029% (мас./об.), 0,0030% (мас./об.), 0,005% (мас./об.), 0,01% (мас./об.), 0,03% (мас./об.) и диапазон, включающий указанные выше значения в качестве верхнего предельного значения или нижнего предельного значения и 0,002% (мас./об.) является наиболее предпочтительным. Следует отметить, что указанное выше содержание является предпочтительным примером для глазных капель, но не ограничивается только глазными каплями.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, представляет собой средство для инъекции в глаза, нижнее предельное значение содержания омиденепага, его сложного эфира или его соли в фармацевтическом препарате, предлагаемом в настоящем изобретении, предпочтительно составляет 0,000001% (мас./об.), более предпочтительно 0,000003 (мас./об.), более предпочтительно 0,000005% (мас./об.), еще более предпочтительно 0,00001% (мас./об.) и особенно предпочтительно 0,00003% (мас./об.). Кроме того, верхнее предельное значение указанного выше содержания предпочтительно составляет 30% (мас./об.), более предпочтительно 10% (мас./об.), более предпочтительно 1% (мас./об.), еще более предпочтительно 0,1% (мас./об.) и особенно предпочтительно 0,01% (мас./об.). Более предпочтительно, если указанное выше содержание может находиться в диапазоне, образованном путем объединения любых нижних предельных значений и верхних предельных значений и предпочтительно составляет от 0,000001 до 30% (мас./об.), более предпочтительно от 0,000003 до 10% (мас./об.), более предпочтительно от 0,000005 до 1% (мас./об.), еще более предпочтительно от 0,00001 до 0,1% (мас./об.) и особенно предпочтительно от 0,00003 до 0,01% (мас./об.). Следует отметить, что указанное выше содержание является предпочтительным примером средства для инъекции в глаза, но не ограничивается только средством для инъекции в глаза.
Следует отметить, что в случае, когда фармацевтический препарат, предлагаемый в настоящем изобретении, содержит соль омиденепага или его сложный эфир, содержание омиденепага или его сложного эфира при высвобождении соли находится в указанном выше диапазоне.
[Добавка]
При необходимости в фармацевтическом препарате, предлагаемом в настоящем изобретении, можно использовать добавку. В качестве добавки, например, можно прибавить поверхностно-активные вещества, буферные агенты, агенты, регулирующие тоничность, стабилизаторы, консерванты, антиоксиданты, загустители, основания, регуляторы pH и т. п.
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с поверхностно-активным веществом, которое можно использовать в качестве фармацевтической добавки.
Примеры поверхностно-активного вещества включают системы полиоксиэтилен касторовое масло, системы полиоксиэтилен - гидрированное касторовое масло, полиоксиэтиленсорбитановые эфиры жирных кислот, витамин E TPGS, полиоксиэтиленовые эфиры жирных кислот, полиоксиэтиленполиоксипропиленгликоль, эфиры сахарозы жирных кислот и т. п.
Более предпочтительно, если в качестве систем полиоксиэтилен касторовое масло, можно использовать разные системы полиоксиэтилен касторовое масло, обладающие разными степенями полимеризации этиленоксида, и степень полимеризации этиленоксида предпочтительно равна от 5 до 100, более предпочтительно от 20 до 50, еще более предпочтительно от 30 до 40 и наиболее предпочтительно 35. Конкретные примеры систем полиоксиэтилен касторовое масло включают полиоксил 5 касторовое масло, полиоксил 9 касторовое масло, полиоксил 15 касторовое масло, полиоксил 35 касторовое масло, полиоксил 40 касторовое масло и т. п., и полиоксил 35 касторовое масло является наиболее предпочтительным.
В качестве систем полиоксиэтилен - гидрированное касторовое масло можно использовать различные системы полиоксиэтилен - гидрированное касторовое масло, обладающие разными степенями полимеризации этиленоксида, и степень полимеризации этиленоксида предпочтительно равна от 10 до 100, более предпочтительно от 20 до 80, еще более предпочтительно от 40 до 70 и наиболее предпочтительно 60. Конкретные примеры системы полиоксиэтилен - гидрированное касторовое масло включают полиоксиэтилен - гидрированное касторовое масло 10, полиоксиэтилен - гидрированное касторовое масло 40, полиоксиэтилен - гидрированное касторовое масло 50, полиоксиэтилен - гидрированное касторовое масло 60, и полиоксиэтилен - гидрированное касторовое масло 60 является наиболее предпочтительным.
Полиоксиэтиленсорбитановые эфиры жирных кислот включают полисорбат 80, полисорбат 60, полисорбат 40, полиоксиэтиленсорбитанмонолаурат, полиоксиэтиленсорбитантриолеат, полисорбат 65 и т. п., и полисорбат 80 является наиболее предпочтительным.
Витамин E TPGS также называется, как токоферолполиэтиленгликоль 1000 сукцинат.
Полиоксиэтиленовые эфиры жирных кислот включают полиоксил 40 стеарат и т. п.
Полиоксиэтиленполиоксипропиленгликоль включает полиоксиэтилен (160) полиоксипропилен (30) гликоль, полиоксиэтилен (42) полиоксипропилен (67) гликоль, полиоксиэтилен (54) полиоксипропилен (39) гликоль, полиоксиэтилен (196) полиоксипропилен (67) гликоль, полиоксиэтилен (20) полиоксипропилен (20) гликоль и т. п.
Эфиры сахарозы жирных кислот включают стеарат сахарозы.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают с поверхностно-активным веществом, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. поверхностно-активного вещества. Точнее, нижнее предельное значение предпочтительно составляет 0,001% (мас./об.), более предпочтительно 0,01% (мас./об.), более предпочтительно 0,1% (мас./об.), еще более предпочтительно 0,5% (мас./об.) и наиболее предпочтительно 0,8% (мас./об.). Верхнее предельное значение предпочтительно составляет 10% (мас./об.), более предпочтительно 5% (мас./об.), более предпочтительно 4% (мас./об.), еще более предпочтительно 3% (мас./об.) и наиболее предпочтительно 2% (мас./об.). Более предпочтительно, если указанное выше содержание может находиться в диапазоне, образованном путем объединения любых нижних предельных значений и верхних предельных значений и предпочтительно составляет от 0,001 до 10% (мас./об.), более предпочтительно от 0,01 до 5% (мас./об.), более предпочтительно от 0,03 до 4% (мас./об.), еще более предпочтительно от 0,05 до 3% (мас./об.) и наиболее предпочтительно от 0,1 до 2% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с буферным агентом, который можно использовать в качестве фармацевтической добавки.
Примеры буферного агента включают фосфорную кислоту или ее соль, борную кислоту или ее соль, лимонную кислоту или ее соль, уксусную кислоту или ее соль, угольную кислоту или ее соль, винную кислоту или ее соль, ε-аминокапроновую кислоту, трометамол и т. п. Более предпочтительно, если фосфаты включают фосфат натрия, дигидрофосфат натрия, динатрий гидрофосфат, фосфат калия, дигидрофосфат калия, гидрофосфат калия и т. п., бораты включают буру, борат натрия и борат калия, лимонная кислота или ее соль включают моногидрат лимонной кислоты, цитрат натрия, динатрийцитрат, тринатрийцитрат и т. п., ацетаты включают ацетат натрия, ацетат калия и т. п., карбонаты включают карбонат натрия, бикарбонат натрия и т. п. и тартраты включают тартрат натрия, тартрат калия и т. п. Из них борная кислота или ее соль или лимонная кислота или ее соль является предпочтительной.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают с буферным агентом, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. буферного агента и оно предпочтительно равно от 0,001 до 10% (мас./об.), более предпочтительно от 0,01 до 5% (мас./об.), более предпочтительно от 0,05 до 3% (мас./об.) и наиболее предпочтительно от 0,1 до 2% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с агентом, регулирующий тоничность, который можно использовать в качестве фармацевтической добавки.
Примеры агента, регулирующего тоничность, включают ионогенные агенты, регулирующие тоничность и неионогенные агенты, регулирующие тоничность.
Ионогенные агенты, регулирующие тоничность включают хлорид натрия, хлорид калия, хлорид кальция, хлорид магния и т. п. и неионогенные агенты, регулирующие тоничность включают глицерин, пропиленгликоль, сорбит, маннит и т. п. Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают с агентом, регулирующим тоничность, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. агента, регулирующего тоничность, оно предпочтительно равно от 0,01 до 10% (мас./об.), более предпочтительно от 0,02 до 7% (мас./об.), более предпочтительно от 0,1 до 5% (мас./об.), еще более предпочтительно от 0,5 до 4% (мас./об.) и наиболее предпочтительно от 0,8 до 3% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать со стабилизатором, который можно использовать в качестве фармацевтической добавки.
Примеры стабилизатора включают этилендиаминтетрауксусную кислоту, мононатрийэтилендиаминтетраацетат, динатрийэтилендиаминтетраацетат, тетранатрийэтилендиаминтетраацетат, цитрат натрия и т. п., и динатрийэтилендиаминтетраацетат является особенно предпочтительным. Этилендиаминтетраацетат натрия может представлять собой гидрат. Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают со стабилизатором, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. стабилизатора, предпочтительно от 0,001 до 1% (мас./об.), более предпочтительно от 0,005 до 0,5% (мас./об.) и наиболее предпочтительно от 0,01 до 0,1% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с консервантом, который можно использовать в качестве фармацевтической добавки.
Примеры консерванта включают бензалконийхлорид, бензалконийбромид, бензэтонийхлорид, сорбиновую кислоту, сорбат калия, метил-пара-оксибензоат, пропил-пара-оксибензоат, хлорбутанол и т. п. Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают консервантом, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. консерванта, оно предпочтительно равно от 0,0001 до 1% (мас./об.), более предпочтительно от 0,0005 до 0,1% (мас./об.), более предпочтительно от 0,001 до 0,05% (мас./об.) и наиболее предпочтительно от 0,005 до 0,010% (мас./об.). Кроме того, случай, когда консервант не содержится, также является предпочтительным.
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с антиоксидантом, который можно использовать в качестве фармацевтической добавки.
Примеры антиоксиданта включают аскорбиновую кислоту, токоферол, дибутилгидрокситолуол, бутилгидроксианизол, эриторбат натрия, пропилгаллат, сульфит натрия и т. п. Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают с антиоксидантом, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. антиоксиданта, оно предпочтительно равно от 0,0001 до 1% (мас./об.), более предпочтительно от 0,0005 до 0,1% (мас./об.) и наиболее предпочтительно от 0,001 до 0,05% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с загустителем, который можно использовать в качестве фармацевтической добавки.
Примеры загустителя включают метилцеллюлозу, этилцеллюлозу, гидроксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилметилцеллюлозу, гидроксипропилметилцеллюлозу, карбоксиметилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, гидроксипропилметилацетат-сукцинат целлюлозы, фталат гидроксипропилметилцеллюлозы, карбокосиметилэтилцеллюлозу, ацетатфталат целлюлозы, поливинилпирролидон, поливиниловый спирт, карбоксивиниловый полимер, полиэтиленгликоль и т. п.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, смешивают с загустителем, его содержание можно соответствующим образом регулировать в зависимости от типа и т. п. загустителя, оно предпочтительно равно от 0,001 до 5% (мас./об.), более предпочтительно от 0,01 до 1% (мас./об.) и наиболее предпочтительно от 0,1 до 0,5% (мас./об.).
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно соответствующим образом смешать с основой, которую можно использовать в качестве фармацевтической добавки.
Примеры основы включают воду, физиологический раствор, диметилсульфоксид, полиэтиленгликоли, такие как PEG 400, трибутилцитрат, ацетилтрибутилцитрат, бензилбензоат, белое вазелиновое масло, жидкий парафин и т. п., и вода, физиологический раствор, диметилсульфоксид и PEG 400 являются предпочтительными.
Значение pH фармацевтического препарата, предлагаемого в настоящем изобретении, предпочтительно составляет от 4,0 до 8,0, более предпочтительно от 4,5 до 7,5, еще более предпочтительно от 5,0 до 7,0 и наиболее предпочтительно от 5,5 до 6,1. Кроме того, значение pH может составлять от 6,0 до 8,0. К фармацевтическому препарату, предлагаемому в настоящем изобретении, можно добавить регулятор pH для регулирования pH, такой как хлористоводородная кислота, фосфорная кислота, лимонная кислота, уксусная кислота, гидроксид натрия и гидроксид калия.
[Применение]
Фармацевтический препарат, предлагаемый в настоящем изобретении, обладает превосходной способностью снижать внутриглазное давление даже у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии, и таким образом, он применим в качестве средства лечения или предупреждения глаукомы и/или средства лечения или предупреждения глазной гипертензии и/или средства снижения внутриглазного давления. В настоящем изобретении глаукома включает первичную открытоугольную глаукому, вторичную открытоугольную глаукому, глаукому с нормальным давлением, гиперсекреторную глаукому, первичную закрытоугольную глаукому, вторичную закрытоугольную глаукому, глаукому с плоской радужкой, смешанную глаукому, врожденную глаукому, стероидную глаукому, эксфолиативную глаукому, амилоидную глаукому, обусловленную реваскуляризацией глаукому, злокачественную глаукому, капсулярную глаукому хрусталика, синдром плоской радужки и т. п. и предпочтительно первичную открытоугольная глаукому, глаукому с нормальным давлением и первичную закрытоугольную глаукому. В частности, фармацевтический препарат, предлагаемый в настоящем изобретении, эффективен в случае первичной открытоугольной глаукомы.
Фармацевтический препарат, предлагаемый в настоящем изобретении, предпочтительно вводят пациентам, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии. Другие средства лечения глаукомы или глазной гипертензии представляют собой любое средство лечения глаукомы или глазной гипертензии, содержащее активный ингредиент, не представляющий собой омиденепаг, его сложный эфир или его соль (другой активный ингредиент), и конкретные примеры активного ингредиента, не представляющего собой омиденепаг, его сложный эфир или его соль, включают неселективные симпатомиметики, агонисты α2-рецептора, блокаторы α1-рецептора, блокаторы β-рецептора, парасимпатомиметики, ингибиторы карбоангидразы, простагландины и ингибиторы киназы Rho.
Конкретные примеры неселективных симпатомиметиков включают дипивефрин, конкретные примеры агонистов α2-рецептора включают бримонидин и апраклонидин, конкретные примеры блокаторов α1-рецептора включают буназозин, конкретные примеры блокаторов β-рецептора включают тимолол, бефунолол, картеолол, нипрадилол, бетаксолол, левобунолол и метипранолол, конкретные примеры парасимпатомиметиков включают пилокарпин, конкретные примеры ингибиторов карбоангидразы включают дорзоламид, бринзоламид и ацетазоламид, конкретные примеры простагландинов включают латанопрост, изопропил унопростон, биматопрост и травопрост и конкретные примеры ингибиторов киназы Rho включают фазудил. Из них простагландины являются предпочтительными, производные простагландина F2α являются более предпочтительными, латанопрост также является предпочтительным, офтальмологический раствор латанопроста является особенно предпочтительным и 0,005% офтальмологический раствор латанопроста является наиболее предпочтительным.
Пациентами, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии являются пациенты, для которых не может быть обеспечено преимущество, обусловленное достаточной эффективностью при лечении другими средствами лечения глаукомы или глазной гипертензии. Точнее, пациентами предпочтительно являются такие, у которых при лечении другими средствами лечения глаукомы или глазной гипертензии степень снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (степень снижения внутриглазного давления: [внутриглазное давление до лечения (мм рт.ст.) - внутриглазное давление после лечения (мм рт.ст.)]/[внутриглазное давление до лечения (мм рт.ст.)]×100) составляет 18% или менее, предпочтительно 17% или менее, более предпочтительно 16% или менее, более предпочтительно 15% или менее, еще более предпочтительно 14% или менее, особенно предпочтительно 13% или менее, еще более предпочтительно 12% или менее и наиболее предпочтительно 10% или менее. Кроме того, пациентами также предпочтительно являются такие, у которых при лечении другими средствами лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (= изменение внутриглазного давления: [внутриглазное давление до лечения (мм рт.ст.) - внутриглазное давление после лечения (мм рт.ст.)]) равно 4,5 мм рт.ст. или менее, предпочтительно 4,2 мм рт.ст. или менее, более предпочтительно 4 мм рт.ст. или менее, более предпочтительно 3,7 мм рт.ст. или менее, еще более предпочтительно 3,5 мм рт.ст. или менее, особенно предпочтительно 3,2 мм рт.ст. или менее, еще более предпочтительно 3 мм рт.ст. или менее и наиболее предпочтительно 2,5 мм рт.ст. или менее. Это лечение другими средствами лечения глаукомы или глазной гипертензии обычно проводят путем введения в глаза от 1 до 3 капель одновременно и от 1 до 3 капель в сутки в течение 1 недели или более, предпочтительно 2 недель или более, более предпочтительно 4 недель или более, более предпочтительно 2 месяцев или более, еще более предпочтительно 6 месяцев или более и наиболее предпочтительно 1 года или более. Кроме того, пациенты, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии включают пациентов, которых нельзя лечить другими средствами лечения глаукомы или глазной гипертензии или которые не могут их применять вследствие побочных эффектов и т. п. Следует отметить, что пациентами, для которых предназначен фармацевтический препарат, предлагаемый в настоящем изобретении, являются млекопитающие, включая домашних животных, таких как коровы и свиньи, кролики, обезьяны, собаки, кошки, и люди, и предпочтительно люди.
С другой стороны, фармацевтический препарат, предлагаемый в настоящем изобретении, дает возможность дополнительно снизить внутриглазное давление у пациента, которого лечат другими средствами лечения глаукомы или глазной гипертензии, даже в случае степени снижения внутриглазного давления и изменения внутриглазного давления до такой степени, что эффективность считается недостаточной, как описано выше. Степень снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (степень снижения внутриглазного давления), приписываемая фармацевтическому препарату, предлагаемому в настоящем изобретении, предпочтительно составляет не менее 5%, например, 6% или более, предпочтительно 7% или более, более предпочтительно 8% или более, более предпочтительно 9% или более, еще более предпочтительно 10% или более, особенно предпочтительно 11% или более, еще более предпочтительно 12% или более и наиболее предпочтительно 13% или более. Верхнее предельное значение степени снижения внутриглазного давления, приписываемое фармацевтическому препарату, предлагаемому в настоящем изобретении, может составлять, например, 40% или менее, предпочтительно 35% или менее, более предпочтительно 30% или менее, более предпочтительно 28% или менее, еще более предпочтительно 26% или менее, особенно предпочтительно 24% или менее, еще более предпочтительно 22% или менее и наиболее предпочтительно 20% или менее. Можно подходящим образом выбрать диапазон, получаемый подходящим объединением любых из указанных выше верхних предельных значений и нижних предельных значений. Предпочтительная степень снижения внутриглазного давления, приписываемая фармацевтическому препарату, предлагаемому в настоящем изобретении, составляет, например, от 5 до 40%, предпочтительно от 7 до 35% и более предпочтительно от 9 до 30%.
Кроме того, при использовании фармацевтического препарата, предлагаемого в настоящем изобретении, значение снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (изменение внутриглазного давления), приписываемое фармацевтическому препарату, предлагаемому в настоящем изобретении, предпочтительно равно не менее 1,0 мм рт.ст. или более, предпочтительно 1,2 мм рт.ст. или более, более предпочтительно 1,4 мм рт.ст. или более, более предпочтительно 1,6 мм рт.ст. или более, еще более предпочтительно 1,8 мм рт.ст. или более, особенно предпочтительно 2,0 мм рт.ст. или более, еще более предпочтительно 2,5 мм рт.ст. или более и наиболее предпочтительно 2,9 мм рт.ст. или более. Верхнее предельное значение изменения внутриглазного давления, приписываемое фармацевтическому препарату, предлагаемому в настоящем изобретении, может составлять, например, 10,0 мм рт.ст. или менее, предпочтительно 8,0 мм рт.ст. или менее, более предпочтительно 6,0 мм рт.ст. или менее, более предпочтительно 5,5 мм рт.ст. или менее, еще более предпочтительно 5,0 мм рт.ст. или менее, особенно предпочтительно 4,5 мм рт.ст. или менее, еще более предпочтительно 4,0 мм рт.ст. или менее и наиболее предпочтительно 3,2 мм рт.ст. или менее. Можно подходящим образом выбрать диапазон, получаемый подходящим объединением любых из указанных выше верхних предельных значений и нижних предельных значений. Предпочтительное изменение внутриглазного давления, приписываемое фармацевтическому препарату, предлагаемому в настоящем изобретении, равно, например, от 1,0 до 10,0 мм рт.ст., предпочтительно от 1,4 до 8,0 мм рт.ст. и более предпочтительно от 1,8 до 6,0 мм рт.ст.
Следует отметить, что "степень снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (степень снижения внутриглазного давления), приписываемая фармацевтическому препарату, предлагаемому в настоящем изобретении" и "значение снижения (изменение внутриглазного давления)", определенные в настоящем изобретении, означают степень снижения и значение снижения внутриглазного давления на второй стадии лечения, как указано в параграфе (3) раздела [Способ введения], описанном ниже, но не включают степень снижения внутриглазного давления и изменение внутриглазного давления вследствие лечения другими средствами лечения глаукомы или глазной гипертензии, как на первой стадии лечения, как указано в параграфе (1) раздела [Способ введения]. Поэтому фармацевтический препарат, предлагаемый в настоящем изобретении, содержащий омиденепаг и т. п. в качестве активного ингредиента, может снижать внутриглазное давление в дополнение к терапевтическим воздействиям других средств лечения глаукомы или глазной гипертензии, содержащих латанопрост и т. п. в качестве активных ингредиентов.
Для более значительного снижения внутриглазного давления фармацевтический препарат, предлагаемый в настоящем изобретении, можно использовать в комбинации (например, можно использовать в виде набора в комбинации) с одним или более, предпочтительно с одним - тремя и более предпочтительно с одним или двумя дополнительными средствами лечения глаукомы или глазной гипертензии или он может содержать дополнительный активный ингредиент. На дополнительные средства лечения глаукомы или глазной гипертензии не налагаются особые ограничения. В частности, имеющиеся в продаже или разрабатывающиеся средства лечения глаукомы или глазной гипертензии и т. п. являются предпочтительными, имеющиеся в продаже средства лечения глаукомы или глазной гипертензии и т. п. являются более предпочтительными и имеющиеся в продаже средства лечения глаукомы или глазной гипертензии, обладающие механизмом действия, отличающимся от механизма действия соединения, предлагаемого в настоящем изобретении, являются особенно предпочтительными. Более конкретные примеры включают средства лечения глаукомы или глазной гипертензии, содержащие в качестве активных ингредиентов неселективные симпатомиметики, агонисты α2-рецептора, блокаторы α1-рецептора, блокаторы β-рецептора, парасимпатомиметики, ингибиторы карбоангидразы, простагландины, ингибиторы киназы Rho и т. п. Конкретные примеры дополнительного активного ингредиента включают неселективные симпатомиметики, агонисты α2-рецептора, блокаторы α1-рецептора, блокаторы β-рецептора, парасимпатомиметики, ингибиторы карбоангидразы, простагландины, ингибиторы киназы Rho и т. п. Следует отметить, что, если фармацевтический препарат, предлагаемый в настоящем изобретении, применяют в комбинации с дополнительным средством лечения глаукомы или глазной гипертензии или он содержит дополнительный активный ингредиент, "степень снижения внутриглазного давления после лечения по сравнению с внутриглазным давлением до лечения (степень снижения внутриглазного давления), приписываемая фармацевтическому препарату, предлагаемому в настоящем изобретении" и "значение снижения (изменение внутриглазного давления)", описанные выше, означают часть воздействия, исключая воздействия дополнительного средства лечения глаукомы или глазной гипертензии или дополнительного активного ингредиента.
Конкретные примеры неселективных симпатомиметиков включают дипивефрин, конкретные примеры агонистов α2-рецептора включают бримонидин и апраклонидин, конкретные примеры блокаторов α1-рецептора включают буназозин, конкретные примеры блокаторов β-рецептора включают тимолол, бефунолол, картеолол, нипрадилол, бетаксолол, левобунолол и метипранолол, конкретные примеры парасимпатомиметиков включают пилокарпин, конкретные примеры ингибиторов карбоангидразы включают дорзоламид, бринзоламид и ацетазоламид, конкретные примеры простагландинов включают изопропил унопростон, биматопрост и травопрост, и конкретные примеры ингибиторов киназы Rho включают фазудил.
[Путь введения]
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно вводить перорально или парентерально, например, путем введения в глаза, введения в стекловидное тело, введения в конъюнктивальный мешок, внутрикамерного введения, подконъюктивального введения, введения под тенонову капсулу или введения с помощью вкладышей в слезные точки. Дозированная форма фармацевтического препарата, предлагаемого в настоящем изобретении, включает глазные капли, глазные мази, средства для инъекции, вкладыши в слезные точки, таблетки, капсулы, гранулы, порошки и т. п. и глазные капли, средства для инъекции в глаза и вкладыши в слезные точки являются особенно предпочтительными. Средства для инъекции в глаза включают средства для инъекции для введения в стекловидное тело, для внутрикамерного введения, введения в конъюнктивальный мешок, внутрикамерного введения, подконъюктивального введения или введения под тенонову капсулу. Дозированную форму фармацевтического препарата, предлагаемого в настоящем изобретении, можно приготовить по обычным методикам, использующейся в области лекарственных средств. В дополнение к описанным выше добавкам пероральные препараты, такие как таблетки, капсулы, гранулы и порошки, можно приготовить при необходимости используя агенты, увеличивающие объем, такие как лактоза, кристаллическая целлюлоза, крахмал и растительное масло, смазывающие вещества, такие как стеарат магния и тальк, связующие, такие как гидроксипропилцеллюлоза и поливинилпирролидон, разрыхлители, такие как кальциевая соль карбоксиметилцеллюлозы и гидроксипропилметилцеллюлоза низкой степени замещения, агенты для нанесения покрытия, такие как гидроксипропилметилцеллюлоза, макрогол и силиконовая смола, пленкообразные материалы, такие как желатиновое покрытие и т. п.
Фармацевтический препарат, предлагаемый в настоящем изобретении, можно хранить в контейнерах, изготовленных из разных материалов. Например, можно использовать контейнеры, изготовленные из полиэтилена, полипропилена и т. п. и в случае применения в качестве глазных капель фармацевтический препарат, предлагаемый в настоящем изобретении, предпочтительно хранят в полиэтиленовом контейнере, что обеспечивает, например, легкость введения по каплям (жесткость контейнера) и стабильность соединения, предлагаемого в настоящем изобретении.
[Дозировка и введение]
Дозировка и введение фармацевтического препарата, предлагаемого в настоящем изобретении, специально не ограничиваются, если дозировка и введение достаточны для обеспечения желательной эффективности и надлежащим образом могут быть выбраны в соответствии с симптомами заболевания, возрастом и массой тела пациента, дозированной формой фармацевтического препарата и т. п.
В частности, в случае глазных капель от 1 до 5 капель, предпочтительно от 1 до 3 капель, более предпочтительно 1 или 2 капли и еще более предпочтительно 1 каплю на дозу можно вводить в глаза от 1 до 4 раз в сутки, предпочтительно от 1 до 3 раз в сутки, более предпочтительно 1 или 2 раза в сутки и особенно предпочтительно 1 раз в сутки и с частотой от ежедневного ввода до еженедельного. Предпочтительно, если глазные капли вводят по 1 капле в сутки ежедневно. В этом случае объем 1 капли обычно равен от примерно 0,01 до примерно 0,1 мл, предпочтительно от примерно 0,015 до примерно 0,07 мл, более предпочтительно от примерно 0,02 до примерно 0,05 мл и еще более предпочтительно примерно 0,03 мл.
В случае средства для инъекции в глаза предпочтительно одновременно вводить от 1 до 1000 мкл, более предпочтительно от 5 до 700 мкл, более предпочтительно от 10 до 500 мкл и наиболее предпочтительно от 20 до 300 мкл. Доза лекарственного средства предпочтительно равна от 0,0001 до 30000 мкг/глаз, более предпочтительно от 0,0005 до 10000 мкг/глаз и наиболее предпочтительно от 0,001 до 5000 мкг/глаз. Если фармацевтический препарат, предлагаемый в настоящем изобретении, непрерывно вводят в глаза путем инъекции, не налагаются особые ограничения на интервал между введениями, если он достаточен для обеспечения желательной эффективности. Однако интервал между введениями предпочтительно составляет от 1 недели до 3 лет, более предпочтительно, если интервал между введениями составляет 1 неделю, 2 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 1 год, 2 года или 3 года и наиболее предпочтительно 2 месяца, 3 месяца, 4 месяца, 5 месяцев или 6 месяцев. Кроме того, интервал между введениями можно соответствующим образом изменить.
В случае перорального препарата его можно вводить в дозе, равной от 0,01 до 5000 мг и предпочтительно от 0,1 до 1000 мг/сутки от одного до нескольких раз по отдельности (от 1 до 5 раз, предпочтительно 2 или 3 раза).
[Способ введения]
Фармацевтический препарат, предлагаемый в настоящем изобретении, вводят после этого, если достаточная эффективность не обеспечивается и не предполагается обеспеченной путем лечения или предупреждения описанными выше другими средствами лечения глаукомы или глазной гипертензии. Точнее, способ введения фармацевтического препарата, предлагаемого в настоящем изобретении, включает
(1) первую стадию лечения или предупреждения глаукомы или глазной гипертензии описанными выше другими активными ингредиентами, не представляющими собой омиденепаг, его сложный эфир или его соль,
(2) необязательную стадию установления того, является ли первая стадия лечения недостаточной для лечения или недостаточной для обеспечения предупреждения, и
(3) проводимую после первой стадии лечения вторую стадию лечения или предупреждения глаукомы или глазной гипертензии путем введения фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента.
Если фармацевтический препарат, предлагаемый в настоящем изобретении, вводят пациенту способом введения, описанным выше, фармацевтический препарат, предлагаемый в настоящем изобретении, дополнительно обеспечивает эффективное снижение внутриглазного давления и т. п., и дополнительно делает возможным лечение или предупреждение глаукомы или глазной гипертензии независимо от эффективности лечения или предупреждения описанными выше другими активными ингредиентами, или если эффективность является недостаточной.
Указанный выше способ введения описан подробнее. Во-первых, другие средства лечения глаукомы или глазной гипертензии (другие активные ингредиенты), не представляющие собой омиденепаг, его сложный эфир или его соль, предлагаемые в настоящем изобретении, вводят для лечения или предупреждения глаукомы или глазной гипертензии. Затем, если ожидается, что другие активные ингредиенты обладают недостаточным лечебным воздействием или недостаточным предупреждающим воздействием, глаукома считается "глаукомой, устойчивой к лечению глаукомы другими активными ингредиентами" или "глазной гипертензией, устойчивой к лечению глазной гипертензии другими активными ингредиентами". Затем вводят омиденепаг, его сложный эфир или его соль, предлагаемый в настоящем изобретении. В этом случае ситуация "ожидается, что обладают недостаточным лечебным воздействием или недостаточным предупреждающим воздействием" включает случай приближенной степени снижения внутриглазного давления и значения снижения внутриглазного давления для описанных выше "пациентов, для которых не может быть обеспечено преимущество, обусловленное достаточной эффективностью при лечении другими средствами лечения глаукомы или глазной гипертензии" а также случай, когда абсолютное значение внутриглазного давления достаточно высокое, чтобы сделать заключение о наличии глаукомы или глазной гипертензии, например, равное 22 мм рт.ст. или более, предпочтительно 21,5 мм рт.ст. или более, более предпочтительно 21 мм рт.ст. или более, более предпочтительно 20,5 мм рт.ст. или более и еще более предпочтительно 20 мм рт.ст. или более. Если глаукома или глазная гипертензия все еще не излечена или потенциальный риск рецидива остается даже после введения описанных выше других активных ингредиентов, целесообразно применять фармацевтический препарат, предлагаемый в настоящем изобретении, в качестве вторичного вводимого средства. Как показано выше, в случае, когда лечение и т. п. глаукомы или глазной гипертензии описанными выше другими активными ингредиентами, такими как латанопрост, является недостаточным и даже в случае, когда на основании обычных знаний считается, что другие активные ингредиенты привели к достаточному завершению лечения или предупреждения, фармацевтический препарат, предлагаемый в настоящем изобретении, обеспечивает непредвиденные воздействия, это лечение или предупреждение может привести к дополнительному завершению и обеспечивает решение задачи, отличающейся от обычной.
Например, если рассмотреть латанопрост в качестве другого активного ингредиента. В случае, если глаукому или глазную гипертензию лечат или предупреждают латанопростом и затем необходимо дополнительное снижение внутриглазного давления, или в случае, когда после лечения или предупреждения латанопростом происходит или ожидается возврат повышенного внутриглазного давления, можно полагать, что фармацевтический препарат, предлагаемый в настоящем изобретении, окажет влияние на необходимое снижение внутриглазного давления или на предупреждение возврат повышенного внутриглазного давления.
Примеры, относящиеся к примерам получения и результатам клинического исследования, проведенного в настоящем изобретении, приведены ниже. Следует отметить, что эти примеры предназначены для лучшего понимания настоящего изобретения и не ограничивают объем настоящего изобретения.
[Примеры]
[Пример получения]
Омиденепаг, его сложный эфир или его соль, предлагаемый в настоящем изобретении, можно использовать для получения фармацевтического препарата, описанного выше. Ниже в настоящем изобретении приведены типичные примеры получения фармацевтического препарата, предлагаемого в настоящем изобретении. Следует отметить, что, в приведенных ниже примерах получения, количество каждого из ингредиентов представляет собой содержание в 100 мл препарата.
[Пример получения 1]
Глазные капли 1 (в количестве, равном 100 мл)
[Пример получения 2]
Глазные капли 2 (в количестве, равном 100 мл)
[Пример получения 3]
Глазные капли 3 (в количестве, равном 100 мл)
[Пример получения 4]
Средство для инъекции 1 (в количестве, равном 100 мл)
[Пример получения 5]
Средство для инъекции 2 (в количестве, равном 100 мл)
Следует отметить, что в примерах получения 1-5, искомый фармацевтический препарат можно приготовить путем надлежащего подбора типа и/или количества смешиваемого омиденепага и/или добавки. В частности, искомый фармацевтический препарат можно приготовить путем использования количества смешиваемого омиденепага, указанного в примерах получения 1-5, равного 0,001 г, 0,0011 г, 0,0012 г, 0,0013 г, 0,0014 г, 0,0015 г, 0,0016 г, 0,0017 г, 0,0018 г, 0,0019 г, 0,0021 г, 0,0022 г, 0,0023 г, 0,0024 г, 0,0025 г, 0,0026 г, 0,0027 г, 0,0028 г, 0,0029 г или 0,003 г.
[Клиническое исследование]
Проведено исследование эффективности омиденепага изопропил для пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
1. Приготовление глазных капель
Омиденепаг изопропил, полиоксил 35 касторовое масло, глицерин, лимонную кислоту, цитрат натрия, этилендиаминтетраацетат натрия и бензалконийхлорид растворяли в очищенной воде для установления pH. Затем добавляли очищенную воду для установления полного объема и таким образом получали 0,002% (мас./об.) омиденепаг изопропил глазные капли A.
2. Методика исследования
Для пациентов с первичной открытоугольной глаукомой или глазной гипертензией использовали период вымывания, равный от 1 до 4 недель, и затем им в оба глаза по каплям вводили 0,005% офтальмологический раствор латанопроста в количестве, равном 1 капле 1 раз в сутки в течение 8 недель в качестве фазы индукции (от недели -8 до исходного состояния). Пациенты с первичной открытоугольной глаукомой (21 человек) или глазной гипертензией (5 человек), устойчивые к лечению офтальмологическим раствором латанопроста, у которых степень снижения внутриглазного давления от начала введения капель составляла 15% или менее к концу фазы индукции, направляли на фазу лечения (от исходного состояния до недели 4) и им в оба глаза вводили описанные выше 0,002% (мас./об.) омиденепаг изопропил глазные капли A в количестве, равном 1 капле (примерно 0,03 мл) 1 раз в сутки ежедневно в течение 4 недель.
3. Результаты исследования и обсуждение
Результаты приведены на фиг. 1.
Изменение внутриглазного давления (среднее значение ± стандартная погрешность) через 4 недели после введения капель, что является моментом времени (неделя 4) в конце фазы лечения, от момента времени (исходного состояния) с переходом от введения 0,005% офтальмологического раствора латанопроста в фазе индукции к введению 0,002% (мас./об.) омиденепаг изопропил глазных капель в фазе лечения составляло -2,99 ± 0,43 мм рт.ст. Таким образом, наблюдалось статистически значимое снижение внутриглазного давления (P < 0,0001). Кроме того, степень снижения внутриглазного давления в конце фазы лечения (неделя 4) по сравнению с внутриглазным давлением в исходном состоянии составляла 13,2%. Таким образом, стало понятно, что у пациентов, устойчивых к лечению латанопростом, омиденепаг изопропил снижает внутриглазное давление в большей степени, чем капли латанопроста.
На основании полученных выше данных установлено, что омиденепаг, его сложный эфир или его соль обладает превосходной способностью снижать внутриглазное давление у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии.
Изобретение относится к области медицины и фармацевтики и может быть использовано для лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии у пациентов, для которых недостаточно эффективны другие средства лечения или у которых указанные заболевания устойчивы к лечению другими активными ингредиентами, так что при лечении другими средствами для лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше. Предложено применение фармацевтического препарата для приготовления лекарственного средства для лечения или предупреждения указанных заболеваний, где фармацевтический препарат содержит омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента. Также предложены варианты способа лечения или предупреждения указанных заболеваний путем введения фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента. Обеспечивается снижение внутриглазного давления у пациентов, для которых недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии. 5 н. и 14 з.п. ф-лы, 1 ил.
1. Применение фармацевтического препарата для приготовления лекарственного средства для лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии, где фармацевтический препарат содержит омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента, где фармацевтический препарат предназначен для введения пациенту, для которого недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии, так что при лечении другими средствами для лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше.
2. Применение по п. 1, где лечение или предупреждение глаукомы или глазной гипертензии включает лечение или предупреждение глаукомы или глазной гипертензии другими средствами лечения глаукомы или глазной гипертензии и последующее лечение или предупреждение глаукомы или глазной гипертензии путем снижения внутриглазного давления с помощью омиденепага, его сложного эфира или его соли.
3. Применение по п. 1 или 2, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является производное простагландина F2α.
4. Применение по любому из пп. 1-3, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является латанопрост.
5. Применение по любому из пп. 1-4, в котором содержание омиденепага, его сложного эфира или его соли составляет от 0,001 до 0,003% (мас./об.).
6. Применение по любому из пп. 1-5, в котором содержание омиденепага, его сложного эфира или его соли составляет 0,002% (мас./об.).
7. Применение по любому из пп. 1-6, в котором омиденепаг, его сложный эфир или его соль представляет собой омиденепаг изопропил.
8. Применение по любому из пп. 1-7, в котором фармацевтический препарат представляет собой глазные капли.
9. Применение фармацевтического препарата для приготовления лекарственного средства для лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии, где фармацевтический препарат содержит: омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента, где глаукома представляет собой глаукому, устойчивую к лечению глаукомы другими активными ингредиентами, не представляющими собой омиденепаг, его сложный эфир или его соль, и где глазная гипертензия представляет собой глазную гипертензию, устойчивую к лечению глазной гипертензии другими активными ингредиентами, так что при лечении другими средствами для лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше.
10. Способ лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии, включающий: введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента, где пациентом является пациент, для которого недостаточно эффективны другие средства лечения глаукомы или глазной гипертензии, так что при лечении другими средствами для лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше.
11. Способ по п. 10, где лечение или предупреждение глаукомы или глазной гипертензии включает лечение или предупреждение глаукомы или глазной гипертензии другими средствами лечения глаукомы или глазной гипертензии и последующее лечение или предупреждение глаукомы или глазной гипертензии путем снижения внутриглазного давления с помощью омиденепага, его сложного эфира или его соли.
12. Способ по п. 10 или 11, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является производное простагландина F2α.
13. Способ по любому из пп. 10-12, где активным ингредиентом других средств лечения глаукомы или глазной гипертензии является латанопрост.
14. Способ по любому из пп. 10-13, в котором содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате составляет от 0,001 до 0,003% (мас./об.).
15. Способ по любому из пп. 10-14, в котором содержание омиденепага, его сложного эфира или его соли в фармацевтическом препарате составляет 0,002% (мас./об.).
16. Способ по любому из пп. 10-15, в котором омиденепаг, его сложный эфир или его соль представляет собой омиденепаг изопропил.
17. Способ по любому из пп. 10-16, в котором введением является введение в глаза.
18. Способ лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии, включающий: введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента, где глаукома представляет собой глаукому, устойчивую к лечению глаукомы другими активными ингредиентами, не представляющими собой омиденепаг, его сложный эфир или его соль, и где глазная гипертензия представляет собой глазную гипертензию, устойчивую к лечению глазной гипертензии другими активными ингредиентами, так что при лечении другими средствами для лечения глаукомы или глазной гипертензии значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше.
19. Способ лечения или предупреждения первичной открытоугольной глаукомы, вторичной открытоугольной глаукомы, глаукомы с нормальным давлением или глазной гипертензии, включающий введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве единственного активного ингредиента, способ включает следующие стадии:
(1) первую стадию введения пациенту другого средства лечения глаукомы или глазной гипертензии, не представляющего собой омиденепаг, его сложный эфир или его соль;
(2) стадию установления того, является ли первая стадия лечения недостаточной для лечения или недостаточной для обеспечения предупреждения; и
(3) вторую стадию лечения, включающую дополнительное введение пациенту фармацевтического препарата, содержащего омиденепаг, его сложный эфир или его соль в качестве активного ингредиента, если первая стадия лечения является недостаточной для лечения или недостаточной для обеспечения предупреждения, так что значение снижения внутриглазного давления до лечения и после лечения составляет 4,5 мм рт. ст. или меньше.
| WO 2017006985 A1, 12.01.2017 | |||
| WO 2015105144 A1, 16.07.2015 | |||
| US 20140018396 A1, 16.01.2014 | |||
| US 20140018350 A1, 16.01.2014 | |||
| KOCLUK Y | |||
| et al | |||
| Efficacy of Monotherapy with Either Bimatoprost or Travoprost in Patients with Primary Open-Angle Glaucoma Resistant to Latanoprost Therapy | |||
| TJO, 2011; 41(5): 295-298 | |||
| KALOUCHE G | |||
| et al | |||
| Activation of |
Авторы
Даты
2022-07-19—Публикация
2018-12-27—Подача