Ссылка на родственные заявки
Данная заявка заявляет приоритет в соответствии с 35 U.S.C. §119(e) предварительной заявки на патент США, серийный номер 62/341587, поданной 25 мая 2016 г., которая в полном объеме включена здесь посредством ссылки.
Область техники, к которой относится изобретение
Изобретение, описанное в настоящем документе, относится к способам лечения рака с использованием одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер. Более конкретно, изобретение, описанное здесь, относится к способам лечения рака с использованием одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения.
Уровень техники и сущность изобретения
Несмотря на тот факт, что в технологиях лечения рака имеются существенные достижения, такие как лучевая терапия, химиотерапия и гормональная терапия, рак по-прежнему остается второй по значимости причиной смертности после сердечных заболеваний в Соединенных Штатах. Чаще всего рак лечат химиотерапией с использованием высокоактивных лекарственных средств, таких как митомицин, паклитаксел и камптотецин. Во многих случаях эти химиотерапевтические агенты проявляют дозозависимый эффект, и подавление опухолей пропорционально дозе лекарственного средства. Таким образом, для лечения новообразований используется агрессивный режим введения препаратов; однако химиотерапия в высоких дозах имеет ограничения за счет низкой селективности для раковых клеток и токсичности для нормальных клеток. Отсутствие специфичности для опухолей является одним из многих препятствий, которые необходимо преодолеть с помощью химиотерапии.
Одним решением существующих в настоящее время ограничений для химиотерапии является обеспечение эффективной концентрации противоопухолевого средства с очень высокой специфичностью. Для достижения этой цели, много усилий было направлено на разработку опухолеспецифических препаратов посредством конъюгации противоопухолевых препаратов с гормонами, антителами и витаминами. Например, низкомолекулярный витамин, фолиевая кислота, и другие лиганды, связывающиеся с фолатным рецептором, особенно пригодны в качестве нацеливающих агентов при фолат-рецептор-позитивном раке.
Фолиевая кислота является членом семейства витаминов группы В, и играет важную роль в выживаемости клеток, участвуя в биосинтезе нуклеиновых кислот и аминокислот. Данный необходимый витамин также является высокоаффинным лигандом, который повышает специфичность конъюгированных противоопухолевых препаратов, нацеливая на фолат-рецептор-позитивные раковые клетки. Было установлено, что фолатный рецептор (FR) подвергается повышающей регуляции более чем в 90% немуцинозных карцином яичника. Фолатный рецептор также обнаруживается на высоком или умеренном уровне в злокачественных опухолях почек, головного мозга, легких и молочной железы. В противоположность, сообщалось, что фолатный рецептор присутствует на низких уровнях в большинстве нормальных тканей, что приводит к механизму селективного нацеливания на раковые клетки. Несмотря на то, что фолатный рецептор можно использовать для доставки агентов к опухолевой ткани с очень высокой специфичностью, существует ряд опухолей, которые вообще не экспрессируют фолатный рецептор или в достаточном количестве для обеспечения желаемой специфичности. Таким образом, существует необходимость в разработке способов лечения таких фолат-рецептор-негативных форм рака.
Супрессорные клетки миелоидного происхождения (MDSC) ассоциированы с опухолями и могут усиливать иммуносупрессию в опухолевой среде, посредством супрессии таких клеток, как T-клетки, NK-клетки, макрофаги DC и NKT-клетки. Таким образом, MDSC могут способствовать росту опухолей, ангиогенезу и метастазированию. Широкое распространение этих клеток в опухолевой среде отрицательно коррелирует с выживаемостью пациентов с раком. Таким образом, были бы пригодны лекарственные средства, которые истощают MDSC,.
Заявители обнаружили, что опухоли, которые экспрессируют фолатный рецептор, или которые не экспрессируют фолатный рецептор в достаточном количестве, или вообще его не экспрессируют, можно лечить посредством нацеливания лекарственных средств на MDSC, поскольку MDSC экспрессируют фолатный рецептор-β. Таким образом, здесь описаны способы лечения рака посредством нацеливания на MDSC с использованием лигандов, связывающихся с фолатным рецептором, присоединенных к лекарственному средству через линкер. Нацеливание на MDSC может быть осуществлено с использованием фолата в качестве нацеливающего лиганда для доставки лекарственного средства к MDSC для истощения или ингибирования MDSC и для лечения рака у хозяина, независимо от того, экспрессирует злокачественная опухоль фолатный рецептор или нет. Соответственно, следует понимать, что способы, описанные в настоящем документе, можно использовать для лечения злокачественной опухоли, которая не экспрессирует фолатный рецептор, а также злокачественной опухоли, которая экспрессирует фолатный рецептор.
В одном варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются.
В другом варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются.
В еще одном варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака у животного-хозяина, где супрессорные клетки миелоидного происхождения находятся в злокачественной опухоли, где способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству в через линкер, и лечение опухоли, имеющей супрессорные клетки миелоидного происхождения.
В еще одном варианте осуществления обеспечивается способ лечения рака. Способ включает идентификацию наличия супрессорных клеток миелоидного происхождения в злокачественной опухоли у животного-хозяина и введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер.
В еще одном иллюстративном варианте осуществления обеспечивается способ лечения рака у животного-хозяина. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для ингибирования или истощения супрессорных клеток миелоидного происхождения.
В еще одном варианте осуществления обеспечивается способ нацеливания на супрессорные клетки миелоидного происхождения у животного-хозяина. Способ включает введение животному-хозяину терапевтически или диагностически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения.
Дополнительные иллюстративные и неограничивающие варианты осуществления изобретения описаны в следующих перечисленных пунктах. Все комбинации следующих пунктов понимаются как дополнительные варианты осуществления изобретения, описанные в данном документе. Все применимые комбинации этих вариантов осуществления с вариантами осуществления, описанными в разделе ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ, также являются вариантами осуществления изобретения.
1. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются.
2. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для истощения или ингибирования супрессорных клеток миелоидного происхождения.
3. Способ лечения фолат-рецептор-негативного рака, у животного-хозяина, где супрессорные клетки миелоидного происхождения находятся в злокачественной опухоли, где способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, и лечение злокачественной опухоли, имеющей супрессорные клетки миелоидного происхождения.
4. Способ лечения рака, включающий идентификацию наличия супрессорных клеток миелоидного происхождения в злокачественной опухоли у животного-хозяина и введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер.
5. Способ лечения рака у животного-хозяина, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для ингибирования или истощения супрессорных клеток миелоидного происхождения.
6. Способ нацеливания на супрессорные клетки миелоидного происхождения у животного-хозяина, где способ включает введение животному-хозяину терапевтически или диагностически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения.
7. Способ по любому из пп.4-6, где рак является фолат-рецептор-негативным раком.
8. Способ по любому из пп.4-6, где рак является фолат-рецептор-позитивным раком.
9. Способ по любому из пп.1-8, где лиганд, связывающийся с фолатным рецептором, специфичен для фолатного рецептора-β, и где лиганд, связывающийся с фолатным рецептором, связывается с фолатным рецептором-β на супрессорных клетках миелоидного происхождения.
10. Способ по любому из пп.1-9, где супрессорные клетки миелоидного происхождения имеют маркер CD11b.
11. Способ по любому из пп.1-10, где супрессорные клетки миелоидного происхождения имеют маркер Gr1.
12. Способ по любому из пп.1-11, где рак выбран из немелкоклеточного рака легкого, рака головы и шеи, тройного негативного рака молочной железы, рака молочной железы, рака яичника, рака толстого кишечника, рака предстательной железы, рака легкого, рака эндометрия и рака почки.
13. Способ по любому из пп.1-12, где лекарственное средство выбрано из CI307, BEZ235, вортманнина, AMT, PF-04691502, CpG-олигонуклеотида, BLZ945, леналидомида, NLG919, 5,15-DPP, пирролобензодиазепина, метотрексета, эверолимуса, тубулизина, GDC-0980, AS1517499, BIRB796, N-ацетил-5-гидрокситриптамина и 2,4-диамино-6-гидроксипиримидина.
14. Способ по любому из пп.1-13, где лекарственное средство представляет ингибитор полимеризации микротрубочек.
15. Способ по п.14, где лекарственное средство вызывает гибель супрессорных клеток миелоидного происхождения.
16. Способ по любому из пп.1-13, где лекарственное средство выбрано из ингибитора PI3K, ингибитора STAT6, ингибитора MAPK, ингибитора iNOS и противовоспалительного лекарственного средства.
17. Способ по п.16, где лекарственное средство инактивирует супрессорные клетки миелоидного происхождения.
18. Способ по любому из пп.1-13, где лекарственное средство представляет агонист TLR.
19. Способ по п.18, где агонист TLR выбран из агониста TLR7 и агониста TLR 9.
20. Способ по пп.18 или 19, где лекарственное средство перепрограммирует супрессорные клетки миелоидного происхождения.
21. Способ по пп.14 или 15, где лекарственное средство представляет тубулизин.
22. Способ по п.16, где лекарственное средство представляет ингибитор PI3K.
23. Способ по п.22, где лекарственное средство выбрано из GDC-0980, вортманнина и PF-04691502.
24. Способ по п.16, где лекарственное средство представляет ингибитор STAT6.
25. Способ по п.24, где лекарственное средство представляет AS1517499.
26. Способ по п.16, где лекарственное средство представляет ингибитор МАРК.
27. Способ по п.26, где лекарственное средство представляет BIRB796.
28. Способ по п.16, где лекарственное средство представляет ингибитор iNOS.
29. Способ по п.28, где лекарственное средство представляет АМТ.
30. Способ по п.16, где лекарственное средство представляет противовоспалительное лекарственное средство.
31. Способ по п.30, где лекарственное средство представляет метотрексат.
32. Способ по любому из пп. 18-20, где лекарственное средство выбрано из CI307, CpG-олигонуклеотида и TLR7A.
33. Способ по любому из пп.1-13, где вводят более чем одно соединение, и эти соединения включают разные лекарственные средства.
34. Способ по п.33, где разные лекарственные средства представляют агонист TLR7 и ингибитор PI3K.
35. Способ по любому из пп.1-32, где вводят одно или более соединений и также вводят неконъюгированное лекарственное средство.
36. Способ по п.35, где лекарственное средство в соединении представляет агонист TLR7, и неконъюгированное лекарственное средство представляет ингибитор PI3K.
37. Способ по любому из пп.1-12, где соединение имеет формулу:
 ,
,
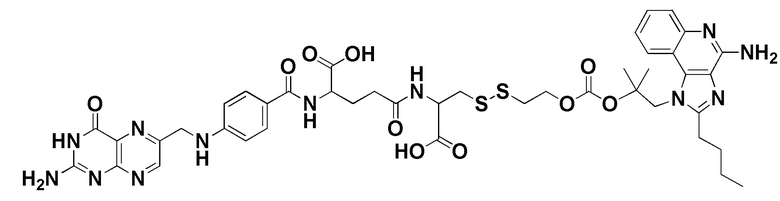
38. Способ по любому из пп.1-12, где соединение имеет формулу: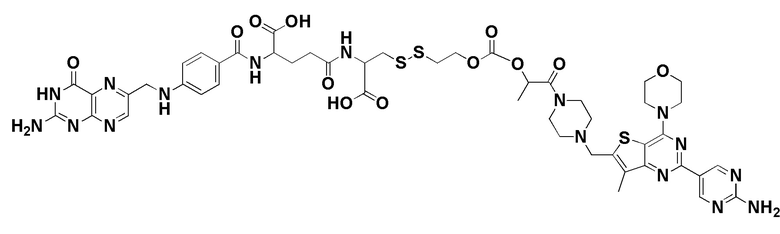 ,
,
39. Способ по любому из пп.1-12, где соединение имеет формулу:
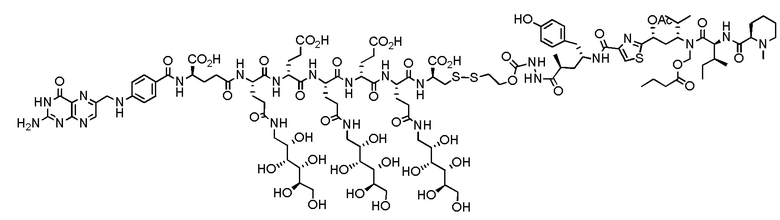
40. Способ по любому из пп.1-12, где соединение имеет формулу:
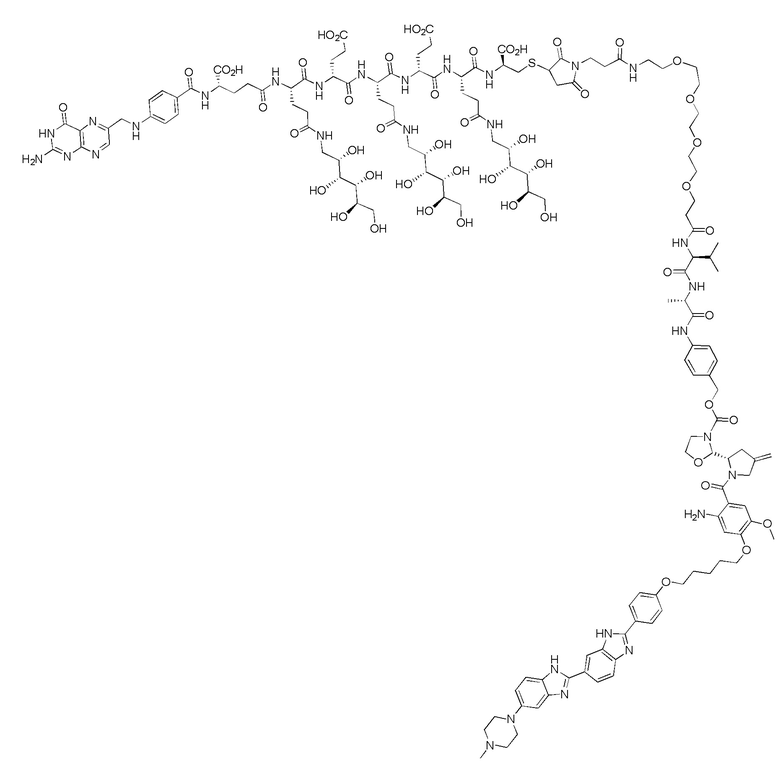
41. Способ по любому из пп.1-40, где одно или более соединений или фармацевтически приемлемую соль любого одного или более соединений вводят животному-хозяину.
42. Способ по любому из пп.1-41, где введение проводится в лекарственной форме для парентерального введения.
43. Способ по п.42, где лекарственная форма для парентерального введения выбрана из лекарственной формы для внутрикожного введения, лекарственной формы для подкожного введения, лекарственной формы для внутримышечного введения, лекарственной формы для внутрибрюшинного введения, лекарственной формы для внутривенного введения и лекарственной формы для интратекального введения.
44. Способ по любому из пп.1-43, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 6,0 мг/м2.
45. Способ по любому из пп.1-44, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 4,0 мг/м2.
46. Способ по любому из пп.1-45, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 2,0 мг/м2.
47. Способ по любому из пп.1-7 или 9-46, где рак является фолат-рецептор-негативным раком, и рак выбран из рака толстого кишечника, рака легкого, рака предстательной железы и рака молочной железы.
Краткое описание фигур
На фиг. 1 показано окрашивание гематоксилин-эозином экспрессии FR-β в различных опухолях человека: опухоль печени (фиг. 1а); опухоль головы и шеи (фиг.1b); тимома (фиг. 1с).
На фиг. 2 показано окрашивание гематоксилин-эозином экспрессии FR-β в различных опухолях человека: опухоль печени (фиг. 2a); опухоль головы и шеи (фиг.2b); тимома (фиг. 2с).
На фиг. 3 показано окрашивание гематоксилин-эозином экспрессии FR-β в различных опухолях человека: опухоль мочевого пузыря (фиг. 3a); опухоль головного мозга (фиг.3b); опухоль печени (фиг.3с).
На фиг. 4 показано окрашивание гематоксилин-эозином экспрессии FR-β в различных опухолях человека: опухоль почки (фиг. 4а); опухоль на коже (фиг.4b); карцинома тимуса (фиг.4с).
На фиг. 5 показана экспрессия FR-β в мышиных MDSC (CD11b+Gr1 +). На фиг. 5a: популяция MDSC, гейтированных в живых клетках; На фиг. 5b: экспрессия FR-β в популяции гейтированных MDSC.
На фиг. 6 показана экспрессия FR-β на мышиных ТАМ (CD11b+F4/80). На фиг. 6а: популяция ТАМ, гейтированных в живых клетках; на фиг. 6b: экспрессия FR-β в популяции гейтированных ТАМ.
На фиг.7 показана продукция аргиназы in vitro клетками ТАМ/MDSC после сокультивирования с различными препаратами. На фиг. 7a: (•) CL307; ( ) BEZ235; (
) BEZ235; ( ) вортманнин; (
) вортманнин; ( ) AMT. На фиг. 7b: (♦) CpG; (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 7c: (∇) N-ацетил-5-гидрокситриптамин; (
) AMT. На фиг. 7b: (♦) CpG; (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 7c: (∇) N-ацетил-5-гидрокситриптамин; ( ) 2,4-диамино-6-гидроксипиримидин; (
) 2,4-диамино-6-гидроксипиримидин; ( ) 5,15-DPP; (х) метотрексат. На фиг. 7d: (+) эверолемус; (
) 5,15-DPP; (х) метотрексат. На фиг. 7d: (+) эверолемус; ( ) тубулизин; (
) тубулизин; ( ) AS1517499; (
) AS1517499; ( ) BIRB796 (дорамапинод).
) BIRB796 (дорамапинод).
На фиг. 8 показана продукция IL-10 in vitro клетками ТАМ/MDSC после сокультивирования с различными препаратами. На фиг. 8a: ( ) BEZ235; (
) BEZ235; ( ) вортманнин; (
) вортманнин; ( ) AMT. На фиг. 8b: (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 8c: (∇) N-ацетил-5-гидрокситриптамин; (
) AMT. На фиг. 8b: (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 8c: (∇) N-ацетил-5-гидрокситриптамин; ( ) 2,4-диамино-6-гидроксипиримидин; (
) 2,4-диамино-6-гидроксипиримидин; ( ) 5,15-DPP; (х) метотрексат. На фиг. 8d: (ǀ) эверолемус; (
) 5,15-DPP; (х) метотрексат. На фиг. 8d: (ǀ) эверолемус; ( ) тубулизин; (
) тубулизин; ( ) AS1517499; (
) AS1517499; ( ) BIRB796 (дорамапинод).
) BIRB796 (дорамапинод).
На фиг. 9 показана продукция оксида азота in vitro клетками ТАМ/MDSC после сокультивирования с различными препаратами. На фиг. 9a: ( ) BEZ235; (
) BEZ235; ( ) вортманнин; (
) вортманнин; ( ) AMT. На фиг. 9b: (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 9c: (∇) N-ацетил-5-гидрокситриптамин; (
) AMT. На фиг. 9b: (○) BIZ945; (□) леналидомид; (Δ) NLG919. На фиг. 9c: (∇) N-ацетил-5-гидрокситриптамин; ( ) 2,4-диамино-6-гидроксипиримидин; (
) 2,4-диамино-6-гидроксипиримидин; ( ) 5,15-DPP; (х) метотрексат. На фиг. 9d: (+) эверолемус; (
) 5,15-DPP; (х) метотрексат. На фиг. 9d: (+) эверолемус; ( ) тубулизин; (
) тубулизин; ( ) AS1517499; (
) AS1517499; ( ) BIRB796 (дорамапинод).
) BIRB796 (дорамапинод).
На фиг. 10 показана приведенная на фиг. 10a продукция оксида азота клетками TAM/MDSC после сокультивирования с двумя агонистами TLR, (•) CpG (агонист TLR9) и (♦) CL307 (агонист TLR7), в различных концентрациях. Черная пунктирная линия указывает уровень оксида азота в необработанном контроле; на фиг. 10b показана экспрессия CD86 на MDSC, измеренная проточной цитометрией после сокультивирования с различными агонистами TLR: резиквимод (агонист TLR7/8), CpG ODN (агонист TLR9), поли(I:C) (агонист TLR3), зимозан (агонист TLR2).
На фиг. 11 показана продукция аргиназы (фиг. 11a) и оксида азота (фиг. 11b) с двумя агонистами TLR7, ( ) CL307 и (•) TLR7A, тестированными in vitro при сокультивировании клеток TAM/MDS с различными концентрациями двух препаратов. Черная пунктирная линия на фиг. 11a показывает уровень аргиназы в необработанном контроле. Черная сплошная линия на фиг. 11a показывает фоновый уровень аргиназы.
) CL307 и (•) TLR7A, тестированными in vitro при сокультивировании клеток TAM/MDS с различными концентрациями двух препаратов. Черная пунктирная линия на фиг. 11a показывает уровень аргиназы в необработанном контроле. Черная сплошная линия на фиг. 11a показывает фоновый уровень аргиназы.
На фиг. 12 показана продукция аргиназы клетками TAM/MDSC после сокультивирования с тремя ингибиторами PI3K (BEZ235, PF-04691502 и GDC-0980) для оценки ингибирующей активности PI3K для эффективного подавления функции TAM/MDSC.
На фиг. 13 показана продукция IL-10 клетками TAM/MDSC после сокультивирования с тремя ингибиторами PI3K (BEZ235, PF-04691502 и GDC-0980) для оценки ингибирующей активности PI3K для эффективного подавления функции TAM/MDSC.
На фиг. 14. показана продукция оксида азота клетками TAM/MDSC после сокультивирования с тремя ингибиторами PI3K (BEZ235, PF-04691502 и GDC-0980) для оценки ингибирующей активности PI3K для эффективного подавления функции TAM/MDSC.
На фиг. 15 приведена кривая синергетической продукции аргиназы после комбинированной обработки клеток TAM/MDSC in vitro агонистом TLR7 (CL307) и ингибитором PI3K (BEZ235); ( ) индивидуальная обработка, (•) комбинированная обработка.
) индивидуальная обработка, (•) комбинированная обработка.
На фиг. 16 приведены результаты исследования с различными дозами агониста FA-TLR7 (FA-TLR7A) на модели солидной опухоли 4T1. На фиг. 16а показан рост опухоли в группах необработанного контроля (•), обработка 2 нмоль ( ) и обработка 5 нмоль (треугольник). На фиг. 16b показан рост опухоли в группах необработанного контроля (•), обработка 10 нмоль (
) и обработка 5 нмоль (треугольник). На фиг. 16b показан рост опухоли в группах необработанного контроля (•), обработка 10 нмоль ( ) обработка 20 нмоль (♦).
) обработка 20 нмоль (♦).
На фиг. 17 показаны массы животных для разных групп в исследовании с различными дозами на модели солидной опухоли 4T1, показанной на фиг. 16. Массу определяли каждые день после начала обработки на сутки 6. На фиг. 17а показаны массы в группах необработанного контроля (•), обработка 2 нмоль ( ) и обработка 5 нмоль (треугольник). На фиг. 17b показаны массы в группах необработанного контроля (•), обработка 10 нмоль (
) и обработка 5 нмоль (треугольник). На фиг. 17b показаны массы в группах необработанного контроля (•), обработка 10 нмоль ( ) и обработка 20 нмоль (♦).
) и обработка 20 нмоль (♦).
На фиг. 18 приведены результаты терапевтического исследования in vivo с FA-агонистом TLR7 на модели солидной опухоли 4Т1. На фиг. 18а показан рост опухолей, измеренный на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-агонист TLR7, (○) конкурент-FA-агонист TLR7. На фиг. 18b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, (
) FA-агонист TLR7, (○) конкурент-FA-агонист TLR7. На фиг. 18b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, ( )FA-агонист TLR7, (○) конкурент-FA-агонист TLR7.
)FA-агонист TLR7, (○) конкурент-FA-агонист TLR7.
На фиг. 19. приведены результаты терапевтического исследования in vivo с FA-тубулизином на модели солидной опухоли 4T1. На фиг.19а показан рост опухолей, измеренный на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-тубулизин, (□) конкурент-FA-тубулизин. На фиг. 19b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, (
) FA-тубулизин, (□) конкурент-FA-тубулизин. На фиг. 19b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-тубулизин, (□) конкурент-FA-тубулизин.
) FA-тубулизин, (□) конкурент-FA-тубулизин.
На фиг. 20 приведены результаты терапевтического исследования in vivo с FA-ингибитором PI3K на модели солидной опухоли 4T1. На фиг. 20а показан рост опухолей, измеренный на каждый день после начала обработки, (•) необработанный контроль, ( )FA-ингибитор PI3K, (Δ) конкурент-FA-ингибитор PI3K. На фиг. 20b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, (
)FA-ингибитор PI3K, (Δ) конкурент-FA-ингибитор PI3K. На фиг. 20b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-ингибитор PI3K, (Δ)конкурент-FA-ингибитор PI3K.
) FA-ингибитор PI3K, (Δ)конкурент-FA-ингибитор PI3K.
На фиг. 21 приведены результаты терапевтического исследования in vivo с комбинированной обработкой FA-агонистом TLR7 и нецелевым ингибитором PI3K (BEZ235) на модели солидной опухоли 4T1. На фиг. 21a показан рост опухолей, измеренный на каждый день после начала обработки, (•) необработанный контроль, (♦) комбинация, (∇) конкурент-комбинация. На фиг. 21b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, (♦) комбинация, (∇) конкурент-комбинация.
На фиг. 22 приведены результаты терапевтического исследования in vivo с FA-агонистом TLR7 и нецелевым ингибитором PI3K (BEZ235) на модели солидной опухоли 4T1. На фиг. 22а показан рост опухолей, измеренный на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-агонист TLR7, (
) FA-агонист TLR7, ( ) ингибитор PI3K. На фиг. 22b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, (
) ингибитор PI3K. На фиг. 22b показана масса животных, определенная на каждый день после начала обработки, (•) необработанный контроль, ( ) FA-агонист TLR7, (
) FA-агонист TLR7, ( ) ингибитор PI3K.
) ингибитор PI3K.
На фиг. 23 показан средний объем опухолей в последний день обработки для терапевтической группы для каждого из необработанного контроля, FA-агониста TLR7, FA-тубулизина, FA-ингибитора PI3K и комбинации FA-агониста TLR7 и нецелевого ингибитора PI3K (BEZ235). * и *** указывают на статистически значимые результаты.
На фиг. 24 показано внутриклеточное окрашивание аргиназы на F4/80+ макрофагах, при тестировании в группах необработанного контроля, FA-агониста TLR7 (фиг. 24a), FA-ингибитора PI3K (фиг. 24c), FA-тубулизина (фиг. 24b) и комбинации (фиг. 24d), а также группах с конкурентом. * указывает на статистически значимые результаты, ns указывает на отсутствие статистически значимых результатов.
На фиг. 25 показано соотношение макрофагов M1 к M2 (F4/80+CD86+:F4/80+CD206+), при тестировании в группах необработанного контроля, FA-агониста TLR7 (фиг. 25a), FA-ингибитора PI3K (фиг. 25c), FA-тубулизина (фиг. 25b) и комбинации (фиг. 25d), а также в группах с конкурентом. * указывает на статистически значимые результаты, ns указывает на отсутствие статистически значимых результатов.
На фиг. 26 показана популяция MDSC (CD11b+Gr1+), при тестировании в группах необработанного контроля, FA-агониста TLR7 (фиг. 26a), FA-ингибитора PI3K (фиг. 26c), FA-тубулизина (фиг. 26b) и комбинации (фиг. 26d), а также в группах с конкурентом. * указывает на статистически значимые результаты, ns указывает на отсутствие статистически значимых результатов.
На фиг. 27 показан процентный уровень CD4 (фиг. 27a) и CD8 (фиг. 27b) T-клеточных популяций, при тестировании в живых клетках, выделенных из солидных опухолей 4T1 в группах необработанного контроля, FA-агониста TLR7, FA-ингибитора PI3K, FA-тубулизина и в группах комбинации.
На фиг. 28 показано, что индуцированные in vitro человеческие MDSC отвечали на действие выбранных препаратов снижением продукции IL-10. (•) винбластин; ( ) GDC0980; (
) GDC0980; ( ) BEZ235; (♦) тубулизин.
) BEZ235; (♦) тубулизин.
На фиг. 29 A-B показано подавление супрессии человеческих Т-клеток под действием MDSC после обработки 3 группами препаратов. На фиг. 29А приведены результаты обработки препаратами в концентрации 0,1 мкМ препарата; на фиг. 29B приведены результаты обработки препаратами в концентрации 1,0 мкМ препарата.
На фиг. 30 A-C показана резистентность клеток 4T1 к 3 группам препаратов. Клетки 4Т1 культивировали с 3 препаратами в течение 36 ч. Цитотоксичность оценивали с помощью анализа на ЛДГ. На фиг. 30А приведены результаты для агониста TLR в различных концентрациях; на фиг. 30B приведены результаты для ингибитора PI3K в различных концентрациях; на фиг. 3°C приведены результаты для тубулизина в различных концентрациях.
На фиг. 31 A-C показана резистентность клеток 4T1 к трем группам FA-конъюгатов. Клетки 4Т1 культивировали с FA-конъюгатами в течение 3 ч. Клетки промывали PBS и инкубировали со средой в течение 36 ч. На фиг. 31А приведены результаты для конъюгата агониста TLR в различных концентрациях; на фиг. 31B приведены результаты для конъюгата ингибитора PI3K в различных концентрациях; на фиг. 31C приведены результаты для конъюгата тубулизина в различных концентрациях.
На фиг. 32 показан рост опухоли 4Т1 при непрерывной обработке FA-конъюгатами в течение 2 недель. (•) контрольная мышь 1; ( ) контрольная мышь 2; (
) контрольная мышь 2; ( ) контрольная мышь 3; (○) конъюгат FA-ингибитор PI3K, мышь 1; (□) конъюгат FA-ингибитор PI3K-, мышь 2; (Δ) конъюгат FA-ингибитор PI3K, мышь 3; (
) контрольная мышь 3; (○) конъюгат FA-ингибитор PI3K, мышь 1; (□) конъюгат FA-ингибитор PI3K-, мышь 2; (Δ) конъюгат FA-ингибитор PI3K, мышь 3; ( ) FA- агонист TLR7, мышь 1; (
) FA- агонист TLR7, мышь 1; ( ) FA-агонист TLR7, мышь 2; (ς) FA-агонист TLR7, мышь 3.
) FA-агонист TLR7, мышь 2; (ς) FA-агонист TLR7, мышь 3.
На фиг. 33 показаны уровни аргиназы, измеренные в клетках MDSC и TAM из опухоли 4T1, после 2 недель непрерывной обработки конъюгатами фолат-препарат. ( ) MDSC; (
) MDSC; ( ) ТАМ.
) ТАМ.
На фиг. 34 приведены результаты оценки метастазирования в легкие у мышей Balb/c с солидной опухолью 4Т1, которых обрабатывали тремя группами FA-конъюгатов в течение 2 недель (7 суток в неделю). Образцы легких извлекали в конце исследования, и метастазирование оценивали в соответствии со стандартными процедурами, описанными в примере 15.
На фиг. 35 приведены обобщающие результаты оценки метастазирования в легкие на модели опухоли 4T1 в результате нацеливания на MDSC/TAM.
На фиг. 36 показаны результаты мониторинга оценки выживаемости и роста опухолей: объем опухоли контролировали в исследовании выживаемости на модели опухоли 4Т1 с тремя конъюгатами фолат-препарат до хирургического извлечения опухоли на сутки 5. (•) контроль; (○) конъюгат FA-агонист TLR7; (Δ) конъюгат FA-ингибитор PI3K; (□) конъюгат FA-тубулизин.
На фиг. 37 приведена кривая выживаемости мышей с солидной опухолью 4T1 (n=2 для FA-агониста TLR7, n=3 для FA-ингибитора PI3K и контроля заболевания, n=4 для FA-тубулизина). ( ) контроль; (Δ) конъюгат FA-агонист TLR7; (○) конъюгат FA-ингибитор PI3K; (□) конъюгат FA-тубулизин. Временная точка сутки 41 на 100% включает все символы, кроме символа для контроля.
) контроль; (Δ) конъюгат FA-агонист TLR7; (○) конъюгат FA-ингибитор PI3K; (□) конъюгат FA-тубулизин. Временная точка сутки 41 на 100% включает все символы, кроме символа для контроля.
Подробное описание иллюстративных вариантов осуществления
Следует понимать, что каждый вариант осуществления изобретения, описанный здесь, при необходимости, может быть объединен с любым другим вариантом осуществления, описанным здесь. Например, любой из вариантов осуществления в разделе «Сущность изобретения» и/или перечисленных пунктах, описанных здесь, или любая применимая их комбинация, может быть объединена с любым из вариантов осуществления, описанных в разделе «Подробное описание иллюстративных вариантов осуществления» данной патентной заявки.
Как здесь используется, термин «супрессорные клетки миелоидного происхождения» (MDSC) относится к клеткам, которые находятся в микросреде раковой опухоли, например, злокачественной опухоли, которые являются иммуносупрессивными и имеют один или более маркеров CD11b и Gr1. MDSC можно идентифицировать методами, известными в данной области, например, проточной цитометрией с использованием маркеров, специфичных для MDSC, таких как CD11b и Gr1.
Как здесь используется, выражение «где супрессорные клетки миелоидного происхождения находятся в опухоли» обычно относится к MDSC, которые находятся в микросреде раковой опухоли (например, злокачественной опухоли), или, например, обнаружены в раковой ткани (например, опухолевой ткани).
Как здесь используется, термин «введение» в общем, относится к любому и всем способам введения соединений, описанных здесь, животному-хозяину, включая, не ограничиваясь этим, пероральный (per os), внутривенный (в/в), внутримышечный (в/м), подкожный (п/к), чрескожный, ингаляционный, буккальный, интраокулярный, сублингвальный, интравагинальный, ректальный и аналогичные пути введения. Соединения, описанные здесь, можно вводить в разовых лекарственных формах и/или композициях, содержащих один или более фармацевтически приемлемых носителей, адъювантов, разбавителей, эксципиентов и/или наполнителей и их комбинации.
Как здесь используется, термин «композиция» в общем, относится к любому продукту, содержащему более одного ингредиента, включая соединения, описанные здесь. Следует понимать, что композиции, описанные здесь, могут быть приготовлены из выделенных соединений, описанных здесь, или из солей, растворов, гидратов, сольватов и других форм соединений, описанных здесь. Понятно, что определенные функциональные группы, такие как гидрокси, амино и подобные группы, могут образовывать комплексы с водой и/или различными растворителями в различных физических формах соединений. Также следует понимать, что композиции можно приготовить из различных аморфных, неаморфных, частично кристаллических, кристаллических и/или других морфологических форм соединений, описанных здесь. Также следует понимать, что композиции могут быть приготовлены из различных гидратов и/или сольватов соединений, описанных здесь. Следовательно, следует понимать, что такие фармацевтические композиции, которые содержат соединения, описанные здесь, включают каждую или любую комбинацию, или индивидуальные формы, различных морфологических форм и/или сольватных или гидратных форм соединений, описанных здесь.
Заявители изобретения обнаружили, что опухоли, которые экспрессируют фолатный рецептор, или которые не экспрессируют фолатный рецептор в достаточном количестве или вообще его не экспрессируют, можно лечить нацеливанием лекарственных средств на MDSC, поскольку MDSC экспрессируют фолатный рецептор-β. Таким образом, здесь описаны способы лечения рака нацеливанием на MDSC с использованием лигандов, связывающихся с фолатным рецептором, присоединенных к лекарственному средству через линкер. Нацеливание на MDSC может быть осуществлено с использованием фолата в качестве нацеливающего лиганда для доставки лекарственного средства в MDSC для истощения или ингибирования MDSC и для лечения рака у хозяина, независимо от того, экспрессирует опухоль фолатный рецептор или нет. Соответственно, следует понимать, что способы, описанные здесь, можно использовать для лечения злокачественной опухоли, которая не экспрессирует фолатный рецептор, а также злокачественной опухоли, которая экспрессирует фолатный рецептор.
В одном варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются.
В еще одном варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для истощения или ингибирования супрессорных клеток миелоидного происхождения.
В еще одном варианте осуществления обеспечивается способ лечения фолат-рецептор-негативного рака, у животного-хозяина, где супрессорные клетки миелоидного происхождения находятся в опухоли, где способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, и лечение фолат-рецептор-негативной опухоли, имеющей супрессорные клетки миелоидного происхождения.
В еще одном варианте осуществления обеспечивается способ лечения рака. Способ включает идентификацию наличия супрессорных клеток миелоидного происхождения в злокачественной опухоли у животного-хозяина и введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер.
В еще одном иллюстративном варианте осуществления обеспечивается способ лечения рака у животного-хозяина. Способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для ингибирования или истощения супрессорных клеток миелоидного происхождения.
В еще одном варианте осуществления обеспечивается способ нацеливания на супрессорные клетки миелоидного происхождения у животного-хозяина. Способ включает введение животному-хозяину терапевтически или диагностически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения.
Дополнительные иллюстративные и неограничивающие варианты осуществления изобретения описаны в следующих перечисленных пунктах.
1. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются.
2. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для истощения или ингибирования супрессорных клеток миелоидного происхождения.
3. Способ лечения фолат-рецептор-негативного рака, у животного-хозяина, где супрессорные клетки миелоидного происхождения находятся в злокачественной опухоли, где способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, и лечение злокачественной опухоли, имеющей супрессорные клетки миелоидного происхождения.
4. Способ лечения рака, включающий идентификацию наличия супрессорных клеток миелоидного происхождения в злокачественной опухоли у животного-хозяина и введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер.
5. Способ лечения рака у животного-хозяина, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для ингибирования или истощения супрессорных клеток миелоидного происхождения.
6. Способ нацеливания на супрессорные клетки миелоидного происхождения у животного-хозяина, где способ включает введение животному-хозяину терапевтически или диагностически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения.
7. Способ по любому из пп.4-6, где рак является фолат-рецептор-негативным раком.
8. Способ по любому из пп.4-6, где рак является фолат-рецептор-позитивным раком.
9. Способ по любому из пп.1-8, где лиганд, связывающийся с фолатным рецептором, специфичен для фолатного рецептора-β, и где лиганд, связывающийся с фолатным рецептором, связывается с фолатным рецептором-β на супрессорных клетках миелоидного происхождения.
10. Способ по любому из пп.1-9, где супрессорные клетки миелоидного происхождения имеют маркер CD11b.
11. Способ по любому из пп.1-10, где супрессорные клетки миелоидного происхождения имеют маркер Gr1.
12. Способ по любому из пп.1-11, где рак выбран из немелкоклеточного рака легкого, рака головы и шеи, тройного негативного рака молочной железы, рака молочной железы, рака яичника, рака толстого кишечника, рака предстательной железы, рака легкого, рака эндометрия и рака почки.
13. Способ по любому из пп.1-12, где лекарственное средство выбрано из CI307, BEZ235, вортманнина, AMT, PF-04691502, CpG-олигонуклеотида, BLZ945, леналидомида, NLG919, 5,15-DPP, пирролобензодиазепина, метотрексета, эверолимуса, тубулизина, GDC-0980, AS1517499, BIRB796, N-ацетил-5-гидрокситриптамина и 2,4-диамино-6-гидроксипиримидина.
14. Способ по любому из пп.1-13, где лекарственное средство представляет ингибитор полимеризации микротрубочек.
15. Способ по п.14, где лекарственное средство вызывает гибель супрессорных клеток миелоидного происхождения.
16. Способ по любому из пп.1-13, где лекарственное средство выбрано из ингибитора PI3K, ингибитора STAT6, ингибитора MAPK, ингибитора iNOS и противовоспалительного лекарственного средства.
17. Способ по п.16, где лекарственное средство инактивирует супрессорные клетки миелоидного происхождения.
18. Способ по любому из пп.1-13, где лекарственное средство представляет агонист TLR.
19. Способ по п.18, где агонист TLR выбран из агониста TLR7 и агониста TLR9.
20. Способ по пп.18 или 19, где лекарственное средство перепрограммирует супрессорные клетки миелоидного происхождения.
21. Способ по пп.14 или 15, где лекарственное средство представляет тубулизин.
22. Способ по п.16, где лекарственное средство представляет ингибитор PI3K.
23. Способ по п.22, где лекарственное средство выбрано из GDC-0980, вортманнина и PF-04691502.
24. Способ по п.16, где лекарственное средство представляет ингибитор STAT6.
25. Способ по п.24, где лекарственное средство представляет AS1517499.
26. Способ по п.16, где лекарственное средство представляет ингибитор МАРК.
27. Способ по п.26, где лекарственное средство представляет BIRB796.
28. Способ по п.16, где лекарственное средство представляет ингибитор iNOS.
29. Способ по п.28, где лекарственное средство представляет АМТ.
30. Способ по п.16, где лекарственное средство представляет противовоспалительное лекарственное средство.
31. Способ по п.30, где лекарственное средство представляет метотрексат.
32. Способ по любому из пп. 18-20, где лекарственное средство выбрано из CI307, CpG-олигонуклеотида и TLR7A.
33. Способ по любому из пп.1-13, где вводят более чем одно соединение, и эти соединения включают разные лекарственные средства.
34. Способ по п.33, где разные лекарственные средства представляют агонист TLR7 и ингибитор PI3K.
35. Способ по любому из пп.1-32, где вводят одно или более соединений и также вводят неконъюгированное лекарственное средство.
36. Способ по п.35, где лекарственное средство в соединении представляет агонист TLR7, и неконъюгированное лекарственное средство представляет ингибитор PI3K.
37. Способ по любому из пп.1-12, где соединение имеет формулу:
 ,
,
38. Способ по любому из пп.1-12, где соединение имеет формулу: ,
,
39. Способ по любому из пп.1-12, где соединение имеет формулу:

40. Способ по любому из пп.1-12, где соединение имеет формулу:

41. Способ по любому из пп.1-40, где одно или более соединений или фармацевтически приемлемую соль любого одного или более соединений вводят животному-хозяину.
42. Способ по любому из пп.1-41, где введение проводится в лекарственной форме для парентерального введения.
43. Способ по п.42, где лекарственная форма для парентерального введения выбрана из лекарственной формы для внутрикожного введения, лекарственной формы для подкожного введения, лекарственной формы для внутримышечного введения, лекарственной формы для внутрибрюшинного введения, лекарственной формы для внутривенного введения и лекарственной формы для интратекального введения.
44. Способ по любому из пп.1-43, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 6,0 мг/м2.
45. Способ по любому из пп.1-44, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 4,0 мг/м2.
46. Способ по любому из пп.1-45, где терапевтически эффективное количество или диагностически эффективное количество составляет примерно от 0,5 мг/м2 до примерно 2,0 мг/м2.
47. Способ по любому из пп.1-7 или 9-46, где рак является фолат-рецептор-негативным раком, и рак выбран из рака толстого кишечника, рака легкого, рака предстательной железы и рака молочной железы.
В одном варианте осуществления нацеливание на MDSC для истощения или ингибирования активности MDSC может привести к ингибированию роста опухоли, полной или частичной элиминации опухоли, стабильному течению заболевания, гибели опухолевых клеток и подобным терапевтическим эффектам у животного-хозяина. Как здесь используется, термин «истощать» или «ингибировать» MDSC означает гибель некоторых клеток или всей популяции MDSC, ингибирование или элиминацию активности MDSC (например, снижение или элиминацию способности MDSC стимулировать ангиогенез в опухолевой ткани), перепрограммирование MDSC таким образом, чтобы MDSC ингибировали, а не поддерживали выживаемость опухоли, предотвращение увеличения количества MDSC или уменьшение количества MDSC, или оказание какого-либо другого влияния на MDSC, что приведет к проявлению противоопухолевого терапевтического эффекта у животного-хозяина.
Способы, описанные здесь, используются для лечения «животного-хозяина» с раком, нуждающегося в таком лечении. В одном варианте осуществления способы, описанные здесь, можно использовать для гуманной медицины в лечении человека или для ветеринарных применений. Таким образом, «животному-хозяину» можно вводить одно или более соединений или конъюгат фолат-визуализирующего агента, как здесь описано (описано ниже), и животным-хозяином может быть человек (например, пациент-человек) или, в случае ветеринарных применений животным-хозяином могут быть лабораторные, сельскохозяйственные, домашние или дикие животные. В одном аспекте животное-хозяин может представлять человека, лабораторное животное, такое как грызуны (например, мыши, крысы, хомяки и т. д.), кролика, обезьяну, шимпанзе, домашних животных, таких как собаки, кошки и кролики, сельскохозяйственных животных, таких как коровы, лошади, свиньи, овцы, козы, и диких животных, содержащихся в неволе, таких как медведи, панды, львы, тигры, леопарды, слоны, зебры, жирафы, горилы, дельфины и киты.
В различных вариантах осуществления опухоли, описанные здесь, могут представлять туморогенные опухоли, включая доброкачественные опухоли и злокачественные опухоли, или опухоль может быть нетуморогенной. В одном варианте осуществления рак может возникнуть спонтанно или в результате таких процессов, как мутации, присутствующие в зародышевой линии животного-хозяина, или в результате соматических мутаций, или рак может быть вызван воздействием химического, вирусного или радиационного фактора. В еще одном варианте осуществления злокачественные новообразования, применимые для изобретения, описанного здесь, включают, не ограничиваясь этим, карциному, саркому, лимфому, меланому, мезотелиому, назофарингеальную карциному, лейкоз, аденокарциному и миелому.
В некоторых аспектах рак может представлять рак легких, рак кости, рак поджелудочной железы, рак кожи, рак головы, рак шеи, кожную меланому, внутриглазную меланому, рак матки, рак яичников, эндометриальный рак, рак прямой кишки, рак желудка, рак толстого кишечника, рак молочной железы, тройной негативный рак молочной железы, карциному фаллопиевых труб, карциному эндометрия, рак шейки матки, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак органов эндокринной системы, рак щитовидной железы, рак паращитовидной железы, немелкоклеточный рак легкого, рак надпочечника, саркому мягких тканей, рак уретры, рак предстательной железы, тимому, рак тимуса, лейкоз, лимфому, мезотелиому плевры, рак мочевого пузыря, лимфому Беркитта, рак мочеточника, рак почки, новообразования в центральной нервной системе, рак головного мозга, аденому гипофиза или аденокарциному желудочно-пищеводного соединения.
В некоторых аспектах рак может быть выбран из группы, состоящей из немелкоклеточного рака легкого, анапластического рака щитовидной железы, протоковой аденокарциномы поджелудочной железы, рака головы и шеи, рецептор эпидермального фактора роста-негативного рака молочной железы, мезотелиомы, классической лимфомы Ходжкина у взрослых, увеальной меланомы, глиобластомы, почечной карциномы, лейомиосаркомы и пигментного виллонодулярного синовита.
В еще одном варианте осуществления рак выбран из немелкоклеточного рака легкого, рака головы и шеи, тройного негативного рака молочной железы, рака молочной железы, рака яичника, рака толстого кишечника, рака предстательной железы, рака легкого, рака эндометрия и рака почки.
В еще одном варианте осуществления рак является фолат-рецептор-негативным раком, и рак выбран из рака толстого кишечника, рака легкого, рака предстательной и рака молочной железы. Любой тип рака, с которым ассоциированы MDSC, можно лечить в соответствии со способами, описанными здесь.
Иллюстративные варианты осуществления «фолата», который является частью лиганда, связывающегося с фолатным рецептором, включают фолиевую кислоту и аналоги и производные фолиевой кислоты, такие как фолиниевая кислота, птероилполиглутаминовая кислота, птероил-D-глутаминовая кислота и связывающиеся с фолатным рецептором птеридины, такие как тетрагидроптерины, дигидрофолаты, тетрагидрофолаты и их деаза и дидеаза аналоги. Термины «деаза» и «дидеаза» относятся к известным в данной области аналогам, содержащих атом углерода, замещенный одним или двумя атомами азота в структуре встречающейся в природе фолиевой кислоты, или их аналог или производное. Например, деаза аналоги включают 1-деаза, 3-деаза, 5-деаза, 8-деаза и 10-деаза аналоги фолата, фолиниевой кислоты, птерополиглутаминовой кислоты и связывающихся с фолатным рецептором птеридинов, таких как тетрагидроптерины, дигидрофолаты, и тетрагидрофолаты. Дидеазы аналоги включают, например, 1,5-дидеаза, 5,10-дидеаза, 8,10-дидеаза и 5,8-дидеаза аналоги фолата, фолиниевой кислоты, птерополиглутаминовой кислоты и птеридинсвязывающих рецепторов фолата, такие как тетрагидроптерины, дигидрофолаты и тетрагидрофолаты. Другими фолатами, пригодными в качестве комплексообразующих лигандов для данного изобретения, являются связывающиеся с фолатным рецептором аналоги аминоптерин, аметоптерин (также известный как метотрексат), N10 метилфолат, 2-деамино-гидроксифолат, деаза аналоги, такие как 1-деазаметоптерин или 3-деазаметоптерин, и 3',5'-дихлор-4-амино-4-дезокси-N10-метилтероилглутаминовая кислота (дихлорметотрексат). Дополнительные фолаты (например, аналоги фолиевой кислоты), которые связываются с фолатными рецепторами, описаны в публикациях патентных заявок США № 2005/0227985 и 2004/0242582, раскрытие которых включено здесь посредством ссылки. Фолиевая кислота и вышеуказанные аналоги и/или производные также называются «фолатом», «фолатом» или «фолатами», отражая их способность связываться с фолатными рецепторами, и такие лиганды, когда они конъюгированы с экзогенными молекулами, эффективны для усиления трансмембранного транспорта, такого как фолат-опосредованный эндоцитоз. Вышеуказанные соединения можно использовать в лигандах, связывающихся с фолатным рецептором, описанных здесь.
В одном варианте осуществления лиганды, связывающиеся с фолатным рецептором, описанные здесь, могут быть связаны с лекарственным средством через линкер с получением соединений для применения в способах, описанных здесь. Любое лекарственное средство, подходящее для истощения или ингибирования MDSC, можно использовать в соответствии со способами, описанными здесь. В одном варианте осуществления лекарственное средство выбрано из CI307, винбластина, GDC0980, BEZ235, вортманнина, AMT, PF-04691502, CpG-олигонуклеотида, BLZ945, леналидомида, NLG919, 5,15-DPP, пирролобензодиазепина, метотрексата, эверолимуса, тубулизина, GDC-0980, AS1517499, BIRB796, N-ацетил-5-гидрокситриптамина и 2,4-диамино-6-гидроксипиримидина.
В одном аспекте лекарственное средство может быть ингибитором полимеризации микротрубочек. В этом варианте осуществления лекарственное средство может приводить к гибели супрессорных клеток миелоидного происхождения, и лекарственное средство может представлять собой тубулизин.
В еще одном варианте осуществления лекарственное средство выбрано из ингибитора PI3K, ингибитора STAT6, ингибитора MAPK, ингибитора iNOS и противовоспалительного лекарственного средства. В данном варианте осуществления лекарственное средство может инактивировать супрессорные клетки миелоидного происхождения. В данном варианте осуществления лекарственное средство может представлять ингибитор PI3K, выбранный из GDC-0980, вортманнина и PF-04691502, ингибитора STAT6 (например, AS1517499), ингибитора MAPK (например, BIRB796), ингибитора iNOS (например, AMT), или противовоспалительного лекарственного средства (например, метотрексата).
В еще одном варианте осуществления лекарственное средство может представлять агонист TLR, такой как агонист TLR7, агонист TLR9, агонист TLR3 (например, поли(I:C)) или агонист TLR7/8 (например, имиквимод). Агонист TLR может быть выбран, например, из CI307, CpG-олигонуклеотида и TLR7A. В этом варианте осуществления лекарственное средство может перепрограммировать супрессорные клетки миелоидного происхождения.
В еще одном варианте осуществления лекарственное средство может быть выбрано из группы, состоящей из ДНК-алкилирующего агента или ДНК-интеркалирующего агента (например, PBD, про-PBD или красителя Hoechst), трабектедина, доксорубицина, гемцитабина, бисфосфоната (например, свободного или в липосомальной форме) и проапоптотического пептида. В еще одном варианте осуществления лекарственное средство может быть выбрано из группы, состоящей из монофосфориллипида A (например, детоксифицированного ЛПС), ингибитора mTOR (например, эверолимуса или рапамицина), агониста PPARγ и агониста PPARδ.
В еще одном аспекте лекарственное средство может быть выбрано из группы, состоящей из силибинина, ингибитора src-киназы, ингибитора MerTK и ингибитора Stat3. В данном варианте осуществления лекарственное средство может представлять ингибитор src-киназы (например, дазатиниб). В еще одном варианте осуществления лекарственное средство может представлять ингибитор MerTK (например, UNC1062). В еще одном варианте осуществления лекарственное средство может представлять ингибитор Stat3 (например, выбранный из сунитиниба и сорафениба).
Следует понимать, что аналоги или производные лекарственных средств, описанных здесь, также могут быть использованы в соединениях, описанных здесь. Лекарственное средство также может представлять визуализирующий агент, связанный с лигандом, связывающимся с фолатным рецептором, связанный через линкер.
В еще одном аспекте можно вводить более одного соединения, и соединения могут включать различные лекарственные средства. В одном варианте осуществления различные лекарственные средства могут быть выбраны, например, из агониста TLR7 и ингибитора PI3K. В еще одном варианте осуществления одно или более соединений можно вводить вместе с одним или более неконъюгированными лекарственными средствами (т.е. не связанными с лигандом, связывающимся с фолатным рецептором). Для вариантов осуществления комбинированной терапии можно использовать любые соединения и лекарственные средства, описанные здесь, или другие лекарственные средства, которые истощают или ингибируют MDSC, в соответствии со способами, описанными здесь. В вариантах осуществления комбинированной терапии может возникнуть синергизм, как здесь описано.
В одном варианте осуществления перед обработкой животного-хозяина способами, описанными здесь, для истощения или ингибирования MDSC, животное-хозяина можно обработать введением конъюгата фолат-визуализирующего агента животному-хозяину, для определения статуса фолатных рецепторов у животного-хозяина, как описано в публикации заявки на патент США № 20140140925, включенной здесь посредством ссылки. В этом варианте осуществления статус фолатных рецепторов у животного-хозяина может быть определен как позитивный или негативный, и статус фолатных рецепторов можно использовать для определения соединения, которое следует вводить животному-хозяину.
В дополнительном аспекте способов, описанных здесь, фолат в одном или более соединениях выбран из фолата, специфичного для фолатного рецептора-α, и фолата, специфичного для фолатного рецептора-β. В этом аспекте можно вводить, по меньшей мере, два соединения, и фолат в одном соединении является фолатом, специфичным для фолатного рецептора-α, и фолат в другом соединении является специфичным для фолатного рецептора-β. В этом иллюстративном аспекте фолат-рецептор-позитивные формы рака, можно лечить, обрабатывая опухоль непосредственно посредством связывания соединения с опухолью, и опосредованно обрабатывая опухоль посредством связывания другого соединения с MDSC, для ингибирования или истощения MDSC.
В еще одном варианте соединение имеет формулу:
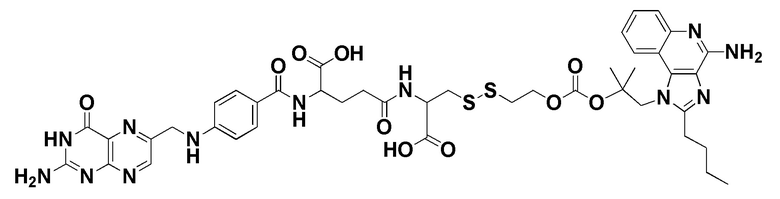
(также относится здесь к FA-TLR7) или его фармацевтически приемлемой соли).
В еще одном варианте осуществления соединение имеет формулу:
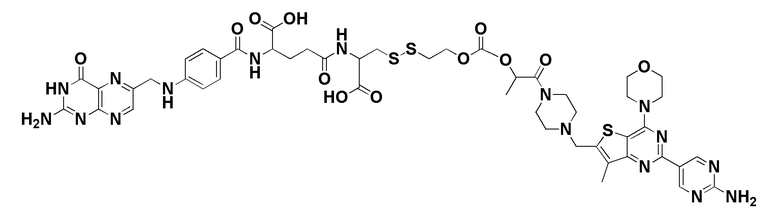
(также относится здесь к FA-PI3K) или его фармацевтически приемлемой соли).
В еще одном варианте осуществления соединение имеет формулу:
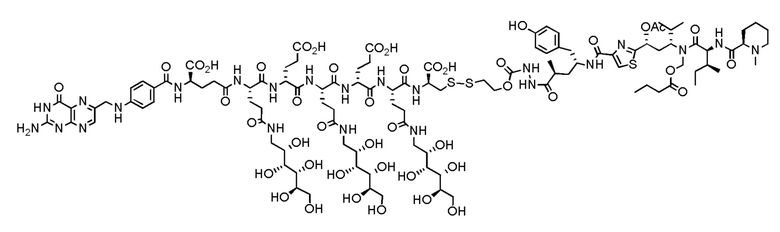
(также относится здесь к FA-тубулизину) или его фармацевтически приемлемой соли).
В еще одном варианте осуществления соединение имеет формулу:
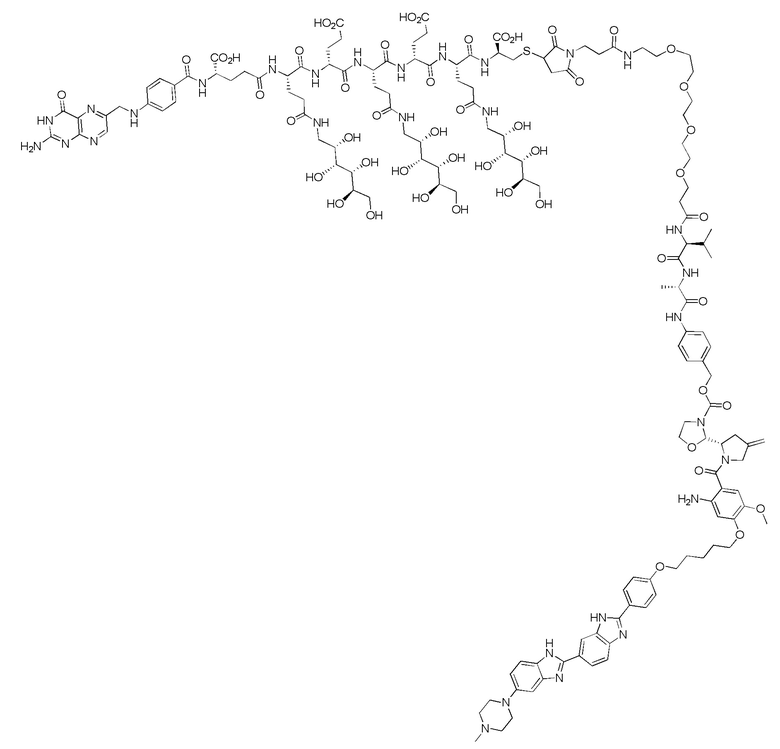
(также относится здесь к FA-PBD) или его фармацевтически приемлемой соли).
Как здесь используется, термин «фармацевтически приемлемая соль» относится к таким солям с противоионами, которые могут быть использованы в фармацевтических препаратах. Такие соли включают (1) кислотно-аддитивные соли, которые можно получить взаимодействием свободного основания исходного соединения с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, фосфорная кислота, серная кислота и хлорная кислота и тому подобное, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, D- или L-яблочная кислота, малеиновая кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота и т.п.; или (2) соли, образованные, когда кислотный протон, присутствующий в исходном соединении, замещается ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, триметамин, N-метилглюкамин и тому подобное. Фармацевтически приемлемые соли хорошо известны специалистам в данной области, и любые такие фармацевтически приемлемые соли могут предусматриваться в связи с вариантами осуществления, описанными здесь.
Подходящие кислотно-аддитивные соли получают из кислот, которые образуют нетоксичные соли. Иллюстративные примеры включают ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, эдисилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат.
Подходящие основные соли соединений, описанных здесь, получают из оснований, которые образуют нетоксичные соли. Иллюстративные примеры включают соли аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Также могут образовываться гемисоли кислот и оснований, например, гемисульфат и гемисоли кальция.
В одном аспекте соединение, как здесь описано, можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие пути для такого парентерального введения включают внутривенную, внутриартериальную, внутрибрюшинную, интратекальную, эпидуральную, интрацеребровентрикулярную, интрауретральную, интрастернальную, интракраниальную, интратуморальную, внутримышечную и подкожную доставку. Подходящие средства для парентерального введения включают инъекторы с иглой (включая микроиглы), безыгольные инъекторы и методы инфузии.
В одном иллюстративном аспекте композиции для парентерального введения обычно представляют водные растворы, которые могут содержать носители или наполнители, такие как соли, углеводы и буферные агенты (предпочтительно с рН от 3 до 9), но для некоторых применений они могут быть более подходящим образом формулированы в виде стерильного неводного раствора или в сухом виде для применения в сочетании с подходящим носителем, таким как стерильная апирогенная вода или забуференный фосфатом физиологический раствор. В еще одних вариантах осуществления любая из композиций, содержащих соединения, описанные здесь, может быть адаптирована для парентерального введения соединений, описанных здесь. Приготовление композиций для парентерального введения в стерильных условиях, например, лиофилизацией в стерильных условиях, может быть легко осуществлено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области. В одном варианте осуществления растворимость соединения, используемого для приготовления парентеральной композиции, может быть повышена посредством применения соответствующих методик формуляции, таких как включение агентов, повышающих растворимость.
Дозировка соединения может существенно варьироваться в зависимости от состояния животного-хозяина, типа рака, который лечат, пути введения соединения и распределения в ткани, а также возможности совместного применения других терапевтических методов лечения, таких как лучевая терапия или дополнительные препараты в комбинированной терапии. Терапевтически эффективное количество (т. е. соединения) или диагностически эффективное количество (например, конъюгатов фолат-визуализирующего агента, как описано в публикации заявки США № 20140140925, включенной здесь посредством ссылки), предназначенное для введения животному-хозяину, основано на площади поверхности тела, массе и врачебной оценки состояния животного-хозяина. Терапевтически эффективные или диагностически эффективные количества могут варьироваться, например, примерно от 0,05 мг/кг массы тела пациента до примерно 30,0 мг/кг массы тела пациента или примерно от 0,01 мг/кг массы тела пациента до примерно 5,0 мг/кг массы тела пациента, включая, не ограничиваясь этим, 0,01 мг/кг, 0,02 мг/кг, 0,03 мг/кг, 0,04 мг/ кг, 0,05 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 1,0 мг/кг, 1,5 мг/кг, 2,0 мг/кг, 2,5 мг/кг, 3,0 мг/кг, 3,5 мг/кг, 4,0 мг/кг, 4,5 мг/кг и 5,0 мг/кг, каждое из которых выражено на кг массы тела пациента. Общее терапевтически или диагностически эффективное количество соединения может вводиться в единичных или разделенных дозах и может, по усмотрению врача, выходить за пределы типичного диапазона, приведенного здесь.
В еще одном варианте осуществления соединение или конъюгат фолат-визуализирующего агента можно вводить в терапевтически или диагностически эффективном количестве примерно от 0,5 мкг/м2 до примерно 500 мг/м2, примерно от 0,5 мкг/м2 до примерно 300 мг/м2, или примерно от 100 мкг/м2 до примерно 200 мг/м2. В еще одних вариантах осуществления количества могут составлять примерно от 0,5 мг/м2 до примерно 500 мг/м2, примерно от 0,5 мг/м2 до примерно 300 мг/м2, примерно от 0,5 мг/м2 до примерно 200 мг/м2, примерно от 0,5 мг/м2 до примерно 100 мг/м2, примерно от 0,5 мг/м2 до примерно 50 мг/м2, примерно от 0,5 мг/м2 до примерно 600 мг/м2, примерно от 0,5 мг/м2 до примерно 6,0 мг/м2, примерно от 0,5 мг/м2 до примерно 4,0 мг/м2 или примерно от 0,5 до 2,0 мг/м2. Общее количество может вводиться в единичных или разделенных дозах и может, по усмотрению врача, выходить за пределы типичного диапазона, приведенного здесь. Эти количества выражены на м2 площади поверхности тела.
Соединения, описанные здесь, могут содержать один или несколько хиральных центров или иначе могут существовать в виде нескольких стереоизомеров. Следует понимать, что в одном варианте осуществления изобретение, описанное в данном документе, не ограничивается каким-либо конкретным стереохимическим требованием, и что соединения могут быть оптически чистыми или могут представлять любую из различных стереоизомерных смесей, включая рацемические и другие смеси энантиомеров, другие смеси диастереомеров и тому подобное. Также следует понимать, что такие смеси стереоизомеров могут включать одну стереохимическую конфигурацию в одном или более хиральных центрах, в то же время, включая смеси стереохимических конфигураций в одном или более других хиральных центрах.
Аналогично, соединения, описанные здесь, могут включать геометрические центры, такие как цис-, транс-, Е- и Z-двойные связи. Следует понимать, что в еще одном варианте осуществления изобретение, описанное здесь, не ограничивается каким-либо требованием к конкретному геометрическому изомеру, и что соединения могут быть чистыми или могут представлять собой любую из множества смесей геометрических изомеров. Также следует понимать, что такие смеси геометрических изомеров могут включать одну конфигурацию в одной или нескольких двойных связях, в то же время, включая смеси геометрии в одной или нескольких других двойных связях.
Как здесь используется, термин «линкер» включает цепочку атомов, которая соединяет два или более функциональных фрагментов молекулы с образованием соединения по изобретению. Иллюстративно, цепочка атомов выбрана из C, N, O, S, Si и P, или C, N, O, S и P, C, N, O и S. Цепочка атомов ковалентно соединяет различные функциональные активности соединения, такие как фолат и лекарственное средство. Линкер может иметь большое разнообразие длин, например, в диапазоне примерно от 2 до примерно 100 атомов в смежной основной цепи.
Как здесь используется, термин «высвобождаемый линкер» или «линкер, который высвобождается» относится к линкеру, который включает, по меньшей мере, одну связь, которая может расщепиться в физиологических условиях, такую как рН-лабильная, кислото-лабильная, основно-лабильная, окислительно-лабильная, метаболически-лабильная, биохимически-лабильная или фермент-лабильная связь. Понятно, что такие физиологические условия, приводящие к разрыву связи, необязательно включают биологический или метаболический процесс и вместо этого могут включать обычную химическую реакцию, такую как реакция гидролиза, например, при физиологическом pH или в результате компартментализации в клеточную органеллу, такую как эндосома, имеющую более низкий рН, чем цитозольный рН.
Понятно, что расщепляемая связь может соединять два смежных атома внутри высвобождаемого линкера и/или соединять другие части линкера, или фолата и/или лекарственного средства, как здесь описано, на одном или обоих концах высвобождаемого линкера. В случае, когда расщепляемая связь соединяет два смежных атома внутри высвобождаемого линкера, то после разрыва связи высвобождаемый линкер расщепляется на два или более фрагментов. Альтернативно, в случае, когда расщепляемая связь находится между высвобождаемым линкером и другим фрагментом, то после разрыва связи высвобождаемый линкер отделяется от другого фрагмента.
В еще одном варианте осуществления композиции для введения соединения готовят из соединения с чистотой, по меньшей мере, примерно 90%, или примерно 95%, или примерно 96%, или примерно 97%, или примерно 98%, или примерно 99%, или примерно 99,5%. В еще одном варианте осуществления композиции для введения соединения готовят из соединения с чистотой, по меньшей мере, 90%, или, по меньшей мере, 95%, или, по меньшей мере, 96%, или, по меньшей мере, 97%, или, по меньшей мере, 98%, или, по меньшей мере, 99% или, по меньшей мере, 99,5%.
Примеры
Химические соединения и реагенты:
Fmoc-Glu-OtBu получали от AAPPTEC Inc. 4-Хлор-3-нитрохинолин был приобретен у Matrix Scientific Inc. Fmoc-8-амино-3,6-диоксаоктановую кислоту получали от PolyPeptide Inc. N10-(трифторацетил)птероевая кислота, тубулизин были предоставлены Endocyte Inc. Набор для мониторинга твердофазного синтеза был приобретен у ANASPEC Inc. 2,2-Диметилоксиран, гидроксид аммония, ди-трет-бутилдикарбонат, трифторуксусная кислота, толуол, 2-пропанол, метанол, Pd/C, 1,2-диаминоэтантритиловая смола (полимер-связанная смола), триэтиламин, валерилхлорид, этилацетат, гексан, Na2SO4, оксид кальция, дихлорметан, 3-хлорпероксибензойная кислота, бензоилизоцианат, H-цис(Trt)-2-хлортритиловая смола, метоксид натрия, диметиламинопиридин, ацетонитрил, ДМСО, 4-хлор-3-нитро-а,а,а-трифтортолуол, гидразин гидрат, этанол, Na2CO3, NaHCO3, концентрированная HCl, диэтиловый эфир, трихлорметилхлорформиат, сульфурилхлорид, 2-меркапропиридин, 2-меркаптоэтанол, ДМФА, PyBOP, DIPEA, этандитиол, тиизопроилсилан, 20% раствор пиридина в ДМФА, 4-хлор-3-нитро-а,а,а-трифтортолуол, гидразин гидрат, 5,15-DPP, резиквимод, 2,4-диамино-6-гидроксипиримидин, N-ацетил-5-гидрокситриптамин, метотрексат, эверолимус, зимозан, MnCl2, L-аргинин, физиологический раствор, забуференный фосфатом Дульбекко (PBS), коллагеназа из Clostridium histolyticum, дезоксирибонуклеаза I из поджелудочной железы крупного рогатого скота, гиалуронидаза из семенников крупного рогатого скота, бычий сывороточный альбумин (BSA), глицин, азид натрия, субстрат OPD были приобретены у Sigma. Сжатые газы водород, аргон, азот были приобретены у компании Indiana Oxygen Company. BEZ235, PF-04691502, GDC-0980, вортманнин, BLZ945, леналидомид, NLG 919, AS1517499 и BIRB796 были приобретены у Selleckchem. АМТ был приобретен у Tocris Bioscience. CL307, CpG и поли(I:C) были получены от InvivoGen Inc. Реагент Грейса получали от Lifetechnology Inc. 10% Тритон Х-100 был приобретен у Pierce Inc. Ингибитор протеаз был приобретен у Research Products International. Набор для анализа мочевины QuantiChrom™ был приобретен у BioAssay Systems. Набор для определения мышиного IL-10 Duoset и анти-мышиную FITC-аргиназу приобретали в R & D systems. Среда RPMI 1640, фолат-дефицитная среда RPMI 1640 были приобретены у Gibco Inc. Раствор пенициллина и стрептомицина (50×), L-глютамин (200 мМ), 0,25% трипсин с 2,21 мМ ЭДТА (1×) были приобретены у Corning Inc. Фетальная бычья сыворотка (FBS) была приобретена у Atlantagics Inc. Фолат-дефицитный корм для животных был приобретен у Envigo Inc. Антитело к мышиному фолатному рецептору-β (F3IgG2a) было предоставлено доктором Димитровым из NIH. Блокатор мышиного Fc (CD16/CD32), анти-мышиный FITC-CD11b, анти-мышиный PEF4/80, анти-мышиный PE-Gr1, анти-мышиный PE-CD4, анти-мышиный FITC-CD8, окрашивающий раствор для оценки жизнеспособности клеток 7-AAD, лизирующий буфер для эритроцитов (10×) были приобретены у Biolegend Inc. Фиксируемый краситель eFluor® 660 для оценки жизнеспособности клеток был приобретен у eBioscience, Inc. Pierce™ 16% формальдегид (масса/объем) (без метанола) был приобретен у Thermo Fischer Scientific. Изофлуран получали от VetOne Inc. Andy Fluor™ 647 сложный эфир NHS (сукцинимидиловый сложный эфир) был приобретен у Applied Bioprobes. Мышиный GM-CSF получали от Miltenyi Biotec Inc. Фолат-тубулизин готовили в соответствии с методикой, описанной в литературе (см., например, процедуру, описанную в WO 2014/062697). Антитело к человеческому APC-CD33 было приобретено у Biolegend Inc. Среда для культивирования человеческих Т-клеток (среда TexMACS), человеческий IL-2 были получены от Miltenyi Biotech. Набор для выделения человеческих Т-клеток (набор для обогащения человеческих Т-клеток) был приобретен у STEMMCELL. Фиколл PaqueTM Plus был приобретен у GE Healthcare. 6-тиогуанин и метиленовый синий были получены от Sigma.
Биологические примеры
Пример 1: культивирование клеток и содержание животных
Клетки 4T1, которые не экспрессируют фолатный рецептор, были предоставлены Endocyte Inc. Клетки культивировали в полной среде RPMI 1640 (среда RPMI 1640 с добавлением 10% фетальной бычьей сыворотки, 1% пенициллина-стрептомицина и 2 мМ L-глютамина) при 37°С во влажной атмосфере 95% воздуха и 5% CO2. В клеточную среду добавляли 0,25% трипсина с 2,21 мМ ЭДТА каждые 3-4 суток. Мышей самок Balb/c в возрасте от 6 до 8 недель получали из питомника Envigo Inc. Животных содержали на обычном сбалансированном рационе для грызунов или на фолат-дефицитном рационе и помещали в стерильную среду при стандартном 12-ч цикле свет и темнота в течение всего периода исследования. Все процедуры на животных были одобрены Комитетом по содержанию и использованию животных Purdue в соответствии с рекомендациями NIH.
Пример 2: опухолевые модели
Модель солидной опухоли 4T1: мышей самок Balb/c в возрасте от 6 до 8 недель содержали на фолат-дефицитном рационе в течение 2 недель. Перед прививкой опухолевых клеток шерстный покров с левой стороны тела мыши удаляли электрическим триммером. 0,05 млн клеток 4T1, суспендированных в 50 мкл полной среды RPMI 1640, подкожно имплантировали около жировой подушки молочной железы. Обработку начинали на сутки 6, когда объем опухолей достигал 20-50 мм3. Для характеристики FR+ TAM/MDSC опухолевую ткань расщепляли, когда объем достигал 300-500 мм3. Была разработана процедура расщепления опухолей, которая вызывала минимальное повреждение белков клеточной поверхности. Смесь для расщепления состояла из 1 мг/мл коллагеназы IV, 0,1 мг/мл гиалуронидазы из семенников крупного рогатого скота и 0,2 мг/мл дезоксирибонуклеазы I в 10 мл бессывороточной фолат-дефицитной среды RPMI 1640. После расщепления в течение 1 ч при 37°C при легком встряхивании реакцию расщепления останавливали добавлением фолат-дефицитной среды RPMI 1640, содержащей 10% инактивированной нагреванием FBS, и разрушенные опухоли пропускали через клеточный фильтр 40 мкм для сбора отдельных клеток. Затем выделенные клетки центрифугировали для удаления расщепляющей смеси и ресуспендировали в 5-10 мл лизирующего буфера эритроцитов (1×) в течение 5 мин на льду. Для остановки реакции лизиса клеток добавляли от 30 до 40 мл PBS. Затем клетки центрифугировали для удаления супернатанта и ресуспендировали в проточной среде для окрашивания, которая представляла собой PBS, содержащий 2% FBS. Подсчитывали количество клеток и готовили для окрашивания для проточной цитометрии.
Модель перитонеальной опухоли 4Т1: мышей самок Balb/c в возрасте от 6 до 8 недель содержали на обычном сбалансированном рационе для грызунов. 10 млн клеток 4T1 в 300 мкл PBS вводили в брюшную полость. Перитонеальную асцитную жидкость собирали в период между сутками 7 и 10 с использованием перитонеального лаважа. Клетки центрифугировали для удаления супернатанта и ресуспендировали в 5-10 мл лизирующего буфера для эритроцитов (1×) в течение 5 мин на льду. Для остановки реакции лизиса клеток добавляли от 30 до 40 мл PBS. Затем клетки центрифугировали для удаления супернатанта и ресуспендировали в полной среде RPMI 1640 с добавлением 10 нг/мл мышиного GM-CSF. Подсчитывали количество клеток и готовили для окрашивания для проточной цитометрии и скрининга in vitro.
Модель солидной опухоли RM1: мышей самцов C57BL/6 в возрасте от 6 до 8 недель содержали на фолат-дефицитном рационе в течение 2 недель. Перед прививкой опухолевых клеток шерстный покров с шеи мыши удаляли электрическим триммером. 2 млн клеток RM1, суспендированных в 50 мкл полной среды RPMI 1640, имплантировали подкожно. За животными наблюдали каждые два дня после имплантации опухоли. Когда размер опухолей достигал примерно 500 мм3, мышей подвергали эвтаназии. Опухолевую ткань расщепляли с использованием смеси, аналогичной смеси, которую использовали для опухолевой модели 4T1. После расщепления в течение 1 ч при 37°C при легком встряхивании реакцию расщепления останавливали добавлением фолат-дефицитной среды RPMI 1640, содержащей 10% инактивированной нагреванием FBS, и разрушенные опухоли пропускали клеточный фильтр 40 мкм для сбора отдельных клеток. Затем выделенные клетки центрифугировали для удаления расщепляющей смеси и ресуспендировали в 5-10 мл лизирующего буфера для эритроцитов (1×) в течение 5 мин на льду. Для остановки реакции лизиса клеток добавляли от 30 до 40 мл PBS. Затем клетки центрифугировали для удаления супернатанта и ресуспендировали в проточной среде для окрашивания, которая представляла собой PBS, содержащий 2% FBS. Подсчитывали количество клеток и готовили для окрашивания для проточной цитометрии.
Модель солидной опухоли CT26: мышей самок Balb/C в возрасте от 6 до 8 недель содержали на фолат-дефицитном рационе в течение 2 недель. Перед прививкой опухолевых клеток шерстный покров с шеи мышей удаляли электрическим триммером. 2 млн клеток CT26, суспендированных в 50 мкл полной среды RPMI 1640, имплантировали подкожно. За животными наблюдали каждые два дня после имплантации опухоли. Когда размер опухолей достигал примерно 500 мм3, мышей подвергали эвтаназии. Опухолевую ткань расщепляли с использованием смеси, аналогичной смеси, которую использовали для опухолевой модели 4T1. После расщепления в течение 1 ч при 37°C при легком встряхивании реакцию расщепления останавливали добавлением фолат-дефицитной среды RPMI 1640, содержащей 10% инактивированной нагреванием FBS, и разрушенные опухоли пропускали через клеточный фильтр 40 мкм для сбора отдельных клеток. Затем выделенные клетки центрифугировали для удаления расщепляющей смеси и ресуспендировали в 5-10 мл лизирующего буфера для эритроцитов (1×) в течение 5 мин на льду. Для остановки реакции лизиса клеток добавляли от 30 до 40 мл PBS. Затем клетки центрифугировали для удаления супернатанта и ресуспендировали в проточной среде для окрашивания, которая представляла собой PBS, содержащий 2% FBS. Подсчитывали количество клеток и готовили для окрашивания для проточной цитометрии.
Модель солидной опухоли EMT6: мышей самок Balb/C в возрасте от 6 до 8 недель содержали на фолат-дефицитном рационе в течение 2 недель. Перед прививкой опухолевых клеток шерстный покров с шеи мыши удаляли электрическим триммером. 2 млн клеток EMT6, суспендированных в 50 мкл полной среды RPMI 1640, имплантировали подкожно. За животными наблюдали каждые два дня после имплантации опухолей. Когда размер опухолей достигал примерно 500 мм3, мышей подвергали эвтаназии. Опухолевую ткань расщепляли с использованием смеси, аналогичной смеси, которую использовали для опухолевой модели 4T1. После расщепления в течение 1 ч при 37°C при легком встряхивании реакцию расщепления останавливали добавлением фолат-дефицитной среды RPMI 1640, содержащей 10% инактивированной нагреванием FBS, и разрушенные опухоли пропускали через клеточный фильтр 40 мкм для сбора отдельных клеток. Затем выделенные клетки центрифугировали для удаления расщепляющей смеси и ресуспендировали в 5-10 мл лизирующего буфера для эритроцитов (1×) в течение 5 мин на льду. Для остановки реакции лизиса клеток добавляли от 30 до 40 мл PBS. Затем клетки центрифугировали для удаления супернатанта и ресуспендировали в проточной среде для окрашивания, которая представляла собой PBS, содержащий 2% FBS. Подсчитывали количество клеток и готовили для окрашивания для проточной цитометрии.
Пример 3: анализ проточной цитометрией
Окрашивание клеточной поверхности на маркеры: суспензии отдельных клеток, полученные на модели солидной опухоли или модели перитонеальной опухоли, готовили, как описано выше. 1 млн клеток в 100 мкл проточной среды для окрашивания инкубировали с 0,7 мкл блокатора мышиного Fc в течение 5 мин на льду. Поверхностные маркеры для MDSC (CD11b, Gr1), ТАМ (CD11b, F4/80) и фолатный рецептор-β (F3IgG2a) добавляли после инкубации с блокатором Fc. В таблицах 1 и 2 приведены объемы антител, используемых для окрашивания на поверхностные маркеры. После инкубации на льду в течение 1 ч клетки промывали 500 мкл PBS и ресуспендировали в 200 мкл проточной среды для окрашивания. Маркер мертвых/живых клеток (3 мкл 7-AAD или 1 мкл BV421 для мертвых/живых) добавляли к каждому образцу и инкубировали при комнатной температуре в темноте. Через 15 мин клетки анализировали с использованием проточного цитометра BD Accuri C6TM без промывки (окрашивание в таблице 1). Однократную промывку проводили для окрашивания, приведенного в таблице 2, и клетки анализировали с использованием проточного цитометра BD Forteassa. Результаты представлены на фиг. 5 и фиг. 6. Как показано на фиг. 5 и фиг. 6, популяция мышиных MDSC и TAM в солидной опухоли 4T1 может быть идентифицирована маркерами CD11b+Gr1+ и CD11b+F4/80+ соответственно. После гейтирования этих двух клеточных популяций экспрессию FR-β можно было наблюдать в большинстве клеток этих двух популяций (61,2% в MDSC и 95% в TAM).
Объемы антител в 100 мкл клеточной суспензии для окрашивания для проточной цитометрии PDL-1 и FR-β
Внутриклеточное окрашивание на аргиназу: маркеры клеточной поверхности для ТАМ/MDSC метили согласно процедурам, описанным выше. 0,1 мкл фиксируемого красителя для оценки жизнеспособности eFluor® 660 добавляли вместе со смесями антител. После промывания PBS клетки фиксировали в 4% формальдегиде в 500 мкл PBS в течение 15 мин при 4°C. Клетки центрифугировали для удаления фиксирующего раствора. Клетки дважды промывали 500 мкл промывочного буфера, содержащего 0,1 М глицина и 0,05% азида натрия. После конечного центрифугирования к клеткам добавляли 1 мл раствора для пермеабилизации, содержащего 0,1 М глицина, 0,05% азида натрия и 0,1% тритона-100. Пермеабилизацию проводили при комнатной температуре в течение 5 мин. Пермеабилизованные клетки центрифугировали при 1500 об/мин в течение 1 мин, и клетки трижды промывали 1 мл блокирующего буфера, содержащего 0,05 М глицина, 0,05% азида натрия и 0,2% желатина. Затем клетки ресуспендировали в 1 мл блокирующего буфера при 4°С в течение ночи для блокирования неспецифического внутриклеточного связывания. Затем клетки центрифугировали при 1500 об/мин в течение 1 мин для удаления супернатанта, и добавляли еще 100 мкл блокирующего буфера, содержащего 1 мкл FITC-аргиназы. Клетки выдерживали в темноте при 4°С в течение ночи. После центрифугирования при 1500 об/мин в течение 1 мин клетки промывали 1 мл блокирующего буфера и затем готовили для анализа проточной цитометрией (проточный цитометр BD Accuri C6TM).
Пример 4: скрининг TAM/MDSC in vitro
Клетки, выделенные из модели перитонеальной опухоли, ресуспендировали в полной среде RPMI 1640 с добавлением 10 нг/мл мышиного GM-CSF и высевали в 96-луночные планшеты. Различные концентрации препаратов, предназначенных для скрининга, приведенные в таблице 2, растворяли в той же среде и добавляли в каждую лунку, содержащую 0,5 млн клеток, в 300 мкл среды. Лунки, содержащие 0,5 млн клеток в 300 мкл среды без добавления испытуемых препаратов, использовали в качестве необработанного контроля. В три дополнительные лунки вносили 300 мкл среды без клеток и препаратов, которые использовали в качестве фонового контроля. Затем клетки инкубировали при 37°C во влажной атмосфере 95% воздуха и 5% CO2 в течение от 24 ч до 48 ч. В конце инкубации супернатант собирали для анализа IL-10 с использованием ELISA и анализа оксида азота. Клетки дважды промывали 300 мкл PBS и затем готовили для анализа аргиназы.
Перечень соединений и функции для скрининга in vitro
ингибитор
Пример 5: анализ активности аргиназы
Активность аргиназы определяли в клеточных лизатах, как описано в публикации I.M. Corraliza, M.L. Campo, G. Soler, M. Modolell, «Determination of arginase activity in macrophages: a micromethod», Journal of Immunological Methods 174 (1994) 231-235. Вкратце, после инкубации in vitro выделенных ТАМ/MDSC с различными испытуемыми препаратами в 96-луночных планшетах клетки дважды промывали 300 мкл PBS. Затем клетки лизировали в течение 30 мин при комнатной температуре с использованием 100 мкл 0,1% Тритона Х-100 с ингибитором протеаз (1×). Затем 50 мкл растворов лизата переносили в новый V-образный 96-луночный планшет. 50 мкл раствора для активации аргиназы (10 мМ MnCl2/50 мМ Трис⋅HCl (рН 7,5)) добавляли в клеточный лизат. Фермент активировали нагреванием в течение 10 мин при 56°С. Гидролиз аргинина проводили инкубацией 25 мкл активированного раствора с 25 мкл раствора субстрата аргиназы (0,5 М L-аргинина (рН 9,7)) при 37°С в течение 60 мин при легком встряхивании. После охлаждения до комнатной температуры 10 мкл реакционного раствора затем разбавляли до 90 мкл PBS. 10 мкл этого разбавленного раствора переносили в 96-луночный плоскодонный прозрачный планшет. 200 мкл реагентов для определения мочевины добавляли в каждую лунку. После инкубации в темноте при комнатной температуре в течение 10 мин концентрацию мочевины измеряли при 520 нм с помощью планшетного ридера. Результаты показаны на фиг. 7, фиг. 11, фиг. 12, фиг. 15 и фиг. 24.
Как показано на фиг. 7, было установлено, что некоторые препараты могут эффективно снижать продукцию аргиназы клетками TAM/MDSC in vitro, включая CL307, BEZ235, вортманнин, CpG, тубулизин, AS1517499 и BIRB796. Уровень аргиназы был пропорционален поглощению при 520 нм. Черная пунктирная линия на каждой фигуре показывает уровень аргиназы в необработанном контроле. Черная сплошная линия указывает на фоновый уровень аргиназы. Строили график зависимости поглощения при 520 нм для каждого образца от концентрации тестированных препаратов в концентрации от 0,1 до 100 мкМ.
Как показано на фиг. 11, для тестирования эффективности нового синтезированного агониста TLR7 (TLR7A) в отношении влияния на продукцию аргиназы клетками TAM/MDSC, TLR7A и Cl307 сокультивировали с TAM/MDSC в различных концентрациях. По данным фиг. 11 следует, что TLR7A более эффективен в снижении уровня аргиназы, чем коммерчески доступный агонист TLR7 (Cl307).
Как показано на фиг. 12, при сравнении влияния трех ингибиторов PI3K на уменьшение продукции аргиназы клетками TAM/MDSC in vitro, было установлено, что GDC-0980 является наилучшим кандидатом, который может эффективно снижать уровень аргиназы, продуцированной TAM/MDSC.
Как показано на фиг. 15, TAM/MDSC, полученные из модели перитонеальной опухоли 4T1, культивировали с агонистом TLR7 (Cl307), ингибитором PI3K (BEZ235) и/или комбинацией двух препаратов в различных концентрациях. EC50 каждой комбинации наносили на график между двумя препаратами, как показано на фиг. 15. Квадратный символ обозначал EC50 при индивидуальной обработке Cl307 или BEZ235. Было установлено, что при объединении двух разных препаратов, которые по отдельности могут оказывать влияние на продукцию аргиназы, наблюдается синергетический эффект, который может дополнительно снизить продукцию аргиназы клетками ТАМ/MDSC.
Как показано на фиг. 24, внутриклеточное окрашивание на аргиназу на F4/80+ макрофагах тестировали в группах необработанного контроля, FA-агониста TLR7, FA-ингибитора PI3K, FA-тубулизина и их комбинации, а также в группах с конкурентом. Как представлено в предшествующем разделе описания методов, после разрушения опухолей в конце терапевтических исследований выделенные клетки окрашивали на поверхностный маркер макрофагов (F4/80) и функциональный маркер макрофагов М2 (аргиназу) для тестирования уровня экспрессии аргиназы на F4/80+ макрофагах. Было установлено, что повышающая регуляция аргиназы является важным показателем супрессии ТАМ/MDSC, поскольку истощение L-аргинина аргиназой может ингибировать пролиферацию цитотоксических Т-клеток. Клеточную популяцию аргиназа+F4/80+ в живых клетках из групп с обработкой препаратами и конкурентом, сравнивали с той же популяцией из необработанной группы. Как показано на фиг. 24, популяция клеток аргиназа+F4/80+ из групп с обработкой достоверно уменьшилась по сравнению с необработанным контролем, и данный эффект мог конкурировать дополнительным добавлением конкурента (FA-PEG-NH2). Таким образом, можно сделать вывод, что посредством нацеливания на FR+ TAM/MDSC в солидной опухоли 4T1 три группы FADC-конъюгированных SMDC способны оказывать отрицательное влияние на иммуносупрессию TAM/MDSC.
Пример 6. Анализ IL-10 с использованием ELISA
Продукцию IL-10 клетками TAM/MDSC после инкубации in vitro с различными соединениями оценивали с помощью анализа ELISA, следуя протоколу, предоставленному к набору для определения мышиного IL-10 ELISA DuoSet от R&D Systems. Вкратце, 96-луночный планшет с высокой аффинностью к белкам покрывали 100 мкл на лунку разведенного захватывающего антитела с рабочей концентрацией 4 мкг/мл в PBS без белка-носителя. Планшет герметично закрывали и инкубировали в течение ночи при комнатной температуре. Содержимое каждой лунки аспирировали и трижды промывали 400 мкл промывочного буфера (0,05% Твин®20 в PBS, pH 7,2-7,4) с использованием опрыскивателя. После последнего промывания оставшийся промывочный буфер удаляли переворачиванием планшета и промоканием чистыми бумажными полотенцами. Планшеты блокировали добавлением 300 мкл разбавляющего реагента (1% BSA в PBS, pH 7,2-7,4) в каждую лунку и инкубировали при комнатной температуре в течение 1 ч. Аспирацию/промывание повторяли три раза аналогично тому, как описано выше. Планшеты были готовы для добавления образцов. В каждую лунку вносили 100 мкл образца супернатанта из скрининга TAM/MDSC in vitro. Планшет накрывали липкой лентой и инкубировали в течение 2 ч при комнатной температуре. Вышеописанную процедуру аспирации/промывания повторяли три раза. В каждую лунку добавляли 100 мкл детектирующего антитела в концентрации 300 нг/мл в разбавляющем реагенте. Планшет накрывали другой липкой лентой и инкубировали в течение 2 ч при комнатной температуре. Вышеописанную процедуру аспирации/промывания повторяли три раза. 100 мкл рабочего разведения стрептавидин-HRP (разведения от 1 до 40 в разбавляющем реагенте) добавляли в каждую лунку. Планшет накрывали и инкубировали в течение 20 мин при комнатной температуре в темноте. Вышеописанную процедуру аспирации/промывания повторяли три раза. 200 мкл раствора субстрата (один пакетик серебристых и золотистых таблеток OPD в 20 мл деионизированной воды) вносили в каждую лунку. Планшет инкубировали в течение 20 мин при комнатной температуре в темноте. 50 мкл стоп-раствора (3 М HCl) добавляли в каждую лунку. Планшет осторожно постукивали для обеспечения тщательного перемешивания. Концентрация IL-10 была пропорциональна оптической плотности, определенной на микропланшетном ридере при 492 нм. Результаты показаны на фиг. 8 и фиг. 13.
Как показано на фиг. 8, было установлено, что некоторые испытуемые препараты могут эффективно снижать продукцию IL-10 TAM/MDSC in vitro, включая BEZ235, вортманнин, тубулизин, леналидомид, AS1517499 и BIRB796. Концентрация IL-10 была пропорциональна поглощению при 492 нм. Черная пунктирная линия на каждой фигуре указывает на уровень IL-10 в необработанном контроле. Черная сплошная линия указывает фоновый уровень IL-10. Строили график зависимости поглощения при 492 нм для каждого образца от концентрации тестированных препаратов от 0,1 до 100 мкМ.
Как показано на фиг. 13, сравнивая влияние трех ингибиторов PI3K на уменьшение продукции IL-10 клетками TAM/MDSC in vitro, было установлено, что GDC-0980 является наилучшим кандидатом, который может эффективно снижать уровень IL-10, продуцированный TAM/MDSC.
Пример 7: анализ оксида азота
Продукцию оксида азота измеряли с помощью реагента Грейса, как описано в публикации Je-In Youn, Srinivas Nagaraj, Michelle Collazo и Dmitry I. Gabrilovich, «Subsets of Myeloid-Derived Suppressor Cells in Tumor Bearing Mice», J. Immunol., 2008, Oct. 15; 181(8): 5791-5802. Вкратце, после инкубации in vitro клеток ТАМ/MDSC с различными испытуемыми препаратами 50 мкл супернатанта из каждой лунки переносили в 96-луночный плоскодонный прозрачный планшет. В каждую лунку добавляли 20 мкл реагента Грейса и 30 мкл деионизированной воды с 50 мкл супернатанта. Реакционный раствор выдерживали в темноте при комнатной температуре в течение 30 мин до измерения на планшетном ридере. Поглощение при 548 нм коррелирует с концентрацией оксида азота, продуцированного клетками ТАМ/MDSC. Результаты показаны на фиг. 9, фиг. 10, фиг. 11 и фиг. 14.
Как следует из данных фиг.9, было установлено, что некоторые испытуемые препараты могут эффективно снижать продукцию оксида азота клетками TAM/MDSC in vitro, включая BEZ235, вортманнин, AMT, метотрексат, тубулизин, AS1517499, эверолимус и BIRB796. Концентрация оксида азота была пропорциональна поглощению при 548 нм. Черная пунктирная линия на каждой фигуре указывает на уровень оксида азота в необработанном контроле. Черная сплошная линия указывает фоновый уровень оксида азота. Строили график зависимости поглощения при 548 нм для каждого образца от концентрации тестированных препаратов от 0,1 до 100 мкМ.
Как показано на фиг. 10, имеет место резко повышенная продукция оксида азота и активация CD86 in vitro после сокультивирования клеток TAM/MDSC с различными агонистами TLR, что указывает на перепрограммирование TAM/MDSC на макрофаги M1 с противоопухолевой активностью.
Как показано на фиг. 11, для тестирования эффективности нового синтезированного агониста TLR7 (TLR7A) в отношении влияния на продукцию оксида азота клетками TAM/MDSC, TLR7A и Cl307 сокультивировали с TAM/MDSC в различных концентрациях. По данным фиг. 11 можно видеть, что TLR7A более эффективен в увеличении продукции оксида азота, чем коммерчески доступный агонист TLR7 (Cl307).
Как показано на фиг. 14, сравнивая влияние трех ингибиторов PI3K на снижение продукции оксида азота клетками TAM/MDSC in vitro, было обнаружено, что GDC-0980 является наилучшим кандидатом, который может эффективно уменьшать уровень оксида азота, продуцированного клетками TAM/MDSC.
Пример 8: статистический анализ
Статистическую значимость между значениями определяли с использованием t-критерия Стьюдента. Все данные выражены в виде среднего значения±стандартное отклонение. Значения вероятности p ≤ 0,05 считались значимыми.
Пример 9: соотношение макрофагов М1 к М2
Соотношение макрофагов M1 к M2 (F4/80+CD86+:F4/80+CD206+) определяли в группах необработанного контроля, FA-агониста TLR7, FA-ингибитора PI3K, FA-тубулизина и комбинации, а также в группах с конкурентом.
Как описано в предшествующем разделе описания методов, после расщепления опухолей в конце терапевтического исследования, выделенные клетки окрашивали на маркер макрофагов F4/80 и маркеры M1 (CD86), M2 (CD206). Определяли соотношение макрофагов M1 к M2 в солидной опухоли 4T1, и обобщенные результаты представлены на фиг.25. Макрофаги в опухолевой среде в основном рассматривались в качестве функции макрофагов M2, которая может поддерживать рост опухоли и подавлять иммунный ответ. С другой стороны, полагается, что макрофаги M1 способны вызывать элиминацию опухолевых клеток и стимулировать противоопухолевый иммунный ответ. Следовательно, определение соотношения макрофагов M1 к M2 очень важно для нацеливания на FR-β-позитивные TAM/MDSC. Как показано на фиг.25, соотношение макрофагов M1 к M2 (клеточная популяция F4/80+CD86+ к клеточной популяции F4/80+CD206+) из групп с обработками препаратами и с конкурентом сравнивали с соотношением в необработанном контроле. В результате соотношение в трех группах с обработками (FA-агонист TLR7, FA-ингибитор PI3K и их комбинация) достоверно увеличилось по сравнению с необработанным контролем, и данный эффект мог конкурировать с дополнительным добавлением конкурента (FA-PEG-NH2). Таким образом, можно сделать вывод, что посредством нацеливания на FR+ TAM/MDSC в солидной опухоли 4T1, три группы FA-конъюгированных MDSC способны превращать среду иммуносупрессии макрофагов M2 в среду противоопухолевых макрофагов M1, что будет способствовать замедленному росту опухоли.
Пример 10: популяция MDSC
Популяцию MDSC (CD11b+Gr1+) тестировали в группах необработанного контроля, FA-агониста TLR7, FA-ингибитора PI3K, FA-тубулизина и комбинации, а также в группах c конкурентом.
Как описано в предшествующем разделе описания методов, после расщепления опухоли, в конце терапевтического исследования выделенные клетки окрашивали на маркеры MDSC CD11b+Gr1+, см. фиг. 26. Только группы с FA-агонистом TLR7 и комбинацией показали достоверно уменьшенную популяцию MDSC. Популяция MDSC в группах обработки FA-тубулизином и FA-ингибитором PI3K не изменялась по сравнению с необработанной контрольной и группой с конкурентом. Уменьшение популяции MDSC при обработке агонистами TLR7 (группы с FA-агонистом TLR7 и комбинацией) может быть результатом перепрограммирования MDSC в функцию ингибирования выживаемости опухоли, что может вызвать изменение фенотипа MDSC. Несмотря на то, что данные in vitro указывают на токсичность тубулизина для TAM/MDSC, опухолевая среда in vivo может подавлять гибель под действием тубулизина, поскольку опухолевые клетки могут высвобождать факторы роста и цитокины, которые могут поддерживать выживаемость MDSC даже при наличии токсического вещества тубулизина. В результате популяция MDSC при обработке FA-тубулизином не изменялась. Однако, проводя совокупный анализ данных на фиг. 24, 25 и 26, можно обнаружить, что функция TAM/MDSC (уровень аргиназы) и опухолевая среда (отношение макрофагов M1 к M2) в группах FA-тубулизина и FA-ингибитор PI3K модифицировались даже без изменения фенотипа MDSC.
Пример 11: процентный уровень популяций CD4 и CD8 Т-клеток
Процентный уровень популяции CD4 и CD8 T-клеток определяли в живых клетках, выделенных из солидных опухолей 4T1 в группах необработанного контроля, FA-агониста TLR7, FA-ингибитора PI3K, FA-тубулизина, а также в группах с конкурентом (см. фиг. 27).
Обработка фолатом SMDC оказывает более достоверное влияние на увеличение популяции CD4+ T-клеток, чем на увеличение CD8+ T-клеток. Следует отметить, что, поскольку PI3K играет важную роль в пролиферации и активации Т-клеток, то CD4+ и CD8+ Т-клетки в комбинированных группах не показали различий или уменьшения популяции по сравнению с необработанным контролем.
Пример 12: исследования in vivo
Исследование с различными дозами FA-TLR7A проводили на модели солидной опухоли 4T1 с 2 мышами на группу. Обработку проводили в/в инъекцией различных доз FA-TLR7A в течение 5 суток в неделю, начиная с суток 6 после имплантации опухоли (подкожно, 0,05 млн клеток/мышь). Обработку продолжали 2 недели. Объем опухоли измеряли каждый день. По результатам данного исследования можно видеть, что посредством нацеливания на TAM/MDSC через фолатный рецептор-β с использованием агониста TLR7 рост опухоли замедлялся, особенно в группах с дозами 5 нмоль, 10 нмоль и 20 нмоль. Результаты показаны на фиг. 16 и 17.
Терапевтическое исследование с FA-агонистом TLR7 проводили на модели солидной опухоли 4T1 с 3 мышами на группу. Обработку проводили в/в инъекцией 100 мкл 10 нмоль FA-агониста TLR7 в PBS в течение 5 суток в неделю, начиная с суток 6 после имплантации опухоли (подкожно, 0,05 млн клеток/мышь). Обработку продолжали 2 недели. Группу с конкурентом обрабатывали по аналогичной схеме путем совместного введения в 200 раз большего количества конкурента (FA-PEG-NH2) с 10 нмоль FA-агониста TLR7. Общий объем инъекции составил 100 мкл. Объем опухолей измеряли каждый день. По результатам данного исследования можно прийти к заключению, что при воздействии на TAM/MDSC через фолатный β-рецептор агонистом TLR7 рост опухоли замедляется. И данный эффект мог конкурировать при добавлении дополнительного FA-PEG-NH2, подтверждая, что противоопухолевая активность FA-агониста TLR7 была опосредована через FR-β. Результаты показаны на фиг. 18.
Терапевтическое исследование с FA-тубулизином проводили на модели солидной опухоли 4T1 с 3 мышами на группу. Обработку проводили в/в инъекцией 100 мкл 30 нмоль FA-тубулизина в PBS в течение 5 суток в неделю, начиная с суток 6 после имплантации опухоли (подкожно, 0,05 млн клеток/мышь). Обработку продолжали 2 недели. Группу с конкурентом обрабатывали по аналогичной схеме путем совместного введения в 200 раз большего количества конкурента (FA-PEG-NH2) с 30 нмоль FA-тубулизина. Общий объем инъекции составил 100 мкл. Объем опухолей измеряли каждый день. По результатам данного исследования можно видеть, что при воздействии на TAM/MDSC через фолатный рецептор-β тубулизином рост опухолей замедлялся. И данный эффект мог конкурировать при добавлении дополнительного FA-PEG-NH2, подтверждая, что противоопухолевая активность FA-тубулизина была опосредована через FR-β. Результаты показаны на фиг. 19.
Терапевтическое исследование с FA-ингибитором PI3K проводили на модели солидной опухоли 4T1 с 3 мышами на группу. Обработку проводили в/в инъекцией 100 мкл 10 нмоль FA-ингибитора PI3K в PBS в течение 5 суток в неделю, начиная с суток 6 после имплантации опухоли (подкожно, 0,05 млн клеток/мышь). Обработку продолжали 2 недели. Группу с конкурентом обрабатывали по аналогичной схеме путем совместного введения в 200 раз большего количества конкурентов (FA-PEG-NH2) с 10 нмоль FA-ингибитора PI3K. Общий объем инъекции составил 100 мкл. Объем опухолей измеряли каждый день. По результатам данного исследования можно прийти к заключению, что путем нацеливания на ТАМ/MDSC через фолатный рецептор-β ингибитором PI3K рост опухолей замедлялся. И данный противоопухолевый эффект мог конкурировать при добавлении дополнительного FA-PEG-NH2, подтверждая что противоопухолевая активность FA-ингибитора PI3K была опосредована через FR-β. Результаты показаны на фиг. 20.
Терапевтическое исследование с комбинацией FA-агониста TLR7 и нецелевого ингибитора PI3K (BEZ235) проводили на модели солидной опухоли 4T1 с 3 мышами на группу. Обработку проводили в/в инъекцией 100 мкл 10 нмоль FA-агониста TLR7 в PBS в комбинации с пероральным введением BEZ235 по 0,27 мг на мышь в течение 5 суток в неделю, начиная с суток 6 после имплантации опухоли (подкожно, 0,05 млн клеток/мышь). Обработку продолжали 2 недели. Группу с конкурентом обрабатывали по аналогичной схеме совместной инъекцией в 200 раз большего количества конкурента (FA-PEG-NH2) с 10 нмоль FA-агониста TLR7 в комбинации с пероральным введением BEZ235 по 0,27 мг на мышь. Общий объем инъекции составил 100 мкл. Объем опухолей измеряли каждый день. По результатам данного исследования можно видеть, что при комбинировании FA-агониста TLR7 с нецелевым ингибитором PI3K рост опухолей достоверно замедлялся. И данный эффект мог конкурировать при добавлении дополнительного FA-PEG-NH2, подтверждая, что противоопухолевая активность комбинированного лечения опосредована через FR-β. Однако в начале введения ингибитора PI3K, BEZ235, можно было наблюдать определенную токсичность в виде снижения массы животного. Результаты показаны на фиг. 21.
Терапевтическое исследование с FA-агонистом TLR7 in vivo проводили, как описано выше. Нецеленаправленную терапию ингибитором PI3K (BEZ235) проводили по аналогичной схеме путем перорального введения 0,27 мг на мышь в течение 5 суток в неделю. Исследование продолжали 2 недели. Сравнивая фиг. 21 и 22, можно видеть синергетический эффект в замедлении роста опухоли для комбинированной терапии, что подтвердило вывод предыдущего исследования in vitro о наличии синергетического эффекта на выработку аргиназы при сокультивировании ТАМ/MDSC с агонистом TLR7 и ингибитором PI3K. Результаты показаны на фиг. 22.
На фиг. 23 показан средний объем опухолей в последний день обработки для терапевтической группы.
Пример 13: индукция in vitro человеческих MDSC из PBMC
Человеческие РВМС от здорового донора выделяли центрифугированием в градиенте плотности в соответствии со стандартной процедурой:
Кровь представляла кровь, разведенную PBS (разведения 1:2). 15 мл фиколла переносили в пробирку емкостью 50 мл. 35 мл разбавленной крови аккуратно наносили на среду фиколла. Пробирку центрифугировали при 400 g в течение 30 мин при 24°C без торможения. После остановки центрифуги пробирку осторожно извлекали из центрифуги, не нарушая расслоения. РВМС осторожно извлекали из пробирки и переносили в другую коническую пробирку емкостью 50 мл. Выделенные РВМС промывали PBS и центрифугировали при 300 g в течение 10 мин. Супернатант декантировали. Осадок снова промывали PBS и центрифугировали при 200 g в течение 15 мин. Выделенные РВМС подсчитывали с помощью гемоцитометра.
Выделенные РВМС дополнительно очищали адгезией в бессывороточной среде в течение 4 ч при 37°С при плотности 3 × 106 клеток/мл. После удаления взвешенных клеток прикрепленные PBMC культивировали в полной среде RPMI-1640 с добавлением 10 нг/мл IL-6 и GM-CSF в течение 7 суток. Затем человеческие MDSC подвергали сортингу проточной цитометрией как клетки CD33+. Нормальные человеческие макрофаги дифференцировали путем совместного культивирования PBMC в полной среде RPMI-1640 в течение 7 суток.
Человеческие MDSC культивировали с выбранными препаратами в течение 2 суток. Измеряли продукцию IL-10 клетками MDSC и строили график зависимости от концентрации препарата. Человеческие MDSC показали аналогичную реакцию на эти препараты снижением IL-10, что может способствовать подавлению иммуносупрессии MDSC. Результаты показаны на фиг. 28.
Пример 14: активация человеческих Т-клеток in vitro и подавление супрессии Т-клеток
Человеческие PBMC выделяли центрифугированием в градиенте плотности, как описано в примере 13. Выделенные PBMC ресуспендировали в 1 мл PBS с 2% FBS и 1 мМ ЭДТА в пробирке емкостью 15 мл с концентрацией 5 × 107 клеток/мл. К суспензии добавляли 50 мкл раствора смеси из набора для обогащения человеческих Т-клеток. Клетки инкубировали в течение 10 мин при комнатной температуре. Добавляли 50 мкл магнитных шариков (набор для обогащения человеческих Т-клеток) и инкубировали в течение 5 мин при комнатной температуре. Пробирку с Т-клетками и магнитными шариками помещали на магнит на 5 мин при комнатной температуре. Супернатант содержал негативно отобранные человеческие Т-клетки, которые собирали и подсчитывали. Выделенные Т-клетки культивировали с 50 Е/мл IL-2 при плотности 1 × 106 клеток/мл в течение 3 суток. Затем клеточный раствор хорошо перемешивали с помощью пипетки и помещали рядом с магнитом на 5 мин для удаления шариков. Суспензию собирали, которая содержала активированные человеческие Т-клетки для анализа супрессии.
Человеческие MDSC, которые сокультивировали с 3 группами препаратов в концентрации 0,1 или 1 мкМ в течение 2 суток, смешивали с активированными человеческими Т-клетками в соотношении 8:1 на 18 ч. Продукцию IFN-γ измеряли в качестве показателя активации Т-клеток. По сравнению с макрофагами, MDSC показали 50% ингибирование активации Т-клеток. Для концентрации препарата 0,1 мкМ отсутствовали достоверные изменения в продукции IFN-γ Т-клетками. Однако при концентрации 1 мкМ MDSC, обработанные агонистом TLR7, показали резко повышенный уровень IFN-γ из T-клеток, указывая на то, что функция супрессии MDSC может быть подавлена или изменена стимуляцией агонистом TLR7 in vitro. Результаты показаны на фиг. 29.
Пример 15: анализ метастазирования в легкие
Мышей Balb/c, которым прививали клетки 4T1, обрабатывали тремя группами FA-конъюгатов в течение 2 недель (7 суток в неделю), когда размер опухолей достигал 50 мм3. Через 2 недели обработки животных подвергали эвтаназии, и ткань легких расщепляли с использованием 5 мл раствора коллагеназы IV PBS (1 мг/мл) в течение 2 ч при 37°С. Суспензию пропускали через клеточный фильтр 70 мкм для получения суспензии отдельных клеток. Клетки сокультивировали в 10 мл полной среды RPMI-1640, содержащей 60 мкМ 6-тиогуанина, в течение 10-14 суток. Среду удаляли в конце культивирования. Клетки фиксировали в 5 мл метанола в течение 5 мин при комнатной температуре и один раз промывали деионизированной водой. Добавляли 5 мл метиленового синего (0,03%, об./об.) для окрашивания клеток на 5 мин при комнатной температуре. После промывания водой клетки высушивали на воздухе для оценки метастазирования.
Клетки 4T1 проявляют резистентность к FA-конъюгатам и к высвобождаемым препаратам. Следовательно, можно полагать, что противоопухолевую активность FA-конъюгатов in vivo следует отнести к нацеливанию на FR-β-позитивные миелоидные клетки посредством ингибирования или перепрограммирования функции иммуносупрессии. Результаты показаны на фиг. 30 и фиг. 31.
Схему введения FA-конъюгатов изменяли с 5 суток в неделю до 7 суток в неделю для определения того, можно ли достичь улучшенного терапевтического эффекта. Непрерывное введение FA-конъюгатов в солидную опухоль 4T1 может уменьшить рост опухоли. Результаты показаны на фиг. 32.
Посредством нацеливания на MDSC/TAM активность аргиназы достоверно снижалась в трех группах обработки, что могло способствовать элиминации супрессии Т-клеток. Результаты показаны на фиг. 33.
MDSC непосредственно вовлечены в распространение опухолевых метастазов, участвуя в формировании преметастатической ниши, способствуя ангиогенезу и инвазированию опухолевых клеток. Гипотеза заявителей заключается в том, что элиминация MDSC/TAM предотвращает метастазирование рака. Результаты предыдущего исследования показали, что стимуляция TLR7/ингибирование PI3K может уменьшить популяцию MDSC или превратить MDSC/TAM с иммуносупрессией в M1-подобные макрофаги, или подавить функцию иммуносупрессии, такую как аргиназа и IL-10. В результате, активация Т-клеток может быть повышена, и системный иммунитет будет усиливаться. Данные по метастазированию показали снижение метастазирования в легких в опытных группах с обработкой по сравнению с необработанным контролем заболевания. Результаты показаны на фиг. 34 и 35.
Пример 16: исследование с оценкой выживаемости
Мышам Balb/c прививали подкожно 5 × 104 клеток. Обработку FA-конъюгатами начинали, когда размер опухолей достигал примерно 50 мм3, и продолжали в течение 2 недель по схеме 7 суток в неделю. Опухоль удаляли хирургическим путем, когда размер достигал 150-200 мм3. Проводили наблюдение за выживанием животных.
Мышей, несущих солидную опухоль 4T1, обрабатывали FA-конъюгатами для нацеливания на MDSC/TAM, когда размер опухоли достигал 50 мм3. Опухоль удаляли, когда размер достигал 150-200 мм3. В общей сложности обработку продолжали 2 недели (7 суток в неделю). Контролировали выживаемость мышей. Можно сделать заключение, что после элиминации иммуносупрессорной функции MDSC/TAM выживаемость животных достоверно увеличивалась. Это исследование также было направлено на мониторинг выживаемости животных и уровня цитокинов сыворотки крови. Результаты показаны на фиг. 36 и фиг. 37.
Химические примеры
Пример 1: синтез агониста TLR7 (TLR7A)
Агонист TLR7 (TLR7A) синтезировали, следуя процедуре, показанной на схеме реакций 1, как описано Nikunj M. Shukla, Cole A. Mutz, Subbalakshmi S. Malladi, Hemamali J. Warshakoon, Rajalakshmi Balakrishna, and Sunil A. David, «Regioisomerism-dependent TLR7 agonism and antagonism in an imidazoquinoline; Structure-Activity Relationships in Human Toll-Like Receptor 7-Active Imidazoquinoline Analogues», J. Med. Chem., 2012 Feb 9; 55(3): 1106-1116.
Схема реакций 1
Стадия 1: синтез 1-амино-2-метилпропан-2-ола (соединение 1')
2,2-диметилоксиран (0,1 г, 1,388 ммоль) по каплям добавляли к 20 мл охлажденного на льду раствора гидроксида аммония. Реакционную смесь перемешивали в течение 12 ч при комнатной температуре. Растворитель удаляли в вакууме, и остаток растворяли в метаноле. К реакционной смеси добавляли ди-трет-бутилдикарбонат (0,75 г, 3,47 ммоль) и перемешивали в течение 4 ч. Смесь очищали с использованием колоночной хроматографии (смесь 24% EtOAc/гексан) с получением трет-бутил-2-гидрокси-2-метилпропилкарбамата. Чистый трет-бутил-2-гидрокси-2-метилпропилкарбамат растворяли в 5 мл трифторуксусной кислоты и перемешивали в течение 35 мин. Растворитель удаляли при пониженном давлении с полуением 1-амино-2-метилпропан-2-ола в виде трифторацетата соединения 1'. 1H ЯМР 500 МГц (500 МГц, CDCl3, δ в ppm): δ 8,62 (с, 2H), 3,02 (д, 2H), 2,06-2,04 (м, 2H), 1,37-1,34 (с, 6H).
Стадия 2: синтез 2-метил-1-(3-нитрохинолин-4-иламино) пропан-2-ола (соединение 2)
Трифторацетатную соль 1-амино-2-метилпропан-2-ола (соединение 1') (450 мг, 2,4 ммоль) добавляли к раствору 4-хлор-3-нитрохинолина (соединение 1) (250 мг, 1,2 ммоль) и Et3N (0,5 мл, 3 ммоль) в смеси 4:1 толуола и 2-пропанола. Смесь нагревали до 70°С в течение получаса, пока не началось осаждение твердого вещества. Затем реакционную смесь охлаждали, фильтровали, промывали смесью толуол/2-пропанол (7:3), диэтиловым эфиром и холодной водой. Остаток высушивали при 80°С с получением 2-метил-1-(3-нитрохинолин-4-иламино)пропан-2-ола (соединение 2). ЖХМС: [M+H]+ m/z=261.
Стадия 3: синтез 1-(3-аминохинолин-4-иламино)-2-метилпропан-2-ола (соединение 3)
2-Метил-1-(3-нитрохинолин-4-иламино)пропан-2-ол (соединение 2) (450 мг, 1,72 ммоль) растворяли в метаноле и гидрировали над Pd/C, который использовали в качестве катализатора, с использованием баллонного водорода в течение 4 ч. Затем раствор фильтровали с использованием целита с последующим выпариванием растворителя при пониженном давлении с получением 1-(3-аминохинолин-4-иламино)-2-этилпропан-2-ола (соединение 3). ЖХМС: [M+H]+ m/z=231. 1H ЯМР 500 МГц (CDCl3, δ в ppm): δ 8,12 (с, 1H), 7,61-7,58 (м, 1H), 7,48-7,40 (м, 2H), 4,90 (с, 2H), 3,47 (2H), 1,35-1,21 (с, 6H).
Стадия 4: синтез 1-(4-амино-2-бутил-1Н-имидазо[4,5-с] хинолин-1-ил)-2-метилпропан-2-ола (соединение 5, TLR7A)
К раствору соединения 3 (100 мг, 0,43 ммоль) в безводном ТГФ добавляли триэтиламин (66 мг, 0,65 ммоль) и валерилхлорид (62 мг, 0,52 ммоль). Затем реакционную смесь перемешивали в течение 6-8 ч с последующим удалением растворителя в вакууме. Остаток растворяли в EtOAc, промывали водой и насыщенным раствором соли и затем высушивали над Na2SO4 с получением промежуточного амидного производного. Это соединение растворяли в МеОН с последующим добавлением оксида кальция и нагревали в микроволновом реакторе при 110°С в течение 1 ч. Затем растворитель удаляли и остаток очищали с использованием колоночной хроматографии (смесь 9% МеОН/дихлорметан) с получением соединения 4 (58 мг). К раствору соединения 4 в смеси растворителей MeOH:дихлорметан:хлороформ (0,1:1:1) добавляли 3-хлорпероксибензойную кислоту (84 мг, 0,49 ммоль) и раствор нагревали с обратным холодильником при 45-50°C в течение 40 мин. Затем растворитель удаляли и остаток очищали с использованием колоночной хроматографии (смесь 20% МеОН/дихлорметан) с получением оксидного производного (55 мг). Затем его растворяли в безводном дихлорметане с последующим добавлением бензоилизоцианата (39 мг, 0,26 ммоль) и нагревали при 45°С в течение 15 мин. Затем растворитель удаляли в вакууме и остаток растворяли в безводном МеОН с последующим добавлением избытка метоксида натрия. Затем реакционную смесь нагревали при 80°С в течение 1 ч. Растворитель удаляли в вакууме, и остаток очищали с использованием колоночной хроматографии (смесь 11% МеОН/дихлорметан) с получением соединения 5. ЖХ-МС: [M+H]+ m/z=312. 1H ЯМР 500 МГц (CDCl3, δ в ppm): δ 8,16-8,15 (д, 1H), 7,77-7,46 (д, 1H), 7,46-7,43 (м, 1H), 7,33-7,26 (м, 1H), 3,00 -2,97 (м, 2Н), 1,84-1,78 (м, 2Н), 1,47-1,41 (м, 2Н), 1,36 (с, 6Н), 0,98-0,95 (м, 3Н).
Пример 2: синтез гетеробифункционального дисульфидного линкера (соединение 7)
Гетеробифункциональный дисульфидный линкер (соединение 7) синтезировали, как показано на схеме реакций 2, следуя процедуре, описанной Satyam A., «Design and synthesis of releasable folate-drug conjugates using a novel heterobifunctional disulfide-containing linker», Bioorg. Med. Chem. Lett., 2008 Jun. 1;18(11):3196-9.
Схема реакций 2
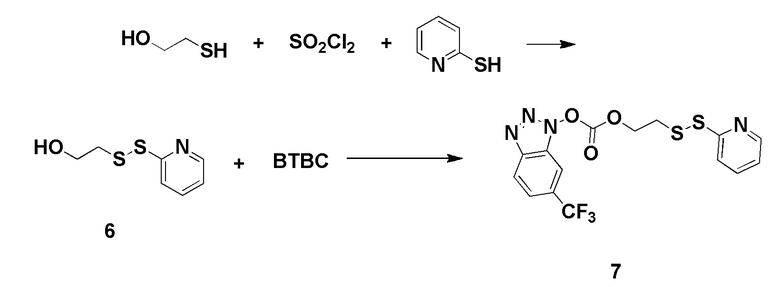
Стадия 1: Синтез гетеробифункционального дисульфидного линкера (соединение 7)
Сульфурилхлорид (25 мл 1 М раствора в метиленхлориде) добавляли в течение 20 мин к перемешиваемому раствору 2-меркапропиридина (2,5 г, 22,5 ммоль) в 25 мл сухого метиленхлорида при 0-5°С в атмосфере азота. Желтое твердое вещество выпадало в осадок. Смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали на роторном испарителе, и полученное таким образом гранулированное твердое вещество растворяли в 50 мл сухого метиленхлорида и охлаждали на ледяной бане. К этой перемешиваемой суспензии при 0-5°С в атмосфере азота добавляли раствор 2-меркаптоэтанола (1,7 мл, 24,2 ммоль) в 30 мл сухого метиленхлорида в течение 5 мин. Вначале суспензия растворяется с образованием прозрачного раствора. Однако через 15-20 мин светло-желтое гранулированное твердое вещество начинало отделяться. Смесь перемешивали при комнатной температуре в течение ночи. Осадок отфильтровывали, промывали метиленхлоридом для ВЭЖХ и высушивали в вакуум-эксикаторе в течение нескольких часов. Свободное основание соединения (соединение 6) можно получить смешиванием суспензии его гидрохлорида в метиленхлориде с количеством диметиламинопиридина, немного превышающим эквимолярное, и пропусканием смеси через короткую колонку с силикагелем, используя 5% метанол в метиленхлориде в качестве элюента. Раствор соединения 6 (свободное основание, 1 г, 5,4 ммоль) в 10 мл ацетонитрила добавляли в течение 2 мин к перемешиваемому раствору BTBC (2,5 г, 5,7 ммоль) в 50 мл ацетонитрила при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 38 ч. Смесь концентрировали в вакууме и остаток распределяли между этилацетатом (50 мл) и 1 Н раствором NaHCO3 (25 мл). Органический слой отделяли, дополнительно промывали 1 Н раствором NaHCO3 (10 мл), высушивали (безводный Na2SO4), фильтровали и концентрировали в вакууме с получением соединения 7. ЖХМС: [M+H]+ m/z=416. 1H ЯМР 500 МГц (CDCl3, δ в ppm): δ 8,38-8,32 (м, 3H), 8,09-8,07 (м, 1H), 7,77-7,75 (м, 1H), 7,70-7,69 (м, 1H), 7,14 -7,13 (м, 1H), 4,81-4,78 (м, 2H), 3,33-3,31 (м, 2H).
Пример 3: синтез BTBC (соединение 8)
BTBC синтезировали, как показано на схеме реакций 3, следуя процедуре, описанной Takeda, K.; Tsuboyama, K.; Hoshino, M.; Kishino, M.; Ogura, H. 'A Synthesis of a New Type of Alkoxycarbonylating Reagents from 1,1-Bis[6-(trifluoromethyl)benzotriazolyl] Carbonate (BTBC) and Their Reactions', Synthesis, 1987, 557-560.
Схема реакций 3
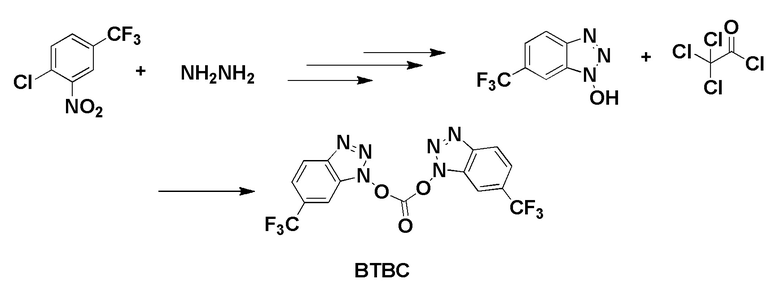
Смесь 4-хлор-3-нитро-а,а,а-трифтортолуола (2,5 г, 0,011 моль) и гидразина гидрата (1,65 г, 0,033 моль) в 99% этаноле (20 мл) кипятили с обратным холодильником в течение 24 ч. После удаления растворителя при пониженном давлении остаток растворяли в 10% водном растворе Na2CO3. Раствор промывали диэтиловым эфиром для удаления исходного соединения и подкисляли концентрированной HCl для осаждения продукта, который промывали водой и высушивали с получением 1-гидрокси-6-(трифторметил)бензотриазола. К перемешиваемому раствору 1-гидрокси-6-(трифторметил) бензотриазола (1 г, 5 ммоль) в сухом диэтиловом эфире (50 мл) добавляли трихлорметилхлорформиат (0,26 г, 1,23 ммоль) при комнатной температуре. Через 10 мин к смеси добавляли дополнительное количество трихлорметилхлорформиата (0,26 г, 1,23 ммоль), осторожно кипятили с обратным холодильником в течение 1 ч и образовавшийся осадок собирали и промывали сухим диэтиловым эфиром. Получали почти чистые кристаллы BTBC. ЖХМС: [M+H]+ m/z=432.
Пример 4: синтез фолиевой кислоты-цистеина (соединение 9) твердофазным синтезом
H-Cys(Trt)-2-хлортритиловую смолу (100 мг) диспергировали в 12 мл дихлорметана и барботировали аргоном в течение 10 мин. После удаления дихлорметана добавляли 10 мл ДМФА и барботировали в течение 5 мин. 5 мл 20% раствора пиперидина в ДМФА добавляли три раза по 10 мин каждый раз. Смолу промывали 3 раза по 10 мл ДМФА в течение 5 мин каждый раз. 10 мл изопропанола добавляли для промывания смолы 3 раза по 5 мин каждый раз. После высушивания на воздухе в течение нескольких минут свободный амин анализировали с помощью набора для мониторинга твердофазного синтеза с голубыми шариками, указывающими на полное снятие защиты амина. Fmoc-Glu-OtBu (64 мг, 0,15 моль), DIPEA (0,105 мл, 0,6 моль), PyBOP (79 мг, 0,15 моль), растворенные в ДМФА, добавляли к шарикам в растворе ДМФА. После реакции в течение 5-6 ч проводили повторное промывание 3 раза смесью ДМФА/IPA. Снятие защиты с амина проводили добавлением 5 мл 20% раствора пиперидин в ДМФА 3 раза. После промывания 3 раза ДМФА к шарикам добавляли 2 мл раствора ДМФА с N10-(трифторацетил)птероевой кислотой (62 мг, 0,15 моль), DIPEA (0,105 мл, 0,6 моль), PyBOP (79 мг, 0,15 моль) в растворе ДМФА. Реакцию продолжали в атмосфере аргона в течение 5-6 ч. 8 мл смешанного раствора ТФК/этандитиол/тиизопроилсилан/ H2O в объемном соотношении 96,25/1,25/1,25/1,25 добавляли 3 раза в течение 30 мин каждый раз для отщепления соединения от смолы. Трифторацетил-защищенное соединение 8 очищали с помощью ВЭЖХ. Соединение 8 получали после снятия защиты трифторацетильной группы раствором аммония (5 мл, 0,5 М) в течение 2 ч при комнатной температуре. ЖХМС: [M+H]+ m/z=544.
Схема реакций 4
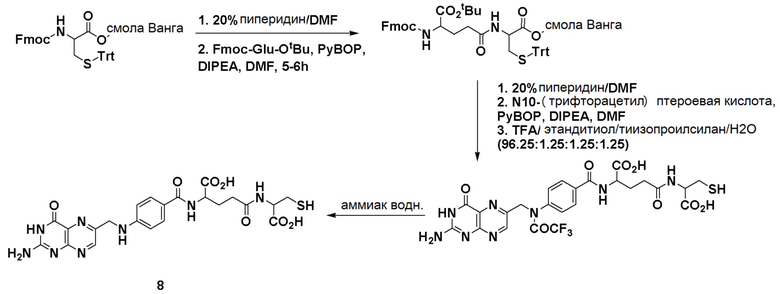
Пример 5: синтез конъюгатов фолиевой кислоты с агонистом TLR7 (TLR7A)
Конъюгат фолиевой кислоты с агонистом TLR7 (TLR7A) синтезировали, как показано на схеме реакций 5.
Схема реакций 5
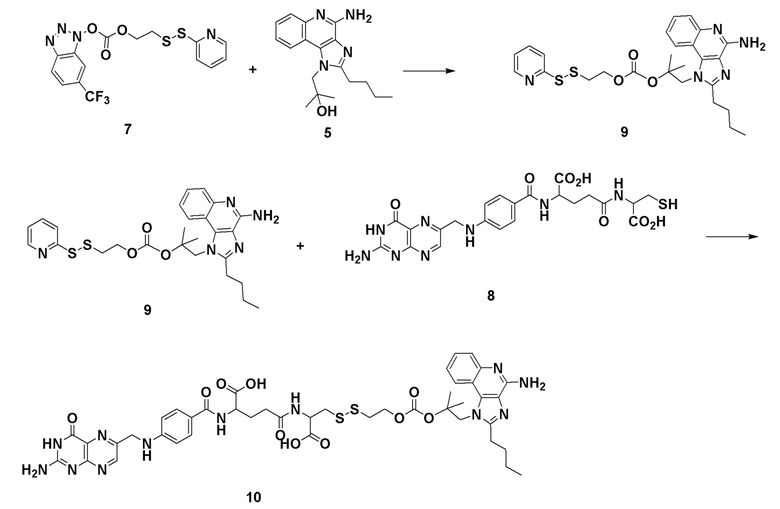
Гетеробифункциональный линкер 7 (88 мг, 0,213 ммоль) добавляли к раствору соединения 5 (33 мг, 0,106 ммоль) и диметиламинопиридина (39 мг, 0,319 ммоль) в 4 мл метиленхлорида при комнатной температуре в атмосфере азота и смесь перемешивали при температуре кипения с обратным холодильником в течение 7 ч, после чего анализ смеси ТСХ указывал на > 80% превращение. Смесь концентрировали и очищали колоночной хроматографией, используя 10% ацетонитрил в метиленхлориде в качестве элюента. Продукт чистое соединение 9 получали в виде светло-желтого твердого вещества. Раствор соединения 8 (1 экв) в ДМСО добавляли 3 порциями с 20-мин интервалами к раствору промежуточного соединения 9 лекарственное средство-линкер (1,0-1,5 экв) в ДМСО с диметиламинопиридином (1 экв). После перемешивания в течение 1-2 ч при комнатной температуре в атмосфере аргона анализ смеси ЖХМС показывал образование желаемого конъюгата фолат-лекарственное средство (соединение 10) в качестве основного продукта. Смесь очищали препаративной ВЭЖХ. ЖХМС: [M+H]+ m/z=959.
Пример 6: синтез FA-ингибитора PI3K (соединение 12)
Конъюгат фолиевой кислоты с ингибитором PI3K (GDC-0980) синтезировали, как показано на схеме 6.
Схема реакций 6
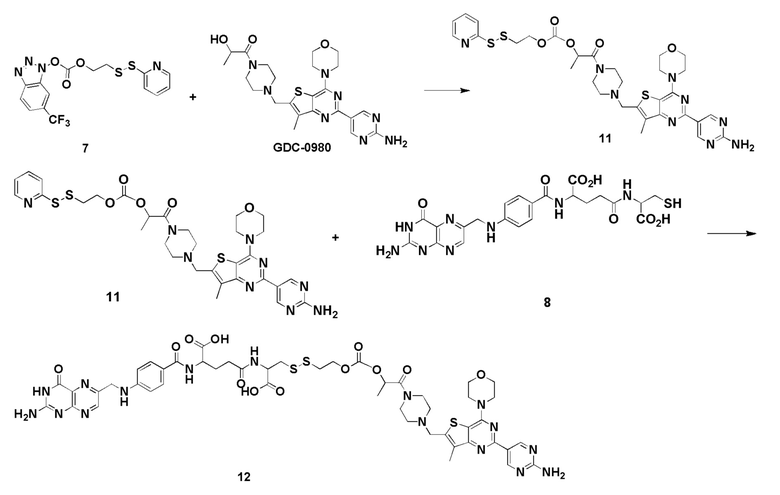
Гетеробифункциональный линкер 7 (50 мг, 0,12 ммоль) добавляли к раствору GDC-0980 (5 мг, 0,01 ммоль) и диметиламинопиридина (5 мг, 0,03 ммоль) в 4 мл метиленхлорида при комнатной температуре в атмосфере азота и смесь перемешивали при температуре кипения с обратным холодильником в течение 7 ч, после чего анализ смеси ТСХ указывал на > 80% превращение. Смесь концентрировали и очищали колоночной хроматографией, используя 10% ацетонитрил в метиленхлориде в качестве элюента. Продукт чистое соединение 9 получали в виде светло-желтого твердого вещества. Раствор соединения 8 (1 экв) В ДМСО добавляли 3 порциями с 20-мин интервалами к раствору промежуточного соединения 11 лекарственное средство-линкер (1,0-1,5 экв) в ДМСО с диметиламинопиридином (1 экв). После перемешивания в течение 1-2 ч при комнатной температуре в атмосфере аргона анализ смеси ЖХМС показывал образование желаемого соединения 12 фолат-лекарственное средство в качестве основного продукта. Смесь очищали препаративной ВЭЖХ. ЖХМС: [M+H]+ m/z=1145.
Пример 7: синтез FA-ингибитора PBD (соединение 25)
Фенольное производное (2,20 г, 12,1 ммоль) растворяли в ацетоне (высушивали пропусканием через слой Na2SO4, 48,4 мл) и к этому раствору добавляли 1,5-дибромпентан (49,4 мл, 36,3 ммоль) и K2CO3 (6,69 г, 48,4 ммоль). Реакционную смесь кипятили с обратным холодильником в атмосфере аргона в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Фильтрат концентрировали и очищали с использованием CombiFlash в смеси 0-30% EtOAc/p-эфир с получением соединения 13 (3,3893 г, выход 84,5%) в виде твердого вещества. ЖХМС: [M+H]+ m/z=331. 1H ЯМР (CDCl3, δ в ppm): 7,65 (дд, J=8,5, 2,0 Гц, 1H), 7,54 (д, J=2,0 Гц, 1H), 6,86 (д, J=8,50 Гц, 1H), 4,08 (т, J=6,50 Гц, 2H), 3,91 (с, 3H), 3,89 (с, 3H), 3,44 (т, J=6,5 Гц, 2H), 1,95 (м, 4H), 1,65 (м, 2H).
Соединение 13 (3,3893 г, 10,23 ммоль) в Ac2O (52 мл) охлаждали до 0°C и обрабатывали Cu(NO3)⋅3H2O (2,967 г, 12,28 ммоль) при медленном добавлении. Реакционную смесь перемешивали при 0°С в течение 1 ч, затем при комнатной температуре в течение 2 ч. После завершения реакции реакционную смесь выливали в ледяную воду и перемешивали в течение 1 ч. Полученный осадок собирали фильтрованием. Продукт промывали водой (3 раза) и высушивали на воздухе с получением соединения 14 (3,7097 г, выход 96%). ЖХМС: [M+H]+ m/z=376. 1H ЯМР (CDCl3, δ в ppm): 7,41 (с, 1H), 7,05 (с, 1H), 4,08 (т, J=6,50 Гц, 2H), 3,94 (с, 3H), 3,89 (с, 3H), 3,42 (т, J=7,0 Гц, 2H), 1,93 (м, 4H), 1,63 (м, 2H).
Раствор соединения 14 (37,6 мг, 0,1 ммоль) и красителя Hochest (53,3 мг, 0,1 ммоль) в ДМФА (1,5 мл) в атмосфере Ar обрабатывали K2CO3 при комнатной температуре. Реакционную смесь нагревали до 60°С и выдерживали в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Остаток очищали препаративной ВЭЖХ (подвижная фаза A: 50 мМ буфер на основе NH4HCO3, pH 7,0; B=ACN. Метод: 10-100 B% в течение 30 мин с получением соединения 15 (13,1 мг, выход 18%). ЖХМС: [M+H]+ m/z=720,71.
Соединение 15 (13,1 мг, 0,0182 ммоль) растворяли в смеси ТГФ/MeOH/H2O (3/1/1, 0,2 мл) и обрабатывали водным раствором LiOH (1 М раствор, 36 мкл) в течение 4 ч при комнатной температуре в атмосфере аргона. Большую часть растворителя удаляли в вакууме и водную фазу подкисляли концентрированной HCl до рН 2-3, осадок собирали в виде твердого вещества (соединение 16, 12,8 мг, без очистки) фильтрованием. Фильтрат промывали водой (3×) и высушивали на воздухе для использования на следующей стадии. ЖХМС: [M+H]+ m/z=706.
Соединение 16 (15,7 мг, 0,022 ммоль) в МеОН (10 мл) подвергали гидрированию в смесительной колбе Парра (10% влажный Pd/C, 5 мас.%, 7,85 мг, H2 41 psi) в течение 2 ч. Продукт выделяли фильтрованием через слой целита. Растворитель удаляли в вакууме с получением неочищенного соединения 17, ЖХМС: [M+H]+ m/z=676,79.
К раствору Val-Ala-OH (1 г, 5,31 мМ) в воде (40 мл) добавляли Na2CO3 (1,42 г, 13,28 мМ) и охлаждали до 0°C перед добавлением диоксана (40 мл). Раствор Fmoc-Cl (1,44 г, 5,58 мМ) в диоксане (40 мл) добавляли по каплям в течение 10 мин при 0°C. Реакционную смесь перемешивали при 0°C в течение 2 ч, затем перемешивали при комнатной температуре в течение 16 ч. Диоксан удаляли в вакууме, реакционную смесь разбавляли водой (450 мл), рН доводили до 2, используя 1 Н HCl, и экстрагировали EtOAc (3 × 250 мл). Объединенные органические слои промывали насыщенным раствором соли, высушивали над MgSO4, фильтровали, концентрировали при пониженном давлении и высушивали с получением Fmoc-Val-Ala-OH. Данный продукт суспендировали в сухом DCM (25 мл), добавляли PABA (0,785 г, 6,38 мМ) и EEDQ (1,971 г, 7,97 мМ). Полученную смесь обрабатывали в атмосфере аргона метанолом до получения прозрачного раствора. Реакционную смесь перемешивали в течение ночи и фильтровали. Фильтрат промывали диэтиловым эфиром (4×) и высушивали в высоком вакууме с получением соединения 18 (1,85 г, 68%). 1H ЯМР (500 МГц, CD3OD): δ 7,79 (д, J1=8,0 Гц, 2H), 7,65 (т, J1=7,0 Гц, J2=7,5 Гц, 2H), 7,54 (д, J1=8,0 Гц, 2H) 7,38 (т, J1=7,5 Гц, J2=7,5 Гц, 2H), 7,33-7,24 (м, 4H), 4,54 (с, 2H), 4,48 (кв, J1=14,0 Гц, J2=7,0 Гц, 1H) 4,42-4,32 (м, 2H), 4,22 (т, J1=7,0 Гц, J2=6,5 Гц, 1H), 3,94 (д, J1=7,0 Гц, 1H), 2,07 (м, 1H), 1,43 (д, J1=7,5 Гц, 3H), 0,97 (д, J1=7,0 Гц, 3H), 0,95 (д, J1=7,0 Гц, 3H); ЖХМС (ESI): (М+Н)+=рассчитано для C30H33N3O5, 516,24; найдено 516,24.
Соединение 19. (S)-1-трет-Бутил-2-метил 4-оксопирролидин-1,2-дикарбоксилат превращали в соединение 19 реакцией Виттига. Ph3PCH3Br (917,8 мг, 2,57 ммоль) в ТГФ (30 мл) обрабатывали KOtBu (1 М раствор в ТГФ, 2,57 мкл, 2,57 ммоль) при 0°С добавлением по каплям. Реакционную смесь выдерживали при комнатной температуре в течение 2 ч. В перемешиваемый раствор добавляли кетон (250 мг, 1,028 ммоль) в 20 мл ТГФ) при 0-10°С. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили смесью вода/EtOAc (1:1, 40 мл) и большую часть ТГФ удаляли при пониженном давлении. Водную фазу экстрагировали EtOAc (20 мл, 3×) и органическую фазу последовательно промывали H2O и насыщенным раствором соли, высушивали над безводным Na2SO4 и концентрировали. Остаток очищали с использованием CombiFlash в смеси 0-50% EtOAc/петролейный эфир с получением соединения 19 (77,2 мг, 31%). ЖХМС: [M-Boc+H]+ m/z=142.
Соединение 20. (S)-1-трет-Бутил-2-метил 4-метиленпирролидин-1,2-дикарбоксилат (353,2 мг, 1,46 ммоль) в смеси DCM/толуол (1:3, 9,8 мл) обрабатывали DIBAL (1 М раствор в толуоле, 2 экв, 2,92 ммоль) по каплям при -78°C в атмосфере аргона. Реакционную смесь перемешивали при -78°С в течение примерно 4 ч. Затем реакцию гасили добавлением 60 мкл МеОН при -78°С, и затем 5% HCl (0,5 мл) и EtOAc (18 мл). Охлаждающую баню убирали и реакционную смесь перемешивали в течение 30 мин. EtOAc-слой отделяли и промывали насыщенным раствором соли, высушивали над безводным Na2SO4 и концентрировали с получением соединения 20.
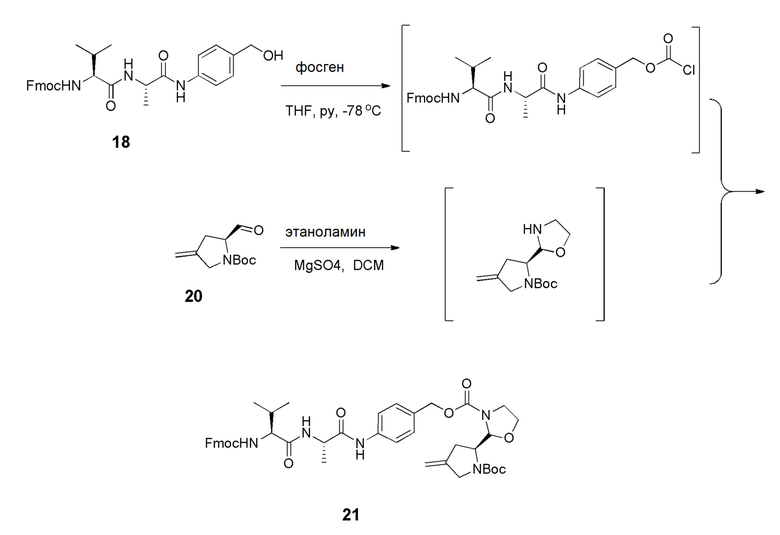
Соединение 20 (550 мг, 2,6 ммоль) растворяли в DCM (10 мл) и добавляли MgSO4 (3 г) с последующим добавлением по каплям этаноламина (0,16 мл, 2,6 ммоль) в DCM (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Фильтрование и концентрирование в вакууме давали промежуточное оксазолиновое производное. В другой колбе соединение 18 (516 мг, 1,0 ммоль) растворяли в ТГФ (40 мл) и добавляли пиридин (0,8 мл, 10 ммоль). Раствор охлаждали до -78°C и добавляли дифосген (0,16 мл, 1,5 ммоль). Реакционную смесь перемешивали при -78°С в течение 1 ч, по каплям добавляли DCM (20 мл) и раствор промежуточного оксазолидинового производного. Реакционной смеси давали нагреться до -20°C в течение нескольких часов. Результаты ЖХ-МС и ТСХ показывали образование продукта. Реакционную смесь концентрировали с использованием силикагеля и очищали флэш-хроматографией (колонка gold Redisep 120, смесь 0-100% EtOAc в петролейном эфире) с получением соединения 21 (0,59 г, 74%). ЖХМС (ESI): (М+Н)+=рассчитано для C44H53N5O9, 796,38; найдено 796,74.
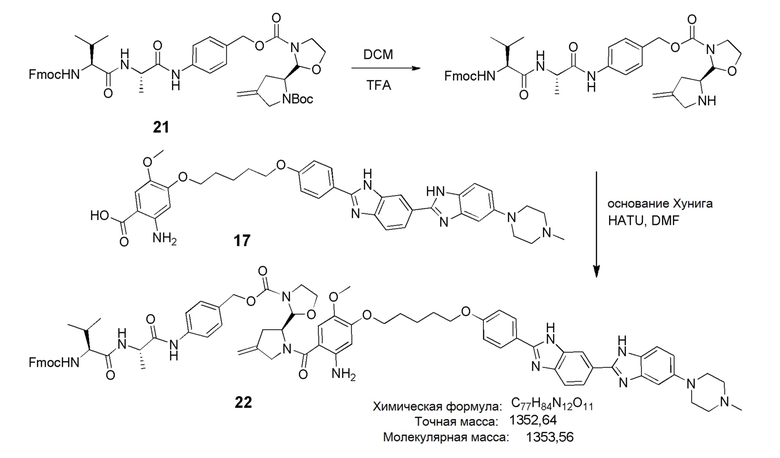
Соединение 21 (101,0 мг, 0,127 ммоль) перемешивали в смеси ТФК/DCM (по 0,5 мл каждого) при комнатной температуре в течение 30 мин. Результаты ЖХ-МС показывали полное удаление Boc-группы. Реакционную смесь концентрировали в высоком вакууме для удаления ТФК и DCM, повторно растворяли в ДМФА (1,0 мл) и доводили pH до 8-9 добавлением основания Хунига (0,3 мл). Добавляли соединение 17 (86,0 мг, 0,127 ммоль) с последующим добавлением PyBoP (84 мг, 0,16 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Результаты ЖХ-МС на 90 мин показывали, что основной пик имел желаемый продукт. Реакционную смесь загружали на картридж с силикагелем и очищали флэш-хроматографией (12 г gold, смесь 0-30% MeOH/DCM) с получением требуемого продукта, соединение 22 (140 мг, 81%). ЖХМС (ESI): (М+Н)+=рассчитано для C77H84N12O11, 1353,64; найдено 1354,18.
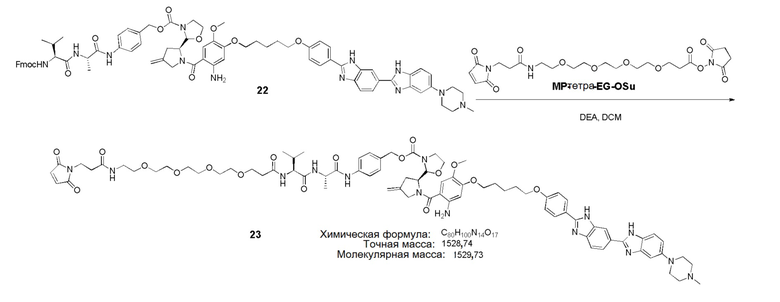
Соединение 22 (140 мг, 0,10 ммоль) растворяли в смеси DEA/ DCM (12/18 мл) и перемешивали при комнатной температуре в течение 30 мин. Результаты ЖХ-МС показывали полное удаление Fmoc-группы. Реакционную смесь концентрировали в высоком вакууме для удаления избытка диэтиламина и повторно растворяли в DCM (5 мл). Добавляли коммерчески доступный α-малеимидопропионил-ω-сукцинимидил-4(этиленгликоль) (Mal-PEG4-NHS) (62 мг, 0,12 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали, снова растворяли в ДМСО и загружали непосредственно на колонку для ВЭЖХ и очищали препаративной ВЭЖХ (колонка С18, смесь 5-80% ACN/pH7 буфер) с получением целевого продукта, соединения 23 (55,8 мг, 36%). ЖХМС: [M+2H]2+ m/z=рассчитано для C80H100N14O17, 765,37; найдено 765,74.
N10-TFA защищенное соединение 24. N10-TFA защищенное соединение 24 получали в соответствии со следующим способом.
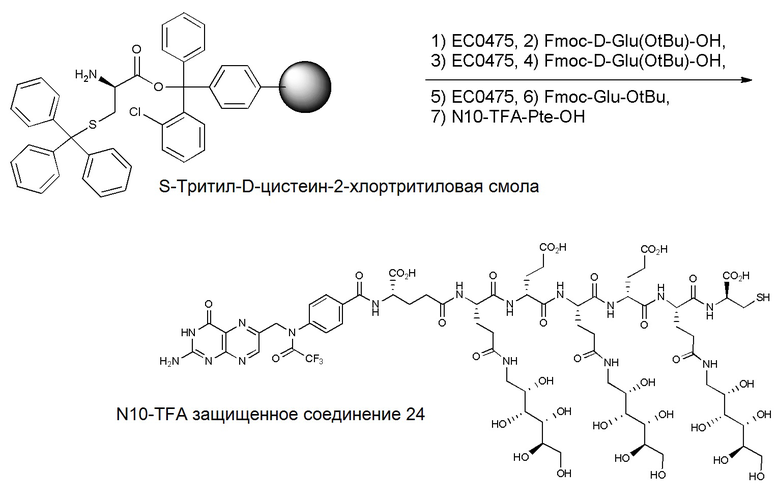
Соединение 24 получали, как описано в WO 2014/062679. Соединение 24 получали в соответствии со следующим способом.
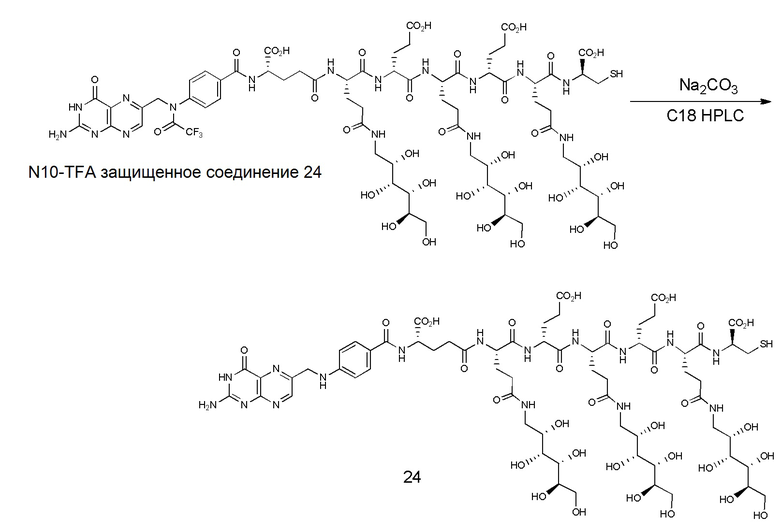 .
.
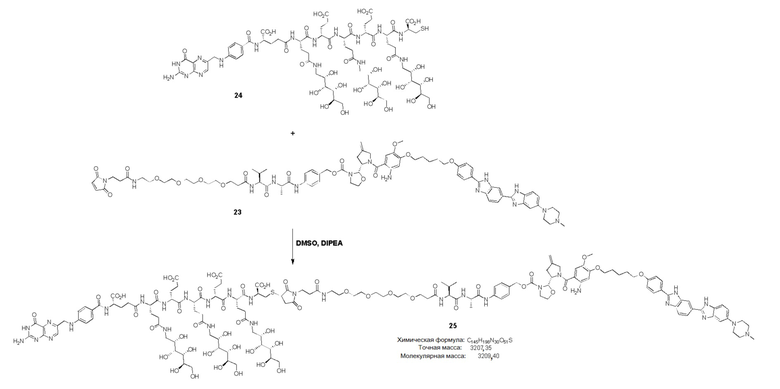
Соединение 24 (9,85 мг, 0,006 ммоль) перемешивали в ДМСО (2 мл) до растворения. Добавляли DIPEA (50 мкл) с последующим добавлением соединения 2 (6,24 мг, 0,004 ммоль) в ДМСО (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 50 мин. Анализ ЖХ-МС через 10 мин показывал полное превращение. Реакционную смесь непосредственно загружали на колонку для препаративной ВЭЖХ и очищали (смесь 10-100% MeCN/бикарбонат аммония, буфер pH 7) с получением желаемого продукта, примера 25 (5,5 мг, 42%). 1H ЯМР (500 МГц, ДМСО-D6+D2O) (выбранные данные): δ 8,60 (с, 1H), 8,44-8,08 (м*, 1H), 8,07 (д, J=8,5 Гц, 2H), 8,06-7,84 (м*, 2H), 7,80 -7,57 (м*, 2H), 7,57 (д, J=8 Гц, 2H), 7,51 (д, J=6,5 Гц, 2H), 7,44 (м*, 1H), 7,22 (м*, 2H), 7,08 (д, J=8 Гц, 2H), 6,93 (д, J=8,5 Гц, 1H), 6,60 (д, J=8,5 Гц, 2H), 6,33 (с, 1H), 4,95 (м*, 4H), 4,45 (м*, 3Н); ЖХМС: [M+4H]4+ m/z=рассчитано для C145H198N30O51S, 803,34; найдено 803,80.
Сравнительный пример 1:
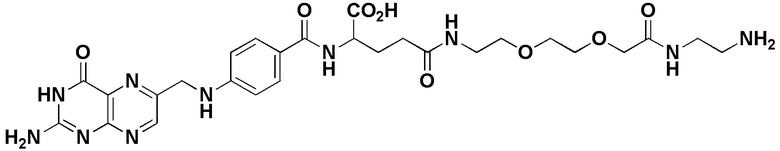
(также относится здесь к конкуренту или конкуренции).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКС АГОНИСТА ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА 7 ИЛИ 8 И ХОЛЕСТЕРИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2790702C1 |
| КОМБИНИРОВАННЫЕ СПОСОБЫ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2017 |
|
RU2747258C2 |
| КОНЪЮГАТЫ ЛИГАНДА С НЕСКОЛЬКИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ | 2006 |
|
RU2470668C2 |
| ИММУНОМОДИФИЦИРУЮЩИЕ ЧАСТИЦЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2794261C2 |
| КОНЪЮГАТЫ, СОДЕРЖАЩИЕ ГИДРОФИЛЬНЫЕ СПЕЙСЕРЫ ЛИНКЕРОВ | 2008 |
|
RU2523909C2 |
| ПОЛИЛИГАНДНЫЕ ЛЕКАРСТВЕННЫЕ КОНЪЮГАТЫ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2722449C2 |
| УМЕНЬШЕНИЕ МАССЫ ОПУХОЛИ ПУТЕМ ВВЕДЕНИЯ CCR1 АНТАГОНИСТОВ В КОМБИНАЦИИ С PD-1 ИНГИБИТОРАМИ ИЛИ PD-L1 ИНГИБИТОРАМИ | 2017 |
|
RU2745195C2 |
| БИЛИГАНДНЫЙ КОНЪЮГАТ ЛЕКАРСТВЕННОГО СРЕДСТВА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2820346C2 |
| НОВЫЕ СИНЕРГИЧЕСКИЕ ЭФФЕКТЫ | 2009 |
|
RU2471499C2 |
| МУЛЬТИДОМЕННАЯ ВЕЗИКУЛА, СОДЕРЖАЩАЯ МАТЕРИАЛ, КОНТРОЛИРУЮЩИЙ ИММУНОСУПРЕССИВНЫЙ ФАКТОР, СПОСОБ ЕЁ ПРОИЗВОДСТВА И СОДЕРЖАЩАЯ ЕЁ ИММУНОМОДУЛИРУЮЩАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2733124C1 |
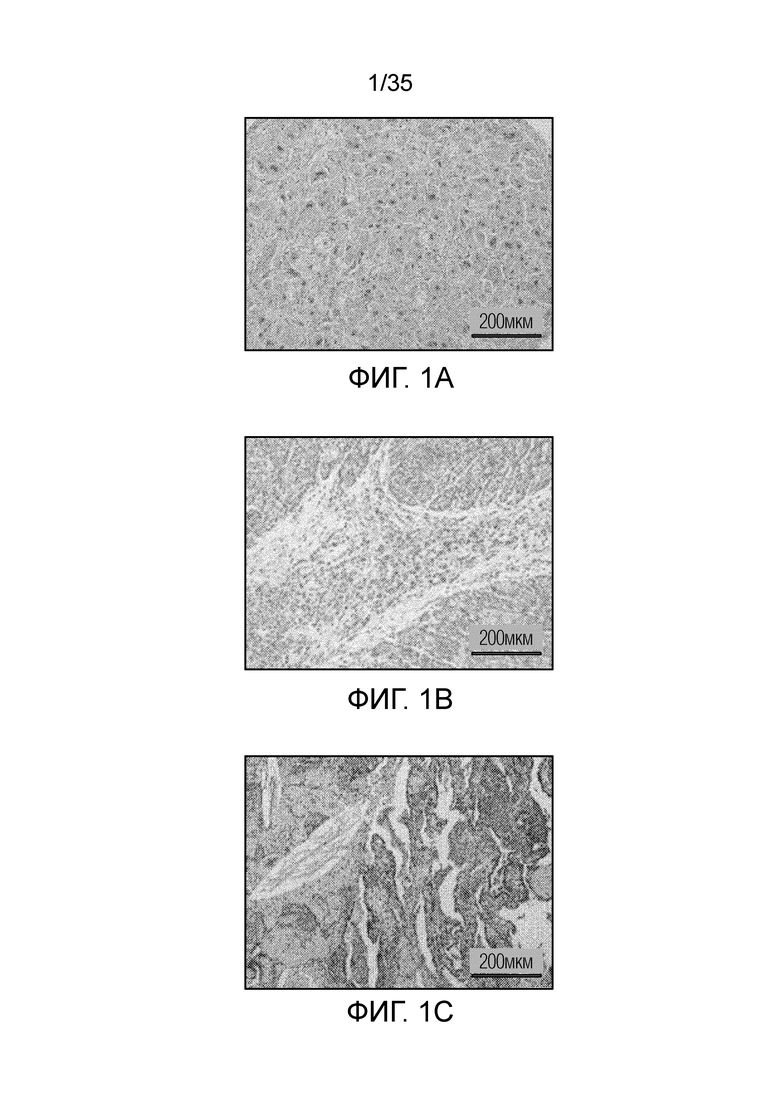
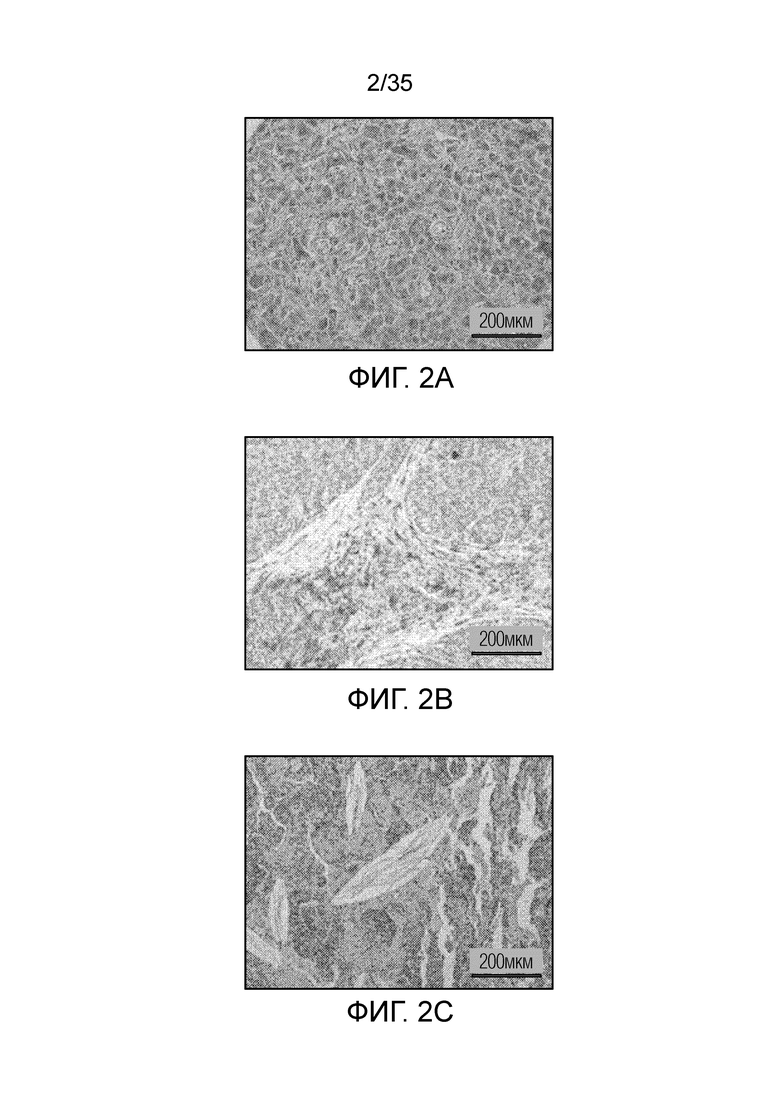

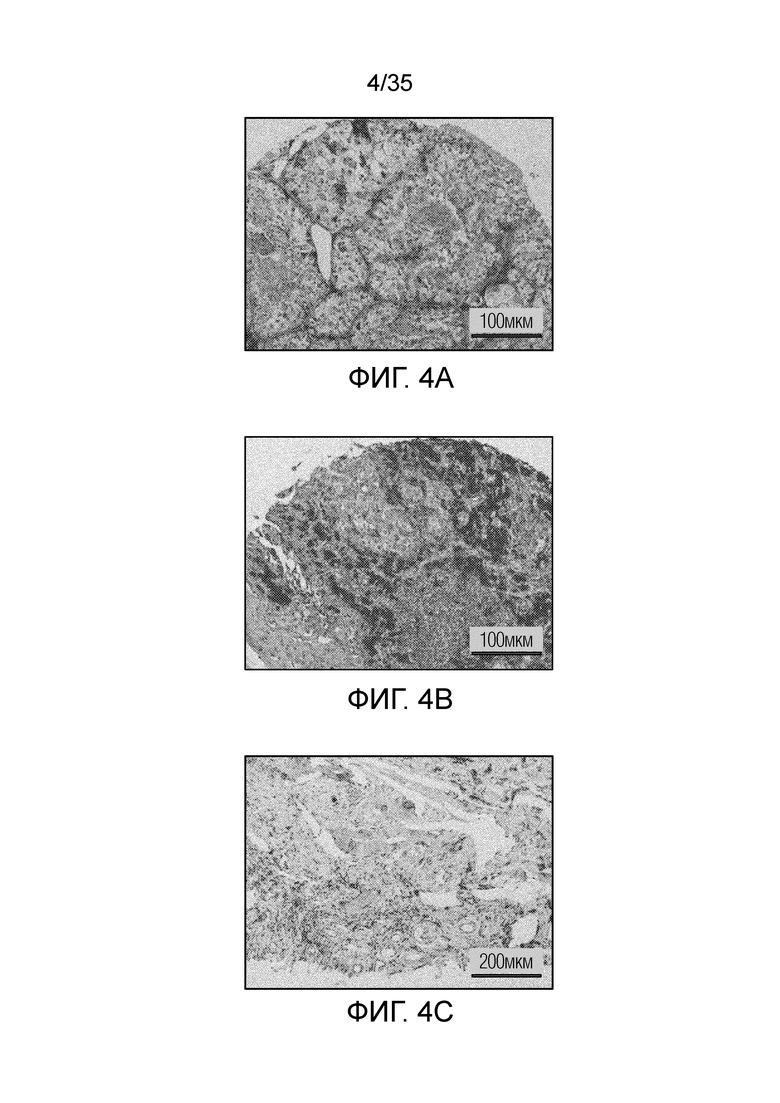
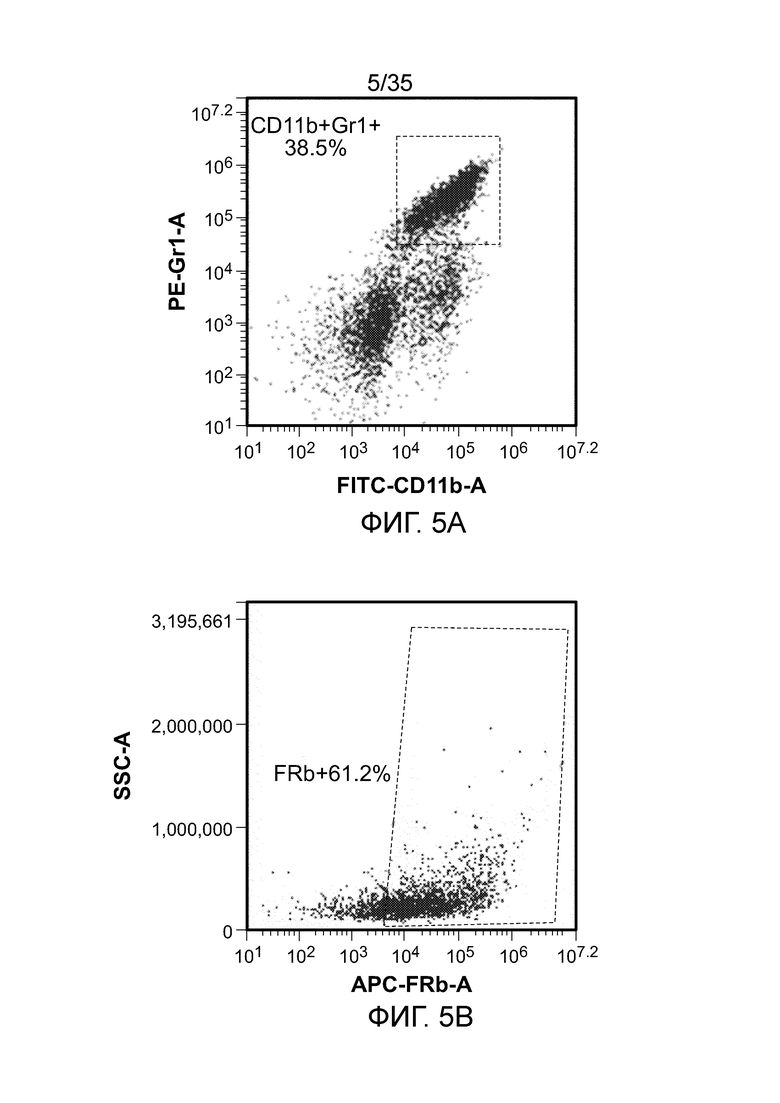
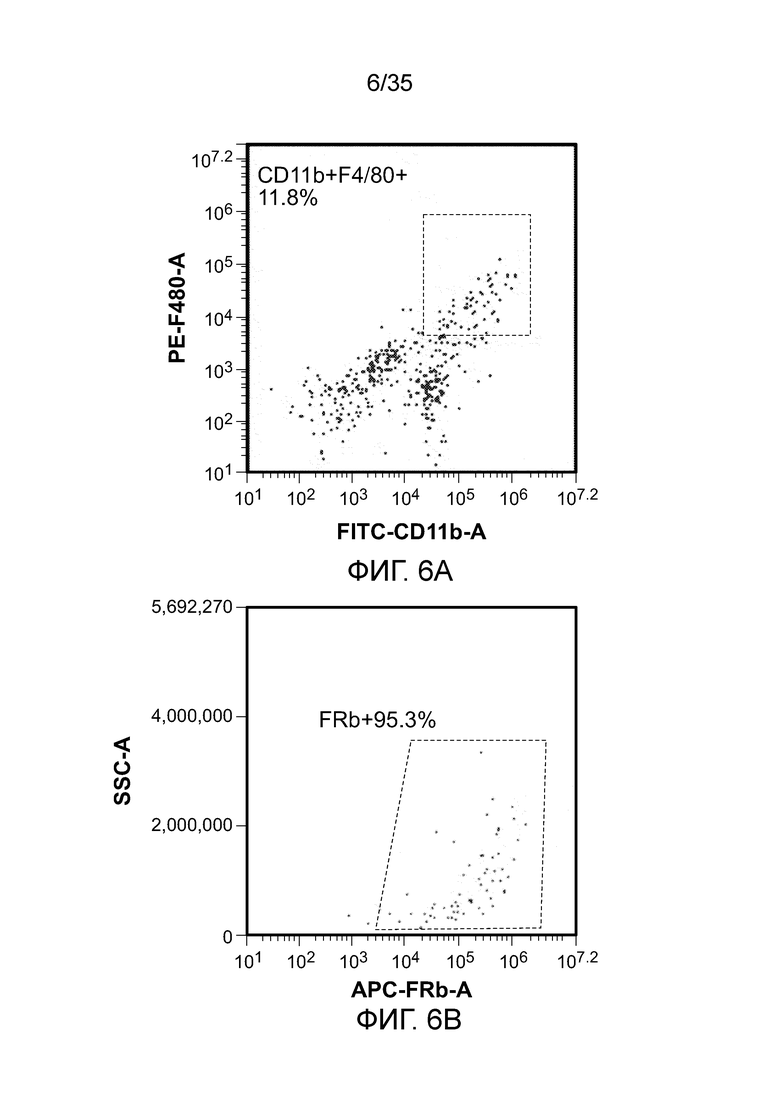
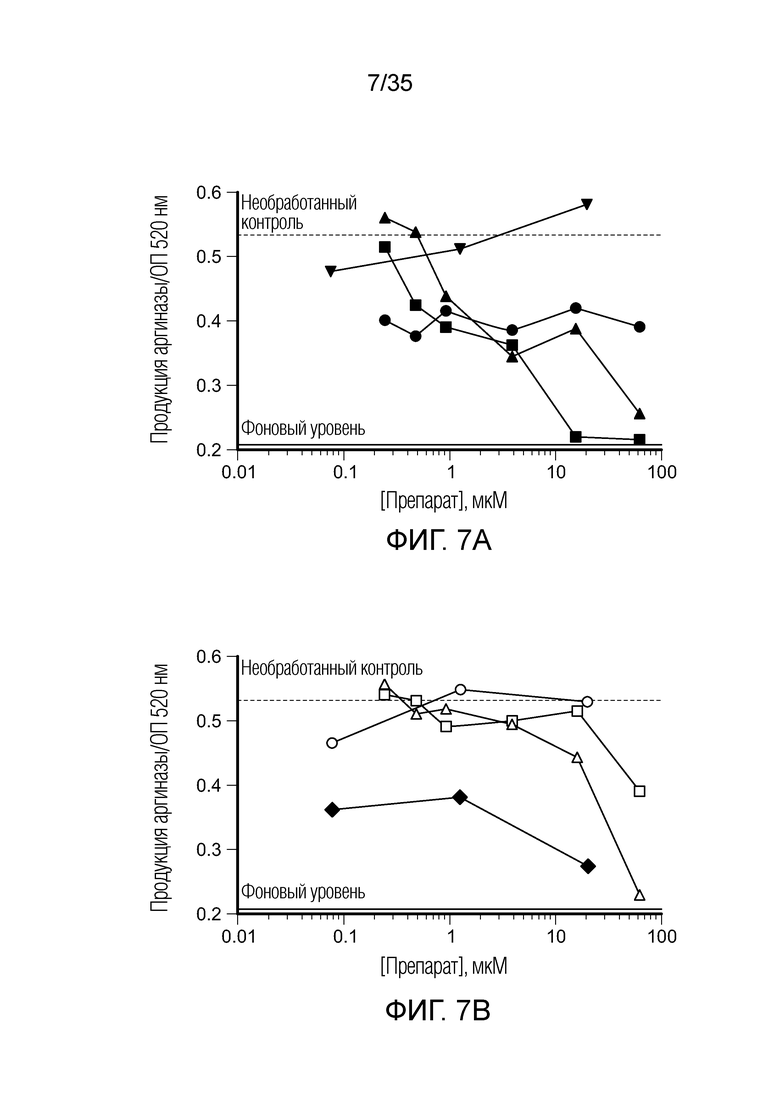
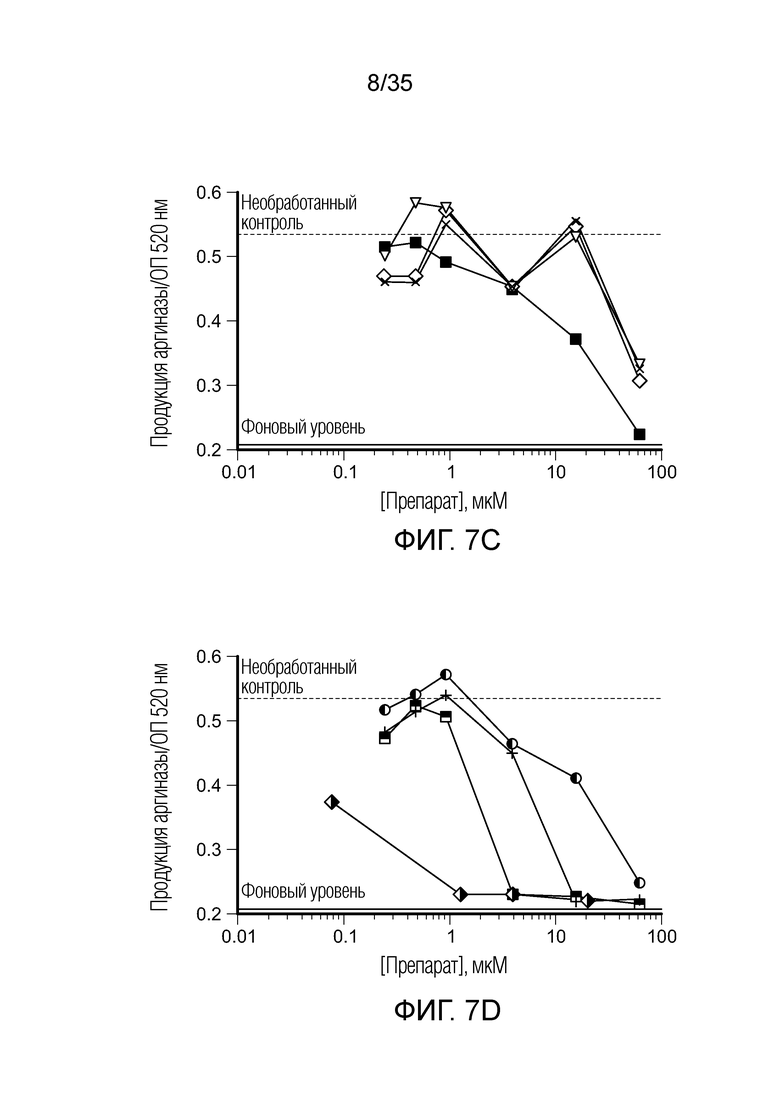
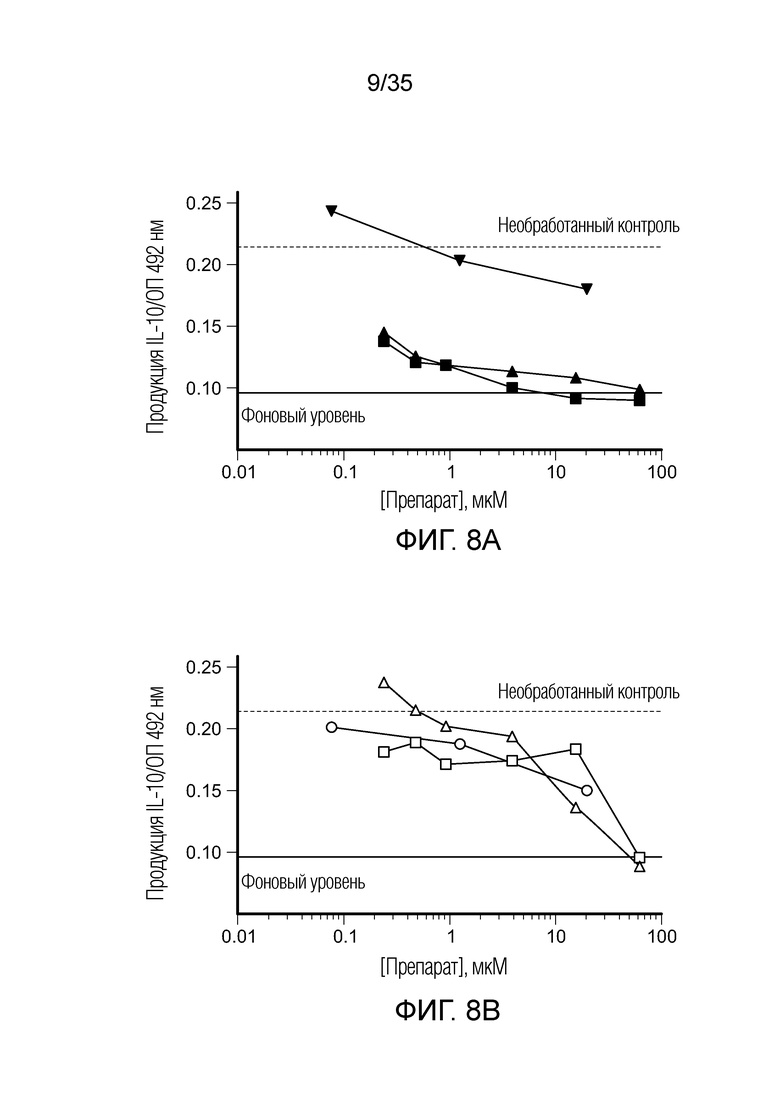
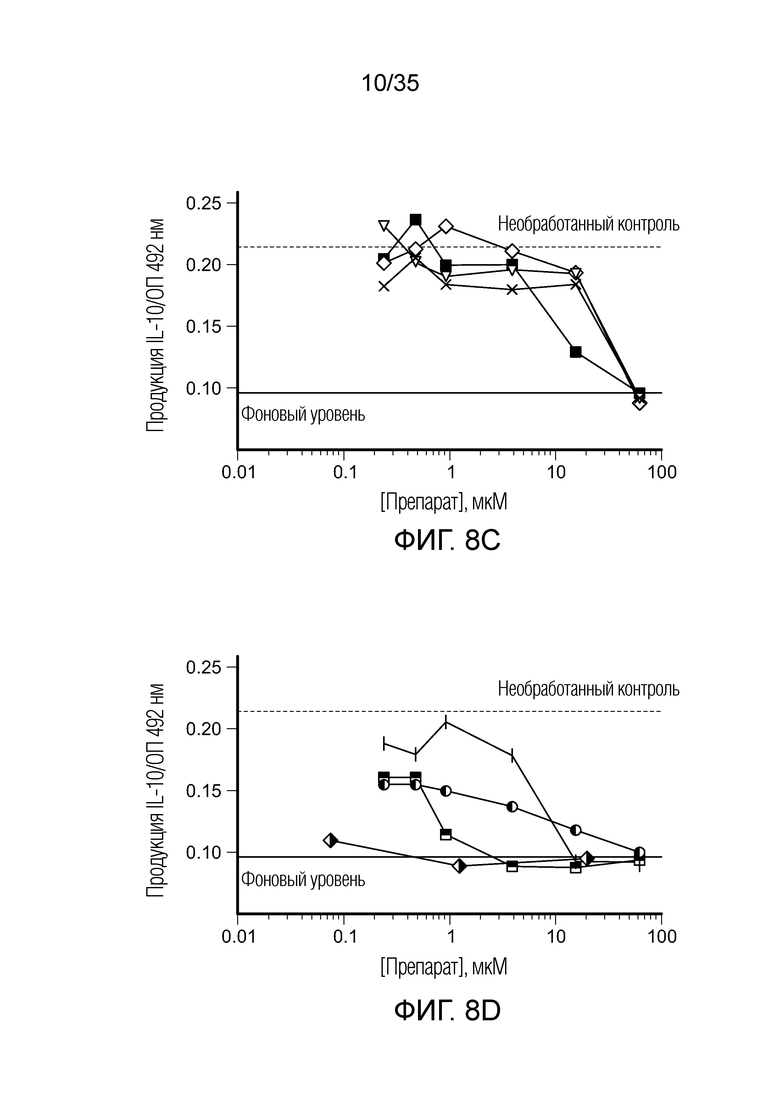
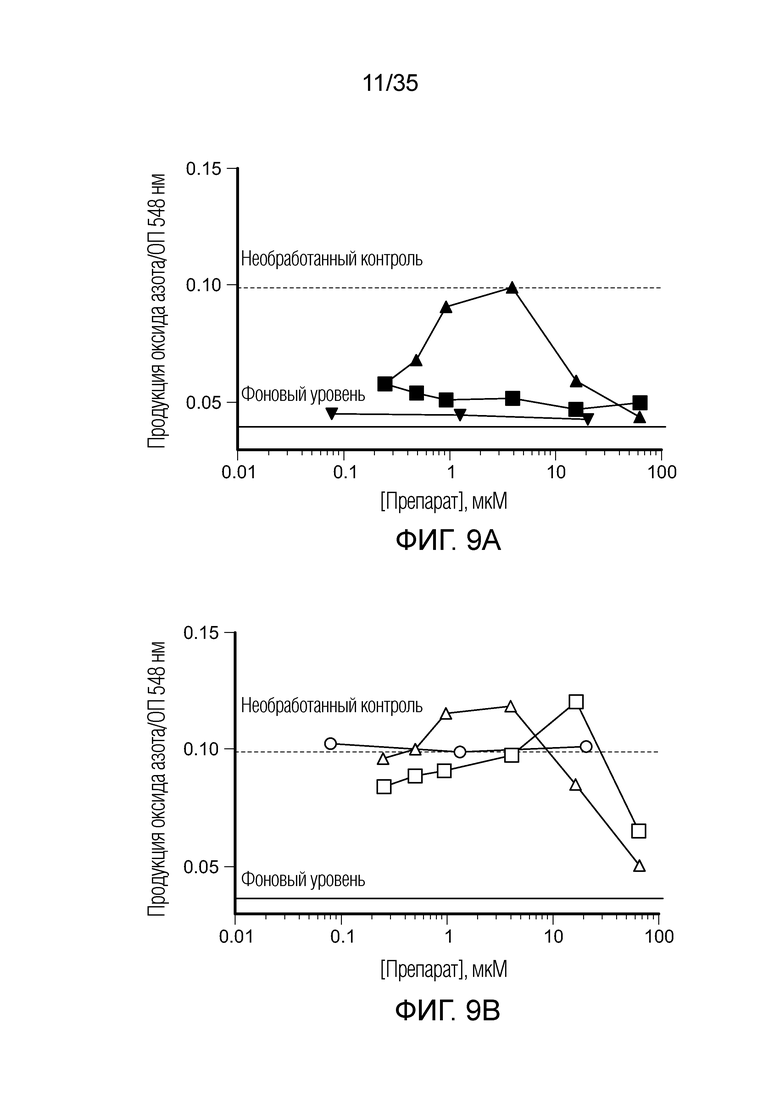
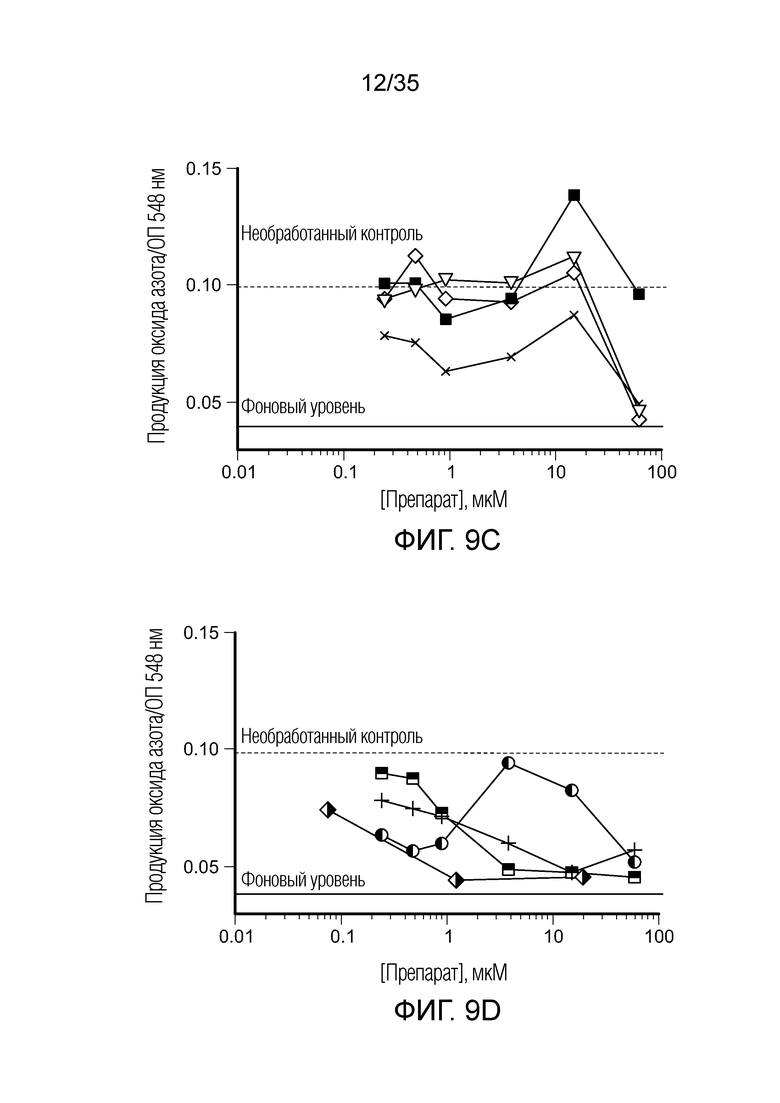
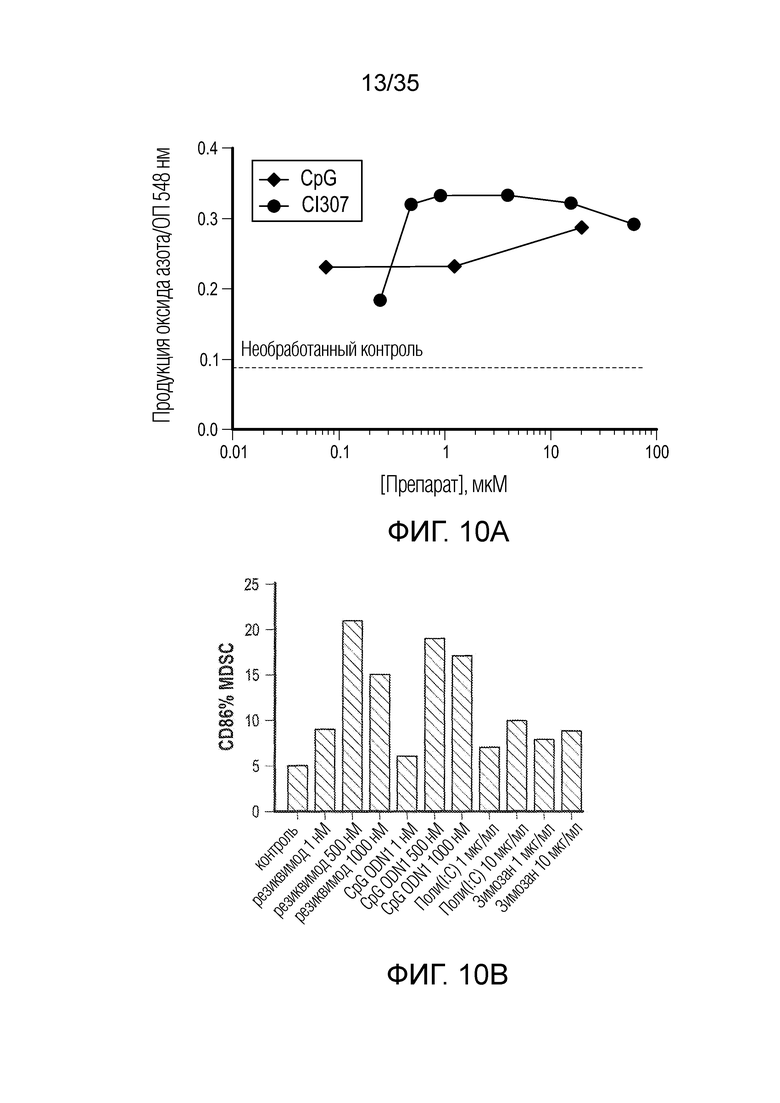
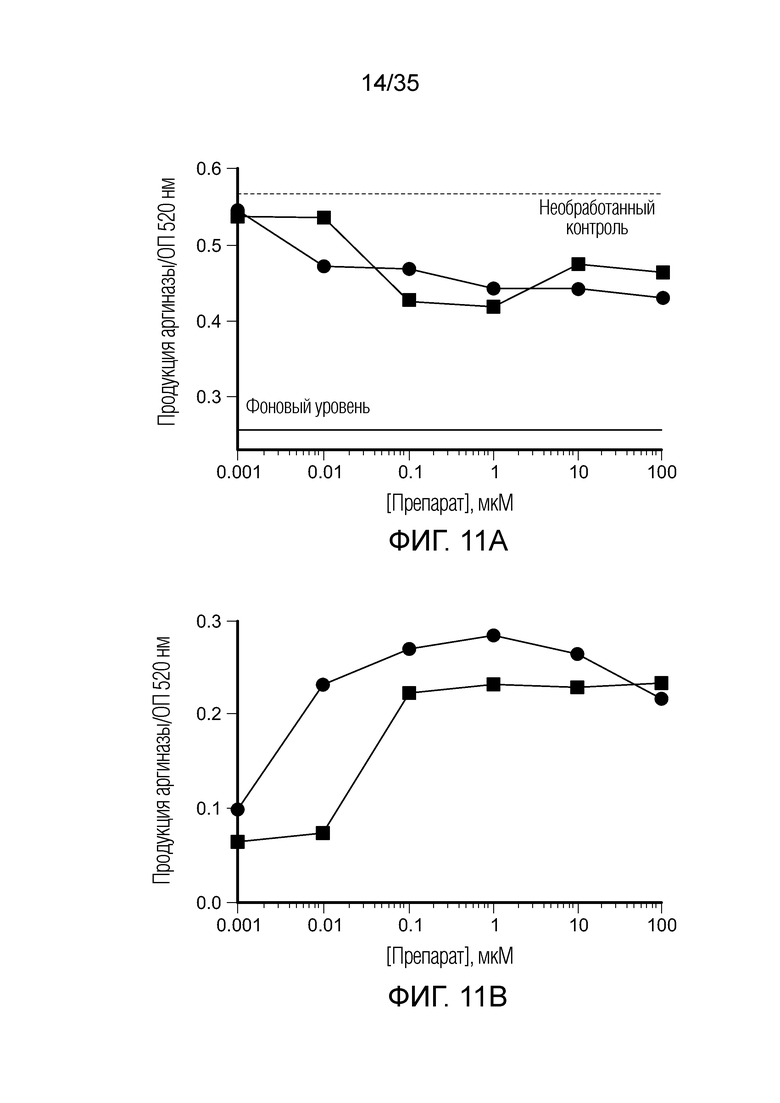
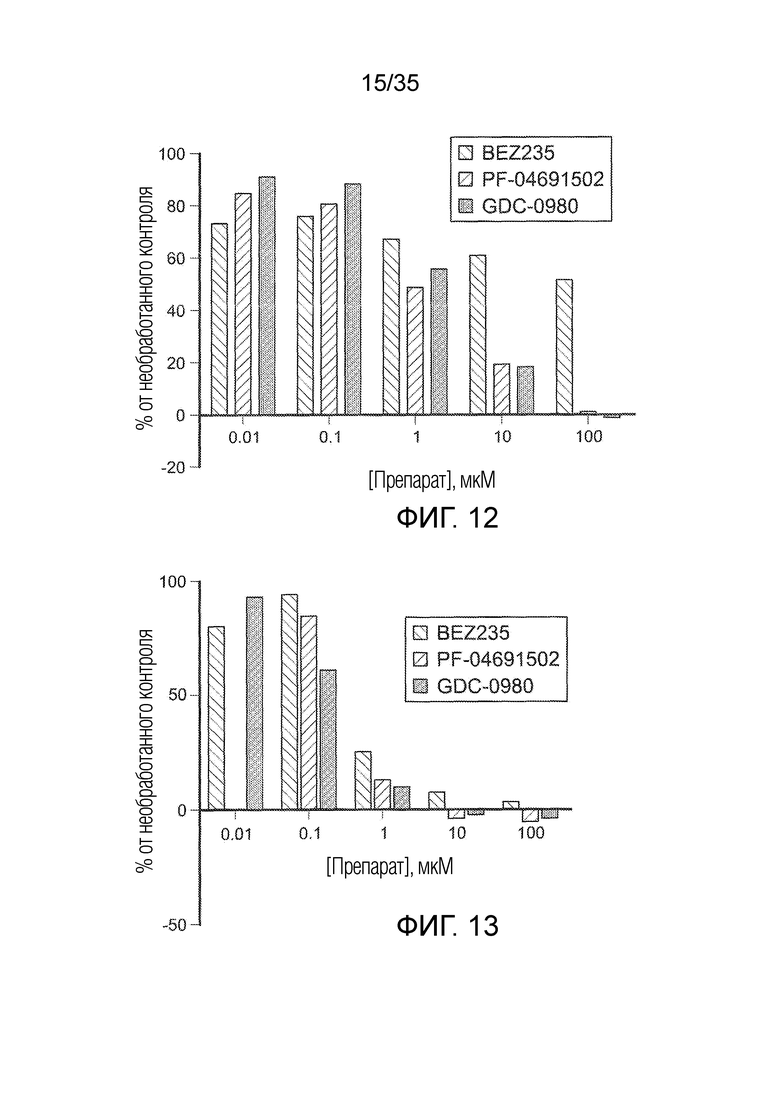
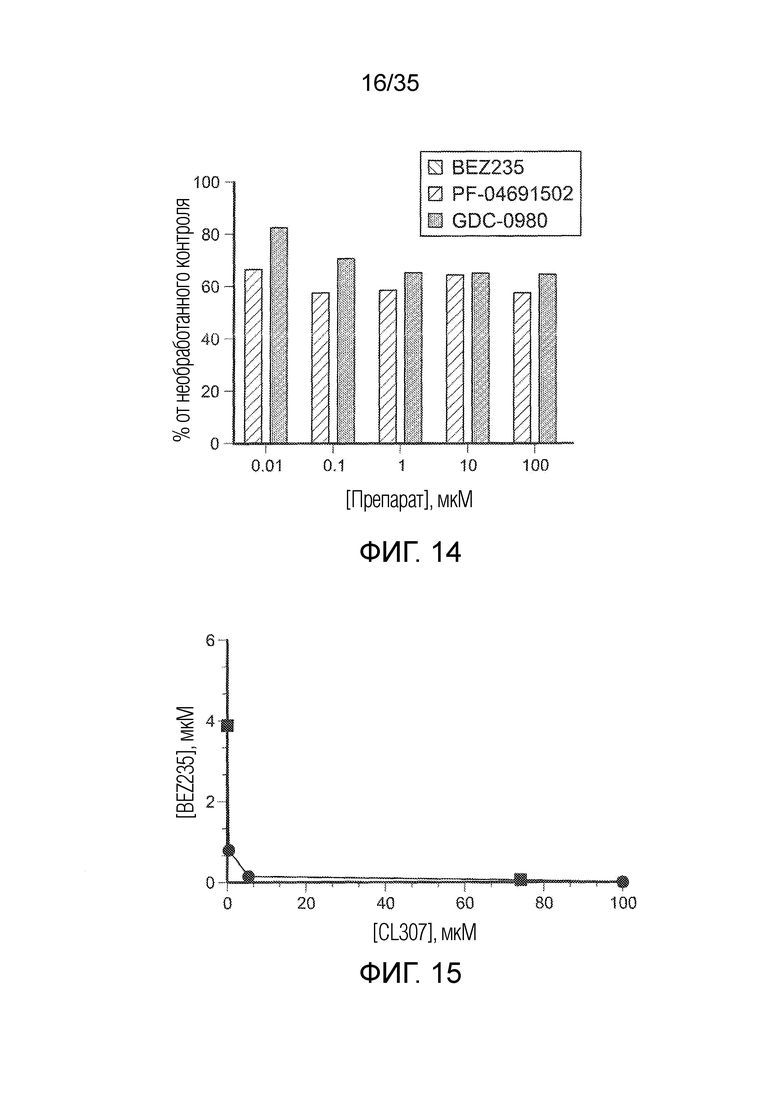
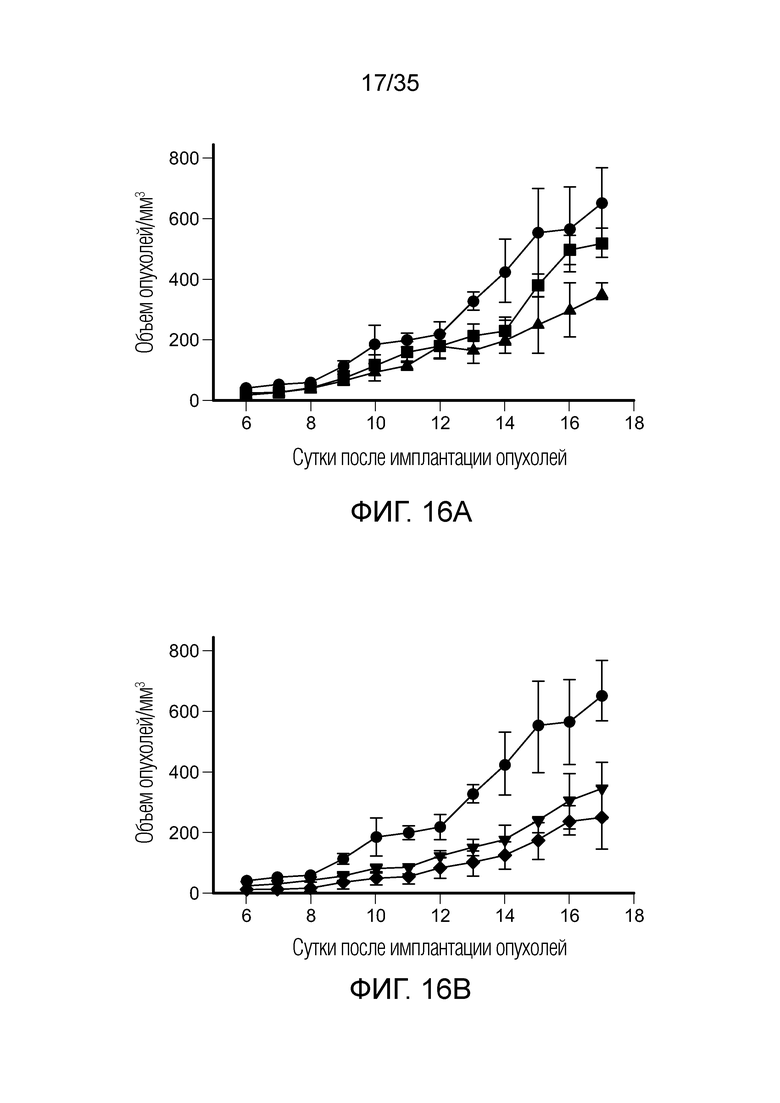
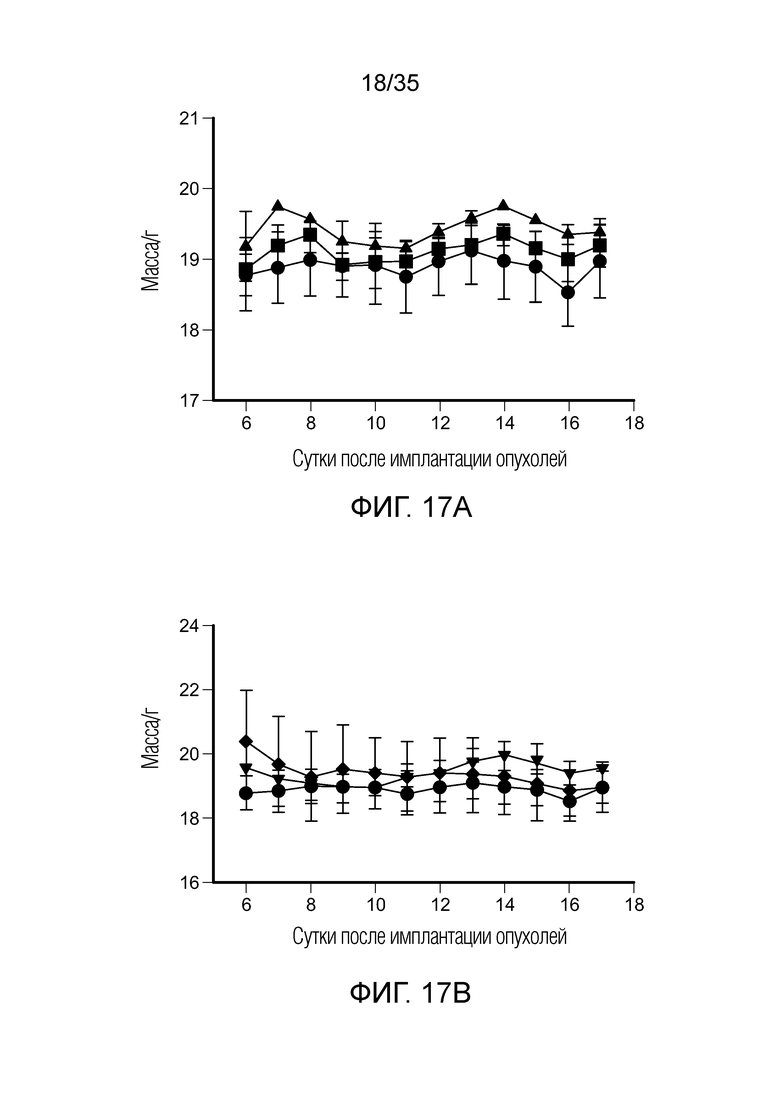
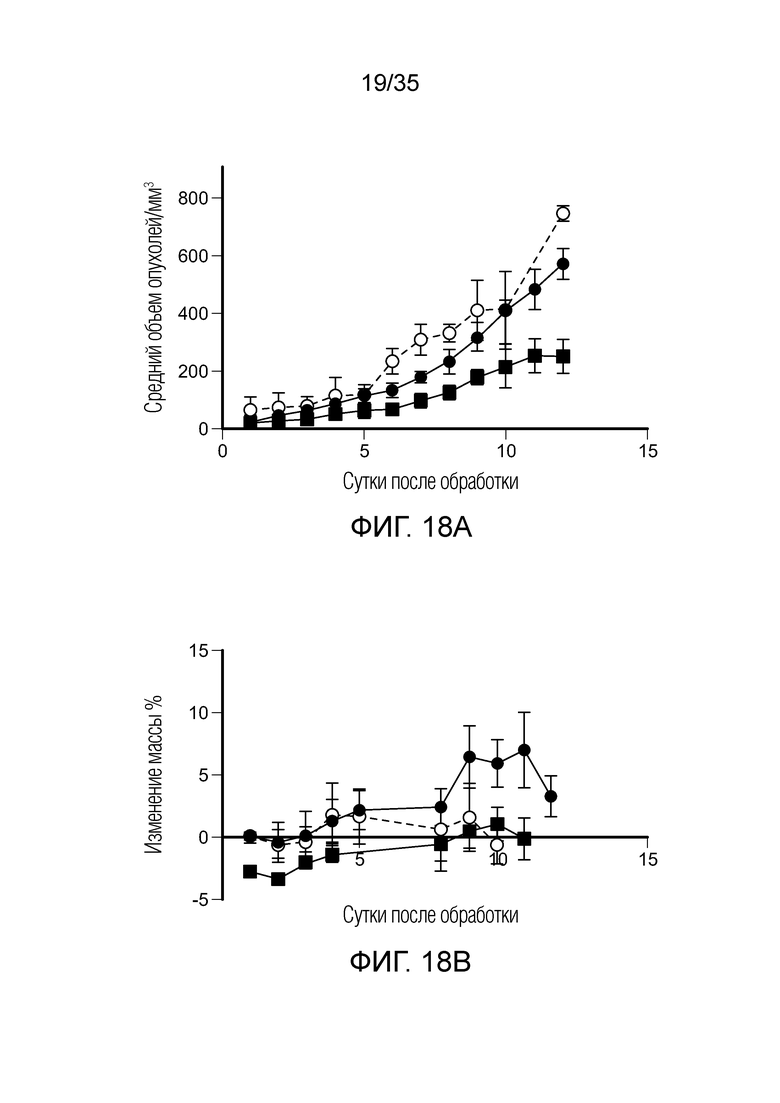
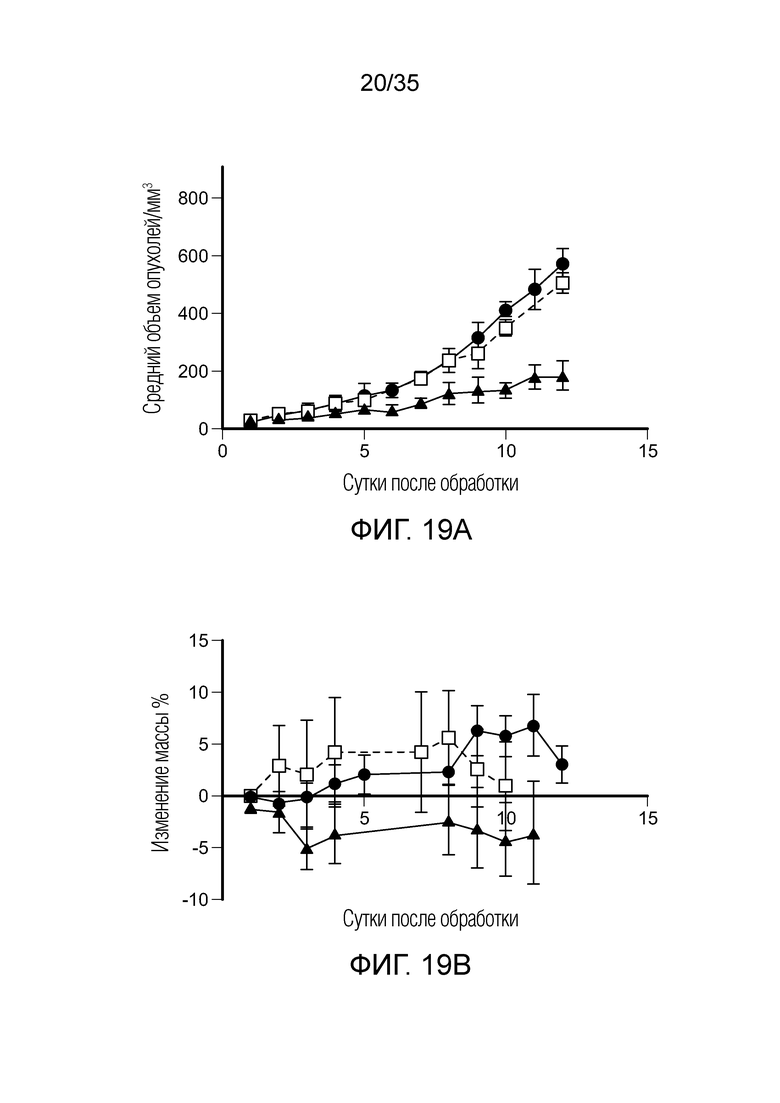
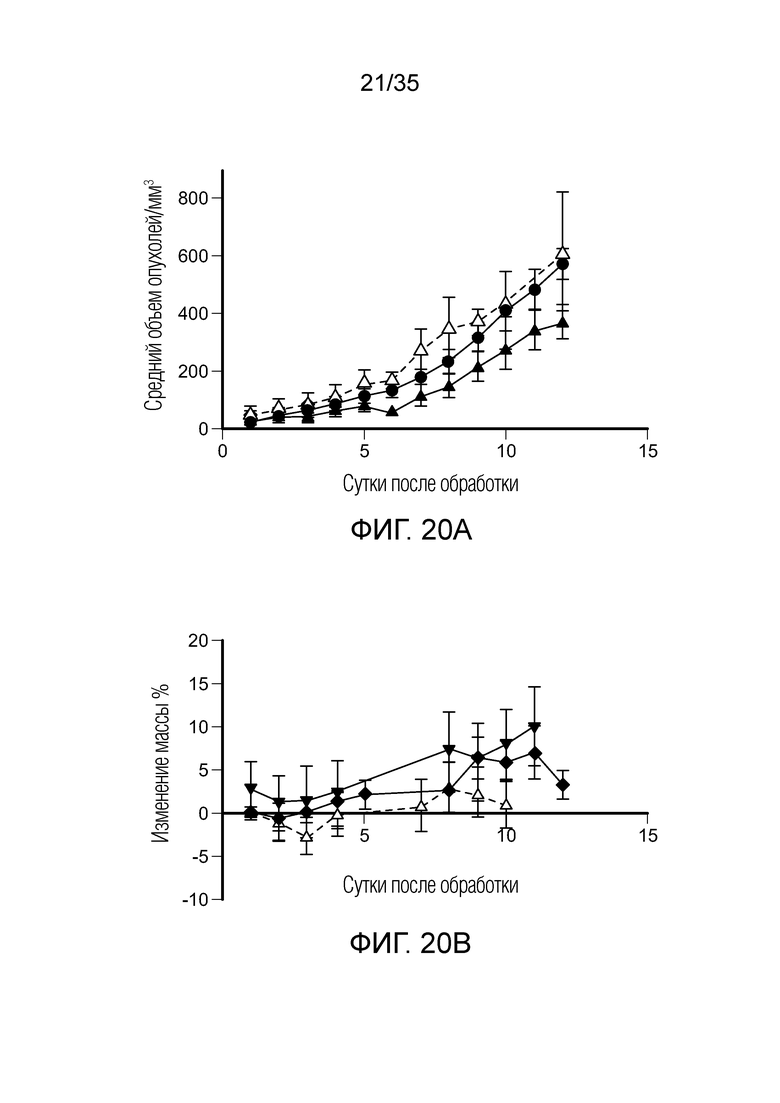
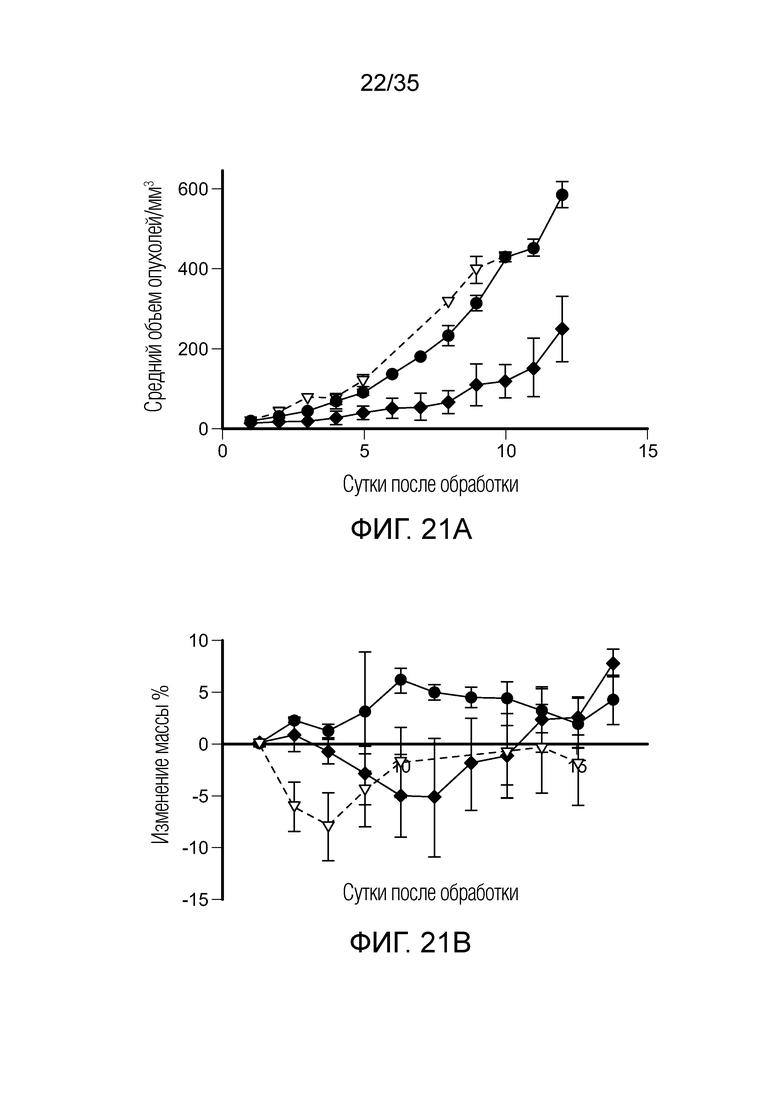
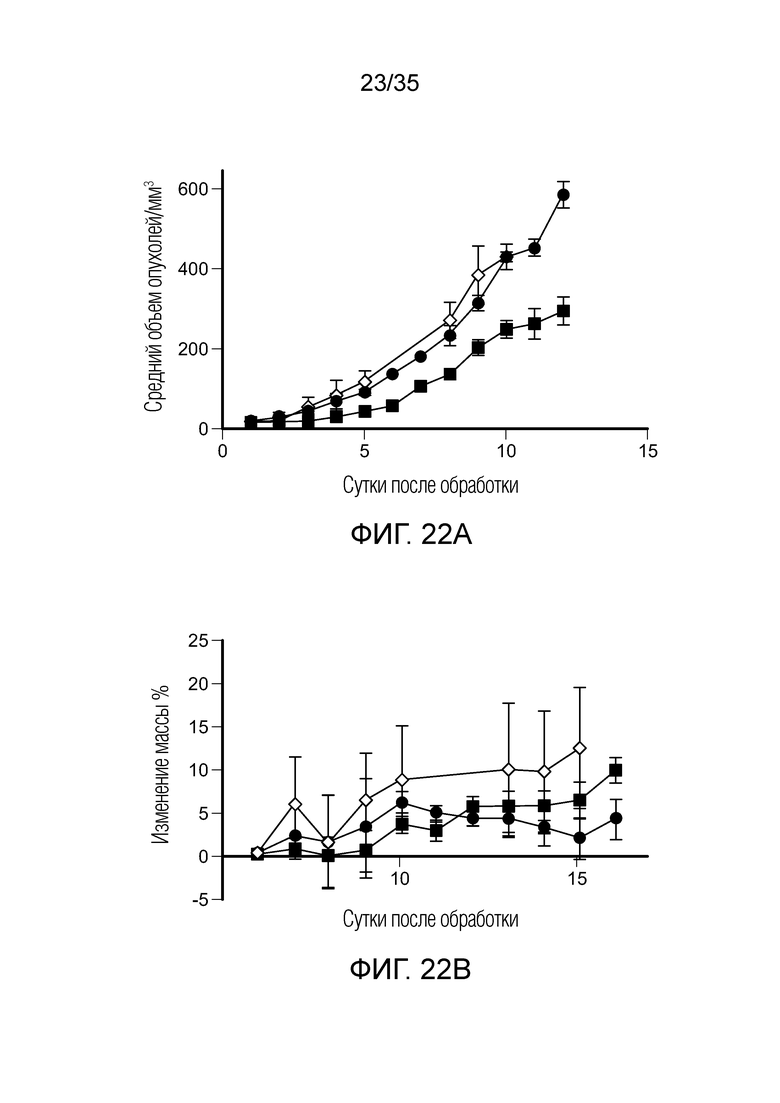
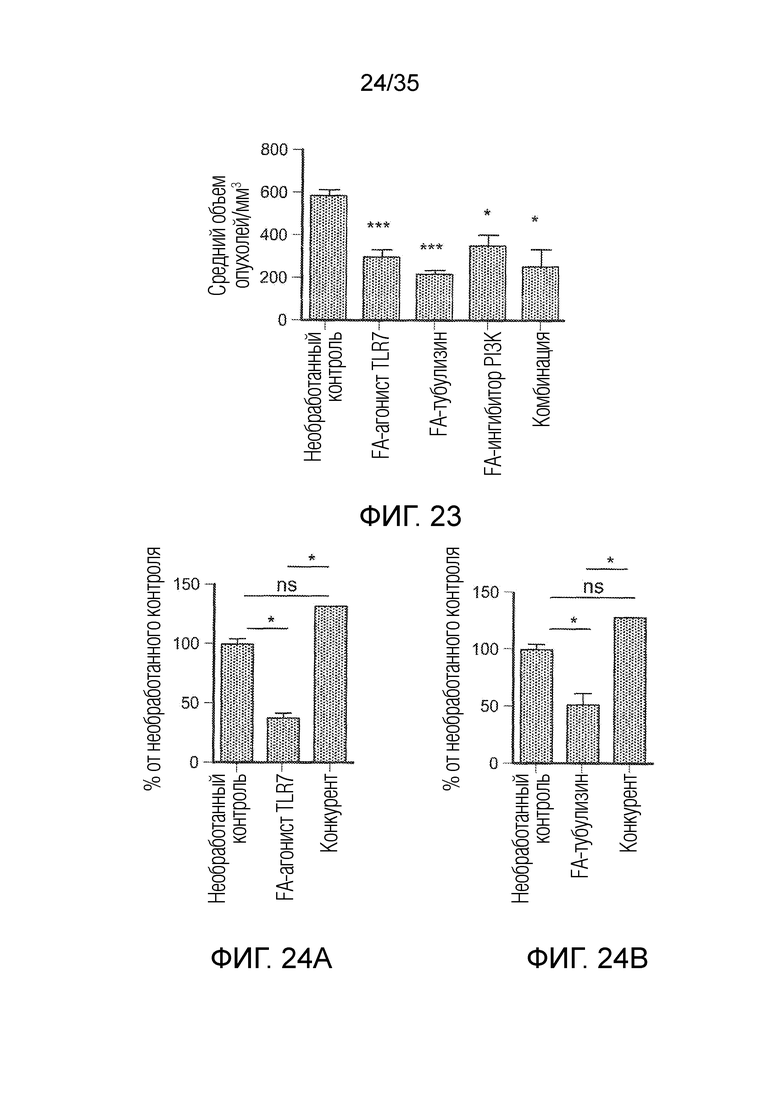
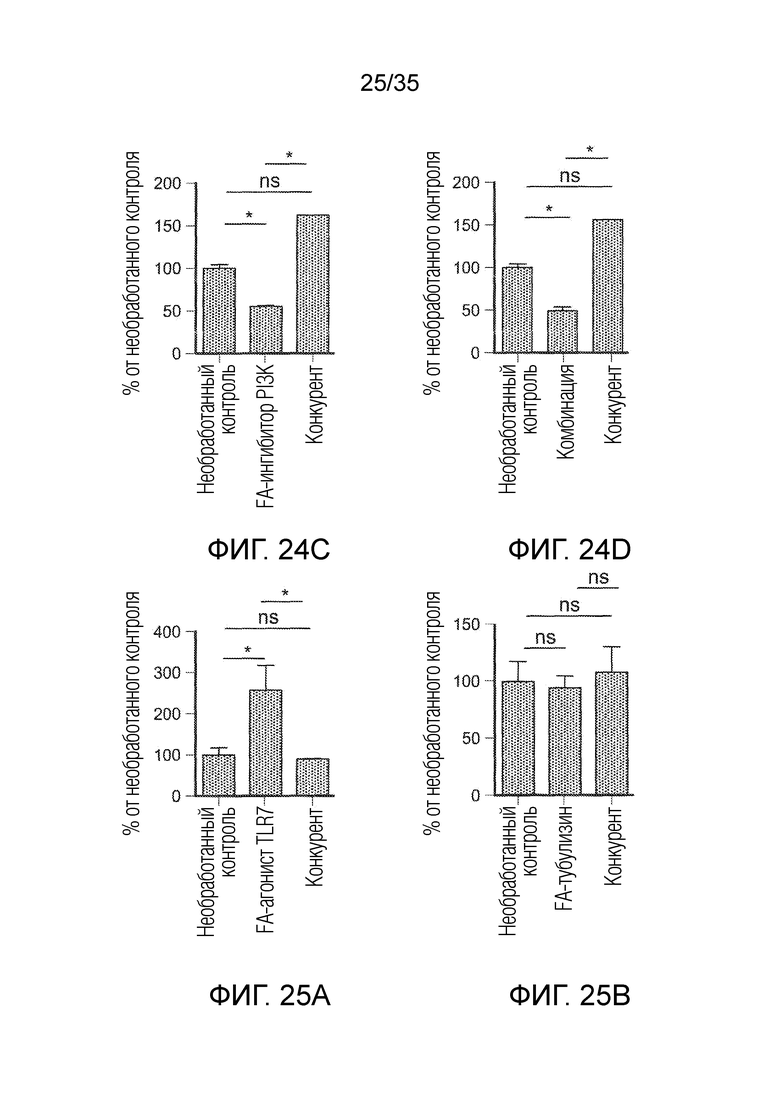
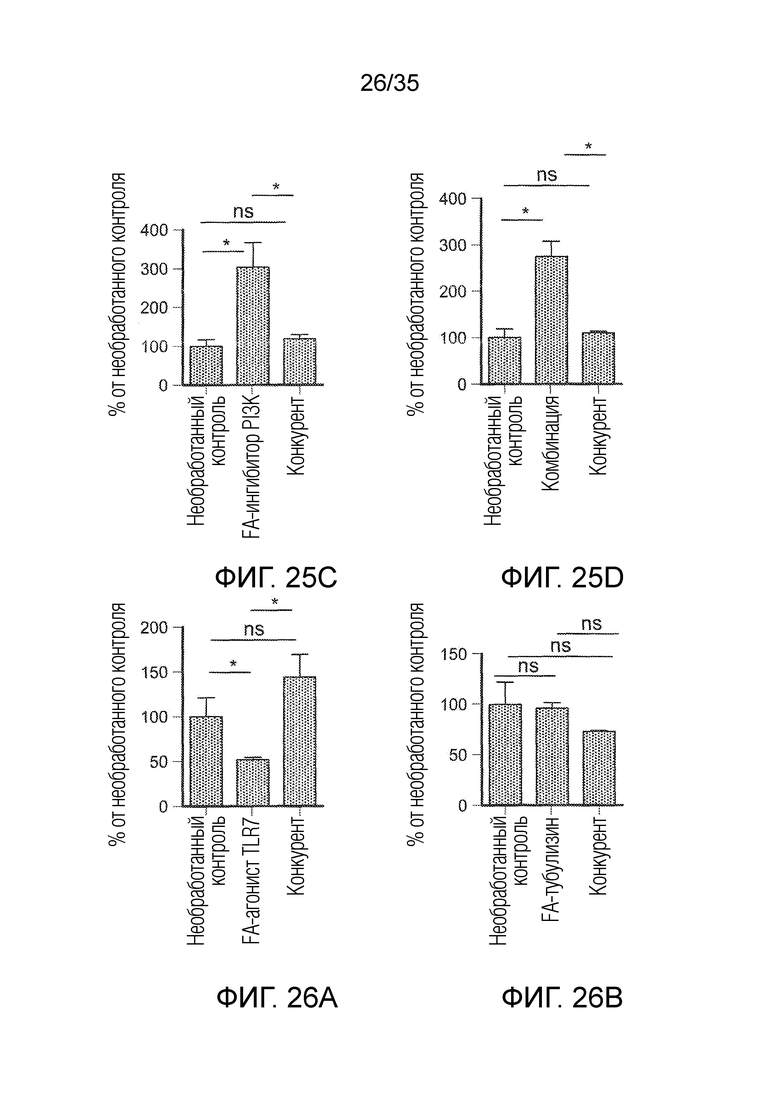
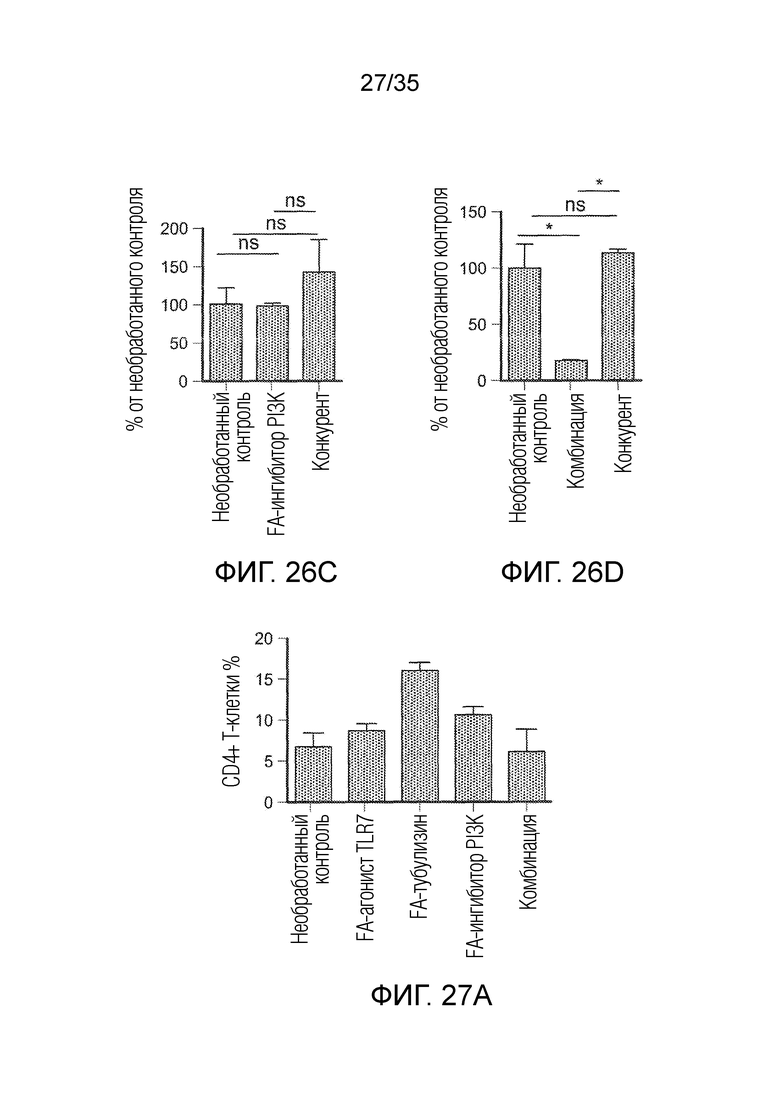
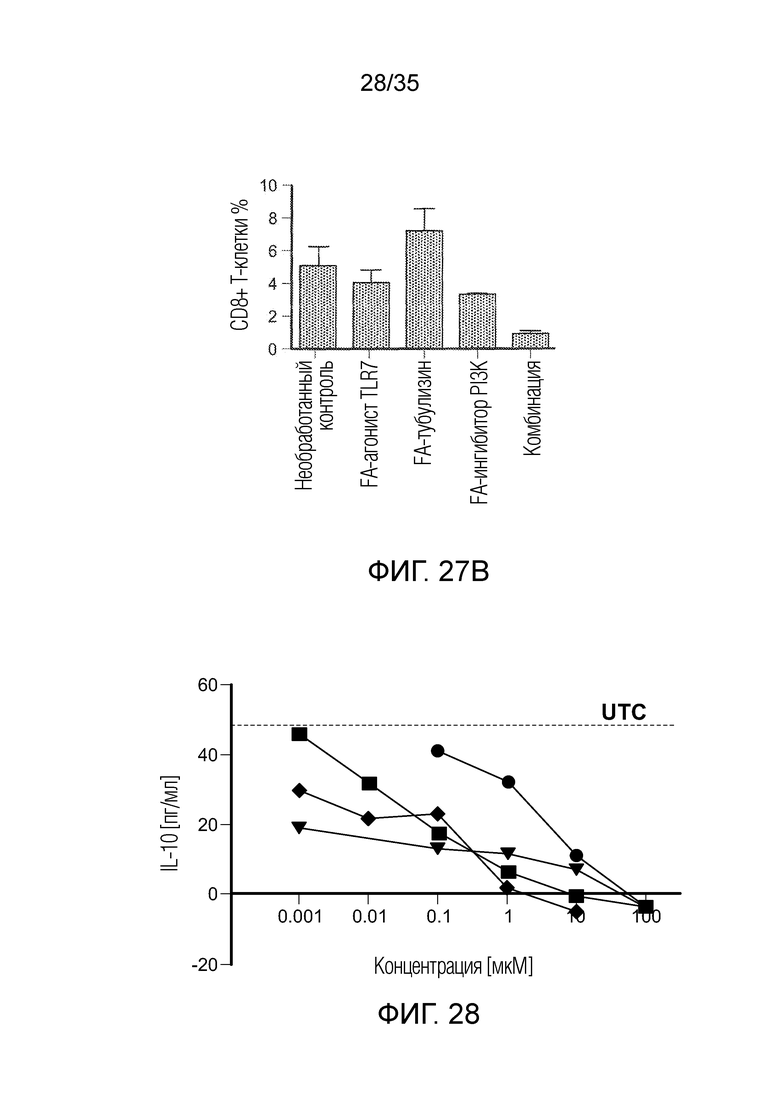
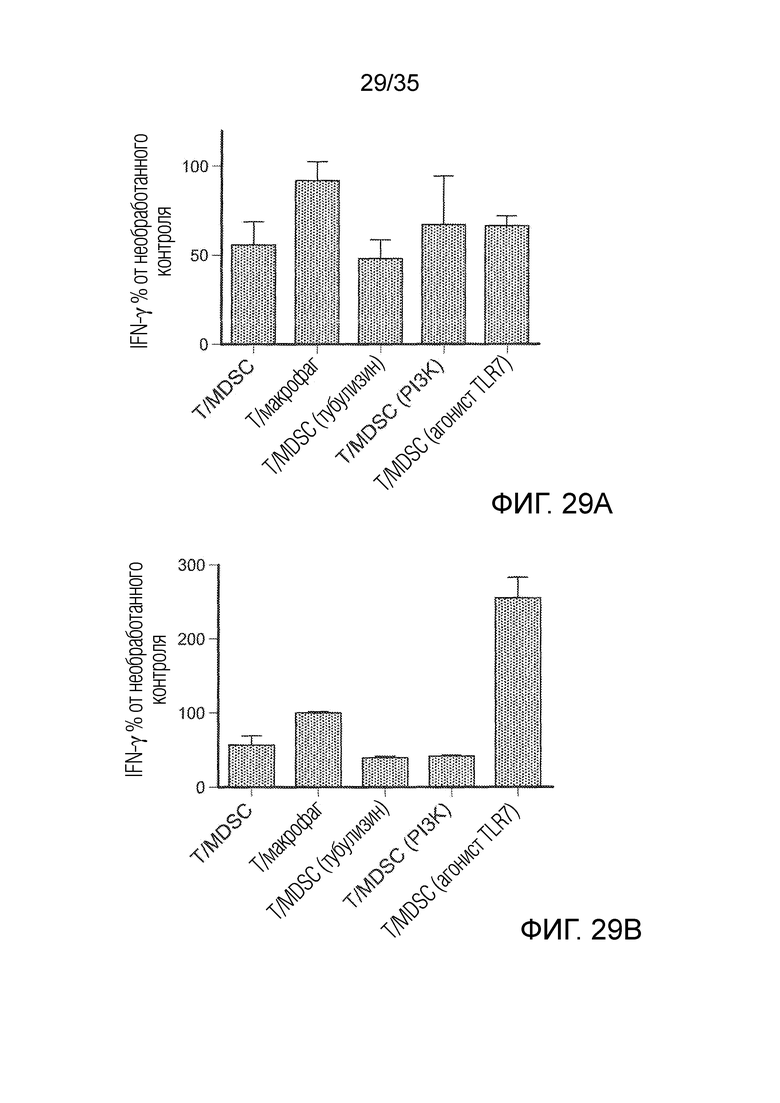
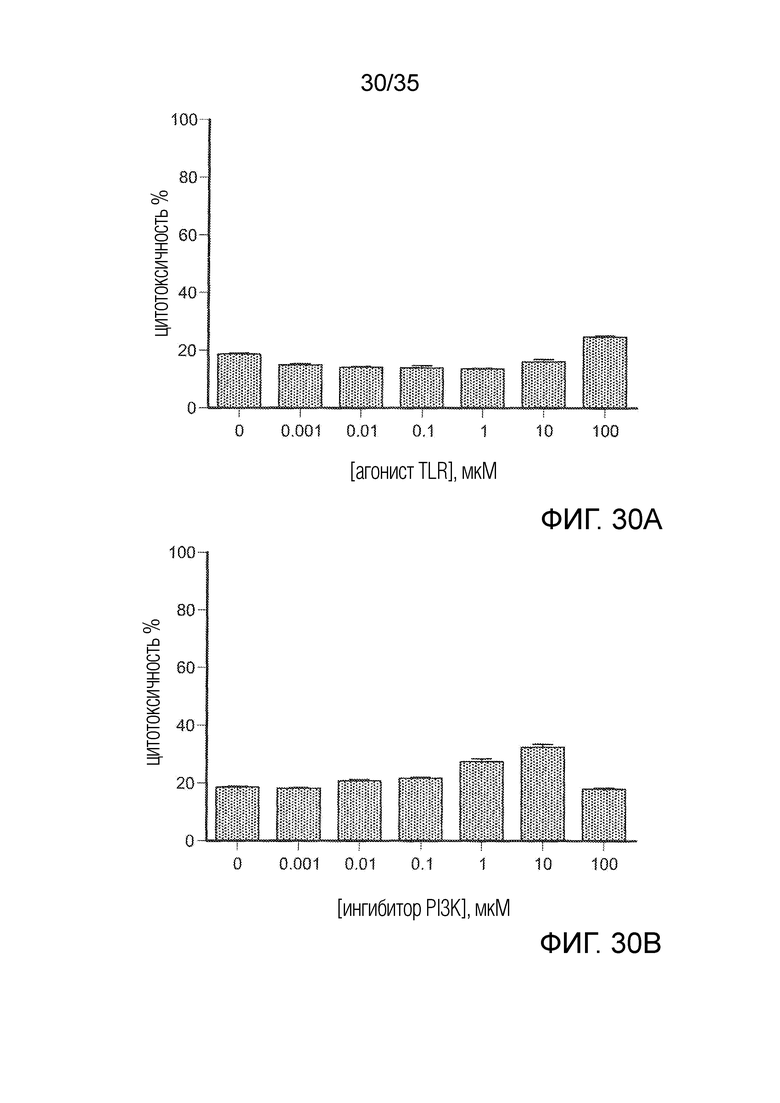
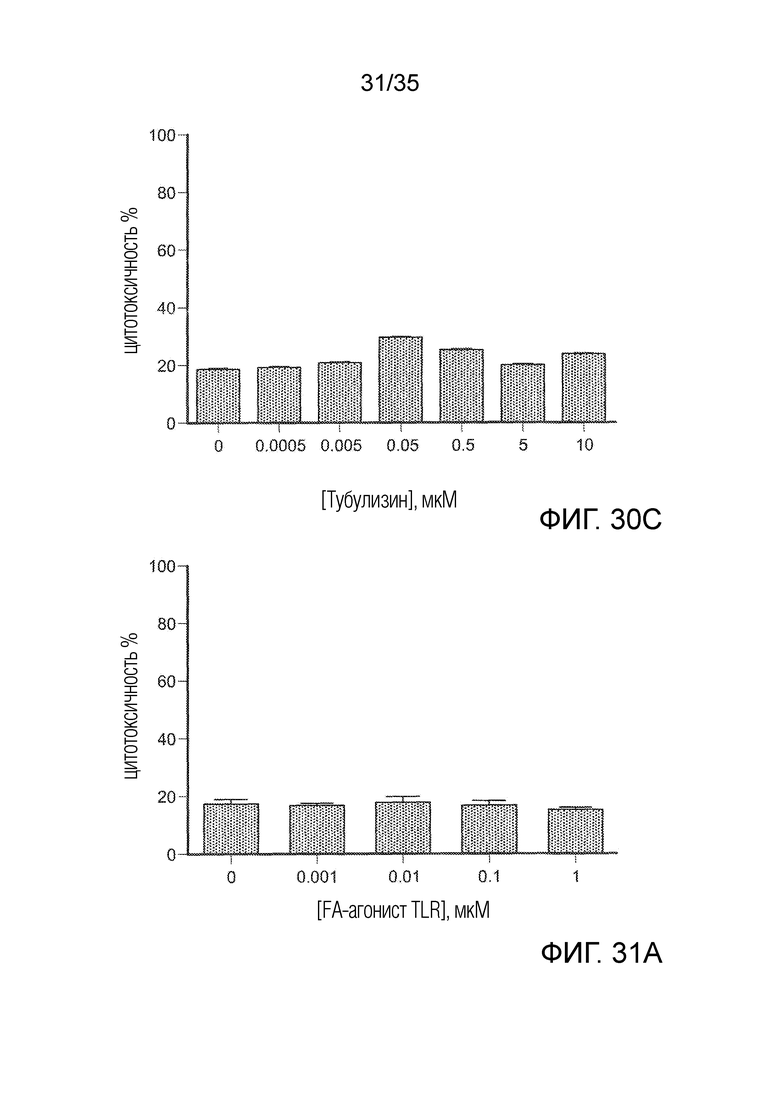
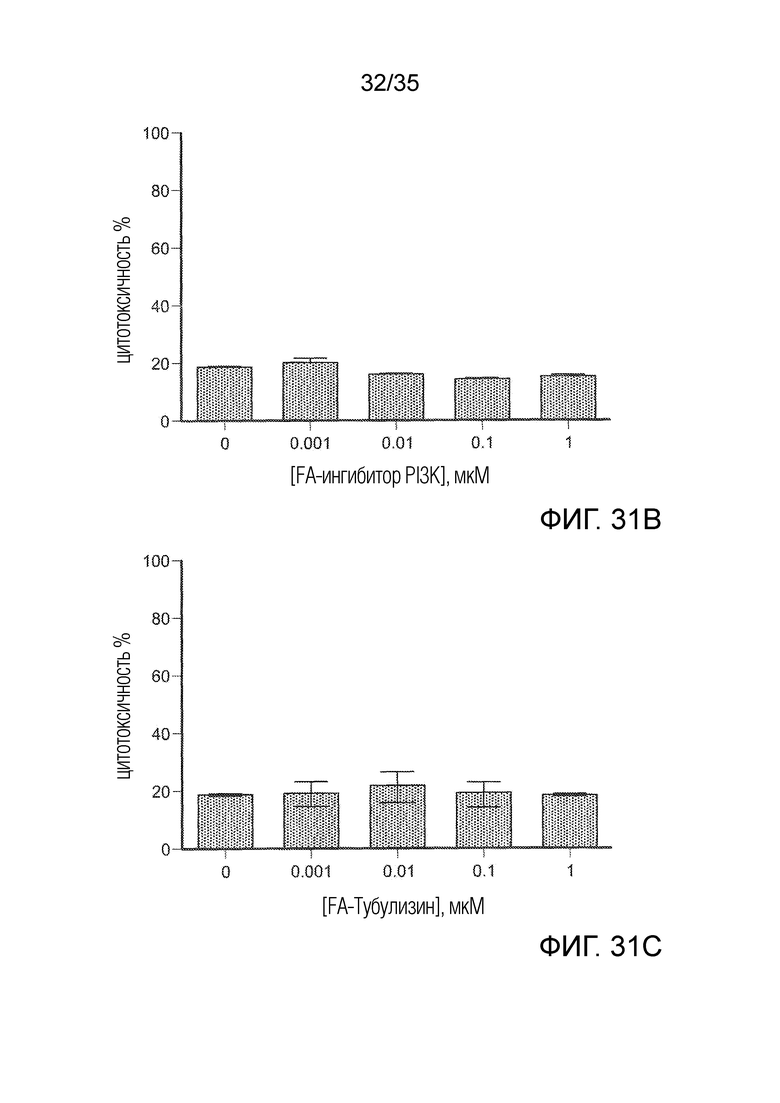
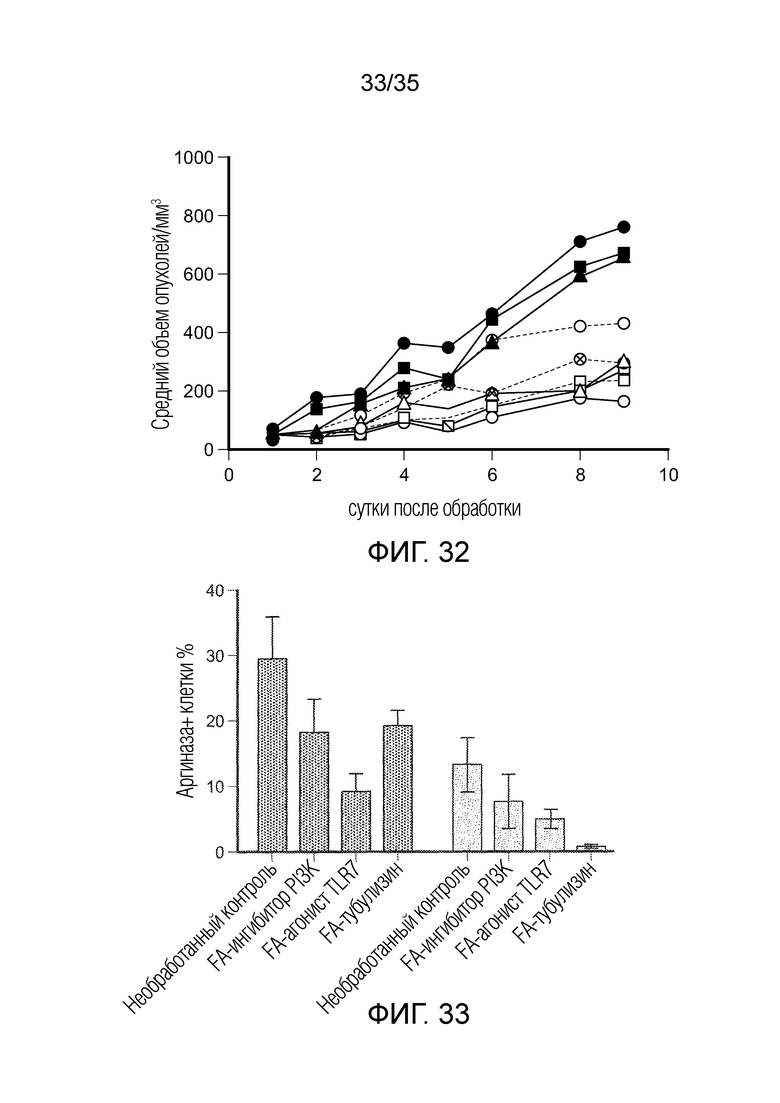
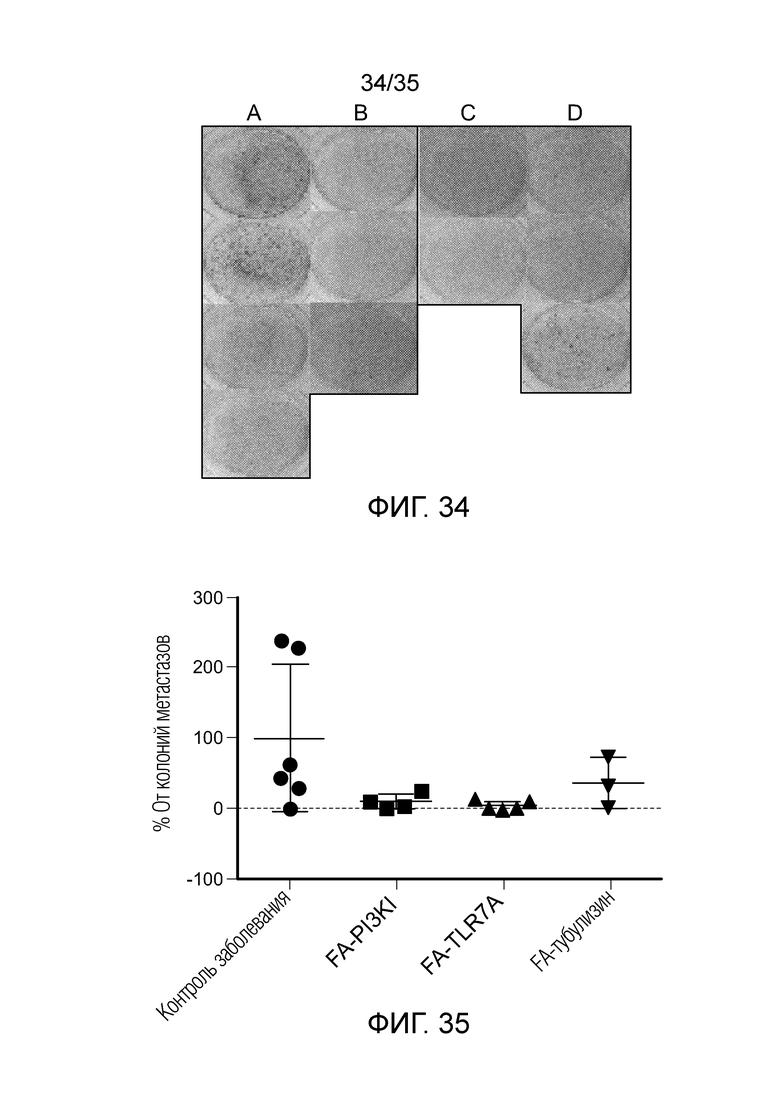
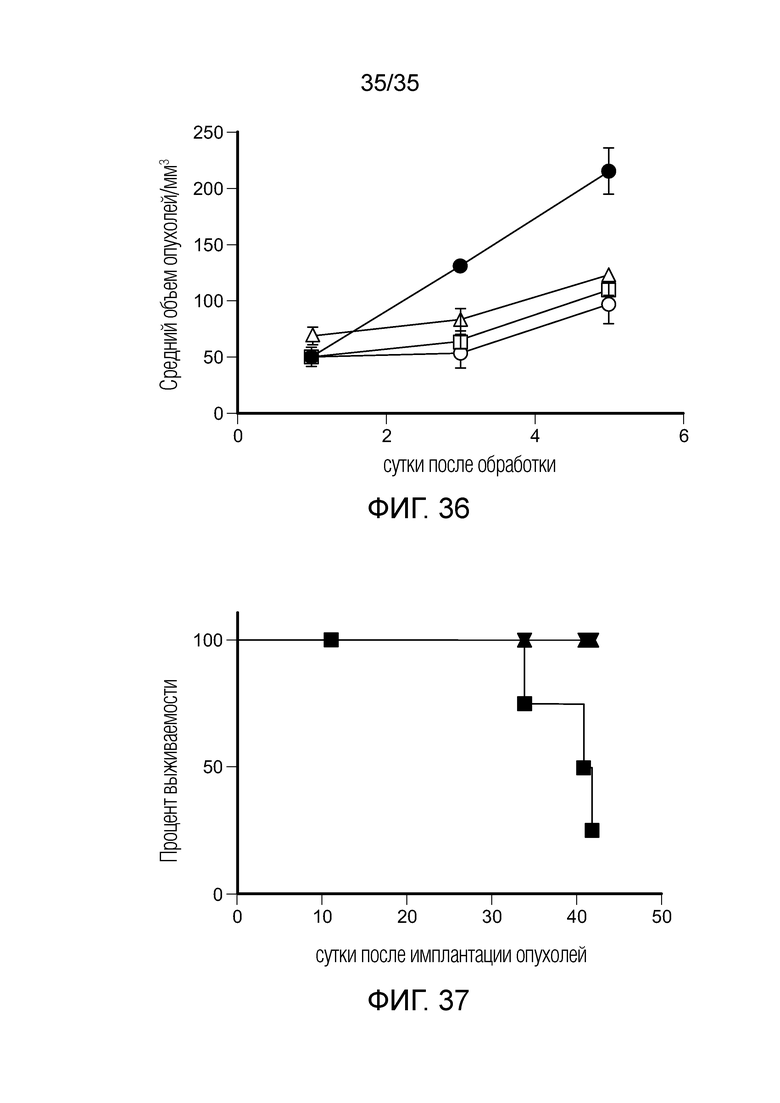
Группа изобретений относится к области медицины и фармацевтики и может быть использована для лечения фолат-рецептор-негативного рака. Способ лечения фолат-рецептор-негативного рака включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат. Группа изобретений относится также к вариантам указанного способа и к способу нацеливания на супрессорные клетки миелоидного происхождения. Группа изобретений обеспечивает эффективное лечение фолат-рецептор-негативного рака путем нацеливания на супрессорные клетки миелоидного происхождения. 6 н. и 39 з.п. ф-лы, 37 ил., 2 табл., 16 пр.
1. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, где супрессорные клетки миелоидного происхождения ингибируются или истощаются, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
2. Способ лечения фолат-рецептор-негативного рака, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для истощения или ингибирования супрессорных клеток миелоидного происхождения, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
3. Способ лечения фолат-рецептор-негативного рака, у животного-хозяина, где супрессорные клетки миелоидного происхождения находятся в злокачественной опухоли, где способ включает введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, и лечение злокачественной опухоли, имеющей супрессорные клетки миелоидного происхождения, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
4. Способ лечения фолат-рецептор-негативного рака, включающий идентификацию наличия супрессорных клеток миелоидного происхождения в злокачественной опухоли у животного-хозяина и введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
5. Способ ингибирования фолат-рецептор-негативного рака у животного-хозяина, включающий введение животному-хозяину терапевтически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для ингибирования или истощения супрессорных клеток миелоидного происхождения, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
6. Способ нацеливания на супрессорные клетки миелоидного происхождения у животного-хозяина для лечения фолат-рецептор-негативного рака, где способ включает введение животному-хозяину терапевтически или диагностически эффективного количества одного или более соединений, включающих лиганд, связывающийся с фолатным рецептором, присоединенный к лекарственному средству через линкер, для нацеливания на супрессорные клетки миелоидного происхождения, и где лиганд, связывающийся с фолатным рецептором, представляет собой фолат.
7. Способ по любому из пп.1-6, где лиганд, связывающийся с фолатным рецептором, специфичен для фолатного рецептора-β и где лиганд, связывающийся с фолатным рецептором, связывается с фолатным рецептором-β на супрессорных клетках миелоидного происхождения.
8. Способ по любому из пп.1-6, где супрессорные клетки миелоидного происхождения имеют маркер CD11b.
9. Способ по любому из пп.1-6, где супрессорные клетки миелоидного происхождения имеют маркер Gr1.
10. Способ по любому из пп.1-6, где рак выбран из немелкоклеточного рака легкого, рака головы и шеи, тройного негативного рака молочной железы, рака молочной железы, рака яичника, рака толстого кишечника, рака предстательной железы, рака легкого, рака эндометрия и рака почки.
11. Способ по любому из пп.1-6, где лекарственное средство выбрано из CI307, BEZ235, вортманнина, AMT, PF-04691502, CpG-олигонуклеотида, BLZ945, леналидомида, NLG919, 5,15-DPP, пирролобензодиазепина, метотрексата, эверолимуса, тубулизина, GDC-0980, AS1517499, BIRB796, N-ацетил-5-гидрокситриптамина и 2,4-диамино-6-гидроксипиримидина.
12. Способ по любому из пп.1-6, где лекарственное средство представляет ингибитор полимеризации микротрубочек.
13. Способ по п.12, где лекарственное средство вызывает гибель супрессорных клеток миелоидного происхождения.
14. Способ по любому из пп.1-6, где лекарственное средство выбрано из ингибитора PI3K, ингибитора STAT6, ингибитора MAPK, ингибитора iNOS и противовоспалительного лекарственного средства.
15. Способ по п.14, где лекарственное средство инактивирует супрессорные клетки миелоидного происхождения.
16. Способ по любому из пп.1-6, где лекарственное средство представляет агонист TLR.
17. Способ по п.16, где агонист TLR выбран из агониста TLR7 и агониста TLR9.
18. Способ по п.17, где лекарственное средство перепрограммирует супрессорные клетки миелоидного происхождения.
19. Способ по п.12, где лекарственное средство представляет тубулизин.
20. Способ по п.14, где лекарственное средство представляет ингибитор PI3K.
21. Способ по п.20, где лекарственное средство выбрано из GDC-0980, вортманнина и PF-04691502.
22. Способ по п.14, где лекарственное средство представляет ингибитор STAT6.
23. Способ по п.22, где лекарственное средство представляет AS1517499.
24. Способ по п.14, где лекарственное средство представляет ингибитор МАРК.
25. Способ по п.24, где лекарственное средство представляет BIRB796.
26. Способ по п.14, где лекарственное средство представляет ингибитор iNOS.
27. Способ по п.26, где лекарственное средство представляет АМТ.
28. Способ по п.14, где лекарственное средство представляет противовоспалительное лекарственное средство.
29. Способ по п.28, где лекарственное средство представляет метотрексат.
30. Способ по п. 16, где лекарственное средство выбрано из CI307, CpG-олигонуклеотида и TLR7A.
31. Способ по любому из пп.1-6, где вводят более чем одно соединение и эти соединения включают разные лекарственные средства.
32. Способ по п.31, где разные лекарственные средства представляют агонист TLR7 и ингибитор PI3K.
33. Способ по любому из пп.1-6, где вводят одно или более из соединений и также вводят неконъюгированное лекарственное средство.
34. Способ по п.33, где лекарственное средство в соединении представляет агонист TLR7 и неконъюгированное лекарственное средство представляет ингибитор PI3K.
35. Способ по любому из пп.1-6, где соединение имеет формулу
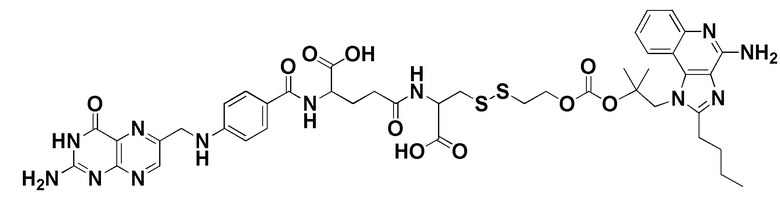 .
.
36. Способ по любому из пп.1-6, где соединение имеет формулу
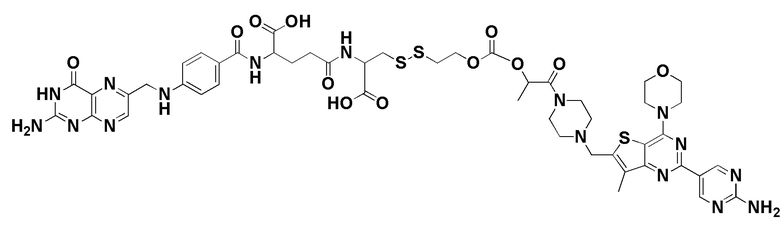 .
.
37. Способ по любому из пп.1-6, где соединение имеет формулу
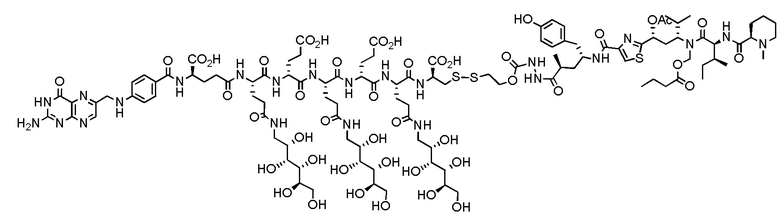 .
.
38. Способ по любому из пп.1-6, где соединение имеет формулу
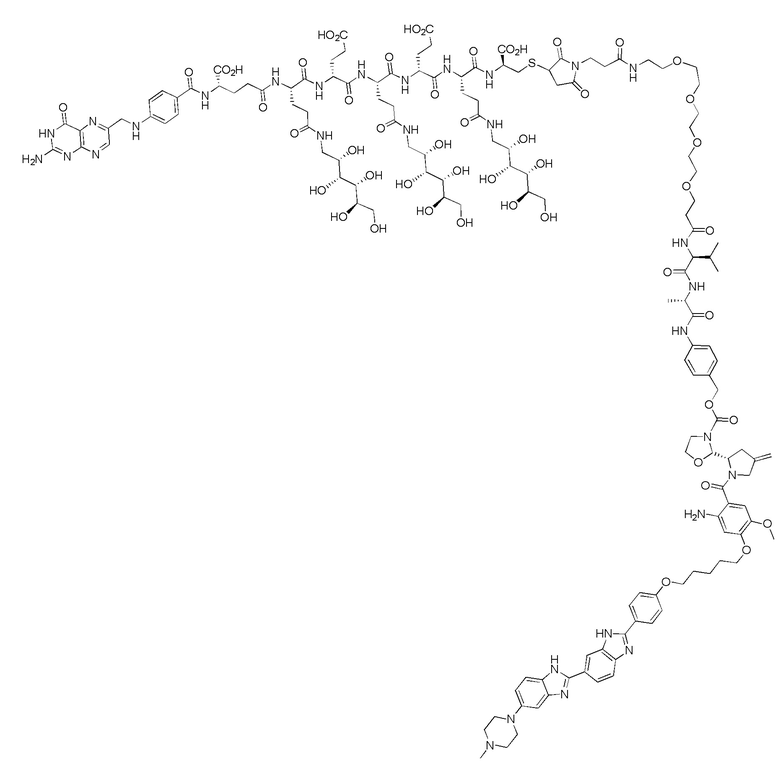 .
.
39. Способ по любому из пп.1-6, где одно или более из соединений или фармацевтически приемлемую соль любого одного или более из соединений вводят животному-хозяину.
40. Способ по любому из пп.1-6, где введение проводится в лекарственной форме для парентерального введения.
41. Способ по п.40, где лекарственная форма для парентерального введения выбрана из лекарственной формы для внутрикожного введения, лекарственной формы для подкожного введения, лекарственной формы для внутримышечного введения, лекарственной формы для внутрибрюшинного введения, лекарственной формы для внутривенного введения и лекарственной формы для интратекального введения.
42. Способ по любому из пп.1-6, где терапевтически эффективное количество или диагностически эффективное количество составляет от 0,5 до 6,0 мг/м2.
43. Способ по любому из пп.1-6, где терапевтически эффективное количество или диагностически эффективное количество составляет от 0,5 до 4,0 мг/м2.
43. Способ по любому из пп.1-6, где терапевтически эффективное количество или диагностически эффективное количество составляет от 0,5 до 2,0 мг/м2.
45. Способ по любому из пп.1-6, где рак является фолат-рецептор-негативным раком и рак выбран из рака толстого кишечника, рака легкого, рака предстательной железы и рака молочной железы.
| WO 2014062697 А2, 24.04.2014 | |||
| WO 2016027273, 25.02.2016 | |||
| JIAYIN SHEN Folate receptor beta: A New Surface Molecule for Selective Targeting of Activated Macrophages in Inflammatory Diseases and Cancer // ProQuest Dissertations Publishing, May 2013, [он-лайн], [найдено 27.07.2020] | |||
| Найдено из Интернет: |
Авторы
Даты
2022-07-28—Публикация
2017-05-25—Подача