Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, включающей полипептид, и ее медицинскому применению, например, для лечения или профилактики ожирения, диабета или неалкогольной жировой болезни печени. Полипептид имеет эффекты снижения потребления пищи, усиления секреции инсулина, сдерживания опорожнения желудка, стимулирования липолиза и снижения уровня триглицеридов без побочных эффектов, таких как рвота или тошнота.
Предпосылки к созданию изобретения
В последнее время в связи с экономическим развитием и высокими темпами роста научных технологий старение населения растет, а заболеваемость взрослого населения быстро увеличивается. Это вызвано стрессом, неправильным питанием, чрезмерным потреблением калорий и снижением физической активности. Показатели смертности от сердечных и цереброваскулярных заболеваний, которые являются осложнениями, сопровождающими ожирение, занимают первое и второе место, а ожирение считается причиной различных заболеваний взрослых, таких как диабет, неалкогольное жировое заболевание печени и т.п.
Ожирение относится к состоянию, при котором жир накапливается в большем количестве, чем обычно, и наиболее точным методом оценки ожирения является измерение жировой массы тела. Однако точное измерение жировой массы является дорогостоящим и поэтому оценивается косвенными методами. Наиболее часто используемыми косвенными методами являются измерение индекса массы тела (ИМТ) и окружности талии. Всемирная организация здравоохранения (ВОЗ) объявила классификации на основе данных, касающихся связи ИМТ с риском смерти, которые базируются на нормальной массе тела: от 18,5 до 24,9 кг/м2, избыточной массе тела: от 25 до 29,9 кг/м2 и ожирении: 30 кг/м2 или более.
Причины ожирения известны как энергетический дисбаланс из-за чрезмерного потребления калорий и относительно пониженной активности, что приводит к увеличению жировых отложений. Однако трудно определить только один фактор, поскольку ожирение связано с различными факторами риска, такими как привычки питания, образ жизни, возраст, раса, генетические факторы и т.д.
Диабет подразделяется на инсулинозависимый диабет (диабет I типа), инсулиннезависимый диабет (диабет II типа) и сахарный диабет, связанный с недостаточностью питания (MRDM). Сахарный диабет II типа, на долю которого приходится более 90% всех случаев диабета, является метаболическим заболеванием, характеризующимся гипергликемией, и, как сообщается, вызывается снижением секреции инсулина бета-клетками поджелудочной железы или повышенной инсулинорезистентностью в периферических тканях из-за генетических, метаболических и экологических факторов. В связи с этим, когда жировые отложения увеличиваются, чувствительность к инсулину снижается, в частности, накопление абдоминального жира, как известно, связано с непереносимостью глюкозы. Также известно, что инсулинорезистентность тесно связана с ожирением у пациентов, страдающих диабетом II типа, при этом чем тяжелее ожирение, тем выше инсулинорезистентность.
Неалкогольные жировые заболевания печени (NAFLD) относятся к ряду заболеваний, включающих простой стеатоз с чрезмерным накоплением жира в клетках печени независимо от употребления алкоголя, неалкогольный стеатогепатит (NASH), включая гепатоцеллюлярное повреждение (баллонная дистрофия клеток печени), воспаление, фиброз и, в более запущенных случаях, цирроз. Уровень распространенности неалкогольной жировой болезни печени быстро увеличивается с увеличением распространенности ожирения во всем мире, и, хотя уровень распространенности диабета в разных странах варьирует, он затрагивает от 20 до 30% от общей численности населения в западных странах, и уровень заболеваемости достигает около 16% в Корее.
Неалкогольная жировая болезнь печени демонстрирует тесную связь с метаболическими синдромами, включая ожирение, диабет II типа, дислипидемию и т.п., основанными на резистентности к инсулину. Действительно, известно, что многие пациенты с преддиабетом и диабетом II типа страдают неалкогольным ожирением печени/неалкогольным стеатогепатитом, а скорость прогрессирования до цирроза и рака печени (т.е. гепатоцеллюлярной карциномы) является высокой у этих пациентов. Между тем, распространенность диабета у пациентов с неалкогольной жировой болезнью печени высока и очевидна у пациентов с неалкогольным стеатогепатитом.
Пациентам с ожирением в первую очередь рекомендуется контролировать массу тела путем более здорового питания и физической активности, но когда эти методы неэффективны, пациентов можно лечить лекарственными или хирургическими методами.
Существующий рынок лекарственных средств от ожирения оценивается более чем в один миллиард долларов и ежегодно растет примерно на 10%. Лекарственные препараты, которые в основном используются в качестве средств от ожирения, представляют собой аноректические средства (лоркасерин, фентермин и т.д.), которые классифицируются как психотропные препараты, большинство из которых действуют на центральную нервную систему. Такие лекарственные средства, как известно, проявляют эффект подавления аппетита у пациентов, чтобы они могли похудеть, но имеют побочные эффекты, такие как привыкание и зависимость, сердцебиение, беспокойство, бессонница и т.п., при использовании в течение длительного периода времени.
Ксеникал является одним из лекарственных средств, используемых в качестве средства от ожирения, но не психотропного средства. Липаза поджелудочной железы действует как ключевой фермент, расщепляющий триглицерид на 2-моноацилглицерин и жирную кислоту. Типичным ингибитором липазы поджелудочной железы является тетрагидролипстатин (орлистат), который является производным липстатина, получаемого из Streptomyces toxitricini, и обладает высокой эффективностью ингибирования абсорбции примерно 30% потребляемых жиров. В настоящее время тетрагидролипстатин (орлистат) коммерчески доступен как лекарственное средство, но имеет побочные эффекты, такие как желудочно-кишечные расстройства, анафилаксия, холестаз и т.п. Поэтому существует мало терапевтических средств, которые можно безопасно использовать для пациентов с ожирением.
В лекарственной терапии для лечения неалкогольной жировой болезни печени лекарственные средства воздействуют на механизмы, обостряющие неалкогольную жировую болезнь печени, такие как инсулинорезистентность, окислительный стресс, апоптоз, воспалительные цитокины и т.п., и ингибируют прогрессирование неалкогольной жировой болезни печени. Из них противодиабетические средства, как известно, имеют эффект облегчения ожирения печени, а также эффект снижения уровня глюкозы в крови за счет улучшения общих физиопатологических состояний против начала ожирения печени. Однако, поскольку до сих пор ни одно лекарственное средство не одобрено для лечения жировой болезни печени, существует неудовлетворенная медицинская потребность в разработке эффективных терапевтических средств.
Между тем в настоящее время внимание сфокусировано на производных глюкагона. Глюкагон вырабатывается в поджелудочной железе, когда уровень глюкозы в крови начинает падать из-за медикаментозного лечения, заболеваний, дефицита гормонов или ферментов и т.д. Глюкагон стимулирует выделение глюкозы печенью путем расщепления гликогена и служит для повышения уровня глюкозы в крови до нормального уровня. В дополнение к эффекту повышения уровня глюкозы в крови глюкагон, согласно сообщениям, также подавляет аппетит и активирует гормоночувствительную липазу в жировых клетках, способствуя расщеплению жиров, тем самым проявляя эффект против ожирения. В качестве одного из таких производных глюкагона глюкагоноподобный пептид-1 (GLP-1) представляет собой вещество, которое все еще находится в стадии разработки в качестве терапевтического средства для облегчения гипергликемии у пациентов с диабетом, и его действие направлено на промотирование синтеза и секреции инсулина, ингибирование секреции глюкагона, сдерживание опорожнения желудка, облегчение усвоения глюкозы и ингибирование приема пищи. Также известно, что эксендин-4, полученный из яда ящерицы, который имеет приблизительно 50% гомологию аминокислот с GLP-1, служит для активации рецептора GLP-1 для облегчения гипергликемии у пациентов с диабетом. Однако, согласно сообщениям, агонисты рецепторов GLP-1 для лечения ожирения или диабета имеют проблему, поскольку они вызывают побочные эффекты, такие как рвота и тошнота.
В качестве альтернативы GLP-1 в центре внимания оказался оксинтомодулин, который может связываться с рецепторами как GLP-1, так и глюкагона. Оксинтомодулин представляет собой пептид, который происходит из предшественника глюкагона (то есть пре-глюкагона), демонстрирует эффекты подавления приема пищи посредством GLP-1, ингибирования гликонеогенеза в печени для регулирования уровня глюкозы в крови и улучшения насыщения, а также обладает липолитической функцией глюкагона. Поэтому оксинтомодулин имеет высокую вероятность применения в качестве противодиабетического средства и средства против ожирения.
На основе двойной функции пептида оксинтомодулина активно ведутся исследования по разработке лекарственных средств для лечения диабета и ожирения. Например, в зарегистрированном корейском патенте № 925017 раскрыта фармацевтическая композиция для перорального, парентерального, мукозального, ректального, подкожного или чрескожного введения для лечения избыточной массы тела у людей, которая включает оксинтомодулин в качестве активного ингредиента. Однако сообщается, что лекарственное средство от ожирения, включающее оксинтомодулин, имеет короткий период полужизни in vivo и имеет низкий уровень терапевтического эффекта при ожирении даже при приеме трижды в день при высокой дозе.
Между тем, предпринимаются постоянные попытки преодолеть короткий период полужизни терапевтического пептида in vivo, чтобы сохранить высокий уровень фармакологического эффекта в течение длительного периода времени и, соответственно, максимизировать эффект терапевтического средства. Патент США № 7141547 раскрывает слитые белки GLP-1 и его аналогов с альбумином с использованием метода рекомбинантной ДНК, а патент США № 8273854 раскрывает слитые белки GLP-1 и его аналогов с фрагментом иммуноглобулина (Fc). Эти методы частично улучшили короткий период полужизни пептида in vivo, но не лишены проблем, связанных с иммуногенностью, вызываемых введением белков, которые не являются нативными для человеческого организма. Как результат, эти методы имеют недостаток, заключающийся в том, что фармакологический эффект лекарственных средств может уменьшаться, если лекарственные средства вводят в течение длительного периода времени. Кроме того, существуют дополнительные проблемы, поскольку требуются крупномасштабные системы культивирования клеток и очистки для производства лекарственных препаратов, и может быть трудно контролировать качество лекарственных средств, поскольку лекарственные средства могут содержать примеси, происходящие из клеток-хозяев, в зависимости от природы рекомбинантных белков, и могут не быть абсолютно одинаковыми для каждой партии. Кроме того, использование пептида, содержащего дисульфидную связь, такого как кальцитонин, имеет такой недостаток, что выход может быть снижен из-за неправильной укладки. Кроме того, трудно получить лекарственное средство способом получения рекомбинантного белка, когда он имеет неприродные аминокислотные остатки.
Между тем, в патенте США № 8110665 раскрыт пептид, короткий период полужизни которого увеличивают путем получения конъюгата с использованием непептидного полимера и фрагмента иммуноглобулина (Fc). Однако в этом патенте описан сложный способ получения, который включает получение биологически активного пептида, непептидного полимера и фрагмента иммуноглобулина по отдельности, а также объединение пептида, полимера и фрагмента иммуноглобулина вместе, что создает такие проблемы, как остаточные побочные продукты и уменьшенный выход.
Между тем, ПЭГилирование терапевтических пептидов и белков является наиболее эффективным фармацевтическим методом для увеличения периода полужизни in vivo. ПЭГилирование пептидов и белков служит для увеличения их молекулярной массы, защиты протеолитического сайта и маскировки иммуногенного сайта, что приводит к увеличению периода полужизни лекарственных средств in vivo и снижению иммуногенности пептидов и белков. Поэтому метод ПЭГилирования эффективен для усиления терапевтического эффекта за счет решения проблем, связанных с пептидными лекарственными средствами. Благодаря этим преимуществам, ПЭГилирование пептидов и белков играет важную роль в усилении терапевтического эффекта в системе доставки лекарственного средства.
Однако метод с использованием ПЭГ имеет недостатки, поскольку ПЭГилирование снижает активность пептидных лекарственных средств и дает низкий выход из-за плохой реактивности в отношении пептидов с увеличивающейся молекулярной массой ПЭГ. В связи с этим существует необходимость в способе ПЭГилирования с использованием простого производственного процесса и реакции с высокой селективностью.
Поэтому существует потребность в терапевтическом средстве для лечения ожирения, диабета или неалкогольной жировой болезни печени, которое имеет эффекты снижения потребления пищи, усиления секреции инсулина, сдерживания опорожнения желудка, стимулирования липолиза и снижения уровня триглицеридов без каких-либо побочных эффектов, таких как рвота или тошнота, и которое может быть получено с высоким выходом за счет оптимизации способа получения.
[Документы предшествующего уровня техники]
[Патентные документы]
Патентный документ 1: Зарегистрированный корейский патент № 0925017, озаглавленный “Oxyntomodulin for Preventing or Treating Excess Weight”
Патентный документ 2: Зарегистрированный патент США № 7141547, озаглавленный “Albumin Fusion Proteins Comprising GLP-1 Polypeptides”
Патентный документ 3: Зарегистрированный патент США № 8273854, озаглавленный “GLP-1 Analog Fusion Proteins”
Патентный документ 4: Зарегистрированный патент США № 8110665, озаглавленный “Pharmaceutical Composition Comprising an Immunoglobulin FC Region as a Carrier”
Патентный документ 5: Зарегистрированный корейский патент № 1665009, озаглавленный “Pharmaceutical Composition for Preventing or Treating Non-alcoholic Fatty Liver Diseases”
Раскрытие изобретения
Техническая задача
Для решения указанных выше задач авторами настоящего изобретения были осуществлены исследования и предприняты попытки разработать терапевтическое средство для лечения ожирения, диабета или неалкогольной жировой болезни печени, которое является безопасным, а также обладает эффектами уменьшения потребления пищи, повышения секреции инсулина, сдерживания опорожнения желудка, промотирования липолиза и снижения уровня триглицеридов без каких-либо побочных эффектов, таких как рвота или тошнота, а также разработать способ получения терапевтического средства с высоким выходом и получения полипептида, имеющего аминокислотную последовательность, представленную следующей общей формулой 1. В результате, авторы настоящего изобретения подтвердили, что композиция, включающая полипептид, обладает отличным эффектом профилактики или лечения ожирения, диабета или неалкогольной жировой болезни печени, и сайт-специфический конъюгат с полипептидом и непептидным полимером обладает превосходным эффектом профилактики или лечения ожирения, диабета или неалкогольной жировой болезни печени путем повышения периода полужизни в крови с поддержанием при этом активности полипептида in vivo, создав, таким образом, настоящее изобретение.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидроксиимидазопропионил, 4-имидазоацетил или бета-карбокси-имидазопропионил;
X1 представляет собой делецию, глицин или аминоизомасляную кислоту (Aib);
R2 представляет собой EKRAK, EQAAK или EEAVK; и
R3 представляет собой делецию, цистеин, лизин или метионин.
Поэтому, целью настоящего изобретения является получение фармацевтической композиции, включающей полипептид, для профилактики или лечения ожирения, диабета или неалкогольной жировой болезни печени.
Решение задачи
Для решения указанных выше задач фармацевтическая композиция в соответствии с одним иллюстративным вариантом осуществления настоящего изобретения включает полипептид, имеющий аминокислотную последовательность, представленную следующей общей формулой 1.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазопропионил; X1 представляет собой делецию, глицин или аминоизомасляную кислоту (Aib); R2 представляет собой EKRAK, EQAAK или EEAVK; и R3 представляет собой делецию, цистеин, лизин или метионин.
Полипептид может быть ковалентно связан или может образовывать микросферы с любым одним или более, выбранными из группы, состоящей из непептидного полимера, жирной кислоты, холестерина, антитела, фрагмента антитела, альбумина и его фрагмента, нуклеотида, фибронектина, трансферрина, FcRn-связывающего вещества, сахарида, эластина, гепарина и их производных.
R2 включает глутаминовую кислоту (E) и лизин (K), и глутаминовая кислота и лизин могут быть взяты вместе с образованием кольца через амидную связь, что может способствовать альфа-спиральной структуре полипептида.
Непептидный полимер может быть выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), полипропиленгликоля, coполимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта (PVA), полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты (PLA), полимолочной-гликолевой кислоты (PLGA), липидного полимера, хитина, гиалуроновой кислоты и их комбинации. Производные непептидного полимера известны из соответствующего уровня техники, и другие производные, которые легко можно получить при техническом уровне предшествующего уровня техники, также охватываются объемом настоящего изобретения.
Предпочтительно, непептидный полимер может представлять собой полиэтиленгликоль или его производное.
Непептидный полимер может иметь молекулярную массу 3000-100000 Да.
В этом случае производное полиэтиленгликоля может представлять собой по меньшей мере одно, выбранное из группы, состоящей из метоксиполиэтиленгликоля, метоксиполиэтиленгликоль-N-гидроксисукцинимида, метоксиполиэтиленгликоль-пропиональдегида, метоксиполиэтиленгликоль-малеимида, полиэтиленгликоль-сукцинимидилпропионата (ПЭГ-сукцинимидилпропионат), метоксиполиэтиленгликоль-сукцинимидилпропионата (метокси-ПЭГ-сукцинимидилпропионат), полиэтиленгликоль-сукцинимидилпропионата акрилата (ПЭГ-сукцинимидилпропионата акрилат), тиол-полиэтиленгликоль-сукцинимидилпропионата (тиол-ПЭГ-сукцинимидилпропионат), гидроксисукцинимидил-полиэтиленгликоля (гидроксисукцинимидил-ПЭГ), сукцинимидилкарбоксиметилового эфира метоксиполиэтиленгликоля (сукцинимидилкарбоксиметиловый эфир мПЭГ), сукцинимидилкарбоксиметилового эфира полиэтиленгликоля акрилата (сукцинимидилкарбоксиметиловый эфир ПЭГ акрилат), полиэтиленгликоль-сукцинимидилкарбоната (ПЭГ-сукцинимидилкарбонат), полиэтиленгликоль-пропиональдегида (ПЭГ-пропиональдегид), полиэтиленгликоль-бутилальдегида (ПЭГ-бутилальдегид), их производных и мультиразветвленных форм их производных.
Полиэтиленгликоль или его производное может быть линейным или разветвленным.
Фармацевтическую композицию можно использовать для профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени.
Неалкогольная жировая болезнь печени может включать одно или более заболеваний, выбранных из группы, состоящей из неалкогольного ожирения печени, неалкогольного стеатогепатита, цирроза печени и рака печени.
Способ получения фармацевтической композиции в соответствии с другим иллюстративным вариантом осуществления настоящего изобретения включает смешивание непептидного полимера с полипептидом, имеющим аминокислотную последовательность, представленную следующей общей формулой 1, для взаимодействия друг с другом.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазо-пропионил; X1 представляет собой делецию, глицин или аминоизомасляную кислоту (Aib); R2 представляет собой EKRAK, EQAAK или EEAVK; и R3 представляет собой делецию, цистеин, лизин или метионин.
Непептидный полимер может быть выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), полипропиленгликоля, coполимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта (PVA), полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты (PLA), полимолочной-гликолевой кислоты (PLGA), липидного полимера, хитина, гиалуроновой кислоты и их комбинации. Производные непептидного полимера, известные в данной области техники, и другие производные, которые легко можно получить при техническом уровне предшествующего уровня техники, также охватываются объемом настоящего изобретения.
Предпочтительно, непептидный полимер может представлять собой полиэтиленгликоль или его производное.
В этом случае производное полиэтиленгликоля может представлять собой по меньшей мере одно производное, выбранное из группы, состоящей из метоксиполиэтиленгликоля, метоксиполиэтиленгликоль-N-гидроксисукцинимида, метоксиполиэтиленгликоль-пропиональдегида, метоксиполиэтиленгликоль-малеимида, полиэтиленгликоль-сукцинимидилпропионата (ПЭГ-сукцинимидилпропионат), метоксиполиэтиленгликоль-сукцинимидилпропионата (метокси-ПЭГ-сукцинимидилпропионат), полиэтиленгликоль-сукцинимидилпропионата акрилата (ПЭГ-сукцинимидилпропионата акрилат), тиол-полиэтиленгликоль-сукцинимидилпропионата (тиол-ПЭГ-сукцинимидилпропионат), гидроксисукцинимидил-полиэтиленгликоля (гидроксисукцинимидил-ПЭГ), сукцинимидилкарбоксиметилового эфира метоксиполиэтиленгликоля (сукцинимидилкарбоксиметиловый эфир мПЭГ), сукцинимидилкарбоксиметилового эфира полиэтиленгликоля акрилата (сукцинимидилкарбоксиметиловый эфир ПЭГ акрилат), полиэтиленгликоль-сукцинимидилкарбоната (ПЭГ-сукцинимидилкарбонат), полиэтиленгликоль-пропиональдегида (ПЭГ-пропиональдегид), полиэтиленгликоль-бутилальдегида (ПЭГ-бутилальдегид), их производных и мультиразветвленных форм их производных.
Смешивание непептидного полимера с полипептидом для их взаимодействия друг с другом может включать обеспечение возможности взаимодействия полипептида и непептидного полимера при молярном соотношении от 1:1 до 1:5.
Смешивание непептидного полимера с полипептидом для взаимодействия друг с другом можно осуществить при pH 4,0-9,0.
При смешивании непептидного полимера с полипептидом для их взаимодействия друг с другом время реакции может находиться в пределах от 0,5 до 24 часов.
Фармацевтическую композицию можно использовать для профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени.
Неалкогольная жировая болезнь печени может включать одно или более заболеваний, выбранных из группы, состоящей из неалкогольного ожирения печени, неалкогольного стеатогепатита, цирроза печени и рака печени.
Способ профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени, в соответствии с другим иллюстративным вариантом осуществления настоящего изобретения включает введение фармацевтической композиции субъекту.
Полезные эффекты изобретения
Фармацевтическая композиция в соответствии с настоящим изобретением может включать полипептид, и таким образом, обладать эффектами уменьшения потребления пищи, повышения секреции инсулина, сдерживания опорожнения желудка, промотирования липолиза и снижения уровня триглицеридов.
Также фармацевтическая композиция в соответствии с настоящим изобретением может включать полипептид, и таким образом, может снижать побочные эффекты, такие как рвота или тошнота, и т.п.
Кроме того, фармацевтическая композиция в соответствии с настоящим изобретением может включать непептидный полимер, который является высокоселективным и реактивным с полипептидом, и таким образом, может быть получена с высоким выходом.
Кроме того, фармацевтическая композиция в соответствии с настоящим изобретением может включать конъюгат, включающий полипептид и непептидный полимер, и таким образом, может иметь продолжительный период полужизни in vivo и высокий терапевтический эффект на ожирение даже при введении при низкой дозе, а также может обладать эффектами снижения уровня глюкозы в крови, чтобы глюкозу в крови можно было поддерживать таким образом на нормальном уровне, и эффективного снижения уровня триглицеридов.
Краткое описание чертежей
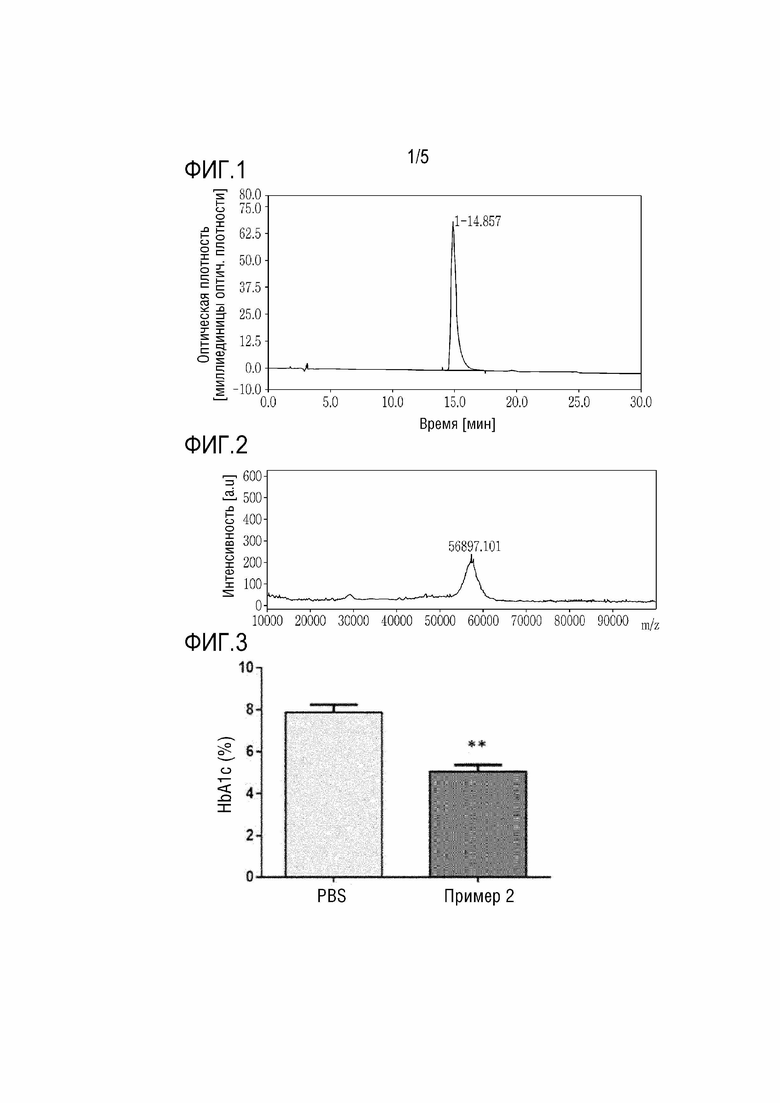
Фиг. 1 показывает результаты ВЭЖХ анализа конъюгата Примера 2, включающего полипептид и непептидный полимер.
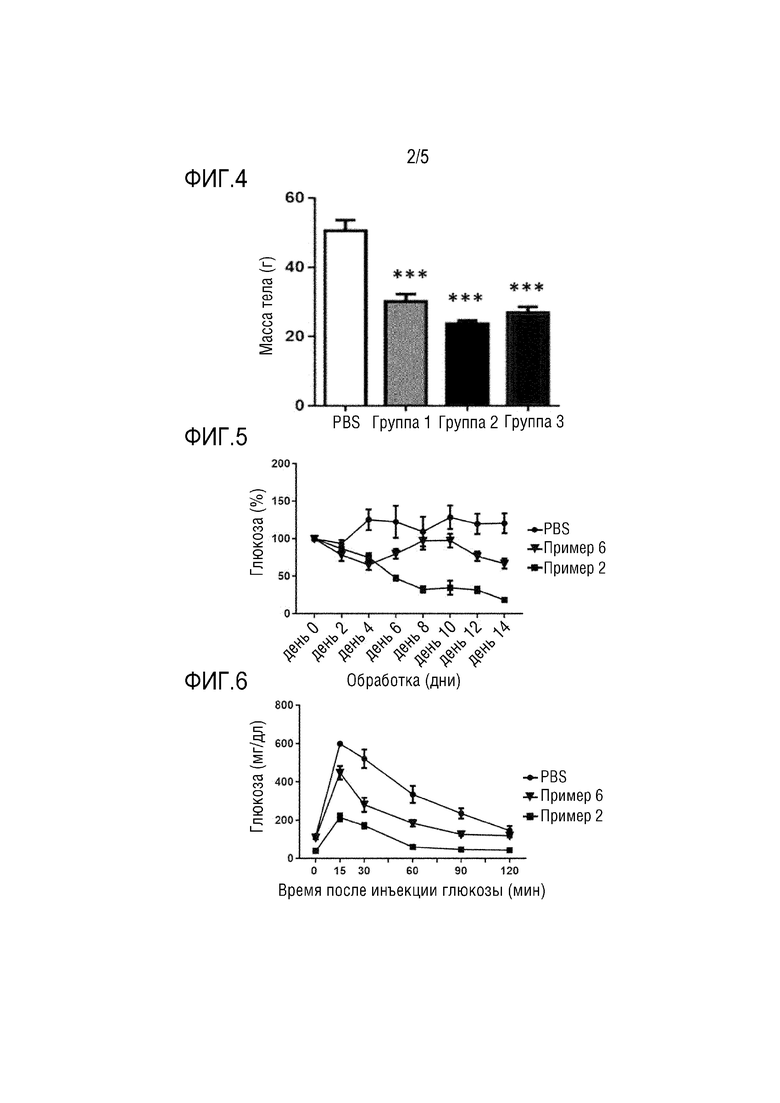
Фиг. 2 показывает результаты MALDI-TOF (времяпролетная масс-спектрометрия с матрично-активированной лазерной десорбцией/ионизацией) анализа конъюгата Примера 2, включающего полипептид и непептидный полимер.
Фиг. 3 показывает результаты измерения уровня гликированного гемоглобина (HbA1c) после окончания лечения конъюгатом Примера 2 для определения степени изменения долгосрочной средней концентрации глюкозы в крови (** p < 0,01).
Фиг. 4 показывает результаты измерения конечной массы тела мышей после лечения конъюгатом Примера 2 в течение двух недель с разной частотой введения (*** p < 0,001).
Фиг. 5 показывает результаты изменений уровня глюкозы в крови у мышей после введения конъюгата Примера 2 или 6.
Фиг. 6 показывает результаты интраперитонеального теста переносимости глюкозы (ipGTT) после введения конъюгата Примера 2 или 6.
Фиг. 7 показывает результаты измерения изменений сывороточного холестерин после введения конъюгата Примера 2.
Фиг. 8 показывает результаты измерения изменений массы печени после введения конъюгата Примера 2.
Фиг. 9 показывает результаты наблюдения тканей печени мышей после введения конъюгата Примера 2 (более темно окрашенная область представляет собой нормальную ткань печени, белая (ярко)-окрашенная область представляет собой жировую каплю).
Фиг. 10 показывает результаты измерения изменений сывороточного холестерина после введения конъюгата Примера 2.
Фиг. 11 показывает результаты измерения изменений массы печени после введения конъюгата Примера 2.
Фиг. 12 показывает результаты измерения изменений уровней триглицеридов в печени после введения конъюгата Примера 2.
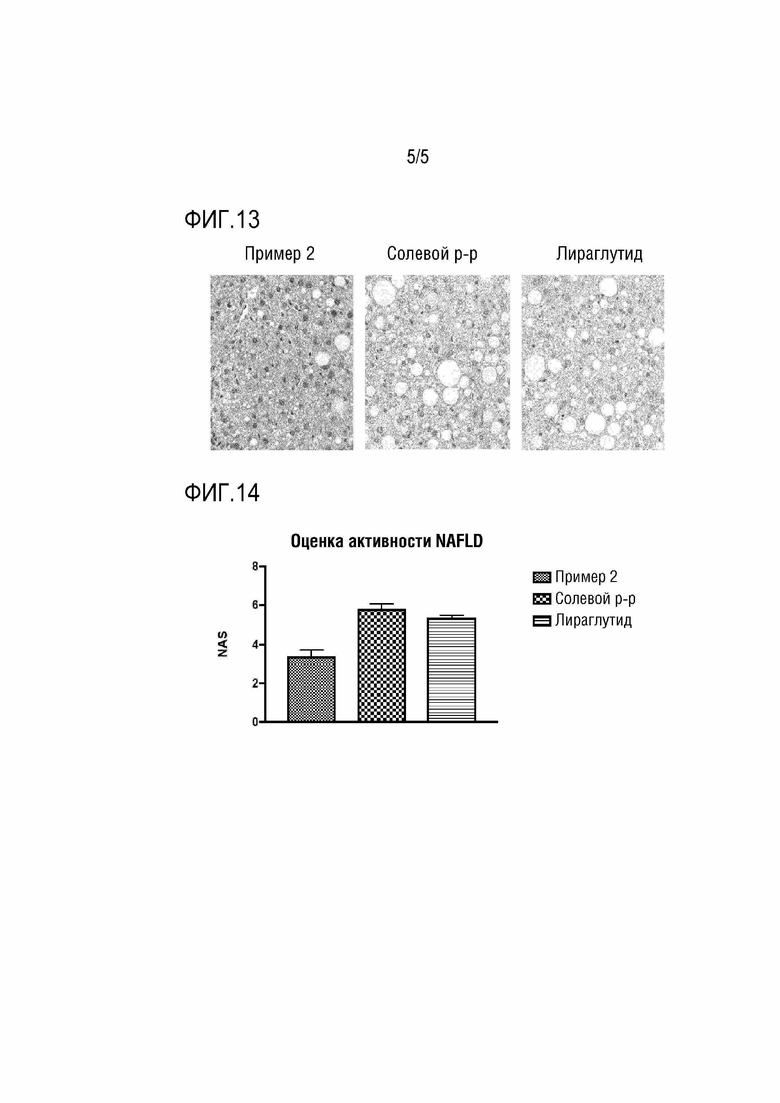
Фиг. 13 показывает результаты наблюдения тканей печени мышей после введения конъюгата Примера 2 (более темно окрашенная область представляет собой нормальную ткань печени, а белая (ярко)-окрашенная область представляет собой жировую каплю).
Фиг. 14 показывает результаты определения оценок NAFLD активности (NAS) после введения конъюгата Примера 2.
Лучший способ осуществления изобретения
Настоящее изобретение относится к полипептиду, имеющему аминокислотную последовательность, представленную следующей общей формулой 1.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазо-пропионил;
X1 представляет собой делецию, глицин или аминоизомасляную кислот (Aib);
R2 представляет собой EKRAK, EQAAK или EEAVK; и
R3 представляет собой делецию, цистеин, лизин или метионин.
Настоящее изобретение относится к полипептиду, имеющему аминокислотную последовательность, представленную следующей общей формулой 1, для применения в профилактике или лечении заболевания, выбранного из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазо-пропионил;
X1 представляет собой делецию, глицин или аминоизомасляную кислот (Aib);
R2 представляет собой EKRAK, EQAAK или EEAVK; и
R3 представляет собой делецию, цистеин, лизин или метионин.
Настоящее изобретение относится к фармацевтической композиции, которая включает полипептид, имеющий аминокислотную последовательность, представленную следующей общей формулой 1.
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазо-пропионил;
X1 представляет собой делецию, глицин или аминоизомасляную кислот (Aib);
R2 представляет собой EKRAK, EQAAK или EEAVK; и
R3 представляет собой делецию, цистеин, лизин или метионин.
Настоящее изобретение относится к фармацевтической композиции, включающей полипептид, имеющий аминокислотную последовательность, представленную общей формулой 1, выше, для профилактики или лечения заболевания, выбранного из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени.
Аминокислоты, указанные в настоящей заявке, сокращенно указаны в соответствии с номенклатурой IUPAC-IUB, как показано в следующей Таблице 1.
В общей формуле 1, R1 представляет собой предпочтительно гистидин на N-конце полипептида, но настоящее изобретение не ограничивается этим.
X1 предпочтительно представляет собой глицин или Aib, более предпочтительно Aib. В этом случае X1 конкретно не ограничивается, при условии, что он может повышать химическую стабильность полипептида.
Также X1 является предпочтительным, если он может иметь резистентность к дипептидилпептидазе-4 (DPP-4), повышая таким образом стабильность фермента.
R2 представляет собой предпочтительно EQAAK или EEAVK, более предпочтительно EQAAK, но настоящее изобретение не ограничивается этим.
R2 включает глутаминовую кислоту (E) и лизин (K), и глутаминовая кислота и лизин предпочтительно взяты вместе с образованием кольца через амидную связь, но настоящее изобретение не ограничивается этим. Таким образом, когда два остатка в аминокислотной последовательности полипептида образуют ковалентное кольцо через амидную связь, ковалентное кольцо может повышать стабильность in vivo и улучшать способность к связыванию с рецептором глюкагона или рецептором производного глюкагона. Также ковалентное кольцо может способствовать альфа-спиральной структуре полипептида.
R3 представляет собой C-конец полипептида, который может связываться с веществом для повышения периода полужизни in vivo или устойчивости in vivo. В этом случае R3 предпочтительно представляет собой цистеин, но настоящее изобретение не ограничивается этим.
Полипептид может иметь 70%-90% гомологию последовательности с аминокислотной последовательностью, представленной в SEQ ID NO. 1 (SEQ ID NO. 1: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT).
При этом, согласно сообщениям, аминокислотная последовательность, представленная в SEQ ID NO. 1, идентична части или всей аминокислотной последовательности природного глюкагона, а природный глюкагон промотирует разложение гликогена и инсулина и демонстрирует эффект против ожирения. Однако применение природного глюкагона в качестве терапевтического средства ограничено из-за низкой растворимости и его осаждения при нейтральном pH.
Таким образом, полипептид, включающий аминокислотную последовательность, имеющую 70%-90% гомологию последовательности с аминокислотной последовательностью, представленной в SEQ ID NO. 1, может представлять собой производное глюкагона или производное оксинтомодулина. В этом случае производное оксинтомодулина представляет собой пептид, который получен из предшественника глюкагона (например, преглюкагон).
Предпочтительно, полипептид может иметь 73%-90%, более предпочтительно 75%-90% гомологию последовательности с аминокислотной последовательностью, представленной в SEQ ID NO. 1, но настоящее изобретение не ограничивается этим.
В настоящем описании термин “гомология” относится к степени сходства с аминокислотной последовательностью дикого типа и последовательностью нуклеиновой кислоты дикого типа. В этом случае сравнение гомологии между этими последовательностями осуществляют с использованием доступной программы сравнения. Можно использовать коммерчески доступную компьютерную программу для расчета гомологии между двумя или более последовательностями в процентах (%). Гомологию (%) можно рассчитать для смежных последовательностей. Можно обеспечить большое количество пептида путем вставки полинуклеотида, кодирующего пептид, в вектор и экспрессии пептида.
В настоящем описании термин “пептид” относится к соединению, в котором две или более α-аминокислот связаны через пептидную связь.
При этом полипептид может быть ковалентно связан или может образовывать микросферы с любым одним или более, выбранными из группы, состоящей из непептидного полимера, жирной кислоты, холестерина, антитела, фрагмента антитела, альбумина и его фрагмента, нуклеотида, фибронектина, трансферрина, FcRn-связывающего вещества, сахарида, эластина, гепарина и их производных.
Предпочтительно, непептидный полимер ковалентно связан с полипептидом, но настоящее изобретение не ограничивается этим.
Полипептид ковалентно связывается или образует микросферы с указанными выше веществами и, таким образом, обладает эффектами повышения стабильности в крови, замедления выделения лекарственного средства в почку и индукции изменений сродства к рецепторам.
Полипептид может повышать период полужизни in vivo и увеличивать время удерживания in vivo, когда полипептид ковалентно связан с непептидным полимером. В этом случае сайт связывания между непептидным полимером и полипептидом может варьироваться в зависимости от функциональной группы непептидного полимера и аминокислотной последовательности полипептида. Предпочтительно, сайт связывания конкретно не ограничивается, при условии, что непептидный полимер полимеризован с C-концом полипептида, или его можно получить с высоким выходом благодаря высокой скорости реакции.
Когда непептидный полимер связывают с полипептидом, непептидный полимер, имеющий малеимидную группу, можно связывать с полипептидом с использованием сульфгидрильной(-SH) группы C-концевого цистеина полипептида, или непептидный полимер, имеющий сукцинимидное производное, можно связывать с полипептидом с использованием амино группы лизина (K) полипептида.
Непептидный полимер может быть выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), полипропиленгликоля, coполимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта (PVA), полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты (PLA), полимолочной-гликолевой кислоты (PLGA), липидного полимера, хитина, гиалуроновой кислоты и их комбинаци. Предпочтительно непептидный полимер представляет собой полиэтиленгликоль или его производное, но настоящее изобретение не ограничивается этим. Производные непептидного полимера, известные в данной области техники, и другие производные, которые легко можно получить при техническом уровне предшествующего уровня техники, также охватываются объемом настоящего изобретения.
Производное полиэтиленгликоля может представлять собой по меньшей мере одно производное, выбранное из группы, состоящей из метоксиполиэтиленгликоля, метоксиполиэтиленгликоль-N-гидроксисукцинимида, метоксиполиэтиленгликоль-пропиональдегида, метоксиполиэтиленгликоль-малеимида, полиэтиленгликоль-сукцинимидилпропионата (ПЭГ-сукцинимидилпропионат), метоксиполиэтиленгликоль-сукцинимидилпропионата (метокси-ПЭГ-сукцинимидилпропионат), полиэтиленгликоль-сукцинимидилпропионата акрилата (ПЭГ-сукцинимидилпропионата акрилат), тиол-полиэтиленгликоль-сукцинимидилпропионата (тиол-ПЭГ-сукцинимидилпропионат), гидроксисукцинимидил-полиэтиленгликоля (гидроксисукцинимидил-ПЭГ), сукцинимидилкарбоксиметилового эфира метоксиполиэтиленгликоля (сукцинимидилкарбоксиметиловый эфир мПЭГ), сукцинимидилкарбоксиметилового эфира полиэтиленгликоля акрилата (сукцинимидилкарбоксиметиловый эфир ПЭГ акрилат), полиэтиленгликоль-сукцинимидилкарбоната (ПЭГ-сукцинимидилкарбонат), полиэтиленгликоль-пропиональдегида (ПЭГ-пропиональдегид), полиэтиленгликоль-бутилальдегида (ПЭГ-бутилальдегид), их производных и мультиразветвленных форм их производных. Предпочтительно, производное полиэтиленгликоля представляет собой линейный метоксиполиэтиленгликоль-малеимид, диразветвленный метоксиполиэтиленгликоль-малеимид или триразветвленный метоксиполиэтиленгликоль-малеимид, более предпочтительно триразветвленный метоксиполиэтиленгликоль-малеимид.
Полиэтиленгликоль или его производное, который можно использовать в настоящей заявке, является линейным или разветвленным, предпочтительно диразветвленным или триразветвленным, и более предпочтительно триразветвленным.
Непептидный полимер может иметь молекулярную массу 3000-100000 Да, предпочтительно 20000-70000 Да и более предпочтительно 40000-60000 Да. Когда непептидный полимер имеет молекулярную массу в этом молекулярно-массовом диапазоне, непептидный полимер может связываться с полипептидом для повышения растворимости получаемого конъюгата и увеличения времени удерживания конъюгата in vivo.
Поэтому фармацевтическая композиция в соответствии с настоящим изобретением включает конъюгат, содержащий непептидный полимер, связанный с полипептидом, и, таким образом, может повышать стабильность in vivo и увеличивать период полужизни in vivo.
Также фармацевтическая композиция в соответствии с настоящим изобретением включает конъюгат, включающий полипептид, или включающий полипептид и непептидный полимер, и таким образом, может использоваться в фармацевтической композиции для профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени.
Также фармацевтическую композицию, включающую конъюгат, который включает полипептид или включает полипептид и непептидный полимер, в соответствии с настоящим изобретением можно использовать в фармацевтической композиции для профилактики или лечения заболеваний, причиной которых является недостаточная секреция инсулина или пониженная чувствительность к инсулину.
Заболевания, причиной которых является недостаточная секреция инсулина или пониженная чувствительность к инсулину, могут включать диабет I типа, диабет II типа и диабетические осложнения.
Также фармацевтическую композицию, включающую конъюгат, который включает полипептид или включает полипептид и непептидный полимер, в соответствии с настоящим изобретением можно использовать в качестве фармацевтической композиции для профилактики, облегчения или лечения заболеваний, таких как гиперлипидемия, сердечно-сосудистые заболевания, артериосклероз и липид-связанные метаболические синдромы.
Также фармацевтическую композицию, включающую конъюгат, который включает полипептид или включает полипептид и непептидный полимер, в соответствии с настоящим изобретением можно использовать в качестве фармацевтической композиции для профилактики, облегчения или лечения заболеваний печени, таких как рак печени, цирроз печени, неалкогольный стеатогепатит и неалкогольное ожирение печени.
Когда композицию по настоящему изобретению используют в качестве лекарственного средства, фармацевтическая композиция, включающая полипептид, может быть сформулирована в виде следующих различных лекарственных форм для перорального или парентерального введения, которые затем вводят клинически, но настоящее изобретение этим не ограничивается.
Лекарственные формы для перорального введения включают, например, таблетки, пилюли, твердые/мягкие капсулы, растворы, суспензии, эмульсии, сиропы, гранулы, эликсиры, пастилки и т.п. В дополнение к активному ингредиенту эти композиции содержат разбавители (например, лактозу, декстрозу, сахарозу, маннит, сорбит, целлюлозу и/или глицин), лубриканты (например, диоксид кремния, тальк, стеариновую кислоту и ее магниевые или кальциевые соли, и/или полиэтиленгликоль). Таблетки могут также содержать связующее, такое как силикат магния и алюминия, крахмальная паста, желатин, метилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидин, и могут необязательно содержать разрыхлитель, такой как крахмал, агар, альгиновая кислота или ее натриевые соли, или шипучую смесь и/или абсорбент, краситель, ароматизатор и подсластитель.
Фармацевтическую композицию, включающую полипептид, можно вводить парентерально. В этом случае парентеральное введение осуществляют такими методами, как подкожные, внутривенные, внутримышечные инъекции, интраназальный спрей, введение в полость носа или кишечник через слизистую оболочку, введение путем ингаляции или интраторакальной инъекции.
В этом случае, чтобы получить препарат для парентерального введения, полипептид можно смешать со стабилизатором или буфером для получения раствора или суспензии, которые могут быть получены в виде стандартных дозированных форм для ампул или флаконов. Композиция может быть стерильной и/или может содержать адъюванты, такие как консервант, стабилизатор, увлажняющий агент или агент, способствующий образованию эмульсии, соль и/или буфер для осмотического регулирования и другие терапевтически полезные вещества. В этом случае композицию можно формулировать в соответствии с обычными методами, такими как смешивание, гранулирование или нанесение покрытия.
Количество фармацевтической композиции, включающей полипептид в соответствии с настоящим изобретением, для введения в организм человека, может варьировать в зависимости от возраста, массы тела, пола, способа введения, состояния здоровья и тяжести заболевания пациента. Например, фармацевтическую композицию можно вводить пероральным или парентеральным путем введения в дозе от 0,001 до 200 мг/кг/день по усмотрению врача или фармацевта.
Настоящее изобретение также относится к способу получения фармацевтической композиции, включающей конъюгат, который включает полипептид и непептидный полимер.
Прежде всего, в способе получения фармацевтической композиции полипептид имеет аминокислотную последовательность, представленную общей формулой 1, как описано выше. Кроме того, непептидный полимер описан выше, поэтому подробное описание полипептида и непептидного полимера будет опущено.
Более конкретно, способ получения фармацевтической композиции включает смешивание непептидного полимера с полипептидом для их взаимодействия друг с другом. В этом случае полипептид и непептидный полимер могут взаимодействовать при молярном соотношении от 1:1 до 1:5, таким образом, полипептид и непептидный полимер могут связываться друг с другом при молярном соотношении 1:1. В этом случае смешивание предпочтительно осуществляют при молярном соотношении от 1:1 до 1:2 и более предпочтительно при молярном соотношении 1:1,2, но настоящее изобретение не ограничивается этим. Когда смешивание осуществляют в этих пределах молярного соотношениия, конъюгат можно получить с высоким выходом, что делает возможным получение конъюгата, включающего полипептид и непептидный полимер, с высокой чистотой.
В соответствии с одним иллюстративным вариантом осуществления настоящего изобретения, конъюгат также можно получить путем ковалентного связывания непептидного полимера с C-концом полипептида. Например, конъюгат также можно получить с высокой реактивностью с использованием, в качестве непептидного полимера, метоксиполиэтиленгликоля, имеющего малеимидную группу, и с использованием, в качестве полипептида, полипептида, имеющего цистеин на его C-конце, и, таким образом, можно получить высокий выход и увеличенный период полужизни в крови.
Смешивание непептидного полимера с полипептидом для их взаимодействия друг с другом можно осуществить при pH 4,0-9,0, предпочтительно при pH 5,5-7,5, но настоящее изобретение не ограничивается этим. Когда смешивание осуществляют вне этого диапазона pH, выход может уменьшаться. Например, когда в качестве непептидного полимера используют метоксиполиэтиленгликоль, имеющий малеимидную группу, а в качестве полипептида используют полипептид, имеющий цистеин на его C-конце, смешивание предпочтительно осуществляют при pH 6-8. Когда полипептид и метоксиполиэтиленгликоль взаимодействуют в этом диапазоне pH, побочные реакции, такие как раскрытие кольца для малеимида, могут подавляться без побочных реакций, вызываемых амино группой полипептида.
Поскольку выход конъюгата составляет 85-95% при смешивании непептидного полимера с полипептидом для их взаимодействия друг с другом, этот способ будет рентабельным благодаря очень высокому выходу и будет высоковоспроизводимым. Поэтому этот способ будет эффективно использоваться для получения лекарственных средств.
При смешивании непептидного полимера с полипептидом для их взаимодействия друг с другом время реакции может составлять от 0,5 до 24 часов или от 1 до 24 часов, и предпочтительно составляет 2 часа, но настоящее изобретение не ограничивается этим. Когда время реакции меньше чем 0,5 часа, выход будет снижаться и чистота будет снижаться. С другой стороны, когда время реакции больше 24 часов, полипептид может разлагаться или экономические эффекты могут снижаться из-за длительного времени переработки.
Также при смешивании непептидного полимера с полипептидом для их взаимодействия друг с другом температура может составлять 0-10°C, предпочтительно 4-40°C, но настоящее изобретение не ограничивается этим. Также температура конкретно не ограничивается, при условии отсутствия химических изменений полипептида или непептидного полимера.
При смешивании непептидного полимера с полипептидом для их взаимодействия друг с другом каждый из полипептида и непептидного полимера можно растворить с использованием одинаковых или разных растворителей. Предпочтительно растворитель представляет собой буферный раствор, спирт, диметилсульфоксид (DMSO) или их смесь, но настоящее изобретение не ограничивается этим. Также растворитель включает растворители, которые легко можно использовать в данной обьласти техники.
Настоящее изобретение относится к способу профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени, который включает введение субъекту фармацевтической композиции, включающей полипептид.
Настоящее изобретение также относится к способу профилактики или лечения одного или более заболеваний, выбранных из группы, состоящей из ожирения, диабета и неалкогольной жировой болезни печени, который включает введение субъекту фармацевтической композиции, включающей полипептид.
Способ осуществления изобретения
Далее настоящее изобретение будет подробно описано со ссылкой на прилагаемые чертежи, чтобы специалист в области техники, к которой относится настоящее изобретение, мог легко осуществить изобретение на практике. Однако должно быть понятно, что настоящее изобретение может быть осуществлено в различных формах, но не предполагает ограничения в этом контексте. По всему описанию одинаковые ссылочные позиции относятся к одинаковым элементам.
Пример 1
Полипептид, в который был введен цистеин (молекулярная масса: 3,509 Да; SEQ ID NO. 2:
H(Aib)QGTFTSDYSKYLDEQAAKEFVQWLMNTC).
Остатки, подчеркнутые и выделенные жирным шрифтом в аминокислотной последовательности SEQ ID NO. 2, означают, что ковалентное кольцо образовано между этими остатками.
Пример получения 1: Синтез конъюгата, включающего полипептид и непептидный полимер
Для получения конъюгата, включающего полипептид и непептидный полимер, в качестве полипептида использовали полипептид, в который был введен цистеин в C-концевую область (в положение 30) (молекулярная масса(MW): 3509 Да; SEQ ID NO. 2: H(Aib)QGTFTSDYSKYLDEQAAKEFVQWLMNTC).
При этом, малеимид-активированный монометокси ПЭГ (мПЭГ-MAL, NOF (Japan)) использовали в качестве непептидного полимера, как показано в следующей Таблице 2.
Для получения конъюгатов Примеров 2-7 полипептиды получали, как показано в следующей Таблице 2. В этом случае каждый из полипептидов растворяли в диметилсульфоксиде (DMSO), а мПЭГ-MAL растворяли в 50 мМ фосфатно-солевом буферном растворе (pH 6).
H(Aib)QGTFTSDYSKYLDEQAAKEFVQWLMNTC
(SEQ ID NO. 2)
H(Aib)QGTFTSDYSKYLDEQAAKEFVQWLMNTC
(SEQ ID NO. 2)
H(Aib)QGTFTSDYSKYLDEQAAKEFVQWLMNTC
(SEQ ID NO. 2)
HGQGTFTSDYSKYLDEKRAKEFVQWLMNTC
(SEQ ID NO. 3)
H(Aib)QGTFTSDYSKYLDEEAVKEFVQWLMNTC
(SEQ ID NO. 4)
HGQGTFTSDYSKYLDEEAVKEFVQWLMNTC
(SEQ ID NO. 5)
В аминокислотных последовательностях SEQ ID NO. 2-4, как показано в Таблице 2, два остатка, подчеркнутые и выделенные жирным шрифтом, относятся к остаткам, имеющим ковалентное кольцо, образованное между ними.
Полипептид и непептидный конъюгат смешивали в молярном соотношении 1:1,2 и осуществляли взаимодействие при комнатной температуре в течение 2 часов. После завершения реакции реакционный раствор разделяли ионообменной хроматографией с использованием колонки TSK SP-5PW (7,5 × 75 мм, Tosoh, Japan) при скорости потока 0,8 мл/мин. Разделение отслеживали при УФ длине волны 280 нм. ПЭГилированный полипептид разделяли с использованием метода линейного градиента с использованием в качестве подвижных фаз 20 мМ ацетатного буферного раствора (pH 4) (подвижная фаза A) и 1 M раствора хлорида натрия (в 20 мМ ацетатного буферного раствора (pH 4)) (подвижная фаза B). ВЭЖХ осуществляли для оценки чистоты ПЭГилированного полипептида (см. Фиг. 1). Затем измеряли молекулярную массу ПЭГилированного полипептида с использованием масс-спектрометра MALDI-TOF (см. Фиг. 2). Также на основании хроматограммы, полученной в процессе хроматографического разделения, рассчитывали выходы конъюгатов Примеров 2-7 как отношения площадей конъюгатов по отношению к полипептиду. Результаты представлены в Таблице 3.
Как показано в Таблице 3, было подтверждено, что конъюгаты были получены с выходом 90% или больше. Поэтому способ получения фармацевтической композиции в соответствии с настоящим изобретением обладает преимуществом, заключающимся в том, что этот способ можно эффективно использовать для получения терапевтического средства, поскольку конъюгаты получают с высоким выходом благодаря высокой реактивности с пептидами, и способ является рентабельным и высоковоспроизводимым благодаря простым процедурам получения.
Экспериментальный Пример 1: Измерение активности Примера 2 in vitro
Для проверки профилактического или терапевтического эффекта конъюгата Примера 2 на ожирение, диабет и неалкогольную жировую болезнь печени этот эксперимент осуществляли с использованием клеточной линии, экспрессирующей рецептор GLP-1 (производное глюкагона) и рецептор глюкагона (GCGR).
Для определения активности в отношении рецептора GLP-1 клетки HEK293/CRE-Luc, экспрессирующие человеческий глюкагоновый GLP-1 рецептор, закупали у GenScript и использовали. Клетки высевали в 96-луночный планшет при 5 × 104 клеток/лунка и каждую из лунок затем обрабатывали полипептидом Примера 1 (0,001-300 нМ), конъюгатом Примера 2 (0,001-300 нМ), природным глюкагоном (SEQ ID NO. 1: HSQGTFTSDYSKYLDSRRAQDFVQWLMNT, 0,013-300 нМ) и GLP-1 (SEQ ID NO. 6: HAEGTFTSDVSSYLEGQAAKEFIAWLVKGR, 0,001-300 нМ). Затем клетки инкубировали в течение 4 часов при температуре 37°C в CO2 инкубаторе. Затем измеряли количество генерируемого цАМФ (люциферазный репортер) с использованием системы анализа люциферазы One-Glo™ (Promega) для расчета EC50 значения в отношении GLP-1 рецептора. Результаты представлены в следующей Таблице 4.
Кроме того, для определения активности в отношении рецептора глюкагона (GCGR), использовали набор для анализа cAMP Hunter™ eXpress GCGR CHO-K1 GPCR от компании DiscoverX. Использовали CHO-K1 клетки, экспрессирующие рецептор глюкагона человека, и высевали в 96-луночный планшет при плотности 3 × 104 клеток/лунка. Затем каждую из лунок обрабатывали полипептидом Примера 1 (0,013-300 нМ), конъюгатом Примера 2 (0,013-300 нМ), природным глюкагоном (0,015-33,33 нМ) и GLP-1 (0,001-30,00 нМ) и клетки инкубировали в течение 30 минут при температуре 37°C в CO2 инкубаторе. Затем измеряли количество генерируемого цАМФ для расчета EC50 значения в отношении рецептора глюкагона (GCGR). Результаты представлены в следующей Таблице 4.
Как показано в Таблице 4, GLP-1 показал высокую активность в отношении GLP-1 рецептора, но имел очень низкую активность в отношении рецептора глюкагона, которую нельзя было измерить. С другой стороны, природный глюкагон имел очень высокую активность в отношении рецептора глюкагона, но показал низкую активность в отношении рецептора GLP-1. На основании этих результатов было подтверждено, что экспериментальный способ имел высокую селективность.
При этом, было подтверждено, что полипептид Примера 1 имел значение EC50=0,13 в отношении GLP-1 рецептора, значение, которое почти идентично значению GLP-1, что указывает на то, что полипептид Примера 1 показал очень высокую активность в отношении GLP-1 рецептора, и что полипептид Примера 1 также обладал активностью в отношении рецептора глюкагона. Также с использованием эксперимента на животных было подтверждено, что полипептид Примера 1 имел эффект против ожирения.
Также было подтверждено, что конъюгат Примера 2 сохранял аналогичную активность в отношении GLP-1 рецептора и рецептора глюкагона по сравнению с полипептидом Примера 1. Было подтверждено, что полипептид, как правило, имел значительно более низкую активность в отношении рецепторов, когда непептидный полимер (например, ПЭГ) был связан с полипептидом, по сравнению с активностью до конъюгации, тогда как конъюгат Примера 2 имел менее уменьшенную активность в отношении рецепторов, даже когда непептидный полимер был связан с полипептидом, что указывает на то, что конъюгат Примера 2 показал увеличенный период полужизни in vivo с поддержанием при этом высокой активности.
Поэтому было подтверждено, что фармацевтическая композиция в соответствии с настоящим изобретением обладает отличной активностью в отношении рецептора глюкагона и GLP-1 рецептора и, таким образом, обладает антидиабетическим эффектом и эффектом против ожирения, а также эффектом снижения уровня триглицеридов путем подавления аппетита, повышения секреции инсулина и промотирования липолиза в жировых клетках.
Экспериментальный Пример 2: Измерение 1 активности Примера 2 in vivo
Для проверки профилактического или терапевтического эффекта конъюгата Примера 2 на ожирение или диабет конъюгат Примера 2 вводили C57BL/6 мышам для измерения изменения потребления пищи, глюкозы в крови и массы тела. Результаты представлены в Таблице 5.
Сначала получали животную модель ожирения путем содержания нормальных C57BL/6 мышей (примерно 6-недельного возраста) на 60% высокожировой диете в течение примерно 24 недель и увеличения массы тела мышей в среднем до примерно 50 г. Затем вводили конъюгат Примера 2 подкожной инъекцией при дозе 20 нмоль/кг один раз в два дня в течение 2 недель. В качестве положительного контроля также вводили агонист GLP-1 ‘лираглутид’ подкожной инъекцией при дозе 100 нмоль/кг один раз в день в течение 2 недель. В течение 2 недель, когда вводили лекарственное средство, потребление пищи, уровень глюкозы в крови и массу тела измеряли один раз в два дня в заданных точках времени. Результаты представлены в следующей Таблице 5.
В этом случае массу тела и уровень глюкозы в крови выражали в процентах (%), исходя из 100% до введения (День 0).
В этом случае необработанная группа относится к группе мышей, которым вводили PBS вместо конъюгата Примера 2.
Как показано в Таблице 5, необработанная группа потребляла примерно 40 г пищи в течение 2 недель, тогда как группа мышей, которым вводили конъюгат Примера 2, потребляла примерно 18 г пищи, в которой кумулятивное потребление пищи снижалось более чем наполовину по сравнению с необработанной группой. Потребление пищи было схожим в группах мышей, которым вводили положительный контроль и конъюгат Примера 2.
При этом, что касается паттерна изменений массы тела с течением времени, изменения массы тела не наблюдали в необработанной группе по сравнению с массой тела, наблюдаемой в момент времени введения (День 0), и масса тела снижалась примерно на 15% в группе положительного контроля по сравнению с массой тела, наблюдаемой до введения, что указывает на то, что лираглутид обладал низким профилактическим или терапевтическим эффектом на ожирение. С другой стороны, в группе мышей, которым вводили конъюгат Примера 2, масса тела заметно снижалась до 61% по сравнению с массой тела, измеренной до введения.
Также, что касается паттерна изменений уровня глюкозы в крови с течением времени, было показано, что уровень глюкозы в крови снижался на примерно 80% по сравнению с уровнем, измеренным до введения, что указывает на то, что конъюгат Примера 2 обладал эффектом снижения уровня глюкозы в крови, но что положительный контроль обладал низким эффектом снижения уровня глюкозы в крови.
На основании этих результатов можно видеть, что эффект конъюгата Примера 2 на снижение массы тела был эффектом, проявляемым за счет повышения энергетического метаболизма в организме, а также просто уменьшения потребления пищи. Фармацевтическая композиция в соответствии с настоящим изобретением могла обладать эффектами уменьшения потребления пищи, сдерживания опорожнения желудка и промотирования липолиза.
Экспериментальный Пример 3: Измерение 2 активности Примера 2 in vivo
Этот эксперимент осуществляли таким же образом, как в Экспериментальном примере 2, и затем оценивали переносимость глюкозы в мышиной модели с использованием интраперитонеального теста переносимости глюкозы (ipGTT).
По завершении 2-недельного введения лекарственных средств таким же образом, как в Экспериментальном примере 2, интраперитонеально вводили 2 г/кг глюкозы для измерения изменения уровня глюкозы в крови с течением времени (0, 15, 30, 60, 90 и 120 минут). Результаты представлены в следующей Таблице 6.
Как показано в Таблице 6, на основании результатов, полученных после введения лекарственных средств в течение 2 недель, было подтверждено, что уровень глюкозы в крови резко повышался, а затем снижался в необработанной группе из-за введения глюкозы, но что повышение уровня глюкозы в крови существенно уменьшалось в группе мышей, которым вводили конъюгат Примера 2. Поэтому, было подтверждено, что для конъюгата Примера 2 переносимость глюкозы повышалась, по сравнению с необработанной группой. Также было показано, что повышение уровня глюкозы в крови было меньше в группе мышей, которым вводили конъюгат Примера 2, по сравнению с положительным контролем.
Экспериментальный Пример 4: Измерение 3 активности Примера 2 in vivo
Для оценки профилактического или терапевтического эффекта конъюгата Примера 2 на диабет конъюгат Примера 2 вводили мышам BKS.Cg-+Leprdb/+Leprdb/OlaHsd (db/db мышам) примерно 7-недельного возраста и измеряли изменения уровня глюкозы в крови и массы тела с течением времени.
Прежде всего, 7-недельным мышам db/db вводили конъюгат Примера 2 подкожной инъекцией при дозе 20 нмоль/кг один раз в два дня в течение 12 дней. В течение 12 дней, когда вводили лекарственное средство, изменение уровня глюкозы в крови и массы тела определяли один через день после каждого введения лекарственного средства. Результаты представлены в следующей Таблице 7.
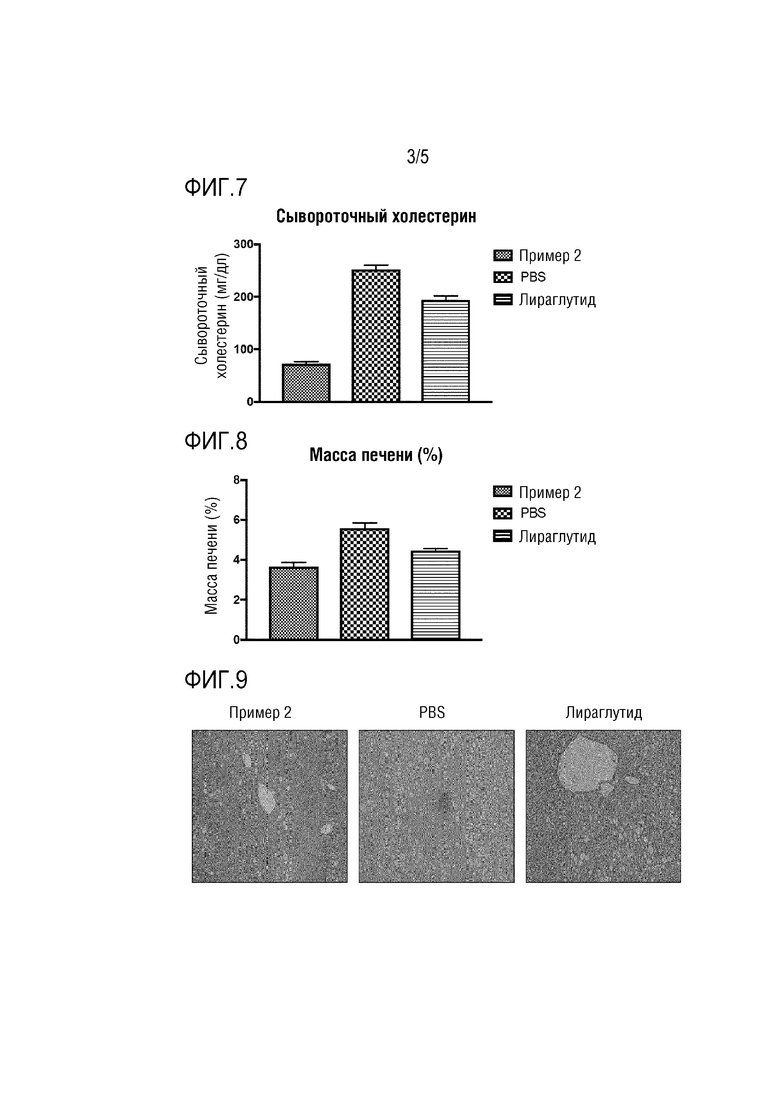
Затем для осуществления интраперитонеального теста переносимости глюкозы (ipGTT) 2 г/кг глюкозы вводили интраперитонеально после 12-дневого введения лекарственного средства и определяли изменение уровня глюкозы в крови с течением времени (0, 15, 30, 60, 90, и 120 минут). Результаты представлены в Таблице 8. Для определения степени долгосрочного изменения среднего уровня глюкозы в крови также измеряли уровень гликированного гемоглобина (HbA1c) после введения лекарственного средства. Результаты показаны на Фиг. 3.
Как показано в Таблице 7, было подтверждено, что потеря массы тела наблюдалась в группе мышей, которым вводили конъюгат Примера 2, по сравнению с необработанной группой. Также было подтверждено, что высокий уровень глюкозы в крови сохранялся в течение 2 недель в необработанной группе, тогда как в группе мышей, которым вводили конъюгат Примера 2, уровень глюкозы в крови снижался.
Как показано в Таблице 8, также было обнаружено, что группа мышей, которым вводили конъюгат Примера 2, показала более высокую переносимость глюкозы по сравнению с необработанной группой.
Также, как показано на Фиг. 3, было обнаружено, что введение конъюгата Примера 2 существенно снижало уровень гликированного гемоглобина, что указывает на то, что уровень глюкозы в крови стабильно поддверживался на низком уровне посредством введения конъюгата Примера 2.
Экспериментальный Пример 5: Измерение 4 активности Примера 2 in vivo
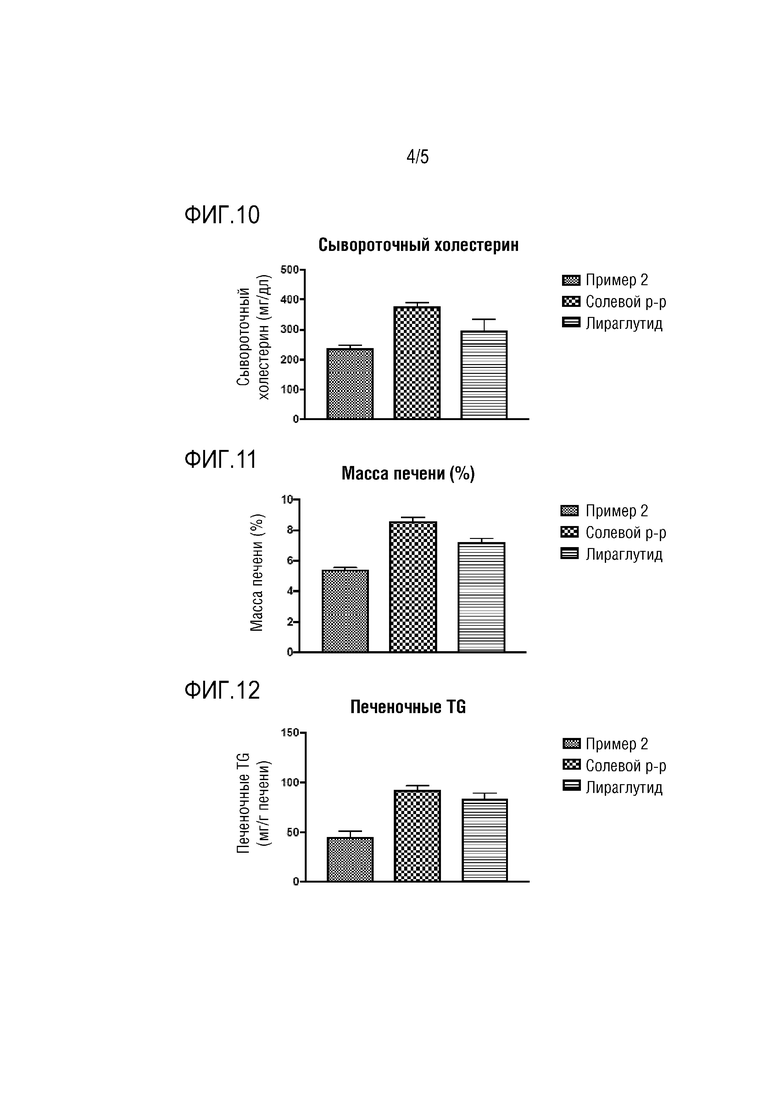
Для проверки профилактического или терапевтического эффекта концентрации и количества введений конъюгата Примера 2 на ожирение конъюгат Примера 2 вводили мышам C57BL/6 и определяли изменения потребления пищи и массы тела с течением времени.
Сначала получали животную модель ожирения путем содержания нормальных C57BL/6 мышей (примерно 6-недельного возраста) на 60% высокожировой диете в течение примерно 24 недель и увеличения массы тела мышей в среднем до примерно 50 г. Затем каждой из групп вводили конъюгат Примера 2 в течение 2 недель, как показано в следующей Таблице 9. Через 2 недели измеряли конечную массу тела мышей. Результаты показаны на Фиг. 4.
Как показано на Фиг. 4, было определено, что эффект конъюгата Примера 2 на снижение массы тела был более заметным при введении конъюгата Примера 2 при увеличивающейся дозе, и что конъюгат Примера 2 имел существенный эффект на снижение массы тела даже при введении при низкой дозе 20 нмоль/кг. Поэтому было подтверждено, что конъюгат Примера 2 показал дозозависимый ответ. Также было подтверждено, что, даже когда интервал между введениями конъюгата Примера 2 увеличивали до введения один раз в неделю, конъюгат Примера 2 имел такой же эффект на снижение массы тела. Поэтому фармацевтическая композиция для профилактики или лечения ожирения в соответствии с настоящим изобретением имела продолжительный период полужизни in vivo и была способна демонстрировать высокий уровень терапевтического эффекта на ожирение даже при введении при низкой дозе.
Экспериментальный Пример 6: Измерение 5 активности Примеров 2 и 6 in vivo
Для проверки профилактического или терапевтического эффекта конъюгатов Примеров 2 и 6, которые имели разные аминокислотнные последовательности, на ожирение или диабет получали животную модель ожирения путем содержания нормальных C57BL/6 мышей (примерно 6-недельного возраста) на 60% высокожировой диете в течение примерно 24 недель и увеличения массы тела мышей в среднем примерно до 50 г. Затем каждый из конъюгатов Примеров 2 или 6 вводили подкожной инъекцией при дозе 20 нмоль/кг один раз в два дня в течение 2 недель. В качестве контроля вводили PBS вместо конъюгатов Примеров. В течение 2 недель, когда вводили конъюгаты Примеров 2 или 6, определяли изменения уровня глюкозы в крови с течением времени. Результаты показаны на Фиг. 5. Также для осуществления интраперитонеального теста переносимости глюкозы (ipGTT) после 2-недельного введения лекарственного средства вводили 2 г/кг глюкозы интраперитонеально и определяли изменения уровня глюкозы в крови с течением времени (0, 15, 30, 60, 90, и 120 минут). Результаты показаны на Фиг. 6.
Как показано на Фиг. 5, было обнаружено, что уровень глюкозы в крови снижался у мышей, которым вводили конъюгаты Примеров 2 или 6, по сравнению с контролем, но что уровень глюкозы в крови повышался в контрольной группе, которой вводили PBS.
Как показано на Фиг. 6, было обнаружено, что уровень глюкозы в крови резко повышался, а затем снижался в контрольной группе из-за введения глюкозы, но что повышение уровня глюкозы в крови существенно уменьшалось у мышей, которым вводили конъюгаты Примеров 2 или 6 в течение 2 недель, по сравнению с контролем. На основании этих результатов, было подтверждено, что переносимость глюкозы при введении конъюгатов Примеров 2 и 6 повышалась, по сравнению с контролем.
Поэтому было подтверждено, что фармацевтическая композиция, включающая полипептид в соответствии с настоящим изобретением, имела профилактический или терапевтический эффект на ожирение и диабет, как показано в Фиг. 5 и 6.
Экспериментальный Пример 7: Измерение 6 активности Примера 2 in vivo
Для проверки профилактического или терапевтического эффекта конъюгата Примера 2 на неалкогольные жировые заболевания печени конъюгат Примера 2 вводили животным моделям неалкогольной жировой болезни печени, проверяли уровень сывороточного холестерина и изменение массы печени и брали биопсию печени. Результаты показаны на Фиг. 7-9.
Более конкретно, сначала получали лабораторную животную модель неалкогольных жировых заболеваний печени путем содержания нормальных C57BL/6 мышей (примерно 6-недельного возраста) на 60% высокожировой диете в течение примерно 24 недель и увеличения массы тела мышей в среднем примерно до 50 г. Затем вводили конъюгат Примера 2 подкожной инъекцией при дозе 20 нмоль/кг один раз в два дня в течение 2 недель. В качестве контроля также подкожной инъекцией вводили агонист GLP-1 ‘лираглутид’ при дозе 100 нмоль/кг ежедневно в течение 2 недель. После 2-недельного введения лекарственного средства кровь мышей собирали для измерения концентрации сывороточного холестерина и печень извлекали, взвешивали и заливали в парафин, а затем при помощи микротома получали тонкие срезы. Затем осуществляли биопсию печени с использованием гематоксилина & эозина (H&E).
Что касается Фиг. 7 и 8, показывающих измерение уровня сывороточного холестерина и массы печени, было подтверждено, что уровень сывороточного холестерина и масса печени существенно снижались у мышей, которым вводили конъюгат Примера 2, по сравнению с необработанной группой, которой вводили PBS, а также снижались по сравнению с положительным контролем (т.е. лираглутид-обрабатываемой группой). Также, что касается результатов биопсии печени, показанных на Фиг. 9, можно видеть, что жировой гепатоз существенно уменьшался в группе мышей, которым вводили конъюгат Примера 2, по сравнению с необработанной группой, которой вводили PBS, а также уменьшался по сравнению с положительным контролем (т.е. лираглутид-обрабатываемой группой).
Таким образом, было обнаружено, что фармацевтическая композиция для профилактики или лечения неалкогольной жировой болезни печени в соответствии с настоящим изобретением была эффективна в профилактике и лечении неалкогольной жировой болезни печени, поскольку фармацевтическая композиция уменьшала массу печени, уровень сывороточного холестерина и жировой гепатоз в животной модели неалкогольных жировых заболеваний печени.
Экспериментальный Пример 8: Измерение 7 активности Примера 2 in vivo
Для проверки профилактического или терапевтического эффекта конъюгата Примера 2 на неалкогольные жировые заболевания печени животной модели неалкогольных жировых заболеваний печени вводили конъюгат Примера 2 и измеряли уровень сывороточного холестерина, массу печени и изменение уровня триглицеридов в печени. Результаты показаны на Фиг. 10-12.
Прежде всего, получали лабораторную животную модель неалкогольных жировых заболеваний печени путем содержания нормальных C57BL/6 мышей (примерно 6-недельного возраста) на диете с высоким содержанием трансжиров, которая содержала 40% жиров, 20% фруктозы и 2% холестерина, в течение примерно 16 недель. Затем вводили конъюгат Примера 2 подкожной инъекцией при дозе 20 нмоль/кг один раз в три дня в течение 4 недель. В качестве положительного контроля также подкожной инъекцией вводили агонист GLP-1 ‘лираглутид’ при дозе 53 нмоль/кг ежедневно в течение 4 недель. По завершении 4-недельного эксперимента измеряли уровень сывороточного холестерина, массу печени и уровень триглицеридов в печени (печеночные TG).
Что касается Фиг. 10-12, показывающих измерение уровня сывороточного холестерина, массы печени и печеночных TG, можно видеть, что уровень сывороточного холестерина, масса печени и уровень триглицеридов в печени существенно снижались у мышей, которым вводили конъюгат Примера 2, по сравнению с необработанной группой, которой вводили физиологический раствор, а также снижались по сравнению с положительным контролем (т.е. лираглутид-обрабатываемой группой). Таким образом, было обнаружено, что фармацевтическая композиция для профилактики или лечения неалкогольной жировой болезни печени в соответствии с настоящим изобретением была эффективна в профилактике и лечении неалкогольной жировой болезни печени, поскольку фармацевтическая композиция снижала массу печени, уровни сывороточного холестерина и триглицеридов в печени в животной модели неалкогольных жировых заболеваний печени.
Экспериментальный Пример 9: Измерение 8 активности Примера 2 in vivo
После осуществления эксперимента таким же образом, как в Экспериментальном примере 8, брали биопсию печени и осуществляли оценку NAFLD активности (NAS) для проверки профилактического или терапевтического эффекта на неалкогольные жировые заболевания печени. Эксперимент осуществляли таким же образом, как в Экспериментальном примере 8, после 4-недельного введения конъюгата Примера 2 печени мышей извлекали, заливали в парафин, а затем при помощи микротома получали тонкие срезы. Затем осуществляли окрашивание гематоксилином & эозином (H&E) и окрашивание oil-red-O красителем.
В результате, как показано на Фиг. 13 и 14, гистология печени и NAS результаты после 4-недельного введения показали, что жировой гепатоз и NAS существенно уменьшались у мышей, которым вводили конъюгат Примера 2, по сравнению с необработанной группой, которой вводили физиологический раствор, и с положительным контролем (т.е. лираглутид-обрабатываемой группой). Таким образом, было обнаружено, что фармацевтическая композиция для профилактики или лечения неалкогольной жировой болезни печени в соответствии с настоящим изобретением была эффективна в профилактике и лечении неалкогольной жировой болезни печени, поскольку фармацевтическая композиция уменьшала жировой гепатоз и имела пониженную NAS в животной модели неалкогольных жировых заболеваний печени.
Хотя предпочтительные варианты осуществления настоящего изобретения были подробно описаны выше, должно быть понятно, что многие изменения и/или модификации изложенных основных концепций изобретения, которые могут быть очевидными для специалистов в соответствующей области техники, тем не менее будут охватываться объемом настоящего изобретения, как определено в прилагаемой формуле изобретения.
Промышленная применимость
Фармацевтическая композиция, включающая полипептид в соответствии с настоящим изобретением, может быть использована для безопасной профилактики или лечения ожирения, диабета или неалкогольной жировой болезни печени, поскольку фармацевтическая композиция обладает эффектами уменьшения потребления пищи, повышения секреции инсулина, сдерживания опорожнения желудка, промотирования липолиза и снижения уровня триглицеридов без каких-либо побочных эффектов, таких как рвота или тошнота.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> D&D Pharmatech Inc.
Lee, Kang Choon
Park, Og Yi
An, Hyoung Tae
Park, Eun Ji
Shin, Jae Hee
Lim, Sung Mook
<120> ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ПОЛИПЕПТИД
<130> DDP 100 PCT
<140> PCT/KR2019/008918
<141> 2019-07-19
<150> KR 10-2018-0083946
<151> 2018-07-19
<150> KR 10-2019-0060513
<151> 2019-05-23
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 29
<212> Белок
<213> Неизвестно
<220>
<223> Глюкагон
<400> 1
His Ser Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Ser
1 5 10 15
Arg Arg Ala Gln Asp Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 2
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> Xaa = аминоизомасляная кислота (Aib)
<222> (2)..(2)
<400> 2
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Gln Ala Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 3
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 3
His Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Lys Arg Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 4
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> Xaa = аминоизомасляная кислота (Aib)
<222> (2)..(2)
<400> 4
His Xaa Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 5
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 5
His Gly Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu
1 5 10 15
Glu Ala Val Lys Glu Phe Val Gln Trp Leu Met Asn Thr Cys
20 25 30
<210> 6
<211> 30
<212> Белок
<213> Неизвестно
<220>
<223> GLP-1
<400> 6
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg
20 25 30
<210> 7
<211> 27
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 7
Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu Lys Arg
1 5 10 15
Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 8
<211> 27
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 8
Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu Gln Ala
1 5 10 15
Ala Lys Glu Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 9
<211> 27
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 9
Gln Gly Thr Phe Thr Ser Asp Tyr Ser Lys Tyr Leu Asp Glu Glu Ala
1 5 10 15
Val Lys Glu Phe Val Gln Trp Leu Met Asn Thr
20 25
<210> 10
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 10
Glu Lys Arg Ala Lys
1 5
<210> 11
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 11
Glu Gln Ala Ala Lys
1 5
<210> 12
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<400> 12
Glu Glu Ala Val Lys
1 5
<---
Настоящее изобретение относится к области биотехнологии, конкретно к получению терапевтически активных пептидных конъюгатов, и может быть использовано в медицине для профилактики или лечения заболевания, выбранного из ожирения, диабета и неалкогольной жировой болезни печени. Изобретение обеспечивает получение композиции, включающей сайт-специфический конъюгат с полипептидом и непептидным полимером, которая обладает превосходным эффектом профилактики или лечения ожирения, диабета или неалкогольной жировой болезни печени путем повышения периода полужизни в крови с поддержанием при этом активности полипептида in vivo. Фармацевтическая композиция является безопасной в части побочных эффектов, таких как рвота или тошнота, и обладает эффектами уменьшения потребления пищи, повышения секреции инсулина, сдерживания опорожнения желудка, промотирования липолиза и снижения уровня триглицеридов. 7 н. и 12 з.п. ф-лы, 14 ил., 9 табл., 10 пр.
1. Терапевтическое средство для профилактики или лечения заболевания, выбранного из ожирения, диабета и неалкогольной жировой болезни печени, состоящее из полипептида, имеющего аминокислотную последовательность, представленную следующей общей формулой 1:
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин, дезамино-гистидил, N-диметил-гистидил, бета-гидрокси-имидазо-пропионил, 4-имидазоацетил или бета-карбокси-имидазо-пропионил;
X1 представляет собой делецию, глицин или аминоизомасляную кислоту (Aib);
R2 представляет собой EKRAK, EQAAK или EEAVK; и
R3 представляет собой делецию, цистеин, лизин или метионин, и
непептидного полимера,
причем полипептид ковалентно связан с непептидным полимером.
2. Фармацевтическая композиция для профилактики или лечения заболевания, выбранного из ожирения, диабета и неалкогольной жировой болезни печени, содержащая эффективное количество терапевтического средства по п.1.
3. Фармацевтическая композиция по п.2, где терапевтическое средство не включает фрагмент антитела.
4. Фармацевтическая композиция по п.2, где R2 включает глутаминовую кислоту (E) и лизин (K), и глутаминовая кислота и лизин образуют кольцо через амидную связь.
5. Фармацевтическая композиция по п.2, где непептидный полимер выбран из группы, состоящей из полиэтиленгликоля (ПЭГ), полипропиленгликоля, coполимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта (PVA), полисахарида, декстрана, поливинилэтилового эфира, полимолочной кислоты (PLA), полимолочной-гликолевой кислоты (PLGA), липидного полимера, хитина, гиалуроновой кислоты и их комбинаций.
6. Фармацевтическая композиция по п.5, где непептидный полимер представляет собой полиэтиленгликоль или его производное.
7. Фармацевтическая композиция по п.6, где непептидный полимер имеет молекулярную массу 3000-100000 Да.
8. Фармацевтическая композиция по п.6, где производное полиэтиленгликоля представляет собой по меньшей мере одно производное, выбранное из группы, состоящей из метоксиполиэтиленгликоля, метоксиполиэтиленгликоль-N-гидроксисукцинимида, метоксиполиэтиленгликоль-пропиональдегида, метоксиполиэтиленгликоль-малеимида, полиэтиленгликоль-сукцинимидилпропионата (ПЭГ-сукцинимидилпропионат), метоксиполиэтиленгликоль-сукцинимидилпропионата (метокси-ПЭГ-сукцинимидилпропионат), полиэтиленгликоль-сукцинимидилпропионата акрилата (ПЭГ-сукцинимидилпропионата акрилат), тиол-полиэтиленгликоль-сукцинимидилпропионата (тиол-ПЭГ-сукцинимидилпропионат), гидроксисукцинимидил-полиэтиленгликоля (гидроксисукцинимидил-ПЭГ), сукцинимидилкарбоксиметилового эфира метоксиполиэтиленгликоля (сукцинимидилкарбоксиметиловый эфир мПЭГ), сукцинимидилкарбоксиметилового эфира полиэтиленгликоля акрилата (сукцинимидилкарбоксиметиловый эфир ПЭГ акрилат), полиэтиленгликоль-сукцинимидилкарбоната (ПЭГ-сукцинимидилкарбонат), полиэтиленгликоль-пропиональдегида (ПЭГ-пропиональдегид), полиэтиленгликоль-бутилальдегида (ПЭГ-бутилальдегид), их производных и мультиразветвленных форм их производных.
9. Фармацевтическая композиция по п.6, где полиэтиленгликоль или его производное является линейным или разветвленным.
10. Фармацевтическая композиция по п.2, где фармацевтическую композицию используют для профилактики или лечения ожирения.
11. Фармацевтическая композиция по п.2, где фармацевтическую композицию используют для профилактики или лечения диабета.
12. Фармацевтическая композиция по п.2, где фармацевтическую композицию используют для профилактики или лечения неалкогольной жировой болезни печени.
13. Фармацевтическая композиция по п.12, где неалкогольная жировая болезнь печени включает одно или более заболеваний, выбранных из группы, состоящей из неалкогольного ожирения печени, неалкогольного стеатогепатит, цирроза печени и рака печени.
14. Терапевтическое средство для профилактики или лечения заболевания, выбранного из ожирения, диабета и неалкогольной жировой болезни печени, состоящее из полипептида, имеющего аминокислотную последовательность, представленную следующей общей формулой 1:
[Общая формула 1]
R1-X1-QGTFTSDYSKYLD-R2-EFVQWLMNT-R3,
где R1 представляет собой гистидин;
X1 представляет собой аминоизомасляную кислоту (Aib);
R2 представляет собой EQAAK; и
R3 представляет собой цистеин; и
причем полипептид ковалентно связан с триразветвленным метоксиполиэтиленгликоль-малеимидом.
15. Фармацевтическая композиция для профилактики или лечения заболевания, выбранного из ожирения, диабета и неалкогольной жировой болезни печени, содержащая эффективное количество терапевтического средства по п.14.
16. Способ профилактики или лечения неалкогольной жировой болезни печени, включающий введение субъекту фармацевтической композиции по п.2 или 15.
17. Способ по п.16, где неалкогольная жировая болезнь печени включает одно или более заболеваний, выбранных из группы, состоящей из неалкогольного ожирения печени, неалкогольного стеатогепатита, цирроза печени и рака печени.
18. Способ профилактики или лечения ожирения, включающий введение субъекту фармацевтической композиции по п.2 или 15.
19. Способ профилактики или лечения диабета, включающий введение субъекту фармацевтической композиции по п.2 или 15.
| КОНЪЮГАТ, СОДЕРЖАЩИЙ ОКСИНТОМОДУЛИН И ФРАГМЕНТ ИММУНОГЛОБУЛИНА, И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2607365C2 |
| et al., Spliceosomal peptide P140 for immunotherapy of systemic lupus erythematosus: results of an early phase II clinical trial, Arthritis & Rheumatism: Official Journal of the American College of Rheumatology, 2008, V | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
2022-08-01—Публикация
2019-07-19—Подача