Предпосылки создания изобретения
Изобретение относится к промежуточным продуктам, применимым для синтеза фармацевтически активных макролидных соединений, и к способам синтеза макролидных соединений. Галихондрин B представляет собой мощное противораковое средство, впервые выделенное из морской губки Halichondria okadai, и впоследствии обнаруженное у Axinella sp., Phakellia carteri, и Lissodendoryx sp.Полный синтез галихондрина B был опубликован в 1992 году (Aicher T.D. et al., J. Am. Chem. Soc., 114:3162-3164). Дальнейшие исследования синтеза и взаимосвязи структуры и активности были раскрыты в патентах США №№5,338,865 и 5,436,238 и в документах Towle et al., Annual Meeting of the American Association for Cancer Research, April 6-10, 2002, 5721 и Wang et al., Bioorg. Med. Chem. Lett., 10:1029-1032, 2000. Эрибулина мезилат (также называемый Halaven®, E7389, и мезилат B1939), ингибитор динамики микротрубочек нетаксанового ряда, представляет собой структурно упрощенный синтетический аналог галихондрина B. Способы и промежуточные продукты для синтеза определенных аналогов галихондрина B и промежуточных продуктов раскрыты в международных публикациях №№WO 2005/118565, WO 2009/046308, WO 2009/064029 и WO 2009/124237; патенте США №6,214,865; документах Austad et al., Synlett, 24(3):333-337, 2013; Austad et al., Synlett, 24(3):327-332, 2013; и Chase et al., Synlett, 24(3):323-326, 2013. Желательны новые способы синтеза галихондрина и его аналогов (например, аналогов макролидов).
Сущность изобретения
В общем, настоящее изобретение относится к способам получения макроциклических промежуточных продуктов при синтезе макролида галихондринового ряда или его аналога. В частности, способы, раскрытые в настоящем документе, могут быть применимы при получении макролида галихондринового ряда или его аналога путем формирования связи C.26-C.27 в реакции Принса с участием промежуточного продукта-аллена. Изобретение также относится к промежуточным продуктам, которые могут быть использованы в реакциях, описанных в настоящем документе.
Согласно одному аспекту, изобретение относится к способу получения макроциклического промежуточного продукта при синтезе макролида галихондринового ряда или его аналога, причем способ включает в себя осуществление взаимодействия промежуточного продукта формулы (IA) с R12OH и кислотой Льюиса, причем в результате взаимодействия получают макроциклический промежуточный продукт путем формирования связи в структуре макролида галихондринового ряда или его аналога,
где R12 представляет собой необязательно замещенный ацил;
где соединение формулы (IA) представляет собой:
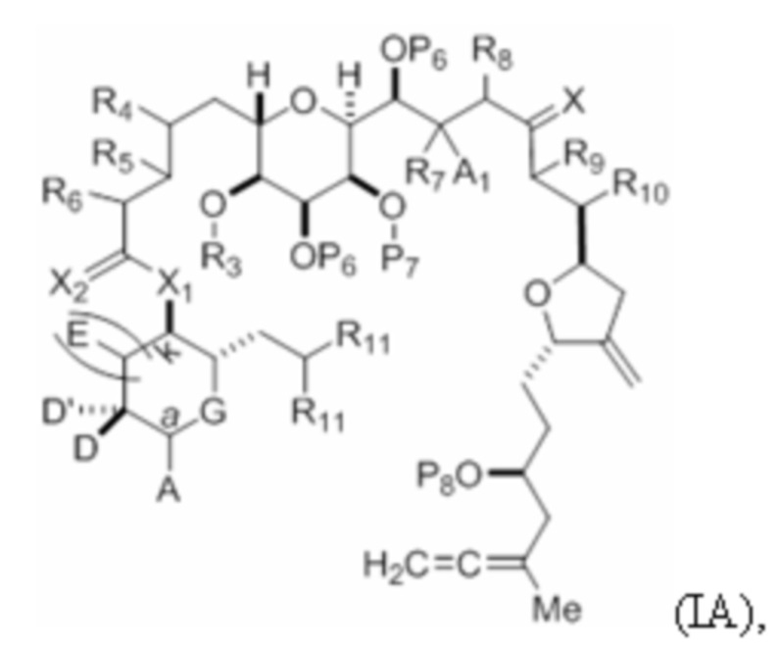
или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:
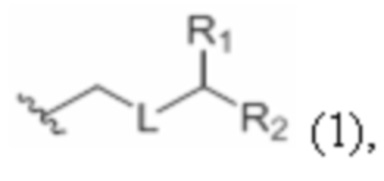
где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
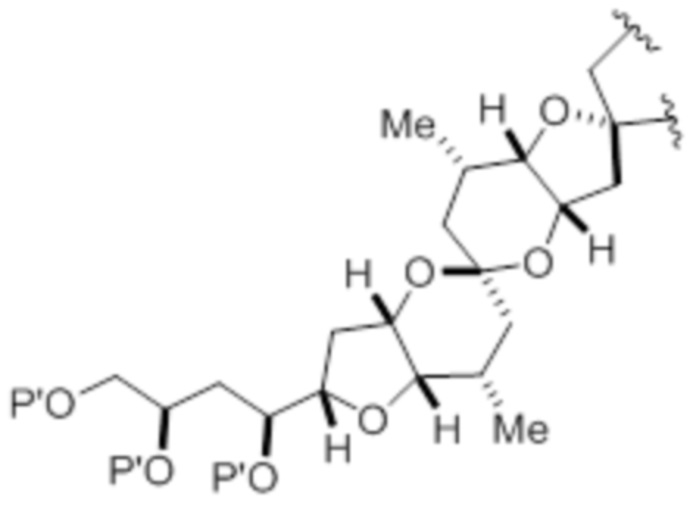 ,
, 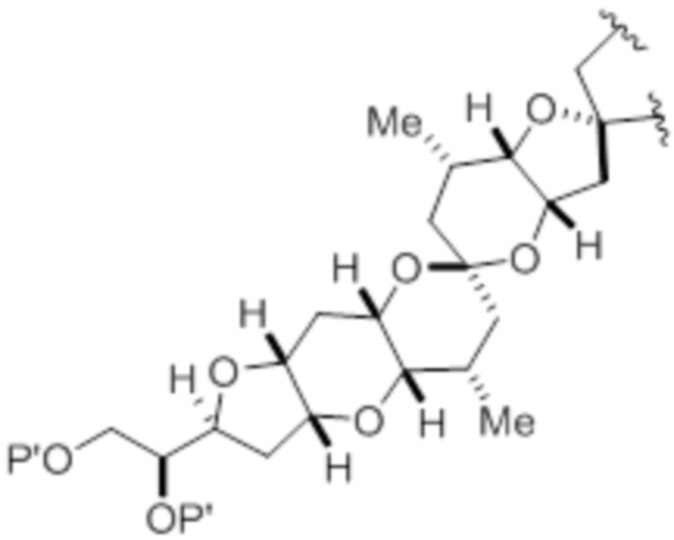 и
и 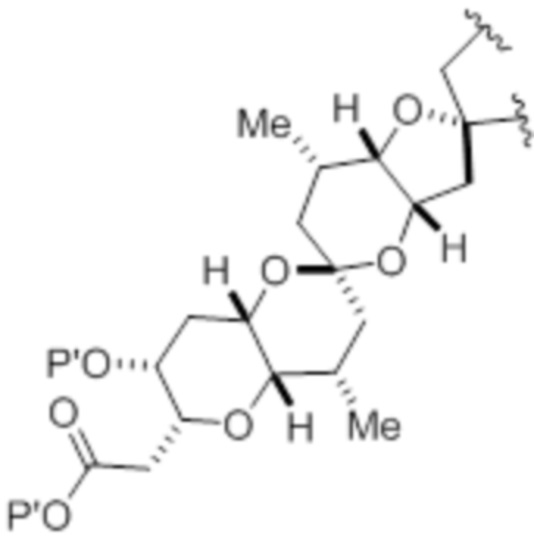 ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-,
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(a) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
(i) каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя; X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу; или
(iii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя; и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
R9 представляет собой H, OP' или Y, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу; и
P8 представляет собой H или силил; и
где макроциклический промежуточный продукт при синтезе макролида галихондринового ряда или его аналога представляет собой соединение формулы (IB):
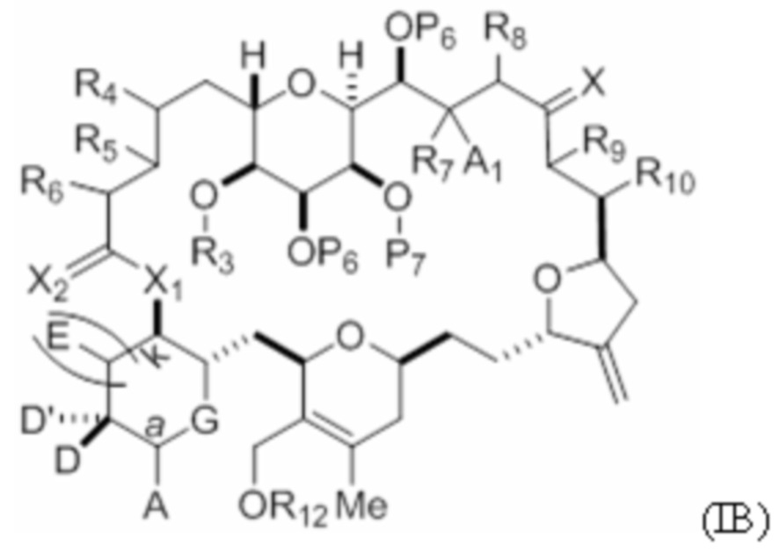
или его соль или таутомер.
Согласно некоторым вариантам осуществления, кислота Льюиса представляет собой оксофильную кислоту Льюиса (например, трифторид бора или его сольват).
Согласно другому аспекту, изобретение относится к способу получения макролида галихондринового ряда или его аналога:
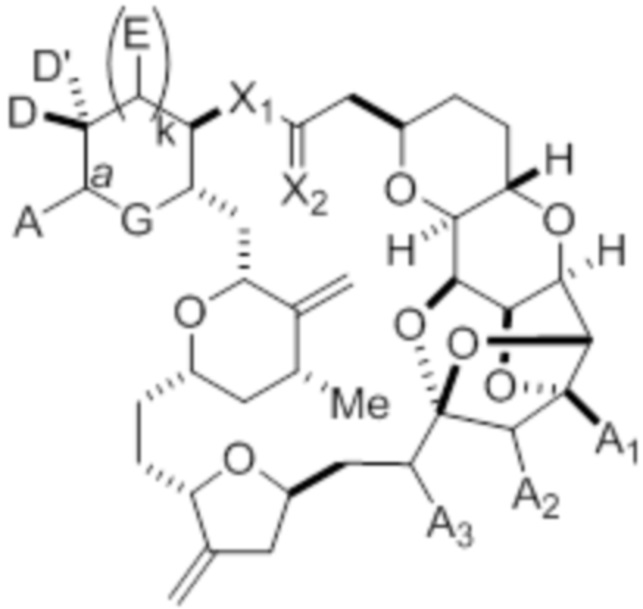
или его соли,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой H или N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой H или N-защитную группу, (b) P2 и P4 объединены с формированием алкилидена, или (c) каждый из P2 и P4 представляет собой H;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
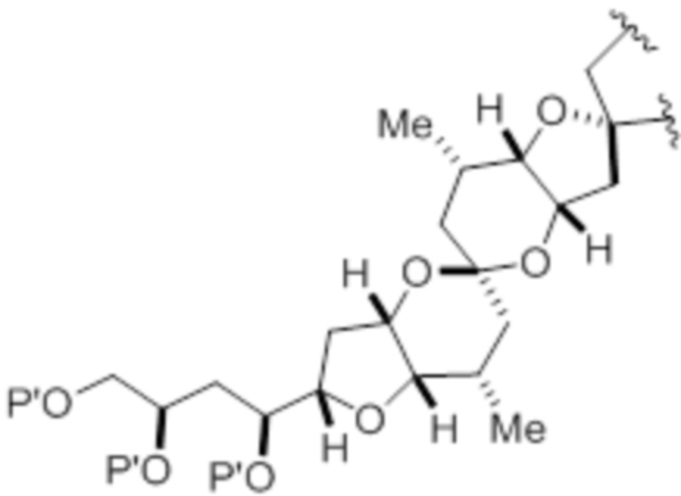 ,
, 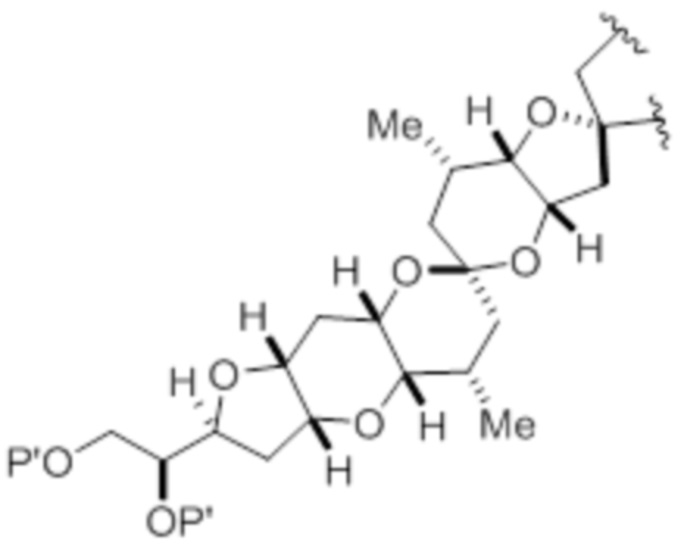 и
и 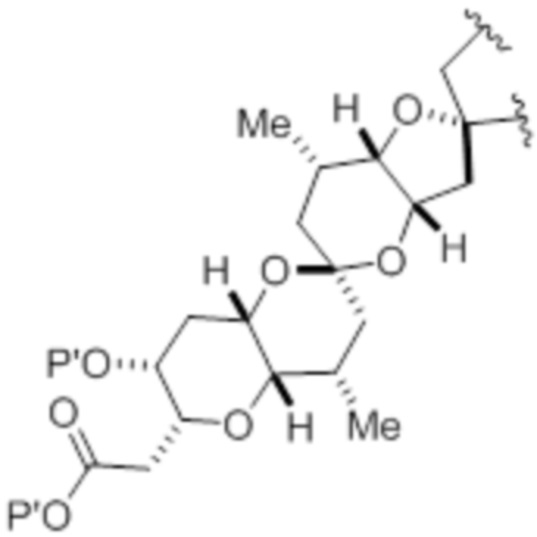 ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
каждый из A1, A2, и A3 независимо представляет собой H или OPʺ, где каждый P(независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH2- или -O-, и
X2 представляет собой=O;
путем
(A) получения соединения формулы (IB) из соединения формулы (IA) и R12OH, где R12 представляет собой необязательно замещенный ацил, и соединение формулы (IA) представляет собой следующую структуру:

или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
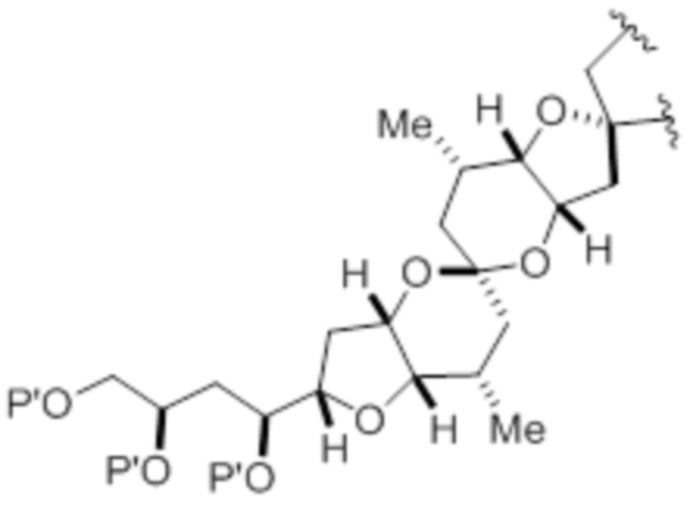 ,
,  и
и 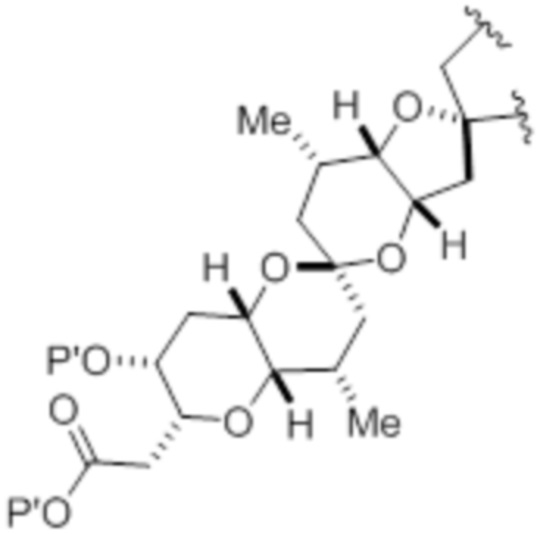 ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-,
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(a) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
(i) каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя; X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу; или
(iii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя; и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
R9 представляет собой H, OPʺ или Y, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу; и
P8 представляет собой H или силил;
и
соединение формулы (IB) представляет собой следующую структуру:

или его соль или таутомер;
где
R12 представляет собой необязательно замещенный ацил; и
(B) получения макролида ряда галихондрина или его аналога из соединения (IB).
Согласно определенным вариантам осуществления, получение соединения формулы (IB) включает в себя осуществление взаимодействия соединения формулы (IA) с R12OH и кислотой Льюиса (например, оксофильной кислотой Льюиса (например, трифторид бора или его сольват)). Согласно конкретным вариантам осуществления, получение макролида ряда галихондрина или его аналога включает в себя осуществление взаимодействия соединения формулы (IB) с аллильным восстановителем. Согласно дополнительным вариантам осуществления, R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H. Согласно некоторым вариантам осуществления, R5 и R6 объединены вместе с атомом, к которому каждый из них присоединен, с формированием двойной связи, R4 представляет собой H, и R3 представляет собой гидроксил-защитную группу. Согласно другим вариантам осуществления, каждый P6 представляет собой гидроксил-защитную группу, и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-. Согласно еще одним вариантам осуществления, R7 и P7 объединены с формированием связи, и R8 представляет собой H. Согласно другим вариантам осуществления, P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи. Согласно некоторым вариантам осуществления, R9 представляет собой H или SO2RC, и R10 представляет собой H. Согласно другим вариантам осуществления, P8 представляет собой силил. Согласно конкретным вариантам осуществления, каждый R11 представляет собой -OP10, где P10 представляет собой алкил. Согласно определенным вариантам осуществления, G представляет собой O. Согласно дополнительным вариантам осуществления, D представляет собой H. Согласно другим дополнительным вариантам осуществления, D' представляет собой OP1, где P1 представляет собой алкил. Согласно другим вариантам осуществления, стереогенный центр, обозначаемый как a, представляет собой (R), и A имеет следующую структуру:
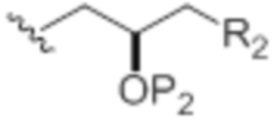 .
.
Согласно еще одним вариантам осуществления, k равен 0, и X1 представляет собой -CH2-. Согласно другим вариантам осуществления, R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0. Согласно дополнительным вариантам осуществления, A и D объединены с формированием следующей структуры:
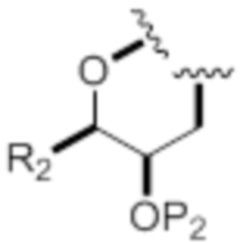 ,
,
где связь с атомом кислорода возникает по атому углерода, к которому присоединен D в формуле (IA), и
где R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 2.
Согласно некоторым вариантам осуществления, k равен 1, и E представляет собой необязательно замещенный алкил. Согласно конкретным вариантам осуществления, X1 представляет собой -O-.
Способы согласно настоящему изобретению могут быть использованы для получения эрибулина или его соли (например, эрибулина мезилата). Соединения формулы (IA), (IB), (IC), (IE), (IJ) или (IN), где k равен 0, X1 представляет собой -CH(Y)- или -CH2-, D представляет собой H, D' представляет собой OP1, G представляет собой O, и A имеет следующую структуру:
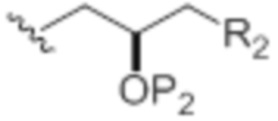 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой H или N-защитную группу, и P2 и P4 объединены с формированием алкилидена, или P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо;
могут быть использованы для получения эрибулина или его соли (например, эрибулина мезилата).
Согласно определенным вариантам осуществления формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, X1 представляет собой -CH(Y)- или -CH2-, D представляет собой H, D' представляет собой OP1, G представляет собой O, и A имеет следующую структуру:
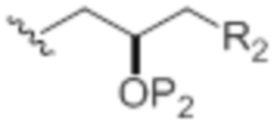 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой N-защитную группу, и P2 и P4 объединены с формированием алкилидена; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо;
могут быть использованы для получения эрибулина или его соли (например, эрибулина мезилата).
Согласно другому аспекту, изобретение относится к соединениям формулы (IA), (IB), (IC), (ID), (IDa), (IDb), (IDc), (IDd), (IE), (IF), (IH), (IHa), (IHb), (IJ) или (IN).
Структура соединения формулы (IA) имеет вид:

или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
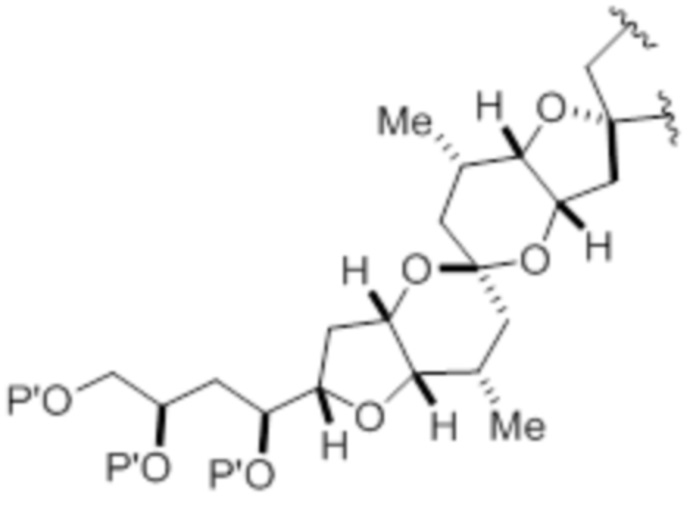
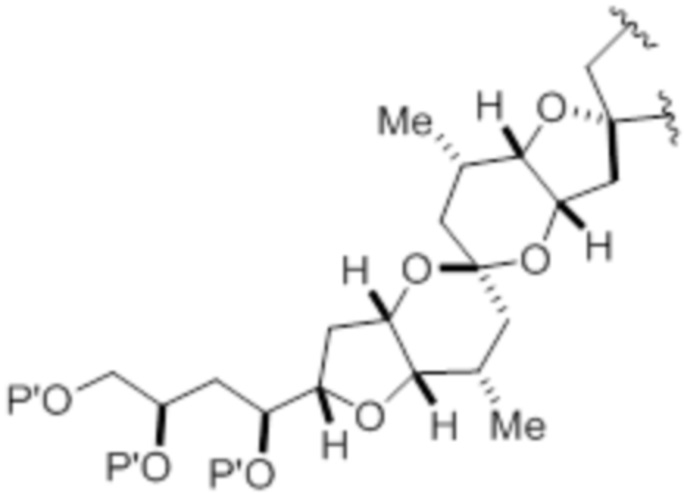 ,
,  , и
, и  ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-;
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(i) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(ii) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
(i) каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя; X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу; или
(iii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя; и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
R9 представляет собой H, OPʺ или Y, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу; и
P8 представляет собой H или силил.
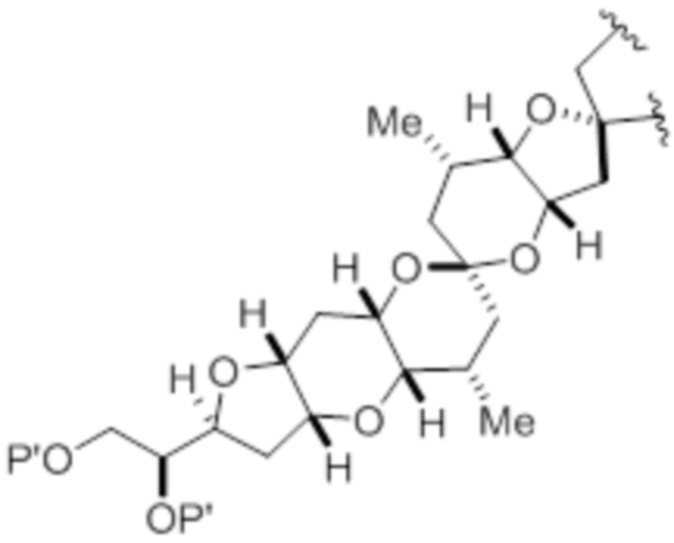
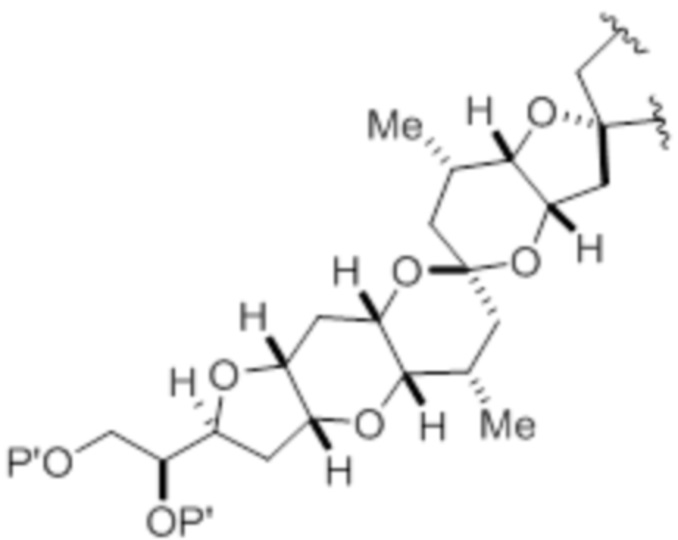
Структура соединения формулы (IB) имеет вид:

или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
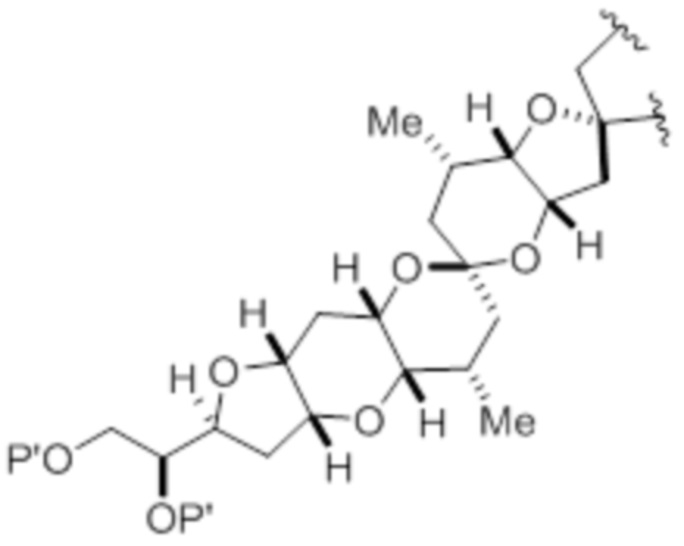
 ,
,  , и
, и  ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-;
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(a) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
(i) каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя; X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; или
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
R9 представляет собой H, OPʺ или Y, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу; и
R12 представляет собой необязательно замещенный ацил.
Структура соединения формулы (IC) имеет вид:
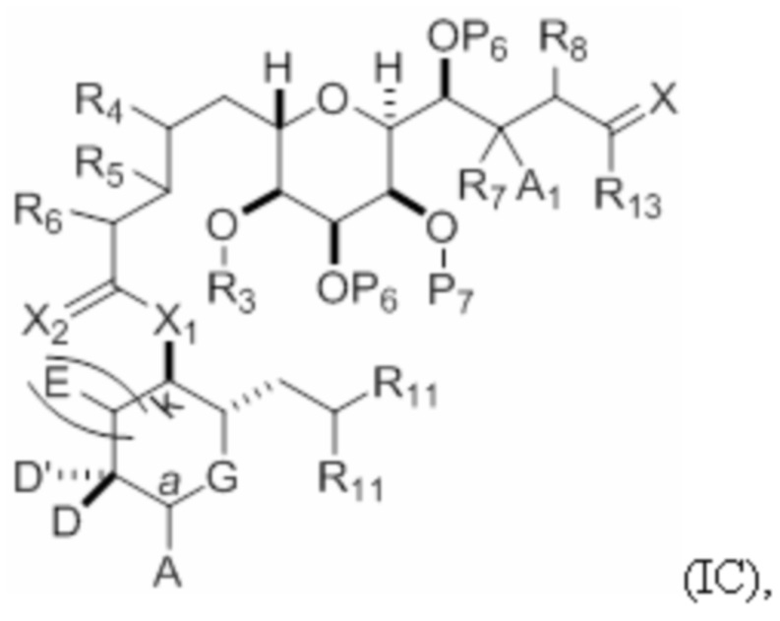
или его соль или таутомер,
где
каждый из D и D(независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
 ,
,  , и
, и  ,
,
где каждый P' независимо представляет собой гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)- или -CH2-;
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой (C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
(a) каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый R11 независимо представляет собой -OP10, или
оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
или
(b) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя;
R13 представляет собой H или -CH2P(O)(ORE)2, где каждый RE, при наличии, независимо представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(i) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(ii) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
и
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу.
Структура соединения формулы (ID) имеет вид:
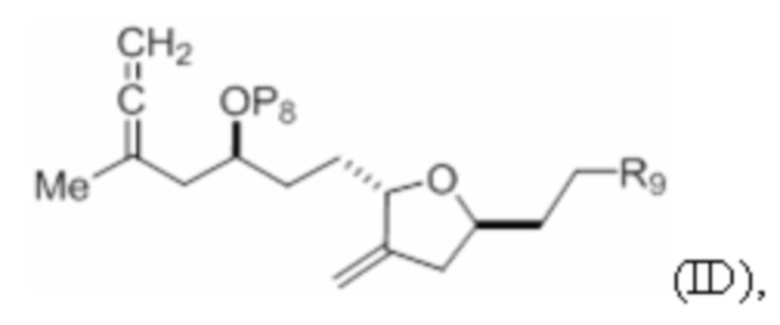
где
P8 представляет собой H или гидроксил-защитную группу; и
R9 представляет собой SO2RC или COORC, если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил.
Структура соединения формулы (IDa) имеет вид:
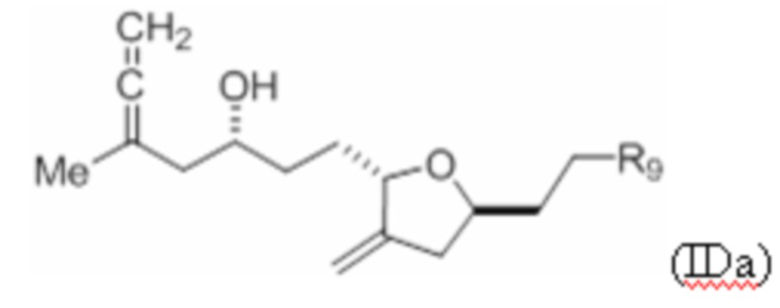
где R9 представляет собой SO2RC или COORC, если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил.
Структура соединения формулы (IDb) имеет вид:
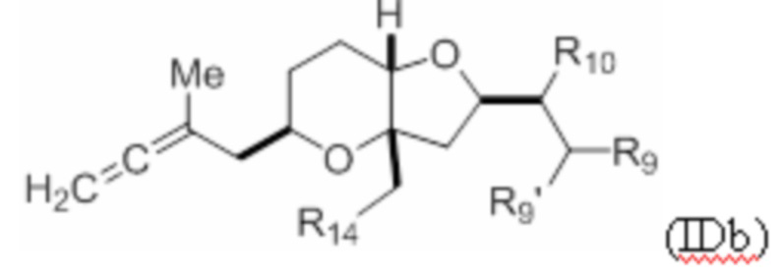
где R9' и R10 оба представляют собой H, или R9' и R10 объединены с формированием двойной связи; R14 представляет собой гидроксил, галоген (например, йодид) или псевдогалоген (например, трифлат); и R9 представляет собой SO2RC или COORC, если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил.
Структура соединения формулы (IDc) имеет вид:
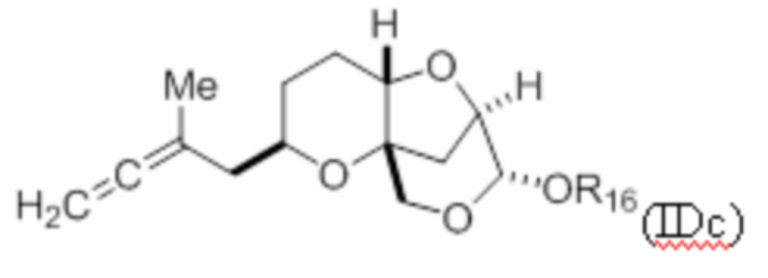
где R16 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил.
Структура соединения формулы (IDd) имеет вид:
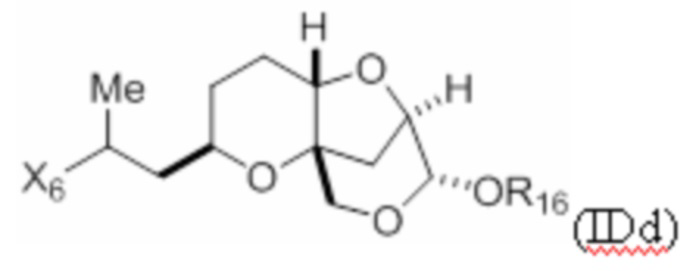
где X6 представляет собой -C(R17)=CH2 или -C(O)- Me, где R17 представляет собой псевдогалоген (например, трифлат) или галоген; и R16 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил.
Структура соединения формулы (IE) имеет вид:
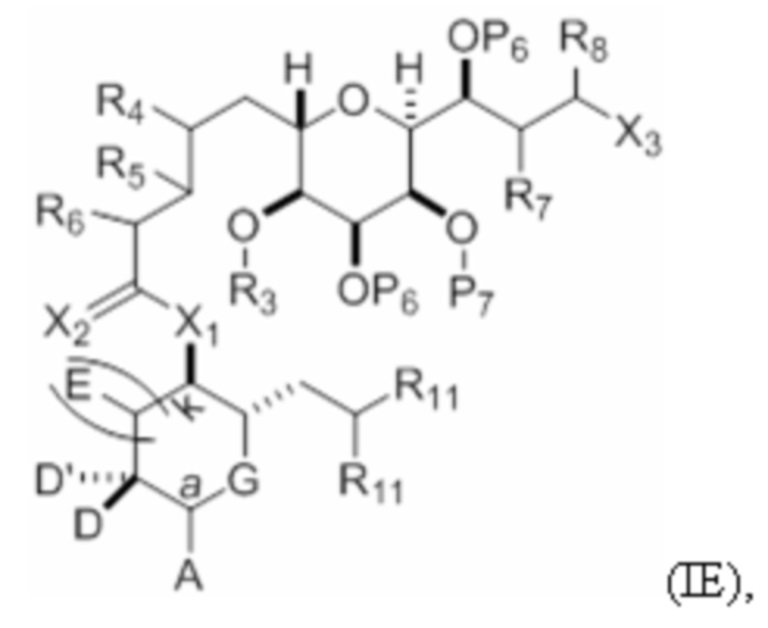
или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо и Q1, причем группа формулы (1) характеризуется структурой:
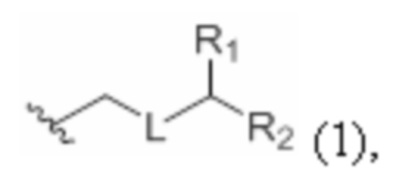
где
L представляет собой -(CH(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
 ,
,  , и
, и  ,
,
где каждый P' независимо представляет собой гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)- или -CH2-;
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
R7 и P7 объединены с формированием связи, и R8 представляет собой H; или P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
(i) каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый R11 независимо представляет собой -OP10, или
оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
или
(ii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя; и
X3 представляет собой -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA, где каждый RE представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил, и где каждый PA независимо представляет собой H или гидроксил-защитную группу, или оба PA объединены с формированием циклического защищенного диола.
Структура соединения формулы (IF) имеет вид:
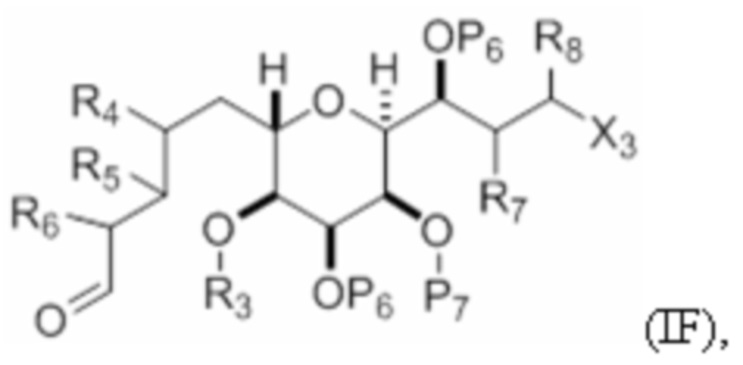
где
X3 представляет собой -CHO, -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
R7 и P7 объединены с формированием связи, и R8 представляет собой H; или P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи; и
каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя.
Структура соединения формулы (IH) имеет вид:
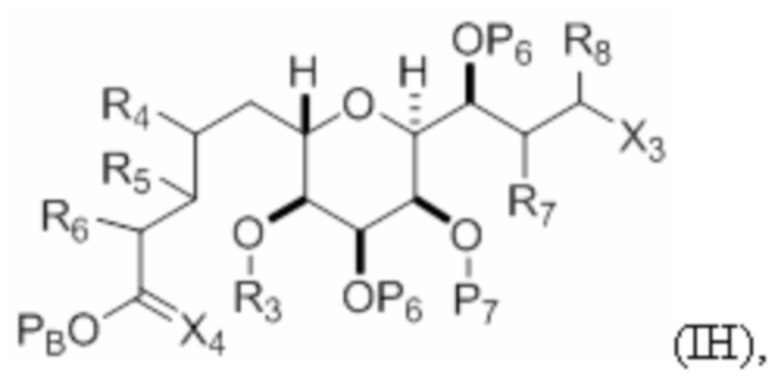
или его соль,
где
X3 представляет собой -CHO, -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA;
X4 представляет собой=O, или X4 объединен вместе с атомом углерода, к которому он присоединен, с формированием -CH2-;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
R7 и P7 объединены с формированием связи, и R8 представляет собой H; или P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый PA независимо представляет собой H или гидроксил-защитную группу, или оба PA объединены с формированием циклического защищенного диола; и
PB представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил.
Структура соединения формулы (IHa) имеет вид:
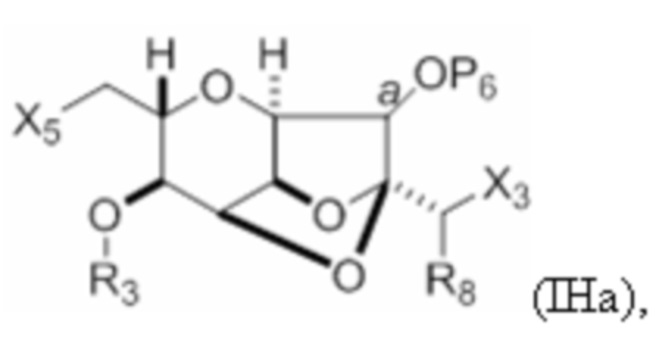
где
a определяет углерод-кислородную связь как  или
или  ,
,
X3 представляет собой -CHO, -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA;
X5 представляет собой -CH=CH2 или -CH(R4)- CH(R5)- CH(R6)- C(X4)OPB;
X4 представляет собой=O, или X4 объединен вместе с атомом углерода, к которому он присоединен, с формированием -CH2-;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
P6 представляет собой гидроксил-защитную группу, или оба P6;
каждый PA независимо представляет собой H или гидроксил-защитную группу, или оба PA объединены с формированием циклического защищенного диола; и
PB представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил.
Структура соединения формулы (IHb) имеет вид:
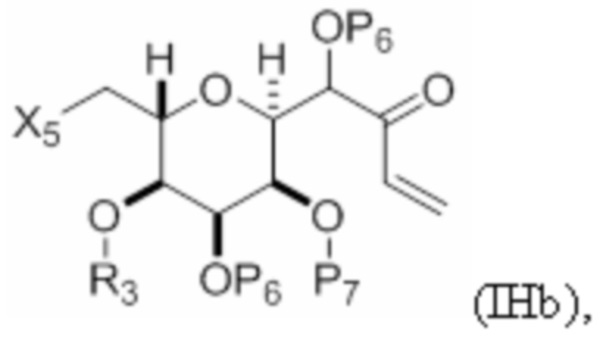
где
X5 представляет собой -CH=CH2 или -CH(R4)- CH(R5)- CH(R6)- C(X4)OPB;
X4 представляет собой=O, или X4 объединен вместе с атомом углерода, к которому он присоединен, с формированием -CH2-;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H; и
каждый из P6 и P7 независимо представляет собой гидроксил-защитную группу, или один P6 и P7 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя (например, один P6 и P7 объединены с формированием циклогексилидена), и оставшийся P6 представляет собой гидроксил-защитную группу; или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, и P7 представляет собой гидроксил-защитную группу.
Структура соединения формулы (IJ) имеет вид:
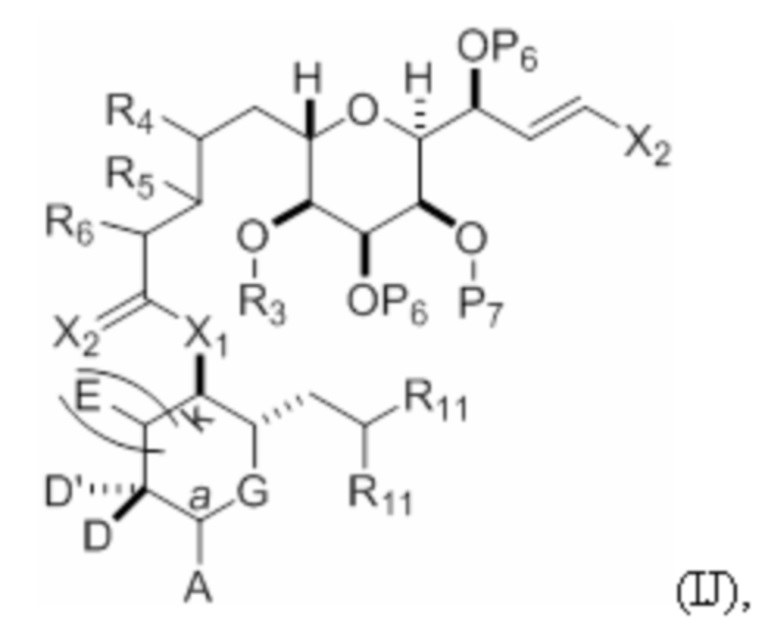
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
 ,
,  , и
, и  ,
,
где каждый P(независимо представляет собой гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-;
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
(i) каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый R11 независимо представляет собой -OP10, или
оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу;
или
(ii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя;
P7 представляет собой гидроксил-защитную группу; и
X2 представляет собой галоген или псевдогалоген.
Структура соединения формулы (IN) имеет вид:
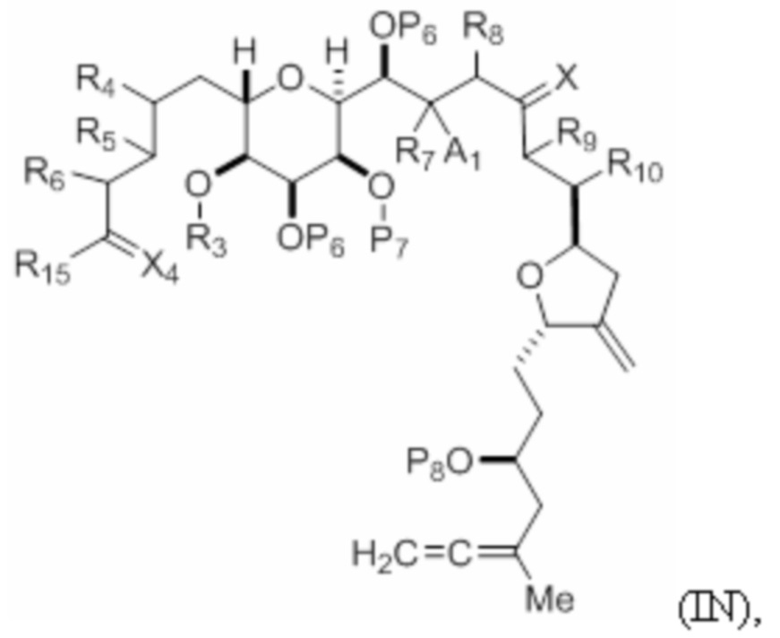
или его соль или таутомер,
где
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(i) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(ii) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу;
каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя, и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; или оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя; где если оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, то P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
R9 представляет собой H, SO2RC или COORC, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, где если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R15 представляет собой H или -OP11, где P11 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил;
X4 представляет собой=O или вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-, при условии, что если R15 представляет собой H, то X4 представляет собой=O; и
P8 представляет собой H или силил.
Согласно некоторым вариантам осуществления, каждый PA представляет собой H, или оба PA объединены с формированием циклического защищенного диола. Согласно другим вариантам осуществления, A1 представляет собой H. Согласно еще одним вариантам осуществления, каждый R11 представляет собой -OP10, где P10 представляет собой алкил. Согласно другим вариантам осуществления, R9 представляет собой H или SO2RC, и R10 представляет собой H. Согласно определенным вариантам осуществления, R9 представляет собой SO2RC. Согласно дополнительным вариантам осуществления, P8 представляет собой силил. Согласно конкретным вариантам осуществления, P6 представляет собой гидроксил-защитную группу, и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-. Согласно определенным вариантам осуществления, R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H. Согласно дополнительным вариантам осуществления, R5 и R6 объединены вместе с атомом, к которому каждый из них присоединен, с формированием двойной связи, R4 представляет собой H, и R3 представляет собой гидроксил-защитную группу. Согласно другим дополнительным вариантам осуществления, R7 и P7 объединены с формированием связи, и R8 представляет собой H. Согласно другим дополнительным вариантам осуществления, P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи. Согласно определенным вариантам осуществления, A3 представляет собой H. Согласно конкретным вариантам осуществления, A2 представляет собой H.
Согласно дополнительным вариантам осуществления, стереогенный центр, обозначаемый как a, представляет собой (R), и A имеет следующую структуру:
 .
.
Согласно другим дополнительным вариантам осуществления, k равен 0, и X1 представляет собой -CH2-. Согласно другим дополнительным вариантам осуществления, R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0.
Согласно другим вариантам осуществления, A и D объединены с формированием следующей структуры:
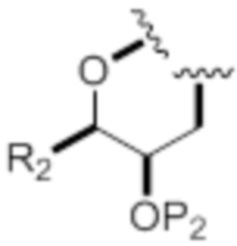 ,
,
где связь с атомом кислорода возникает по атому углерода, к которому присоединен D в формуле (IA), и где R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 2.
Согласно еще одним вариантам осуществления, k равен 1, и E представляет собой необязательно замещенный алкил. Согласно другим вариантам осуществления,X1 представляет собой -O-.
Согласно определенным вариантам осуществления соединения формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, D представляет собой H, D' представляет собой OP1, и A имеет следующую структуру:
 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой H или N-защитную группу, и P2 и P4 объединены с формированием алкилидена; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо.
Согласно конкретным вариантам осуществления соединения формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, D представляет собой H, D' представляет собой OP1, и A имеет следующую структуру:
 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой N-защитную группу, и P2 и P4 объединены с формированием алкилидена; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, каждый из P2 и P5 независимо представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо.
Согласно еще одному аспекту, изобретение относится к соединениям 1, 2, 3, 5, 7, 7a, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 21, 23, 24, 25, 27, 28, 29, 31, 32, 33, 34, 35, 36, 36b, 36c, 37, 38, 39, 40, 41, 43, 44, 44a, 45, 47, 47a, 47b, 47c, 48, 49, 50, 50a, 51, 52, 53, 54, 55, 56, 57, 58, 59, 61, 62, 63, 66, 67, 68, 69, 70, 71, 72, 73, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86 и 87.
Определения
Соединения, применимые в настоящем изобретении, могут представлять собой меченые изотопами соединения. Применимые изотопы включают в себя водород, углерод, азот и кислород (например, 2H, 3H, 13C, 14C, 15N, 18O и 17O). Меченые изотопами соединения могут быть получены путем синтеза соединения с использованием легкодоступного меченого изотопами реагента вместо не меченого изотопами реагента.
Для любого из последующих химических определений, число, следующее за символом атома, обозначает общее число атомов этого элемента, которое содержится в конкретном химическом фрагменте. Как следует понимать, для удовлетворения требований к валентности атомов, при необходимости могут присутствовать другие атомы, такие как атомы водорода или замещающие группы, описанные в настоящем документе. Например, незамещенная C2алкильная группа характеризуется формулой -CH2CH3. При использовании в группах, определенных в настоящем документе, ссылка на число атомов углерода включает в себя двухвалентный атом углерода в ацетальной и кетальной группах, но не включает в себя карбонильный атом углерода в ацильной, сложноэфирной, карбонатной или карбаматной группах. Ссылка на число атомов кислорода, азота или серы в гетероарильной группе включает в себя только те атомы, которые формируют гетероциклическое кольцо.
Под «ацеталем» подразумевают -O- (CHR)- O-, где R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил, или группа R представляет собой связь с пронумерованным атомом углерода, представленным на чертеже 1, в составе промежуточного продукта или в составе макролида галихондринового ряда или его аналога.
Под «ацетилом» подразумевают ацил, в котором R представляет собой -CXnH3-n, где n равен 0, 1, 2 или 3, и каждый X независимо представляет собой алкокси или галоген, при условии, что если n равен 3, то каждый X независимо представляет собой галоген, и если n равен 2, то либо обе группы X независимо представляют собой галоген, либо обе группы X независимо представляют собой алкокси. Ацетильная группа может быть замещенной (т.е., n равен 1, 2 или 3) либо незамещенной (т.е., n равен 0).
Под «ацилом» подразумевают -C(O)R, где R представляет собой H, алкил, алкенил, арил или арилалкил. В иллюстративных ацильных группах, R представляет собой H, C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 или C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 или C3-6алкенил), C6-20арил (например, C6-14, C6-10, C8-20 или C8-14арил), моноциклический C1-6 гетероарил (например, моноциклический C1-4 или C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-14)арил(C1-6)алкил, (C1-6)гетероарил(C1-6)алкил или (C4-9)гетероарил(C1-6)алкил. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в ацильной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N и S. Ацильная группа может быть незамещенной или замещенной (например, необязательно замещенный ацил). В необязательно замещенной ацильной группе, заместитель R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил. Согласно некоторым вариантам осуществления, ацил представляет собой C2-10ацил.
Под «ацилирующим агентом» подразумевают соединение, которое взаимодействует с амином или гидроксильной группой с получением амида или сложного эфира, соответственно. Ацилирующий агент характеризуется формулой R-LG, где R представляет собой ацил, и LG представляет собой галоген, карбонат или -OR', где R' представляет собой ацил.
Под «алкоксидом» подразумевают анионное соединение RO-, где R представляет собой алкил. Противоион для алкоксида может представлять собой катион щелочного металла, катион щелочноземельного металла или катион тетраалкиламмония. Алкоксид может быть необязательно замещен таким же образом, как и алкил.
Под «алкокси» подразумевают -OR, где R представляет собой алкил. Алкокси может быть необязательно замещен таким же образом, как и алкил.
Под «алкоксиалкилом» подразумевают -OR, где R представляет собой алкил, замещенный алкокси. Каждая часть алкоксиалкила может быть необязательно замещена таким же образом, как и алкил.
Под «алкоксиарилом» подразумевают -R'(Rʺ)n, где n равен 1 или 2, R' представляет собой арилен, и R'' представляет собой алкокси, определенный в настоящем документе. R' может быть дополнительно необязательно замещен таким же образом, как и арил. R'' может быть необязательно замещен таким же образом, как и алкил.
Под «алкоксиарилалкилом» подразумевают -R'(Rʺ(Rʺ')n), где n равен целому числу от 1 до 3, R' представляет собой алкилен, R'' представляет собой арилен, и Rʺ' представляет собой алкокси, определенный в настоящем документе. R' может быть необязательно замещен таким же образом, как и алкил. R'' может быть дополнительно необязательно замещен таким же образом, как и арил. Rʺ' может быть необязательно замещен таким же образом, как и алкил.
Под «алкилом» подразумевают неразветвленную или разветвленную насыщенную циклическую (т.е., циклоалкильную) или ациклическую углеводородную группу, содержащую от 1 до 12 атомов углерода, если не указано иное. Согласно некоторым вариантам осуществления, алкил представляет собой C1-6алкил. Иллюстративные алкильные группы включают в себя C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил. Конкретные примеры включают в себя метил, этил, 1-пропил, 2-пропил, 2-метил-1-пропил, 1-бутил, 2-бутил, и т.п. Алкильная группа может быть необязательно замещена 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из галогена, гидрокси, алкокси, арилокси, арилалкилокси, амино, оксо, алкилтио, алкилендитио, алкиламино, [алкенил]алкиламино, [арил]алкиламино, [арилалкил]алкиламино, диалкиламино, силила, сульфонила, циано, нитро, карбоксила и азидо.
Под «алкиламино» подразумевают -NHR, где R представляет собой алкил. Под «[алкенил]алкиламино» подразумевают -NRR', где R представляет собой алкил, и R' представляет собой алкенил. Под «[арил]алкиламино» подразумевают -NRR', где R представляет собой алкил, и R' представляет собой арил. Под «[арилалкил]алкиламино» подразумевают -NRR', где R представляет собой алкил, и R' представляет собой арилалкил. Под «диалкиламино» подразумевают -NR2, где каждый R представляет собой независимо выбранный алкил.
Под «алкиларилом» подразумевают -R'(Rʺ)n, где n равен целому числу от 1 до 3, R' представляет собой арилен, и R' представляет собой алкил. Алкиларил может быть необязательно замещен таким же образом, как определено для каждой группы R' и Rʺ.
Под «алкиленом» подразумевают многовалентную алкильную группу. Алкиленовые группы могут быть необязательно замещены таким же образом, как и алкильные группы. Алкилен может представлять собой двухвалентный алкилен. Например, C1алкиленовая группа представляет собой -CH2-.
Под «алкилендитио» подразумевают -S-алкилен-S-. Алкилендитио может быть необязательно замещен таким же образом, как и алкиленовая группа.
Под «алкилгалогенарилом» подразумевают -R'(Rʺ)n-Rʺ', где n равен целому числу от 1 до 5, и R' представляет собой арилен, Rʺ представляет собой галоген, и Rʺ' представляет собой алкилен, определенный в настоящем документе. R' может быть дополнительно необязательно замещен таким же образом, как и арил. Rʺ' может быть дополнительно необязательно замещен таким же образом, как и алкил.
Под «алкилтио» подразумевают -SR, где R представляет собой алкил. Алкилтио может быть необязательно замещен таким же образом, как и алкильная группа.
Под «алкенилом» подразумевают неразветвленную или разветвленную циклическую или ациклическую углеводородную группу, состоящую, если не указано иное, из 2-12 атомов углерода и содержащую одну или несколько углерод-углеродных двойных связей. Согласно некоторым вариантам осуществления, алкенил представляет собой C2-6алкенил. Иллюстративные алкенильные группы включают в себя C2-8, C2-7, C2-6, C2-4, C3-12 и C3-6алкенил. Конкретные примеры включают в себя этенил (т.е., винил), 1-пропенил, 2-пропенил (т.е., аллил), 2-метил-1-пропенил, 1-бутенил, 2-бутенил (т.е., кротил), и т.п. Алкенильная группа может быть необязательно замещена таким же образом, как и алкильные группы. Алкенильные группы, использованные в любом контексте в настоящем документе, могут быть также замещены арильной группой.
Под «амидо» подразумевают -NHR, где R представляет собой ацил. Амидо может быть необязательно замещен таким же образом, как и ацил.
Под «аминалем» подразумевают -O-CR2-NR'-, где каждый R независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил, или обе группы R вместе представляют собой необязательно замещенный алкилен, и R(представляет собой H или N-защитную группу. В частности, R(может представлять собой N-защитную группу (например, Boc).
Под «амино» подразумевают -NR2, где N и R2 объединены с формированием азидо, или каждый R независимо представляет собой H или N-защитную группу, или оба R объединены с формированием N-защитной группы. Амино может быть незащищенным, если каждый R представляет собой H, или защищенным, если по меньшей мере один R не представляет собой H. Таким образом, необязательно замещенный амино может быть защищенным или незащищенным амино.
Под «аминоалкил» подразумевают -R'(Rʺ)n, где n равен 1 или 2, R' представляет собой алкилен, и Rʺ представляет собой амино, определенный в настоящем документе. R' может быть необязательно замещен таким же образом, как и алкильная группа.
Под «арилом» подразумевают моноциклическую или многоциклическую кольцевую систему, содержащую одно или несколько ароматических колец, где кольцевая система является карбоциклической. Иллюстративные арильные группы включают в себя C6-20, C6-15, C6-10, C8-20 и C8-15арил. Предпочтительная арильная группа представляет собой C6-10арильную группу. Конкретные примеры карбоциклической арильной группы включают в себя фенил, инданил, инденил, нафтил, фенантрил, антрацил и флуоренил. Арильная группа может быть необязательно замещена 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из алкила, алкенила, арила, арилалкила, галогена, алкокси, арилокси, арилалкилокси, алкилтио, алкилендитио, алкиламино, [алкенил]алкиламино, [арил]алкиламино, [арилалкил]алкиламино, диалкиламино, силила, сульфонила, циано, нитро, карбоксила и азидо.
Под «арилалкилом» подразумевают -R'Rʺ, где R' представляет собой алкилен, и Rʺ представляет собой арил. Арилалкил может быть необязательно замещен таким же образом, как определено для каждой группы R' и Rʺ.
Под «арилалкилокси» подразумевают -OR, где R представляет собой арилалкил. Арилалкилокси может быть необязательно замещен таким же образом, как определено для арилалкила.
Под «ариленом» подразумевают многовалентную арильную группу. Ариленовые группы могут быть необязательно замещены таким же образом, как и арильные группы. Например, C6ариленовая группа представляет собой фенилен.
Под «арилокси» подразумевают -OR, где R представляет собой арил. Арилокси может быть необязательно замещен таким же образом, как и арил.
Под «азидо» подразумевают -N3.
Под «боронатом» подразумевают -OB(R)O-, где R представляет собой алкил, алкенил, арил, арилалкил, алкокси или 2,6-диацетамидофенил. Боронат может быть замещенным, если R представляет собой замещенный алкил, замещенный алкенил, замещенный арил, замещенный арилалкил или замещенный алкокси. В качестве альтернативы, боронат может быть незамещенным, если R представляет собой незамещенный алкил, незамещенный алкенил, арил, незамещенный арилалкил, незамещенный алкокси или 2,6-диацетамидофенил.
Под «карбаматом» подразумевают группу, в которой гидроксил-защитная группа, характеризующаяся формулой -OC(O)NR2, или в которой амин-защитная группа, характеризующаяся формулой -NR'-C(O)OR, где каждый R и R' независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под «карбонатом» подразумевают -OC(O)OR, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под «карбонилом» подразумевают -C(O)-.
Под «карбоксилом» подразумевают -C(O)OH в виде свободной кислоты, в ионизированной или солевой форме.
Под «карбоновой кислотой» подразумевают R-OH, где R представляет собой необязательно замещенный ацил.
Под «ангидридом карбоновой кислоты» подразумевают R-O-R, где каждый R независимо представляет собой необязательно замещенный ацил.
Под «циклическим карбонатом» подразумевают -OC(O)O-, который представляет собой часть кольца.
Под «дикарбонилом» подразумевают -C(O)- C(O)-. Дикарбонилдиоксо представляет собой -OC(O)- COO-.
Под «сложным эфиром» подразумевают -OC(O)R, где -C(O)R представляет собой необязательно замещенную ацильную группу.
Под «простым эфиром» подразумевают -OR, где R представляет собой алкил, алкенил, арилалкил, силил или 2-тетрагидропиранил. Простой эфир может быть необязательно замещен, как определено для каждой группы R.
Под «макролидом галихондринового ряда» подразумевают лактон, включающий в себя структуру из атомов углерода 1-30, представленную на чертеже 1, где атомы углерода 29 и 30 формируют часть пяти- или шести-членного кольца.
Под «галогеналкилом» подразумевают -R'(Rʺ)n, где n равен целому числу от 1 до 5, и R(представляет собой алкилен, и R' представляет собой галоген, определенный в настоящем документе. R(может быть дополнительно необязательно замещен таким же образом, как и алкил.
Под «галогенарилом» подразумевают -R'(Rʺ)n, где n равен целому числу от 1 до 5, и R' представляет собой арилен, и Rʺ представляет собой галоген, определенный в настоящем документе. R' может быть дополнительно необязательно замещен таким же образом, как и арил.
Под «галогенарилалкилом» подразумевают -R'(Rʺ(Rʺ')n), где n равен целому числу от 1 до 5, и R' представляет собой алкилен, Rʺ представляет собой арилен, и Rʺ' представляет собой галоген, определенный в настоящем документе. R' может быть дополнительно необязательно замещен таким же образом, как и алкил. Rʺ может быть дополнительно необязательно замещен таким же образом, как и арил.
Под «галогеном» подразумевают фтор, хлор, бром или йод.
Если не указано иное, то под «гетероциклическим радикалом» подразумевают 5-, 6- или 7-членное кольцо, содержащее 1, 2, 3 или 4 гетероатома, независимо выбранные из группы, состоящей из азота, кислорода и серы. Пятичленное кольцо содержит 0-1 двойных связей, и 6- и 7-членные кольца содержать 0-2 двойных связей. Определенные гетероциклические группы включают в себя от 1 до 9 атомов углерода. Другие такие группы могут включать в себя до 12 атомов углерода. Термин «гетероциклил» также описывает гетероциклическое соединение, содержащее связанную мостиковой связью многоциклическую структуру, в которой один или несколько атомов углерода и/или гетероатомов связывают мостиковой связью два несмежных атома моноциклического кольца, например, хинуклидинильную группу. Термин «гетероциклил» включает в себя бициклические, трициклические и тетрациклические группы, в которых любое из описанных выше гетероциклических колец конденсировано с одним, двумя или тремя карбоциклическими кольцами, например, арильным кольцом, циклогексановым кольцом, циклогексеновым кольцом, циклопентановым кольцом, циклопентеновым кольцом или другим моноциклическим гетероциклическим кольцом, таким как индолил, хинолил, изохинолил, тетрагидрохинолил, бензофурил, бензотиенил, и т.п. Примеры конденсированных гетероциклилов включают в себя тропаны и 1,2,3,5,8,8a-гексагидроиндолизин. Гетероциклилы включают в себя пирролил, пирролинил, пирролидинил, пиразолил, пиразолинил, пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиперидинил, гомопиперидинил, пиразинил, пиперазинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолил, тиазолидинил, изотиазолил, изотиазолидинил, индолил, хинолинил, изохинолинил, бензимидазолил, бензотиазолил, бензоксазолил, фурил, тиенил, тиазолидинил, изотиазолил, изоиндазолил, триазолил, тетразолил, оксадиазолил, пуринил, тиадиазолил (например, 1,3,4-тиадиазол), тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, дигидротиенил, дигидроиндолил, тетрагидрохинолил, тетрагидроизохинолил, пиранил, дигидропиранил, дитиазолил, бензофуранил, бензотиенил и т.п. Другие иллюстративные гетероциклилы включают в себя: 2,3,4,5-тетрагидро-2-оксооксазолил; 2,3-дигидро-2-оксо-1H-имидазолил; 2,3,4,5-тетрагидро-5-оксо-1H-пиразолил (например, 2,3,4,5-тетрагидро-2-фенил-5-оксо-1H-пиразолил); 2,3,4,5-тетрагидро-2,4-диоксо-1H-имидазолил (например, 2,3,4,5-тетрагидро-2,4-диоксо-5-метил-5-фенил-1H-имидазолил); 2,3-дигидро-2-тиоксо-1,3,4-оксадиазолил (например, 2,3-дигидро-2-тиоксо-5-фенил-1,3,4-оксадиазолил); 4,5-дигидро-5-оксо-1H-триазолил (например, 4,5-дигидро-3-метил-4-амино-5-оксо-1H-триазолил); 1,2,3,4-тетрагидро-2,4-диоксопиридинил (например, 1,2,3,4-тетрагидро-2,4-диоксо-3,3-диэтилпиридинил); 2,6-диоксопиперидинил (например, 2,6-диоксо-3-этил-3-фенилпиперидинил); 1,6-дигидро-6-оксопиримидинил; 1,6-дигидро-4-оксопиримидинил (например, 2-(метилтио)-1,6-дигидро-4-оксо-5-метилпирмидин-1-ил); 1,2,3,4-тетрагидро-2,4-диоксопиримидинил (например, 1,2,3,4-тетрагидро-2,4-диоксо-3-этилпиримидинил); 1,6-дигидро-6-оксопиридазинил (например, 1,6-дигидро-6-оксо-3-этилпиридазинил); 1,6-дигидро-6-оксо-1,2,4-триазил (например, 1,6-дигидро-5-изопропил-6-оксо-1,2,4-триазил); 2,3-дигидро-2-оксо-1H-индолил (например, 3,3-диметил-2,3-дигидро-2-оксо-1H-индолил и 2,3-дигидро-2-оксо-3,3'-спиропропан-1H-индол-1-ил); 1,3-дигидро-1-оксо-2H-изоиндолил; 1,3-дигидро-1,3-диоксо-2H-изоиндолил; 1H-бензопиразолил (например, 1-(этоксикарбонил)-1H-бензопиразолил); 2,3-дигидро-2-оксо-1H-бензимидазолил (например, 3-этил-2,3-дигидро-2-оксо-1H-бензимидазолил); 2,3-дигидро-2-оксобензоксазолил (например, 5-хлор-2,3-дигидро-2-оксобензоксазолил); 2,3-дигидро-2-оксобензоксазолил; 2-оксо-2H-бензопиранил; 1,4-бензодиоксанил; 1,3-бензодиоксанил; 2,3-дигидро-3-оксо,4H-1,3-бензотиазинил; 3,4-дигидро-4-оксо-3H-хиназолинил (например, 2-метил-3,4-дигидро-4-оксо-3H-хиназолинил); 1,2,3,4-тетрагидро-2,4-диоксо-3H-хиназолил (например, 1-этил-1,2,3,4-тетрагидро-2,4-диоксо-3H-хиназолил); 1,2,3,6-тетрагидро-2,6-диоксо-7H-пуринил (например, 1,2,3,6-тетрагидро-1,3-диметил-2,6-диоксо-7H-пуринил); 1,2,3,6-тетрагидро-2,6-диоксо-1H-пуринил (например, 1,2,3,6-тетрагидро-3,7-диметил-2,6-диоксо-1H-пуринил); 2-оксобенз[c,d]индолил; 1,1-диоксо-2H-нафт[1,8-c,d]изотиазолил; и 1,8-нафтилендикарбоксамидо. Гетероциклические группы также включают в себя группы формулы
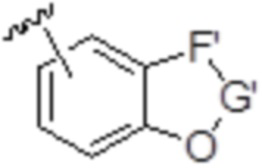 , где
, где
F′ выбран из группы, состоящей из -CH2-, -CH2O- и -O-, и G′ выбран из группы, состоящей из -C(O)- и -(C(R')(Rʺ))v-, где каждый из R' и Rʺ независимо выбран из группы, состоящей из водорода или алкила, состоящего из 1-4 атомов углерода, и v равен 1-3, и включает в себя такие группы, как 1,3-бензодиоксолил, 1,4-бензодиоксанил, и т.п. Любая из упомянутых в настоящем документе гетероциклильных групп может быть необязательно замещена одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из группы, состоящей из: (1) алканоила (например, формил, ацетил, и т.п.); (2) алкила (например, алкоксиалкилен, алкилсульфинилалкилен, аминоалкилен, азидоалкилен, ацилалкилен, галогеналкилен (например, перфторалкил), гидроксиалкилен, нитроалкилен или тиоалкоксиалкилен); (3) алкенила; (4) алкинила; (5) алкокси (например, перфторалкокси); (6) алкилсульфинила; (7) арила; (8) амино; (9) арилалкилена; (10) азидо; (11) циклоалкила; (12) циклоалкилалкилена; (13) циклоалкенила; (14) циклоалкенилалкилена; (15) галогена; (16) гетероциклила (например, гетероарил); (17) (гетероциклил)окси; (18) (гетероциклил)аза; (19) гидрокси; (20) оксо; (21) нитро; (22) сульфида; (23) тиоалкокси; (24) (CH2)qCO2RA, где q равен целому числу от 0 до 4, и RA выбран из группы, состоящей из (a) алкила, (b) арила, (c) водорода и (d) арилалкилена; (25) -(CH2)qCONRBRC, где q равен целому числу от 0 до 4, и где RB и RC независимо выбраны из группы, состоящей из (a) водорода, (b) алкила, (c) арила и (d) арилалкилена; (26) -(CH2)qSO2RD, где q равен целому числу от 0 до 4, и где RD выбран из группы, состоящей из (a) алкила, (b) арила и (c) арилалкилена; (27) -(CH2)qSO2NRERF, где q равен целому числу от 0 до 4, и где каждый из RE и RF независимо выбран из группы, состоящей из (a) водорода, (b) алкила, (c) арила и (d) арилалкилена; (28) тиола; (29) арилокси; (30) циклоалкокси; (31) арилалкокси; (31) гетероциклилалкилена (например, гетероарилалкилен); (32) силила; (33) циано; и (34) -S(O)RH, где RH выбран из группы, состоящей из (a) водорода, (b) алкила, (c) арила и (d) арилалкилена. Согласно некоторым вариантам осуществления, каждая из указанных групп, может быть дополнительно замещена, как описано в настоящем документе. Например, алкиленовая группа арил-C1-алкилена или гетероциклил-C1-алкилена может быть дополнительно замещена оксогруппой с получением соответствующей арилоильной и (гетероциклил)оильной замещающей группы. Кроме того, если гетероциклильная группа присутствует в биообратимой группе согласно настоящему изобретению, то она может быть замещена сложноэфирной, тиоэфирной или дисульфидной группой, которая связана с конъюгирующим фрагментом, гидрофильной функциональной группой или вспомогательным фрагментом, описанными в настоящем документе.
Используемый в настоящем документе термин «гетероциклический радикал-алкил» представляет собой алкильную группу, замещенную гетероциклическим радикалом. Фрагмент гетероциклического радикала и фрагмент алкила может быть замещен, как отдельные группы, описанные в настоящем документе.
Под «гидроксиалкилом» подразумевают -R'(Rʺ)n, где n равен 1 или 2, R' представляет собой алкилен, и Rʺ представляет собой гидроксил, определенный в настоящем документе. R(может быть дополнительно необязательно замещен таким же образом, как и алкил.
Под «гидроксиарилом» подразумевают -R'(Rʺ)n, где n равен 1 или 2, R' представляет собой арилен, и Rʺ представляет собой гидроксил, определенный в настоящем документе. R(может быть дополнительно необязательно замещен таким же образом, как и арил.
Под «гидроксилом» подразумевают -OH.
Под «гидроксил-защитной группой» подразумевают любую группу, способную защитить атом кислорода, к которому она присоединена, от взаимодействия или формирования связи. Гидроксил-защитные группы известны из уровня техники, например, описаны в документе Wuts, Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 4th Edition, 2006. Иллюстративные защитные группы (с атомом кислорода, к которому они присоединены) независимо выбирают из группы, состоящей из сложных эфиров, карбонатов, карбаматов, сульфонатов и простых эфиров. В иллюстративных сложноэфирных гидроксил-защитных группах, R в ацильной группе представляет собой C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6алкенил), карбоциклический C6-20арил (например, C6-15, C6-10, C8-20 и C8-15арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры ацильных групп для применения в сложных эфирах включают в себя формил, бензоилформил, ацетил (например, незамещенный или хлорацетил, трифторацетил, метоксиацетил, трифенилметоксиацетил, и пара-хлорфеноксиацетил), 3-фенилпропионил, 4-оксопентаноил, 4,4-(этилендитио)пентаноил, пивалоил (Piv), винилпивалоил, кротоноил, 4-метоксикротоноил, нафтоил (например, 1- или 2-нафтоил) и бензоил (например, незамещенный или замещенный, например, пара-метоксибензоил, фталоил (включая соли, такие как соли триэтиламина и калия), пара-бромбензоил и 2,4,6-триметилбензоил). Как определено в настоящем документе, любая гетероарильная группа, присутствующая в сложноэфирной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S. В иллюстративных карбонатных гидроксил-защитных группах, R представляет собой C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6алкенил), карбоциклический C6-20арил (например, C6-15, C6-10, C8-20 и C8-15арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры включают в себя метил, 9-флуоренилметил, этил, 2,2,2-трихлорэтил, 2-(триметилсилил)этил, 2-(фенилсульфонил)этил, винил, аллил, трет-бутил, пара-нитробензил и бензилкарбонаты. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в карбонатной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S. В иллюстративных карбаматных гидроксил-защитных группах, каждый R независимо представляет собой H, C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6алкенил), карбоциклический C6-20арил (например, C6-15, C6-10, C8-20 и C8-15арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры включают в себя N-фенил и N-метил-N-(орто-нитрофенил)карбаматы. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в карбаматной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S. Иллюстративные эфирные гидроксил-защитные группы включают в себя C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6алкенил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил, (C1-6)гетероарил(C1-6)алкил, (C1-6)алкокси(C1-6)алкил, (C1-6)алкилтио(C1-6)алкил, (C6-10)арил(C1-6)алкокси(C1-6)алкил и силил (например, три(C1-6алкил)силил, три(C6-10арил или C1-6 гетероарил)силил, ди(C6-10арил или C1-6 гетероарил)(C1-6алкил)силил и (C6-10арил или C1-6 гетероарил)ди(C1-6алкил)силил). Конкретные примеры алкилэфиров включают в себя метил- и трет-бутил, и примером алкенилэфира является аллил. Эфирные гидроксил-защитные группы могут быть использованы для защиты карбоксильной группы (например, C1-12алкилом (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6алкилом), (C6-15)арил(C1-6)алкилом, (C1-6)алкокси(C1-6)алкилом, (C1-6)алкилтио(C1-6)алкилом или (C6-10)арил(C1-6)алкокси(C1-6)алкилом). Примеры алкоксиалкилов и алкилтиоалкилов, которые могут быть использованы в качестве эфирной гидроксил-защитной группы, включают в себя метоксиметил, метилтиометил, (2-метоксиэтокси)метил и β-(триметилсилил)-этоксиметил. Примеры арилалкильных групп, которые могут быть использованы в качестве эфирной гидроксил-защитной группы, включают в себя бензиловый, пара-метоксибензиловый (MPM), 3,4-диметоксибензиловый, трифенилметиловый (тритиловый), орто-нитробензиловый, пара-нитробензиловый, пара-галогенбензиловый, 2,6-дихлорбензиловый, пара-цианобензиловый, нафтилметиловый, и 2- и 4-пиколиловые эфиры. Конкретные примеры силиловых эфиров включают в себя триметилсилиловый (TMS), триэтилсилиловый (TES), трет-бутилдиметилсилиловый (TBS), трет-бутилдифенилсилиловый (TBDPS), триизопропилсилиловый (TIPS) и трифенилсилиловый (TPS) эфиры. Примером арилалкилоксиалкилового эфира является бензилоксиметиловый эфир. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в эфирной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S. Вицинальные или 1,3-диолы могут быть замещены диол-защитной группой (например, с получением «циклического защищенного диола»), такой как ацеталь (например, содержащий C1-6алкилен), кеталь (например, содержащий C3-6алкилен или C3-6циклоалкил), циклический силилен, циклический карбонат и циклический боронат. Примеры ацеталя и кеталя включают в себя метилендиоксо, этилидендиоксо, бензилидендиоксо, изопропилидендиоксо, циклогексилидендиоксо и циклопентилидендиоксо. Примером циклического силилена является ди-трет-бутилсилилен. Другой диол-защитной группой является 1,1,3,3-тетраизопропилсилоксандиил. Примеры циклических боронатов включают в себя метил, этил, фенил и 2,6-диацетамидофенил боронаты. Защитные группы могут быть защищены, как известно из уровня техники; например, арильные и арилалкильные группы, такие как фенил, бензил, нафтил или пиридинил, могут быть замещены C1-6алкилом, C1-6алкокси, нитро, циано, карбоксилом или галогеном. Алкильные группы, такие как метил, этил, изопропил, н-пропил, трет-бутил, н-бутил и втор-бутил, и алкенильные группы, такие как винил и аллил, также могут быть замещены оксо, арилсульфонильными, галогеновыми и триалкилсилильными группами. Предпочтительными защитными группами являются TBS и Piv. Защитные группы, которые являются ортогональными, удаляются в различных условиях, известных из уровня техники.
Под «имидо» подразумевают -NR2, где каждый R независимо представляет собой необязательно замещенный ацил.
Под «кеталем» подразумевают -O-CR2-O-, где каждый R независимо представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил, или обе группы R вместе представляют собой необязательно замещенный алкилен, или каждая из групп R представляет собой связь с пронумерованным атомом углерода, представленным на чертеже 1, в составе промежуточного продукта или в составе макролида галихондринового ряда или его аналога.
Под «макроциклическим» подразумевают соединение, содержащее по меньшей мере одно n-членное кольцо, где n больше или равен 10.
Под «неенолизируемой» подразумевают группу, которая по отдельности или в сочетании с группой, к которой она присоединена, не способна формировать енол посредством депротонирования/репротонирования. Например, «неенолизируемый алкил» может быть связан с сульфоновой группой или с карбонильной группой через четвертичный атом углерода (т.е., атом углерода, который не связан с атомом водорода).
Под «N-защитной группой» подразумевают группу, защищающую в молекуле атом азота от участия в одной или нескольких нежелательных реакциях в процессе химического синтеза (например, в реакциях окисления или определенных нуклеофильных и электрофильных замещениях). Традиционно используемые N-защитные группы раскрыты в документе Wuts, Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 4th Edition, 2006. Иллюстративные N-защитные группы включают в себя ацил (например, формил, ацетил, трифторацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, орто-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил и 4-бромбензоил); сульфонил-содержащие группы (например, бензолсульфонил, пара-толуолсульфонил, орто-нитробензолсульфонил и пара-нитробензолсульфонил); карбонат-образующие группы (например, бензилоксикарбонил, пара-хлорбензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, пара-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(пара-бифенилил)-1-метилэтоксикарбонил, α, (-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил и фенилтиокарбонил), арилалкил (например, трифенилметил); силильные группы (например, триметилсилил); и имин-образующие группы (например, дифенилметилен). Предпочтительными N-защитными группами являются ацетил, бензоил, фенилсульфонил, пара-толуолсульфонил, пара-нитробензолсульфонил, орто-нитробензолсульфонил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Под «оксо» или (O) подразумевают=O.
Под «фармацевтически приемлемой солью» подразумевают соль, подходящую в рамках здравого медицинского суждения для использования в контакте с тканями людей и животных без проявления нежелательной токсичности, раздражения, аллергической реакции, и т.п., соразмерного с приемлемым соотношением пользы и риска. Фармацевтически приемлемые соли хорошо известны из уровня техники. Например, фармацевтически приемлемые соли описаны в документах Berge et al., J. Pharmaceutical Sciences 66:1-19, 1977 и Pharmaceutical Salts: Properties, Selection, и Use, (Eds. P.H. Stahl and C.G. Wermuth), Wiley-VCH, 2008. Типичные представители кислотно-аддитивных солей включают в себя ацетаты, адипаты, альгинаты, аскорбаты, аспартаты, бензолсульфонаты, бензоаты, бисульфаты, бораты, бутираты, камфораты, камфорсульфонаты, цитраты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, глюкогептонаты, глицерофосфаты, гемисульфаты, гептонаты, гексаноаты, гидробромиды, гидрохлориды, гидройодиды, 2-гидроксиэтансульфонаты, лактобионаты, лактаты, лаураты, лаурилсульфаты, малаты, малеаты, малонаты, метансульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, олеаты, оксалаты, пальмитаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, фосфаты, пикраты, пивалаты, пропионаты, стеараты, сукцинаты, сульфаты, тартраты, тиоцианаты, толуолсульфонаты, ундеканоаты, валераты, и т.п. Предпочтительной солью является мезилат.
Под «псевдогалогеном» подразумевают -O-SO2R, где R представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил. Неограничивающие примеры псевдогалогенов включают в себя трифторметансульфонат и нонафлат.
Под «силилом» подразумевают -SiR3, где каждый R независимо представляет собой алкил, алкенил, арил или арилалкил. Примеры силильной группы включают в себя три(C1-6алкил)силил, три(C6-10арил или C1-6 гетероарил)силил, ди(C6-10арил или C1-6 гетероарил)(C1-6алкил)силил и (C6-10арил или C1-6 гетероарил)ди(C1-6алкил)силил. Следует понимать, что если силильная группа включает в себя две или более алкильные, алкенильные, арильные, гетероарильные или арилалкильные группы, то указанные группы выбирают независимо. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в силильной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S. Силил может быть необязательно замещен таким же образом, как определено для каждой группы R.
Под «силиленом» подразумевают -SiR2-, где каждый R независимо представляет собой алкил, алкенил, арил, арилалкил или алкокси. Под «диалкилсилиленом» подразумевают силилен, где каждый R представляет собой алкил. Силилен может быть необязательно замещен таким же образом, как определено для каждой группы R. Силилендиоксо представляет собой группу, характеризующуюся формулой -O-SiR2-O-.
Под «сильным основанием» подразумевают основание Бренстеда, сопряженная кислота которого характеризуется значением pKa, большим или равным 13. Неограничивающие примеры сильных оснований включают в себя алкил-щелочные металлы (например, бутиллитий или основание Шлоссера), реактивы Гриньяра (например, алкилмагнийгалогенид), алкоксиды щелочных или щелочноземельных металлов (например, третичные алкоксиды, такие как трет-бутоксид), амиды щелочных или щелочноземельных металлов (например, диизопропиламид, тетраметилпиперидид или бис(триметилсилил)амид) и фосфазеновые основания (например, основание Швезингера). Неограничивающими примерами амидов щелочных металлов являются лития диизопропиламид, лития тетраметилпиперидид, лития бис(триметилсилил)амид, натрия бис(триметилсилил)амид и калия бис(триметилсилил)амид.
Под «сульфонамидом» подразумевают -NR, где R представляет собой сульфонил.
Под «сульфонатом» подразумевают -OS(O)2R, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил. В иллюстративных сульфонатах, R представляет собой C1-12алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 или C3-6алкил), C2-12алкенил (например, C2-8, C2-6, C2-4, C3-12 или C3-6алкенил), карбоциклический C6-20арил (например, C6-15, C6-10, C8-20 или C8-15арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Как определено в настоящем документе, любая гетероарильная группа, присутствующая в сульфонатной группе, содержит от 1 до 4 гетероатомов, независимо выбранных из O, N, и S.
Под «сульфонилом» подразумевают -S(O)2R, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил, необязательно замещенный арилалкил или силил. Предпочтительными группами R для сульфонила являются те же группы, что и описанные выше для сульфонатов.
Под «тиоацеталем» подразумевают -S- (CHR)- S-, где R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под «тиокеталем» подразумевают -S- (CR2)- S-, где каждый R независимо представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под «трифлатом» подразумевают трифторметансульфонат.
Если не указано иное, то значения pKa, приведенные в настоящем документе, относятся к значения pKa конъюгированной кислоты Бренстеда в воде при комнатной температуре.
Если не указано иное, то все технические и научные термины, использованные в настоящем документе, имеют те же значения, что и обычно понимаемые средним специалистом в области техники, к которому принадлежит настоящее описание. Хотя в практике применения раскрытых способов и композиций могут быть использованы способы и вещества, сходные или эквивалентные описанным в настоящем документе, в настоящем документе раскрыты иллюстративные способы, устройства и вещества.
Для целей настоящего описания, для любого термина в данной области техники, идентичного любому термину, явным образом определенному в настоящем описании, определение термина, присутствующее в настоящем описании, будет иметь преимущественную силу во всех аспектах.
Подробное описание изобретения
Настоящее изобретение относится к способам синтеза макролида галихондринового ряда или его аналога (см. чертеж 1). Предпочтительно, аналог макролида галихондринового ряда представляет собой эрибулин. Предпочтительно, макролид галихондринового ряда представляет собой макролид галихондрин B. Способы согласно настоящему изобретению включают в себя воздействие на промежуточный продукт условиями реакции Принса. Порядок нумерации атом углерода в макролиде галихондринового ряда и его аналоге представлен на чертеже 1.
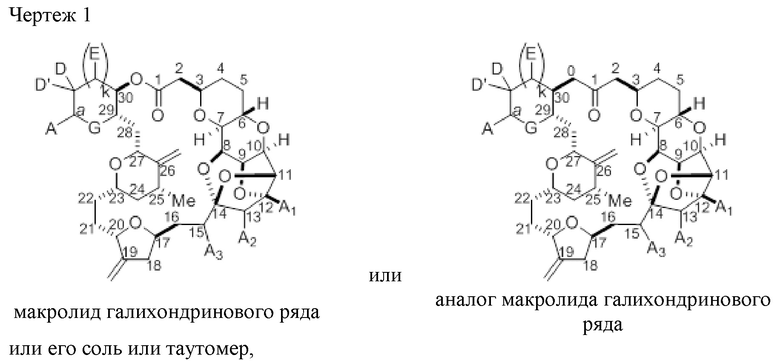
где каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой H или N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой H или N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена, или (c) каждый из P2 и P4 представляет собой H;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
 ,
, 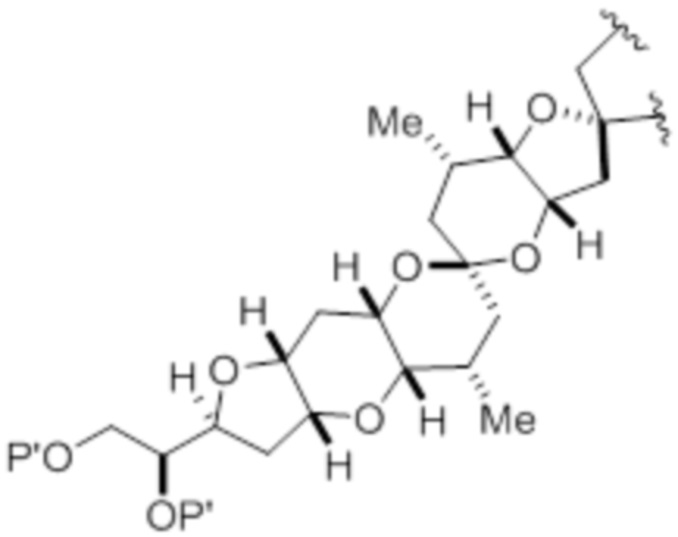 и
и 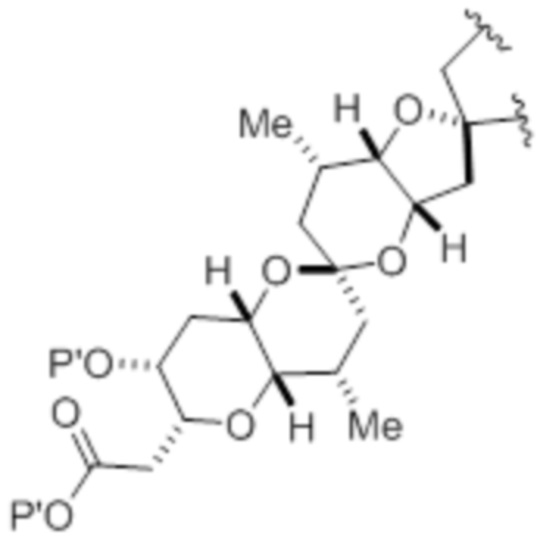 ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
каждый из A1, A2, и A3 независимо представляет собой H или OPʺ, где каждый P(независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
k равен 0 или 1; и
n is 0, 1 или 2.
Получение макролида галихондринового ряда или его аналога включает в себя осуществление взаимодействия соединения формулы (IA), R12OH (R12 может представлять собой необязательно замещенный ацил) и кислоты Льюиса (например, оксофильной кислоты Льюиса (например, трифторид бора или его сольват)) с получением соединения формулы (IB). Соединение формулы (IA) имеет следующую структуру:
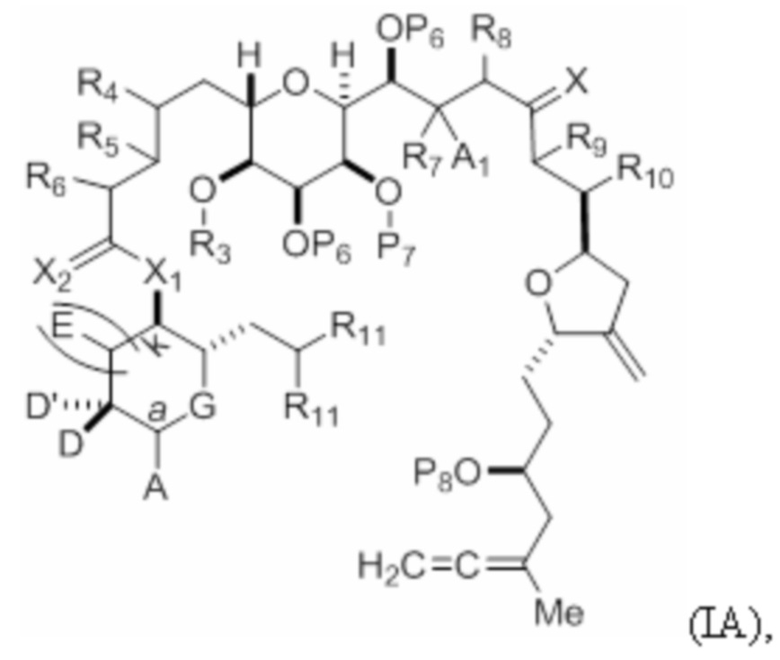
или его соль или таутомер,
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо, оксо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))-, -(C(OH)(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
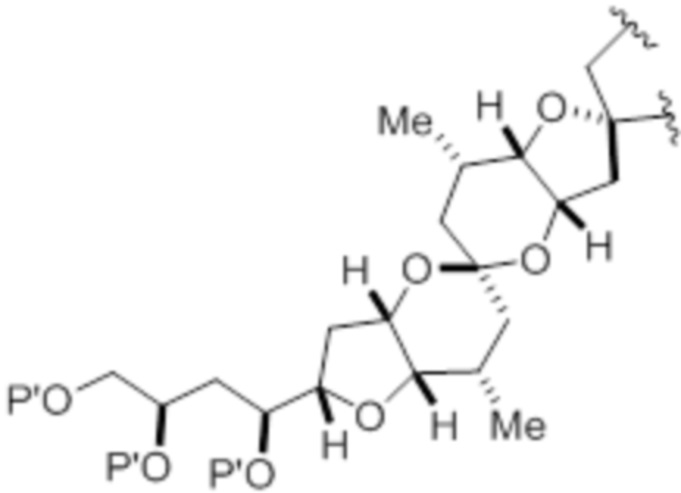 ,
, 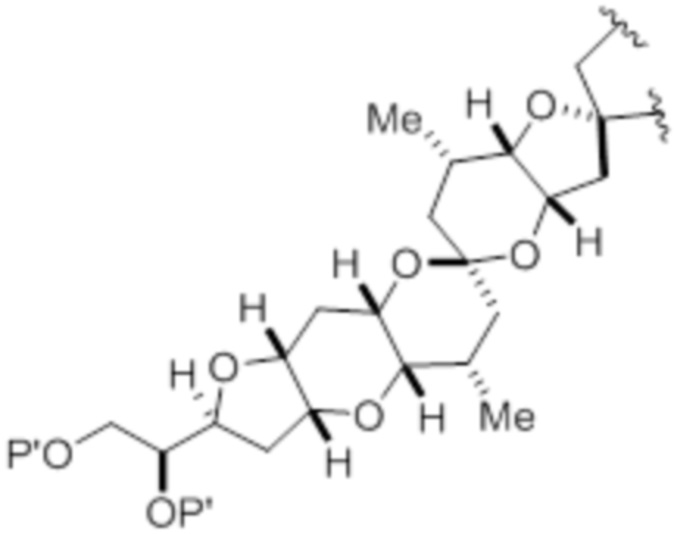 и
и 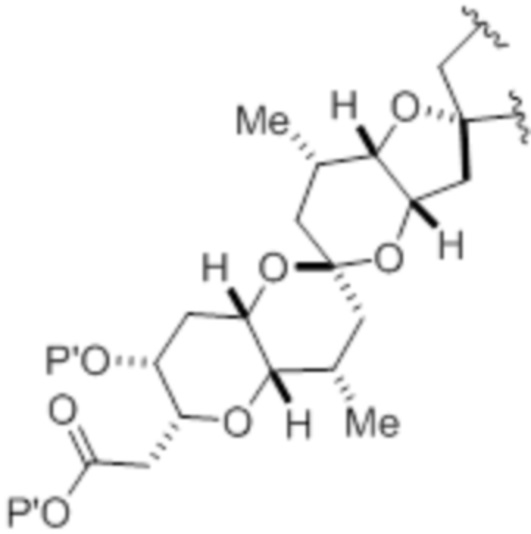 ,
,
где каждый P' независимо представляет собой H или гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой H, алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-, и X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O; и где Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(i) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(ii) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
(i) каждый P6 независимо представляет собой H или гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя; X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу (например, силил);
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ; и каждый R11 представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу (например, силил); или
(iii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя; и X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
R9 представляет собой H, OPʺ или Y, и R10 представляет собой H; или R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
P8 представляет собой H или силил; и
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу.
Соединение формулы (IB) имеет следующую структуру:
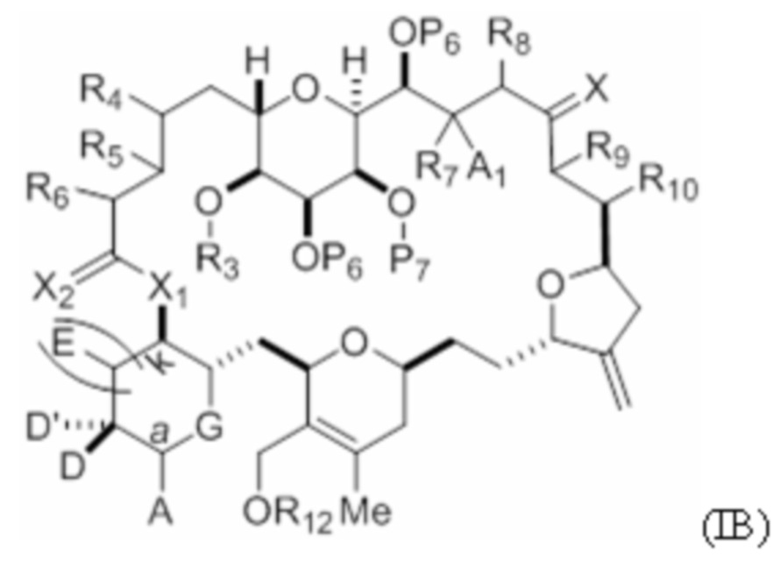
или его соль или таутомер,
где R12 представляет собой необязательно замещенный ацил, и значения всех переменных определены для соединения формулы (IA).
Обычно, условия реакции для преобразования соединения формулы (IA) до соединения формулы (IB) представляют собой условия, известные из уровня техники для реакции Принса.
Получение макролида ряда галихондрина или его аналога из соединения формулы (IB) дополнительно включает в себя осуществление взаимодействия соединения формулы (IB) с аллильным восстановителем с получением макролида галихондринового ряда или его аналога.
В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), G может представлять собой O. В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), D может представлять собой H. В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), D(может представлять собой OP1, где P1 может представлять собой алкил (например, метил).
В аналоге макролида галихондринового ряда, формуле (IA) или формуле (IB), k может представлять собой 0, и X1 может представлять -CH2-. В макролиде галихондринового ряда, формуле (IA) или формуле (IB), k может представлять собой 1, и X1 может представлять собой -O-.
В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), E может представлять собой необязательно замещенный алкил.
В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), A1 может представлять собой H.
В макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), стереогенный центр, обозначенный как a, может представлять собой (R), и A может представлять собой следующую структуру:
 .
.
Согласно дополнительным вариантам осуществления макролида галихондринового ряда, его аналога, формулы (IA) или формулы (IB), k равен 0, и X1 представляет собой -CH2-. Согласно еще одним вариантам осуществления макролида галихондринового ряда, его аналога, формулы (IA) или формулы (IB), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0.
В качестве альтернативы, в макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB), A и D могут объединены с формированием следующей структуры:
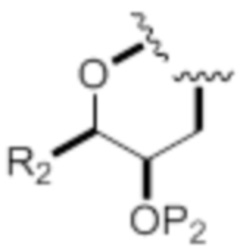 ,
,
где связь с атомом кислорода возникает на атоме углерода, к которому присоединен D в макролиде галихондринового ряда, его аналоге, формуле (IA) или формуле (IB). Согласно еще одним вариантам осуществления макролида галихондринового ряда, его аналога, формулы (IA) или формулы (IB), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, и n равен 2.
Согласно другим вариантам осуществления макролида галихондринового ряда, его аналога, формулы (IA) или формулы (IB), k равен 1, и E представляет собой необязательно замещенный алкил. Согласно еще одним вариантам осуществления макролида галихондринового ряда, его аналога, формулы (IA) или формулы (IB), X1 представляет собой -O-.
Если в соединении формулы (IA) R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H, то путем обработки соединения формулы (IA) кислотой Льюиса (например, оксофильной кислотой Льюиса) и R12OH можно получать соединение формулы (IB), в котором R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H.
Получение макролида ряда галихондрина или его аналога может включать в себя дополнительные стадии в зависимости от природы A1, R3, R4, R5, R6, R7, R8, R9, R10, X, X1, P6 и P7.
Получение определенных соединений формулы (IA) или формулы (IB) может дополнительно включать в себя преобразование соединения формулы (IA) или формулы (IB), в котором A1 представляет собой H, и R7 и R8 объединены с формированием двойной связи, до соединения формулы (IA) или формулы (IB), в котором R7 и A1 объединены с формированием O. Согласно неограничивающему примеру, енон в соединении формулы (IA) или формулы (IB), в котором R7 и R8 объединены с формированием двойной связи, может быть преобразован в C.12-C.13 эпоксид с использованием нуклеофильного агента-пероксида, например, трет-бутилового гидропероксида, который затем может быть преобразован до соединения формулы (IA) или формулы (IB), в котором A1 и R7 объединены с формированием оксо, с использованием способов, известных из уровня техники, например, путем осуществления взаимодействия с бидентатным фосфиновым лигандом и источником Pd(0) (см., например, Muzart, J., Eur. J. Org. Chem., 4717-4741, 2011). Таким образом, может быть получено соединение формулы (IA) или формулы (IB), в котором A1 представляет собой OPʺ. Другие преобразования могут включать в себя α-окисление с получением соединения формулы (IA) или формулы (IB), в котором R8 и/или R9 представляет собой OPʺ.
Если в соединении формулы (IA) или формулы (IB) X1 представляет собой -CH(Y)-, и/или R9 представляет собой SO2RC или COORC, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя реакцию декарбоксилирования (если X1 представляет собой -CH(Y)-, и Y представляет собой COORC, и/или R9 представляет собой COORC) или реакцию десульфонилирования (если X1 представляет собой -CH(Y)-, и Y представляет собой SO2RC, и/или R9 представляет собой SO2RC), как описано в настоящем документе. Реакция декарбоксилирования или десульфонилирования может проводиться на соединении формулы (IA) или формулы (IB), или на промежуточном продукте, расположенном после соединения формулы (IB) (например, после осуществления взаимодействия соединения формулы (IB) с аллильным восстановителем).
Если в соединении формулы (IA) или формулы (IB) R9 и R10 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя 1,4-восстановление, как описано в настоящем документе (например, с использованием реактива Страйкера). 1,4-Восстановление может проводиться на соединении формулы (IA) или формулы (IB), или на промежуточном продукте, расположенном после соединения формулы (IB). Таким образом, может быть получено соединение формулы (IA) или формулы (IB), в котором R9 и R10 оба представляют собой H.
Если в соединении формулы (IA) или формулы (IB) X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя осуществление взаимодействия этого соединения формулы (IB) с окислителем, способным преобразовывать спирт до карбонильной группы, с получением соединения формулы (IB), в котором X представляет собой=O. В качестве альтернативы, обработку окислителем, способным преобразовывать спирт до карбонильной группы, можно проводить на промежуточном продукте, расположенном после соединения формулы (IB) (например, после осуществления взаимодействия соединения формулы (IB) с аллильным восстановителем). Реакция, посредством которой X преобразуют до оксо, может также проводиться на соединении формулы (IA) до проведения реакции макроциклизации.
Если в соединении формулы (IB) каждый P6 представляет собой H, и X представляет собой=O, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя осуществление взаимодействия этого соединения формулы (IB) с кислотой Бренстеда (например, с кислотой Бренстеда, характеризующейся значением pKa 5±3) с получением соединения формулы (IB), в котором оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя. В качестве альтернативы, обработку кислотой Бренстеда (например, кислотой Бренстеда, характеризующейся значением pKa 5±3) можно проводить на промежуточном продукте, расположенном после соединения формулы (IB) (например, после осуществления взаимодействия соединения формулы (IB) с аллильным восстановителем).
Если в соединении формулы (IB) каждый P6 представляет собой гидроксил-защитную группу (например, силил), и X представляет собой=O, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя осуществление взаимодействия этого соединения формулы (IB) с агентом для удаления гидроксил-защитной группы (например, источником фторида, если P6 представляет собой силил) с получением соединения формулы (IB), в котором каждый P6 представляет собой H, и X представляет собой=O, которое затем может быть подвергнуто обработке кислотой Бренстеда (например, кислотой Бренстеда, характеризующейся значением pKa 5±3) с получением соединения формулы (IB), в котором оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя. В качестве альтернативы, обработку агентом для удаления гидроксил-защитной группы (например, источником фторида, если P6 представляет собой силил) можно проводить на промежуточном продукте, расположенном после соединения формулы (IB) (например, после осуществления взаимодействия соединения формулы (IB) с аллильным восстановителем).
Если в соединении формулы (IB) каждый P6 представляет собой H, X представляет собой=O, P7 представляет собой H, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, то синтез макролида ряда галихондрина или его аналога может дополнительно включать в себя осуществление взаимодействия этого соединения формулы (IB) с кислотой Бренстеда (например, с кислотой Бренстеда, характеризующейся значением pKa 5±3) с получением соединения формулы (IB), в котором оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи. В качестве альтернативы, обработку кислотой Бренстеда (например, кислотой Бренстеда, характеризующейся значением pKa 5±3) можно проводить на промежуточном продукте, расположенном после соединения формулы (IB) (например, после осуществления взаимодействия соединения формулы (IB) с аллильным восстановителем).
Если аналог макролида галихондринового ряда содержит A, который представляет собой группу формулы (1), в которой L представляет собой -CH(OH)-, R1 представляет собой H, и R2 представляет собой -(CH2)nNP3P4 (например, эрибулин или его соль), и в соединении формулы (IB) A представляет собой группу формулы (1), в которой L представляет собой -CH(OH)-, R1 представляет собой H, и R2 представляет собой -(CH2)nOP5, где P5 представляет собой H, то синтез аналога макролида галихондринового ряда может включать в себя аминирование, как описано в настоящем документе. Согласно некоторым вариантам осуществления, аналог макролида галихондринового ряда представляет собой эрибулин или его соль (например, эрибулина мезилат).
Если аналог макролида галихондринового ряда представляет собой эрибулина мезилат, то синтез может дополнительно включать в себя солеобразование эрибулина, как описано в настоящем документе.
Дополнительные манипуляции с защитными группами будут совершенно очевидны с точки зрения изобретения, раскрытого в настоящем документе, и знания из уровня техники. В частности, специалисту в данной области техники будет очевидно, что преобразование, посредством которого спирт окисляют до карбонила, может потребовать удаления защиты со спирта, если спирт защищен гидроксил-защитной группой (например, путем обработки агентом для удаления гидроксил-защитной группы), кроме тех случаев, когда такое удаление защиты происходит in situ в условиях реакции окисления. По аналогии, специалисту в данной области техники будет очевидно, что окислительное преобразование, проводимое на соединении, включающем первичный или вторичный спирт, может потребовать удаления защиты с первичного или вторичного спирта, если такой спирт подлежит сохранению, и если первичный или вторичный спирт подвержен окислению в условиях, присущих окислительному преобразованию.
Синтез промежуточных продуктов
Соединение формулы (IA) может быть получено с использованием способов и промежуточных продуктов, раскрытых, например, в патентах США №№5,338,865; 5,436,238; и 6,214,865; в публикациях международных патентных заявок №№WO 2015/066729 и WO 2016/179607; и в документах Towle et al., Annual Meeting of the American Association for Cancer Research, April 6-10, 2002, 5721; Wang et al., Bioorg. Med. Chem. Lett., 10:1029-1032, 2000; Aicher et al., J. Am. Chem. Soc., 114:3162-3164, 1992; Ueda et al., J. Am. Chem. Soc., 136:5171-5176; и Yamamoto et al., J. Am. Chem. Soc., 134:893-896, 2012; каждый из которых включен во всей своей полноте в настоящий документ посредством ссылки.
Синтез через соединение формулы (IC)
Соединение формулы (IA), в котором X1 представляет собой -CH(Y)- или -CH2-, может быть получено путем осуществления взаимодействия соединения формулы (IC), в котором R13 представляет собой H, с соединением формулы (ID), которое обрабатывали сильным основанием (например, амидом щелочного металла или алкиллитием).
Соединение формулы (IC) характеризуется следующей структурой:
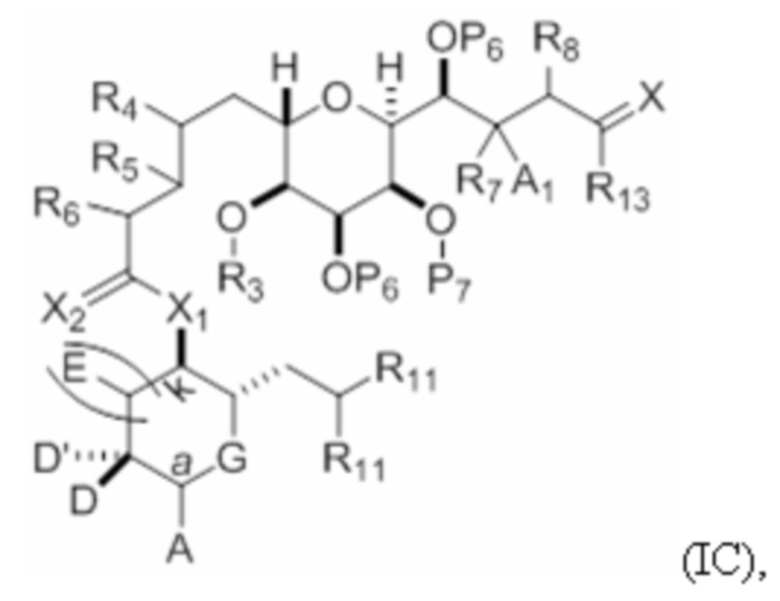
где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
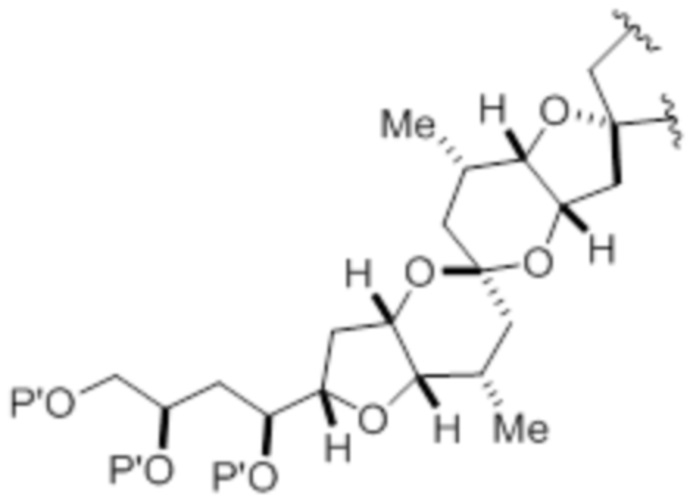 ,
, 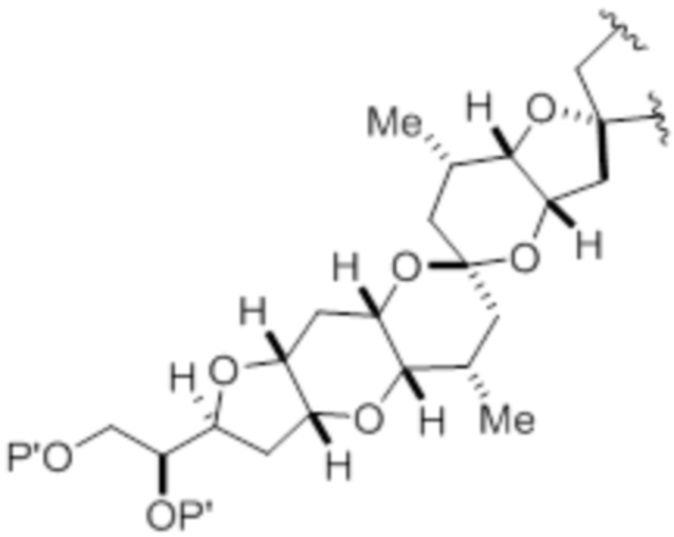 и
и  ,
,
где каждый P(независимо представляет собой гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)- или -CH2-
X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой (C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена;
Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
R13 представляет собой H или -CH2P(O)(ORE)2, где каждый RE, при наличии, независимо представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
(i) каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый R11 независимо представляет собой -OP10, или
оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу (например, силил);
или
(ii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя;
X представляет собой=O, или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H или гидроксил-защитную группу;
A1 и R7 объединены с формированием оксо, P7 представляет собой H или гидроксил-защитную группу, и R8 представляет собой H;
или
A1 представляет собой H или OPʺ, и:
(i) P7 представляет собой H или гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(ii) P7 и R7 объединены с формированием связи, и R8 представляет собой H или OPʺ;
и
каждый Pʺ, при наличии, независимо представляет собой H или гидроксил-защитную группу.
В формуле (IC) стереогенный центр, обозначенный как a, может представлять собой (R), и A может представлять собой следующую структуру:
 .
.
Согласно определенным вариантам осуществления формулы (IC), k равен 0, и X1 представляет собой -CH2-. Согласно определенным вариантам осуществления формулы (IC), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0.
В качестве альтернативы, в формуле (IC) A и D могут быть объединены с формированием следующей структуры:
 ,
,
где связь с атомом кислорода возникает на атоме углерода, к которому присоединен D в формуле (IC). Согласно некоторым вариантам осуществления формулы (IC), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, и n равен 2.
Согласно другим вариантам осуществления формулы (IC), k равен 1, и E представляет собой необязательно замещенный алкил. Согласно еще одним вариантам осуществления формулы (IC), X1 представляет собой -O-.
Соединение формулы (ID) имеет следующую структуру:
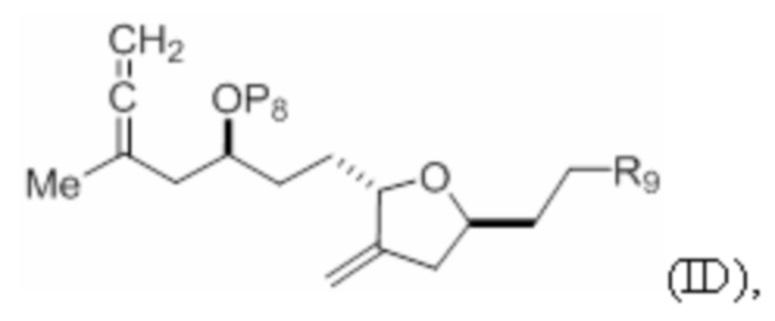
где
P8 представляет собой H или гидроксил-защитную группу; и
R9 представляет собой SO2RC или COORC, если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил.
В качестве альтернативы, соединение формулы (IA), в котором X1 представляет собой -CH(Y)- или -CH2-, может быть получено путем осуществления взаимодействия соединения формулы (IC), в котором X представляет собой=O, и R13 представляет собой -CH2P(O)(ORE)2, с соединением формулы (ID') в условиях реакции Хорнера-Уодсворта-Эммонса.
Соединение формулы (ID') имеет следующую структуру:
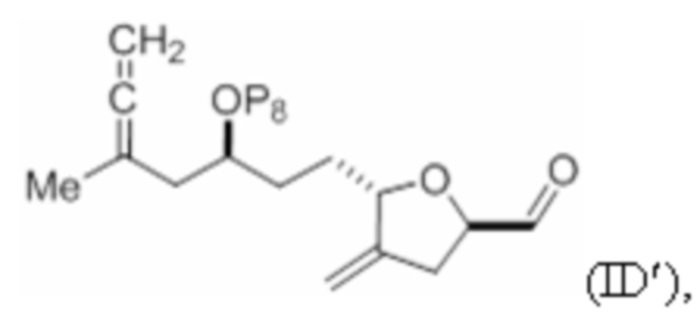
где P8 представляет собой H или гидроксил-защитную группу.
Соединение формулы (IC), в котором X представляет собой=O, и R13 представляет собой H, может вступать во взаимодействие с (REO)2P(O)-CH=N+=N- (например, реагент Сейферта-Гилберта) с получением соединения формулы (IC), в котором X представляет собой=O, и R13 представляет собой CH2P(O)(ORE)2.
Соединение формулы (IC) может быть получено из соединения формулы (IE)
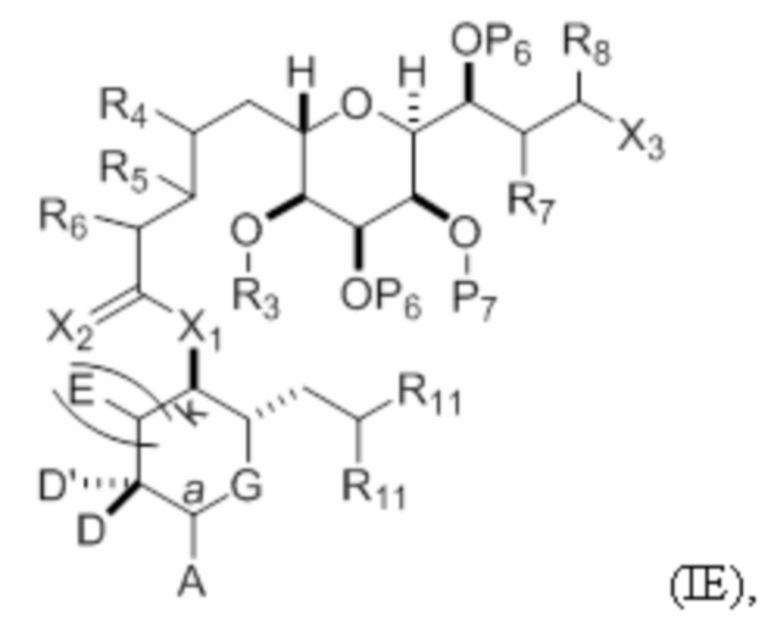
где
X3 представляет собой -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA, где каждый PA независимо представляет собой H или гидроксил-защитную группу, или оба PA объединены с формированием циклического защищенного диола; R7 и P7 объединены с формированием связи, и R8 представляет собой H; или P7 представляет собой гидроксил-защитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи; и значения всех переменных определены для соединения формулы (IC).
Получение соединения формулы (IC) из соединения формулы (IE) может проводиться путем осуществления взаимодействия соединения формулы (IE), в котором X3 представляет собой -CH(OPA)CH2OPA, и оба PA представляют собой H, с агентом для расщепления гликоля (например, перйодная кислота или ее соль, например, NaIO4) с получением соединения формулы (IC), в котором X представляет собой=O, и R13 представляет собой H.
Получение определенных соединений формулы (IC) может дополнительно включать в себя преобразование соединения формулы (IC), в котором A1 представляет собой H, R7 и R8 объединены с формированием двойной связи, и X представляет собой=O, до соединения формулы (IC), в котором R7 и A1 объединены с формированием O. Согласно неограничивающему примеру, еналь в соединении формулы (IC), в котором R7 и R8 объединены с формированием двойной связи, может быть преобразован до C.12-C.13 эпоксида с использованием нуклеофильного агента-пероксида, например, трет-бутилового пероксида, который затем может быть преобразован до соединения формулы (IC), в котором A1 и R7 объединены с формированием оксо, с использованием способов, известных из уровня техники, например, путем осуществления взаимодействия с бидентатным фосфиновым лигандом и источником Pd(0) (см., например, Muzart, J., Eur. J. Org. Chem., 4717-4741, 2011). Таким образом, может быть получено соединение формулы (IC), в котором A1 представляет собой OPʺ. Другие преобразования могут включать в себя α-окисление с получением соединения формулы (IC), в котором R8 представляет собой OPʺ.
Если в соединении формулы (IE) по меньшей мере один из PA представляет собой гидроксил-защитную группу, или оба PA объединены с формированием циклического защищенного диола, то соединение формулы (IE) может быть обработано агентом для удаления гидроксил-защитной группы (например, кислотой Бренстеда (например, p-TsOH), если оба PA объединены с формированием диола, защищенного в виде кеталя) с получением соединения формулы (IE), в котором оба PA представляют собой H.
Соединение формулы (IE) может быть получено путем осуществления взаимодействия соединения формулы (IF) с соединением формулы (IG), которое обрабатывали сильным основанием (например, амидом щелочного металла или алкиллитием). Перед этой реакцией, соединение формулы (IF), в котором X3 представляет собой -CH(OPA)CH2OPA, и оба PA представляют собой H, может быть преобразовано до соединения формулы (IF), в котором X3 представляет собой -CH2OPA, где PA представляет собой гидроксил-защитную группу, в соответствии со следующей методикой. Соединение формулы (IF), в котором X3 представляет собой -CH(OPA)CH2OPA, и оба PA представляют собой H, может вступать во взаимодействие с агентом для расщепления гликоля (например, перйодной кислотой или ее солью, например, NaIO4) с получением соединения формулы (IF), в котором X3 представляет собой -CHO, после восстановления которого 1,2-восстановителем и защиты гидроксил-защитной группой, можно получать соединение формулы (IF), в котором X3 представляет собой -CH2OPA, где PA представляет собой гидроксил-защитную группу. Для стадии восстановления, альдегид, ближайший к R6 в формуле (IF), может быть замещен с использованием защитных групп, известных из уровня техники как подходящие для защиты карбонилов.
Соединение формулы (IF) имеет следующую структуру:

где X3 представляет собой -CHO, -CH2OPA, -CH=CH2 или -CH(OPA)CH2OPA, и значения всех переменных определены для соединения формулы (IE).
Соединение формулы (IG) имеет следующую структуру:
где значения всех переменных определены для формулы (IE).
В формуле (IG) стереогенный центр, обозначенный как a, может представлять собой (R), и A может представлять собой следующую структуру:
 .
.
Согласно определенным вариантам осуществления формулы (IG), k равен 0, и X1 представляет собой -CH2-. Согласно определенным вариантам осуществления формулы (IG), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0.
Соединение формулы (IG) может быть получено с использованием способов, известных из уровня техники, например, способов, описанных в WO 2015/066729.
Соединение формулы (IF) может быть получено путем осуществления взаимодействия соединения формулы (IH), в котором X4 объединен вместе с атомом углерода, к которому он присоединен, с формированием -CH2-, с окислителем, способным окислять спирт до карбонила. В качестве альтернативы, соединение формулы (IF) может быть получено путем осуществления взаимодействия соединения формулы (IH), в котором X4 представляет собой=O, и PB представляет собой гидроксил-защитную группу или необязательно замещенный алкил, с 1,2-восстановителем (например, DIBAL).
Соединение формулы (IH) имеет следующую структуру:

где PB представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил, X4 представляет собой=O, или X4 объединен вместе с атомом углерода, к которому он присоединен, с формированием -CH2-, и значения всех оставшихся переменных определены для соединения формулы (IF).
Согласно некоторым вариантам осуществления формулы (IH), R3 и R5 объединены с формированием связи. Согласно конкретным вариантам осуществления, P7 и R7 объединены с формированием связи.
Соединение формулы (IH), в котором R7 и P7 объединены с формированием связи, может быть получено из соединения формулы (IHa)

где X5 представляет собой -CH=CH2 или -CH(R4)- CH(R5)- CH(R6)- C(X4)OPB, a определяет углерод-кислородную связь как  или
или  , и значения оставшихся переменных определены для соединения формулы (IH).
, и значения оставшихся переменных определены для соединения формулы (IH).
Согласно некоторым вариантам осуществления формулы (IHa), X3 представляет собой -CH2OPA. Согласно конкретным вариантам осуществления, R8 представляет собой H.
Соединение формулы (IHa) может вступать во взаимодействие с гидросиланом (например, Et3SiH, Ph2SiH2, Ph2MeSiH или PMHS) и кислотой (например, кислотой Бренстеда (например, трифторуксусной кислотой) или кислотой Льюиса (например, бора трифторида эфират)) для восстановления кеталя, с получением тем самым соединения формулы (IH), если X5 представляет собой -CH(R4)- CH(R5)- CH(R6)- C(X4)OPB. Если X5 в соединении формулы (IHa) представляет собой -CH=CH2, то получение соединения формулы (IH) может дополнительно включать в себя операцию с X5, посредством которой -CH=CH2 преобразуется в -CH(R4)- CH(R5)- CH(R6)- C(X4)OPB. Например, такое преобразование может включать в себя гидроборирование/окисление с последующей реакцией олефинирования (например, реакция Хорнера-Уодсворта-Эммонса с PBO-C(O)- CH2-P(O)(ORP)2, где RP представляет собой необязательно замещенный алкил).
Если a в формуле (IHa) определяет связь как  , то соединение формулы (IHa) может быть подвергнуто реакции эпимеризации (например, с использованием последовательности реакций, включающей в себя окисление группы -CH(OP6)- до карбонила с последующим восстановлением и защитой гидроксил-защитной группой) с получением соединения формулы (IHa), в котором a представляет собой
, то соединение формулы (IHa) может быть подвергнуто реакции эпимеризации (например, с использованием последовательности реакций, включающей в себя окисление группы -CH(OP6)- до карбонила с последующим восстановлением и защитой гидроксил-защитной группой) с получением соединения формулы (IHa), в котором a представляет собой  .
.
Соединение формулы (IHa), в котором X3 представляет собой -CH2OPA, может быть получено из соединения формулы (IHb):

где каждый из P6 и P7 независимо представляет собой гидроксил-защитную группу, или один P6 и P7 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя (например, один P6 и P7 объединены с формированием циклогексилидена), и оставшийся P6 представляет собой гидроксил-защитную группу; или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, и P7 представляет собой гидроксил-защитную группу.
Соединение формулы (IHb) может быть подвергнуто окса-присоединению по Михаэлю с последующим удалением гидроксил-защитных групп с OP6 и OP7 с одновременной кетализацией (например, с использованием агента для удаления гидроксил-защитных групп (например, кислоты Бренстеда (например, пара-толуолсульфоновой кислоты)) с получением соединения формулы (IHa).
Соединение формулы (IH) может быть также получено с использованием способов, известных из уровня техники, например, способов, описанных в WO 2015/066729 и WO 2005/118565.
Соединение формулы (ID) может быть получено из соединения формулы (Ii):
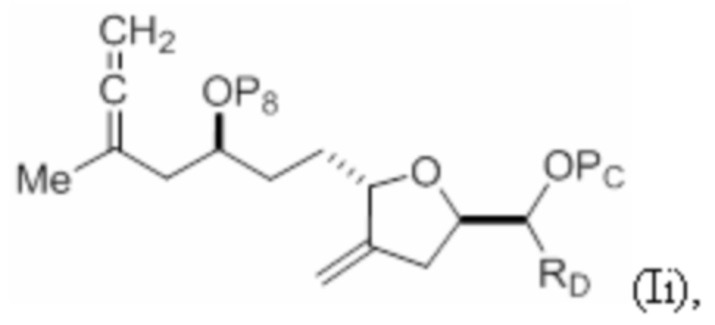
где
P8 представляет собой H или гидроксил-защитную группу;
(i) PC представляет собой H или гидроксил-защитную группу, и RD представляет собой -CH2OPD, где PD представляет собой H или гидроксил-защитную группу; или PC и PD объединены с формированием циклического защищенного диола; или
(ii) PC и RD объединены вместе с атомами, к которым каждый из них присоединен, с формированием карбонила.
Синтез соединения формулы (ID) из соединения формулы (Ii), в котором P8 представляет собой гидроксил-защитную группу, и PC и RD объединены вместе с атомами, к которым каждый из них присоединен с формированием карбонила, может включать в себя осуществление взаимодействия соединения формулы (Ii) с депротонированным R9-CH2-P(O)(ORE)2 с получением продукта, после обработки которого 1,4-восстановителем (например, LiHBEt3) можно получать соединение формулы (ID), где RE представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил; и R9 представляет собой SO2RC или COORC, где если R9 представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если R9 представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил. Реакция между соединением формулы (Ii) и R9-CH2-P(O)(ORE)2 может проводиться в условиях реакции, известных из уровня техники для реакции Хорнера-Уодсворта-Эммонса. Например, перед добавлением соединения формулы (Ii), R9-CH2-P(O)(ORE)2 может быть депротонирован in situ с использованием сильного основания (например, амида щелочного металла).
Если в соединении формулы (Ii), PC представляет собой H, и RD представляет собой -CH2OPD, где PD представляет собой H, то синтез соединения формулы (ID) или формулы (ID') может включать в себя осуществление взаимодействия этого соединения формулы (Ii) с агентом расщепления гликолей (например, перйодной кислотой или ее солью, например, NaIO4) с получением соединения формулы (Ii), в котором PC и RD объединены вместе с атомами, к которым каждый из них присоединен, с формированием карбонила.
Соединение формулы (ID') соответствует соединению формулы (Ii), в котором PC и RD объединены вместе с атомами, к которым каждый из них присоединен, с формированием карбонила.
Соединение формулы (Ii) может быть получено с использованием способов, известных из уровня техники, например, описанных в WO 2015/066729 и в WO 2005/118565.
В качестве альтернативы, соединение формулы (ID) может быть получено из соединения формулы (IDa):
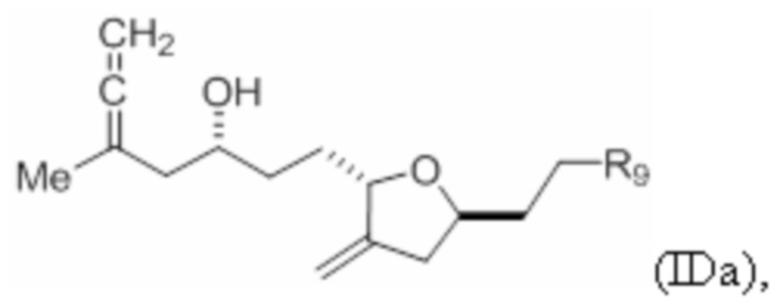
где значение R9 определено для формулы (ID).
Соединение формулы (IDa) может быть преобразовано до соединения формулы (ID), в котором P8 представляет собой гидроксил-защитную группу, посредством эпимеризации вторичного карбинола (например, в реакции Митцунобу с P8-OH, где P8 представляет собой гидроксил-защитную группу, такую как пара-нитробензил)). Если соединение формулы (ID), в котором P8 представляет собой H, является целевым, то соединение формулы (ID), в котором P8 представляет собой гидроксил-защитную группу, может быть обработано агентом для удаления гидроксил-защитных групп с получением соединения формулы (ID), в котором P8 представляет собой H.
Соединение формулы (IDa) может быть получено путем воздействия на соединение формулы (IDb), в котором R14 представляет собой галоген (например, йодид) или псевдогалоген, и каждый из R9(и R10 представляет собой H, условиям реакции фрагментации по Васеллу (например, Zn и водная уксусная кислота). Соединение формулы (IDb) соответствует следующей формуле:
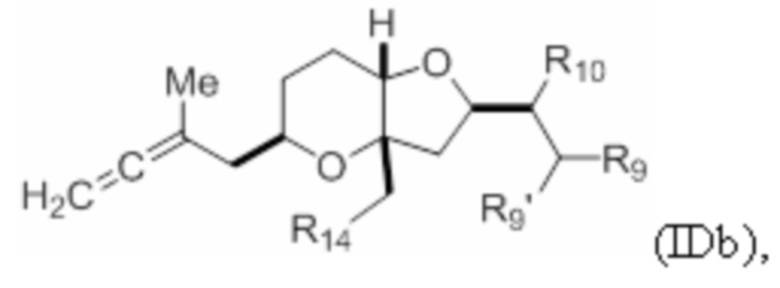
где R9(и R10 оба представляют собой H, или R9(и R10 объединены с формированием двойной связи; R14 представляет собой гидроксил, галоген (например, йодид) или псевдогалоген (например, трифлат); и значение R9 определено для формулы (ID).
Соединение формулы (IDb), в котором R9(и R10 оба представляют собой H, может быть получено путем обработки соединения формулы (IDb), в котором R9(и R10 объединены с формированием двойной связи, с 1,4-восстановителем (например, LiBH4).
Соединение формулы (IDb), в котором R14 представляет собой гидроксил, может быть преобразовано до соединения формулы (IDb), в котором R14 представляет собой псевдогалоген, посредством осуществления взаимодействия с соответствующим ангидридом псевдогалогена (например, ангидридом трифторметансульфоновой кислоты) в щелочных условиях (например, в присутствии объемного основания, например, основания Хунига). Соединение формулы (IDb), в котором R14 представляет собой псевдогалоген, может быть обработано солью галогенида (например, йодидом натрия или йодидом тетрабутиламмония) с получением соединения формулы (IDb), в котором R14 представляет собой галоген (например, йод). Две реакции могут проводиться в виде однореакторного процесса.
Соединение формулы (IDb), в котором R14 представляет собой гидроксил, и R9(и R10 объединены с формированием двойной связи, может быть получено из соединения формулы (IDc), в котором R16 представляет собой H, посредством реакции Хорнера-Уодсворта-Эммонса с R9-CH2-P(O)(ORE)2, где каждый RE независимо представляет собой необязательно замещенный алкил. Соединение формулы (IDc) соответствует следующей формуле:
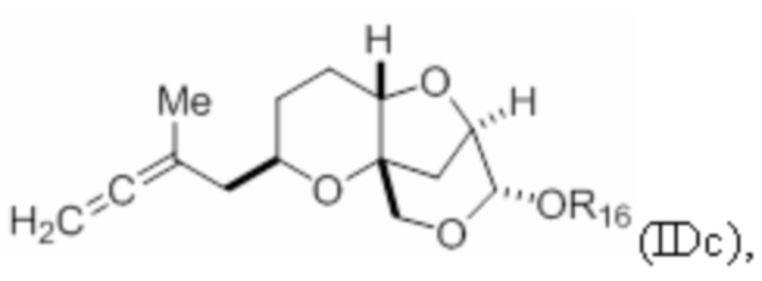
где R16 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил.
Соединение формулы (IDc), в котором R16 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, может быть преобразовано до соединения формулы (IDc), в котором R16 представляет собой H, посредством использования катализированного кислотой гидролиза (например, с использованием смеси водной кислоты Бренстеда и полярно органического растворителя, например, THF).
Соединение формулы (IDc), в котором R16 представляет собой необязательно замещенный алкил или гидроксил-защитную группу, может быть получено из соединения формулы (IDd), в котором X6 представляет собой -C(R17)=CH2, посредством катализированного металлами net elimination H-R17 (например, с использованием Pd(0), лиганда MOP и основания Хунига). Соединение формулы (IDd) соответствует следующей формуле:

где X6 представляет собой -C(R17)=CH2, -C(O)- Me или циано, где R17 представляет собой псевдогалоген (например, трифтлат) или галоген; и значение R16 определено для формулы (IDc).
Соединение формулы (IDd), в котором R16 представляет собой H, и X6 представляет собой циано, известно из уровня техники (например, из WO 2009/046308). Соединение формулы (IDd), в котором R16 представляет собой H, может быть подвергнуто катализированному кислотой взаимодействию R16-OH с получением соединения формулы (IDd), в котором R16 представляет собой гидроксил-защитную группу или необязательно замещенный алкил. Соединение формулы (IDd), в котором X6 представляет собой циано, и R16 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, может быть подвергнуто взаимодействию с нуклеофильным источником метила (например, MeLi·LiBr) с получением соединения формулы (IDd), в котором X6 представляет собой -C(O)- Me. Соединение формулы (IDd), в котором X6 представляет собой -C(O)- Me, может быть подвергнуто взаимодействию с электрофильным источником псевдогалогена (например, PhNTf2 и объемное основание, например, NaHMDS) или с электрофильным источником галогена (например, трифенилфосфитом, элементарным галогеном и основанием, например, триэтиламином) с получением соединения формулы (IDd), в котором X6 представляет собой -C(R17)=CH2.
Синтез через соединение формулы (IJ)
Соединение формулы (IA) может быть получено путем осуществления взаимодействия соединения формулы (IJ) с соединением формулы (IK) в условиях реакции Нозаки-Хияма-Киши, описанных в настоящем документе. Соединение формулы (IJ) соответствует следующей формуле:

где
каждый из D и D' независимо представляет собой H, необязательно замещенный алкил или OP1, при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой H, алкил или гидроксил-защитную группу; и A представляет собой группу формулы (1) или C1-6насыщенный или C2-6ненасыщенный углеводородный скелет, причем скелет является незамещенным или содержит от 1 до 10 заместителей, независимо выбранных из группы, состоящей из циано, галогена, азидо и Q1, причем группа формулы (1) характеризуется структурой:

где
L представляет собой -(CH(OP2))- или -C(O)-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
(i) R2 представляет собой H, где P2 отсутствует, представляет собой замещенный алкил или гидроксил-защитную группу;
(ii) R2 представляет собой -(CH2)nNP3P4, где P3 представляет собой N-защитную группу, и (a) P2 отсутствует, представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу, или (b) P2 и P4 объединены с формированием алкилидена;
(iii) R2 представляет собой -(CH2)nOP5, где P2 отсутствует, представляет собой замещенный алкил или гидроксил-защитную группу, и P5 представляет собой необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо; или
(iv) R2 и P2 объединены с формированием необязательно замещенного этилена или структуры, выбранной из группы, состоящей из:
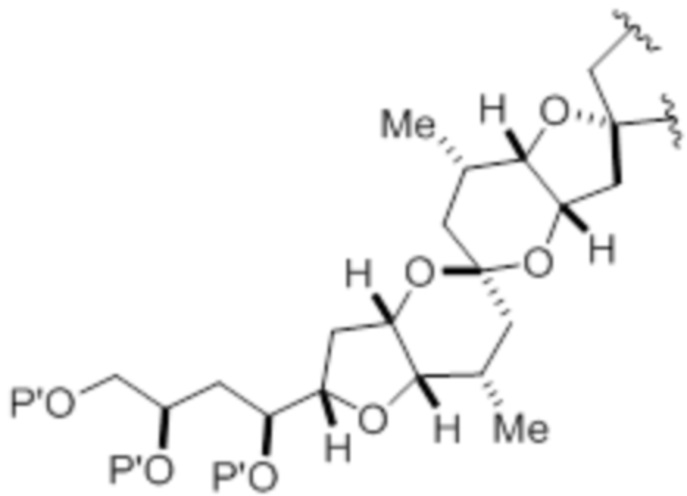 ,
, 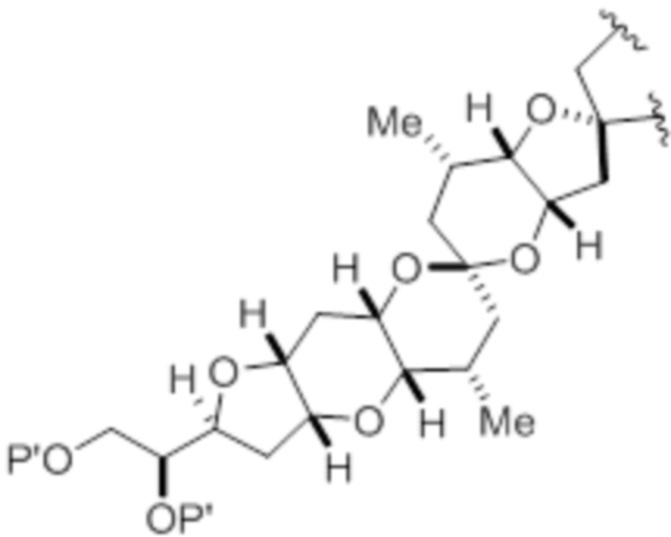 и
и 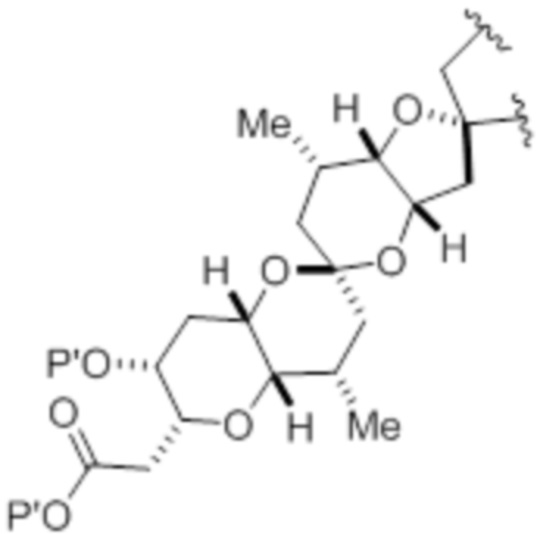 ,
,
где каждый P' независимо представляет собой гидроксил-защитную группу;
E представляет собой H, необязательно замещенный алкил или необязательно замещенный алкокси;
G представляет собой O, S, CH2 или NRN, где RN представляет собой H, N-защитную группу или необязательно замещенный алкил;
каждый Q1 независимо представляет собой ORA, SRA, SO2RA, OSO2RA, NRBRA, NRB(CO)RA, NRB(CO)(CO)RA, NRB(CO)NRBRA, NRB(CO)ORA, (CO)ORA, O(CO)RA, (CO)NRBRA или O(CO)NRBRA, где каждый из RA и RB независимо представляет собой алкил, галогеналкил, гидроксиалкил, аминоалкил, арил, галогенарил, гидроксиарил, алкоксиарил, арилалкил, алкиларил, галогенарилалкил, алкилгалогенарил, (алкоксиарил)алкил, гетероциклический радикал или (гетероциклический радикал)алкил;
n, при наличии, равен 0, 1 или 2;
k равен 0 или 1;
X1 представляет собой -CH(Y)-, -CH2- или -O-, и X2 представляет собой=O, или X2 вместе с атомом углерода, к которому он присоединен, представляет собой -(C(RX)2)-; где каждый RX независимо представляет собой H, -ORX1 или -SRX1, при условии, что по меньшей мере один RX, при наличии, представляет собой -ORX1 или -SRX1; где каждый RX1 независимо представляет собой необязательно замещенный алкил, или оба RX1 объединены с формированием необязательно замещенного алкилена, при условии, что если X1 представляет собой -O-, то X2 представляет собой=O; и где Y представляет собой SO2RC или COORC, где если Y представляет собой SO2RC, то RC представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и если Y представляет собой COORC, то RC представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H; или R3 представляет собой H или гидроксил-защитную группу, R5 и один из R4 и R6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи, и оставшийся R4 или R6 представляет собой H;
(i) каждый P6 независимо представляет собой гидроксил-защитную группу, или оба P6 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя или ацеталя;
каждый R11 независимо представляет собой -OP10, или
оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу (например, силил);
или
(ii) оба P6 и оба R11 объединены вместе с атомами, к которым они присоединены, с формированием ацеталя;
каждый P7 независимо представляет собой гидроксил-защитную группу; и
X2 представляет собой галоген или псевдогалоген.
В формуле (IJ) стереогенный центр, обозначенный как a, может представлять собой (R), и A может представлять собой следующую структуру:
 .
.
Согласно определенным вариантам осуществления формулы (IJ), k равен 0, и X1 представляет собой -CH2-. Согласно определенным вариантам осуществления формулы (IJ), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, где n равен 0.
В качестве альтернативы, в формуле (IJ) A и D могут быть объединены с формированием следующей структуры:
 ,
,
где связь с атомом кислорода возникает на атоме углерода, к которому присоединен D в формуле (IJ). Согласно некоторым вариантам осуществления формулы (IJ), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, и n равен 2.
Согласно другим вариантам осуществления формулы (IJ), k равен 1, и E представляет собой необязательно замещенный алкил. Согласно еще одним вариантам осуществления формулы (IJ), X1 представляет собой -O-.
Соединение формулы (IK) имеет следующую структуру:
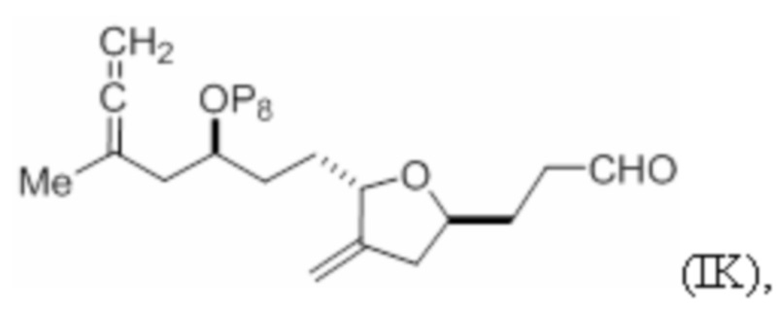
где P8 представляет собой гидроксил-защитную группу.
Соединение формулы (IK) может быть получено с использованием способов, известных из уровня техники, например, способов, описанных в WO 2015/066729 и WO 2005/118565.
Соединение формулы (IJ), в котором X1 представляет собой -CH(Y)- или -CH2-, может быть получено из соединения формулы (IG) и соединения формулы (IL), в котором R15 представляет собой H, и X4 представляет собой=O. Соединение формулы (IL) имеет следующую структуру:
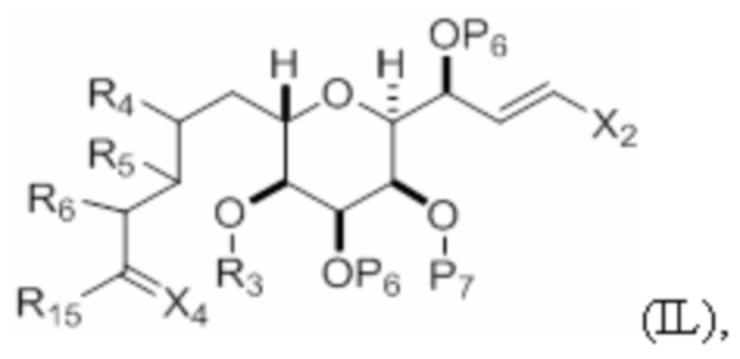
или его соль,
где R15 представляет собой H или -OP11, и P11 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил; X4 представляет собой=O или вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-; и значения всех оставшихся переменных определены для соединения формулы (IJ); при условии, что если R15 представляет собой H, то X4 представляет собой=O.
Соединение формулы (IL) может быть получено с использованием способов, известных из уровня техники, например, способов, описанных в международных патентных заявках №№WO 2005/118565 и WO 2015/066729, и в патентах США №№5,338,865; 5,436,238; и 6,214,865.
Синтез соединения формулы (IJ), в котором X1 представляет собой -CH(Y)- или -CH2-, включает в себя осуществление взаимодействия соединения формулы (IL), в котором R15 представляет собой H, и X4 представляет собой=O, с соединением формулы (IG), которое обрабатывали сильным основанием (например, амидом щелочного металла или алкиллитием), и последующее окисление спирта, образовавшегося из альдегидной группы посредством использования окислителя, способного преобразовывать спирт до карбонильной группы (например, перйодинана Десс-Мартина).
Если следует получить соединение формулы (IJ), в котором X1 представляет собой -CH2-, то синтез такого соединения формулы (IJ) может дополнительно включать в себя воздействие на соединение формулы (IJ), в котором X1 представляет собой -CH(Y)-, условиями реакции декарбоксилирования (если Y представляет собой COORC) или десульфонилирования (если Y представляет собой SO2RC), описанными в настоящем документе.
Соединение формулы (IJ), в котором X1 представляет собой -O-, может быть получено путем осуществления взаимодействия соединения формулы (IL), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-, с соединением формулы (IM) в условиях реакции эстерификации (например, эстерификации по Ямагучи, описанной в настоящем документе, или с использованием EDCI/DMAP, например, как описано в Namba and Kishi, J. Am. Chem. Soc., 127:15382-15383, 2005).
Соединение формулы (IL), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-, может вступать во взаимодействие с окислителем, способным окислять гидроксил до карбонильной группы, с получением соединения формулы (IL), в котором R15 представляет собой H, и X4 представляет собой=O. Соединение формулы (IL), в котором R15 представляет собой H, и X4 представляет собой=O, может быть окислено с использованием окисления по Пиннику с получением соединения формулы (IL), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 представляет собой=O. Соединение формулы (IL), в котором X4 представляет собой=O, R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, может быть обработано 1,2-восстановителем (например, DIBAL) с получением соединения формулы (IL), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-. Соединение формулы (IL), в котором X4 представляет собой=O, и R15 представляет собой H, может быть получено путем осуществления взаимодействия соединения формулы (IL), в котором X4 представляет собой=O, R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, с 1,2-восстановителем в условиях, известных из уровня техники для преобразования сложных эфиров до альдегидов (например, с использованием DIBAL при низкой (например, приблизительно от 80°C приблизительно до 50°C) температуре).
Соединение формулы (IM) имеет следующую структуру:
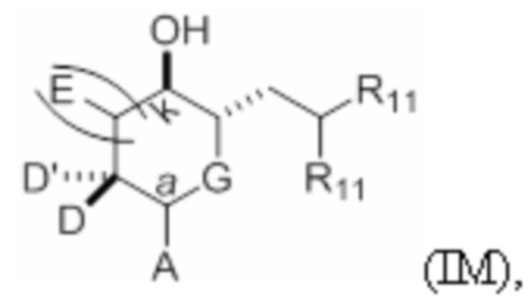
где каждый R11 независимо представляет собой -OP10, или оба R11 объединены с формированием оксо, где P10 представляет собой алкил или гидроксил-защитную группу (например, силил); и значения всех оставшихся переменных определены для формулы (IM).
В формуле (IM) A и D могут быть объединены с формированием следующей структуры:
 ,
,
где связь с атомом кислорода возникает на атоме углерода, к которому присоединен D в формуле (IM). Согласно некоторым вариантам осуществления формулы (IM), R2 представляет собой -(CH2)nNP3P4 или -(CH2)nOP5, и n равен 2.
Согласно другим вариантам осуществления формулы (IM), k равен 1, и E представляет собой необязательно замещенный алкил. Согласно еще одним вариантам осуществления формулы (IM), X1 представляет собой -O-.
Соединения формул (IL) и (IM) могут быть получены с использованием способов, известных из уровня техники, например, способов, описанных в международных патентных заявках №№WO 2005/118565 и WO 2015/066729, и в патентах США №№5,338,865 и 5,436,238.
Синтез через соединение формулы (IN)
Соединение формулы (IA), в котором X1 представляет собой -O-, может быть получено путем осуществления взаимодействия соединения формулы (IN), в котором R15 представляет собой -OP11, и P11 представляет собой H, с соединением формулы (IM). Эта реакция может проводиться в условиях реакции эстерификации, известной из уровня техники (например, эстерификации по Ямагучи, которая может включать в себя использование 2,4,6-трихлорбензоилхлорида, основания-амина (например, основания Хунига) и каталитических количеств 4-диметиламинопиридина). Условия реакции эстерификации по Ямагучи были описаны, например, в документе Aicher et al., J. Am. Chem. Soc., 114:3162-3164, 1992). В качестве альтернативы, условия реакции эстерификации могут включать в себя использование реагента-карбодиимида (например, EDCI) и каталитической кислоты Льюиса (например, DMAP); неограничивающий пример такой трансформации описан в документе Namba and Kishi, J. Am. Chem. Soc., 127:15382-15383, 2005.
Соединение формулы (IA), в котором X1 представляет собой -CH(Y)-, может быть получено путем осуществления взаимодействия соединения формулы (IN), в котором R15 представляет собой H, с соединением формулы (IG), которое обрабатывали сильным основанием (например, амидом щелочного металла или алкиллитием).
Соединение формулы (IN) имеет следующую структуру:

или его соль,
где R15 представляет собой H или -OP11, где P11 представляет собой H, гидроксил-защитную группу или необязательно замещенный алкил; X4 представляет собой=O или вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-; и значения всех оставшихся переменных определены для формулы (IA); при условии, что если R15 представляет собой H, то X4 представляет собой=O.
Соединение формулы (IN), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-, может вступать во взаимодействие с окислителем, способным окислять гидроксил до карбонильной группы, с получением соединения формулы (IN), в котором R15 представляет собой H, и X4 представляет собой=O. Соединение формулы (IN), в котором R15 представляет собой H, и X4 представляет собой=O, может быть окислено с использованием окисления по Пиннику с получением соединения формулы (IN), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 представляет собой=O. Соединение формулы (IN), в котором X4 представляет собой=O, R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, может быть обработано 1,2-восстановителем (например, DIBAL) с получением соединения формулы (IN), в котором R15 представляет собой -OP11, P11 представляет собой H, и X4 вместе с атомом углерода, к которому он присоединен, представляет собой -CH2-. Соединение формулы (IN), в котором X4 представляет собой=O, и R15 представляет собой H, может быть получено путем осуществления взаимодействия соединения формулы (IN), в котором X4 представляет собой=O, R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, с 1,2-восстановителем в условиях, известных из уровня техники для преобразования сложных эфиров до альдегидов (например, с использованием DIBAL при низкой (например, приблизительно от 80°C приблизительно до 50°C) температуре).
Соединение формулы (IN) в котором R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу или необязательно замещенный алкил, может быть получено из соединения формулы (ID) и соединения формулы (IH), в котором PB представляет собой гидроксил-защитную группу или необязательно замещенный алкил, X3 представляет собой -CHO, и X4 представляет собой=O.
Синтез соединения формулы (IN), в котором R15 представляет собой -OP11, из соединения формулы (IH) и соединения формулы (ID) может включать в себя осуществление взаимодействия соединения формулы (IH) с соединением формулы (ID), которое обрабатывали сильным основанием (например, амидом щелочного металла или алкиллитием), с получением содержащего спиртовую группу продукта, путем удаления PB (например, с использованием 1,2-восстановителя, если PB представляет собой ацильную группу, такую как пивалоил) с которого и последующего окисления (например, последовательного окисления с использованием окислителя, способного преобразовывать спирт до карбонильной группы, а затем окисления по Пиннику) можно получать соединение формулы (IN).
В качестве альтернативы, соединение формулы (IN) может быть получено из соединения формулы (IL) и соединения формулы (IK). Например, соединение формулы (IL), в котором X4 представляет собой=O, R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу, может вступать во взаимодействие с соединением формулы (IK) в условиях реакции Нозаки-Хияма-Киши с получением соединения формулы (IN), в котором R15 представляет собой -OP11, и P11 представляет собой гидроксил-защитную группу; R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи; и X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H. Путем последующего удаления защиты и осуществления взаимодействия с окислителем, способным преобразовывать спирт до карбонильной группы, можно получать соединение формулы (IN), в котором X представляет собой=O и R15 представляет собой -OP11, и P11 представляет собой H.
Получение определенных соединений формулы (IN) может дополнительно включать в себя преобразование соединения формулы (IN), в котором A1 представляет собой H, R7 и R8 объединены с формированием двойной связи, и X представляет собой=O, до соединения формулы (IN) в котором R7 и A1 объединены с формированием O. Согласно неограничивающему примеру, еналь в соединении формулы (IN), в котором R7 и R8 объединены с формированием двойной связи, может быть преобразован с использованием нуклеофильного агента-пероксида, например, трет-бутилового гидропероксида, до C.12-C.13 эпоксида, который затем может быть преобразован до соединения формулы (IN), в котором A1 и R7 объединены с формированием оксо, с использованием способов, известных из уровня техники, например, путем осуществления взаимодействия с бидентатным фосфиновым лигандом и источником Pd(0) (см., например, Muzart, J., Eur. J. Org. Chem., 4717-4741, 2011). Таким образом, может быть получено соединение формулы (IN), в котором A1 представляет собой OPʺ. Другие преобразования могут включать в себя α-окисление с получением соединения формулы (IN), в котором R8 и/или R9 представляет собой OPʺ.
Согласно определенным вариантам осуществления формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, X1 представляет собой -CH(Y)- или -CH2-, D представляет собой H, D(представляет собой OP1, G представляет собой O, и A имеет следующую структуру:
 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой H или N-защитную группу, и P2 и P4 объединены с формированием алкилидена; или P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо;
могут быть использованы для получения эрибулина или его соли (например, эрибулина мезилата).
Согласно определенным вариантам осуществления формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, X1 представляет собой -CH(Y)- или -CH2-, D представляет собой H, D(представляет собой OP1, G представляет собой O, и A имеет следующую структуру:
 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой N-защитную группу, и P2 и P4 объединены с формированием алкилидена, или P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P4 представляет собой N-защитную группу; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, P2 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу, и P5 представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо;
могут быть использованы для получения эрибулина или его соли (например, эрибулина мезилата).
Согласно дополнительным вариантам осуществления соединения формулы (IA), (IB), (IC), (IE), (IJ) или (IN), k равен 0, D представляет собой H, D' представляет собой OP1, и A имеет следующую структуру:
 ,
,
где
(i) R2 представляет собой -(CH2)nNP3P4, где n равен 0, P3 представляет собой N-защитную группу, и P2 и P4 объединены с формированием алкилидена; или
(ii) R2 представляет собой -(CH2)nOP5, где n равен 0, каждый из P2 и P5 независимо представляет собой H, необязательно замещенный алкил или гидроксил-защитную группу; или P2 и P5 объединены вместе с атомами, к которым каждый из них присоединен, с формированием кеталя, циклического карбоната, дикарбонилдиоксо или силилендиоксо.
Защищенные амины и агенты для снятия защиты с аминов
Соединения, использованные в способах согласно настоящему изобретению, могут содержать защищенный и незащищенный амин (например, на атоме углерода C.35 молекулы аналога макролида галихондринового ряда, такого как эрибулин). Незащищенный амин представляет собой -NH2. Амин может быть защищен с использованием способов, известных из уровня техники, например, путем защиты амина N-защитной группой. В качестве альтернативы, амин может быть защищен в виде азотсодержащего фрагмента, который может взаимодействовать с агентом для снятия защиты с аминов с получением амина. Неограничивающие примеры азотсодержащих фрагментов включают в себя азид и имид (например, фталимид). Агенты для снятия защиты с аминов могут представлять собой агенты, известные из уровня техники, для удаления N-защитных групп с аминов. Согласно неограничивающему примеры, Boc-группа может быть удалена с использованием агентов для снятия защиты с аминов, известных из уровня техники, например, кислоты Бренстеда (например, HCl в 1,4-диоксане или трифторуксусная кислота). Если амин защищен в виде азида, то защита может быть снята с амина путем воздействия на соединение, содержащее защищенный амин, условий реакции Штауденгира (например, путем приведения в контакт с фосфином, таким как триалкилфосфин, диалкиларилфосфин, алкилдиарилфосфин или триарилфосфин) или путем осуществления взаимодействия соединения, содержащего защищенный амин, с восстановителем (например, LiAlH4). Если амин защищен в виде имида (например, фталимида), то защита может быть снята с амина путем осуществления взаимодействия с агентом для снятия защиты с аминов, известным из уровня техники, например, гидразином.
Окислители, способные преобразовывать спирты до карбонильной группы
Окислители, способные преобразовывать спирты до карбонильной группы, известны из уровня техники. Неограничивающие примеры таких окислителей включают в себя перйодинан Десс-Мартина, TEMPO (в присутствии гипохлорита или BAIB), соединение диметилсульфония (например, хлорид диметилхлорсульфония), триалкоксид алюминия и избыток кетона (например, ацетона), и каталитическое количество перрутената тетрапропиламмония (TPAP) (в присутствии N-метилморфолиноксида). Соединение диметилсульфония может быть получено in situ в условиях, известных для окисления по Парих-Дерингу, окисление по Сверну, окисление по Кори-Киму или окисление по Пфицнеру-Моффату. В качестве альтернативы, соединение диметилсульфония может быть получено in situ путем осуществления взаимодействия между трихлоруксусным ангидридом и диметилсульфоксидом. Реакция окисления спирта до карбонильной группы (например, кетона) может проводиться с использованием триалкоксида алюминия и избытка кетона (например, ацетона) в условиях, известных из уровня техники для окисления по Оппенауэру. Аллильные и бензильные спирты также могут быть окислены MnO2.
Восстановители
Восстановители, которые могут быть использованы в способах согласно настоящему изобретению, представляют собой восстановители, известные из уровня техники. Восстановитель может представлять собой восстановитель-переносчик электрона, гидрид металла или гидрид металлоида. Неограничивающие примеры восстановителей-переносчиков электрона включают в себя щелочные металлы со степенью окисления (0), щелочноземельные металлы со степенью окисления (0), арениды щелочей, соли лантанидов(II) (например, SmI2), Zn(0), Fe(0) и Mn(0). Неограничивающие примеры гидридов металлов и гидридов металлоидов включают в себя боргидридные соединения (например, NaBH4, LiBH4, LiHBEt3, селектриды (например, L-селектрид) и бораны (например, 9-BBN и Alpine-Borane)), алюмогидридные соединения (например, LiAlH4, Red-Al(и аланы (например, диизобутилалюминия гидрид (DIBAL))), гидросиланы (например, PMHS и Ph2SiH2), гидростаннаны (например, Bu3SnH), гидридные комплексы меди (например, реактив Страйкера), гидридные комплексы палладия, гидридные комплексы платины, гидридные комплексы иридия, гидридные комплексы родия и гидридные комплексы рутения. Восстановители могут формироваться in situ, например, гидридный комплекс меди может формироваться путем осуществления взаимодействия соли меди, например, с боргидридным соединением или с гидросиланом. Поэтому, некоторые восстановители (например, боргидридные соединения, гидросиланы и гидростаннаны) могут использоваться в комбинации с каталитическим количеством соли металла (например, соли Cu, Pd, Pt, Ir, Rh или Ru). В качестве альтернативы, каталитические восстановители могут представлять собой соли металлов (например, изопропоксид алюминия или комплекс рутения) в комбинации со спиртом, который выполняют гидрирование с переносом водорода карбонил-содержащих соединений без посредничества гидрида металла. Неограничивающие примеры реакций гидрирования с переносом водорода включают в себя восстановление по Меервейну-Понндорфу-Верлею (например, с использованием алюминия изопропоксида/изопропанола) и Ru-катализированного гидрирования с переносом водорода (например, Hashiguchi et al., J. Am. Chem. Soc., 117:7562-7563, 1995).
Если субстрат представляет собой α, (-ненасыщенное карбонильное или сульфоновое соединение (например, α, (-енон или винилсульфон), то восстановитель может представлять собой 1,2-восстановитель или 1,4-восстановитель. Например, путем осуществления взаимодействия между α, (-ненасыщенным карбонильным соединением и 1,2-восстановителем можно получать, например, аллиловый спирт (или аллиловый амин, если исходное вещество представляет собой енамид), тогда как путем осуществления взаимодействия между α, (-ненасыщенным карбонильным соединением и 1,4-восстановителем можно получать α, (-насыщенное соединение и оставлять карбонильную группу в неизменном виде после выделения продукта реакции. Неограничивающие примеры 1,2-восстановителей включают в себя гидриды металлов и гидриды металлоидов, например, алюмогидридные соединения, боргидридные соединения (например, CeCl3 с NaBH4) и гидридные комплексы рутения. Неограничивающие примеры 1,4-восстановителей включают в себя боргидридные соединения (например, LiHBEt3 и L-селектрид), гидростаннаны, гидридные комплексы меди (например, реактив Страйкера), гидридные комплексы палладия, гидридные комплексы платины, гидридные комплексы иридия, гидридные комплексы родия и гидридные комплексы рутения.
Соединение, содержащее аллильную уходящую группу (например, карбоксилат, галогенид или сульфонат), может быть обработано аллильным восстановителем для замены аллильной группы атомом водорода. Неограничивающим примером аллильного восстановителя является соль или комплекс палладия (например, Pd(PPh3)4) в комбинации с солью муравьиной кислоты (например, триалкиламмония формиат).
Гидроксил-защитные группы и агенты для удаления гидроксил-защитных групп
Гидроксил-защитные группы могут представлять собой группы, определенные в настоящем документе. В частности, гидроксил-защитная группа может представлять собой ацил, сульфонил, арилалкил (например, бензил или пара-метоксибензил), арил (например, пара-метоксифенил) или необязательно замещенный силил (например, TMS, TES, TBS, TIPS, TBDPS или TPS). Гидроксил-защитные группы, гидроксил-защитные агенты и гидроксил-защитные условия реакций могут быть выбраны для избирательной защиты определенных гидроксильных групп в соединении, оставляя при этом другие гидроксильные группы незащищенными. Выбор гидроксил-защитных групп для соединения может облегчать последующие стратегии снятия защиты, так как с использованием соответствующих агентов для удаления гидроксил-защитных групп некоторые гидроксил-защитные группы могут быть удалены с сохранением других групп. Некоторые из таких стратегий, включающих в себя выбор силильных гидроксил-защитных групп, обсуждается, например, в Silicon-Based Blocking Agents, Gelest, Inc., 2011.
Агенты для удаления гидроксил-защитных групп представляют собой такие агенты, которые могут взаимодействовать с соединением, содержащим защищенную гидроксильную группу, с получением соединения с незащищенной гидроксильной группой. Агенты для удаления гидроксил-защитных групп и условия реакций снятия защиты могут представлять собой таковые, известные из уровня техники. Согласно неограничивающему примеру, с гидроксила, защищенного в виде силилового эфира, защита может быть снята путем осуществления взаимодействия с источником фторида (например, солью фторида, такой как KF или TBAF). В качестве альтернативы, с гидроксила, защищенного в виде TMS или TES эфира, защита может быть снята путем осуществления взаимодействия с кислотой Бренстеда (например, карбоновой кислотой). Согласно другому неограничивающему примеру, с гидроксила, защищенного в виде сложного эфира, защита может быть снята путем осуществления взаимодействия с основанием (например, с гидроксидом щелочного металла (например, гидроксид лития, гидроксид натрия или гидроксид калия) или с C1-6алкоксидом (например, C1-6алкоксидом щелочного металла или C1-6алкоксидом щелочноземельного металла)). В качестве альтернативы, с гидроксила, защищенного в виде сложного эфира (например, сложного пивалоилового эфира), защита может быть снята путем осуществления взаимодействия с 1,2-восстановителем (например, DIBAL-H). Согласно еще одному неограничивающему примеру, с гидроксила, защищенного в виде арилалкилового эфира (например, 1-арилалк-1-иловый эфир), защита может быть снята с использованием реакции восстановления, например, с Pd/C и H2 или с Na/NH3. В качестве альтернативы, с гидроксила, защищенного в виде алкоксиарилалкилового эфира (например, MPM эфир) защита может быть снята путем осуществления взаимодействия с 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ). Согласно другому неограничивающему примеру, с гидроксила, защищенного в виде алкоксиалкилового эфира (например, 1-алкоксиалк-1-илового) или THP эфира, защита может быть снята путем осуществления взаимодействия с кислотой Бренстеда. С циклических защищенных диолов, таких как ацетали или кетали (например, 2-алкил-1,3-диоксолан, 2,2-диалкил-1,3-диоксолан, 2-алкил-1,3-диоксан или 2,2-диалкил-1,3-диоксан), защита может быть снята путем осуществления взаимодействия с кислотой Бренстеда (например, карбоновая кислота).
Декарбоксилирование и десульфонилирование
Условия для реакции декарбоксилирования могут представлять собой условия, известные из уровня техники, например, декарбоксилирование по Крапчо или последовательность, включающая в себя снятие защиты, если RC не представляет собой H, путем преобразования RC до H и последующее протодекарбоксилирование. Условия для реакции десульфонилирования могут представлять собой условия, известные из уровня техники. Например, реакция десульфонилирования может включать в себя приведение соединения формулы (IA) или формулы (IB), или промежуточного продукта, расположенного после соединения формулы (IA) или формулы (IB), в контакт с восстановителем-переносчиком электронов (например, SmI2; соль Cr(III) и Mn(0); или Mg(0)). Типовые условия десульфонилирования см. WO 2009/064029.
Реакция Нозаки-Хияма-Киши
Условия реакции Нозаки-Хияма-Киши, которые могут быть использованы в описанном в настоящем документе преобразовании, могут представлять собой условия, известные из уровня техники. Реакция Нозаки-Хияма-Киши может включать в себя осуществление взаимодействия субстратов (альдегида и винилгалогенида или псевдогалогенида) с солью Cr(II) и солью Ni(II). В комбинации с солями металлов могут быть использованы дополнительные лиганды. Согласно неограничивающему примеру, в комбинации с солью Ni(II) может быть использован замещенный 1,10-фенантролин. Для придания реакции стереоселективности могут быть использованы хиральные дополнительные лиганды. Согласно неограничивающему примеру, хиральные N-(дигидрооксазолилфенил)сульфонамиды могут быть использованы с солью Cr(II) для регуляции стереохимии атома углерода карбонила, к которому в процессе реакции Нозаки-Хияма-Киши присоединяется виниловый нуклеофил.
Солеобразование
Условия реакций солеобразования известны из уровня техники. Путем солеобразования эрибулина можно получать фармацевтически приемлемую соль эрибулина (например, эрибулина мезилат). В частности, реакция солеобразования может включать в себя приведение эрибулина в контакт с кислотой Бренстеда (например, фармацевтически приемлемой кислотой Бренстеда (например, ментансульфоновой кислотой)) с получением фармацевтически приемлемой соли эрибулина (например, Handbook of Pharmaceutical Salts: Properties, Selection and Use, ed.: Stahl and Wermuth, Wiley-VCH/VHCA, Weinheim/Zurich, 2002). Фармацевтически приемлемые соли эрибулина, например, эрибулина мезилат, могут формироваться способами, известными из уровня техники, например, in situ в процессе конечного выделения и очистки соединения, или отдельно путем осуществления взаимодействия свободной основной группы с подходящей органической кислотой. Согласно одному примеру, эрибулин обрабатывают раствором MsOH и NH4OH в воде и ацетонитриле. Смесь концентрируют.Остаток растворяют в смеси DCM/пентан, и добавляют раствор к безводному пентану. Полученный осадок фильтруют и сушат в условиях высокого вакуума с получением эрибулина мезилата.
Эпимеризация
Реакции эпимеризации могут быть использованы для обращения стереогенного центра, характеризующегося нежелательной стереохимической конфигурацией. Например, посредством эпимеризации R-стереогенный центр может быть преобразован до S-стереогенного центра, и наоборот.Эпимеризация стереогенного sp3-атома углерода, связанного с одним атомом водорода и с одной гидроксильной группой, может достигаться посредством последовательности реакций, включающей в себя окисление гидроксильной группы до карбонильной группы с последующей реакцией 1,2-восстановления. Реакция 1,2-восстановления может диастереоселективно обеспечивать нужную стереохимическую конфигурацию, или реакция может осуществляться с использованием хирального катализатора, хирального вспомогательного вещества или хирального восстановителя. Неограничивающие примеры хиральных восстановителей включают в себя Alpine-Borane и Prapine-Borane. Неограничивающими примерами реакций 1,2-восстановления с использованием хиральных катализаторов являются восстановление по Кори-Бакши-Шибата, гидрирование по Нойори и гидрирование с переносом водорода по Нойори. Последовательность реакций окисления/восстановления может проводиться in situ с использованием динамического кинетического разделения. Динамическое кинетическое разделение может дополнительно включать в себя взаимодействие с гидроксил-защитным агентом, который выводит целевой стереоизомер из окислительно-восстановительного равновесия. Согласно неограничивающему примеру, динамическое кинетическое разделение хиральных вторичных спиртов может включать в себя установление окислительно-восстановительного равновесия с использованием η5 Ph5CpRu(CO)2H в сочетании с энантиоселективной эстерификацией с использованием изопропенилацетата, катализируемой липазой (например, липазой B из Candida Antarctica, см., например, Martin-Matute et al., J. Am. Chem. Soc., 127:8817-8825, 2005).
Эпимеризация также может проводиться на соединении, содержащем тетрагидропиран-2-илацетальдегидный фрагмент, в котором атом углерода во 2-м положении пиранового кольца характеризуется нежелательной стереохимической конфигурацией. Путем приведения этого соединения в контакт с L-пролином можно достигать равновесия между двумя стереоизомерами. Если в соединении присутствуют другие неуравновешиваемые стереогенные центры, то наиболее устойчивый стереоизомер будет присутствовать в большем количестве по сравнению с другими находящимися в равновесии с ним стереоизомерами.
Последующие примеры предназначены для иллюстрации изобретения. Они никоим образом не предназначены для ограничения изобретения.
Примеры
Пример 1 - Получение аналога макролида галихондринового ряда через соединение формулы (IC)
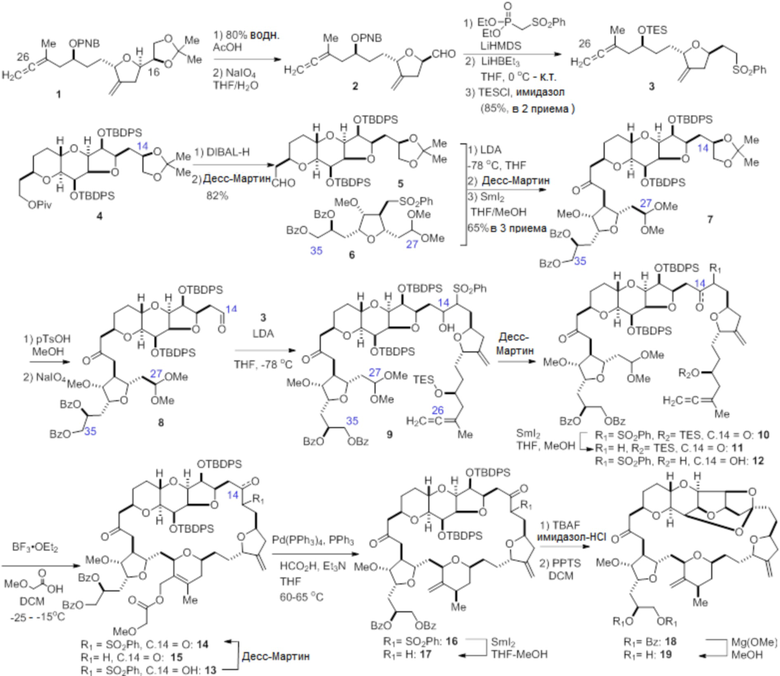
(S)-1-((2S,5R)-5-((R)-1,2-дигидроксиэтил)-3-метилентетрагидрофуран-2-ил)-5-метилгепта-5,6-диен-3-ил-4-нитробензоат

К раствору (S)-1-((2S,5R)-5-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3-метилентетрагидрофуран-2-ил)-5-метилгепта-5,6-диен-3-ил-4-нитробензоата (0,70 г, 1,53 ммоль) в уксусной кислоте (8 мл) при температуре окружающей среды добавляли воду (2 мл). Полученную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, реакционную смесь концентрировали в условиях вакуума и дважды подвергали азеотропной перегонке с толуолом с получением 0,62 г целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,56-1,70 (м, 2H) 1,73 (т, J=3,13 Гц, 3H) 1,81-1,94 (м, 2H) 2,25-2,32 (м, 1H) 2,37-2,47 (м, 1H) 2,50-2,59 (м, 1H) 2,60-2,70 (м, 1H) 3,51-3,59 (м, 1H) 3,60-3,68 (м, 1H) 3,69-3,76 (м, 1H) 4,04-4,14 (м, 1H) 4,42-4,50 (м, 2H) 4,50-4,59 (м, 1H) 4,84 (кв, J=2,21 Гц, 1H) 5,02 (кв, J=1,95 Гц, 1H) 5,31-5,39 (м, 1H) 8,16-8,23 (м, 2H) 8,26-8,32 (м, 2H)
(S)-5-метил-1-((2S,5R)-3-метилен-5-((E)-2-(фенилсульфонил)-винил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил-4-нитробензоат
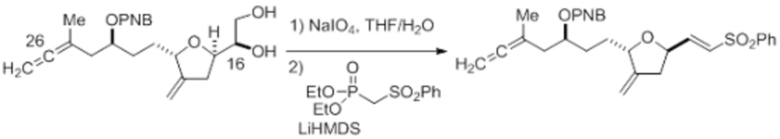
((S)-1-((2S,5R)-5-((R)-1,2-дигидроксиэтил)-3-метилентетрагидрофуран-2-ил)-5-метилгепта-5,6-диен-3-ил-4-нитробензоат (0,62 г, 1,49 ммоль) растворяли в THF (12,4 мл) при температуре окружающей среды. Затем, добавляли воду (6,20 мл) и перйодат натрия (0,953 г, 4,46 ммоль). Полученную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, реакционную смесь разбавляли MTBE (30 мл), дважды промывали 30% (масс./об.) водным NaCl (15 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 573 мг (S)-1-((2S,5R)-5-формил-3-метилентетрагидрофуран-2-ил)-5-метилгепта-5,6-диен-3-ил 4-нитробензоата. Неочищенный продукт растворяли в THF (8,6 мл) и охлаждали до 78°C. В отдельной колбе, диметил((фенилсульфонил)метил)фосфонат (589 мг, 2,23 ммоль) растворяли в THF (7 мл) и обрабатывали 1,0 M LiHMDS (2304 мкл, 2,304 ммоль) в течение 20 мин при 0°C. Полученный раствор добавляли в раствор альдегида при 78°C. Полученную реакционную смесь перемешивали до расходования всего альдегида. После завершения преобразования, реакционную смесь гасили добавлением насыщенного водного NH4Cl (9 мл) и воды (3 мл). Полученную смесь нагревали до температуры окружающей среды и дважды экстрагировали MTBE (по 12 мл каждый раз). Объединенные органические слои промывали 30% водным NaCl (10 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 20-50% этилацетата в н-гептане получали 438 мг целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,60-1,75 (м, 5H) 1,80-1,92 (м, 2H) 2,21-2,30 (м, 1H) 2,33-2,54 (м, 2H) 2,78-2,98 (м, 1H) 4,42-4,48 (м, 2H) 4,48-4,56 (м, 1H) 4,61-4,75 (м, 1H) 4,87 (д, J=1,95 Гц, 1H) 5,00-5,10 (м, 1H) 5,24-5,47 (м, 1H) 6,54 (дд, J=15,05, 1,76 Гц, 1H) 6,92 (дд, J=14,85, 3,91 Гц, 1H) 7,49-7,58 (м, 2H) 7,58-7,68 (м, 1H) 7,80-7,95 (м, 2H) 8,11-8,23 (м, 2H) 8,24-8,33 (м, 2H)
(S)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ол
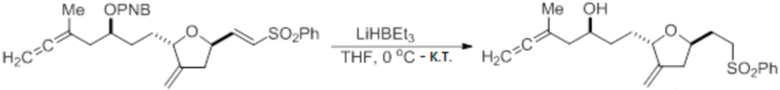
(S)-5-метил-1-((2S,5R)-3-метилен-5-((E)-2-(фенилсульфонил)-винил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил-4-нитробензоат (438 мг, 0,837 ммоль) растворяли в THF (15 мл) и охлаждали до 0°C. Добавляли 1,0 M супергидрид в THF (3,35 мл, 3,35 ммоль), и доводили полученную смесь до температуры окружающей среды. После завершения расходования исходного вещества, добавляли нас.водн. раствор NH4Cl (30 мл). Полученную смесь дважды экстрагировали MTBE (по 30 мл каждый раз). Объединенные органические слои промывали 30% (масс./об.) водным раствором NaCl (10 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 30-50% этилацетата в н-гептане получали 280 мг целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,48-1,66 (м, 3H) 1,69 (т, J=3,12 Гц, 3H) 1,83-1,94 (м, 2H) 2,06 (дт, J=5,08, 2,54 Гц, 2H) 2,19-2,31 (м, 1H) 2,43 (д, J=2,73 Гц, 1H) 2,64-2,76 (м, 1H) 3,05-3,17 (м, 1H) 3,20-3,32 (м, 1H) 3,65-3,78 (м, 1H) 4,01-4,14 (м, 1H) 4,32 (ушир. с, 1H) 4,58-4,69 (м, 2H) 4,85 (кв, J=2,21 Гц, 1H) 4,98 (кв, J=1,95 Гц, 1H) 7,52-7,60 (м, 2H) 7,61-7,68 (м, 1H) 7,88-7,92 (м, 2H)
Триэтил(((S)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил)окси)силан
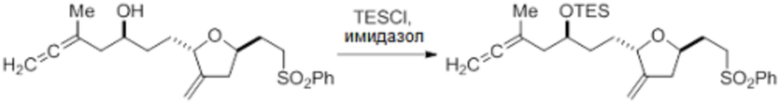
К раствору (S)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ола (0,14 г, 0,372 ммоль) в дихлорметане (4 мл) при 0°C добавляли имидазол (101 мг, 1,4 ммоль) и хлортриэтилсилан (0,127 мл, 0,744 ммоль). Полученную реакционную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.раствора NH4Cl (10 мл). Полученную смесь экстрагировали MTBE (20 мл), промывали 30% (масс./об.) водным NaCl (5 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 0-25% этилацетата в н-гептане получали 128 мг целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,57 (кв, J=8,08 Гц, 6H) 0,94 (т, J=7,82 Гц, 9H) 1,44-1,58 (м, 4H) 1,67 (т, J=3,13 Гц, 3H) 1,79-1,95 (м, 2H) 1,99-2,07 (м, 1H) 2,07-2,16 (м, 1H) 2,18-2,30 (м, 1H) 2,63-2,72 (м, 1H) 3,05-3,18 (м, 1H) 3,24-3,37 (м, 1H) 3,72-3,87 (м, 1H) 3,96-4,06 (м, 1H) 4,21-4,33 (м, 1H) 4,48-4,60 (м, 2H) 4,83 (д, J=1,95 Гц, 1H) 4,97 (д, J=1,95 Гц, 1H) 7,49-7,59 (м, 2H) 7,61-7,71 (м, 1H) 7,84-7,95 (м, 2H).
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегид
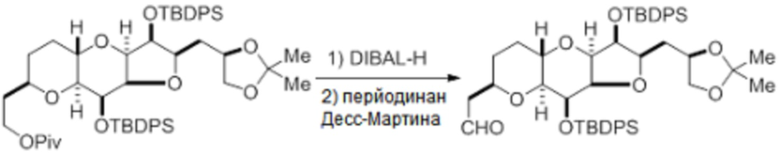
К раствору 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалата (0,100 г, 0,107 ммоль) в дихлорметане (2,0 мл) при 78°C добавляли 1,0 M Dibal-H в толуоле (0,214 мл, 0,214 ммоль). Реакционную смесь перемешивали при 78°C до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением метанола (0,043 мл, 1,07 ммоль) и раствора сегнетовой соли (0,453 г) в воде (2,0 мл). Полученную смесь доводили до температуры окружающей среды в течение ночи. Органический слой отбрасывали, и дважды экстрагировали водный слой дихлорметаном (4,00 мл). Объединенные органические слои сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 89 мг [2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этанола]. Неочищенный продукт растворяли в дихлорметане (1,8 мл) при температуре окружающей среды и обрабатывали бикарбонатом натрия (43,9 мг, 0,523 ммоль) и перйодинаном Десс-Мартина (111 мг, 0,261 ммоль). После завершения реакции, добавляли MTBE (1,8 мл), насыщенный водный NaHCO3 (8% масс./об.) (1 мл), воду (0,5 мл) и тиосульфат натрия (165 мг, 1,05 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 1 ч, и разделяли слои. Органический слой промывали 30% водным NaCl (1 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента смеси н-гептана и этилацетата (2/1) получали 73 мг целевого продукта в виде белого пенообразного твердого вещества. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,09 (с, 9H) 1,11 (с, 9H) 1,21-1,30 (м, 6H) 1,32-1,44 (м, 3H) 1,58-1,68 (м, 1H) 1,82-1,90 (м, 1H) 1,96-2,20 (м, 1H) 2,10-2,29 (м, 2H) 3,05 (дд, J=9,57, 3,71 Гц, 1H) 3,17-3,26 (м, 1H) 3,64-3,83 (м, 4H) 3,85-3,92 (м, 1H) 3,99-4,09 (м, 1H) 4,14-4,20 (м, 1H) 4,23 (т, J=5,28 Гц, 1H) 4,36 (дд, J=6,45, 3,71 Гц, 1H) 7,29-7,41 (м, 12H) 7,68-7,80 (м, 8H) 9,54 (ушир. с, 1H).
(R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
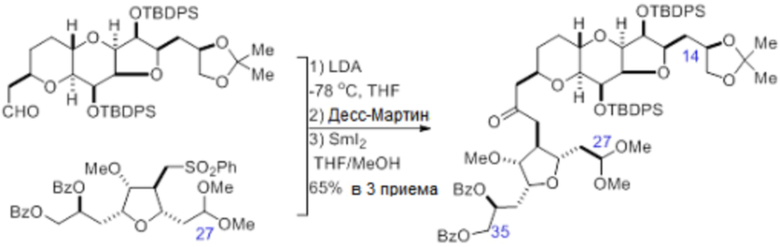
К раствору (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (593 мг, 0,946 ммоль) в THF (3,6 мл) при 78°C добавляли 0,35 M диизопропиламид лития (LDA) в THF (2,65 мл, 0,927 ммоль). Спустя 1 ч, добавляли раствор 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегида (358 мг, 0,422 ммоль) в н-гептане (5,4 мл). Реакционную смесь перемешивали при 78°C до расходования всего альдегида. После завершения реакции, реакционную смесь гасили добавлением нас.водн. раствора NH4Cl (7 мл). Полученную смесь дважды экстрагировали MTBE (50 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (4 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-66% этилацетата в н-гептане получали 576 мг (2R)-3-((2R,3R,4S,5S)-4-((1S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-гидрокси-1-(фенилсульфонил)пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата, загрязненного побочными продуктами. Неочищенный продукт (658 мг) растворяли в дихлорметане (13 мл) и обрабатывали бикарбонатом натрия (0,187 г, 2,229 ммоль) и перйодинаном Десс-Мартина (0,473 г, 1,115 ммоль) при температуре окружающей среды. Реакционную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, добавляли MTBE (30 мл), нас.водн. раствор NaHCO3 (15 мл), нас.водн. Na2S2O3 (10 мл) и воду (10 мл). Полученную смесь перемешивали в течение 1 ч при температуре окружающей среды, и разделяли слои. Органический слой отбрасывали, и экстрагировали водный слой MTBE (30 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (10 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 0,590 г (R)-3-((2R,3R,4S,5S)-4-((S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксо-1-(фенилсульфонил)пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата в виде белого пенообразного твердого вещества. Неочищенный кетоновый продукт растворяли в смеси THF/метанол (9/6 мл) и охлаждали до 78°C. Добавляли 0,1 M SmI2 в THF (18,0 мл, 1,80 ммоль) до тех пор, пока сохраняется зеленый цвет. После завершения реакции, добавляли насыщенный водный раствор сегнетовой соли (30 мл), MTBE (7,2 мл) и воду (4 мл). Полученную смесь нагревали до температуры окружающей среды в течение 4 ч. Органический слой разделяли, и экстрагировали водный слой MTBE (7,2 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (2,4 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-88% этилацетата в н-гептане получали 353 мг целевого продукта в виде белого пенообразного твердого вещества. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,07 (с, 9H) 1,10 (с, 9H) 1,22-1,45 (м, 6H) 1,57-1,66 (м, 1H) 1,73-1,95 (м, 4H) 1,97-2,07 (м, 1H) 2,12-2,30 (м, 5H) 2,31-2,41 (м, 1H) 3,03 (дд, J=9,57, 3,32 Гц, 1H) 3,17-3,22 (м, 1H) 3,23 (с, 3H) 3,25 (с, 3H) 3,33 (с, 3H) 3,29-3,39 (м, 1H) 3,40-3,49 (м, 1H) 3,64 (т, J=6,45 Гц, 1H) 3,68-3,79 (м, 3H) 3,81-3,90 (м, 2H) 3,98-4,08 (м, 1H) 4,09-4,17 (м, 1H) 4,21 (т, J=5,28 Гц, 1H) 4,31 (дд, J=6,64, 3,52 Гц, 1H) 4,43 (дд, J=7,62, 3,71 Гц, 1H) 4,55 (д, J=4,69 Гц, 2H) 5,53-5,64 (м, 1H) 7,28-7,45 (м, 16H) 7,50-7,59 (м, 2H) 7,67-7,73 (м, 6H) 7,78 (д, J=6,64 Гц, 2H) 8,00 (д, J=7,43 Гц, 2H) 8,05 (д, J=7,43 Гц, 2H).
(R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-((R)-2,3-дигидроксипропил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат, соединение 7a
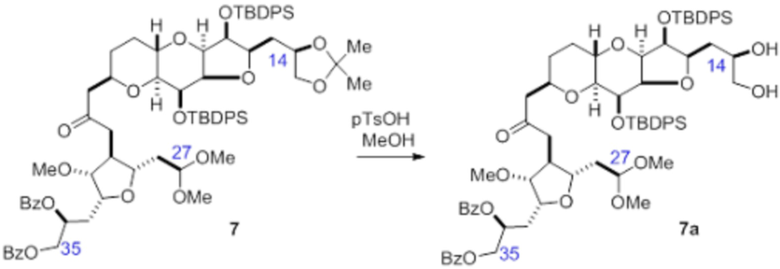
К раствору (R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (87 мг, 0,065 ммоль) в метаноле (5 мл) при температуре окружающей среды добавляли моногидрат пара-толуолсульфоновой кислоты (3,10 мг, 0,016 ммоль). Реакционную смесь перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.водн. раствора NaHCO3 (5 мл) и воды (5 мл). Полученную смесь дважды экстрагировали MTBE (по 10 мл каждый раз), объединенные органические слои промывали 30% (масс./об.) водным NaCl (2 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-100% этилацетата в н-гептане получали 51 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,06 (с, 9H) 1,08 (с, 9H) 1,33-1,48 (м, 2H) 1,59-1,67 (м, 1H) 1,70-1,95 (м, 4H) 1,99-2,04 (м, 1H) 2,07-2,31 (м, 5H) 2,32-2,42 (м, 1H) 2,75 (д, J=5,08 Гц, 1H) 3,02 (дд, J=9,97, 4,49 Гц, 1H) 3,22 (с, 3H) 3,24 (с, 3H) 3,29-3,33 (м, 1H) 3,34 (с, 3H) 3,38 (ушир. с, 3H) 3,57 (дд, J=6,64, 4,69 Гц, 1H) 3,62 (т, J=4,89 Гц, 1H) 3,67-3,77 (м, 1H) 3,86 (ушир. с, 3H) 4,05 (тд, J=10,26, 4,49 Гц, 1H) 4,23 (с, 2H) 4,43 (дд, J=7,62, 3,71 Гц, 1H) 4,55 (д, J=5,08 Гц, 2H) 5,54-5,66 (м, 1H) 7,29-7,43 (м, 16H) 7,49-7,59 (м, 2H) 7,61-7,69 (м, 6H) 7,72-7,78 (м, 2H) 7,97-8,01 (м, 2H) 8,02-8,08 (м, 2H)
(R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-оксоэтил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат

К раствору (R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-((R)-2,3-дигидроксипропил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (51 мг, 0,039 ммоль) в THF (2 мл) при температуре окружающей среды добавляли воду (0,7 мл, 39 ммоль) и перйодат натрия (50,6 мг, 0,237 ммоль). Реакционную смесь перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением 30% (масс./об.) водного NaCl (5 мл). Полученную смесь экстрагировали MTBE (12 мл), органический слой дважды промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 48 мг целевого продукта в виде белого пенообразного твердого вещества. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. 1H-ЯМР (400 МГц, бензол-d6) (м.д. 1,19 (с, 9H) 1,30 (с, 9H) 1,35-1,44 (м, 2H) 1,75 (дд, J=16,61, 4,89 Гц, 1H) 1,85-1,92 (м, 1H) 1,92-1,99 (м, 2H) 2,08-2,22 (м, 3H) 2,27-2,44 (м, 2H) 2,50-2,61 (м, 2H) 2,78-2,85 (м, 1H) 2,85-2,93 (м, 1H) 2,99 (дд, J=7,23, 4,10 Гц, 1H) 3,12-3,17 (м, 1H) 3,15 (с, 3H) 3,18-3,21 (м, 1H) 3,23 (с, 3H) 3,28 (с, 3H) 3,33 (д, J=3,13 Гц, 1H) 3,62-3,75 (м, 2H) 3,95-4,02 (м, 1H) 4,05 (дд, J=6,45, 5,28 Гц, 1H) 4,12 (дд, J=7,62, 2,54 Гц, 2H) 4,24 (кв, J=6,38 Гц, 1H) 4,48-4,62 (м, 2H) 4,76 (дд, J=7,23, 4,10 Гц, 1H) 5,84-5,97 (м, 1H) 6,92-6,98 (м, 2H) 6,99-7,08 (м, 4H) 7,19-7,38 (м, 12H) 7,72-7,79 (м, 2H) 7,82-7,95 (м, 6H) 8,12 (д, J=7,43 Гц, 2H) 8,17 (д, J=6,64 Гц, 2H) 9,59 (с, 1H)
(2R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
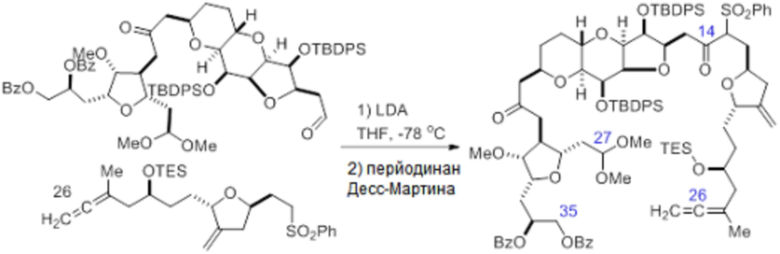
К раствору триэтил(((S)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил)окси)силана (25,09 мг, 0,051 ммоль) в THF (1,5 мл) при 78°C добавляли 0,35 M LDA в THF (0,156 мл, 0,055 ммоль). После 30 мин при 78°C, добавляли раствор (R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(2-оксоэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (43 мг, 0,034 ммоль) в THF (1,5 мл). После перемешивания в течение 30 мин при 78°C, реакционную смесь обрабатывали нас.водн. раствором NH4Cl (3 мл), водой (2 мл) и MTBE (5 мл). Полученную смесь доводили до температуры окружающей среды, и разделяли слои. Водный слой экстрагировали MTBE (10 мл), объединенные органические слои промывали 30% (масс./об.) водным NaCl (2 мл) дважды и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 15-50% этилацетата в н-гептане получали 36 мг смеси (2R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-гидрокси-4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-3-(фенилсульфонил)бутил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата и исходного альдегида, которую использовали на следующей стадии без дополнительной очистки.
К раствору неочищенного продукта в дихлорметане (1 мл) при температуре окружающей среды добавляли бикарбонат натрия (10,35 мг, 0,123 ммоль) и перйодинан Десс-Мартина (26,1 мг, 0,062 ммоль). После перемешивания в течение 6 ч, реакционную смесь разбавляли MTBE (5 мл) и обрабатывали нас.водн. раствором NaHCO3 (3 мл) и нас.водн. Na2S2O3 (2 мл). Полученную смесь перемешивали в течение 20 мин, и разделяли слои. Водный слой экстрагировали MTBE (12 мл), объединенные органические слои дважды промывали 30% (масс./об.) водным NaCl и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-50% этилацетата в н-гептане получали 24 мг целевого продукта в виде диастереоизомерной смеси 1:1. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,49-0,64 (м, 6H) 0,90-1,00 (м, 9H) 1,04-1,14 (м, 18H) 1,20-1,55 (м, 7H) 1,60-1,64 (м, 1,5H) 1,65-1,70 (м, 1,5H) 1,71-2,70 (м, 18H) 2,97-3,09 (м, 1H) 3,22 (с, 1,5H) 3,22 (с, 1,5H) 3,24 (с, 1,5H) 3,24 (с, 1,5H) 3,25-3,31 (м, 1H) 3,33 (с, 3H) 3,36-3,48 (м, 1H) 3,49-3,63 (м, 1H) 3,65-3,90 (м, 3H) 3,94-4,30 (м, 8H) 4,39-4,45 (м, 1H) 4,48-4,53 (м, 1H) 4,53-4,58 (м, 3H) 4,80 (ушир. д, J=8,99 Гц, 1H) 4,88-4,98 (м, 1H) 5,52-5,64 (м, 1H) 7,27-7,83 (м, 31H) 8,00 (ушир. д, J=7,43 Гц, 2H) 8,05 (ушир. д, J=7,82 Гц, 2H)
Соединение 14
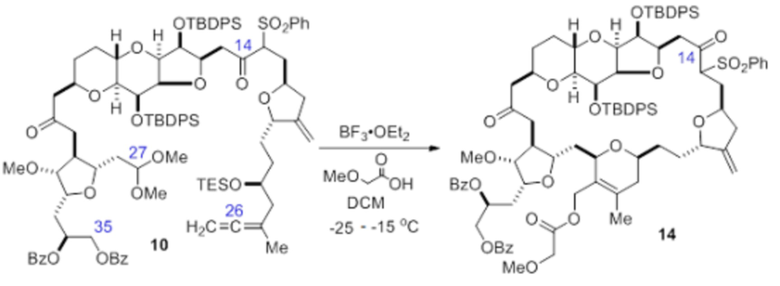
К раствору (2R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (12 мг, 5,484 мкмоль) в дихлорметане (2,4 мл) при 18°C добавляли метоксиуксусную кислоту (0,017 мл, 0,219 ммоль) и BF3⋅OEt2 (5,6 мкл, 0,044 ммоль). Реакционную смесь перемешивали при температуре от 25°C до 15°C до завершения циклизации. После завершения реакции, реакционную смесь гасили добавлением нас.водн. NaHCO3 (5 мл). Полученную смесь дважды экстрагировали MTBE (10 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 10-40% этилацетата в н-гептане получали 5,5 мг целевого продукта в виде диастереоизомерной смеси (3:2). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,93 (с, 5H) 0,99 (с, 4H) 1,11 (с, 4H) 1,13 (с, 5H) 1,31-1,58 (м, 9H) 1,70 (с, 1,2H) 1,74 (с, 1,8H) 1,74-2,12 (м, 6H) 2,19 (ушир. т, J=6,25 Гц, 2H) 2,27-2,78 (м, 7H) 2,95 (т, J=9,18 Гц, 0,4H) 3,07 (т, J=8,99 Гц, 0,6H) 3,32 (с, 1,8H) 3,34 (с, 1,2H) 3,35-3,39 (м, 2H) 3,41 (с, 1,2H) 3,42 (с, 1,8H) 3,49-3,55 (м, 1H) 3,56-3,62 (м, 1H) 3,64-3,90 (м, 4H) 3,99 (с, 0,8H) 3,99 (с, 1,2H) 4,01-4,10 (м, 2H) 4,20-4,44 (м, 3H) 4,50-4,59 (м, 2H) 4,60-4,73 (м, 2H) 4,77 (с, 0,4H) 4,82 (с, 0,6H) 4,87 (с, 0,4H) 4,96 (с, 0,6H) 5,50-5,64 (м, 1H) 7,27-7,81 (м, 31H) 7,96-8,10 (м, 4H)
Соединение 16
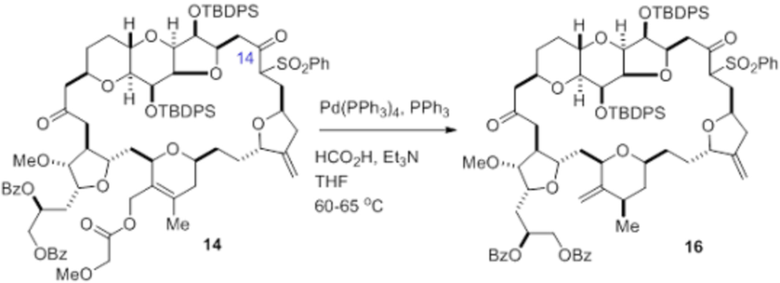
К раствору соединения 14 (5,5 мг, 3,309 мкмоль) в THF (1 мл) добавляли муравьиную кислоту (6,35 мкл, 0,165 ммоль), триэтиламин (0,023 мл, 0,165 ммоль) и раствор Pd(Ph3P)4 (1,147 мг, 0,993 мкмоль) и трифенилфосфина (1,041 мг, 3,971 мкмоль) в THF (0,1 мл). Полученную смесь перемешивали при 60-65°C в течение ночи и охлаждали до температуры окружающей среды. Реакционную смесь разбавляли MTBE (10 мл), промывали нас.водн. NaHCO3 (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 30-50% этилацетата в н-гептане получали 1,8 мг целевого продукта (диастереоизомерная смесь 2:1). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,94 (с, 6H) 0,98 (с, 3H) 1,03 (ушир. д, J=6,25 Гц, 3H) 1,10 (с, 3H) 1,12 (с, 6H) 1,27-1,76 (м, 8H) 1,90- 2,12 (м, 7H) 2,21 (ушир. т, J=6,25 Гц, 2H) 2,27-2,82 (м, 8H) 2,95-3,03 (м, 0,33H) 3,10 (т, J=9,18 Гц, 0,66H) 3,37 (с, 2H) 3,38 (с, 1H) 3,34-3,43 (м, 1H) 3,44-3,51 (м, 1H) 3,52-3,57 (м, 0,33H) 3,60-3,86 (м, 5H) 3,88-4,06 (м, 3H) 4,13-4,21 (м, 2H) 4,27 (т, J=6,25 Гц, 0,66H) 4,32 (т, J=6,84 Гц, 0,33H) 4,54-4,62 (м, 3H) 4,71 (с, 0,33H) 4,74 (с, 0,66H) 4,78 (с, 0,33H) 4,81 (с, 0,33H) 4,84 (ушир. с, 1,3H) 4,87 (ушир. с, 0,33H) 4,95 (с, 0,66H) 5,59-5,67 (м, 1H) 7,27-7,74 (м, 31H) 7,98-8,02 (м, 2H) 8,05 (ушир. д, J=7,03 Гц, 2H)
Соединение 17
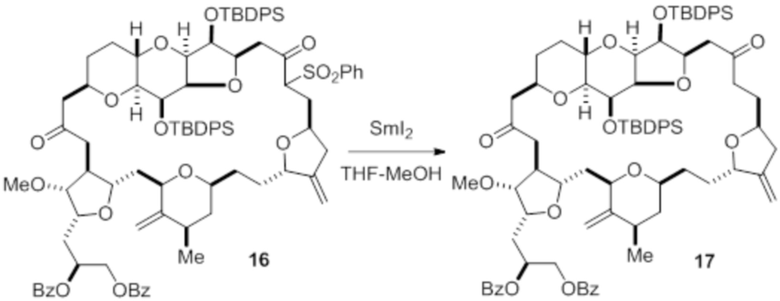
К раствору соединения 16 (1,8 мг, 1,144 мкмоль) в смеси THF (0,5 мл)/метанол (0,25 мл) при 78°C добавляли 0,1 M дийодида самария в THF (0,057 мл, 5,718 мкмоль) до тех пор, пока сохраняется зеленый цвет. Реакционную смесь перемешивали при 78°C в течение 10 мин, и обрабатывали нас.водн. сегнетовой солью (3 мл), MTBE (5 мл) и водой (2 мл). Полученную смесь нагревали до температуры окружающей среды, а затем экстрагировали MTBE (7 мл). Органический слой промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 10-33% этилацетата в н-гептане получали 1,4 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,98 (с, 9H) 1,03 (ушир. д, J=6,25 Гц, 3H) 1,06 (с, 9H) 1,27-2,15 (м, 11H) 2,20-2,33 (м, 3H) 2,56-2,81 (м, 5H) 2,89-2,94 (м, 1H) 3,02-3,12 (м, 2H) 3,41 (с, 3H) 3,45-3,48 (м, 2H) 3,68 (дд, J=5,86, 4,69 Гц, 1H) 3,76 (ушир. д, J=8,60 Гц, 2H) 3,79-3,86 (м, 2H) 3,86-3,96 (м, 2H) 4,03 (дд, J=8,99, 3,52 Гц, 1H) 4,10-4,19 (м, 1H) 4,30-4,39 (м, 2H) 4,55-4,60 (м, 2H) 4,76 (с, 1H) 4,82 (ушир. с, 1H) 4,85 (с, 1H) 4,95 (д, J=1,17 Гц, 1H) 5,57-5,66 (м, 1H) 7,27-7,67 (м, 26H) 8,01 (д, J=7,43 Гц, 2H) 8,05 (д, J=7,43 Гц, 2H).
Соединение 18
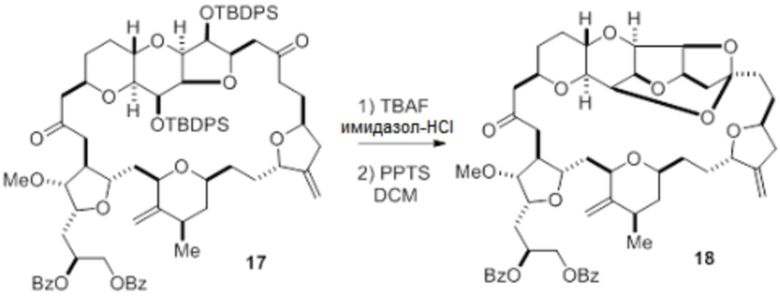
К соединению 17 (1,4 мг, 0,976 мкмоль) во флаконе при температуре окружающей среды добавляли THF (280 мкл) и N,N-диметилацетамид (98 мкл). Добавляли смесь TBAF (1,0 M в THF, 49 мкл, 0,049 ммоль) и имидазола гидрохлорид (2,6 мг, 0,024 ммоль). Полученную смесь перемешивали в течение 15 ч при температуре окружающей среды, а затем обрабатывали 30% (масс./об.) водным NaCl (2 мл) и MTBE (3 мл). Слои разделяли, и дважды экстрагировали водный слой MTBE (по 3 мл каждый раз). Объединенные органические слои концентрировали в условиях вакуума. Остаток растворяли в дихлорметане (0,5 мл) при температуре окружающей среды, и добавляли PPTS (0,9 мг, 3,6 мкмоль). После расходования исходного вещества, реакционную смесь очищали методом колоночной хроматографии на силикагеле с использованием смеси гептан/этилацетат (1/1) и этилацетата в качестве элюента с получением 0,6 мг целевого продукта, который подтверждали методом ЯМР-анализа с аутентичным образцом.
(S)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(4-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксобутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
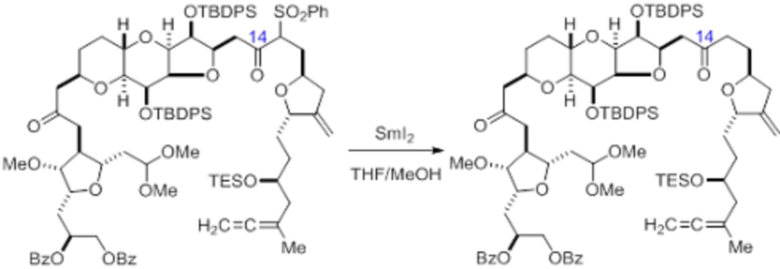
К раствору (S)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (12 мг, 6,856 мкмоль) в смеси THF (1,2 мл)/метанол (0,4 мл) при 78°C добавляли раствор дийодид самария в THF (0,1 M, 0,34 мл, 34 мкмоль) до тех пор, пока сохраняется зеленый цвет.Реакционную смесь перемешивали при 78°C в течение 10 мин, и обрабатывали нас.водн. сегнетовой солью (1,5 мл), MTBE (3 мл) и водой (1 мл). Полученную смесь нагревали до температуры окружающей среды и экстрагировали MTBE (7 мл). Органический слой промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-50% этилацетата в н-гептане получали 6,0 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,60 (кв, J=7,82 Гц, 6H) 0,96 (т, J=7,82 Гц, 9H) 1,05 (с, 9H) 1,06 (с, 9H) 1,32-1,67 (м, 8H) 1,69 (т, J=3,13 Гц, 3H) 1,73-1,89 (м, 2H) 1,90-1,98 (м, 1H) 2,02-2,45 (м, 12H) 2,54-2,64 (м, 1H) 2,73-2,80 (м, 2H) 2,97 (дд, J=9,77, 3,13 Гц, 1H) 3,23 (с, 3H) 3,24 (с, 3H) 3,33 (ушир. с, 4H) 3,39-3,48 (м, 1H) 3,52-3,63 (м, 2H) 3,66-3,77 (м, 1H) 3,78-3,93 (м, 3H) 4,04-4,16 (м, 1H) 4,18-4,25 (м, 2H) 4,27-4,32 (м, 1H) 4,35 (кв, J=6,12 Гц, 1H) 4,42 (дд, J=7,62, 3,71 Гц, 1H) 4,51-4,58 (м, 4H) 4,82 (д, J=1,56 Гц, 1H) 4,95 (д, J=1,95 Гц, 1H) 5,52-5,63 (м, 1H) 7,26-7,46 (м, 16H) 7,50-7,57 (м, 2H) 7,63-7,70 (м, 6H) 7,72-7,79 (м, 2H) 7,98-8,01 (м, 2H) 8,03-8,06 (м, 2H)
Соединение 15
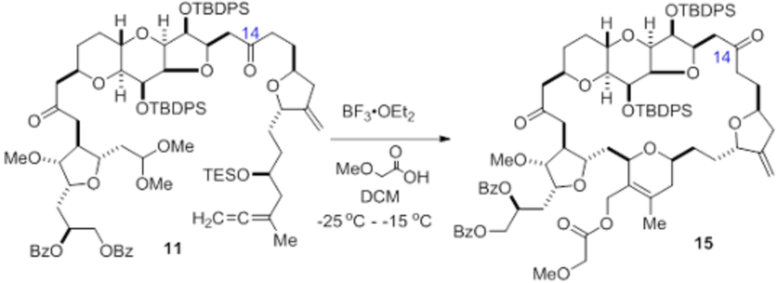
К раствору (R)-3-((2R,3R,4S,5S)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксобутил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (6,0 мг, 3,726 мкмоль) в дихлорметане (1,8 мл) при 25°C добавляли метоксиуксусную кислоту (8,6 мкл, 0,112 ммоль) и BF3·OEt2 (3,8 мкл, 0,03 ммоль). Реакционную смесь перемешивали при температуре от 20°C до 15°C, и отслеживали реакцию методом ТСХ. После завершения реакции, реакционную смесь гасили добавлением нас.водн. NaHCO3 (2 мл). Полученную смесь дважды экстрагировали MTBE (10 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (2 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 10-40% этилацетата в н-гептане получали 2,8 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,98 (с, 9H) 1,07 (с, 9H) 1,40-1,70 (м, 4H) 1,73 (с, 3H) 1,75-2,11 (м, 11H) 2,20 (т, J=6,45 Гц, 2H) 2,23-2,31 (м, 1H) 2,49 (ушир. д, J=2,74 Гц, 1H) 2,50-2,55 (м, 1H) 2,58-3,10 (м, 4H) 2,92-3,02 (м, 1H) 3,03-3,12 (м, 2H) 3,39 (с, 3H) 3,37-3,42 (м, 1H) 3,42 (с, 3H) 3,45-3,51 (м, 2H) 3,63-3,70 (м, 2H) 3,74-3,89 (м, 3H) 3,94 (ддд, J=11,43, 7,72, 3,52 Гц, 1H) 4,00 (с, 2H) 4,04 (дд, J=8,79, 3,71 Гц, 1H) 4,11-4,26 (м, 2H) 4,33 (т, J=6,64 Гц, 2H) 4,56 (д, J=4,69 Гц, 2H) 4,60-4,72 (м, 2H) 4,82 (с, 1H) 4,95 (с, 1H) 5,54-5,67 (м, 1H) 7,29-7,45 (м, 16H) 7,49-7,57 (м, 2H) 7,57-7,70 (м, 8H) 7,98-8,02 (м, 2H) 8,02-8,08 (м, 2H)
Соединение 17
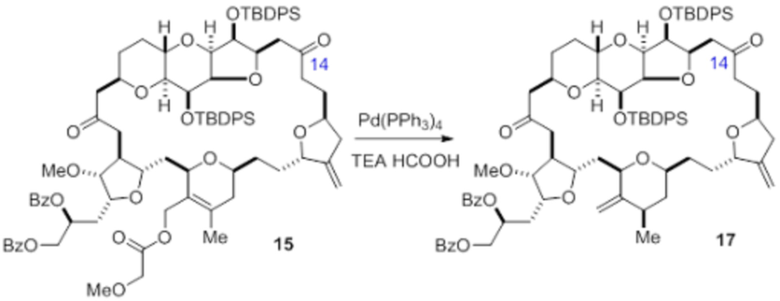
К раствору соединения 15 (1,3 мг, 0,85 мкмоль) в THF (0,5 мл) добавляли муравьиную кислоту (1,6 мкл, 0,043 ммоль), триэтиламин (6,0 мкл, 0,043 ммоль) и раствор Pd(Ph3P)4 (0,5 мг, 0,42 мкмоль) и трифенилфосфина (0,5 мг, 1,7 мкмоль) в THF (0,1 мл). Полученную смесь перемешивали при 60-65°C в течение ночи и охлаждали до температуры окружающей среды. Реакционную смесь разбавляли MTBE (5 мл), промывали нас.водн. NaHCO3 (1 мл) и 30% (масс./об.) водным NaCl (1 мл), и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 20-50% этилацетата в н-гептане получали 0,2 мг целевого продукта, который подтверждали путем сравнения методом ЯМР с аутентичным образцом.
Альтернативный синтез через соединение (IC)
Соединение 17 также может быть получено из соединения 8 в соответствии со следующей последовательностью синтеза.
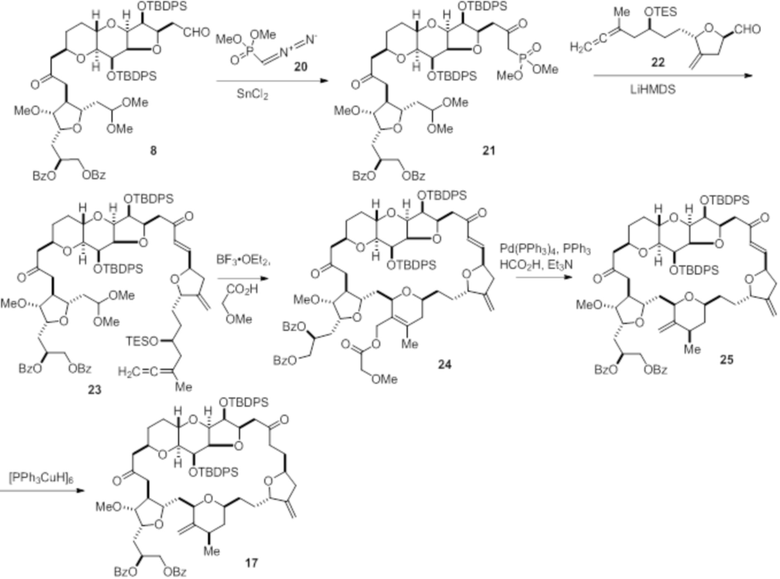
Как представлено выше на схеме, может быть осуществлено взаимодействие соединения 8 с реагентом Сейферта-Гилберта 20 в присутствии SnCl2 с получением соединения 21, после взаимодействия которого с сильным основанием (например, LiHMDS) соединением 22, можно получить соединение 23. Соединение 23 может быть подвергнуто реакции Принса с оксофильной Льюисовой кислотой и карбоновой кислотой с получением соединения 24, после аллильного восстановления (например, Pd-катализируемого аллильного восстановления) и 1,4-восстановления (например, реагентом Страйкера) которого получали соединение 17.
Пример 2 - Получение аналога макролида галихондринового ряда через соединение формулы (IJ)
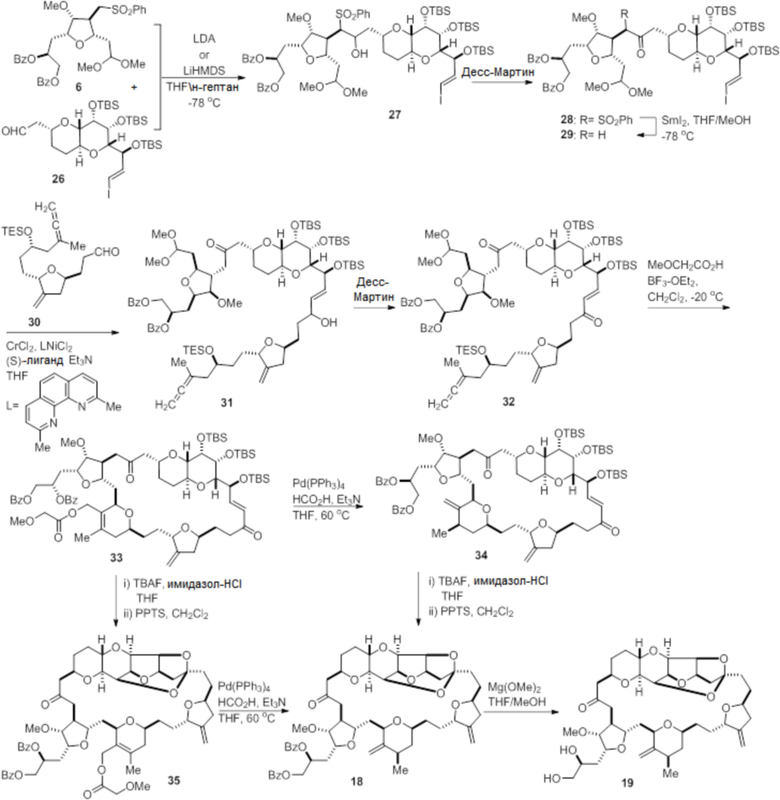
(2S)-3-((2R,3R,4S,5S)-4-((1R)-3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)-2-гидрокси-1-(фенилсульфонил)пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
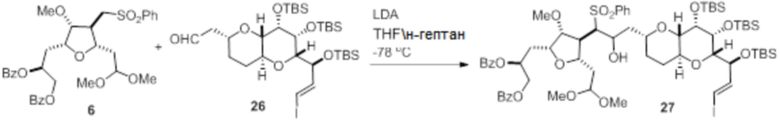
Раствор (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (4,95 г, 7,89 ммоль) (дважды подвергали азеотропной перегонке с THF) в THF (40,5 мл) охлаждали до 78°C и обрабатывали свежеприготовленным диизопропиламидом лития (LDA, 19,7 мл, 0,40 M), поддерживая внутреннюю температуру ниже 68°C. После перемешивания при 78°C в течение 30 мин, смесь обрабатывали раствором 2-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)-окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)ацетальдегида (4,50 г, 6,07 ммоль) в н-гептане (54,0 мл) в течение 15 мин, поддерживая внутреннюю температуру ниже 65°C. Смесь перемешивали при 78°C в течение 2 ч, после чего реакционную смесь гасили добавлением нас.водн. NH4Cl (45,0 мл) и дважды экстрагировали метил-трет-бутиловым эфиром (MTBE, 45,0 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения (8,6 г, 104%).
(S)-3-((2R,3R,4S,5S)-4-((R)-3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)-2-оксо-1-(фенилсульфонил)пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
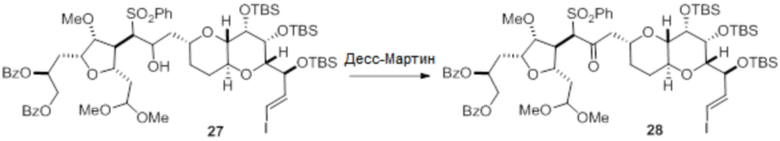
Раствор неочищенного (2R)-3-((2R,3R,4S,5S)-4-((1S)-3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)-октагидропирано[3,2-b]пиран-2-ил)-2-гидрокси-1-(фенилсульфонил)-пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (10,8 г, 7,88 ммоль) в CH2Cl2 (162 мл) обрабатывали перйодинаном Десс-Мартина (4,01 г, 9,45 ммоль) и перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили добавлением нас.водн. NaHCO3 (86 мл) и 20% (масс./об.) водн. Na2SO3 (86 мл). Смесь дважды экстрагировали MTBE (86 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения (11,23 г, 104%).
(S)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
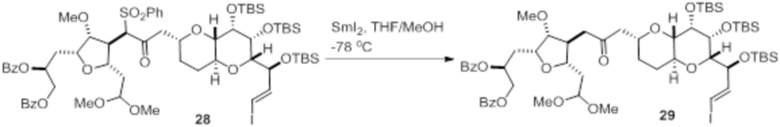
Раствор неочищенного (R)-3-((2R,3R,4S,5S)-4-((S)-3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)-октагидропирано[3,2-b]пиран-2-ил)-2-оксо-1-(фенилсульфонил)-пропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (10,75 г, 7,87 ммоль) в смеси THF (82 мл) и метанола (56 мл) охлаждали до 78°C и обрабатывали 0,1 M SmI2 в THF (197 мл, 19,7 ммоль) в течение 40 мин, поддерживая внутреннюю температуру ниже 60°C. Полученную смесь перемешивали при 78°C в течение 1 ч. Реакционную смесь гасили добавлением 40% (масс./об.) сегнетовой солью в воде (153 мл), и нагревали полученную смесь до комнатной температуры. После обработки карбонатом калия (32,6 г, 236 ммоль), смесь перемешивали при комнатной температуре в течение 30 мин и дважды экстрагировали MTBE (108 мл). Органические слои объединяли, промывали солевым раствором и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-25%) с получением указанного в заголовке соединения (6,65 г, 69% в 3 этапа). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. -0,01 (с, 3H), 0,01 (с, 3H), 0,02 (с, 3H), 0,08 (с, 6H), 0,09 (с, 3H), 0,85 (с, 9H), 0,91 (с, 9H), 0,92 (с, 9H), 1,21-1,40 (м, 2H), 1,67-1,76 (м, 1H), 1,82-1,97 (м, 3H), 2,12-2,25 (м, 2H), 2,34 (дд, J=16,61, 4,89 Гц, 1H), 2,42-2,46 (м, 3H), 2,66 (дд, J=16,41, 7,82 Гц, 1H), 2,92 (дд, J=9,57, 2,15 Гц, 1H), 3,26 (с, 3H), 3,27 (с, 3H), 3,35 (с, 3H), 3,39-3,48 (м, 2H), 3,49-3,57 (м, 1H), 3,77-3,94 (м, 4H), 4,03 (с, 1H), 4,45 (дд, J=6,64, 4,69 Гц, 1H), 4,55 (д, J=5,08 Гц, 2H), 4,87 (дд, J=8,01, 3,32 Гц, 1H), 5,50-5,67 (м, 1H), 6,27 (д, J=14,46 Гц, 1H), 6,84 (дд, J=14,46, 7,82 Гц, 1H), 7,35-7,48 (м, 4H), 7,49-7,63 (м, 2H), 7,91-8,11 (м, 4H).
(2R)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((1S,E)-1-((трет-бутилдиметилсилил)окси)-4-гидрокси-6-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)гекс-2-ен-1-ил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
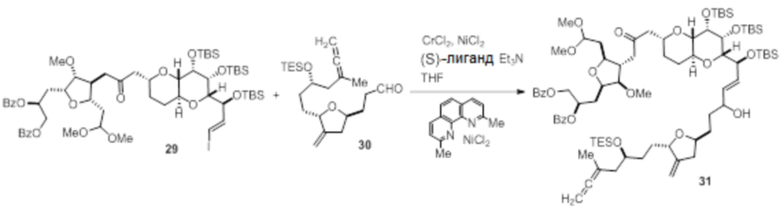
Трехгорлую колбу продували азотом и загружали в нее(S)-N-(2-(4-изопропил-4,5-дихидрооксазол-2-ил)-6-метилфенил)метансульфонамид ((S)-лиганд, 2,42 г, 8,16 ммоль). После продувки азотом в течение 5 мин, добавляли хлорид хрома (1,00 г, 8,16 ммоль). После продувки азотом в течение 5 мин, смесь нагревали до 35°C и обрабатывали Et3N (1,14 мл, 8,16 ммоль), поддерживая внутреннюю температуру ниже 35°C. Смесь перемешивали при 30-35°C в течение 1 ч. После охлаждения до 0°C, смесь обрабатывали комплексом хлорида никеля(II) и 2,9-диметил-1,10-фенантролина (0,069 г, 0,20 ммоль) и раствором 3-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)пропаналя (1,066 г, 2,815 ммоль) и (R)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)-окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (2,5 г, 2,04 ммоль) в THF (11,25 мл). Смесь перемешивали при 0°C в течение 5 мин и при комнатной температуре в течение 16 ч. После охлаждения до 0°C, смесь обрабатывали 1,2-этилендиамином (2,05 мл, 30,6 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Смесь обрабатывали водой (25 мл) и н-гептаном (37,5 мл). Органический слой разделяли, и дважды экстрагировали водный слой MTBE (30,0 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в условиях вакуума. Остаток обрабатывали 2-пропанолом (~10 мл) и перемешивали при комнатной температуре в течение 1 ч. Выпавший в осадок лиганд отфильтровывали и промывали 2-пропанолом. Фильтрат концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-40%) с получением указанного в заголовке соединения (1,398 г, 46%, смесь двух изомеров). 1H-ЯМР (400 МГц, хлороформ-d, смесь двух изомеров) (м.д. -0,01 (с, 6H), 0,01-0,04 (м, 3H), 0,06 (с, 3H), 0,08-0,12 (м, 6H), 0,59 (кв, J=8,08 Гц, 6H), 0,79-0,87 (м, 9H), 0,88-0,92 (м, 9H), 0,92-0,94 (м, 9H), 0,96 (т, J=8,21 Гц, 9H), 1,48-1,66 (м, 12H), 1,68 (т, J=2,93 Гц, 3H), 1,77-1,85 (м, 1H), 1,85-1,92 (м, 2H), 2,06-2,35 (м, 7H), 2,41-2,52 (м, 3H), 2,58-2,73 (м, 2H), 2,87-2,97 (м, 1H), 3,26 (2 с, 6H), 3,35 (с, 3H), 3,38-3,42 (м, 1H), 3,43-3,60 (м, 2H), 3,73-3,85 (м, 3H), 3,86-3,94 (м, 2H), 3,96-4,07 (м, 2H), 4,31-4,40 (м, 1H), 4,42-4,47 (м, 1H), 4,50-4,64 (м, 4H), 4,83 (с, 1H), 4,96 (с, 1H), 4,99-5,10 (м, 1H), 5,49-5,62 (м, 1H), 5,62-5,75 (м, 1H), 5,78-5,99 (м, 1H), 7,35-7,47 (м, 4H), 7,48-7,64 (м, 2H), 7,93-8,13 (м, 4H).
(R)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-6-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-4-оксогекс-2-ен-1-ил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
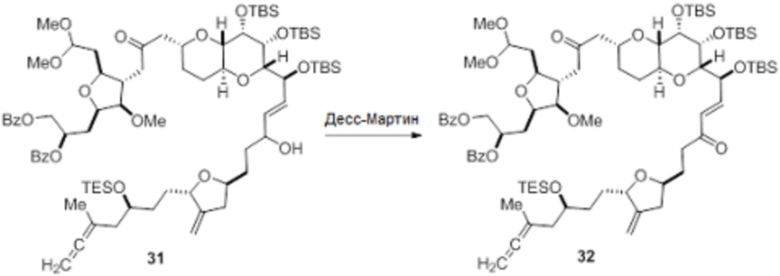
Раствор (2R)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((1S,E)-1-((трет-бутилдиметилсилил)окси)-4-гидрокси-6-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)гекс-2-ен-1-ил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (0,957 г, 0,647 ммоль) в CH2Cl2 (9,6 мл) обрабатывали водн. бикарбонатом натрия (0,163 г, 1,94 ммоль) и перйодинаном Десс-Мартина (0,33 г, 0,78 ммоль). Смесь перемешивали при комнатной температуре в течение 40 мин. Реакционную смесь гасили добавлением 20% (масс./об.) водн. Na2SO3 (7,66 мл) и нас.водн. NaHCO3 (7,66 мл). Смесь дважды экстрагировали MTBE (9,57 мл). Органические слои объединяли, промывали солевым раствором (9,6 мл) и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-40%) с получением указанного в заголовке соединения (828 мг, 87%). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. -0,03 (с, 3H), -0,01 (с, 3H), 0,04 (с, 3H), 0,09 (с, 3H), 0,11 (с, 6H), 0,58 (кв, J=7,43 Гц, 6H), 0,86 (с, 9H), 0,92 (с, 9H), 0,93 (с, 9H), 0,96 (т, J=7,82 Гц, 9H), 1,47-1,66 (м, 7H), 1,68 (т, J=3,32 Гц, 3H), 1,71-1,84 (м, 4H), 1,85-1,93 (м, 2H), 2,05-2,17 (м, 2H), 2,18-2,34 (м, 5H), 2,52-2,78 (м, 5H), 2,86-2,97 (м, 1H), 3,26 (2 с, 6H), 3,28-3,32 (м, 1H), 3,35 (с, 3H), 3,37-3,45 (м, 1H), 3,46-3,56 (м, 1H), 3,73-3,86 (м, 2H), 3,87-3,97 (м, 3H), 3,97-4,07 (м, 2H), 4,33 (ушир. с, 1H), 4,39-4,49 (м, 1H), 4,51-4,63 (м, 4H), 4,83 (с, 1H), 4,96 (с, 1H), 5,04-5,18 (м, 1H), 5,49-5,66 (м, 1H), 6,29 (д, J=16,02 Гц, 1H), 7,07 (дд, J=16,22, 7,23 Гц, 1H), 7,33-7,48 (м, 4H), 7,48-7,62 (м, 2H), 7,97-8,13 (м, 4H).
Соединение 33
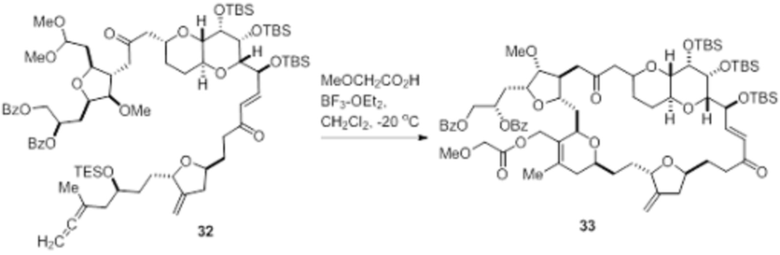
Раствор (R)-3-((2R,3R,4S,5S)-4-(3-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((S,E)-1-((трет-бутилдиметилсилил)окси)-6-((2S,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-4-оксогекс-2-ен-1-ил)октагидропирано[3,2-b]пиран-2-ил)-2-оксопропил)-5-(2,2-диметоксиэтил)-3-метокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (0,10 г, 0,068 ммоль) в CH2Cl2 (22 мл) охлаждали до 25°C и обрабатывали метоксиуксусной кислотой (0,104 мл, 1,36 ммоль) и BF3·OEt2 (0,026 мл, 0,20 ммоль). Смесь перемешивали при 25°C - 15°C в течение 3 ч. Дополнительно добавляли BF3·OEt2 (0,017 мл, 0,135 ммоль), и продолжали перемешивание при 15 - 25°C еще в течение 1 ч. Реакционную смесь гасили добавлением нас.водн. NaHCO3 (20 мл). Смесь дважды экстрагировали MTBE (20 мл). Органические слои объединяли, промывали солевым раствором и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-40%) с получением указанного в заголовке соединения (26 мг, 28%). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. -0,05 (с, 3H), 0,03 (с, 3H), 0,12 (с, 9H), 0,16 (с, 3H), 0,87 (с, 9H), 0,93 (с, 9H), 0,96 (с, 9H), 1,29-1,43 (м, 3H), 1,44-1,55 (м, 2H), 1,62-1,80 (м, 5H), 1,73 (с, 3H), 1,80-2,02 (м, 5H), 2,13-2,23 (м, 2H), 2,24-2,36 (м, 1H), 2,38-2,51 (м, 3H), 2,51-2,61 (м, 1H), 2,63-2,75 (м, 3H), 2,83 (дд, J=16,41, 6,64 Гц, 1H), 2,92 (дд, J=9,38, 1,95 Гц, 1H), 3,31 (с, 3H), 3,35-3,44 (м, 2H), 3,41 (с, 3H), 3,49-3,63 (м, 2H), 3,72-3,85 (м, 1H), 3,85-3,94 (м, 2H), 3,98 (с, 2H), 4,00-4,08 (м, 3H), 4,16-4,24 (м, 1H), 4,25-4,33 (м, 1H), 4,45-4,59 (м, 2H), 4,61-4,75 (м, 1H), 4,83 (ушир. с, 1H), 4,94-5,05 (м, 2H), 5,48-5,73 (м, 1H), 6,34 (д, J=16,02 Гц, 1H), 7,19-7,29 (м, 1H), 7,34-7,48 (м, 4H), 7,49-7,61 (м, 2H), 7,91-8,16 (м, 4H).
Соединение 34
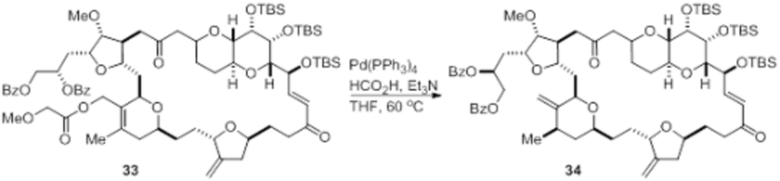
К смеси Pd(Ph3P)4 (2,1 мг, 1,80 мкмоль) и трифенилфосфина (1,9 мг, 7,2 мкмоль) в THF (1,0 мл) добавляли раствор соединения 33 (25 мг, 0,018 ммоль) в THF (1,0 мл), муравьиную кислоту (0,017 мл, 0,45 ммоль) и триэтиламин (0,063 мл, 0,45 ммоль). Смесь перемешивали при 60°C в течение 3 суток. Дополнительно добавляли Pd(Ph3P)4 (2,1 мг, 1,8 мкмоль), триэтиламин (0,063 мл, 0,45 ммоль) и муравьиную кислоту (0,017 мл, 0,45 ммоль), и продолжали перемешивание при 60°C в течение 1 суток. Смесь разбавляли MTBE и промывали нас.водн. NaHCO3. Органический слой концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-25%) с получением указанного в заголовке соединения (17 мг, 73%). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. -0,06 (с, 3H), 0,02 (с, 3H), 0,11 (с, 9H), 0,18 (с, 3H), 0,88 (с, 9H), 0,95 (с, 9H), 0,98 (с, 9H), 1,07 (д, J=6,25 Гц, 3H), 1,24-1,34 (м, 2H), 1,35-1,45 (м, 1H), 1,47-1,56 (м, 3H), 1,56-1,64 (м, 1H), 1,64-1,73 (м, 3H), 1,74-1,84 (м, 3H), 1,85-1,94 (м, 1H), 1,96-2,04 (м, 1H), 2,15-2,36 (м, 4H), 2,43-2,58 (м, 3H), 2,59-2,77 (м, 4H), 2,83 (дд, J=16,02, 7,03 Гц, 1H), 2,92 (дд, J=9,38, 1,95 Гц, 1H), 3,34 (с, 3H), 3,37-3,46 (м, 1H), 3,48-3,60 (м, 2H), 3,71-3,84 (м, 2H), 3,84-3,94 (м, 2H), 3,96-4,10 (м, 4H), 4,21 (ушир. с, 1H), 4,51-4,64 (м, 2H), 4,76 (с, 1H), 4,84 (ушир. с, 2H), 4,95-5,10 (м, 2H), 5,52-5,71 (м, 1H), 6,35 (д, J=16,41 Гц, 1H), 7,34-7,47 (м, 4H), 7,50-7,64 (м, 2H), 7,91-8,13 (м, 4H).
соединение 18
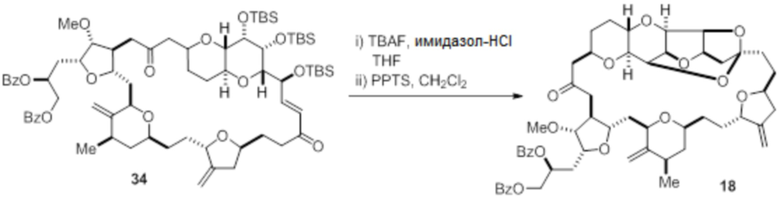
Смесь имидазола гидрохлорида (0,011 г, 0,11 ммоль) и 1 M тетрабутиламмония фторида (TBAF) в THF (0,23 мл, 0,23 ммоль) разбавляли THF (0,46 мл), и обрабатывали раствор соединения 34 (0,023 г, 0,018 ммоль) в THF (0,69 мл). После перемешивания при комнатной температуре в течение 2 суток, смесь обрабатывали толуолом (2,3 мл) и водой (1,2 мл). Органический слой разделяли, водный слой дважды экстрагировали смесью толуола (1,2 мл) и THF (1,2 мл). Органические слои объединяли и концентрировали в условиях вакуума. Остаток дважды подвергали азеотропной перегонке с ацетонитрилом (1,2 мл). Остаток растворяли в CH2Cl2 (3 мл), обрабатывали PPTS (0,045 г, 0,18 ммоль), и перемешивали при комнатной температуре в течение 1 суток. Смесь концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-80%) с получением указанного в заголовке соединения (12 мг, 72%).
Соединение 19
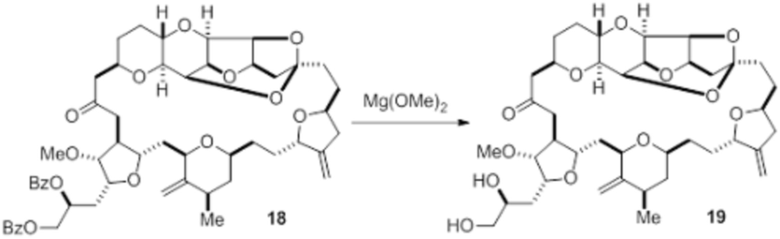
Раствор соединения 18 (0,012 г, 0,013 ммоль) в смеси THF (0,024 мл) и метанола (0,48 мл) обрабатывали 6-10% (масс./об.) Mg(OMe)2 в метаноле (0,051 г, 0,038 ммоль), и перемешивали полученную смесь при комнатной температуре в течение 20 ч. Дополнительно добавляли 6-10% Mg(OMe)2 в метаноле (0,051 г, 0,038 ммоль), и продолжали перемешивание при к.т.еще в течение 1 суток. После концентрирования, смесь очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=30%-100%, а затем 5% MeOH в этилацетате) с получением указанного в заголовке соединения (4 мг, 43%).
Соединение 35
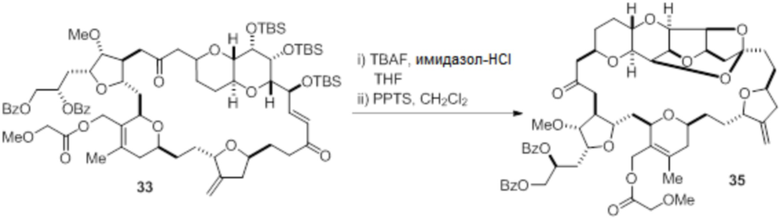
Смесь имидазола гидрохлорида (0,022 г, 0,21 ммоль) и 1 M TBAF в THF (0,44 мл, 0,44 ммоль) разбавляли THF (0,94 мл), и обрабатывали раствор соединения 33 (0,094 г, 0,068 ммоль) в THF (2,256 мл). Смесь перемешивали при комнатной температуре в течение 7 суток. После разбавления толуолом (2,35 мл) и водой (2,35 мл), органический слой разделяли, и дважды экстрагировали водный слой смесью толуола (1,6 мл) и THF (1,6 мл). Органические слои объединяли, концентрировали в условиях вакуума и дважды подвергали азеотропной перегонке с ацетонитрилом (4,7 мл). Остаток растворяли в CH2Cl2 (3,55 мл), обрабатывали пара-толуолсульфонатом пиридиния (PPTS, 0,094 г, 0,37 ммоль), и перемешивали при комнатной температуре в течение 1 суток. Дополнительно добавляли PPTS (0,094 г, 0,37 ммоль), и продолжали перемешивание при комнатной температуре еще в течение 3 суток. После концентрирования, смесь растворяли в этилацетате и фильтровали через стеклянный фильтр для удаления нерастворимого твердого вещества (PPTS). Фильтрат концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-80%) с получением указанного в заголовке соединения (18 мг, 26%). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,29-1,48 (м, 3H), 1,50-1,71 (м, 4H), 1,74 (с, 3H), 1,78-2,35 (м, 13H), 2,37-2,61 (м, 3H), 2,68-2,81 (м, 2H), 2,82-2,96 (м, 1H), 3,38-3,46 (м, 2H), 3,40 (с, 3H), 3,44 (с, 3H), 3,48-3,59 (м, 1H), 3,68-3,76 (м, 1H), 3,77-3,84 (м, 1H), 3,85-3,96 (м, 2H), 3,97-4,07 (м, 4H), 4,08-4,21 (м, 2H), 4,24-4,37 (м, 3H), 4,50-4,62 (м, 3H), 4,62-4,70 (м, 2H), 4,76 (д, J=12,51 Гц, 1H), 4,87 (ушир. с, 1H), 5,01 (ушир. с, 1H), 5,45-5,71 (м, 1H), 7,32-7,47 (м, 4H), 7,48-7,62 (м, 2H), 7,90-8,14 (м, 4H).
Соединение 18
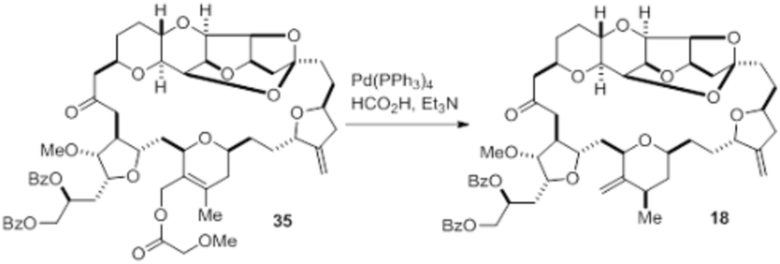
К смеси Pd(Ph3P)4 (2,0 мг, 1,8 мкмоль) и трифенилфосфина (1,8 мг, 7,0 мкмоль) в THF (0,72 мл) добавляли раствор соединения 35 (0,018 г, 0,018 ммоль), муравьиную кислоту (0,013 мл, 0,35 ммоль) и триэтиламин (0,049 мл, 0,35 ммоль) в THF (0,72 мл). Смесь перемешивали при 60°C в течение 20 ч. Дополнительно добавляли триэтиламин (0,049 мл, 0,35 ммоль) и муравьиную кислоту (0,013 мл, 0,35 ммоль), и продолжали перемешивание при 60°C еще в течение 2,5 суток. После разбавления MTBE, смесь промывали нас.водн. NaHCO3. Органический слой концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-80%) с получением указанного в заголовке соединения (18 мг). 1H-ЯМР (400 МГц, хлороформ-d) (1,08 (д, J=6,25 Гц, 3H), 1,28-1,35 (м, 2H), 1,36-1,48 (м, 3H), 1,56-1,62 (м, 1H), 1,63-1,77 (м, 3H), 1,81-1,99 (м, 3H), 2,05-2,34 (м, 11H), 2,37-2,53 (м, 3H), 2,67 (дд, J=16,22, 9,97 Гц, 1H), 2,78-2,89 (м, 2H), 3,32 (д, J=3,52 Гц, 1H), 3,39-3,46 (м, 3H), 3,51-3,64 (м, 2H), 3,72-3,79 (м, 1H), 3,79-3,86 (м, 1H), 3,89-3,98 (м, 1H), 4,02 (дд, J=6,45, 4,49 Гц, 1H), 4,06-4,15 (м, 1H), 4,18 (дд, J=6,45, 4,49 Гц, 1H), 4,24-4,37 (м, 3H), 4,56 (д, J=5,08 Гц, 2H), 4,60 (т, J=4,30 Гц, 1H), 4,68 (т, J=5,08 Гц, 1H), 4,79 (с, 1H), 4,86 (ушир. с, 1H), 4,88 (с, 1H), 4,97-5,03 (м, 1H), 5,50-5,62 (м, 1H), 7,35-7,47 (м, 4H), 7,49-7,62 (м, 2H), 7,97-8,09 (м, 4H).
Соединение 19
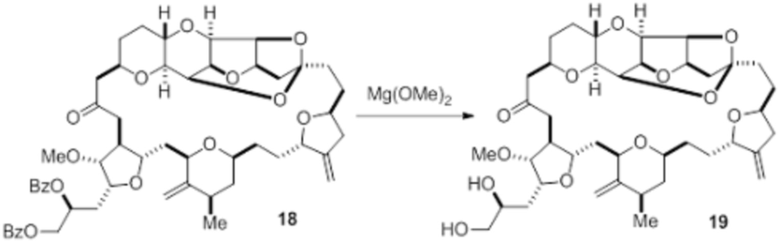
Раствор соединения 18 (0,018 г, 0,019 ммоль) в смеси THF (0,045 мл) и метанола (0,9 мл) обрабатывали 6-10% (масс./об.) Mg(OMe)2 в метаноле (0,186 мл, 0,134 ммоль), и перемешивали при к.т.в течение 3 суток. После концентрирования, смесь очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=30%-100% и 5% MeOH в этилацетате) с получением указанного в заголовке соединения (3 мг, 23% в 2 этапа). 1H-ЯМР (400 МГц, хлороформ-d) (1,08 (д, J=6,25 Гц, 3H), 1,28-1,51 (м, 5H), 1,58-1,63 (м, 2H), 1,66-1,79 (м, 4H), 1,88-2,02 (м, 4H), 2,06-2,56 (м, 12H), 2,71 (дд, J=15,83, 9,97 Гц, 1H), 2,81-2,92 (м, 2H), 3,29 (д, J=0,78 Гц, 1H), 3,30-3,35 (м, 1H), 3,43 (с, 3H), 3,50-3,70 (м, 4H), 3,85 (дт, J=9,48, 3,27 Гц, 1H), 3,88-3,98 (м, 3H), 4,03 (дд, J=6,25, 4,30 Гц, 1H), 4,09-4,12 (м, 1H), 4,18 (дд, J=6,64, 4,69 Гц, 1H), 4,29 (дд, J=10,55, 3,52 Гц, 1H), 4,31-4,39 (м, 2H), 4,60 (т, J=4,49 Гц, 1H), 4,69 (т, J=4,30 Гц, 1H), 4,81 (с, 1H), 4,89 (с, 1H), 4,93 (ушир. с, 1H), 5,07 (ушир. с, 1H).
Пример 3 - Получение аналога макролида галихондринового ряда через соединение формулы (IJ)
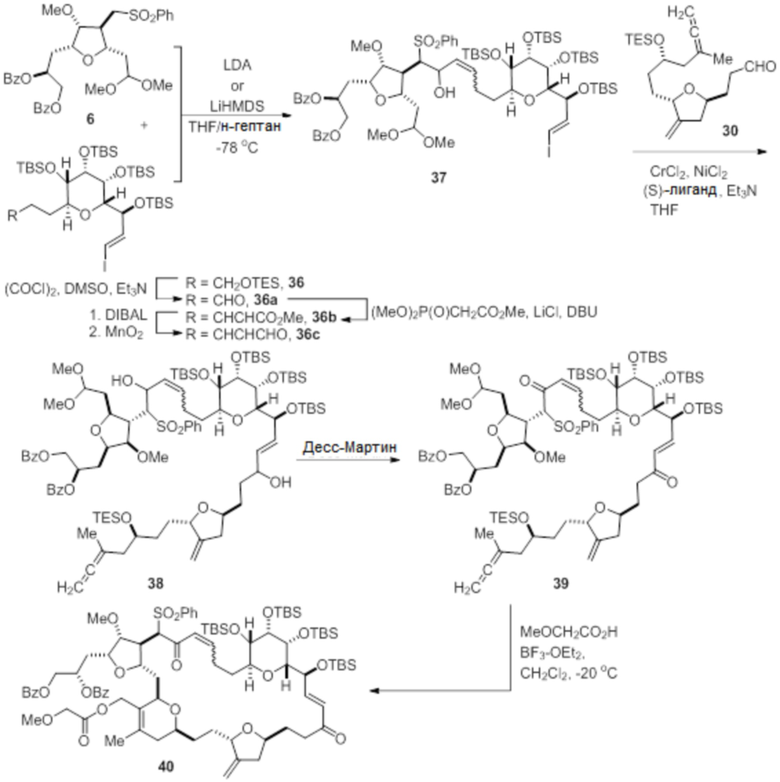
Иллюстративное соединение формулы (IA) может быть получено, как показано выше на представленной схеме. Соединение-гомолог 36 может быть получено в соответствии со следующей последовательностью: окисление по Сверну, реакция Хорнера-Уодсворта-Эммонса (в условиях Масамунэ-Руш), восстановление DIBAL-H и окисление MnO2. Соединение-гомолог 36 может быть затем обработано соединением 6, которое может быть депротонировано, например, LDA или LiHMDS, с получением соединения 37. Путем осуществления взаимодействия соединения 37 и соединения 30 в условиях реакции Нозаки-Хияма-Киши получают соединение 38 (иллюстративное соединение формулы (IA)). Путем последующего окисления соединения 38 перйодинаном Десс-Мартина получают соединение 39 (другое иллюстративное соединение формулы (IA)). Соединение 39 может быть преобразовано до соединения 40 (иллюстративное соединение формулы (IB)) путем осуществления взаимодействия с метоксиуксусной кислотой и BF3·OEt2 (иллюстративные условия реакции Принса).
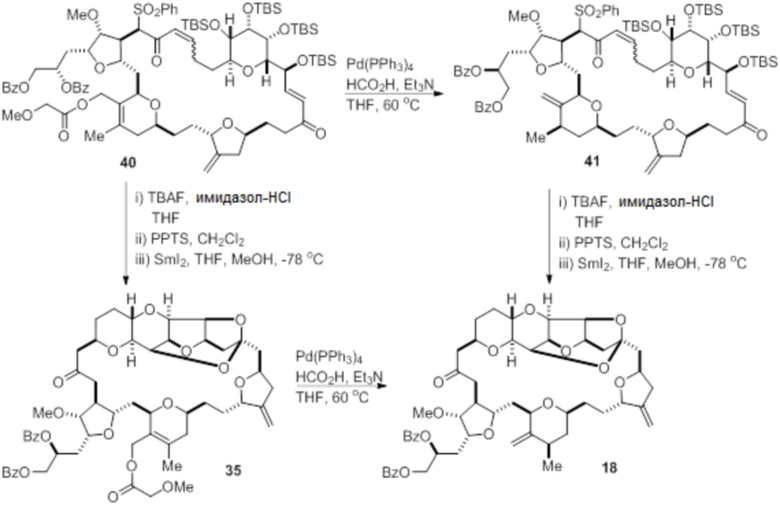
Иллюстративный аналог макролида галихондринового ряда может быть получен из соединения формулы (IB), как показано на представленной выше схеме. Настоящим документов предусмотрены два пути, которые могут быть использованы для получения соединения 18 из соединения 40. Согласно одному подходу, соединение 40 может вступать во взаимодействие с аллильным восстановителем (например, Pd(PPh3)4/HCO2H/Et3N) с получением соединения 41, которое после полного десилилирования источником фторида (например, TBAF, забуференный имидазолия гидрохлоридом), PPTS-катализированной кетализации и восстановительного десульфонилирования (например, SmI2) может приводить к соединению 18. В качестве альтернативы, соединение 40 может быть сначала преобразовано до соединения 35 посредством полного десилилирования источником фторида (например, TBAF, забуференный имидазолия гидрохлоридом), PPTS-катализированной кетализации и восстановительного десульфонилирования (например, SmI2). Осуществляют взаимодействие соединения 35 с аллильным восстановителем (например, Pd(PPh3)4/HCO2H/Et3N) с получением соединения 18, как описано в Примере 2. Соединение 18 преобразуют до соединения 19, как описано в Примере 1.
Пример 4 - Получение макролида галихондринового ряда через соединение формулы (IN)
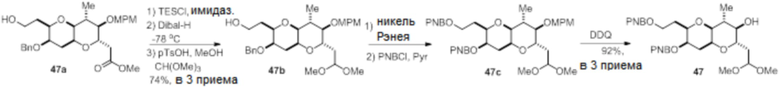
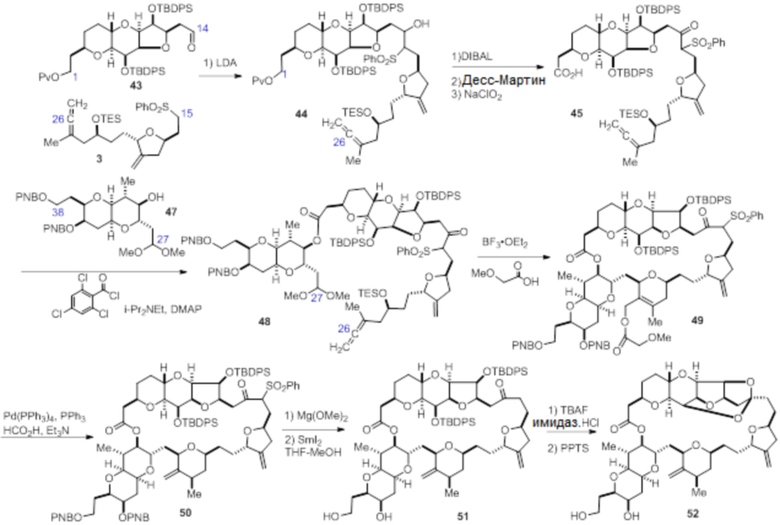
2-((2R,3R,4aS,6S,7R,8R,8aS)-3-(бензилокси)-6-(2,2-диметоксиэтил)-7-((4-метоксибензил)окси)-8-метилоктагидропирано[3,2-b]пиран-2-ил)этанол
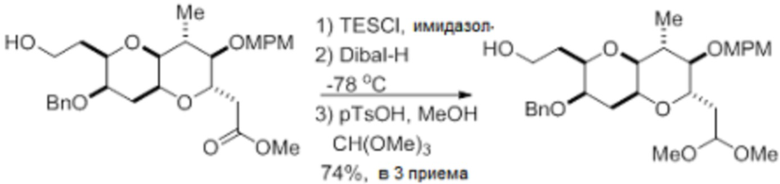
К раствору метил-2-((2S,3R,4R,4aS,6R,7R,8aS)-7-(бензилокси)-6-(2-гидроксиэтил)-3-((4-метоксибензил)окси)-4-метилоктагидропирано[3,2-b]пиран-2-ил)ацетата (1,0 г, 1,94 ммоль) в дихлорметане (10,00 мл, 155,417 ммоль) при 0°C добавляли имидазол (0,397 г, 5,83 ммоль) и хлортриэтилсилан (0,652 мл, 3,89 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 1 ч, а затем обрабатывали MTBE (20 мл) и нас.водн. раствором NH4Cl (15 мл). Органический слой разделяли, дважды промывали 30% (масс./об.) водным NaCl (10 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 1,329 г метил-2-((2S,3R,4R,4aS,6R,7R,8aS)-7-(бензилокси)-3-((4-метоксибензил)-окси)-4-метил-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)ацетата. Неочищенный продукт растворяли в дихлорметане (24 мл) и охлаждали до 78°C. Добавляли 1,0 M DIBAL H в толуоле (3,08 мл, 3,077 ммоль), поддерживая внутреннюю температуру ниже 74°C. После перемешивания в течение 2 ч при 78°C, реакционную смесь гасили добавлением метанолам(0,778 мл, 19,231 ммоль), и добавляли раствор сегнетовой соли (30 мл) и воду (20 мл). Полученную смесь нагревали до температуры окружающей среды в течение ночи. Слои разделяли, и дважды экстрагировали водный слой дихлорметаном (30 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в условиях вакуума с получением 1,314 г неочищенного 2-((2S,3R,4R,4aS,6R,7R,8aS)-7-(бензилокси)-3-((4-метоксибензил)-окси)-4-метил-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)ацетальдегида. Неочищенный продукт растворяли в метаноле (20 мл) при температуре окружающей среды. К полученному раствору добавляли триметилортоформиат (2 мл) и пара-толуолсульфоновой кислоты моногидрат (0,018 г, 0,097 ммоль). Реакционную смесь перемешивали в течение ночи при температуре окружающей среды и обрабатывали насыщенным водным NaHCO3 (34,7 мл) и водой (12 мл). Полученную смесь трижды экстрагировали MTBE (40 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (20 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием 50-100% градиента этилацетата в н-гептане в качестве элюента получали 0,79 г целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,12 (д, J=7,42 Гц, 3H) 1,59-1,75 (м, 3H) 1,97 (ддд, J=14,17, 7,13, 2,93 Гц, 1H) 2,05-2,23 (м, 2H) 2,32 (дт, J=14,75, 4,74 Гц, 1H) 2,51-2,60 (м, 1H) 2,99 (дд, J=8,79, 7,23 Гц, 1H) 3,24 (с, 3H) 3,28 (с, 3H) 3,35-3,40 (м, 1H) 3,46 (дд, J=5,08, 3,91 Гц, 1H) 3,57-3,66 (м, 1H) 3,72-3,83 (м, 3H) 3,79 (с, 3H) 4,04 (тд, J=9,18, 2,74 Гц, 1H) 4,42 (д, J=4,30 Гц, 1H) 4,45 (д, J=2,74 Гц, 1H) 4,50-4,55 (м, 1H) 4,59 (дд, J=7,42, 3,91 Гц, 1H) 4,75 (д, J=12,50 Гц, 1H) 6,86 (д, J=8,99 Гц, 2H) 7,21-7,29 (м, 3H) 7,30-7,38 (м, 4H)
(2R,3R,4aS,6S,7R,8R,8aS)-6-(2,2-диметоксиэтил)-7-((4-метоксибензил)окси)-8-метил-2-(2-((4-нитробензоил)окси)этил)-октагидропирано[3,2-b]пиран-3-ил-4-нитробензоат
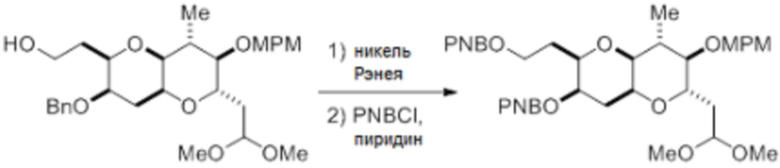
К раствору 2-((2R,3R,4aS,6S,7R,8R,8aS)-3-(бензилокси)-6-(2,2-диметоксиэтил)-7-((4-метоксибензил)окси)-8-метилоктагидропирано[3,2-b]пиран-2-ил)этанола (0,77 г, 1,451 ммоль) в метаноле (31 мл) добавляли суспензию никеля Рэнея в воде (~8 мл). Полученную смесь перемешивали в атмосфере H2 (баллон) до расходования всего исходного вещества. После завершения реакции, смесь разбавляли MeOH и фильтровали через слой Celite, который затем промывали MeOH до удаления всех растворимых продуктов. Путем концентрирования фильтратов получали 0,639 г (2R,3R,4aS,6S,7R,8R,8aS)-6-(2,2-диметоксиэтил)-2-(2-гидроксиэтил)-7-((4-метоксибензил)окси)-8-метилоктагидропирано[3,2-b]пиран-3-ола. Неочищенный продукт растворяли в пиридине (12,8 мл) и при температуре окружающей среды обрабатывали 4-нитробензоилхлоридом (1,077 г, 5,802 ммоль) и 4-диметиламинопиридином (0,018 г, 0,145 ммоль). Полученную смесь перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь разбавляли EtOAc (30 мл) и обрабатывали нас.водн. раствором NaHCO3 (40 мл) и водой (10 мл). Слои разделяли, и дважды экстрагировали водный слой смесью EtOAc/MTBE (1/1, по 30 мл каждого). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (25 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 25-50% этилацетата в н-гептане получали 0,72 г целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,15 (д, J=7,42 Гц, 3H) 1,72 (ддд, J=13,97, 9,28, 4,10 Гц, 1H) 1,81-1,89 (м, 1H) 1,91-1,95 (м, 1H) 1,95-2,00 (м, 1H) 2,15 (с, 2H) 2,37 (дт, J=15,34, 2,88 Гц, 1H) 3,06-3,11 (м, 1H) 3,08 (с, 3H) 3,16 (с, 3H) 3,30-3,44 (м, 1H) 3,64-3,72 (м, 1H) 3,74 (ушир. с, 1H) 3,77 (с, 3H) 3,95 (ддд, J=9,09, 7,52, 3,71 Гц, 1H) 4,38 (дд, J=7,23, 4,10 Гц, 1H) 4,50-4,59 (м, 3H) 5,01-5,07 (м, 1H) 5,48-5,49 (м, 1H) 6,84 (д, J=8,60 Гц, 2H) 7,26 (д, J=8,60 Гц, 2H) 8,14-8,19 (м, 4H) 8,22-8,29 (м, 4H).
(2R,3R,4aS,6S,7R,8R,8aS)-6-(2,2-диметоксиэтил)-7-гидрокси-8-метил-2-(2-((4-нитробензоил)окси)этил)октагидропирано[3,2-b]пиран-3-ил 4-нитробензоат
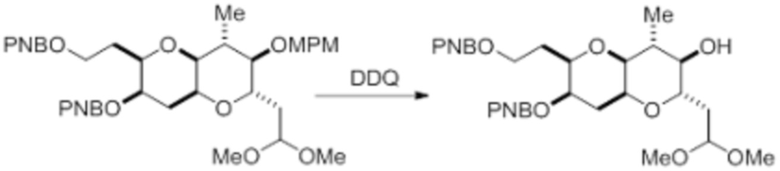
К раствору (2R,3R,4aS,6S,7R,8R,8aS)-6-(2,2-диметоксиэтил)-7-((4-метоксибензил)окси)-8-метил-2-(2-((4-нитробензоил)окси)-этил)октагидропирано[3,2-b]пиран-3-ил-4-нитробензоата (0,70 г, 0,948 ммоль) в дихлорметане (22,4 мл) при температуре окружающей среды добавляли трет-бутанол (0,224 мл), фосфатный буфер (pH 7, 2,2 мл) и DDQ (0,430 г, 1,895 ммоль). Полученную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества (~2 ч). После завершения реакции, реакционную смесь обрабатывали нас.водн. раствором NaHCO3 (30 мл). Слои разделяли, и дважды экстрагировали водный слой CH2Cl2 (по 30 мл каждый раз). Объединенный органический слой промывали 30% водным NaCl (10 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-80% этилацетата в н-гептане получали 574 мг целевого продукта в виде белого твердого вещества. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,13 (д, J=7,82 Гц, 3H) 1,70 (ддд, J=14,17, 7,33, 4,30 Гц, 1H) 1,93-2,01 (м, 3H) 2,13 (ддт, J=14,80, 9,33, 5,52, 5,52 Гц, 1H) 2,26 (кв, J=7,82 Гц, 1H) 2,41 (дт, J=15,63, 2,34 Гц, 1H) 3,19 (с, 3H) 3,25 (с, 3H) 3,34 (дт, J=10,06, 2,78 Гц, 1H) 3,38-3,42 (м, 1H) 3,73 (дд, J=9,77, 3,13 Гц, 1H) 3,85 (ушир. с, 1H) 3,88 (д, J=10,16 Гц, 1H) 4,09 (ушир. д, J=7,03 Гц, 1H) 4,38 (дд, J=7,42, 3,91 Гц, 1H) 4,51 (т, J=6,25 Гц, 2H) 5,07-5,12 (м, 1H) 8,13-8,18 (м, 2H) 8,20-8,31 (м, 6H)
1-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутил-дифенилсилил)окси)-7-(2-гидроксиэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)-4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-3-(фенилсульфонил)бутан-2-ол
Соединение 44a
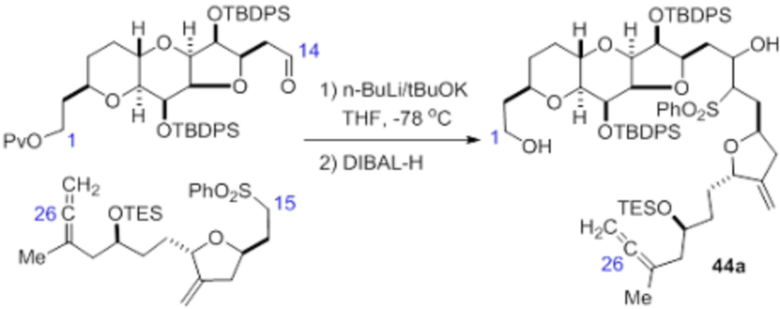
К раствору триэтил(((S)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил)окси)силана (178 мг, 0,363 ммоль) в THF (4,6 мл) при 78°C добавляли калия трет-бутоксид (1,0 M в THF, 0,363 мл, 0,363 ммоль) и n-BuLi (1,6 M в гексане, 0,227 мл, 0,363 ммоль). Полученную смесь перемешивали в течение 10 мин при 78°C и обрабатывали раствором 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-оксоэтил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалатом (116 мг, 0,134 ммоль) в THF (3 мл). Полученную реакционную смесь перемешивали при 78°C до расходования всего альдегида. После завершения реакции, реакционную смесь гасили добавлением нас.водн. раствора NH4Cl (4 мл) и воды (2 мл). Полученную смесь разбавляли MTBE (5 мл) и нагревали до температуры окружающей среды. Слои разделяли, и экстрагировали водный слой MTBE (10 мл). Объединенные органические слои дважды промывали 30% (масс./об.) водным NaCl (4 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(2-гидрокси-4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)-окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (MS m/z 1376,8 [M+Na]+). Неочищенный продукт (теоретич. 182 мг) растворяли в дихлорметане (8 мл) и охлаждали до 78°C. Добавляли 1,0 M DIBAL-H в толуоле (0,672 мл, 0,672 ммоль), и перемешивали полученный раствор при 78°C в течение 1,5 ч. Затем, реакционную смесь гасили добавлением метанола (0,27 мл, 6,72 ммоль) и насыщенного раствора сегнетовой соли (10 мл). Полученную смесь разбавляли дихлорметаном (10 мл) и нагревали до температуры окружающей среды в течение ночи. Слои разделяли, и экстрагировали водный слой дихлорметаном (5 мл). Объединенные органические слои сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 20-50% этилацетата в н-гептане получали 148 мг целевого продукта в виде смеси четырех диастереоизомеров (MS m/z 1291,7 [M+Na]+).
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутил-дифенилсилил)окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)уксусная кислота
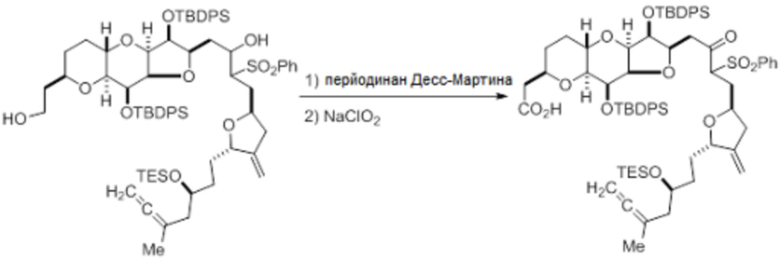
К раствору 1-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-7-(2-гидроксиэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)-4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-3-(фенилсульфонил)бутан-2-ола (148 мг, 0,117 ммоль) в дихлорметане (4,4 мл) при температуре окружающей среды добавляли бикарбонат натрия (78 мг, 0,932 ммоль) и перйодинан Десс-Мартина (198 мг, 0,466 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 4 ч и обрабатывали нас.водн. раствором NaHCO3 (6 мл) и нас.водн. раствором Na2S2O3 (6 мл). Полученную смесь разбавляли MTBE (15 мл) и перемешивали в течение 30 мин. Слои разделяли, и экстрагировали водный слой MTBE (10 мл). Объединенные органические слои дважды промывали 30% (масс./об.) водным NaCl (по 5 мл каждый раз) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 148 мг 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегида (MS m/z 1287,6 [M+Na]+). К неочищенному продукту добавляли трет-бутанол (4,4 мл) и н-амилен (0,444 мл, 4,19 ммоль). Полученную смесь обрабатывали раствором дигидрофосфата натрия (49,1 мг, 0,409 ммоль) и хлорита натрия (31,7 мг, 0,351 ммоль) в воде (2,2 мл). Реакционную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, смесь разбавляли MTBE (15 мл) и обрабатывали нас.водн. раствором NH4Cl (10 мл). Органический слой разделяли, и экстрагировали водный слой MTBE (10 мл). Объединенные органические слои дважды промывали 30% (масс./об.) водным NaCl (по 5 мл каждого) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-75% этилацетата в н-гептане получали 118 мг целевого продукта в виде смеси (1:1) двух диастереоизомеров (MS m/z 1303,8 [M+Na]+). 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,54-0,62 (м, 6H) 0,90-0,98 (м, 9H) 1,05 (с, 4,5H) 1,10 (с, 4,5H) 1,11 (с, 4,5H) 1,13 (с, 4,5H) 1,29-1,75 (м, 8H) 1,62 (т, J=3,12 Гц, 1,5H) 1,68 (т, J=3,12 Гц, 1,5H) 1,87-2,19 (м, 6,5H) 2,25-2,38 (м, 2H) 2,47 (дд, J=18,94, 2,54 Гц, 0,5H) 2,50-2,57 (м, 0,5H) 2,58-2,68 (м, 0,5H) 3,04 (дд, J=18,55, 2,15 Гц, 0,5H) 3,13 (дд, J=9,76, 5,86 Гц, 0,5H) 3,23 (дд, J=9,76, 6,64 Гц, 0,5H) 3,31 (дд, J=18,74, 8,98 Гц, 0,5H) 3,40-3,50 (м, 1,5H) 3,63-3,76 (м, 2,5H) 3,77-3,85 (м, 1H) 3,90 (ддд, J=9,18, 6,25, 2,54 Гц, 0,5H) 3,96-4,12 (м, 3,5H) 4,16 (дд, J=8,39, 4,10 Гц, 0,5H) 4,20 (т, J=5,47 Гц, 0,5H) 4,23-4,28 (м, 1,5H) 4,32 (дд, J=10,15, 2,73 Гц, 0,5H) 4,47-4,52 (м, 1H) 4,52-4,58 (м, 1H) 4,80 (дд, J=4,49, 2,15 Гц, 1H) 4,94 (дд, J=3,51, 1,95 Гц, 1H) 7,27-7,60 (м, 15H) 7,65-7,81 (м, 10H)
(2R,3R,4aS,6S,7R,8S,8aS)-7-(2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетокси)-6-(2,2-диметоксиэтил)-8-метил-2-(2-((4-нитробензоил)окси)этил)октагидропирано[3,2-b]пиран-3-ил-4-нитробензоат
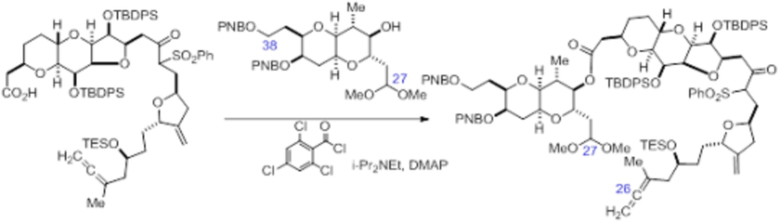
К раствору 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)-декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)уксусной кислоты (118 мг, 0,092 ммоль) и (2R,3R,4aS,6S,7R,8R,8aS)-6-(2,2-диметоксиэтил)-7-гидрокси-8-метил-2-(2-((4-нитробензоил)окси)-этил)октагидропирано[3,2-b]пиран-3-ил-4-нитробензоата (159 мг, 0,258 ммоль) в дихлорметане (3,0 мл) при температуре окружающей среды добавляли триэтиламин (TEA, 0,026 мл, 0,184 ммоль), 6-нитро-орто-толуиловый ангидрид (47,5 мг, 0,138 ммоль) и 4-диметиламинопиридин (5,62 мг, 0,046 ммоль). После перемешивания в течение ночи, реакционную смесь концентрировали в условиях вакуума. Путем очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 33-66% этилацетата в н-гептане получали 152 мг целевого продукта в виде смеси (1:1) диастереоизомеров. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,52-0,62 (м, 6H) 0,90-0,97 (м, 9H) 1,04 (д, J=7,42 Гц, 3H) 1,06 (с, 4,5H) 1,08 (с, 4,5H) 1,11 (с, 4,5H) 1,13 (с, 4,5H) 1,17-1,53 (м, 5H) 1,62 (т, J=3,13 Гц, 1,5H) 1,67 (т, J=3,13 Гц, 1,5H) 1,72-2,24 (м, 16H) 2,35-2,46 (м, 3H) 2,55-2,66 (м, 1H) 3,02-3,06 (м, 0,5H) 3,07 (с, 1,5H) 3,08 (с, 1,5H) 3,16 (с, 1,5H) 3,16 (с, 1,5H) 3,22 (д, J=5,47 Гц, 1H) 3,29 (дд, J=18,95, 8,40 Гц, 0,5H) 3,38 (ушир. с, 1H) 3,56-3,63 (м, 1H) 3,64-3,75 (м, 4H) 3,76-3,81 (м, 1,5H) 3,86-3,94 (м, 1H) 3,95-4,17 (м, 4H) 4,18-4,30 (м, 2,5H) 4,30-4,37 (м, 1H) 4,46-4,57 (м, 4H) 4,58-4,65 (м, 1H) 4,78 (с, 1H) 4,89 (д, J=1,95 Гц, 0,5H) 4,93 (д, J=1,95 Гц, 0,5H) 5,09 (ушир. с, 1H) 7,27-7,57 (м, 15H) 7,65-7,81 (м, 10H) 8,14-8,32 (м, 8H)
Соединение 49
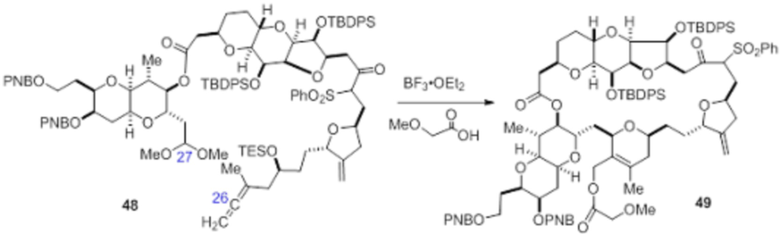
К раствору (2R,3R,4aS,6S,7R,8S,8aS)-7-(2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)-окси)-2-(4-((2R,5S)-5-((S)-5-метил-3-((триэтилсилил)окси)гепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)-2-оксо-3-(фенилсульфонил)бутил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетокси)-6-(2,2-диметоксиэтил)-8-метил-2-(2-((4-нитробензоил)окси)этил)октагидропирано[3,2-b]пиран-3-ил-4-нитробензоата (76 мг, 0,04 ммоль) в дихлорметане (38 мл) при 20°C добавляли метоксиуксусную кислоту (0,155 мл, 2,02 ммоль) и BF3·OEt2 (51 мкл, 0,40 ммоль). Реакционную смесь перемешивали при температуре от 20°C до -10°C, и отслеживали реакцию методом ТСХ и LCMS. После завершения реакции, реакционную смесь гасили добавлением нас.водн. NaHCO3 (20 мл). Органический слой разделяли и промывали 30% (масс./об.) водным NaCl (5 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-66% этилацетата в н-гептане получали 58 мг целевого продукта в виде смеси (1:1) диастереоизомеров. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,96 (с, 4,5H) 1,02 (с, 4,5H) 1,09 (с, 4,5H) 1,12 (с, 4,5H) 1,35 (с, 1,5H) 1,45 (с, 1,5H) 1,18-2,24 (м, 19H) 2,31-2,54 (м, 3H) 2,56-2,80 (м, 3H) 2,98-3,10 (м, 1H) 3,18-3,42 (м, 2H) 3,40 (с, 1,5H) 3,41 (с, 1,5H) 3,47 (дд, J=5,28, 2,15 Гц, 1H) 3,54 (т, J=4,10 Гц, 0,5H) 3,59-3,78 (м, 5,5H) 3,82 (тд, J=10,26, 4,10 Гц, 1H) 3,95 (с, 2H) 3,97-4,04 (м, 1H) 4,09-4,37 (м, 6H) 4,48-4,73 (м, 6H) 4,77 (ушир. д, J=5,86 Гц, 1H) 4,83 (ушир. с, 1H) 4,94 (с, 1H) 5,13 (ушир. с, 1H) 7,27-7,55 (м, 15H) 7,56-7,82 (м, 10H) 8,15-8,35 (м, 8H)
Соединение 50
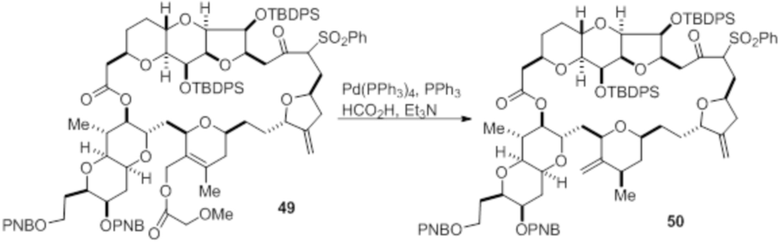
К раствору Pd(Ph3P)4 (8,05 мг, 6,967 мкмоль) и трифенилфосфина (7,31 мг, 0,028 ммоль) в THF (1,0 мл) при температуре окружающей среды добавляли раствор соединения 49 (25 мг, 0,014 ммоль) в THF (0,5 мл). Шприцем добавляли муравьиную кислоту (3,2 мкл, 0,084 ммоль) и триэтиламин (0,012 мл, 0,084 ммоль). Полученную смесь перемешивали при 60-65°C в течение 15 ч и охлаждали до температуры окружающей среды. Реакционную смесь разбавляли MTBE (10 мл), промывали нас.водн. NaHCO3 (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 25-60% этилацетата в н-гептане получали 10 мг целевого продукта в виде смеси (2:1) диастереоизомеров. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,97 (с, 6H) 1,02 (с, 3H) 1,05 (с, 3H) 1,08 (ушир. д, J=6,64 Гц, 3H) 1,12 (с, 6H) 1,23 (ушир. д, J=7,42 Гц, 3H) 1,28 -1,88 (м, 8H) 1,90-2,24 (м, 12H) 2,32-2,84 (м, 6H) 2,99-3,10 (м, 1H) 3,22-3,95 (м, 10H) 4,00-4,07 (м, 1H) 4,07-4,39 (м, 4H) 4,47-4,93 (м, 9H) 5,21 (ушир. с, 0,3H) 5,26 (ушир. с, 0,7H) 7,28-7,50 (м, 14H) 7,54-7,80 (м, 11H) 8,11-8,42 (м, 8H)
Соединение 50a
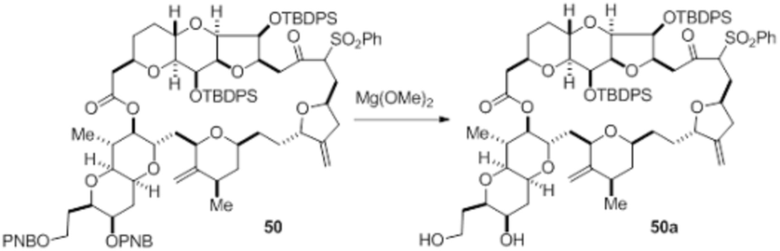
К раствору соединения 50 (10 мг, 5,861 мкмоль) в MeOH (0,5 мл, 12,359 ммоль) и THF (0,20 мл, 2,441 ммоль) при температуре окружающей среды добавляли раствор магния метоксида (3,88 мкл, 2,931 мкмоль). Реакцию отслеживали методами LCMS и TLC, и дополнительно добавляли раствор метоксида натрия (0,16 мл) в течение 6 суток. Полученную смесь разбавляли EtOAc (6 мл) и промывали нас.водн. раствором NH4Cl (5 мл). Водный слой экстрагировали EtOAc (5 мл), объединенные органические слои промывали 30% водным NaCl (2 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-100% этилацетата в н-гептане получали 5 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,97 (с, 9H) 1,07 (ушир. д, J=6,64 Гц, 3H) 1,10 (с, 9H) 1,19 (д, J=7,82 Гц, 3H) 1,28-1,54 (м, 4H) 1,65-2,04 (м, 9H) 2,06-2,35 (м, 8H) 2,41 (дд, J=16,02, 9,38 Гц, 1H) 2,62-2,71 (м, 1H) 2,75 (дд, J=16,02, 5,47 Гц, 1H) 2,82-2,90 (м, 2H) 3,13 (дд, J=9,38, 8,21 Гц, 1H) 3,25-3,34 (м, 3H) 3,37-3,45 (м, 1H) 3,53 (дд, J=4,69, 3,13 Гц, 1H) 3,58 (с, 2H) 3,59-3,63 (м, 1H) 3,70-3,88 (м, 6H) 3,91 (ушир. с, 1H) 4,00 (дд, J=7,82, 5,08 Гц, 1H) 4,03-4,09 (м, 1H) 4,18 (дд, J=7,62, 4,88 Гц, 1H) 4,23-4,31 (м, 1H) 4,36 (ушир. д, J=11,33 Гц, 1H) 4,55 (д, J=8,60 Гц, 1H) 4,71 (с, 1H) 4,80 (ушир. с, 2H) 4,83 (с, 1H) 4,98 (с, 1H) 7,27-7,47 (м, 12H) 7,49-7,55 (м, 2H) 7,58-7,72 (м, 9H) 7,76-7,81 (м, 2H)
Соединение 51
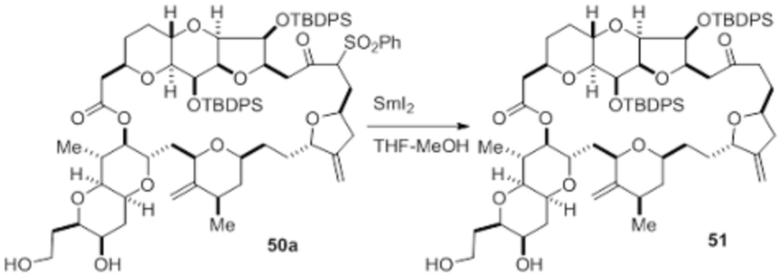
К раствору соединения 50a (5,0 мг, 3,551 мкмоль) в смеси THF (0,9 мл)/метанол (0,3 мл) при 78°C добавляли дийодид самария в виде 0,1 M раствора в THF (0,2 мл, 0,02 ммоль). Спустя 10 мин, добавляли нас.водн. раствор сегнетовой соли (1,5 мл), MTBE (3 мл) и воду (1 мл). Полученную смесь нагревали до температуры окружающей среды и экстрагировали MTBE (5 мл). Органический слой промывали 30% (масс./об.) водн. NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-75% этилацетата в н-гептане получали 4,0 мг целевого продукта в виде пенообразного твердого вещества. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,01 (с, 9H) 1,06 (с, 9H) 1,09 (ушир. д, J=6,64 Гц, 3H) 1,19 (ушир. д, J=7,82 Гц, 3H) 1,28-1,53 (м, 6H) 1,67-1,88 (м, 6H) 1,91-1,99 (м, 1H) 2,06-2,36 (м, 8H) 2,54 (дд, J=6,84, 2,93 Гц, 1H) 2,59-2,67 (м, 1H) 2,68-2,84 (м, 3H) 2,91-3,01 (м, 1H) 3,05 (т, J=8,99 Гц, 1H) 3,09-3,16 (м, 1H) 3,31 (с, 1H) 3,44-3,49 (м, 1H) 3,50 (т, J=4,10 Гц, 1H) 3,54-3,62 (м, 3H) 3,64 (дд, J=5,67, 4,10 Гц, 1H) 3,73 (ушир. д, J=11,72 Гц, 1H) 3,76-3,86 (м, 2H) 3,89-3,98 (м, 2H) 4,04-4,18 (м, 3H) 4,25-4,35 (м, 2H) 4,41 (ушир. д, J=8,99 Гц, 1H) 4,76 (ушир. с, 1H) 4,81 (д, J=1,17 Гц, 1H) 4,82 (ушир. с, 1H) 4,84 (с, 1H) 4,96 (д, J=1,56 Гц, 1H) 7,28-7,46 (м, 12H) 7,57-7,73 (м, 8H)
Соединение 52
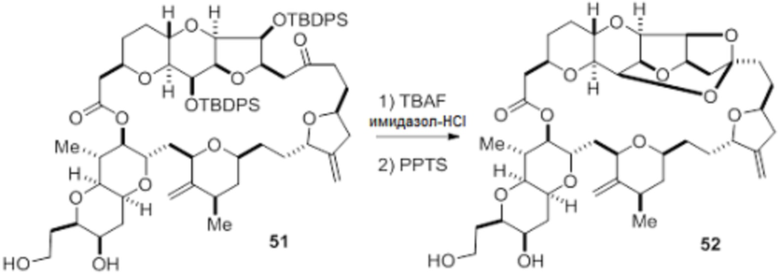
К соединению 51 (2,5 мг, 3,2 мкмоль) во флаконе при температуре окружающей среды добавляли THF (0,8 мл) и N,N-диметилацетамид (0,28 мл). Добавляли TBAF (1,0 M в THF, 95 мкл, 0,095 ммоль) и имидазола гидрохлорид (5,0 мг, 0,047 ммоль). Полученную смесь перемешивали в течение 2 суток при температуре окружающей среды. Добавляли 30% (масс./об.) водный NaCl (2,0 мл), и дважды экстрагировали полученную смесь смесью THF (5,0 мл) и толуола (5,0 мл). Объединенный органический слой концентрировали под струей азота. Остаток растворяли в дихлорметане (1,5 мл) при температуре окружающей среды, и добавляли PPTS (33 мг, 132 мкмоль). После расходования всего исходного вещества, реакционную смесь очищали методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 0-10% метанола в этилацетате с получением 0,7 мг целевого продукта, которое подтверждали методом LCMS (MS m/z 795,4 [M+Na]+) и путем сравнения с ранее полученными данными 1H-ЯМР. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,10 (ушир. д, J=6,25 Гц, 3H) 1,18 (д, J=7,82 Гц, 3H) 1,27-2,40 (м, 25H) 2,39-2,45 (м, 1H) 2,48-2,57 (м, 1H) 2,77-2,86 (м, 1H) 2,91 (дд, J=9,38, 2,34 Гц, 1H) 3,29 (с, 1H) 3,51-3,57 (м, 2H) 3,65 (ушир. д, J=10,94 Гц, 1H) 3,72-3,89 (м, 5H) 4,04 (дд, J=6,25, 4,30 Гц, 1H) 4,19 (дд, J=6,25, 4,69 Гц, 1H) 4,24 (тд, J=10,06, 3,71 Гц, 1H) 4,36-4,44 (м, 3H) 4,50 (т, J=2,34 Гц, 1H) 4,60 (т, J=4,30 Гц, 1H) 4,65-4,72 (м, 1H) 4,76-4,85 (м, 2H) 4,98 (ушир. с, 1H) 5,08 (с, 1H)
Пример 5 - Получение макролида галихондринового ряда через соединение формулы (IJ)
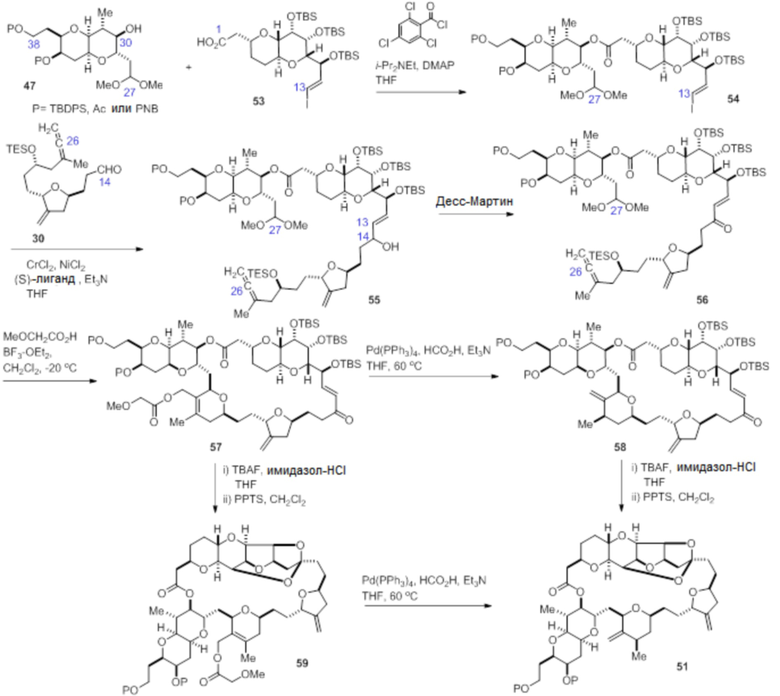
Иллюстративное соединение формулы (IA) может быть получено, как показано на представленной выше схеме. Подвергая соединение 52 эстерификации по Ямагучи с соединением 53, получают соединение 54, которое после осуществления взаимодействия с соединением 30 в условиях реакции Нозаки-Хияма-Киши дает соединение 55 (иллюстративное соединение формулы (IA)). Путем окисления соединения 55 перйодинаном Десс-Мартина получают соединение 56 (другое иллюстративное соединение формулы (IA)).
Иллюстративный макролид галихондринового ряда может быть получен, как показано на представленной выше схеме. Соединение 56 может быть преобразовано до соединения 57 путем осуществления взаимодействия с метоксиуксусной кислотой и BF3·OEt2 (типовые условия реакции Принса). Настоящим документом предусмотрены два пути получения иллюстративного макролида галихондринового ряда 51 из соединения 57. Согласно одному подходу, соединение 57 может вступать во взаимодействие с аллильным восстановителем (например, Pd(PPh3)4/HCO2H/Et3N) с получением соединения 58, которое после полного десилилирования источником фторида (например, TBAF, забуференный имидазолия гидрохлоридом), PPTS-катализированной кетализации и восстановительного десульфонилирования (например, SmI2) может приводить к соединению 51. В качестве альтернативы, путем полного десилилирования соединения 57 источником фторида (например, TBAF, забуференный имидазолия гидрохлоридом) с последующей PPTS-катализированной кетализацией и взаимодействием с аллильным восстановителем (например, Pd(PPh3)4/HCO2H/Et3N) получают соединение 51.
Согласно некоторым вариантам осуществления, P представляет собой PNB.
Пример 6 - Получение макролида галихондринового ряда через соединение формулы (IN)
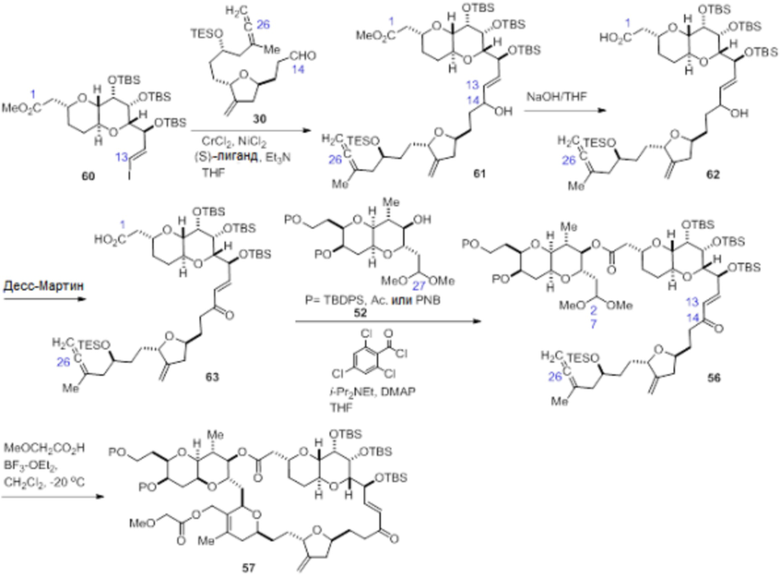
Иллюстративное соединение формулы (IA) может быть получено, как показано на представленной выше схеме. Путем осуществления взаимодействия соединения 60 с соединением 30 в условиях реакции Нозаки-Хияма-Киши получают соединение 61 (иллюстративное соединение (IN)). Путем гидролиза сложного эфира в соединении 61 получают соединение 62. Путем окисления (например, перйодинаном Десс-Мартина) соединения 62 получают соединение 63. Путем эстерификации по Ямагучи соединения 63 с соединением 52 получают соединение 56 (иллюстративное соединение формулы (IA)). Путем проведения реакции Принса (метоксиуксусная кислота и BF3·OEt2; типовые условия реакции Принса) соединения 56 получают соединение 57 (иллюстративное соединение формулы (IB)).
Пример 7 - Получение соединения (IH)
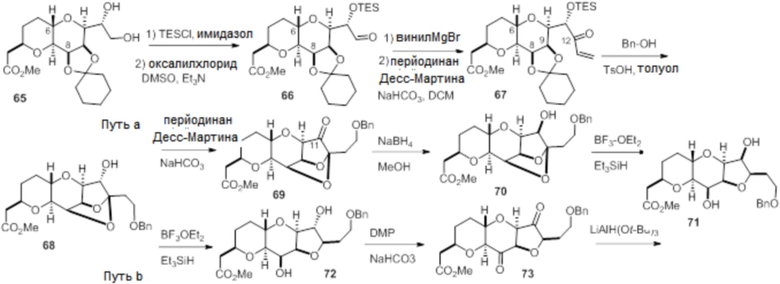
Метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((R)-3,3,8,8-тетраэтил-4,7-диокса-3,8-дисиладекан-5-ил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат
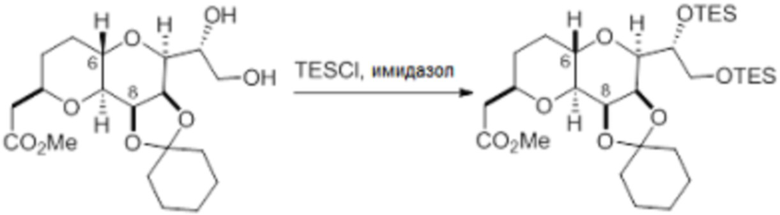
К раствору метил-2-((3aR,4S,5aS,8R,9aS,9bS)-4-((R)-1,2-дигидроксиэтил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетата (1,1 г, 2,847 ммоль) в дихлорметане (11,0 мл) при 0°C добавляли имидазол (0,775 г, 11,4 ммоль) и хлортриэтилсилан (1,19 мл, 7,12 ммоль). Полученную смесь нагревали до температуры окружающей среды и перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.водн. раствора NH4Cl (10 мл). Полученную смесь экстрагировали MTBE (20 мл). Органический слой промывали 30% (масс./об.) водным NaCl (5 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 0-25% этилацетата в н-гептане получали 1,64 г целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,55-0,68 (м, 12H) 0,95 (т, J=8,01 Гц, 13H) 1,14-1,81 (м, 16H) 2,01-2,10 (м, 1H) 2,41 (дд, J=16,02, 6,25 Гц, 1H) 2,71 (дд, J=16,22, 6,84 Гц, 1H) 3,45 (дд, J=10,16, 2,74 Гц, 1H) 3,62-3,65 (м, 1H) 3,66 (с, 3H) 3,74 (д, J=3,91 Гц, 2H) 3,82 (ушир. с, 3H) 4,39-4,45 (м, 1H) 4,45-4,51 (м, 1H)
Метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((S)-2-оксо-1-((триэтилсилил)окси)этил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат
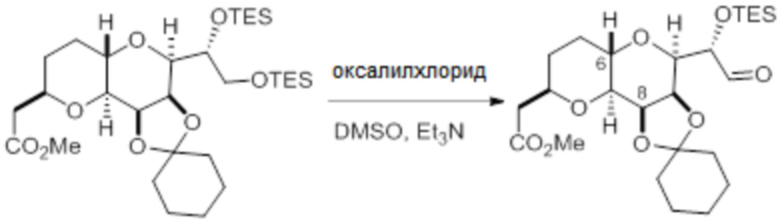
Раствор оксалилхлорида (2,67 мл, 5,33 ммоль, 2,0 M в дихлорметане) при 70°C по каплям добавляли в раствор DMSO (0,76 мл, 10,7 ммоль) в дихлорметане (4,1 мл). Спустя 15 мин, добавляли метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((R)-3,3,8,8-тетраэтил-4,7-диокса-3,8-дисиладекан-5-ил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат (0,82 г, 1,33 ммоль) в дихлорметане (4,1 мл). Реакционный раствор перемешивали в течение 20 мин при 70°C и в течение 20 мин при 40°C, охлаждали до 78°C и обрабатывали TEA (2,2 мл, 16,0 ммоль). Полученную смесь нагревали до температуры окружающей среды, обрабатывали водой (16,4 мл) и экстрагировали MTBE (32,8 мл). Органический слой трижды промывали 30% (масс./об.) водным NaCl (24,6 мл) и дважды водой (25 мл), и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали целевой продукт в виде масла (теоретич. выход 100%), который использовали на следующей стадии без дополнительной очистки.
Метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((S)-2-оксо-1-((триэтилсилил)окси)бут-3-ен-1-ил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат
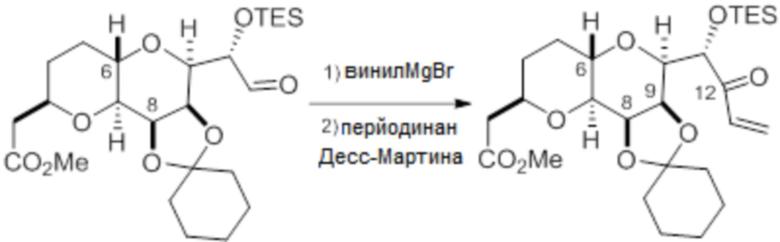
Метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((S)-2-оксо-1-((триэтилсилил)окси)этил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат (0,666 г, 1,33 ммоль) растворяли в THF (13 мл), полученный раствор охлаждали до 25°C и обрабатывали винилмагнийбромидом (1,0 M в THF, 1,6 мл, 1,6 ммоль). При необходимости, дополнительно добавляли винил-реактив Гриньяра до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.водн. раствора NH4Cl (15 мл) и воды (5 мл). Полученную смесь дважды экстрагировали MTBE (по 20 мл каждый раз). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (10 мл) и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((1R)-2-гидрокси-1-((триэтилсилил)-окси)бут-3-ен-1-ил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетат (теоретич. выход 100%), который использовали на следующей стадии без дополнительной очистки.
Неочищенный продукт растворяли в дихлорметане (14 мл). К раствору добавляли перйодинан Десс-Мартина (1,01 г, 2,38 ммоль) и бикарбонат натрия (0,556 г, 6,62 ммоль). Полученную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, добавляли MTBE (20 мл), нас.водн. раствор Na2S2O3 (20 мл) и воду (10 мл), и перемешивали полученную смесь в течение 1 ч. Слои разделяли, и экстрагировали водный слой MTBE (20 мл). Объединенные органические слои промывали нас.водн. раствором NaHCO3 (10 мл) и 30% (масс./об.) водным NaCl (10 мл), и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 20-66% этилацетата в н-гептане получали 369 мг целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 0,58-0,66 (м, 6H) 0,90-0,97 (м, 9H) 1,11-1,87 (м, 13H) 2,08-2,14 (м, 1H) 2,41 (дд, J=16,02, 6,25 Гц, 1H) 2,70 (дд, J=16,22, 6,84 Гц, 1H) 3,46 (дд, J=10,16, 3,13 Гц, 1H) 3,66 (с, 3H) 3,77-3,89 (м, 3H) 4,32 (д, J=8,21 Гц, 1H) 4,41-4,51 (м, 2H) 5,67 (дд, J=10,55, 1,56 Гц, 1H) 6,32 (дд, J=17,59, 1,95 Гц, 1H) 6,81 (дд, J=17,59, 10,55 Гц, 1H)
Метил-2-((2R,3S,3aS,4aS,7R,8aS,9S,9aR)-2-(2-(бензилокси)этил)-3-гидроксидекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
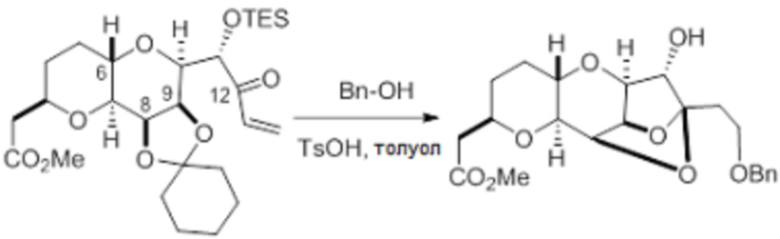
К раствору метил-2-((3aR,4R,5aS,8R,9aS,9bS)-4-((S)-2-оксо-1-((триэтилсилил)окси)бут-3-ен-1-ил)октагидроспиро[[1,3]диоксоло[4,5-d]пирано[3,2-b]пиран-2,1'-циклогексан]-8-ил)ацетата (0,123 г, 0,234 ммоль) в толуоле (6 мл) добавляли бензиловый спирт (0,3 мл, 2,89 ммоль) и пара-толуолсульфоновой кислоты моногидрат (8,92 мг, 0,047 ммоль). Реакционную смесь нагревали при 70-80°C в течение 5 ч, охлаждали до температуры окружающей среды и разбавлял MTBE (20 мл). Полученную смесь промывали нас.водн. раствором NaHCO3 (5 мл), 30% (масс./об.) водным NaCl (5 мл) и водой (5 мл), и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 40-80% этилацетата в н-гептане получали 40 мг целевого продукта в виде белого твердого вещества. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,42-1,62 (м, 2H) 1,78-1,90 (м, 1H) 2,05-2,11 (м, 1H) 2,15 (ддд, J=15,05, 5,28, 1,95 Гц, 1H) 2,33-2,48 (м, 2H) 2,68 (дд, J=16,02, 7,03 Гц, 1H) 3,08 (д, J=9,38 Гц, 1H) 3,50 (тд, J=9,97, 4,30 Гц, 1H) 3,61-3,71 (м, 1H) 3,67 (с, 3H) 3,77-3,82 (м, 1H) 3,83-3,90 (м, 1H) 4,02-4,06 (м, 1H) 4,13-4,19 (м, 2H) 4,45-4,51 (м, 1H) 4,51-4,61 (м, 2H) 7,27-7,43 (м, 5H).
Метил-2-((2S,3aR,4aS,7R,8aS,9S,9aS)-2-(2-(бензилокси)этил)-3-оксодекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
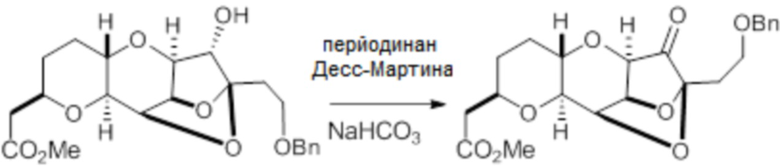
К раствору метил-2-((2R,3S,3aS,4aS,7R,8aS,9S,9aR)-2-(2-(бензилокси)этил)-3-гидроксидекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (13 мг, 0,031 ммоль) в дихлорметане (1 мл) при температуре окружающей среды добавляли перйодинан Десс-Мартина (26,2 мг, 0,062 ммоль) и бикарбонат натрия (12,99 мг, 0,155 ммоль). После перемешивания в течение 1 ч, реакционную смесь разбавляли MTBE (5 мл) и обрабатывали нас.водн. Na2S2O3 (3 мл) и водой (1 мл). После перемешивания в течение 30 мин, органический слой разделяли, промывали 30% (масс./об.) водным NaCl и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 11 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,38-1,56 (м, 2H) 1,79-1,88 (м, 1H) 2,10-2,19 (м, 1H) 2,32-2,37 (м, 2H) 2,41 (дд, J=16,02, 5,47 Гц, 1H) 2,65 (дд, J=16,02, 7,43 Гц, 1H) 3,21 (с, 1H) 3,23 (дд, J=9,77, 1,17 Гц, 1H) 3,31-3,40 (м, 1H) 3,67 (с, 3H) 3,66-3,72 (м, 1H) 3,82-3,92 (м, 1H) 4,26 (д, J=5,86 Гц, 1H) 4,34 (ушир. с, 1H) 4,50 (с, 2H) 4,79 (дд, J=5,67, 2,93 Гц, 1H) 7,26-7,41 (м, 5H)
Метил-2-((2R,3R,3aS,4aS,7R,8aS,9S,9aR)-2-(2-(бензилокси)-этил)-3-гидроксидекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
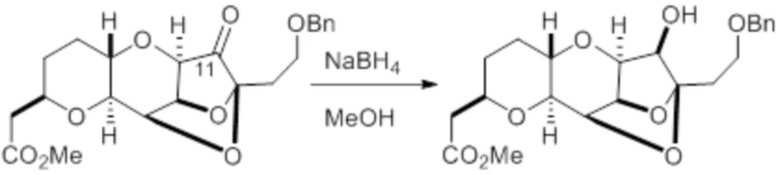
К раствору метил-2-((2S,3aR,4aS,7R,8aS,9S,9aS)-2-(2-(бензилокси)этил)-3-оксодекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (11 мг, 0,026 ммоль) в метаноле (1 мл) при 0°C добавляли боргидрид натрия (2,98 мг, 0,079 ммоль). Спустя 15 мин, реакционную смесь гасили добавлением нас.водн. раствора NH4Cl (2 мл) и воды (1 мл). Полученную смесь трижды экстрагировали EtOAc (по 5 мл каждый раз). Объединенные органические слои промывали солевым раствором (2 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-80% этилацетата в н-гептане получали 8,0 мг целевого продукта в виде бесцветного масла. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,38-1,58 (м, 2H) 1,79-1,86 (м, 1H) 2,12-2,25 (м, 3H) 2,43 (дд, J=16,02, 5,47 Гц, 1H) 2,69 (дд, J=16,02, 7,03 Гц, 1H) 3,13 (дд, J=9,77, 1,17 Гц, 1H) 3,59-3,64 (м, 1H) 3,67 (с, 3H) 3,75-3,80 (м, 1H) 3,83-3,93 (м, 3H) 4,23 (дд, J=8,99, 5,47 Гц, 1H) 4,28-4,30 (м, 1H) 4,36 (тд, J=10,36, 4,30 Гц, 1H) 4,50-4,61 (м, 3H) 7,26-7,37 (м, 5H)
Метил-2-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-2-(2-(бензилокси)этил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
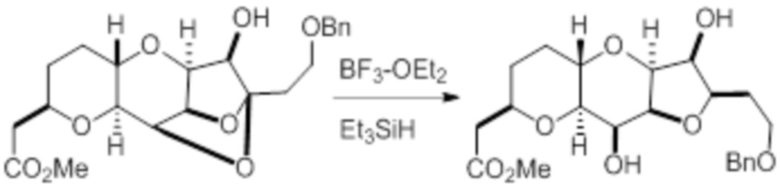
К раствору метил-2-((2R,3R,3aS,4aS,7R,8aS,9S,9aR)-2-(2-(бензилокси)этил)-3-гидроксидекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (8 мг, 0,019 ммоль) в дихлорметане (1 мл) добавляли триэтилсилан (0,1 мл, 0,626 ммоль). Полученный раствор охлаждали до 0°C и обрабатывали BF3·OEt2 (0,012 мл, 0,095 ммоль). Реакционную смесь доводили до температуры окружающей среды и перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.водн. NaHCO3 (1 мл) и 30% (масс./об.) водного NaCl (1 мл). Полученную смесь дважды экстрагировали EtOAc (5 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-100% этилацетата в н-гептане, а затем градиента 0-20% метанола в этилацетате, получали 3,0 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,37-1,49 (м, 2H) 1,76-1,83 (м, 1H) 1,92-2,10 (м, 2H) 2,12-2,22 (м, 1H) 2,43 (дд, J=15,63, 5,47 Гц, 1H) 2,63 (дд, J=16,02, 7,43 Гц, 1H) 3,05 (дд, J=9,77, 1,95 Гц, 1H) 3,43-3,51 (м, 1H) 3,52-3,65 (м, 2H) 3,66-3,68 (м, 3H) 3,83-3,93 (м, 1H) 3,94-4,07 (м, 3H) 4,09-4,20 (м, 2H) 4,37-4,43 (м, 2H) 4,49-4,52 (м, 2H) 7,27-7,38 (м, 5H)
Метил-2-((2R,3R,3aS,4aS,7R,8aR,9S,9aS)-2-(2-(бензилокси)этил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
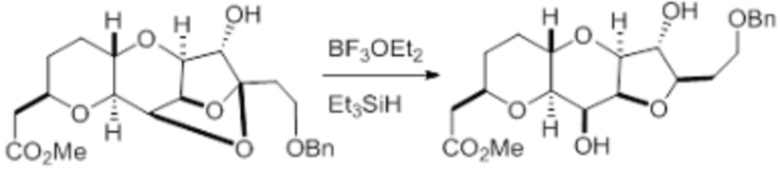
К раствору метил-2-((2R,3S,3aS,4aS,7R,8aS,9S,9aR)-2-(2-(бензилокси)этил)-3-гидроксидекагидро-2,9-эпоксифуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (13 мг, 0,031 ммоль) в дихлорметане (1 мл) добавляли триэтилсилан (0,1 мл, 0,626 ммоль). Полученный раствор охлаждали до 0°C и обрабатывали BF3·OEt2 (0,020 мл, 0,155 ммоль). Реакционную смесь доводили до температуры окружающей среды и перемешивали до расходования всего исходного вещества. После завершения реакции, реакционную смесь гасили добавлением нас.водн. NaHCO3 (1 мл) и 30% (масс./об.) водного NaCl (1 мл). Полученную смесь дважды экстрагировали EtOAc (5 мл). Объединенные органические слои промывали 30% (масс./об.) водным NaCl (3 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 60-100% этилацетата в н-гептане получали 8,0 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,37-1,55 (м, 2H) 1,71-1,80 (м, 1H) 1,94-2,02 (м, 1H) 2,04-2,18 (м, 2H) 2,43 (дд, J=15,83, 5,67 Гц, 1H) 2,63 (дд, J=15,83, 7,23 Гц, 1H) 3,08 (дд, J=9,38, 2,34 Гц, 1H) 3,67 (с, 5H) 3,72-3,81 (м, 2H) 3,82-3,91 (м, 1H) 4,02-4,06 (м, 1H) 4,06-4,12 (м, 1H) 4,27 (дд, J=9,38, 7,43 Гц, 1H) 4,34 (дд, J=9,38, 8,21 Гц, 1H) 4,51-4,55 (м, 2H) 7,26-7,38 (м, 5H)
Метил-2-((2R,3aR,4aS,7R,8aS,9aR)-2-(2-(бензилокси)этил)-3,9-диоксодекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
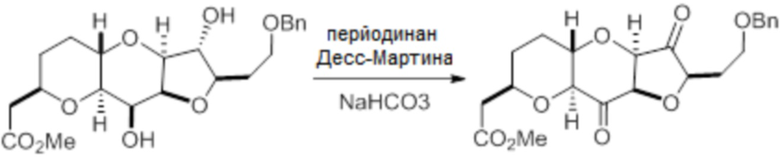
К раствору метил-2-((2R,3R,3aS,4aS,7R,8aR,9S,9aS)-2-(2-(бензилокси)этил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (4 мг, 9,468 мкмоль) в дихлорметане (1 мл) при температуре окружающей среды добавляли перйодинан Десс-Мартина (12 мг, 0,028 ммоль) и бикарбонат натрия (4 мг, 0,047mmol). После перемешивания в течение 2 ч, реакционную смесь разбавляли MTBE (5 мл) и обрабатывали нас.водн. Na2S2O3 (3 мл) и водой (1 мл). После перемешивания в течение 30 мин, органический слой разделяли, промывали 30% (масс./об.) водным NaCl и сушили над MgSO4. Путем фильтрования и концентрирования в условиях вакуума получали 4,0 мг целевого продукта. 1H-ЯМР (400 МГц, хлороформ-d) (м.д. 1,05-1,18 (м, 1H) 1,64-1,72 (м, 1H) 1,72-1,81 (м, 1H) 1,81-1,89 (м, 1H) 1,90-2,01 (м, 1H) 2,18-2,27 (м, 1H) 2,35-2,44 (м, 1H) 2,70 (дд, J=16,02, 6,64 Гц, 1H) 3,34 (тд, J=10,26, 4,89 Гц, 1H) 3,67 (с, 3H) 3,70-3,77 (м, 2H) 3,79-3,86 (м, 1H) 3,89 (д, J=10,16 Гц, 1H) 4,40-4,46 (м, 1H) 4,48 (с, 1H) 4,85 (д, J=10,55 Гц, 1H) 5,07 (дд, J=10,75, 1,37 Гц, 1H) 7,27-7,37 (м, 5H)
Метил-2-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-2-(2-(бензилокси)этил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
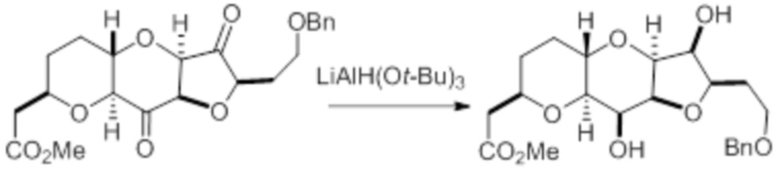
К раствору метил-2-((2R,3aR,4aS,7R,8aS,9aR)-2-(2-(бензилокси)этил)-3,9-диоксодекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата (4 мг, 9,464 мкмоль) в THF (1 мл) при 0°C добавляли 1,0 M три-трет-бутоксиалюмогидрид лития (0,047 мл, 0,047 ммоль). Реакционную смесь перемешивали при температуре окружающей среды до расходования всего исходного вещества. После завершения реакции, реакционную смесь обрабатывали нас.водн. раствором сегнетовой соли (3 мл) и экстрагировали EtOAc (5 мл) дважды. Объединенные органические слои промывали 30% (масс./об.) водным NaCl (2 мл) и сушили над MgSO4. Путем фильтрования, концентрирования в условиях вакуума и очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента градиента 50-100% этилацетата в н-гептане, а затем градиента 0-20% метанола в этилацетате, получали 3,1 мг целевого продукта.
Пример 8 - Получение соединения (ID)
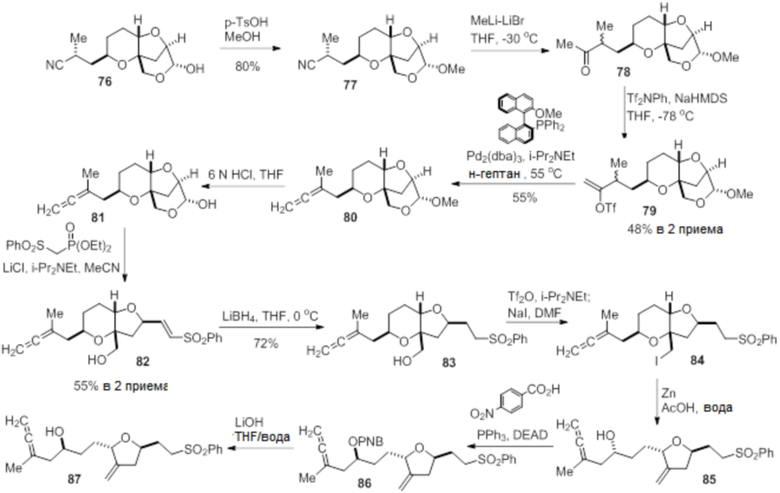
(R)-3-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-5H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-2-метилпропаннитрил
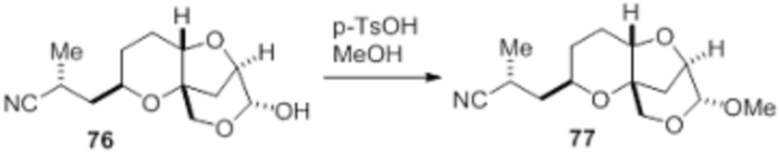
Раствор (R)-3-((2R,3R,5aR,7R,9aS)-3-гидроксигексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-2-метилпропаннитрила (20 г, 79 ммоль) в метаноле (200 мл) обрабатывали p-TsOH (0,751 г, 3,95 ммоль) и перемешивали при 40°C в течение 22 ч. Смесь концентрировали в условиях вакуума, снова упаривали с метанолом (100 мл) и подвергали азеотропной перегонке с толуолом (100 мл). Остаток обрабатывали нас.водн. NaHCO3 (100 мл) и дважды экстрагировали MTBE (160 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в условиях вакуума. Остаток растворяли в MTBE (30 мл) при нагревании для получения прозрачного раствора и обрабатывали н-гептаном (60 мл). Полученную суспензию перемешивали при 65°C (баня) в течение 30 мин и медленно охлаждали до комнатной температуры в течение 1 суток. Осадок фильтровали, промывали смесью MTBE/н-гептан=1/5 и сушили под струей N2 с получением указанного в заголовке соединения (16,94 г, 80%). 1H-ЯМР (400 МГц, хлороформ-d) (1,15-1,28 (м, 1H), 1,30 (д, 3H), 1,45-1,59 (м, 3H), 1,61-1,72 (м, 1H), 1,92 (д, 1H), 2,12-2,21 (м, 1H), 2,41-2,49 (м, 1H), 2,82-2,92 (м, 1H), 3,35-3,39 (м, 1H), 3,38 (с, 3H), 3,72-3,80 (м, 3H), 4,12 (дд, 1H), 4,42 (дд, 1H).
4-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-5H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-3-метилбутан-2-он
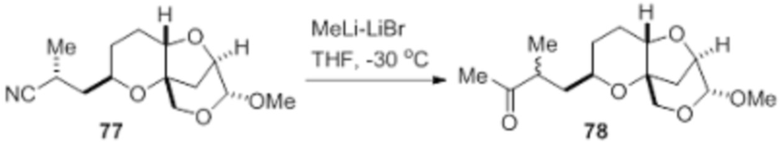
Раствор (R)-3-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-2-метилпропаннитрила (7,0 г, 26 ммоль) в THF (105 мл) охлаждали до 35°C и обрабатывали 1,5 M метиллитием в виде комплекса бромида лития в диэтиловом эфире (21,0 мл, 31,4 ммоль), поддерживая внутреннюю температуру ниже 30°C. Смесь перемешивали при 30°C в течение 2 ч. Реакционную смесь гасили добавлением нас.водн. NH4Cl (70 мл) и нагревали до комнатной температуры в течение 10 мин при перемешивании. Смесь дважды экстрагировали MTBE (56 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде смеси двух изомеров (3,43 г, 105%).
4-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-5H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-3-метилбут-1-ен-2-илтрифторметансульфонат
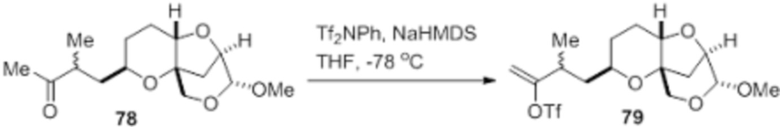
Раствор 4-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-3-метилбутан-2-она (0,13 г, 0,46 ммоль) в THF (3,3 мл) охлаждали до 78°C и обрабатывали 1 M NaHMDS в THF (0,50 мл, 0,50 ммоль) в течение 10 мин, поддерживая внутреннюю температуру ниже 65°C. Смесь перемешивали при 78°C в течение 30 мин. Добавляли раствор 1,1,1-трифтор-N-фенил-N-(трифторметил)сульфонилметансульфонамида (0,245 г, 0,686 ммоль) в THF (1,0 мл), и продолжали перемешивание при 78°C в течение 1 ч. Дополнительно добавляли 1 M NaHMDS в THF (0,091 мл, 0,091 ммоль), и продолжали перемешивание при 78°C еще в течение 1 ч. Реакционную смесь гасили добавлением нас.водн. NH4Cl (1,3 мл) и дважды экстрагировали н-гептаном (0,9 мл). Органические слои объединяли, промывали солевым раствором, концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-30%) с получением указанного в заголовке соединения в виде смеси двух изомеров (130 мг 68%).
(2R,3R,5aR,7R,9aS)-3-метокси-7-(2-метилбута-2,3-диен-1-ил)гексагидро-5H-2,5a-метанопирано[3,2-e][1,4]диоксепин
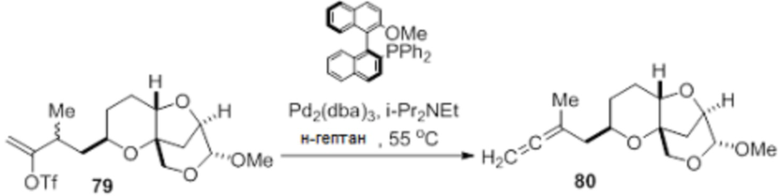
В колбу емкостью 100 мл загружали Pd2(dba)3 (0,088 г, 0,096 ммоль), (S)-(-)-(дифенилфосфино)-2'-метокси-1,1'-бинафтил (0,180 г, 0,384 ммоль) и н-гептан (32 мл), и нагревали до 55°C в течение 5 мин. Смесь обрабатывали смесью 4-((2R,3R,5aR,7R,9aS)-3-метоксигексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин-7-ил)-3-метилбут-1-ен-2-илтрифторметансульфоната (2,0 г, 4,8 ммоль) и N,N-диизопропилэтиламина (1,7 мл, 9,6 ммоль) в н-гептане (15 мл). Смесь перемешивали при 55°C в течение 24 ч. После охлаждения до комнатной температуры, смесь фильтровали через слой Celite и промывали н-гептаном. Фильтрат концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-40%) с получением указанного в заголовке соединения (700 мг, 55%). 1H-ЯМР (400 МГц, хлороформ-d) (1,12-1,35 (м, 2H), 1,40-1,53 (м, 1H), 1,61-1,66 (м, 1H), 1,68 (т, J=3,13 Гц, 3H), 1,88 (д, J=10,55 Гц, 1H), 1,95-2,05 (м, 1H), 2,06-2,21 (м, 2H), 2,36-2,52 (м, 1H), 3,39 (с, 2H), 3,37-3,42 (дд, J=9,77, 2,74 Гц, 1H), 3,63-3,72 (м, 1H), 3,75 (д, J=9,77 Гц, 1H), 3,79 (дд, J=10,55, 6,64 Гц, 1H), 4,11 (дд, J=6,25, 2,74 Гц, 1H), 4,43 (д, J=2,74 Гц, 1H), 4,53-4,65 (м, 2H).
(2R,3R,5aR,7R,9aS)-7-(2-метилбута-2,3-диен-1-ил)гексагидро-5H-2,5a-метанопирано[3,2-e][1,4]диоксепин-3-ол

(2R,3R,5aR,7R,9aS)-3-метокси-7-(2-метилбута-2,3-диен-1-ил)гексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин (0,60 г, 2,25 ммоль) растворяли в THF (9 мл) и обрабатывали 6 N HCl (9,0 мл, 54 ммоль). Смесь перемешивали при комнатной температуре в течение 14 ч. Смесь дважды экстрагировали этилацетатом (9 мл). Органические слои объединяли, промывали нас.водн. NaHCO3 (9 мл), сушили над MgSO4 и концентрировали в условиях вакуума с получением указанного в заголовке соединения в виде смеси двух аномерных изомеров (630 мг, 110%).
((2R,3aR,5R,7aS)-5-(2-метилбута-2,3-диен-1-ил)-2-((E)-2-(фенилсульфонил)винил)гексагидро-3aH-фуро[3,2-b]пиран-3a-ил)метанол
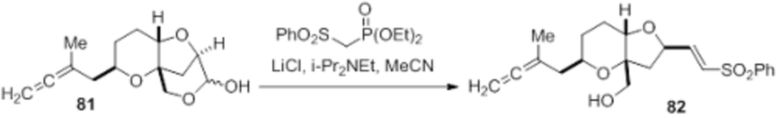
Смесь (2R,3R,5aR,7R,9aS)-7-(2-метилбута-2,3-диен-1-ил)гексагидро-2H-2,5a-метанопирано[3,2-e][1,4]диоксепин-3-ола (0,68 г, 2,7 ммоль), диэтил((фенилсульфонил)метил)фосфоната (0,87 г, 3,0 ммоль) и хлорида лития (0,17 г, 4,0 ммоль) в ацетонитриле (13,6 мл) охлаждали до 0°C и обрабатывали N,N-диизопропилэтиламином (0,75 мл, 4,3 ммоль). Смесь перемешивали при 0°C в течение 1 ч и при комнатной температуре в течение 4 ч. Дополнительно добавляли фосфонат (157 мг), хлорид лития (34 мг) и N,N-диизопропилэтиламин (0,14 мл), и продолжали перемешивание при комнатной температуре еще в течение 15 ч. Реакционную смесь вливали в воду (6,8 мл) и дважды экстрагировали MTBE (10 мл). Органические слои объединяли, сушили над MgSO4, концентрировали в условиях вакуума и очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-50%) с получением указанного в заголовке соединения (548 мг, 55% в 2 приема). 1H-ЯМР (400 МГц, хлороформ-d) (1,19-1,34 (м, 1H), 1,60-1,80 (м, 3H), 1,69 (т, J=3,13 Гц, 3H), 1,81-1,95 (м, 1H), 2,00-2,09 (м, 1H), 2,09-2,21 (м, 1H), 2,44-2,60 (м, 1H), 3,40 (с, 2H), 3,68-3,84 (м, 1H), 3,88-4,01 (м, 1H), 4,54-4,67 (м, 2H), 4,76-4,91 (м, 1H), 6,56 (дд, J=14,85, 1,95 Гц, 1H), 6,93 (дд, J=14,85, 3,52 Гц, 1H), 7,46-7,57 (м, 2H), 7,57-7,67 (м, 1H), 7,81-7,92 (м, 2H).
((2R,3aR,5R,7aS)-5-(2-метилбута-2,3-диен-1-ил)-2-(2-(фенилсульфонил)этил)гексагидро-3aH-фуро[3,2-b]пиран-3a-ил)метанол

Раствор ((2R,3aR,5R,7aS)-5-(2-метилбута-2,3-диен-1-ил)-2-((E)-2-(фенилсульфонил)винил)гексагидро-2H-фуро[3,2-b]пиран-3a-ил)метанола (0,51 г, 1,3 ммоль) в THF (10 мл) охлаждали до 0°C и обрабатывали 2 M LiBH4 в THF (0,98 мл, 2,0 ммоль). Смесь перемешивали при 0°C в течение 4 ч. Реакционную смесь гасили добавлением 20% (масс./об.) лимонной кислоты в воде (8,16 мл) и дважды экстрагировали MTBE (10 мл). Органические слои объединяли, промывали нас.водн. NaHCO3 (5 мл), а затем солевым раствором (5 мл), и концентрировали в условиях вакуума. Остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-60%) с получением указанного в заголовке соединения (370 мг, 72%). 1H-ЯМР (400 МГц, хлороформ-d) (1,13-1,26 (м, 1H), 1,40 (дд, J=13,87, 6,06 Гц, 1H), 1,53-1,63 (м, 1H), 1,65 (т, J=3,13 Гц, 3H), 1,67-1,72 (м, 1H), 1,74-1,85 (м, 2H), 1,86-1,97 (м, 1H), 1,97-2,05 (м, 1H), 2,05-2,14 (м, 1H), 2,28 (дд, J=14,07, 8,60 Гц, 1H), 3,07 (ддд, J=14,07, 10,94, 5,08 Гц, 1H), 3,24 (ддд, J=14,07, 10,94, 5,08 Гц, 1H), 3,41 (с, 2H), 3,62-3,72 (м, 1H), 3,77 (дд, J=8,60, 5,86 Гц, 1H), 4,12-4,22 (м, 1H), 4,51-4,61 (м, 2H), 7,49-7,58 (м, 2H), 7,59-7,67 (м, 1H), 7,83-7,93 (м, 2H).
(2R,3aS,5R,7aS)-3a-(йодметил)-5-(2-метилбута-2,3-диен-1-ил)-2-(2-(фенилсульфонил)этил)гексагидро-2H-фуро[3,2-b]пиран
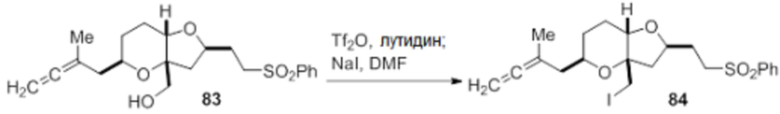
Раствор ((2R,3aR,5R,7aS)-5-(2-метилбута-2,3-диен-1-ил)-2-(2-(фенилсульфонил)этил)гексагидро-2H-фуро[3,2-b]пиран-3a-ил)метанола (0,37 г, 0,94 ммоль) в CH2Cl2 (3 мл) охлаждали до 5°C и обрабатывали 2,6-лутидином (0,33 мл, 2,8 ммоль) и 1M Tf2O в CH2Cl2 (1,4 мл, 1,4 ммоль). После перемешивания при 5°C в течение 1,5 ч, смесь разбавляли DMF (2,78 мл) и обрабатывали йодидом натрия (0,42 г, 2,8 ммоль). Смесь перемешивали при комнатной температуре в течение 20 ч. Смесь разбавляли MTBE (19 мл) и последовательно промывали водой (5,6 мл), 1 N HCl (5,6 мл), нас.водн. NaHCO3 (3,7 мл) и 20% (масс./об.) Na2S2O3 в воде (3,7 мл). После концентрирования, остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-40%) с получением указанного в заголовке соединения (140 мг, 30%). 1H-ЯМР (400 МГц, хлороформ-d) (1,13-1,32 (м, 1H), 1,54-1,82 (м, 3H), 1,68 (т, J=3,13 Гц, 3H), 1,72-1,82 (м, 1H), 1,82-1,99 (м, 2H), 2,00-2,09 (м, 1H), 2,11-2,23 (м, 1H), 2,43 (дд, J=14,07, 8,21 Гц, 1H), 3,07 (ддд, J=13,97, 10,84, 5,28 Гц, 1H), 3,20-3,30 (м, 1H), 3,27 (д, J=10,16 Гц, 1H), 3,35 (д, J=10,94 Гц, 1H), 3,60-3,70 (м, 1H), 3,77 (дд, J=7,82, 5,47 Гц, 1H), 4,11-4,24 (м, 1H), 4,52-4,60 (м, 2H), 7,51-7,59 (м, 2H), 7,60-7,70 (м, 1H), 7,84-7,96 (м, 2H).
(R)-5-метил-1-((2S,5R)-3-метилен-5-(2-(фенилсульфонил)-этил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ол
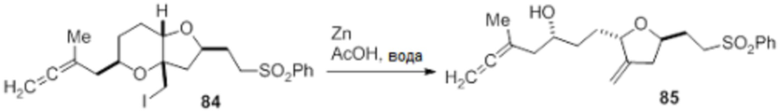
Суспензию цинковой пыли (0,128 г, 1,95 ммоль) в воде (0,9 мл) охлаждали до 0°C и обрабатывали уксусной кислотой (0,019 мл, 0,33 ммоль). После перемешивания в течение 10 мин, смесь обрабатывали раствором (2R,3aS,5R,7aS)-3a-(йодметил)-5-(2-метилбута-2,3-диен-1-ил)-2-(2-(фенилсульфонил)этил)гексагидро-2H-фуро[3,2-b]пирана (0,14 г, 0,28 ммоль) в THF (1,4 мл). После перемешивания при 0°C в течение 1 ч, реакционную смесь гасили добавлением 20% (масс./об.) лимонной кислоты в воде (0,84 мл) и перемешивали при 0°C в течение 10 мин. Смесь фильтровали через слой Celite для удаления нерастворенного цинка и промывали MTBE (14 мл). Органические слои разделяли и промывали нас.NaHCO3 (1,4 мл) и солевым раствором (1,4 мл). После концентрирования, остаток очищали методом колоночной хроматографии на силикагеле (этилацетат/н-гептан=10%-50%) с получением указанного в заголовке соединения (76 мг, 72%). 1H-ЯМР (400 МГц, хлороформ-d) (1,43-1,65 (м, 3H), 1,69 (т, J=3,12 Гц, 3H), 1,70-1,80 (м, 1H), 1,83-1,96 (м, 2H), 1,98-2,12 (м, 2H), 2,19-2,30 (м, 2H), 2,62-2,76 (м, 1H), 3,05-3,19 (м, 1H), 3,21-3,34 (м, 1H), 3,74 (ушир. с, 1H), 4,06 (дт, J=12,88, 6,44 Гц, 1H), 4,28 (ушир. с, 1H), 4,58-4,70 (м, 2H), 4,85 (кв, J=2,34 Гц, 1H), 4,98 (кв, J=2,34 Гц, 1H), 7,50-7,60 (м, 2H), 7,61-7,69 (м, 1H), 7,87-7,94 (м, 2H).
Другие варианты осуществления
Различные модификации и вариации описанных композиций и способов согласно настоящему изобретению будут очевидны специалистам в данной области техники, не выходя за пределы объема и сущности настоящего изобретения. Хотя настоящее изобретение было описано вместе с конкретными вариантами осуществления, следует понимать, что заявляемое изобретение не следует неправомерно ограничивать такими конкретными вариантами осуществления. В этой связи, различные модификации описанных способов осуществления настоящего изобретения, которые очевидны специалистам в данной области техники, подлежат включению в объем настоящего изобретения.
Другие варианты осуществления заключены в формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ДРУГИЕ ФРАГМЕНТЫ, ПРИГОДНЫЕ В ПОЛУЧЕНИИ АНАЛОГОВ ХАЛИХОНДРИНА B | 2014 |
|
RU2710545C2 |
| РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ И ДРУГИЕ ФРАГМЕНТЫ, ПОЛЕЗНЫЕ В СИНТЕЗЕ МАКРОЛИДОВ ГАЛИХОНДРИНОВ | 2016 |
|
RU2739034C2 |
| МЕХАНОХИМИЧЕСКИЙ СПОСОБ СИНТЕЗА КУМАРИНОВ | 2022 |
|
RU2799566C1 |
| ПИРРОЛОПИРРОЛОВЫЕ КОМПОЗИЦИИ В КАЧЕСТВЕ АКТИВАТОРОВ ПИРУВАТКИНАЗЫ (PKR) | 2018 |
|
RU2736217C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ДИГИДРОНАФТИРИДИНОНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2809869C1 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2658919C2 |
| ПРОИЗВОДНЫЕ ФУРО[3,2-В]ПИРАНА, ПРИМЕНИМЫЕ В СИНТЕЗЕ АНАЛОГОВ | 2011 |
|
RU2579511C2 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2586974C2 |
| ЦИТОСКЕЛЕТОАКТИВНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2006 |
|
RU2407745C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2571662C2 |
Изобретение относится к способам синтеза макролидов галихондринового ряда и их аналогов с использованием стратегии реакции циклизации. Стратегия согласно настоящему изобретению включает в себя воздействие на промежуточный продукт условиями реакции Принса с получением макролида. Изобретение также относится к соединениям, применимым в качестве промежуточных продуктов при синтезе макролидов галихондринового ряда или их аналогов, и к способам их получения. 5 н. п. ф-лы и 24 з. п. ф-лы, 8 пр.
1. Способ получения макроциклического промежуточного продукта при синтезе макролида галихондринового ряда или его аналога, включающий осуществление взаимодействия соединения формулы (IА) с R12OH и оксофильной кислотой Льюиса, причем в результате взаимодействия получают макроциклический промежуточный продукт путем формирования связи в структуре макролида галихондринового ряда или его аналога,
где R12 представляет собой -C(O)R, где R представляет собой C1-12 алкил, замещенный C1-12 алкокси;
где соединение формулы (IA) представляет собой:
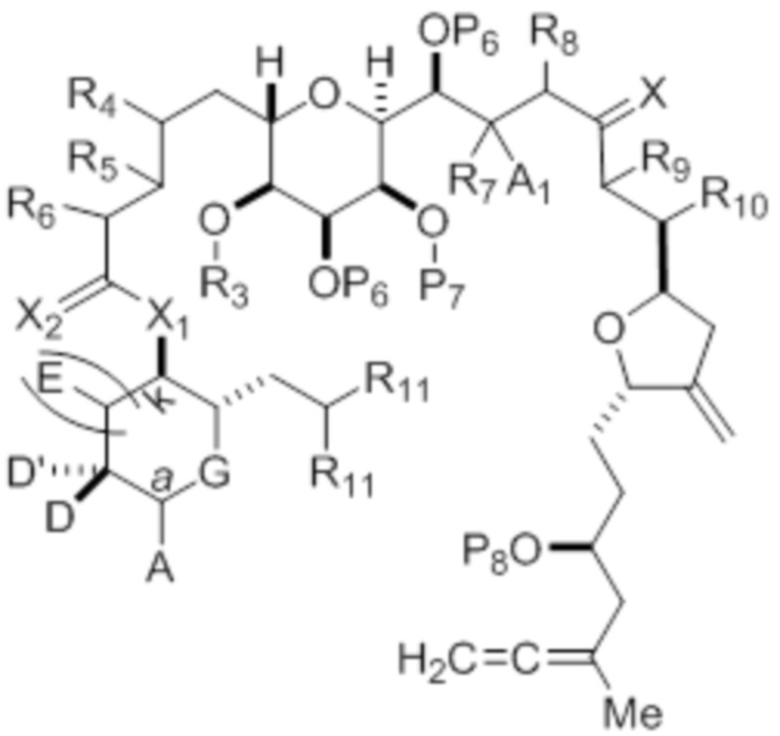 (IA),
(IA),
где
а обозначает стереогенный центр;
каждый из D и D' независимо представляет собой H или OP1 при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой C1-12 алкил; и A представляет собой группу формулы (1):
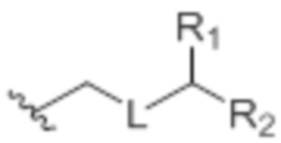 (1),
(1),
где
L представляет собой -(CH(OP2))-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
R2 представляет собой -(CH2)nOP5, где P2 представляет собой гидроксилзащитную группу, и P5 представляет собой гидроксилзащитную группу;
E представляет собой C1-12 алкил;
G представляет собой O;
n равен 0 или 2;
k равен 0 или 1;
X1 представляет собой -CH2- или -O-;
X2 представляет собой =O;
Y представляет собой SO2RC, где RC представляет собой C6-20 арил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H;
A1 представляет собой H, и:
(a) P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H;
каждый P6 независимо представляет собой гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; и каждый R11 представляет собой -OP10, где P10 представляет собой C1-12 алкил;
R9 представляет собой H или Y, и R10 представляет собой H;
P8 представляет собой –SiR3, где каждый R независимо представляет собой C1-12 алкил; и
где макроциклический промежуточный продукт при синтезе макролида галихондринового ряда или его аналога представляет собой соединение формулы (IB):
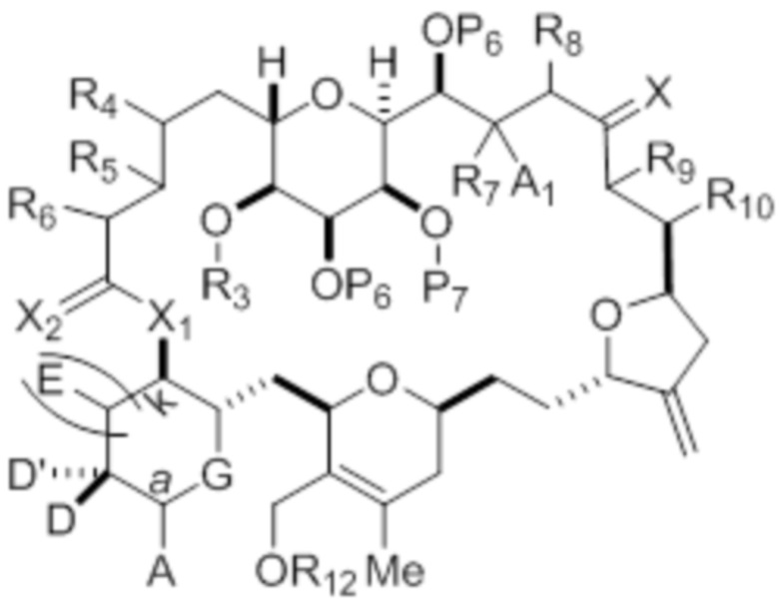 (IB),
(IB),
где
(i) каждый P6 независимо представляет собой гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; или
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием –O–CR2–O–, где один R представляет собой связь с атомом углерода, к которому присоединен R8, а другой R представляет собой связь с атомом углерода, к которому присоединен R9; P7 и R7 объединены с формированием связи, и R8 представляет собой H;
R12 представляет собой -C(O)R, где R представляет собой C1-12 алкил, замещенный C1-12 алкокси; и
все другие переменные такие, как определено для формулы (IA); и где
каждая гидроксильная защитная группа вместе с атомом кислорода, к которому каждая присоединена, независимо представляет собой сложный эфир структуры -OCOR, где R представляет собой C6-20 арил; или простой эфир структуры –OR, где R представляет собой (C6-15 арил, замещенный нитро)(C1-6 алкил), три(C1-6 алкил)силил или ди(C6-10 арил)(C1-6 алкил)силил.
2. Способ по п. 1, где оксофильная кислота Льюиса представляет собой трифторид бора или его сольват.
3. Способ получения
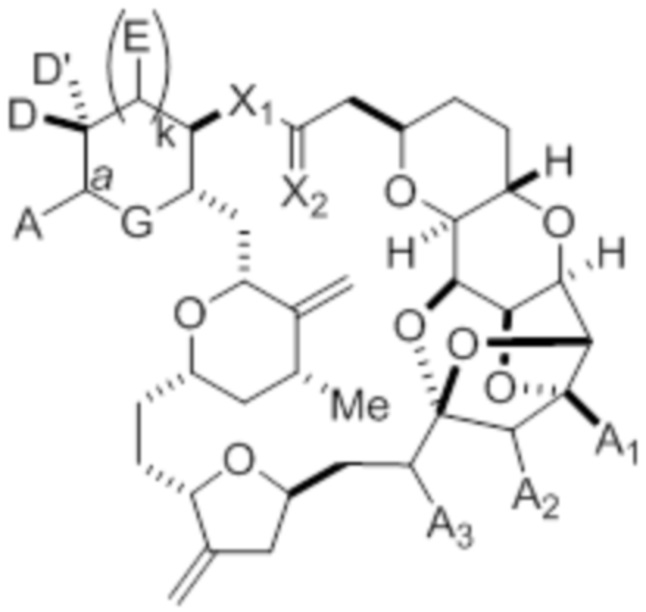
макролида галихондринового ряда или его аналога,
где
а представляет собой стереогенный центр;
каждый из D и D' независимо представляет собой H или OP1 при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой C1-12 алкил; и A представляет собой группу формулы (1):
 (1),
(1),
где
L представляет собой -(CH(OP2))-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
P2 представляет собой гидроксилзащитную группу;
каждый из A1, A2 и A3 представляет собой H;
E представляет собой C1-12 алкил;
G представляет собой O;
n равен 0 или 2;
k равен 0 или 1; и
X1 представляет собой -CH2- или -O-, и X2 представляет собой =O;
включающий:
(A) получение соединения формулы (IB) из соединения формулы (IA) и R12OH, где R12 представляет собой -C(O)R, где R представляет собой C1-12 алкил, замещенный C1-12 алкокси, и получение соединения формулы (IB) включает взаимодействие соединения формулы (IА) с R12OH и оксофильной кислотой Льюиса, и соединение формулы (IA) имеет следующую структуру:
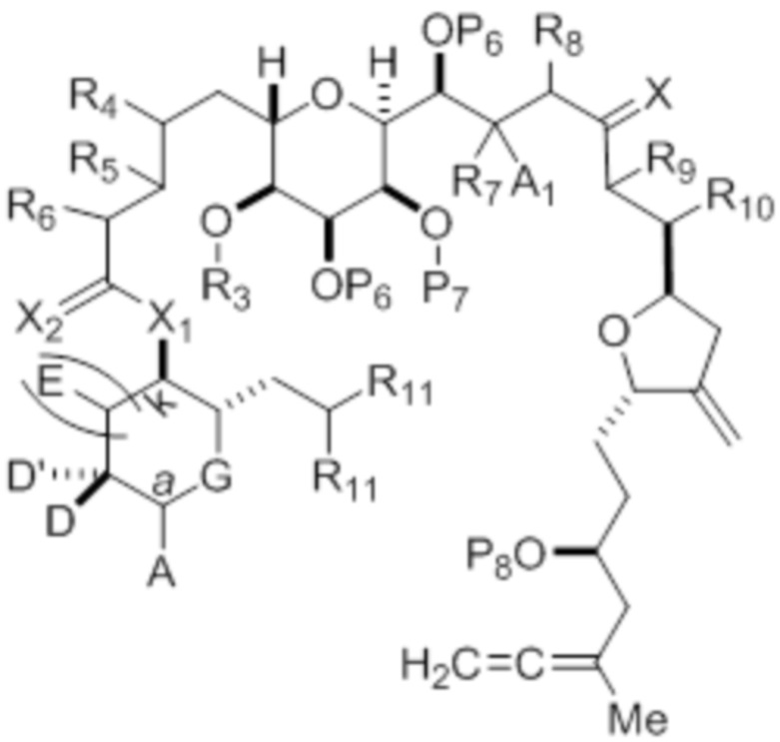 (IA)
(IA)
где
а представляет собой стереогенный центр;
каждый из D и D' независимо представляет собой H или OP1 при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой C1-12 алкил; и A представляет собой группу формулы (1):
 (1),
(1),
где
L представляет собой -(CH(OP2))-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
R2 представляет собой -(CH2)nOP5, где P5 представляет собой гидроксилзащитную группу;
P2 представляет собой гидроксилзащитную группу;
E представляет собой C1-12 алкил;
G представляет собой O;
n равен 0 или 2;
k равен 0 или 1;
X1 представляет собой -CH2- или -O-, и X2 представляет собой =O;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H;
A1 представляет собой H, и:
(a) P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H;
каждый P6 независимо представляет собой гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; и каждый R11 представляет собой -OP10, где P10 представляет собой C1-12 алкил;
R9 представляет собой H или SO2RC, где RC представляет собой C6-20 арил, и R10 представляет собой H; и
P8 представляет собой–SiR3, где каждый R независимо представляет собой C1-12 алкил;
и
соединение формулы (IB) имеет следующую структуру:
 (IB)
(IB)
где
(i) каждый P6 независимо представляет собой гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; или
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием –O–CR2–O–, где один R представляет собой связь с атомом углерода, к которому присоединен R8, а другой R представляет собой связь с атомом углерода, к которому присоединен R9; P7 и R7 объединены с формированием связи, и R8 представляет собой H;
R12 представляет собой C(O)R, где R представляет собой C1-12 алкил, замещенный C1-12 алкокси; и
все другие переменные такие, как определено для формулы (IA);
(B) получение макролида ряда галихондрина или аналога из соединения (IB), и где
каждая гидроксильная защитная группа вместе с атомом кислорода, к которому каждая присоединена, независимо представляет собой сложный эфир структуры -OCOR, где R представляет собой C6-20 арил; или простой эфир структуры –OR, где R представляет собой (C6-15 арил, замещенный нитро)(C1-6 алкил), три(C1-6 алкил)силил или ди(C6-10 арил)(C1-6 алкил)силил.
4. Способ по п. 2 или 3, где получение макролида ряда галихондрина или его аналога включает осуществление взаимодействия соединения формулы (IB), или его соли, или таутомера с аллильным восстановителем.
5. Способ по любому из пп. 1-4, где P6 представляет собой гидроксилзащитную группу.
6. Способ по любому из пп. 1-4, где R7 и P7 объединены с формированием связи, и R8 представляет собой H.
7. Способ по любому из пп. 1-5, где P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи.
8. Способ по любому из пп. 1-7, где R9 представляет собой H.
9. Способ по любому из пп. 1-8, где D представляет собой H.
10. Способ по любому из пп. 1-9, где D' представляет собой OP1, где P1 представляет собой C1-12 алкил.
11. Способ по любому из пп. 1-10, где стереогенный центр, обозначаемый как a, представляет собой (R), и А представляет следующую структуру:
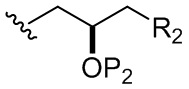 .
.
12. Способ по любому из пп. 1-11, где k равен 0, и X1 представляет собой -CH2-.
13. Способ по любому из пп. 1-12, где R2 представляет собой -(CH2)nOP5, где n равен 0.
14. Способ по любому из пп. 1-8, где A и D объединены с формированием следующей структуры:
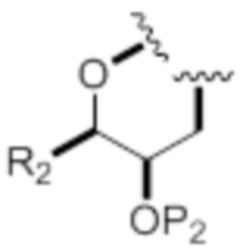 ,
,
где связь с атомом кислорода возникает по атому углерода, к которому D присоединен в формуле (IA), и
где R2 представляет собой -(CH2)nOP5, где n равен 2.
15. Способ по п. 14, где k равен 1, и E представляет собой метил.
16. Способ по п. 14 или 15, где X1 представляет собой -O-.
17. Соединение формулы (IA):
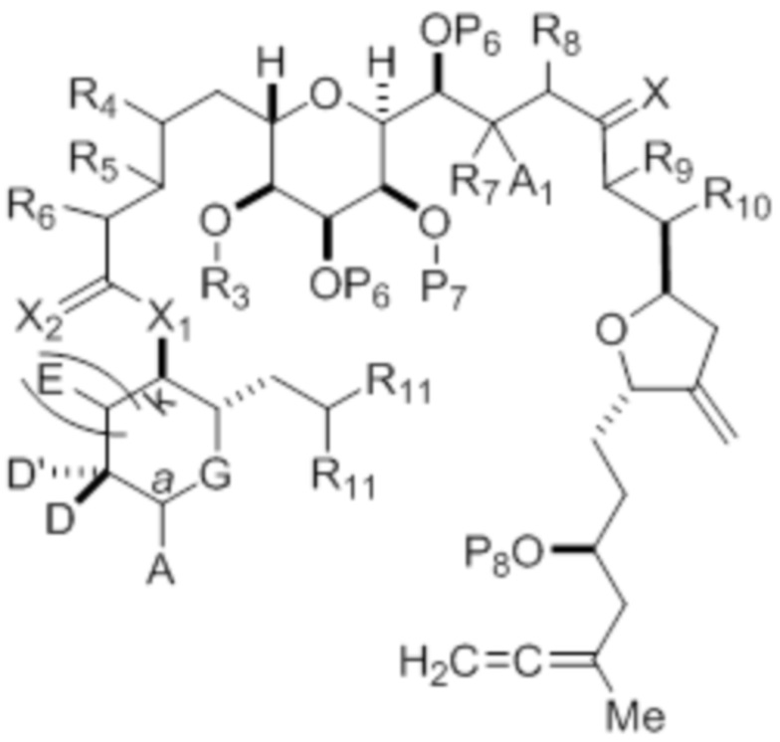 (IA),
(IA),
где
а представляет собой стереогенный центр,
каждый из D и D' независимо представляет собой H или OP1 при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой C1-12 алкил; и A представляет собой группу формулы (1):
 (1),
(1),
где
L представляет собой -(CH(OP2))-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
R2 представляет собой -(CH2)nOP5, где P2 представляет собой гидроксилзащитную группу, и P5 представляет собой гидроксилзащитную группу;
E представляет собой C1-12 алкил;
G представляет собой O;
n равен 0 или 2;
k равен 0 или 1;
X1 представляет собой -CH2- или -O-;
X2 представляет собой =O;
Y представляет собой SO2RC, где RC представляет собой C6-20 арил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H;
A1 представляет собой H, и:
(а) P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H;
каждый P6 независимо представляет собой гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; и каждый R11 представляет собой -OP10, где P10 представляет собой C1-12 алкил;
R9 представляет собой H или Y, и R10 представляет собой H; и
P8 представляет собой SiR3, где каждый R независимо представляет собой C1-12 алкил;
каждая гидроксильная защитная группа вместе с атомом кислорода, к которому каждая присоединена, независимо представляет собой сложный эфир структуры -OCOR, где R представляет собой C6-20 арил; или простой эфир структуры –OR, где R представляет собой (C6-15 арил, замещенный нитро)(C1-6 алкил), три(C1-6 алкил)силил или ди(C6-10 арил)(C1-6 алкил)силил.
18. Соединение формулы (IB):
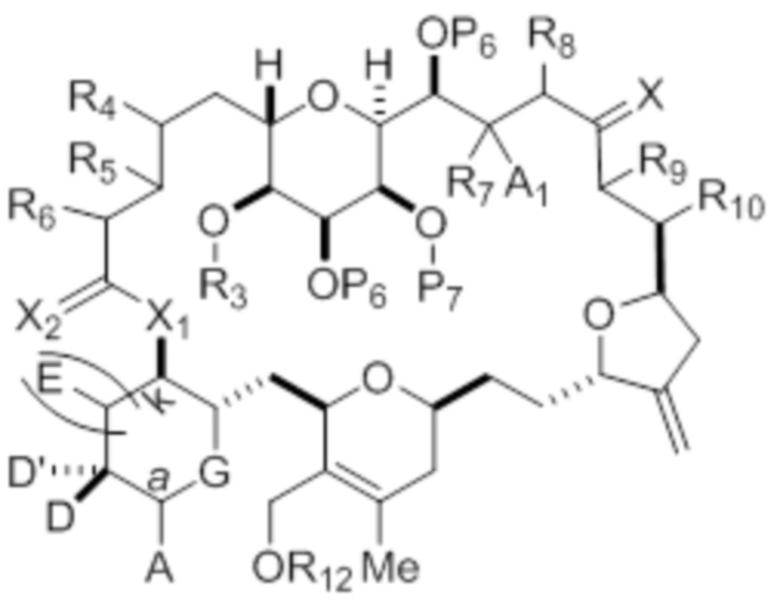 (IB)
(IB)
где
а представляет собой стереогенный центр;
каждый из D и D' независимо представляет собой H или OP1 при условии, что только один из D и D' представляет собой OP1, где P1 представляет собой C1-12 алкил; и A представляет собой группу формулы (1):
 (1),
(1),
где
L представляет собой -(CH(OP2))-;
R1 представляет собой H, или R1 и P1 объединены с формированием связи;
R2 представляет собой -(CH2)nOP5, где P2 представляет собой гидроксилзащитную группу, и P5 представляет собой гидроксилзащитную группу;
E представляет собой C1-12 алкил;
G представляет собой O;
n равен 0 или 2;
k равен 0 или 1;
X1 представляет собой -CH2- или -O-;
X2 представляет собой =O;
Y представляет собой SO2RC, где RC представляет собой необязательно замещенный C6-20 арил;
R3 и R5 объединены с формированием связи, и каждый из R4 и R6 представляет собой H;
A1 представляет собой H, и:
(a) P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи;
или
(b) P7 и R7 объединены с формированием связи, и R8 представляет собой H;
(i) каждый P6 независимо представляет собой H или гидроксилзащитную группу; X представляет собой =O или X объединен вместе с атомом углерода, к которому он присоединен, с формированием -(CH(OP9))-, где P9 представляет собой H; или
(ii) оба P6 и X объединены вместе с атомами, к которым каждый из них присоединен, с формированием –O–CR2–O–, где один R представляет собой связь с атомом углерода, к которому присоединен R8, а другой R представляет собой связь с атомом углерода, к которому присоединен R9, P7 и R7 объединены с формированием связи, и R8 представляет собой H;
R9 представляет собой H или Y, и R10 представляет собой H; и
R12 представляет собой-C(O)R, где R представляет собой C1-12 алкил, замещенный C1-12 алкокси; и где
каждая гидроксильная защитная группа вместе с атомом кислорода, к которому каждая присоединена, независимо представляет собой сложный эфир структуры -OCOR, где R представляет собой C6-20 арил; или простой эфир структуры –OR, где R представляет собой (C6-15 арил, замещенный нитро)(C1-6 алкил), три(C1-6 алкил)силил или ди(C6-10 арил)(C1-6 алкил)силил.
19. Соединение по п. 17 или 18, где R9 представляет собой H.
20. Соединение по п. 17 или 18, где P6 представляет собой гидроксилзащитную группу.
21. Соединение по любому из пп. 17-20, где стереогенный центр, обозначаемый как a, представляет собой (R), и А представляет собой следующую структуру
 .
.
22. Соединение по любому из пп. 17-21, где k равен 0, и X1 представляет собой -CH2-.
23. Соединение по любому из пп. 17-22, где R2 представляет собой -(CH2)nOP5, где n равен 0.
24. Соединение по любому из пп. 17-20, где A и D объединены с формированием следующей структуры:
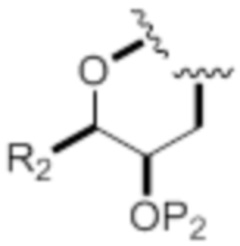 ,
,
где связь с атомом кислорода возникает по атому углерода, к которому D присоединен в формуле (IA), и
где R2 представляет собой -(CH2)nOP5, где n равен 2.
25. Соединение по п. 24, где k равен 1, и E представляет собой метил.
26. Соединение по п. 24 или 25, где X1 представляет собой -O-.
27. Соединение по любому из пп. 17-26, где R7 и P7 объединены с формированием связи, и R8 представляет собой H.
28. Соединение по любому из пп. 17-26, где P7 представляет собой гидроксилзащитную группу, и R7 и R8 объединены вместе с атомами, к которым каждый из них присоединен, с формированием двойной связи.
29. Соединение, выбранное из группы, состоящей из:
 ,
,  ,
,  ,
, 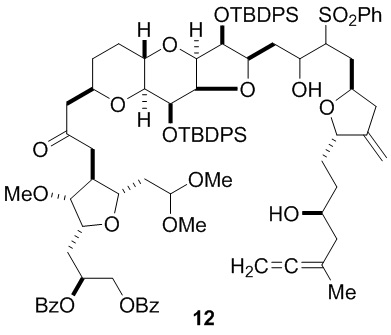 ,
, 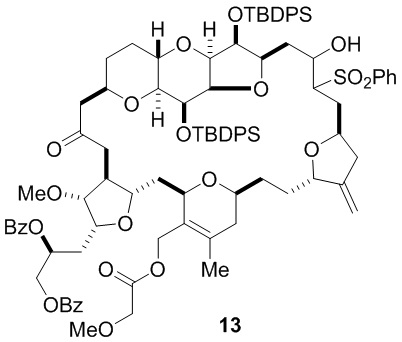 ,
, 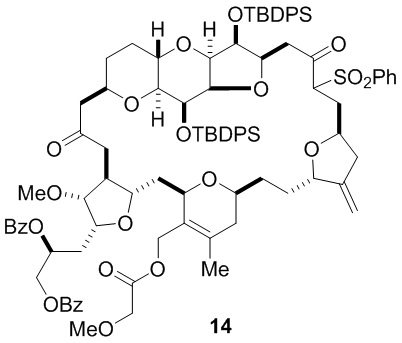 ,
, 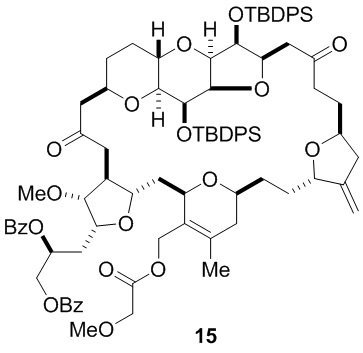 ,
, 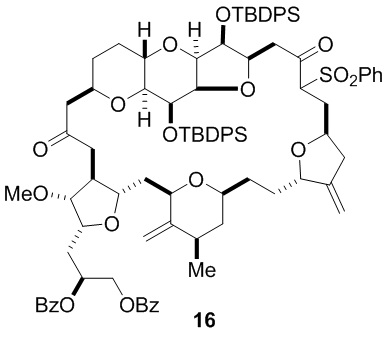 ,
, 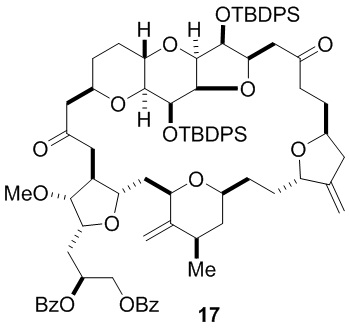 ,
, 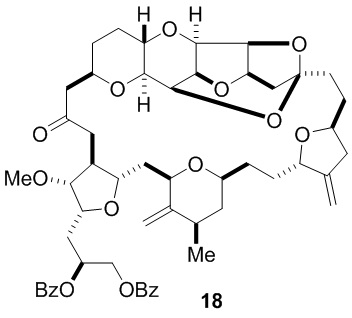 ,
, 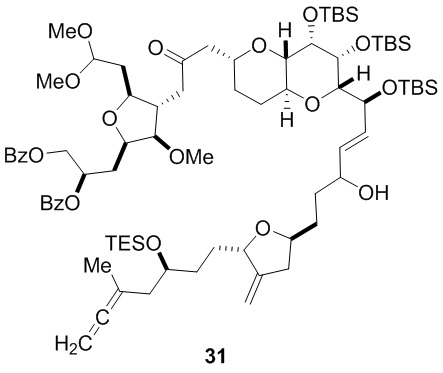 ,
, 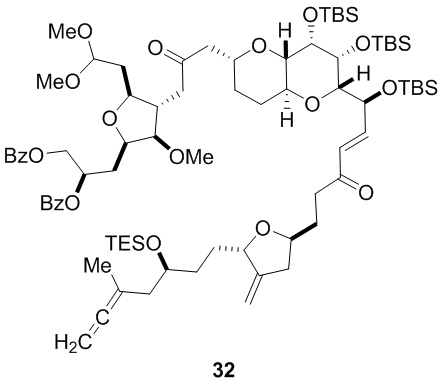 ,
, 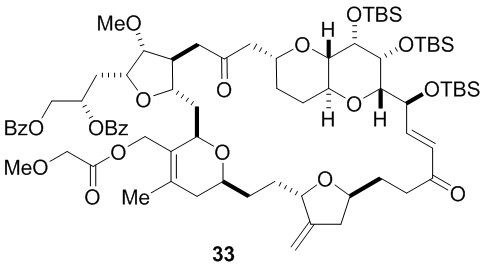 ,
,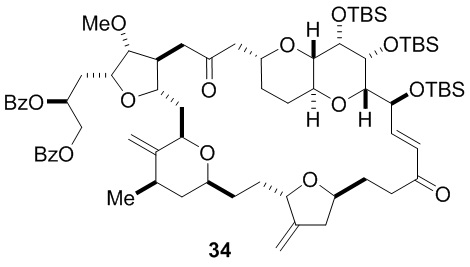 ,
, 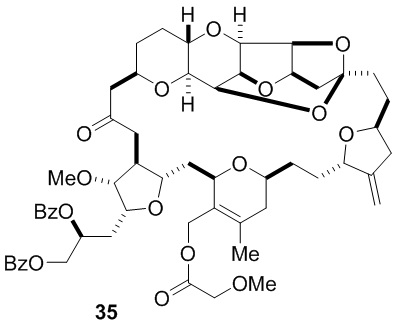 ,
, 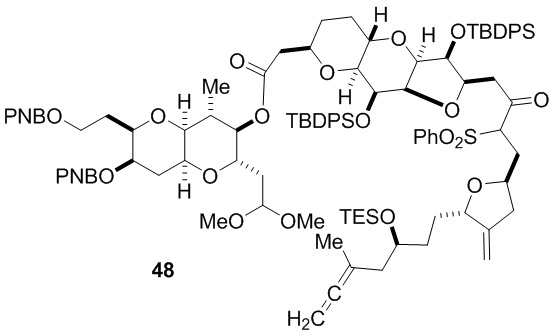 ,
, 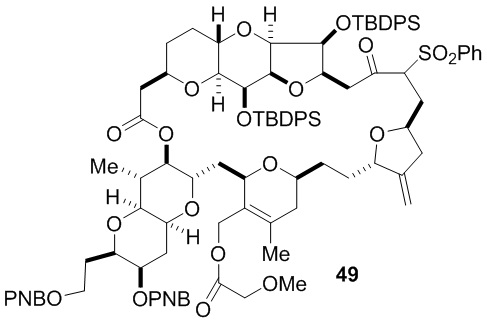 ,
,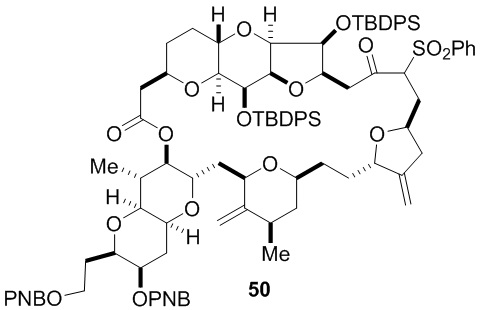 ,
, 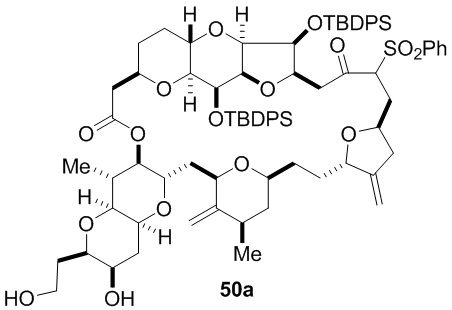 и
и  .
.
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| В.И | |||
| Исагулянц и др | |||
| "Конденсация ненасыщенных соединений с формальдегидом (реакция Принса)" Успехи химии, 1968, Том 37, Номер 1, Страницы 61-77. | |||
Авторы
Даты
2022-08-11—Публикация
2017-06-30—Подача