Настоящее изобретение относится к области инженерных технологий в области медицины и пищевой промышленности. Разработанная микрофлюидная система может применяться в био-, пищевых и медицинских технологиях, в частности, для проведения быстрого ПЦР (полимеразная цепная реакция) анализа пробы или контроля качества пищевой продукции, а также клинических анализов проб пациента в амбулаторных условиях.
На сегодняшний день для обнаружения патогенов используются различные методы, основанные на оптических и электрохимических принципах [Acharya N, et al. (2006) Complex formation with Rev1 enhances the proficiency of Saccharomyces cerevisiae DNA polymerase zeta for mismatch extension and for extension opposite from DNA lesions. Mol Cell Biol 26(24):9555-63], [Labib M, Zamay AS, Kolovskaya OS, Reshetneva IT, Zamay GS, Kibbee RJ, Sattar SA, Zamay TN, Berezovski MV. Aptamer-based viability impedimetric sensor for bacteria. Anal Chem. 2012 Nov 6;84(21):8966-9. doi: 10.1021/ac302902s. Epub 2012 Oct 22. PMID: 23075417.], [Pandey, Prachi, Vadivelmurugan Irulappan, Muthukumar V. Bagavathiannan, and Muthappa Senthil-Kumar. "Impact of Combined Abiotic and Biotic Stresses on Plant Growth and Avenues for Crop Improvement by Exploiting Physio-Morphological Traits." Frontiers in Plant Science 8, no. April (2017): 1-15. https://doi.org/10.3389/fpls.2017.00537].
Стоит отдельно отметить такой метод детекции любых молекул и даже их следовых количеств в различных композициях, как поверхностно-усиленная Рамановская спектроскопия. Данный метод позволяет проводить детекцию молекул без использования дополнительных маркерных соединений. Кроме того, нет необходимости в проведении полимеразной реакции, тк используемые приборы позволяют детектировать очень низкие концентрации целевых молекул. Главным и существенным недостатком этого метода является длительность проведения анализа, дороговизна, сложность и крупногабаритность используемого оборудования, которое абсолютно исключает возможность использования этого метода для проведения портативного анализа.
ПЦР-диагностика является одним из наиболее широко применяемых методов и рутинным методом, используемым в клинической практике. Данный метод удобен тем, что для анализа требуется небольшой объем пробы и реагентов, а полученные результаты позволяют точно определить присутствие патогена. Однако высокая специфичность данного метода позволяет выявлять только ограниченное количество патогенов в пробе, т.е. метод отличается высокой точностью, но низкой универсальностью. Применение мультиплексной ПЦР частично решает проблему универсальности, однако требует сложного протокола проведения реакции. Дополнительно, метод ПЦР-диагностики имеет ряд ограничений, не позволяющих использовать ПЦР-диагностику более широко, например, в клиниках, расположенных на удаленных территориях или в передвижных лабораториях. К таким ограничениям относятся необходимость организации дорогостоящих и габаритных ПЦР-боксов, поддержание высокого класса биологической чистоты лабораторных помещений, а также безусловной высокой квалификации обслуживающего персонала. Эти требования связаны прежде всего с необходимостью предварительной пробоподготовки, трудоемкостью и времязатратностью проведения ПЦР-анализа генетического материала и сопряжены с дороговизной необходимого лабораторного оборудования. Для предотвращения заражения в лабораториях вводится особый режим работы и предписывается проведение регулярной дезинфекции помещений и оборудования.
В настоящее время существуют решения по автоматизации и упрощению отдельных стадий ПЦР, таких как смешение жидкостей [Патент РФ №2019131465, 07.10.2019. Микрофлюидный чип смешения // Патент России №2724254. 2019. Бюл №18. / Эпштейн О.П., Тарасов С.А., Никифорова М.В., Сарбашев К.А.] выделение ДНК [Mahalanabis M. и др. An integrated disposable device for DNA extraction and helicase dependent amplification // Biomed. Microdevices. 2010. T. 12. №2. C. 353-359], очистки [Патент РФ №2008138958/13 01.10.2008. Сменный микрофлюидный модуль для автоматизированного выделения и очистки нуклеиновых кислот из биологических образцов и способ выделения и очистки нуклеиновых кислот с его использованием // Патент России №2380418. 2010. Бюл №3./ Ходаков Д.А., Мамаев Д.Д., Филатов И.В., и др.]; и стадий манипуляции генетическим материалом, вплоть до оценки результата проведенного теста [Liu P., Mathies R. A. Integrated microfluidic systems for high-performance genetic analysis // Trends Biotechnol. 2009. T. 27. №10. C. 572-581]. Однако, предложенные решения пока не позволяют полной интеграции всех стадий анализа на одной платформе, сложны в эксплуатации или неприменимы в полевых условиях в силу необходимости оснащения самой платформы дополнительным лабораторным оборудованием для обеспечения движения жидкости по платформе (например, шприцевые инфузионные насосы, пневмонасосы или клапана, магнитные клапана), прецизионного термоциклирования образца (настольные амплификаторы), а также непосредственно детекции протекания реакции (установка для электрофореза и УФ спектрометр). Одним из существующих способов интеграции стадий ПЦР-реакций на единой платформе является концепция "лаборатории на чипе" (lab-on-a-chip / lab-on-a-board, lab-on-a-disc). Подобные устройства/платформы изготовлены на базе микрофлюидного картриджа. Микрофлюидика и такой ее раздел как лаборатории на чипе - научное направление, занимающееся миниатюризацией химических и биологических аналитических методов и приборов. Перемещение жидкостей по каналам обычно осуществляется либо за счет капиллярных сил, явно выраженных в миниатюрных микроканалах, либо за счет искусственно вызванной в них разницы давлений (подачи жидкостей под давлением с использованием шприцевых инфузионных насосов или пневматических контроллеров давления). Преимуществом таких систем является сокращение расхода дорогостоящих реагентов за счет сокращения объемов, необходимых для проведения ПЦР-анализа и детекции, а также упрощенное обращение с малыми количествами жидкости. Подобные диагностические платформы позволяют свести к минимуму влияние человеческого фактора, халатной кросс-контаминации образца и риск заражения обслуживающего персонала, проводящего анализ, а также позволяет использовать такого рода устройства в экспресс-диагностике в непосредственной близости от пациента или предмета исследования (point-of-care diagnostics) и полностью исключает необходимость транспортировки и хранения пробы (сокращение логистической цепочки и ускорения времени постановки диагноза до часов в сравнении с днями).
В научной литературе и патентных архивах существует огромное количество технологий изготовления и конструкций микрофлюидных систем, позволяющих проводить некоторые стадии ПЦР-диагностики выделение, сорбцию и десорбцию ДНК, амплификацию [Mahjoob S., Vafai K., Beer N.R. Rapid microfluidic thermal cycler for polymerase chain reaction nucleic acid amplification // Int. J. Heat Mass Transf. 2008. T. 51. №9-10. C. 2109-2122], [Ahrberg C.D., Manz A., Chung B.G. Polymerase chain reaction in microfluidic devices // Lab Chip.2016. T. 16. №20. C. 3866 3884], гибридизацию и осуществлять анализ результатов теста на компактном носителе [Lui С, Cady N.C., Batt С.A. Nucleic acid-based detection of bacterial pathogens using integrated microfluidic platform systems., 2009. 3713-3744 c], [Khandurina J. и др. Integrated System for Rapid PCR-Based DNA Analysis in Microfluidic Devices // Anal. Chem. 2000. T. 72. №13. C. 2995-3000].
Однако, основной проблемой существующих устройств является необходимость использования дополнительного внешнего оборудования, такого как инфузионный насос, амплификатор и трудоемкой детекции положительного ПЦР-результата при помощи установки для электрофореза или УФ спектрометра. Однако применение такого большого числа трудоемких и чувствительных методов в практике походных условий и амбулаторного анализа затруднительно. В результате получаются большие и дорогие приборы, еще менее доступные, чем устройства для ПЦР в реальном времени.
Помимо необходимости подключения внешних лабораторных устройств для проведения анализа одной из основных проблем микрофлюидных устройств является диффузионное ограничение перемешивания химических реактивов, вызванное ламинарным характером течения жидкости в небольших микроканалах. Для осуществления перемешивания задействуются длинные каналы в форме меандра, что ведет к вынужденному увеличению объема пробы и реагентов, необходимых для проведения анализа. Существуют концепции искусственного создания завихрений внутри жидкостного потока, целью которых является ускорение перемешивания. Подобные завихрения могут осуществляться посредством создания различных препятствий, бороздок [Chang, С., Yang, R. Electrokinetic mixing in microfluidic systems. Microfluid Nanofluid 3, 501-525 (2007)] и прочих микронеровностей дна микроканалов [Nguyen N-T, Wu Z. Micromixers - a review. J Micromechanics Microengineering. 2005;15(2)]; [L. Capretto, W. Cheng, M. Hill, and X. Zhang, Top Curr Chem V. 304, pp. 27-68 (2011)], а также обратной циркуляции жидкости [Nivedita, N., Ligrani, P. & Papautsky, I. Dean Flow Dynamics in Low-Aspect Ratio Spiral Microchannels. Sci Rep 7, 44072 (2017)]; [Daniel Ahmed, Xiaole Mao, Bala Krishna Juluri and Tony Jun Huang, Microfluid Nanofluid V. 7, pp. 727-731 (2009)] [Ward, K., & Fan, Z.H. (2015). Mixing in microfluidic devices and enhancement methods. Journal of Micromechanics and Microengineering, 25(9), 094001. doi:10.1088/0960-1317/25/9/094001]. Подобные инженерные конструкционные решения позволяют сократить объем и время, необходимые для перемешивания реагентов, но не способны полностью избавить от проблемы возникновения при этом, так называемого "мертвого объема" (death volume), то есть объема реагентов, остающихся в микроканалах и не задействованных непосредственно в протекании реакции.
Отдельное внимание следует уделить микрофлюидным клапанам. Существует большое количество концепций систем многослойных клапанов, обеспечивающих управление течением жидкостью внутри микрофлюидных платформ. Зачастую они основаны на изгибании мембраны из гибкого материала, перекрывающей течение жидкости в канале, под внешним воздействием системы дополнительных пневматических клапанов, внешних винтов и/или магнитного поля [Park, J. and Park, J.-K. (2019). Integrated microfluidic pumps and valves operated by finger actuation. Lab on a Chip, 18, doi: 10.1039/C9LC00422J] [Chen, D., Mauk, M., Qiu, X., Liu, C., Kim, J., Ramprasad, S., et al. (2010). An integrated, self-contained microfluidic cassette for isolation, amplification, and detection of nucleic acids. Biomedical Microdevices, 12(4), 705-719. doi:10.1007/s10544-010-9423-4] [Le, T.N., Nguyen, V.-A., Bach, G.L., Tran, L.D., & Cao, H.H. (2020). Design and Fabrication of a PDMS-Based Manual Micro-Valve System for Microfluidic Applications. Advances in Polymer Technology, 2020, 1-7. doi: 10.1155/2020/2460212] [Chen, C.-Y., Chen, C.-H., Tu, T.-Y., Lin, C.-M., & Wo, A.M. (2011). Electrical isolation and characteristics of permanent magnet-actuated valves for PDMS microfluidics. Lab Chip, 11(4), 733-737. doi:10.1039/c01c00415d] [Yang, R.-J., Hou, H.-H., Wang, Y.-N., & Fu, L.-M. (2016). Micro-magnetofluidics in microfluidic systems: A review. Sensors and Actuators B: Chemical, 224, 1-15. doi:10.1016/j.snb.2015.10.053]. Функционирование подобных конструкций не является пассивным и требует источников внешнего воздействия (пневматических насосов, источников сжатого воздуха, сильного магнитного поля), что значительно усложняет общую конструкцию системы и лишает ее автономности и портативности. Проведенный обзор известных решений однозначно свидетельствует о большом разнообразии конструкций и систем для манипулирования движением и перемешиванием жидкости внутри микрофлюидной платформы, однако данные конструкции диагностических ПЦР-устройств не могут быть воплощены в портативном формате и для своей работы требуют дополнительного лабораторного оборудования. Это свидетельствует о необходимости создания новой конструкции и метода перемешивания, позволяющих проводить полный цикл ПЦР-диагностики на единой платформе с минимальным расходом химических реагентов на удаленных территориях, вне стен оснащенных лабораторий.
В данной патентной заявке представлены к рассмотрению метод активного перемешивания многокомпонентной реакционной смеси и необходимая для его функционирования система микрофлюидных клапанов, каналов и реакционных камер. Основой предлагаемой методики является использование полифазных магнитных микрочастиц магнетита и гетита, помещенных во вращательное магнитное поле, для активного перемешивания двух и более компонентной смеси. Для проведения перемешивания требуются непосредственно взвесь магнитных частиц исходя из соотношения 20 мкл взвеси частиц на 300 мкл перемешиваемой смеси, а также система микрофлюидных клапанов и камер с гибкими мембранами, препятствующая неконтролируемому течению жидкости. Преимуществом патентуемого микрофлюидного устройства являются не только активное перемешивание магнитными частицами без создания дополнительного мертвого объема (продемонстрированого ранее в [Chong, W.H., Chin, L.K., Tan, R.L.S., Wang, H., Liu, A.Q., & Chen, H. (2013). Stirring in Suspension: Nanometer-Sized Magnetic Stir Bars. Angewandte Chemie International Edition, 52(33), 8570-8573. doi:10.1002/anie.201303249] [Kitenbergs, G.,  , K., Perzynski, R., & Cebers, A. (2015). Magnetic particle mixing with magnetic micro-convection for microfluidics. Journal of Magnetism and Magnetic Materials, 380, 227-230. doi: 10.1016/j.jmmm.2014.10.033] [Yang, R.-J., Hou, H.-H., Wang, Y.-N., & Fu, L.-M. (2016). Micro-magnetofluidics in microfluidic systems: A review. Sensors and Actuators B: Chemical, 224, 1-15. doi:10.1016/j.snb.2015.10.053] [Van Reenen, A., de Jong, A. M., den Toonder, J. M. J., & Prins, M. W. J. (2014). Integrated lab-on-chip biosensing systems based on magnetic particle actuation - a comprehensive review. Lab Chip, 14(12), 1966-1986. doi:10.1039/c31c51454d] [Seung Hwan Lee, Danny van Noort, Ji Youn Lee, Byoung-Tak Zhang and Tai Hyun Park (2009). Effective mixing in a microfluidic chip using magnetic particles. Lab Chip, 9(3), 479-482. doi: 10.1039/b814371d]), но и одновременная с перемешиванием сорбция ДНК непосредственно на перемешивающих образец и реакционную смесь магнитных микрочастицах; выполнение сразу двух функций (активного перемешивания и сорбции ДНК) одновременно является отличительной особенностью и преимуществом патентуемого метода. В заявляемой платформе используется эффективный метод визуализации нуклеиновых кислот-мишеней с помощью изменяющих свою окраску ДНКзимов (дезоксирибозимов). Они способны распозновать определенные последовательности генов или мРНК и обладают максимальной эффективностью с минимумом побочных эффектов [Lyalina, Tatiana A., Ekaterina A. Goncharova, Nadezhda Y. Prokofeva, Ekaterina S. Voroshilina, and Dmitry M. Kolpashchikov. "A DNA Minimachine for Selective and Sensitive Detection of DNA." Analyst 144, no. 2 (2019): 416-20]. Отсутствие высоких требований к квалификации персонала, а также портативность финального устройства являются отличительными особенностями патентуемой микрофлюидной платформы, позволяющей проводить полный цикл ПЦР-анализа.
, K., Perzynski, R., & Cebers, A. (2015). Magnetic particle mixing with magnetic micro-convection for microfluidics. Journal of Magnetism and Magnetic Materials, 380, 227-230. doi: 10.1016/j.jmmm.2014.10.033] [Yang, R.-J., Hou, H.-H., Wang, Y.-N., & Fu, L.-M. (2016). Micro-magnetofluidics in microfluidic systems: A review. Sensors and Actuators B: Chemical, 224, 1-15. doi:10.1016/j.snb.2015.10.053] [Van Reenen, A., de Jong, A. M., den Toonder, J. M. J., & Prins, M. W. J. (2014). Integrated lab-on-chip biosensing systems based on magnetic particle actuation - a comprehensive review. Lab Chip, 14(12), 1966-1986. doi:10.1039/c31c51454d] [Seung Hwan Lee, Danny van Noort, Ji Youn Lee, Byoung-Tak Zhang and Tai Hyun Park (2009). Effective mixing in a microfluidic chip using magnetic particles. Lab Chip, 9(3), 479-482. doi: 10.1039/b814371d]), но и одновременная с перемешиванием сорбция ДНК непосредственно на перемешивающих образец и реакционную смесь магнитных микрочастицах; выполнение сразу двух функций (активного перемешивания и сорбции ДНК) одновременно является отличительной особенностью и преимуществом патентуемого метода. В заявляемой платформе используется эффективный метод визуализации нуклеиновых кислот-мишеней с помощью изменяющих свою окраску ДНКзимов (дезоксирибозимов). Они способны распозновать определенные последовательности генов или мРНК и обладают максимальной эффективностью с минимумом побочных эффектов [Lyalina, Tatiana A., Ekaterina A. Goncharova, Nadezhda Y. Prokofeva, Ekaterina S. Voroshilina, and Dmitry M. Kolpashchikov. "A DNA Minimachine for Selective and Sensitive Detection of DNA." Analyst 144, no. 2 (2019): 416-20]. Отсутствие высоких требований к квалификации персонала, а также портативность финального устройства являются отличительными особенностями патентуемой микрофлюидной платформы, позволяющей проводить полный цикл ПЦР-анализа.
Заявляемый метод и конструкция были продемонстрированы на примере детекции патогенов семейства Enterobacteriaceae (E. coli), которые могут быть расширены для анализа широкого спектра инфекционных заболеваний, стандартизировано детектируемых при помощи ПЦР-анализа, в разрезе персонализированной медицины и экспресс диагностики в пищевом производстве. Новизна предлагаемого аналитического концепта связана с нетривиальным подходом и новой концепцией быстрой и надежной диагностики опасных для здоровья человека микроорганизмов (патогенов), включающей использование высоко специфичных и чувствительных бинарных дезоксирибозимных сенсоров и интеграцию всех этапов анализа биологического материала в единое компактное микрофлюидное устройство. Благодаря применению данного метода разобщенные во времени и пространстве этапы (выделение нуклеиновых кислот из биологических образцов, амплификацию генов мишеней и детекцию продуктов амплификации при использовании бинарных дезоксирибозимных сенсоров) могут быть интегрированы в одном портативном устройстве и может быть создан компактный, портативный и высокочувствительный инструмент для диагностики инфекционных заболеваний, как в клинических, так и в условиях передвижных медицинских, пищевых и прочих биотехнологических лабораторий. Это позволит значительно повысить точность и скорость мониторинга энтеробактерий в продуктах питания и различном сырье, постановки диагноза, а также качество предоставляемых медицинских услуг в удаленных регионах и сложных походных условиях, и в этой связи повысить выявляемость и даже уменьшить смертность от таких инфекционных и вирусных заболеваний как менингит Neisseria meningitidis, MRSA S. aureus мультирезистивный стафилококк, гонорея Neisseria gonohrrea и прочие.
Заявляемый способ активного перемешивания и проведения ПЦР-анализа характеризуется следующими свойствами, которые могут быть расценены как технический результат:
1. Метод активного перемешивания при помощи магнитных частиц без задействования длинных диффузионных каналов позволяет значительно сократить объем дорогостоящих реагентов и сократить "мертвого" объем реагентов на более чем 20* % от общего объема использованных реагентов.
*расчетное значение при условии использования микроканалов в форме меандра, длинной в 40 мм, необходимой для осуществления диффузионного перемешивания (Рис. 2 (а) показывает сравнительные геометрические размеры двух типов микрофлюидных систем).
2. Методика одновременных перемешивания и сорбции ДНК является универсальной, и позволяет проводить перемешивание любых жидкостей с вязкостью до 4⋅10-3 Па⋅с, а также одновременную сорбцию ДНК на поверхности магнитных микрочастиц.
3. В конструкции заявляемой микрофлюидной платформы передзагружены жидкости (раствор для выделения ДНК, реакционная камера с помещенным в нее сорбирующим материалом, раствор для амплификации), необходимые для интегрирования четырех стадий ПЦР-анализа (выделение ДНК, очистка ДНК, амплификация и оптический анализ) в единую тест-систему на основе одноразового микрофлюидного картриджа, управление течением жидкости в котором осуществляется посредством нажатия на гибкие мембраны.
4. Методика активного перемешивания и заявляемая микрофлюидная платформа просты в эксплуатации.
5. При задействовании заявляемой микрофлюидной платформы длительность проведения ПЦР-анализа от забора пробы до получения результата составляет не более 2,5 часов.
6. Детекция наличия биологических патогенов в пробе подтверждается визуально по изменению цвета раствора с прозрачного на коричневатый.
7. Заявленная методика теста может быть применена как в условиях стационарных лаборатории, так и в полевых условиях передвижных лабораторий и клиник.
В конструкции заявленной аналитической системы проведено интегрирование четырех стадий анализа (выделение ДНК, очистка ДНК, амплификация и оптический анализ) в единую тест-систему на основе одноразового микрофлюидного картриджа, управление течением жидкости, в котором осуществляется посредством нажатия оператора на гибкие мембраны, детекция наличия биологических патогенов в пробе подтверждается визуально по изменению цвета раствора. Предлагаемая аналитическая платформа позволит минимизировать объем используемых реагентов и сократить время манипуляции образцами, что, как следствие, позволит снизить возможность загрязнения образцов и контаминацию лаборатории или помещения, в котором проводится анализ, ДНК патогенных образцов. Риск заражения персонала при этом сведен к минимуму или полностью отсутствует. Это позволит увеличить надежность и биологическую безопасность теста, а также значительно снизить стоимость проведения подобных анализов.
Список изображений:
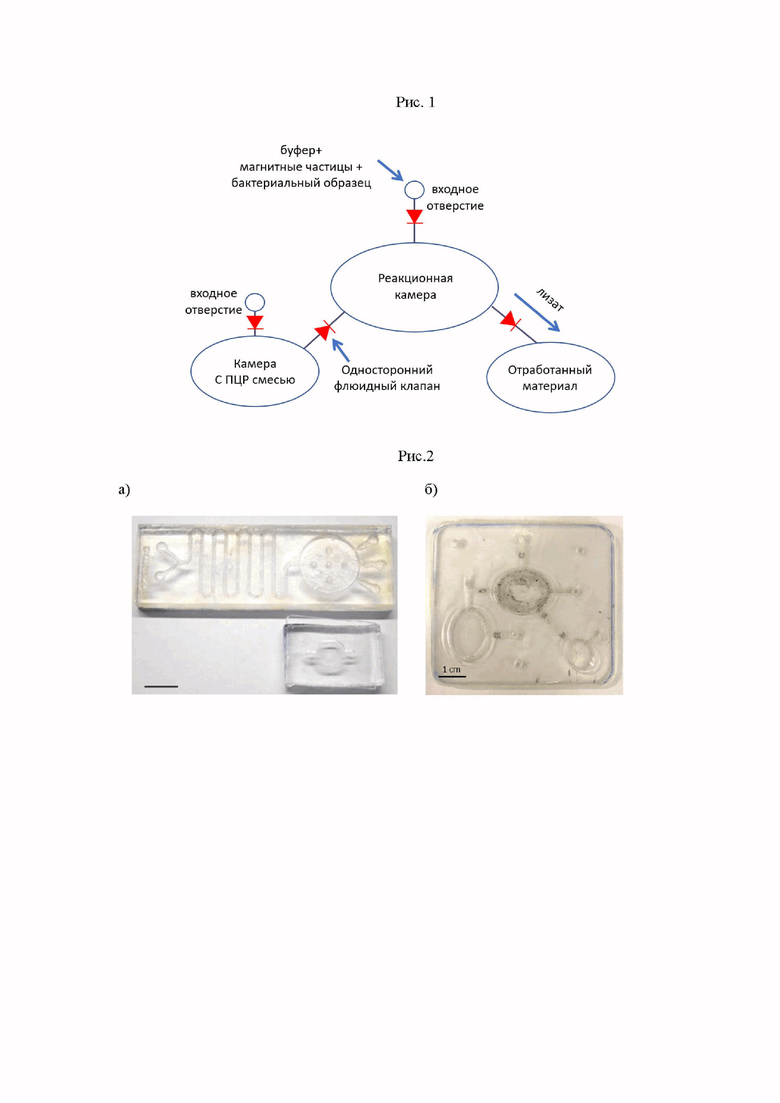
Рис. 1. Принципиальная схема устройства микрофлюидной платформы с указанием необходимых камерами для проведения пробоподготовки и непосредственно ПЦР-анализа.
Рис. 2.
(а) Сравнение геометрических размеров микрофлюидных платформ, эксплуатирующих метод диффузионного перемешивания с каналами в форме меандров (вверху) и реакционной камеры с активным перемешиванием магнитными частицами во вращающемся магнитном поле и мертвым объемом, сведенным к минимуму (внизу);
(б) Фотография реальной автономной микрофлюидной платформы для активного перемешивания реагентов при помощи интеграции магнитных частиц в центральную реакционную камеру, оснащенная системой односторонних клапанов, управляемых оператором посредством нажатия пальцем на гибкие мембраны.
Рис. 3 Конструкция пассивного одностороннего микрофлюидного клапана, пропускающего жидкость строго в одном направлении и представляющего из себя многослойную конструкцию (1), состоящую из двух жестких заготовок из полиметилметакрилата (ПММА, прозрачные) и гибкой мембраны из полидиметилсилоксана (ПДМС) с прорезями (помечена красным).
(2) - Общий вид клапана после склейки, присоединенного к реакционной камере и пропускающего жидкость строго в одном направлении.
(3)-(5) - Схема перекачивания жидкости посредством нажатия на гибкую мембрану реакционной камеры сначала по нижней заготовке ПММА, изгибание гибкой мембраны (3, выноска), перетекание жидкости в верхнюю заготовку ПММА (4) и возвращение жидкости в нижнюю заготовку через сквозное отверстие в мембране (5). Повышение давления с обратной стороны клапана вдавливает гибкую мембрану в стопор в нижней заготовке и клапан остается закрытым.
Рис. 4. Демонстрация работы и фотография системы, схематично представленной на Рис. 3: нажатие оператором на гибкую мембрану реакционной камеры приводит к повышению давления в системе и выдавливанию жидкости в каналы микрофлюидного клапана. Микрофлюидный клапан работает по типу флюидного "диода", пропуская жидкость только в одном направлении.
Рис. 5.
(а) Визуализация морфологии микрочастиц магнетита при помощи сканирующего электронного микроскопа, используемых для метода активного перемешивания.
(б) Демонстрация магнитной активности синтезированных магнитных микрочастиц магнетита.
Рис. 6.
(а) Пример вращения магнитных частиц в реакционной камере при скорости вращения магнитного поля в 2500 об/мин; (б) осаждение и концентрация магнитных микрочастиц внутри реакционной камеры при помощи постоянного магнита.
Рис. 7. Демонстрация протекания стадии детекции и качественного изменения цвета жидкости при наличии патогена E. Coli в пробе (положительной реакции) с прозрачного (нет цвета) на светло-коричневый.
Примеры
1. Выявление инфицирования пробы Е. Coli
Схема используемой микрофлюидной платформы приведена на Рис. 1 и Рис. 2 (б). Она содержит камеры и каналы с гибкой мембраной, в которых уже находится соответствующие аналитические жидкости (раствор для выделения ДНК, реакционная камера с помещенными в нее магнитными частицами, раствор для амплификации). Магнитные микрочастицы с гидродинамичексим радиусом порядка 2-6 μm (Рис. 5) в объеме 20 мкл помещаются в реакционную камеру объемом 300 мкл. Они используются для перемешивания реактивов и проб с вязкостью до 4⋅10-3 Па⋅с в микрофлюидных камерах, следуя за вращающимся магнитным полем (частота вращения >2000 об/мин и магнитная индукция порядка 300-500 мТл) они образуют турбулентные потоки внутри реакционной камеры, захватывая при движении слои жидкости (Рис 6 (а)). Перемешиваемые биологические и аналитические жидкости могут иметь любое происхождение (слюна, желудочный сок, моча, кровь и пр.).
При добавлении 150 мкл химического лизирующего буфера (0,25% раствора додецилсульфата натрия и 50 ммоль раствора гидроксида натрия), 150 мкл биологического образца и активного перемешивания в течение 10 мин при комнатной температуре происходит лизис (разрушение клеточной стенки бактерии и выделение ДНК) и сорбция ДНК на поверхности магнитных частиц. Управление течением жидкости происходит за счет нажатия оператором на гибкие мембраны толщиной 1 мм реакционной камеры и камеры с предзагруженными компонентами (лизирующая жидкость, ПЦР-смесь, этиловый спирт и пр.), Рис. 2 (б). Изгибаясь, мембрана создает дополнительное давление внутри камер, которое заставляет жидкости вытекать из камеры и попадать в систему микроканалов и клапанов. Это позволяет платформе работать при полном отсутствии внешних устройств, обеспечивающих дополнительное давление для манипулирования потоком (регуляторы давления или шприцевые насосы и пр.). Работа односторонних клапанов ("микрофлюидные диоды") продемонстрирована на Рис. 3 и Рис. 4 и обусловлена изгибом тонкой мембраны клапана из полидиметилсилоксана под воздействием внешнего давления и запиранием клапана при возвращении мембраны в исходное положение и приложении давления с обратной стороны.
После лизиса магнитные частицы удерживаются на дне реакционной камеры с помощью неодимового магнита (Рис. 6 (б)), а вся остальная жидкость сливается в камеру с отработанными реактивами с последующей промывкой частиц этанолом (300 мкл). Поскольку ДНК растворима в воде, десорбция ДНК была организована путем добавления 50 мкл дистиллированной воды в центральную реакционную камеру, с находящимися внутри микрочастицами.
Стадия циклической амплификации основывается на увеличении количества определенного участка гена, который будет детектирован в последующих стадиях. Для реализации данной стадии, необходимо поддержание определенных температурных режимов с определенными интервалами и последовательностями. Данные условия зависят от используемых в ходе реакции праймеров. В данном случае, температурные режимы, использованные для реакции амплификации: 95°С - 56°С - 72°С. Интервалы изменения и выдержки температур составляли: 95°С - 2 минуты, в качестве предварительного прогрева образца, далее 95°С - 15 секунд, 56°С - 30 секунд, 72°С - 50 секунд. Завершающей температурной стадией цикла является выдержка при температуре 72°С в течение 2 мин для закрепления формирования нового фрагмента. Описанный температурный цикл повторяется минимум 29 раз для достижения концентрации фрагмента ДНК, достаточного для детекции системами на основе дезоксирибозимных наномашин.
На последующей стадии детекции в реакционную камеру впрыскиваются гибридизационные зонды на основе дезоксирибозимов с высокой селективностью на основе последовательности генома E. coli (NC 004547) в объеме 50 мкл, которые специфично связываются с ампликонами ДНК кишечной палочки при помощи маркеров, и изменяют при этом цвет. Процедура детекции осуществляется путем наблюдения за изменением цвета от бесцветного (нет патогена) до коричневатого (присутствие бактерии в пробе в количестве, превышающем или равном пределу детекции), которое можно констатировать невооруженным глазом. Результат анализа будет качественным - изменение цвета будет указывать на наличие или отсутствие в биологическом образце определяемого патогена. Чувствительность проведения анализа >10 бактерий Е. coli в пробе. Пример результата проверки как в пробирке, так и на микрофлюидной платформе приведен на Рис. 7 (справа).
2. Подтверждение отсутствия контаминации пробы патогеном (Е. coli)
Схема теста идентична описанному в п. 1. При этом в результате теста после введения дезоксирибозимных сенсоров в реакционную камеру цвет и прозрачность содержимого камеры не изменяется (остается прозрачным, бесцветным). Пример результата проверки приведен на Рис. 7 (слева).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ С ОДНОВРЕМЕННОЙ ОЧИСТКОЙ НУКЛЕИНОВЫХ КИСЛОТ ИЗ НЕСКОЛЬКИХ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ | 2014 |
|
RU2595374C2 |
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| АВТОМАТИЗИРОВАННЫЙ ПРИБОР ДЛЯ ВЫДЕЛЕНИЯ, ОЧИСТКИ И АНАЛИЗА НУКЛЕИНОВЫХ КИСЛОТ МЕТОДОМ ПЦР-РВ | 2020 |
|
RU2784821C2 |
| УСТРОЙСТВО ДЛЯ АВТОМАТИЧЕСКОГО ВЫДЕЛЕНИЯ, ОЧИСТКИ И АМПЛИФИКАЦИИ УЧАСТКОВ ДНК Mycobacterium tuberculosis С РЕГИСТРАЦИЕЙ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2024 |
|
RU2837310C1 |
| УСОВЕРШЕНСТВОВАННАЯ КАССЕТА ДЛЯ ПРИМЕНЕНИИЯ ПРИ ДИАГНОСТИКЕ IN VITRO И СПОСОБ ЕЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2753866C1 |
| УНИВЕРСАЛЬНАЯ СИСТЕМА ПОДГОТОВКИ ОБРАЗЦОВ И ПРИМЕНЕНИЕ В ИНТЕГРИРОВАННОЙ СИСТЕМЕ АНАЛИЗА | 2010 |
|
RU2559541C2 |
| ОДНОРАЗОВЫЙ КАРТРИДЖ ДЛЯ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ И ИХ ПОСЛЕДУЮЩЕЙ АМПЛИФИКАЦИИ (ВАРИАНТЫ) | 2021 |
|
RU2768005C1 |
| МИКРОФЛЮИДНЫЙ КАРТРИДЖ ДЛЯ ДЕТЕКЦИИ БИОМОЛЕКУЛ | 2016 |
|
RU2663749C1 |
| Способ выявления ДНК микроорганизмов класса Mollicutes в крови и других биоматериалах методом ПЦР-РВ | 2023 |
|
RU2831277C1 |
| ОДНОРАЗОВЫЙ КАРТРИДЖ ДЛЯ ИЗОТЕРМАЛЬНОЙ АМПЛИФИКАЦИИ | 2022 |
|
RU2797710C1 |


Настоящее изобретение относится к области микрофлюидики, биотехнологии и медицины и может быть использовано для экспресс ПЦР-диагностики, в частности для установления факта инфекционного заражения пациента и контроля качества пищевой продукции в непосредственной близости к месту забора пробы и амбулаторно (point-of-care-diagnostics) путём детекции патогенов семейства Enterobacteriaceae. Платформа содержит микрофлюидные камеры, соединённые микрофлюидными каналами с расположенными в них клапанами. Микрофлюидные камеры, каналы и клапаны выполнены с гибкими мембранами, обеспечивающими возможность управления перемещением текучих сред за счет деформации указанных гибких мембран при нажатии на них пальцем оператора. Детекция наличия биологических патогенов в пробе подтверждается визуально по изменению цвета раствора. Микрофлюидная платформа обеспечивает выполнение четырех стадий анализа - выделение ДНК, очистку ДНК, амплификацию и оптический анализ в единой тест-системе на основе одноразового микрофлюидного картриджа. Система проста и надежна в реализации и обеспечивает получение результата в течение менее 3 часов после взятия пробы, может быть применена как в клинических лабораториях, так и в полевых условиях мобильных центров. Это позволит увеличить надёжность и биологическую безопасность ПЦР-теста, снизить стоимость проведения анализа. 2 н. и 5 з.п. ф-лы, 7 ил., 1 пр.
1. Автономная диагностическая микрофлюидная платформа для детекции патогенов семейства Enterobacteriaceae, содержащая
- по меньшей мере одну камеру с ПЦР-смесью, выполненную с возможностью приема и хранения по меньшей мере одного текучего реагента и/или текучей пробы;
- по меньшей мере одну реакционную камеру, выполненную с возможностью пропускать внутрь вращающееся магнитное поле и температурное воздействие, а также принимать золь магнитных микрочастиц магнетита и гетита, по меньшей мере один текучий реагент и/или текучую пробу;
- по меньшей мере одну камеру для отработанных материалов;
причем указанные микрофлюидные камеры выполнены с гибкими мембранами, обеспечивающими возможность управления перемещением текучих сред в микрофлюидной платформе за счет деформации указанных гибких мембран при нажатии на них оператором;
- систему микрофлюидных каналов, соединяющих указанные реакционную камеру, камеру с ПЦР смесью, камеру для отработанных материалов и выполненных с возможностью перемещения внутри них текучих сред при нажатии оператором на гибкие мембраны и выдавливании текучих сред из реакционной камеры, камеры с ПЦР-смесью или камеры для отработанных реагентов;
- по меньшей мере один микрофлюидный клапан, расположенный внутри микрофлюидного канала и присоединенный к реакционной камере;
- по меньшей мере один микрофлюидный клапан, расположенный внутри микрофлюидного канала между реакционной камерой и камерой с ПЦР-смесью и обеспечивающий прохождение текучих реагентов строго в одном направлении из камеры с ПЦР смесью в реакционную камеру;
- по меньшей мере один микрофлюидный клапан, расположенный внутри микрофлюидного канала между реакционной камерой и камерой для отработанного материала и обеспечивающий прохождение жидкости строго в одном направлении из реакционной камеры в камеру для отработанного материала;
причем указанные микрофлюидные клапаны представляют собой многослойную конструкцию, содержащую два жестких слоя и одну гибкую мембрану, изготовленную с возможностью открытия за счет деформации указанной гибкой мембраны при повышении давления внутри системы микрофлюидных каналов и самого клапана, вызванном нажатием оператором на гибкие мембраны микрофлюидных камер;
и характеризующаяся тем, что указанная микрофлюидная платформа выполнена с возможностью проведения таких стадий ПЦР-анализа текучей пробы как:
- перемешивание указанной текучей пробы и текучих реагентов непосредственно внутри реакционной камеры посредством захвата слоев текучей пробы и текучих реагентов упомянутыми магнитными микрочастицами магнетита и гетита, вращающимися во внешнем магнитном поле;
- выделение нуклеиновых кислот внутри хотя бы одной реакционной камеры в присутствии указанных магнитных микрочастиц магнетита и гетита;
- сорбция нуклеиновых кислот, высвободившихся в процессе разрушения клеточной стенки микроорганизмов, на поверхности указанных магнитных микрочастиц магнетита и гетита, проводимая внутри указанной реакционной камеры;
- десорбция нуклеиновых кислот внутри хотя бы одной реакционной камеры в присутствии указанных магнитных микрочастиц;
- амплификация;
- качественная визуальная детекция наличия патогена в пробе по изменению цвета содержимого реакционной камеры в присутствии нуклеиновых кислот патогенов, проводимая с задействованием дезоксирибозимов.
2. Микрофлюидная платформа по п. 1, где патоген семейства Enterobacteriaceae представляет собой Е. coli.
3. Микрофлюидная платформа по п. 1, выполненная с возможностью приема и хранения таких текучих реагентов, как лизирующая смесь, ПЦР-смесь, этиловый спирт, дистиллированная вода.
4. Микрофлюидная платформа по п. 1, в которой реакционная камера содержит золь магнитных частиц магнетита и гетита.
5. Микрофлюидная платформа по п. 1, выполненная с возможностью проведения анализа текучих проб с вязкостью до 4⋅10-3 Па⋅с.
6. Способ проведения ПЦР-анализа текучей пробы в диагностической микрофлюидной платформе по п. 1 для детекции патогенов семейства Enterobacteriaceae, содержащий следующие стадии:
а) в микрофлюидную платформу из внешней среды помещают лизирующую смесь, ПЦР-смеси и дистиллированную воду, в реакционную камеру помещают магнитные микрочастицы магнетита и гетита;
б) из внешней среды помещают текучую пробу в реакционную камеру микрофлюидной платформы;
в) через входной клапан внутрь реакционной камеры микрофлюидной платформы помещают лизирующую смесь;
г) наводят вращающееся магнитное поле и перемешивают текучие реагенты и текучую пробу внутри реакционной камеры посредством захвата слоев текучей пробы и текучих реагентов магнитными микрочастицами магнетита и гетита при их вращении в магнитном поле;
д) осуществляют сорбцию нуклеиновых кислот на поверхности упомянутых магнитных микрочастиц магнетита и гетита пассивно в процессе их вращения внутри смеси текучего реагента, золя магнитных микрочастиц и текучей среды пробы под действием наведенного вращающегося магнитного поля;
е) нажатием на гибкую мембрану реакционной камеры перемещают содержимое реакционной камеры в камеру для отработанного материала через выходной клапан микрофлюидной платформы и систему микрофлюидных каналов, причем указанные магнитные микрочастицы удерживают магнитным полем внутри реакционной камеры;
ж) через входной клапан внутрь реакционной камеры помещают дистиллированную воду, наводят вращающееся магнитное поле, приводя магнитные микрочастицы во вращательное движение, и проводят десорбцию нуклеиновых кислот путем добавления дистиллированной воды;
з) внутрь реакционной камеры вводят ПЦР-смеси и проводят амплификацию десорбированных на стадии (ж) нуклеиновых кислот;
и) помещают раствор дезоксирибозимов внутрь реакционной камеры, проводят перемешивание, выключают магнитное поле и проводят качественную визуальную детекцию присутствия патогена в пробе за счет изменения цвета содержимого реакционной камеры в случае присутствия нуклеиновой кислоты патогена в текучей пробе.
7. Способ проведения ПЦР-анализа текучей пробы по п. 6, где патоген семейства Enterobacteriaceae представляет собой Е. coli.
| СМЕННЫЙ МИКРОФЛЮИДНЫЙ МОДУЛЬ ДЛЯ АВТОМАТИЗИРОВАННОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ ИЗ БИОЛОГИЧЕСКИХ ОБРАЗЦОВ И СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ НУКЛЕИНОВЫХ КИСЛОТ С ЕГО ИСПОЛЬЗОВАНИЕМ | 2008 |
|
RU2380418C1 |
| МИКРОФЛЮИДНЫЕ СПОСОБЫ И КАРТРИДЖИ ДЛЯ РАЗДЕЛЕНИЯ КЛЕТОК | 2015 |
|
RU2732235C2 |
| СПОСОБ НАНЕСЕНИЯ РЕЛЬЕФНОГО РИСУНКА НА МЕХОВЫЕ ШКУРКИ | 0 |
|
SU164923A1 |
| WO 2017048975 A1, 23.03.2017 | |||
| KR 1020070115966 A, 06.12.2007. | |||
Авторы
Даты
2022-08-17—Публикация
2021-02-04—Подача