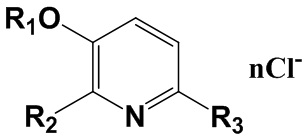
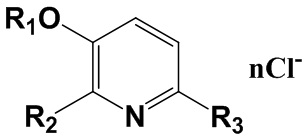
Изобретение относится к химии органических гетероциклических соединений, а именно к новым четвертичным аммониевым соединениям на основе 3-гидроксипиридина общей формулы I, проявляющим антибактериальные свойства. Соединения могут найти применение в медицине и ветеринарии.

где:
R1=C2H5; R2=CH2N+(CH3)2C8H17; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C10H21; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C12H25; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C14H29; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C16H33; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C18H37; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C8H17; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C12H25; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C18H37; R3=H; n=1;
R1=CH2C6H5; R2=CH2N+(CH3)2C16H33; R3=H; n=1;
R1=CH3; R2=R3=CH2N+(CH3)2C8H17; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C10H21; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C14H29; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C16H33; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C18H37; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C8H17; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C18H37; n=2;
R1=CH2C6H5; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C8H17; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C10H21; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C12H25; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C14H29; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C16H33; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C18H37; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C8H17; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C12H25; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C18H37; n=1;
R1=CH2C6H5; R2=CH3; R3=CH2N+(CH3)2C14H29; n=1.
Инфекционные заболевания являются одной из важнейших проблем мирового здравоохранения. В последние годы во всем мире наблюдается взрывной рост распространенности локальных и системных бактериальных инфекций, вызываемых не чувствительными к антибиотикам и антисептикам штаммами бактерий. Подобный рост наблюдается как для внутрибольничных инфекций, возникающих в лечебно-профилактических учреждениях вследствие распространения бактерий от пациента к пациенту, так и для внебольничных случаев заражения. Все это обуславливают необходимость разработки принципиально новых высокоэффективных в отношении, прежде всего, резистентных штаммов бактерий противомикробных средств [Brown G.D., Denning D.W., Gow N.A.R., Levitz S.M., Netea M.G., White T.C. Hidden killers: human fungal infections / Sci. Transl. Med. - 2012. - V. 4, Iss. 165. - P. 165rv13].
Четвертичные аммониевые соединения (ЧАС) уже более 100 лет применяются в лечебной практике в качестве антисептических средств и в настоящее время являются важнейшим сегментом рынка антисептических препаратов как в РФ, так и во всем мире. Они имеют широкую область применения, в частности, в терапии местных гнойно-воспалительных процессов, обработке неповрежденной кожи перед операциями, консервировании глазных капель, инъекционных растворов, косметических средств, а также дезинфекции и очистке поверхностей и медицинского оборудования. Механизм антибактериального действия ЧАС заключается в их адсорбции и проникновении через клеточную стенку бактерий с последующим взаимодействием с фосфолипидами цитоплазматической мембраны, что приводит к полной структурной дезорганизации и последующей гибели бактериальной клетки [McDonnell G., Russell A.D. Antiseptics and Disinfectants: Activity, Action, and Resistance / Clinical Microbiology Reviews. - 1999 - V. 12, №. 1. - P. 147-179]. Среди представителей данного класса соединений стоит выделить высокоэффективные антисептические препараты мирамистин, деквалиния хлорид, цетилпиридиния хлорид, дидецилдиметиламмония хлорид, бензалкония хлорид и ряд других [Gilbert P., Moore L.E. Cationic antiseptics: Diversity of action under a common epithet / J. Appl. Microbiol. - 2005. - V. 99, Iss. 4. - P. 703-715]. Обладая широким спектром противомикробной активности в отношении грамположительных и грамотрицательных бактерий, грибов, вирусов и простейших они не лишены некоторых недостатков. Главными недостатками этих соединений являются, с одной стороны, выработка к ним резистентности, а с другой - достаточно высокая токсичность. Кроме этого, ЧАС недостаточно активны в отношении спор, простых вирусов, грамотрицательных бактерий, микобактерий и грибов [Jennings M.C., Minbiole K.P.C., Wuest W.M. Quaternary ammonium compounds: an antimicrobial mainstay and platform for innovation to address bacterial resistance / ACS Infect. Dis. - 2015. - V. 1, Iss. 7. - P. 288-303].
Следует отметить, что описанные выше лекарственные препараты, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному изобретению вследствие того, что они не совпадают с заявляемым соединением по химической структуре, хотя и обладают сходной в целом антибактериальной активностью (совпадают по назначению), сопоставимой с заявленным техническим решением, в большей или меньшей степени.
Техническим результатом заявленного технического решения является расширение арсенала известных средств указанного назначения путем создания новых соединений общей формулы (I), содержащих в своем составе фрагмент 3-гидроксипиридина и четвертичные аммониевые фрагменты, и обладающих антибактериальной активностью.
Сущностью заявленного технического решения являются четвертичные аммониевые соединения на основе 3-гидроксипиридина общей формулы (I):
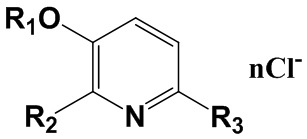
где:
R1=C2H5; R2=CH2N+(CH3)2C8H17; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C10H21; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C12H25; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C14H29; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C16H33; R3=H; n=1;
R1=C2H5; R2=CH2N+(CH3)2C18H37; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C8H17; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C12H25; R3=H; n=1;
R1=C4H9; R2=CH2N+(CH3)2C18H37; R3=H; n=1;
R1=CH2C6H5; R2=CH2N+(CH3)2C16H33; R3=H; n=1;
R1=CH3; R2=R3=CH2N+(CH3)2C8H17; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C10H21; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C14H29; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C16H33; n=2;
R1=CH3; R2=R3=CH2N+(CH3)2C18H37; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C8H17; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=C4H9; R2=R3=CH2N+(CH3)2C18H37; n=2;
R1=CH2C6H5; R2=R3=CH2N+(CH3)2C12H25; n=2;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C8H17; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C10H21; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C12H25; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C14H29; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C16H33; n=1;
R1=CH3; R2=CH3; R3=CH2N+(CH3)2C18H37; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C8H17; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C12H25; n=1;
R1=C4H9; R2=CH3; R3=CH2N+(CH3)2C18H37; n=1;
R1=CH2C6H5; R2=CH3; R3=CH2N+(CH3)2C14H29; n=1.
Четвертичные аммониевые соединения на основе 3-гидроксипиридина по п.1, обладающие антибактериальной активностью.
Заявленное техническое решение иллюстрируется Фиг.1 - Фиг.4.
На Фиг.1 приведена Таблица 1, в которой представлены значения МПК (минимальная подавляющая концентрация) четвертичных аммониевых соединений на основе 3-гидроксипиридина, в отношении грамположительных и грамотрицательных бактерий (в мкг/мл).
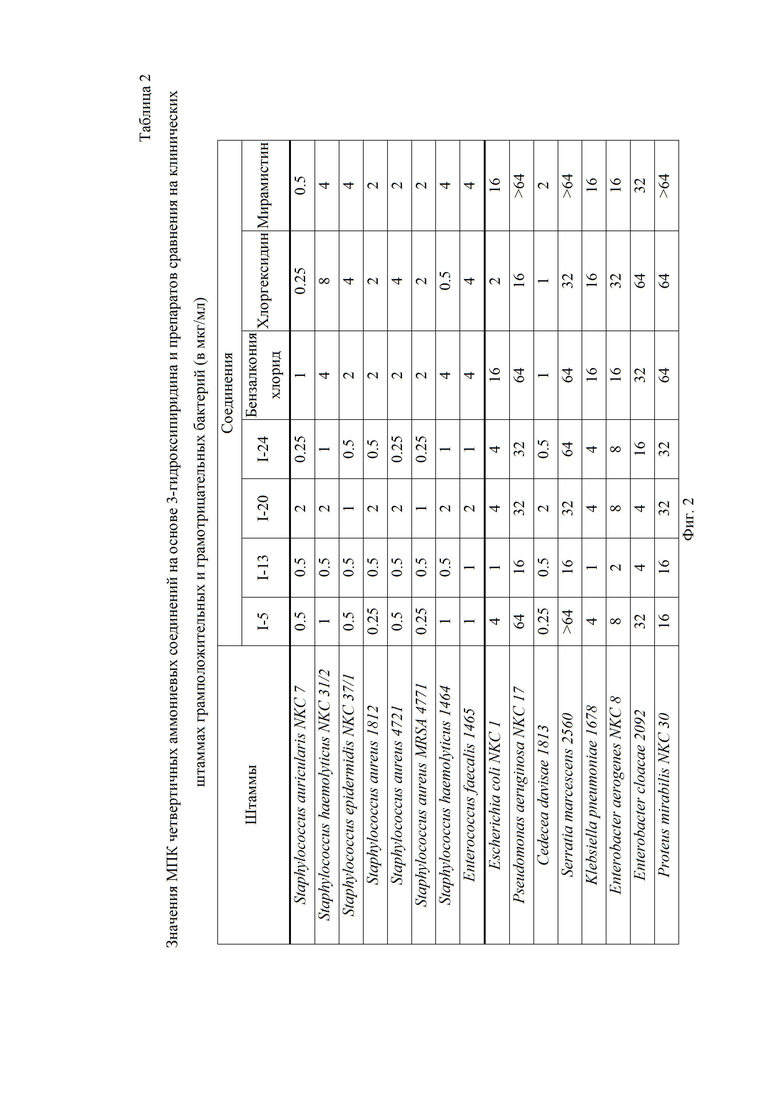
На Фиг.2 приведена Таблица 2, в которой представлены значения МПК четвертичных аммониевых соединений на основе 3-гидроксипиридина и препаратов сравнения на клинических штаммах грамположительных и грамотрицательных бактерий (в мкг/мл).
На Фиг.3 приведена Таблица 3, в которой представлены значения СC50 (мкг/мл) для исследуемых соединений и препаратов сравнения на условно-нормальных клеточных линиях.
На Фиг.4 приведена Таблица 4, в которой представлены результаты исследования острой токсичности соединения I-13 на мышах, где:  - мужской пол,
- мужской пол,  - женский пол.
- женский пол.
Далее заявителем приведено осуществление заявленного технического решения.
Заявленные соединения получают в целом по следующем схемам 1, 2, 3.
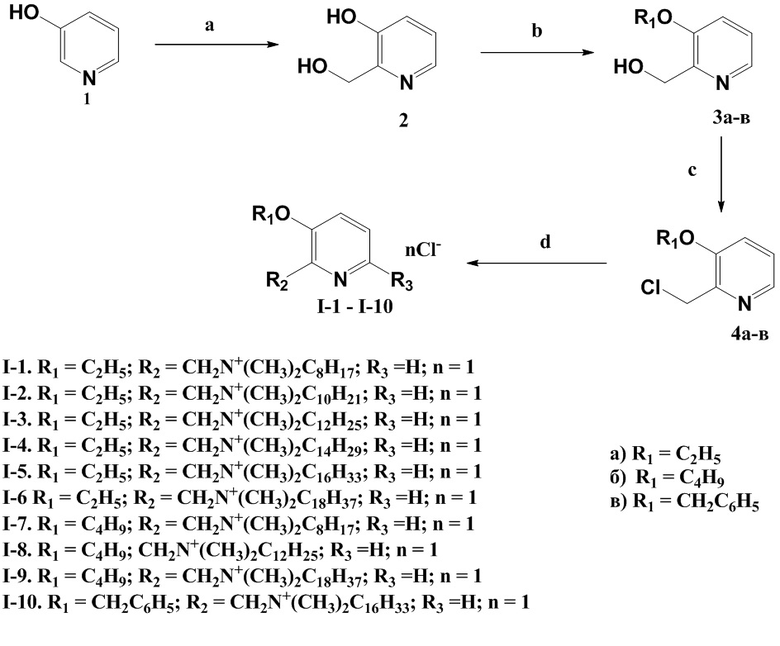
Схема 1. (a) формалин (37%), NaOH, вода, 90°C, 3ч; (b) для 3а: NaOH, H2O/метанол, ДМСО, EtI,, 0°C; для 3б: NaOH, H2O/метанол, ДМСО, BuBr, 20°C, 8ч; для 3в: NaOH, H2O/метанол, ДМФА, BnBr, 20°C, 4ч; (c) для 4а: SOCl2, CHCl3, кипячение, 12 ч, NaHCO3/H2O; для 4б: SOCl2, ДМФА, CHCl3, кипячение, 15ч, NaHCO3/H2O; для 4в: SOCl2, CHCl3, кипячение, 12 ч, NaHCO3/H2O; (d) (CH3)2N(C8-C18), этанол, 70°C, 5ч.

Схема 2. (a) формалин (37%), NaOH, вода, 90°C, 30 ч; (b) для 6а: NaOH, H2O/метанол, ДМСО, CH3I, 20°C, 8 ч; для 6б: NaOH, H2O/метанол, BuBr, ДМСО, 0°C, 8 ч; для 6в: NaOH, H2O/метанол, ДМФА, BnBr, 20°C, 4ч; (c) для 7а: SOCl2, CHCl3, кипячение, 8 ч, NaHCO3/H2O; для 7б: SOCl2, ДМФА, CHCl3, кипячение, 15 ч, NaHCO3/H2O; для 7в: SOCl2, CHCl3, кипячение, 12 ч, NaHCO3/H2O; (d) (CH3)2N(C8-C18), этанол, 70°C, 5 ч.
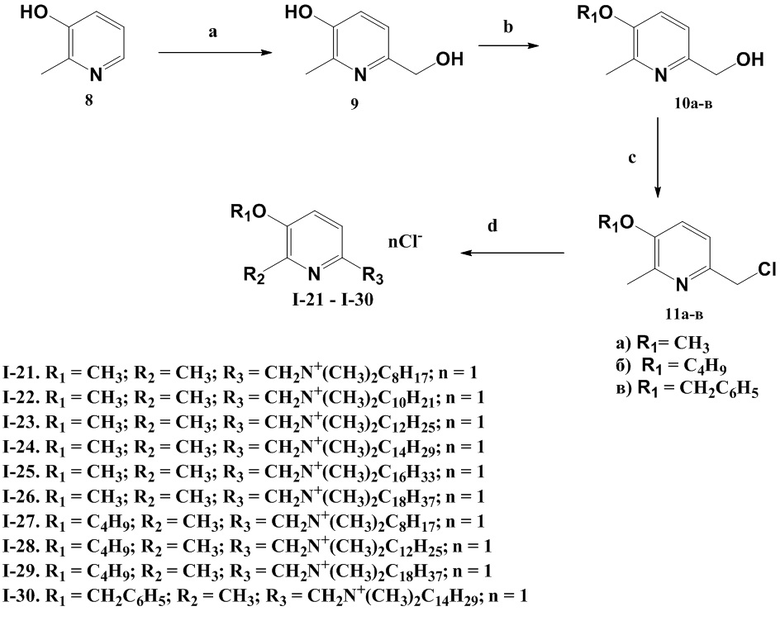
Схема 3. (a) формалин (40%), NaOH, вода, кипячение, 2 ч; (b) для 10а: NaOH, H2O/метанол, ДМСО, CH3I, 20°C, 8 ч; для 10б: NaOH, H2O/метанол, BuBr, ДМСО, 20°C, 8 ч; для 10в: NaOH, H2O/метанол, ДМФА, BnBr, 20°C, 4 ч; (c) для 11а: SOCl2, CHCl3, кипячение, 8 ч, NaHCO3/H2O; для 11б: SOCl2, ДМФА, CHCl3, кипячение, 15ч, NaHCO3/H2O; для 7в: SOCl2, CHCl3, кипячение, 12 ч, NaHCO3/H2O; (d) (CH3)2N(C8-C18), этанол, 70°C, 5 ч.
Характеристики новых соединений приведены далее в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии. Спектры ЯМР регистрировали на приборе Bruker AVANCE-400. Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированных растворителей (1H и 13С). Температуры плавления определялись с помощью прибора Stanford Research Systems MPA-100 OptiMelt. Контроль за ходом реакций и чистотой соединений проводили методом ТСХ на пластинах Sorbfil Plates.
HRMS-эксперимент был проведен с использованием масс-спектрометра сверхвысокого разрешения TripleTOF 5600, AB Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Примеры конкретного выполнения заявленного технического решения
Следующие соединения были получены по известным литературным методикам:
- соединения 2, 5 [Shtyrlin N.V., Vafina R.M., Pugachev M.V., Khaziev R.M., Nikitina Е.V., Zeldi M.I., Iksanova A.G., Shtyrlin Yu.G. Synthesis and biological activity of quaternary phosphonium salts based on 3-hydroxypyridine and 4-deoxypyridoxine / Izv. Akad. Nauk, Ser. Khim. - 2016 - V. 9, Iss. 2. - P. 537-545];
- соединение 3а [Michael G. N. R., Robert W. C., John R. A., Frances A. B., Susan M. C., Peter H., Catherine I., Matt L., Ruth M. M., Andrew M., Kevin W. M., Robert N., Alison J. M., David T., Sally-Anne T., Keith A. W.,  L. C. Discovery of Functionally Selective 7,8,9,10-Tetrahydro-7,10-ethano-1,2,4-triazolo[3,4-a]phthalazines as GABAA Receptor Agonists at the α3 Subunit / J. Med. Chem. - 2005 - V. 48, Iss. 5. - P. 1367-1383];
L. C. Discovery of Functionally Selective 7,8,9,10-Tetrahydro-7,10-ethano-1,2,4-triazolo[3,4-a]phthalazines as GABAA Receptor Agonists at the α3 Subunit / J. Med. Chem. - 2005 - V. 48, Iss. 5. - P. 1367-1383];
- соединение 4а [Nouvelles guanidines, leur procede de preparation et leur application. Патент Франции FR2319343 (A1) от 1977-02-25];
- соединение 3в [Junfeng W., Huan W., Ian A. R., Derek J. E., Bryan C. Fuchs, Kenneth K. T., Peter C., Eric M. G.. Manganese-Based Contrast Agents for Magnetic Resonance Imaging of Liver Tumors: Structure-Activity Relationships and Lead Candidate Evaluation / J. Med. Chem. - 2018 - V. 61, Iss. 19. - P. 8811-8824];
- соединение 4в [Fgf-receptor agonist dimeric compounds. Патент США US2009069368 (A1) от 2009-03-12];
- соединение 5 [Yi L., Alain F.-R.,  P.R., Marc L. Synthesis of pyridine-based polyaminocarboxylic ligands bearing a thioalkyl anchor / Тetrahedron Lett. - 2007 - V. 48, Iss. 19. - P. 3463-3466];
P.R., Marc L. Synthesis of pyridine-based polyaminocarboxylic ligands bearing a thioalkyl anchor / Тetrahedron Lett. - 2007 - V. 48, Iss. 19. - P. 3463-3466];
- соединения 6в и 7в [Kimberly M. L., Michael E. O., Travis D. H., Ryker E. S., Kayla N. G. Structural, Spectral, and Electrochemical Properties of Nickel(II), Copper(II), and Zinc(II) Complexes Containing 12-Membered Pyridine- and Pyridol-Based Tetra-aza Macrocycles / Inorg. Chem. - 2014 - V. 53, Iss. 3. - P. 1406 - 1416];
- соединение 9 [Seredyuk M., Gaspar A. B., Ksenofontov V., Galyametdinov Y., Kusz J.,  P. Does the Solid-Liquid Crystal Phase Transition Provoke the Spin-State Change in Spin-Crossover Metallomesogens? / J. Am. Chem. Soc. - 2008 - V. 130, Iss. 4. - P. 1431-1439];
P. Does the Solid-Liquid Crystal Phase Transition Provoke the Spin-State Change in Spin-Crossover Metallomesogens? / J. Am. Chem. Soc. - 2008 - V. 130, Iss. 4. - P. 1431-1439];
- соединение 10в [Timothy J., James F., Mark S., Carl K. Adrenergic Agents. 7. Synthesis and β-Adrenergic Agonist Activity of Several 2-Pyridylethanolamines / J. Med. Chem. - 1997 - V. 20, Iss. 10. - P. 1258-1262];
Пример 1. Получение 2-(метилен(N,N-диметил-N-октадециламмоний))-3-этоксипиридин хлорида (I-1)
0.25 г (1.46 ммоль) соединения 4а растворяли в 20.0 мл этанола и добавляли 0.3 мл (1.46 ммоль) N,N-диметилоктиламина. Реакционную смесь перемешивали в течение 5 часов при температуре 70°С. Растворитель удаляли в вакууме. Осадок перекристаллизовывали из ацетона. Выход 0.30 г (63%); маслообразное вещество светло-желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.79 т (3H, 3JHH=6.8 Гц, СH3), 1.10-1.33 м (10H, 5CH2), 1.41 т (3H, 3JHH=7.0 Гц, СH3этил), 1.74-1.86 м (2H, CH2), 3.33 с (6H, 2CH3N+), 3.50-3.60 м (2H, СH2N+), 4.08 кв (2H, 3JHH=7.0 Гц, СH2этил), 4.58 с (2H, СH2пирN+), 7.29 дд (1H, 3JHH=8.4 Гц, 4JHH=0.9 Гц, CHпир), 7.34 дд (1H, 3JHH=8.4 Гц, 3JHH=4.4 Гц, CHпир), 8.17 дд (1H, 3JHH=4.4 Гц, 4JHH=0.9 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.10 (СH3), 14.67 (СH3эт), 22.60 (CH2), 23.00 (CH2), 26.25 (CH2), 29.05 (CH2), 29.15 (CH2), 31.66 (CH2), 51.73 (CH3N+), 61.56 (CH2), 64.69 (CH2), 64.93 (CH2пир), 119.97 (Cпир), 126.54 (Cпир), 137.47 (Cпир), 141.62 (Cпир), 155.02 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 293.2593, C18H33N2O+. Вычислено [М-Cl]+ 293.2587.
Пример 2. Получение 2-(метилен(N,N-диметил-N-дециламмоний))-3-этоксипиридин хлорида (I-2)
Синтезировали и разрабатывали аналогично соединению I-1. Использовали 0.25 г (1.46 ммоль) соединения 4а и 0.4 мл (1.46 ммоль) N,N-диметилдециламина. Выход 0.29 г (56%); маслообразное вещество светло-желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=6.8 Гц, СH3), 1.13-1.38 м (14H, 7CH2), 1.47 т (3H, 3JHH=7.0 Гц, СH3этил), 1.77-1.92 м (2H, CH2), 3.41 с (6H, 2CH3N+), 3.56-3.67 м (2H, СH2N+), 4.13 кв (2H, 3JHH=7.0 Гц, СH2этил), 4.61 с (2H, СH2пирN+), 7.32 д (1H, 3JHH=8.4 Гц, CHпир), 7.38 дд (1H, 3JHH=8.4 Гц, 3JHH=4.5 Гц, CHпир), 8.22 д (1H, 3JHH=4.5 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.20 (СH3), 14.75 (СH3эт), 22.75 (CH2), 23.11 (CH2), 26.32 (CH2), 29.29 (CH2), 29.33 (CH2), 29.45 (CH2), 29.51 (CH2), 31.92 (CH2), 51.85 (CH3N+), 61.56 (CH2), 64.74 (CH2), 65.01 (CH2), 119.91 (Cпир), 126.52 (Cпир), 137.60 (Cпир), 141.71 (Cпир), 155.03 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 321.2906, C20H37N2O+. Вычислено [М-Cl]+ 321.2900.
Пример 3. Получение 2-(метилен(N,N-диметил-N-додециламмоний))-3-этоксипиридин хлорида (I-3)
0.25 г (1.46 ммоль) соединения 4а растворяли в 20.0 мл этанола и добавляли 0.4 мл (1.46 ммоль) N,N-диметилдодециламина. Перемешивали в течение 5 часов при температуре 70°С. Реакционную смесь охлаждали, осадок отфильтровывали и промывали ацетоном. Выход 0.35 г (63%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.7 Гц, СH3), 1.16-1.40 м (18H, 9CH2), 1.48 т (3H, 3JHH=7.0 Гц, СH3этил), 1.79-1.92 м (2H, CH2), 3.42 с (6H, 2CH3N+), 3.59-3.68 м (2H, СH2N+), 4.14 кв (2H, 3JHH=7.0 Гц, СH2этил), 4.61 с (2H, СH2пирN+), 7.32 д (1H, 3JHH=8.3 Гц, CHпир), 7.38 дд (1H, 3JHH=8.3 Гц, 3JHH=4.5 Гц, CHпир), 8.23 д (1H, 3JHH=4.5 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.07 (СH3), 14.59 (СH3эт), 22.60 (CH2), 22.92 (CH2), 26.17 (CH2), 29.12 (CH2), 29.25 (CH2), 29.31 (CH2), 29.40 (CH2), 29.51 (CH2), 31.82 (CH2), 51.63 (CH3N+), 61.45 (CH2), 64.60 (CH2), 64.81 (CH2), 119.92 c (Cпир), 126.46 c (Cпир), 137.39 c (Cпир), 141.51 c (Cпир), 154.90 c (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 349.3213, C22H41N2O+. Вычислено [М-Cl]+ 349.3213.
Пример 4. Получение 2-(метилен(N,N-диметил-N-тетрадециламмоний))-3-этоксипиридин хлорида (I-4)
Синтезировали и разрабатывали аналогично соединению I-3. Использовали 0.25 г (1.46 ммоль) соединения 4а и 0.4 мл (1.46 ммоль) N,N-диметилтетрадециламина. Выход 0.38 г (63%); маслообразное вещество светло-желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.83 т (3H, 3JHH=6.3 Гц, СH3), 1.17-1.35 м (22H, 11CH2), 1.45 т (3H, 3JHH=6.9 Гц, СH3этил), 1.78-1.89 м (2H, CH2), 3.40 с (6H, 2CH3N+), 3.57-3.65 м (2H, СH2N+), 4.12 кв (2H, 3JHH=6.9 Гц, СH2этил), 4.60 с (2H, СH2пирN+), 7.31 д (1H, 3JHH=7.7 Гц, CHпир), 7.34-7.39 м (1H, CHпир), 8.19-8.22 м (1H, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.07 (СH3), 14.59 (СH3эт), 22.62 (CH2), 22.93 (CH2), 26.18 (CH2), 29.13 (CH2), 29.29 (CH2), 29.33 (CH2), 29.42 (CH2), 29.54 (CH2), 29.58 (CH2), 29.61 (CH2), 31.85 (CH2), 51.64 (CH3N+), 61.47 (CH2), 64.60 c (CH2), 64.81 (CH2пир), 119.92 (Cпир), 126.47 (Cпир), 137.40 (Cпир), 141.52 (Cпир), 154.92 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 377.3534, C24H45N2O+. Вычислено [М-Cl]+ 377.3526.
Пример 5. Получение 2-(метилен(N,N-диметил-N-гексадециламмоний))-3-этоксипиридин хлорида (I-5)
Синтезировали и разрабатывали аналогично соединению I-3. Использовали 0.25 г (1.46 ммоль) соединения 4а и 0.5 мл (1.46 ммоль) N,N-диметилгексадециламина. Выход 0.41 г (64%); бежевое кристаллическое вещество; т.пл. 38-40°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3H, 3JHH=6.4 Гц, СH3), 1.16-1.39 м (26H, 13CH2), 1.47 т (3H, 3JHH=6.4 Гц, СH3этил), 1.80-1.90 м (2H, CH2), 3.40 с (6H, 2CH3N+), 3.56-3.66 м (2H, СH2N+), 4.13 кв (2H, 3JHH=6.9 Гц, СH2этил), 4.61 с (2H, СH2пирN+), 7.31 д (1H, 3JHH=8.5 Гц, CHпир), 7.37 дд (1H, 3JHH=8.5 Гц, 3JHH=4.5 Гц, CHпир), 8.23 д (1H, 3JHH=4.5 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.19 (СH3), 14.72 (СH3эт), 22.74 (CH2), 23.07 (CH2), 26.28 (CH2), 29.26 (CH2), 29.43 (CH2), 29.53 (CH2), 29.60 (CH2), 29.65 (CH2), 29.71 (CH2), 29.74 (CH2), 31.97 (CH2), 51.80 (CH3N+), 61.48 (CH2), 64.69 (CH2), 64.90 (CH2), 119.88 (Cпир), 126.48 (Cпир), 137.59 (Cпир), 141.65 (Cпир), 154.97 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 405.3845, C26H49N2O+. Вычислено [М-Cl]+ 405.3839.
Пример 6. Получение 2-(метилен(N,N-диметил-N-октадециламмоний))-3-этоксипиридин хлорида (I-6)
Синтезировали и разрабатывали аналогично соединению I-3. ИСпользовали 0.25 г (1.46 ммоль) соединения 4а и 0.6 мл (1.46 ммоль) N,N-диметилоктадециламина. Выход 0.45 г (66%); бежевое кристаллическое вещество; т.пл. 50-52°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3H, 3JHH=6.7 Гц, СH3), 1.14-1.38 м (30H, 15CH2), 1.47 т (3H, 3JHH=7.0 Гц, СH3этил), 1.79-1.90 м (2H, CH2), 3.40 с (6H, 2CH3N+), 3.55-3.65 м (2H, СH2N+), 4.13 кв (2H, 3JHH=6.9 Гц, СH2этил), 4.61 с (2H, СH2пирN+), 7.31 дд (1H, 3JHH=7.8 Гц, 4JHH=1.2 Гц, CHпир), 7.37 дд (1H, 3JHH=8.5 Гц, 3JHH=4.5 Гц, CHпир), 8.23 дд (1H, 3JHH=4.5 Гц, 4JHH=1.2 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.26 (СH3), 14.79 (СH3эт), 22.82 (CH2), 23.16 (CH2), 26.35 (CH2), 29.34 (CH2), 29.49 (CH2), 29.60 (CH2), 29.73 (CH2), 29.79 (CH2), 29.83 (CH2), 32.05 (CH2), 51.89 (CH3N+), 61.54 (CH2), 64.75 (CH2), 65.04 (CH2), 119.85 (Cпир), 126.50 (Cпир), 137.69 (Cпир), 141.75 (Cпир), 155.02 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 433.4158, C28H53N2O+. Вычислено [М-Cl]+ 433.4152.
Пример 7. Получение 3-бутокси-2-(метилен(N,N-диметил-N-октиламмоний))пиридин хлорида (I-7)
Синтез 3-бутокси-2-гидроксиметилпиридина (промежуточное вещество 3б)
В 30.0 мл смеси метанол : вода = 4:1 растворяли 1.00 г (7.93 ммоль) гидрохлорида 3-гидрокси-2-гидроксиметилпиридина 2, добавляли 0.63 г (15.86 ммоль) NaOH и перемешивали до гомогенности. Растворители отгоняли в вакууме, сухой остаток заливали 25.0 мл ДМСО и добавляли 0.8 мл (7.93 ммоль) бромистого бутила. Реакционную смесь перемешивали 8 ч при 20°С. Ход реакции контролировали по ТСХ (элюент : смесь этилацетат : хлороформ = 1:2). Растворитель отгоняли в вакууме, остаток экстрагировали 40.0 мл CHCl3 и очищали с помощью колоночной хроматографии (элюент - этилацетат). Выход 0.81 г (57%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.98 т (3Н, 3JHH=7.4 Гц, CH2CH2CH2CH3), 1.47-1.53 м (2Н, CH2CH2CH2CH3), 1.78-1.82 м (2Н, CH2CH2CH2CH3), 4.02 д (2Н, CH2CH2CH2CH3, 3JHH=6.0 Гц), 4.81 c (2H, CH2O), 7.21, 7.26 (AMX-система, 2Н, 5-PyH, 4-PyH, 3JHH=8.3, 4JHH=4.0 Гц), 8.17 (AMX-система, 1Н, 6-PyH, 3JHH=4.0 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.92 (СH3), 17.21 (СH2), 19.35 (СH2), 24.28 (СH2), 31.12 (СH2), 59.59 (СH2O), 68.29 (СН2O), 118.64 (CPyr), 119.86 (CPyr), 123.23 (CPyr), 138.02 (CPyr), 147.21 (CPyr), 153.27 (CPyr).
Синтез 3-бутокси-2-хлорметилпиридина (промежуточное вещество 4б)
Смесь 0.75 г (4.14 ммоль) 3-бутокси-2-гидроксиметилпиридина 3б, 0.3 мл (4.14 ммоль) тионилхлорида и 0.1 мл (1.30 ммоль) ДМФА в 50.0 мл хлороформа кипятили 15 часов. Реакционную смесь охладили до ~20°C. Растворитель отгоняли в вакууме. Остаток растворяли в 20.0 мл этилацетата и промывали 10.0 мл 10% водного раствора NaHCO3. Органическую часть отделяли и отгоняли в вакууме. Выход 0.69 г (83%), маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.92 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц), 1.42-1.50 м (2Н, CH2CH2CH2CH3), 1.70-1.78 м (2Н, CH2CH2CH2CH3), 3.95 д (2Н, CH2CH2CH2CH3, 3JHH=6.3 Гц), 4.68 c (2H, CH2Cl), 7.12, 7.16 (AMX-система, 2Н, 5-PyH, 4-PyH, 3JHH=5.4, 4JHH=4.2 Гц), 8.08 (AMX-система, 1Н, 6-PyH, 3JHH=4.2 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.87 (СH3), 19.28 (СH2), 31.12 (СH2), 42.40 (СH2Cl), 68.17 (СН2O), 118.95 (CPyr), 124.60 (CPyr), 140.76 (CPyr), 145.21 (CPyr), 153.87 (CPyr).
Получение 3-бутокси-2-(метилен(N,N-диметил-N-октиламмоний))пиридин хлорида (I-7)
Раствор 0.51 мл (2.50 ммоль) N,N-диметилоктиламина и 0.50 г (2.50 ммоль) 3-бутокси-2-хлорметилпиридина 4б в 30.0 мл этанола нагревали 15 ч при 40°C. Далее растворитель отгоняли в вакууме, сухой остаток растворяли в хлороформе и очищали с помощью колоночной хроматографии (элюент смесь этилацетат : хлороформ = 1:2). Выход 0.61 г (68%); маслообразное вещество оранжевого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.73 т (3Н, CH3C7H14, 3JHH=6.7 Гц), 0.85 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц), 1.11-1.22 м (10Н, 5CH2), 1.31-1.37 м (2Н, CH2CH2CH2CH3), 1.67-1.73 м (4Н, 2СН2), 3.23 с (6Н, 2СH3N+), 3.44-3.48 м (2Н, СH2N+), 3.96 т (2Н, CH2CH2CH2CH3, 3JHH=6.7 Гц), 4.51 м (2Н, CH2N+), 7.25, 7.30 (AMX-система, 2Н, 5-PyH, 4-PyH, 3JHH=8.6 Гц, 4JHH =4.3 Гц), 8.13 (AMX-система, 1Н, 6-PyH, 3JHH=4.3 Гц).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 13.59 (CH3), 13.93 (CH3), 19.10 (CH2), 22.47 (CH2), 22.80 (CH2), 24.30 (CH2), 26.04 (CH2), 26.43 (CH2), 29.38 (CH2), 30.73 (CH2), 31.68 (CH2), 51.45 (CH3N+), 57.56 (CH3N+), 61.25 (CH2N+), 64.78 (CH2N+), 68.57 (CH3O), 119.88 (CPyr), 126.41 (CPyr), 137.17 (CPyr), 141.42 (CPyr), 154.92 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [M-Cl]+ 377.3523, C24H45N2O+. Вычислено [M-Cl]+ 377.3526.
Пример 8. Получение 3-бутокси-2-(метилен(N,N-диметил-N-додециламмоний))пиридин хлорида (I-8)
Раствор 0.7 мл (2.53 ммоль) N,N-диметилдодециламина и 0.50 г (2.50 ммоль) 3-бутокси-2-хлорметилпиридина 4б в 30.0 мл этанола нагревали 15 ч при 40°C. Далее растворитель отгоняли в вакууме, сухой остаток растворяли в хлороформе и очищали с помощью колоночной хроматографии (элюент ацетонитрил). Выход 0.72 г (70%); маслообразное вещество оранжевого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (3Н, CH3C11H22, 3JHH=6.70 Гц), 1.00 т (3Н, CH2CH2CH2CH3, 3JHH=7.5 Гц), 1.25-1.40 м (18Н, 9CH2), 1.45-1.52 м (2Н, CH2CH2CH2CH3), 1.82-1.88 м (4Н, 2СН2), 3.44 с (6Н, 2СH3N+), 3.66-3.70 с (2Н, СH2N+), 4.08 т (2Н, CH2CH2CH2CH3, 3JHH=6.8 Гц), 4.60 м (2Н, CH2N+), 7.36, 7.42 (AMX-система, 2Н, 5-PyH, 4-PyH, 3JHH =8.9 Гц, 4JHH=3.8 Гц), 8.10 (AMX-система, 1Н, 6-PyH, 3JHH =3.8 Гц).
Спектр ЯМР 13С (100 МГц,CDCl3) δ, м.д.: 13.84 (CH3), 14.19 (CH3), 19.37 (CH2), 22.73 (CH2), 23.08 (CH2), 24.33 (CH2), 26.27 (CH2), 29.09 (CH2), 29.26 (CH2), 29.40 (CH2), 29.52 (CH2), 29.63 (CH2), 30.97 (CH2), 31.94 (CH2), 51.75 (CH3N+), 57.99 (CH3N+), 61.33 (CH2N+), 65.03 (CH2N+), 68.81 (CH3O), 120.02 (CPyr), 126.59 (CPyr), 137.33 (CPyr), 141.63 (CPyr), 155.12 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [M-Cl]+ 377.3523, C24H45N2O+. Вычислено [M-Cl]+ 377.3526.
Пример 9. Получение 3-бутокси-2-(метилен(N,N-диметил-N-октадециламмоний))пиридин хлорида (I-9)
Синтезировали и разрабатывали аналогично соединению I-8. Использовали 0.9 мл (2.50 ммоль) N,N-диметилоктадециламина и 0.50 г (2.50 ммоль) 3-бутокси-2-хлорметилпиридина 4б. Выход 0.53 г (43%); маслообразное вещество оранжевого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3Н, CH3C17H34, 3JHH=6.6 Гц), 0.98 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц ), 1.16-1.26 м (30Н, 15CH2), 1.42-1.46 м (2Н, CH2CH2CH2CH3), 1.79-1.86 м (4Н, CH2CH2CH2CH3), 3.43 с (6Н, 2СH3N+), 3.64-3.69 с (2Н, СH2N+), 4.05 т (2Н, CH2CH2CH2CH3, 3JHH=6.6 Гц), 4.58 м (2Н, CH2N+), 7.32, 7.38 (AMX-система, 2Н, 5-PyH, 4-PyH, 3JHH=8.1 Гц, 4JHH=4.4 Гц), 8.24 (AMX-система, 1Н, 6-PyH, 3JHH=4.4 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.87 (CH3), 14.22 (CH3), 19.43 (CH2), 22.79 (CH2), 23.16 (CH2), 26.33 (CH2), 29.33 (CH2), 29.46 (CH2), 29.58 (CH2), 29.70 (CH2), 29.76 (CH2), 29.80 (CH2), 31.03 (CH2), 32.03 (CH2), 51.86 (CH3N+), 61.36 (СH3N+), 65.02 (CH3N+), 68.84 (CH3N+), 119.87 (CPyr), 126.48 (CPyr), 137.65 (CPyr), 141.74 (CPyr), 155.11 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [M-Cl]+ 461.4471, C30H57N2O+. Вычислено [M-Cl]+ 461.4465.
Пример 10. 3-бензилокси-2-(метилен(N,N-диметил-N-гексадециламмоний))пиридин хлорида (I-10)
В 20.0 мл этанола растворяли 0.35 г (1.50 ммоль) соединения 4в и добавляли 0.5 мл (1.50 ммоль) N,N-диметилгексадециламина. Реакционную смесь перемешивали в течение 5 часов при температуре 70°С. Охлаждали, растворитель удаляли в вакууме, осадок промывали ацетоном. Выход 0.45 г (60%); бежевое кристаллическое вещество; т.пл. 76-78°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (3H, 3JHH=6.7 Гц, СH3), 1.10-1.45 м (26H, 13CH2), 1.76-1.83 м (2H, CH2), 3.42 с (6H, 2CH3N+), 3.61-3.69 м (2H, CH2N+), 4.61 с (2H, СH2пирN+), 5.17 с (2H, СH2бенз), 7.33-7.46 м (7H, 2CHпир, 5СHбенз), 8.28 дд (1H, 3JHH=4.2 Гц, 4JHH=1.0 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.27 (СH3), 22.82 (CH2), 23.16 (CH2), 26.31 (CH2), 29.32 (CH2), 29.48 (CH2), 29.60 (CH2), 29.73 (CH2), 29.79 (CH2), 29.82 (CH2), 32.05 (CH2), 51.80 (CH3N+), 61.41 (CH2N+), 65.10 (CH2пирN+), 71.31 (CH2О), 120.61 (Cпир), 126.50 (Cпир), 127.98 (Cбенз), 129.17 (Cбенз), 129.26 (Cбенз), 127.98 (Cбенз), 134.85 (Cбенз), 137.96 (Cпир), 142.20 (Cпир), 154.89 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 467.4001, C31H51N2O+. Вычислено [М-Cl]+ 467.3996.
Пример 11. Получение 2,6-(бис(метилен(N,N-диметил-N-октиламмоний)))-3-метоксипиридин дихлорида (I-11)
Синтез 3-метокси-2,6-бис(хлорметил)пиридина (промежуточное вещество 7а):
1.00 г (5.91 ммоль) 2,6-ди(гидроксиметил)-3-метоксипиридина 6а суспензировали в 30.0 мл хлороформа и добавляли 3.0 мл (41.30 ммоль) хлористого тионила. Реакционную смесь кипятили 8 часов, охлаждали, растворитель отгоняли в вакууме. Далее 1.00 г (4.10 ммоль) полученного осадка растворяли в 10.0 мл хлороформа. При интенсивном перемешивании добавляли водный раствор 0.38 г (4.60 ммоль) гидрокарбоната натрия. Органический слой отделяли и высушивали на роторном испарителе. Осадок промывали ацетоном. Выход 0.70 г (83%); бежевое кристаллическое вещество; т.пл. 80-81°С.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 3.89 с (3H, СH3), 4.71 c (2H, CH2), 4.74 c (2H, CH2), 7.56 с (2H, 2CHпир).
Спектр ЯМР 13С (100 МГц, ДМСО-d6) δ, м.д.: 42.36 (CH2), 46.35 (CH2), 56.12 (CH3), 120.23 (Cпир), 125.35 (Cпир), 144.56 (Cпир), 147.14 (Cпир), 153.40 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М+H]+ 206.0134, C8H10Cl2NO+. Вычислено [М+H]+ 206.0134.
Получение 2,6-(бис(метилен(N,N-диметил-N-октиламмоний)))-3-метоксипиридин дихлорида (I-11):
0.25 г (1.21 ммоль) соединения 7а растворяли в 20.0 мл этанола и добавляли 0.5 мл (2.42 ммоль) N,N-диметилоктиламина. Перемешивали в течение 5 часов при температуре 70°С. Растворитель удаляли досуха, осадок промывали ацетоном. Выход 0.32 г (51%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3H, 3JHH=6.7 Гц, СH3), 0.85 т (3H, 3JHH=7.0 Гц, СH3), 1.15-1.40 м (20H, 10CH2), 1.72-1.87 м (4H, 2CH2), 3.33 с (6H, 2CH3N+), 3.38 с (6H, 2CH3N+), 3.47-3.64 м (4H, 2 СH2N+), 3.96 с (3H, CH3О), 4.85 с (2H, СH2пирN+), 5.07 с (2H, СH2пирN+), 7.51 д (1H, 3JHH=8.5 Гц, CHпир), 8.22 д (1H, 3JHH=8.5 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.17 (СH3), 22.68 (CH2), 23.04 (CH2), 23.16 (CH2), 26.42 (CH2), 26.47 (CH2), 29.17 (CH2), 29.38 (CH2), 31.76 (CH2), 50.67 (CH3N+), 51.39 (CH3N+), 56.64 (CH3О), 62.03 (CH2N+), 65.35 (CH2N+), 65.94 (CH2пирN+), 66.85 (CH2пирN+), 120.72 (Cпир), 132.08 (Cпир), 138.12 (Cпир), 141.17 (Cпир), 156.65 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 224.7171, C28H55N3O2+. Вычислено [М-2Cl]2+ 224.7167.
Пример 12. Получение 2,6-(бис(метилен(N,N-диметил-N-дециламмоний)))-3-метоксипиридин дихлорида (I-12)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.25 г (1.21 ммоль) соединения 7а и 0.6 мл (2.42 ммоль) N,N-диметилдециламина. Выход 0.38 г (54%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (6H, 3JHH=6.2 Гц, 2СH3), 1.15-1.36 м (28H, 14CH2), 1.79 с (4H, 2CH2), 3.31 с (6H, 2CH3N+), 3.35 с (6H, 2CH3N+), 3.48-3.59 м (4H, 2СH2N+), 3.95 с (3H, CH3О), 4.79 с (2H, СH2пирN+), 5.01 с (2H, СH2пирN+), 7.52 д (1H, 3JHH=8.6 Гц, CHпир), 8.17 д (1H, 3JHH=8.6 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.00 (СH3), 22.53 (CH2), 22.80 (CH2), 22.95 (CH2), 26.29 (CH2), 29.15 (CH2), 29.16 (CH2), 29.27 (CH2), 29.38 (CH2), 31.72 (CH2), 50.50 (CH3N+), 51.22 (CH3N+), 56.46 (CH3О), 61.59 (CH2N+), 64.78 (CH2N+), 65.61 (CH2пирN+), 66.48 (CH2пирN+), 120.73 (Cпир), 131.78 (Cпир), 137.81 (Cпир), 140.76 (Cпир), 156.43 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 252.7486, C32H63N3O2+. Вычислено [М-2Cl]2+ 252.7480.
Пример 13. Получение 2,6-(бис(метилен(N,N-диметил-N-додециламмоний)))-3-метоксипиридин дихлорида (I-13)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.25 г (1.21 ммоль) соединения 7а и 0.7 мл (2.42 ммоль) N,N-диметилдодециламина. Выход 0.40 г (52%); маслообразное вещество светло-желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (6H, 3JHH=6.8 Гц, 2СH3), 1.15-1.45 м (36H, 18CH2), 1.76-1.88 м (4H, 2CH2), 3.34 с (6H, 2CH3N+), 3.39 с (6H, 2CH3N+), 3.48-3.56 м (2H, СH2N+), 3.57-3.65 м (2H, СH2N+), 3.97 с (3H, CH3О), 4.75 с (2H, СH2пирN+), 5.11 с (2H, СH2пирN+), 7.49 д (1H, 3JHH=8.6 Гц, CHпир), 8.27 д (1H, 3JHH=8.6 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.27 (СH3), 22.82 (CH2), 23.09 (CH2), 23.17 (CH2), 26.48 (CH2), 26.52 (CH2), 29.46 (CH2), 29.53 (CH2), 29.63 (CH2), 29.73 (CH2), 32.03 (CH2), 50.72 (CH3N+), 51.31 (CH3N+), 56.60 (CH3О), 62.23 (CH2N+), 65.70 (CH2N+), 66.10 (CH2пирN+), 67.04 (CH2пирN+), 120.64 (Cпир), 132.20 (Cпир), 138.10 (Cпир), 141.27 (Cпир), 156.69 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 280.7799, C36H71N3O2+. Вычислено [М-2Cl]2+ 280.7793.
Пример 14. Получение 2,6-(бис(метилен(N,N-диметил-N-тетрадециламмоний)))-3-метоксипиридин дихлорида (I-14)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.25 г (1.21 ммоль) соединения 7а и 0.73 мл (2.42 ммоль) N,N-диметилтетрадециламина. Выход 0.47 г (57%); бежевое кристаллическое вещество; т.пл. 76-78°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (6H, 3JHH=6.1 Гц, 2СH3), 1.14-1.40 м (44H, 22CH2), 1.79 с (4H, 2CH2), 3.31 с (6H, 2CH3N+), 3.35 с (6H, 2CH3N+), 3.46-3.60 м (4H, 2СH2N+), 3.95 с (3H, CH3О), 4.79 с (2H, СH2пирN+), 5.01 с (2H, СH2пирN+), 7.52 д (1H, 3JHH=8.0 Гц, CHпир), 8.17 д (1H, 3JHH=8.0 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.26 (СH3), 22.81 (CH2), 23.09 (CH2), 23.18 (CH2), 26.49 (CH2), 26.51 (CH2), 29.48 (CH2), 29.54 (CH2), 29.63 (CH2), 29.77 (CH2), 32.03 (CH2), 50.69 (CH3N+), 51.36 (CH3N+), 56.62 (CH3О), 62.16 (CH2N+), 65.58 (CH2N+), 66.02 (CH2пирN+), 66.97 (CH2пирN+), 120.64 (Cпир), 132.17 (Cпир), 138.12 (Cпир), 141.26 (Cпир), 156.66 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 308.8112, C40H79N3O2+. Вычислено [М-2Cl]2+ 308.8106.
Пример 15. Получение 2,6-(бис(метилен(N,N-диметил-N-гексадециламмоний)))-3-метоксипиридин дихлорида (I-15)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.25 г (1.21 ммоль) соединения 7а и 0.8 мл (2.42 ммоль) N,N-диметилгексадециламина. Выход 0.45 г (55%); бежевое кристаллическое вещество; т.пл. 68-70°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (6H, 3JHH=5.8 Гц, 2СH3), 1.14-1.43 м (52H, 26CH2), 1.81 с (4H, 2CH2), 3.34 с (6H, 2CH3N+), 3.39 с (6H, 2CH3N+), 3.49-3.66 м (4H, 2CH2N+), 3.96 с (3H, CH3О), 4.93 с (2H, СH2пирN+), 5.12 с (2H, СH2пирN+), 7.49 д (1H, 3JHH=8.2 Гц, CHпир), 8.27 д (1H, 3JHH=8.2 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.26 (СH3), 22.81 (CH2), 23.08 (CH2), 23.17 (CH2), 26.48 (CH2), 26.50 (CH2), 29.48 (CH2), 29.55 (CH2), 29.64 (CH2), 29.78 (CH2), 29.82 (CH2), 32.03 (CH2), 50.64 (CH3N+), 51.32 (CH3N+), 56.60 (CH3О), 62.10 (CH2N+), 65.49 (CH2N+), 66.00 (CH2пирN+), 66.92 (CH2пирN+), 120.64 (Cпир), 132.13 (Cпир), 138.10 (Cпир), 141.22 (Cпир), 156.65 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 336.8423, C44H87N3O2+. Вычислено [М-2Cl]2+ 336.8419.
Пример 16. Получение 2,6-(бис(метилен(N,N-диметил-N-октадециламмоний)))-3-метоксипиридин дихлорида (I-16)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.25 г (1.21 ммоль) соединения 7а и 0.9 мл (2.42 ммоль) N,N-диметилоктадециламина. Выход 0.51 г (53%); бежевое кристаллическое вещество; т.пл. 79-80°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (6H, 3JHH=6.8 Гц, 2СH3), 1.19-1.39 м (60H, 30CH2), 1.82 с (4H, 2CH2), 3.34 с (6H, 2CH3N+), 3.39 с (6H, 2CH3N+), 3.48-3.56 м (2H, CH2N+), 3.57-3.65 м (2H, CH2N+), 3.97 с (3H, CH3О), 4.99 с (2H, СH2пирN+), 5.13 с (2H, СH2пирN+), 7.48 д (1H, 3JHH=8.6 Гц, CHпир), 8.31 д (1H, 3JHH=8.6 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.27 (СH3), 22.82 (CH2), 23.09 (CH2), 23.17 (CH2), 26.47 (CH2), 26.52 (CH2), 29.49 (CH2), 29.54 (CH2), 29.64 (CH2), 29.75 (CH2), 29.80 (CH2), 29.84 (CH2), 32.05 (CH2), 50.69 (CH3N+), 51.30 (CH3N+), 56.60 (CH3О), 62.22 (CH2N+), 65.70 (CH2N+), 66.04 (CH2пирN+), 66.97 (CH2пирN+), 120.59 (Cпир), 132.22 (Cпир), 138.11 (Cпир), 141.30 (Cпир), 156.67 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 364.8730, C48H95N3O2+. Вычислено [М-2Cl]2+ 364.8732.
Пример 17. Получение 3-бутокси-2,6-(бис(метилен(N,N-диметил-N-октиламмоний)))пиридин дихлорида (I-17)
Получение 3-бутокси-2,6-бис(гидроксиметил)пиридина (промежуточное вещество 6б)
В 30.0 мл смеси растворителей метанол : вода = 4:1 растворяли 1.00 г (6.44 ммоль) 3-гидрокси-2,6-бис(гидроксиметил)пиридина 5, добавляли 0.26 г (6.44 ммоль) NaOH и перемешивали до гомогенности. Растворитель отгоняли в вакууме, сухой остаток заливали 25.0 мл ДМСО и при 0°С по каплям добавляли 0.7 мл (6.44 ммоль) бромистого бутила. Далее реакционную смесь перемешивали при 0°С в течении 8 ч. Ход реакции контролировали по ТСХ (элюент смесь этиалцетат : этанол = 10:1). Растворитель отгоняли в вакууме, остаток экстрагировали смесью хлороформ : метанол = 4:1 и очищали с помощью колоночной хроматографии (элюент этилацетат). Выход 0.95 г (70%); маслообразное вещество оранжевого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 (т, 3Н, CH2CH2CH2CH3, 3JHH=8.4 Гц), 1.34-1.40 (м, 2Н, CH2CH2CH2CH3), 1.64-1.68 (м, 2Н, CH2CH2CH2CH3), 3.87 (т, 2Н, CH2CH2CH2CH3, 3JHH=6.5 Гц), 4.60 (c, 2H, CH2O), 4.64 (c, 2H, CH2O), 7.01, 7.07 (AВ-система, 2Н, 4-PyH, 5-PyH, 3JHH=8.0 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.78 (CH3), 18.84 (CH2), 30.71 (CH2), 60.17 (СН2Cl), 63.85 (СН2Cl), 67.72 (СН2O), 120.05 (CPyr), 122.64 (CPyr), 145.90 (CPyr), 149.56 (CPyr), 150.61 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 212.1286, C11H18NO3+. Вычислено [М+Н]+ 212.1281.
Получение 3-бутокси-2,6-бис(хлорметил)пиридина (промежуточное вещество 7б)
Смесь 0.85 г (4.03 ммоль) 3-бутокси-2,6-бис(гидроксиметил)пиридина 6б, 0.6 мл (8.06 ммоль) тионилхлорида и 0.1 мл (1.30 ммоль) ДМФА в 50.0 мл хлороформа кипятили 15 ч. Реакционную смесь охлаждали до ~20°C. Растворитель отгоняли в вакууме. Остаток растворяли в 20.0 мл этилацетата и промывали 10.0 мл 10% раствора NaHCO3. Органическую часть отделяли и отгоняли в вакууме. Выход 0.89 г (89%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 1.10 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц), 1.60-1.64 м (2Н, CH2CH2CH2CH3), 1.90-1.93 м (2Н, CH2CH2CH2CH3), 4.13 м (2Н, CH2CH2CH2CH3), 4.78 c (2H, CH2Cl), 4.86 c (2H, CH2Cl), 7.25, 7.45 (AВ-система, 2Н, 4-PyH, 5-PyH, 3JHH=7.6 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.89 (CH3), 19.33 (CH2), 31.08 (CH2), 46.38 (СН2Cl), 59.57 (СН2Cl), 68.23 (СН2O), 118.14 (CPyr), 122.38 (CPyr), 146.01 (CPyr), 148.40 (CPyr), 153.87 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 248.0609, C11H16Cl2NO+. Вычислено [М+Н]+ 248.0603.
Получение 3-бутокси-2,6-(бис(метилен(N,N-диметил-N-октиламмоний)))пиридин дихлорида (I-17)
Раствор 0.8 мл (4.02 ммоль) N,N-диметилоктиламина и 0.50 г (2.01 ммоль) 3-бутокси-2,6-бис(хлорметил)пиридина (7б) в 30.0 мл этанола нагревали 15 ч при 40°C. Далее растворитель отгоняли в вакууме, сухой остаток растворяли в хлороформе и очищали с помощью колоночной хроматографии (элюент ацетонитрил). Выход 0.78 г (69%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3Н, CH3C7H14, 3JHH=6.7 Гц), 0.97 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц ), 1.23-1.32 м (20Н, 10CH2), 1.41-1.49 м (2Н, CH2CH2CH2CH3), 1.79-1.82 м (6Н, 3СН2), 3.34 с (6Н, 2СH3N+), 3.40 с (6Н, 2СH3N+), 3.56-3.61 м (4Н, 2СН2N+), 4.09 т (2Н, CH2CH2CH2CH3, 3JHH=6.4 Гц), 4.91 м (2Н, CH2N+), 5.11 м (2Н, CH2N+), 7.45, 8.25 (AВ-система, 2Н, 4-PyH, 5-PyH, 3JHH =8.5 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.88 (CH3), 14.14 (CH3), 19.37 (CH2), 22.66 (CH2), 23.05 (CH2), 23.13 (CH2), 26.45 (CH2), 29.13 (CH2), 29.35 (CH2), 30.98 (CH2), 31.74 (CH2), 50.68 (СH3N+), 51.37 (CH3N+), 65.50 (CH2N+), 66.00 (СH2N+), 66.78 (CH2N+), 69.35 (CH2N+), 121.24 (CPyr), 132.13 (CPyr), 138.03 (CPyr), 141.01 (CPyr), 156.11 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 245.7409, C31H61N3O2+. Вычислено [М-2Cl]2+ 245.7402.
Пример 18. Получение 3-бутокси-2,6-(бис(метилен(N,N-диметил-N-додециламмоний)))пиридин дихлорида (I-18)
Синтезировали и разрабатывали аналогично соединению I-17. Взяли 1.1 мл (4.02 ммоль) N,N-диметилдодециламина и 0.50 г (2.01 ммоль) 3-бутокси-2,6-бис(хлорметил)пиридина (7б). Выход 1.01 г (74%); маслообразное вещество бежевого цвета.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3Н, CH3C11H22, 3JHH=6.6 Гц), 0.95 т (3Н, CH2CH2CH2CH3, 3JHH=7.6 Гц ), 1.22-1.32 м (36Н, 18CH2), 1.41-1.46 м (2Н, CH2CH2CH2CH3), 1.75-1.79 м (6Н, 3СН2), 3.26 с (6Н, 2СH3N+), 3.31 с (6Н, 2СH3N+), 3.47-3.51 м (4Н, 2СH2N+), 4.07 т (2Н, CH2CH2CH2CH3, 3JHH=6.4 Гц), 4.78 с (2Н, CH2N+), 4.96 м (2Н, CH2N+), 7.41, 8.12 (AВ-система, 2Н, 4-PyH, 5-PyH, 3JHH=7.8 Гц).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 13.87 (CH3), 14.18 (CH2), 19.35 (CH2), 22.74 (CH2), 23.00 (CH2), 23.12 (CH2), 26.46 (CH2), 29.41 (CH2), 29.52 (CH2), 29.55 (CH2), 29.62 (CH2), 29.68 (CH2), 30.99 (CH2), 31.96 (CH2), 50.59 (СH3N+), 51.24 (CH3N+), 65.13 (CH2N+), 65.94 (СH2N+), 65.94 (CH2N+), 69.16 (CH2N+), 121.06 (CPyr), 131.84 (CPyr), 138.04 (CPyr), 141.06 (CPyr), 155.92 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [M-2Cl]2+ 301.8034, C39H77N3O2+. Вычислено [M-2Cl]2+ 301.8028.
Пример 19. Получение 3-бутокси-2,6-(бис(метилен(N,N-диметил-N-октадециламмоний)))пиридин дихлорида (I-19)
Синтезировали и разрабатывали аналогично соединению I-17. Использовали 1.5 мл (4.02 ммоль) N,N-диметилоктадециламина и 0.50 г (2.01 ммоль) 3-бутокси-2,6-бис(хлорметил)пиридина 7б. Выход 1.24 г (73%); маслообразное вещество бежевого цвета.
Спектр ЯМР 1H (ДМСО-d6) δ, м.д.: 0.85 т (6Н, 2CH3C15H30, 3JHH=6.6 Гц), 0.98 т (3Н, CH2CH2CH2CH3, 3JHH=7.4 Гц ), 1.22-1.32 м (60Н, 30CH2), 1.39-1.46 м (2Н, CH2CH2CH2CH3), 1.76-1.80 м (6Н, CH2CH2CH2CH3, 2СН2), 3.33 с (6Н, 2СH3N+), 3.39 с (6Н, 2СH3N+), 3.52-3.57 м (2Н, СH2N+), 3.61-3.68 м (2Н, СH2N+), 4.09 т (2Н, CH2CH2CH2CH3, 3JHH=6.6 Гц), 4.94 с (2Н, CH2N+), 5.11 м (2Н, CH2N+), 7.41, 8.25 (AВ-система, 2Н, 4-PyH, 5-PyH, 3JHH =8.6 Гц).
Спектр ЯМР 13С (ДМСО-d6) δ, м.д.: 13.88 (CH3), 14.22 (CH3), 19.38 (CH2), 22.78 (CH2), 23.14 (CH2), 26.48 (CH2), 29.46 (CH2), 29.52 (CH2), 29.62 (CH2), 29.80 (CH2), 30.99 (CH2), 32.01 (CH2), 50.67 (СH3N+), 51.31 (CH3N+), 65.54 (CH3N+), 65.98 (СH3N+), 66.90 (CH3N+), 69.31 (CH3N+), 121.08 (CPyr), 132.06 (CPyr), 138.12 (CPyr), 141.11 (CPyr), 156.05 (CPyr).
Масс-спектр (HRMS-ESI): Найдено [M-2Cl]2+ 385.8953, C51H101N3O2+. Вычислено [M-2Cl]2+ 385.8967.
Пример 20. Получение 2,6-(бис(метилен(N,N-диметил-N-додециламмоний)))-3-бензилоксипиридин дихлорида (I-20)
0.30 г (1.06 ммоль) соединения 7в растворяли в 30 мл этанола и добавляли 0.6 мл (2.12 ммоль) N,N-диметилдодециламина. Перемешивали в течение 5 часов при температуре 70°С. Затем растворитель удаляли в вакууме. Сухой остаток промывали ацетоном. Выход 0.40 г (53%); бежевое кристаллическое вещество; 78-80°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=7.1 Гц, СH3), 0.86 т (3H, 3JHH=7.0 Гц, СH3), 1.09-1.41 уш м (36H, 18CH2), 1.66-1.84 м (4H, 2CH2), 3.34 с (6H, 2CH3N+), 3.37 с (6H, 2CH3N+), 3.45-3.53 м (2H, CH2N+), 3.57-3.65 м (2H, CH2N+), 4.96 с (2H, СH2пирN+), 5.13 с (2H, СH2пирN+), 5.18 с (2H, СH2бенз), 7.34-7.43 м (5H, 5СHбенз), 7.56 д (1H, 3JHH=8.7 Гц, CHпир), 8.27 д (1H, 3JHH=8.7 Гц, CHпир).
Спектр ЯМР 13С (100 МГц, CDCl3) δ, м.д.: 14.25 (CH3), 22.79 (CH2), 23.00 (CH2), 23.09 (CH2), 26.45 (CH2), 29.37 (CH2), 29.45 (CH2), 29.50 (CH2), 29.52 (CH2), 29.59 (CH2), 29.61 (CH2), 29.71 (CH2), 32.00 (CH2), 50.67 (СH3N+), 51.28 (CH3N+), 62.20 (CH2N+), 65.57 (СH2N+), 66.03 (CH2пирN+), 66.89 (CH2пирN+), 71.63 (CH2О), 121.80 (Cпир), 128.14 (Cбенз), 129.22 (Cбенз), 132.09 (CPyr), 134.59 (Cбенз), 138.31 (Cпир), 141.50 (Cпир), 155.88 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-2Cl]2+ 318.7949, C42H75N3O2+. Вычислено [М-2Cl]2+ 318.7950.
Пример 21. Получение 2-(метилен(N,N-диметил-N-октиламмоний))-5-метокси-6-метилпиридин хлорида (I-21)
Синтез 6-гидроксиметил-2-метил-3-метоксипиридина (промежуточное вещество 10а)
В смеси 30.0 мл растворителей метанол : вода = 4:1 растворяли 1.00 г (7.19 ммоль) соединения 9, добавляли 0.29 г (7.19 ммоль) NaOH и перемешивали до гомогенности. Растворитель отгоняли в вакууме, сухой остаток заливали 25.0 мл ДМСО и при 0°С по каплям добавляли 0.5 мл (7.19 ммоль) йодистого метила. Перемешивали 8 часов при комнатной температуре. Ход реакции контролировали по ТСХ (элюент хлороформ : этанол=10:1). Отгоняли растворитель на роторном испарителе. Остаток очищали на колонке. Элюент хлороформ : этанол = 10:1. Выход 0.90 г (82%); серое аморфное вещество.
Спектр ЯМР 1H (400 МГц, ДМСО-d6) δ, м.д.: 2.33 с (3H, CH3пир), 3.71 с (3H, CH3О), 4.54 с (2H, СH2пир), 6.97 д (1H, 3JHH=8.3 Гц, CHпир), 7.01 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 19.30 (CH3пир), 55.61 (CH3О), 64.03 (CH2), 117.40 (Cпир), 118.61 (Cпир), 147.98 (Cпир), 149.26 (Cпир), 153.12 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 154.0869, C8H12NO2+. Вычислено [М+Н]+ 154.0863.
Синтез 2-метил-3-метокси-6-(хлорметил)пиридина (промежуточное вещество (11а)
1.00 г (6.53 ммоль) соединения 10а суспензировали в 20.0 мл хлороформа, добавляли 0.5 мл (6.53 ммоль) хлористого тионила и кипятили 8 часов. Далее охлаждали, осадок отфильтровывали и высушивали. Осадок растворяли в 20.0 мл хлороформа и при интенсивном перемешивании добавляли 15 мл водного раствора 0.55 г (6.53 ммоль) гидрокарбоната натрия. Органическую часть отделяли и высушивали в вакууме. Выход 0.99 г (88%); бежевое кристаллическое вещество; т.пл. 66-68°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 2.44 с (3H, CH3пир), 3.81 с (3H, CH3О), 4.60 с (2H, СH2пир), 7.04 д (1H, 3JHH=8.3 Гц, CHпир), 7.22 д (1H, 3JHH=8.3 Гц, CHпир).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 172.0528, C8H11СlNO+. Вычислено [М+Н]+ 172.0524.
Получение 2-(метилен(N,N-диметил-N-октиламмоний))-5-метокси-6-метилпиридин хлорида (I-21):
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.2 мл (1.17 ммоль) N,N-диметилоктиламина. Выход 0.23 г (61%); бежевое кристаллическое вещество; т.пл. 172-174°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=6.8 Гц, СH3), 1.17-1.41 м (10H, 5CH2), 1.80-1.92 м (2H, CH2), 2.43 с (3H, CH3пир), 3.32 с (6H, 2CH3N+), 3.42-3.52 м (2H, СH2N+), 3.86 с (3H, CH3О), 4.94 с (2H, СH2пирN+), 7.16 д (1H, 3JHH=8.3 Гц, CHпир), 7.95 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.11 (СH3), 19.60 (CH3пир), 22.61 (CH2), 22.87 (CH2), 26.28 (CH2), 29.10 (CH2), 29.19 (CH2), 31.67 (CH2), 50.80 (CH3N+), 55.53 (CH3О), 64.31 (CH2N+), 66.08 (CH2пирN+), 116.58 (Cпир), 127.74 (Cпир), 138.57 (Cпир), 149.59 (Cпир), 154.78 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 293.2573, C18H33N2O+. Вычислено [М-Cl]+ 293.2587.
Пример 22. Получение 2-(метилен(N,N-диметил-N-дециламмоний))-5-метокси-6-метилпиридин хлорида (I-22)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.3 мл (1.17 ммоль) N,N-диметилдециламина. Выход 0.24 (70%); бежевое кристаллическое вещество; т.пл. 156-157°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.83 т (3H, 3JHH=5.5 Гц, СH3), 1.14-1.39 м (14H, 7CH2), 1.78-1.91 м (2H, CH2), 2.38 с (3H, CH3пир), 3.30 с (6H, 2CH3N+), 3.38-3.50 м (2H, СH2N+), 3.82 с (3H, CH3О), 4.84 с (2H, СH2пирN+), 7.08 д (1H, 3JHH=8.2 Гц, CHпир), 7.85 д (1H, 3JHH=8.2 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.16 (СH3), 19.60 (CH3пир), 22.69 (CH2), 22.88 (CH2), 26.29 (CH2), 29.24 (CH2), 29.27 (CH2), 29.45 (CH2), 31.88 (CH2), 50.83 (CH3N+), 55.54 (CH3О), 64.33 (CH2N+), 66.15 (CH2пирN+), 116.62 (Cпир), 127.74 (Cпир), 138.56 (Cпир), 149.61 (Cпир), 154.79 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 321.2910, C20H37N2O+. Вычислено [М-Cl]+ 321.2900.
Пример 23. Получение 2-(метилен(N,N-диметил-N-додециламмоний))-5-метокси-6-метилпиридин хлорида (I-23)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.32 мл (1.17 ммоль) N,N-диметилдодециламина. Выход 0.26 г (58%); бежевое кристаллическое вещество; т.пл. 149-150°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.87 т (3H, 3JHH=6.4 Гц, СH3), 1.18-1.47 м (18H, 9CH2), 1.82-1.94 м (2H, CH2), 2.43 с (3H, CH3пир), 3.31 с (6H, 2CH3N+), 3.43-3.53 м (2H, СH2N+), 3.87 с (3H, CH3О), 4.95 с (2H, СH2пирN+), 7.12 д (1H, 3JHH=8.0 Гц, CHпир), 7.97 д (1H, 3JHH=8.0 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.18 (СH3), 19.61 (CH3пир), 22.74 (CH2), 22.92 (CH2), 26.33 (CH2), 29.26 (CH2), 29.38 (CH2), 29.47 (CH2), 29.52 (CH2), 29.64 (CH2), 31.95 (CH2), 50.88 (CH3N+), 55.56 (CH3О), 64.41 (CH2N+), 66.16 (CH2пирN+), 116.66 (Cпир), 127.80 (Cпир), 138.63 (Cпир), 149.63 (Cпир), 154.83 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 349.3212, C22H41N2O+. Вычислено [М-Cl]+ 349.3213.
Пример 24. Получение 2-(метилен(N,N-диметил-N-тетрадециламмоний))-5-метокси-6-метилпиридин хлорида (I-24)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.35 мл (1.17 ммоль) N,N-диметилтетрадециламина. Выход 0.31 г (65%); бежевое кристаллическое вещество; т.пл. 158-159°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.84 т (3H, 3JHH=6.6 Гц, СH3), 1.12-1.40 м (22H, 11CH2), 1.78-1.92 м (2H, CH2), 2.40 с (3H, CH3пир), 3.31 с (6H, 2CH3N+), 3.41-3.49 м (2H, СH2N+), 3.83 с (3H, CH3О), 4.87 с (2H, СH2пирN+), 7.10 д (1H, 3JHH=8.3 Гц, CHпир), 7.88 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.21 (СH3), 19.64 (CH3пир), 22.76 (CH2), 22.92 (CH2), 26.33 (CH2), 29.28 (CH2), 29.43 (CH2), 29.48 (CH2), 29.54 (CH2), 29.66 (CH2), 29.71 (CH2), 29.74 (CH2), 31.99 (CH2), 50.84 (CH3N+), 55.57 (CH3О), 64.43 (CH2N+), 66.17 (CH2пирN+), 116.65 (Cпир), 127.83 (Cпир), 138.61 (Cпир), 149.64 (Cпир), 154.84 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 377.3532, C24H45N2O+. Вычислено [М-Cl]+ 377.3526.
Пример 25. Получение 2-(метилен(N,N-диметил-N-гексадециламмоний))-5-метокси-6-метилпиридин хлорида (I-25)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.4 мл (1.17 ммоль) N,N-диметилгексадециламина. Выход 0.32 г (62%); бежевое кристаллическое вещество; т.пл. 159-160°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=6.5 Гц, СH3), 1.15-1.39 м (26H, 13CH2), 1.79-1.93 м (2H, CH2), 2.40 с (3H, СH3пир), 3.30 с (6H, 2CH3N+), 3.39-3.48 м (2H, СH2N+), 3.84 с (3H, СH3О), 4.85 с (2H, СH2пирN+), 7.11 д (1H, 3JHH=8.0 Гц, CHпир), 7.86 д (1H, 3JHH=8.0 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.20 (СH3), 19.64 (CH3пир), 22.76 (CH2), 22.93 (CH2), 26.34 (CH2), 29.28 (CH2), 29.43 (CH2), 29.49 (CH2), 29.55 (CH2), 29.66 (CH2), 29.73 (CH2), 29.76 (CH2), 32.00 (CH2), 50.85 (CH3N+), 55.57 (CH3О), 64.44 (CH2N+), 66.14 (CH2пирN+), 116.65 (Cпир), 127.84 (Cпир), 138.67 (Cпир), 149.64 (Cпир), 154.85 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 405.3845, C26H49N2O+. Вычислено [М-Cl]+ 405.3839.
Пример 26. Получение 2-(метилен(N,N-диметил-N-октадециламмоний))-5-метокси-6-метилпиридин хлорида (I-26)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (1.17 ммоль) соединения 11а и 0.4 мл (1.17 ммоль) N,N-диметилоктадециламина. Выход 0.36 г (65%); бежевое кристаллическое вещество; т.пл. 156-157°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=6.7 Гц, СH3), 1.12-1.40 м (30H, 15CH2), 1.81-1.91 м (2H, CH2), 2.42 с (3H, CH3пир), 3.32 с (6H, 2CH3N+), 3.42-3.51 м (2H, СH2N+), 3.85 с (3H, CH3О), 4.91 с (2H, СH2пирN+), 7.13 д (1H, 3JHH=8.0 Гц, CHпир), 7.92 д (1H, 3JHH=8.0 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.24 (СH3), 19.69 (CH3пир), 22.80 (CH2), 22.94 (CH2), 26.36 (CH2), 29.31 (CH2), 29.47 (CH2), 29.51 (CH2), 29.58 (CH2), 29.69 (CH2), 29.77 (CH2), 29.81 (CH2), 32.03 (CH2), 50.84 (CH3N+), 55.59 (CH3О), 64.51 (CH2N+), 66.19 (CH2пирN+), 116.65 (Cпир), 127.94 (Cпир), 138.61 (Cпир), 149.66 (Cпир), 154.88 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 433.4158, C28H53N2O+. Вычислено [М-Cl]+ 433.4152.
Пример 27. Получение 5-бутокси-2-(метилен(N,N-диметил-N-октиламмоний))-6-метилпиридин хлорида (I-27)
Синтез 3-бутокси-6-(гидроксиметил)-2-метилпиридина (промежуточное вещество 10б)
В 30.0 мл смеси метанол : вода = 4:1 растворяли 3.00 г (21.56 ммоль) соединения 9, добавляли 0.86 г (21.56 ммоль) NaOH и перемешивали до гомогенности. Растворитель отгоняли в вакууме, сухой остаток заливали 25.0 мл ДМСО и при 0°С добавляли 2.3 мл (21.56) бромистого бутила. Перемешивали 8 часов при 20°С. Растворитель отгоняли, остаток очищали с помощью колоночной хроматографии (элюент хлороформ : этанол = 10:1). Выход 3.6 г (86%); бесцветное аморфное вещество.
Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.97 т (3Н, 3JHH=7.4 Гц, CH3бут), 1.43-1.56 м (2Н, CH2бут), 1.70-1.83 (2Н, CH2бут), 2.43 с (3Н, CH3пир), 3.94 т (2Н, 3JHH=6.4 Гц, CH2бутО), 4.64 c (2H, CH2пирO), 7.04 с (2Н, 2СНпир).
Спектр ЯМР 13С (CDCl3) δ, м.д.: 14.02 (СH3), 19.94 (СH2бут), 20.35 (СH3пир), 30.51 (СH2бут), 63.70 СН2пирO), 70.64 (СH2бутO), 121.97 (Cпир), 123.53 (Cпир), 149.08 (Cпир), 153.49 (Cпир), 155.06 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 196.1337, C11H18NO2+. Вычислено [М+Н]+ 196.1332.
Синтез 3-бутокси-2-метил-6-(хлорметил)пиридина (промежуточное вещество 11б)
Смесь 3.00 г (15.36 ммоль) соединения 10б и 3.3 мл (46.08 ммоль) тионилхлорида в 20.0 мл хлороформа кипятили 8 часов. Реакционную смесь охлаждали, растворитель отгоняли в вакууме. Остаток растворяли в 15.0 мл хлороформа и при интенсивном перемешивании добавляли 15 мл 10% водного раствора NaHCO3. Органическую часть отделяли и отгоняли в вакууме. Выход 2.60 г (79%); маслообразное вещество желтого цвета.
Спектр ЯМР 1H (CDCl3) δ, м.д.: 0.98 т (3Н, 3JHH=7.4 Гц, CH3бут), 1.44-1.56 м (2Н, CH2бут), 1.73-1.84 м (2Н, CH2бут), 2.46 с (3Н, CH3пир), 3.96 т (2Н, 3JHH=6.3 Гц, CH2бутО), 4.61 c (2H, CH2пирCl), 7.04 с (1Н, 3JHH=8.3 Гц, СНпир), 7.21 с (1Н, 3JHH=8.3 Гц, СНпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 14.08 (СH3бут), 19.56 (СH2бут), 19.60 (СH2бут), 31.42 (СH2бут), 47.20 (СН2пир), 68.21 (CH2бутО), 117.85 (Cпир), 127.50 (Cпир), 146.74 (Cпир), 149.27 (Cпир), 153.23 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М+Н]+ 214.0999, C11H17СlNO+. Вычислено [М+Н]+ 214.0993.
Получение 5-бутокси-2-(метилен(N,N-диметил-N-октиламмоний))-6-метилпиридин хлорида (I-27):
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (0.94 ммоль) соединения 11б и 0.2 мл (0.94 ммоль) N,N-диметилоктиламина. Выход 0.23 г (67%); белое кристаллическое вещество; т.пл. 149-150°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.5 Гц, СH3), 0.97 т (3H, 3JHH=7.4 Гц, СH3бут), 1.20-1.38 м (10H, 5CH2), 1.44-1.57 м (2H, CH2бут), 1.74-1.82 м (2H, CH2бут), 1.83-1.91 уш м (2H, CH2), 2.41 с (3H, CH3пир), 3.32 с (6H, 2CH3N+), 3.43-3.51 уш м (2H, СH2N+), 3.97 т (2H, 3JHH=6.3 Гц, СH2О), 4.89 с (2H, СH2пирN+), 7.07 д (1H, 3JHH=8.3 Гц, CHпир), 7.87 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 13.92 (СH3), 14.16 (СH3), 19.37 (CH2), 19.66 (CH2), 22.67 (CH2), 22.93 (CH2), 26.35 (CH2), 29.15 (CH2), 29.25 (CH2), 31.13 (CH2), 31.74 (CH2), 50.83 (CH3N+), 64.49 (CH2N+), 66.30 (CH2О), 68.11 (CH2пирN+), 117.25 (Cпир), 127.85 (Cпир), 138.32 (Cпир), 149.76 (Cпир), 154.38 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 335.3062, C21H39N2O+. Вычислено [М-Cl]+ 335.3057.
Пример 28. Получение 5-бутокси-2-(метилен(N,N-диметил-N-додециламмоний))-6-метилпиридин хлорида (I-28)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (0.94 ммоль) соединения 11б и 0.3 мл (0.94 ммоль) N,N-диметилдодециламина. Выход 0.24 г (60%); белое кристаллическое вещество; т.пл. 140-141°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.5 Гц, СH3), 0.98 т (3H, 3JHH=7.4 Гц, СH3бут), 1.18-1.38 м (18H, 9CH2), 1.45-1.55 м (2H, CH2бут), 1.75-1.83 м (2H, CH2бут), 1.83-1.91 м (2H, CH2), 2.41 с (3H, CH3пир), 3.32 с (6H, 2CH3N+), 3.44-3.50 м (2H, СH2N+), 3.97 т (2H, 3JHH=6.2 Гц, СH2О), 4.89 с (2H, СH2пирN+), 7.07 д (1H, 3JHH=8.3 Гц, CHпир), 7.89 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 13.93 (СH3), 14.23 (СH3), 19.38 (CH2), 19.68 (CH2), 22.78 (CH2), 22.94 (CH2), 26.36 (CH2), 29.30 (CH2), 29.42 (CH2), 29.50 (CH2), 29.56 (CH2), 29.68 (CH2), 31.13 (CH2), 32.00 (CH2), 50.83 (CH3N+), 64.51 (CH2О), 66.29 (CH2N+), 68.11 (CH2пирN+), 117.26 (Cпир), 127.87 (Cпир), 138.32 (Cпир), 149.75 (Cпир), 154.38 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 391.3688, C25H47N2O+. Вычислено [М-Cl]+ 391.3683.
Пример 29. Получение 5-бутокси-2-(метилен(N,N-диметил-N-октадециламмоний))-6-метилпиридин хлорида (I-29)
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.20 г (0.94 ммоль) соединения 11б и 0.4 мл (0.94 ммоль) N,N-диметилоктадециламина. Выход 0.30 г (63%); белое кристаллическое вещество; т.пл. 136-138°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.86 т (3H, 3JHH=6.5 Гц, СH3), 0.99 т (3H, 3JHH=7.4 Гц, СH3бут), 1.22-1.38 м (30H, 15CH2), 1.47-1.56 м (2H, CH2бут), 1.77-1.82 м (2H, CH2бут), 1.85-1.91 м (2H, CH2), 2.42 с (3H, CH3пир), 3.32 с (6H, 2CH3N+), 3.44-3.50 м (2H, СH2N+), 3.97 т (2H, 3JHH=6.3 Гц, СH2О), 4.91 с (2H, СH2пирN+), 7.08 д (1H, 3JHH=8.3 Гц, CHпир), 7.90 д (1H, 3JHH=8.3 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, CDCl3) δ, м.д.: 13.81 (СH3), 14.12 (СH3), 19.27 (CH2), 19.53 (CH2), 22.68 (CH2), 22.86 (CH2), 26.27 (CH2), 29.22 (CH2), 29.35 (CH2), 29.43 (CH2), 29.48 (CH2), 29.60 (CH2), 29.65 (CH2), 29.70 (CH2), 31.04 (CH2), 31.92 (CH2), 50.79 (CH3N+), 64.23 (CH2О), 66.11 (CH2N+), 68.00 (CH2пирN+), 117.16 (Cпир), 127.59 (Cпир), 138.31 (Cпир), 149.65 (Cпир), 154.23 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 475.4627, C31H59N2O+. Вычислено [М-Cl]+ 475.4622.
Пример 30. Получение 5-бензилокси-2-(метилен(N,N-диметил-N-тетрадециламмоний))-6-метилпиридин хлорида (I-30)
Синтез 3-(бензилокси)-6-(хлорметил)-2-метилпиридина (промежуточное вещество 11в)
1.00 г (4.36 ммоль) соединения 10в растворяли в 20.0 мл хлороформа, добавляли по каплям 0.95 мл (13.08 ммоль) хлористого тионила. Реакционную смесь кипятили 5 часов при перемешивании. После охлаждения растворитель удаляли в вакууме. Далее к 1 г сухого остатка в 20 мл хлороформа при интенсивном перемешивании добавляли 0.30 г (3.52 ммоль) гидрокарбоната натрия в 10.0 мл воды и перемешивали в течение 10 мин. Органическую часть отделяли, растворитель удаляли в вакууме. Остаток очищали с помощью колоночной хроматографии (элюент хлороформ : этанол = 10:1). Выход 0.7 г (80%); бежевое кристаллическое вещество; т.пл. 62-64°С
2.53 с (3H, CH3пир), 4.62 с (2H, СH2Cl), 5.10 с (2H, СH2бенз), 7.12 д (1H, 3JHH=8.3 Гц, CHпир), 7.22 д (1H, 3JHH=8.3 Гц, CHпир), 7.31-7.44 уш м (5H, 5СHбенз),
Спектр ЯМР 13С (CDCl3) δ, м.д.: 19.61 (СH3пир), 46.87 (СH2пир), 70.19 (СH2O), 118.51 (Cпир), 121.34 (Cбенз), 127.23 (Cпир), 128.29 (Cбенз), 128.82 (Cбенз), 136.37 (Cпир), 147.15 (Cбенз), 149.28 (Cпир), 152.62 (Cпир).
Получение 5-бензилокси-2-(метилен(N,N-диметил-N-тетрадециламмоний))-6-метилпиридин бромида (I-30):
Синтезировали и разрабатывали аналогично соединению I-11. Использовали 0.31 г соединения 11в и 0.38 мл (1.25 ммоль) N,N-диметилтетрадециламина. Выход 0.38 г (61%); белое кристаллическое вещество; т.пл. 88-90°С.
Спектр ЯМР 1H (400 МГц, CDCl3) δ, м.д.: 0.85 т (3H, 3JHH=6.7 Гц, СH3), 1.13-1.45 м (22H, 11CH2), 1.81-1.92 м (2H, CH2), 2.43 с (3H, CH3пир), 3.33 с (6H, 2CH3N+), 3.42-3.50 м (2H, СH2N+), 4.91 с (2H, СH2пирN+), 5.09 с (2H, CH2О), 7.17 д (1H, 3JHH=8.4 Гц, CHпир), 7.30-7.43 м (5H, 5CHбенз), 7.91 д (1H, 3JHH=8.4 Гц, CHпир).
Спектр ЯМР 13C (100 МГц, ДМСО-d6) δ, м.д.: 14.22 (СH3), 19.84 (CH3пир), 22.78 (CH2), 22.94 (CH2), 26.36 (CH2), 29.30 (CH2), 29.44 (CH2), 29.50 (CH2), 29.56 (CH2), 29.68 (CH2), 29.73 (CH2), 29.76 (CH2), 32.01 (CH2), 50.87 (CH3N+), 64.54 (CH2N+), 66.14 (CH2О), 70.25 (CH2пирN+), 118.10 (Cпир), 127.41 (C), 127.84 (C), 128.45 (C), 128.84 (C), 135.90 (C), 138.98 (C), 149.95 (Cпир), 153.93 (Cпир).
Масс-спектр (HRMS-ESI): Найдено [М-Cl]+ 453.3845, C30H49N2O+. Вычислено [М-Cl]+ 453.3839.
Пример 31. Исследование антибактериальной активности заявленных четвертичных аммониевых соединений на основе 3-гидроксипиридина in vitro
Измерение антибактериальной активности заявленных соединений проводилось на музейных штаммах Staphylococcus aureus ATCC 25923, Staphylococcus epidermidis ATCC 14990, Bacillus subtilis ATCC 6633, Escherichia coli ATCC 25922, Klebsiella pneumoniae ATCC 13883, Pseudomonas aeruginosa ATCC 27853. Сравнительная оценка спектра антибактериального действия на эталонных штаммах и клинических изолятах грамположительных и грамотрицательных бактерий проводилась с использованием микрометода определения минимальной подавляющей концентрации (МПК) методом серийных разведений в бульоне Мюллера-Хинтон [Определение чувствительности микроорганизмов к антибактериальным препаратам (Методические указания МУК 4.2.1890-04) / М.: Федеральный центр госсанэпиднадзора Минздрава России, 2004. - 91 с.].
Метод разведения основан на использовании двойных последовательных разведений концентраций заявленных соединений от максимальной к минимальной. Оценку роста культур проводят визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест - соединений с ростом культуры без них. Наличие роста микроорганизма в бульоне (помутнение бульона) свидетельствует о том, что данная концентрация заявленного соединения недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации заявленного соединения рост микроорганизма ухудшается.
Первую наименьшую концентрацию заявленного соединения (из серии последовательных разведений), где визуально не определяется бактериальный рост, принято считать минимальной подавляющей концентрацией (МПК).
Для приготовления инокулюма использовали чистую, суточную культуру бактерий, выросших на плотной питательной среде (агаризованная среда Мюллера-Хинтона (МХ)). В стерильном изотоническом растворе хлорида натрия готовили взвесь микроорганизмов, доводя плотность инокулюма до 0.5 по стандарту МакФарланда (1.5⋅108 КОЕ/мл). Затем полученный инокулят разводили до концентрации 107 КОЕ/мл МХ-бульоном. Инокулюм использовали в течение 15 минут после приготовления; чистота бактериальных штаммов контролировалась перед каждым экспериментом.
В лунки каждого планшета вносили по 100 мкл бульона Мюллера-Хинтон; в первую лунку вносили исследуемое соединение в концентрации 128 мкг/мл в объеме 100 мкл и последовательным двукратным разведением доводили его концентрацию до 0.06 мкг/мл. Затем в каждую лунку вносили приготовленный инокулюм, разводя тем самым вдвое концентрацию заявленных соединений (начальной концентрация составила 64.0 мкг/мл). Каждое соединение в эксперименте титровали трижды. В качестве контроля включали лунки, не содержащие тестируемых соединений (контроль роста культуры). Кроме того, ставился контроль чистоты питательных сред и растворителей. Планшеты инкубировали в термостате при 37°С в течение 18-24 часов.
В качестве препаратов сравнения использовали широко применяемые известные антисептические средства - мирамистин, бензалкония хлорид и хлоргексидин.
Как видно из представленных в Таблице 1 на Фиг. 1 данных, ряд из заявленных соединений (I-5, I-8, I-13, I-18, I-20 и I-24) обладают, в целом, большей антибактериальной активностью, чем препараты сравнения. Cоединения I-4, I-10, I-12, I-25 и I-28 обладали активностью сопоставимой с бензалконием хлоридом, мирамистином и хлоргексидином.
Для соединений I-5, I-13, I-20 и I-24 было проведено углубленное исследование антибактериальной активности на клинических штаммах микроорганизмов (Staphylococcus auricularis NKC 7, Staphylococcus haemolyticus NKC 31/2, Staphylococcus epidermidis NKC 37/1, Staphylococcus aureus 1812, Staphylococcus aureus 4721, Staphylococcus aureus MRSA 4771, Staphylococcus haemolyticus 1464, Enterococcus faecalis 1465, Escherichia coli NKC 1, Pseudomonas aeruginosa NKC 17, Cedecea davisae 1813, Serratia marcescens 2560, Klebsiella pneumoniae 1678, Enterobacter aerogenes NKC 8, Enterobacter cloacae 2092, Proteus mirabilis NKC 30), результаты представлены в Таблице 2 на Фиг. 2. В качестве препаратов сравнения использовались мирамистин, бензалкония хлорид и хлоргексидин. Соединения I-5, I-13 и I-20 проявили большую в сравнении с референсными препаратами активность на штаммах как грамположительных, так и грамотрицательных бактерий. Соединение I-20 обладало активностью сопоставимой с хлоргексидином. При этом оно было существенно более активно, чем мирамистин и бензалконий хлорид.
Пример 32. Исследование цитотоксичности заявленных четвертичных аммониевых соединений на основе 3-гидроксипиридина in vitro
Цитотоксичность наиболее активных из заявленных соединений (I-4, I-5, I-10, I-12, I-13, I-20 и I-24), в отношении условно-нормальных клеток человека (эмбриональные клетки почки человека НЕК-293, клетки печени человека CHL, фибробласты кожи человека HSF), определяли в сопоставлении с коммерческими антисептиками - хлоргексидином, бензалкония хлоридом и мирамистином. Исследование включало в себя пролиферативный МТТ-тест с последующим построением кривой доза-эффект и определения концентраций полумаксимального ингибирования роста условно-нормальных клеток (СС50).
Клетки культивировали в среде α-MEM (содержащей глутамин, 10 %-ную эмбриональную телячью сыворотку, 1 % пенициллин-стрептомицин) в атмосфере 5 %-го СО2 при 37°С до образования монослоя. Для получения клеточной суспензии монослой клеток трипсинизировали с последующей инактивацией трипсина добавлением среды α-MEM с сывороткой. Подсчет клеток производили в камере Нэйбауэра методом исключения трипанового синего. Клетки пересевали 2 раза в неделю в отношении 1:6.
Для осуществления трехдневного теста в лунки 96-ти луночного планшета в зависимости от пролиферативного потенциала вносили 20000÷40000 клеток в 200 микролитрах культуральной среды. Перед внесением в планшет клетки тщательно суспензировали. Клеточную суспензию вносили в лунки планшета с помощью многоканального дозатора и стерильных наконечников. Далее планшеты с клетками инкубировали 24 часа в СО2 инкубаторе для адгезии клеток к субстрату.
По истечении этого времени в стерильном 96-ти луночном планшете готовили серийные разведения (8 концентраций) анализируемых соединений в стерильной очищенной воде. В лунки планшета с клетками вносили аликвоты приготовленных растворов исследуемых соединений в объеме 22.2 микролитра в каждую лунку. Исследование проводили в трех повторностях.
После внесения исследуемых веществ клетки культивировали в СО2 инкубаторе в стандартных условиях в течение 72 часов. На третий день культивирования конфлюентность клеток в контрольных лунках составляла 70-90 % поверхности дна. По истечении времени инкубации культуральную среду с исследуемыми веществами удаляли из планшета с помощью вакуумного аспиратора.
В ванночке для многоканального дозатора готовили смесь: 8 мл культуральной среды + 2 мл MTT-реагента (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) (5 мг/мл в растворе Хэнкса) на один 96-ти луночный планшет. Приготовленную реакционную смесь вносили в объеме 100 мкл в каждую лунку планшета и инкубировали в СО2 инкубаторе 3 часа. Культуральную среду с исследуемыми соединениями удаляли вакуумным аспиратором. В каждую лунку планшета вносили 100 мкл ДМСО и инкубировали 5-10 минут. Появившееся фиолетовое окрашивание детектировали на планшетном ридере Tecan при 550 нм (референтная длина волны - 700 нм).
Далее рассчитывали концентрацию полумаксимального ингибирования роста клеток (CС50), принимая жизнеспособность клеток в контрольных лунках за 100%. Результаты представляли в процентном отношении к контролю, который не обрабатывали исследуемыми препаратами. Для препаратов строили кривую «доза-эффект» и определяли величины СC50 с помощью программного обеспечения OriginPro8. Результаты исследования представлены в таблице 3 на Фиг. 3.
По результатам исследования цитотоксической активности можно сделать вывод, что среди исследованных соединений наименее токсичным является I-20, чья токсичность оказалась сопоставимой с мирамистином. Другие соединения были более токсичными, величина СС50 для них была сопоставима с хлоридом бензалкония.
Пример 33. Исследование острой токсичности соединения I-13 в эксперименте in vivo на мышах
Исследование острой токсичности соединения I-13 проводилось на мышах СD-1 (ICR) (6-10 недель, 20-25 г). Формировали группы, состоящие из 3-х самок, при необходимости добавляли 3-х самцов. Использовалось однократное внутрижелудочное введение каждого из тестируемых соединений в объеме не более 1.0 мл на 25 г массы тела мыши. После введения тестируемого вещества животные наблюдались индивидуально на протяжении 30 минут, затем не реже раза в час на протяжении 4-х часов, далее ежедневно 1 раз в день в течение 14 дней. Расчет ЛД50 производился с использованием пробит-анализа в программном обеспечении IBM SPSS Statistics. Результаты исследования представлены в Таблице 4 на Фиг.4.
Сразу после перорального введения 3 самкам и 3 самкам мышей соединения I-13 в дозе 500 мг/кг наблюдали угнетение состояния животных, нахохливание, у одного самца непродолжительно наблюдался тремор. Несмотря на угнетенное состояние, до конца периода наблюдения не пало ни одно животное.
После перорального введения 3 самкам и 3 самкам мышей дозы 750 мг/кг наблюдали угнетение состояния животных, тяжелое дыхание, нахохливание. В течение следующих двух суток пали два самца и одна самка.
После перорального введения 3 самкам мышей дозы 1000 мг/кг сразу наступало заметное ухудшение состояния животных: нахохливание, прикрытые глаза. В течение следующих суток пали 2 животных.
Вскрытие животных, получивших соединение I-13 в дозах 500, 750 и 1000 мг/кг после 14 дневного наблюдения, не выявило существенных патологий.
Таким образом, соединение I-13 имеет величину ЛД50 составляющую 826 мг/кг. Данное соединение обладает существенно меньшей токсичностью в сравнении с бензалкония хлоридом (ЛД50=150 мг/кг) [Benzalkonium chloride.Kemsol MOSS-KILL safety data sheet] и является немного более токсичным чем мирамистин (ЛД50=1000 мг/кг) [Пат. 2161961 Российская Федерация, МПК7, С1, А 61 К 31/14, А 61 Р 31/00. Лекарственный препарат / Кривошеин Ю.С., Рудько А.П.; заявитель и патентообладатель Кривошеин Ю.С., Рудько А.П. - № 2000106427/14; заявкл. 17.03.2000№ опубл. 20.01.2001] и хлоргексидин (ЛД50=1260 мг/кг) [0.05 % Chlorhexidine & 0.5 % Cetrimide Aqueous Irrigation Pfizer material safety data sheet.].
Таким образом, из описанного выше можно сделать вывод, что заявителем достигнут заявленный технический результат, а именно - расширен арсенал известных средств указанного назначения путем создания новых соединений общей формулы (I), содержащих в своем составе фрагмент 3-гидроксипиридина и четвертичные аммониевые фрагменты, и обладающих антибактериальной активностью, в т.ч. в отношении клинических бактериальных штаммов.
Заявленное техническое решение соответствует критерию «новизна», предъявляемому к изобретениям, так как из исследованного уровня техники не выявлены технические решения, обладающие заявленной совокупностью отличительных признаков, обеспечивающих достижение заявленных результатов.
Заявленное техническое решение соответствует критерию «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалиста в данной области науки и техники.
Заявленное техническое решение соответствует критерию «промышленная применимость», так как может быть реализовано на любом специализированном предприятии с использованием стандартного оборудования, известных отечественных материалов и технологий.
| название | год | авторы | номер документа |
|---|---|---|---|
| Бис-аммониевые соединения на основе пиридоксина, обладающие антибактериальными и антимикотическими свойствами | 2020 |
|
RU2731999C1 |
| Четвертичные аммониевые соединения на основе производных пиридоксина и жирных карбоновых кислот, обладающие антибактериальной активностью | 2022 |
|
RU2795265C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Способ получения 5,8-(бис(метилен(N,N-диметил-N-додециламмоний))-2-этил-4H-[1,3]диоксино[4,5-c]пиридиний дихлорида | 2019 |
|
RU2697848C1 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
| Азопроизводные аминофенолов, обладающие способностью ингибировать образование конечных продуктов гликирования | 2024 |
|
RU2839138C1 |
| НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ПРОИЗВОДНЫХ ПИРИДОКСИНА | 2012 |
|
RU2513089C1 |
| ПРОИЗВОДНЫЕ ПИРИДОКСИНА С НЕЛИНЕЙНЫМИ ОПТИЧЕСКИМИ СВОЙСТВАМИ | 2012 |
|
RU2501801C1 |




Изобретение относится к химии органических гетероциклических соединений, а именно к новым четвертичным аммониевым соединениям на основе 3-гидроксипиридина общей формулы (I), где R1-R3 определены в формуле изобретения, проявляющим антибактериальную активность. Соединения могут найти применение в медицине и ветеринарии. 1 з.п. ф-лы, 4 ил., 33 пр.
I
1. Четвертичные аммониевые соединения на основе 3-гидроксипиридина общей формулы (I):
где:
R1 = C2H5; R2 = CH2N+(CH3)2C8H17; R3 =H; n = 1;
R1 = C2H5; R2 = CH2N+(CH3)2C10H21; R3 =H; n = 1;
R1 = C2H5; R2 = CH2N+(CH3)2C12H25; R3 =H; n = 1;
R1 = C2H5; R2 = CH2N+(CH3)2C14H29; R3 =H; n = 1;
R1 = C2H5; R2 = CH2N+(CH3)2C16H33; R3 =H; n = 1;
R1 = C2H5; R2 = CH2N+(CH3)2C18H37; R3 =H; n = 1;
R1 = C4H9; R2 = CH2N+(CH3)2C8H17; R3 =H; n = 1;
R1 = C4H9; R2 = CH2N+(CH3)2C12H25; R3 =H; n = 1;
R1 = C4H9; R2 = CH2N+(CH3)2C18H37; R3 =H; n = 1;
R1 = CH2C6H5; R2 = CH2N+(CH3)2C16H33; R3 =H; n = 1;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C8H17; n = 2;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C10H21; n = 2;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C12H25; n = 2;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C14H29; n = 2;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C16H33; n = 2;
R1 = CH3; R2 = R3 = CH2N+(CH3)2C18H37; n = 2;
R1 = C4H9; R2 = R3 = CH2N+(CH3)2C8H17; n = 2;
R1 = C4H9; R2 = R3 = CH2N+(CH3)2C12H25; n = 2;
R1 = C4H9; R2 = R3 = CH2N+(CH3)2C18H37; n = 2;
R1 = CH2C6H5; R2 = R3 = CH2N+(CH3)2C12H25; n = 2;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C8H17; n = 1;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C10H21; n = 1;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C12H25; n = 1;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C14H29; n = 1;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C16H33; n = 1;
R1 = CH3; R2 = CH3; R3 = CH2N+(CH3)2C18H37; n = 1;
R1 = C4H9; R2 = CH3; R3 = CH2N+(CH3)2C8H17; n = 1;
R1 = C4H9; R2 = CH3; R3 = CH2N+(CH3)2C12H25; n = 1;
R1 = C4H9; R2 = CH3; R3 = CH2N+(CH3)2C18H37; n = 1;
R1 = CH2C6H5; R2 = CH3; R3 = CH2N+(CH3)2C14H29; n = 1.
2. Четвертичные аммониевые соединения на основе 3-гидроксипиридина по п. 1, обладающие антибактериальной активностью.
| Бис-аммониевые соединения на основе пиридоксина, обладающие антибактериальными и антимикотическими свойствами | 2020 |
|
RU2731999C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| Сапожников Сергей Витальевич, "Синтез и биологическая активность четвертичных аммониевых соединений на основе производных витамина В6", Автореферат, Казань, 2020, 26 стр | |||
| С.В | |||
| Сапожников и др., "СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ НА ОСНОВЕ ПРОИЗВОДНЫХ | |||
Авторы
Даты
2022-08-22—Публикация
2021-12-17—Подача