Изобретение относится к рыбному хозяйству и может быть использовано для контроля происхождения продукции осетровых рыб.
Осетровые виды рыб, такие как сибирский осетр и стерлядь, традиционно считаются одними из самых ценных рыбных ресурсов. Из-за масштабного снижения численности осетровых видов рыб, промысел данных видов в водных объектах Российской Федерации строго ограничен или полностью запрещен. В настоящее время основными источниками поступления черной икры и филе в торговые сети являются рыбоводные хозяйства. Однако, несмотря на запрет промысла осетровых рыб, известно, что заметная доля продукции осетровых рыб, присутствующей на рынке, является результатом браконьерского промысла.
Следует отметить, что визуальный анализ морфологических характеристик икры и филе не дает оснований для установления происхождения рыб-производителей из аквакультуры или же природных местообитаний.
Для определения происхождения филе (мышечной ткани) рыб предложено использовать маркерные жирные кислоты (далее - ЖК), являющиеся естественными метаболитами клеток и усваивающимися из пищевых источников [Sciuto S., Esposito G., Guglielmetti C., Mazza M., Cocco C., Ru G., Acutis P.L. 2019. Development of a novel method for rapid discrimination between wild and farmed sea bream. Journal of Food Protection. V. 82. P. 1870-1873]. При исследовании филе дорады (Sparusaurata) было предложено использовать соотношение докозагексаеновой кислоты, ДГК, 22:6n-3, и альфа-линоленовой кислоты, АЛК, 18:3n-3. Соотношение ДГК/АЛК, превышающее 3,25, указывало на природное происхождение филе дорады.
Недостатком данного способа является ограниченное число ЖК-маркеров, предложенных для идентификации дикого или аквакультурного происхождения филе рыб, поскольку жирнокислотный состав мышечной ткани в значительной степени вариабелен и зависит от кормовой базы рыб, сезона вылова, стадии онтогенеза и репродуктивного цикла. Кроме того, исследование выполнено для одного вида морских рыб, значительно отличающихся по составу ЖК от пресноводных. Поэтому, предложенное соотношение ДГК/АЛК может не работать при определении происхождения продукции осетровых, являющихся пресноводными гидробионтами, из природных популяций или же аквакультуры.
Наиболее близким по технической сущности является способ определения происхождения икры осетровых видов рыб с использованием отдельных ЖК в качестве биохимических маркеров [Birstein V.J., Poletaev A.I, Goncharov B.F. 1993. The DNA content in Eurasian sturgeon species determined by flow cytometry. Cytometry. V. 14. P. 377-383.]. При сравнении биохимического состава икры русского осетра (Acipenser gueldenstaedtii) из природных местообитаний и выращенного в условиях аквакультуры сибирского осетра (Acipenser baerii) было обнаружено, что относительное содержание линолевой кислоты, 18:2n-6, выше в икре аквакультурного сибирского осетра, тогда как относительное содержание арахидоновой кислоты, 20:4n-6, - в икре дикого русского осетра. Различия в относительном содержании этих ЖК авторы предлагают использовать для определения происхождения икры осетровых из аквакультуры или же природных местообитаний.
У данного способа были отмечены недостатки, а именно, отсутствовали вышеуказанные различия при сравнении икры севрюги (Acipenser stellatus) дикой популяции и экстенсивно выращиваемой аквакультуры (на естественной кормовой базе прудов). Кроме того, в работе отсутствуют пороговые значения предложенных маркерных ЖК, которые позволили бы четко разграничивать природных и аквакультурно выращенных рыб. Для успешного применения ЖК-маркерного подхода для определения среды обитания осетровых, авторы предлагают добавлять в аквакультурные корма специфические компоненты, содержащие маркерные ЖК. Такой подход требует всесторонних исследований о влиянии внесенных в корма добавок на рост и развитие рыб в условиях аквакультуры, заключения договоров с производителями кормов и рыбоводными хозяйствами, финансовых расходов при составлении новых формул аквакультурных кормов.
Задачей настоящего изобретения является разработка способа идентификации среды обитания осетровых рыб с помощью биохимических маркеров.
Состав и пропорции жирных кислот тканей рыб также, как и у многих других животных, в значительной степени зависит от этих характеристик их пищи. При современном аквакультурном выращивании рыб, как правило, используются искусственные корма, содержащие добавки растительных масел. Как известно, растительные масла отличаются специфическим ЖК составом с высокими уровнями олеиновой, линолевой и иногда линоленовой кислот. Кроме того, в аквакультурные корма добавляют пищевые ингридиенты морского происхождения (рыбная мука, рыбий жир), содержащие большую долю мононенасыщенных длинноцепочечных ЖК. В свою очередь, осетровые рыбы, нагуливающиеся в естественных пресноводных местообитаниях, главных образом - в реках, питаются преимущественно бентосными беспозвоночными животными. Жирнокислотный состав организмов бентоса включает компоненты, синтезируемые водорослями и передаваемые по трофическим цепям. Характерными особенностями биохимического состава речного бентоса является повышенное содержание пальмитолеиновой и эйкозапентаеновой кислот, синтезируемых диатомовыми водорослями.
Задача достигается тем, что в способе идентификации среды обитания осетровых рыб с помощью биохимических маркеров, характеризующегося тем, что включает подготовку проб из икры либо мышечной ткани осетровых рыб, содержащих жирные кислоты, применяющиеся как биохимические маркерные вещества, экстракцию липидов из вышеуказанных проб, приготовление метиловых эфиров жирных кислот, их последующий газохроматографический анализ с измерением процентного содержания от общей суммы всех идентифицированных жирных кислот; при этом в качестве идентификатора среды обитания предложены пороговые значения соотношения суммы процентного содержания пальмитолеиновой кислоты, эйкозапентаеновой кислоты, вакценовой кислоты и насыщенных разветвленных кислот с 15-17 атомами углерода, к сумме процентного содержания олеиновой кислоты, линолевой кислоты и мононенасыщенных кислот с 20-22 атомами углерода, при этом пороговые значения равные 0,45 и более свойственны для рыб из природных популяций, а менее 0,45 для рыб из аквакультуры.
Использование в данном техническом решении строгих пороговых значений соотношения содержаний нескольких биомаркерных ЖК в икре и филе осетровых видов рыб, отличает заявляемое техническое решение от прототипа и не выявлено в других технических решениях данных и смежных областей. Отличительные признаки заявляемого технического решения позволяют реализовать способ быстро и точно проводить экспертизу рыбной продукции осетровых, а именно икры и филе, для идентификации ее происхождения и позволит выявлять и предотвращать появление браконьерской продукции, происходящей из природных мест обитаний, в торговых сетях и товарном экспорте под видом аквакультурной, что, тем самым, обеспечивает заявляемому решению соответствие критерию «изобретательский уровень».
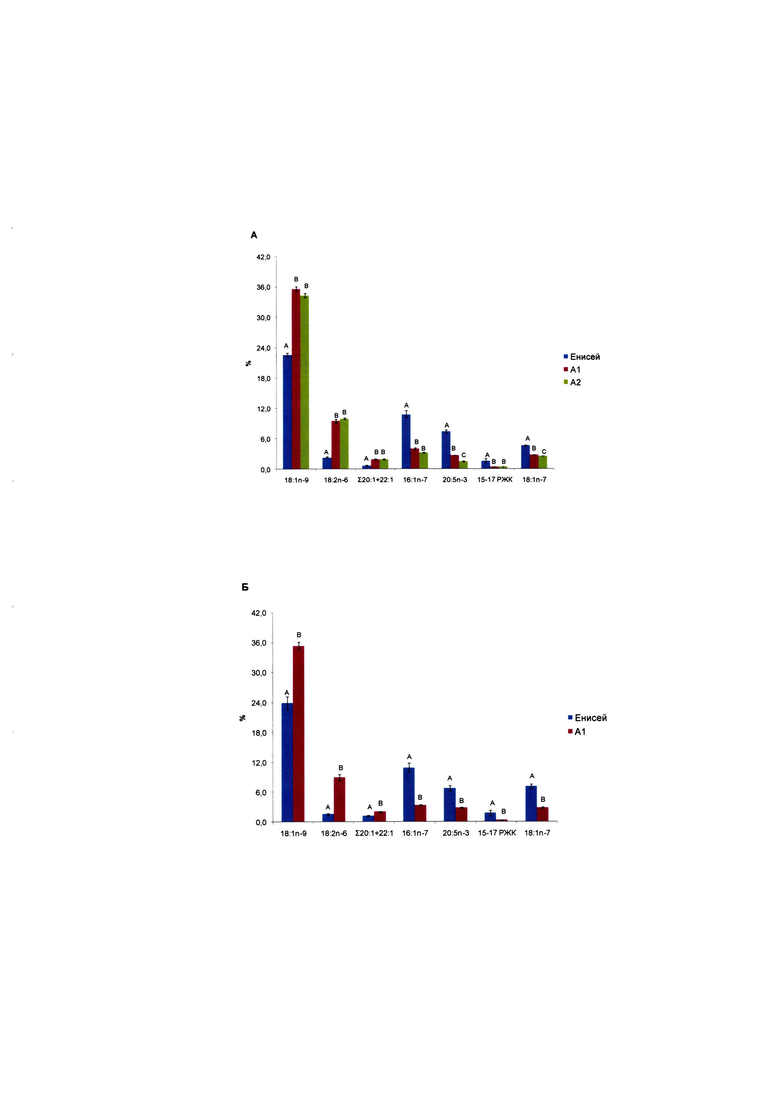
Способ идентификации среды обитания осетровых рыб с помощью биохимических маркеров поясняется рисунком. На рис. представлено содержание (% от суммы ЖК) биомаркерных жирных кислот в икре стерляди (Acipenser ruthenus) (А) и сибирского осетра (Acipenser baerii) (Б) из р. Енисей и рыбоводных хозяйств А1 и А2. Средние значения отдельных ЖК, обозначенные одинаковыми буквами, достоверно не отличаются по критерию LSD Фишера для posthoc теста в однофакторном дисперсионном анализе (для стерляди) и по критерию Манна-Уитни (для осетра).
Способ идентификации среды обитания осетровых рыб с помощью биохимических маркеров реализуется следующим образом.
От исследуемых тканей осетровых рыб (икра или филе) берут навеску образца массой 0,5-1 г. Для фиксации каждую пробу икры или филе помещают в стеклянный флакон с 5 мл смеси (хлороформ: метанол, 2:1 по объему), флакон плотно укупоривают, и хранят при температуре -20°С до экстракции липидов.
Экстракцию липидов из пробы проводят по методу Фолча с модификацией [ChristieW.W., HanX. 2003. Lipid analysis - Isolation, Separation, Identification and Structural Analysis of Lipids. Bridgewater P.J. Barnes & Associates. The Oily Press. 416 p.]. Для этого пробу и фиксирующую смесь перемещают в фарфоровую ступку, добавляют стеклянные бусы. Далее пробу гомогенизируют в ступке в течение 2-3 мин. Экстракт фильтруют через слой безводного Na2SO4 для осушения, затем к пробе добавляют 3 мл той же экстрагирующей смеси и выполняют повторную гомогенизацию в течение такого же времени. Повторно сливают экстракт и гомогенизируют с новой порцией смеси объемом 3 мл. Все осушенные экстракты липидов собирают в колбу. Далее растворители упаривают на роторном вакуумном испарителе при температуре 37°С.
Затем проводят метанол из липидного экстракта следующим способом: к сухому экстракту добавляют 0,2 мл 5% раствора металлического Na в метаноле и 1 мл гексана. После добавления реактивов плотно закрытую колбу необходимо непрерывно встряхивать в течение 1 мин и оставить в покое еще на 2-3 мин для завершения реакции. По окончании реакции в колбу добавляют 2 мл насыщенного водного раствора NaCl. Полученные метиловые эфиры жирных кислот дважды экстрагируют из реакционной смеси гексаном. Гексановый экстракт дважды промывают аликвотами насыщенного раствора NaCl и осушают, пропуская через слой безводного Na2SO4. Гексан отгоняют на роторном вакуумном испарителе.
Анализ метиловых эфиров жирных кислот проводят на газовом хроматографе с масс-спектрометрическим детектором (модель 6890/5975С, «Agilent Technologies», США) с колонкой HP-FFAP. Условия анализа следующие: несущий газ - гелий, ввод без деления потока, капиллярная колонка HP-FFAP длиной 30 м и внутренним диаметром 0,25 мм.
Применяется следующий температурный режим: подъем от 100 до 190°С со скоростью 3°С/мин, затем 5 мин изотермально, второй подъем температуры от 190 до 230°С со скоростью 10°С/мин и 20 мин изотермально; температура ввода - 250°С, интерфейса -280°С; энергия ионизации детектора - 70 эВ, сканирование в диапазоне 45-450 атомных единиц. Идентификацию пиков жирных кислот можно осуществлять по полученным масс-спектрам, сравнением их с имеющимися в базе данных Agilent NIST 2005, а также сравнением времен удерживания с таковыми стандартов (Sigma, США).
Реализация шагов экстракции липидов, приготовления метиловых эфиров ЖК и газохроматографического анализа возможна с применением методик, дающих сопоставимые результаты определения ЖК состава тканей рыб.
На хроматограмме образца идентифицируют количественно значимые жирные кислоты (процент от общей суммы которых составляет 0,2% и выше), с помощью программы расчета определяют их процентное содержание от общей суммы. В качестве биохимических маркеров аквакультурного происхождения продуктов осетровых используется сумма процентного содержания в общих липидах олеиновой кислоты, 18:1n-9, линолевой кислоты, 18:2n-6, и сумма длинноцепочечных мононенасыщенньгх кислот с 20-22 атомами углерода, Σ20:1+22:1. Данные ЖК имеют высокое относительное содержание в искусственных кормах, содержащих растительные масла и рыбную муку, и накапливаются в различных тканях (в том числе, в икре и мышцах)осетровых рыб, выращиваемых в аквакультуре. Сумма процентного содержания таких жирных кислот, как пальмитолеиновая кислота, 16:1n-7, эйкозапентаеновая кислота 20:5n-3, вакценовая кислота, 18:1n-7, и сумма насыщенных разветвленных жирных кислот с 15-17 атомами углерода, 15-17РЖК, используется как маркер происхождения икры и филе осетровых рыб от диких популяций. Данные ЖК продуцируются в водных экосистемах диатомовыми водорослями и бактериями, передаются по трофическим сетям и накапливаются в тканях осетровых рыб. Однако все перечисленные ЖК маркеры могут быть обнаружены в продуктах как аквакультурного, так и природного происхождения. Поэтому для идентификации происхождения контрольных проб мы предлагаем использовать их соотношение и его следующие пороговые значения:
Соотношение процентного содержания ЖК-маркеров, Σ(16:1n-7+20:5n-3+18:1n-7+15-17РЖК)/Σ(18:1n-9+18:2n-6+20:1+22:1) - больше или равное 0,45 указывает на происхождение особи осетровых из природной популяции, а данное соотношение не более 0,45 идентифицирует образец как аквакультурный объект.
Пример реализации
Для анализа состава и содержания ЖК собирали окулированную икру прижизненным способом у самок стерляди (Acipenser ruthenus, Linnaeus, 1758) и сибирского осетра (Acipenser baerii, Brandt, 1869) из р. Енисей и двух рыбоводных хозяйств, расположенных в Красноярском крае. Икру отбирали у 5 самок каждого вида. Икру отделяли от ястыков, промывали и высушивали на бумажном фильтре. Подготовку проб, экстракцию липидов, метанолиз и газовую хроматографию проводили описанными выше методами. Рассчитывали процентное содержание количественно значимых ЖК от общей суммы. Данные представлены на рисунке.
Данные рисунка указывают, что проценты таких ЖК как, пальмитолеиновая кислота, 16:1n-7, эйкозапентаеновая кислота 20:5n-3, вакценовая кислота, 18:1n-7, и сумма насыщенных разветвленных жирных кислот с 15-17 атомами углерода, 15-17РЖК, действительно были выше в икре диких популяций, тогда как уровни олеиновой кислоты, 18:1n-9, линолевой кислоты, 18:2n-6, и суммы длинноцепочечных мононенасыщенных кислот с 20-22 атомами углерода, Σ20:1+22:1 были выше в икре аквакультурных осетровых рыб.
Величины соотношения процентов жирных кислот - маркеров дикого и аквакультурного происхождения, представлены в таблице 1.
Из таблицы видно, что величины соотношения маркерных ЖК в пробах икры стерляди и осетра из дикой популяции и аквакультуры соответствовали установленным пороговым значениям. Икра осетровых р. Енисей имела соотношения маркерных ЖК не менее 0,45, тогда как икра из аквакультурных источников обладала соотношением менее 0,45.
Таким образом, выбранные маркерные жирные кислоты и установленные данным техническим решением пороговые значения их соотношения позволяют точно и быстро определить происхождение икры и филе осетровых рыб, а также проводить судебные экспертизы в рамках контроля за незаконной добычей и оборотом осетровой продукции.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ обогащения искусственного корма для молоди осетровых рыб микробным белком и жирными кислотами | 2022 |
|
RU2825804C2 |
| СПОСОБ КРИОКОНСЕРВИРОВАНИЯ СПЕРМЫ ОСЕТРОВЫХ РЫБ | 2006 |
|
RU2317703C1 |
| Защитная среда для криоконсервации спермы осетровых рыб | 2018 |
|
RU2683682C1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЖИВОГО КОРМА ДЛЯ ЛИЧИНОК И МОЛОДИ ОСЕТРОВЫХ РЫБ | 2014 |
|
RU2577478C1 |
| Способ обогащения науплиусов артемии микробным белком гаприном и жирными кислотами для кормления личинок осетровых рыб | 2022 |
|
RU2785671C1 |
| СПОСОБ ПОВЫШЕНИЯ КАЧЕСТВА ПОЛОВЫХ ПРОДУКТОВ И ПОТОМСТВА ОСЕТРОВЫХ РЫБ | 2008 |
|
RU2384057C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГИБРИДНОГО ПРОИСХОЖДЕНИЯ ОСЕТРОВЫХ РЫБ | 2003 |
|
RU2257053C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОДНОПОЛО-ЖЕНСКОГО ПОТОМСТВА У ОСЕТРОВЫХ РЫБ | 2005 |
|
RU2312495C2 |
| Продукционный комбикорм для осетровых рыб с фитобиотиком | 2024 |
|
RU2829995C1 |
| Способ повышения эффективности содержания ремонтно-маточного стада годовиков осетровых рыб в индустриальной садковой аквакультуре | 2024 |
|
RU2839018C1 |
Изобретение относится к области сельского хозяйства. Предложен способ идентификации среды обитания осетровых рыб с помощью биохимических маркеров, который включает подготовку проб из икры либо мышечной ткани осетровых рыб, содержащих жирные кислоты, применяющиеся как биохимические маркерные вещества, экстракцию липидов из вышеуказанных проб, приготовление метиловых эфиров жирных кислот, их последующий газохроматографический анализ с измерением процентного содержания от общей суммы всех идентифицированных жирных кислот. В качестве идентификатора среды обитания предложены пороговые значения соотношения суммы процентного содержания пальмитолеиновой кислоты, эйкозапентаеновой кислоты, вакценовой кислоты и насыщенных разветвленных кислот с 15-17 атомами углерода к сумме процентного содержания олеиновой кислоты, линолевой кислоты и мононенасыщенных кислот с 20-22 атомами углерода. Пороговые значения, равные 0,45 и более, свойственны для рыб из природных популяций, а менее 0,45 - для рыб из аквакультуры. Изобретение может быть использовано для контроля происхождения продукции осетровых рыб. 1 ил., 1 табл.
Способ идентификации среды обитания осетровых рыб с помощью биохимических маркеров, характеризующийся тем, что включает подготовку проб из икры либо мышечной ткани осетровых рыб, содержащих жирные кислоты, применяющиеся как биохимические маркерные вещества, экстракцию липидов из вышеуказанных проб, приготовление метиловых эфиров жирных кислот, их последующий газохроматографический анализ с измерением процентного содержания от общей суммы всех идентифицированных жирных кислот; при этом в качестве идентификатора среды обитания предложены пороговые значения соотношения суммы процентного содержания пальмитолеиновой кислоты, эйкозапентаеновой кислоты, вакценовой кислоты и насыщенных разветвленных кислот с 15-17 атомами углерода к сумме процентного содержания олеиновой кислоты, линолевой кислоты и мононенасыщенных кислот с 20-22 атомами углерода, при этом пороговые значения, равные 0,45 и более, свойственны для рыб из природных популяций, а менее 0,45 - для рыб из аквакультуры.
| СПОСОБ ОПРЕДЕЛЕНИЯ ГРАНИЦ ПРИРОДНЫХ ОЧАГОВ БИОГЕЛЬМИНТОЗОВ | 2013 |
|
RU2545707C1 |
| Способ оценки состояния рыб | 1984 |
|
SU1194342A1 |
| БИОЛОГИЧЕСКИЙ МАРКЕР ДЛЯ ОПРЕДЕЛЕНИЯ ПОРОДЫ РЫБ, НАБОР И СПОСОБ ОПРЕДЕЛЕНИЯ ПОРОДНОЙ ПРИНАДЛЕЖНОСТИ РЫБ | 2005 |
|
RU2294633C2 |
| CN 109060800 A, 21.12.2018. | |||
Авторы
Даты
2022-09-06—Публикация
2021-07-19—Подача