ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящая заявка относится к олигонуклеотидам и их применению, в частности к применению для лечения инфекции гепатита В.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0002] Инфекция, вызванная вирусом хронического гепатита В (HBV), является серьезной причиной заболеваемости и смертности во всем мире. Современные способы лечения гепатита В, такие как лечение аналогами нуклеозидов, требуют пожизненной терапии для снижения виремии плазмы, и в целом неэффективны в долгосрочной перспективе. Обычно наилучшим результатом лечения считается функциональное излечение хронического HBV. Технологии РНК-интерференции (RNAi) обладает потенциалом для применения в фармакологии.
[0003] Белки внешней оболочки вируса известны под общим названием поверхностных антигенов гепатита В (HBsAg). HBsAg состоит из трех родственных полипептидов, называемых S, M и L, которые кодируются перекрывающимися открытыми рамками считывания (ORF). Наиболее коротким белком оболочки является S белок длиной 226 аминокислот, называемый S-ORF. М и L синтезируются при использовании предшествующих сайтов инициации трансляции и добавляют к длине S-белка 55 и 108 аминокислот, соответственно. Гликопротеины HBV S, M и L обнаруживаются в вирусной оболочке интактных, инфекционных вирионов HBV, называемых частицами Дейна, и все три из них продуцируются и секретируются в огромном избытке, на основе которого формируются неинфекционные субвирусные сферические и нитевидные частицы (обе называются приманочными частицами), обнаруживаемые в крови пациентов с хроническим HBV. Считается, что избыток HBsAg на поверхности приманочных частиц ингибирует как гуморальный иммунитет, так и спонтанный клиренс у пациентов с хронической инфекцией HBV (обозначаемой как CHB).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0004] Аспекты раскрытия относятся к улучшенным композициям на основе олигонуклеотидов и связанным с ними способам лечения инфекции HBV у субъекта. В некоторых вариантах осуществления изобретение относится к разработке высокоэффективных олигонуклеотидов, вызывающих длительный нокдаун экспрессии поверхностного антигена HBV (HBsAg). Олигонуклеотид индуцирует опосредованное РНК-интерференцией (RNAi) распознавание и разрушение мРНК, кодирующей все формы HBsAg в гепатоцитах. Таковые включают белки, транслированные с вирусных РНК, транскрибированных как с cccDNA (кольцевых ковалентно-замкнутых ДНК), так и с ДНК HBV, интегрированной в геном хозяина. Здесь представлены олигонуклеотиды, предназначенные для нацеливания на транскрипты HBsAg, кодируемые геномами HBV, по всем известным генотипам. В некоторых вариантах осуществления было обнаружено, что описанные здесь олигонуклеотиды, нацеленые на транскрипты HBsAg в гепатоцитах, могут вызывать стабильное высокоспецефичное снижение экспрессии HBsAg, и такое снижение экспрессии сохраняется в течение длительного периода времени (например, от более 7 недель до нескольких месяцев) после введения таковых субъекту (см., например, Примеры 1 и 3). В некоторых вариантах осуществления было обнаружено, что использование олигонуклеотидов, раскрытых в настоящем изобретении, нацеленных на экспрессию HBsAg, приводит к снижению количества прегеномной РНК (pgRNA) и других промежуточных продуктов жизненного цикла вируса. Также было обнаружено, что определенные олигонуклеотиды RNAi, раскрытые в настоящем изобретении, могут обеспечить нокдаун транскриптов мРНК HBsAg, считанных либо с cccDNA, либо с интегрированного вируса. В дополнительных аспектах было обнаружено, что использование олигонуклеотидов, раскрытых в настоящем изобретении, нацеленных на экспрессию HBsAg, снижает экспрессию всех белков HBV (за исключением HBx), а именно HBcAg, HBeAg и HBV-полимеразы, что приводит к удерживанию основного белка ядра HBV в цитозоле. Кроме того, в некоторых вариантах осуществления клиренс циркулирующего HBsAg в результате нокдауна мРНК с использованием способов, представленных в настоящем изобретении, является клинически выгодным, поскольку он позволяет убрать иммунную толерантность к HBV, вызванную высокими уровнями циркулирующего HBsAg у пациентов с CHB. Считается, что перезапуск активности иммунной системы, борющейся против инфекции HBV, является краеугольным камнем достижения функционального излечения, определяемого как постоянное (или длительное) отсутствие HBsAg в плазме крови (клиренс).
[0005] Предыдущие исследования показали, что использование комбинации агентов RNAi, нацеленных на многие различные гены HBV (а именно, гены S, C, P и X), или, в некоторых случаях, нацеленных только на транскрипты гена X, обеспечивает эффективное ингибирование репликации и экспрессии генов HBV. Однако результаты, представленные в настоящем изобретении, демонстрируют, что использование олигонуклеотидов RNAi, нацеленных только на транскрипты HBsAg, также обеспечивает эффективное ингибирование репликации HBV и экспрессии генов, что представляет собой новый терапевтический подход к лечению инфекций HBV. В дополнение к прямому эффекту сайленсинга вирусных РНК, предшественники HSB(s)-219 предотвращают ядерную локализацию основного антигена (основного белка ядра) HBV (HBcAg). Важно отметить, что нацеливание на HBV-X или оба гена одновременно не предотвращает ядерную локализацию HBcAg. Данные доклинических исследований убедительно свидетельствуют о том, что ингибирование ядерной локализации, вызванное S-нацеленной терапией РНКi, приводит к значительному увеличению продолжительности супрессии HBsAg. Примечательно, что отсутствие ядерной локализации HBcAg у пациентов, как было показано, коррелирует с благоприятными результатами противовирусной терапии.
[0006] Некоторые аспекты настоящего раскрытия относятся к олигонуклеотидам для снижения экспрессии мРНК поверхностного антигена вируса гепатита B (HBsAg), содержащие антисмысловую цепь длиной от 19 до 30 нуклеотидов, где антисмысловая цепь содержит область комплементарности последовательности мРНК HBsAg, указанной как ACAANAAUCCUCACAAUA (SEQ ID NO: 1).
[0007] В некоторых вариантах осуществления олигонуклеотид дополнительно содержит смысловую цепь длиной от 19 до 50 нуклеотидов, причем смысловая цепь образует дуплексный участок с антисмысловой цепью. В некоторых вариантах осуществления смысловая цепь содержит область комплементарности к последовательности, указанной как UUNUUGUGAGGAUUN (SEQ ID NO: 2). В некоторых вариантах осуществления смысловая цепь содержит область комплементарности к последовательности, указанной как 5'-UUAUUGUGAGGAUUNUUGUC (SEQ ID NO: 3).
[0008] В некоторых вариантах осуществления антисмысловая цепь содержит последовательность, такую как UUAUUGUGAGGAUUNUUGUCGG (SEQ ID NO: 4). В некоторых вариантах осуществления антисмысловая цепь состоит из последовательности, такой как UUAUUGUGAGGAUUCUUGUCGG (SEQ ID NO: 5). В некоторых вариантах осуществления антисмысловая цепь состоит из последовательности, такой как UUAUUGUGAGGAUUUUUGUCGG (SEQ ID NO: 5.1).
[0009] В некоторых вариантах осуществления смысловая цепь содержит последовательность, такую как ACAANAAUCCUCACAAUAA (SEQ ID NO: 6). В некоторых вариантах осуществления смысловая цепь содержит последовательность, такую как GACAANAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 7). В некоторых вариантах осуществления смысловая цепь состоит из последовательности, такой как GACAAAAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8). В некоторых вариантах осуществления смысловая цепь состоит из последовательности, такой как GACAAGAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8.1).
[00010] Другие аспекты настоящего изобретения относятся к олигонуклеотидам для снижения экспрессии мРНК поверхностного антигена вируса гепатита B (HBsAg), причем олигонуклеотид содержит смысловую цепь, образующую дуплексную область с антисмысловой цепью, где смысловая цепь содержит последовательность, такую как GACAAAAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8), и где антисмысловая цепь содержит последовательность, такую как UUAUUGUGAGGAUUUUUUGUCGG (SEQ ID NO: 5.1), где каждая из антисмысловой и смысловой цепей содержат один или более 2'-фторо- и 2'-O-метил-модифицированных нуклеотидов и, по меньшей мере, одну фосфоротиоатную связь, и где 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог, и где смысловая цепь конъюгирована с одним или несколькими N -ацетилгалактозаминовыми (GalNAc) фрагментами.
[00011] Далее настоящее изобретение относится к олигонуклеотидам для снижения экспрессии мРНК поверхностного антигена (HBsAg) вируса гепатита B, содержащим смысловую цепь, образующую дуплексную область с антисмысловой цепью, причем: смысловая цепь содержит последовательность, такую как GACAAAAAUCCCACAAAGAGAGA (SEQ ID NO: 8), включающую 2'-фтор-модифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17, 2'-O-метил-модифицированные нуклеотиды в положениях 1, 2, 4-7, 11, 14-16, 18-26 и 31-36 и, по меньшей мере, одну фосфоротиоатную межнуклеотидную связь, и где смысловая цепь конъюгирована с одним или несколькими N-ацетилгалактозаминовыми (GalNAc) фрагментами; антисмысловая цепь содержит последовательность, такую как UUAUUGUGAGGAUUUUUGUCGG (SEQ ID NO: 5.1), включающую 2'-фтормодифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19, 2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22 и, по меньшей мере, три фосфоротиоатные межнуклеотидные связи, и где 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог, а смысловая цепь содержит фосфоротиоатную связь между нуклеотидами в положениях 1 и 2.
[00012] В некоторых вариантах осуществления антисмысловая цепь содержит пять фосфоротиоатных связей между нуклеотидами 1 и 2, 2 и 3, 3 и 4, 20 и 21 и 21 и 22.
[00013] В некоторых вариантах осуществления 5'-нуклеотид антисмысловой цепи имеет следующую структуру:
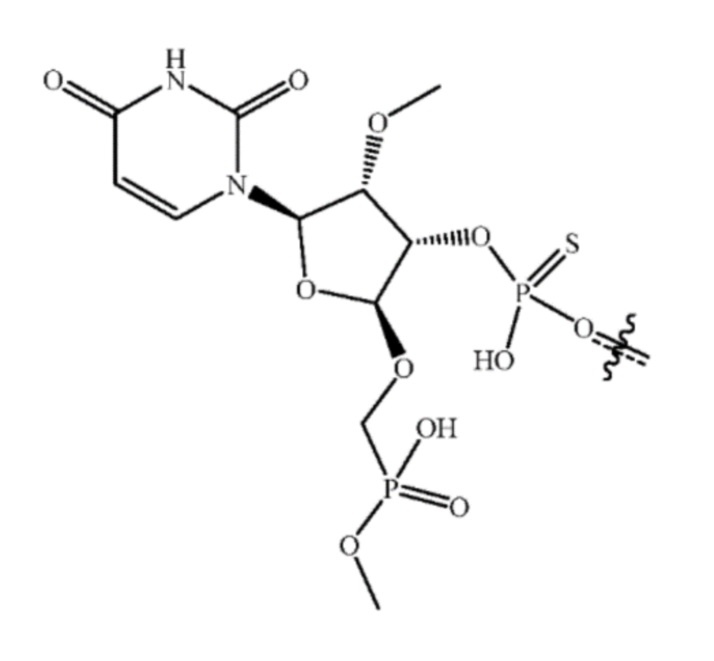
[00014] В некоторых вариантах осуществления один или более нуклеотидов последовательности -GAAA- смысловой цепи конъюгированы с моновалентным фрагментом GalNac.
[00015] В некоторых вариантах осуществления каждый из нуклеотидов последовательности -GAAA- на смысловой цепи конъюгирован с моновалентным фрагментом GalNac. В некоторых вариантах осуществления мотив -GAAA- содержит структуру:
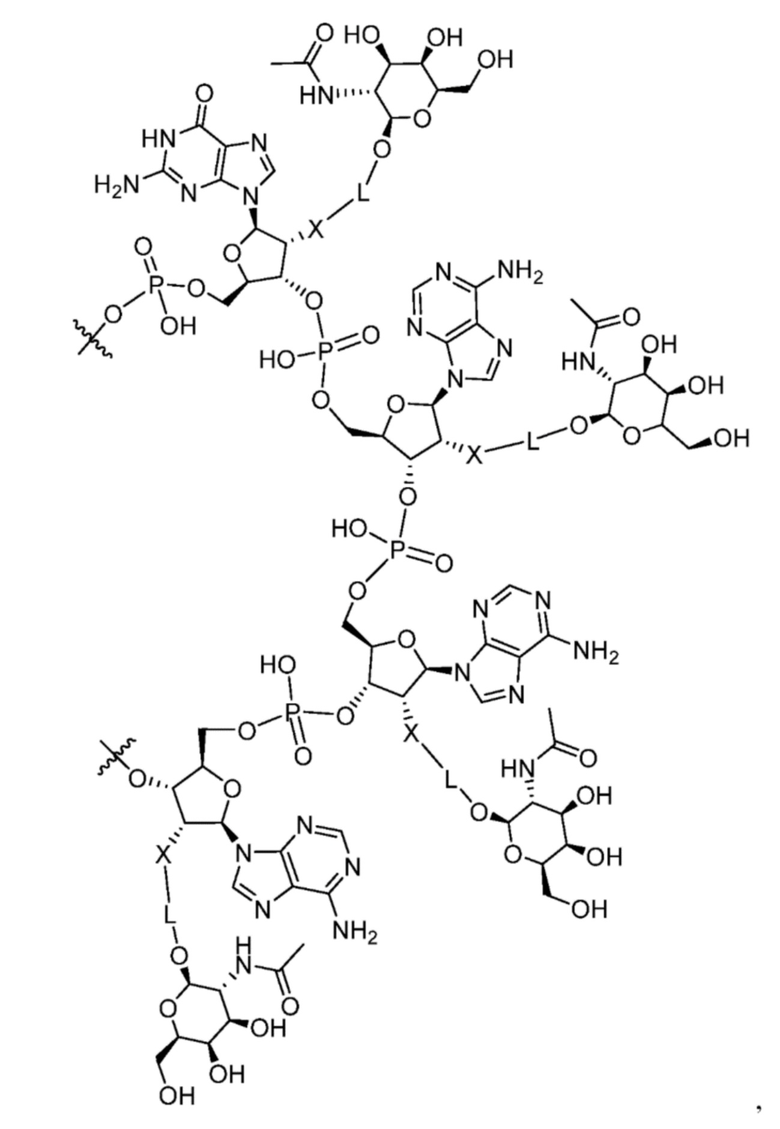
в которой:
L представляет собой связь, клик-химическую защелку или линкер, длиной от 1 до 20 включительно, из последовательно ковалентно связанных атомов, выбраных из группы, состоящей из замещенного и незамещенного алкилена, замещенного и незамещенного алкенилена, замещенного и незамещенного алкинилена, замещенного и незамещенного гетероалкилена, замещенного и незамещенного гетероалкенилена, замещенного и незамещенного гетероалкинилена и комбинации таковых; а
Х представляет собой О, S или N.
[00016] В некоторых вариантах осуществления L представляет собой ацетальный линкер. В некоторых вариантах осуществления X представляет собой О.
[00017] В некоторых вариантах осуществления последовательность -GAAA- содержит структуру:
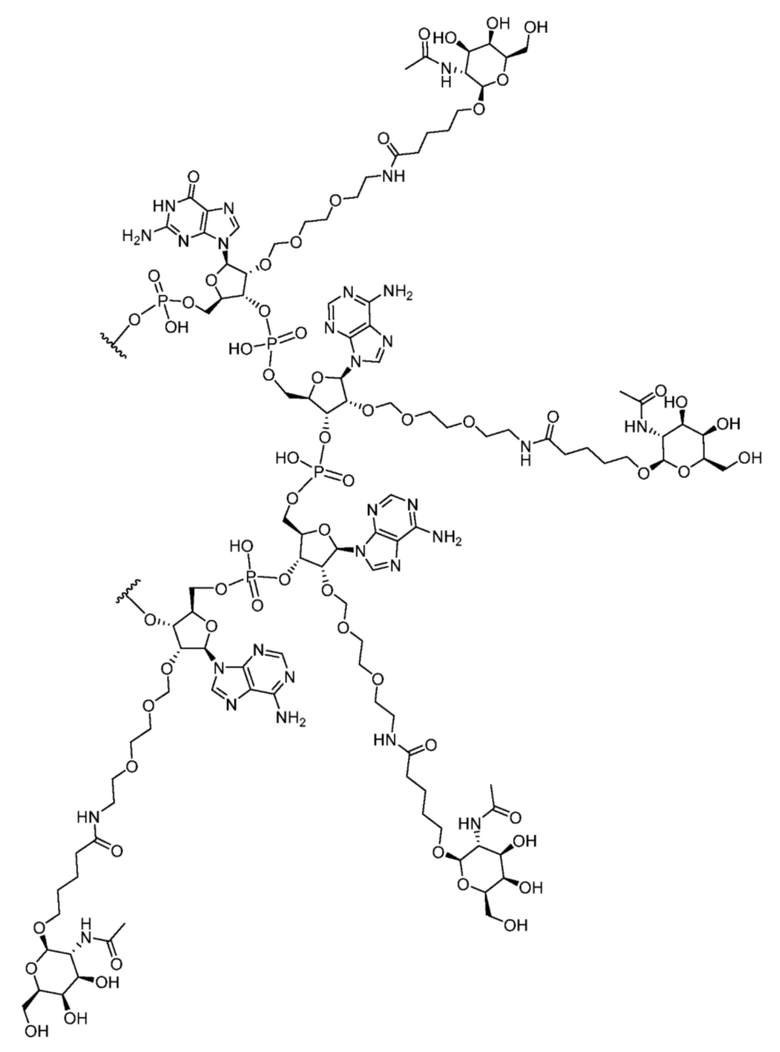 .
.
[00018] В некоторых вариантах осуществления смысловая цепь содержит на своем 3'-конце стволовую петлю, обозначенную как: S1-L-S2, где S1 комплементарна S2, и где L образует петлю между S1 и S2 длиной до 6 нуклеотидов. В некоторых вариантах осуществления L представляет собой тетра-петлю. В некоторых вариантах осуществления L образует петлю между S1 и S2 длиной 4 нуклеотида. В некоторых вариантах осуществления L содержит последовательность, обозначенную как GAAA. В некоторых вариантах осуществления присутствует до 4 нуклеотидов L стволовой петли, где каждый сконъюгирован с отдельным GalNAc.
[00019] В некоторых вариантах осуществления олигонуклеотид содержит по меньшей мере один модифицированный нуклеотид. В некоторых вариантах осуществления модифицированный нуклеотид содержит 2'-модификацию. В некоторых вариантах осуществления 2'-модификация представляет собой модификацию, выбранную из: 2'-аминоэтила, 2'-фторо, 2'-O-метила, 2'-O-метоксиэтила и 2'-дезокси-2'-фтор- β-d-арабинонуклеиновой кислоты. В некоторых вариантах осуществления все нуклеотиды олигонуклеотида являются модифицированными нуклеотидами. В некоторых вариантах осуществления олигонуклеотид содержит по меньшей мере одну модифицированную межнуклеотидную связь. В некоторых вариантах осуществления по меньшей мере одна модифицированная межнуклеотидная связь представляет собой фосфоротиоатную связь, где 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог.
[00020] В некоторых вариантах осуществления по меньшей мере один нуклеотид олигонуклеотида конъюгирован с нацеливающим лигандом. В некоторых вариантах осуществления нацеливающий лиганд представляет собой N-ацетилгалактозаминовый (GalNAc) фрагмент.
[00021] Далее настоящее изобретение относится к композициям, содержащим олигонуклеотид по любому из предыдущих пунктов формулы изобретения и противо-ион, и композициям, содержащим олигонуклеотид по любому из предыдущих пунктов формулы изобретения и фармацевтически приемлемый носитель.
[00022] Другие аспекты настоящего изобретения относятся к способам снижения экспрессии поверхностного антигена вируса гепатита B (HBV) в клетке, включающим доставку в клетку олигонуклеотида, описанного в настоящем изобретении. В некоторых вариантах осуществления клетка представляет собой гепатоцит. В некоторых вариантах осуществления клетка находится in vivo. В некоторых вариантах осуществления клетка находится в in vitro.
[00023] Другие аспекты настоящего раскрытия относятся к способам лечения инфекции вируса гепатита B (HBV) у субъекта, включающим введение субъекту олигонуклеотида или композиции, описанной в настоящем изобретении.
[00024] Также изобретение относится к способам лечения инфекции HBV у субъекта, включающим введение субъекту олигонуклеотида RNAi, избирательно нацеленного на мРНК HBsAg, причем такой олигонуклеотид RNAi вводится в отсутствие лечения олигонуклеотидом RNAi, нацеленного на транскрипт мРНК HBV, кодирущий не-поверхностный антиген. Также изобретение относится к способам лечения инфекции HBV у субъекта, включающим введение субъекту олигонуклеотида RNAi, избирательно нацеленного на мРНК HBsAg, и при этом субъекту не вводится олигонуклеотид RNAi, избирательно нацеленный на транскрипт мРНК HBxAg. В некоторых вариантах осуществления способ дополнительно включает введение субъекту эффективного количества Энтекавира.
[00025] Другие аспекты настоящего изобретения относятся к олигонуклеотидам для снижения экспрессии мРНК поверхностного антигена вируса гепатита B (HBsAg), содержащим смысловую цепь, образующую дуплексную область с антисмысловой цепью, где:
смысловая цепь содержит последовательность, такую как указано в GACAAAAACCCCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8), и содержащую 2'-фтор-модифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17, 2'-O-метил-модифицированные нуклеотиды в положения 1, 2, 4-7, 11, 14-16, 18-26 и 31-36 и одну фосфоротиоатную межнуклеотидную связь между нуклеотидами в положениях 1 и 2, где каждый из нуклеотидов последовательности -GAAA- на смысловой цепи конъюгирован с моновалентным фрагментом GalNac, и где последовательность -GAAA- содержит структуру:
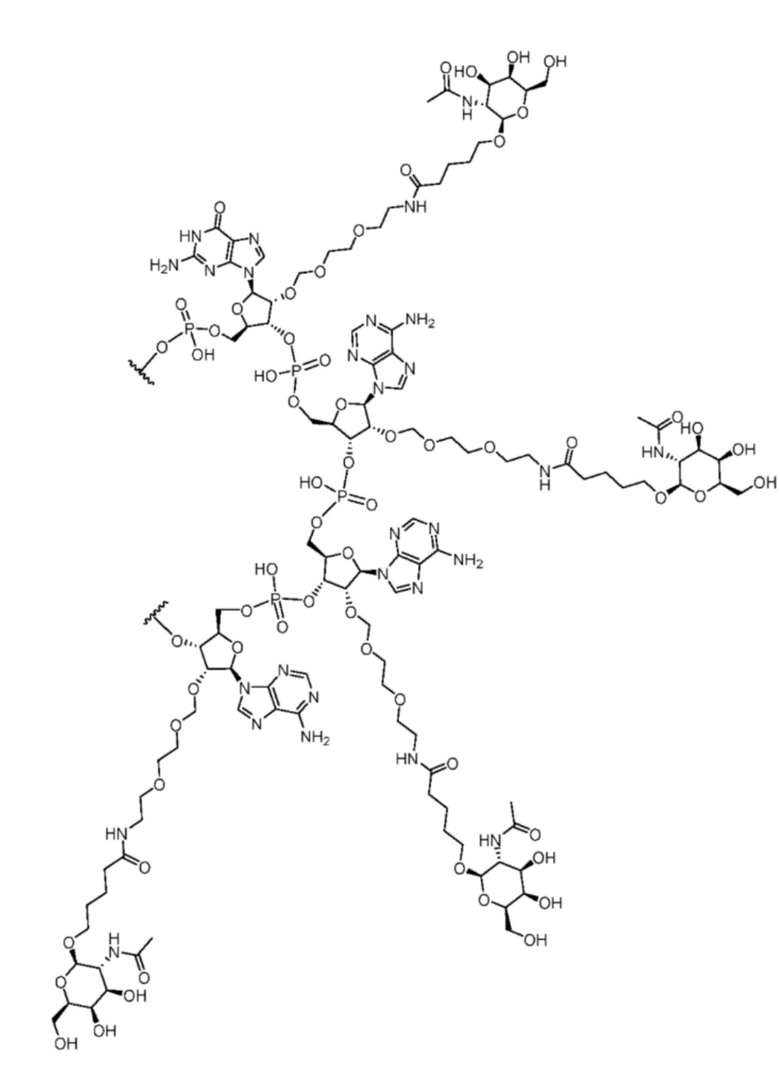 ; и
; и
где антисмысловая цепь содержит последовательность, такую как UUAUUGUGAGGAUUUUUGUCGG (SEQ ID NO: 5.1) и содержащую 2'-фтормодифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19, 2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22 и пять фосфоротиоатных межнуклеотидных связей между нуклеотидами 1 и 2, 2 и 3, 3 и 4 , 20 и 21 и 21 и 22, и где 4'-углерод сахара 5'-нуклеотида антисмысловой цепи имеет следующую структуру:
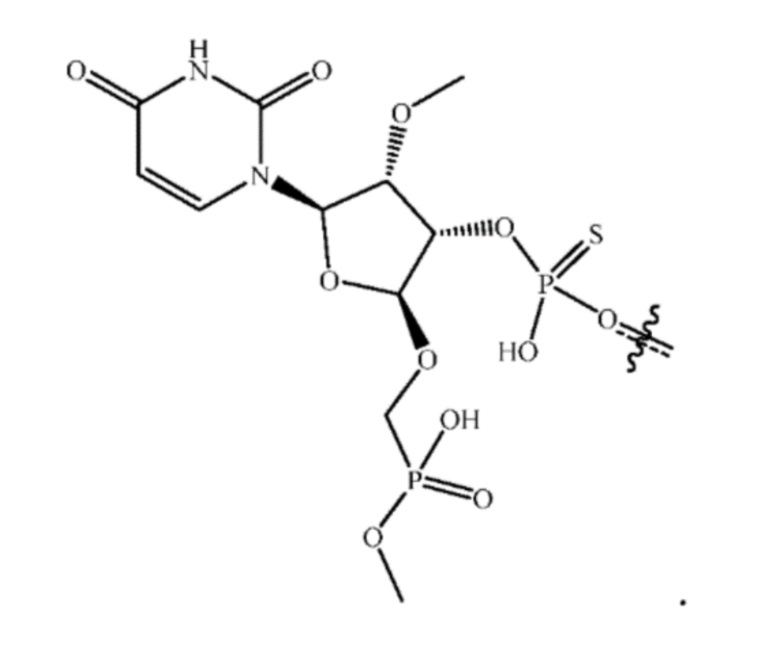
[00026] Также изобретение относится к композиции, содержащей олигонуклеотид. В некоторых вариантах осуществления композиция дополнительно содержит противо-ионы Na+.
[00027] Также изобретение относится к способам снижения экспрессии поверхностного антигена вируса гепатита B (HBV) в клетке, включающим доставку олигонуклеотида или композиции. В некоторых вариантах осуществления клетка представляет собой гепатоцит. В некоторых вариантах осуществления клетка находится in vivo. В некоторых вариантах осуществления клетка находится in vitro.
[00028] Изобретение относится к способам лечения инфекции вируса гепатита B (HBV) у субъекта, включающим введение субъекту олигонуклеотида или композиции. В некоторых вариантах осуществления способ включает введение субъекту эффективного количества Энтекавира (Entecavir).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00029] Прилагаемые чертежи, которые включены в настоящее описание и представляют собой его часть, иллюстрируют определенные варианты осуществления и, наряду с письменным описанием, служат для предоставления неограничивающих примеров определенных аспектов композиций и способов, раскрытых в настоящем изобретении.
[00030] На ФИГ. 1 показан пример сайта-мишени RNAi на схематической диаграмме организации генома HBV.
[00031] На ФИГ. 2 показана оценка однократной дозы олигонуклеотида для снижения экспрессии HBsAg у мышей в модели HDI.
[00032] ФИГ. 3 является графическим отображением уровней HBsAg в плазме с течением времени при применении определенной схемы дозирования с использованием HBsAg-нацеленного олигонуклеотида. Как показано в этом примере, олигонуклеотид продемонстрировал потенциал в доклинических исследованиях и поддерживал пониженные уровни на протяжении значительного времени после периода дозирования.
[00033] ФИГ. 4 предоставляет графики, изображающие результаты картирования HBsAg в клетках HeLa с использованием репортерного анализа. Немодифицированная siРНК нацеленная на позицию 254 генома HBV была использована в качестве положительного контроля при указанных концентрациях. Коммерчески доступная Silencer siRNA (Thermo Fisher) служила отрицательным контролем для этих экспериментов. Полосы разброса значений отображают SEM.
[00034] ФИГ. 5 показывает сравнение степеней консервации генотипов, показывающее, что спроектированное мисматч-несоответствие в HBs Ag-нацеленном олигонуклеотиде, HBV-219, увеличивает охват генотипов HBV.
[00035] ФИГ. 6 иллюстрирует вектор, разработанный для репортерных анализов psiCHECK2, где HBV Генотип A используется в качестве последовательности прототипа.
[00036] На ФИГ. 7 показано несколько примеров олигонуклеотидов, разработанных для оценки эффекта введения мисматч-несовпадений. Олигонуклеотидные последовательности для родительских цепей и цепей с мисматчами показаны выровненными, и позиции мисматчей заключены в прямоугольники. Соответствующие репортерные последовательности, используемые в репортерных анализах psiCHECK2, представлены дополнительно.
[00037] ФИГ. 8 показывает график титрования однократной дозы олигонуклеотида, применявшегося в исследованиях по оценке мисматчей, который демонстрирует, что мисматч в нацеливающей цепи допускается in vivo.
[00038] ФИГ. 9 показывает график титрования дозы in vivo, демонстрирующий, что включение мисматча в HBsAg-нацеленный олигонуклеотид не оказывает отрицательного влияния на его активность in vivo.
[00039] ФИГ. 10 показывает пример HBsAg-нацеленного олигонуклеотида (HBV(s)-219) с химическими модификациями и в дуплексной форме. Более темный оттенок указывает на 2'-O-метил рибонуклеотид. Более светлый оттенок указывает на 2'-фтор-дезоксирибонуклеотид.
[00040] На ФИГ. 11А показаны результаты иммуногистохимического окрашивания, показывающие внутриклеточное распределение основного антигена (основного белка ядра) HBV (HBcAg) в гепатоцитах.
[00041] ФИГ. 11B предоставляет результаты секвенирования РНК, с картированием обнаруженных последовательностей РНК-транскриптов по сравнению с pgРНК (pgRNA) HBV.
[00042] На ФИГ. 12А показан временной ход экспрессии мРНК HBsAg после обработки одигонуклеотидом HBV(s)-219P2, предшественником HBV(s)-219-олигонуклеотида, нацеленным на мРНК HBsAg, по сравнению с контролем на носитель и контрольным РНКi олигонуклеотидом, нацеленным на мРНК HbxAg, в гидродинамической модели инъекции (HDI) HBV.
[00043] На ФИГ. 12B показан временной ход экспрессии мРНК HBsAg после обработки одигонуклеотидом HBV(s)-219P2, предшественником HBV(s)-219-олигонуклеотида, нацеленным на мРНК HBsAg, по сравнению с контролем на носитель и контрольным РНКi олигонуклеотидом, нацеленным на мРНК HbxAg, в модели AAV-HBV.
[00044] На ФИГ. 13 показаны результаты иммуногистохимического окрашивания, показывающие внутриклеточное распределение HBcAg в гепатоцитах, полученных на модели AAV-HBV и на модели HDI HBV после обработки олигонуклеотидом HBV(s)-219, нацеленным на мРНК HBsAg, по сравнению с контролем на носитель и контрольным олигонуклеотидом RNAi, нацеленным на HBxAg mRNA (GalXC-HBVX).
[00045] На ФИГ. 14A-14D показана противовирусная активность предшественника 1 олигонуклеотида HBV(s)-219 (обозначен как HBV(s)-219 P1) в модели PXB-HBV. Когортам из 9 мышей вводили подкожно 3 еженедельные дозы либо 0 мг/кг либо 3 мг/кг HBV(s)-219P1 в PBS. Шесть мышей из каждой когорты анализировали с помощью не вызывающих смерть кровотечений из нижней челюсти в каждый из указанных моментов времени (ФИГ. 14A и 14B) для определения HBsAg и ДНК HBV в сыворотке. В день 28 (считая от дня введения первой дозы HBV(s)-219P1) всех оставшихся мышей умерщвляли и собирали биоптаты печени для получения содержания ДНК HBV в печени (ФИГ. 14C) и cccDNA (кольцевые ковалентно - замкнутые ДНК) в печени (ФИГ. 14D) с помощью RT-qPCR (количественная ПЦР в реальном времени).
[00046] ФИГ. 15A-15C показывают, что предшественник 2 HBV(s)-219 (обозначен как HBV(s)-219P2) усиливает противовирусную активность Энтекавира. В HBV модели гидродинамической инъекции мыши (HDI) однократную дозу HBV(s)-219P2 вводили мышам подкожно в день 1 с последующим ежедневным пероральным введением Энтекавира 500 нг/кг (ETV) в течение 14 дней. Циркулирующую вирусную нагрузку (ДНК HBV) измеряли с помощью qPCR (ФИГ. 15А). Уровень HBsAg в плазме измеряли с помощью теста ELISA (ФИГ. 15B). Уровни мРНК и pgРНК (pgRNA) HBV в печени измеряли с помощью qPCR (ФИГ. 15C). Результаты показывают явные кумулятивные эффекты при комбинированной терапии. Применение одной только ETV-терапии неэффективно против циркулирующего HBsAg или вирусных РНК в печени. Противовирусная активность HBV(s)-219P2, как показывают результаты измерений HBsAb или РНК HBV, не изменяется при совместном введении с ETV. «BLOD» означает «ниже предела обнаружения».
[00047] На ФИГ. 16A-16B показано сравнение супрессироания HBsAg олигонуклеотидом, конъюгированным с GalNac, и нацеленным на S-антиген (HBV(s)-219P2) или X-антиген (обозначен как GalXC-HBVX). Результат показывает, что HBVS-219P2 подавляет HBsAg в течение более длительного периода времени, чем GalXC-HBVX или эквимолярная комбинация обоих РНКi агентов. ФИГ. 16А показывает, что расположение сайта-мишени HBV, на который нацелены РНКi, влияет на кинетику восстановления HBsAg у мышей, экспрессирующих HBV. На ФИГ. 16B показан уровень HBsAg в плазме через 2 недели после введения дозы (левая панель) и через 9 недель после введения дозы (правая панель), указывающие на то, что нацеливание на область кодирования HBVX, отдельно или в сочетании с HBV(s)-219P2, приводит к меньшей продолжительности супрессии. Показаны данные индивидуальных животных. В нескольких точках данные (светло-серые кружки) были ниже предела обнаружения.
[00048] На ФИГ. 17A-17C показано внутриклеточная локализация основного антигена HBV (HBcAg) у мышей, экспрессирующих HBV, и обработанных HBV(s)-219P2, GalXC-HBVX или их комбинацией 1: 1. На ФИГ. 17А показаны репрезентативные гепатоциты срезов печени, полученные через 1, 2, 6, 9 и 13 недели после введения и окрашенные на HBcAg. ФИГ. 17B показывает процент HBcAg-позитивных клеток с окрашиванием ядер для каждого животного (n=3/на группу, 50 клеток на животное, через 2 недели после введения дозы). Были разработаны и протестированы альтернативные последовательности в пределах открытых рамок считывания X и S. На ФИГ. 17C показано внутриклеточное распределение HBcAg в гепатоцитах, полученных на 2, 3 и 9 неделе после введения альтернативного олигонуклеотида RNAi, нацеленного либо на S-антиген, либо на X-антиген.
[00049] На ФИГ. 18 представлена информация о дозе по когортам для проведения исследования безопасности и переносимости HBV(s)-219 у здоровых пациентов и терапевтической эффективности HBV(s)-219 у пациентов с HBV.
[00050] На ФИГ. 19А-19В показана химическая структура HBV(s)-219 и HBV(s)-219P2. (ФИГ. 19А) Химическая структура HBV(s)-219. (ФИГ. 19B) Химическая структура HBV(s)-219P2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00051] В соответствии с некоторыми аспектами настоящее изобретение относится к высокоэффективным олигонуклеотидам, снижающих экспрессию HBsAg в клетках, в частности в клетках печени (например, гепатоцитах), для лечения инфекций HBV. В некоторых вариантах осуществления предлагаемые здесь олигонуклеотиды, нацеленные на HBsAg, предназначены для доставки в выбранные клетки тканей-мишеней (например, гепатоциты печени) для лечения инфекции HBV в этих тканях. Соответственно, в родственных аспектах настоящее изобретение относится к способам лечения инфекции HBV, включающих селективное снижение экспрессии гена поверхностного антигена HBV в клетках (например, в клетках печени).
[00052] Дополнительные аспекты раскрытия, включая описание определенных терминов, представлены ниже.
I. Определения
[00053] Приблизительно: Термин «приблизительно» или «примерно/около», как используется в настоящем описании, применительно к одному или более обсуждаемых величин, относится к значению, сходному с указанной определенной величиной. В некоторых вариантах осуществления термин «приблизительно» или «около» относится к диапазону значений, которые находятся в пределах 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% или менее в любом направлении (больше или меньше) заявленного определенного значения, если иное не указано или не следует из контекста (за исключением случаев, когда это число превышает 100% возможного значения).
[00054] Введение. Используемый здесь термин «введение» или «назначение введения» означает предоставление субъекту вещества (например, олигонуклеотида) фармакологически приемлемым способом (например, для лечения состояния у субъекта).
[00055] Рецептор асиалогликопротеина (ASGPR). Используемый здесь термин «рецептор асиалогликопротеина» или «ASGPR» относится к дву-фрагментному лектину С-типа, образованному основной субъединицей 48 кДа (ASGPR-1) и минорной субъединицей 40 кДа (ASGPR-). 2). ASGPR преимущественно экспрессируется на синусоидальной поверхности клеток гепатоцитов и играет главную роль в связывании, интернализации и последующем клиренсе циркулирующих гликопротеинов, содержащих концевые остатки галактозы или N-ацетилгалактозамина (асиалогликопротеины).
[00056] Комплементарный: используемый здесь термин «комплементарный» относится к структурной взаимосвязи между двумя нуклеотидами (например, на двух противоположных нуклеиновых кислотах или на противоположных участках одной цепи нуклеиновой кислоты) или между двумя последовательностями нуклеотидов, которая позволяет двум нуклеотидам или двум последовательностям нуклеотидов образовывать пары оснований друг с другом. Например, пуриновый нуклеотид одной нуклеиновой кислоты, комплементарный пиримидиновому нуклеотиду противоположной нуклеиновой кислоты, взаимодействуя с таковым, может образовывать пару оснований, образуя водородные связи друг с другом. В некоторых вариантах осуществления комплементарные нуклеотиды могут образовывать пару оснований Уотсона-Крика или взаимодействовать любым другим способом, который обеспечивает образование стабильных дуплексов. В некоторых вариантах осуществления две нуклеиновые кислоты могут иметь области из нескольких нуклеотидов, комплементарные друг другу для формирования областей комплементарности, как описано здесь.
[00057] Дезоксирибонуклеотид: Используемый здесь термин «дезоксирибонуклеотид» относится к нуклеотиду, имеющему водород вместо гидроксила в положении 2' пентозного сахара по сравнению с рибонуклеотидом. Модифицированный дезоксирибонуклеотид представляет собой дезоксирибонуклеотид, имеющий одну или несколько модификаций или замен атомов, в положениях, отличных от положения 2', включая модификации или замены в сахаре, фосфатной группе или основании.
[00058] Двухцепочечный олигонуклеотид: Используемый здесь термин «двухцепочечный олигонуклеотид» относится к олигонуклеотиду, который по существу находится в дуплексной форме. В некоторых вариантах воплощения комплементарное спаривание оснований дуплексной области (областей) двухцепочечного олигонуклеотида образуется между антипараллельными последовательностями нуклеотидов отдельных цепей нуклеиновой кислоты. В некоторых вариантах комплементарное спаривание оснований дуплексной области (областей) двухцепочечного олигонуклеотида образуется между антипараллельными последовательностями нуклеотидов цепей нуклеиновых кислот, которые ковалентно связаны. В некоторых вариантах осуществления комплементарное спаривание оснований дуплексной области (областей) с образованием двухцепочечного олигонуклеотида формируется на одной цепи нуклеиновой кислоты, которая сворачивается (например, посредством шпильки), чтобы обеспечить комплементарное взаимодействие антипараллельных последовательностей нуклеотидов с образованием пар оснований. В некоторых вариантах осуществления двухцепочечный олигонуклеотид содержит две отдельные ковалентные цепи нуклеиновой кислоты, которые полностью дуплексированы друг с другом. Однако, в некоторых вариантах осуществления двухцепочечный олигонуклеотид содержит две отдельные ковалентные цепи нуклеиновой кислоты, которые частично дуплексированы, например, имеют выступы на одном или обоих концах. В некоторых вариантах осуществления двухцепочечный олигонуклеотид содержит антипараллельные последовательности нуклеотидов, которые частично комплементарны и, таким образом, могут иметь одно или несколько мисматчей (несоответствий/некомплементарностей), и эти мисматчи могут включать внутренние мисматчи или концевые мисматчи (некомплементарности).
[00059] Дуплекс: Используемый здесь термин «дуплекс» в отношении нуклеиновых кислот (например, олигонуклеотидов) относится к структуре, образованной путем комплементарного спаривания оснований двух антипараллельных последовательностей нуклеотидов.
[00060] Эксципиент: Используемый здесь термин «эксципиент» относится к нетерапевтическому агенту, который может быть включен в композицию, например, для обеспечения или внесения желаемой консистенции или стабилизирующего эффекта.
[00061] Гепатоцит: Используемый здесь термин «гепатоцит» или «гепатоциты» относится к клеткам паренхиматозных тканей печени. Эти клетки составляют примерно 70-85% массы печени и вырабатывают сывороточный альбумин, фибриноген и протромбиновую группу факторов свертывания крови (за исключением факторов 3 и 4). Маркеры клеток линии гепатоцитов могут включать, но не ограничиваться таковыми: транстиретин (Ttr), глутаминсинтетазу (Glul), ядерный фактор гепатоцитов 1a (Hnf1a) и ядерный фактор гепатоцитов 4a (Hnf4a). Маркеры для зрелых гепатоцитов могут включать, но не ограничиваться таковыми: цитохром P450 (Cyp3a11), фумарилацетоацетат гидролазу (Fah), глюкозо-6-фосфат (G6p), альбумин (Alb) и OC2-2F8. См., например, публикацию Huch et al., (2013), Nature, 494 (7436): 247-250, содержание которой раскрывает маркеры гепатоцитов и включается в настоящее описание посредством ссылки.
[00062] Вирус гепатита B: используемый здесь термин «вирус гепатита B» или «HBV» относится к небольшому ДНК-вирусу, принадлежащему к семейству Hepadnaviridae и классифицируемому как типичный вид рода Orthohepadnavirus. Частицы вируса HBV (вирионы) содержат внешнюю липидную оболочку и икосаэдрическое ядро нуклеокапсида, состоящее из белка. Нуклеокапсид обычно включает вирусную ДНК и ДНК-полимеразу, которая обладает активностью обратной транскриптазы, аналогичной таковой ретровирусов. Внешняя оболочка HBV содержит встроенные белки, участвующие в связывании вируса с клеткой и в его проникновении в восприимчивые клетки. HBV, поражающий печень, классифицирован на основе последовательности, и имеет, по меньшей мере, десять генотипов (A-J). Как правило, существует четыре гена, кодируемых геномом, гены которых обозначаются как C, P, S и X. Основной белок вируса (называемый основным белком ядра) кодируется геном C (HBcAg), и его стартовому кодону предшествует расположенный выше по течению стартовый кодона AUG, расположенный в рамке считывания, с которого синтезируется предшественник основного белка. HBeAg производится путем протеолитической обработки предшественника основного белка. ДНК-полимераза кодируется геном P. Ген S кодирует поверхностный антиген (HBsAg). Ген HBsAg представляет собой одну длинную открытую рамку считывания, но содержит три «стартовых» (ATG) кодона в рамке считывания, которые делят ген на три секции: pre-S1, pre-S2 и S. Из-за множественных стартовых кодонов образуются полипептиды трех различных размеров, называемые большими, средними и маленькими (pre-S1+pre-S2+S, pre-S2+S или S). Они могут иметь соотношение 1: 1: 4 (Heermann et al, 1984).
[00063] Белки вируса гепатита В (HBV) могут быть организованы в несколько категорий и имеют несколько функций. Полимеразы функционируют как обратные транскриптазы (RT), осуществляя синтез вирусной ДНК из прегеномной РНК (pgRNA), а также как ДНК-зависимые полимеразы с целью формирования ковалентно замкнутой кольцевой ДНК (cccDNA) из вирусной ДНК. Они ковалентно прикреплены к 5'-концу минусовой нити. Основные белки образуют вирусный капсид и секретируемый Е-антиген. Поверхностные антигены являются лигандами интернализации гепатоцитами, а также основным компонентом сферических и нитевидных частиц. Авиральные частицы (вирусопдобные частицы, не несущие генетического материала) производятся в 1000 раз чаще, чем частицы Дейна (инфекционные вирионы), и могут действовать как иммунные приманки.
[00064] Поверхностный антиген вируса гепатита В: используемый здесь термин «поверхностный антиген вируса гепатита В» или «HBsAg» относится к белку, содержащему S-домен, кодируемому геном S (например, с ORF S) генома HBV. Частицы вируса гепатита В несут вирусную нуклеиновую кислоту в основе частиц, окруженную тремя белками, кодируемыми геном S, которые представляют собой белки поверхности: большой, средний и основной. Среди этих белков преобладающий поверхностный белок обычно содержит около 226 аминокислот и содержит только S-домен.
[00065] Инфекция: используемый здесь термин «инфекция» указывает на патогенную инвазию и/или размножение микроорганизмов, таких как вирусы, у субъекта. Инфекция может быть лизогенной, например, когда вирусная ДНК находится в состоянии покоя внутри клетки. Альтернативно, инфекция может быть литической, например, при которой вирус активно размножается и вызывает разрушение инфицированных клеток. Инфекция может вызывать или не вызывать клинически выраженные симптомы. Инфекция может оставаться локализованной или распространяться, например, через кровь или лимфатическую систему пациента. Индивидуума, имеющего, например, инфекцию HBV, можно идентифицировать путем обнаружения одного или нескольких маркеров вирусной нагрузки, поверхностного антигена (HBsAg), е-антигена (HBeAg); а также существуют различные другие методы выявления инфекции HBV, известные в данной области техники. Методы выявления инфекции HBV могут включать тестирование образцов сыворотки или крови на наличие HBsAg и/или HBeAg и, необязательно, дополнительный скрининг на наличие одного или нескольких вирусных антител (например, IgM и /или IgG) в те периоды времени, когда антиген HBV может присутствовать на уровне ниже порога детекции.
[00067] Воспаление печени: используемый здесь термин «воспаление печени» или «гепатит» относится к физическому состоянию, при котором печень опухает, становится дисфункциональной и/или болезненной, особенно в результате травмы или инфекции, что может быть вызвано воздействием гепатотоксического агента. Симптомы могут включать желтуху (пожелтение кожи или глаз), усталость, слабость, тошноту, рвоту, снижение аппетита и потерю веса. Воспаление печени, если его не лечить, может прогрессировать до фиброза, цирроза печени, печеночной недостаточности или рака печени.
[00068] Фиброз печени: используемый здесь термин «фиброз печени» относится к чрезмерному накоплению в печени белков внеклеточного матрикса, которые могут включать коллагены (I, III и IV), фибронектин, андулин, эластин, ламинин, гиалуронан и протеогликаны, образующиеся в результате воспаления и гибели клеток печени. Фиброз печени, если его не лечить, может перерасти в цирроз, печеночную недостаточность или рак печени.
[00069] Петля/шпилька: используемый здесь термин «петля» или «шпилька» относится к неспаренной области нуклеиновой кислоты (например, олигонуклеотида), которая фланкирована двумя антипараллельными областями нуклеиновой кислоты, достаточно комплементарными друг другу, чтобы при подходящих условиях гибридизации (например, в фосфатном буфере в клетках) две антипараллельные области, фланкирующую неспаренную область, гибридизовались с образованием дуплекса (называемого «стволом»).
[00070] Модифицированная межнуклеотидная связь: используемый здесь термин «модифицированная межнуклеотидная связь» относится к межнуклеотидной связи, имеющей одну или несколько химических модификаций по сравнению со стандартной межнуклеотидной связью, содержащей фосфодиэфирную связь. В некоторых вариантах осуществления модифицированный нуклеотид содержит не встречающуюся в природе связь. Как правило, модифицированная межнуклеотидная связь придает одно или несколько желательных свойств нуклеиновой кислоте, обладающей модифицированной межнуклеотидной связью. Например, модифицированный нуклеотид может улучшать термостабильность, устойчивость к деградации, устойчивость к нуклеазам, модифицированную растворимость, биодоступность, биоактивность, сниженную иммуногенность и т.д.
[00071] Модифицированный нуклеотид: Используемый здесь термин «модифицированный нуклеотид» относится к нуклеотиду, имеющему одну или несколько химических модификаций по сравнению с соответствующим стандартным нуклеотидом, выбранным из списка: рибонуклеотид аденина, рибонуклеотид гуанина, рибонуклеотид цитозина, рибонуклеотид урацила, дезоксирибонуклеотид аденина, дезоксирибонуклеотид гуанина, дезоксирибонуклеотид цитозина и дезоксирибонуклеотид тимидина. В некоторых вариантах осуществления модифицированный нуклеотид представляет собой не встречающийся в природе нуклеотид. В некоторых вариантах осуществления модифицированный нуклеотид имеет одну или несколько химических модификаций в своей сахарной, нуклеиновой и/или фосфатной группе. В некоторых вариантах осуществления модифицированный нуклеотид имеет одну или несколько химических групп, конъюгированных с соответствующим стандартным нуклеотидом. Как правило, модифицированный нуклеотид придает одно или несколько желательных свойств нуклеиновой кислоте, в которой присутствует модифицированный нуклеотид. Например, модифицированный нуклеотид может улучшать термостабильность, устойчивость к деградации, устойчивость к нуклеазам, биодоступность, биоактивность, модифицировать растворимость, обладать сниженной иммуногенностью и т.д.
[00072] Структура Тетра-петля с разрывом (Nicked Tetraloop): «Структура Nicked Tetraloop (Тетра-петля с разрывом)» представляет собой структуру олигонуклеотида RNAi, характеризующегося наличием отдельных смысловых (доставляемых) и антисмысловых (направляющих) цепей, в которых смысловая цепь имеет область комплементарности с антисмысловой цепью, и в которой, по меньшей мере, одна из цепей, обычно смысловая цепь, имеет тетра-петлю, сконфигурированную для стабилизации соседней области ствола (дуплекса), образованного в пределах, по меньшей мере, одной из цепей.
[00073] Олигонуклеотид: используемый здесь термин «олигонуклеотид» относится к короткой нуклеиновой кислоте, например, длиной менее 100 нуклеотидов. Олигонуклеотид может быть одноцепочечным или двухцепочечным. Олигонуклеотид может иметь или не иметь дуплексные области. Как вариант неограничивающих примеров олигонуклеотид может представлять собой небольшую интерферирующую РНК (siРНК), микроРНК (miРНК), короткую шпилечную РНК (shРНК), Дайцер-субстратную (dicer substrate) интерферирующую РНК (dsiРНК), антисмысловой олигонуклеотид, короткую siРНК или одноцепочечную siРНК, но не ограничивается таковыми. В некоторых вариантах осуществления двухцепочечный олигонуклеотид представляет собой олигонуклеотид RNAi.
[00074] Выступ: используемый здесь термин «выступ» относится к концевому неспаренному нуклеотиду(ам), образующимся в результате того, что одна цепь или область выступает за пределы конца комплементарной цепи, с которой эта цепь или область образует дуплекс. В некоторых вариантах осуществления выступ содержит один или более неспаренных нуклеотидов, выступающих за пределы дуплексной области на 5'-конце или 3'-конце двухцепочечного олигонуклеотида. В некоторых вариантах воплощения выступ является 3'- или 5'-выступом антисмысловой или смысловой цепи двухцепочечного олигонуклеотида.
[00075] Фосфатный аналог: используемый здесь термин «фосфатный аналог» относится к химическому фрагменту, который имитирует электростатические и/или стерические свойства фосфатной группы. В некоторых вариантах осуществления аналог фосфата расположен в позиции 5'-концевого нуклеотида олигонуклеотида вместо 5'-фосфата, часто подверженому ферментативному удалению. В некоторых вариантах осуществления 5'-фосфатный аналог обладает устойчивой к фосфатазе связью. Примеры фосфатных аналогов включают 5'-фосфонаты, такие как 5'-метиленфосфонат (5'-MP) и 5'-(E)-винилфосфонат (5'-VP). В некоторых вариантах осуществления олигонуклеотид имеет фосфатный аналог в позиции 4'-углерода сахара (называемый «4'-фосфатный аналог») в 5'-концевом нуклеотиде. Примером 4'-фосфатного аналога является оксиметилфосфонат, в котором атом кислорода оксиметильной группы связан с фрагментом сахара (например, на его 4'-углероде) или аналогом такового. См., например, предварительные заявки США под номерами: 62/383,207, поданную 2 сентября 2016 года, и 62/393,401, поданную 12 сентября 2016 года, содержание каждой из которых раскрывает фосфатные аналоги и включено в настоящий документ посредством ссылки. Другие модификации были разработаны для 5'-конца олигонуклеотидов (см., например, публикации WO 2011/133871; патент США № 8,927,513; и Prakash et al. (2015), Nucleic Acids Res., 43 (6): 2993-3011, содержание каждой из которых, относящееся к фосфатным аналогам, и включено в настоящее описание посредством ссылки).
[00076] Сниженная экспрессия: используемый здесь термин «сниженная экспрессия» гена относится к уменьшению количества РНК-транскрипта или белка, кодируемого геном, и/или снижению активности гена в клетке или субъекте, по сравнению с соответствующей контрольной клеткой или субъектом. Например, при проведении обработки клетки двухцепочечным олигонуклеотидом (например, имеющим антисмысловую цепь, комплементарную последовательности мРНК HBsAg) может привести к снижению количества РНК-транскрипта, белка и/или ферментативной активности (например, продуктов, кодируемых геном S генома HBV) по сравнению с клеткой, не обработанной двухцепочечным олигонуклеотидом. Подобным образом, «снижение/уменьшение экспрессии» в контексте настоящего описания относится к действию, которое приводит к уменьшенной экспрессии гена (например, гена S генома HBV).
[00076] Область комплементарности: используемый здесь термин «область комплементарности» относится к последовательности нуклеотидов нуклеиновой кислоты (например, двухцепочечного олигонуклеотида), которая комплементарна антипараллельной последовательности нуклеотидов в достаточной степени, чтобы обеспечить гибридизацию между двумя последовательностями нуклеотидов в соответствующих условиях гибридизации, например, в фосфатном буфере, в клетке и т.д.
[00077] Рибонуклеотид: используемый здесь термин «рибонуклеотид» относится к нуклеотиду, имеющему рибозу вместо сахара пентозы, содержащую гидроксильную группу в позиции 2'. Модифицированный рибонуклеотид представляет собой рибонуклеотид, имеющий одну или несколько модификаций или замен атомов в положениях, отличных от положения 2', включая модификации или замены и/или в рибозе, и/или фосфатной группе и/или основании.
[00078] РНКi-олигонуклеотид: используемый здесь термин «РНКi олигонуклеотид» относится к (а) двухцепочечному олигонуклеотиду, имеющему смысловую цепь (доставляемую) и антисмысловую цепь (направляющую/нацеливающую), в которой антисмысловая цепь или часть антисмысловой нить используется эндонуклеазой Argonaute 2 (Ago2) для расщепления мРНК-мишени или (b) одноцепочечный олигонуклеотид, имеющий одну антисмысловую нить, где эта антисмысловая нить (или часть этой антисмысловой нити) используется эндонуклеазой Ago2 для расщеплении целевой мРНК.
[00079] Цепь: используемый здесь термин «цепь» относится к единой непрерывной последовательности нуклеотидов, связанных вместе с помощью межнуклеотидных связей (например, фосфодиэфирных связей, фосфоротиоатных связей). В некоторых вариантах осуществления цепь имеет два свободных конца, например, 5'-конец и 3'-конец.
[00080] Субъект: используемый здесь термин «субъект» означает любое млекопитающее, включая мышей, кроликов и человека. В одном варианте осуществления субъект является человеком или приматом, не являющимся человеком. Термины «индивидуум» или «пациент» могут использоваться взаимозаменяемо с термином «субъект».
[00081] Синтетический: используемый здесь термин «синтетический» относится к нуклеиновой кислоте или другой молекуле, которая была искусственно синтезирована (например, с использованием аппарата (например, синтезатора нуклеиновых кислот на твердой фазе)) или к молекуле, которая в норме не происходит из естественного источника (например, клетки или организма), производящего молекулу естественным образом.
[00082] Нацеливающий лиганд: используемый здесь термин «нацеливающий лиганд» относится к молекуле (например, углеводу, аминосахару, холестерину, полипептиду или липиду), которая селективно связывается с родственной молекулой (например, рецептором) в ткани или клетке, представляющей интерес, и которая может быть конъюгирована с другим веществом с целью нацеливания другого вещества на ткань или клетку, представляющую интерес. Например, в некоторых вариантах осуществления нацеливающий лиганд может быть конъюгирован с олигонуклеотидом, для нацеливания олигонуклеотида на конкретную ткань или клетку, представляющую интерес. В некоторых вариантах осуществления нацеливающий лиганд избирательно связывается с рецептором клеточной поверхности. Соответственно, в некоторых вариантах осуществления нацеливающий лиганд, в случае, если он конъюгирован с олигонуклеотидом, облегчает доставку олигонуклеотида в конкретную клетку посредством селективного связывания с рецептором, экспрессируемым на поверхности клетки, и эндосомной интернализации клеткой комплекса, содержащего олигонуклеотид, нацеливающий лиганд и рецептор. В некоторых вариантах осуществления нацеливающий лиганд конъюгируют с олигонуклеотидом через линкер, который расщепляется после или во время клеточной интернализации, таким образом, что олигонуклеотид высвобождается от нацеливающего лиганда в самой клетке.
[00083] Тетра-петля: используемый здесь термин «тетра-петля» относится к петле, повышающей стабильность соседнего дуплекса, образованного гибридизацией фланкирующих последовательностей нуклеотидов. Увеличение стабильности определяется как повышение температуры плавления (Tm) ствола смежного дуплекса, которая выше, чем ожидаемая Tm ствола смежного дуплекса при наличии петель сопоставимой длины, состоящих из случайно выбранных последовательностей нуклеотидов. Например, тетра-петля может обеспечивать температуру плавления по меньшей мере 50°C, по меньшей мере 55°C, по меньшей мере 56°C, по меньшей мере 58°C, по меньшей мере 60°C, по меньшей мере 65°C или по меньшей мере 75°C в 10 мМ NaHPO4 для шпильки, содержащей дуплекс длиной не менее 2 пар оснований. В некоторых вариантах осуществления тетра-петля может стабилизировать пару оснований в прилежащем стволе дуплекса с помощью стековых взаимодействий (нековалентные взаимодействия ароматических соединений). Кроме того, взаимодействия между нуклеотидами в тетра-петле включают, но не ограничиваются ими, спаривание оснований по Уотсону-Крику, стековые взаимодействия, водородные связи и контактные взаимодействия (Cheong et al., Nature 1990 Aug. 16; 346 (6285) : 680-2; Heus and Pardi, Science 1991 Jul. 12; 253 (5016): 191-4). В некоторых вариантах осуществления тетра-петля содержит от 4 до 5 нуклеотидов. В некоторых вариантах осуществления тетра-петля содержит или состоит из трех, четырех, пяти или шести нуклеотидов, которые могут быть или не быть модифицированы (например, которые могут быть или не быть конъюгированы с нацеливающим фрагментом). В одном варианте осуществления тетра-петля состоит из четырех нуклеотидов. В тетра-петле может быть использован любой нуклеотид, и стандартные символы IUPAC-IUB для таких нуклеотидов выбираются, как описано в Cornish-Bowden (1985) Nucl. Acids Res. 13: 3021-3030. Например, буква «N» может использоваться для обозначения того, что в этом положении может находиться любое основание, буква «R» может использоваться для обозначения, что A (аденин) или G (гуанин) могут находиться в данном положении, а «B» может использоваться для обозначения, что C (цитозин), G (гуанин) или T (тимин) могут находиться в данном положении. Примеры тетра-петель включают тетра-петли семейства UNCG (например, UUCG), тетра-петли семейства GNRA (например, GAAA) и тетра-петли семейства CUUG (Woese et al., Proc Natl Acad Sci USA. 1990 November; 87(21):8467-71; Antao et al., Nucleic Acids Res. 1991 Nov. 11; 19(21):5901-5). Примеры тетра-петель ДНК включают семейство тетра-петель d(GNNA) (например, d (GTTA)), семейство тетра-петель d (GNRA), семейство тетра-петель d(GNAB), семейство тетра-петель d(CNNG) и семейство тетра-петель d(TNCG) (например, d(TTCG)). См., например, публикации: Nakano et al. Biochemistry, 41 (48), 14281-14292, 2002. SHINJI et al. Nippon Kagakkai Koen Yokoshu. VOL. 78th; NO. 2; PAGE. 731 (2000), которые включены сюда посредством ссылки для соответствующих раскрытий таковых. В некоторых вариантах осуществления тетра-петля содержится в структуре «тетра-петли с разрывом (nicked tetraloop structure)».
[00084] Лечение: используемый здесь термин «лечить» относится к акту оказания помощи субъекту, нуждающемуся в этом, например, посредством введения терапевтического агента (например, олигонуклеотида) субъекту в целях улучшения здоровья и/или качества жизни субъекта по отношению к существующему состоянию (например, при существующей инфекции HBV) или для предотвращения или уменьшения вероятности возникновения нежелательного состояния (например, для предотвращения фиброза печени, гепатита, рака печени или другого состояния, связанного с инфекцией HBV). В некоторых вариантах осуществления лечение включает уменьшение частоты или тяжести, по меньшей мере, одного признака, симптома или сопутствующего фактора состояния (например, при инфекции HBV или связанного состояния), испытываемого субъектом. Во время HBV-инфекции у субъекта могут проявляться такие симптомы, как пожелтение кожи и глаз (желтуха), темная моча, сильная усталость, тошнота, рвота и боль в животе. Соответственно, в некоторых вариантах осуществления лечение, раскрытое в настоящем изобретении, может привести к снижению частоты или тяжести одного или нескольких таких симптомов. Однако инфекция HBV может развиться в одно или несколько заболеваний печени, таких как цирроз печени, фиброз печени, воспаление печени или рак печени. Соответственно, в некоторых вариантах осуществления лечение, раскрытое в настоящем изобретении, может привести к снижению частоты или тяжести или предотвращению или ослаблению одного или нескольких таких состояний.
II. Ингибиторы на основе олигонуклеотидов
i. Нацеливание на поверхностный антиген HBV
[00085] В некоторых вариантах осуществления в настоящем изобретении предоставляются ингибиторы экспрессии поверхностного антигена HBV на основе олигонуклеотидов, которые можно использовать для достижения терапевтического эффекта. В результате изучения мРНК поверхностного антигена HBV и тестирования различных олигонуклеотидов были разработаны высокоэффективные олигонуклеотиды для снижения экспрессии поверхностного антигена HBV (HBsAg) для лечения инфекции HBV. Представленные здесь олигонуклеотиды в некоторых вариантах осуществления предназначены для нацеливания на последовательности мРНК HBsAg, присутствующие в >95% известных геномов HBV по всем известным генотипам. В некоторых вариантах осуществления такие олигонуклеотиды приводят к снижению прегеномной РНК (pgRNA) HBV и мРНК HBsAg в печени более чем 90%. В некоторых вариантах осуществления снижение экспрессии HBsAg сохраняется в течение продолжительного периода времени после введения одной дозы или завершения схемы лечения.
[00086] Соответственно, в некоторых вариантах осуществления представленные здесь олигонуклеотиды сконструированы таким образом, чтобы иметь области комплементарности с мРНК HBsAg для осуществления нацеливания на транскрипты такового в клетках и ингибирования их экспрессии. Область комплементарности обычно имеет приемлемую длину и такой подбор оснований, чтобы обеспечить отжиг олигонуклеотида (или его цепи) с мРНК HBsAg для ингибирования экспрессии такового. В некоторых вариантах осуществления область комплементарности составляет по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19 или, по меньшей мере 20 нуклеотидов в длину. В некоторых вариантах осуществления представленный здесь олигонуклеотид имеет область комплементарности мРНК HBsAg, находящуюся в диапазоне от 12 до 30 (например, от 12 до 30, от 12 до 22, от 15 до 25, от 17 до 21, от 18 до 27, от 19 до 27 или 15-30) нуклеотидов в длину. В некоторых вариантах осуществления представленный здесь олигонуклеотид имеет область комплементарности мРНК HBsAg, которая имеет 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов в длину.
[00087] В некоторых вариантах осуществления представленные здесь олигонуклеотиды предназначены для нацеливания на последовательности мРНК, кодирующие HBsAg. Например, в некоторых вариантах осуществления предоставляется олигонуклеотид, имеющий антисмысловую цепь, содержащую область комплементарности последовательности, такую как: ACAANAAUCCUCACAAUA (SEQ ID NO: 1), где N относится к любому нуклеотиду (A, G, T, или С). В некоторых вариантах осуществления олигонуклеотид дополнительно содержит смысловую цепь, образующую дуплексную область с антисмысловой цепью. В некоторых вариантах осуществления смысловая цепь содержит область комплементарности последовательности, обозначенной как: UUNUUGUGAGGAUUN (SEQ ID NO: 2). В некоторых вариантах осуществления смысловая цепь содержит область комплементарности последовательности, такую как (показано с 5 'по 3'): UUAUUGUGAGGAUUNUUGUC (SEQ ID NO: 3).
[00088] В некоторых вариантах осуществления антисмысловая цепь содержит или состоит из последовательности, такой как: UUAUUGUGAGGAUUNUUGUCGG (SEQ ID NO: 4). В некоторых вариантах осуществления антисмысловая цепь содержит или состоит из последовательности, обозначенной как: UUAUUGUGAGGAUUCUUGUCGG (SEQ ID NO: 5). В некоторых вариантах осуществления антисмысловая цепь содержит или состоит из последовательности, такой как: UUAUUGUGAGGAUUUUUGU CGG (SEQ ID NO: 5.1). В некоторых вариантах осуществления смысловая цепь включает в себя или состоит из последовательности, указанной как: ACAANAAUCCUCACAAUAA (SEQ ID NO: 6). В некоторых вариантах осуществления смысловая цепь содержит или состоит из последовательности, представленной в виде: GACAANAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 7). В некоторых вариантах осуществления смысловая цепь содержит или состоит из последовательности, такой как: GACAAAAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8). В некоторых вариантах осуществления смысловая цепь содержит или состоит из последовательности, такой как: GACAAGAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8.1).
[00089] В некоторых вариантах осуществления олигонуклеотид для снижения экспрессии мРНК HBsAg содержит смысловую цепь, образующую дуплексную область с антисмысловой цепью, где смысловая цепь содержит последовательность, указанную в любой из SEQ ID NO: 6-8.1, и антисмысловая цепь содержит последовательность, указанную в любой из SEQ ID NO: 4-5.1. В некоторых вариантах осуществления смысловая цепь содержит 2'-фтор и 2'-O-метил модифицированные нуклеотиды и, по меньшей мере, одну фосфоротиоатную межнуклеотидную связь. В некоторых вариантах осуществления смысловая цепь конъюгирована с N-ацетилгалактозаминовой (GalNAc) группой. В некоторых вариантах осуществления антисмысловая цепь содержит 2'-фтор- и 2'-O-метил-модифицированные нуклеотиды и, по меньшей мере, одну фосфоротиоатную межнуклеотидную связь. В некоторых вариантах осуществления 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог. В некоторых вариантах осуществления каждая из антисмысловой и смысловой цепи содержит 2'-фторо и 2'-O-метил модифицированные нуклеотиды и, по меньшей мере, одну фосфоротиоатную межнуклеотидную связь, причем 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог, а смысловая цепь конъюгирована с N-ацетилгалактозаминовой (GalNAc) группой.
[00090] В некоторых вариантах осуществления смысловая цепь, содержащая последовательность, изложенную в любой из SEQ ID NO: 7-8.1, содержит 2'-фтормодифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17. В некоторых вариантах осуществления смысловая цепь содержит 2'-O-метил-модифицированные нуклеотиды в положениях 1, 2, 4-7, 11, 14-16, 18-26 и 31-36. В некоторых вариантах осуществления смысловая цепь содержит одну фосфоротиоатную межнуклеотидную связь. В некоторых вариантах осуществления смысловая цепь содержит фосфоротиоатную межнуклеотидную связь между нуклеотидами в положениях 1 и 2. В некоторых вариантах осуществления смысловая цепь конъюгирована с N-ацетилгалактозаминовой (GalNAc) группой.
[00091] В некоторых вариантах осуществления антисмысловая цепь, содержащая последовательность, указанную в любом из SEQ ID NO: 4-5.1, содержит 2'-фтормодифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19. В некоторых вариантах осуществления антисмысловая цепь содержит 2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22. В некоторых вариантах осуществления антисмысловая цепь содержит три фосфоротиоатные межнуклеотидные связи. В некоторых вариантах осуществления антисмысловая цепь содержит фосфоротиоатные межнуклеотидные связи между нуклеотидами в положениях 1 и 2, между нуклеотидами в положениях 2 и 3, между нуклеотидами в положениях 3 и 4, между нуклеотидами в положениях 20 и 21 и между нуклеотидами в положениях 21 и 22. В некоторых вариантах осуществления 4'-углерод сахара 5'-нуклеотида антисмысловой цепи содержит фосфатный аналог.
II. Двухцепочечные олигонуклеотиды
[00092] Существует множество структур олигонуклеотидов, которые выгодны для нацеливания на экспрессию мРНК HBsAg в способах по настоящему изобретению, включающие RNAi, антисмысловые, miRNA и т.д. Любая из структур, описанных в настоящем изобретении или в другом месте, может использоваться как основа для включения или нацеливания последовательностей, описанных в настоящем изобретении. Двухцепочечные олигонуклеотиды для нацеливания на экспрессию антигена HBV (например, методами RNAi) обычно имеют смысловую цепь и антисмысловую цепь, образующие дуплекс друг с другом. В некоторых вариантах смысловые и антисмысловые цепи не связаны ковалентно. Однако в некоторых вариантах смысловые и антисмысловые цепи ковалентно связаны.
[00093] В некоторых вариантах осуществления двухцепочечные олигонуклеотиды для снижения экспрессии мРНК HBsAg вовлекаются в процесс интерференции РНК (RNAi). Например, олигонуклеотиды RNAi были разработаны таким образом, чтобы каждая цепь имела размеры 19-25 нуклеотидов и обладала, по меньшей мере, одним 3'-выступом от 1 до 5 нуклеотидов (см., например, патент США № 8372998). Также были разработаны более длинные олигонуклеотиды, которые обрабатываются ферментом Dicer для получения активных продуктов RNAi (см., например, патент США № 8,883,996). Дальнейшая работа позволила получить удлиненные двухцепочечные олигонуклеотиды, в которых, по меньшей мере, один конец, по меньшей мере, одной цепи выходит за пределы дуплекса области нацеливания, включая структуры, в которых одна из цепей содержит термодинамически стабилизирующую структуру тетра-петли (см., например, патенты США №№ 8,513,207. и 8,927,705, а также WO 2010033225, раскрывающие данные олигонуклеотиды и содержание которых включено в настоящее описание посредством ссылки. Варианты таких структур могут включать одноцепочечные выступы-удлинения (на одной или обеих сторонах молекулы), а также двухцепочечные удлинения.
[00094] В некоторых вариантах осуществления олигонуклеотиды, представленные в настоящем изобретении, расщепляются ферментами Dicer. Такие олигонуклеотиды могут иметь выступ (например, 1, 2 или 3 нуклеотида в длину) на 3'-конце смысловой цепи. Такие олигонуклеотиды (например, siРНК) могут содержать 21 нуклеотидную направляющую цепь, которая является антисмысловой по отношению к РНК-мишени, и комплементарную цепь (доставляемую цепь), где обе цепи отжигаются с образованием дуплекса длиной 19 п.н. и выступов длиной в 2 нуклеотида на одном или обоих 3'-концах. Также доступны более длинные конструкции олигонуклеотидов, включающие олигонуклеотиды, имеющие направляющую цепь из 23 нуклеотидов и доставляемую цепь из 21 нуклеотида, где имеется тупой конец с правой стороны молекулы (3'-конец доставляемой цепи/5'-конец направляющей цепи) и 3'-выступ длиной в два нуклеотида с левой стороны молекулы (5'-конец доставляемой цепи/3'-конец направляющей цепи). В таких молекулах имеется дуплексная область из 21 пары оснований. См., например, публикации US 9012138, US 9012621 и US 9193753, каждая из которых включена в настоящий документ посредством ссылки на предмет их соответствующих раскрытий.
[00095] В некоторых вариантах осуществления олигонуклеотиды, раскрытые в настоящем изобретении, могут содержать смысловые и антисмысловые цепи, длина которых находится в диапазоне от 17 до 26 (например, от 17 до 26, от 20 до 25, от 19 до 21 или 21-23) нуклеотидов. В некоторых вариантах осуществления смысловые и антисмысловые цепи имеют одинаковую длину. В некоторых вариантах осуществления у олигонуклеотидов, имеющих смысловые и антисмысловые цепи, длина которых составляет 21-23 нуклеотида, есть 3'-выступ по смысловой, антисмысловой или обеим смысловым и антисмысловым цепям составляющий 1 или 2 нуклеотида в длину. В некоторых вариантах осуществления олигонуклеотид имеет направляющую цепь из 23 нуклеотидов и доставляемую цепь из 21 нуклеотида, и имеет тупой конец с правой стороны молекулы (3'-конец доставляемой цепи/5'-конец направляющей цепи) и двухнуклеотидный 3'-выступ направляющей цепи на левой стороне молекулы (5'-конец доставляемой цепи/3'-конец направляющей цепи). В таких молекулах имеется дуплексная область, состоящая из 21 пары оснований. В некоторых вариантах осуществления олигонуклеотид содержит смысловую цепь из 25 нуклеотидов и антисмысловую цепь из 27 нуклеотидов, которая, когда на нее воздействует фермент Дайцера, приводит к включению антисмысловой цепи в зрелый RISC.
[00096] Другие конструкции олигонуклеотидов для использования в композициях и способах, раскрытых в настоящем изобретении, включают: 16-мерные siРНК (см., например, Nucleic Acids in Chemistry and Biology. Blackburn (ed.), Royal Society of Chemistry, 2006), shРНК (например, имеющие 19 п.н. или более короткие стволы, см., например, Moore et al. Methods Mol. Biol. 2010; 629: 141-158), «тупые» siРНК (например, длиной 19 п.н.; см.: например, Kraynack and Baker, RNA Vol. 12, p163-176 (2006)), асимметричные siРНК (aiRNA; см., например, Sun et al., Nat. Biotechnol. 26, 1379-1382 (2008)), асимметричные коротко-дуплексные siРНК (см., например, Chang et al., Mol Ther. 2009 Apr; 17 (4): 725-32), siРНК с вилкой (см., например, Hohjoh, FEBS Letters, Vol 557, issues 1-3; Jan 2004, p 193-198), одноцепочечные siРНК (Elsner; Nature Biotechnology 30, 1063 (2012)), кольцевые siРНК в форме гантелей (см., например, Abe et al. J Am Chem Soc. 129: 15108-15109 (2007)) и небольшие внутренне сегментированные интерферирующие РНК (sisiRNA; см., например, Bramsen et al., Nucleic Acids Res. 2007 Sep; 35 (17): 5 886-5897). Каждая из вышеупомянутых публикаций включена в данное описание во всей своей полноте посредством ссылки на предмет соответствующих раскрытий. Другими неограничивающими примерами олигонуклеотидных структур, которые могут быть использованы в некоторых вариантах осуществления изобретения для снижения или ингибирования экспрессии HBsAg, являются микроРНК (miRNA), короткая РНК (shRNA) с короткой шпилькой и короткая siРНК (см., например, Hamilton et al., Embo J., 2002, 21 (17): 4671-4679; см. также патентную заявку США № 20090099115).
а. Антисмысловые цепи
[00097] В некоторых вариантах осуществления антисмысловая цепь олигонуклеотида может упоминаться как «направляющая или нацеливающая цепь». Например, если антисмысловая цепь способна взаимодействовать с РНК-индуцированным комплексом сайленсинга (RISC) и связываться с белком Argonaut, или вовлекать во взаимодействие один или более сходных факторов или связываться с ними, и обеспечивать сайленсинг (выключение) целевого гена, то она может определяться как направляющая цепь. В некоторых вариантах осуществления смысловая цепь, комплементарная направляющей цепи, может упоминаться как «пассажирская» или доставляемая цепь.
[00098] В некоторых вариантах осуществления олигонуклеотид, представленный в настоящем изобретении, содержит антисмысловую цепь длиной до 50 нуклеотидов (например, до 30, до 27, до 25, до 21 или до 19 нуклеотидов в длину). В некоторых вариантах осуществления олигонуклеотид, представленный в настоящем изобретении, содержит антисмысловую цепь, длина которой составляет по меньшей мере 12 нуклеотидов (например, по меньшей мере, 12, по меньшей мере, 15, по меньшей мере, 19, по меньшей мере, 21, по меньшей мере, 25 или, по меньшей мере, 27 нуклеотидов в длину). В некоторых вариантах осуществления антисмысловая цепь олигонуклеотида, раскрытого в настоящем изобретении, находится в диапазоне от 12 до 50 или от 12 до 30 (например, от 12 до 30, от 11 до 27, 11-25, 15-21, 15-27, 17-21, 17-25, 19-27 или 19-30) нуклеотидов в длину. В некоторых вариантах осуществления антисмысловая цепь любого из олигонуклеотидов, раскрытых в настоящем изобретении, составляет 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 нуклеотидов в длину.
[00099] В некоторых вариантах осуществления антисмысловая цепь содержит область комплементарности последовательности, такой как (показано 5'- 3'): AATCCTCACA (SEQ ID NO: 9). В некоторых вариантах осуществления антисмысловая цепь содержит последовательность, такую как (показано с 5' по 3'): UGUGAGGAUU (SEQ ID NO: 10). В некоторых вариантах осуществления антисмысловая цепь содержит последовательность, такую как (показано с 5' по 3'): TGTGAGGATT (SEQ ID NO: 11).
[000100] В некоторых вариантах осуществления олигонуклеотид для уменьшения экспрессии мРНК HBsAg может содержать антисмысловую цепь, имеющую область комплементарности последовательности, такой как указано в SEQ ID NO: 9, и один или два некомплементарных нуклеотида на ее 3' -конце. В некоторых вариантах осуществления антисмысловая цепь содержит нуклеотидную последовательность, представленную любой из SEQ ID NO: 4-5.1.
[000101] В некоторых вариантах осуществления олигонуклеотид для снижения экспрессии мРНК HBsAg может содержать антисмысловую цепь, имеющую область комплементарности последовательности, указанной в SEQ ID NO: 9, где антисмысловая цепь не имеет последовательности, указанной в любом из следующих пунктов (показано с 5' по 3'): TATTGTGAGGATTCTTGTCA (SEQ ID NO: 12); CGGTATTGTGAGGATTCTTG (SEQ ID NO: 13); TGTGAGGATTCTTGTCAACA (SEQ ID NO: 14); UAUUGUGAGGAUUUUUGUCAA (SEQ ID NO: 15); UGCGGUAUUGUGAGGAUUCTT (SEQ ID NO: 16); ACAGCATTGTGAGGATTCTTGTC (SEQ ID NO: 17); UAUUGUGAGGAUUUUUGUCAACA (SEQ ID NO: 18); AUUGUGAGGAUUUUUGUCAACAA (SEQ ID NO: 19); и UUGUGAGGAUUUUUGUCAACAAG (SEQ ID NO: 20). В некоторых вариантах осуществления антисмысловая цепь отличается от нуклеотидной последовательности, представленной в SEQ ID NO: 4, 5 или 5.1 не более чем на три нуклеотида.
b. Смысловые цепи
[000102] В некоторых вариантах осуществления двухцепочечный олигонуклеотид может иметь смысловую цепь длиной до 40 нуклеотидов (например, до 40, до 35, до 30, до 27, до 25, до 21 до 19, до 17 или до 12 нуклеотидов в длину). В некоторых вариантах осуществления олигонуклеотид может иметь смысловую цепь длиной, по меньшей мере, 12 нуклеотидов (например, по меньшей мере 12, по меньшей мере 15, по меньшей мере 19, по меньшей мере 21, по меньшей мере 25, по меньшей мере 27, по меньшей мере 30, по меньшей мере 35 или, по меньшей мере 38 нуклеотидов в длину). В некоторых вариантах осуществления олигонуклеотид может иметь смысловую цепь в диапазоне от 12 до 50 нуклеотидов длиной (например, от 12 до 40, от 12 до 36, от 12 до 32, от 12 до 28, от 15 до 40, от 15 до 36, от 15 до 32, от 15 до 28, от 17 до 21, от 17 до 25, от 19 до 27, от 19 до 30, до 20 до 40, от 22 до 40, от 25 до 40 или от 32 до 40). В некоторых вариантах осуществления олигонуклеотид может иметь смысловую цепь 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов в длину. В некоторых вариантах осуществления смысловая цепь олигонуклеотида длиннее 27 нуклеотидов (например, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 нуклеотидов). В некоторых вариантах осуществления смысловая цепь олигонуклеотида длиннее 25 нуклеотидов (например, 26, 27, 28, 29 или 30 нуклеотидов).
[000103] В некоторых вариантах осуществления смысловая цепь содержит петлю ствола на своем 3'-конце. В некоторых вариантах осуществления смысловая цепь содержит петлю ствола на своем 5'-конце. В некоторых вариантах осуществления длина цепи, содержащей петлю ствола, составляет от 2 до 66 нуклеотидов в длину (например, от 2 до 66, от 10 до 52, от 14 до 40, от 2 до 30, от 4 до 26, от 8 до 22, от 12 до 18, от 10 до 22, от 14 до 26 или от 14 до 30 нуклеотидов длиной). В некоторых вариантах осуществления цепь, содержащая петлю ствола, составляет 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов в длину. В некоторых вариантах осуществления ствол содержит дуплекс длиной 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 нуклеотидов. В некоторых вариантах осуществления петля ствола обеспечивает молекуле повышенную защиту от деградации (например, ферментативного расщепления) и улучшает возможности нацеливания при доставке в клетку-мишень. Например, в некоторых вариантах осуществления петля несет добавленные нуклеотиды, в которые можно вносить модификации, не оказывая существенного влияния на активность олигонуклеотида по ингибированию экспрессии генов. В некоторых вариантах осуществления в настоящем изобретении представлен олигонуклеотид, в котором смысловая цепь включает (например, на своем 3'-конце) петлю ствола, обозначенную как: S1-L-S2, в которой S1 является комплементарной S2, и в которой L образует петлю между S1 и S2 длиной до 10 нуклеотидов (например, длиной 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеотидов).
[000104] В некоторых вариантах осуществления сама петля (L) петли ствола представляет собой тетра-петлю (например, в структуре тетра-петли с разрезом). Тетра-петля может содержать рибонуклеотиды, дезоксирибонуклеотиды, модифицированные нуклеотиды и комбинации таковых. Как правило, тетра-петля имеет от 4 до 5 нуклеотидов.
с. Длина дуплекса
[000105] В некоторых вариантах осуществления дуплекс, образованный смысловой и антисмысловой цепями, составляет, по меньшей мере, 12 (например, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20 или по меньшей мере 21) нуклеотидов в длину. В некоторых вариантах осуществления дуплекс, образованный смысловой и антисмысловой цепями, имеет длину от 12 до 30 нуклеотидов (например, от 12 до 30, от 12 до 27, от 12 до 22, от 15 до 25, от 18 до 30, от 18 до 22, от 18 до 25, от 18 до 27, от 18 до 30, от 19 до 30 или от 21 до 30 нуклеотидов в длину). В некоторых вариантах осуществления дуплекс, образованный смысловой и антисмысловой цепями, составляет 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, или 30 нуклеотидов в длину. В некоторых вариантах осуществления дуплекс, образованный смысловой и антисмысловой цепями, не охватывает всю длину смысловой цепи и/или антисмысловой цепи. В некоторых вариантах осуществления дуплекс смысловой и антисмысловой цепей охватывает всю длину либо смысловой, либо антисмысловой цепей. В некоторых вариантах осуществления дуплекс между смысловой и антисмысловой цепями охватывает всю длину как смысловой цепи, так и антисмысловой цепи.
d. Концы олигонуклеотида
[000106] В некоторых вариантах осуществления олигонуклеотид содержит смысловые и антисмысловые цепи таким образом, что имеется 3'-выступ по отношению либо к смысловой цепи, либо к антисмысловой цепи, либо к обеим смысловой и антисмысловой цепям. В некоторых вариантах осуществления олигонуклеотиды, представленные в настоящем изобретении, имеют один 5'-конец, который является термодинамически менее стабильным по сравнению с другим 5'-концом. В некоторых вариантах осуществления предоставляется асимметрический олигонуклеотид, который содержит тупой конец на 3'-конце смысловой цепи и выступ на 3'-конце антисмысловой цепи. В некоторых вариантах осуществления 3'-выступ антисмысловой цепи составляет 1-8 нуклеотидов в длину (например, 1, 2, 3, 4, 5, 6, 7 или 8 нуклеотидов в длину).
[000107] Как правило, RNAi олигонуклеотид имеет двухнуклеотидный выступ на 3'-конце антисмысловой (направляющей) цепи. Однако возможны и другие варианты выступов. В некоторых вариантах осуществления выступ является 3'-выступом длиной от одного до шести нуклеотидов, необязательно от одного до пяти, от одного до четырех, от одного до трех, от одного до двух, от двух до шести, от двух до пяти, от двух до четырех, от двух до трех, от трех до шести, от трех до пяти, от трех до четырех, от четырех до шести, от четырех до пяти, от пяти до шести нуклеотидов или один, два, три, четыре, пять или шесть нуклеотидов. Тем не менее, в некоторых вариантах осуществления выступ является 5' -выступом, длиной от одного до шести нуклеотидов, необязательно от одного до пяти, от одного до четырех, от одного до трех, от одного до двух, от двух до шести, от двух до пяти, от двух до четыре, от двух до трех, от трех до шести, от трех до пяти, от трех до четырех, от четырех до шести, от четырех до пяти, от пяти до шести нуклеотидов или составляет один, два, три, четыре, пять или шесть нуклеотидов в длину.
[000108] В некоторых вариантах осуществления один или более (например, 2, 3, 4) концевых нуклеотидов 3'-конца или 5'-конца смысловой и/или антисмысловой цепи модифицированы. Например, в некоторых вариантах осуществления один или два концевых нуклеотида 3'-конца антисмысловой цепи модифицированы. В некоторых вариантах осуществления последний нуклеотид на 3'-конце антисмысловой цепи модифицирован, например, содержит 2'-модификацию, например, 2'-O-метоксиэтил. В некоторых вариантах осуществления последние один или два концевых нуклеотида на 3'-конце антисмысловой цепи являются комплементарными мишени. В некоторых вариантах осуществления последние один или два нуклеотида на 3'-конце антисмысловой цепи не являются комплементарными мишени.
[000109] В некоторых вариантах осуществления предоставляется двухцепочечный олигонуклеотид, который содержит структуру тетра-петлеви с разрывом на 3' конце смысловой цепи и два концевых выступающих нуклеотида на 3' конце антисмысловой цепи такового. В некоторых вариантах осуществления два терминальных выступающих нуклеотида представляют собой GG. Как правило, один или оба из двух концевых нуклеотидов GG антисмысловой цепи не являются комплементарными мишени.
[000110] В некоторых вариантах осуществления 5'-конец и/или 3'-конец смысловой или антисмысловой цепи имеет инвертированный «кэп»-нуклеотид.
[000111] В некоторых вариантах осуществления предусмотрены одна или несколько (например, 2, 3, 4, 5, 6) модифицированных межнуклеотидных связей, расположенных между концевыми нуклеотидами 3'-конца или 5'-конца смысловой и/или антисмысловой цепи. В некоторых вариантах осуществления предусмотрены модифицированные межнуклеотидные связи между нуклеотидами выступа на 3'-конце или 5'-конце смысловой и/или антисмысловой цепи.
е. Мисматчи (или неспаренные нуклеотиды)
[000112] В некоторых вариантах осуществления олигонуклеотид может иметь один или более (например, 1, 2, 3, 4, 5) мисматчей между смысловой и антисмысловой цепями. Если имеется более одного мисматча между смысловой и антисмысловой цепями, то они могут быть расположены последовательно (например, 2, 3 или более в ряд) или разбросаны по всей области комплементарности. В некоторых вариантах осуществления 3'-конец смысловой цепи содержит один или более мисматчей. В одном варианте осуществления два мисматча включены в 3'-конец смысловой цепи. В некоторых вариантах осуществления мисматч оснований или дестабилизация сегментов на 3'-конце смысловой цепи олигонуклеотида увеличивали потенциал синтетических дуплексов при RNAi, возможно, с помощью облегчения обработки ферментом Дэйцер (Dicer).
[000113] В некоторых вариантах осуществления антисмысловая цепь может иметь область комплементарности транскрипту HBsAg, которая содержит один или более мисматчей по сравнению с соответствующей последовательностью транскрипта. Область комплементарности олигонуклеотида может иметь до 1, до 2, до 3, до 4, до 5 и т.д. мисматчей при условии, что она сохраняет способность образовывать комплементарные пары оснований с транскриптом при соответствующих условиях гибридизации. Альтернативно, область комплементарности олигонуклеотида может иметь не более 1, не более 2, не более 3, не более 4 или не более 5 мисматчей при условии, что она сохраняет способность образовывать комплементарные пары оснований с мРНК HBsAg в соответствующих условиях гибридизации. В некоторых вариантах осуществления, если имеется более одного мисматча в области комплементарности, то они могут быть расположены последовательно (например, 2, 3, 4 или более в ряд) или разбросаны по всей области комплементарности при условии, что олигонуклеотид сохраняет способность образовывать комплементарные пары оснований с мРНК HBsAg в соответствующих условиях гибридизации.
III. Одноцепочечные олигонуклеотиды
[000114] В некоторых вариантах осуществления олигонуклеотид для снижения экспрессии HBsAg, как описано здесь, представляет собой одноцепочечный олигонуклеотид, комплементарные мРНК HBsAg. Такие структуры могут включать одноцепочечные RNAi-олигонуклеотиды, но не ограничиваться таковыми. Недавние исследования продемонстрировали активность одноцепочечных РНКi-олигонуклеотидов (см., например, Matsui et al. (May 2016), Molecular Therapy, Vol. 24 (5), 946-955). Однако в некоторых вариантах осуществления, представленные здесь олигонуклеотиды являются антисмысловыми олигонуклеотидами (ASO). Антисмысловой олигонуклеотид представляет собой одноцепочечный олигонуклеотид, имеющий такую последовательность нуклеиновых оснований, которая при написании в направлении от 5' до 3' содержит обратный комплемент целевого сегмента конкретной нуклеиновой кислоты и соответствующим образом модифицируется (например, в качестве гэпмера) для индукции опосредованного РНКазой Н расщепления РНК-мишени в клетках или модифицируется (например, в качестве миксмера) для ингибирования трансляции мРНК-мишени в клетках. Антисмысловые олигонуклеотиды для использования в настоящем описании могут быть модифицированы любым подходящим способом, известным в данной области техники, включая, например, как описано в патенте США № 9567587, который включен сюда посредством ссылки в области раскрытия, касающегося модификаций антисмысловых олигонуклеотидов (включая, например, длину, сахарные фрагменты нуклеиновых оснований (пиримидин, пурин) и модификаций гетероциклической части нуклотидных оснований). Кроме того, известно, что антисмысловые молекулы использовались в течение десятилетий для снижения экспрессии специфических генов-мишеней (см., например, Bennett et al., Pharmacology of Antisense Drugs, Annual Review of Pharmacology and Toxicology, Vol. 57: 81-105).
iv. Модификации олигонуклеотидов
[000115] Олигонуклеотиды могут быть модифицированы различными способами для улучшения или контроля специфичности, стабильности, доставки, биодоступности, устойчивости к деградации нуклеазой, иммуногенности, спаривания оснований, распределения РНК и клеточного поглощения и других свойств, имеющих значение для терапевтического или научно-исследовательского применения. См., например, Bramsen et al., Nucleic Acids Res., 2009, 37, 2867-2881; Bramsen and Kjems (Frontiers in Genetics, 3 (2012): 1-22). Соответственно, в некоторых вариантах осуществления олигонуклеотиды по настоящему изобретению могут включать одну или несколько подходящих модификаций. В некоторых вариантах осуществления модифицированный нуклеотид несет модификацию по своему основанию (нуклеотидному основанию), сахару (например, рибозе, дезоксирибозе) или по фосфатной группе.
[000116] Количество модификаций олигонуклеотида и позиции этих нуклеотидных модификаций могут влиять на свойства самого олигонуклеотида. Например, олигонуклеотиды могут доставляться in vivo путем конъюгирования или включения таковых в липидную наночастицу (LNP) или аналогичный носитель. Однако, если олигонуклеотид защищается с помощью LNP или подобного носителя, то может быть выгодно, чтобы, по меньшей мере, некоторые из его нуклеотидов были модифицированы. Соответственно, в некоторых вариантах осуществления любого из представленных здесь олигонуклеотидов, все или по существу все нуклеотиды олигонуклеотида являются модифицированными. В некоторых вариантах осуществления более половины нуклеотидов являются модифицированными. В некоторых вариантах осуществления менее половины нуклеотидов являются модифицированными. Как правило, при доставке «голым» способом каждый сахар модифицируется в 2'-позиции. Эти модификации могут быть обратимыми или необратимыми. В некоторых вариантах осуществления олигонуклеотид, раскрытый в настоящем изобретении, имеет то количество и такой тип модификаций нуклеотидов, которые достаточны для обеспечения желаемой характеристики (например, защиты от ферментативного расщепления, способность нацеливаться на нужную клетку после введения in vivo и/или термодинамическую стабильность).
а. Модификации сахара
[000117] В некоторых вариантах осуществления модифицированный сахар (также называемый в настоящем изобретении аналогом сахара) включает модифицированный дезоксирибозный или рибозный компонент, например, в котором одна или несколько модификаций наблюдаются в 2', 3', 4' и/или 5' позиции углерода сахара. В некоторых вариантах осуществления модифицированный сахар может также включать неприродные альтернативные углеродные структуры, такие как присутствующие в «заблокированных» нуклеиновых кислотах («LNA») (см., например, Koshkin et al. (1998), Tetrahedron 54, 3607-3630), в разблокированных нуклеиновых кислотах («UNA») (см., например, Snead et al. (2013), Molecular Therapy - Nucleic Acids, 2, e103) и в мостиковых нуклеиновые кислотах («BNA»)) (Imanishi and Obika (2002), The Royal Society of Chemistry, Chem. Commun., 1653-1659). Koshkin et al., Snead et al.). Эти публикации включены в настоящий документ посредством ссылки в отношении раскрытий, касающихся модификаций сахара.
[000118] В некоторых вариантах осуществления нуклеотидная модификация сахара включает 2'-модификацию. 2'-модификация может представлять собой 2'-аминоэтил, 2'-фторо, 2'-O-метил, 2'-O-метоксиэтил и 2'-дезокси-2'-фтор-β-d-арабинонуклеиновую кислоту. Обычно модификация представляет собой 2'-фторо, 2'-O-метил или 2'-O-метоксиэтил. В некоторых вариантах осуществления модификация сахара включает модификацию сахарного кольца, которая может включать модификацию одного или нескольких атомов углерода кольца сахара. Например, модификация сахара нуклеотида может представлять собой 2'-кислород сахара, напрямую связанный с 1'-углеродом или 4'-углеродом сахара, или 2'-кислород, связанный с 1' -углеродом или 4'-углеродом через этиленовый или метиленовый мостик. В некоторых вариантах осуществления модифицированный нуклеотид имеет ациклический сахар, в котором отсутствует связь 2'-углерод-3'-углерод. В некоторых вариантах осуществления модифицированный нуклеотид содержит тиоловую группу, например, в положении 4' сахара.
[000119] В некоторых вариантах осуществления терминальная 3'-концевая группа (например, 3'-гидроксил) представляет собой фосфатную группу или другую группу, которую можно использовать, например, для присоединения линкеров, адаптеров или меток или для прямого лигирования олигонуклеотида с другой нуклеиновой кислотой.
b. 5'-концевые фосфаты
[000120] В некоторых вариантах осуществления 5'-концевые фосфатные группы олигонуклеотидов усиливают взаимодействие с Argonaut 2. Однако олигонуклеотиды, содержащие 5'-фосфатную группу, могут быть подвержены деградации фосфатазами или другими ферментами, способными ограничивать их биодоступность in vivo. В некоторых вариантах осуществления олигонуклеотиды включают аналоги 5'-фосфатов, устойчивых к такой деградации. В некоторых вариантах осуществления фосфатный аналог может представлять собой оксиметилфосфонат, винилфосфонат или малонилфосфонат. В некоторых вариантах осуществления 5'-конец олигонуклеотидной цепи присоединен к химическому фрагменту, способному имитировать электростатические и стерические свойства естественной 5'-фосфатной группы («имитатор фосфата») (см., например, публикацию Prakash et al. (2015) ), Nucleic Acids Res., Nucleic Acids Res. 2015 Mar 31; 43 (6): 2993-3011, содержание которой описывает фосфатные аналоги, и которая включена в настоящий документ посредством ссылки). Было разработано множество имитаторов фосфатов, которые могут быть прикреплены к 5'-концу (см., например, патент США № 8 927 513, содержание описывает аналоги фосфатов, публикация включена в настоящий документ посредством ссылки). Другие модификации были разработаны для 5'-конца олигонуклеотидов (см., например, WO 2011/133871, содержание которого описывает фосфатным аналоги, публикация включена в настоящий документ посредством ссылки). В некоторых вариантах осуществления гидроксильная группа присоединена к 5'-концу олигонуклеотида.
[000121] В некоторых вариантах осуществления олигонуклеотид содержит фосфатный аналог в 4'-углеродном положении сахара (называемый «4'-фосфатный аналог»). См., например, предварительную заявку США № 62/383207, озаглавленную «4'-фосфатные аналоги и олигонуклеотиды, содержащие таковые», поданную 2 сентября 2016 г., и №62/393,401, поданную 12 сентября 2016 г., «4'-фосфатные аналоги и олигонуклеотиды, содержащие таковые», содержание каждой из которых, относящееся к фосфатным аналогам, включено в настоящий документ посредством ссылки. В некоторых вариантах осуществления олигонуклеотид, представленный в настоящем изобретении, содержит 4'-фосфатный аналог на 5'-концевом нуклеотиде. В некоторых вариантах осуществления фосфатный аналог представляет собой оксиметилфосфонат, в котором атом кислорода оксиметильной группы связан с сахарным фрагментом (например, с его 4'-углеродом) или его аналогом. В других вариантах осуществления 4'-фосфатный аналог представляет собой тиометилфосфонат или аминометилфосфонат, в котором атом серы тиометильной группы или атом азота аминометильной группы связан с 4'-углеродом сахарного фрагмента или его аналога. В некоторых вариантах осуществления 4'-фосфатный аналог представляет собой оксиметилфосфонат. В некоторых вариантах осуществления оксиметилфосфонат представлен формулой -O-CH2-PO(OH)2 или -O-CH2-PO(OR)2, в которой R независимо выбран из H, CH3, алкильной группы, CH2CH2CN, CH2OCOC(CH3)3, CH2OCH2CH2Si(CH3)3, или защитной группы. В некоторых вариантах осуществления алкильная группа представляет собой CH2CH3. В большинстве случаев R независимо выбирается из H, CH3, или CH2CH3.
[000122] В некоторых вариантах осуществления фосфатный аналог, присоединенный к олигонуклеотиду, представляет собой метоксифосфонат (MOP). В конкретных воплощениях, фосфатный аналог, присоединенный к олигонуклеотиду, представляет собой 5'-моно-метил-защищенный MOP. В некоторых вариантах осуществления может использоваться следующий уридиновый нуклеотид, содержащий фосфатный аналог, например, в первой позиции направляющей (антисмысловой) цепи:
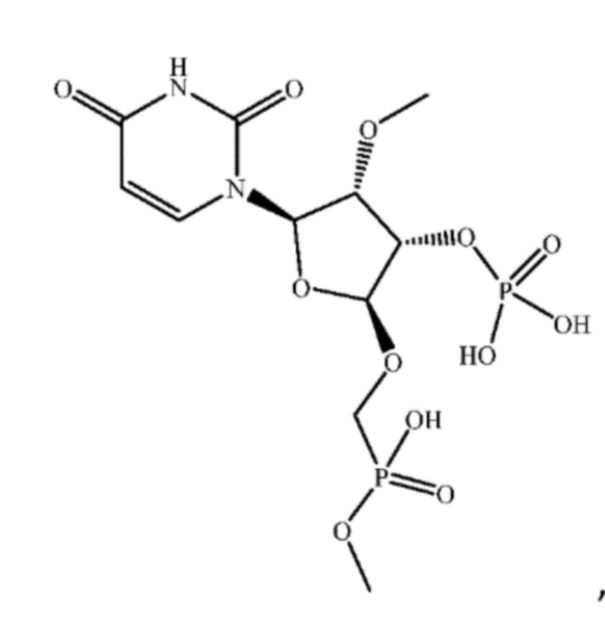
где модифицированный нуклеотид представляет собой как [MePhosphonate-4O-mU] или 5'-метокси, фосфонат-4'окси-2'-O-метилуридин.
с. Модифицированные межнуклеозидные связи
[000123] В некоторых вариантах осуществления модификации или замены фосфатов могут приводить к олигонуклеотиду, который содержит по меньшей мере одну (например, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 или, по меньшей мере 5) модифицированную межнуклеотидную связь. В некоторых вариантах осуществления любой из олигонуклеотидов, раскрытых в настоящем изобретении, может содержать от 1 до 10 (например, от 1 до 10, от 2 до 8, от 4 до 6, от 3 до 10, от 5 до 10, от 1 до 5, от 1 до 3 или от 1 до 2) модифицированных межнуклеотидных связей. В некоторых вариантах осуществления любой из олигонуклеотидов, раскрытых в настоящем изобретении, может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 модифицированных межнуклеотидных связей.
[000124] Модифицированная межнуклеотидная связь может представлять собой фосфоротиоатную связь, фосфотриэфирную связь, тионоалкилфосфонатную связь, тионоалкилфосфотриэфирную связь, фосфорамидитную связь, фосфонатную связь или боранофосфатную связь. В некоторых вариантах осуществления по меньшей мере одна модифицированная межнуклеотидная связь любого из олигонуклеотидов, описанных в настоящем изобретении, представляет собой фосфоротиоатную связь.
d. Модификации оснований
[000125] В некоторых вариантах осуществления олигонуклеотиды, представленные в настоящем изобретении, имеют одну или несколько модифицированных нуклеиновых оснований. В некоторых вариантах осуществления модифицированные нуклеиновые основания (также называемые в настоящем изобретении аналогами оснований) связаны в позиции 1' нуклеотидного сахара. В некоторых вариантах осуществления модифицированное нуклеиновое основание представляет собой азотистое основание. В некоторых вариантах осуществления модифицированная нуклеиновое основание не содержит атома азота. См., например, публикацию патентной заявки США № 20080274462. В некоторых вариантах осуществления модифицированный нуклеотид содержит универсальное основание. Кроме того, в некоторых вариантах осуществления модифицированный нуклеотид не содержит азотистого основания (является abasic).
[000126] В некоторых вариантах универсальное основание представляет собой гетероциклический фрагмент, расположенный в позиции 1' нуклеотидного фрагмента сахара в модифицированном нуклеотиде, или занимает эквивалентную позицию в замещенном фрагменте сахара нуклеотида, который, если он присутствует в дуплексе, может быть расположен напротив более чем одного типа основания без существенного изменения структуры дуплекса. В некоторых вариантах осуществления, если сравнивать со стандартной одноцепочечной нуклеиновой кислотой (например, олигонуклеотидом), полностью комплементарной целевой нуклеиновой кислоте, одноцепочечная нуклеиновая кислота, содержащая универсальное основание, образует дуплекс с целевой нуклеиновой кислотой, и при этом дуплекс имеет более низкую Tm, чем дуплекс, образованный комплементарной нуклеиновой кислотой. Однако в некоторых вариантах осуществления по сравнению со стандартной одноцепочечной нуклеиновой кислотой, в которой универсальное основание было замещено основанием для генерирования единственного мисматча, одноцепочечная нуклеиновая кислота, содержащая универсальное основание, образует дуплекс с целевой нуклеиновой кислотой, имеющий более высокую Tm, чем дуплекс, образованный нуклеиновой кислотой, содержащей мисматч-основание.
[000127] Неограничивающие примеры универсально- связывающихся нуклеотидов включают инозин, 1-β-D-рибофуранозил-5-нитроиндол и/или 1-β-D-рибофуранозил-3-нитропиррол (патент США Appl. Publ. No. 20070254362, Quay et al.; Van Aerschot et al., An acyclic 5-nitroindazole nucleoside analogue as ambiguous nucleoside. Nucleic Acids Res. 1995 Nov 11;23(21):4363-70; Loakes et al., 3-Nitropyrrole and 5-nitroindole as universal bases in primers for DNA sequencing and PCR. Nucleic Acids Res. 1995 Jul 11;23(13):2361-6; Loakes and Brown, 5-Nitroindole as an universal base analogue. Nucleic Acids Res. 1994 Oct 11;22(20):4039-43. Каждая из вышеупомянутых публикаций включена в настоящий документ посредством ссылки в отношении раскрытия, относящегося к модификациям оснований).
е. Обратимые модификации
[000128] Хотя определенные модификации могут быть сделаны с целью защиты олигонуклеотида от воздействий in vivo для обеспечения доставки в клетки-мишени, они могут снижать эффективность или активность олигонуклеотида после того, как он войдет в цитозоль клетки-мишени. Обратимые модификации могут быть сделаны таким образом, что молекула сохраняет желательные свойства вне клетки, но эти модификации удаляются при вхождении молекулы в цитозоль клетки. Обратимая модификация же может быть удалена, например, под действием внутриклеточного фермента или при соответствующих химических условий внутри клетки (например, путем восстановления внутриклеточным глутатионом).
[000129] В некоторых вариантах осуществления обратимо модифицированный нуклеотид содержит группу, чувствительную к глютатиону. Как правило, молекулы нуклеиновой кислоты химически модифицированы с помощью циклических дисульфидных фрагментов для маскировки отрицательного заряда, создаваемого межнуклеотидными дифосфатными связями, для улучшения клеточного поглощения и повышения устойчивости к нуклеазе. См. публикацию заявки на патент США № 2011/0294869, первоначально поданную Traversa Therapeutics, Inc. («Traversa»), публикацию PCT № WO 2015/188197 Solstice Biologics, Ltd. («Solstice»), Meade et al., Nature Biotechnology, 2014,32:1256-1263 («Meade»), публикацию PCT № WO 2014/088920 Merck Sharp & Dohme Corp, каждая из которых включена в настоящее описание посредством ссылки в области раскрытия таких модификаций. Такая обратимая модификация межнуклеотидных дифосфатных связей предназначена для внутриклеточного расщепления восстанавительной средой цитозоля (например, глутатионом). Известные ранее примеры включают нейтрализаию фосфотриэфирных модификаций, которые, как сообщалось, расщепляются внутри клеток (Dellinger et al. J. Am. Chem. Soc. 2003, 125: 940-950).
[000130] В некоторых вариантах осуществления такая обратимая модификация обеспечивает защиту во время введения in vivo (например, при прохождении сквозь кровь и/или лизосомальные/эндосомные компартменты клетки), где олигонуклеотид подвержен воздействию нуклеаз и других неблагоприятных условий окружающей среды (например, рН). При высвобождении в цитозоль клетки, имеющей более высокий уровень глутатиона по сравнению с внеклеточным пространством, модификация убирается (подвергается воздействию), в результате чего получается расщепленный олигонуклеотид. Применяя обратимые модификации с использованием чувствительных к глутатиону фрагментов, можно вводить стерически более громоздкие химические группы в представляющий интерес олигонуклеотид по сравнению с теми, которые можно вводить с использованием необратимых химических модификаций. Это возможно потому, что эти большие химические группы будут удалены в цитозоле и, следовательно, не будут мешать биологической активности олигонуклеотидов внутри цитозоля клетки. В результате эти более крупные химические группы могут быть сконструированы так, чтобы придать нуклеотиду или олигонуклеотиду различные преимущества, такие как устойчивость к нуклеазам, липофильность, заряд, термическую стабильность, специфичность и пониженную иммуногенность. В некоторых вариантах осуществления структура чувствительного к глутатиону фрагмента может быть сконструирована для изменения кинетики его высвобождения.
[000131] В некоторых вариантах осуществления чувствительный к глутатиону фрагмент присоединен к сахару нуклеотида. В некоторых вариантах осуществления чувствительный к глутатиону фрагмент присоединен к 2'-углероду сахара модифицированного нуклеотида. В некоторых вариантах осуществления чувствительный к глутатиону фрагмент находится на 5'-углероде сахара, особенно тогда, когда модифицированный нуклеотид является 5'-концевым нуклеотидом олигонуклеотида. В некоторых вариантах осуществления чувствительный к глутатиону фрагмент находится на 3'-углероде сахара, особенно тогда, когда модифицированный нуклеотид является 3'-концевым нуклеотидом олигонуклеотида. В некоторых вариантах осуществления чувствительный к глутатиону фрагмент содержит сульфонильную группу. См., например, предварительную заявку патента США № 62/378 635 «Compositions Comprising Reversibly Modified Oligonucleotides and Uses Thereof», поданную 23 августа 2016 года, содержание которой включено в настоящий документ посредством ссылки в области соответствующего раскрытия.
V. Лиганды нацеливания
[000132] В некоторых вариантах осуществления желательно нацелить олигонуклеотиды, раскрытые в изобретении на одну или несколько клеток или один или более органов. Такая стратегия может помочь избежать нежелательных эффектов в других органах или предотвратить чрезмерную потерю олигонуклеотида в тех клетках, тканях или органах, где олигонуклеотид не принесет пользы. Соответственно, в некоторых вариантах осуществления раскрытые здесь олигонуклеотиды могут быть модифицированы с целью улучшения нацеливания на конкретную ткань, клетку или орган, например, для облегчения доставки олигонуклеотида в печень. В некоторых вариантах осуществления олигонуклеотиды, раскрытые в настоящем изобретении, могут быть модифицированы для облегчения доставки олигонуклеотида в гепатоциты печени. В некоторых вариантах осуществления олигонуклеотид содержит нуклеотид, конъюгированный с одним или несколькими нацеливающими лигандами.
[000133] Нацеливающий лиганд может содержать углевод, аминосахар, холестерин, пептид, полипептид, белок или часть белка (например, антитело или фрагмент антитела) или липид. В некоторых вариантах осуществления нацеливающий лиганд представляет собой аптамер. Например, нацеливающий лиганд может представлять собой пептид RGD, применяющийся для нацеливания на сосудистую сеть опухоли или клетки глиомы, пептид CREKA для нацеливания на сосудистую сеть или стому опухоли, трансферрин, лактоферрин или аптамер для нацеливания на рецепторы трансферрина, экспрессируемые на сосудистой сети ЦНС, или анти-EGFR антитело для нацеливания на EGFR клеток глиомы. В некоторых вариантах осуществления нацеливающий лиганд представляет собой один или более фрагментов GalNAc.
[000134] В некоторых вариантах осуществления присутствуют 1 или более (например, 1, 2, 3, 4, 5 или 6) нуклеотидов олигонуклеотида, где каждый конъюгируют с отдельным нацеливающим лигандом. В некоторых вариантах осуществления присутствует от 2 до 4 нуклеотидов олигонуклеотида, где каждый конъюгирован с отдельным нацеливающим лигандом. В некоторых вариантах осуществления нацеливающие лиганды конъюгированы с 2-4 нуклеотидами на любом конце смысловой или антисмысловой цепи (например, лиганды конъюгированы с 2-4 нуклеотидами выступа или удлинения на 5' или 3' конце смысловой или антисмысловой последовательности цепи) так, что нацеливающие лиганды похожи на щетину зубной щетки, а олигонуклеотид выглядит как зубная щетка. Например, олигонуклеотид может содержать петлю ствола на 5 'или 3' конце смысловой цепи, и 1, 2, 3 или 4 нуклеотида петли ствола могут быть индивидуально конъюгированы с нацеливающими лигандами.
[000135] В некоторых вариантах осуществления желательно нацелить олигонуклеотид, снижающий экспрессию антигена HBV в гепатоцитах печени субъекта на гепатоциты. Для этой цели может быть использован любой подходящий фрагмент, нацеленный на гепатоциты.
[000136] GalNAc является лигандом с высоким сродством к рецептору асиалогликопротеина (ASGPR), который в основном экспрессируется на синусоидальной поверхности клеток гепатоцитов и играет главную роль в связывании, интернализации и последующем клиренсе циркулирующих гликопротеинов, содержащих терминальную галактозу или N-остатки ацетилгалактозамина (асиалогликопротеины). Конъюгирование (как косвенное, так и прямое) фрагментов GalNAc с олигонуклеотидами по настоящему изобретению может быть использовано для нацеливания таких олигонуклеотидов на ASGPR, экспрессируемые на поверхности клеток гепатоцитов.
[000137] В некоторых вариантах осуществления олигонуклеотид по настоящему изобретению конъюгирован прямо или косвенно с моновалентным GalNAc. В некоторых вариантах осуществления олигонуклеотид прямо или косвенно конъюгирован с более чем одним моновалентным GalNAc (т.е. конъюгирован с 2, 3 или 4 моновалентными фрагментами GalNAc и обычно конъюгирован с 3 или 4 моновалентными фрагментами GalNAc). В некоторых вариантах осуществления олигонуклеотид по настоящему изобретению конъюгирован с одним или несколькими двухвалентными фрагментами GalNAc, трехвалентными GalNAc или четырехвалентными GalNAc.
[000138] В некоторых вариантах осуществления 1 или более (например, 1, 2, 3, 4, 5 или 6) нуклеотидов олигонуклеотида каждый конъюгирован с фрагментом GalNAc. В некоторых вариантах осуществления присутствует от 2 до 4 нуклеотидов петли (L) петли ствола, где каждый нуклеотид конъюгирован с отдельным GalNAc. В некоторых вариантах осуществления нацеливающие лиганды конъюгированы с 2-4 нуклеотидами на обоих концах смысловой или антисмысловой цепи (например, лиганды конъюгированы с 2-4х нуклеотидным выступом или удлинением на 5' или 3' конце смысловой или антисмысловой последовательности цепи) так, что фрагменты GalNAc напоминают щетинки зубной щетки, а сам олигонуклеотид напоминает зубную щетку. Например, олигонуклеотид может содержать петлю ствола на 5' или 3' конце смысловой цепи, и 1, 2, 3 или 4 нуклеотида петли ствола могут быть индивидуально конъюгированы с фрагментами GalNAc. В некоторых вариантах осуществления фрагменты GalNAc конъюгированы с нуклеотидом смысловой цепи. Например, четыре фрагмента GalNAc могут быть конъюгированы с нуклеотидами в тетра-петле смысловой цепи, где каждый фрагмент GalNAc конъюгирован с одним нуклеотидом.
[000139] В некоторых вариантах осуществления олигонуклеотид, раскрытый в настоящем изобретении, содержит моновалентный GalNac, присоединенный к нуклеотиду гуанидина, и называется [ademG-GalNAc] или 2'-аминодиэтоксиметанол-гуанидин-GalNAc, как изображено ниже:
[000140] В некоторых вариантах осуществления олигонуклеотид в настоящем изобретении содержит моновалентный GalNac, присоединенный к адениновому нуклеотиду, и называется [ademA-GalNAc] или 2'-аминодиэтоксиметанол-аденин-GalNAc, как изображено ниже.
[000141] Пример такого конъюгирования показан ниже для петли, содержащей в направлении от 5' до 3' нуклеотидную последовательности GAAA (L=линкер, X=гетероатом), где показаны точки присоединения ствола. Такая петля может присутствовать, например, в положениях 27-30 молекулы, показанной на ФИГ. 1А. В химической формуле обозначение  является точкой присоединения к цепи олигонуклеотида.
является точкой присоединения к цепи олигонуклеотида.
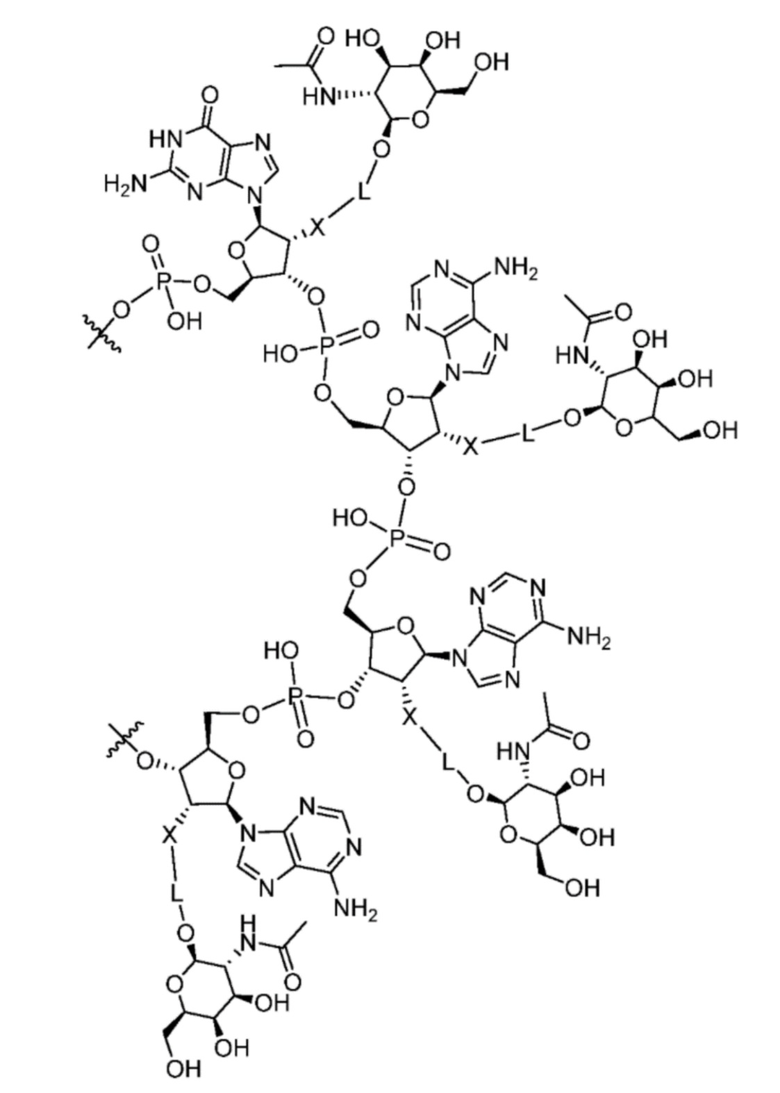
[000142] Подходящие способы или химические методы (например, методы клик-химии) можно использовать для связывания нацеливающего лиганда с нуклеотидом. В некоторых вариантах осуществления нацеливающий лиганд конъюгируют с нуклеотидом с использованием клик-линкера (защелки). В некоторых вариантах осуществления линкер на основе ацеталя используют для конъюгирования нацеливающего лиганда с нуклеотидом любого из олигонуклеотидов, описанных в настоящем изобретении. Линкеры на основе ацетала раскрыты, например, в публикации международной патентной заявки WO 2016100401 A1, опубликованной 23 июня 2016 года, содержание которой, касающееся таких линкеров, включено в настоящий документ посредством ссылки. В некоторых вариантах осуществления линкер представляет собой лабильный линкер. Однако в других вариантах осуществления линкер является довольно стабильным.
[000143] Пример показан ниже для петли, содержащей нуклеотиды GAAA, в направлении от 5' до 3', где фрагменты GalNac присоединены к нуклеотидам петли с использованием ацетального линкера. Такая петля может присутствовать, например, в положениях 27-30 молекулы, показанной на ФИГ. 10. В химической формуле обозначение  является точкой присоединения к цепи олигонуклеотида.
является точкой присоединения к цепи олигонуклеотида.

III. Рецептуры
[000144] Для простоты использования олигонуклеотидов были разработаны различные составы. Например, олигонуклеотиды могут быть доставлены субъекту или в клеточную среду с использованием состава, минимизируещего деградацию, облегчающего доставку и/или поглощение или обеспечивающего другое полезное свойство олигонуклеотида в композиции. В некоторых вариантах осуществления в настоящем изобретении представлены композиции, содержащие олигонуклеотиды (например, одноцепочечные или двухцепочечные олигонуклеотиды) для снижения экспрессии антигена HBV (например, HBsAg). Такие композиции могут быть подходящим образом составлены так, что при введении субъекту, либо в непосредственное окружение клетки-мишени, либо системно, количество олигонуклеотида, достаточное для снижения экспрессии антигена HBV, поступило в клетку. Любой из множества подходящих олигонуклеотидных составов, как описано здесь, может быть использован для доставки олигонуклеотидов, уменьшающих экспрессию антигена HBV. В некоторых вариантах осуществления олигонуклеотид включается в буферные растворы, такие как забуференные фосфатом солевые растворы, липосомы, мицеллярные структуры и капсиды.
[000145] Для облегчения трансфекции олигонуклеотидов в клетки могут использоваться составы олигонуклеотидов с катионными липидами. Например, могут быть использованы катионные липиды, такие как липофектин, катионные производные глицерина и поликатионные молекулы (например, полилизин). Подходящие липиды включают олигофектамин, липофектамин (Life Technologies), NC388 (Ribozyme Pharmaceuticals, Inc., Boulder, Colo.) и FuGene 6 (Roche), каждый из которых можно использовать в соответствии с инструкциями производителя.
[000146] Соответственно, в некоторых вариантах композиция содержит липидную наночастицу. В некоторых вариантах осуществления эксципиент содержит липосомы, липиды, липидный комплекс, микросферы, микрочастицы, наносферы или наночастицы или может быть составлен иным образом для введения в клетки, ткани, органы или организм субъекта, в этом нуждающегося (см., например, Remington: The Science and Practice of Pharmacy, 22nd edition, Pharmaceutical Press, 2013).
[000147] В некоторых вариантах осуществления составы, раскрытые в настоящем изобретении, содержат наполнитель. В некоторых вариантах осуществления наполнитель придает композиции улучшенную стабильность, улучшенную абсорбцию, улучшенную растворимость и/или улучшает терапевтические свойства активного ингредиента. В некоторых вариантах осуществления эксципиент представляет собой буферный агент (например, цитрат натрия, фосфат натрия, трис-основание или гидроксид натрия) или носитель (например, буферный раствор, вазелин, диметилсульфоксид или минеральное масло). В некоторых вариантах осуществления олигонуклеотид лиофилизируют для продления срока его хранения, а затем переводят в раствор перед использованием (например, введением субъекту). Соответственно, эксципиент в композиции, содержащей любой из олигонуклеотидов, описанных здесь, может быть лиопротектором (например, маннитом, лактозой, полиэтиленгликолем или поливинилпирролидоном) или модификатором температуры свертывания (например, декстраном, фиколлом или желатином).
[000148] В некоторых вариантах осуществления фармацевтическая композиция составлена таким образом, чтобы она была совместимой с предполагаемым путем введения. Примеры способов введения включают парентеральное, например, внутривенное, внутрикожное, подкожное, пероральное (например, ингаляционное), трансдермальное (местное), трансмукозальное и ректальное введение.
[000149] Фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (если композиции растворимы в воде) или дисперсии и стерильные порошки для быстрого приготовления стерильных инъекционных растворов или дисперсий. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, Cremophor EL.TM. (BASF, Parsippany, N.J.) или физиологический раствор на фосфатном буфере (PBS). Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное) и подходящие смеси таковых. Во многих случаях предпочтительнее включать в композицию изотонические агенты, например сахара, полиспирты, такие как маннит, сорбит и хлорид натрия. Стерильные растворы для инъекций могут быть приготовлены путем включения олигонуклеотидов в необходимом количестве в выбранном растворителе с одним ингредиентом или комбинацией таковых, перечисленных выше, по мере необходимости, с последующей стерилизацией фильтрацией.
[000150] В некоторых вариантах осуществления композиция может содержать, по меньшей мере, примерно 0,1% терапевтического агента (например, олигонуклеотида для снижения экспрессии антигена HBV) или более, хотя процентное содержание активного ингредиента(ов) может находиться в диапазоне от примерно 1% до примерно 80% или более от массы или объема всей композиции. Такие факторы, как растворимость, биодоступность, биологический период полураспада, способ введения, срок годности продукта, а также другие фармакологические характеристики должны быть рассмотрены специалистом в области приготовления таких фармацевтических составов применительно к различным дозировкам и желательным схемам лечения.
[000151] Несмотря на то что ряд вариантов осуществления направлен на доставку в печень любого из олигонуклеотидов, раскрытых в настоящем изобретении, олигонуклеотиды, по предположению, могут быть нацелены на другие ткани.
IV. Методы использования
i. Уменьшение экспрессии HBsAg
[000152] В некоторых вариантах осуществления предлагаются способы доставки в клетку эффективного количества любого из олигонуклеотидов, раскрытых в настоящем изобретении, в целях снижения экспрессии HBsAg. Методы, предоставленные в настоящем изобретении, могут быть осуществлены для любого подходящего типа клеток. В некоторых вариантах осуществления клетка представляет собой любую клетку, экспрессирующую антиген HBV (например, гепатоциты, макрофаги, клетки, происходящие из моноцитов, клетки рака предстательной железы, клетки головного мозга, эндокринной ткани, костного мозга, лимфатических узлов, легких, желчного пузыря, печени, двенадцатиперстной кишки, тонкой кишки, поджелудочной железы, почек, желудочно-кишечного тракта, мочевого пузыря, жировой и мягких тканей и кожи). В некоторых вариантах осуществления клетка представляет собой первичную клетку, полученную от субъекта и прошедшую ограниченное количество пассажей (пересевов), так что клетка по существу сохраняет свои естественные фенотипические свойства. В некоторых вариантах осуществления клетка, в которую доставляется олигонуклеотид, находится ex vivo или in vitro (т.е. олигонуклеотид может быть доставлен в клетку культуры клеток или в организм, в котором находится клетка). В конкретных вариантах осуществления предоставлены способы доставки в клетку эффективного количества любого из олигонуклеотидов, раскрытых в настоящем изобретении, в целях снижения экспрессии HBsAg исключительно в гепатоцитах.
[000153] В некоторых вариантах осуществления олигонуклеотиды, раскрытые в настоящем изобретении, могут быть введены с использованием подходящих способов доставки нуклеиновой кислоты, включая инъекцию раствора, содержащего олигонуклеотиды, бомбардировку частицами, покрытыми олигонуклеотидами, обработку клетки или организма раствором, содержащим олигонуклеотиды, или электропорацию клеточных мембран в присутствии олигонуклеотидов. Могут быть использованы другие подходящие способы доставки олигонуклеотидов в клетки, такие как опосредованный липидами транспорт, химически-опосредованный транспорт и трансфекция катионными липосомами с использованием фосфата кальция, и другие.
[000154] То, что ингибирование произошло, может быть подтверждено соответствующим анализом одного или нескольких свойств клетки или субъекта или биохимическими методами для определения молекул-индикаторов экспрессии антигена HBV (например, РНК или белка). В некоторых вариантах осуществления степень, в которой олигонуклеотид, представленный в настоящем изобретении, снижает уровни экспрессии антигена HBV, оценивается путем сравнения уровней экспрессии (например, уровней мРНК или белка) антигена HBV с соответствующим контролем (например, уровнем экспрессии антигена HBV в клетке или популяции клеток, к которым не доставлялся олигонуклеотид, или к которым был доставлен отрицательный контроль). В некоторых вариантах осуществления подходящий контрольный уровень экспрессии антигена HBV может быть представлен заранее определенным уровнем или значением, для того, чтобы уровень экспрессии контроля не нужно было измерять каждый раз. Предопределенный уровень или значение могут принимать различные формы. В некоторых вариантах осуществления заданный уровень или значение может быть единственным пороговым значением, таким как среднее значение (median) или среднестатистическое (mean) значение.
[000155] В некоторых вариантах осуществления введение олигонуклеотида, как описано здесь, приводит к снижению уровня экспрессии антигена HBV (например, HBsAg) в клетке. В некоторых вариантах осуществления снижение уровня экспрессии антигена HBV может представлять собой уменьшение экспресии до 1% или ниже, 5% или ниже, 10% или ниже, 15% или ниже, 20% или ниже, 25% или ниже, 30% или ниже, 35% или ниже, 40% или ниже, 45% или ниже, 50% или ниже, 55% или ниже, 60% или ниже, 70% или ниже, 80% или ниже, или 90% или ниже по сравнению с соответствующим контрольным уровнем экспрессии антигена HBV. Подходящим контрольным уровнем может быть уровень экспрессии антигена HBV в клетке или популяции клеток, которые не обрабатывались олигонуклеотидом, как описано здесь. В некоторых вариантах осуществления эффект доставки олигонуклеотида в клетку в соответствии со способом, раскрытым в настоящем изобретении, характеризуют по прохождении определенного промежутка времени. Например, уровни антигена HBV можно анализировать в клетке, по меньшей мере, через 8 часов, 12 часов, 18 часов, 24 часа; или по крайней мере через один, два, три, четыре, пять, шесть, семь, четырнадцать, двадцать один, двадцать восемь, тридцать пять, сорок два, сорок девять, пятьдесят шесть, шестьдесят три, семьдесят, семьдесят через семь, восемьдесят четыре, девяносто один, девяносто восемь, 105, 112, 119, 126, 133, 140 или 147 дней после введения олигонуклеотида в клетку.
[000156] В некоторых вариантах осуществления снижение уровня экспрессии антигена HBV (например, HBsAg) сохраняется в течение продолжительного периода времени после введения. В некоторых вариантах осуществления обнаруживаемое снижение экспрессии HBs Ag сохраняется в течение периода от 7 до 70 дней после введения олигонуклеотида, описанного здесь. Например, в некоторых вариантах осуществления обнаруживаемое снижение сохраняется в течение периода от 10 до 70, от 10 до 60, от 10 до 50, от 10 до 40, от 10 до 30 или от 10 до 20 дней после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение сохраняется в течение периода от 20 до 70, от 20 до 60, от 20 до 50, от 20 до 40 или от 20 до 30 дней после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение сохраняется в течение периода от 30 до 70, от 30 до 60, от 30 до 50 или от 30 до 40 дней после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение экспрессии сохраняется в течение периода от 40 до 70, от 40 до 60, от 40 до 50, от 50 до 70, от 50 до 60 или от 60 до 70 дней после введения олигонуклеотида.
[000157] В некоторых вариантах осуществления обнаруживаемое снижение экспрессии HBsAg сохраняется в течение периода от 2 до 21 недель после введения олигонуклеотида, описанного здесь. Например, в некоторых вариантах осуществления обнаруживаемое снижение экспрессии сохраняется в течение периода от 2 до 20, от 4 до 20, от 6 до 20, от 8 до 20, от 10 до 20, от 12 до 20, от 14 до 20, от 16 до 20 или от 18 до 20 недель после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение экспрессии сохраняется в течение периода от 2 до 16, от 4 до 16, от 6 до 16, от 8 до 16, от 10 до 16, от 12 до 16 или от 14 до 16 недель после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение сохраняется в течение периода от 2 до 12, от 4 до 12, от 6 до 12, от 8 до 12 или от 10 до 12 недель после введения олигонуклеотида. В некоторых вариантах осуществления обнаруживаемое снижение сохраняется в течение периода от 2 до 10, от 4 до 10, от 6 до 10 или от 8 до 10 недель после введения олигонуклеотида.
[000158] В некоторых вариантах осуществления олигонуклеотид доставляется в форме трансгена, сконструированного для осуществления экспрессии олигонуклеотидов (например, их смысловых и антисмысловых цепей) в клетке. В некоторых вариантах осуществления олигонуклеотид доставляется с использованием трансгена, сконструированного для экспрессии любого олигонуклеотида, раскрытого здесь. Трансгены могут быть доставлены с использованием вирусных векторов (например, на основе аденовируса, ретровируса, вируса коровьей оспы, поксвируса, аденоассоциированного вируса или вируса простого герпеса) или невирусных векторов (например, с помощью плазмид или синтетических мРНК). В некоторых вариантах осуществления трансгены могут быть инъецированы субъекту непосредственно.
II. Методы лечения
[000159] Аспекты раскрытия относятся к способам снижения экспрессии HBsAg (например, к способам снижения экспрессии HBsAg) для лечения инфекции HBV у субъекта. В некоторых вариантах осуществления способы могут включать введение субъекту, нуждающемуся в этом, эффективного количества любого из олигонуклеотидов, раскрытых в настоящем изобретении. Настоящее раскрытие предусматривает как профилактические, так и терапевтические способы лечения субъекта, подверженного риску (или восприимчивомому к) инфекции HBV и/или заболеванию или расстройству, связанному с инфекцией HBV.
[000160] В определенных аспектах настоящее изобретение обеспечивает способ предотвращения у субъекта заболевания или расстройства, как описано в настоящем изобретении, путем введения субъекту терапевтического агента (например, олигонуклеотида или вектора, или его кодирующего трансгена). В некоторых вариантах осуществления субъектом, подлежащим лечению, является субъект, которому тереапевтически выгодно снижение количества белка HBsAg, например, в печени. Субъекты, подверженные риску заболевания или расстройства, могут быть идентифицированы, например, с помощью определенного анализа или комбинации диагностических или прогностических анализов, известных в данной области техники (например, идентификация цирроза печени и/или воспаления печени). Введение профилактического средства может происходить до обнаружения или проявления симптомов, характерных для заболевания или расстройства, с целью предотвращения заболевания или расстройства или, наоборот, с целью задержки прогрессирования таковых.
[000161] Способы, описанные в настоящем изобретении, обычно включают введение субъекту эффективного количества олигонуклеотида, то есть количества, способного обеспечить желаемый терапевтический результат. Терапевтически приемлемое количество может представлять собой количество, которое способно излечивать заболевание или расстройство. Подходящая дозировка для любого отдельного субъекта будет зависеть от определенных факторов, включая рост и пропорции субъекта, площадь поверхности тела, возраст, определенную композицию вводимого препарата, активный ингредиент(ы) в композиции, время и способ введения, общее состояние здоровья пациента, и учет других препаратов, вводимых одновременно. Например, дозировка может лежать в диапазоне от 0,1 до 12 мг/кг. Дозировка также может лежать в диапазоне от 0,5 до 10 мг/кг. Альтернативно, дозировка может лежать в диапазоне от 1,0 до 6,0 мг/кг. Дозировка также может лежать в диапазоне от 3,0 до 5,0 мг/кг.
[000162] В некоторых вариантах осуществления субъекту можно вводить любую из композиций, раскрытых в настоящем изобретении, энтерально (например, перорально, через желудочную трубку для кормления, через дуоденальную трубку для кормления, через гастростому или ректально), парентерально (например, подкожной инъекцией, внутривенной инъекцией или инфузией, внутриартериальной инъекцией или инфузией, внутрикостной инфузией, внутримышечной инъекцией, интрацеребральной инъекцией, интрацеребровентрикулярной инъекцией, интратекальной терапией), местно (например, надкожно, ингаляционно, посредством глазных капель или через слизистую оболочку) или путем прямой инъекции в орган-мишень (например, печень субъекта). Как правило, раскрытые здесь олигонуклеотиды вводят внутривенно или подкожно.
[000163] В качестве неограничивающего набора примеров, олигонуклеотиды по настоящему изобретению обычно вводят ежеквартально (один раз каждые три месяца), через два месяца (один раз каждые два месяца), ежемесячно или еженедельно. Например, олигонуклеотиды можно вводить через одну, две или три недели. Олигонуклеотиды могут быть введены ежедневно.
[000164] В некоторых вариантах субъектом, подлежащим лечению, является человек, примат, не являющийся человеком, или другое млекопитающее. Примеры других субъектов включают домашних животных, таких как собаки и кошки; домашний скот, например лошади, крупный рогатый скот, свиньи, овцы, козы и цыплята; и других животных, такие как мыши, крысы, морские свинки и хомяки.
ПРИМЕРЫ
Пример 1. Разработка эффективных олигонуклеотидных ингибиторов экспрессии HBsAg
[000165] Поверхностный антиген HBV был идентифицирован в качестве мишени для терапии на основе RNAi для лечения инфекции HBV. Как показано на диаграмме организации генома HBV, показанной на ФИГ. 1, HBsAg кодируется тремя молекулами РНК, транскрибирующимися с одной ORF. Были сконструированы олигонуклеотиды для обеспечения сайленсинга одного или нескольких РНК-транскриптов, на основе которых синтезируется группа белков HBsAg (пример сайта-мишени РНКi, обозначенного "X" на ФИГ. 1). Нацеленный на HBsAg олигонуклеотид, HBV-254, был сконструирован, его применимость оценивалась in vitro и in vivo. HBV-254 был выбран и сконструирован со способностью непосредственно нацеливаться на транскрипты мРНК для четырех видов РНК HBV. Дуплексный олигонуклеотид HBV-254, использованный в экспериментах, включал смысловую цепь последовательности, такую как (показано с 5 'по 3'): GUGGUGGACUUCUCUCAAUAGCAGCCGAAAGGCUGC (SEQ ID NO: 21); и антисмысловую цепь последовательности, такую как (показано 5 '- 3'): UAUUGAGAGAAGUCCACCACGG (SEQ ID NO: 22).
[000166] Была проведена оценка однократной дозы олигонуклеотида HBV-254 на мышах HDI, демонстрирующая способность полинуклеотида, вводимого подкожно, нацеливаться на вирусный транскрипт HBsAg (ФИГ. 2). Как показано, HBV-254 систематически снижал уровни HBsAg у мышей с увеличением дозы. Активность, показанную в доклинических исследованиях, дополнительно оценивали у мышей при режиме дозирования QW × 3, в котором HBV-254 вводили подкожно в дозе 3 мг/кг (ФИГ. 3). Время введения указано стрелками на диаграмме. Уровни HBsAg контролировали как у мышей, получавших олигонуклеотид, так и у необработанных контрольных мышей в течение периода, охватывающего 147 дней. Пониженные уровни HBs Ag сохранялись у обработанных мышей на протяжении всего исследования, причем уровни экспрессии (относительно контроля), по-видимому, стабилизировались на линии сниженной экспрессии примерно через два месяца после первого введения.
[000167] Дополнительные высокоэффективные HBsAg-нацеленные олигонуклеотиды были идентифицированы путем скрининга in vitro с использованием репортерного анализа psiCHECK с олигонуклеотидами с немодифицированной формой тетрапетли. Результаты трех разных планшетов показаны на ФИГ. 4. Каждый олигонуклеотид, включая HBV-254, оценивали в трех концентрациях (1, 10 и 100 пМ) в клетках HeLa при помощи флуоресцентного репортерного анализа. Результаты, представленные для каждого планшета, дополнительно показаны в сравнении с положительным контролем (8, 40 и 200 пМ), отрицательным контролем (1 нМ) и контролем имитированной (mock) трансфекции. Олигонуклеотиды, показанные выделенными прямоугольниками, были выбраны для тестирования in vivo, в результате которого было обнаружено, что HBV-219 и HBV-258 являются наиболее сильнодействующими олигонуклеотидами по сравнению с HBV-254 и другими, выявленными при скрининге. HBV-219 продемонстрировал многократное улучшение эффективности по сравнению с HBV-254 и был выбран для дополнительного тестирования и оценки.
Пример 2. Анализ степени консервации последовательностей и создание мисматчей для увеличения общей терапевтической эффективности
[000168] Некоторые из наиболее высокоэффективных олигонуклеотидов, охарактеризованных в Примере 1, сравнивали с последовательностями генома различных генотипов A-I HBV. Результаты первоначального консервационного анализа приведены в Таблице 1. Как показано, HBV-219 имеет относительно низкий процент консервации (соответствия) по всем этим геномам. Тем не менее, процент консервации значительно возрастает (с 66% до 96%), если мисматч (MM) вводится в позиции 15 направляющей цепи. Данные генотипированной последовательности вируса гепатита B (HBV) из общедоступной базы данных GenBank, включенной в настоящий документ в качестве ссылки, использовались для выбора и выравнивания последовательностей методами биоинформатики.
Таблица 1. Первоначальный анализ консервации основных последовательностей HBV
[000169] Был сделан последующий консервационный анализ, с фокусом на нескольких олигонуклеотидах из Таблицы 1 и включающий более широкие параметры поиска. Например, в то время как первоначальный анализ включал только последовательности генома полной длины, сфокусированный анализ включал последовательности полной длины и частичной длины (>80% идентичности с сайтом-мишенью). Кроме того, количество исследованных геномов увеличилось с 5628 в первоначальном анализе до более чем 17000 геномов в сфокусированном анализе. Результаты сфокусированного анализа в целом выявили те же самые тенденции, которые наблюдались в первоначальном анализе (Таблица 2). Как показано- (и дополнительно проиллюстрировано на ФИГ. 5) - HBV-219, как и было предсказано, неактивен в отношении генотипов HBV B, E, F, H и I, если не введен мисматч в положении 15 направляющей цепи.
Таблица 2. Сфокусированный консервационный анализ
(сфокусированный анализ)
(начальный анализ)
[000170] Репортерную систему psiCHECK-2 с двумя генами люциферазы использовали для оценки эффекта мисматчей, введенных в определенном положении в каждом из HBV-217, HBV-219, HBV-254, HBV-255 и HBV-258. Вектор psiCHECK позволяет отслеживать изменения в экспрессии целевого гена, слитого с репортерным геном, в котором активные РНКi разрушают слитую конструкцию, вызывая соответствующее уменьшение сигнала репортера. Диаграмма на ФИГ. 6 в целом показывает вектор, используемый в этих анализах. Родительский фрагмент репортерной последовательности содержал фрагмент из 120 пар оснований генотипа A (GenBank: AM282986.1) охватывающий целевые сайты, представляющих интерес в S ORF. Дуплексные последовательности родительских олигонуклеотидов имеющие 100% гомологию с репортерной плазмидой в соответствующих сайтах, показаны на ФИГ. 6, тогда как олигонуклеотидные дуплексные последовательности с мисматчами несут один мисматч с репортерной плазмидой. Родительские последовательности и последовательности с мисматчами протестированных олигонуклеотидов показанные на ФИГ. 7, выровнены по соответствующим родительским фрагментам репортерных последовательностей.
[000171] В примерах анализа мисматчей тестируемые олигонуклеотиды имеют одинаковые паттерны модификации. Согласно схеме нумерации, показанной для каждого олигонуклеотида на ФИГ. 7, модификации были следующими: 5'-метокси, фосфонат-4'-окси-2'-O-метилуридин в позиции 1; 2'-фтор-модифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19; 2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22; и фосфоротиоатные межнуклеотидные связи между нуклеотидами в положениях 1 и 2, 2 и 3, 3 и 4, 20 и 21, и 21 и 22. Позиции мисматчей различались в каждой выборке родительской и мисматч- последовательностей, и показаны в прямоугольниках на ФИГ. 7.
[000172] Репортерные анализы psiCHECK2 для каждого олигонуклеотида проводили в течение трехдневного периода с использованием 6-точечного 5-кратного серийного разведения, начиная с 1 нМ, с трансфекцией в клетки HeLa. В 1-й день 10000 клеток HeLa/на лунку (96-луночного планшета) высевали в лунку с прозрачным дном и черными стенками (клетки 80-90% конфлюэнтности). На 2-й день векторную ДНК и молекулы РНКi разводили в соответствующем количестве среды Opti-MEM® I без сыворотки и осторожно перемешивали. После осторожного перемешивания Lipofectamine® 2000 0,2 мкл разводили в 25 мкл среды Opti-MEM® I без сыворотки для каждой реакции. Данное разведение осторожно перемешивали и инкубировали в течение 5 минут при комнатной температуре. После 5-минутной инкубации равные объемы разведений молекул ДНК и РНКi объединяли с разбавленным Lipofectamine® 2000. Объединенную смесь осторожно перемешивали и инкубировали в течение 20 минут при комнатной температуре с целью образования комплекса. После этого комплексы ДНК-РНКi-молекула Липофектамин® 2000 добавляли в каждую лунку, содержащую клетки и среду, и осторожно перемешивали, покачивая планшет вперед-назад. Затем клетки инкубировали при 37°C в CO2-инкубаторе до тех пор, пока клетки не были готовы к сбору и анализу целевого гена. В день 3 в каждую лунку добавляли 100 мкл реагента Dual-Glo, перемешивали и инкубировали в течение 10 минут перед измерением люминесценции. В каждую лунку добавляли еще 100 мкл Dual-Glo Stop&Glo, перемешивали и инкубировали в течение 10 минут перед измерением люминесценции. Кривые доза-ответ были построены для каждого родительского генотипа и олигонуклеотидов с мисматчами, чтобы оценить влияние мисматчей на активность. Значения EC50, определенные для каждого олигонуклеотида, показаны в Таблице 3 с дополнительными характеристиками.
Таблица 3. Оценка эффективности мисматчей HBsAg-нацеленных олигонуклеотидов
[000173] Как показывают относительные значения EC50s, кривые доза-ответ in vitro для дуплексов HBV-219 не обнаруживают потери активности при единственном мисматче в позиции 15 направляющей цепи. Последующий анализ in vivo, сравнивающий родительский HBV-219 (здесь обозначенный HBV(s)-219P1) и мисматч-олигонуклеотид (здесь обозначенный HBV(s)-219P2), подтвердил, что введение мисматча не вызывает потери активности (ФИГ. 8). Как показано на графике титрования однократной дозы, изображенном на ФИГ. 9, дуплексный олигонуклеотид HBV-219, имеющий мисматч (HBV(s)-219P2) хорошо переносился in vivo в течение 70-дневного периода после введения.
[000174] ФИГ. 10 иллюстрирует пример модифицированной дуплексной структуры для HBV-219 со встроенным мисматчем (здесь обозначено как HBV(s)-219). Согласно схеме нумерации, показанной для каждого олигонуклеотида на ФИГ. 7, смысловая цепь охватывает нуклеотиды с 1 по 36, а антисмысловая цепь охватывает олигонуклеотиды с 1 по 22, причем последняя пронумерована в направлении справа налево. Дуплексная форма показана с разрывом между нуклеотидами в положении 36 в смысловой цепи и в положении 1 в антисмысловой цепи. Модификации в смысловой цепи были следующими: 2'-фтормодифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17; 2'-O-метил-модифицированные нуклеотиды в положениях 1, 2, 4-7, 11, 14-16, 18-26 и 31-36; фосфоротиоатная межнуклеотидная связь между нуклеотидами в положениях 1 и 2; 2'-ОН-нуклеотиды в положениях 27-30; 2'-аминодиэтоксиметанол-гуанидин-GalNAc в позиции 27; и 2'-аминодиэтоксиметанол-аденин-GalNAc в каждой из позиций 28, 29 и 30. Модификации в антисмысловой цепи были следующими: 5'-метокси, фосфонат-4'-окси-2'-O-метилуридинфосфоротиоат в позиции 1; 2'-фтор-модифицированные нуклеотиды в полозициях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19; 2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22; и фосфоротиоатные межнуклеотидные связи между нуклеотидами в положениях 1 и 2, 2 и 3, 3 и 4, 20 и 21, и 21 и 22. Антисмысловая цепь включала мисматч в позиции 15. Также, как показано, антисмысловая цепь дуплекса имеет включенный «GG» выступ в положениях 21-22.
[000175] Подробная информация о HBV (s) -219 и двух предшественниках, упомянутых выше (HBV (s) -219P1 и HBV (s) -219P2), показана в таблице 4.
Таблица 4. HBV(s)-219 и предшественники
(смысловая/антисмысловая)
Пример 3. Противовирусная активность предшественников HBV(s)-219.
[000176] Оценивали влияние обработки предшественниками HBV(s)-219 на внутриклеточную локализацию основного антигена (основного белка ядра) HBV (HBcAg). Мышей NODscid подвергали гидродинамической инъекции (HDI) димера «хвост-голова» генома HBV. Лечение олигонуклеотидом было начато через 2 недели после инъекции HDI. Иммуногистохимическое окрашивание гепатоцитов, выделенных из мышей после обработки, показало резкое снижение экспрессии основного антигена (основного белка ядра) HBV (HBcAg).
[000177] РНК-секвенирование проводили для изучения влияния нокдауна HBsAg на общую экспрессию вирусных транскриптов HBV. Гепатоциты были выделены от мышей, подвергшихся HDI, через четыре дня после введения трех доз, вводимых один раз в неделю, 3 мг/кг каждая. Общая РНК была выделена из гепатоцитов и отсеквенирована с использованием платформы Illumina HiSeq. ФИГ. 11В показаны результаты секвенирования РНК, где обнаруженные последовательности транскриптов РНК были сопоставлены с РНК HBV. Также показаны сайты-мишени HBV(s)-219 и его предшественников, для демонстрации того, что олигонуклеотид нацелен на транскрипты pgRNA (3.5kb), S1 (2.4kb) и S2 (2.1kb). Результаты показывают, что по сравнению с контролями, обработка HBV(s)-219P1 приводит к более чем 90% сайленсингу (ингибированию) всех транскриптов вируса HBV.
[000178] Длительные эффекты введения олигонуклеотида HBV(s)-219P1 исследовали на двух разных мышиных моделях HBV - модели HDI, зависящей от cccDNA, и модели AAV, не зависящей от cccDNA. Временной (на протяжении 12 недель) анализ экспрессии мРНК HBsAg проводился в контексте лечения, включающего три однократные дозы 3 мг/кг раз в неделю олигонуклеотида HBV(s)-219P1, нацеленного на мРНК HBsAg, где использовались контроли с введением носителя и введением олигонуклеотида RNAi, нацеленного на мРНК HBxAg в HDI-модели HBV (ФИГ. 12A). Олигонуклеотид HBV(s)-219P1 вызывал снижение ≥3,9 log, при этом сохранял относительно большую продолжительность снижения активности более 7 недель; тогда как используемый для сравнения HBV(х)-нацеленный олигонуклеотид приводило к снижению 3,0 log, которое сохранялось в течение более короткого периода времени.
[000179] Дальнейший временной (12 недель) анализ экспрессии мРНК HBsAg проводился в контексте лечения, включающего три однократные дозы 3 мг/кг раз в неделю олигонуклеотида HBV(s)-219P2, нацеленного на мРНК HBsAg, где использовались контроли с введением носителя и введением олигонуклеотида RNAi, нацеленного на мРНК HBxAg в модели AAV-HBV (ФИГ. 12B). В этой модели олигонуклеотид HBV(s)-219P2 продуцировал сопоставимое логарифмическое снижение активности и сходную продолжительность, как и HGV(x)-нацеленный олигонуклеотид. РНКi-олигонуклеотид, нацеленный на мРНК HBxAg, и показанный на ФИГ. 12A и 12B имеет последовательность смысловой цепи UGCACUUCGCGUCACCUCUAGCAGCCGAAAGGCUGC и последовательность антисмысловой цепи UAGAGGUGACGCGAAGUGCAGG. Этот RNAi-олигонуклеотид, нацеленный на HBxAg, в настоящем изобретении обозначен как GalXC-HBVX.
[000180] Иммуногистохимическое окрашивание проводили для изучения внутриклеточного распределения HbcAg в гепатоцитах, полученных из модели AAV-HBV и модели HDI-HBV после обработки олигонуклеотидом-предшественником HBV(s)-219, как описано выше, нацеленными на мРНК HBsAg по сравнению с контролем носителя и контрольным олигонуклеотидом РНКi, нацеленным на мРНК HBxAg, как описано выше. (ФИГ. 13) Остаточный основной белок (основной белок ядра) HBcAg после обработки продемонстрировал заметные различия в субклеточной локализации между обработками двумя олигонуклеотидами RNAi в модели HDI, но не в модели AAV.
Пример 4. Оценка HBV (s)-219P1 в модели химерной печени человека PXB-HBV, генотип C
[000181] Противовирусную активность HBV(s)-219P1 оценивали в модели PXB-HBV, также известной в HBV-связанной литературе как химерная модель печени человека. Эта технология основана на пересадке гепатоцитов человека мышам с серьезным иммунодефицитом, с последующим использованием генетического механизма для поражения гепатоцитов мыши-хозяина (Tateno et al., 2015). Результатом этого процесса являются мыши с печенью, происхлдящей на > 70% из тканей человека, которые, в отличие от печени мышей дикого типа, могут быть инфицированы HBV (Li et al., 2014). Модель PXB-HBV служит нескольким целям в контексте фармакологии HBV(s)-219, она используется: (1) для подтверждения факта того, что олигонуклеотид может задействовать механизмы РНКi человека (RISC) in vivo, (2) для подтверждения того, что нацеливающая GalNAc конфигурация лиганда может поглощаться гепатоцитами с участием ASGR человека in vivo и (3) для подтверждения эффективности лечения в истинной модели инфекции HBV (в отличие от разработанной модели экспрессии HBV). Несмотря на ограничение того, что привитые человеческие гепатоциты приводят к нерегулярной химерной физиологии печени (Tateno et al., 2015), именно на этой модели можно наблюдать/тестировать значительную противовирусную эффективность.
[000182] Приблизительно через 8 недель после первоначального заражения мышей генотипом HBV, пробы плазмы каждой мыши были взяты для проведения базовых замеров HBsAg. Затем когортам по 9 мышей каждая (n=3 для PK, n=6 для PD) вводили 3 еженедельные SC инъекции 0 мг/кг (PBS) или 3 мг/кг HBV (s) -219P1. Первый день введения дозы считается днем 0. Для определения уровня HBsAg и циркулирующей ДНК HBV в сыворотке у каждой мыши еженедельно собирали пробы крови, не приводящие к смерти мыши (ФИГ. 14A-14D). Мышей подвергали эвтаназии на 28-й день для анализа образцов тканей на конечном этапе (конечная точка). Образцы печени на 28-й день анализировали на содержание внутрипеченочной HBV-ДНК и cccDNA. Значительная противовирусная активность наблюдалась во всех конечных точках, принадлежащих мышам, которых обрабатывали HBV(s)-219P1, и включала снижение HBsAg на > 80%, а также значительное снижение циркулирующей ДНК HBV, внутрипеченочной ДНК HBV и cccДНК (ФИГ. 14A-14D). Эти данные демонстрируют, что обработка HBV(s)-219 приводит к проявлению противовирусной активности в инфицированных гепатоцитах человека после системного введения.
Пример 5. HBV(s)-219P2 улучшает противовирусную активность Энтекавира
[000183] Аналоги нуклеотидов/нуклеозидов (например, Энтекавир) являются стандартом медицинской помощи, и, хотя они эффективны в отношении сокращения циркулирующей геномной ДНК HBV, они не уменьшают циркулирующий HBsAg. Хотя это приводит к контролируемой виремии во время такого лечения, все же требуется пожизненное лечение, а функциональное излечение достигается редко. Олигонуклеотиды RNAi, нацеленные на антиген S, воздействуют как на вирусную полимеразу, так и на белок HBsAg. В этом исследовании совокупный эффект противовирусной активности HBV(s)-219P2, используемого как в монотерапии, так и в лечении в комбинации с Энтекавиром был изучены на HBV-экспрессирующей мыши (модель HDI).
[000184] Мышам вводили ежедневную пероральную дозу 500 нг/кг Энтекавира (ETV) в течение 14 дней. Применялось одно подкожное введение HBV(s)-219P2. Циркулирующую вирусную нагрузку (ДНК HBV) измеряли с помощью количественной ПЦР (qPCR) (ФИГ. 15A); уровень HBsAg в плазме измеряли с помощью теста ELISA (ФИГ. 15B), а уровни мРНК и pgРНК HBV в печени измеряли с помощью количественной ПЦР(qPCR). Явные аддитивные эффекты наблюдались при комбинированной терапии с HBV(s)-219P2 и ETV. Результаты показывают, что применение только одной терапии ETV неэффективно против циркулирующего HBsAg или вирусных РНК печени. Кроме того, противовирусная активность HBV(s)-219P2, определенная на основе замеров HBsAg или РНК HBV, не изменяется при ко-дозировании с ETV (ФИГ. 15B-15C).
[000185] Как показано на ФИГ. 15A-15C, монотерапия Энтекавиром в дозе 500 нг/кг РО ежедневно в течение 14 дней привела к среднему значению ~ 1,6 log снижения HBV ДНК, обнаруживаемой в плазме, по сравнению с мышами, получавшими PBS (n=6). При этом не наблюдалось значимого снижения ни циркулирующего HBsAg, ни вирусных РНК в печени. Монотерапия однократной 1 мг/кг или 3 мг/кг SC дозой HBV (s) -219P2 в день 0 приводила к среднему значению ~ 0,8 log или ~ 1,8 log снижения ДНК HBV, обнаруживаемого в плазме, по сравнению с контролем PBS, соответственно (п=7). Монотерапия однократной 6 мг/кг SC дозой HBV(s)-219P2 в день 0 приводила к среднему значению ~2,5 log снижения HBV ДНК в плазме, а у двух мышей уровень оказался ниже предела обнаружения (n=7). Монотерапия однократной SC-дозой HBV(s)-219P2 в день 0 приводила к зависимому от дозы снижению как циркулирующего HBsAg, так и вирусных РНК в печени. Комбинированная терапия Энтекавиром при дозе 500 нг/кг РО ежедневно в течение 14 дней и однократной дозой 1 мг/кг SC HBV(s)-219P2 в день 0 привела к аддитивному снижению ДНК HBV, обнаруживаемой в плазме, в среднем ~ 2,3 log. Сходное снижение уровней HBsAg в плазме и транскриптов вируса в печени наблюдается при монотерапии однократной дозой 1 мг/кг SC HBV(s) -219P2, что указывает на аддитивность эффектов в снижении ДНК HBV в плазме, но не циркулирующего HBsAg или транскриптов вируса в печени.
Пример 6. Сравнение антивирусной активности HBV(s)-219P2 и GalXC-HBVX
[000186] В данном исследовании мышам, экспрессирующим HBV (модель HDI), вводили HBV(s)-219P2, GalXC-HBVX (та же последовательность, что и у GalXC-HBVX, показанная на ФИГ. 12A и 12B), или комбинацию обоих РНКi олигонуклеотидов и определяли уровень HBsAg в плазме через две или девять недель после введения дозы. Как показано на ФИГ. 16B, сходные уровни подавления HBsAg наблюдались через 2 недели после лечения однократной насыщающей дозой 9 мг/кг SC либо HBV (s)-219P2, либо GalXC-HBVX, либо комбинацией таковых. Длительное подавление HBsAg наблюдалось у мышей, обработанных с HBV(s)-219P2, нацеленным на S, тогда как у мышей, получавших GalXC-HBVX или комбинацию таковых, наблюдалось значительное восстановление HBsAg через 9 недель после обработки (n=3).
[000187] Субклеточную локализацию основного антигена HBV (HBcAg) у экспрессирующих HBV мышей, также оценивали у мышей, получавших HBV(s)-219P2, GalXC-HBVX или комбинацию обоих олигонуклеотидов RNAi. Мышей, экспрессирующих HBV (модель HDI), обрабатывали однократной насыщающей дозой (9 мг/кг, с.с.) либо HBV (s)-219P2, либо GalXC-HBVX, либо комбинацией таковых в соотношении 1:1. В моменты времени, указанные на ФИГ. 17А срезы печени окрашивали на HBcAg; показаны репрезентативные гепатоциты. Когорты, получавшие HBV(s)-219P2 в качестве монотерапии или в комбинации с GalXC-HBVX, показали ядерную локализацию HBcAg. Когорты, обработанные только GalXC-HBVS, показали только цитозольную локализацию HBcAg, которая рассматривается как благоприятный прогностический индикатор ответа на лечение (Huang et al. J. Cell. Mol. Med. 2018). Процент HBcAg-позитивных клеток с окрашиванием ядер для каждого животного показан на ФИГ. 17B (n=3/группа, 50 клеток в расчете на животное, через 2 недели после введения дозы). Чтобы подтвердить, что влияние на субклеточную локализацию HBcAg обусловлено областью транскриптома HBV, а не неизвестным свойством последовательности RNAi, были разработаны и протестированы альтернативные последовательности, нацеленные на открытые рамки считывания X и S (см. ФИГ. 17С). HBV-254 показан на ФИГ. 17С. Последовательность HBV-254 описана в Примере 1. Альтернативный олигонуклеотид, нацеленный на HBxAg, показанный на ФИГ. 17C имеет последовательность смысловой цепи GCACCUCUCUUUACGCGGAAGCAGCCGAAAGGCUGC и антисмысловую последовательность UUCCGCGUAAAGAGAGGUGCGG. Два альтернативных олигонуклеотида РНКi имеют различные последовательности-мишени в антигене S или X, чем олигонуклеотиды РНКi, показанные на ФИГ. 16В. Тем не менее, они демонстрируют тот же самый (схожий) эффект на уровень HBcAg в плазме, что указывает на то, что этот эффект специфичен для воздействия на антиген S как такового, но неспецифичен для используемого олигонуклеотида.
Пример 7. Оценка безопасности применения, переносимости у здоровых людей и эффективности HBV(s)-219 у пациентов с HBV.
[000188] Это исследование предназначено для оценки безопасности применения и переносимости HBV(s)-219 у здоровых субъектов (группа A) и эффективности применения HBV(s)-219 у пациентов с HBV (группа B). Информация о дозе по когорте представлена на ФИГ. 18. Молекулярная структура HBV(s)-219 показана на ФИГ. 10, ФИГ. 19А, а также проиллюстрирована на рисунке ниже (подпись к рисунку следует):
mX: 2'-O-метил рибонуклеотид
fX: 2'-фторо-дезоксирибонуклеотид
[ademA-GalNAc}: 2'-модифицированный-GalNAc -аденозин
[ademG-GalNAc}: 2'-модифицированный-GalNAc -гуанозин
[MePhoshponate-4O-mU]: 4'-O-монометилфосфонат-2'-O-метилуридин
«-» обозначает фосфодиэфирную связь
«-S-» обозначает фосфотиоатную связь
[000189] Критерии отбора пациентов показаны ниже.
[000190] Группа A - Здоровые субъекты
[000191] Критерии отбора:
[000192] 1. Возраст: 18 (или возраст совершеннолетия, в зависимости от того, что выше) до 65 лет включительно, на момент подписания информированного согласия.
[000193] 2. Явно здоров во время проведения отбора, что определяется оценкой медэксперта, включающей историю болезни, физическое обследование и лабораторные анализы
[000194] а. Отсутствие симптомов продолжающегося заболевания
[000195] б. Отсутствие клинически значимых отклонений температуры тела, частоты пульса, частоты дыхания, артериального давления
[000196] с. Отсутствие клинически значимых сердечно-сосудистых или легочных заболеваний, отсутствие сердечно-сосудистых или легочных заболеваний, требующих фармакологического вмешательства.
[000197] 3. Электрокардиограмма с 12 отведениями (ЭКГ) в нормальных пределах или без клинически значимых отклонений при скрининге и в день-1, по мнению исследователя.
[000198] 4. Отрицательный тест на алкоголь или наркотики при осмотре, при первом посещении (1) и при поступлении (день-1)
[000199] 5. Некурящие в течение по меньшей мере 5 лет, предшествующих первому посещению (1), с отрицательной концентрацией котинина в моче при первом посещении (1)
[000200] 6. Индекс массы тела (ИМТ) в диапазоне 18,0-32,0 кг/м2 (включительно).
[000201] 7. Мужчина или Женщина:
[000202] а. Участники мужского пола:
[000203] Участник мужского пола должен быть согласен использовать контрацепцию во время периода лечения и в течение, по меньшей мере, двух недель после введения исследовательской дозы, а также и воздержаться от донорства спермы в течение этого периода.
[000204] б. Участницы женского пола:
[000205] Пациенты женского пола имеет право участвовать при отсутствии беременности, кормлении грудью, и соответствовать, по меньшей мере, одно из следующих условий: не являться женщиной детородного возраста (WOCBP), или, в зависимости от региона; являться WOCBP при согласии следовать инструкциям по применению контрацепции, начиная с момента регистрации после медицинского обследования, в течение всего периода лечения и в течение не менее 12 недель после введения исследовательской дозы.
[000206] 8. Находится в позиции подписать информированное согласие 1, которое включает соблюдение требований и ограничений.
[000207] Критерии исключения, группа A
[000208] 1. Наличие в истории болезни любого медицинского состояния, которое может помешать всасыванию, распределению или элиминации исследуемого лекарственного средства, или клиническим и лабораторным оценкам в этом исследовании, включая (но не ограничиваясь таковыми); хроническое или рецидивирующее заболевание почек, функциональные расстройства кишечника (например, частая диарея или запор), заболевание желудочно-кишечного тракта, панкреатит, судорожное расстройство, слизистые или мышечно-скелетные расстройства, история суицидальных попыток или суицидальных представлений или клинически значимая депрессия, или другие психоневрологические расстройства, требующее фармакологического вмешательства
[000209] 2. Плохо контролируемая или нестабильная гипертензия; или устойчивое систолическое АД >150 мм рт.ст. или диастолическое АД >95 мм рт.ст. при скрининге
[000210] 3. История сахарного диабета, с применением для лечения инсулина или гипогликемических агентов
[000211] 4. История астмы, требующей госпитализации в течение предшествующих 12 месяцев
[000212] 5. Доказанный дефицит G-6-PD, определяемый в центральной исследовательской лаборатории
[000213] 6. В настоящее время плохо контролируемые эндокринные состояния, за исключением состояний щитовидной железы (гипер/гипотиреоз и т.д.), с исключением состояний щитовидной железы, требующих любых фармакологических вмешательств
[000214] 7. Злокачественная опухоль в анамнезе допускается, если злокачественная опухоль участника находится в полной ремиссии после химиотерапии и не требовала дополнительных медицинских или хирургических вмешательств в течение предшествующих трех лет
[000215] 8. Наличие множественной лекарственной аллергии или история аллергической реакции на олигонуклеотид или GalNAc
[000216] 9. Наличие непереносимости инъекций SC или наличие значительных рубцов в брюшной полости, которые могут потенциально препятствовать проведению исследования или оценке локальной переносимости
[000217] 10. Клинически значимый хирургический анамнез
[000218] 11. История постоянного злоупотребления этанолом (>40 г этанола/день) или употребления запрещенных наркотиков в течение предыдущих 3 лет.
[000219] 12. Клинически значимое заболевание в течение 7 дней до начала введения исследуемого вещества
[000220] 13. Донорство более 500 мл крови в течение 2 месяцев до начала исследования или донорства плазмы в течение 7 дней до скрининга
[000221] 14. Значительная инфекция или известный воспалительный процесс, продолжающийся при скрининге (по мнению исследователя)
[000222] 15. История хронической или рецидивирующей инфекции мочевыводящих путей (ИМП) или ИМП в течение одного месяца до скрининга
[000223] 16. Запланированное плановое хирургическое вмешательство во время проведения данного исследования
[000224] 17. Применение лекарств, отпускаемых по рецепту, в течение 4 недель до начала исследований
[000225] 18. Применение лекарств, отпускаемых без рецепта (OTC) или травяных добавок, за исключением обычных витаминов, в течение 7 дней после введения первой дозы, если это не было согласовано с исследователем и спонсором, занимающими соответствующую, клинически значимую позицию.
[000226] 19. Получение/введение исследуемого агента в течение 3 месяцев до введения дозы или участие в другом клиническом исследовании до начала настоящего исследования.
[000227] 20. Серопозитивные антитела к HBV, HIV, HCV или HDV, обнаруженные при скрининге (тестирование в сроки, предшествующие скринингу, может учитываться, если оно выполнено в течение 3 месяцев до скрининга)
[000228] 21. Аланинаминотрансфераза (ALT), аспартатаминотрансфераза (AST), гамма-глутамилтрансфераза (GGT), общий билирубин, щелочная фосфатаза (ALP) или альбумин вне контрольного диапазона при посещении скрининга (1) или в день поступления (день-1)
[000229] 22. Отклонения в анализе крови, которые исследователь считает клинически значимыми и неприемлемыми; гемоглобин <12,0 г/дл (эквивалент 120 г/л); тромбоциты за пределами нормального диапазона.
[000230] 23. Гемоглобин А1С (HbA1C) >7%
[000231] 24. Любой другой результат лабораторных тестов, признанный исследователем клинически значимым и неприемлемым
[000232] 25. Пациент предпринял или планирует провести существенное изменение уровня физической нагрузки, начиная с 48 часов до поступления в центр клинических исследований и до конца исследования.
[000233] 26. Любое условие, которое, по мнению исследователя, делает участника непригодным для участия в исследованиях или может помешать его участию или завершению исследования.
[000234] Группа В - взрослые субъекты с гепатитом B
[000235] Критерии включения, группа B
[000236] 1. Возраст 18 (или возраст совершеннолетия, в зависимости от того, что выше) до 65 лет включительно, на момент подписания информированного согласия.
[000237] 2. Хронический гепатит В, задокументированный:
[000238] а. история болезни совместима с хроническим гепатитом В, основана на совместимой клинической информации и предыдущей серопозитивности на HBsAg и, возможно, на другие серологические маркеры HBV (HBeAg, HBV DNA)
[000239] б. HBsAg в сыворотке >1000 МЕ/мл при скрининге для HBeAg-позитивных пациентов или >500 МЕ/мл для HBeAg-негативных пациентов
[000240] с. HBV DNA >20 000 МЕ /мл в сыворотке при скрининге для пациентов, не получавших лечения, определяется анализом TaqMan™ HBV DNA v2.0 в центральной исследовательской лаборатории
[000241] д. Анализ IgM анти-HBc в сыворотке отрицательный.
[000242] 3. Клинический анамнез, совместимый с компенсированным заболеванием печени, без признаков цирроза:
[000243] а. Нет истории кровотечений из варикозно-расширенных вен пищевода или желудочно-кишечного тракта
[000244] б. Нет истории асцита
[000245] с. Нет истории желтухи, приписываемой хроническому заболеванию печени
[000246] д. Нет истории печеночной энцефалопатии
[000247] и. Нет физических рубцов портальной гипертензии - ангиоматических пауков и др.
[000248] ф. Отсутствие предыдущих биопсий печени, исследований изображений печени или результатов эластографии, указывающих на цирроз печени
[000249] 4. Лечение гепатита В: ранее не проводилось противовирусного лечения гепатита В (ранее не проводилось лечение HBV-нуклеозидами/нуклеотидами или интерфероном) ИЛИ пациенту не проводилась постоянная терапия нуклетидами/нуклеозидми (Энтекавир или Тенофовир) в течение, по крайней мере, 12 недель до посещения на скрининг (1), с удовлетворительной переносимостью и соблюдением правил
[000250] 5. ALT в сыворотке> 60 ед/л (мужчины) или> 38 ед/л (женщины) (2x ULN в соответствии с руководством Американской ассоциации по изучению заболеваний печени (AASLD), HBV Инструкции и критерии, Terrault et al., 2016)
[000251] 6. ЭКГ с 12 отведениями без клинически значимых отклонений при скрининге и в День-1 (по мнению исследователя)
[000252] 7. Отсутствие иных предпосылок заболевания печени
[000253] 8. Отсутствие другого медицинского состояния, требующего постоянного медицинского лечения или постоянного или периодического фармакологического вмешательства, кроме хорошо контролируемой гипертонии и лечения гиперхолестеринемии статинами.
[000254] 9. BMI в диапазоне от 18,0 до 32,0 кг/м2 (включительно)
[000255] 10. Мужчина или Женщина:
[000256] а. Участники мужского пола:
[000257] Участник мужского пола должен быть согласен использовать контрацепцию во время периода лечения и в течение, по меньшей мере, двух недель после введения исследовательской дозы и воздержаться от донорства спермы в течение этого периода.
[000258] б. Участницы женского пола:
[000259] Пациенты женского пола имеет право участвовать при отсутствии беременности, кормлении грудью, и соответствовать, по меньшей мере, одно из следующих условий: не являться женщиной детородного возраста (WOCBP), или, в зависимости от региона; являться WOCBP, при согласии следовать инструкциям по применению контрацепции, начиная с момента регистрации после медицинского обследования, в течение всего периода лечения и в течение не менее 12 недель после введения исследовательской дозы.
[000260] 11. Находится в позиции подписать информированное согласие 1, которое включает соблюдение требований и ограничений.
[000261] Критерий исключения, группа B
[000262] 1. Наличие в истории болезни любого медицинского состояния, которое может помешать всасыванию, распределению или элиминации исследуемого лекарственного средства, или клиническим и лабораторным оценкам в этом исследовании, включая (но не ограничиваясь таковыми); хроническое или рецидивирующее заболевание почек, функциональные расстройства кишечника (например, частая диарея или запор), заболевание желудочно-кишечного тракта, панкреатит, судорожное расстройство, слизистые или мышечно-скелетные расстройства, история суицидальных попыток или суицидальных представлений или клинически значимая депрессия, или другие психоневрологические расстройства, требующее фармакологического вмешательства.
[000263] 2. Плохо контролируемая или нестабильная гипертензия.
[000264] 3. История сахарного диабета, с применением для лечения инсулина или гипогликемических агентов.
[000265] 4. История астмы, требующей госпитализации в течение предшествующих 12 месяцев.
[000266] 5. Доказанный дефицит G-6-PD, определяемый в центральной исследовательской лаборатории.
[000267] 6. В настоящее время плохо контролируемые эндокринные состояния, за исключением состояний щитовидной железы (гипер/гипотиреоз и т.д.), при исключении состояний щитовидной железы, требующих любых фармакологически вмешательств.
[000268] 7. История хронического или рецидивного воспаления мочеиспускательного тракта (UTI) или заболевание UTI в течение одного месяца до скрининга
[000269] 8. Наличие гепатоцеллюлярной карциномы в анмнезе (ГЦК)
[000270] 9. Допускается наличие в анамнезе злокачественной опухоли, отличной от ГЦК, если злокачественная опухоль пациента находится в полной ремиссии после химиотерапии и не требовала дополнительных медицинских или хирургических вмешательств в течение предшествующих трех лет.
[000271] 10. История постоянного злоупотребления этанолом (>40 г этанола/день) или употребления запрещенных наркотиков в течение предыдущих 3 лет.
[000272] 11. Наличие в истории болезни непереносимости инъекций SC или наличие значительных рубцов в брюшной полости, которые могут потенциально препятствовать проведению исследования или оценке локальной переносимости.
[000273] 12. Получение донорской крови (переливание) за последние 6 недель до начала терапии или планируемое переливание в течение наблюдаемого периода по окончании исследования.
[000274] 13. Донорство или потеря >500 мл крови в течение 2 месяцев до скрининга или донорство плазмы в течение 7 дней до скрининга.
[000275] 14. Противовирусная терапия (кроме Энтекавира или Тенофовира) в течение 3 месяцев до скрининга или лечение интерфероном в течение предшествующих 3 лет.
[000276] 15. Применение в течение последних 6 месяцев (или ожидаемая потребность в применении) антикоагулянтов, системно вводимых кортикостероидов, системно вводимых иммуномодуляторов или системно вводимых иммунодепрессантов.
[000277] 16. Применение лекарственного средства, отпускаемого по рецепту, в течение 14 дней до проведения исследования, которое, по мнению исследователя или спонсора, будет мешать проведению исследования. Местные препараты без системного всасывания, статины (кроме розувастатина), гипертонические препараты, лекарства, отпускаемые без рецепта, а также обезболивающие препараты, отпускаемые без рецепта, и гормональные контрацептивы (женщины) являются приемлемыми.
[000278] 17. Инъекции депо-препаратов или имплантации любого лекарственного средства в течение 3 месяцев до начала исследования, за исключением инъекционного депо-препарата/ импланта предотвращения беременности.
[000279] 18. Постоянное использование растительных добавок или системных лекарств, отпускаемых без рецептов; участники должны быть готовы прекратить использование таковых на время проведения исследования.
[000280] 19. Введение/получение исследуемого агента в течение 3 месяцев до введения исследовательской дозы дозы или участие в другом клиническом исследовании до начала данного исследования.
[000281] 20. Эластография печени (то есть FibroScan®), кПа> 10,5 при скрининге.
[000282] 21. Систолическое артериальное давление> 150 мм рт.ст. и диастолическое артериальное давление> 95 мм рт.ст. после 10 минут отдыха лежа при скрининге.
[000283] 22. Печеночные трансаминазы (ALT или AST) подтвержденное значение > 7хULN при скрининге.
[000284] 23. Наличие постоянной или рецидивирующей гипербилирубинемии, не являющейся болезнью Гилберта или синдромом Дубина-Джонсона.
[000285] 24. Серопозитивность антител к вирусу иммунодефицита человека (ВИЧ) или вирусу гепатита С (HCV) или вирусу гепатита дельта (HDV).
[000286] 25. Hgb <12 г/дл (мужчины) или Hgb <11 г/дл (женщины).
[000287] 26. Сывороточный альбумин <3,5 г/дл при скрининге.
[000288] 27. Общее количество лейкоцитов <4000 клеток/мкл или абсолютное количество нейтрофилов (ANC) <1800 клеток/мкл при скрининге.
[000289] 28. Количество тромбоцитов ≤100000 на мкл при скрининге.
[000290] 29. Международное нормализованное отношение (INR) или протромбиновое время (PT) находится выше верхнего предела нормального контрольного диапазона (в соответствии с контрольным диапазоном, принятым в данной лаборатории) при скрининге.
[000291] 30. Сывороточные мочевина (BUN) или креатинин > ULN.
[000292] 31. Сывороточная амилаза или липаза> 1,25 х ULN.
[000293] 32. Сыворотка HbA1c> 7,0%.
[000294] 33. Значение сывороточного альфа-фетопротеина (АФП) >100 нг/мл. Если АФП при скрининге составляет >ULN, но <100 нг/мл, пациент имеет право на участие в исследованиях, если исследование печени не выявило повреждений, предполагающих возможность ГЦК.
[000295] 34. Любой другой результат лабораторных исследований, проведенный из соображений безопасности пациента, признанный исследователем клинически значимым и неприемлемым.
[000296] 35. Пациент предпринял или планирует провести существенное изменение уровня физической нагрузки, начиная с 48 часов до поступления в центр клинических исследований и до конца исследования.
[000297] 36. Любое условие, которое, по мнению исследователя, делает участника непригодным для участия в исследованиях или может помешать его участию или завершению исследования.
[000298] Раскрытие, описанное здесь в целях иллюстрации, может быть осуществлено на практике при отсутствии какого-либо элемента или элементов, ограничения или ограничений, не раскрытых в настоящем изобретении. Таким образом, например, в каждом случае, описанном в настоящем изобретении, любой из терминов «содержащий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов. Используемые термины и выражения используются в качестве терминов описания, а не ограничения, и не предполагается, что при использовании таких терминов и выражений исключаются какие-либо эквиваленты показанных и описанных признаков или частей таковых, однако признается, что возможны различные модификации в пределах объема заявленного изобретения. Таким образом, следует понимать, что, хотя настоящее изобретение было детально раскрыто в предпочтительных вариантах осуществления, специалисты в данной области техники могут использовать дополнительные свойства, модификации и вариации раскрытых здесь концепций, при этом такие модификации и вариации рассматриваются как находящиеся в пределах объема данного изобретения, определенного описанием и прилагаемой формулой изобретения.
[000299] Использование терминов «а» и «an» и «the» и тому подобных в контексте описания изобретения (особенно в контексте следующей далее формулы изобретения) должны толковаться как охватывающие как единственное, так и множественное число, если иное не указано в настоящем изобретении или явно не противоречит контексту. Термины «содержащий», «имеющий», «включающий» и «состоящий из» следует толковать как открытые термины (то есть означающие «включающий, но не ограничивающийся ими»), если не указано иное. Перечисление диапазонов значений в настоящем изобретении просто предназначено для того, чтобы служить сокращенным способом индивидуальной ссылки на каждое отдельное значение, попадающее в этот диапазон, если в настоящем изобретении не указано иное, и, таким образом, каждое отдельное значение включается в описание, как если бы оно было отдельно указано в настоящем изобретении. Все способы, описанные в настоящем изобретении, могут быть выполнены в любом подходящем порядке, если в настоящем изобретении не указано иное или иное явно не противоречит контексту. Использование любых или всех примеров или примерных формулировок (например, «таких как»), представленных в настоящем изобретении, предназначено главным образом для лучшего освещения изобретения и не налагает ограничения на объем изобретения, если не заявлено иное. Ни одно выражение в описании не должно быть истолковано как указывающее на любой незаявленный элемент как существенный для практического применения изобретения.
[000300] Варианты осуществления этого изобретения описаны здесь, включая наилучшие способы, известные изобретателям для осуществления изобретения. Изменения этих вариантов осуществления могут быть очевидными для специалистов в данной области техники после прочтения предшествующего описания.
[000301] Авторы изобретения ожидают, что квалифицированные специалисты будут использовать такие варианты в зависимости от ситуации, и предполагают, что изобретение будет реализовано на практике иначе, чем конкретно описано здесь. Соответственно, это изобретение включает в себя все модификации и эквиваленты обсуждаемого, перечисленного в прилагаемой формуле изобретения, в соответствии с нормами применимого законодательства. Более того, любая комбинация вышеописанных элементов во всех возможных вариациях охватывается изобретением, если в настоящем изобретении не указано иное или иное явно не противоречит контексту. Специалисты в данной области техники распознают или смогут установить, не выходя за пределы стандартных экспериментов, множество эквивалентов конкретных вариантов осуществления изобретения, описанных в настоящем изобретении. Предполагается, что такие эквиваленты охвачены следующей формулой изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Дицерна Фармасютикалс, Инкорпорэйтед.
<120> PCT/US2018/056801
<130> D0800.70003WO00
<140> PCT/US2018/056801
<141> 2018-10-19
<150> US 62/575,358
<151> 2017-10-20
<160> 59
<170> PatentIn Version 3.5
<210> 1
<211> 18
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (5)..(5)
<223> n представляет собой a, c, g, или u
<400> 1
acaanaaucc ucacaaua 18
<210> 2
<211> 15
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (3)..(3)
<223> n представляет собой a, c, g, или u
<220>
<221> отличительная характеристика
<222> (15)..(15)
<223> n представляет собой a, c, g, или u
<400> 2
uunuugugag gauun 15
<210> 3
<211> 20
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (15)..(15)
<223> n представляет собой a, c, g, или u
<400> 3
uuauugugag gauunuuguc 20
<210> 4
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (15)..(15)
<223> n представляет собой a, c, g, или u
<400> 4
uuauugugag gauunuuguc gg 22
<210> 5
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 5
uuauugugag gauucuuguc gg 22
<210> 6
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 6
uuauugugag gauuuuuguc gg 22
<210> 7
<211> 19
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (5)..(5)
<223> n представляет собой a, c, g, или u
<400> 7
acaanaaucc ucacaauaa 19
<210> 8
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (6)..(6)
<223> n представляет собой a, c, g, или u
<400> 8
gacaanaauc cucacaauaa gcagccgaaa ggcugc 36
<210> 9
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 9
gacaaaaauc cucacaauaa gcagccgaaa ggcugc 36
<210> 10
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 10
gacaagaauc cucacaauaa gcagccgaaa ggcugc 36
<210> 11
<211> 10
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 11
aatcctcaca 10
<210> 12
<211> 10
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 12
ugugaggauu 10
<210> 13
<211> 10
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 13
tgtgaggatt 10
<210> 14
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 14
tattgtgagg attcttgtca 20
<210> 15
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 15
cggtattgtg aggattcttg 20
<210> 16
<211> 20
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 16
tgtgaggatt cttgtcaaca 20
<210> 17
<211> 21
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 17
uauugugagg auuuuuguca a 21
<210> 18
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 18
ugcgguauug ugaggauuct t 21
<210> 19
<211> 23
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 19
acagcattgt gaggattctt gtc 23
<210> 20
<211> 23
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 20
uauugugagg auuuuuguca aca 23
<210> 21
<211> 23
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 21
auugugagga uuuuugucaa caa 23
<210> 22
<211> 23
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 22
uugugaggau uuuugucaac aag 23
<210> 23
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 23
gugguggacu ucucucaaua gcagccgaaa ggcugc 36
<210> 24
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 24
uauugagaga aguccaccac gg 22
<210> 25
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 25
uuugugagga uuuuugucaa gg 22
<210> 26
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 26
ucugagagaa guccaccacg gg 22
<210> 27
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 27
uacugagaga aguccaccac gg 22
<210> 28
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 28
uaaaacugag agaaguccac gg 22
<210> 29
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 29
gacaagaatc ctcacaata 19
<210> 30
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 30
cgtggtggac ttctctcaa 19
<210> 31
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 31
gtggacttct ctcaatttt 19
<210> 32
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (6)..(6)
<223> n представляет собой a, c, g, или t
<400> 32
gacaanaatc ctcacaata 19
<210> 33
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (19)..(19)
<223> n представляет собой a, c, g, или t
<400> 33
cgtggtggac ttctctcan 19
<210> 34
<211> 19
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (15)..(15)
<223> n представляет собой a, c, g, или t
<400> 34
gtggacttct ctcantttt 19
<210> 35
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 35
tgttgacaag aatcctcaca at 22
<210> 36
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 36
tcgtggtgga cttctctcaa t 21
<210> 37
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (10)..(10)
<223> n представляет собой a, c, g, или t
<400> 37
tgttgacaan aatcctcaca at 22
<210> 38
<211> 21
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (20)..(20)
<223> n представляет собой a, c, g, или t
<400> 38
tcgtggtgga cttctctcan t 21
<210> 39
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 39
ugcacuucgc gucaccucua gcagccgaaa ggcugc 36
<210> 40
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 40
uagaggugac gcgaagugca gg 22
<210> 41
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 41
gcaccucucu uuacgcggaa gcagccgaaa ggcugc 36
<210> 42
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 42
uuccgcguaa agagaggugc gg 22
<210> 43
<211> 36
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (1)..(1)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (1)..(2)
<223> может быть модифицирован фосфоротиоатом
<220>
<221> отличительная характеристика
<222> (2)..(2)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (3)..(3)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (4)..(7)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (8)..(10)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (11)..(11)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (12)..(13)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (14)..(16)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (17)..(17)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (18)..(26)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (27)..(27)
<223> может быть модифицирован 2'-модифицированным -GalNAc-гуанозином
<220>
<221> отличительная характеристика
<222> (28)..(30)
<223> может быть модифицирован 2'-модифицированным -GalNAc-аденозином
<220>
<221> отличительная характеристика
<222> (31)..(36)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<400> 43
gacaaaaauc cucacaauaa gcagccgaaa ggcugc 36
<210> 44
<211> 23
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<220>
<221> отличительная характеристика
<222> (1)..(1)
<223> может быть модифицирован 4'-O-монометилфосфонатом-2'-O-метилуридином
<220>
<221> отличительная характеристика
<222> (1)..(4)
<223> может быть модифицирован фосфоротиоатом
<220>
<221> отличительная характеристика
<222> (2)..(3)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (4)..(4)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (5)..(5)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (6)..(6)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (7)..(8)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (9)..(9)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (10)..(10)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (11)..(11)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (12)..(12)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (13)..(13)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (14)..(14)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (15)..(15)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (16)..(16)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (17)..(18)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (19)..(19)
<223> может быть модифицирован 2'-фторо-дезоксирибонуклеотидом
<220>
<221> отличительная характеристика
<222> (20)..(22)
<223> может быть модифицирован 2'-O-метил рибонуклеотидом
<220>
<221> отличительная характеристика
<222> (20)..(22)
<223> может быть модифицирован фосфоротиоатом
<400> 44
uuauugugag gauuuuuugu cgg 23
<210> 45
<211> 50
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 45
tgttgacaag aatcctcaca atacctcgtg gtggacttct ctcaattttc 50
<210> 46
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 46
ggaacuguuu uuaggagugu uu 22
<210> 47
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 47
ggaacuguuc uuaggagugu uu 22
<210> 48
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 48
ggcuguuuuu aggaguguua uu 22
<210> 49
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 49
ggcuguucuu aggaguguua uu 22
<210> 50
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 50
ttgacaagaa tcctcacaat ac 22
<210> 51
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 51
gggcaccacc ugaagagagu cu 22
<210> 52
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 52
gggcaccacc ugaagagagu uu 22
<210> 53
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 53
ctcgtggtgg acttctctca at 22
<210> 54
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 54
ggcaccaccu gaagagaguc au 22
<210> 55
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 55
ggcaccaccu gaagagaguu au 22
<210> 56
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 56
tcgtggtgga cttctctcaa tt 22
<210> 57
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 57
ggcaccugaa gagagucaaa au 22
<210> 58
<211> 22
<212> РНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 58
ggcaccugaa gagaguuaaa au 22
<210> 59
<211> 22
<212> ДНК
<213> Синтетическая последовательность
<220>
<223> Синтетический полинуклеотид
<400> 59
tggtggactt ctctcaattt tc 22
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТЫ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2018 |
|
RU2795400C2 |
| МОЛЕКУЛЫ НУКЛЕИНОВЫХ КИСЛОТ ДЛЯ УМЕНЬШЕНИЯ УРОВНЯ мРНК PAPD5 ИЛИ PAPD7 ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННОГО ГЕПАТИТА В | 2017 |
|
RU2768699C2 |
| ОЛИГОНУКЛЕОТИДЫ ДЛЯ ПОНИЖЕНИЯ ЭКСПРЕССИИ PD-L1 | 2017 |
|
RU2835926C1 |
| ЛЕЧЕНИЕ СВЯЗАННЫХ С ГЕНОМ-СУПРЕССОРОМ ОПУХОЛЕЙ ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ИНГИБИРОВАНИЯ ПРИРОДНОГО ТРАНСКРИПТА В АНТИСМЫСЛОВОЙ ОРИЕНТАЦИИ ОТНОСИТЕЛЬНО ЭТОГО ГЕНА | 2009 |
|
RU2746478C2 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОНУКЛЕОТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2802836C2 |
| СРЕДСТВА ДЛЯ РНКи, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ТРАНСТИРЕТИНОМ (TTR) | 2012 |
|
RU2804776C2 |
| ДИАГНОСТИЧЕСКИЙ АНАЛИЗ | 2001 |
|
RU2228530C2 |
| КОМПОЗИЦИИ И СПОСОБЫ МОДУЛИРОВАНИЯ ЭКСПРЕССИИ HBV И TTR | 2014 |
|
RU2782034C2 |
| СТРУКТУРЫ МИРНК С ВЫСОКОЙ АКТИВНОСТЬЮ И СНИЖЕННЫМ ВОЗДЕЙСТВИЕМ ВНЕ МИШЕНИ | 2016 |
|
RU2788030C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ ДЛЯ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ LPA В КЛЕТКЕ | 2018 |
|
RU2822093C1 |
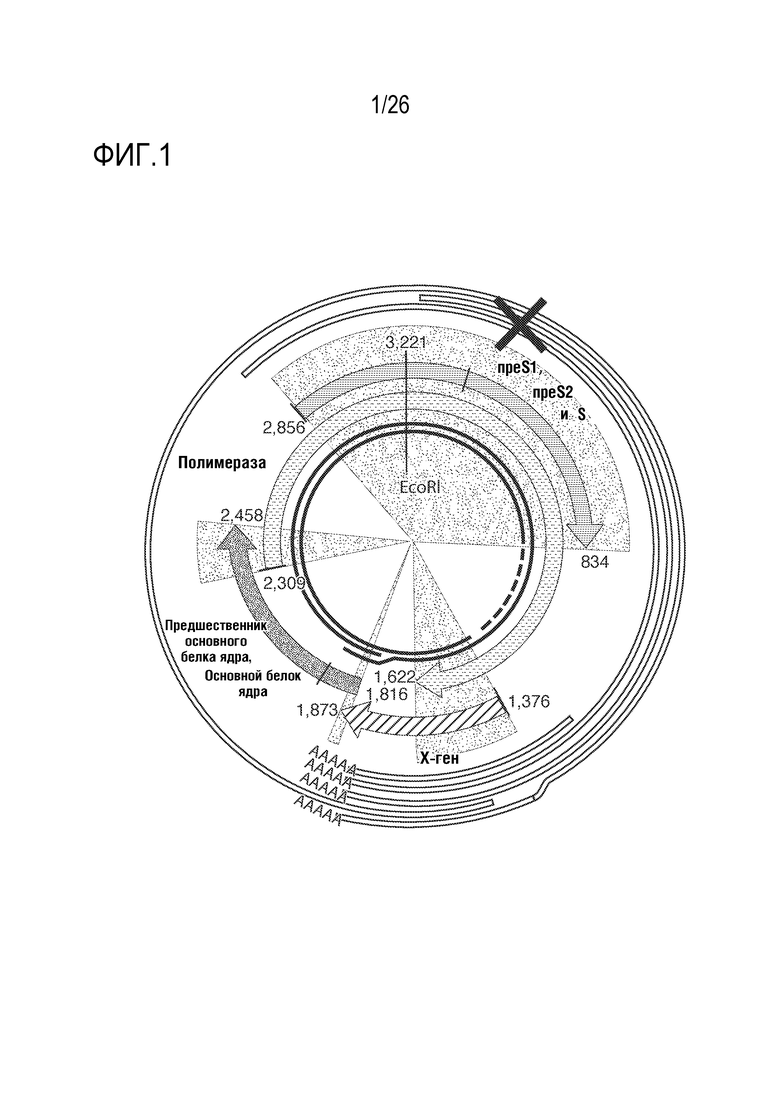
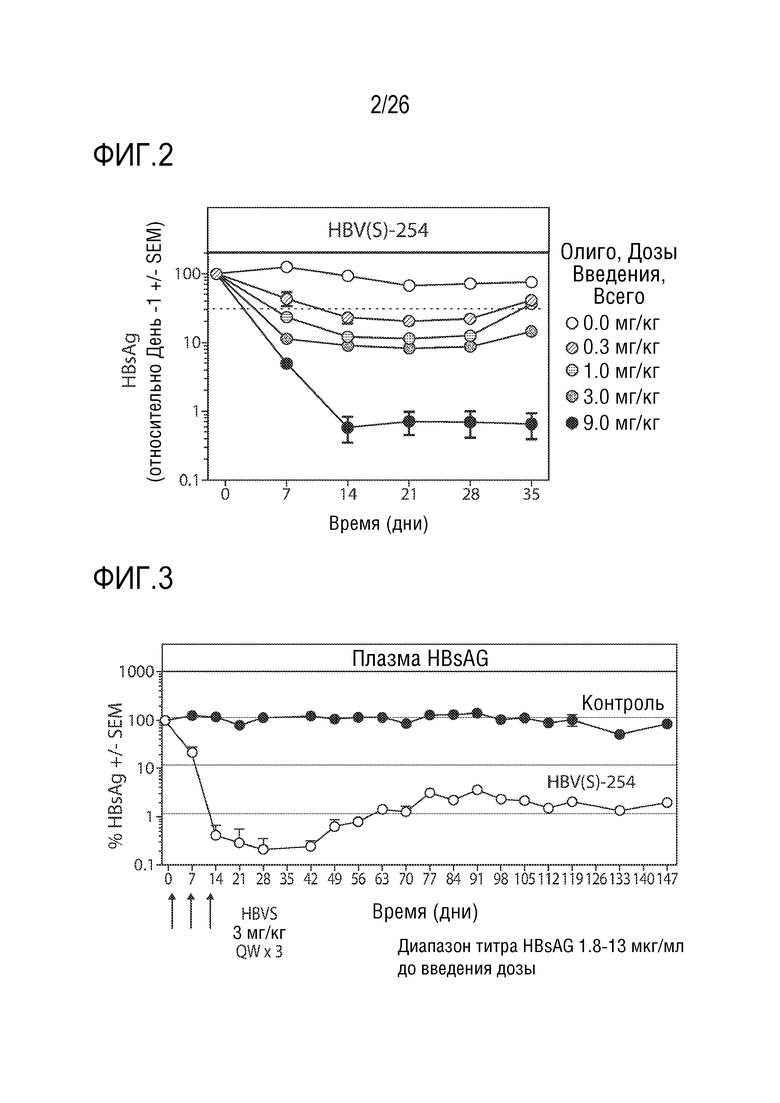
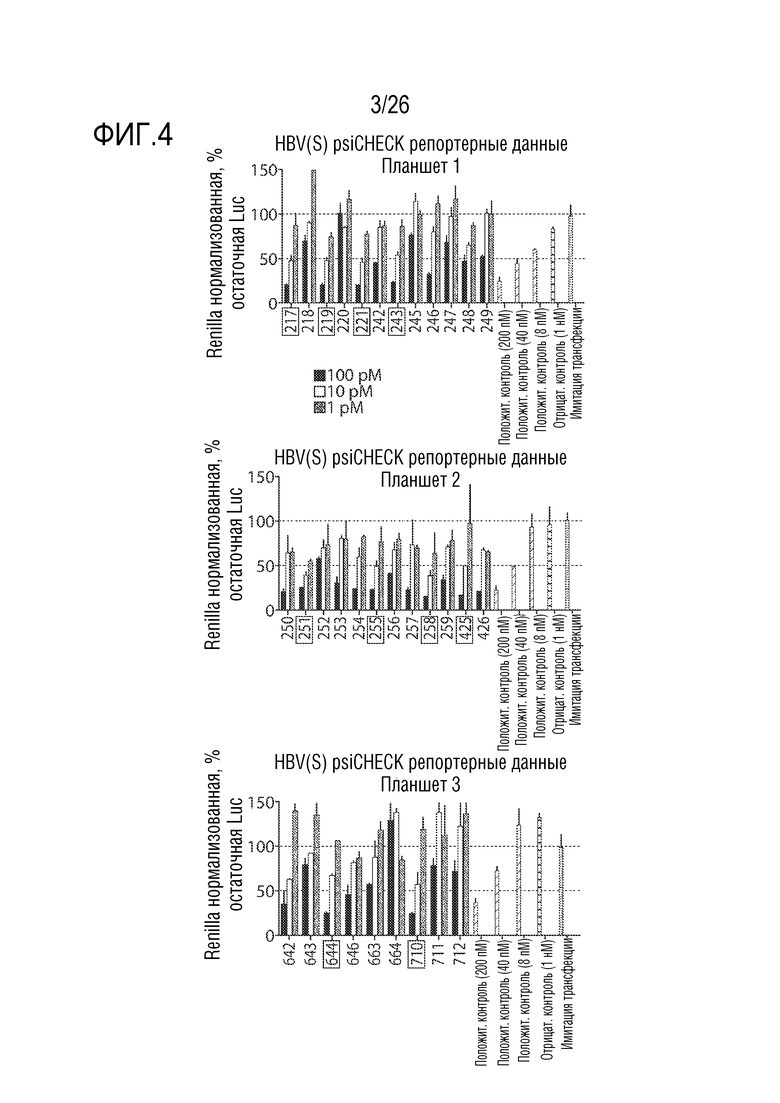
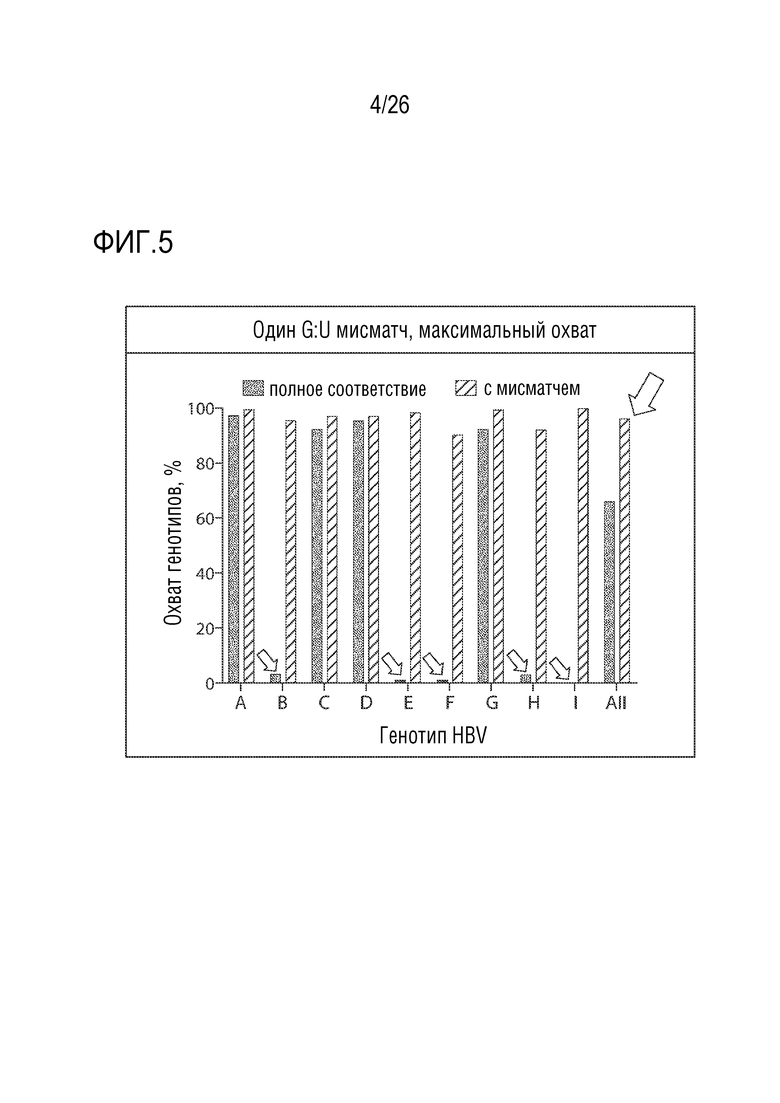
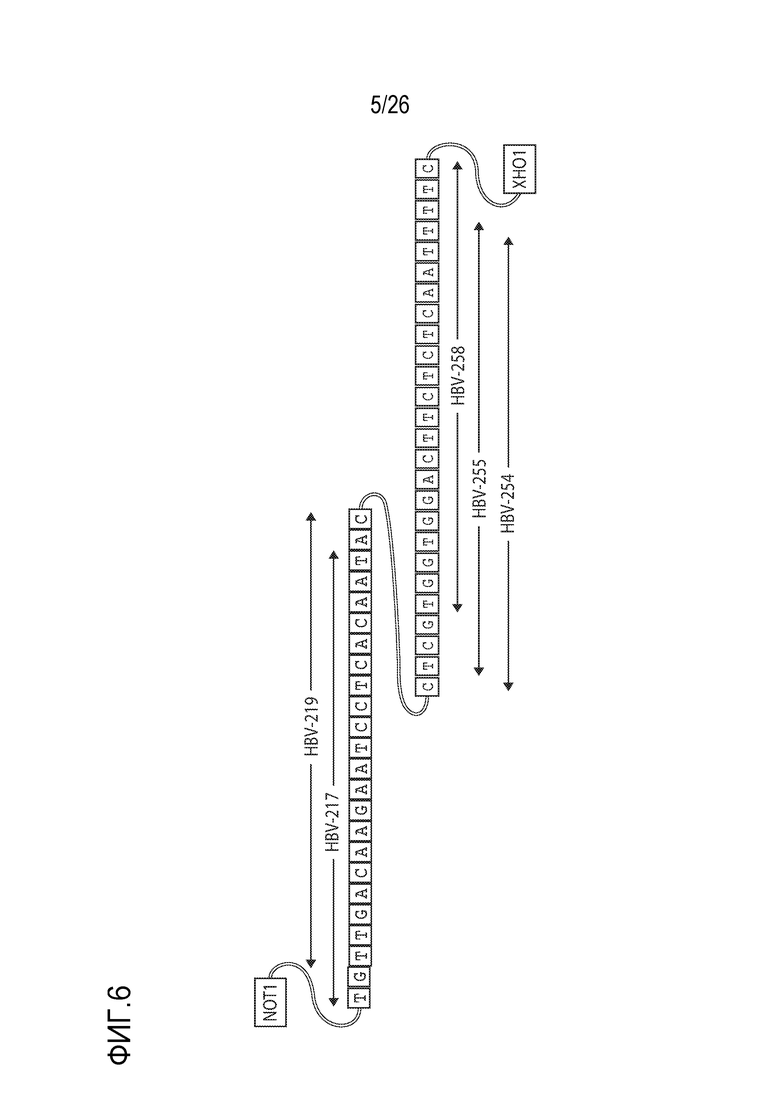

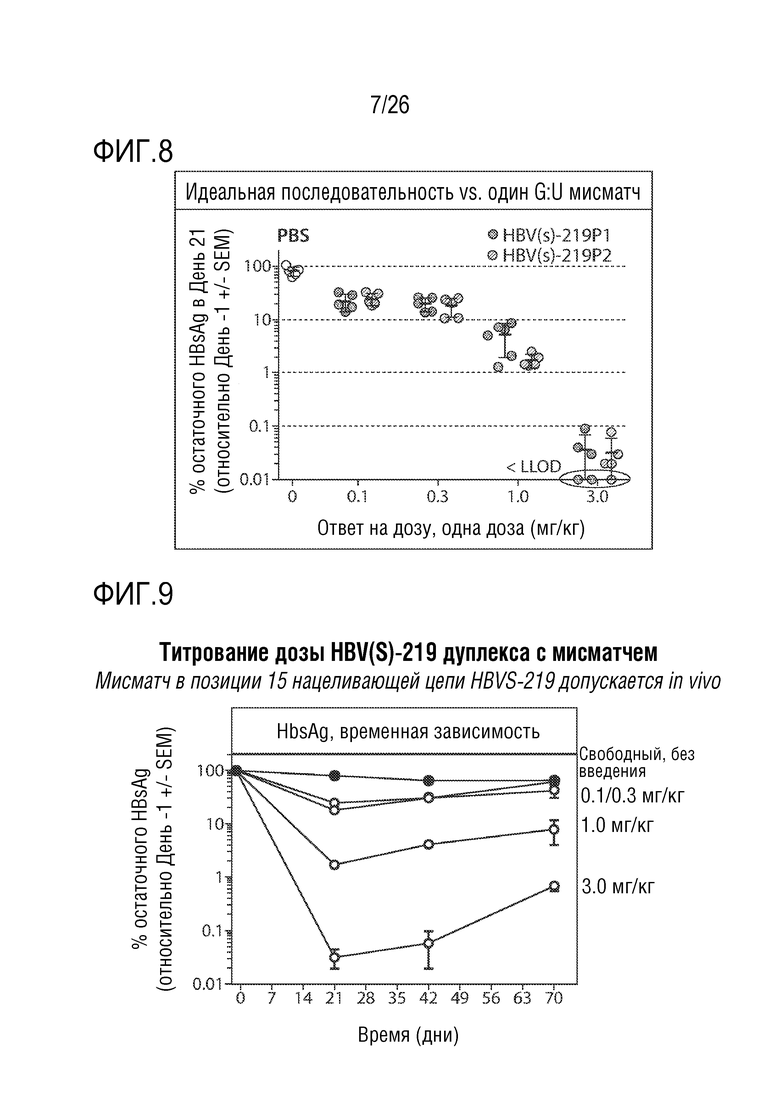
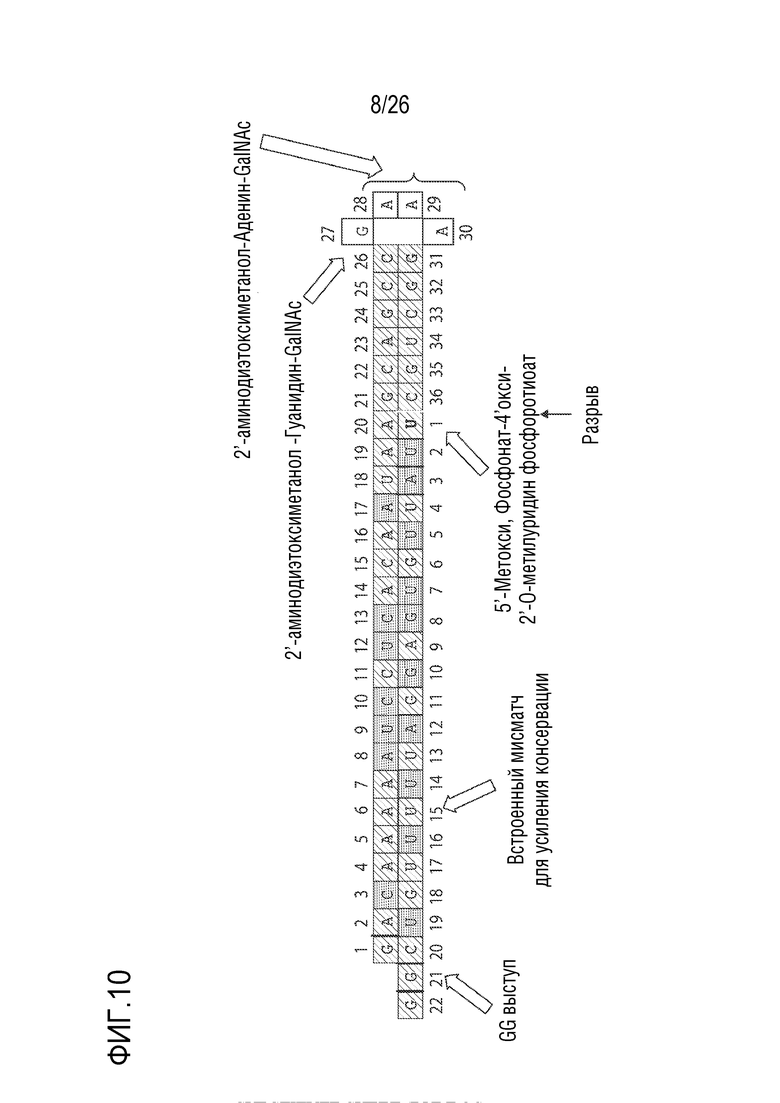
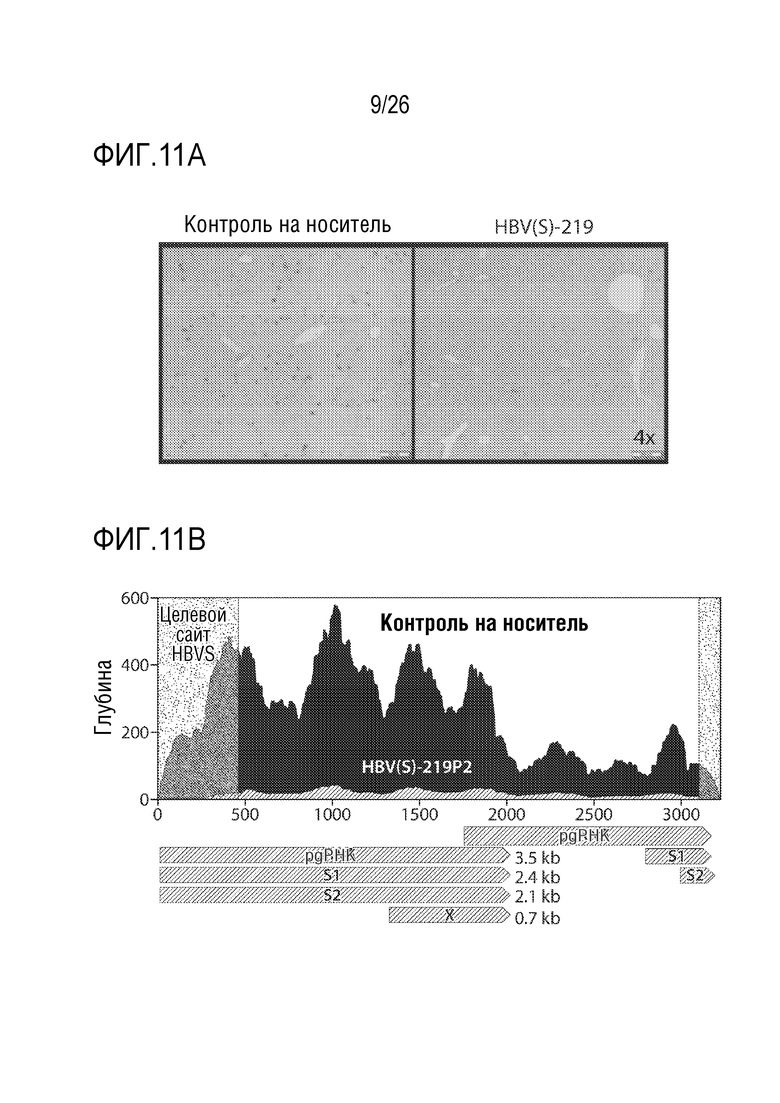

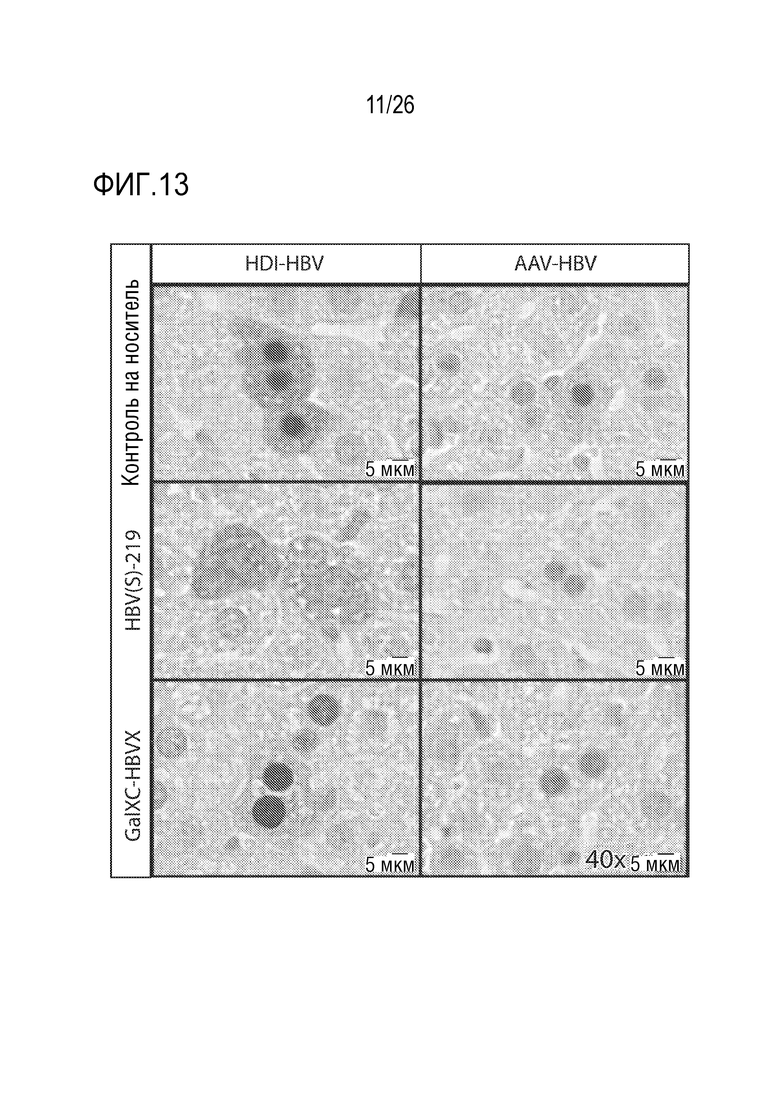
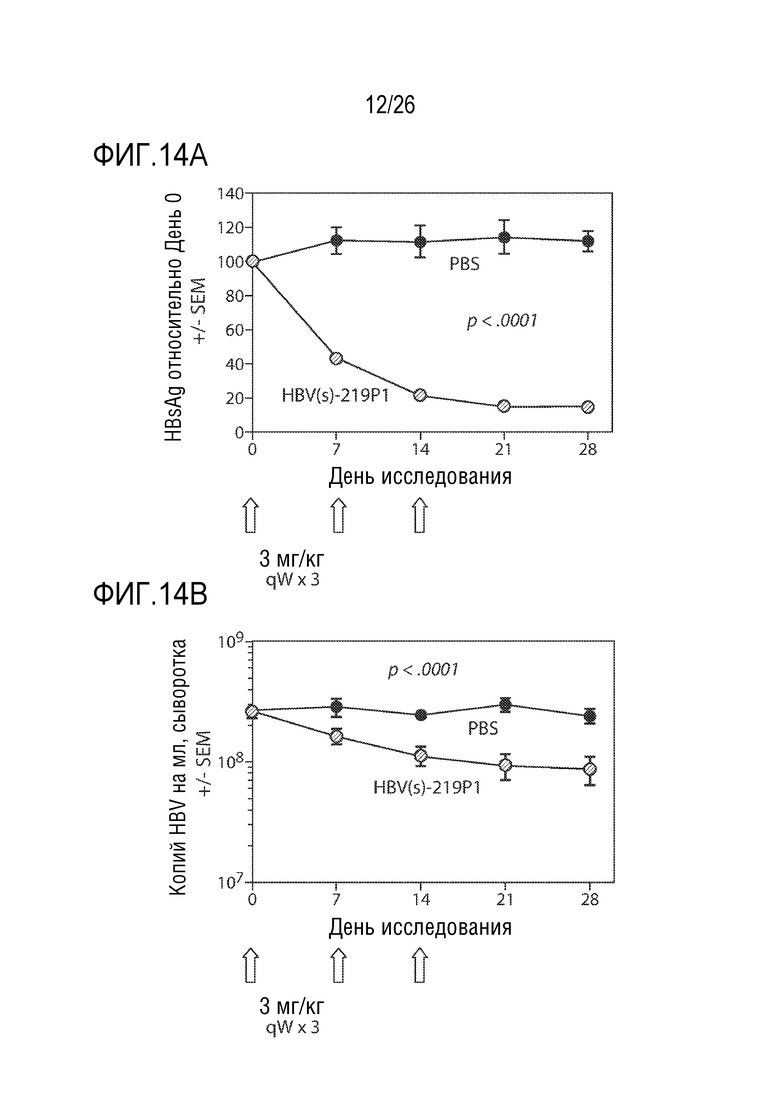
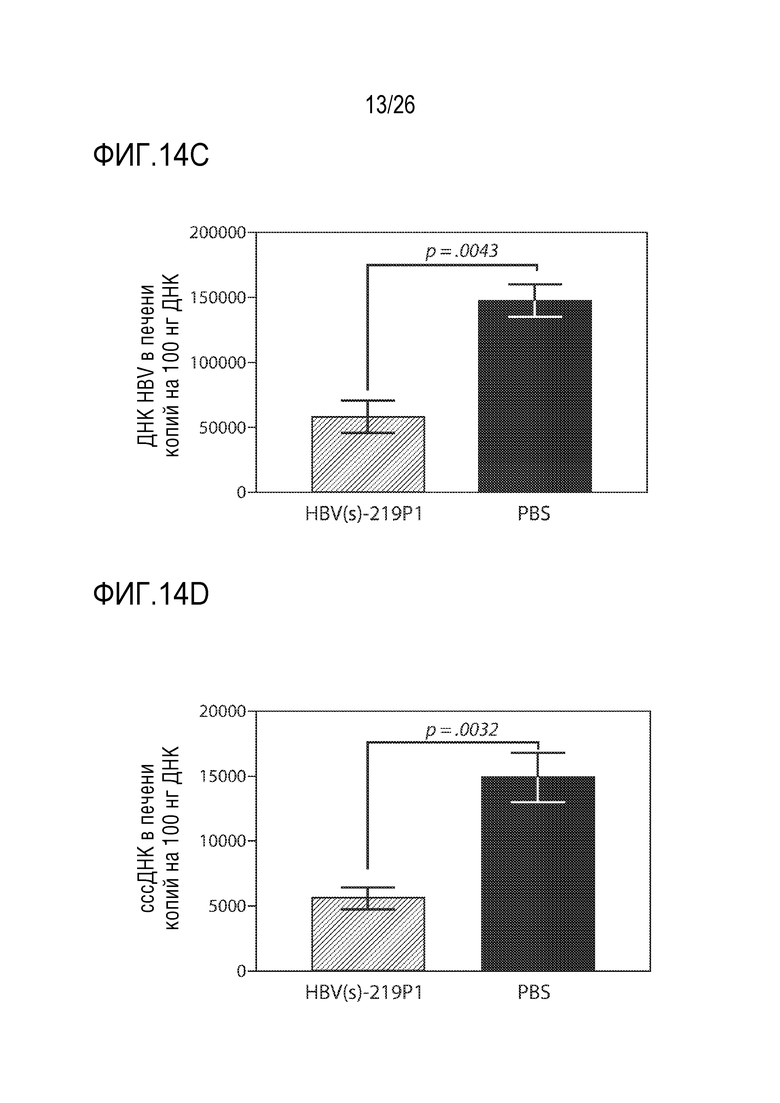
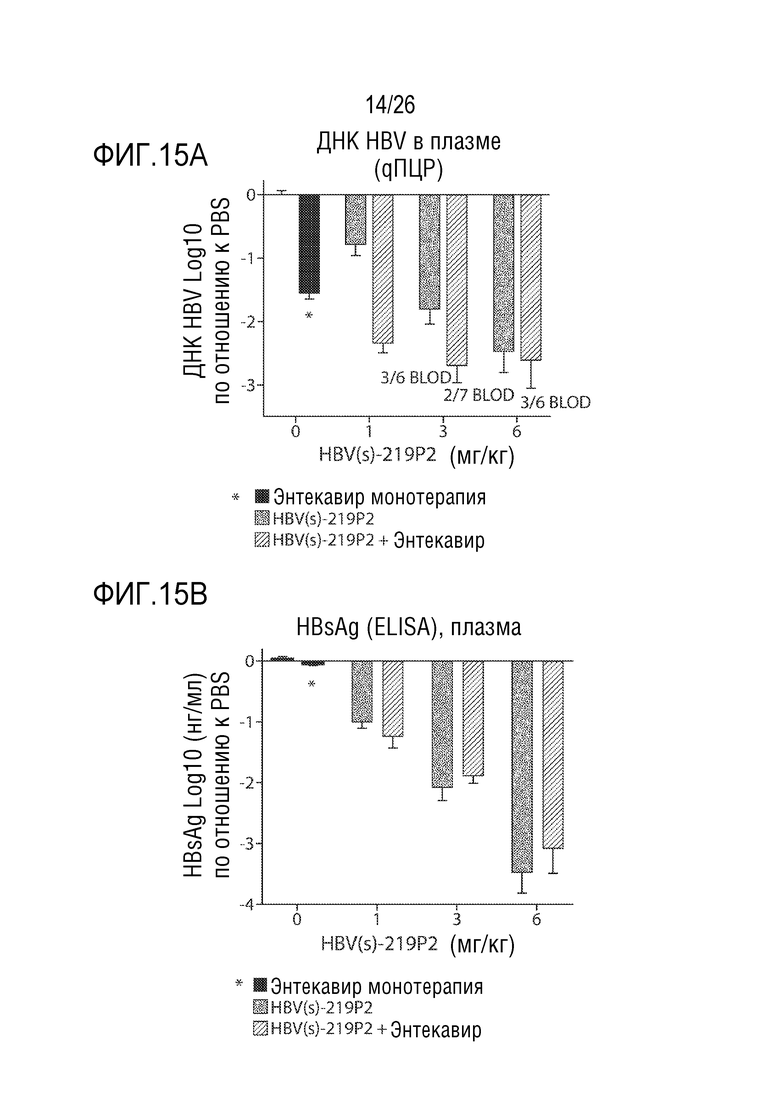
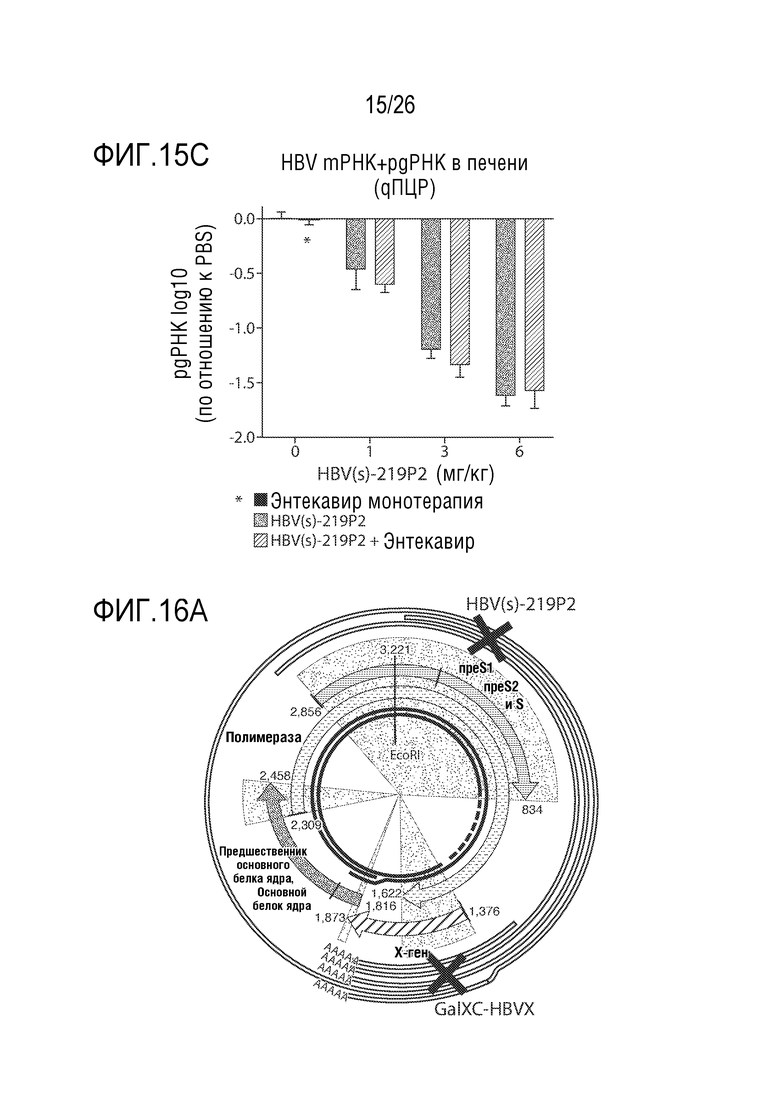
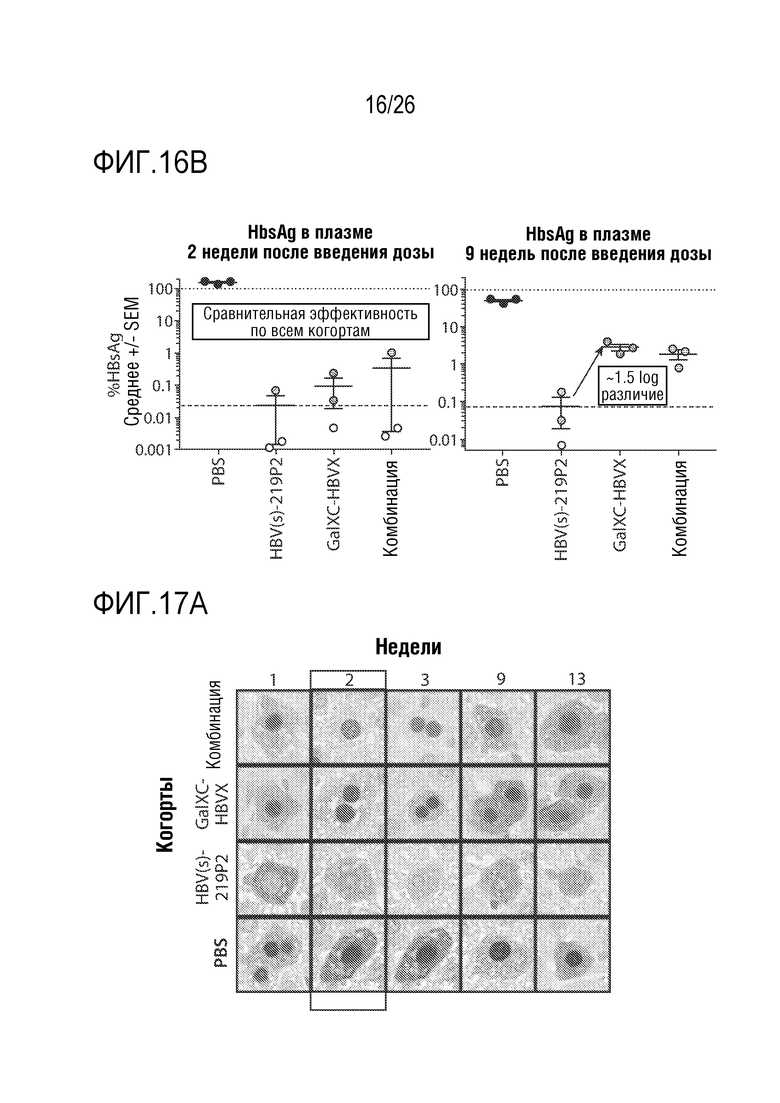
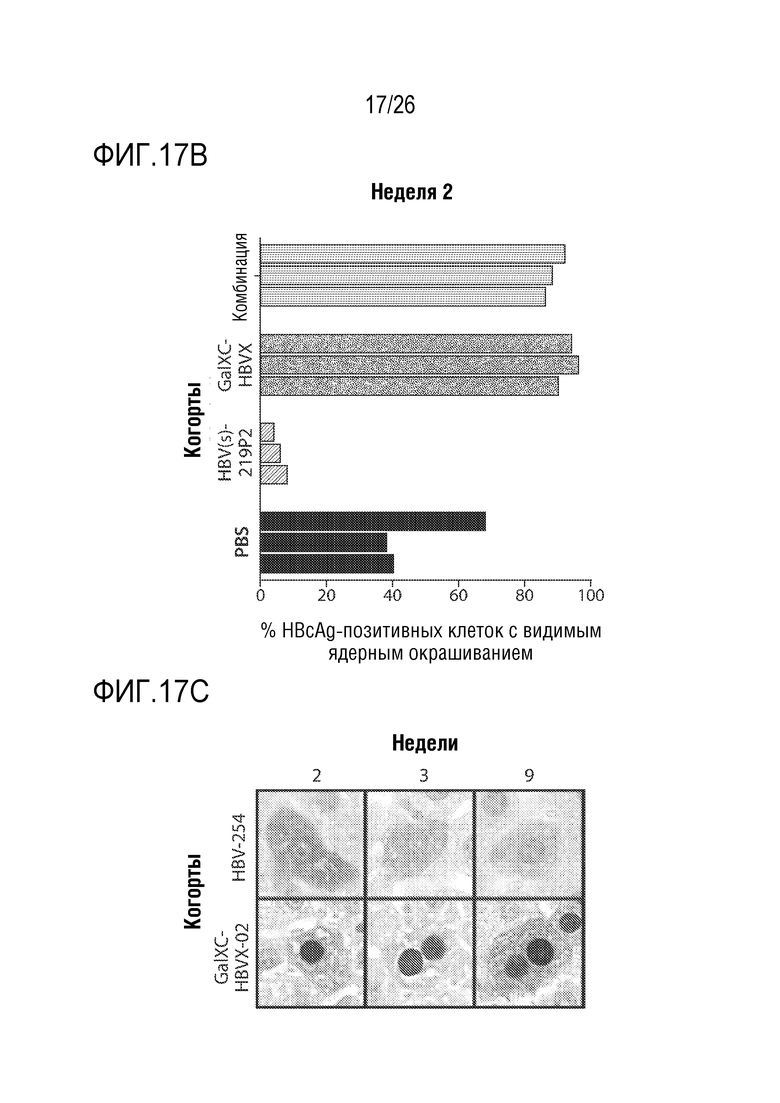
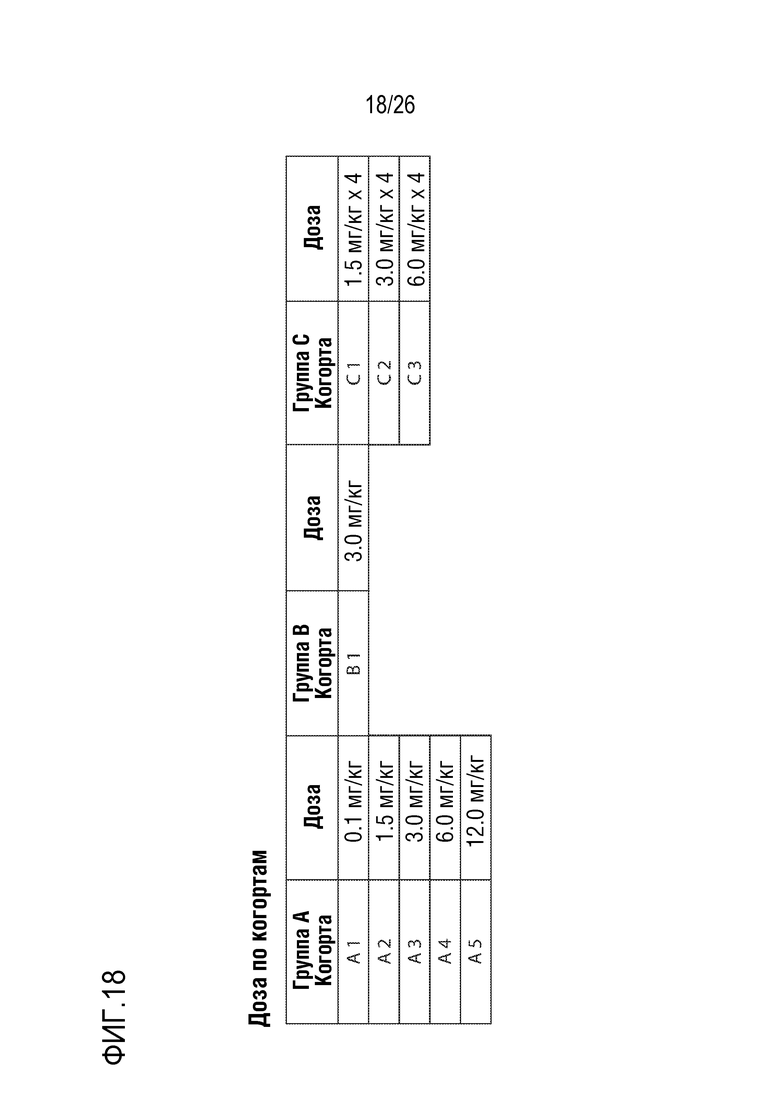
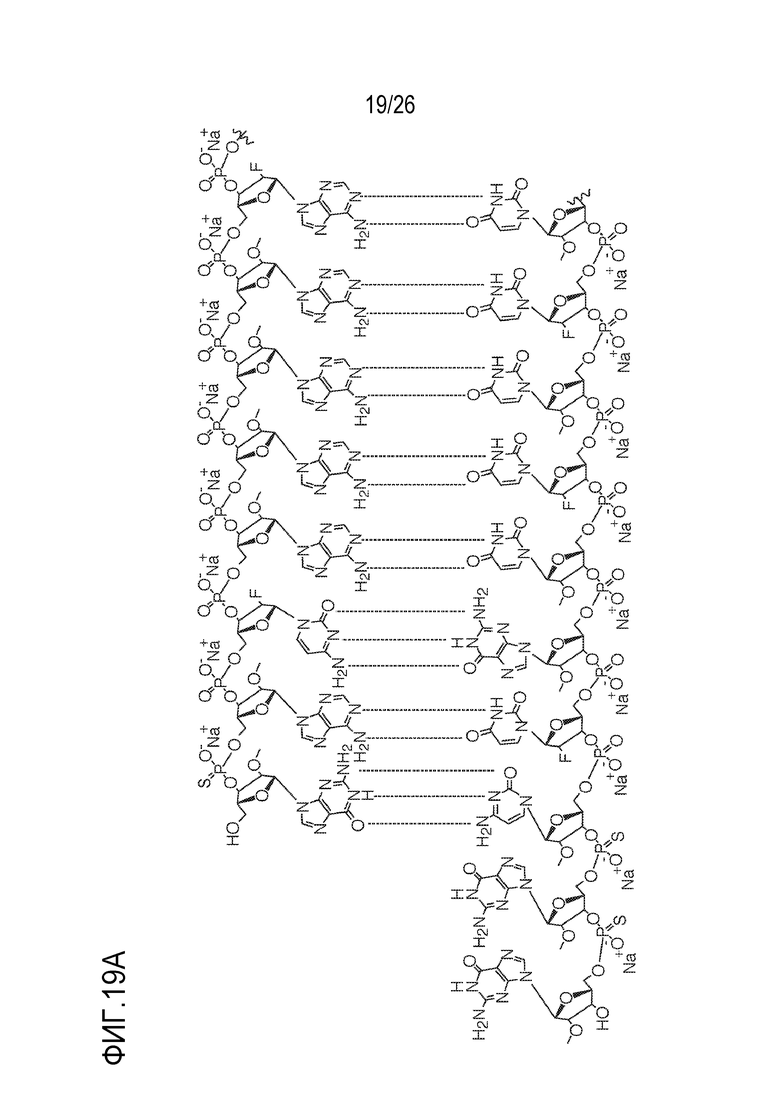
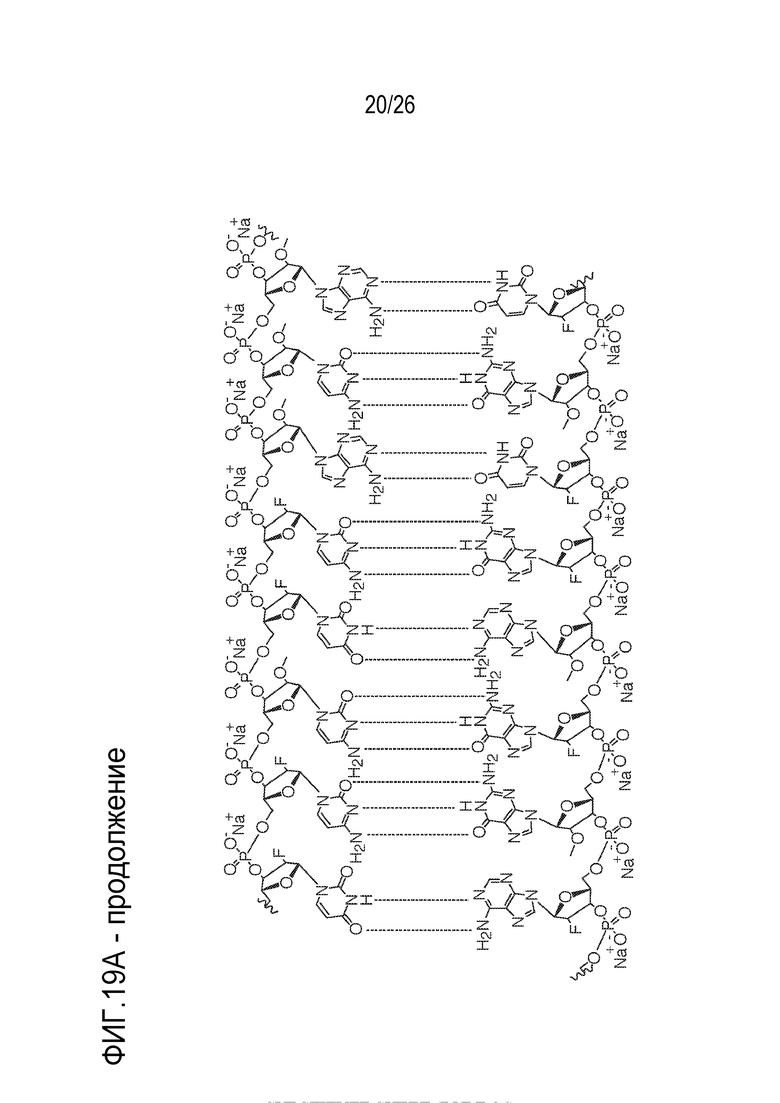
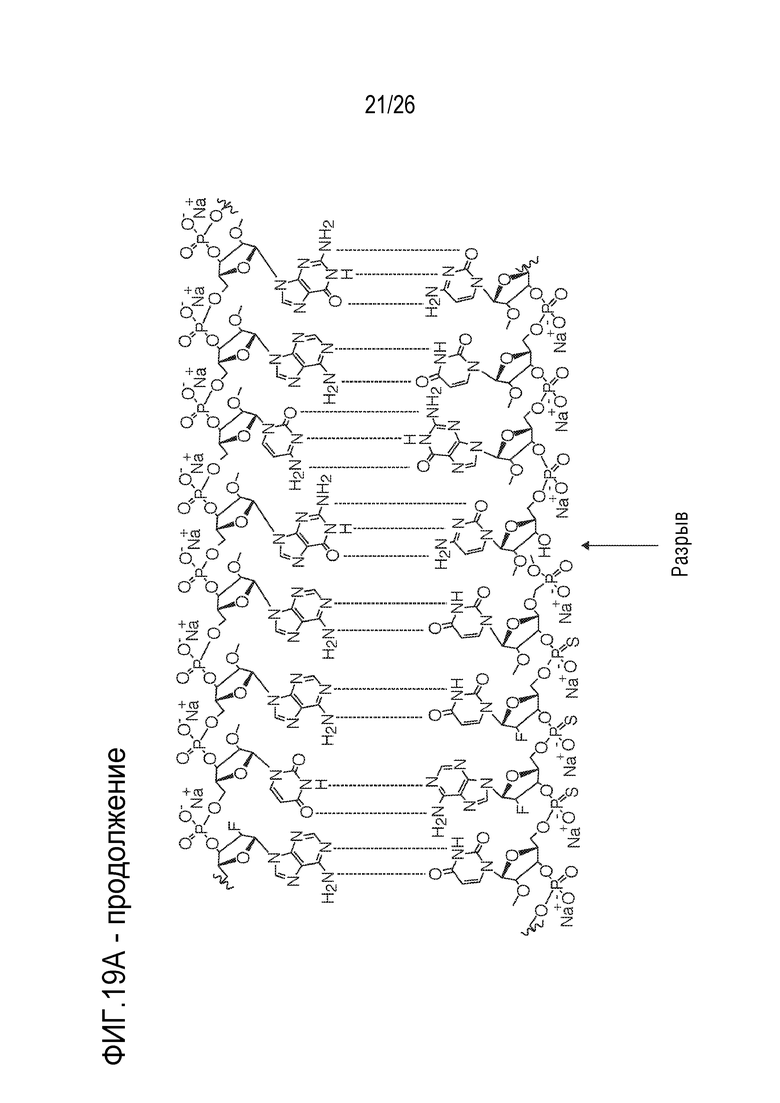
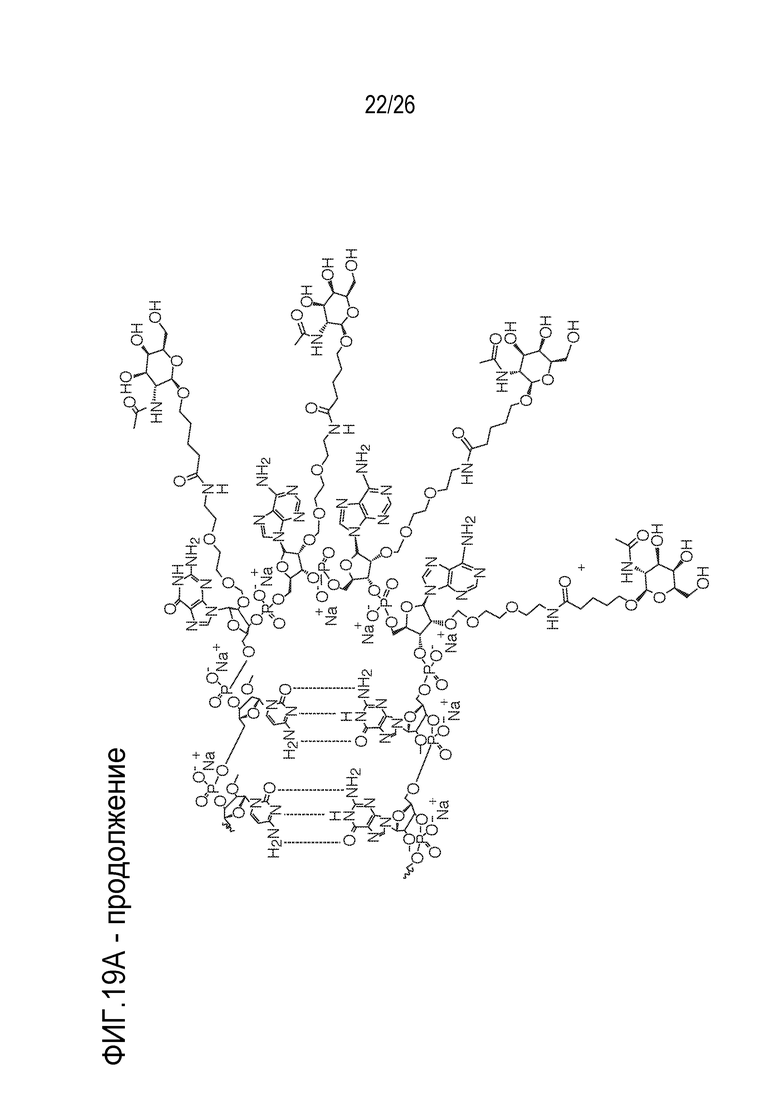
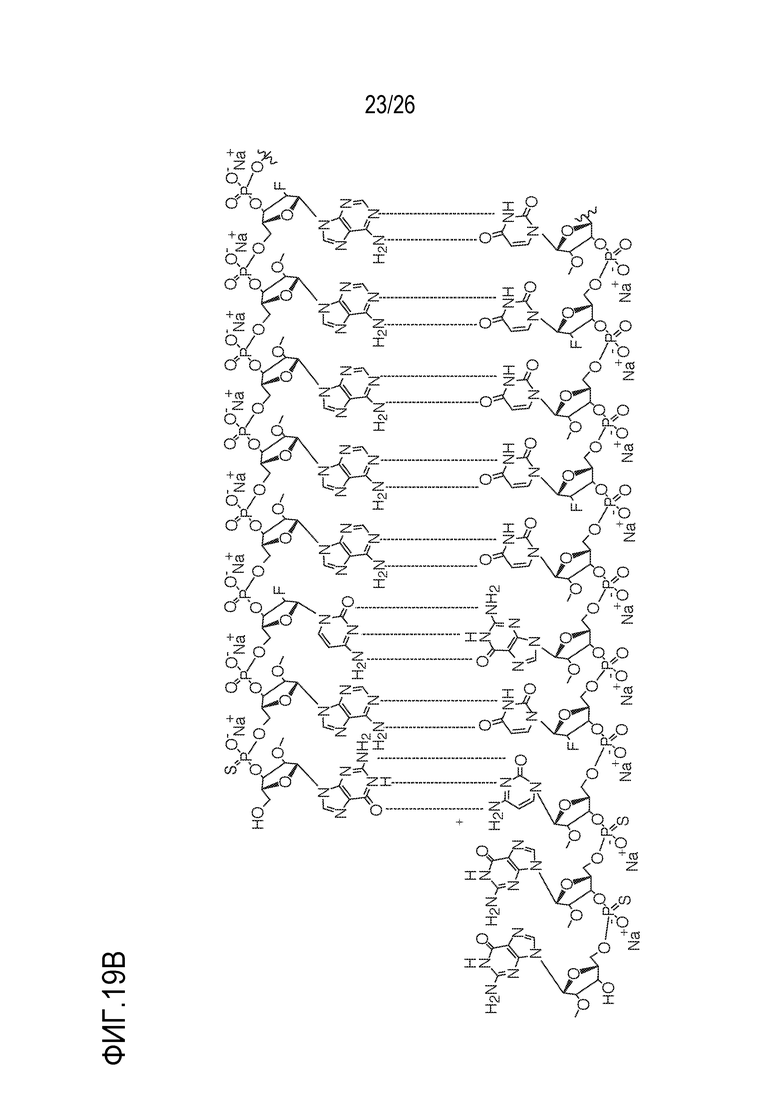
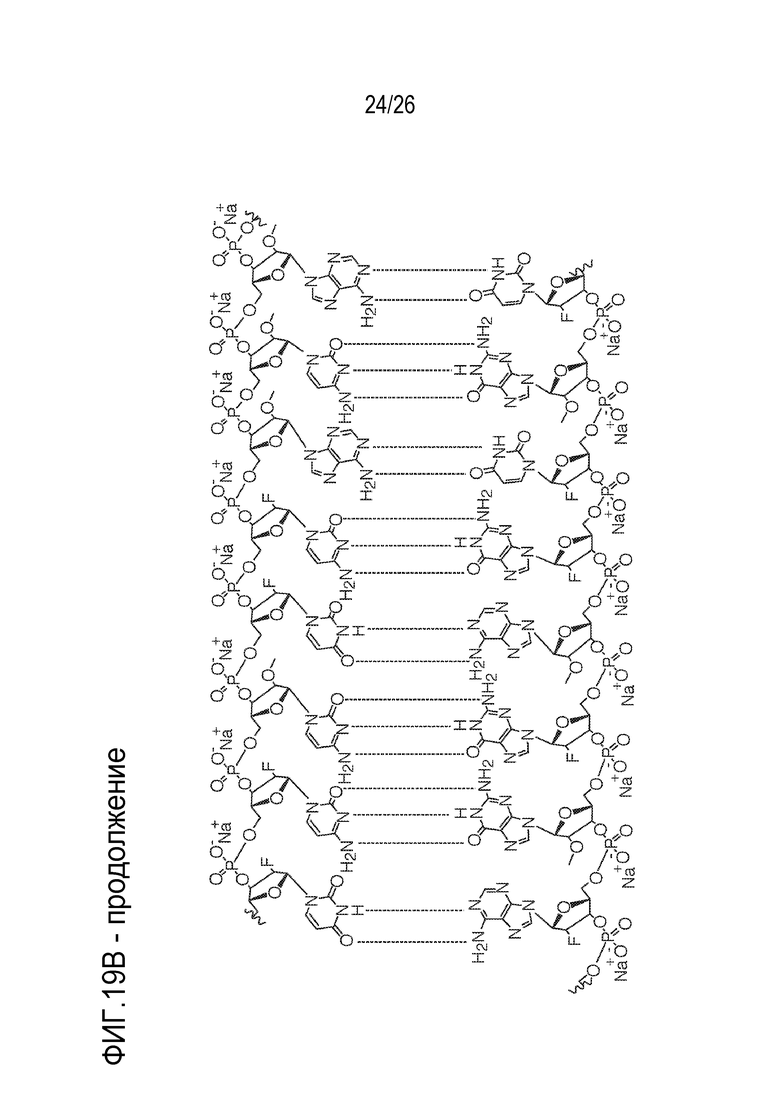
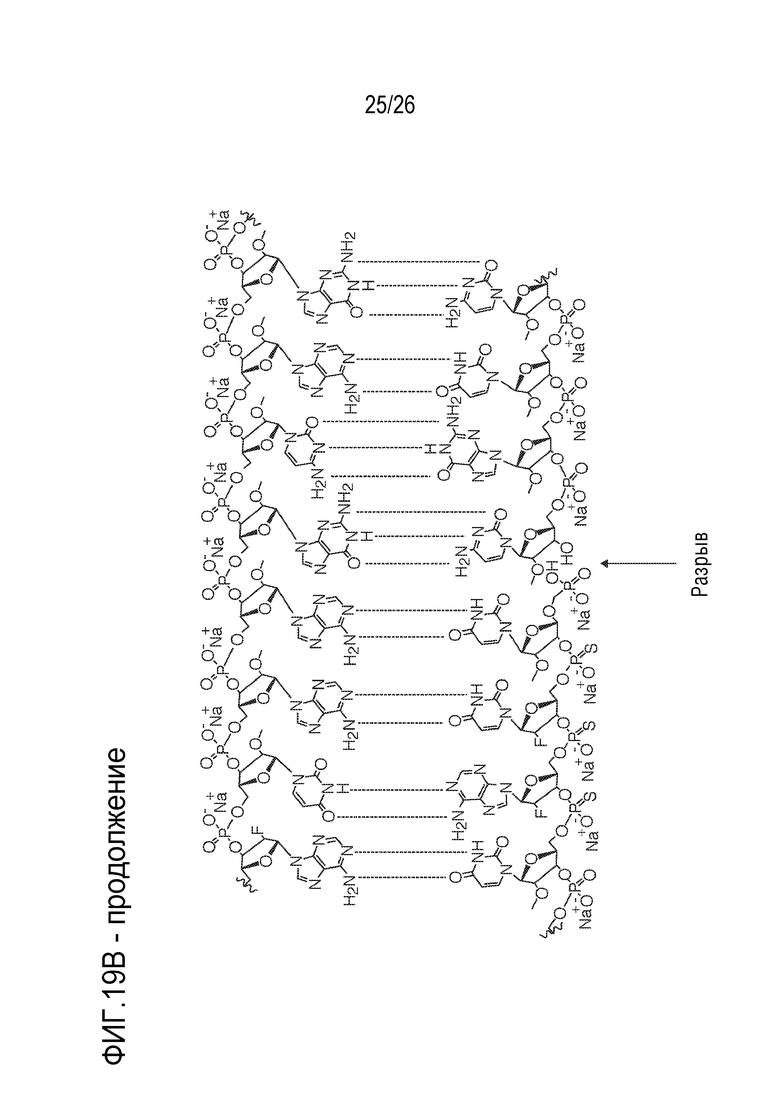
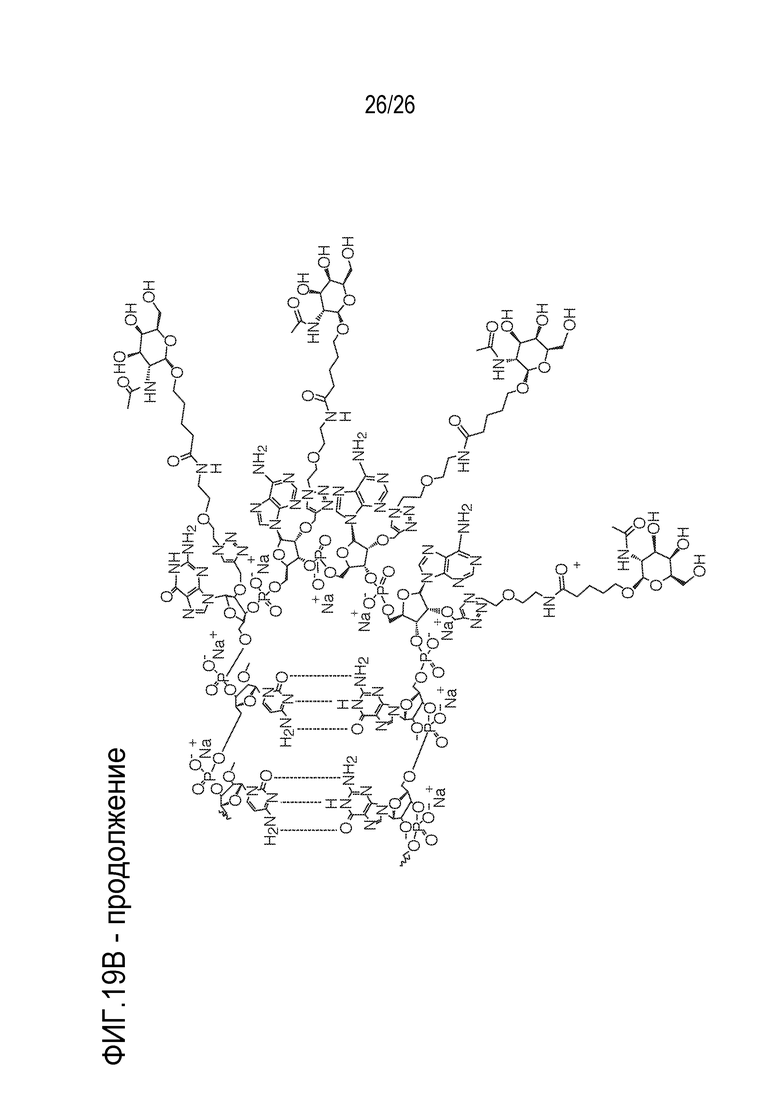
Настоящее изобретение относится к области биотехнологии, в частности к новым антисмысловым олигонуклеотидам, и может быть использовано в медицине. Изобретение раскрывает высокоэффективный модифицированный олигонуклеотид, который способен ингибировать экспрессию мРНК поверхностного антигена вируса гепатита В (HBsAg). Изобретение может быть применимо в медицинской практике для лечения инфекций, вызванных вирусом гепатита B(HBV). 6 н. и 19 з.п. ф-лы, 19 ил., 4 табл., 7 пр.
1. Олигонуклеотид для снижения экспрессии мРНК поверхностного антигена вируса гепатита В (HBsAg),
содержащий смысловую цепь, образующую дуплексную область с антисмысловой цепью,
где:
смысловая цепь состоит из последовательности, такой как GACAAAAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8) и содержащей
2'-фтормодифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17,
2'-O-метил-модифицированные нуклеотиды в положениях 1, 2, 4-7, 11, 14-16, 18-26 и 31-36, и
фосфоротиоатную связь между нуклеотидами в положениях 1 и 2,
где каждый из нуклеотидов последовательности -GAAA- смысловой цепи конъюгирован с моновалентным фрагментом GalNac; а
антисмысловая цепь состоит из последовательности, такой как
UUAUUGUGAGGAUUUUUGUCGG (SEQ ID NO: 5.1) и содержащей
2'-фтор-модифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19,
2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22, и
фосфоротиоатные связи между нуклеотидами в положениях 1 и 2, между нуклеотидами в положениях 2 и 3, между нуклеотидами в положениях 3 и 4, между нуклеотидами в положениях 20 и 21 и между нуклеотидами в положениях 21 и 22, и
где 4'-углерод сахара 5'-нуклеотида антисмысловой цепи включает метоксифосфонат (MOP).
2. Олигонуклеотид по п.1, в котором 5'-нуклеотид антисмысловой цепи имеет следующую структуру:
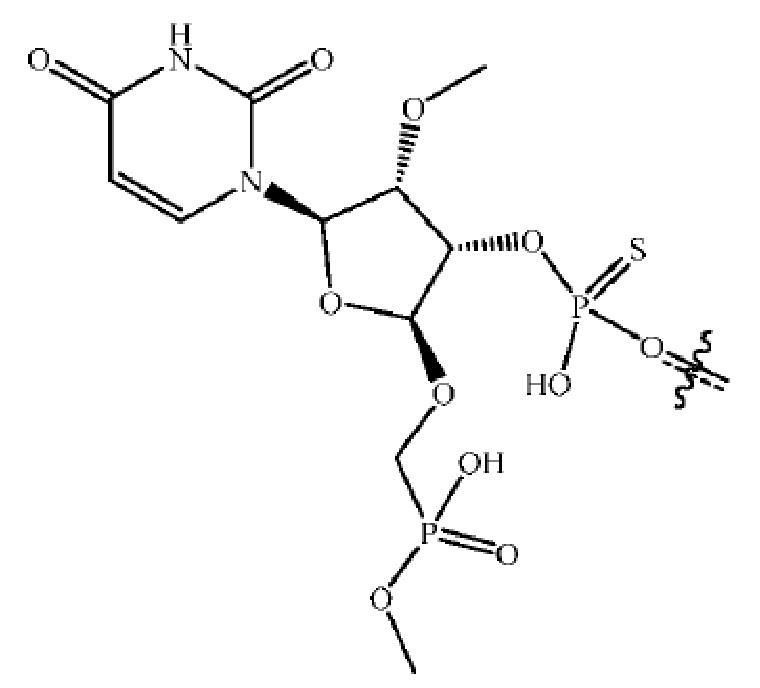
3. Олигонуклеотид по п.1 или 2, где последовательность -GAAA- содержит структуру:

где:
L представляет собой связь, клик-химическую защёлку или линкер длиной от 1 до 20 включительно последовательных ковалентно связанных атомов в длину, выбранный из группы, состоящей из замещенного и незамещенного алкилена, замещенного и незамещенного алкенилена, замещенного и незамещенного алкинилена, замещенного и незамещенного гетероалкилена, замещенного и незамещенного гетероалкенилена, замещенного и незамещенного гетероалкинилена и комбинации таковых; а также
Х представляет собой О или S.
4. Олигонуклеотид по п.3, где L представляет собой ацетальный линкер.
5. Олигонуклеотид по п.3 или 4, где Х представляет собой О.
6. Олигонуклеотид по любому из пп.1-5, где последовательность -GAAA- содержит структуру:
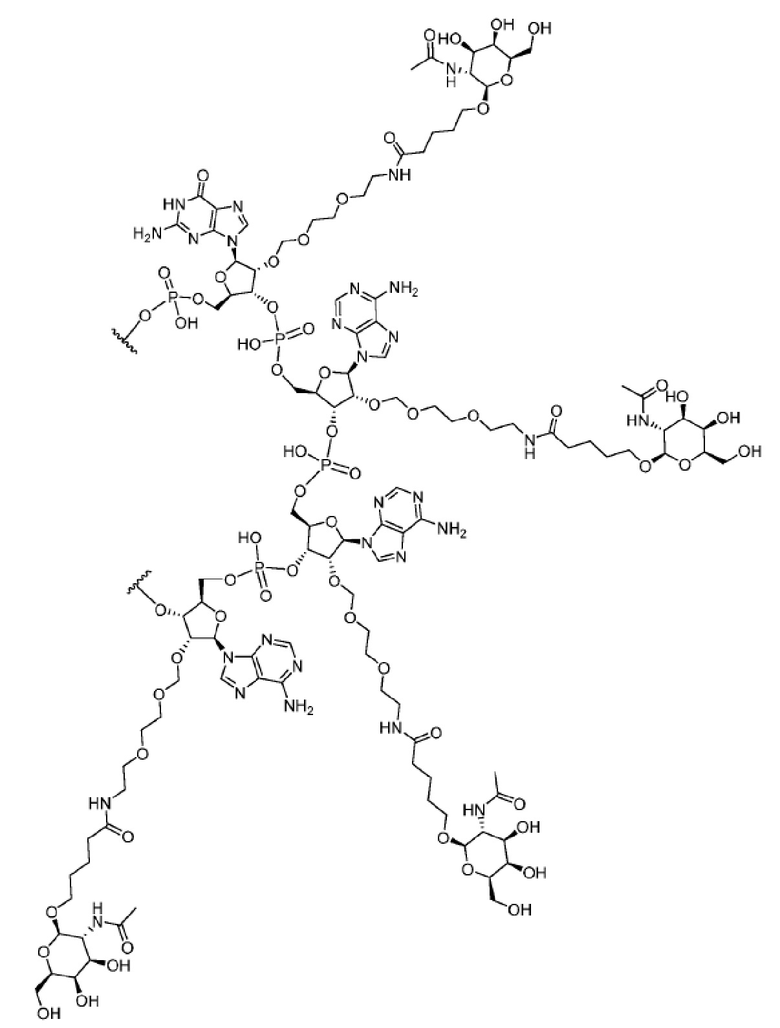 .
.
7. Олигонуклеотид для снижения экспрессии мРНК поверхностного антигена вируса гепатита В (HBsAg), содержащий смысловую цепь, образующую дуплексную область с антисмысловой цепью, где:
смысловая цепь состоит из последовательности, такой как
GACAAAAAUCCUCACAAUAAGCAGCCGAAAGGCUGC (SEQ ID NO: 8) и содержащей
2'-фтормодифицированные нуклеотиды в положениях 3, 8-10, 12, 13 и 17,
2'-O-метил-модифицированные нуклеотиды в положениях 1, 2, 4-7, 11, 14-16, 18-26 и 31-36, и
одну фосфоротиоатную межнуклеотидную связь между нуклеотидами в положениях 1 и 2,
где каждый из нуклеотидов последовательности -GAAA- смысловой цепи конъюгирован с моновалентным фрагментом GalNac, и где последовательность -GAAA- содержит структуру:
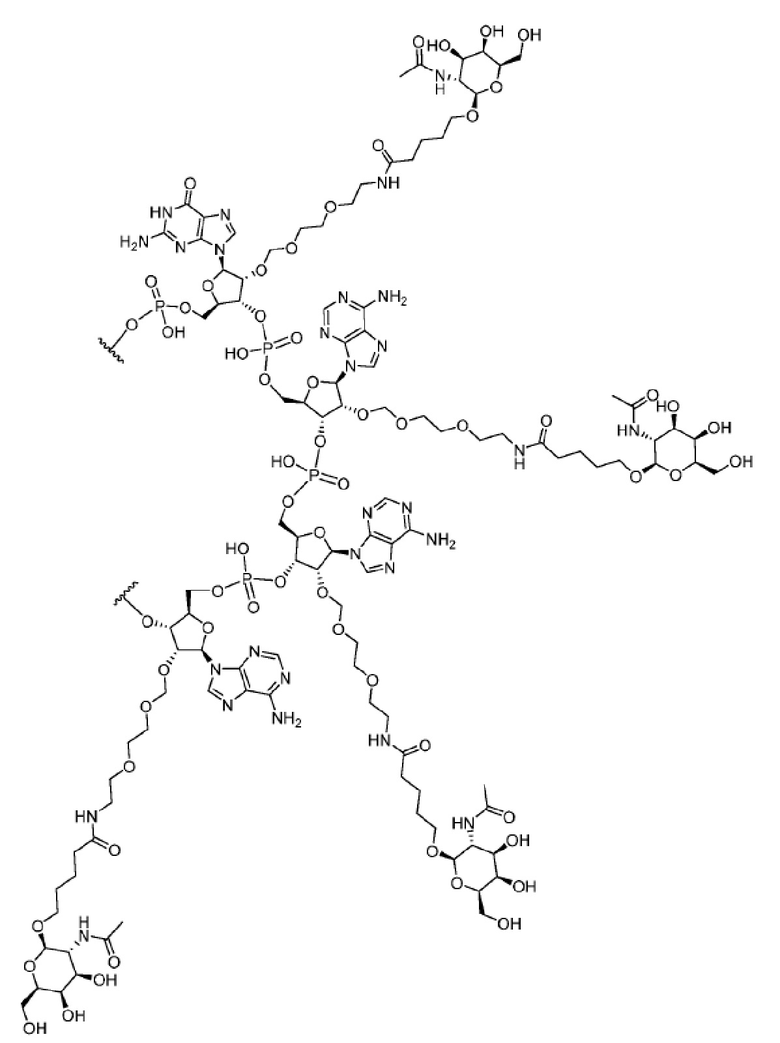 ; и
; и
антисмысловая цепь состоит из последовательности, такой как
UUAUUGUGAGGAUUUUUGUCGG (SEQ ID NO: 5.1) и содержащей
2'-фтор-модифицированные нуклеотиды в положениях 2, 3, 5, 7, 8, 10, 12, 14, 16 и 19,
2'-O-метил-модифицированные нуклеотиды в положениях 1, 4, 6, 9, 11, 13, 15, 17, 18 и 20-22, и
пять фосфоротиоатных межнуклеотидных связей между нуклеотидами в положениях 1 и 2, между нуклеотидами в положениях 2 и 3, между нуклеотидами в положениях 3 и 4, между нуклеотидами в положениях 20 и 21 и между нуклеотидами в положениях 21 и 22,
где 5'-нуклеотид антисмысловой цепи имеет следующую структуру:
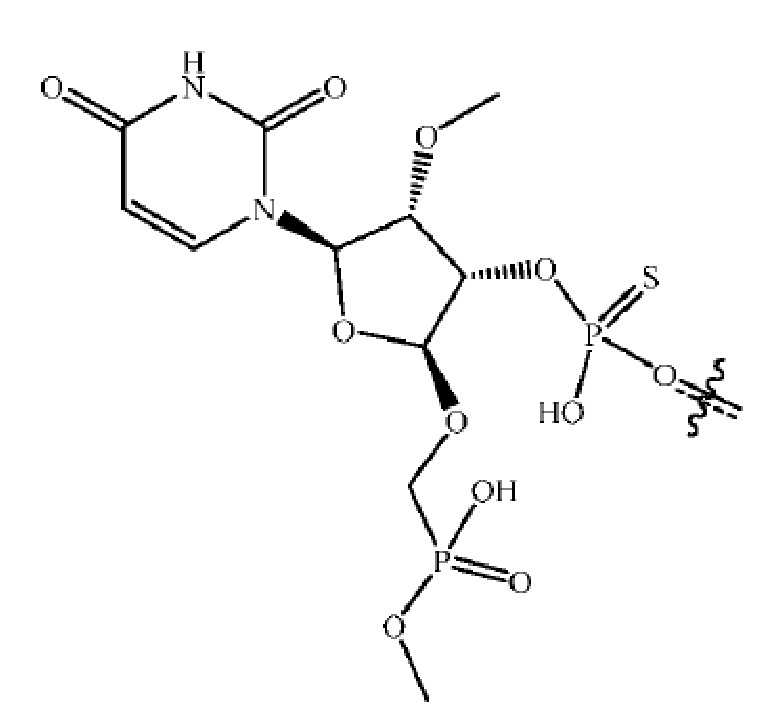 .
.
8. Двухцепочечный олигонуклеотид для снижения экспрессии мРНК поверхностного антигена вируса гепатита В (HBsAg), содержащий смысловую цепь:
5’ mG–S–mA–fC–mA–mA–mA–mA–fA–fU–fC–mC–fU–fC–mA– mC–mA–fA–mU–mA–mA–mG–mC–mA–mG–mC–mC–[ademG–GalNAc]–[ademA–GalNAc]–[ademA–GalNAc]–[ademA–GalNAc]–mG–mG–mC–mU–mG–mC 3’, и
антисмысловую цепь:
5’ [MePhosphonate–4O–mU]–S–fU–S–fA–S–mU–fU–mG–fU– fG–mA–fG–mG–fA–mU–fU–mU–fU–mU–mG–fU–mC–S–mG–S–mG 3’,
в которой:
«—» между нуклеозидами представляют собой фосфодиэфирную межнуклеозидную связь;
«–S–» между нуклеозидами представляют собой фосфоротиоатную межнуклеозидную связь;
mA представляет собой 2'-O-метиладенозинрибонуклеозид;
mG представляет собой 2'-O-метилгуанозинрибонуклеозид;
mC представляет собой 2'-O-метилцитидинрибонуклеозид;
mU представляет собой 2'-O-метилуридинрибонуклеозид;
fA представляет собой 2'-фтораденозин дезоксирибонуклеозид;
fG представляет собой 2'-фторгуанозин дезоксирибонуклеозид;
fC представляет собой 2'-фторцитидин дезоксирибонуклеозид;
fU представляет собой 2'-фторуридиндезоксирибонуклеозид;
[ademG-GalNAc] представляет собой 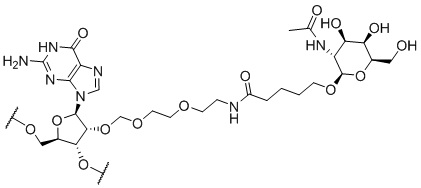 ;
;
[ademA-GalNAc] представляет собой 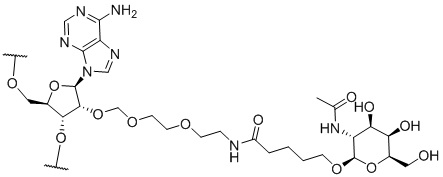 ; и
; и
[MePhosphonate-4O-mU] представляет собой 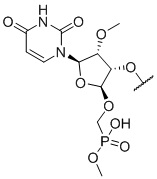 .
.
9. Двухцепочечный олигонуклеотид по п.8, имеющий следующую формулу: 
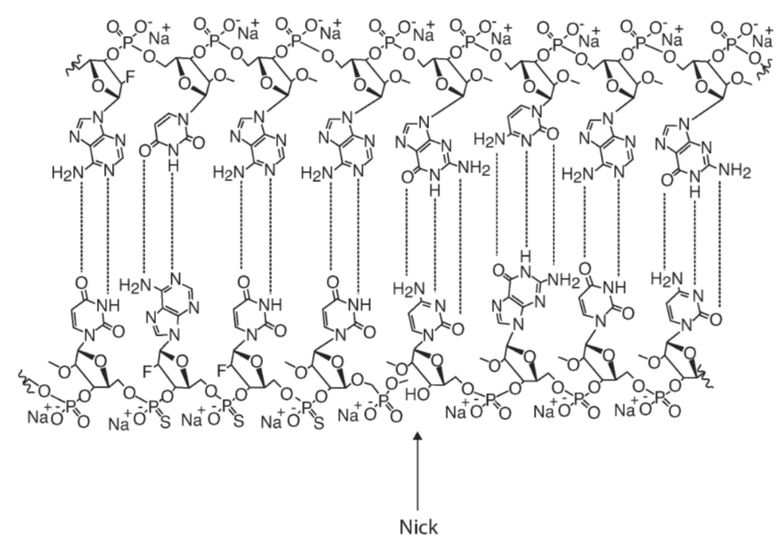
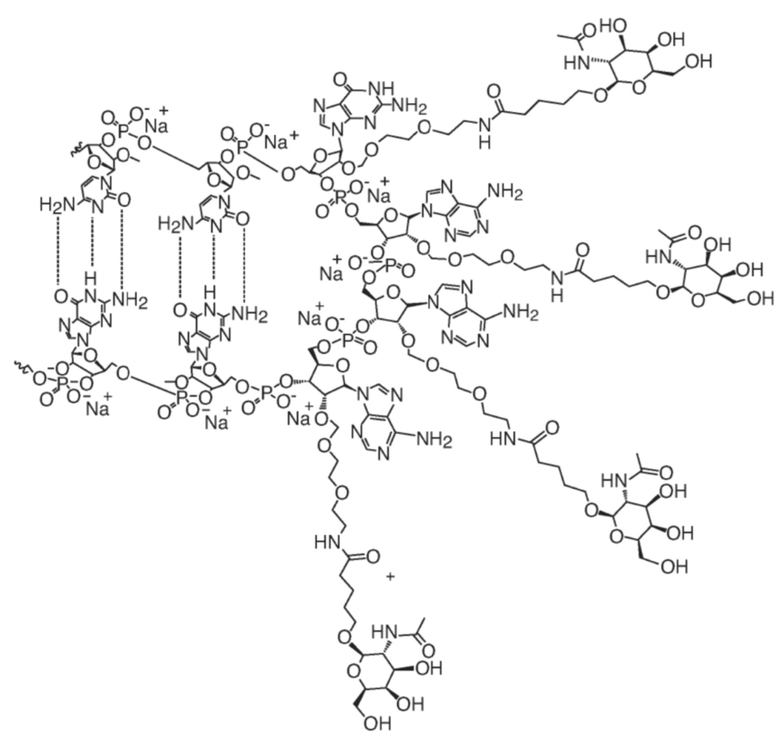
10. Композиция для снижения экспрессии мРНК поверхностного антигена вируса гепатита В (HBsAg), содержащая эффективное количество олигонуклеотида по любому из пп.1-9.
11. Композиция по п.10, содержащая противоион.
12. Композиция по п.10 или 11, содержащая фармацевтически приемлемый носитель.
13. Композиция по любому из пп.10-12, содержащая эксципиент.
14. Композиция по любому из пп.10-13, содержащая фосфатно-солевой буферный раствор.
15. Способ снижения in vitro экспрессии поверхностного антигена вируса гепатита B (HBV) (HBsAg) в клетке, включающий доставку в клетку олигонуклеотида по любому из пп.1-9.
16. Способ по п.15, где клетка представляет собой гепатоцит.
17. Применение олигонуклеотида по любому из пп.1-9 или композиции по любому из пп.10-14 для лечения инфекции HBV у субъекта.
18. Применение по п.17, где олигонуклеотид или композицию вводят субъекту подкожно.
19. Применение по п.17, где олигонуклеотид или композицию вводится субъекту внутривенно.
20. Применение по п.17, где композиция содержит фармацевтически приемлемый носитель, где фармацевтически приемлемый носитель представляет собой растворитель или дисперсионную среду, содержащую воду.
21. Применение по любому из пп.17-20, где субъект является положительным по е-антигену HBV (HbeAg) пациентом.
22. Применение по п.21, где HbeAg-положительный пациент имеет сывороточный поверхностный антиген HBV (HbsAg) >1000 МЕ/мл.
23. Применение по любому из пп.17-20, где субъектом является HbeAg-отрицательный пациент.
24. Применение по п.23, где HbeAg-отрицательный пациент имеет HBsAg в сыворотке >500 МЕ/мл.
25. Применение по любому из пп. 17-20, где субъект имеет ДНК HBV в сыворотке >20000 МЕ/мл.
| US 20100323001 A1, 23.12.2010 | |||
| WO 20160777321 A1, 19.05.2016 | |||
| WO 2004078181 A1, 16.09.2004 | |||
| US 8809293 B2, 19.08.2014 | |||
| WO 2012145697 A1, 26.10.2012 | |||
| US 20160369279 A1, 22.12.2016 | |||
| Способ разделения топливных остатков | 1926 |
|
SU6762A1 |
Авторы
Даты
2022-09-19—Публикация
2018-10-19—Подача