ОБЛАСТЬ ТЕХНИКИ
Желудочно-кишечный тракт (ЖКТ) у людей относится к желудку и кишечнику и иногда и ко всем структурам ото рта до заднего прохода. Верхний желудочно-кишечный тракт состоит из пищевода, желудка и двенадцатиперстной кишки. Некоторые источники также включают полость рта и глотку. Точное разграничение между «верхним» и «нижним» может варьироваться. При полном вскрытии двенадцатиперстная кишка может казаться единым органом, но она часто делится на две части в зависимости от функции, артериального снабжения или эмбриологии. Неотъемлемой частью желудочно-кишечного тракта является поджелудочная железа и печень, называемые вспомогательными органами желудочно-кишечного тракта.
Нижний желудочно-кишечный тракт включает в себя большую часть тонкой кишки и всю толстую кишку. Согласно некоторым источникам, он также включает задний проход. Кишечник - или кишка - разделен на тонкую кишку и толстую кишку. Тонкая кишка состоит из трех частей: i) двенадцатиперстной кишки, где пищеварительные соки из поджелудочной железы и печени смешиваются вместе, ii) тощей кишки, которая является средней частью кишечника, соединяющей двенадцатиперстную кишку с подвздошной кишкой, и iii) подвздошной кишки, которая имеет ворсинки, в которых абсорбируются все растворимые молекулы в кровь. Толстая кишка также состоит из трех частей: i) слепая кишка, где червеобразный отросток прикреплен к слепой кишке, ii) толстая кишка, которая состоит из восходящей толстой кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидного изгиба, и iii) прямая кишка.
Кишечник выполняет две основные функции: переваривание и усвоение питательных веществ, и поддержание барьера против внешней среды. Он также образует самый большой эндокринный орган в организме, а также самую большую и сложную часть иммунной системы. У взрослого человека площадь кишечной поверхности большая, около 100 м2. Эта большая область постоянно подвергается воздействию различных антигенов в форме пищевых компонентов, нормальной микрофлоры кишечника и патогенов.
Поверхность слизистой оболочки кишечника, также называемая в данном документе «кишечной тканью», выстлана одним слоем эпителиальных клеток (ЭИК), которые непрерывно и быстро заменяются репликацией недифференцированных клеток в крипте (7×106 клеток/мин). Эпителиально-клеточный слой слизистой оболочки кишечника очень сложен и уникален. Он выделяет пищеварительные ферменты из апикальной части в полость для пищеварения. Он также секретирует различные белки от второй половины до собственной пластинки (СП). Кроме того, указанные эпителиальные клетки получают сигналы как из полости (и затем передают информацию в различные популяции клеток в СП), так и из базолатеральной стороны. На базолатеральной стороне кишечные эпителиальные клетки (ЭИК) получают множество сигналов от различных иммунных клеток, нервных клеток и стромальных клеток. На сигналы с обеих сторон влияет их микроокружение, влияющее на функциональные состояния, поведение и структуру энтероцитов, что приводит к целостности и гомеостазу желудочно-кишечного тракта.
Защита эпителиального барьера гарантируется соединительными комплексами, состоящими из плотных соединений (ПС) и адгезивных соединений (АС), которые герметизируют эпителиальные клетки и путем образования слизи. Слизь, вырабатываемая также специализированными эпителиальными клетками, а именно бокаловидными клетками, обеспечивает первую линию защиты от физических и химических повреждений, вызванных употреблением пищи, микробов и бактериальных продуктов. Повреждение любой части желудочно-кишечного тракта, в том числе бокаловидных клеток, может привести к нарушению кишечного барьера, позволяя проникнуть содержимому полости в стенку кишечника и вызвать хроническое воспаление, включая воспаление желудочно-кишечного тракта. Существует потребность в новых композициях и способах профилактики и лечения заболеваний и расстройств, связанных с кишечной проницаемостью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предлагаются композиции и способы для профилактики и лечения заболеваний и расстройств, связанных с кишечной проницаемостью, включая воспаление желудочно-кишечного тракта, включающие введение в желудочно-кишечный тракт, нуждающегося в этом субъекта, терапевтически и гомеостатически эффективного количества гидрогеля, предпочтительно гидрогеля, имеющего модуль упругости (G'), как определено в данном документе, по меньшей мере, около 500 Па, предпочтительно от около 500 Па до около 8000 Па и более предпочтительно от около 500 Па до около 10000 Па.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Файл патента или заявки содержит, по меньшей мере, один рисунок, выполненный в цвете. Копии этого патента или публикации патентной заявки с цветными рисунками будут предоставлены ведомством по запросу и уплате необходимой пошлины.
На Фиг. 1 изображена окрашенная тощая кишка контрольных мышей и мышей, обработанных гидрогелем по изобретению, окрашенная Alcian Blue-PAS для визуализации слизи.
На Фиг. 2 изображена окрашенная подвздошная кишка контрольных мышей и мышей, обработанных гидрогелем по изобретению, окрашенная Alcian Blue-PAS для визуализации слизи.
На Фиг. 3 изображена окрашенная слепая кишка контрольных мышей и мышей, обработанных гидрогелем по изобретению, окрашенная Alcian Blue-PAS для визуализации слизи.
На Фиг. 4 изображены окрашенные толстые кишки контрольных мышей и мышей, обработанных гидрогелем по изобретению, окрашенные Alcian Blue-PAS для визуализации слизи.
На Фиг. 5 изображены окрашенные толстые кишки контрольных животных (диета без гидрогеля), окрашенные для соединения ZO-1 (ZO-1, компонент плотных соединений, выделен красным; CD34, маркер для кишечных сосудов выделен синим и DAPI для ядер выделен голубым).
На Фиг. 6 изображены толстые кишки животных, обработанные 8%-ым гелем В, окрашенные для соединения ZO-1.
Фиг. 7 изображает окрашенные толстые кишки контрольных животных и животных, обработанных 8%-ым гелем В.
Фиг. 8 изображает окрашенную подвздошную кишку контрольных животных (ZO-1, компонент плотных соединений, выделен красным; CD34, маркер кишечных сосудов выделен синим и маркер DAPI для ядер выделен голубым).
Фиг. 9 изображает окрашенную подвздошную кишку животных, обработанных 2%-ым гелем В.
Фиг. 10 изображает окрашенную подвздошную кишку животных, обработанных 4%-ым гелем В.
Фиг. 11 изображает окрашенную подвздошную кишку животных, обработанных 6%-ым гелем В.
Фиг. 12 изображает окрашенную подвздошную кишку животных, обработанных 8%-ым гелем В.
Фиг. 13 изображает образцы тканей толстой кишки человека, обработанные средой, PBS, гель В-01, гель В-02, гель В-03 или гель В-04, окрашенных Alcian Blue-PAS для визуализации слизи.
Фиг. 14 изображает график, показывающий изменение массы в процентах от массы тела мышей, которых кормили диетой Chow, диетой с добавлением 2%-ого GelB-02 и диетой с добавлением 4%-ого GelB-02; n=5 на группу (*** Р<0,01, рассчитанное по двухстороннему ANOVA).
Фиг. 15 изображает длину толстой кишки в сантиметрах на 9 день у мышей, которых кормили диетой Chow, диетой с добавлением 2%-ого GelB-02 и диетой с добавлением 4%-ого GelB-02; n=5 на группу (*Р<0,05; *** Р<0,01, рассчитанное по одностороннему ANOVA).
Фиг. 16 изображает срезы толстой кишки мышей, инкубированных различными гидрогелями СМС/СА с различными уровнями эластичности, окрашенными для визуализации слизи (Alcian Blue/PAS и Ki67 IHC).
Фиг. 17 изображает окрашенные срезы толстой кишки мышей, инкубированных различными гидрогелями СМС/СА с различными уровнями эластичности или гидрогелями СМС/ПЭГДЭ со сравнимой эластичностью с гидрогелями СМС/СА.
Фиг. 18 изображает окрашенные срезы толстой кишки мышей, инкубированных с различными гидрогелями СМС/СА с различными уровнями эластичности или гидрогелями ПЭГДА с эластичностью сравнимой с гидрогелями СМС/СА.
Фиг. 19 изображает окрашенные срезы толстой кишки мышей, инкубированных различными несшитыми волокнами с различными уровнями эластичности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как используется в данном документе, формы единственного числа включают ссылки на множественное ссылки, если контекст явно не предписывает иное. Таким образом, например, ссылка на «биомаркер» включает в себя множество таких биомаркеров.
Для целей настоящего изобретения под «желудочно-кишечным трактом» или «ЖК трактом» понимают желудок, тонкую кишку (двенадцатиперстную кишку, тощую кишку, подвздошную кишку), толстую кишку (слепую кишку, толстую кишку, прямую кишку) и задний проход. Нижний желудочно-кишечный тракт включает в себя большую часть тонкой кишки и всю толстую кишку. Согласно некоторым источникам, он также включает задний проход. «Кишечник» делится на тонкую и толстую кишку. Тонкая кишка состоит из трех частей: i) двенадцатиперстной кишки, где пищеварительные соки из поджелудочной железы и печени смешиваются вместе, ii) тощей кишки, которая является срединной частью кишечника, соединяющей двенадцатиперстную кишку с подвздошной кишкой, и iii) подвздошной кишки, которая имеет ворсинки, в которых абсорбируются все растворимые молекулы в кровь. Толстая кишка также состоит из трех частей: i) слепая кишка, где червеобразный отросток прикреплен к слепой кишке, ii) ободочная кишка, которая состоит из восходящей ободочной кишки, поперечной ободочной кишки, нисходящей ободочной кишки и сигмовидного изгиба, и iii) прямая кишка. Используемые в данном документе ткани, выстилающие желудочно-кишечный тракт, могут относиться к «кишечной ткани», «поверхности слизистой оболочки», «слизистой ткани» или «слизистой оболочке».
Термин «заболевание или расстройство, связанное с кишечной проницаемостью» относится к заболеванию или расстройству, которое связано с нарушением кишечной проницаемости, которое увеличивается по сравнению с нормальной проницаемостью и приводит к потере кишечного гомеостаза, функционального нарушения и заболевания. Субъект может быть идентифицирован как страдающий нарушенной кишечной проницаемостью путем измерения кишечной проницаемости у субъекта с использованием известных анализов проницаемости кишечника и/или оценки маркеров целостности эпителия, включая молекулы адгезии, биомаркеры иммунитета или воспаления или бактериальные маркеры, такие как эндотоксин (Bischoff et al., ВС Gastroenterology 2014, 14:189). Субъект также может быть идентифицирован как страдающий нарушенной кишечной проницаемостью при постановке диагноза у субъекта с заболеванием или нарушением, связанным с кишечной проницаемостью, таким, как описано в данном документе.
«Терапевтически эффективное количество», или «эффективное количество», или «терапевтически эффективное», как используется в данном документе, относится к тому количеству, которое обеспечивает терапевтический эффект для данного состояния и схемы введения; например, количество, достаточное для поддержания здоровой эпителиальной ткани кишечника, предотвращения повреждения здоровой эпителиальной ткани кишечника в результате, например, заболеваний, связанных с проницаемостью кишечника или неблагоприятных побочных действий лекарств, восстановления и регенерации кишечной ткани и/или уменьшения патологии, признаки или симптомы заболеваний или расстройств, связанных с кишечной проницаемостью, таких как воспаление в желудочно-кишечном тракте. Это заданное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта в комбинации с необходимой добавкой и разбавителем, то есть носителем или носителем для введения. Кроме того, оно предназначено для обозначения количества, достаточного для уменьшения или предотвращения клинически значимого дефицита активности, функции и реакции пациента. Альтернативно, терапевтически эффективное количество является достаточным для того, чтобы вызвать улучшение клинически значимого состояния у пациента. Как понятно специалистам в данной области, количество соединения может варьироваться в зависимости от его специфической активности. Подходящие дозированные количества могут содержать заранее определенное количество активной композиции, рассчитанное для получения желаемого терапевтического эффекта в комбинации с требуемым разбавителем.
«Субъект» или «пациент» относится к человеку, примату, низшему примату, лабораторному животному, сельскохозяйственному животному, домашнему скоту или домашнему питомцу.
Термин «лечить» или «лечение» относится к медицинскому ведению пациента с намерением излечить, улучшить, стабилизировать или предотвратить заболевание, патологическое состояние или расстройство. Данный термин включает активное лечение, то есть лечение, направленное конкретно на улучшение состояния при заболевании, патологическом состоянии или расстройстве, и также включает причинное лечение, то есть лечение, направленное на устранение причины ассоциированного заболевания, патологического состояния или расстройства. Кроме того, данный термин включает паллиативное лечение, то есть лечение, предназначенное для облегчения симптомов, а не лечения заболевания, патологического состояния или расстройства; профилактическое лечение, то есть лечение, направленное на минимизацию или частичное или полное ингибирование развития ассоциированного заболевания, патологического состояния или расстройства; и поддерживающее лечение, то есть лечение, применяемое для дополнения другой специфической терапии, направленной на улучшение ассоциированного заболевания, патологического состояния или расстройства.
Используемый в данном документе термин «гидрогель» представляет собой гидрофильный полимер или комбинацию двух или более гидрофильных полимеров, которые способны удерживать большой относительный объем водного раствора. Гидрогели могут быть разветвленными или линейными или смесью разветвленных и линейных полимеров, например, около 1, 2, 3, 4, 5, 10, 15, 20, 30, 40, 50, 60, 70, 80, 90, 95, 96, 97, 98, 99 или 100% (вес/вес) линейный или разветвленный. В предпочтительных вариантах реализации гидрофильный полимер или полимеры сшиты, например, посредством физических, ионных или ковалентных связей. Гидрогели могут иметь различные количества сшивок в зависимости от желаемых физических свойств гидрогеля. Предпочтительно, гидрогели, используемые в способах изобретения, имеют эластичные свойства, которые оптимизированы для лечения или профилактики заболеваний и нарушений, связанных с кишечной проницаемостью, в соответствии с изобретением. Эластичные свойства гидрогелей, используемых в способах изобретения, связаны с их макромолекулярной структурой, включая степень сшивания, тип сшивающего агента, молекулярную массу и структуру основной цепи. Предпочтительно, гидрогель не включает пластификатор. Подходящие гидрогели, используемые в способах изобретения, включают те, которые описаны в патентах США №9,353,191 и 8,658,147, и в патентной публикации США: 2016/0222134 и заявке на патент США №15/944,960, содержание каждого из которых включено в настоящий документ посредством ссылки в полном объеме.
Используемый в данном документе термин «гидрофильный полимер» относится к полимеру, который является по сути водорастворимым и, предпочтительно, включает мономерные звенья, которые гидроксилированы. Гидрофильный полимер может представлять собой гомополимер, который включает только одно повторяющееся мономерное звено, или сополимер, содержащий два или более различных повторяющихся мономерных звеньев. В определенных вариантах реализации гидрофильный полимер представляет собой аддитивный полимер или конденсационный полимер. Часть или все повторяющиеся звенья гидрофильного полимера содержат полярную функциональную группу, например, кислотную, основную или нейтральную гидрофильную функциональную группу, например, гидроксил; карбоксил; сульфонат, фосфонат; гуанидин; амандин; первичный, вторичный или третичный амин; или четвертичный аммоний. В предпочтительном варианте реализации гидрофильный полимер является гидроксилированным, таким как полиаллиловый спирт, поливиниловый спирт или полисахарид. Примеры подходящих полисахаридов включают модифицированные целлюлозы, включая замещенные целлюлозы, замещенные декстраны, крахмалы и замещенные крахмалы, гликозаминогликаны, хитозан и альгинаты.
В некоторых вариантах реализации гидрогель содержит сшитый аддитивный полимер, такой как сшитый полиакрилат, сшитый полиметакрилат или сшитый сополимер либо аркрилата, либо метакрилата с нейтральным мономером, таким как акриламид или метакриламид. Такие полимеры и сополимеры могут быть поперечносшиты с использованием способов, известных в данной области техники. В некоторых вариантах реализации гидрогель содержит полиэтиленгликоль диакрилат (ПЭГДА). Предпочтительно средняя молекулярная масса ПЭГДА составляет от около 250 Да до около 20000 Да. Предпочтительно средняя молекулярная масса ПЭГДА составляет 250 Да, 575 Да, 700 Да, 750 Да, 1000 Да, 2000 Да, 6000 Да, 10000 Да или 20000 Да.
Полисахариды, которые можно использовать в гидрогелях изобретения, включают модифицированные целлюлозы, такие как сложные эфиры и простые эфиры целлюлозы. Сложные эфиры целлюлозы включают ацетатцеллюлозу, пропионатацетатцеллюлозу и бутиратацетатцеллюлозу. Простые эфиры целлюлозы включают алкилцеллюлозы, такие как С1-С6-алкилцеллюлозы, включая метилцеллюлозу, этилцеллюлозу и н-пропилцеллюлозу; замещенные алкилцеллюлозы, включая гидрокси-С1-С6-алкилцеллюлозы и гидрокси-С1-С6-алкил-С1-С6-алкилцеллюлозы, такие как гидроксиэтилцеллюлоза, гидрокси-н-пропилцеллюлоза, гидрокси-н-бутилцеллюлоза, гидроксипропилметилцеллюлоза, этилгидроксиэтилцеллюлоза и карбоксиметилцеллюлоза; крахмалы и замещенные крахмалы, такие как кукурузный крахмал, гидроксипропилкрахмал и карбоксиметилкрахмал; замещенные декстраны, такие как декстрансульфат, декстранфосфат и диэтиламинодекстран; гликозаминогликаны, включая гепарин, гиалуронан, хондроитин, хондроитинсульфат и гепарансульфат; и полиуроновые кислоты, такие как полиглюкуроновая кислота, полимануроновая кислота, полигалактуроновая кислота и полиарабиновая кислота.
Используемый в данном документе термин «ионный полимер» относится к полимеру, содержащему мономерные звенья, имеющие кислотную функциональную группу, такую как карбоксильная, сульфатная, сульфонатная, фосфатная или фосфонатная группа, или основную функциональную группу, такую как аминогруппу, замещенную аминогруппу или гуанидильную группу. В водном растворе при подходящем интервале рН ионный полимер, содержащий кислотные функциональные группы, будет полианионом, и такой полимер упоминается в данном документе как «анионный полимер». Аналогично, в водном растворе при подходящем диапазоне рН ионный полимер, содержащий основные функциональные группы, будет поликатионом. Такой полимер упоминается в данном документе как «катионный полимер». Используемые в данном документе термины ионный полимер, анионный полимер и катионный полимер относятся к гидрофильным полимерам, в которых кислотные или основные функциональные группы не заряжены, а также к полимерам, в которых некоторые или все кислотные или основные функциональные группы заряжены, в комбинация с подходящим противоионом. Подходящие анионные полимеры включают альгинат, декстрансульфат, карбоксиметилцеллюлозу, гиалуроновую кислоту, полиглюкуроновую кислоту, полимануроновую кислоту, полигалактуроновую кислоту, полиарабиновую кислоту; хрондроитинсульфат и декстранфосфат. Подходящие катионные полимеры включают хитозан и диметиламинодекстран. Предпочтительным ионным полимером является карбоксиметилцеллюлоза, которую можно использовать в кислотной форме или в виде соли с подходящим катионом, таким как натрий или калий.
Термин «неионный полимер», используемый в данном документе, относится к гидрофильному полимеру, который не содержит мономерных звеньев, имеющих ионизируемые функциональные группы, такие как кислотные или основные группы. Такой полимер будет незаряженным в водном растворе. Примерами подходящих неионогенных полимеров для использования в настоящем способе являются полиаллиловый спирт, поливиниловый спирт, крахмалы и замещенные крахмалы, такие как кукурузный крахмал и гидроксипропилкрахмал, маннаны, глюкоманнан, ацеманнаны, алкилцеллюлозы, такие как С1-С6-алкилцеллюлозы, включая метилцеллюлозу, этилцеллюлозу и н-пропилцеллюлозу; замещенные алкилцеллюлозы, включая гидрокси- C1-С6-алкилцеллюлозы и гидрокси- C1-С6-алкил- С1-С6-алкилцеллюлозы, такие как гидроксиэтилцеллюлоза (ГЭЦ), гидрокси-н-пропилцеллюлоза, гидрокси-н-бутилцеллюлоза, гидроксипропилметилцеллюлоза и этилгидроксиэтилцеллюлоза.
Предпочтительно гидрогели, используемые в способах изобретения, являются сшитыми. Сшивание может быть достигнуто либо с помощью ковалентного сшивания, либо нековалентного сшивания. Ковалентное сшивание может быть достигнуто с использованием бифункционального сшивающего агента (также называемого в данном документе бифункциональным «сшивателем») или путем прямой реакции функциональных групп на двух разных полимерных цепях. Типичные ковалентные сшиватели настоящего изобретения включают, например, гомобифункциональные сшиватели с реакционноспособными функциональными группами, такими как диглицидиловые эфиры, замещенные и незамещенные ди-N-гидроксисукцинимиды (NHS), диизоцианаты, дикислоты, диэфиры, хлорангидриды дикислот, дималеимиды, диакрилаты и тому подобное. Гетеробифункциональные сшиватели также могут быть использованы. Гетеробифункциональные сшиватели обычно включают молекулы, которые содержат различные реакционноспособные функциональные группы для осуществления сшивания, например, комбинацию NHS и малеимида, кислоты и эфира и т.д. Ковалентное сшивание также может быть достигнуто путем облучения гидрофильного полимера или комбинации гидрофильных полимеров, например рентгеновским излучением или электронным пучком.
Нековалентное сшивание, например, основанное на ионных связях, водородных связях, гидрофобных взаимодействиях и других внутримолекулярных ассоциациях, также предполагается для использования в практике изобретения.
Предпочтительные гидрогели изобретения сшивают с использованием сшивающего агента, такого как поликарбоновая кислота. Используемый в данном документе термин «поликарбоновая кислота» относится к органической кислоте, имеющей две или более функциональных карбоксильных групп, такой как дикарбоновые кислоты, трикарбоновые кислоты и тетракарбоновые кислоты, и также включает ангидридные формы таких органических кислот.Дикарбоновые кислоты включают щавелевую кислоту, малоновую кислоту, малеиновую кислоту, яблочную кислоту, янтарную кислоту, глутаровую кислоту, адипиновую кислоту, пимелиновую кислоту, суберовую кислоту, азелаиновую кислоту, себациновую кислоту, фталевую кислоту, о-фталевую кислоту, изофталевую кислоту, м-фталевую кислоту и терефталевую кислоту. Предпочтительные дикарбоновые кислоты включают С4-С12-дикарбоновые кислоты. Подходящие трикарбоновые кислоты включают лимонную кислоту, изолимонную кислоту, аконитиновую кислоту и пропан-1,2,3-трикарбоновую кислоту. Подходящие тетракарбоновые кислоты включают пиромеллитовую кислоту, 2,3,3',4'-бифенилтетракарбоновую кислоту, 3,3',4,4'-тетракарбоксидифениловый эфир, 2,3',3,4'-тетракарбоксидифениловый эфир, 3,3',4,4'-бензофенонететракарбоновую кислоту, 2,3,6,7-тетракарбоксинафталин, 1,4,5,7-тетракарбоксинафталин, 1,4,5,6-тетракарбоксинафталин, 3,3',4,4'-тетракарбоксидифенилметан, 2,2-бис(3,4-дикарбоксифенил)пропан, бутантетракарбоновую кислоту и циклопентантетракарбоновую кислоту. Особенно предпочтительной поликарбоновой кислотой является лимонная кислота.
Предпочтительно, гидрогель изобретения является ковалентносшитым. Предпочтительно гидрогель имеет модуль упругости (G') при набухании в ИЖС/вода (1:8), по меньшей мере, 500 Па, как определено в соответствии со способом, описанным в Примере 2. Предпочтительно, гидрогель изобретения имеет G' при набухании в ИЖС/вода (1:8), по меньшей мере, около 500 Па, предпочтительно, по меньшей мере, около 700, предпочтительно, по меньшей мере, около 800, предпочтительно, по меньшей мере, около 1000 Па, предпочтительно, по меньшей мере, около 1500 Па, предпочтительно, по меньшей мере, около 2000 Па предпочтительно, по меньшей мере, около 3000 Па, по меньшей мере, около 3500 Па, предпочтительно, по меньшей мере, около 4000 Па, предпочтительно, по меньшей мере, около 4500 Па, предпочтительно, по меньшей мере, около 5000 Па, предпочтительно, по меньшей мере, около 5500 Па, предпочтительно, по меньшей мере, около 6000 Па, предпочтительно, по меньшей мере, около 6500 Па, предпочтительно, по меньшей мере, около 7000 Па, предпочтительно, по меньшей мере, около 7500 Па, предпочтительно, по меньшей мере, около 8000 Па, предпочтительно, по меньшей мере, около 8500 Па. Предпочтительно, гидрогель представляет собой сшитую карбоксиметилцеллюлозу, имеющую G' при набухании в ИЖС/вода (1:8) от около 500 Па до около 1500 Па, от около 500 Па до около 800 Па, от около 500 Па до около 1000 Па, от около 1500 Па до около 8000 Па, от около 5000 Па до около 8000 Па, от около 5000 Па до около 5500 Па, от около 6000 Па до около 8000 Па или от около 6500 Па до около 8000 Па.
Предпочтительно, ковалентносшитый гидрогель изобретения имеет модуль упругости (G') при набухании в ИЖС/вода (1:8), по меньшей мере, от около 500 Па до около 10000 Па, предпочтительно, по меньшей мере, от около 600 Па до около 9000 Па, предпочтительно, по меньшей мере, от около 800 Па до около 8000 Па, и, предпочтительно, по меньшей мере, от около 1000 Па до около 6000 Па.
Предпочтительно, ковалентносшитый гидрогель изобретения имеет С при набухании в ИЖС/вода (1:8) от около 500 Па до около 9000 Па, от около 500 Па до около 6000 Па, от около 500 Па до около 5000 Па, от около 1000 Па до около 10000 Па, от около 1000 Па до около 8000 Па, от около 1000 Па до около 5500 Па, от около 1200 Па до около 10000 Па или от около 1200 Па до около 8000 Па. Предпочтительные гидрогели имеют аналогичные свойства упругости и/или абсорбирующие свойства при набухании в ИЖС/вода (1:8) и искусственном кишечном соке (ИКС). Например, предпочтительные гидрогели имеют G' при набухании в ИКС, которое находится в пределах 20% от G' при набухании в ИЖС/вода (1:8). Предпочтительные гидрогели имеют КПС в ИКС, которое находится в пределах 20% от КПС в ИЖС/вода (1:8).
Предпочтительные гидрогели изобретения (ковалентносшитые, нековалентносшитые или несшитые) имеют похожие свойства упругости и/или абсорбирующие свойства при набухании в ИЖС/вода (1:8) и искусственном кишечном соке (ИКС). Например, предпочтительные гидрогели имеют G' при набухании в ИКС, которое находится в пределах 20% от G' при набухании в ИЖС/вода (1:8). Предпочтительные гидрогели имеют КПС в ИКС, которое находится в пределах 20% от КПС в ИЖС/вода (1:8).
Предпочтительно гидрогель изобретения содержит любой гидрогелевый полимер, способный поддерживать предпочтительные свойства модуля упругости (G') во время прохождения через желудочно-кишечный тракт. Предпочтительно, гидрогель остается стабильным во время прохождения через желудочно-кишечный тракт, включая толстую кишку. Альтернативно, предпочтительный гидрогель может разлагаться или частично разлагаться во время прохождения через толстую кишку. Альтернативно, предпочтительный гидрогель может частично разлагаться во время прохождения через тонкую кишку и/или толстую кишку. Частичное разложение гидрогеля может быть достигнуто путем стабилизации сополимеров в сети, где один или несколько полимеров разлагаются в разных частях желудочно-кишечного тракта. Примером такого механизма, без ограничения, является сшивание CMC и хитозана, или CMC и глюкоманнана, например, лимонной кислотой или бифункциональным полиэтиленгликолем (ПЭГ). Эти сополимерные скелеты способны обеспечить такой подход частичного разложения. Часть CMC будет разлагаться в толстой кишке, в то время как часть хитозана или глюкоманнана будет оставаться стабильной, поддерживая высокий модуль упругости. Альтернативно, частичное разложение может быть достигнуто гомополимерами с использованием различных сшивающих агентов, когда один или несколько сшивающих агентов разлагаются в разных желудочно-кишечных трактах. Примером является производное целлюлозы, сшитое лимонной кислотой и бифункциональным ПЭГ, где сшивки лимонной кислоты будут разлагаться, а сшивки ПЭГ - нет. Частичное разложение может быть достигнуто комбинацией способов, описанных выше. Как только гидрогель частично разлагается, либо путем разложения полимера и/или сшивающего агента, упругая реакция на деформацию, которая является энтропийной по природе, уменьшается. Таким образом, модуль упругости соответственно уменьшается. Частичное разложение может быть использовано в качестве инструмента для регулировки модуля упругости гидрогелей, описанных в этих способах, во время их прохождения по различным желудочно-кишечным трактам. В дополнение к ионным полимерам, обсуждаемым ниже, подходящие полимеры изобретения включают следующие полимеры в сшитой или несшитой форме и включают несшитые полимеры, способные к самосшиванию после развертывания в форме желудочно-кишечного тракта, включая, но не ограничиваясь ими: ГЭЦ, хитозан, глюкоманнан, крахмал, акрилаты, микрокристаллическая целлюлоза, псиллиум и гуаровая камедь.
Одним предпочтительным сшивающим агентом является поли(этиленгликоль) диглицидиловый эфир (ПЭГДЭ). Термин «бифункциональный полиэтиленгликоль» и «бифункциональный ПЭГ» используются в данном документе взаимозаменяемо и относятся к полимеру полиэтиленгликоля, который функционализирован на каждом конце терминальной реакционноспособной функциональной группой. Подходящие реакционноспособные группы включают группы, которые способны реагировать с комплементарными группами в полисахариде, такими как гидроксильные, карбоксильные и аминогруппы, с образованием ковалентной связи. Подходящие такие группы включают азидную, тиольную, сукцинимидную, эпоксидную, карбокси, амино, этенильную, этинильную, нитрофенильную и бромалкильную группы. Предпочтительно, функциональная группа стабильна в воде при нейтральном рН. Предпочтительной функциональной группой является эпоксид. Единица ПЭГ бифункционального ПЭГ может иметь любую подходящую длину и обычно характеризуется среднечисленной молекулярной массой (Mn) бифункционального ПЭГ. В некоторых вариантах реализации бифункциональный ПЭГ имеет Mn от около 150 Да до около 1000000 Да, предпочтительно от 200 Да до 100000 Да, предпочтительно от 250 Да до 50000 Да, предпочтительно от 200 Да до 10000 Да, более предпочтительно от 250 Да до 5000 Да, от 400 Да до 2500 Да, от 250 Да до 1000 Да, от 350 Да до 650 Да, от 450 Да до 550 Да или от около 500 Да до около 550 Да. Предпочтительно, бифункциональный ПЭГ представляет собой поли (этиленгликоль) диглицидиловый эфир (ПЭГДЭ), имеющий молекулярную массу от около 450 Да до около 600 Да, или от около 500 Да до около 550 Да, или от около 520 Да до около 530 Да. Предпочтительно ПЭГДЭ имеет среднюю молекулярную массу от около 400 Да до около 10000 Да, предпочтительно от около 400 Да до около 8000 Да, предпочтительно от около 400 Да до 6000 Да, предпочтительно от около 460 Да до около 4600 Да, предпочтительно от около 460 Да до около 3000 Да. Предпочтительно, бифункциональный ПЭГ представляет собой ПЭГДЭ, и массовое отношение полимера(ов), например, полисахарида(ов) к ПЭГДЭ в растворе на стадии (1), составляет от около 20 мас./мас. до около 20000 мас./мас, предпочтительно от около 50 мас./мас. до около 10000 мас./мас. и более предпочтительно от около 100 мас./мас. до около 1000 мас./мас.
Предпочтительно, гидрогель изобретения содержит ионный полимер, предпочтительно анионный полимер и наиболее предпочтительно карбоксиметилцеллюлозу. Предпочтительно, анионный полимер представляет собой карбоксиметилцеллюлозу, которая ковалентно сшита лимонной кислотой или бифункциональным ПЭГ, как описано в настоящем документе.
В определенных вариантах реализации гидрогель изобретения содержит ионный полимер и неионный полимер. Ионный полимер предпочтительно представляет собой анионный полимер и наиболее предпочтительно карбоксиметилцеллюлозу. Неионный полимер предпочтительно представляет собой неионный полисахарид, такой как замещенная целлюлоза, глюкоманнан, гуаровая смола или псиллиум. В других вариантах реализации, неионный полимер представляет собой гидроксиалкилцеллюлозу, такую как гидроксиэтилцеллюлоза («ГЭЦ») или гидроксиалкилалкилцеллюлоза. В некоторых вариантах реализации ионный полимер сшивается с неионным полимером, например, сшивающим агентом, таким как поликарбоновая кислота, предпочтительно лимонная кислота, или бифункциональный ПЭГ, такой как ПЭГДЭ. Массовые соотношения ионных и неионных полимеров (ионный : неионный) могут находиться в диапазоне от около 1:10 до около 10:1, предпочтительно от около 1:5 до около 5:1. В предпочтительных вариантах реализации массовое соотношение составляет более 1:1, например, от около 2 до около 5. В особенно предпочтительном варианте реализации ионный полимер представляет собой карбоксиметилцеллюлозу, неионный полимер представляет собой гидроксиэтилцеллюлозу, и массовое соотношение (ионное : неионный) составляет около 3:1.
Наиболее предпочтительно, изобретение обеспечивает сшитую карбоксиметилцеллюлозу, например сшитую лимонной кислотой карбоксиметилцеллюлозу, которая имеет модуль упругости (G') при набухании в ИЖС/вода (1:8). по меньшей мере, 1500 Па, как определено в соответствии со способом описанным в Примере 2. Предпочтительно, сшитая карбоксиметилцеллюлоза имеет G' при набухании в ИЖС/вода (1:8), по меньшей мере, около 500 Па, предпочтительно, по меньшей мере, около 700, предпочтительно, по меньшей мере, около 800, предпочтительно, по меньшей мере, около 1000 Па предпочтительно, по меньшей мере, около 1500 Па, предпочтительно, по меньшей мере, около 2000 Па, предпочтительно, по меньшей мере, около 3000 Па, по меньшей мере, около 3500 Па, предпочтительно, по меньшей мере, около 4000 Па, предпочтительно, по меньшей мере, около 4500 Па, предпочтительно, по меньшей мере, около 5000 Па, предпочтительно, по меньшей мере, около 5500 Па, предпочтительно, по меньшей мере, около 6000 Па, предпочтительно, по меньшей мере, около 6500 Па, предпочтительно, по меньшей мере, около 7000 Па, предпочтительно, по меньшей мере, около 7500 Па, предпочтительно, по меньшей мере, около 8000 Па, предпочтительно, по меньшей мере, около 8500 Па. Предпочтительно, сшитая лимонной кислотой карбоксиметилцеллюлоза изобретения имеет G' при набухании в ИЖС/вода (1:8) от около 1500 Па до около 8000 Па, от около 5000 Па до около 8000 Па, от около 5000 Па до около 5500 Па, от около 6000 Па до около 8000 Па или от около 6500 Па до около 8000 Па.
Наиболее предпочтительно изобретение обеспечивает сшитую карбоксиметилцеллюлозу, например сшитую лимонной кислотой карбоксиметилцеллюлозу, имеющую модуль упругости (G') при набухании в ЖС /вода (1:8), по меньшей мере, от около 500 Па до около 10000 Па, предпочтительно, по меньшей мере, от около 600 Па до около 9000 Па, предпочтительно, по меньшей мере, от около 800 Па до около 8000 Па, и, предпочтительно, по меньшей мере, от около 1000 Па до около 6000 Па.
Наиболее предпочтительно изобретение предлагает сшитую карбоксиметилцеллюлозу, например, сшитую лимонной кислотой карбоксиметилцеллюлозу, имеющую G' при набухании в ИЖС/вода (1:8) от около 500 Па до около 9000 Па, от около 500 Па до около 6000 Па, от около 500 Па до около 5000 Па, от около 1000 Па до около 10000 Па, от около 1000 Па до около 8000 Па, от около 1000 Па до около 5500 Па, от около 1200 Па до около 10000 Па или от около 1200 Па до около 8000 Па. Предпочтительные гидрогели имеют похожие свойства упругости и/или абсорбирующие свойства при набухании в ИЖС/вода (1:8) и искусственном кишечном соке (ИКС). Например, предпочтительные гидрогели имеют G' при набухании в ИКС, которое находится в пределах 20% от G' при набухании в ИЖС/вода (1:8). Предпочтительные гидрогели имеют КПС в ИКС, которое находится в пределах 20% от КПС в ИЖС/вода (1:8).
Предпочтительно, сшитая карбоксиметилцеллюлоза имеет G' при набухании в ИЖС/воде (1:8), по меньшей мере, от около 500 Па до около 1500 Па, от около 500 Па до около 800 Па, от около 500 Па до около 1000 Па. от около 1500 до около 8000 Па, от около 5000 до около 8000 Па, от около 5000 Па до около 5500 Па, от около 6000 Па до около 8000 Па, от около 6500 Па до около 8000 Па, от около 5000 Па до около 5500 Па; или G', по меньшей мере, около 2700 Па.
Карбоксиметилцеллюлоза является коммерчески доступной в широком диапазоне молекулярных масс. Как правило, наиболее удобно выражать молекулярную массу натрий-карбоксиметилцеллюлозы в пересчете на вязкость 1,0% (мас./мас.) раствора натрий карбоксиметилцеллюлозы в воде при 25°С. Карбоксиметилцеллюлозы, подходящие для использования в настоящем изобретении, предпочтительно образуют 1% (мас./мас.) раствор в воде, имеющей вязкость в этих условиях от около 50 сантипуаз (сП) до около 11000 сП, более предпочтительно от около 500 сП до около 11000 сП. В некоторых вариантах реализации вязкость раствора в этих условиях составляет от около 1000 сП до около 11000 сП, от около 1000 сП до около 2800 сП, от около 1500 сП до около 3000 сП, от около 2500 до около 6000 сП. В определенных вариантах реализации вязкость раствора в этих условиях составляет от около 6000 сП до около 11000 сП. Вязкость раствора карбоксиметилцеллюлозы определяют в соответствии со способом, описанным в Примере 2, который соответствует ASTM D1439-03(2008)e1 (ASTM International, West Conshohocken, Па (2008), полностью включен в настоящий документ посредством ссылки).
В одном варианте реализации гидрогель получают путем сшивания высоковязкой карбоксиметилцеллюлозы. Высоковязкая карбоксиметилцеллюлоза может быть ковалентно сшита или физически сшита. Например, высоковязкая карбоксиметилцеллюлоза может быть ковалентно сшита, например, подходящим, предпочтительным физиологически приемлемым бифункциональным сшивающим агентом. В одном варианте реализации высоковязкая карбоксиметилцеллюлоза сшита поликарбоновой кислотой, такой как лимонная кислота. В другом варианте реализации высоковязкая карбоксиметилцеллюлоза сшивается с помощью бифункционального ПЭГ, такого как ПЭГДЭ. Полимерные гидрогели, образованные сшиванием высоковязкой карбоксиметилцеллюлозы лимонной кислотой, описаны в US 2016/0222134, содержание которого включено в настоящее описание посредством ссылки в полном объеме.
Используемый в данном документе термин «высоковязкая карбоксиметилцеллюлоза» относится к карбоксиметилцеллюлозе в виде натриевой соли, которая образует 1% (мас./мас.) раствор в воде, имеющей вязкость, по меньшей мере, 1500 сП. В предпочтительных вариантах реализации высоковязкая карбоксиметилцеллюлоза также имеет низкий индекс полидисперсности, такой как индекс полидисперсности, равный около 8 или менее. Предпочтительно, высоковязкая карбоксиметилцеллюлоза предпочтительно образует 1% (мас./мас.) раствор в воде, имеющей вязкость при 25°С, по меньшей мере, около 1500, 2000, 3000, 4000, 5000, 6000, 7000, 7500 или 8000 сП. В некоторых вариантах реализации карбоксиметилцеллюлоза образует 1% (мас./мас.) водный раствор, имеющий вязкость от 6000 сП до 10000 сП или от 6000 сП до 11000 сП при 25°С. В определенном варианте реализации карбоксиметилцеллюлоза образует 1% (мас./мас.) водный раствор, имеющий вязкость от около 6000 сП до около 9500 сП или от около 7000 сП до 9500 сП при 25°С. В другом варианте реализации карбоксиметилцеллюлоза образует 1% (мас./мас.) водный раствор, имеющий вязкость от около 7000 сП до около 9200 сП или от около 7500 сП до 9000 сП при 25°С. В еще одном варианте реализации карбоксиметилцеллюлоза образует 1% (мас./мас.) водный раствор, имеющий вязкость от около 8000 сП до около 9300 сП или около 9000 сП при 25°С. Предпочтительно карбоксиметилцеллюлоза находится в форме натриевой соли. Предпочтительно, карбоксиметилцеллюлоза представляет собой натрий карбоксиметилцеллюлозу, которая образует 1% (мас./мас.) водный раствор, имеющий вязкость около 7800 сП или выше, например, от около 7800 сП до 11000 сП или от около 8000 сП до около 11000 сП.
В предпочтительных вариантах реализации высоковязкая карбоксиметилцеллюлоза дополнительно имеет индекс полидисперсности (Mw/Mn) около 8 или менее, предпочтительно около 7 или менее или 6 или менее. В одном варианте реализации индекс полидисперсности составляет от около 3 до около 8, от около 3 до около 7, от около 3 до около 6,5, от около 3,0 до около 6; от около 3,5 до около 8, от около 3,5 до около 7, от около 3,5 до около 6,5, от около 3,5 до около 6, от около 4 до около 8, от около 4 до около 7, от около 4 до около 6,5, от около 4 до около 6, от около 4,5 до около 8, от около 4,5 до около 7, от около 4,5 до около 6,5, от около 4,5 до около 6, от около 5 до около 8, от около 5 до около 7,5, от около 5 до около 7, от около 5 до около 6,5 или от около 5 до около 6.
Предпочтительно, сшитая карбоксиметилцеллюлоза, например, сшитая лимонной кислотой карбоксиметилцеллюлоза, когда находятся в форме частиц, по меньшей мере, 95 мас. % которых имеют размер в диапазоне от 100 мкм до 1000 мкм со средним размером в диапазоне от 400 до 800 мкм, и потерю при сушке 10% или менее (мас./мас), имеют G', коэффициент поглощения среды и насыпную плотность, как описано ниже. Такая сшитая карбоксиметилцеллюлоза может быть получена, например, в соответствии со способами, описанными в данном документе и в US 2016/0354509.
(A) G': по меньшей мере около 1500 Па, 1800 Па, 2000 Па, 2200 Па, 2500 Па или 2700 Па. В некоторых вариантах реализации сшитая карбоксиметилцеллюлоза изобретения имеет G' при набухании в ИЖС/вода (1:8), по меньшей мере, около 2800 Па. В некоторых вариантах реализации сшитая карбоксиметилцеллюлоза изобретения имеет С' при набухании в ИЖС/вода (1:8) от около 1800 Па до около 3000 Па, от около 2000 Па до около 4000 Па, от около 2100 Па до около 3500 Па, от около 2100 Па до около 3400 Па или от около 2500 Па до около 3500 Па.
(B) Коэффициент поглощения среды (КПС) в ИЖС/вода (1:8): по меньшей мере, около 40, предпочтительно, по меньшей мере, около 50 или 60. В некоторых вариантах реализации сшитая карбоксиметилцеллюлоза имеет КПС от около 50 до около 110, от около 55 до около 100, от около 60 до около 95, от около 60 до около 90 или от около 60 до около 85.
(C) Насыпная плотность: по меньшей мере 0,5 г/мл, предпочтительно от около 0,55 г/мл до около 0,9 г/мл. В предпочтительном варианте реализации насыпная плотность составляет около 0,6 г/мл или более, например, от около 0,6 г/мл до около 0,8 г/мл, от около 6,5 г/мл до около 7,5 г/мл или от около 0,6 г/мл до около 0,7 г/мл.
Предпочтительно, изобретение обеспечивает сшитую карбоксиметилцеллюлозу, которая имеет G' и коэффициент поглощения среды, как указано ниже, когда находятся в форме частиц, по меньшей мере, 95 мас. % которых имеют размер в диапазоне от 100 мкм до 1000 мкм со средним размером частиц в диапазон от 400 до 800 мкм и потерю при сушке 10% или менее (мас./мас):
(A) G' от около 500 Па до около 8000 Па и коэффициент поглощения среды от около 40 до 100;
(B) G' от около 1200 Па до около 2000 Па и коэффициент поглощения среды, по меньшей мере, около 75;
(C) G' от около 1400 Па до около 2500 Па и коэффициент поглощения среды, по меньшей мере, около 70;
(D) G' от около 1600 Па до около 3000 Па и коэффициент поглощения среды, по меньшей мере, около 65;
(E) G' от около 1900 Па до около 3500 Па и коэффициент поглощения среды, по меньшей мере, около 60;
(F) G' от около 2200 Па до около 4000 Па и коэффициент поглощения среды, по меньшей мере, 55;
(G) G' от около 2600 до около 5000 Па и коэффициент поглощения, по меньшей мере, 40;
(H) G' более 3000 до около 8000 Па и коэффициент поглощения среды, по меньшей мере, около 30;
(I) G' более 4000 до около 10000 Па и коэффициент поглощения среды, по меньшей мере, около 20;
(J) G' более 6000 до около 11000 Па и коэффициент поглощения среды, по меньшей мере, около 15;
(K) G' более 7000 до около 12000 Па и коэффициент поглощения среды, по меньшей мере, около 10.
Предпочтительно указанная выше сшитая лимонной кислотой карбоксиметилцеллюлоза, необязательно, дополнительно имеет насыпную плотность, по меньшей мере, 0,5 г/мл, предпочтительно от около 0,55 г/мл до около 0,9 г/мл. В предпочтительном варианте реализации насыпная плотность составляет около 0,6 г/мл или более, например, от около 0,6 г/мл до около 0,8 г/мл, от около 0,65 г/мл до около 0,75 г/мл или около 0,6 г/мл до около 0,7 г/мл.
Предпочтительно, сшитая карбоксиметилцеллюлоза имеет G', по меньшей мере, около 2100 Па и коэффициент поглощения среды, по меньшей мере, около 75; или G', по меньшей мере, около 2700 Па и коэффициент поглощения среды, по меньшей мере, около 70.
Если не указано иное, все измерения G', КПС и насыпной плотности, описанные в данном документе, производятся на образцах гидрогеля, такого как сшитая карбоксиметилцеллюлоза, которая имеет (1) потери при сушке 10% (мас./мас.) или менее; и (2) находится в форме частиц, по меньшей мере, 95 мас. % которых имеют размер в диапазоне от 100 до 1000 мкм со средним размером в диапазоне от 400 до 800 мкм.
Если не указано иное, все измерения G', КПС и насыпной плотности, описанные в данном документе, производятся на образцах гидрогеля, включая образцы сшитой лимонной кислотой карбоксиметилцеллюлозы, которая имеет (1) потери при сушке 15% (мас./мас.) или менее; и (2) находится в форме частиц, по меньшей мере, 90 мас. % которых имеют размер в диапазоне от 100 до 1000 мкм со средним размером в диапазоне от 400 до 800 мкм.
Термин «искусственный желудочный сок/вода (1:8)» и эквивалентный термин «ИЖС/вода (1:8)», используемые в данном документе, относятся к раствору, полученному в соответствии со способом, описанным в Примере 2.
Используемый в данном документе термин «коэффициент поглощения среды» или «КПС» сшитого полимера является мерой способности сшитого полимера поглощать указанную водную среду в соответствии с уравнением:
КПС=(Wнабухший-Wсухой)/Wсухой
где Wсухой - масса исходного образца сухого сшитого полимера и Wнабухший - масса сшитого полимера при равновесном набухании. Если не указано иное, ссылка в настоящем документе на коэффициент поглощения среды или КПС относится к значению, полученному в ИЖС/вода (1:8) в соответствии со способом, описанным в Примере 2. Следует понимать, что единицы для значений КПС, приведенные в данном документе, представляют собой г/г.
Используемый в данном документе «модуль упругости» или G' определяют для сшитого полимера, набухшего в ИЖС/вода (1:8), в соответствии со способом, описанным в Примере 2.
Используемая в данном документе «насыпная плотность» определяется в соответствии со способом, описанным в Примере 2.
Используемые в данном документе «содержание воды» или «потери при сушке» образца определяются в соответствии со способом, описанным в Примере 2.
Предпочтительно, полимерные гидрогели, используемые в способах изобретения, включают сшитые полимеры, которые имеют свойства G', которые стабильны, например, при прохождении полимера в желудочно-кишечном тракте, и которые также предотвращают разложение в любой части желудочно-кишечного тракта, в том числе и в толстой кишке. Альтернативно, предпочтительные гидрогели изобретения могут разлагаться до прохождения через толстую кишку. Альтернативно, предпочтительные гидрогели изобретения могут частично разлагаться во время их прохождения через желудочно-кишечный тракт.
Предпочтительно, настоящее изобретение предлагает фармацевтическую композицию для лечения или профилактики заболеваний или расстройств, связанных с кишечной проницаемостью, включающую гидрогель с модулем упругости (G'), по меньшей мере, около 500 Па, например, от около 500 Па до около 8000 Па и предпочтительно гидрогель, содержащий сшитую карбоксиметилцеллюлозу. Фармацевтическая композиция может содержать гидрогель, предпочтительно гидрогель, содержащий сшитую карбоксиметилцеллюлозу в качестве активного агента, необязательно в комбинации с фармацевтически приемлемым наполнителем или носителем. Гидрогель, присутствующий в фармацевтической композиции, может быть гидратированным или дегидратированным, например, с количеством воды менее чем около 25 мас. %. Предпочтительно, фармацевтическая композиция подходит для перорального введения. Например, гидрогель может быть обезвожен и приготовлен в виде капсул, таблеток или саше. Гидрогель также может быть компонентом препарата или устройства, в котором он служит мукоадгезивом. Такие устройства включают патчи, в которых слой гидрогеля прикреплен к барьерному слою. После адгезии гидрогеля к поверхности кишечника патч образует барьер проницаемости на той части кишечной стенки, которую он покрывает. См., например, US 2016/0354509, включенный в настоящий документ посредством ссылки. Гидрогель может быть сшит in situ или введен в частично сшитой форме. Гидрогель можно вводить в сухой (ксерогель) или частично набухшей или набухшей форме (гидрогель), отдельно или в комбинации с пищевыми продуктами или напитками, или их комбинацией. Например, гидрогель может быть смешан с пищей или в качестве компонента пищи, такой как пищевые батончики, хлопья, йогурты с гелевым наполнителем, мороженое и фруктовые соки, предпочтительно, но не ограничиваясь этим, напитки с кислым рН, такие как апельсиновый сок или лимонный сок. В другом варианте реализации гидрогель предоставляется в форме, которая позволяет ему поддерживать контакт со слизистой оболочкой полости рта, например, жевательными композициями и пищевыми продуктами, такими как фруктовое мороженое.
Фармацевтические композиции изобретения могут дополнительно включать фармацевтически приемлемые наполнители. В определенных вариантах реализации фармацевтическую композицию вводят перорально в комбинации с водой или водным раствором. В других вариантах реализации композицию вводят ректально, например, в виде суппозитория или в клизме.
Предпочтительно, гидрогель вводят в тонкую кишку или толстую кишку пациента путем перорального приема дозированной формы, такой как капсула или таблетка, в которой гидрогель покрыт оболочкой, чтобы высвободиться из дозированной формы, когда он достигает кишечной области, где распространено активное заболевание, которое варьирует в зависимости от болезни Крона и язвенного колита. Таким образом, обычно для капсулы с энтеросолюбильным покрытием, энтеросолюбильное покрытие должно растворяться при рН тощей кишки (около рН 5,5), подвздошной кишки (около рН 6) или толстой кишки (около рН 6-7). Например, такая дозировка может быть достигнута путем покрытия гидрогеля, например, в форме микрочастиц, спрессованных в таблетку или в капсулу, покрытием, которое остается интактным при низком рН желудка, но легко растворяется, когда оптимальное рН растворения конкретного покрытия достигается. Покрытие может быть нанесено непосредственно на капсулу, что позволяет растворять капсулу только в интересующей области желудочно-кишечного тракта. Покрытие может быть выбрано таким, чтобы оно растворялось при рН целевой области кишечника. Высвобождение гидрогеля также можно модулировать путем введения композиции ксерогеля, который набухает только при определенных условиях окружающей среды, таких как рН, ионная сила и температура.
Из-за специфической стабилизации и структуры скелета, отсроченное высвобождение композиции может происходить как по механизмам диффузии, так и по механизмам разложения. Молекулярная диффузия через объем может контролироваться механизмами расширения и сжатия сети, а также степенью сшивания. Расширение и сжатие регулируют как стерическое препятствие трехмерной структуры сети диффузии молекулы, так и количество «свободной» воды (той части, которая не связана и не адсорбируется на скелете) в гидрогеле. Большое количество свободной воды активирует конвекционные механизмы, ускоряя проницаемость молекул и, следовательно, высвобождение. Эти механизмы контролируются набуханием и усадкой гидрогеля, которые, в свою очередь, тонко регулируются изменениями рН внешней среды ЖК тракта и ионной силы. Предпочтительно гидрогель быстро набухает в желудочно-кишечных условиях, например, в течение часа, предпочтительно в течение 30 минут или менее. Степень поперечного сшивания регулирует как возможности расширения сети, так и скелетную подвижность. Чем выше расширение и подвижность, тем ниже энергия активации для молекулярной диффузии по всему объему материала. Неожиданно, высокие способности к расширению были получены при высокой степени поперечного сшивания, регулирующего молекулярную массу и степень замещения скелета полимера. Это добавляет мощный инструмент для управления механизмами высвобождения. Дополнительное регулирование может быть получено путем изменения свойств скелета полимера или создания правильно спроектированных композитных сетей.
Описанные в данном документе композиции полезны для поддержания здоровой эпителиальной ткани кишечника и для лечения или профилактики заболеваний и нарушений, связанных с кишечной проницаемостью, на оси кишки-печени-головного мозга. Такие заболевания и расстройства включают воспалительные заболевания и расстройства желудочно-кишечного тракта, такие как, но не ограничиваясь ими: гастрит, язва желудка, язва двенадцатиперстной кишки, гастроэзофагеальное рефлюксное заболевание (ГЭРБ), кислотный рефлюкс, эозинофильный эзофагит, воспалительное заболевание кишечника (ВЗК), включая болезни Крона и язвенный колит, пищевая аллергия, синдром раздраженного кишечника (СРК), целиакия, НПВП-индуцированные язвы, инфекционный колит, инфекция или травма желудочно-кишечного тракта, включая инфекцию N. pylori;; Salmonella spp., включая Salmonella enterica serovar typhimur; Shigella; Staphylococcus; Campylobacter; Clostridium difficile; патогенная Escherichia coli; Yersinia; Vibrio spp, включая V. cholera и V. parahaemolyticus; Candida; Giardia; Entamoeda histolytica, Bacteroides fragilis; ротавирус; норовирус; аденовирус; и астровирус; воспаление в желудочно-кишечном тракте, острый лучевой синдром кишечника, пищевая аллергия; экологическая энтеропатия и мукозит, такой как индуцированный химиотерапией или радиотерапией оральный или кишечный мукозит; колоректальный рак и колит, связанный и спорадический;. Такие заболевания и расстройства дополнительно включают метаболические заболевания и заболевания, поражающие ткани и органы вне желудочно-кишечного тракта, включая ожирение, смешанное заболевание соединительной ткани (СЗСТ); хроническое воспаление, включая артрит; острое воспаление, включая сепсис; заболевание печени, включая неалкогольный стеатогепатит (НАСГ) и неалкогольное ожирение печени (НАЖБП), цирроз печени и гепатоцеллюлярную карциному; сахарный диабет 1 типа; сахарный диабет II типа; последствия хронического алкоголизма; инфекции, включая респираторные инфекции; неврологические расстройства, такие как расстройства аутистического спектра, болезнь Альцгеймера и болезнь Паркинсона.
Описанные в данном документе композиции также полезны для профилактического предотвращения повреждения эпителиальных тканей кишечника в результате побочных действий различных фармакологических терапий, которые могут назначаться пациенту. Например, композиции настоящего изобретения могут использоваться в качестве поддерживающего средства и профилактики после или во время лечения фармакологической терапией.
Композиции настоящего изобретения могут использоваться отдельно или в комбинации с другими фармакологическими терапиями и активными терапевтическими лекарственными средствами. Они могут быть использованы для повышения эффективности фармакологического лечения заболеваний, связанных с кишечной проницаемостью, и/или для уменьшения негативных последствий такого лечения за счет уменьшения требуемых доз и/или периода лечения такого лечения. Используемые в данном документе термины «комбинированная терапия», «схемы совместного лечения» и тому подобное означают схемы лечения, в которых два препарата вводят одновременно, в отдельных или комбинированных препаратах или последовательно в разные моменты времени, разделенные минутами, часами или днями, но каким-то образом действуют вместе для обеспечения желаемого терапевтического ответа. В соответствии с изобретением могут быть использованы любые известные фармакологические способы лечения конкретного заболевания (например, заболевания, связанного с кишечной проницаемостью).
Композиции настоящего изобретения могут быть использованы в качестве средства доставки фармакологической терапии. При использовании в качестве средства доставки лекарств они играют многократную роль как в увеличении доступности лекарства и времени контакта, так и в обеспечении терапевтического эффекта за счет защиты и стимуляции эпителиальной ткани, улучшения регенерации и предотвращения воспаления. С этой точки зрения, гидрогели настоящего изобретения являются не просто дополнительным инструментом для введения лекарственного средства, но обеспечивают синергетический эффект для патологий, связанных с кишечной проницаемостью. Это может быть полезно во время и в период лечения и для защиты и поддержания здоровья кишечника после такого лечения. Комбинированная терапия как таковая может обеспечить улучшенный профиль эффективности и безопасности для всей терапии и/или просто улучшить удобство и качество жизни.
Доставка лекарственного средства может модулироваться как в случае нерастворяющихся, частично растворяющихся или полностью растворяющихся гидрогелей. В нерастворяющихся гидрогелях перенос лекарственного средства может модулироваться, воздействуя на молекулярную массу, степень сшивки скелета, наличие фиксированных зарядов и степень их замещения. Они непосредственно влияют на препятствие для молекулярного переноса внутри гидрогеля и его набухающие свойства, которые, в свою очередь, также модулируют диффузионную кинетику.
Не будучи связанными теорией и просто в качестве примера, гидрогель с более высокой степенью сшивки и более высокой молекулярной массой демонстрирует более высокое препятствие для молекулярного переноса и более низкую подвижность, также уменьшая кинетику переноса. Более низкая способность к набуханию также уменьшает механизм переноса, тем самым уменьшая кинетику доставки. В полиэлектролитах способность к набуханию и, следовательно, кинетика доставки также могут регулироваться свойствами внешней среды, такими как рН и ионная сила. Это позволяет правильно ориентироваться на конкретный желудочно-кишечный тракт доставки лекарств. Комбинация полиэлектролитов и сетей, не основанных на полиэлектролитах, обеспечивает дополнительный контроль над явлениями переноса и, следовательно, механизмами доставки посредством вышеупомянутых механизмов.
Такие комбинации могут также способствовать частичному или полному разложению гидрогеля, как описано в настоящей заявке. Это разложение может использоваться в качестве дополнительного инструмента для модуляции свойств доставки. Фактически, разложение (частичное или полное) основной цепи активирует высвобождение лекарственного средства, присутствующего в разлагающейся массе гидрогеля. В свою очередь, это разложение может быть активировано модификациями внешней среды или внешними инструментами, должным образом контролирующими секции доставки ЖКТ и количество доставляемого лекарственного средства.
Другим инструментом для контроля точного места доставки является правильный подбор зарядов на полиэлектролите. На самом деле известно, что воспаленные ткани сильно взаимодействуют с заряженными главными цепями. Гидрогели на основе полиэлектролитов настоящего изобретения могут связываться с участками воспаленных тканей и как нацеливаться на сайт доставки, так и улучшать доступность лекарственного средства на этих сайтах.
Контроль доставки лекарств также может быть усилен путем инкапсуляции лекарств в микросферах или микрокапсулах, которые, в свою очередь, включаются в гидрогель и растворяются или разрушаются при контакте с внешними средами или внешними инструментами, такими как ультразвук, изменения локальной температуры, облучение и т.д. Их контролируемое растворение высвобождает лекарство, которое ранее было заключено в капсулу или в оболочку из двух или более концентрических капсул. Комбинация гидрогелевой основной цепи и капсулы может происходить простым смешением, вторичным или первичным соединением.
Соединение механизмов регенерации с целевым механизмом доставки лекарств играет важное правило в отношении ряда заболеваний, при которых только введение лекарств имеет проблемы безопасности и эффективности. Примером, без каких-либо ограничений в этом случае, является введение химиотерапевтических агентов, о которых известно, что они связаны с воспалением кишечных тканей.
Терапевтические кандидаты НАЖБП/НАСГ, которые могут оказывать синергетическое действие через воздействие на кишечный барьер или могут добавлять другой механизм для подхода к заболеванию или добавляются в гидрогель, могут обеспечить режим замедленного или медленного высвобождения, включая агонисты FHX, ингибитор поглощения желчных кислот, антиоксидант (Митохинон, агент, разрушающий цистеин), агонисты PPAR (одно- и двухкомпонентные), ингибитор каспазепротеазы, аналог фактора роста фибробластов (FGF 19 или FGF 21), стимулятор сиртуина, ингибитор жирных кислот, ингибитор DGAT1, ингибитор ROCK2, ингибитор ASK1, TLR-4 антагонист, THR-бета-агонист, ингибитор апоптоза, ингибитор киназы-1, ингибитор биосинтеза холестерина / модулятор IL-6, ингибитор стеароил-коэнзима А, ингибитор десатуразы 1, ингибитор хемокиновых рецепторов типа 2 и 5, ингибитор катепсина В, ингибитор ацетил-CoA карбоксилазы и ингибиторы галектина 1 и 3.
Использование гидрогеля для доставки пептидов позволило бы перорально вводить следующее лечение антителом LOXL2, агонистом GLP-1, агонистом GLP-2, ингибиторами галектина 1 и 3.
К терапевтическим кандидатам против воспалительных заболеваний кишечника, которые могут оказывать синергетическое действие через воздействие на кишечный барьер или могут добавить другой механизм, чтобы приблизиться к заболеванию или добавить его в гидрогель, можно обеспечить режим замедленного или медленного высвобождения, включая месаланин, азатиоприн, 6-меркаптопурин, метотрексат, кортикостероиды, препараты против опухолевого фактора некроза (ОФН) (инфликсимаб, адалимумаб, цертолизумаб пегол, инфликсимаб, адалимумаб и голимумаб), антитело анти-альфа-4-бета-7-интегрин (ведолизумаб, этролизумаб), сфингозин-1-фосфат (S1P1) рецепторные модуляторы (озанимод), антитело анти-Р40 (устекинумаб), антитела анти-IL-23, антитело анти-Р19, ингибиторы Janus-киназы (JAK) (тофоцитиниб, филготиниб), антитело металлопротеиназа-9, антисмысловой олигонуклеотид SMAD7 (монгерс).
Терапевтические кандидаты с синдромом раздраженного кишечника (с преобладанием запора), которые могут быть синергичными за счет его воздействия на кишечный барьер или могут добавить другой механизм, чтобы приблизиться к заболеванию или добавить его в гидрогель, могут обеспечить способ введения с замедленным или медленным высвобождением, включая полиэтиленгликолевые вещества; агонисты гуанилатциклазы-С (линаклотид, плеканатид), активатор хлоридных каналов (любипростон), ингибитор натриево-водородного обменника (тенапанор). Для СРК (где преобладает диарея) антагонист рецептора нейрокинина-2 (ибодутант), антагонист рецептора гистамина H1 (эбастин), агонисты FXR могут быть аддитивными или синергическими к гидрогелю. Такие агенты, как элюксадолин и антагонист 5-НТ3, добавленные в гидрогель, могут позволить использовать более низкие дозы и снизить риск панкреатита при СРК -D.
Предпочтительно, изобретение предлагает комбинированную терапию с участием гидрогелей изобретения в комбинации с лекарственными средствами или пищевыми продуктами или пищевыми добавками, имеющими механизм действия, который включает изменение, управление или воздействие на микробиоту кишечника. Например, пациенту можно вводить очень большие количества инулина или других растворимых волокон для достижения положительных изменений в микробиоме и связанных с ним метаболитах. Однако, поскольку многие из этих растворимых волокон имеют очень плохие механические свойства, требуются большие дозы, чтобы быть эффективными, и такие большие дозы могут вызывать нежелательные побочные эффекты. Комбинация гидрогелей изобретения с этими растворимыми волокнами может повысить эффективность, в то же время, позволяя доставлять более низкие дозы с помощью множества механизмов, механических и химических, которые вместе воздействуют на микробиоту, обеспечивая улучшенную терапию.
Фармацевтическую композицию в соответствии с изобретением вводят субъекту в соответствии с терапевтически эффективным режимом в течение продолжительного времени, приводящего к улучшению одного или нескольких симптомов. Например, одну или несколько композиций изобретения можно вводить, по меньшей мере, один раз в день, по меньшей мере, два раза в день, по меньшей мере, три раза в день или более. Субъекта лечат в течение периода времени, эффективного для уменьшения одного или нескольких симптомов, связанных с заболеванием или расстройством, например, степени тяжести воспаления, степени воспаления, боли и так далее. Например, субъект может лечиться в течение 1 недели, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель или 10 недель. Композиции можно вводить отдельно или в комбинации с другими биологически активными веществами.
Таким образом, изобретение относится к способу лечения или профилактики заболеваний или расстройств, связанных с проницаемостью и/или воспалением кишечника, с дисбактериозом или без него (т.е. состояния, связанного с дисбалансом кишечной мутуальной микрофлоры (микробиоты)) у нуждающегося субъекта, включающий введение в желудочно-кишечный тракт субъекта терапевтически эффективного количества гидрогеля, предпочтительно гидрогеля с модулем упругости (G'), по меньшей мере, около 500 Па, например, от около 500 Па до около 8000 Па и предпочтительно от около 500 Па до около 10000 Па, как описано выше. Предпочтительно гидрогель вводят субъекту перорально. Заболевание или расстройство может быть ограничено желудочно-кишечным трактом, проявляться в ткани(ях) или органе(ах) вне желудочно-кишечного тракта или системно. Такие заболевания и расстройства включают воспалительные заболевания желудочно-кишечного тракта и расстройства с дисбиозом или без него, такие как, но не ограничиваясь этим: гастрит, язва желудка, язва двенадцатиперстной кишки, гастроэзофагеальное рефлюксное заболевание (ГЭРБ), кислотный рефлюкс, эозинофильный эзофагит, воспалительное заболевание кишечника (ВЗК), включая болезни Крона и язвенный колит, пищевая аллергия, синдром раздраженного кишечника (СРК), целиакия, НПВП-индуцированные язвы, инфекционный колит, инфекция или травма желудочно-кишечного тракта, включая инфекцию H. pylori; Salmonella spp., включая Salmonella enterica serovar typhimur; Shigella; Staphylococcus; Campylobacter; Clostridium difficile; патогенная Escherichia coli; Yersinia; Vibrio spp, включая V. cholera и V. parahaemolyticus; Gandida; Giardia; Entamoada histolytica, Bacteroides fragilis; ротовирус; норовирус; аденовирус; и астровирус; воспаление в желудочно-кишечном тракте, острый лучевой синдром кишечника, пищевая аллергия; экологическая энтеропатия и мукозит, такой как индуцированный химиотерапией или радиотерапией оральный или кишечный мукозит; колоректальный рак и колит, связанный и спорадический;. Такие заболевания и расстройства дополнительно включают метаболические заболевания и заболевания, поражающие ткани и органы вне желудочно-кишечного тракта, включая ожирение, смешанное заболевание соединительной ткани (СЗСТ); хроническое воспаление, включая артрит; острое воспаление, включая сепсис; заболевание печени, включая неалкогольный стеатогепатит (НАСГ) и неалкогольное ожирение печени (НАЖБП), цирроз печени и гепатоцеллюлярную карциному; сахарный диабет 1 типа; сахарный диабет II типа; последствия хронического алкоголизма; инфекции, включая респираторные инфекции; неврологические расстройства, такие как расстройства аутистического спектра, болезнь Альцгеймера и болезнь Паркинсона.
Предпочтительно гидрогель содержит сшитую лимонной кислотой карбоксиметилцеллюлозу. Предпочтительно композицию вводят в дозированной форме, подходящей для перорального введения, содержащей гидрогель, предпочтительно гидрогель, имеющий модуль упругости (G') по меньшей мере 500 Па, например, от около 500 Па до около 8000 Па и предпочтительно от около 500 Па до около 10000 Па или от около 500 Па до около 6500 Па.
Фармацевтические композиции изобретения также пригодны для использования в способах стимулирования регенерации слизистой оболочки для восстановления физиологической структуры и функции поврежденной или дисфункциональной слизистой оболочки в результате заболевания или расстройства. Регенерация слизистой оболочки и плотные соединения ответственны за лучший барьер для молекулярного движения в кишечнике и, таким образом, уменьшают воспаление тканей под ним. Это оказывает влияние на лечение кишечной проницаемости и/или воспаления или заболеваний и нарушений, связанных с дисбиозом, таких как описанные выше. Следовательно, изобретение предлагает способы лечения кишечной проницаемости и/или воспаления, или заболевания или расстройства, связанные с дисбиозом, включающие стадию контакта с гидрогелем, предпочтительно с гидрогелем, имеющим модуль упругости (G'), по меньшей мере, около 500 Па, например, от около 500 Па до около 10000 Па, при этом ткани кишечника нуждаются в восстановлении или регенерации.
Фармацевтические композиции и способы изобретения также подходят для способов, способствующих образованию плотных контактов между эпителиальными клетками слизистой оболочки желудочно-кишечного тракта. Здоровая зрелая слизистая оболочка кишечника с неповрежденным плотным соединением служит главным барьером для прохождения макромолекул. Следовательно, изобретение также обеспечивает способы стимулирования образования плотных соединений желудочно-кишечного тракта (ЖК), включающие стадию контакта с гидрогелем, предпочтительно с гидрогелем, предпочтительно с гидрогелем, имеющим модуль упругости (G') от около 500 Па до около 8000 Па и предпочтительно от около 500 Па до около 10000 Па, при этом область или области кишечного тракта имеют нарушенную проницаемость.
Гидрогель изобретения необязательно должен непосредственно контактировать со стенкой кишечника в месте с ограниченной проницаемостью, но может просто увеличить упругость переходного объема полости и/или эпителиально-ассоциированного слоя слизи. Контакт стенки кишечника с упругим гелем или наполненным гелем содержимым полости способствует регенерации кишечного барьера или, кроме того, предотвращает или ингибирует разрушение барьера в результате агрессии внешних сред и индуцирования восстановления слоя слизистой оболочки полости. Не ограничиваясь какой-либо теорией, полагают, что гидрогель действует как остов, соответствующий диапазону механических свойств подлежащей ткани или слизи, обеспечивая тем самым сигналы механического восприятия нижележащей ткани и поддерживает регенерацию ткани. Гидрогель не препятствует переносу питательных веществ, необходимому для регенерации подлежащей ткани, из-за его проницаемости и сходства механических свойств со свойствами регенерирующей ткани и/или слизи.
В частности, считается, что, когда гидрогель присутствует в полости кишечника, он способствует взаимодействию клетка-биоматериал, клеточной адгезии, достаточному переносу газов, питательных веществ и регуляторных факторов для выживания, пролиферации и дифференцировки клеток без провоцирования или усиления воспаления ткани полости кишечника по сравнению с количеством воспалений в полости кишечника перед контактом полости кишечника с гидрогелем.
Следовательно, изобретение, кроме того, обеспечивает способ формирования временного остова в желудочно-кишечном тракте, включающий контактирование желудочно-кишечного тракта с гидрогелем, предпочтительно гидрогелем, имеющим модуль упругости (G'), по меньшей мере, около 500 Па, например, от около 500 Па до около 10000 Па, где гидрогель образует остов в желудочно-кишечном тракте, где остов способствует клеточно-биоматериальным взаимодействиям, клеточным адгезиям, достаточному переносу газов, питательных веществ и регуляторных факторов для выживания, пролиферации и дифференцировки клеток или любой их комбинации, где временный остов не увеличивает воспаление желудочно-кишечного тракта по сравнению с количеством воспаления в полости кишечника перед контактом желудочно-кишечного тракта с гидрогелем.
Настоящее изобретение может быть дополнительно понято с учетом следующих неограничивающих примеров.
ПРИМЕРЫ
Пример 1 Способы получения геля В 01, геля В 02, геля В 03 и геля В 04
Полимеры согласно Таблице 1 были получены, как указано в Примере 1 US 2016/0222134, за исключением того, что для геля В-03 и геля В-04 время сшивания было увеличено, как указано в Таблице 1.
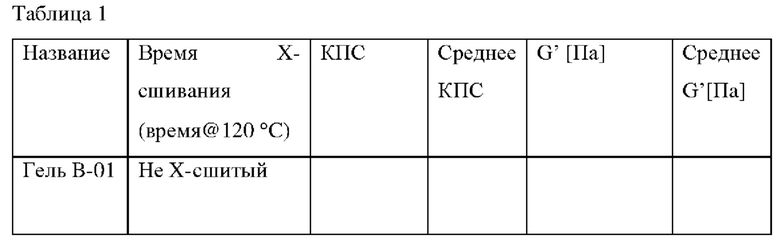
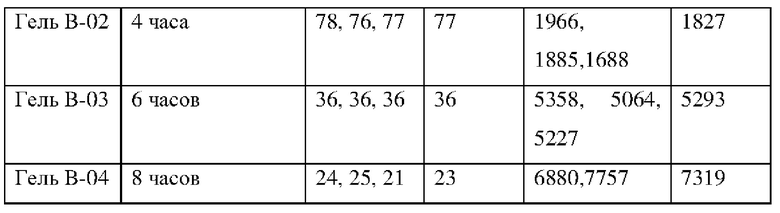
Гель B-01, Гель B-02, Гель В-03 и Гель В-04 получали следующим образом.
Для стадии смешивания, гомогенную смесь лимонной кислоты (0,2% мас./мас. CMCNa), 7H4MF (6% мас./мас. деионизированная вода) карбоксиметилцеллюлозу и деионизированную воду получали с помощью технологии планетарного смесителя. Трех (3) часов перемешивания было достаточно для предотвращения комков в смеси. Для стадии сушки, тонкий слой смеси САУСМС/Вода выкатывали на силиконовом листе. Однородность слоя важна для обеспечения однородного высыхания и предотвращения любого остаточного напряжения в материале. Температура сушки составляла 70°С. На первой стадии измельчения, высушенный материал измельчали с помощью режущей мельницы через сито 2 мм. Для первого просеивания, измельченный материал просеивали между 100-1600 мкм. Материал, полученный на данной стадии, маркируется как гель В-01. Для стадии сшивания, 5 г порошка с выбранным размером частиц 100-1600 мкм помещали в алюминиевые чашки и сшивали при 120°С в течение 4 часов. Материал, полученный на данной стадии, маркируется как гель В-02. Пять (5) грамм геля В-02 дополнительно сшивали в алюминиевых чашках при 120°С в течение 2 и 4 дополнительных часов, чтобы получить гель В-03 и гель В-04, соответственно. Для стадии промывки и сушки, сшитый порошок промывали в деионизированной воде в течение 3 часов при постоянном перемешивании и затем фильтровали и сушили при 70°С. Для второй стадии измельчения, высушенный сшитый материал измельчали с помощью режущей мельницы через сито 1 мм. Для второй стадии просеивания, измельченный материал просеивали до конечного выбранного размера частиц 100-1000 мкм. Упругость (G') при набухании в ИЖС/вода (1:8) каждого из геля В-01, геля В-02, геля В-03 и геля В-04 представлена в Таблице 1.
Гель 4 получали следующим образом.
Для стадии смешивания, гомогенную смесь лимонной кислоты (0,3% мас./мас. CMCNa), 7H3SXF (6% мас./мас. деионизированная вода) карбоксиметилцеллюлозу и деионизированную воду получали с помощью технологии планетарного смесителя. Трех (3) часов перемешивания было достаточно для предотвращения комков в смеси. Для стадии сушки тонкий слой смеси СА/СМС/Вода выкатывали на силиконовом листе. Однородность слоя важна для обеспечения однородного высыхания и предотвращения любого остаточного напряжения в материале. Температура сушки составляла 70°С. Для первой стадии измельчения, высушенный материал измельчали с использованием режущей мельницы через сито 2 мм. Для первой стадии просеивания, измельченный материал просеивали до размера 100-1600 мкм. Для первой стадии сшивания, 5 г порошка с выбранным размером частиц 100-1600 мкм помещали в алюминиевые чашки и сшивали при 120°С в течение 8 часов. Для стадии промывания и сушки, сшитый порошок промывали деионизированной водой в течение 3 часов при постоянном перемешивании и затем фильтровали и сушили при 70°С. Для второй стадии измельчения, высушенный сшитый материал измельчали с использованием режущей мельницы через сито 1 мм. Для второй стадии просеивания, измельченный материал просеивали до конечного выбранного размера частиц 100-1000 мкм. Материал, полученный на данной стадии, помечен как гель А. Упругость (G') при набухании в ИЖС/вода (1:8) геля А находится в Таблице 2.
Гели С м D получали следующим образом.
Гель С и Гель D получали растворением NaCMC 7Н3 и 7Н4 соответственно в дистиллированной воде с образованием гомогенного раствора, содержащего около 6 процентов полимера по массе в расчете на общую массу раствора (раствор А). Поли(этиленгликоль)диглицидиловый эфир (ПЭГДЭ) растворяли в воде с образованием раствора, содержащего 1 процент ПЭГДЭ по массе в расчете на общую массу раствора (раствор В). Гидроксид натрия растворяли в воде с образованием исходного раствора, содержащего 4 процента NaOH (1 М) по массе в расчете на общую массу раствора (раствор С). Раствор В (сшивающий агент) добавляли к Раствору А с получением раствора с желаемым соотношением полимера и ПЭГДЭ. В композициях с катализатором к раствору полимера и ПЭГДЭ добавляли некоторое количество раствора C с получением концентрации гидроксида 0,25М в конечном растворе. Полученный раствор, состоящий из NaCMC, ПЭГДЭ (и необязательно NaOH в комбинациях с катализатором), перемешивали в течение, по меньшей мере, трех часов, чтобы сделать его гомогенным. Смесь обрабатывали испарительной сушкой при 50°С в конвекционной печи в течение 48 часов.
После сушки восстановленную сшитую карбоксиметилцеллюлозу измельчали в гранулы в смесителе. Измельченный материал просеивали и фракцию между 100 и 1000 мм собирали и использовали для следующих стадий.
Сухую смесь полимер/ПЭГДЭ (с катализатором или без катализатора) обрабатывали при 120°С в течение 4 часов в печи для завершения реакции сшивания, где это необходимо, для улучшения механических свойств. Сшитая карбоксиметилцеллюлоза (глюкоманнан или их смесь) реагировала с ПЭГДЭ и NaOH, когда катализатор промывали кислой водой (0,25 М соляной кислотой) от 1 до 3 часов, чтобы удалить непрореагировавшие материалы, и побочные продукты, и нейтрализовать катализатор путем восстановление рН до 7. Сшитую карбоксиметилцеллюлозу, прореагировавшую с ПЭГДЭ без катализатора, промывали дистиллированной водой в течение 1-3 часов для удаления непрореагировавших материалов и побочных продуктов.
Материал, полученный после сушки, измельчали и просеивали между от 500 до 1000 мкм. Конечный материал, полученный на этой стадии, маркируется как Гель С или Гель D (основанный продукт соответственно 7Н3 на 7Н4). Упругость (G') при набухании в ИЖС/вода (1:8) Гелей С и D находится в Таблице 2.
ПЭГДЭ 5%, 10% и 15% гели получали следующим образом.
ПЭГДЭ (Sigma-Aldrich, 700 Да) растворяли в дистиллированной воде (5%, 10% и 15% мас./об.), осторожно перемешивая с получением образцов ПЭГДЭ 5%, ПЭГДЭ 10% и ПЭГДЭ 15%. Фотоинициатор Darocur 1173 (Bast) добавляли в количестве 3% мас./мас. относительно содержания ПЭГДЭ.
Растворы отливали в чашки Петри (1,5 мл в 35-мм чашке) и замораживали в контролируемых условиях (-40°С, скорость замораживания -1°С мин) в лиофилизаторе (Virtis Advantage). После выдерживания при -40°С в течение 1 часа образцы подвергали воздействию ультрафиолетового света (365 нм, 2 мВт/см2) в течение 30 или 60 с и, наконец, подвергали набуханию в дистиллированной воде для удаления кристаллов льда и непрореагировавших предшественников. Затем материалы сушили при 50°С в течение 24 часов. Полученные образцы затем измельчали до получения частиц размером 100-1000 мкм. Упругость (G') при набухании в ИЖС/вода (1:8) каждого соответствующего геля ПЭГДЭ представлена в Таблице 2.
ВОЛОЛКНО А (псиллиум METAMUGIL) списание геля.
Metamucil представляет собой марку волокнистых добавок, содержащих волокно псиллиума, для многих преимуществ. Псиллиум представляет собой ингредиент натурального волокна из Plantago ovata. Упругость (G') при набухании в ИЖС/вода (1:8) ВОЛОКНА А представлена в Таблице 2.
ВОЛОКНО В (микрокристаллическая целлюлоза (AVICEL) описание геля.
Целлюлозный гель AVICEL представляет собой сеть гелей, образованных из коллоидной микрокристаллической целлюлозы (МСС). Он преобразован из особых качеств возобновляемой целлюлозы из твердой и мягкой древесины. Упругость (G') при набухании в ИЖС/вода (1:8) ВОЛОКНА В представлена в Таблице 2.
ВОЛОКНО С (глюкоманнан) описание геля.
Глюкоманнан представляет собой растительное диетическое волокно, полученное из растения Конжак. Это волокно уже много лет известно в Японии благодаря своей пользе для здоровья. Упругость (G') при набухании в ИЖС/вода (1:8) ВОЛОКНА С представлена в Таблице 2.
ВОЛОКНО D (гуаровая камедь) описание геля.
Гуаровая камедь представляет собой продукт, который может образовывать гидроколлоид. Гуаровую камедь получают путем измельчения эндосперма семян гуара Cyamopsis tetragonoloba, травянистого растения бобовых, типичного для Индии и Пакистана, семена которого веками используются в пищу на местах. Основным компонентом является галактоманнан, трисахарид, образованный единицами маннозы и галактозы, специально полимеризованный с образованием α-D-маннопиранозильных цепей в комбинации с β-D-(1-4) гликозидной связью и молекулярной массой около 200000-300000 дальтон, с образованием линейной цепи 1-4 с короткими боковыми ветвями 1-6 галактозы. Упругость (G') при набухании в ИЖС/вода (1:8) ВОЛОКНА D представлена в Таблице 2.
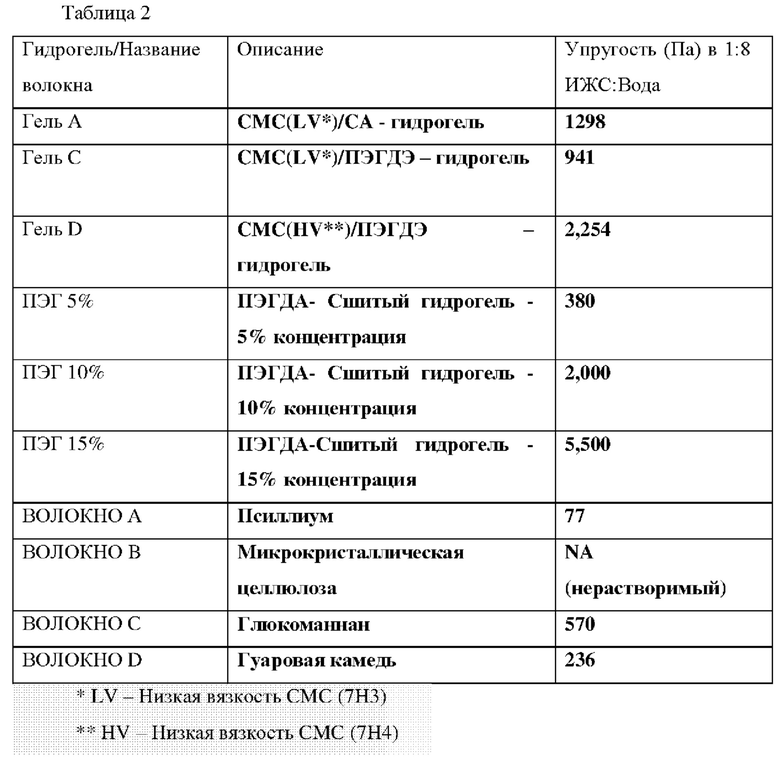
Пример 2. Материалы и способы определения характеристик гидрогелей изобретения с использованием карбоксиметилцеллюлозы (CMC) в качестве примера.
Получение искусственного желудочного сока/воды (1:8)
Реагентами, использованными для получения раствора ИЖС/вода (1:8), являются очищенная вода, хлорид натрия, 1М соляная кислота и пепсин.
1. В мерный цилиндр объемом 1 л наливают около 880 мл воды.
2. Помещают цилиндр на магнитную мешалку, добавляют магнитный брусок и начинают перемешивание.
3. Начинают мониторинг рН воды с помощью pH-метра.
4. Добавляют достаточное количество 1 М соляной кислоты, чтобы довести рН до 2,1±0,1.
5. Добавляют 0,2 г NaCl и 0,32 г пепсина. Оставляют раствор для перемешивания до полного растворения.
6. Убирают магнитный брусок и электрод из цилиндра.
7. Добавляют количество воды, необходимое для доведения объема до 900 мл.
Определение вязкости растворов карбоксиметилцеллюлозы
Оборудование и материалы:
Водяная баня постоянной температуры.
Бутылка стеклянная, 500 мл с крышкой, диаметр горлышка не менее 80 мм.
Вискозиметр Brookfield, модель Myr VR3000 (ЕС0208) или эквивалентный, оснащенный:
Шпиндель L4.
Термопринтер (PRP-058GI).
Механическая верхняя мешалка с якорной мешалкой из нержавеющей стали.
Цепной зажим для закрепления стеклянной посуды.
Лабораторный шпатель.
Алюминиевый тигель.
Аналитические весы, способные взвешивать с точностью до 0,001 г.
Откалиброванные весы, способные взвешивать, с точностью до 0,1 г.
Очищенная вода.
Приготовление тестируемых образцов:
Готовят три раствора CMC/вода, как описано ниже:
1. Измеряют содержание влаги в порошке CMC, как описано в [В] ниже.
2. Рассчитывают количество воды, необходимое по уравнению:
требуемая вода [г]=3*(99-LODсреднее).
3. Взвешивают необходимое количество воды для приготовления раствора CMC в стакан.
4. Наливают примерно половину этой воды в бутылку, а оставшуюся воду оставляют в стакане.
5. Помещают и закрепляют бутылку под двигателем мешалки с помощью цепного зажима.
6. Вставляют мешалку.
7. Смешивают образец, чтобы обеспечить однородность.
8. Взвешивают 3,0±0,1 г порошка CMC.
9. Наливают порошок в небольших количествах во флакон при перемешивании на низкой скорости (около 600 об/мин).
10. Перемешивают в течение 2 минут и устанавливают скорость перемешивания 1000 об/мин.
11. Перемешивают не менее 10 минут, но не более 30 минут.
12. Добавляют оставшуюся воду.
13. Перемешивают еще 30 минут.
14. Если CMC не растворилась полностью, продолжают перемешивание.
15. Когда вся CMC растворится, снимают якорную мешалку из нержавеющей стали и надевают крышку на бутылку.
16. Помещают колбу в баню с постоянной температурой, при 25,0±0,1°С, не менее чем на 30 минут, но не более чем на один час.
17. Энергично встряхивают бутылку в течение 10 секунд. Раствор готово к тестированию.
Измерение вязкости:
1. Определяют вязкость каждого образца в соответствии с инструкциями для вискозиметра. Разрешают вращение шпинделя ровно на 3 минуты.
2. Определяют среднюю вязкость трех растворов.
Определение потерь при высушивании
Содержание влаги в карбоксиметилцеллюлозе или поперечносшитой карбоксиметилцеллюлозе определяют в соответствии с USP<731>, Потери при сушке.
Инструменты/Оборудование
Анализатор влажности Radwag, модель WPS 50S
Лабораторный шпатель
Алюминиевый тигель
Эксикатор с силикагелем
Методика
1. Помещают образец в эксикатор не менее чем на 12 часов.
2. Помещают алюминиевый тигель на чашу весов анализатора влажности и тарируют весы.
3. Точно взвешивают 1,000±0,005 г образца в алюминиевом тигле. Начальный вес образца -Wi.
4. Настраивают анализатор влажности на нагревание образца при температуре 105°С в течение 30 минут при атмосферном давлении и влажности.
5. Включают анализатор влажности и запускают программу ППВ (30 минут при 105°С).
6. Взвешивают образец. Конечный вес образца - Wf.
Значение ППВ определяется по уравнению:
ППВ=(Wi-Wf)/Wi×100%.
Потери при высушивании определяют в трех экземплярах, и заявленная ППВ является средним из трех значений.
Определение диапазона размеров частиц
Оборудование и материалы:
Ситовый шейкер Retsch, модель AS 200 basic
Сита из нержавеющей стали с размерами ячеек 1000 мкм и 100 мкм
Алюминиевая чаша для взвешивания
Лабораторный шпатель из нержавеющей стали
Откалиброванные весы, способные взвешивать с точностью до 0,1 г.
Методика:
1. Взвешивают пустые сита и алюминиевый поддон с точностью до 0,1 г.
2. Отвешивают 40,0±0,1 г порошка.
3. Укладывают контрольные сита размером 1000 и 100 мкм с большим размером пор сверху и меньшим снизу. Собирают алюминиевую чашу на дне гнезда.
4. Наливают образец в сито 1000 мкм в верхней части стопки.
5. Помещают эту стопку между крышкой и концевой чашей шейкера, чтобы образец оставался в сборке.
6. Включают главный выключатель шейкера.
7. Устанавливают ручку UV2 шейкера для непрерывной работы.
8. Поворачивают ручку MN2 шейкера вправо, чтобы увеличить высоту вибрации до 50.
9. Встряхивают стопку с помощью шейкера в течение 5 минут.
10. Разбирают сито и взвешивают каждое сито.
11. Определяют процентный вес испытуемого образца в каждом сите, как описано в пункте 8.
12. После измерения веса заполненных и пустых испытательных сит по разнице определяют вес материала внутри каждого сита.
13. Аналогичным образом определяют вес материала в чаше для сбора.
14. Используют вес образца, содержащегося в каждом сите и в чаше для сбора, чтобы рассчитать % распределения с помощью следующего уравнения:
Wx%=Wx/М/образца*100%
где:
Wx% = вес образца в каждом сите или в чаше, в процентах, где индекс «x» равен: «>1000» для частиц размером более 1000 мкм.
«100-1000» для размера частиц от 100 до 1000 мкм.
«<100» для частиц размером менее 100 мкм.
Wобразца = начальная масса образца.
Измерение насыпной плотности
Оборудование и материалы:
100 мл стеклянный мерный цилиндр
Аналитический стакан на 100 мл
Лабораторный шпатель
Механический измеритель насыпной плотности, модель JV 1000 от Copley Scientific
Откалиброванные весы, способные взвешивать с точностью до 0,1 г.
Методика:
1. Взвешивают 40,0±0,1 г тестируемого образца. Это значение обозначено как М.
2. Помещают образец в сухой стеклянный мерный цилиндр объемом 100 мл.
3. Тщательно выравнивают порошок без уплотнения и считают неустановленный кажущийся объем, V0, до ближайшей мерной единицы.
4. Устанавливают на механическом измерителе насыпной плотности уровень постукивания 500 раз и измеряют насыпную плотность, V500, до ближайшей мерной единицы.
5. Повторяют постукивание 750 раз и измеряют уровень насыпной плотности, V750, до ближайшей мерной единицы.
6. Если разница между двумя измерениями составляет менее 2%, V750 - это конечная насыпная плотность, Vf, в противном случае при необходимости повторяют с шагом 1250 постукиваний, пока разница между последующими измерениями не станет менее 2%.
Определение модуля упругости (G')
Модуль упругости (G') определяется в соответствии с протоколом, изложенным ниже. Используемый реометр - Rheometer Discovery HR-1 (5332-0277 DHR-1) от ТА Instruments или эквивалентный, оснащенный пластиной Пельтье; нижней плоской пластиной Xhatch диаметром 40 мм; и верхней плоской пластиной Xhatch диаметром 40 мм.
Методика
1. Помещают магнитную мешалку в стакан на 100 мл.
2. Добавляют 40,0±1,0 г раствора ИЖС/вода (1:8), полученного, как описано выше, в стакан.
3. Ставят стакан на магнитную мешалку и осторожно перемешивают при комнатной температуре.
4. Точно взвешивают 0,250±0,005 г порошка сшитого полимера (например, карбоксиметилцеллюлозы), используя бумагу для взвешивания (Win).
5. Добавляют порошок в стакан и осторожно перемешивают в течение 30±2 мин с помощью магнитной мешалки без образования вихрей.
6. Убирают мешалку из полученной суспензии, помещают воронку на опору и выливают суспензию в воронку, собирают все оставшиеся материалы с помощью шпателя.
7. Дают материалу стечь в течение 10±1 мин.
8. Собирают полученный материал.
9. Испытывают материал на частоту развертки с помощью реометра и определяют значение G' при угловой частоте 10 рад/с.
Определение сделано трижды. Сообщаемое значение G' является средним из трех определений.
Определение коэффициента поглощения среды (КПС) в ИЖС/вода (1:8)
Коэффициент поглощения среды сшитой карбоксиметилцеллюлозы в ИЖС/вода (1:8) определяют в соответствии со следующим протоколом.
1. Помещают высушенную стеклянную воронку на подложку и наливают 40,0±1,0 г очищенной воды в воронку.
2. Ждут, пока в горловине воронки не будет обнаружено капель (около 5 минут), и просушивают кончик воронки с помощью впитывающей бумаги.
3. Помещают воронку в пустой и сухой стеклянный стакан (стакан №1), помещают их на тарированные весы и записывают вес пустой тары (Wтары).
4. Помещают магнитную мешалку в стакан на 100 мл (стакан №2); помещают стакан №2 на весы и взвешивают.
5. Добавляют 40,0±1,0 г раствора ИЖС/вода (1:8), полученного, как описано выше, в стакан №2.
6. Помещают стакан №2 на магнитную мешалку и осторожно перемешивают при комнатной температуре.
7. Точно взвешивают 0,250±0,005 г сшитого порошка карбоксиметилцеллюлозы с помощью бумаги для взвешивания (Win).
8. Добавляют порошок в стакан №2 и осторожно перемешивают в течение 30±2 мин магнитной мешалкой, не создавая вихрей.
9. Извлекают мешалку из полученной суспензии, помещают воронку на опору и выливают суспензию в воронку, собрав весь оставшийся материал с помощью шпателя.
10. Дают материалу стечь в течение 10±1 мин.
11. Помещают воронку со стекшим материалом внутрь стакана №1 и взвешивают его (W'fin).
Коэффициент поглощения среды (КПС) рассчитывается в соответствии с:
КПС=(Wfin-Win)/Win.
Wfin - масса набухшего гидрогеля, рассчитанная по формуле:
Wfin=W'fin-Wтары.
где Win - вес исходного сухого образца. КПС определяется трижды для каждого образца сшитой карбоксиметилцеллюлозы, и сообщаемый КПС является средним из трех определений.
Пример 3 Исследования на животных
Мыши C57BL6/J были приобретены в лабораториях Charles River. Все используемые мыши были в возрасте от 8 до 12 недель на момент эксперимента. Мышей содержали в животноводческом комплексе IFOM-IEO в особых условиях отсутствия патогенов. Все эксперименты проводились в соответствии с руководящими методиками, установленными в Principles of Laboratory Animal Care (директива 86/609/EEC).
Самок и самцов мышей C57BL6/J в возрасте 8 недель кормили рационом с добавлением различных концентраций геля В-02 (2%-4%-6%-8%) и соответствующим контрольным рационом питания (4RF21 репеллентный, Mucedola srl) на протяжении 4 недель. Описание геля В-02 приведено в Таблице 1 Примера 1.
После 4 недель кормления, мыши голодали по утрам в течение 6 часов и отбирались образцы крови из хвостовой вены через небольшой надрез острым скальпелем. Каплю крови непосредственно использовали для измерения уровня глюкозы с помощью ручного монитора уровня глюкозы в цельной крови от Roche (Accu-Chek Aviva, Roche), и другие 50 мкл крови собирали для получения сыворотки для измерения уровня инсулина с помощью ELISA (Мышиный сверхчувствительный инсулиновый ELISA, Mercodia АВ).
В течение 4 недель мышей взвешивали и контролировали на предмет потребления пищи и воды, а образцы стула отбирали и взвешивали. В конце 4 недель мышей умерщвляли. Кровь собирали из сердца для получения сыворотки и печень, эпидидимальная/паховая белая жировая ткань, межлопаточная коричневая жировая ткань, тонкий и толстый кишечник отбирали у каждой мыши. Различные сегменты кишечника фиксировали в параформальдегиде, L-лизине рН 7,4 и NaIO4 (буфер PLP) или в фиксаторе Карной. Печени фиксировали в буфере PLP или в параформальдегиде и коричневые и белые жировые ткани фиксировали в параформальдегиде.
Все используемые мыши были в возрасте от 8 до 12 недель на момент эксперимента. Мышей содержали в животноводческом комплексе IFOM-IEO в особых условиях отсутствия патогенов. Все эксперименты были выполнены в соответствии с руководящими методиками, установленными в Principles of Laboratory Animal Care (директива 86/609/ЕЕС).
Фиксация Карной и окрашивание слизи
Для сохранения слоя слизи, ткани фиксировали в фиксаторе Карной (этанол, ледяная уксусная кислота, хлороформ 6:1:3). После 40 минут (культивирование органов ex vivo) или 2 часов (эксперименты in vivo) фиксации, ткани переносили в абсолютный этанол и хранили при +4°С в течение не менее 72 часов, обрабатывали и заливали парафином.
Затем ткани окрашивали с использованием готового к использованию окрашивающего набора Alcian Blue-PAS (NOVAULTRATM Alcian Blue/PAS Stain Kit, IHC WORLD) в соответствии с инструкциями поставщика. Альцианский синий окрасит сильно кислые муцины в синий, PAS (раствор перйодной кислоты и реагента Шиффа) окрасит нейтральные муцины в пурпурный цвет. Смеси как кислых, так и нейтральных муцинов будут окрашены в синий и фиолетовый цвета.
Иммуногистохимия для Ki67 была выполнена на фиксированных парафиновых тканях. Срезы тканей депарафинизировали в гистолемоне и гидратировали посредством ряда градуированных спиртов. Демаскирование антигена проводили с использованием Tris-EDTA рН 9 при 95°С в течение 50 минут с последующим гашением эндогенных пероксидаз с использованием 3% Н2О2.
Затем срезы инкубировали с первичным поликлональным антителом кролика против Ki67 (ab15580, ABC AM) в течение 2 часов при комнатной температуре и с готовым к использованию вторичным антителом (система DAKO Envision HRP кролик) в течение 20 минут при комнатной температуре. Затем срезы ткани промывали и инкубировали с раствором пероксидазы (DAB, DAKO). Затем предметные стекла окрашивали гематоксилином и дегидратировали через серию градиентного спирта, промывали гистолоном и заключали в среду. Изображения были получены с помощью широкоугольного микроскопа Olympus ВХ51, подключенного к камере Nikon DS-5M.
Иммунофлуоресцентная и конфокальная микроскопия
Образцы кишечника фиксировали в течение ночи в параформальдегиде, L-лизине, рН 7,4 и NaIO4 (буфер PLP). Затем их промывали, обезвоживали в 20% сахарозе в течение по меньшей мере 4 часов и включали в соединение OCT (Sakura). Криосрезы 10 мкм регидратировали, блокировали 0,1 М Tris-HCl, рН 7,4, 2% FBS, 0,3% Triton Х-100 и окрашивали следующими антителами: анти-мышиный PLVAP (клон МЕСА32, BD Pharmingen), анти-мышиный CD34 (клон RAM34, eBioscience) и анти-мышиный zonula occludens [ZO-1 (клон ZO1-1A12, Invitrogen)]. Затем ломтики инкубировали с соответствующим вторичным антителом, конъюгированным с флуорофором. Перед визуализацией ядра окрашивали 4',6-диамидин-2-фенилиндолом (DAPI), и предметные стекла заключали в VECTASHIELD® Mounting Media (Cat.H-1000). Покрытия были постоянно запечатаны по периметру лаком для ногтей. Слайды хранили при +4°С в темноте до получения Leica TCS SP2 AOBS с программным обеспечением Leica Confocal. Изображения были получены с помощью масляного иммерсионного объектива 63Х или масляного иммерсионного объектива НСХ PL АРО 40Х (NA 1,25). Программный пакет Фиджи был использован для анализа изображений и количественной оценки флуоресценции.
Статистический анализ
Статистический анализ был выполнен с использованием программного обеспечения GraphPad Prism. Значения сравнивались с использованием t-критерия Стьюдента для одной переменной или одностороннего критерия множественного сравнения ANOVA Bonterroni в зависимости от распределения данных. Результаты были представлены как среднее ±SEM. *р<0,05, **р<0,01, ***р<0,001.
Результаты
Результаты данных исследований показаны на Фиг. 1-12. На Фиг. 1 показаны снимки широкоугольным микроскопом срезов тонкой кишки мыши. Окрашивание синим цветом указывает на наличие муцинов. Темно-синие точки обозначают клетки бокалов, ответственные за выработку слизи, и увеличиваются у мышей, получающих гидрогель относительно контрольных мышей. Поскольку исследуемые мыши были здоровыми мышами с нормальным слоем слизи, результаты показывают, что гидрогель способствует выработке муцина также в нормальной ткани. Аналогичный результат показан на Фиг. 2 для ткани подвздошной кишки и на Фиг. 3 для ткани слепой кишки.
На Фиг. 4 показаны результаты окрашивания муцина в ткани толстой кишки у контрольных и получавших гидрогель мышей. По сравнению с другими тканями содержание муцина в тканях толстой кишки увеличивается по сравнению с контрольной группой. В частности, группы гидрогелей имеют лучшее распределение муцина, т.е. темно-синее окрашивание является более распространенным. В этой части кишечного тракта больше бактерий и больше стресса, чем в других тканях, что говорит о том, что гидрогель оказывает большее воздействие на ткани, подверженные стрессу.
На Фиг. 5 показаны результаты окрашивания ZO-1 (красный) в тканях толстой кишки контрольной группы. Изображения в столбцах 2 и 3 показывают низкий уровень белка плотного соединения ZO-1.
На Фиг. 6 показаны результаты окрашивания ZO-1 в ткани толстой кишки в группе с 8% -гидрогелем. По сравнению с контрольной Фиг. 7 эта группа демонстрирует значительное увеличение белка плотного соединения ZO-1 и, таким образом, увеличение герметичности эпителиального барьера.
Фиг. 8-12 показывают результаты окрашивания ZO-1 в ткани подвздошной кишки. Поскольку в подвздошной кишке много бактерий, ZO-1 значительно экспрессируется в нормальной ткани и не наблюдается различий между контрольными и обработанными гелем продуктами.
Результаты показывают, что гидрогель-дополненные диеты индуцируют участки регенерации кишечной ткани у мышей. В частности, образование толстых соединений наблюдалось в толстой кишке. Кроме того, регенерация слизи наблюдается, когда в рацион добавляется материал с надлежащими упругими свойствами. Существует оптимальное значение упругих свойств этого добавленного материала, который отвечает за оптимальную регенерацию. Более низкие и более высокие упругие свойства ответственны за более низкие участки регенерации.
Пример 4- Исследования m с образцами тканей человека.
Здоровые образцы толстой кишки были получены из здоровой ткани пациентов, перенесших операцию по удалению рака. Слизистый слой был отделен от мышечных слоев патологом и перенесен в нашу лабораторию в сбалансированном солевом растворе Хэнка (HBSS) при 4°С с добавлением бактериостатических антибиотиков. Образцы ослеплены.
Чистый слой слизистой оболочки промывали в буфере HBSS и разрезали стерильными скальпелями на кусочки по 1 см2.
Пещерный цилиндр (боросиликатный клонирующий цилиндр, 6×6 мм для образцов мыши и 8×8 мм для образцов человека, BellCo) был приклеен хирургическим клеем (Vetbond, 3М, Милан, Италия) на апикальную поверхность слизистой оболочки. Затем слизистую оболочку помещали на стерильную металлическую сетку, предварительно промытую в эмбриональной бычьей сыворотке, в чашку для культивирования органов в центре лунки (BD Falcon) и 1 мл DMEM, содержащий 15% FBS, глютамин, эпидермальный фактор роста (200 нг/мл, Peprotech) и инсулин-трансферрин-селен-Х (10 мкл/мл, Gibco) использовали для заполнения центра чашки.
Ткани оставляли на 1 час при 37°С в 5%-ном инкубаторе с диоксидом углерода для восстановления слизи. В конце восстановления слизи, пещерные цилиндры были заполнены полной средой, PBS (фосфатно-солевой буфер) и различными составами геля, гелем В-01, гелем В-02. Гель В-03 и гель В-04 соответственно. Соответствующий гель В-01, гель В-02. Гелевые композиции В-03 и В-04 гидратировали в PBS при слабом перемешивании и постоянной температуре 37°С в течение 30 минут. Обработанные ткани инкубировали в течение 2 часов при 37°С в 5% инкубаторе с диоксидом углерода. В конце инкубации, ткани фиксировали в фиксаторе Карной в течение 40 минут и переносили в абсолютный этанол и хранили при + 4°С в течение не менее 72 часов перед обработкой и заливкой парафином.
Результаты
Результаты этих исследований показаны на Фиг. 13, на которой синее окрашивание указывает на слой слизи. Метки Medium и PBS указывают образцы тканей, которые не обрабатывались гидрогелем. Гель В-01, гель В-02. Гель В-03 и гель В-04 являются такими, как описано в Таблице 1 Примера 1. Гидрогель гель В-01 вводили в виде смеси с лимонной кислотой. Наблюдается явное влияние упругих свойств гидрогеля на регенерацию слизистого слоя. Гель В-03 демонстрирует лучшие регенерационные свойства (более темные и лучше равномерно распределенные синие области с гораздо меньшей инфильтрацией воспалительных иммунных клеток). Более низкие (гель В-02) и более высокие (гель В-04) степени сшивки способствуют модели регенерации слизи, но в меньшей степени, чем гель В-03, и не обеспечивают оптимального распределения муцинов (удлиненные модели). Несшитая карбоксиметилцеллюлоза (гель В-01) демонстрирует плохие регенерационные свойства, а также образцы ткани PBS.
Пример 5- Модель мукозита in vivo
Желудочно-кишечный мукозит является распространенным побочным эффектом противоопухолевой химиотерапии, такой как 5-фторурацил (5-FU), обычно используемой противораковой терапии при раке толстой кишки. Мукозит не только снижает качество жизни у большинства больных раком из-за связанной с ней сильной болью но и является фактором высокого риска сепсиса с нейтропенией и недоеданием. Таким образом, эта связь делает мукозит клинически важным заболеванием, и любые дополнительные агенты, способные уменьшать симптомы, связанные с мукозитом, будут иметь большое значение. Это исследование было проведено, чтобы определить, может ли гидрогель, введенный мосле короткого курса 5-FU, изменить процесс заболевания и минимизировать степень мукозита.
Способы
Для этого исследования использовали 15 самцов мышей C57B6/J в возрасте 8 недель, полученных от Charles River. Животных содержали с доступом к гранулированной пище и воде ad libitum в среде с контролируемой температурой с 12-часовым циклом свет/темнота. Все получили болюс 5-FU (450 мг кг внутрибрюшинно) в первый день, а затем еще 3 дня 5-FU 50 мг кг внутрибрюшинно. После воздействия 5-FU мышей случайным образом разделили на три экспериментальные группы по 5 мышей в каждой группе; 1) диета, 2) диета с добавлением геля В-02 2%, или 3) диета с добавлением геля В-02 4% в течение 5 дней. Вес тела регистрировали каждый день, и животных умерщвляли на 5-й день после последнего введения 5-FU.
Статистический анализ
Для результатов всех экспериментальных анализов были рассчитаны средние значения и стандартное отклонение в каждой группе. Статистическая значимость средних значений в каждой группе была проверена с использованием одностороннего ANOVA или двухстороннего ANOVA с пост-тестом Бонферрони для множественного сравнения при уровне значимости α=0,05.
Результаты
Ежедневное введение 5-FU приводило к быстрой потере веса во всех группах. Потеря веса продолжалась во всех группах, кроме группы, подвергавшейся воздействию геля В-02 4%, который продемонстрировал прогрессивное восстановление массы тела в течение 4 дней введения гидрогеля со статистически значимой разницей на 9 день по сравнению с мышами, получавшими Chow (р<0,01) (Фиг. 14).
На 9-й день собирали ткани толстой кишки и оценивали укорочение толстой кишки, измеряя длину толстой кишки как параметр воспаления кишечника. Толстая кишка мышей, которых кормили Chow с добавлением теля В-02 2% и Chow с добавлением геля В-02 4%, пока шла значительное (р<0.05 и р<0,01, соответственно) улучшение длины толстой кишки по сравнению с только контрольной диетой Chow и почти полностью вернулась к нормальной длине (Фиг. 15).
Пример 6- Органная культура и гелевое исследование Ex Vivo.
Целью исследования было изучение способности гидрогелей с различными свойствами упругости сохранять здоровье и регенеративные свойства тканей кишечника.
Образцы были получены из здоровой ткани толстой кишки мышей C57BL6/J, полученных от Charles River Labs.
Чистый слой слизистой оболочки промывали в Dulbecco's Modified Eagle Medium (DMEM), содержащей 15% фетальной бычьей сыворотки (FBS), глютамин (2 мМ), эпидермальный фактор роста (200 нг/мл, Peprotech) и инсулин-трансферрин-селен-Х (10 мкл/мл, Gibco) и нарезали стерильными скальпелями на кусочки по 1 см2.
Пещерный цилиндр (боросиликатный клонирующий цилиндр, 6×6 мм для образцов мышей, BellCo) был приклеен хирургическим клеем (Vetbond, 3М, Милан, Италия) на апикальную поверхность слизистой оболочки. Затем слизистую оболочку помещали на стерильную металлическую сетку, предварительно промытую в эмбриональной бычьей сыворотке, в чашку для культивирования органов в центре лунки (BD Falcon) и 1 мл DMEM, содержащий 15% FBS, глютамин, эпидермальный фактор роста (200 нг/мл, Peprotech) и инсулин-трансферрин-селен-Х (10 мкл/мл, Gibco) использовали для заполнения центра чашки.
Ткани толстой кишки инкубировали с гидрогелями с различной упругостью, а именно с гелем В01 (гидрогель с самой низкой упругостью), 02, 03 и 04 (гидрогели с прогрессивно более высокой упругостью) в течение 2 часов при 37°С, после восстановления слизи (1 час при 37°С без гидрогелей). PBS и обработанные средой ткани использовали в качестве отрицательного и положительного контролей соответственно.
После инкубации ткани фиксировали по Карною и погружали в парафин для получения срезов тканей. Ткань подвергалась воздействию среды или гидрогелей только со стороны, которая обычно подвергается воздействию содержимого кишечника. Таким образом, срезы окрашивали Alcian Blue/PAS (для визуализации слизи и секретирующих слизь клеток) или антителом Ki-67 (для выявления пролиферации клеток).
Гели, указанные в этом примере, были получены, как описано в Примере 1, в Таблицах 1 и 2, и были охарактеризованы, как описано в Примере 2.
Результаты:
А) Сравнение между гидрогелями СМС/СА с разными уровнями упругости:
Из анализа дополнительных независимых экспериментов (с разными мышами, а также с тканями человека из Примера 4) выяснилось, что гель В02 и гель В03 - это те, которые лучше сохраняют целостность структуры ткани, образование и целостность слизистого слоя (как показано окрашиванием Alcian Blue/PAS на Фиг. 16) и пролиферативную способность (как показано присутствием Ki-67-положительных ядер в коричневом цвете). Эти данные свидетельствуют о том, что гель В02 и В03 - это те, с которыми ткань более совместима, и их диапазон упругости является предпочтительным.
Б) Сравнение гидрогелей СМС/СА с различными уровнями упругости с гидрогелями СМС/ПЭГДЭ с сопоставимой упругостью: Часть 1.
Из анализа гелей с аналогичными или различными свойствами жесткости (т.е. гель В-02 по сравнению с гелем D, гель А по сравнению с гелем С; гели В-02 и D по сравнению с гелями А и С) на Фиг. 17, выяснилось, что гель В-02 и гель D обладают лучшим, но схожим сохраняющим эффектом на ткани толстой кишки, лучше сохраняют целостность архитектуры и образование и целостность слизистого слоя. Принимая во внимание, что гель А и гель С оказывают слабое влияние на целостность ткани, в то время как гель А лучше, чем гель С. Это говорит о том, что гель В-02 и гель D - это те, с которыми ткань более совместима, из-за их более высоких и сходных вязкоупругих свойств, по сравнению с гелем А и гелем С.
Было отмечено, что здоровье и регенерация тканей сходны между гидрогелями CMC при изменении типа CMC или сшивающего агента, но зависят от уровня упругости.
Похоже, что гидрогели для улучшения здоровья и регенерации эпителия и слизистой оболочки можно получить, используя CMC с высокой или низкой вязкостью, а также различные типы сшивающих агентов, если упругость находится в нужном диапазоне.
С) Сравнение гидрогелей СМС/СА с различными уровнями упругости с гидрогелями ПЭГДА с сопоставимой упругостью: Часть 2.
Из анализа геля В и ПЭГДА, показанных на Фиг. 18, выяснилось, что соединения с сопоставимыми вязкоупругими/жесткими свойствами (гель В-01 и ПЭГДА 5%; гель В-02 и ПЭГДА 10%; гель В-03 и ПЭГДА 15%) демонстрируют похожее влияние на ткани толстой кишки с точки зрения сохранения архитектуры и образования и целостности слизистого слоя. В заключение, модулирующие вязкоупругие свойства гелей вызывают различные реакции тканей.
Было отмечено, что на здоровье и регенерацию тканей влияет уровень упругости при использовании гидрогелей с ПЭГ-основой. Оптимальное влияние на ткани, которое было достигнуто гидрогелями ПЭГ, было между уровнями упругости, обеспечиваемыми ПЭГ от 5% до ПЭГ 15%. Однако гидрогели на основе CMC обеспечивали лучшие результаты в сопоставимых диапазонах упругости. Это наблюдение предполагает, что существует дополнительное влияние, связанное с веществом композиции на схему регенерации. Это может быть связано с влиянием микробиоты или другими.
Из этих результатов и наблюдений очевидно, что широкий спектр гидрогелей можно использовать для здоровья и регенерации эпителиальных тканей и слизистой оболочки. Упругость гидрогеля является ключевым параметром. Композиция гидрогелей, по-видимому, оказывает дополнительное влияние на режимы регенерации, поэтому мы предлагаем использовать гидрогели, соединяющие надлежащие диапазоны упругости и надлежащий состав вещества. Предпочтительно следует использовать гидрогели с более высокими абсорбционными свойствами и лучшей биосовместимостью, поскольку они позволяют более эффективное, а также безопасное введение и использование.
D) Сравнение несшитых волокон с разными уровнями упругости.
Из этого анализа выяснилось, что Волокно С, по-видимому, сохраняет целостность структуры ткани, а также образование и целостность слизистого слоя (как показано окрашиванием Alcian Blue/PAS на Фиг. 19). Волокно А и Волокно D, по-видимому, негативно влияют на целостность тканей и слизи.
Наблюдения из этого анализа показывают, что здоровье и регенерация тканей не улучшаются за счет механических свойств функциональных волокон, особенно не за счет нерастворимых волокон, таких как микрокристаллическая целлюлоза. Волокна, генерирующие более высокий уровень упругости, такие как глюкоманнан, показывают небольшое улучшение, что связано с их более высокой упругостью. Тем не менее, несшитые волокна не обеспечивают правильную картину регенерации за счет механических воздействий. Следовательно, можно сделать вывод, что глюкоманнан и другие растворимые полисахариды не желательны для использования в их несшитой форме.
Патентная и научная литература, упомянутая в настоящем документе, устанавливает знания, доступные специалистам в данной области. Все патенты США и опубликованные или неопубликованные заявки на патенты США, процитированные в данном документе, включены посредством ссылки. Все опубликованные зарубежные патенты и патентные заявки, цитируемые в данном документе, включены в настоящее описание посредством ссылки. Все остальные опубликованные ссылки, документы, рукописи и научная литература, цитируемые в данном документе, включены в настоящее описание посредством ссылки.
Хотя это изобретение было конкретно показано и описано со ссылками на его предпочтительные варианты реализации, специалистам в данной области техники должно быть понятно, что в него могут быть внесены различные изменения в форме и деталях, не выходя за рамки объема изобретения, охватываемого прилагаемой формулой изобретения. Также следует понимать, что варианты реализации, описанные в данном документе, не являются взаимоисключающими и что признаки из различных вариантов реализации могут быть объединены полностью или частично в соответствии с изобретением.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ОПТИМИЗАЦИИ ВЕСА И ДЛЯ УЛУЧШЕНИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ | 2009 |
|
RU2518262C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОГЕЛЕЙ | 2012 |
|
RU2618329C2 |
| Способ лечения запора | 2017 |
|
RU2745992C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОГЕЛЕЙ, ХАРАКТЕРИЗУЮЩИХСЯ СОЧЕТАНИЕМ ВЫСОКОГО МОДУЛЯ УПРУГОСТИ И ВЫСОКОЙ АБСОРБЦИОННОЙ СПОСОБНОСТИ | 2016 |
|
RU2709361C2 |
| pH-КОНТРОЛИРУЕМЫЕ СИСТЕМЫ ИМПУЛЬСНОЙ ДОСТАВКИ, МЕТОДЫ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЯ | 2005 |
|
RU2412694C2 |
| ПРОТОН-СВЯЗЫВАЮЩИЕ ПОЛИМЕРЫ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2015 |
|
RU2713416C2 |
| ПОЛИМЕРНЫЕ ГИДРОГЕЛИ И СПОСОБЫ ИХ ПРИГОТОВЛЕНИЯ | 2008 |
|
RU2493170C2 |
| Полимерные гидрогели и способы их приготовления | 2013 |
|
RU2641749C2 |
| ПОЛИАКРИЛАМИДНЫЙ ГИДРОГЕЛЬ И ЕГО ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ЭНДОПРОТЕЗА | 2001 |
|
RU2301814C2 |
| ПОКРЫТАЯ КИШЕЧНОРАСТВОРИМОЙ ОБОЛОЧКОЙ КОМПОЗИЦИЯ МАСЛА МЯТЫ ПЕРЕЧНОЙ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ, СОСТОЯЩАЯ ИЗ МНОЖЕСТВА ЧАСТИЦ, И СВЯЗАННЫЕ С НЕЙ СПОСОБЫ | 2013 |
|
RU2606593C1 |
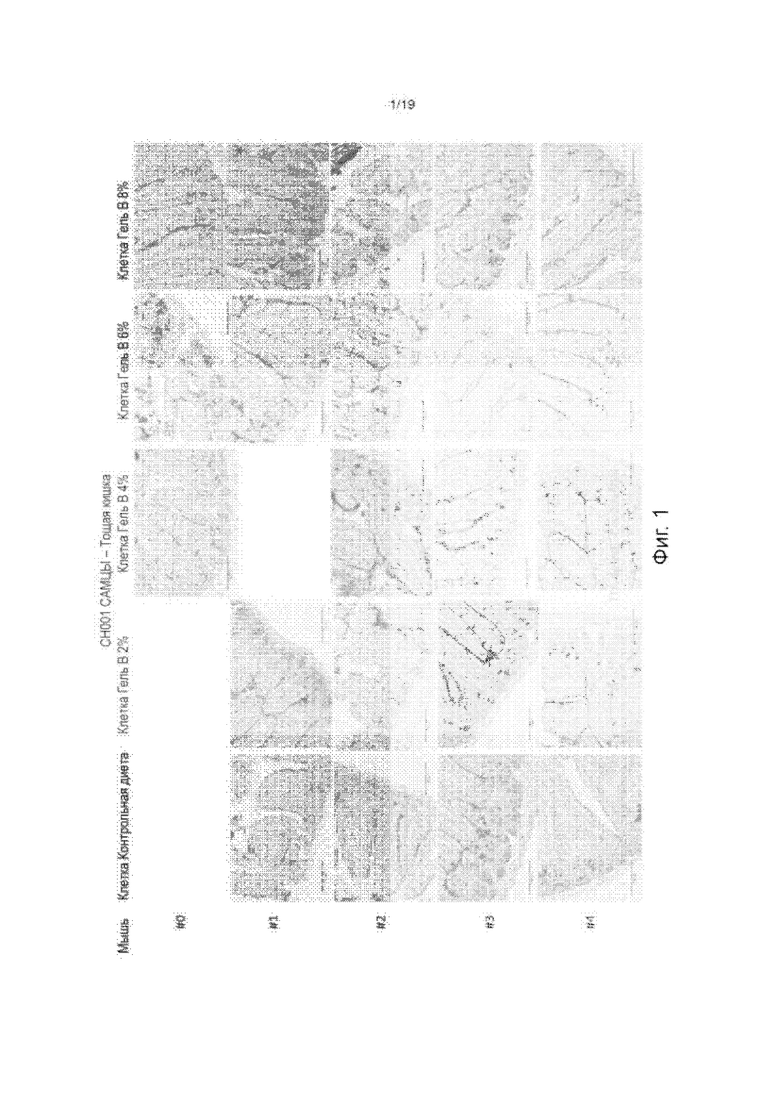


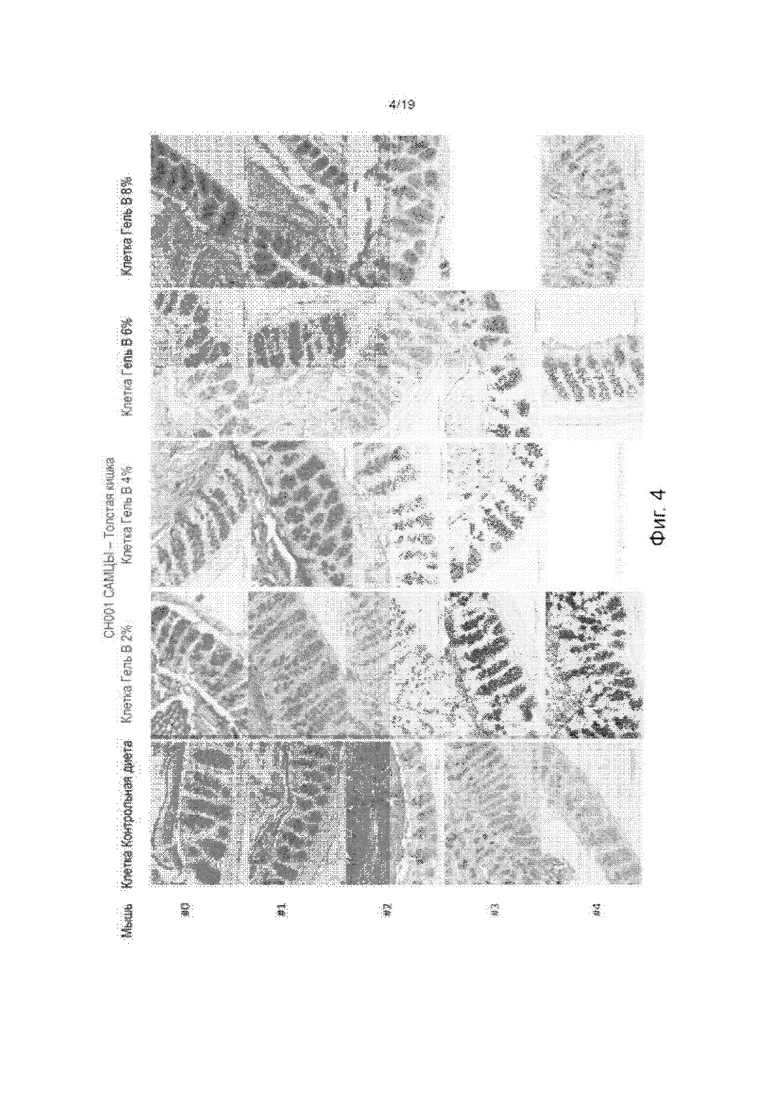



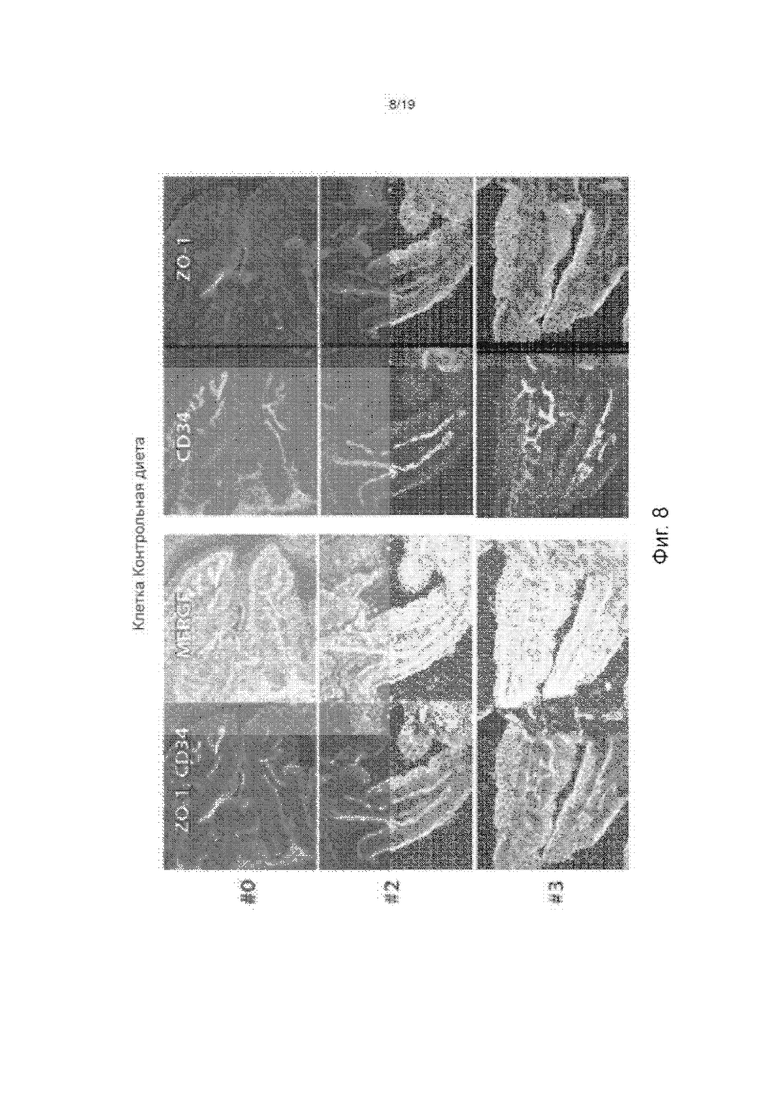

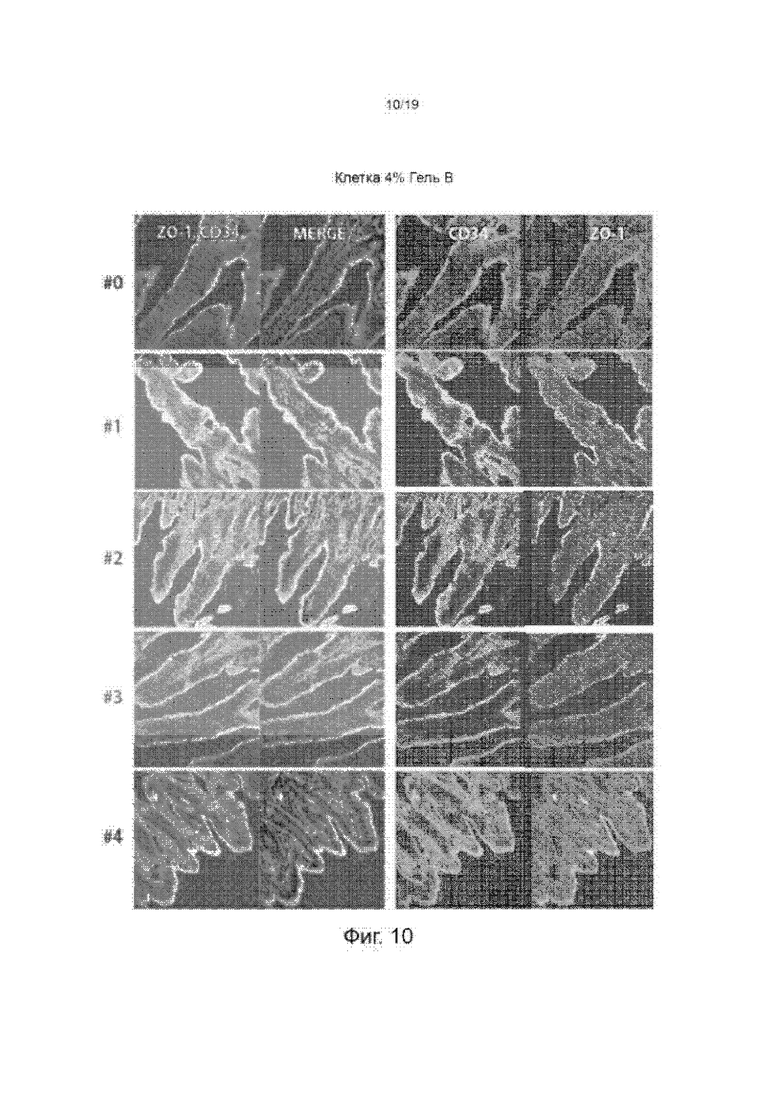

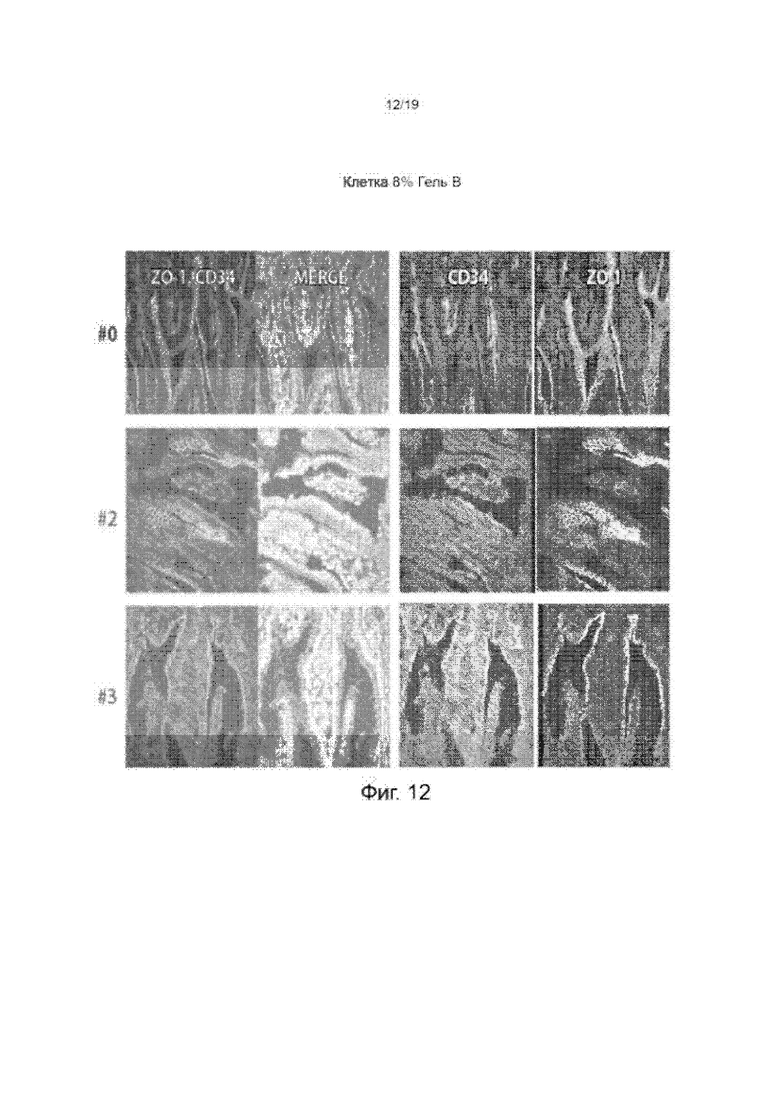

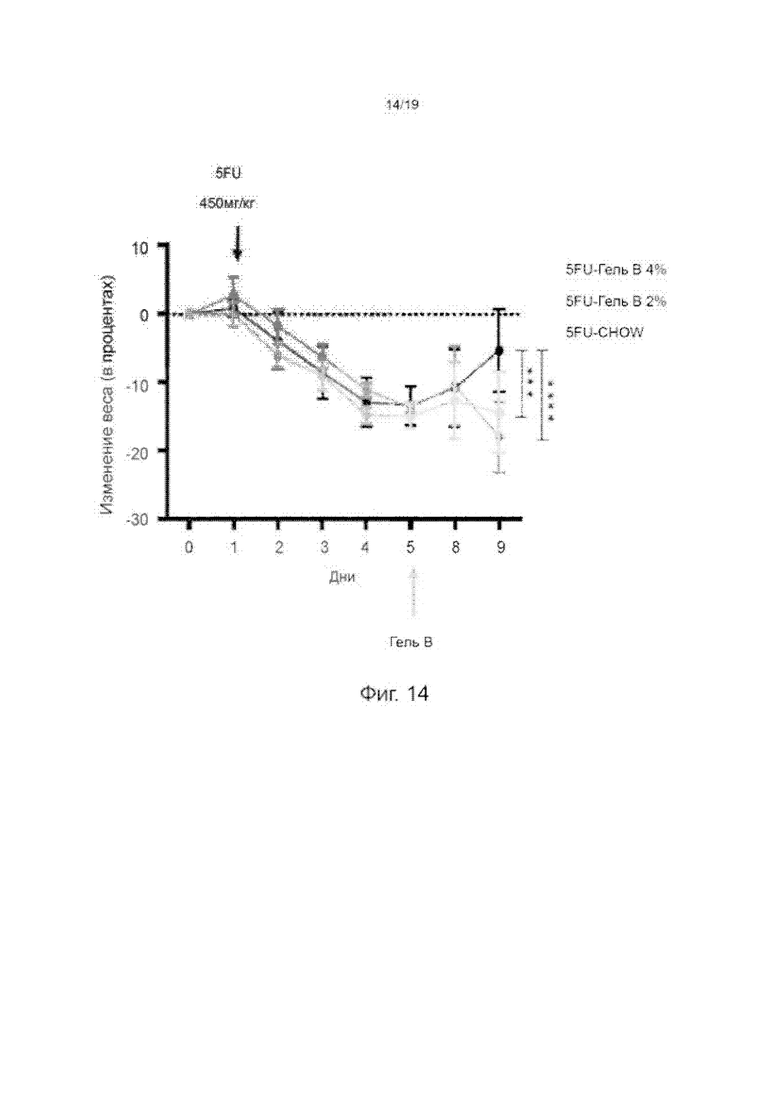
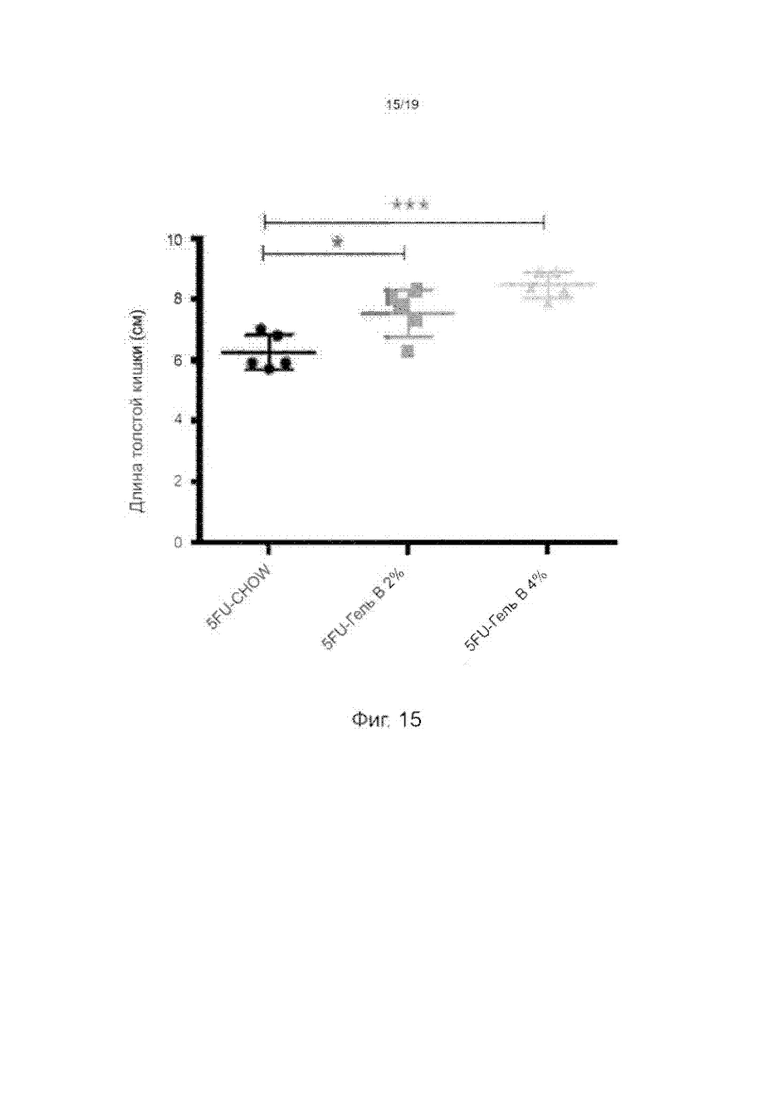

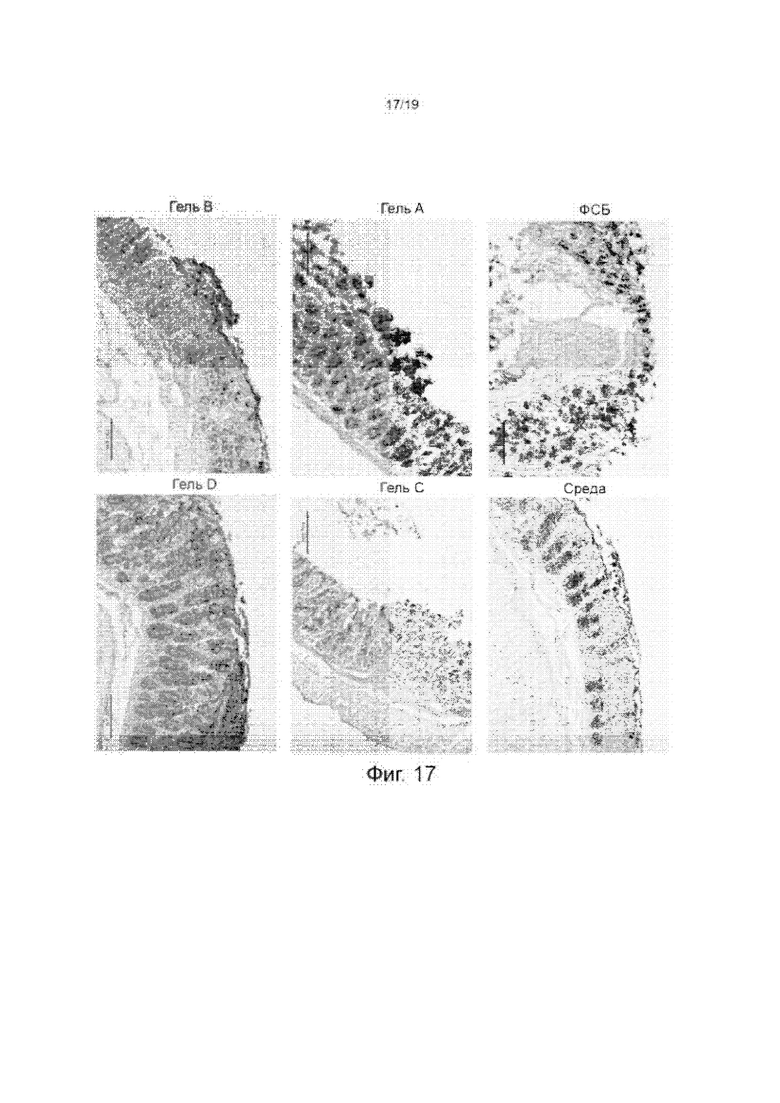
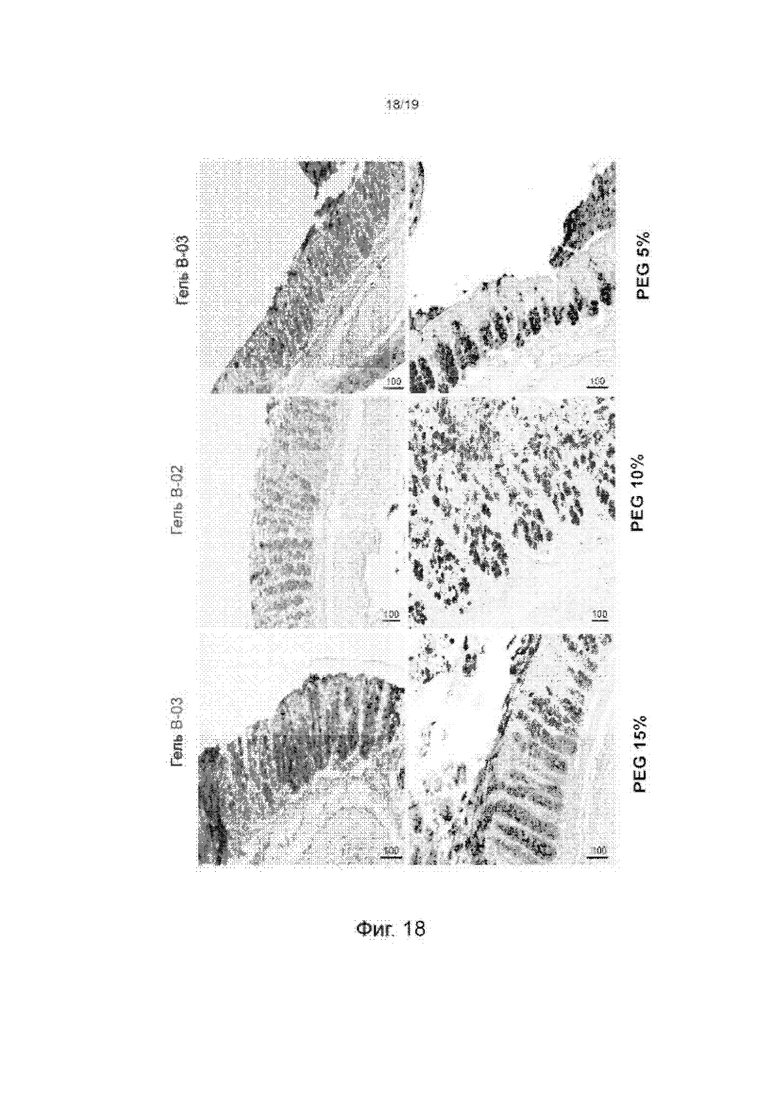
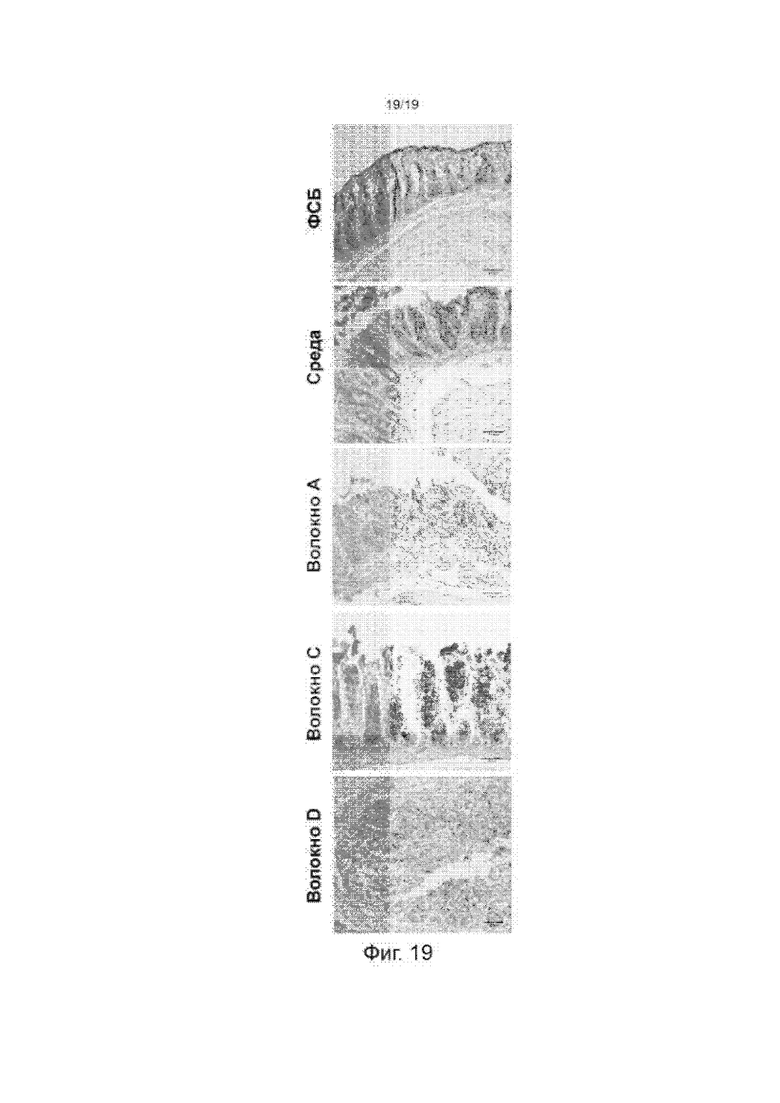
Изобретение относится к области медицины. Предложен способ профилактики или лечения неалкогольной жировой болезни печени или неалкогольного стеатогепатита у субъекта, нуждающегося в этом, включающий введение в желудочно-кишечный тракт субъекта терапевтически эффективного количества сшитого полисахарида, имеющего модуль упругости (G') от 500 Па до 10000 Па. Способ обеспечивает повышение содержания муцина в тканях ЖКТ и увеличение белка плотного соединения ZO-1 в тканях толстой кишки, а также регенерацию тканей кишечника. 13 з.п. ф-лы, 19 ил., 2 табл., 6 пр.
1. Способ профилактики или лечения неалкогольной жировой болезни печени или неалкогольного стеатогепатита у субъекта, нуждающегося в этом, включающий введение в желудочно-кишечный тракт субъекта терапевтически эффективного количества сшитого полисахарида, имеющего модуль упругости (G') от 500 Па до 10000 Па.
2. Способ по п. 1, отличающийся тем, что модуль упругости (G') составляет от 1000 Па до 8000 Па.
3. Способ по п. 1, отличающийся тем, что модуль упругости (G') составляет от 600 Па до 9000 Па.
4. Способ по п. 1, отличающийся тем, что модуль упругости (G') составляет от 800 Па до 8000 Па.
5. Способ по п. 1, отличающийся тем, что модуль упругости (G') составляет от 1000 Па до 6000 Па.
6. Способ по любому из пп. 1-5, отличающийся тем, что полисахарид представляет собой карбоксиметилцеллюлозу.
7. Способ по п. 6, отличающийся тем, что карбоксиметилцеллюлоза ковалентно сшита.
8. Способ по п. 7, отличающийся тем, что карбоксиметилцеллюлоза сшита поликарбоновой кислотой или бифункциональным ПЭГ.
9. Способ по п. 8, отличающийся тем, что карбоксиметилцеллюлоза сшита ПЭГДЭ или лимонной кислотой.
10. Способ по любому из пп. 6-9, отличающийся тем, что сшитая карбоксиметилцеллюлоза получена сшиванием карбоксиметилцеллюлозы, имеющей вязкость для 1% (масс./масс.) раствора в воде при 25 °C от 6000 сП до 11000 сП.
11. Способ по п. 10, отличающийся тем, что карбоксиметилцеллюлоза сшита с лимонной кислотой.
12. Способ по п. 11, отличающийся тем, что сшитая карбоксиметилцеллюлоза имеет (а) насыпную плотность по меньшей мере 0,5 г/мл, (b) коэффициент поглощения среды (КПС) в ИЖС/вода (1:8), который составляет по меньшей мере 40, и (c) G' не менее 1500 Па в форме частиц, которые (i) составляют не менее 95% по массе в диапазоне от 100 мкм до 1000 мкм со средним размером в диапазоне от 400 до 800 мкм и (ii) имеют потери при сушке 10% (масс./масс.) или менее.
13. Способ по п. 12, в котором сшитая карбоксиметилцеллюлоза имеет КПС в ИЖС/вода (1:8) от 50 до 110.
14. Способ по п. 6, где сшитая карбоксиметилцеллюлоза имеет G' от 500 Па до 8000 Па и коэффициент поглощения среды от 40 до 100 в ИЖС/воде (1:8) в форме частиц, которые (i) имеют по меньшей мере 95% по массе в диапазоне от 100 мкм до 1000 мкм со средним размером в диапазоне от 400 до 800 мкм и (ii) имеют потерю при сушке 10% или менее (масс./масс.).
| US 20130089737 A1, 11.04.2013 | |||
| US 20160222134 A1, 04.08.2016 | |||
| US 20100055184 A1, 04.03.2010 | |||
| US 20100233267 A1, 16.09.2010 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2022-10-28—Публикация
2018-04-16—Подача