Изобретение относится к системам доставки, которые делают возможным импульсное высвобождение веществ, таких как лекарственное вещество, в ответ на изменение рН. Более специфично, оно касается введения лекарственных веществ в желудочно-кишечный тракт, в особенности положения-специфичной доставки лекарственных веществ в кишечник посредством перорального применения. Предлагается рН-зависимая система высвобождения, которая позволяет быстро высвобождать лекарственные вещества под влиянием рН жидкостей кишечника. Система доставки лекарственных веществ способна полностью разрушаться в течение короткого периода времени, позволяя осуществлять доставку практически всего объема содержащегося лекарственного вещества в желаемое место/сегмент. Это достигается при помощи окружения лекарственных веществ слоем рН-чувствительного покрытия, содержащего набухающий компонент. Структура покрытия такова, что набухающий компонент включен в непрерывный матрикс рН-чувствительного покрывающего полимера в концентрации ниже порога фильтрации. Как только внешний слой кишечно-растворимого покрытия начинает разрушаться при изменении рН, ЖК-сок может достичь набухающего агента, который набухает достаточно для того, чтобы ускорить дальнейшее полное разрушение оболочки и, как следствие, вызывает высвобождение лекарственного вещества в целевой области.
Поскольку как изобретение проиллюстрировано с помощью рН-зависимой системы доставки, специалисту будет очевидно, что объем изобретения не ограничен фармацевтическими или лекарственными формами. Скорее, изобретение может быть использовано в любой ситуации, в которой желательно быстрое высвобождение вещества в ответ на изменение рН. Примерами таких областей могут служить защита культур или детергенты для мытья.
Специфическая доставка лекарственных веществ в выбранное место или сегмент ЖК тракта желательна при терапии широкого круга различных заболеваний и состояний. Особенно желательно иметь возможность доставлять лекарственные вещества таким образом, чтобы они направлялись к определенным сегментам ЖК тракта. Направленная доставка лекарственных веществ в определенные сегменты ЖК тракта предоставляет возможность локального лечения ЖК заболеваний, уменьшая таким образом побочные эффекты лекарственных веществ или неудобной и болезненной прямой доставки лекарственных веществ. Такая специфическая доставка также сильно увеличивает эффективность лекарственного вещества и делает возможным снижение минимально эффективной дозы. Более того, направленная доставка в отдельные части ЖК тракта может иметь преимущества в случае, когда всасывание лекарственного вещества в систему кровообращения ограничивается только частью ЖК тракта. В таких случаях, всасывание может быть увеличено, если лекарственное вещество доставляется в полной мере импульсным образом во внутрь области всасывания ЖК тракта, поскольку это могло бы увеличить движущую силу абсорбции в том месте, где это особенно необходимо.
Существенные колебания значений рН наблюдаются в ЖК тракте и принимая значения от примерно 1 в желудке, 6,6 в проксимальном (верхнем) отделе тонкой кишки до пиковых значений 7,5 в дистальном отделе тонкой кишки (Evans et al., 1988, Gut, 29: 1035).
Исторически разница между рН желудка и тонкой кишки использовалась для пероральной доставки лекарственных веществ в кишечный тракт с использованием рН-чувствительного полимерного покрытия. Доставка лекарственных веществ в места, расположенные после желудка, особенно желательна для лекарственных веществ, разрушающихся под действием кислой среды или ферментов желудка или для лекарственных веществ, вызывающих неблагоприятные последствия при локальной активности в желудке. Низкие значения рН желудка и присутствие пищеварительных ферментов привело к созданию дозированных форм лекарственных веществ для орального применения, в которых лекарственное вещество поставляется с кишечно-растворимым покрытием.
Материалы кишечно-растворимых покрытий проявляют устойчивость к желудочным жидкостям, но легко растворимы жидкостями кишечника. Кишечно-растворимые материалы являются, в первую очередь, слабыми кислотами, содержащими кислые функциональные группы, которые способны к ионизации при повышенных значениях рН. При низком рН желудка кишечно-растворимые полимеры протонированы и - из-за этого - нерастворимы. При повышении рН в кишечном тракте эти функциональные группы ионизуются, и полимер становится растворимым в жидкостях кишечника. Таким образом, кишечно-растворимое тонкое полимерное покрытие позволяет покрытым твердым формам, например капсуле, содержащей лекарственное вещество, проходить целой через желудок в тонкую кишку, где лекарственное вещество высвобождается рН-зависимым образом. Лекарственное вещество может стать доступным для всасывания в системе кровообращения или локально в ЖК тракте, где оно вызывает свой фармакологический эффект.
Кишечно-растворимые полимеры, используемые в настоящее время для покрытия дозированных фармацевтических форм для орального применения включают целлюлозу, винил и акриловые производные. Наиболее обычными кишечно-растворимыми покрытиями являются сополимеры метакриловой кислоты (Eudgartis), фталат ацетат целлюлоза, сукцинат ацетат целлюлоза и сополимеры стирол-малеиновой кислоты (Ritschel, W.A., Angewante Biopharmazie, Stuttgart (1973), pp. 396-402; Agyilirah, G.A., et al., "Polymers for Enteric Coating Applications" in Polymers for Controlled Drug Delivery, Tarcha, P.J. ed., CRC Press, (1991) Boca Raton, pp. 39-66).
Для достижения положения-специфичной доставки в определенные области желудочно-кишечного тракта существует несколько стратегий. Системы доставки, зависящие от времени, обладают свойством высвобождения лекарственного вещества после определенного периода, проходящего с момента контакта системы с водой (набухание системы). Однако надежность таких систем ограничена значительными изменениями времени прохода по ЖК тракту (OCTT). Если скорость прохождения больше или меньше ожидаемой, лекарственное вещество может быть высвобождено в неправильном месте или вне области всасывания лекарственного вещества. Вторая стратегия использует разницу, наблюдающуюся в окружающих условиях в различных местах ЖК тракта, обходя таким образом проблемы различий OCTT. Существуют две различные подстратегии: системы, реагирующие на бактериальные ферменты, могут быть использованы для направления в прямую кишку, тогда как системы, реагирующие на изменения рН, могут быть использованы для направления в различные области ЖК-тракта. Системы, зависящие от бактериальных ферментов, имеют два основных ограничения. В первую очередь, бактериальная флора может варьировать от индивидуума к индивидууму; если нужная бактерия не присутствует у пациента, лекарственное вещество может вообще быть не высвобождено. Более того, высвобождение из таких систем, как правило, довольно медленно и импульсного типа высвобождения трудно достигнуть. рН-зависимые системы имеют то преимущество, что они место-специфичны. Точно также как системы, зависящие от бактериальных ферментов. Они мало зависят от времени прохода через ЖК-тракт (orocaecal transit time (OCTT)), которое может различаться у разных пациентов. Более того, они не зависят от наличия бактерий. Наконец, рН-чувствительные полимеры, делающие доступным место-специфическое высвобождение, легко коммерчески доступны.
Однако, важным ограничением данной техники является тот факт, что растворение рН-чувствительного покрытия происходит медленно при значениях рН, которые только немного выше заданного значения. Поскольку колебания значений рН в кишечнике могут приводить к ситуации, в которой рН окружающей среды слегка выше заданного значения в желаемом участке, растворение/разрушение покрытия происходит зачастую медленно. Как следствие, кинетика высвобождения лекарственного вещества в заданной желаемой области часто имеет время запаздывания в несколько часов или лекарственное вещество будет медленно высвобождаться в течение нескольких часов. Поскольку из физиологии время нахождения в заданном месте ограничено, эта задержка или медленное высвобождение существенно снижает количество лекарственного вещества, эффективно доставляемого в заданную область. Более того, профиль сокращений кишечника различается у отдельных пациентов и во время различных заболеваний. Сочетание этого со временем запаздывания или медленным высвобождением лекарственного вещества приводит к тому, что место высвобождения лекарственного вещества тяжело контролировать. Например, оно может меняться в области от подвздошной до толстой кишки.
Таким образом, объект настоящего изобретения представляет надежный вариант рН-зависимой системы доставки - импульсной доставки. Импульсное высвобождение лекарственного вещества, запускаемое изменением рН, могло бы обеспечить быстрое и сайт-специфичное высвобождение лекарственного вещества в кишечнике. Оно имеет преимущества в случаях, когда желательно достижение высоких концентраций лекарственного вещества в определенных областях кишечника в течение короткого периода времени, либо для лечения, либо для влияния на градиент концентраций, что позволит увеличить абсорбцию вещества в зоне всасывания.
Авторы настоящего изобретения неожиданно обнаружили, что данная цель может быть достигнута, если включить в структуру слоя рН-чувствительного покрытия разрушающий (например, набухающий) компонент. Как здесь показано, новый тип композитного покрытия существенно увеличивает скорость высвобождения лекарственного вещества по сравнению с обычными рН-чувствительными покрытиями, не содержащими разрушающего агента. Таким образом, изобретение представляет рН-зависимую систему импульсного высвобождения (PPRS), содержащую ядро, окруженное слоем покрытия, где ядром является действующее вещество, а покрытие состоит из рН-чувствительного материала покрытия с включенным набухающим компонентом.
Не вдаваясь в теорию, предполагается, что набухающий материал включен во всю структуру рН-чувствительного полимера. Начинающееся рН-зависимое разрушение композитного покрытия в результате растворения рН-чувствительного полимера делает возможным абсорбцию воды частицами набухающего компонента, расположенного непосредственно под поверхностью покрытия. Внешний пласт покрывающего слоя подвергается разрушению при набухании набухающего компонента, и нижележащие частицы набухающего компонента, а также несмоченный полимер становятся доступными для действия жидкости. Таким образом, покрывающий полимер будет активно разрушаться, что приведет к быстрому и полному разрушению с последующим импульсным высвобождением лекарственного вещества. Дальнейшая информация о предлагаемом в соответствии с изобретением механизме рН-зависимого импульсного высвобождения лекарственных веществ представлена на схеме на Фиг. 1 и в описании чертежей.
Используемый здесь термин «набухающий компонент» относится к смеси соединений, способных к набуханию под действием жидкостей на основе воды. В области технологии приготовления лекарственного вещества он иногда используется как «разрушающий компонент». Это гидрофильный материал природного, синтетического или полусинтетического происхождения. Способность набухающего компонента, используемого для практического применения изобретения, к набуханию может варьировать. Способность к набуханию выражается как в количестве воды, которое компонент может абсорбировать, в пересчете на его сухой вес. Например, набухающий компонент с набухающей способностью, равной 10, может абсорбировать в 10 раз большую массу воды. В одном варианте осуществления, набухающий компонент имеет способность набухания, равную 1,1 или более, предпочтительно 5 или более, более предпочтительно 7 или более. Вообще, чем выше способность к набуханию набухающего компонента в кишечно-растворимом покрытии, тем быстрее и эффективнее произойдет разрушение покрывающего слоя в начале рН-зависимого разрушения (растворения) внешнего слоя кишечно-растворимого покрытия. Таким образом, набухающий компонент предпочтительно имеет способность набирать воду весом более чем в 7 раз больше собственного, например, как минимум в 10 раз, около 15 раз или даже больше, около 20 или 25 раз.
Подходящие набухающие агенты для данного изобретения включают натрия крахмала гликолат (Primojel™, Explotab™) или кросс-сшитую карбоксимтил целлюлозу (Ac-Di-Sol™). Однако специалисту будет очевидно, что другие типы набухающих веществ, уже известных или тех, которые будут открыты, также охвачены. Более того, комбинация двух или более компонентов может быть использована.
В одном варианте осуществления крахмал гликолят натрия используется в качестве набухающего компонента. Крахмал гликолят натрия используется в пероральных препаратах в качестве разрушающего агента (дезинтегранта) в составе капсул или таблеток. Разрушение происходит при быстром захвате воды, с последующим быстрым и обширным набуханием. Однако использование его в матриксе чувствительного к действию pH устойчивого кишечного покрытия, как описано здесь, ранее не было известно. Крахмал гликолят натрия является натриевой солью карбоксиметилового эфира крахмала. Молекулярная масса обычно около 500000-11000000. Это очень мелкий, белый или бесцветный, легко пересыпающийся порошок, без запаха или почти без запаха. Он практически нерастворим в воде и нерастворим в большинстве органических растворителей. Он состоит из сферических или овальных гранул, 30-100 мкм в диаметре, частично из менее сферических гранул размером 10-35 мкм в диаметре. В предпочтительном варианте осуществления Primojel™ или Explotab™ используются в качестве набухающих агентов. Primojel является крахмала гликолатом натрия USP-NF, получаемый при кросс-сшивке и карбоксиметилировании картофельного крахмала с последующей очисткой. Он соответствует последним изданиям Ph. Eur. (натрия крахмала гликолат типы А, В и С), USP/NF (натрия крахмала гликолат типы А и В), JPE. Как степень кросс-сшивки, так и степень замещения были оптимизированы для сохранения максимальной эффективности разрушения. Primojel™ впитывает свой 25-й кратный вес в воде. Получающаяся высокая способность к набуханию в сочетании с водопроницаемостью является причиной его высокоэффективной способности к разрушению.
Используемый здесь термин «кишечно-растворимое покрытие» относится к материалам покрытий, устойчивых в рН-среде, или их смесям. Примеры подходящих материалов покрытий включают ацетатфталат целлюлозы, фталат гидроксипропил-целлюлозы и акриловые полимеры EUDRAGIT™. Сюда также включены современные набухающие гидрогели, полученные из нейтральных или развитых полимерных систем (см. Peppas et al., Expert Opin Biol Ther. 2004 Jun;4(6):881-7 или WO98/43615).
В предпочтительном варианте осуществления используются акриловые полимеры. В одном варианте осуществления Eudragit® L 100 или L 100-55 используются для доставки лекарственных веществ в двенадцатиперстную кишку (рН>5,0). Для доставки в тощую кишку (рН>6,0) подходит для использования Eudragit® L 100. В другом варианте осуществления комбинация Eudragit® S 100 и набухающего компонента делает возможным пульс-высвобождение в нижней части подвздошной кишки и восходящей части толстой кишки (рН от 6,0 до 7,5). Сайт-специфическая доставка лекарственных веществ также может быть достигнута при сочетании Eudragit® S 100 и Eudragit® L-типов.
Покрытие также может содержать одну или более добавок, например пластификатор, который облегчает образование полимерной пленки и делает возможным образование протяженных, легко структурируемых и эластичных слоев покрытия. Подходящие добавки в покрытия включают полиэтиленгликоль (ПЭГ), триэтилцитрат (ТЭЦ), дибутилсебацинат (ДБС), трибутилцитрат, диэтилфталат и ацетилтрибутилцитрат. В отдельных аспектах данного изобретения слой покрытия содержит Eudragit, например Eudragit S 100, в комбинации с натрия крахмала гликолатом в качестве набухающего агента и полиэтиленгликоль (ПЭГ) в качестве пластификатора. Как продемонстрировано нижеследующими примерами, профиль высвобождения лекарственного вещества, содержащегося в капсуле, покрытой слоем такого покрытия, зависит от рН и имеет характер импульсного высвобождения.
В другом аспекте изобретение представляет PPRS, содержащую слой покрытия из Eudragit S 100 в комбинации с кросс-сшитой карбоксиметилцеллюлозой в качестве набухающего компонента. В дальнейшем аспекте изобретение содержит слой покрытия из Eudragit L 100 в комбинации с натрия крахмала глюконатом.
Однако стоит отметить, что общая идея, лежащая в основе настоящего изобретения, т.е. композитный слой покрытия, содержащий как набухающий компонент, так и материал покрытия, не ограничивается определенным типом материала покрытия. Таким образом, изобретение не ограничивается известными рН-чувствительными материалами покрытия, но также охватывает покрывающие и/или набухающие материалы, которые будут открыты.
Использование набухающих компонентов для достижения контролируемого высвобождения лекарственного вещества известно в технологии. Патент US 4871549 раскрывает регулируемую по времени систему длительного высвобождения лекарственного вещества, в которой высвобождение лекарственного вещества вызывается разрывом мембраны через определенный период времени. Система содержит препарат, содержащий ядро, лекарственное вещество, набухающий компонент и внешнюю мембрану из водонерастворимого материала покрытия. Когда система попадает в растворяющую среду ЖК тракта, вход воды и увеличение объема набухающего компонента вызывают разрыв водопроницаемой мембраны. Таким образом, лекарственное вещество высвобождается после предопределенного периода времени. Подчеркивается, что, в отличие от настоящего изобретения, система US 4871549 не зависит от рН желудочно-кишечно жидкостей. Более того, набухающий компонент присутствует как отдельный, внутренний слой и не включен во внешний слой покрытия.
Двухфазная система OROS™ от Alza Company была разработана для контролируемой по времени импульсной доставки водорастворимого и водонерастворимого лекарственных веществ в определенное место ЖК тракта (например, в толстую кишку). Например, OROS-CT™ основано на набухающих свойствах изолированного осмотического ядра, обеспечивающего рН-независимое контролируемое по времени высвобождение лекарственного средства.
Европейский патент EP0384646 B1 описывает лекарственную композицию, которая находится внутри водонерастворимого корпуса капсулы и запечатано пробкой из гидрогеля. Эта система доставки лекарственного средства известна как PULSINCAP™. При оральном применении покрытие капсулы растворяется в желудочном соке, и пробка из гидрогеля набухает. В заданное или определенное время набухающая пробка извлекается из лекарственной формы PULNICAP™ и содержащееся в капсуле лекарственное средство высвобождается.
Европейский патент EP1021171 также относится к контролируемой по времени системе доставки лекарственных средств. Она состоит из ядра, содержащего лекарственное средство и набухающий агент, и покрытия, окружающего ядро. Ядро состоит из водонерастворимого, гидрофобного носителя, в который включен дисперсный материал. В присутствие водоосновных жидкостей, дисперсный материал формирует каналы от внешнего слоя покрытия к ядру. Каналы контролируют скорость попадания воды в ядро. Материал ядра набухает, прорывает покрытие и быстро разрушается для высвобождения лекарственного средства. Есть ряд существенных отличий между EP1021171 и настоящим изобретением. Во-первых, гидрофобная пленка и гидрофильный дисперсный материал нерастворимы в жидкостях ЖК тракта. Таким образом, в отличие от изобретения, покрытие останется нерастворенным вне зависимости от рН. Во-вторых, дисперсный материал включен в материал носителя для создания каналов, через которые вода может достичь набухающего ядра. Скорость, с которой зависимые от времени системы доставки высвобождают содержащееся лекарственное средство, зависит от толщины покрытия и количества дисперсного материала, т.е. количества каналов. Таким образом, количество дисперсного материала в покрытии является решающим для момента доставки лекарственного средства, например 4 или 6 часов после орального приема лекарственного средства. Однако настоящее изобретение касается систем доставки лекарственного средства, в которых момент высвобождения лекарственного средства определяется рН окружающей среды; присутствие набухающего компонента не влияет на начало высвобождения лекарственного средства, только ускоряя процесс, после того, как он был запущен изменением рН. В-четвертых, в EP1021171 набухающее ядро обеспечивает силу для конечного разрушения окружающего покрытия. Система изобретения явно независима от ядра. В-пятых, EP1021171 требует формирования пропускающей структуры гидрофильного дисперсного порошка внутри гидрофобного носителя для гарантированного эффективного формирования каналов. Как будет детально описано ниже, в смешанном кишечно-растворимом покрытии изобретения формирование пропускающего матрикса не должно быть допущено, поскольку это приведет к немедленному рН-независимому высвобождению лекарственного средства. Для системы изобретения важно использование количества набухающего агента меньше порога пропускания.
WO 98/13029 раскрывает пероральный состав с отсроченным немедленным высвобождением (Oral Delayed Immediate Release), содержащий спрессованное ядро, содержащее один или более активных веществ, окруженное покрытием, содержащим один или более полимерных материалов, в котором высвобождение активного вещества (веществ) из ядра происходит из-за пробоя покрытия после определенного времени задержки; вышеуказанное ядро, содержащее один или более мгновенно высвобождаемых носителей и не имеющее существенных свойств набухания при действии ЖК жидкостей, и вышеуказанный полимерный материал покрытия, являющийся существенно нерастворимым и/или неразрушаемым в ЖК жидкостях.
Таким образом, рН-контролируемая система импульсного высвобождения, содержащая набухающий компонент, включенный в непроницаемом виде в структуру рН-чувствительного материала покрытия, в представленном здесь виде не описана ранее.
Для гарантированного рН-зависимого высвобождения вещества, окруженного слоем покрытия, набухающий компонент должен быть доступен для жидкостей только при начальном растворении структуры, в которую он включен. Таким образом, набухающий компонент сначала должен быть отделен от жидкостей рН-чувствительным материалом покрытия для предотвращения преждевременного набухания и разрушения слоя покрытия. Было обнаружено, что это может быть достигнуто при использовании суспензии набухающего агента в растворе рН-чувствительного материала покрытия, такого как кишечно-растворимые полимерные покрытия или иные полимерные покрытия. Покрывающая суспензия содержит растворитель или смесь растворителей, в которых растворим материал покрытия и в которых набухающий компонент нерастворим и не подвержен набуханию. Таким образом, частицы набухающего агента в покрывающей суспензии окружены растворенным материалом покрытия. Покрывающая суспензия может быть нанесена на вещество, которое должно быть покрыто, например, при распрыскивании. После удаления растворителя или смеси растворителей, получающийся слой покрытия состоит из материала покрытия, в который включены частицы набухающего компонента.
В предпочтительном варианте осуществления покрывающая суспензия изготавливается с использованием органического растворителя. Большинство рН-чувствительных материалов покрытия растворимы в органических растворителях, таких как ацетон или изопропиловый спирт, тогда как подходящие набухающие компоненты нерастворимы в органических растворителях и находятся в этих растворителях в ненабухшем виде. В одном аспекте покрывающая суспензия содержит Eudragit в качестве материала покрытия и крахмал гликолят натрия в качестве набухающего компонента в смеси органических растворителей с небольшим процентом воды, например ацетон:вода (97:3, v/v). Вода используется как пластификатор.
Поскольку набухающие частицы располагаются на внешней стороне слоя покрытия, они могут вызывать разрушение покрытия уже перед достижением желаемого значения рН; покрытие, содержащее набухающий компонент может быть, необязательно, окружено дополнительным тонким слоем покрытия, содержащим рН-чувствительный полимер без какого-либо набухающего компонента.
Выполнение покрытия во многом зависит от композиции и структуры материала покрытия. Адекватные свойства достигаются только тогда, когда существует непрерывная пленка рН-чувствительного полимера и набухающий компонент включен в непропускающем виде, чтобы не допустить разрушение покрытия до достижения желаемого значения рН. Точное количество набухающего компонента в слое покрытия будет зависеть от нескольких свойств материала покрытия, физико-химических свойств набухающего компонента (особенное значение здесь имеет размер частиц материала), процесса приготовления и условий во время процесса, других наполнителей, которые могут присутствовать в покрытии и так далее. Специалист сможет экспериментально определить оптимальное количество набухающего компонента для конкретной ситуации без чрезмерных усилий, например, используя систему симуляции ЖКТ, описанную в Примере 1. Основываясь на результатах первоначальных экспериментов и общем знании проводящих систем, специалист сможет определить, как изменить дизайн и композицию состава для достижения желаемой функциональности. Если, например, уменьшается размер частиц набухающего материала, его концентрация в слое покрытия также должна быть снижена для предотвращения формирования проводящей структуры набухающего материала.
В другом аспекте изобретение представляет способ получения системы с рН-контролируемым испульсным высвобождением твердых субстратов, включающий шаги получения покрывающей суспензии в соответствии с изобретением, покрытия твердых веществ вышеуказанной суспензией и создания условий для испарения растворителя таким образом, чтобы формировался слой покрытия, в котором набухающий агент включен в структуру рН-чувствительного материала покрытия. Твердый субстрат легко покрывается суспензией при ее распылении.
Более того, использование описанной здесь выше покрывающей суспензии делает возможным получение рН-контролируемых систем импульсного высвобождения, преимущественно систем доставки лекарственных средств.
рН-контролируемая система импульсного высвобождения (PPRS) представляемая здесь, делающая возможным импульсное высвобождение вещества в ответ на изменение рН, содержит ядро, окруженное слоем покрытия, где вышеуказанное ядро содержит действующее вещество. Также может быть использована смесь двух или более действующих веществ. Слой покрытия может быть нанесен непосредственно на ядро таким образом, что внешняя поверхность ядра будет находиться в контакте с внутренней поверхностью слоя покрытия. Также, однако, возможно присутствие одного или более слоев, отделяющих внешнюю поверхность ядра от внутренней поверхности слоя покрытия.
В предпочтительном варианте осуществления действующее вещество, окруженное рН-чувствительным слоем покрытия, является лекарственным средством, например лекарственным средством для лечения или профилактики заболевания. Однако действующее вещество также может быть диагностическим веществом, таким как отслеживаемые молекулы, например стабильный изотоп. Ядро, содержащее действующее вещество, является, например, капсулой или таблеткой. Твердое ядро, содержащее вещество и, необязательно, дополнительные материалы, может быть покрыто нанесением суспензии по изобретению. Дополнительные материалы, которые могут быть использованы в приготовлении ядер, содержащих лекарственное средство, являются любыми из широко используемых в фармацевтике, и должны отбираться на основании сочетаемости с действующим лекарственным средством и физико-химическими свойствами ядра. Они включают связующие вещества, дезинтегранты, наполнители, сурфактанты, стабилизаторы и любриканты.
Подходящие связующие вещества включают производные целлюлозы, такие как метилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, крахмал и им подобные.
Подходящие набухающие компоненты включают кукурузный крахмал, прежелатинизированный крахмал, кросс-сшитую карбоксиметилцеллюлозу (AC-DI-SOL™), натрия крахмала гликолат (Primojel, EXPLOTAB™), кросс-сшитый поливинилпирролидон, альгиновую кислоту и любой набухающий компонент, известный в технологии производства лекарственных средств. Было показано, что введение набухающего разрушающего компонента не только в материал покрытия, но также в ядро, содержащее лекарственное средство, обеспечивает создание рН-чувствительных систем доставки лекарственных средств с высоким импульсным профилем высвобождения.
Подходящие наполнители включают лактозу, маннит, микрокристаллин, кальция целлюлозы карбонат, фосфат кальция, сульфат кальция, микрокристаллин целлюлозу, декстран, крахмал, сахарозу, ксилит, лактит, маннит, сорбит, хлорид кальция, полиэтиленгликоль и им подобные.
Примерами сурфактантов являются лаурил сульфат натрия, сорбитмоноолеат, полиоксиэтилен сорбитанмонолеат, соли желчных кислот, глицеролмоностеарат и им подобные.
Могут быть использованы стабилизаторы наподобие любых антиоксидантов, буферов, кислот и им подобных.
Примерами любрикантов являются стеарат магния, глицеролбегенат и стеарилфумарат натрия.
В одном варианте осуществления ядро, содержащее лекарственное средство, является наполненной лекарственнымм средством желатиновой капсулой, с дополнительными напонителями или без. Типичные наполнители, которые могут быть добавлены в состав капсулы, включают, но не только: наполнители, такие как микрокристаллическая целлюлоза, двуводный фосфат кальция, сульфат кальция, лактоза, сахароза, сорбитол или любой другой инертный наполнитель. В дополнение также могут быть добавлены жидкие вспомогательные вещества, такие как кремнезем, тальк или любые другие материалы, придающие порошку текучесть. Далее может быть добавлен любрикант по необходимости: полиэтиленгликоль, лейцин, глицеролбегенат, стеарат магния или стеарат кальция.
Лекарственное средство может быть введено в таблетки или гранулы.
Специальный вариант осуществления настоящего изобретения касается PPRS для доставки действующих веществ, например лекарственных средств или диагностических молекул, в определенные места ЖК тракта. В зависимости от используемого типа материала покрытия вышеуказанная система доставки лекарственных средств является специфичной для толстой кишки системой доставки или специфичной для двенадцатиперстной кишки системой доставки.
В специальном аспекте изобретение представляет специфичную для толстой кишки PPRS, например, для специфической доставки лекарственных средств, таких как нестероидные противовоспалительные лекарственные средства (NSAID), цетрореликс или мезалазин (5-ASA), или диагностические молекулы, такие как стабильные изотопы углеводов, в толстую кишку. Проблема направленной доставки лекарственных средств в толстую кишку стояла перед учеными в течение двух последних десятилетий. Исходно рассматриваемая как относительно безопасный орган, необходимый только для абсорбции воды и электролитов, а также временного хранения кала, толстая кишка является в последнее время объектом возрастающей значимости для физиологии человека и для доставки лекарственных средств. Научный интерес в области доставки лекарственных средств в толстую кишку был подогрет необходимостью лучшего лечения заболеваний толстой кишки: от серьезных запоров и диареи, изнуряющих воспалительных заболеваний кишечника (язвенные колиты и болезнь Крона) до карциномы толстой кишки, третьей наиболее распространенной формы рака, как у мужчин, так и у женщин. Направленная доставка лекарственных средств в толстую кишку дает, таким образом, гарантию лечения в месте заболевания, понижение дозы и уменьшение систематических побочных эффектов. Кроме локального лечения, толстая кишка также может быть использована как место попадания лекарственных средств в кровоток для целей систематической терапии. Например, лекарственные средства (например, белки или протеины), которые легко деградируют или плохо абсорбируются в верхних частях ЖК тракта, могут быть преимущественно абсорбированы в толстой кишке из-за пониженного уровня пищеварительных ферментов по сравнению с тонкой кишкой. Более того, доставка лекарственных средств в толстую кишку также может быть использована как средство достижения распределенной по времени терапии заболеваний, чувствительных к циркадным ритмам, таким как астма или артриты.
В то время как оральное применение является предпочтительным для приема лекарственных средств для введения в толстую кишку, оно имеет свои проблемы. Толстая кишка составляет наиболее удаленную часть ЖК тракта и орально принимаемые составы должны в идеале иметь замедленное высвобождение (или препятствовать высвобождению) лекарственного средства в верхних отделах ЖК, но высвобождать лекарственные средства непосредственно при входе в толстую кишку. Эффективная защита лекарственного средства от разнообразных и враждебных условий в желудке и тонкой кишке может быть достигнута при использовании рН-чувствительных покрытий. Однако низкое содержание жидкости и вязкая природа содержимого толстой кишки препятствует растворению и высвобождению лекарственных средств из известных на данный момент специфичных для толстой кишки составов. Авторы настоящего изобретения неожиданно обнаружили, что последняя проблема может быть решена при введении набухающего компонента в слой покрытия.
Изобретатели использовали систему симуляции желудочно-кишечного тракта (GISS; см. Пример 1) для исследования кинетики высвобождения лекарственного средства на модели мезалазина (5-ASA) из капсул, покрытых рН-чувствительным кишечно-растворимым покрытием, содержащим разные количества набухающего компонента. Было показано (см. Пример 2), что процент набухающего компонента в слое покрытия влияет на начало и импульсную природу профиля высвобождения рН-контролирумой системы импульсного высвобождения изобретения. Было показано, что высвобождение лекарственного средства в фазе IV GISS, симулирующей специфичное высвобождение в толстой кишке, составляло 90% от общего количества высвобожденного, если 4 или 5% набухающего компонента Primojel было включено в покрывающую суспензию, содержащую Eudragit и ПЭГ. Содержание 10% Primojel в покрывающей суспензии приводит к 56% высвобождению лекарственного средства в фазе IV. Таким образом, для этого специфического применения PPRS в соответствии с изобретением это является оптимальным уровнем содержания набухающего компонента в слое покрытия.
В дальнейшем варианте осуществления изобретение представляет PPRS, специфически доставляющую лекарственное средство, например L-Dopa (также известное как леводофа) в двенадцатиперстную кишку. Оральное введение L-Dopa является на данное время предпочтительным вариантом лечения дефицита дофамина в мозге, вызывающего паркинсонизм. Наилучшая абсорбция L-Dopa происходит в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Фармакокинетика L-Dopa такова, что в крови наблюдаются флуктуации его уровня, что приводит к флуктуациям моторных функций страдающих пациентов. Устойчивые к среде желудка гранулы (содержащие L-Dopa) основаны на плавучем покрытии с рН-чувствительным покрытием с импульсным высвобождением, как здесь описано, могут быть использованы для поддержания постоянного количества лекарственного средства и зоне абсорбции, предотвращая таким образом эффекты флюктуации моторных функций в настоящей фармакотерапии болезни Паркинсона.
В другом варианте осуществления место-специфическая доставка включает доставку действующего вещества в специализированную ткань тонкой кишки. Например, изобретение представляет PPRS для доставки действующего вещества, наподобие вакцины, в пейеровы бляшки. Пейеровы бляшки - совокупность крупных лимфоидных тканей овальной формы, расположенных в секретирующей слизь выстилки тонкой кишки. Эти лимфоидные узелки особенно многочисленны в самой нижней части тонкой кишки, переходящей в более крупный отдел кишечного тракта, область пищеварительной системы, известная как подвздошная кишка. Они детектируют антигены и мобилизуют высокоспециализированные белые кровяные клетки, называемые В-клетками, для продукции антител, предназначенных для атаки чужеродных частиц. Направленность на пейеровы бляшки может быть достигнута при использовании покрытия, состоящего из полимера, такого как Eudragit S100, соединенного с набухающим компонентом, таким как кросс-сшитая карбоксиметилцеллюлоза (AC-DI-SOL™) и натрия крахмала гликолат (Primojel, EXPLOTAB™).
Подписи к чертежам
Фиг.1. Схема предположительного механизма действия набухающего компонента, включенного в слой покрытия. На стадии 1 система доставки лекарственного средства подвергается воздействию кишечных жидкостей с рН>7. рН-чувствительный полимерный материал слоя покрытия начинает растворяться/разрушаться. На стадии 2 формируются микротрещины и протечки слоя покрытия таким образом, что находящиеся непосредственно под поверхностью частицы набухающего компонента смачиваются. Поглощение жидкости набухающим компонентом приводит к резкому увеличению его объема (стадия 3), сопровождающимся дальнейшим разрушением слоя покрытия, усилением проникновения жидкости в слой покрытия и набухании набухающего компонента. Этот каскад отвечает за быструю и полную деградацию слоя покрытия таким образом, что поверхность ядра, например, капсулы с лекарственным средством, становится доступной для окружающей среды (стадия 4). Имеет место постепенный переход от рН-зависимого разрушения к разрушению, основанному на действии водоосновных жидкостей на набухающий компонент.
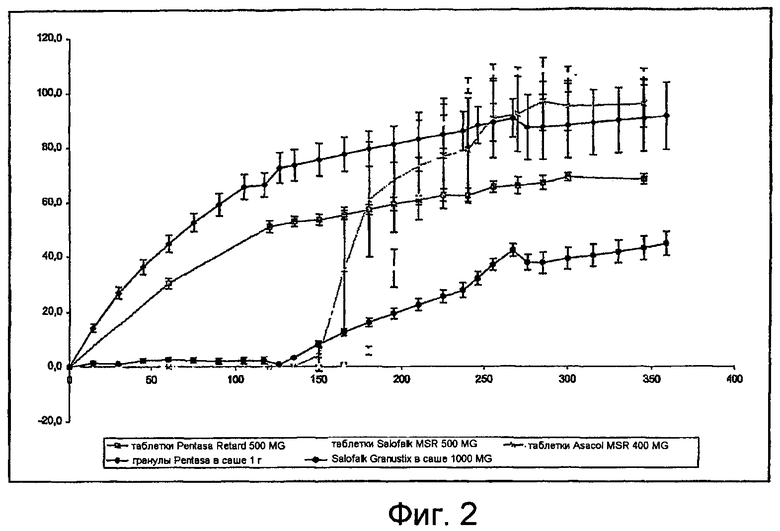
Фиг.2. Профиль высвобождения различных зарегистрированных лекарственных форм 5-ASA, полученный с использованием системы симуляции желудочно-кишечного тракта (GISS), описанной в примере 1. Фаза I - стимуляция желудка, фаза II - двенадцатиперстной кишки, фаза III - дистальной части подвздошной кишки, фаза IV - толстой кишки.
Фиг.3. Усредненный профиль высвобождения из 6 капсул, содержащих 5-ASA, имеющих покрытие из рН-чувствительного полимера (Eudragit S100). Высвобождение 5-ASA определяли за время использования системы GISS, описанной в примере 1. Более детально - см. пример 2.
Фиг.4. Усредненный профиль высвобождения из 6 капсул, содержащих 5-ASA, имеющих покрытие из рН-чувствительного полимера (Eudragit S100) и 5% набухающего компонента (Primojel™). Высвобождение 5-ASA определяли за время использования системы GISS, описанной в примере 1. Более детально - см. пример 2.
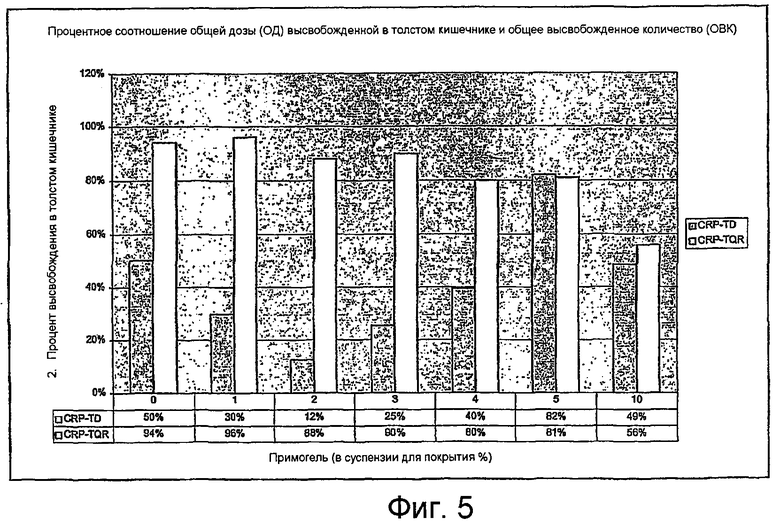
Фиг.5. Специфичность к толстой кишке импульсной рН-зависимой системы высвобождения (PPRS), содержащую желатиновую капсулу с 50 мг лекарственного средства 5-ASA, покрытую слоем покрытия (20 мг/капсулу) 7% Eudragit S100 / 1% ПЭГ6000 и указанный процент набухающего компонента (Primojel™). CRP-TQR означает общее высвобожденное количество, являющееся процентом 5-ASA, высвобожденное в фазе IV, представляющей толстую кишку, от общего количества 5-ASA, высвобожденного в фазах I - IV. Процент высвобождения в толстой кишке от общей дозы (CRP-TD) является процентом от общей дозы, высвобожденном в фазе IV. Более детально - см. пример 2.
Фиг.6. Эффект процентного содержания набухающего компонента в покрывающей суспензии на скорость импульсного высвобождения лекарственного средства. Скорость определяется измерением периода времени, требуемого для высвобождения в среднем 50% (Т50) или 70% (Т70) от общей дозы лекарственного средства по отношению ко времени 0 (Т0), при котором было обнаружено <5% высвобождения лекарственного средства.
Примеры
Настоящее изобретение далее будет проиллюстрировано следующими примерами. Эти примеры - не ограничивающие и не ограничивают объем изобретения. Специалисту будет ясно, что много различных комбинаций рН-чувствительных материалов покрытия и набухающих компонентов подходят для использования в рН-контролируемых импульсных системах высвобождения изобретения; их специфическое соотношение может быть определено эмпирически.
Пример 1: система симуляции желудочно-кишечного тракта (GISS)
Пример описывает систему симуляции желудочно-кишечного тракта, которая была использована настоящими изобретателями для изучения профиля высвобождения лекарственного средства рН-контролируемой импульсной системой доставки лекарственных средств изобретения.
Лекарственное средство мезаламин (5-ASA) было использовано в качестве опытного лекарственного средства для оценки и подтверждения системы GISS. 5-ASA используется при терапии язвенных колитов и быстро абсорбируется в проксимальной части кишечника. Мы протестировали следующие коммерчески доступные лекарственные формы 5-ASA для орального применения: таблетки Salofalk®, гранулы Salofalk®, таблетки Asacol®, таблетки и гранулы Pentasa®.
GISS является тестом на растворимость, основанным на методике фармакопейной пластины (apparatus II, Prolabo, Rhone-Poulenc, Paris, France), как описано в USP 26 и Ph. Eur. IV. Во время теста, лекарственная форма подвергается четырем фазам воздействия, симулирующим последовательно: желудок, двенадцатиперстную кишку и проксимальный отдел толстой кишки. В Таблице 1 дано описание этих фаз, а также используемой биорелевантной среды. Пластина поворачивалась со скоростью 50 оборотов в минуту и температура системы поддерживалась равной 37°С.
Описание четырех фаз GISS
Буферная емкость была тестирована при измерении рН в GISS без или присутствии 5-ASA. Также было тестировано, меняется ли осмолярность во время теста на растворение.
Измерение высвобождения.
Профиль высвобождения модифицированной лекарственной формы для перорального применения измеряли с помощью спектрометрического измерения концентрации 5-ASA с помощью прибора Ultraspec 4052 TDS (LKB, Zoetermeer, The Netherlands). Специфическое поглощение 5-ASA детектировали (n=5) при длине волны 331 нм (Таблица 2). Если полученное значение концентрации выпадало из линейной области измерения, абсорбцию измеряли отдельно, после разведения пробы 3Н соляной кислотой и последующим измерением при 303 нм. Значение специфического поглощения 5-ASA равняется 236.
Специфическое поглощение 5-ASA за фазу
Рассчет.
Скорость высвобождения рассчитывали делением количества высвобожденного вещества за фазу на время пребывания в фазе. Селективность высвобождения в толстой кишке может быть выражено с использованием 3 различных параметров. Процент высвобождения в толстой кишке от общего высвобожденного количества (CRP-TQR), являющийся процентом, высвобожденным во время IV фазы, от общего высвобождения в фазах с I по IV. Во-вторых, процент высвобождения в толстой кишке от общей дозы (CRP-TD). Являющийся процентом от дозы, высвобожденной в фазе IV. В-третьих, доза, специфичная к толстой кишке (CSR), является дозонезависимым параметром, указывающим на селективное высвобождение дозы в толстой кишке по отношению к дозе, высвобожденной в трех остальных фазах GISS. Оно рассчитывается делением фракции, высвобожденной в фазе IV, на общую фракцию, высвобожденную в трех предшествующих фазах.
Результаты.
Система симуляции желудочно-кишечного тракта
Важным аспектом in vitro растворения рН-контролируемых лекарственных форм является то, что возможно влияние на рН самого высвобожденного соединения. В таблице 3 продемонстрировано, что GISS имеет достаточную буферную емкость для поддержания значений рН внутри необходимого диапазона (см. Таблицу 1) во время высвобождения 5-ASA в четырех фазах. Более того, осмолярность остается на уровне требуемых значений (Таблица 1) вне зависимости от присутствия 50 мг 5-ASA.
Средняя величина pH ± стандартное отклонение,
измеренная в GISS
в саше 1000 мг
MSR 400 мг
3.2. Профили высвобождения
На Фиг.2 показаны профили высвобождения исследованных продуктов. Как ожидалось, продукты с рН-чувствительным покрытием (таблетки Salofalk®, гранулы Salofalk® и таблетки Asacol®) вообще не высвобождают 5-ASA в симулированном желудке при наиболее быстрых условиях (фаза I). Более того, было показано, что таблетки Salofalk® высвобождают 5-ASA более проксимально, чем таблетки Asacol®. И те и другие не высвобождали большого количества 5-ASA в симулированной толстой кишке. Таблетки Pentasa® также как и гранулы Pentasa® высвобождали существенное количество (50-70%) 5-ASA в течение 2 часов в SGFsp (USP 26). Более того, и таблетки, и гранулы Pentasa® высвобождали 5-ASA в симулированном желудке в 3-5 раз быстрее, чем в симулированных тонкой и толстой кишке (Таблица 4). Гранулы Salofalk® демонстрируют время задержки, после которого начинается высвобождение с кинетикой 0 порядка. Все продукты действовали в соответствии с их фармацевтически-технологическим описанием.
Скорости высвобождения во время разных фаз для исследованных продуктов (приведенные к дозе 500 мг)
В Таблице 5 представлена селективность к толстой кишке для каждого продукта. Данные указывают на то, что селективность к толстой кишке мала. Только нижний продукт демонстрирует определенный уровень селективности к толстой кишке.
Величины CRP-TQR и CRP-TD для исследованных продуктов
Заключение
Профили высвобождения всех продуктов находятся в соответствии с их технологическими и доступными данными, полученными in vivo. Процент дозы, высвобожденной в симулированной толстой кишке, мал для всех продуктов. GISS является надежной системой, способной различать лекарственные средства орального применения с различными типами измененного высвобождения.
Пример 2. Разработка рН-контролируемой системы импульсного высвобождения (PPRS)
Этот пример демонстрирует положительный эффект включения набухающего компонента (в данном случае твердого крахмала гликолята натрия под торговым названием Primojel) в слой покрытия рН-чувствительного кишечно-растворимого материала покрытия.
Материалы и методы.
Готовили стандартный раствор для покрытия, содержащий 7% полиакрилановой смолы (Eudragit S100) и 1% ПЭГ6000 в смешанном растворителе ацетон/вода [97:3; по объему]. В стандартный раствор для покрытия вносили различные количества (1, 2, 3, 4, 5 или 10% (мас./об.)) вещества Primojel для получения различных покрывающих суспензий. Во втором эксперименте капсулы покрывали с помощью улучшенной процедуры покрытия. В стандартный раствор покрытия добавляли различные количества (4, 5, 6, 7% мас./об.) вещества Primojel.
Покрывающую суспензию наносили посредством распрыскивания (Capsule Coater, Labo Tech) на твердые желатиновые капсулы в количестве 29 г покрывающей суспензии на 20 капсул. Капсулы содержали 50 мг 5-ASA и Avicel™. Размер заряда равнялся 20 капсулам. Вслед за этапом покрытия капсулы подвергали нагреванию в течение 1 часа при 50°С для испарения смеси растворителей и получения полимерной пленки, такой как была образована вокруг капсулы композитным слоем покрытия.
Проведенные тесты.
Описанная в Примере 1 GISS была использована для исследования профиля высвобождения 5-ASA для каждой серии покрытых капсул. Усредненный профиль высвобождения определяли в реальном времени посредством определения каждые 3 минуты концентрации 5-ASA с использованием спектрофотометрии при 331 нм (n=6).
Рассчеты.
Скорость высвобождения выражали как время, необходимое для высвобождения 50% (T50) относительно 70% (T70) содержимого, рассчитанных из последнего измерения с величиной ниже 5%. Селективность к толстой кишке выражали с помощью двух параметров:
процент высвобождения в толстой кишке от общего высвобожденного количества (CRP-TQR),
процент высвобождения в толстой кишке от общей дозы (CRP-TD)
Результаты.
На Фиг.3 показано среднее геометрическое значение профилей высвобождения пяти различных капсул, которые были покрыты стандартными растворами покрытия, т.е. без набухающего компонента. Фиг.4 показывает средний профиль высвобождения шести различных капсул, покрытых 20 г слоя покрытия, содержащего набухающий компонент. Капсулы покрытые без набухающего компонента демонстрировали недостаточное высвобождение 5-ASA (50,4%) после 360 мин в GISS. К тому же наблюдался большой разброс в высвобожденной дозе (от 5 до 98%). Добавление набухающего компонента в покрывающую суспензию приводило к импульсному профилю высвобождения, после времени задержки примерно в 240 минут. Присутствие набухающего компонента в слое покрытия четко увеличивало скорость высвобождения лекарственного средства из капсулы, уменьшало вариабельность между капсулами, увеличивало CRP-TD. В Таблице 6 показаны все данные.
Характеристики капсул с покрытием, содержащим набухающий компонент Primojel в разной концентрации
Primojel
(t=360)
Влияние количества набухающего компонента в слое покрытия на специфичное к толстой кишке высвобождение лекарственного средства графически отображено на Фиг.5. Селективность к толстой кишке выражали в CRP-TQR и CRP-TD (аббревиатуры см. в Примере 1).
Капсулы, покрытые стандартным раствором для покрытия, содержащим 0-5% вещества Primojel демонстрируют CRP-TQR более 80%. CRP-TQR ниже в капсулах, покрытых 10% вещества Primojel в покрывающей суспензии. Только при концентрации 5% вещества Primojel, большая фракция от общей дозы высвобождается в симулированной проксимальной части толстой кишки, что видно по высокому значению CRP-TD. В среднем, 82% от общей дозы 5-ASA высвобождается в фазе IV данной GISS, тогда как другие тестированные капсулы высвобождают только до 50% в фазе IV.
Фиг.6 демонстрирует эффект процентного содержания вещества Primojel в покрывающей суспензии на скорость импульсного высвобождения лекарственного средства. Эта скорость определяется при измерении периода времени, теряющегося для высвобождения приблизительно 50% (T50) или 70% (Т70) от общей дозы лекарственного средства, по отношению ко времени ноль (Т0), в котором меньше 5% лекарственного средства детектируется.
Пример 3. Оптимизация PPRS
Этот пример описывает оптимизацию процедуры, описанной в примере 2 для производства рН-контролируемых систем импульсной доставки. Оптимизация включает первичные механические аспекты процесса покрытия, такие как уменьшение входной и выходной трубок, предварительный запуск насоса и использование стандартизованных стеклянных изделий и мешалок для приготовления покрывающей суспензии. Более того, набухающий компонент был включен не только в слой покрытия, но также и в ядро.
Материалы и методы.
На желатиновые капсулы, наполненные Avicel, 50 мг 5-ASA и 5% Primojel наносят слой из покрывающей суспензии, содержащей 7% Eudragit S100 и 1% ПЭГ:000 в смеси ацетон/вода [97:3]. Покрывающая суспензия далее содержит 4,5,6 или 7% вещества Primojel. Капсулы были покрыты 20 г покрывающей суспензии, как описано в примере 2. Каждая партия, содержащая 20 капсул, была тестирована в GISS, описанной в Примере 1 для определения профиля высвобождения 5-ASA.
Результаты.
Селективное для толстой кишки высвобождение выражалось как CRP-TQR и CRP-TD (см. Пример 1 для объяснения этих аббревиатур). Как показано в Таблице 7, высвобождение лекарственного средства из капсул, покрытых 4 или 5% вещества Primojel на 90% происходило в фазе IV GISS (CRP-TQR). Оставшееся высвобождалось в фазе III. Высвобождение лекарственного средства в симулированной проксимальной части толстой кишки из капсулы, покрытой 4 или 5% вещества Primojel составляло соответственно 67% и 59% от общей дозы (CRP-TD). Оба параметра уменьшались с увеличением процентного содержания вещества Primojel в покрытии из-за сокращения времени открытия покрытия. Для капсул с 6 и 7% вещества Primojel начало высвобождения наступало во второй фазе GISS (T0 составляло 155 и 149 мин, соответственно). Ранняя эрозия приводила к раннему разрушению покрытия в фазе III. Напротив, Т0 для капсул с 4 и 5% составляло 186 и 183 минуты, соответственно.
Данные измерений капсул с покрытием, нанесенным в соответствии с улучшенной процедурой нанесения покрытия, которая описана в Примере 3
Primojel
Все тестированные капсулы имели импульсный профиль высвобождения, что проиллюстрировано значениями Т50 и Т70 в Таблице 7. Капсулы, покрытые покрывающей суспензией с 4% вещества Primojel, высвобождали 70% лекарственного средства в течение 67 минут от начала высвобождения. Увеличение процентного содержания вещества Primojel сопровождалось уменьшением скорости высвобождения лекарственного средства; включение 7% вещества Primojel в покрывающую суспензию приводило к увеличению Т70 до 99 минут. В заключение, хотя все тестированные процентности продемонстрировали хороший импульсный профиль высвобождения, концентрации 4 или 5% вещества Primojel работали лучше всего в отношении к высвобождению в (симулированной) толстой кишке.
Пример 4
Этот Пример описывает использование второго типа набухающих компонентов. Готовили стандартный покрывающий раствор, содержащий 7% полиакрилатных смол (Eudragit S100) и 1% ПЭГ6000 в смеси растворителей ацетон/вода [97:3; по объему]. В стандартный покрывающий раствор добавляли различные количества (0,3 и 5%) Ac-Di-Sol™ в качестве набухающего компонента для производства покрывающих суспензий. Покрывающие суспензии наносили распрыскиванием (Capsule Coater, Labo Tech) на желатинизированные капсулы в количестве 50±5 мг сухого материала покрытия на капсулу. Капсулы содержали 50 мг 5-ASA, Avicel и 5% Primojel™. Размер заряда равнялся 20 капсулам. Вслед за этапом покрытия капсулы подвергали нагреванию в течение 1 часа при 50°С для испарения смеси растворителей и получения полимерной пленки, такой как была образована вокруг капсулы композитным слоем покрытия.
Капсулы тестировали в GISS, описанной в Примере 1 для изучения профиля высвобождения 5-ASA из каждой партии покрытых капсул.
Результаты.
В Таблице 8 показаны результаты измерений высвобождения, произведенные на капсулах, содержащих различное количество Ac-Di-Sol. В таблице приведены общие количества лекарственного средства во время теста (Released), время, при котором начиналось высвобождение лекарственного средства (Т0), время, необходимое для высвобождения 50% лекарственного средства после начала высвобождения (Т50), время, необходимое для высвобождения 70% лекарственного средства (Т70), и процент высвобождения в толстой кишке от общего высвобожденного количества (CRP-TQR).
Результаты измерений высвобождения лекарственного вещества с использованием покрытий на базе Eudragit S100, содержащих разные количества Ac-Di-Sol
Результаты четко показывают, что включение Ac-Di-Sol в покрытие увеличивает импульсное высвобождение лекарственного средства и увеличивает количество лекарственного средства, доставленного в прямую кишку.
Пример 5
В другом варианте осуществления изобретения водная дисперсия следующего состава:
Eudragit S100
Аммоний (1 М)
Триэтилцитрат
Primojel™
8,43 г
4,29 г
4,22 г
0,12 г
Дисперсия быстро превращалась в очень вязкую массу, которая не могла быть нанесена распрыскиванием на таблетки, капсулы или пилюли. Это означает, что использование водных растворителей не подходит для производства систем, описанных в данном изобретении.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2478372C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2646825C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИСФОСФОНАТОВ | 2005 |
|
RU2359678C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ АЗИТРОМИЦИНА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 1995 |
|
RU2130311C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С НАБУХАЮЩИМ ПОКРЫТИЕМ | 2004 |
|
RU2375048C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ РИЗЕДРОНАТА | 2005 |
|
RU2381791C2 |
| КОМПОЗИЦИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 2003 |
|
RU2336865C2 |
| ПРИМЕНЕНИЕ 5-АМИНОЛЕВУЛИНОВОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ В ТВЕРДОЙ ФОРМЕ ДЛЯ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ И ДИАГНОСТИКИ | 2008 |
|
RU2521228C2 |
| КОМПОЗИЦИЯ ПОКРЫТИЯ, СОДЕРЖАЩАЯ КРАХМАЛ | 2007 |
|
RU2440104C2 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА, УСТОЙЧИВАЯ К ДЕЙСТВИЮ ЖЕЛУДОЧНОГО СОКА, ВКЛЮЧАЮЩАЯ N-(2-(2-ФТАЛИМИДОЭТОКСИ)АЦЕТИЛ)-L-АЛАНИЛ-D-ГЛУТАМИНОВУЮ КИСЛОТУ (LK 423) | 2005 |
|
RU2375047C2 |




рН-контролируемая система импульсной доставки, согласно изобретению, включает ядро, окруженное внешним слоем покрытия. Указанное ядро включает действующее вещество, которое, предпочтительно, является фармацевтически активным веществом. Указанный внешний слой покрытия включает рН-чувствительный материал покрытия, в который включен набухающий компонент, имеющий способность набухать в воде, равную, по меньшей мере, 1,1 по отношению к собственному весу. Указанный набухающий компонент присутствует в вышеуказанном слое покрытия в количестве, которое, в зависимости от размера частиц и структуры покрытия, образует покрытие с непропускающей системой. рН-контролируемая система импульсной доставки предназначена для рН-зависимой место-специфической доставки действующего вещества, предпочтительно, в толстую или двенадцатиперстную кишку. Изобретение позволяет быстро освобождать действующее вещество благодаря наличию во внешнем слое покрытия набухающего компонента. 6 н. и 9 з.п. ф-лы, 6 ил., 8 табл.
1. рН-контролируемая система импульсного высвобождения (PPRS), включающая ядро, окруженное внешним слоем покрытия, в которой указанное ядро включает действующее вещество, и в которой указанный внешний слой покрытия включает рН-чувствительный материал покрытия, в который включен набухающий компонент, имеющий способность набухать в воде, равную, по меньшей мере, 1,1 по отношению к собственному весу, причем указанный набухающий компонент присутствует в вышеуказанном слое покрытия в количестве, которое в зависимости от размера частиц и структуры покрытия образует покрытие с непропускающей системой.
2. Система по п.1, в которой указанный набухающий агент способен набирать воду, равную как минимум 5, предпочтительно как минимум 10 по отношению к собственному весу.
3. Система по п.1 и 2, в которой вышеуказанный набухающий компонент выбирается из группы, состоящей из крахмал гликолята натрия и кросс-сшитой карбоксиметилцеллюлозы, предпочтительно где вышеуказанным набухающим компонентом является крахмала гликолят натрия.
4. Система по п.1, в которой вышеуказанный набухающий компонент представляет собой крахмал гликолят натрия.
5. Система по п.1, в которой указанный материал покрытия выбирается из группы, состоящей из тримелитата ацетата целлюлозы, фталата гидроксипропилметил-целлюлозы, поливинил ацетат фталата, со-полимеризованных метакриловой кислоты/метиловых эфиров метакриловой кислоты, например, материалов, известных под торговой маркой EUDRAGIT™.
6. Система по п.1, в которой указанный слой покрытия дополнительно содержит пластификатор.
7. Система по п.1, в которой указанное действующее вещество представляет собой фармацевтически активное вещество.
8. Система по п.7, в которой указанное фармацевтически активное вещество выбирается из группы, состоящей из нейротрансмиттеров, таких как L-Dopa, агонистов или антагонистов гормонов, таких как сетрореликс, стероидных и нестероидных противовоспалительных средств, стабильных изотопов, иммуногенных веществ, таких как вакцины, или их комбинации.
9. Покрывающая суспензия для применения при получении рН-контролируемых систем импульсного высвобождения (PPRS) по п.1, в которой указанная суспензия включает смесь рН-чувствительного материала покрытия и набухающего агента в растворителе или смеси растворителей, в которой указанный материал покрытия растворим в указанном растворителе, и где набухающий агент нерастворим и не набухает в указанном растворителе.
10. Покрывающая суспензия по п.9, в которой указанный растворитель или смесь растворителей содержит органический растворитель.
11. Способ получения систем для рН-контролируемого импульсного высвобождения твердого субстрата, включающий стадии получения покрывающей суспензии по п.9 или 10, нанесения вышеуказанной суспензии на твердый субстрат и испарения растворителя из суспензии таким образом, чтобы формировался слой покрытия, в котором набухающий компонент включен в матрикс рН-чувствительного материала покрытия.
12. Применение покрывающей суспензии по п.9 или 10 для получения рН-контролируемых систем импульсной доставки, предпочтительно систем доставки лекарственных веществ.
13. Фармацевтическая композиция, содержащая рН-контролируемую систему импульсного высвобождения (PPRS) по любому из пп.1-8 и фармацевтически приемлемый носитель.
14. Способ для место-специфической доставки лекарственного вещества, включающий введение подходящего количества фармацевтической композиции по п.13 субъекту, нуждающемуся в этом.
15. Способ по п.14, в котором указанная место-специфическая доставка включает доставку лекарственного вещества, направленную в толстую кишку или в двенадцатиперстную кишку.
| US 6277412 B1, 21.08.2001 | |||
| US 2002110593 A1, 15.08.2002 | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| http://www.solimide.eu/en/pharmapolymers/eudragit/enteric/enteric_spec.html | |||
| Edge S., Steel D.F., Staniforth J.N | |||
| et al | |||
| Powder compaction properties of sodium | |||
Авторы
Даты
2011-02-27—Публикация
2005-07-29—Подача