ПРИОРИТЕТ
[0001] Настоящая заявка заявляет приоритет по предварительной заявке США № 61/378199, поданной 30 августа 2010 года, которая включена в данный документ ссылкой.
ПРЕДПОСЫЛКИ
[0002] Левулиновая кислота или 4-оксопентановая кислота представляет собой органическое соединение с формулой CH3C(O)CH2CH2CO2H. Это – кетокислота. Левулиновую кислоту, как правило, получают химически, например, путем нагревания сахарозы с концентрированной соляной кислотой. Процесс протекает через промежуточное образование глюкозы, которая изомеризуется во фруктозу и затем гидроксиметилфурфурол.
Левулиновая кислота представляет собой потенциальный предшественник для нейлоноподобных полимеров, синтетических каучуков и пластмасс. Левулиновая кислота представляет собой универсальный синтетический промежуточный продукт, например, в синтезе фармацевтических препаратов, и является предшественником в промышленном производстве других химических продуктов, таких как метилтетрагидрофуран, валеролактон и этиллевулинат.
КРАТКОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
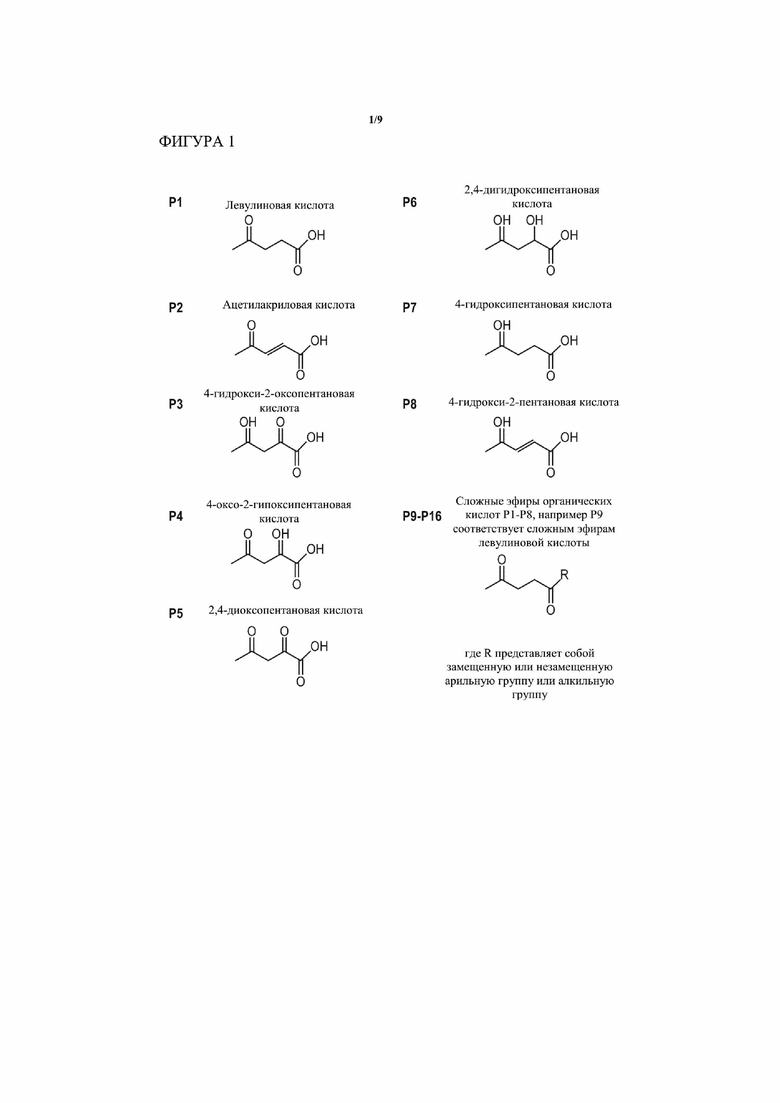
[0003] В определенных аспектах и вариантах осуществления настоящее изобретение обеспечивает химический путь для превращения пирувата, получаемого из сахаров или других углеродных источников, в ценные C5 материалы, такие как левулиновая кислота. Типичные C5 соединения показаны на Фигурах 1 и 2. При применении с сахарами в качестве углеродного источника ключом к данному пути является превращение C6 сахаров (таких как, без ограничения, глюкоза, фруктоза, галактоза) и/или C5 сахаров (таких как, без ограничения, ксилоза, арабиноза) в пируват, а затем превращение пирувата в одно или несколько ценных C5 соединений посредством химических или биохимических реакций альдольного присоединения, окисления, восстановления, дегидратации и циклизации. При применении с другим углеродным источником, таким как, без ограничения, жирные кислоты и глицерин, углеродный источник сначала превращают в пируват, а затем превращают в одно или несколько ценных C5 соединений, которые включают линейные C5 кетокислоты или сложные эфиры, или их циклизированные производные следующей общей формулы: C5C4(X)C3C2(Y)C1(=O)(Z), где X представляет собой либо гидроксильный, либо кетоновый кислород, Y представляет собой либо водород, либо гидроксильный или кетоновый кислород, связь между C3 и C2 углеродами является либо одинарной, либо двойной (например, насыщенной или ненасыщенной), и Z представляет собой алкокси, сульфидную или феноксигруппу с тем, чтобы получить функциональную группу либо сложного эфира, либо сложного тиоэфира, либо карбоновой кислоты. В некоторых вариантах осуществления C5 соединение представляет собой C5C4(O1)C3C2(Y)C1(=O)(O1), где индекс “O1” означает один и тот же кислородный атом так, что образуется циклический сложный эфир или лактон, и Y представляет собой либо водород, либо гидроксильный или кетоновый кислород. Все другие атомные валентности или связи, как предполагается, заняты водородными атомами, если ранее не указано иное.
[0004] В одном аспекте настоящее изобретение обеспечивает способ создания соединения, которое представляет собой C5 кетокислоту или сложный эфир или C5 гидроксикислоту или сложный эфир или их циклическое производное. Способ включает превращение пирувата в C5 промежуточный продукт путем альдольного присоединения и превращение C5 промежуточного продукта в указанное соединение посредством химических или ферментативных этапов или их комбинации. В определенных вариантах осуществления C5 соединение имеет общую формулу C5C4(X)C3C2(Y)C1(=O)(Z) или C5C4(O1)C3C2(Y)C1(=O)(O1), которые описаны выше. В определенных вариантах осуществления соединение получают из 5-углеродного и/или 6-углеродного сахаров или сырья, подходящего в качестве углеродного источника для микробного хозяина. В этих вариантах осуществления способ включает образование пирувата из сахара или сырья (например, с помощью микробного хозяина) и альдольное присоединение ацетилальдегида к пирувату (например, в микробном хозяине или в бесклеточной системе) с получением, таким образом, 5-углеродной кетокислоты в качестве промежуточного продукта для получения желаемого C5 соединения. Ацетилальдегид для альдольного присоединения можно получить декарбоксилированием пирувата в микробном хозяине. Продукт альдольного присоединения может быть дополнительно подвержен одной или нескольким реакциям восстановления, окисления, дегидратации, переноса группы, гидролиза и/или лактонизации (например, каждая независимо в микробном хозяине или бесклеточной системе) с получением желаемого C5 продукта.
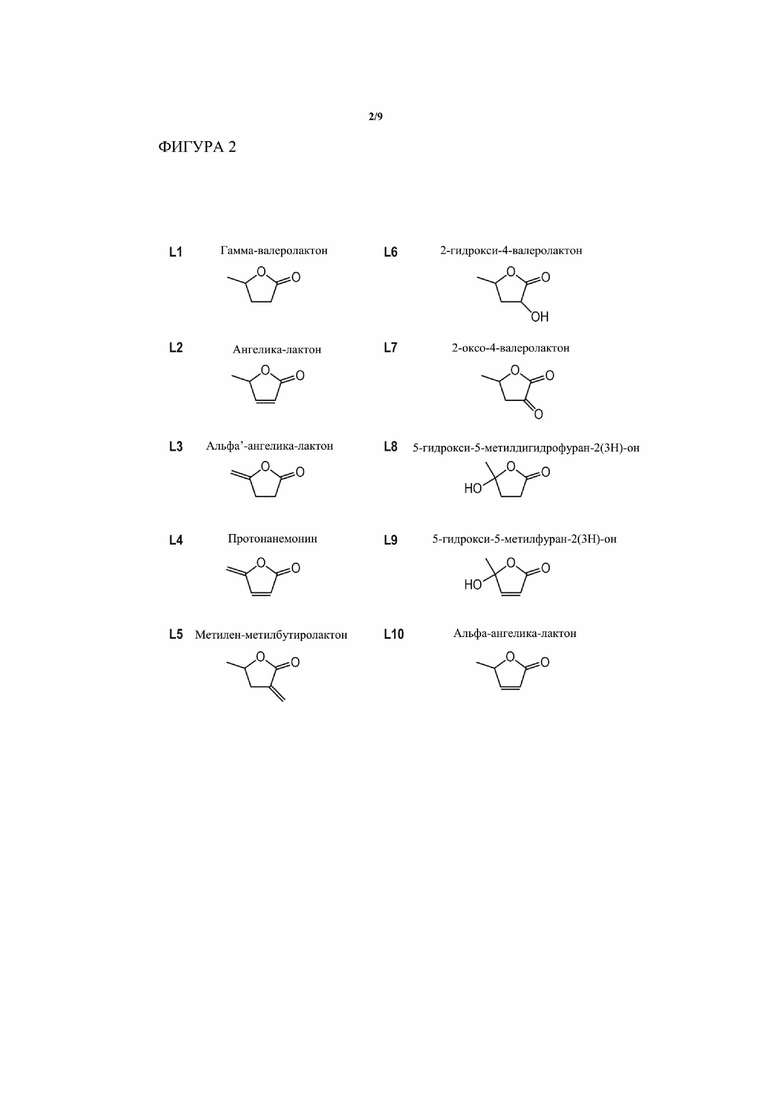
[0005] Такие продукты можно применять в качестве структурных элементов для получения коммерчески ценных химических веществ и топлив. Например, лактоны, такие как 2-оксовалеролактон (соединение L7 на Фиг. 2), 2-гидроксивалеролактон (соединение L6 на Фиг. 2), ангеликалактоны (соединение L2, L3 и L10 на Фиг. 2) и 4-валеролактон (γ-валеролактон, соединение L1 на Фиг.2) можно применять в качестве растворителя. Ангеликалактон и 4-валеролактон также можно превратить химически в метиленметилбутиролактон (MeMBL) (смотри, например, WO/2006/015023, WO/2006/015024 касательно способов катализа этого превращения). Метиленметилбутиролактон можно применять в качестве мономера или сополимера для увеличения термической устойчивости полиметилакрилатных (PMMA) полимеров, широко применяемых в электронике и сферах применения, связанных с двигателем внутреннего сгорания, или для производства полимеров в целом (таких как Poly(MeMBL), смотри, например, WO/2005/028529). К тому же, 4-валеролактон можно превращать с помощью химического катализа в валериановую кислоту и, дополнительно, в валератные сложные эфиры, а также изомерные бутены, бутадиен и другие алкены, включая алкены с восемью углеродами или более, как рассмотрено в Bozell J., Connecting Biomass petroleum Processing with a chemical bridge, Science 329:522-523 (2010). Левулиновую кислоту (соединение P1 на Фиг. 1) можно превратить в 1,4-пентандиол и дифеноловую кислоту, оба из которых можно применять для производства полимеров. δ-амминолевулиновая кислота (производное из левулиновой кислоты) представляет собой гербицид с оценочным спросом свыше 300 фунтов в год. Более того, левулиновую кислоту можно превратить в пирролидоны (WO/2004/085048), пирролидинoн (WO/2010/065833, WO/2004/085390, WO/2004/085349, WO/2004/084633), ангеликалактон (WO/2005/097723), 4-валеролактон и 2-метил-THF, которые являются конечными продуктами, или их можно дополнительно преобразовывать в другие соединения с различными полезными свойствами, такие как анионные жидкости (WO/2010/065833), биотоплива и топливные присадки. Левулиновую кислоту можно дополнительно использовать в качестве материала для батарей (например, патентный документ JP09190820), красок (патентный документ US5769929), покрытий (патентный документ JP06280041), антикоррозийных покрытий (патентный документ EP496555). Левулиновые сложные эфиры (или левулинатные сложные эфиры, соединения P9 на Фиг.1) представляют собой собственно полимерные структурные элементы, и после преобразования в кетали (патентный документ US 2008/0242721) и их можно также применять в качестве топливных присадок (как описано в патенте США 7153996, который включен в данный документ ссылкой в его полном объеме). К тому же, левулиновые сложные эфиры можно применять в продуктах личной гигиены (например, японский патент JP 05320023), поверхностно-активных веществах и смазочных средствах (патентный документ EP 882745), абсорбентах (смотри WO/1998/9843684). Все справочные материалы, упомянутые в этом абзаце, включены в данный документ ссылкой.
[0006] И левулиновую кислоту, и левулиновые сложные эфиры, и некоторые из лактонов, перечисленных на Фиг. 2, также можно применять в производстве фармацевтически активных ингредиентов и фармацевтических областях применения, некоторые из которых перечислены в Bozell J., Production of levulinic acid and use as a platform chemical for derived products, Resources, Conservation and Recycling 28:227-239 (2000). Например, в WO/1995/022524 сообщается о применении левулинатного метилового сложного эфира для синтеза новых индоловых производных, применяемых в качестве противоопухолевых средств. Левулиновую кислоту и 4-гидроксипентановую кислоту также можно применять в качестве хирального реагента с широким полем потенциальных областей применения (смотри, например, Meyers et al., Stereoselective alkylations in rigid systems. Effect of remote substituents on p-facial additions to lactam enolates. Stereoelectronic and steric effects, J. Am. Chem. Soc. 120:7429-7438 (1998). Фармацевтические области применения C5, полученных с помощью настоящего изобретения, могут включать применение бутиро- и валеро-лактоновых производных в качестве антибиотиков и средств, препятствующих образованию биопленок, посредством того, что они нарушают молекулярный механизм «чувства кворума» у бактерий (смотри, например, патентные документы EP 1716131 и WO/2006/117113). Дополнительные применения могут проистекать из биологически активного протоанемонима (соединение L4 на Фиг. 2). В довершение ко всему, левулиновую кислоту и сложные эфиры применяли в отношении продуктов питания, вкусовой добавки и ароматизаторов (патентный документ EP1533364), а также добавок во множестве потребительских товарах. Например, левулиновую кислоту применяют в качестве добавки в сигаретах (патентный документ WO/2010/051076). Все справочные материалы в данном абзаце включены в данный документ посредством ссылки.
[0007] В определенных вариантах осуществления настоящего изобретения способ включает превращение пирувата в 4-валеролактон. В другом варианте осуществления способ включает превращение пирувата в левулиновую кислоту. В другом варианте осуществления способ включает превращение пирувата в левулиновые сложные эфиры (левулинаты), такие как, без ограничения, этиллевулинат и пропиллевулинат. В другом альтернативном варианте осуществления настоящего изобретения способ включает превращение пирувата в ангеликалактон, альфа- и альфа’-ангеликалактоны. В еще одних вариантах осуществления способ включает превращение пирувата в 2,4-дигидроксипентановую кислоту или ее циклизированную форму, 2-гидрокси-4-валеролактон. В еще одном варианте осуществления способ включает превращение пирувата в 2-оксо-4-гидроксипентановую кислоту или ее циклизированную форму, 2-оксо-4-валеролактон.
В некоторых вариантах осуществления настоящего изобретения способ включает множественные ферментативные этапы, объединённые в единый метаболический путь в эукариотическом, прокариотическом или archaea ферментирующем хозяине, включая, без ограничения, Saccharamyces sp., Pichia sp., Pseudomonas sp., Bacillus sp., Chrysosporium sp. и Escherichia coli. В этих и других вариантах осуществления способ включает один или несколько ферментативных этапов, проводимых в бесклеточной системе, или этапов химического катализа, или их комбинацию, при этом различные промежуточные продукты пути необязательно выделяют и/или очищают из ферментативного бульона, что необходимо для завершения процесса.
[0008] Преимущество определенных вариантов осуществления настоящего изобретения в том, что они построены поверх основного метаболизма. Например, как C5, так и C6 метаболизм у эукариот, прокариот и archea может задействовать гликолиз для получения пирувата. Пируват представляет собой один из наиболее важных промежуточных продуктов основного метаболизма и помимо гликолиза может быть получен в результате метаболизма липидов, а также метаболизма аминокислот. Согласно способу настоящего изобретения берут пируват и превращают две молекулы пирувата в одну C5 молекулу, такую как левулиновая кислота и 4-валеролактон. В случае C6 сахаров выход углерода может составить до 80%. В случае C5 сахаров выход углерода теоретически может составить до 100%. Если в способе используют микробный штамм, способный к одновременному ферментированию C5 и C6, такой как, без ограничения, сконструированный Saccharomyces cerevisae и Pichia stipitis, то это делает возможным прямую ферментацию сахаров до левулиновой кислоты, 4-валеролактона или любого из C5 соединений, изображаемых на Фиг. 1 и Фиг. 2. Этот высокий достижимый выход представляет бесспорное промышленное преимущество по сравнению с альтернативными термохимическими способами получения левулиновой кислоты или гамма-валеролактона, в которых, как правило, получают молярные выходы 40% или менее.
[0009] В одном варианте осуществления настоящего изобретения в соответствии со способом превращают поток сахаров в одно или несколько из C5 соединений, перечисленных на Фигурах 1 и 2. В другом варианте осуществления крахмал применяют в качестве сырья для процесса. В другом варианте осуществления в соответствии со способом превращают лигноцеллюлозное сырье (включая, без ограничения, кукурузную солому, древесные стружки, бытовые отходы, отбросы целлюлозных и бумажных заводов) по меньшей мере в одно из C5 соединений, перечисленных на Фигурах 1 и 2.
[0010] В одном варианте осуществления настоящего изобретения в соответствии со способом превращают C6 сахара в одно или несколько из C5 соединений, перечисленных на Фигурах 1 и 2, предпочтительно в ферментирующих штаммах, высокоэффективных при потреблении и ферментировании C6 сахаров, таких как, без ограничения, Saccharomyces cerevisiae, штамм Cargill CB1 (как описано в WO/2007/106524), Pseudomonas, Chrysosporium и Escherichia coli (E.coli). В другом варианте осуществления настоящего изобретения в соответствии со способом превращают C5 сахара в одно или несколько из C5 соединений, перечисленных на Фигурах 1 и 2, предпочтительно в ферментирующих штаммах, высокоэффективных при потреблении и ферментировании C5 сахаров, таких как, без ограничения, сконструированные Saccharomyces cerevisiae и Pichia stipitis. В варианте осуществления настоящего изобретения в соответствии со способом одновременно превращают C5 и C6 сахара в C5 соединение, предпочтительно в ферментирующих штаммах, высокоэффективных при потреблении и ферментировании как C5, так и C6 сахаров (например, Saccharomyces cerevisiae). В другом варианте осуществления настоящего изобретения ферментирующие штаммы демонстрируют высокий уровень устойчивости к ингибиторам гидролизата биомассы, таким как, без ограничения, фураны, и к низкому pH или среде с высоким титром органической кислоты.
[0011] В определенных вариантах осуществления сырье содержит один или несколько C6 сахаров, выбранных из аллозы, альтрозы, глюкозы, маннозы, гулозы, идозы, талозы, галактозы, фруктозы, псикозы, сорбозы и тагатозы. В этих или других вариантах осуществления сырье содержит один или несколько C5 сахаров, выбранных из ксилозы, арабинозы, рибозы, ликсозы, ксилулозы и рибулозы.
[0012] Если способ настоящего изобретения применяют для превращения C5 и C6 сахаров в 4-гидроксипентановую кислоту или 4-валеролактон, путь конструируют так, чтобы он был редокс (восстановление-окисление) уравновешенным: два восстановительных эквивалента (образование NAD(P)H) образуются во время гликолиза с выходом пирувата (одна молекула глюкозы к двум молекулам пирувата) и два восстанавительных эквивалента расходуются (образование NAD(P)) в дальнейшем процессе от пирувата до 4-гидроксипентановой кислоты или 4-валеролактона (γ-валеролактона). Тот факт, что этот путь является редокс-уравновешенным в отношении образования этих двух молекул, даст в результате оптимизированное превращение в случае ферментационного процесса и снизит или устранит потребность дополнительного конструирования ферментирующего хозяина для противодействия неуравновешенности. В том, что касается ферментации сахаров непосредственно во все другие соединения или структурные элементы (Фиг. 1), ферментирующий хозяин будет зависеть от отдельных побочных реакций для уравновешивания пути или внешнего источника редокс-эквивалента, подходящего для уравновешивания пути.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0013] На Фигуре 1 показаны молекулярные формулы для левулиновой кислоты (соединение P1 на Фиг. 1), а также ценные производные, которые могут быть получены на различных этапах в пути и в различных вариантах осуществления процессов, описанных в настоящем документе (соединения P1 - P16 на Фиг. 1).
[0014] На Фигуре 2 показаны молекулярные формулы для различных C5 лактонов, которые могут быть получены на различных этапах в пути в соответствии с различными вариантами осуществления способа (соединения L1 - L10).
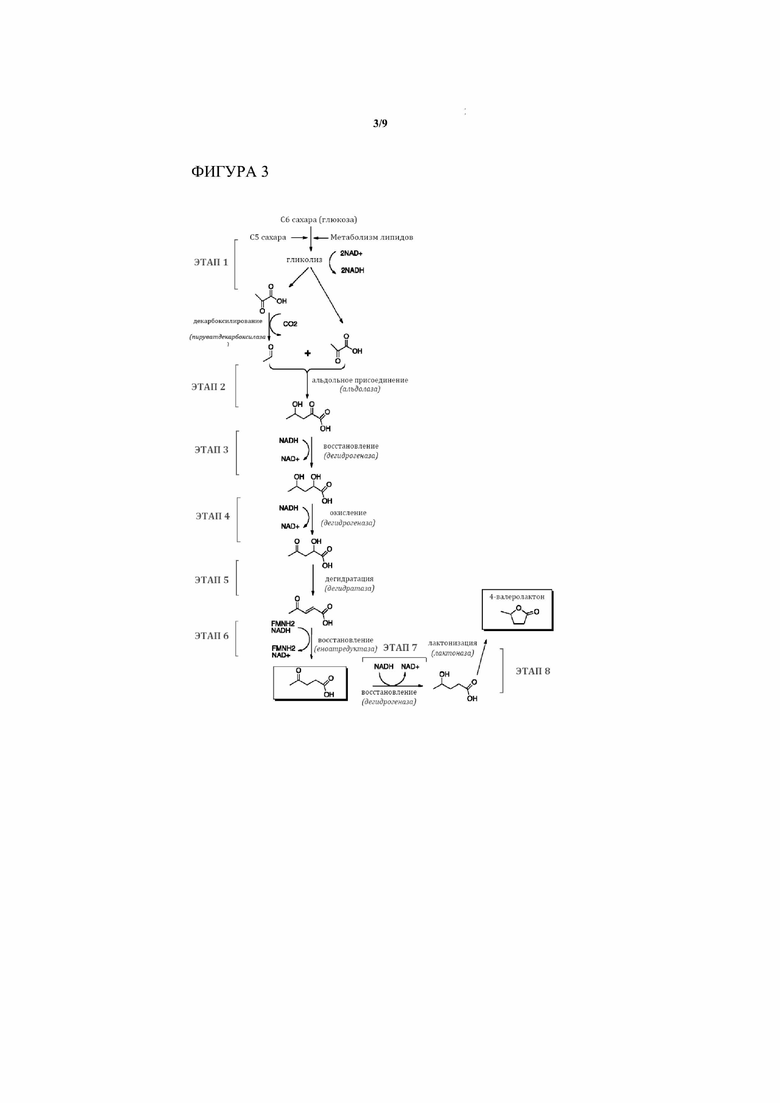
[0015] На Фигуре 3 приведен общий обзор биохимических процессов превращения пирувата в любое из C5 соединений Фиг 1 или Фиг. 2 с выделением определенных этапов. Некоторые возможные химические промежуточные продукты и субпути здесь не изображены. Смотри Фигуру 5 для более исчерпывающего изображения возможностей различных путей.
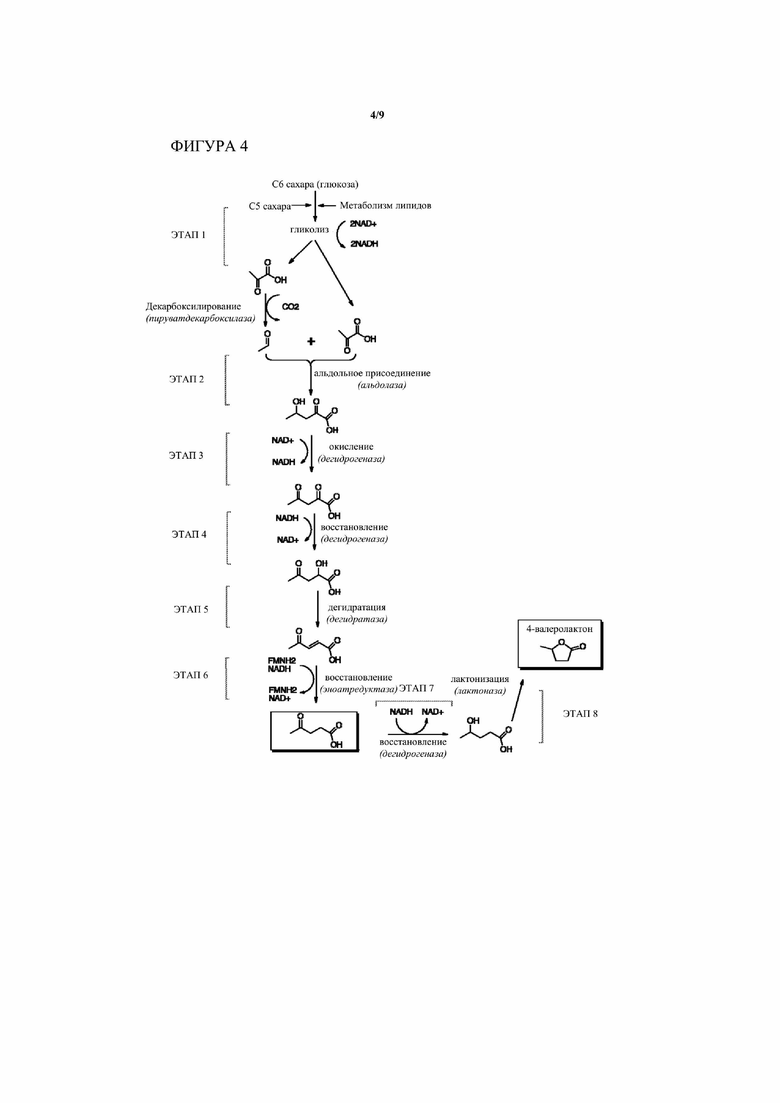
[0016] На Фигуре 4 приведен общий обзор биохимического пути и процессов в соответствии с определенными вариантами осуществления настоящего изобретения, где порядок этапов окисления/восстановления (соответствующих этапам 3 и 4 на Фиг. 3) инвертирован. Как и на Фиг. 3, некоторые возможные химические промежуточные продукты и субпути здесь не изображены. Смотри Фиг. 6 для более исчерпывающего изображения возможностей различных путей.
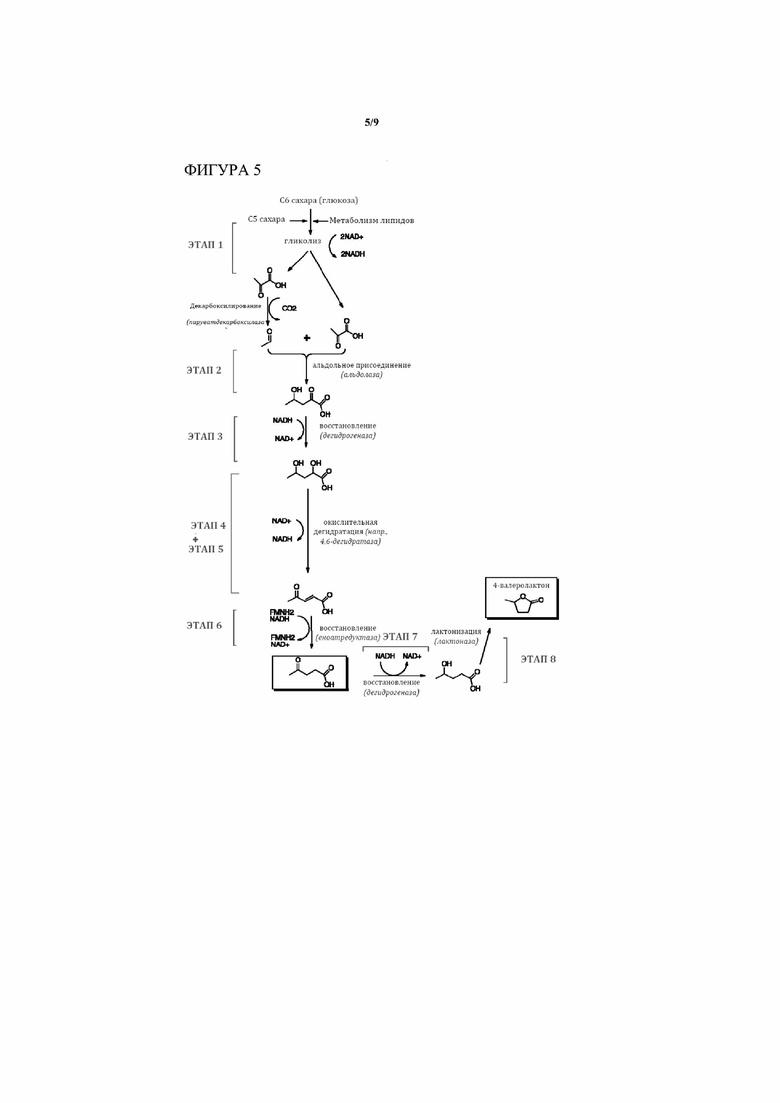
[0017] На Фигуре 5 приведен общий обзор биохимического пути/процессов Фиг. 3, где этап 4 и этап 5 сокращены в один этап с применением окислительной дегидратазы.
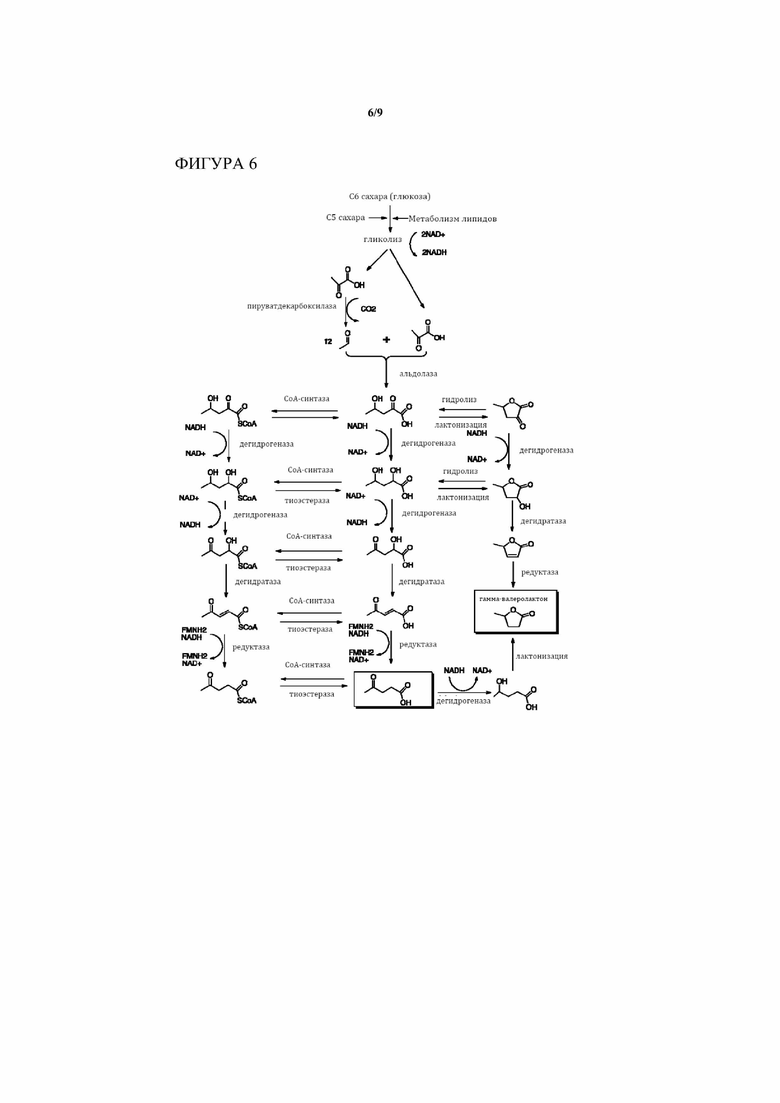
[0018] На Фигуре 6 приведен детальный обзор биохимического пути/процессов превращения пирувата в любое из C5 соединений или структурных элементов Фиг. 1 или 2. Вдобавок к химическим этапам, изображаемым на Фиг. 3, 4 и 5, изображены различные циклические промежуточные продукты, которые могут быть получены в результате реакции циклизации из промежуточных продуктов от основного пути, а также химическое преобразование, которое ведет от циклических лактоновых промежуточных продуктов к различным C5 соединениям или структурным элементам. Дополнительно также представлены различные CoA промежуточные продукты, которые могут быть получены из промежуточных продуктов в основном пути. Путь можно использовать для производства левулинил-CoA, из которого могут быть легко получены либо левулиновая кислота и 4-валеролактон, либо левулинат и/или другие пентановые сложные эфиры, такие как 4-оксопентановый сложный эфир (соединение P9) на Фиг. 1.
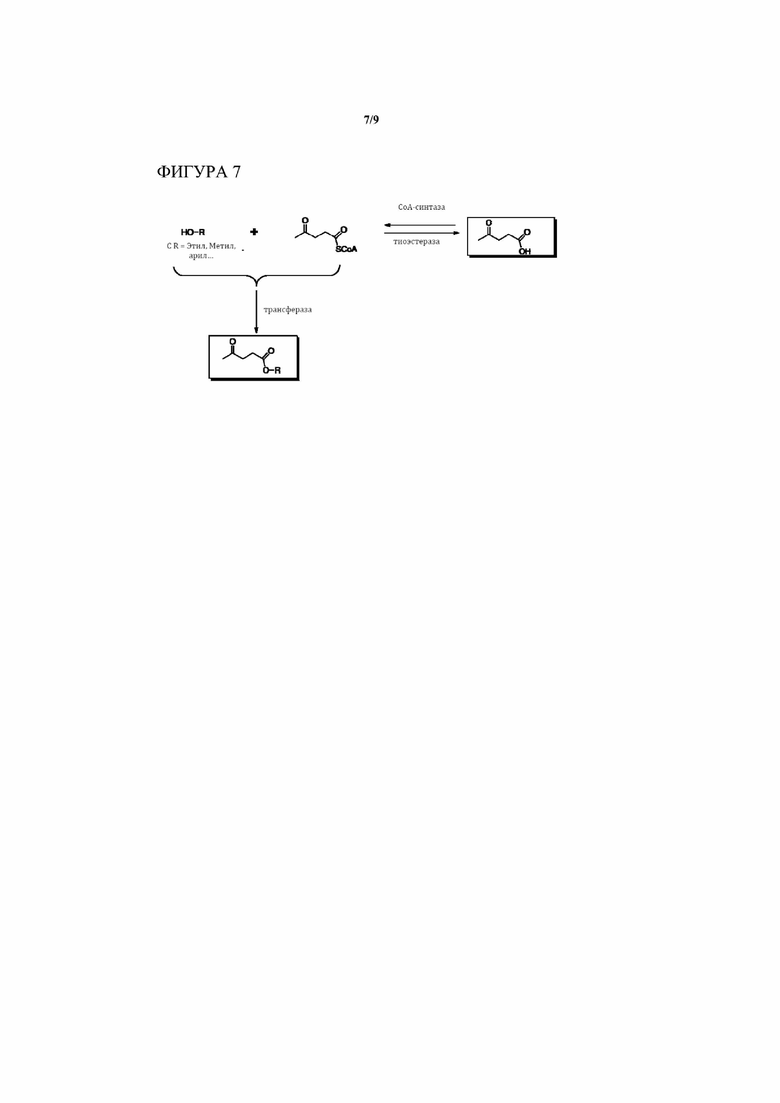
[0019] На Фигуре 7 показан принцип получения левулиновых сложных эфиров (левулинатов) и левулиновой кислоты из промежуточного продукта левулинил-CoA посредством действия либо тиоэстеразы, либо трансферазы. Боковая цепь R может быть любой функциональной группой, такой как, без ограничения, метильная, этильная, пропильная, арильная, фенильная, нафтильная и другие ароматические группы, а также алкильная группа с кислородными и азотными заместителями, как, например, кетоны, первичные, вторичные и третичные спирты, первичные, вторичные и третичные амины и т.д.
[0020] На Фигуре 8 показаны кинетические кривые, полученные при вступлении в реакцию двух ферментов еноатредуктаз (номера доступа в Genbank AAA64522 и AAD16106, обозначенные 6001 и 6002 на Фигуре 8) с субстратом 4-оксо-2-пентеновая кислота (также известная как ацетилакриловая кислота, смотри соединение P2 на Фигуре 1) и субстратом циклогексенон в качестве контроля. Кривая, обозначенная “6001 ацето” и “6002 ацето”, демонстрирует активность белков в присутствии 100 мкM NADPH и субстрата 4-оксо-2-пентеновая кислота. Кривая, обозначенная “6001 цикло” и “6002 цикло”, демонстрирует активность белков в присутствии 100 мкM NADPH и субстрата циклогексенон. Отслеживается уменьшение поглощения при 340 нм, отображающее превращение NADPH в окисленную форму NADP+. Эта кривая демонстрирует превращение субстрата 4-оксо-2-пентеновая кислота в левулиновую кислоту (соединение P1 на Фигуре 1) с помощью обоих белков. Контрольные кривые (обозначенные “6001 буфер”, и “6002 буфер”, и “буфер цикло”, и “буфер ацето”) демонстрируют уменьшение поглощающей способности с субстратами отдельно в буфере или белками отдельно в буфере. Не обнаружено значимой активности при данных условиях. Все кривые получены в буфере на основе фосфата калия 100 мM, pH 7,0 и при комнатной температуре (25ºC). Начальная концентрация NADPH 100 мкM, начальная концентрация 4-оксо-2-пентеновой кислоты 100 мM, начальная концентрация циклогексенона 50 мM. Концентрация белка варьировала.
[0021] На Фигуре 9 продемонстрирована активность фермента альдолазы класса II из Pseudomonas putida, HpaI альдолазы (номер доступа в Genbank ADA63518) на субстратах ацетальдегид и пируват. Условия анализа были следующими: экспрессировали белок, и очистили на Ni из E. Coli, и ввели в реакцию со смесью ацетальдегида и пирувата при начальной концентрации 100 мг/мл, в Тris буфере, pH 8,0, дополненным 100 мM MnCl2. Белок и субстраты инкубировали при комнатной температуре на протяжении 30 мин. перед гашением посредством HCl и запуском в ВЭЖХ с полярной колонкой EPIC. На фигуре 9 показаны полученные кривые ВЭЖХ, при этом пики, соответствующие субстратам и продуктам, указаны на фигуре черной стрелкой. Химическая идентичность продукта, 4-гидрокси-2-оксопентановая кислота, была подтверждена LC/MS (данные не показаны).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0022] В определенных аспектах и вариантах осуществления настоящее изобретение обеспечивает химический путь для превращения пирувата, получаемого из сахаров или других углеродных источников, в ценные C5 материалы, такие как левулиновая кислота. По сути, способ настоящего изобретения обеспечивает путь, который организован по меньшей мере в два этапа, и в некоторых вариантах осуществления 4-8 этапов, как, например, 7-8 этапов (смотри 8 основных этапов, изображаемых на Фиг. 3), с до 4 добавочными этапами циклизации промежуточных продуктов, полученных на всем протяжении пути. Присоединение промежуточного продукта на множественных стадиях к кoфермент A (CoA)-фрагменту позволяет пути привести к образованию CoA-промежуточных продуктов, таких как левулинил-CoA (смотри Фиг. 6). К тому же, четыре необязательных этапа могут привести к образованию циклизированных вариантов ключевых промежуточных продуктов в данном пути (смотри снова Фиг. 6).
[0023] В соответствии с различными вариантами осуществления первый этап представляет собой гликолиз, в котором сахара (например, из биомассы) превращаются в пируват, или, альтернативно, любое химическое превращение из сахаров в пируват. На втором этапе две молекулы пирувата превращаются в одну молекулу 4-гидрокси-2-оксопентановой кислоты и CO2. На необязательном этапе циклизации получают соответствующий лактон, 2-оксо-4-валеролактон. Необязательный этап присоединения CoA может привести к образованию 4-гидрокси-2-оксопентаноил-CoA. В третьем этапе 4-гидрокси-2-оксопентановая кислота восстанавливается до 2,4-дигидроксипентановой кислоты, или 4-гидрокси-2-оксопентаноил-CoA – до 2,4-дигидрокси-пентаноил-CoA, или 2-оксо-4-валеролактон – до 2-гидрокси-4-валеролактона. На необязательном этапе циклизации получают соответствующий лактон, 2-гидрокси-4-валеролактон, либо из 2,4-дигидроксипентановой кислоты, либо из 2,4-дигидрокси-пентаноил-CoA. Необязательный этап присоединения CoA приводит к образованию 2,4-дигидрокси-пентаноил-CoA из 2,4-дигидроксипентановой кислоты. На четвертом этапе 2,4-дигидроксипентановая кислота окисляется до 2-гидрокси-4-оксопентановой кислоты, или 2,4-дигидрокси-пентаноил-CoA – до 2-гидрокси-4-оксопентаноил-CoA. На необязательном этапе присоединения CoA 2-гидрокси-4-оксопентановая кислота превращается в 2-гидрокси-4-оксопентаноил-CoA. На пятом этапе 2-гидрокси-4-оксопентановая кислота дегидратируется до 4-оксо-2-пентеновой кислоты, или 2-гидрокси-4-оксопентаноил-CoA – до 4-оксо-2-пентеноил-CoA. На необязательном этапе присоединения CoA 4-оксо-2-пентеновая кислота превращается в 4-оксо-2-пентеноил-CoA. На необязательном этапе дополнительно 4-оксо-2-пентеновая кислота восстанавливается до 4-гидрокси-2-пентеновой кислоты, или 4-оксо-2-пентеновая кислота – до 4-гидрокси-2-пентеноил-CoA, оба из которых могут необязательно циклизироваться с образованием ангеликалактона. Другой необязательный этап присоединения CoA приводит к образованию 4-гидрокси-2-пентеноил-CoA из 4-гидрокси-2-пентеновой кислоты, который снова может необязательно циклизироваться с образованием ангеликалактона. Альтернативный вариант осуществления настоящего изобретения “сокращает” четвертый и пятый этап в один единый этап. На шестом этапе в результате образуется левулиновая кислота (4-гидроксипентановая кислота) путем восстановления 4-оксо-2-пентеновой кислоты сходным образом, как описывалось выше. На необязательном этапе кофермент A (CoA) присоединяется к левулиновой кислоте, что приводит к образованию левулинил-CoA. Левулинил-CoA может затем преобразовываться в разнообразные левулиновые сложные эфиры с помощью трансферазы, вступая в реакцию с подходящим спиртом. В некоторых вариантах осуществления на седьмом этапе левулиновая кислота дополнительно восстанавливается с образованием 4-гидроксипентановой кислоты. На восьмом этапе 4-гидроксипентановую кислоту циклизируют с выходом 4-валеролактона.
[0024] В определенных вариантах осуществления этапы 4 и 5 можно осуществлять за одно преобразование, окислительной дегидратацией. В другом варианте осуществления настоящего изобретения этапы 3 и 4 обращены порядком так, что 2-гидрокси-4-оксопентановая кислота первоначально окисляется до 2,4-диоксопентановой кислоты и затем восстанавливается до 2-оксо-4-гидроксипентановой кислоты, так что путь Фиг. 3 становится таким, как представлено на Фиг. 4.
[0025] В другом варианте осуществления настоящего изобретения этапы 3, 5 и 6 (Фиг. 3) проводят непосредственно на соответствующих лактонах L1, L2, L6, L7, L8, L9 и L10, где ответвление от линейных промежуточных продуктов, полученных изначально из пирувата и ацетальдегида, происходит на любом из этапов циклизации, описанных на Фигуре 6. Этот вариант осуществления настоящего изобретения можно применять либо для получения непосредственно лактонов, либо после гидролиза для получения обратно любого из соединений P1 - P16 (включая левулиновую кислоту).
[0026] Еще в одном аспекте настоящего изобретения этапы 2, 3, 4, 5 и 6 (Фиг. 3) проводят на промежуточных продуктах CoA, где ответвление от линейных промежуточных продуктов, полученных изначально из пирувата и ацетальдегида, происходит на любом из этапов присоединения CoA, описанных в абзаце Фигуры 6. Этот вариант осуществления настоящего изобретения можно применять для получения любого из соединений P1 - P16 (включая левулиновую кислоту) с помощью тиоэстераз. Левулиновые сложные эфиры (P9) можно получить из левулинил-CoA и соответствующего спирта с помощью трансферазы.
Этап 1: превращение сахаров в пируват
[0027] Превращение сахаров в пируват является частью хорошо исследованного метаболического пути, гликолиза. В гликолизе действие множества ферментов приводит к превращению каждой молекулы C6 сахара, такого как глюкоза, в две молекулы пирувата, две молекулы ATP и два восстановительных эквивалента в форме двух молекул NAD(P)H.
[0028] В одном варианте осуществления настоящего изобретения пируват получают в результате гликолиза в ферментирующем организме и впоследствии применяют в дальнейшем пути в ферментирующем хозяине. В альтернативном варианте осуществления пируват выделяют из ферментативного бульона и потом обрабатывают в соответствии с дальнейшим путем.
Этап 2: превращение пирувата в 4-гидрокси-2-оксопентановую кислоту
[0029] 4-гидрокси-2-оксопентановую кислоту можно получить путем альдольного присоединения ацетальдегида (альдегида) к пирувату (α кето-кислоте). В присоединении реагирует один эквивалент ацетальдегида с одним эквивалентом пирувата. Ацетилальдегид можно получить различными способами. Например, пируватдекарбоксилаза катализирует неокислительное декарбоксилирование пирувата до ацетальдегида. Следовательно, можно использовать пируватдекарбоксилазу из множества эукариотических или прокариотических источников (например Saccharomcyes cerevisiae). В предпочтительном варианте осуществления настоящего изобретения ацетилальдегид получают из пирувата с ферментом пируватдекарбоксилаза.
[0030] Было выделено множество альдолаз, которые, как было продемонстрировано, катализируют альдольное присоединение пирувата с ацетальдегидом. Альдолаза класса I, альдолаза 4-гидрокси-2-кето-пентановой кислоты (HKP-альдолаза), представляет собой альдолазу, задействующую Шиффово основание с остатком лизина, и катализирует прямую и обратную реакцию. В одном варианте осуществления настоящего изобретения альдольное присоединение пирувата с ацетальдегидом катализируется HKP-альдолазой из E. coli, описанной в Pollard, JR et al., Substrate selectivity and biochemical properties of 4-hydroxy-2-keto-pentanoic acid aldolase from E. coli, Appl. and Environ. Microbiology, 64(10):4093-4094 (1998), или ее гомологом, или ее мутантами (при этом эти мутанты необязательно получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или их комбинации). Техники компьютерного расчета раскрыты в патентных документах US 2009-0191607 и WO 2010/077470, которые включены в данный документ ссылкой во всей полноте.
[0031] Известно, что по меньшей мере две альдолазы класса II катализируют присоединение пирувата к ацетальдегиду, и две (BphI и HpaI) были охарактеризованы с некоторой степенью детализации в Wang W et al., Comparison of two metal-dependent pyruvate aldolases related by convergent evolution: substrate specificity, kinetic mechanism and substrate channeling, Biochemistry, 49:3774-3782 (2010). Эти ферменты используют металлический кo-фактор (в основном либо Zn, либо Mn). BphI и HpaI не имеют выявляемого общего сходства последовательностей. Поскольку BphI является стереоселективным и приводит к образованию 4S аддукта, HpaI, благодаря своему очень открытому активному сайту, производит рацемическую смесь (4R и 4S аддукты). BphI аллостерически связана с BphJ, ацетальдегиддегидрогеназой, и не активна и стабильна при экспрессии в изоляции. HpaI однако, может экспрессироваться сама по себе в E. coli и демонстрирует активность. В альтернативном варианте осуществления настоящего изобретения альдольное присоединение пирувата к ацетальдегиду катализируется HpaI, или BphI, или их мутантами (при этом эти мутанты необязательно получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или комбинации трех).
[0032] В продолжение, любую подходящую пируватальдолазу и другие сходные альдолазы (например, KDPG-альдолаза), катализирующие альдольное присоединение альдегида к кетону, предположительно можно реконструировать для катализа альдольного присоединения ацетальдегида к пирувату. Реконструкция может включать, без ограничения, достижение желаемой субстратной специфичности как к пирувату, так и к ацетальдегиду, контроль желаемой стереоселективности для образования либо рацемических, либо энантиочистых аддуктов ((R)4-гидрокси-2-оксопентановая кислота и (S)4-гидрокси-3-оксопентановая кислота), стабилизацию фермента для получения желаемой каталитической активности в промышленных условиях, в которых настоящее изобретение осуществляют на практике (например, термостабилизация или стабилизация при высоком титре органических веществ), и/или повышение экспрессируемости и растворимости фермента в контексте промышленных условий, в которых настоящее изобретение осуществляют на практике (например в метаболическом пути в Saccharomyces cerevisiae). В другом варианте осуществления настоящего изобретения альдольное присоединение пирувата к ацетальдегиду катализируется пируватальдолазой или любыми ее гомологами и мутантами (при этом эти мутанты необязательно получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или комбинации трех).
[0033] Наконец, с помощью техники конструирования фермента de novo, такой как та, что описана у Zanghellini, A et al, New Algorithms and an in silico Benchmark for Computational Enzyme Design, Protein Science 15:2785-2794 (2006), можно сконструировать новые альдолазные ферменты для субстратов, которые могут или не могут существовать в природе. До 70 таких альдолаз были сконструированы de novo, как описано в заявке на патент США 2009-0191607, которая включена в данный документ ссылкой во всей полноте. Применение данной методологии к субстратам пируват и ацетальдегид может привести к получению альдолаз с желаемой активностью. В другом варианте осуществления настоящего изобретения альдольное присоединение пирувата к ацетальдегиду катализируется сконструированой de novo альдолазой.
Этап 2’: циклизация 4-гидрокси-2-оксопентановой кислоты в 2-оксо-4-валеролактон
[0034] 4-Гидрокси-2-оксопентановую кислоту циклизируют в 2-гидрокси-4-валеролактон (соединение L7 на Фигуре 1). В кислотно-нейтральных растворах термодинамическое равновесие располагает к циклизации в лактон. Циклизацию в лактон можно кинетически увеличить посредством либо химического, либо биохимического катализа. Гомогенные и гетерогенные катализаторы для лактонизации включают сильные кислотные условия (например, серную кислоту), металлические катализаторы (например, палладий, рубидий). Биохимический катализ можно получить под действием липаз, эстераз, протеаз и лактоназ при условиях, которые способствуют прямой реакции лактонизации (низкий-нейтральный pH / высокий титр органического растворителя), как демострируется, например, в Martin CH, et al, Integrated bioprocessing for pH-dependent of 4-valerolactone from levulinate in Pseudomonas Putida KT2440, Appl. and Environ, Microbiology 76(2):417-424.
[0035] В одном варианте осуществления настоящего изобретения 2-оксо-4-валеролактон получают из 4-гидрокси-2-оксопентановой кислоты в присутствии катализатора после выделения 4-гидрокси-2-оксопентановой кислоты из ферментативного бульона или бесклеточного раствора. В другом варианте осуществления настоящего изобретения лактонизация 4-гидрокси-2-оксопентановой кислоты в 2-оксо-4-валеролактон катализируется непосредственно липазой, или эстеразой, или протеазой, или лактоназой, или их мутантами (при этом эти мутанты необязательно получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития, рационального мутагенеза или комбинации трех).
Этап 3: восстановление 4-гидрокси-2-оксопентановой кислоты до 2,4-дигидроксипентановой кислоты
[0036] Среди широкого разнообразия природных дегидрогеназ с помощью in silico и/или экспериментального скрининга можно отобрать дегидрогеназы с субстратной специфичностью, которая допускает 4-гидрокси-2-оксопентановую кислоту и 2,4-дигидроксипентановую кислоту. К тому же, компьютерный расчет, техники направленного развития, или рациональный мутагенез, или комбинацию трех можно применять для изменения или увеличения субстратной специфичности существующей дегидрогеназы по отношению к 4-гидрокси-2-оксопентановой кислоте и 2,4-дигидроксипентановой кислоте. Примеры подходящих отправных точек дегидрогеназ включают L- и D-лактатдегидрогеназы (NAD(P)H- или гем-зависимые, эукариотического или бактериального происхождения), малат-, аспартат- и глутамат-дегидрогеназы (NAD(P)H-зависимые эукариотического или бактериального происхождения), а также алкогольдегидрогеназы (такие как NAD(P)H-зависимые дегидрогеназы алкиловых и фениловых спиртов). Примеры таких дегидрогеназ перечислены в разделе примеров.
[0037] В одном варианте осуществления настоящего изобретения 4-гидрокси-2-оксопентановую кислоту селективно восстанавливают до 2,4-дигидроксипентановой кислоты с помощью гомогенного или гетерогенного химического катализа. Для завершения данного этапа 2,4-дигидроксипентановая кислота может быть или не быть выделена/очищена из ферментативного или бесклеточного раствора. Предпочтительно, 2,4-дигидроксипентановую кислоту выделяют из раствора или ферментативного бульона перед тем, как подвергнуть указанному восстановлению.
[0038] В одном варианте осуществления настоящего изобретения NAD(P)H-зависимую дегидрогеназу применяют для катализа восстановления кетона во 2 положении 4-гидрокси-2-оксопентановой кислоты. В другом варианте осуществления указанная дегидрогеназа восстанавливает кетон с высокой степенью субстратной специфичности к 4-гидрокси-2-оксопентановой кислоте и высокой региоселективностью по кетону во 2 положении. В одном варианте осуществления настоящего изобретения указанная дегидрогеназа не является стереоселективной и может принять как 4R, так и 4S энантиомеры. В другом варианте осуществления настоящего изобретения указанная дегидрогеназа селективно восстанавливает либо 4R, либо 4S энантиомерную форму 4-гидрокси-2-оксопентановой кислоты.
[0039] В другом варианте осуществления настоящего изобретения вместо NAD(P)H-зависимой дегидрогеназы применяют FAD-зависимую дегидрогеназу, предпочтительно с высокой степенью субстратной и региоселективности. В одном варианте осуществления настоящего изобретения указанная дегидрогеназа не является стереоселективной и может принимать как 4R, так и 4S энантиомеры. В другом варианте осуществления настоящего изобретения указанная дегидрогеназа селективно восстанавливает либо 4R, либо 4S энантиомерную форму 4-гидрокси-2-оксопентановой кислоты.
[0040] В другом варианте осуществления настоящего изобретения вместо NAD(P)H-зависимой дегидрогеназы применяют FMN-зависимую дегидрогеназу, предпочтительно с высокой степенью субстратной и региоселективности. В одном варианте осуществления настоящего изобретения указанная дегидрогеназа не является стереоселективной и может принимать как 4R, так и 4S энантиомеры. В другом варианте осуществления настоящего изобретения указанная дегидрогеназа селективно восстанавливает либо 4R, либо 4S энантиомерную форму 4-гидрокси-2-оксопентановой кислоты.
[0041] В еще одном варианте осуществления настоящего изобретения вместо NAD(P)H-зависимой дегидрогеназы применяют феррицитохром-зависимую дегидрогеназу, предпочтительно с высокой степенью субстратной и региоселективности. В одном варианте осуществления настоящего изобретения указанная дегидрогеназа не является стереоселективной и может принимать как 4R, так и 4S энантиомеры. В другом варианте осуществления настоящего изобретения указанная дегидрогеназа селективно восстанавливает либо 4R, либо 4S энантиомерную форму 4-гидрокси-2-оксопентановой кислоты.
[0042] В еще одном варианте осуществления настоящего изобретения вместо NAD(P)H-зависимой дегидрогеназы применяют хинон-зависимую дегидрогеназу, предпочтительно с высокой степенью субстратной и региоселективности. В одном варианте осуществления настоящего изобретения указанная дегидрогеназа не является стереоселективной и может принимать как 4R, так и 4S энантиомеры. В другом варианте осуществления настоящего изобретения указанная дегидрогеназа селективно восстанавливает либо 4R, либо 4S энантиомерную форму 4-гидрокси-2-оксопентановой кислоты.
Этап 3’: циклизация 2,4-дигидроксипентановой кислоты в 2-гидрокси 4-валеролактон
[0043] 2,4-Дигидроксипентановую кислоту циклизируют в 2-гидрокси-4-валеролактон (соединение L6 на Фигуре 1). В кислотно-нейтральных растворах термодинамическое равновесие располагает к циклизации в 4-валеролактон. Сходные примечания о термодинамическом равновесие и химическом и биохимическом катализе остаются в силе, как описано выше.
[0044] В одном варианте осуществления настоящего изобретения 2-гидрокси-4-валеролактон получают из 2,4-дигидроксипентановой кислоты в присутствии катализатора после выделения 2,4-дигидроксипентановой кислоты из ферментативного бульона или бесклеточного раствора. В другом варианте осуществления настоящего изобретения лактонизация 2,4-дигидроксипентановой кислоты в 2-гидрокси-4-валеролактон катализируется непосредственно липазой, или эстеразой, или протеазой, или лактоназой, или их мутантами (при этом эти мутанты получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или комбинации трех).
Этап 4: окисление 2,4-дигидроксипентановой кислоты до 4-оксо-2-гидроксипентановой кислоты
[0045] В одном варианте осуществления настоящего изобретения 2,4-дигидроксипентановую кислоту селективно окисляют до 4-оксо-2-гидроксипентановой кислоты с применением гомогенного или гетерогенного химического катализа. Для завершения данного этапа 2,4-дигидроксипентановая кислота может быть или не быть выделена/очищена из ферментативного или бесклеточного раствора. Предпочтительно, 4-оксо-2-гидроксипентановую кислоту выделяют из раствора или ферментативного бульона перед тем, как подвергнуть указанному окислению.
[0046] В предпочтительном варианте осуществления настоящего изобретения NAD(P)H-зависимую дегидрогеназу применяют для катализа окисления гидроксила в 4 положении 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа окисляет гидроксил с высокой степенью субстратной специфичности к 2,4-дигидроксипентановой кислоте и высокой региоселективностью по гидроксилу в 4 положении. Предпочтительно, указанная дегидрогеназа принимает четыре различных энантиомера (2R4R, 2R4S, 2S4R, 2S4S) 2,4-дигидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа селективно окисляет либо 2R (2R4R, 2R4S), либо 2S (2S4R, 2S4S) энантиомеры 2,4-дигидроксипентановой кислоты в зависимости от того, какой наиболее многочисленный энантиомер получается в результате предыдущего восстановления 4-гидрокси-2-оксопентановой кислоты. Примеры таких дегидрогеназ перечислены в разделе примеры.
[0047] В другом варианте осуществления настоящего изобретения FAD-зависимую дегидрогеназу применяют для катализа окисления гидроксила в 4 положении 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа окисляет гидроксил с высокой степенью субстратной специфичности к 2,4-дигидроксипентановой кислоте и высокой региоселективностью по гидроксилу в 4 положении. Предпочтительно, указанная дегидрогеназа принимает четыре различных энантиомера (2R4R, 2R4S, 2S4R, 2S4S) 2,4-дигидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа селективно окисляет либо 2R (2R4R, 2R4S), либо 2S (2S4R, 2S4S) энантиомеры 2,4-дигидроксипентановой кислоты в зависимости от того, какой наиболее многочисленный энантиомер получается в результате восстановления 4-гидрокси-2-оксопентановой кислоты.
[0048] В другом варианте осуществления настоящего изобретения FMN-зависимую дегидрогеназу применяют для катализа окисления гидроксила в 4 положении 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа окисляет гидроксил с высокой степенью субстратной специфичности к 2,4-дигидроксипентановой кислоте и высокой региоселективностью по гидроксилу в 4 положении. Предпочтительно, указанная дегидрогеназа принимает четыре различных энантиомера (2R4R, 2R4S, 2S4R, 2S4S) 2,4-дигидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа селективно окисляет либо 2R (2R4R, 2R4S), либо 2S (2S4R, 2S4S) энантиомеры 2,4-дигидроксипентановой кислоты в зависимости от того, какой наиболее многочисленный энантиомер получается в результате восстановления 4-гидрокси-2-оксопентановой кислоты.
[0049] В еще одном варианте осуществления настоящего изобретения феррицитохром-зависимую дегидрогеназу применяют для катализа окисления гидроксила в 4 положении 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа окисляет гидроксил с высокой степенью субстратной специфичности к 2,4-дигидроксипентановой кислоте и высокой региоселективностью по гидроксилу в 4 положении. Предпочтительно, указанная дегидрогеназа принимает четыре различных энантиомера (2R4R, 2R4S, 2S4R, 2S4S) 2,4-дигидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа селективно окисляет либо 2R (2R4R, 2R4S), либо 2S (2S4R, 2S4S) энантиомеры 2,4-дигидроксипентановой кислоты в зависимости от того, какой наиболее многочисленный энантиомер получается в результате восстановления 4-гидрокси-2-оксопентановой кислоты.
[0050] В еще одном варианте осуществления настоящего изобретения хинон-зависимую дегидрогеназу применяют для катализа окисления гидроксила в 4 положении 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа окисляет гидроксил с высокой степенью субстратной специфичности к 2,4-дигидроксипентановой кислоте и высокой региоселективностью по гидроксилу в 4 положении. Предпочтительно, указанная дегидрогеназа принимает четыре различных энантиомера (2R4R, 2R4S, 2S4R, 2S4S) 2,4-дигидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа селективно окисляет либо 2R (2R4R, 2R4S), либо 2S (2S4R,2S4S) энантиомеры 2,4-дигидроксипентановой кислоты в зависимости от того, какой наиболее многочисленный энантиомер получается в результате восстановления 4-гидрокси-2-оксопентановой кислоты.
Этап 5: дегидратация 4-оксо-2-гидроксипентановой кислоты до 4-оксо-2-пентеновой кислоты
[0051] Обычно, химическая дегидратация достигается либо гомогенным, либо гетерогенным катализом, таким как температура > 100°C, концентрированная кислота (4,0 M серная кислота) и/или катализатор на основе оксида металла (оксиды цинка или алюминия). В одном варианте осуществления настоящего изобретения 4-оксо-2-гидроксипентановую кислоту, полученную после этапов восстановления и окисления, химически дегидратируют до 4-оксо-2-пентеновой кислоты при помощи гомогенного или гетерогенного катализа. Для завершения данного этапа 4-оксо-2-гидроксипентановая кислота может быть или не быть выделена/очищена из ферментативного или бесклеточного раствора. Предпочтительно, 4-оксо-2-гидроксипентановую кислоту выделяют из раствора или ферментативного бульона перед тем, как подвергнуть указанной дегидратации.
[0052] Дегидратация органических соединений может альтернативно катализироваться ферментом дегидратаза. Были охарактеризованы несколько классов дегидратазы, и они зависят от различных механизмов: радикальный механизм, такой как у витамин B12-зависимых или SAM-зависимых дегидратаз (например, диолдегидратаза, глицериндегидратаза), механизм на основе кислот Льюиса, такой как у содержащих железо-серу дегидратаз (например, дигидроксикислотная дегидратаза, аконитаза), и механизм на основе промежуточного продукта, являющегося енолят-ионом, как, например, дикислотная дегидратаза (например, тартратдегидратаза). С учётом того, что все механизмы применимы для дегидратации 4-оксо-2-гидроксипентановой кислоты, механизмы, основанные на енолятном промежуточном продукте, предпочтительны, поскольку при формировании енолятного аниона на карбониле β с образованием отщепляемого гидроксила снижается pKa α-протона, таким образом позволяя ему легко уходить на главную кислотную/основную группу. Добавочная главная кислотно/основная группа протонирует уходящую молекулу воды. Этот механизм используется широким спектром природных дегидратаз: магний-зависимые дегидратазы из надсемейства енолаз, такие как тартратдегидратаза, глюконатдегидратаза, задействуют этот механизм для дегидратации структурно различных дикислот с высокой субстратной специфичностью, как описано, например, в Gerlt et al., Divergent evolution in the enolase superfamily: the interplay of mechanism and specificity, Biochemistry, 433:59-70 (2005). Фумараза (также известная как фумарат-гидратаза) катализирует основанную на еноляте обратимую гидрацию малата в фумарат. Еноилдегидратаза (также известная как кротоназа) задействует енолятный анион сложного тиоэфира-CoA для катализа обратимой гидратации различных CoA-субстратов (смотри, например, Holden et al., The Crotonase Superfamily: divergently related enzymes that catalyze different reactions involving acyl Coenzyme A thioesters, Acc. Chem. Res. 34:145-157.(2001)).
[0053] В одном варианте осуществления настоящего изобретения дегидратация 4-оксо-2-гидроксипентановой кислоты до 4-оксо-2-пентеновой кислоты катализируется дегидратазой. В предпочтительном варианте осуществления настоящего изобретения указанная дегидратаза задействует енолятный промежуточный продукт для катализа дегидратации. Предпочтительно, указанная дегидратаза является членом надсемейства енолаз, надсемейства фумараз или еноил-coA-дегидратаз, или их мутантами, полученными с помощью методов белковой инженерии. В предпочтительном варианте осуществления настоящего изобретения указанная дегидратаза проявляет высокий уровень субстратной специфичности к 4-оксо-2-гидроксипентановой кислоте. В другом предпочтительном варианте осуществления настоящего изобретения указанная дегидратаза дегидратирует в равной степени 2R и 2S энантиомеры 4-оксо-2-гидроксипентановой кислоты. В альтернативном варианте осуществления настоящего изобретения указанная дегидратаза селективно дегидратирует либо 2R, либо 2S энантиомер 4-оксо-2-гидроксипентановой кислоты.
Альтернатива этапу 4 и 5:
[0054] Альтернативно 2-этапному превращению 2,4-дигидроксипентановой кислоты в 4-оксо-2-пентеновую кислоту, 1-этапное превращение можно осуществить с помощью окислительной дегидратации. Окислительные дегидратации типичны в метаболизме сахаров. Так называемые ферменты 4,6-дегидратазы, такие как UDP-GlcNAc-инвертирующая 4,6-дегидратаза, структурные детали которой описаны в Ishiyama et al., Structural studies of FlaA1 from helicobacter pylori reveal the mechanism for inverting 4,6-dehydratase activity, J. Bio. Chem. 281(34):24489-24495 (2006). В одном варианте осуществления настоящего изобретения такую 4,6-дегидратазу применяют для катализа окислительной дегидратации 2,4-дигидроксипентановой кислоты до 4-оксо-2-пентановой кислоты. В одном аспекте настоящего изобретения указанная 4,6-дегидратаза является энантиоселективной и дегидратирует предпочтительно один из энантиомеров 2,4-дигидроксипентановой кислоты (любой из 2R4R, 2R4S, 2S4R или 2S4S). В других аспектах настоящего изобретения указанная 4,6-дегидратаза не является энантиоселективной и дегидратирует с подобной каталитической эффективностью два или более энантиомеров 2,4-дигидроксипентановой кислоты. В предпочтительном варианте осуществления настоящего изобретения 4,6-дегидратаза – высоко активна на 2,4-дигидроксипентановой кислоте, получена из природной 4,6-дегидратазы с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или их комбинации.
Этап 6: восстановление 4-оксо-2-пентеновой кислоты до 4-оксопентановой кислоты (левулиновой кислоты)
[0055] Двойные связи на замещенных алкенах можно восстановить (гидрогенизировать) с получением соответствующих насыщенных алканов. Замещенные алкены можно восстановить с применением химического катализа или, в целом асимметрично, с применением биокатализаторов, таких как еноатредуктазы, как рассмотрено в Stuermer et al., Asymmetric bioreduction of activated C=C bonds using enoat reductases from the old yellow enzyme family, Curr. Opin. In Chem. Bio. 11:203-213 (2007). Охарактеризованы еноатредуктазы как из эукариотических, таких как Sacharomyces cerevisiae и marchantia, так и из прокариотических организмов, таких как Clostridium. Семейство ферментов еноатредуктаз зависит от флавинового кофактора (FMN), который окисляется в каждом цикле фермента. За исключением одного известного случая, который является никотинамид-независимым, флавиновый кофактор, в свою очередь, восстанавливается никотинамидным кофактором, либо NADH, либо NADPH, который также связывается в активном сайте. По завершении одного цикла субстрат восстанавливался в связи с тем, что кофактор NAD(P)H окислялся до NAD(P)+. Еноатредуктазы отличаются по их субстратной специфичности. Однако, несколько еноатредуктаз, таких как еноатредуктазы дрожжей и Clostridium, имеют широкую субстратную специфичность и могут давать линейные замещенные алкены (с кислотными или кетоновыми функциональными группами), а также замещенные лактоны, такие как 4-валеролактон.
[0056] В одном варианте осуществления настоящего изобретения 4-гидрокси-2-оксопентановую кислоту выделяют из бульона для разделения или бесклеточного раствора и селективно восстанавливают двойную связь с помощью гомогенного или гетерогенного катализа.
[0057] В другом варианте осуществления настоящего изобретения фермент еноатредуктазу применяют для восстановления 4-гидрокси-2-оксопентановой кислоты до левулиновой кислоты. В предпочтительном варианте осуществления указанная еноатредуктаза зависит как от FMNH2, так и от NAD(P)H кофакторов, причем указанный NAD(P)H кофактор используется в активном сайте для регенерации FMNH2 до его окслительно-восстановительного состояния до катализа. В предпочтительном варианте осуществления настоящего изобретения указанная еноатредуктазая клонирована и экспрессируется в ферментирующем хозяине. В альтернативном варианте осуществления указанную еноатредуктазу применяют внеклеточно или в бесклеточной системе с соответствующей системой регенерации кофактора. В другом альтернативном варианте осуществления указанное восстановление катализируется катализатором целой клетки, экспрессирующей одну или несколько еноатредуктаз, так, чтобы указанная клетка отличалась от ферментирующей(их) клетки(ок)-хозяина(ев), в которой(ых) задействуется часть пути и полностью путь.
Этап 7: восстановление 4-оксопентановой кислоты (левулиновой кислоты) до 4-гидроксипентановой кислоты
[0058] Сходно с этапом 3 (абзац [0037] - [0043]), восстановление кетона в 4 положении на левулиновой кислоте можно осуществить либо посредством химического катализа, либо с помощью биокатализатора дегидрогеназы. В контексте метаболического пути данное последнее восстановление (и соответствующее окисление одного восстановительного эквивалента) обеспечивает редокс-равновесие всего пути от C5 и/или C6 сахаров.
[0059] В одном варианте осуществления настоящего изобретения левулиновую кислоту выделяют из бульона или бесклеточного раствора и кетон в 4 положениях селективно восстанавливают с помощью гомогенного или гетерогенного катализа с получением 4-гидроксипентановой кислоты.
[0060] В альтернативном варианте осуществления настоящего изобретения NAD(P)-зависимую дегидрогеназу применяют для катализа восстановления кетона в 4 положении на левулиновой кислоте до соответствующего гидроксила с получением 4-гидроксипентановой кислоты. В предпочтительном варианте осуществления указанная дегидрогеназа восстанавливает кетон с высокой степенью субстратной специфичности к левулиновой кислоте и высокой региоселективностью по кетону в 4 положении. Предпочтительно, указанная дегидрогеназа представляет собой такой же фермент, как для окисления гидроксила в 4 положении 4-оксо-2-гидроксипентановой кислоты, или его мутант (при этом мутант получен компьютерным расчетом, или экспериментальным мутагенезом, или комбинацией двух). В предпочтительном варианте осуществления настоящего изобретения указанная дегидрогеназа селективно производит один из энантиомеров (4R или 4S) 4-гидроксипентановой кислоты. В альтернативном варианте осуществления указанная дегидрогеназа производит рацемическую смесь 4R и 4S энантиомеров 4-гидроксипентановой кислоты.
Этап 8: циклизация 4-гидроксипентановой кислоты в 4-валеролактон
[0061] 4-Гидроксипентановую кислоту циклизируют в 4-валеролактон (также известный как γ-валеролактон, соединение L1 на Фиг. 1). В кислотных растворах термодинамическое равновесие располагает к циклизации до 4-валеролактона. Такие же примечания о термодинамическом равновесие и химическом и биохимическом катализе остаются в силе, как и в абзаце [0035].
[0062] В одном варианте осуществления настоящего изобретения 4-валеролактон получают из 4-гидроксипентановой кислоты в присутствии катализатора после выделения 4-гидроксипентановой кислоты из ферментативного бульона или бесклеточного раствора. В предпочтительном варианте осуществления настоящего изобретения энантиочистую 4-гидроксипентановую кислоту (либо 4R, либо 4S энантиомер) превращают с помощью указанного катализатора в энантиочистый 4-валеролактон. В альтернативном варианте осуществления рацемическую смесь двух энантиомеров 4-гидроксипентановой кислоты (4R и 4S) превращают с помощью указанного катализатора в рацемическую смесь 4-валеролактона.
[0063] В другом варианте осуществления настоящего изобретения лактонизация 4-гидроксипентановой кислоты до 4-валеролактона катализируется непосредственно липазой, или эстеразой, или протеазой, или лактоназой, или их мутантами (при этом эти мутанты получены с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития или рационального мутагенеза или комбинации трех) внутри клетки или за ее пределами. В предпочтительном варианте осуществления настоящего изобретения указанная липаза, или эстераза, или протеаза, или лактоназа действует на субстрат из энантиочистой 4-гидроксипентановой кислоты с получением энантиочистого 4-валеролактона. В альтернативном варианте осуществления указанные липаза, или эстераза, или протеаза, или лактоназа действует на рацемическую смесь из 4R и 4S энантиомеров 4-гидроксипентановой кислоты с получением рацемической смеси из 4R и 4S энантиомеров 4-валеролактона.
ПРИМЕРЫ
[0064] Примеры ферментов пируватдекарбоксилаз: фермент семейства пируватдекарбоксилаз (EC номер EC 4.1.1.1), такой как фермент пируватдекарбоксилаза, можно применять для катализа первого этапа пути, превращения пирувата в ацетальдегид. В Таблице 1 ниже перечислены примеры таких ферментов (наряду с их организмами-источниками), которые изучены и охарактеризованы в литературе, с перечислением их номера доступа для общедоступной базы данных GenBank (NCBI). Также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в таблице 1 (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
ТАБЛИЦА 1
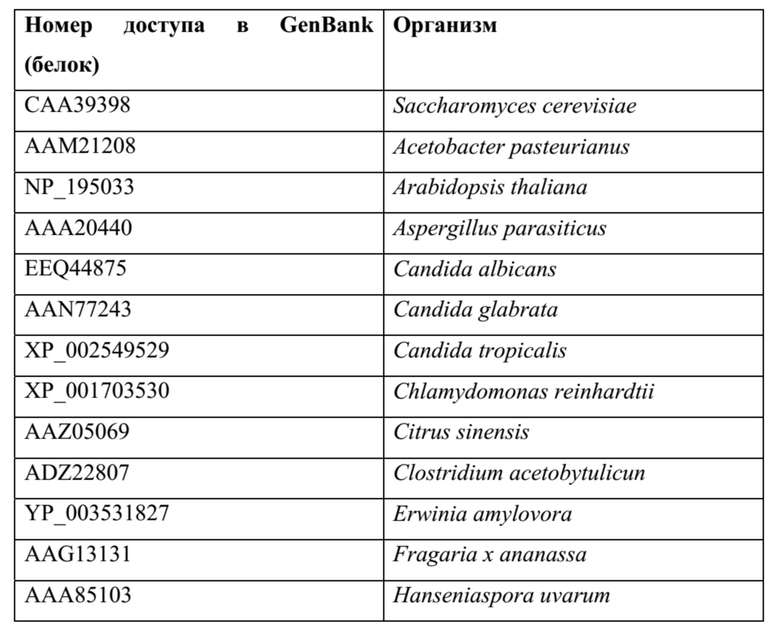
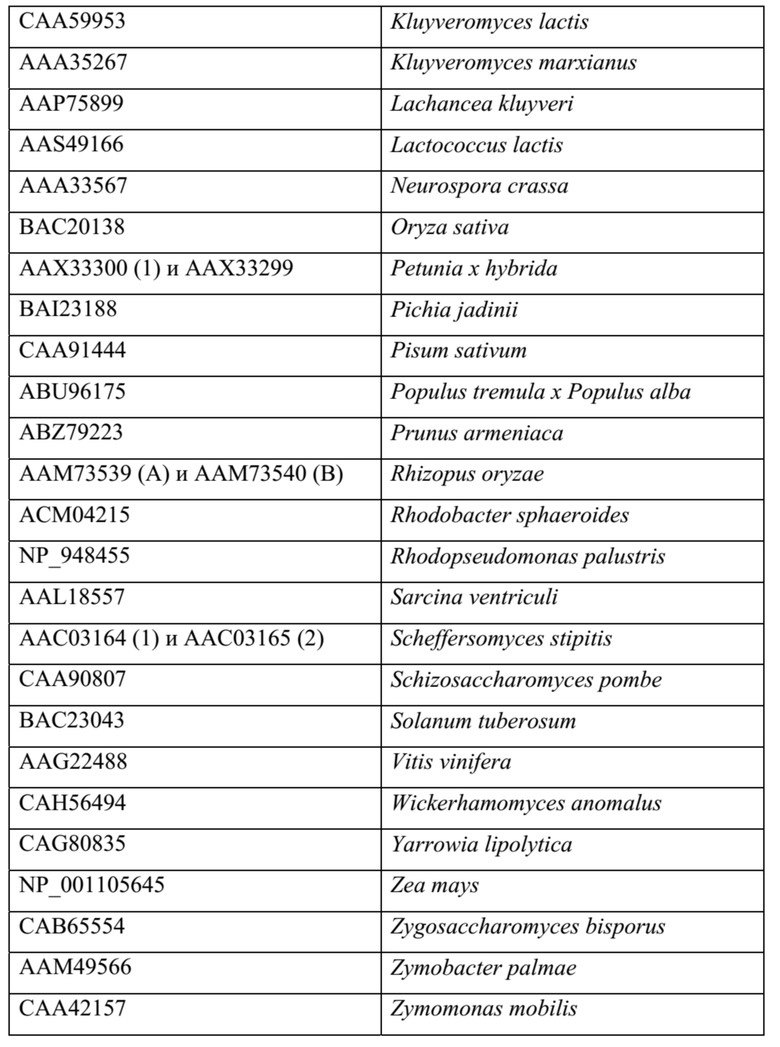
[0065] Примеры альдолазных ферментов, катализирующих получение 4-гидрокси-2-кето-пентановой кислоты: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
ТАБЛИЦА 2: альдолаза класса I: EC 4.1.3.39, официальное название: 4-гидрокси-2-оксовалерат-альдолаза
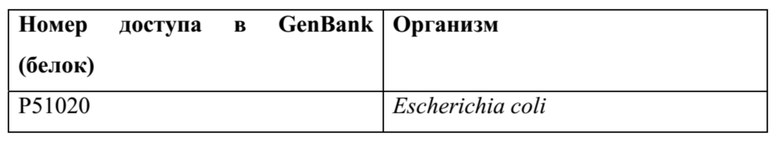
ТАБЛИЦА 3: альдолазы класса II: EC 4.1.3.39, официальное название: 4-гидрокси-2-оксовалерат-альдолаза

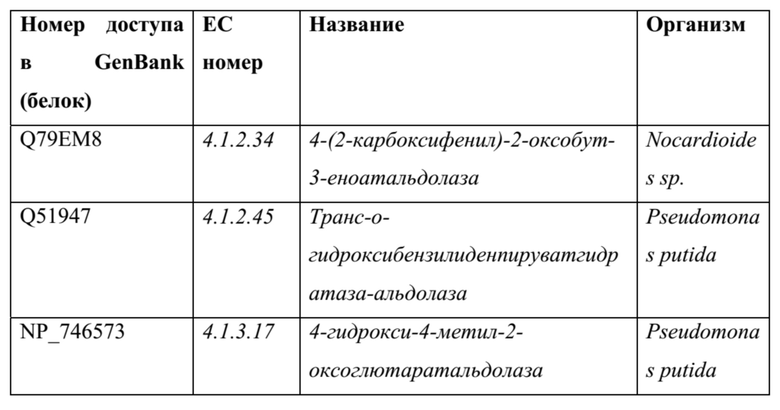
ТАБЛИЦА 4: примеры дополнительных пируватальдолаз, подходящих для катализа реакции, либо в виде WT, либо после белковой инженерии
[0066] Примеры ферментов дегидрогеназ, способных восстанавливать кетон в положении 4 производных пентановой кислоты до вторичного спирта (гидроксила) / окислять вторичный спирт (гидроксил) в положении 4 производных пентановой кислоты до кетона: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
[0067] Широкое разнообразие дегидрогеназ способно окислять/восстанавливать вторичные спирты/кетоны с различными степенями субстратной специфичности. Последовательности дегидрогеназ, перечисленные ниже, представляют собой некоторые примеры дегидрогеназ, описанные в литературе как активные на заместителях вторичных спиртов/кетонов на алкильных цепях из трех углеродов или более.
ТАБЛИЦА 5
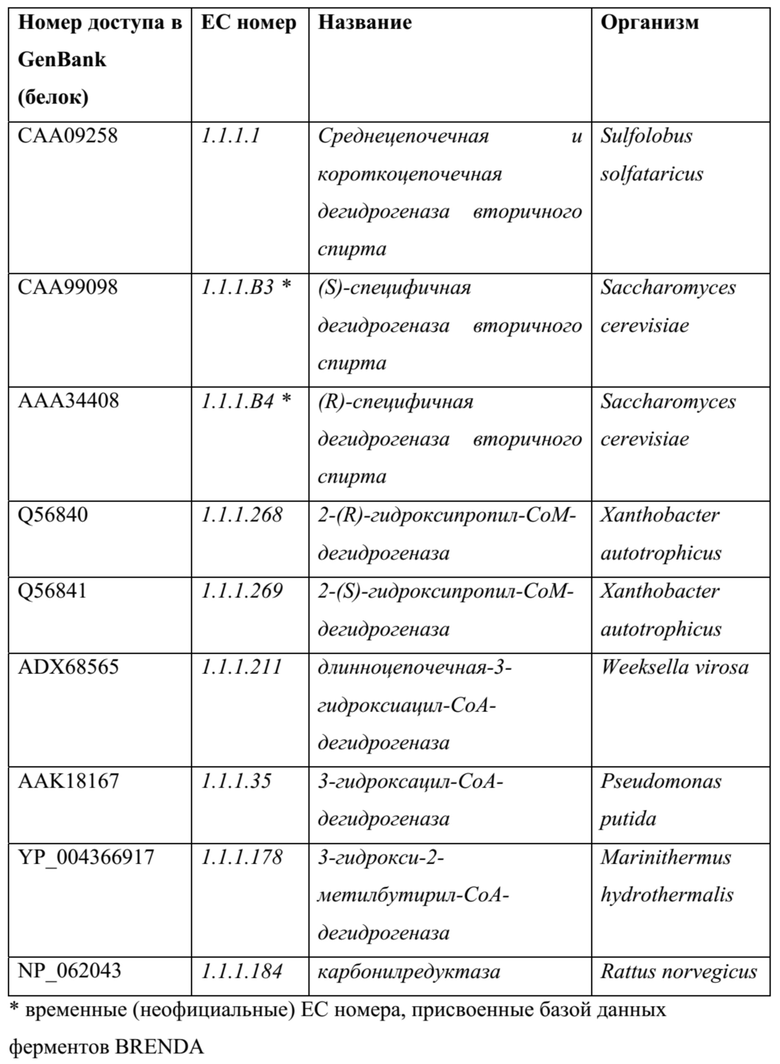
[0068] Примеры ферментов дегидрогеназ для восстановления 2,4-диоксопентановой кислоты до 4-оксо-2-гидроксипентановой кислоты: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
[0069] Ферменты лактатдегидрогеназы с широкой субстратной специфичностью, продемонстрированные в литературе, для приема субстрата из 2,4-диоксопентановой кислоты. Две нижеприведенные последовательности имеют различные стереоселективности.
ТАБЛИЦА 6
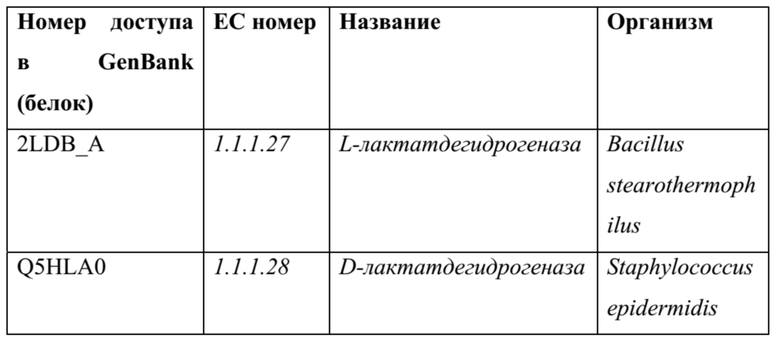
[0070] Пример ферментов дегидратаз, катализирующих превращение 4-оксо-2-гидроксипентановой кислоты в 4-оксо-2-пентеновую кислоту: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратную трансляцию) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
[0071] Дегидратазы енолятного надсемейства: эти дегидратазные ферменты, которые структурно связаны с “енолазным” семейством ферментов, стабилизируют енолят-ион, формирующийcя после отщепления одного из водородов α в функциональной группе кислоты. Поскольку эти ферменты зависят от стабилизации енолятного аниона для уменьшения энергии активации для реакции дегидратации, они могут быть активны на субстрате с β с отщепляемым гидроксилом с любой из функциональных групп карбоновой кислоты, кетона или сложного эфира. Несколько примеров этого класса дегидратаз приведены в таблице ниже:
ТАБЛИЦА 7
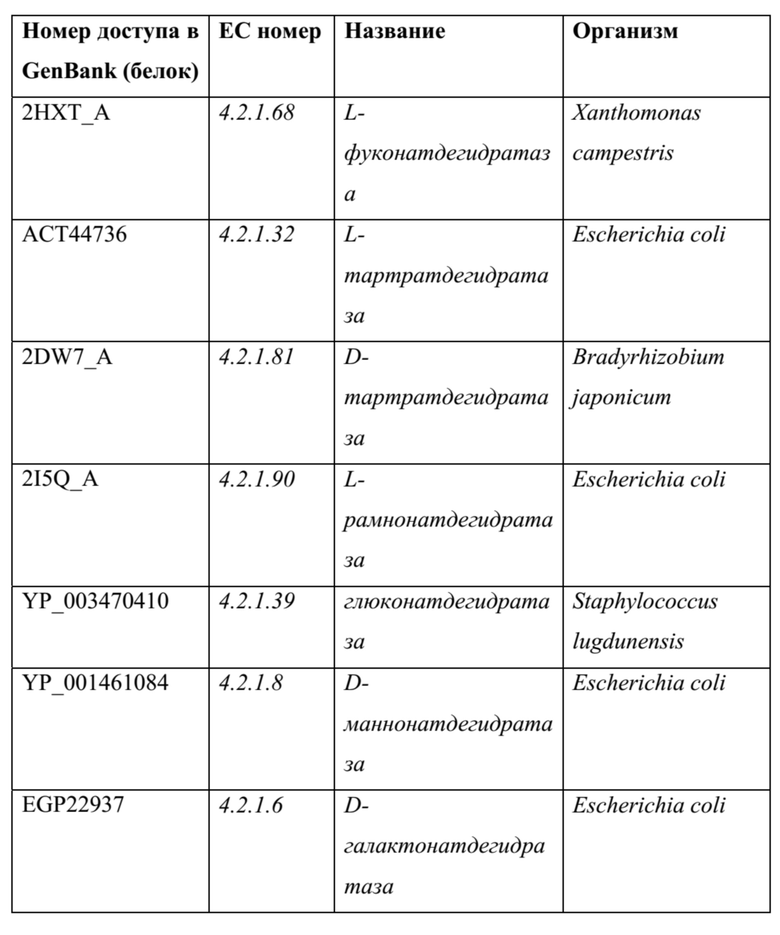
[0072] Дегидратазы семейства еноил-coA-гидратаз или “кротоназ”: эти ферменты могут катализировать обратимое присоединение/удаление молекул воды к/из α,β-ненасыщенных сложных тиоэфиров (производные кофермента A). Поскольку они зависят от стабилизации енолятного аниона, образованного после отщепления протона, ферменты также способны катализировать гидратацию (и обратимую дегидратацию) α,β-ненасыщенных карбоновых кислот и кетонов. В противоположность дегидратазе из надсемейства енолаз, эти ферменты не нуждаются в каком-либо кофакторе.
ТАБЛИЦА 8
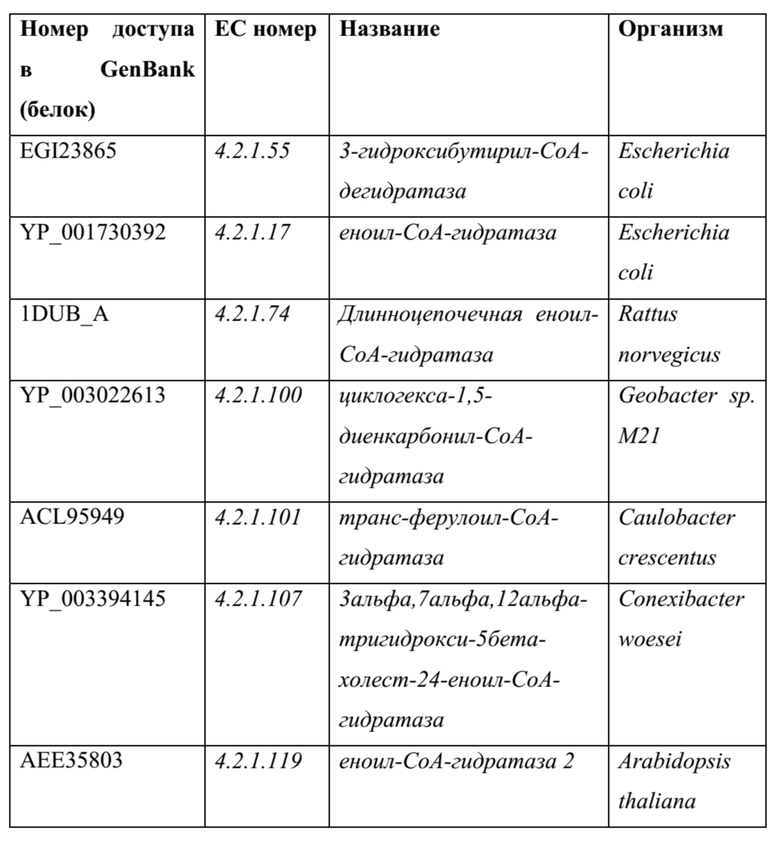
[0073] Дегидратазы семейства фумаразы C (ферменты семейства фумаразы A и B используют железо-серный кластер): Касательно семейства еноил-coA-гидратаз, эти ферменты стабилизируют енолят без необходимости какого-либо кофактора. Связывание субстрата и стабилизация переходного состояния достигается с помощью аминокислот с активного центра.
ТАБЛИЦА 9
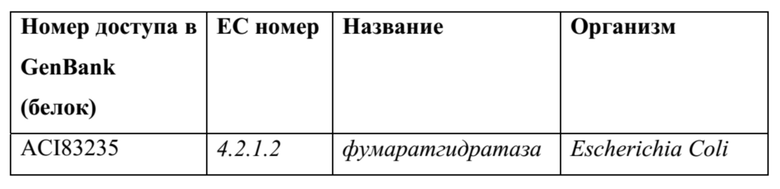
[0074] Другие дегидратазы: все другие известные дегидратазы (EC номера 4.2.1.*) можно также применять для катализа дегидратации 4-оксо-2-гидроксипентановой кислоты до 4-оксо-2-пентеновой кислоты, как, например, ферменты дегидратазы на основе железо-серного кластера (например, дигидроксидиол-дегидратаза, фумараза A и C) или витамин B12-зависимые и SAM-зависимые дегидратазы, такие как глицерин- и пропандиолдегидратаза.
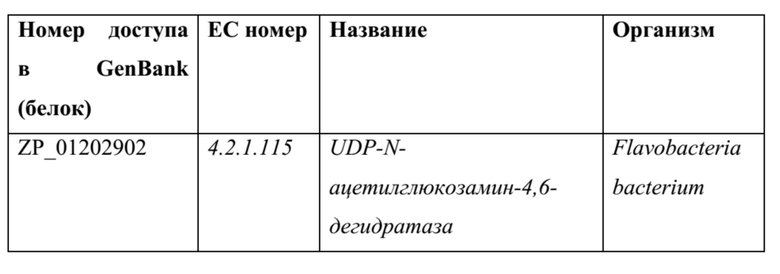
[0075] Примеры ферментов оксидаз/эпимераз, способных катализировать окислительную дегидратацию/превращение 2,4-дигидроксипентановой кислоты в 4-оксо-2-пентеновую кислоту: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
ТАБЛИЦА 10
[0076] Примеры ферментов, катализирующих восстановление 4-оксо,2-гидроксопентановой кислоты до левулиновой кислоты: также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
[0077] Семейство ферментов, называемых еноат-редуктазы или, более неофициально, старые желтые ферменты, являются NAD(P)H- и FMN-зависимым ферментом, катализирующим обратимое восстановление α,β-ненасыщенных сложных тиоэфиров, карбоновых кислот и кетонов. Они проявляют широкие субстратные специфичности, и следующие последовательности, как было успешно доказано экспериментально (смотри данные), катализируют восстановление 4-оксо, 3-гидроксипентановой кислоты до левулиновой кислоты.
ТАБЛИЦА 11
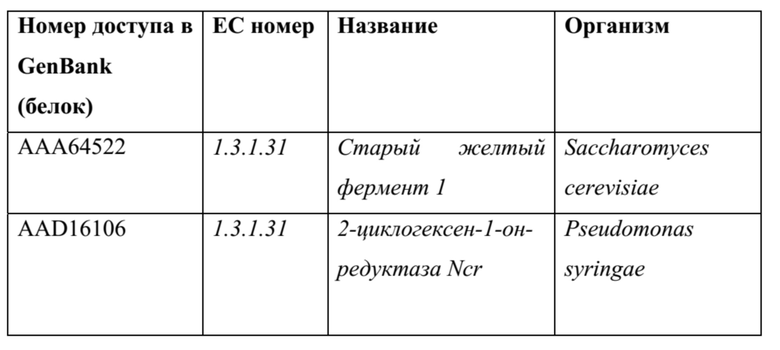
Также было показано экспериментально, что мутанты по множеству сайтов фермента NCR из Pseudomonas syringae проявляют различные каталитические активности по отношению к 4-оксо,2-гидроксопентановой кислоте в качестве субстрата. Эти мутанты соответствуют Y178A, P242Q, D338Y и F315Y в аминокислотной нумерации последовательности AAD16106.
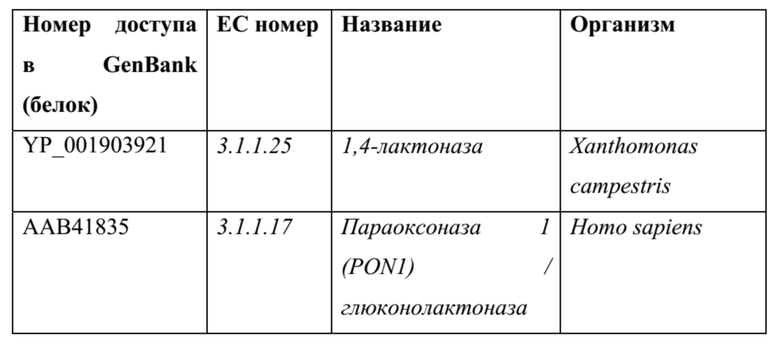
[0078] Примеры ферментов, способных катализировать лактонизацию 4-гидроксикислот в их соответствующие циклические сложные эфиры (лактоны): также можно использовать гомологичные ферменты, например, последовательности белка и ДНК, полученные из последовательностей в нижеприведенных таблицах (или их обратной трансляции) с применением программного обеспечения для выравнивания, такого как, без ограничения, Blast, PSI-Blast или HMMER3, и со значением е для выравнивания <0,1.
[0079] Известны многие виды лактоназ (например, лактоногидролазы), которые можно использовать для катализа обратимого образования 1,4-циклических сложных эфиров из 4-гидроксикислот. В частности, 1,4-лактоназы (EC 3.1.1.25) демонстрируют некоторую специфичность по отношению к 4-гидроксикислотам и, следовательно, являются предпочтительными последовательностями для катализа реакций этапов 8 на фигурах 3, 4 и 5 и реакций множественной лактонизации на фигуре 6. В частности, некоторые 1,4-лактоназы были проанализированы с 4-гидроксипентановой кислотой и, как было подтверждено, катализируют их обратимую циклизацию в гамма-валеролактон. В нижеприведенной таблице перечисляются некоторые ферменты лактоназы, которые, как сообщалось в литературе, катализируют эту реакцию.
ТАБЛИЦА 12
[0080] Для катализа циклизации 4-гидроксикислот подходит широкий спектр других охарактеризованных лактоназ. Ниже приведена таблица, в которой перечисляются EC номера, соответствующие существующим лактоназам (подкласс карбоксиэстераз).
ТАБЛИЦА 13

[0081] В конечном счете наблюдали, что эстеразы, липазы и пептидазы/амидазы катализируют реакции лактонизации при подходящих экспериментальных условиях (нещелочном pH и, как правило, комнатной температуре). Например, липазы упоминаются в PCT/US2010/055524 для лактонизации, и амидазу/пептидазу применяли успешно для синтеза лактонов в WO/2009/142489, обе из которых включены в данный документ посредством ссылки.
[0082] Примеры небиокаталитических способов катализа лактонизации 4-гидроксикислот в их соответствующие циклические сложные эфиры (лактоны): есть множество небиокаталитических способов катализа 1,4-лактонизации гидроксикислот. Например, хорошо известно, что такая лактонизация катализируется кислотой и, следовательно, снижение pH среды (либо внутри, либо вне живых клеток) увеличивает скорость реакции лактонизации. Дополнительно, в PCT/US2010/055524 (которая включена в данный документ ссылкой) сообщалось, что активация посредством переноса группы на функциональную группу кислоты 4-гидроксикислоты достаточна при приемлемых условиях, таких как pH 2,5–7,0 и комнатная температура, для количественного выхода лактонной формы. Например, в PCT/US2010/055524 приведена (1) активация с фосфатной группой (с образованием, в данном случае, 4-гидроксилбутирилфосфата) и (2) активация с коферментом A (с образованием 4-гидроксилбутирил-CoA). Предполагается, что синтез промежуточных продуктов 4-гидроксилпентаноилфосфата или 4-гидроксилпентаноил-CoA с применением природного или сконструированного фермента киназы или CoA-синтетазы, соответственно, или химический синтез приводит к сходной активации и произвольной лактонизации при подходящих условиях.
[0083] Все справочные материалы, упомянутые в данном документе, включены в данный документ посредством ссылки для всех целей.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФЕРМЕНТАТИВНЫЙ ПУТЬ ДЛЯ ПОЛУЧЕНИЯ ЛЕВУЛИНОВОЙ КИСЛОТЫ, ЛЕВУЛИНАТНЫХ СЛОЖНЫХ ЭФИРОВ, ВАЛЕРОЛАКТОНА И ИХ ПРОИЗВОДНЫХ | 2011 |
|
RU2634120C2 |
| МОДИФИЦИРОВАННЫЕ МИКРООРГАНИЗМЫ И СПОСОБЫ ПОЛУЧЕНИЯ БУТАДИЕНА С ИХ ПРИМЕНЕНИЕМ | 2012 |
|
RU2639564C2 |
| БИОЛОГИЧЕСКИЙ СИНТЕЗ ДИФУНКЦИОНАЛЬНЫХ АЛКАНОВ ИЗ АЛЬФА-КЕТОКИСЛОТ | 2009 |
|
RU2496880C2 |
| СПОСОБ ФЕРМЕНТНОЙ РЕГЕНЕРАЦИИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ КОФАКТОРОВ | 2013 |
|
RU2635087C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,4-ДИГИДРОКСИБУТИРАТА | 2013 |
|
RU2645260C2 |
| КАТАЛИЗАТОР НА ОСНОВЕ γ-ВАЛЕРОЛАКТОНА И/ИЛИ ПРОДУКТОВ ЕГО ГИДРОЛИЗА И ЕГО ПРИМЕНЕНИЕ В ПРОЦЕССЕ ГИДРООЧИСТКИ И/ИЛИ ГИДРОКРЕКИНГА | 2016 |
|
RU2705382C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ГИДРОКСИ-3-МЕТИЛМАСЛЯНОЙ КИСЛОТЫ ИЗ АЦЕТОНА И АЦЕТИЛ-СОА | 2010 |
|
RU2573389C2 |
| ИНГИБИТОРЫ МАТРИКСНЫХ МЕТАЛЛОПРОТЕИНАЗ | 2004 |
|
RU2370488C2 |
| ПИТЬЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ МОНАТИН, И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2004 |
|
RU2380989C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ И ИХ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2480454C2 |


Настоящее изобретение обеспечивает процессы превращения пирувата, получаемого из сахаров или других углеродных источников, в ценные C5 материалы, такие как левулиновая кислота, левулинатные сложные эфиры, валеролактон и их производные. В частности, изобретение относится к способу получения 2-оксо-4-валеролактона, при этом способ включает превращение пирувата в 4-гидрокси-2-оксопентановую кислоту путем альдольного присоединения и превращение 4-гидрокси-2-оксопентановой кислоты в 2-оксо-4-валеролактон посредством лактонизации, где лактонизацию осуществляют при pH от низкого до нейтрального. Изобретение также относится к способу получения метиленметилбутиролактона. 2 н. и 12 з.п. ф-лы, 13 табл., 9 ил.
1. Способ получения 2-оксо-4-валеролактона, при этом способ включает: превращение пирувата в 4-гидрокси-2-оксопентановую кислоту путем альдольного присоединения и превращение 4-гидрокси-2-оксопентановой кислоты в 2-оксо-4-валеролактон посредством лактонизации, где лактонизацию осуществляют при pH от низкого до нейтрального.
2. Способ по п. 1, где пируват получают из углеродного источника, содержащего один или несколько C6 сахаров и/или один или несколько C5 сахаров.
3. Способ по п. 2, где углеродный источник содержит одно или несколько из глицерина, жирной кислоты или аминокислоты.
4. Способ по любому из пп. 1-3, где пируват получают по меньшей мере частично посредством гликолиза в микробной системе.
5. Способ по п. 2, где один или несколько C6 сахаров выбраны из группы, состоящей из: аллозы, альтрозы, глюкозы, маннозы, гулозы, идозы, талозы, галактозы, фруктозы, псикозы, сорбозы и тагатозы.
6. Способ по п. 2, где один или несколько C5 сахаров представляют собой одну или несколько из ксилозы, арабинозы, рибозы, ликсозы ксилулозы и рибулозы.
7. Способ по любому из пп. 1-6, дополнительно включающий катализ альдольного присоединения сконструированной пируватальдолазой.
8. Способ по любому из пп. 1-6, где лактонизацию катализируют с помощью сконструированного биохимического катализатора.
9. Способ по п. 8, где альдольное присоединение осуществляют в ферментативном бульоне или бесклеточном растворе, и где катализ лактонизации осуществляют после выделения 4-гидрокси-2-оксопентановой кислоты из ферментативного бульона или бесклеточного раствора.
10. Способ по п. 8, где альдольное присоединение осуществляют в ферментативном бульоне или бесклеточном растворе, и где катализ лактонизации осуществляют непосредственно в ферментативном бульоне или бесклеточном растворе с помощью сконструированного биохимического катализатора.
11. Способ по п. 9 или 10, где сконструированный биохимический катализатор представляет собой мутант липазы, эстеразы, протеазы или лактоназы.
12. Способ по любому из пп. 7-11, где сконструированную пируватальдолазу и/или сконструированный биохимический катализатор получают с помощью методов белковой инженерии с использованием компьютерного расчета, техник направленного развития, рационального мутагенеза или их комбинации.
13. Способ по любому из пп. 8-12, где сконструированный биохимический катализатор представляет собой 1,4-лактоназу.
14. Способ получения метиленметилбутиролактона, при этом способ включает: превращение пирувата в 4-гидрокси-2-оксопентановую кислоту путем альдольного присоединения; превращение 4-гидрокси-2-оксопентановой кислоты в 2-оксо-4-валеролактон посредством лактонизации; превращение 2-оксо-4-валеролактона в 2-гидрокси-4-валеролактон; превращение 2-гидрокси-4-валеролактона в ангеликалактон посредством восстановления; и превращение ангеликалактона в метиленметилбутиролактон с получением таким образом метиленметилбутиролактона.
| Weijun Wang "Comparison of Two Metal-Dependent Pyruvate Aldolases Related by Convergent Evolution: Substrate Specificity, Kinetic Mechanism, and Substrate Channeling" Biochemistry 2010, 49, 17, 3774-378 Publication Date: April 5, 2010 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЛЕВУЛИНОВОЙ КИСЛОТЫ КИСЛОТНО-КАТАЛИТИЧЕСКОЙ КОНВЕРСИЕЙ САХАРОЗЫ | 2007 |
|
RU2339612C1 |
Авторы
Даты
2022-11-30—Публикация
2011-08-30—Подача