Предпосылки создания изобретения
За последние годы значительно ускорился поиск новых терапевтических средств вследствие лучшего понимания структуры ферментов и других биологических молекул, ассоциированных с заболеваниями. Одним из важных классов ферментов, который подвергается интенсивному исследованию, являются протеинкиназы.
Протеинкиназы составляют большое семейство структурно родственных ферментов, которые ответственны за контроль различных процессов передачи сигналов в клетке. Полагают, что протеинкиназы эволюционировали из общего предкового гена вследствие консервативности их структуры и каталитической функции. Практически все киназы содержат сходный каталитический домен, состоящий из 250-300 аминокислот. Киназы могут быть разделены на семейства в соответствии с субстратами, которые они фосфорилируют (например, протеин-тирозин, протеин-серин/треонин, липиды и т.д.).
ДНК-зависимая протеинкиназа (ДНК-ПК) представляет собой серин/треонин протеинкиназу, которая активируется в комплексе с ДНК. Биохимические и генетические данные свидетельствуют о том, что ДНК-ПК состоит из (а) каталитической субъединицы, которая называется ДНК-ПКкс, и (б) двух регуляторных компонентов (Ku70 и Ku80). По функциональным показателям, ДНК-ПК является чрезвычайно важной составляющей, с одной стороны, репарации двухцепочечных разрывов ДНК (ДЦР), а с другой стороны, соматической или V(D)J рекомбинации. Дополнительно, ДНК-ПК и ее компоненты связаны с множеством других физиологических процессов, включая модуляцию структуры хроматина и поддержание теломер (Smith & Jackson (1999) Genes и Dev 13: 916; Goytisolo и др. (2001) Mol. Cell. Biol. 21: 3642; Williams и др. (2009) Cancer Res. 69: 2100).
Генетический материал человека в форме ДНК постоянно подвержен атакам активных форм кислорода (АФК), которые образуются главным образом в качестве побочных продуктов окислительного метаболизма. АФК способны вызывать повреждение ДНК в форме одноцепочечных разрывов. Двухцепочечные разрывы могут возникать, если предшествующие одноцепочечные разрывы происходят в непосредственной близости. Дополнительно, одно- и двухцепочечные разрывы могут возникать, если репликативная вилка ДНК наталкивается на поврежденные структуры оснований. Кроме того, экзогенные влияния, такие как ионизирующее излучение (например, гамма или корпускулярное излучение), и определенные противораковые лекарственные средства (например, блеомицин) способны вызывать двухцепочечные разрывы ДНК. Кроме того, ДЦР могут встречаться в качестве промежуточных продуктов соматической рекомбинации, процесса, который является важным для образования функциональной иммунной системы всех позвоночных. Если двухцепочечные разрывы ДНК не репарированы или репарированы неправильно, то могут встречаться мутации и/или хромосомные аберрации, которые в результате могут привести к клеточной гибели. Для противодействия тяжелым повреждениям, возникающим вследствие двухцепочечных разрывов ДНК, эукариотические клетки разработали различные механизмы для их репарации. Высшие эукариоты используют главным образом так называемое негомологичное соединение концов, в котором ключевую роль выполняет ДНК-зависимая протеинкиназа. В биохимических исследованиях было показано, что ДНК-ПК наиболее эффективно активируется посредством случаев ДНК-ДЦР. Клеточные линии, у которых ДНК-ПК компоненты были мутированы и являются нефункциональными, оказываются чувствительными к действию радиации (Smith и Jackson, 1999).
Многие заболевания связаны с аномальными клеточными ответными реакциям, пролиферацией и уклонением от запрограммированной клеточной гибели, запускаемыми событиями, опосредованными протеинкиназами, как описано выше и в дальнейшем в настоящей заявке. Несмотря на существенный прогресс в развитии ингибиторов протеинкиназ, пригодных в качестве терапевтических средств, который был осуществлен до настоящего времени, сохраняется потребность в идентификации, какие предпочтительные лечения и состояния могут предоставлять благоприятное расширение потенциала ингибиторов протеинкиназ.
Сущность изобретения
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способы лечения, стабилизации или ослабления тяжести или прогрессирования одного или нескольких заболеваний или нарушений, связанных с ДНК-ПК, включающие введение пациенту, который в этом нуждается, ингибитора ДНК-ПК в комбинации с дополнительным химиотерапевтическим средством. В некоторых аспектах, ингибитор ДНК-ПК представляет собой (S)-[2-хлор-4-фтор-5-(7-морфолин-4-ил-хиназолин-4-ил)-фенил]-(6-метокси-пиридазин-3-ил)-метанол, имеющий представленную ниже структуру Соединения 1:
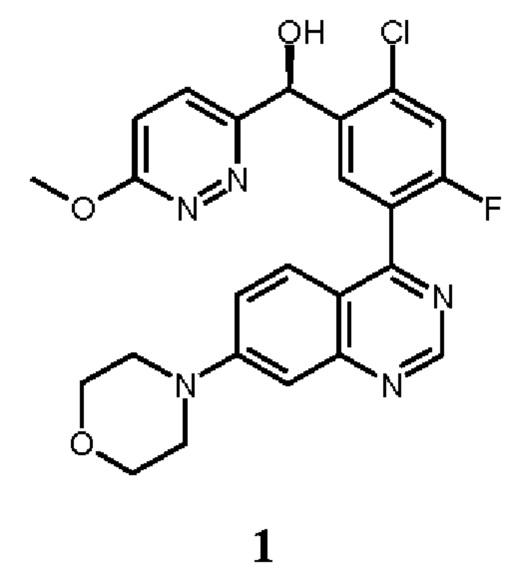
Соединение 1 описано более подробно в опубликованной заявке на патент США 2016/0083401, опубликованной 24 марта 2016 г. (обозначаемой далее в настоящей заявке как " '401 публикация"), которая полностью таким образом включена в настоящую заявку путем ссылки. Соединение 1 обозначается как соединение 136 в Таблице '401 публикация. Соединение 1 является активным в различных исследованиях и терапевтических моделях, демонстрирующих ингибирование ДНК-ПК (см., например, Таблицу 4 '401 публикации). Таким образом, Соединение 1 или его фармацевтически приемлемая соль, пригодно для лечения одного или нескольких нарушений, связанных с активностью ДНК-ПК, как описано в более подробно в настоящей заявке ниже.
Настоящее изобретение, в особенности, охватывает следующие аспекты и варианты осуществления:
Во-первых, оно относится к способу лечения злокачественного новообразования у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину.
В предпочтительных вариантах осуществления, злокачественное новообразование выбирают из злокачественного новообразования ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов.
В некоторых предпочтительных вариантах осуществления, Соединение 1 вводят с этопозидом.
В альтернативных предпочтительных вариантах осуществления, Соединение 1 вводят с цисплатином.
В других предпочтительных вариантах осуществления, Соединение 1 вводят и с этопозидом, и с цисплатином.
Способ лечения, как указано выше, может дополнительно включать стадию осуществления лучевой терапии пациенту.
В любом из предпочтительных вариантов осуществления, Соединение 1 может вводиться в количестве от приблизительно 1 до приблизительно 800 мг, например, в количестве от приблизительно 10 до приблизительно 800 мг.
Этопозид может вводиться внутривенно в количестве приблизительно 100 мг/м2.
Например, этопозид может вводиться путем внутривенной инфузии приблизительно в течение 1 часа.
Цисплатин может вводиться внутривенно в количестве приблизительно 75 мг/м2.
Например, цисплатин может вводиться путем внутривенной инфузии приблизительно в течение 1 часа.
В способе лечения злокачественного новообразования у пациента, который в этом нуждается, включающего введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с этопозидом, эффект Соединения 1 в комбинации с этопозидом является синергическим, где индуцируемые этопозидом миело- и лимфоидные уменьшения, в дальнейшем не повышаются с помощью Соединения 1.
Кроме того, настоящее изобретение обеспечивает Соединение 1 или его фармацевтически приемлемую соль для применения для лечения злокачественного новообразования в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения, и как изложено ниже.
Таким образом, настоящее изобретение обеспечивает Соединение 1 или его фармацевтически приемлемую соль для применения для лечения злокачественного новообразования, включающее введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения, и как изложено ниже.
Настоящее изобретение также обеспечивает комбинацию Соединения 1 или его фармацевтически приемлемой соли с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину, для применения для лечения злокачественного новообразования. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения, и как изложено ниже.
Настоящее изобретение также обеспечивает этопозид для применения для лечения злокачественного новообразования у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения, и как изложено ниже.
Настоящее изобретение также обеспечивает применение комбинации Соединения 1 или его фармацевтически приемлемой соли и по меньшей мере одного дополнительного терапевтического средства выбранного из этопозида и препарата, содержащего платину, для приготовления лекарственного средства для лечения злокачественного новообразования у пациента. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения. Предпочтительные варианты осуществления изобретения являются такими, как указано выше, применительно к способу лечения, и как изложено ниже.
Особенно предпочтительными является комбинация Соединения 1 или его фармацевтически приемлемой соли и этопозида, необязательно дополнительно комбинированная с препаратом, содержащим платину, таким как цисплатин.
Злокачественные новообразования, для которых особенно предпочтительными являются комбинация, соответственно способ лечения в соответствии с настоящим изобретением, изложены в типичных вариантах осуществления, которые также являются релевантными за пределами и в дальнейших предпочтительных применяемых экспериментальных условиях. Чем выше оценка синергизма, тем больше благоприятный эффект. Несомненно, поскольку Соединение 1 является ингибитором ДНК-ПК, то не будет предполагаться эффективность в раковых клетках/типах, дефицитных по ДНК-ПК, как подтверждается экспериментальными данными, представленными в настоящей заявке.
Дополнительные варианты осуществления, описывающие способы использования заявленной комбинации, раскрыты более подробно далее в настоящей заявке.
Не желая ограничиваться какой-либо теорией, на основании примеров, представленных ниже в настоящей заявке, можно получить следующие сведения: Экспериментальные данные, представленные в настоящей заявке, демонстрируют потенцирование этопозида с помощью Соединения 1 в широком диапазоне активности. Расширение диапазона активности по сравнению с отдельным взятым средством свидетельствует о том, что Соединение 1 повышает специфичность действия этопозида, расширяя, таким образом, его клинические применения. Экспериментальные результаты дополнительно обеспечивают существенное подтверждение синтетического механизма поражения, возникающего вследствие комбинации этопозида с Соединением 1.
Краткое описание фигур
На Фигуре 1 показано эффективность Соединения 1 в комбинации с облучением на шести мышиных моделях ксенотрансплантатов рака человека.
На Фигуре 2 показано эффективность Соединения 1 в комбинации с ИИ в 6-ти недельной схеме лечения на модели FaDu ксенотрансплантата.
На Фигуре 3 показано эффективность Соединения 1 в комбинации с ИИ в 6-ти недельной схеме лечения на модели NCI-H460 ксенотрансплантата.
На Фигуре 4а показано эффективность Соединения 1 в комбинации с этопозидом/ цисплатином на модели NCI-H526 ксенотрансплантата; на Фигуре 4b показано, что введение Соединения 1 ежедневно во время исследования приводит к лучшей эффективности, чем раздельное лечение с применением SoC и Соединения 1 либо 7 ч или дней.
На Фигуре 5 показано изменение веса тела при лечении с применением этопозида/ цисплатина и комбинации с Соединением 1 у мышей.
На Фигуре 6 показано количество ретикулоцитов и лимфоцитов при лечении с и восстановлением от этопозида/цисплатина и комбинации с Соединением 1.
На Фигуре 7 показана эффективность отдельно взятого средства Соединения 1 на модели LoVo ксенотрансплантата с дефектным ATM путем.
На Фигуре 8 показано, что Соединение 1 ингибирует ДНК-ПК аутофосфорилирование (p-Ser2056) на WM164 ксенотрансплантате опухоли.
На Фигуре 9 показаны результаты комбинации Соединения 1 с этопозидом в NCI-H460 анализе жизнеспособности (инкубация с соединением в течение 72 ч).
На Фигуре 10 показаны результаты комбинации Соединения 1 с этопозидом в NCI-H460 анализе жизнеспособности (инкубация с соединением в течение 168 ч).
На Фигуре 11 показаны результаты комбинации Соединения 1 с этопозидом в M059K (ДНК-ПК дикого типа) анализе жизнеспособности (инкубация с соединением в течение 72 ч).
На Фигуре 12 показаны результаты комбинации Соединения 1 с этопозидом в M059K (ДНК-ПК дикого типа) анализе жизнеспособности (инкубация с соединением в течение 168 ч).
На Фигуре 13 показаны результаты комбинации Соединения 1 с этопозидом в MO59J (ДНК-ПК дефицитном) анализе жизнеспособности (инкубация с соединением в течение 168 ч).
На Фигуре 14 показаны результаты комбинации Соединения 1 с этопозидом на панели раковых клеточных линий in vitro.
На Фигуре 15 показаны результаты комбинации Соединения 1 с этопозидом на панели раковых клеточных линий in vitro.
На Фигуре 16 показаны синергетические результаты комбинации Соединения 1 с этопозидом.
На Фигуре 17 показаны результаты комбинации Соединения 1 по сравнению с VX-984 с этопозидом в MO59K (ДНК-ПК дикого типа) анализе жизнеспособности (инкубация с соединением в течение 72 ч).
ПОДРОБНОЕ ОПИСАНИЕ ОПРЕДЕЛЕННЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Как описано в настоящей заявке, в некоторых вариантах осуществления, настоящее изобретение обеспечивает способы лечения, стабилизации или ослабления тяжести или прогрессирования одного или нескольких заболеваний или нарушений, связанных с ДНК-ПК, включающий введение пациенту, который в этом нуждается, ингибитора ДНК-ПК в комбинации с дополнительным химиотерапевтическим средством. Как также описано в настоящей заявке, в некоторых вариантах осуществления, настоящее изобретение обеспечивает способы лечения злокачественного новообразования, включающие введение пациенту, который в этом нуждается, ингибитора ДНК-ПК в комбинации с дополнительным химиотерапевтическим средством. В некоторых вариантах осуществления, ДНК-ПК ингибитор представляет собой Соединение 1 или его фармацевтически приемлемую соль.
Термины "содержащий" и "включающий" используются в настоящей заявке в их неисчерпывающем и неограничивающем значении, если специально не указано иначе.
Термины, указанные в единственном числе, и их сходные ссылки в контексте описания изобретения (в особенности в контексте последующих пунктов формулы изобретения) рассматриваются как охватывающие как единственное число, так и множественное число, если специально не указано в настоящей заявке или очевидно не опровергается контекстом. Если используется форма множественного числа для соединений, солей и т.д., то это обозначает также единственное соединение, соль или т.д.
Как используется в настоящей заявке, термин "в комбинации" по отношению к введению Соединения 1 и дополнительного химиотерапевтического средства обозначает, что каждый из компонентов, Соединение 1 или его фармацевтически приемлемую соль, и дополнительное химиотерапевтическое средство вводят пациенту в любом порядке (то есть, одновременно или последовательно) или совместно в одной композиции, препарате или единичной дозированной форме. В некоторых вариантах осуществления, термин "комбинация" обозначает, что Соединение 1 или его фармацевтически приемлемую соль, и дополнительное терапевтическое средство, вводят одновременно или последовательно. В определенных вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, и дополнительное терапевтическое средство, вводят одновременно в одной и той же композиции, содержащей Соединение 1 или его фармацевтически приемлемую соль, и дополнительное терапевтическое средство. В определенных вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, и дополнительное терапевтическое средство, вводят одновременно в раздельных композициях (то есть, где Соединение 1 или его фармацевтически приемлемую соль, и дополнительное терапевтическое средство вводят одновременно каждый в раздельной единичной дозированной форме. Следует принять во внимание, что Соединение 1 или его фармацевтически приемлемую соль, и дополнительное химиотерапевтическое средство вводят в тот же самый день или в различные дни и в любом порядке в соответствии с подходящем протоколом дозирования.
Термин "приблизительно" или "приблизительно" будет иметь значения в пределах 10%, например, в пределах 5%, данного значения или диапазона.
Как используется в настоящей заявке, "терапевтически эффективное количество" обозначает количество вещества (например, терапевтического агента, композиции и/или препарата), которое проявляет желательный биологический ответ. В некоторых вариантах осуществления, терапевтически эффективное количество вещества представляет собой количество, которого достаточно, при введении в виде части режима дозирования субъекту, страдающему от или чувствительному к заболеванию, состоянию или нарушению, для лечения, диагностики, предотвращения и/или замедления начала заболевания, состояния или нарушения. Как будет понятно для квалифицированного специалиста в данной области техники, эффективное количество вещества может изменяться в зависимости от таких факторов, как желательная биологическая конечная точка, доставляемое вещество, целевая клетка или ткань, и т.д. Например, эффективное количество Соединения в препарате для лечения заболевания, состояния или нарушения представляют собой количество, которое ослабляет, облегчает, снимает, ингибирует, предотвращает, замедляет начало, снижает тяжесть и/или уменьшает распространение одного или нескольких симптомов или характерных особенностей заболевания, состояния или нарушения. В некоторых вариантах осуществления, "терапевтически эффективное количество" представляет собой по меньшей мере минимальное количество соединения или композиции, содержащей соединение, которого достаточно для лечения одного или нескольких симптомов заболевания или нарушения, связанного с ДНК-ПК.
Термины "лечить" или "лечение", как используется в настоящей заявке, относится к частичному или полному ослаблению, ингибированию, замедлению начала, предотвращению, облегчению и/или купированию заболевания или нарушения, или одного или нескольких симптомов заболевания или нарушения. Как используется в настоящей заявке, термины "терапия", "лечить" и "лечение" относится к частичному или полному ослаблению, ингибированию, замедлению начала, предотвращению, облегчению и/или купированию заболевания или нарушения, или одного или нескольких симптомов заболевания или нарушения, как описано в настоящей заявке. В некоторых вариантах осуществления, лечение может осуществляться после развития одного или нескольких симптомов. В некоторых вариантах осуществления, термин "лечение" включает предотвращение или остановку прогрессирования заболевания или нарушения. В других вариантах осуществления, лечение может осуществляться при отсутствии симптомов. Например, лечение может осуществляться чувствительному индивидууму перед началом симптомов (например, с учетом анамнеза симптомов и/или с учетом генетических или других факторов чувствительности). Лечение также можно продолжать после устранения симптомов, например, для предотвращения или задержки их повторного появления. Таким образом, в некоторых вариантах осуществления, термин "лечение" включает предотвращения рецидива или повторного появления заболевания или нарушения.
Выражение "единичная дозированная форма", как используется в настоящей заявке, относится к физически дискретной единице терапевтического препарата, подходящей для субъекта, подвергаемого лечению. Тем не менее, подразумевается, что общая применяемая суточная дозировка композиций согласно настоящему изобретению будет определяться лечащим врачом с учетом тщательной медицинской клинической оценки. Уровень специфической эффективной дозы для любого конкретного субъекта или организма будет зависеть от различных факторов, включая нарушение, подвергаемое лечению, и тяжесть нарушения; активность специфического применяемого агента; специфичность применяемой композиции; возраст, вес тела, общее состояние здоровья, пол и питание субъекта; время введения, и скорость выведения специфического активного средства; продолжительность лечения; лекарственных средств и/или дополнительных терапий, используемых в комбинации или совместно с применяемым (и) специфическим (и) соединением (ями), и другими факторами, хорошо известными в области медицины.
Как описано в целом выше, настоящее изобретение обеспечивает способы лечения, стабилизации или ослабления тяжести или прогрессирования одного или нескольких заболеваний или нарушений, связанных с ДНК-ПК, включающие введение пациенту, который в этом нуждается, ингибитора ДНК-ПК в комбинации с дополнительным химиотерапевтическим средством. В некоторых аспектах, ингибитор ДНК-ПК представляет собой (S)-[2-хлор-4-фтор-5-(7-морфолин-4-ил-хиназолин-4-ил)-фенил]-(6-метокси-пиридазин-3-ил)-метанол, имеющий представленную ниже структуру Соединение 1:
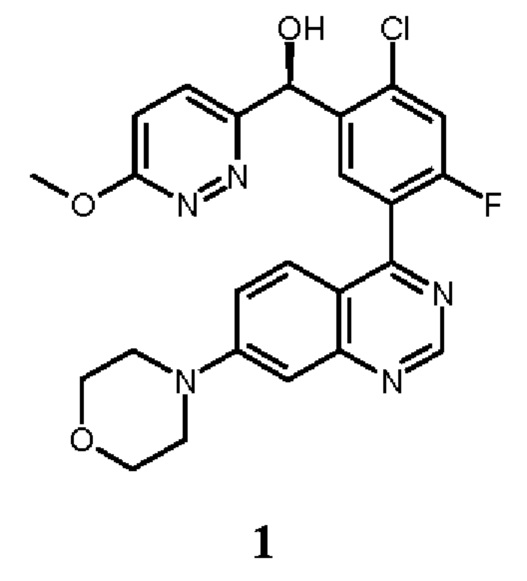
или его фармацевтически приемлемую соль.
Подразумевает, что, несмотря на то, что способы, описанные в настоящей заявке, могут относиться к препаратам, дозам и режимам/схемам дозирования Соединения 1, такие препараты, дозы и/или режимы/схемы дозирования аналогичным образом применимы к любой фармацевтически приемлемой соли Соединения 1. Таким образом, в некоторых вариантах осуществления, доза или режим дозирования для фармацевтически приемлемой соли Соединения 1, или его фармацевтически приемлемую соль, выбирают из любых доз или режимов дозирования для Соединения 1, как описано в настоящей заявке.
Дополнительные химиотерапевтические средства
Как описано в целом выше, заявляемые способы включают комбинированные терапии с применением Соединения 1 или его фармацевтически приемлемой соли и химиотерапевтического средства. В определенных вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой этопозид. В определенных вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой препарат, содержащий платину. В определенных вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой цисплатин. В определенных вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой карбоплатин. В некоторых вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой комбинацию обоих средств: этопозида и препарате, содержащего платину. В некоторых вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой комбинацию обоих средств: этопозида и цисплатина. В некоторых вариантах осуществления, дополнительное химиотерапевтическое средство представляет собой комбинацию обоих средств: этопозида и карбоплатина.
Этопозид образует тройной комплекс с ДНК и ферментом топоизомераза II, который способствует расплетанию ДНК во время репликации. Это предотвращает повторное лигирование цепей ДНК и вызывает разрыв цепей ДНК. Раковые клетки в большей степени зависят от этого фермента, чем здоровые клетки, поскольку они делятся более быстро. Следовательно, лечение с применением этопозида приводит к погрешностям при синтезе ДНК и способствует апоптозу раковых клеток. Не желая ограничиваться какой-либо конкретной теорией, полагают, что ДНК-ПК ингибитор блокирует один из основных путем репарации разрывов двухцепочечной ДНК в ДНК, таких образом замедляя процесс репарации и приводя к усилению противоопухолевой активности этопозида.
Препараты, содержащие платину, представляют собой химиотерапевтические средства на основании платины. Как используется в настоящей заявке, термин "препарат, содержащий платину" используется взаимозаменяемо с термином "платиносодержащий агент." Платиносодержащие агенты хорошо известны в данной области техники. В некоторых вариантах осуществления, препарат, содержащий платину (или платиносодержащий агент) выбирают из цисплатина, карбоплатина, оксалиплатина, недаплатина и сатраплатина.
Цисплатин перекрестно сшивает клеточную ДНК несколькими различными путям, препятствуя делению клетки путем митоза. Наиболее заметными изменения в ДНК являются внутрицепочечные перекрестные сшивки с пуриновыми основаниями. Эти перекрестные сшивки репарируются главным образом путем эксцизионной репарации нуклеотидов. Поврежденная ДНК активирует механизмы контрольных точек, которые, в свою очередь, активируют апоптоз, если репарация оказывается невозможной.
В определенных вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, вводят в комбинации с лучевой терапией. В определенных вариантах осуществления, заявленные способы включают введение Соединения 1 или его фармацевтически приемлемой соли, в комбинации с одним или обоими средствами: этопозидом и цисплатином, где указанный способ дополнительно включает осуществление лучевой терапии пациента.
Способы лечения
Соединение 1 является эффективным и селективным АТФ-конкурентным ингибитором ДНК-ПК, как показано с помощью кристаллографических исследований и исследований ферментативной кинетики. ДНК-ПК, совместно с пятью дополнительными белковыми факторами (Ku70, Ku80, XRCC4, лигаза IV, и Artemis) имеют решающее значение в репарации двухцепочечных разрывов ДНК посредством NHEJ (негомологичное соединение концов). Киназная активность ДНК-ПК является важной для надлежащей и своевременной репарации ДНК и длительного выживания раковых клеток (Salles и др., 2006; Dobbs и др., 2011). Не желая ограничиваться какой-либо конкретной теорией, полагают, что основными эффектами Соединения 1 является подавление активности ДНК-ПК и репарации двухцепочечных разрывов ДНК (DSB), что приводит к изменению репарации ДНК и потенцированию противоопухолевой активности агентов, повреждающих ДНК.
Данные in vitro демонстрируют синергизм Соединения 1 в комбинации с этопозидом по сравнению с этопозидом отдельно. Таким образом, в некоторых вариантах осуществления, обеспечиваемая комбинация Соединения I или его фармацевтически приемлемой соли с этопозидом является синергической. В особенности, экспериментальные результаты, представленные в настоящей заявке, обеспечивают убедительное доказательство потенцирования этопозида, в особенности, с помощью Соединения 1 или его фармацевтически приемлемой соли.
В определенных вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину.
В определенных вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и препарата, содержащего платину. В некоторых вариантах осуществления, препарат, содержащий платину (или платиносодержащий агент) выбирают из цисплатина, карбоплатина, оксалиплатина, недаплатина и сатраплатина. В определенных вариантах осуществления, препарат, содержащий платину, представляет собой цисплатин. В определенных вариантах осуществления, заявляемый способ дополнительно включает проведение пациенту лучевой терапии.
В определенных вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с этопозидом и цисплатином. В определенных вариантах осуществления, заявляемый способ дополнительно включает проведение пациенту лучевой терапии.
Соединение 1 или его фармацевтически приемлемая соль и их композиции в соответствии со способами согласно настоящему изобретению, вводятся, используя любое количество и любой путь введения, эффективный для лечения или ослабления тяжести нарушения, обеспечиваемого выше. Точное необходимое количество будет изменяться для различных субъектов, в зависимости от видов, возраста и общего состояния субъекта, тяжести инфекции, конкретного средства, его режима введения и т.д.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в количестве от приблизительно 1 до приблизительно 800 мг в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из препарата, содержащего платину, и этопозида.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в количестве от приблизительно 10 до приблизительно 800 мг в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из препарата, содержащего платину, и этопозида, в количествах в соответствии с местным клиническим стандартом руководств осуществления лечения. В определенных вариантах осуществления, цисплатин вводят внутривенно в количестве от приблизительно 50 до приблизительно 75 мг/м2. В некоторых вариантах осуществления, этопозид вводят внутривенно в количестве от приблизительно 50 до приблизительно 100 мг/м2. Как правило, цисплатин вводят в дозе 75 мг/м2 и этопозид в дозе 100 мг/м2.
В определенных вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и цисплатина, где Соединение 1 или его фармацевтически приемлемая соль и дополнительное терапевтическое средство обеспечиваются в одной и той же композиции. В определенных вариантах осуществления, заявляемый способ дополнительно включает проведение пациенту лучевой терапии.
В определенных вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования, выбранного из ободочной кишки, легких, головы и шеи, поджелудочной железы и их гистологических подтипов (например, адено, сквамозного, крупноклеточного) у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, в комбинации с по меньшей мере одним дополнительным терапевтическим средством, выбранным из этопозида и цисплатина, где Соединение 1 или его фармацевтически приемлемая соль и дополнительное терапевтическое средство обеспечиваются в раздельных композициях для одновременного или последовательного введения указанному пациенту. В определенных вариантах осуществления, заявляемый способ дополнительно включает проведение пациенту лучевой терапии.
В некоторых вариантах осуществления, настоящее изобретение обеспечивает способ лечения злокачественного новообразования у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1 или его фармацевтически приемлемой соли, с последующим введением цисплатина и затем водят этопозид. В определенных вариантах осуществления, Соединение 1 вводят приблизительно за 1-2, предпочтительно приблизительно 1,5 часа перед введением цисплатина. В некоторых вариантах осуществления, Соединение 1 вводят указанному пациенту QD. В определенных вариантах осуществления, Соединение 1 вводят в течение 5 дней. В некоторых вариантах осуществления, Соединение 1 вводят в течение от приблизительно 4 дней до приблизительно 3 недель, приблизительно в течение 5 дней, приблизительно в течение 1 недели, или приблизительно в течение 2 недель.
В определенных вариантах осуществления, цисплатин вводят путем внутривенной инфузии. В определенных вариантах осуществления, цисплатин вводят путем внутривенной инфузии в дозе приблизительно 75 мг/м2 в течение 60-минутного периода. В некоторых вариантах осуществления, этопозид вводят путем внутривенной инфузии. В определенных вариантах осуществления, этопозид вводят путем внутривенной инфузии в дозе приблизительно 100 мг/м2 в течение 60-минутного периода.
В определенных вариантах осуществления, этопозид вводят путем внутривенной инфузии в день 1 и затем путем внутривенной инфузии или пероральное введение в дни 2 и 3.
В некоторых вариантах осуществления, заявленные способы включают введение фармацевтически приемлемой композиции, содержащей Соединение 1 или его фармацевтически приемлемую соль, один, два, три или четыре раза в сутки.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят ежедневно.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят один раз в сутки ("QD").
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят два раза в сутки. В некоторых вариантах осуществления, введение два раза в сутки относится к соединению или композиции, которое (ую) вводят "BID", или две эквивалентные дозы вводят в два различные периоды времени в один день.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят три раза в день. В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят "TID", или три эквивалентные дозы вводят в три различные периоды времени в один день.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят четыре раза в день. В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль, вводят "QID", или четыре эквивалентные дозы вводят в четыре различные периоды времени в один день.
В некоторых вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, вводят пациенту натощак и общая суточная доза представляет собой любую из указанных выше и в настоящей заявке.
В некоторых вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, вводят пациенту после еды и общая суточная доза представляет собой любую из указанных выше и в настоящей заявке.
В некоторых вариантах осуществления, Соединение 1 или его фармацевтически приемлемую соль, вводят перорально.
В предпочтительном варианте осуществления введения этопозида и Соединения 1 или его фармацевтически приемлемой соли, Соединение 1 вводят в тот же самый день и, например, за приблизительно 2 часа перед этопозидом, или в дозе приблизительно в то же время, что и этопозид, или менее, чем через 7 часов после этопозида, например, менее, чем через 5, 3 или 1 час после этопозида.
Введение дополнительного химиотерапевтического средства
В некоторых вариантах осуществления, заявленные способы включают введение фармацевтически приемлемой композиции, содержащей химиотерапевтическое средство, один, два, три или четыре раза в сутки.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят один раз в сутки ("QD").
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят два раза в сутки. В некоторых вариантах осуществления, введение два раза в сутки относится к соединению или композиции, которое (ую) вводят "BID", или две эквивалентные дозы вводят в два различные периоды времени в один день.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят три раза в день. В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят "TID", или три эквивалентные дозы вводят в три различные периоды времени в один день.
В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят четыре раза в день. В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят "QID", или четыре эквивалентные дозы вводят в четыре различные периоды времени в один день. В некоторых вариантах осуществления, фармацевтически приемлемую композицию, содержащую химиотерапевтическое средство, вводят в течение различного количества дней (например, 14, 21, 28) с различным количеством дней между лечениями (0, 14, 21, 28).
В некоторых вариантах осуществления, химиотерапевтическое средство вводят пациенту натощак и общая суточная доза представляет собой любую из указанных выше и в настоящей заявке.
В некоторых вариантах осуществления, химиотерапевтическое средство вводят пациенту после еды и общая суточная доза представляет собой любую из указанных выше и в настоящей заявке.
В некоторых вариантах осуществления, химиотерапевтическое средство вводят перорально по соображениям удобства. В некоторых вариантах осуществления, при введении перорально, химиотерапевтическое средство вводят с едой и водой. В другом варианте осуществления, химиотерапевтическое средство диспергируют в воде или соке (например, яблочном соке или апельсиновом соке) и вводят перорально в виде суспензии. В некоторых вариантах осуществления, при введении перорально, химиотерапевтическое средство вводят после приема пищи.
Химиотерапевтическое средство также можно вводить интрадермально, внутримышечно, внутрибрюшинно, чрескожно, внутривенно, подкожно, интраназально, эпидурально, сублингвально, интрацеребрально, интравагинально, трансдермально, ректально, мукозально, путем ингаляции или местно в уши, нос, глаза или кожу. Способ введение остается в компетенции лечащего врача и может частично зависеть от сайта медицинского состояния.
Фармацевтически приемлемые композиции Соединения 1 и/или химиотерапевтического средства
В некоторых вариантах осуществления, настоящее изобретение обеспечивает фармацевтически приемлемую композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль. В некоторых вариантах осуществления, настоящее изобретение обеспечивает фармацевтически приемлемую композицию химиотерапевтического средства. В некоторых вариантах осуществления, композиция, содержащая Соединение 1 или его фармацевтически приемлемую соль, отделена от композиции, содержащей химиотерапевтическое средство. В некоторых вариантах осуществления, Соединение 1 или его фармацевтически приемлемая соль и химиотерапевтическое средство присутствуют в одной и той же композиции.
В определенных вариантах осуществления, настоящее изобретение обеспечивает композицию, содержащую Соединение 1 или его фармацевтически приемлемую соль и по меньшей мере один из этопозида и цисплатина. В некоторых вариантах осуществления, обеспечиваемая композиция, содержащая Соединение 1 или его фармацевтически приемлемую соль и по меньшей мере один из этопозида и цисплатина, приготовлена для перорального введения.
Типичные примеры таких фармацевтически приемлемых композиций описаны ниже в дальнейшем и в настоящей заявке.
Жидкие дозированные формы для перорального введения включают, но не ограничиваясь ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Дополнительно к Соединению 1 или его фармацевтически приемлемой соли и/или химиотерапевтическому средству, жидкие дозированные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульсификаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в особенности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоль и сложные эфиры жирных кислот и сорбита, и их смеси. Кроме инертных разбавителей, пероральные композиции также могут включать адъюванты, такие как смачивающие вещества, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы и отдушки.
Инъекционные препараты, например, стерильные инъекционные водные или масляные суспензии могут быть приготовлены в соответствии с известными в данной области сведениями, используя подходящие диспергирующие или смачивающие вещества и суспендирующие агенты. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. В качестве приемлемых наполнителей и растворителей, которые могут применяются, можно упомянуть воду, раствор Рингера, Фармакопея США и изотоничный раствор хлорида натрия. Дополнительно, общепринято применяются стерильные, нелетучие масла в качестве растворителя или суспендирующей среды. Для этой цели, может применяться любой мягкое нелетучее масло, включая синтетические моно- или диглицериды. Дополнительно, в препаратах для инъекций используют жирные кислоты, такие как олеиновая кислота.
Инъекционные препараты можно стерилизовать, например, путем фильтрации через фильтр, задерживающий бактерии, или путем инкорпорации стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или дисперировать в стерильной воде или другой стерильной инъецируемой средой перед использованием.
Для пролонгирования эффекта Соединения 1 и/или дополнительного химиотерапевтического средства, часто является желательным замедлить абсорбцию из подкожной или внутримышечной инъекции. Это можно осуществлять путем применения жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Таким образом, скорость абсорбции будет зависеть от его скорости растворения, что, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленная абсорбция парентерально вводимого Соединения 1 или его фармацевтически приемлемой соли и/или химиотерапевтического средства, осуществляется путем растворения или суспендирования Соединения в масляном наполнителе. Депо-формы для инъекций получают путем образования микроинкапсулированных матриц Соединения 1 или его фармацевтически приемлемой соли и/или химиотерапевтического средства, в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения между Соединением и полимером и природой конкретного применяемого полимера, можно контролировать скорость высвобождения Соединения. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо инъекционные препараты также приготавливают путем включения Соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть приготовлены путем смешивания соединений согласно настоящему изобретению с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воском для суппозитория, которые являются твердыми при температуре окружающей среды, но жидкими при температуре организма, и, следовательно, расплавляются в прямой кишке или полости влагалища и высвобождают активное соединение.
Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах, активное соединение смешивают по меньшей мере с одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дикальцийфосфат и/или а) заполнителями или добавками, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, б) связующими, такими как, например, карбоксимэтилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, в) увлажнителями, такими как глицерин, г) дезинтегрирующими средствами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, д) средствами, замедляющими растворения, такими как парафин, э) ускорителями абсорбции, такими как четвертичные аммониевые соединения, е) смачивающими веществами, такими как, например, цетиловый спирт и глицеринмоностеарат, ж) абсорбентами, такими как каолин и бентонитовая глина, и з) смазывающими веществаами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, натрийлуарилсульфат и их смеси. В случае капсул, таблеток и пилюль, дозированная форма также может включать буферные агенты.
Также могут применяться твердые композиции сходного типа в качестве заполнителей в мягких и твердых заполненных желатиновых капсулах, используя наполнители, такие как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и другие. Твердые дозированные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть приготовлены с покрытиями и оболочками, такими как кишечнорастворимые покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических препаратов. Они необязательно могут содержать средства, придающие непрозрачность, и также могут представлять собой композицию, таким образом, что они высвобождают активный (ые) компонент (ы) только или предпочтительно, в определенной части кишечника, необязательно, замедленным образом. Примерами композиций для включения, которые могут использоваться, являются полимерные вещества и воски.
Также могут применяться твердые композиции сходного типа в качестве заполнителей в мягких и твердых заполненных желатиновых капсулах, используя наполнители, такие как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и другие.
Соединение 1 или его фармацевтически приемлемая соль и/или химиотерапевтическое средство, также может быть представлено в микроинкапсулированной форме с одним или несколькими наполнителями, как указано выше. Твердые дозированные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть приготовлены с покрытиями и оболочками, такими как кишечнорастворимые покрытия, покрытия с контролируемым высвобождением и другими покрытиями, хорошо известными в области приготовления фармацевтических препаратов. В таких твердых дозированных формах, Соединение 1 или его фармацевтически приемлемая соль и/или химиотерапевтическое средство, могут быть смешаны по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы также могут включать, в качестве общепринятой практики, дополнительные вещества, отличающиеся от инертных разбавителей, например, таблетирующие смазывающие вещества и другие таблетирующие вспомогательные средства, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблетки и пилюль, дозированные формы также могут включать буферные агенты. Они необязательно могут содержать средства, придающие непрозрачность, и также могут представлять собой композицию, таким образом, что они высвобождают активный (ые) компонент (ы) только или предпочтительно, в определенной части кишечника, необязательно, замедленным образом. Примерами композиций для включения, которые могут использоваться, являются полимерные вещества и воски.
Дозированные формы для местного или трансдермального введения Соединения 1 или его фармацевтически приемлемой соли и/или химиотерапевтического средства, включают мази, пасты, кремы, лосьоны, гели, порошки, раствори, спреи, препараты для ингаляций или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми требуемыми консервантами или буферами, что может быть необходимым. Глазные препараты, ушные капли и глазные капли также охватываются объемом изобретения. Дополнительно, настоящее изобретение охватывает применение трансдермальных пластырей, которые могут предоставлять преимущество обеспечения контролируемой доставки соединения в организм. Такие дозированные формы могут быть приготовлены путем растворения или диспергирования Соединения в надлежащей среде. Также можно использовать ускорители абсорбции для повышения потока Соединения через кожу. Скорость можно контролировать либо путем обеспечения мембраны, контролирующей скорость высвобождения, или путем диспергирования Соединения в полимерной матрице или геле.
ИЛЛЮСТРАТИВНЫЕ ПРИМЕРЫ
Последующие примеры иллюстрируют изобретение, описанное выше; однако они не предназначены для какого-либо ограничения объема изобретения. Благоприятные эффекты фармацевтических соединений, комбинаций и композиций согласно настоящему изобретению также могут быть определены с помощью других тестируемых моделей, хорошо известных квалифицированным специалистам в данной области техники.
Пример 1
Эффективность Соединения 1 в комбинации с лучевой терапией
Терапевтическая значимость ингибирования ДНК-ПК с помощью Соединения 1 исследовали в условиях in vivo в комбинации с ионизирующим излучение (ИИ), клинически установленным лечением, индуцирующим разрывы двухцепоченой ДНК. Соединение 1 тестировали относительно активности на шести мышиных моделях ксенотрансплантата рака человека. Модели выбирали из злокачественных новообразований различного происхождения (ободочной кишки, легких, головы и шеи, поджелудочной железы), и гистологических подтипов (адено, сквамозного, крупноклеточного). Ионизирующее излучение применяли с использованием фракционированной схемы 2 Гр в сутки, применяемое в течение пяти последовательных дней (общая доза облучения = 10 Гр). Соединение 1 вводили перорально за 10 минут перед каждой фракцией облучения (ONC397-1-2AZ, ONC397-1-3AZ, ONC397-1-4AZ, ONC397-1-5AZ, ONC397-1-8AZ).
Во всех моделях, пероральное введение Соединения 1 приводило к сильному усиление эффекта облучения (Фигура 1 - Эффективность Соединения 1 в комбинации с облучением на шести мышиных моделях ксенотрансплантатов рака человека). Усиленный лучевой терапией эффект Соединения 1 количественно представляли для тестируемых моделей с помощью времени до достижения 400% исходного объема для исследуемых групп в дозе 150 мг/кг. Полученные графики Каплана-Майера сравнивали с помощью логарифмического рангового критерия. Было обнаружено, что коэффициент усиления, установленный в этом исследовании, составляет 1,5 (А549, НСТ116), и 2,6 (NCI-Н460) (Таблица 1).
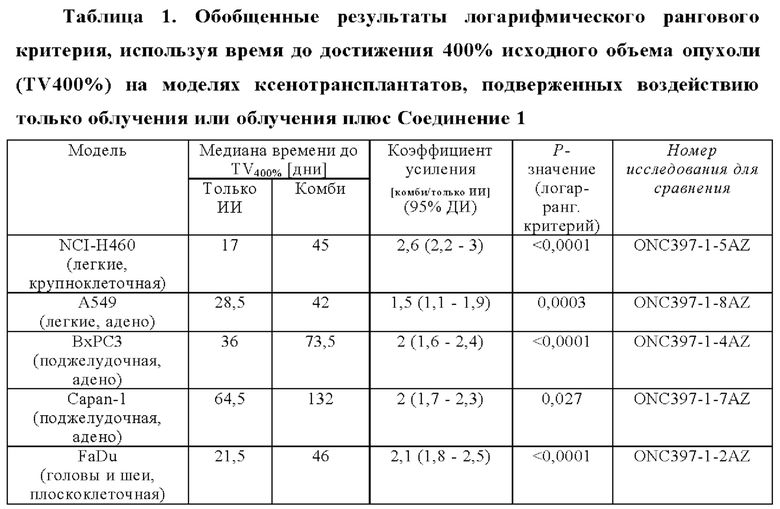
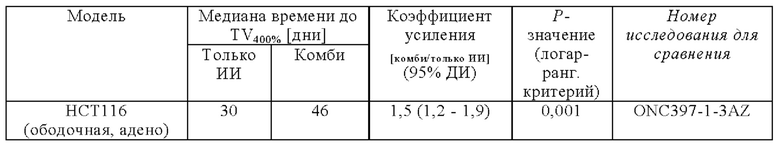
Как продемонстрировано на модели FaDu ксенотрансплантата, результаты этого исследования обобщены в Таблице 2, ниже, эти эффекты повышаются либо путем применения более высокой дозы Соединения 1 или более высокой дозы облучения. Например, 100 мг/кг Соединения 1 в комбинации с суточной дозой 4 Гр (общая доза 20 Гр) приводили к полному ответу (CR) на FaDu модели в течение 92-дневного периода наблюдения (ONC397-1-11AZ), и когда животных облучали суточной дозой 6 Гр (общая доза 30 Гр), то наблюдали коэффициент усиления 2 с дозой 10 мг/кг Соединения 1 (ONC397-1-12AZ).
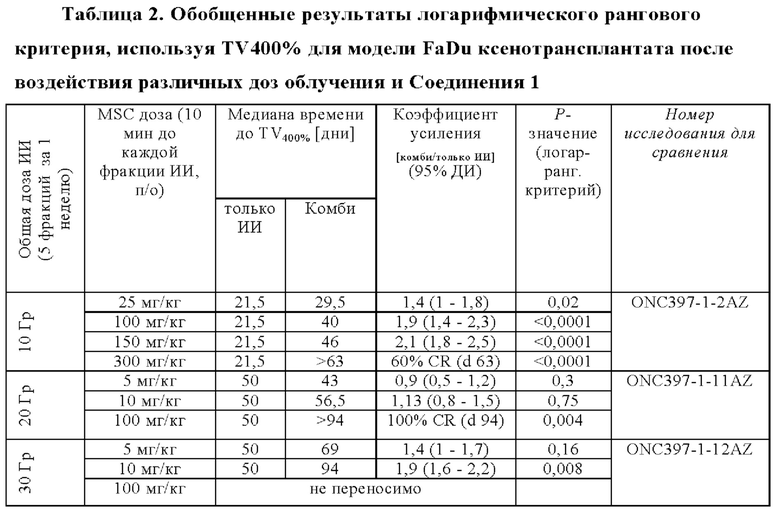
Стандартная схема лучевой терапии, используемая в клинике, представляет собой 6-ти недельную фракционированную схему лечения (5 фракций по 2 Гр ИИ в неделю - всего 60 Гр). Для исследования терапевтического потенциала Соединения 1, эту схему применяли на двух моделях ксенотрансплантата модели рака человека (FaDu и NCI-H460). Соединение 1 вводили перорально за 10 минут перед каждой фракцией облучения в дозах 5, 10, 25, и 50 мг/кг в FaDu (обозначается как ONC397-1-13AZ) и 25 и 50 мг/кг в NCI-H460 исследовании (ONC398-1-5aAZ).
В FaDu исследовании, это комбинированное лечение приводило к сильному ингибированию роста опухоли по сравнению с опухолями, леченными только с применением с ИИ. Полную регрессию опухоли наблюдали у 44% животных, леченных с применением 10 мг/кг Соединения 1, и опухоли не возобновляли свой рост в течение периода исследования (113 дней). В дозах 25 и 50 мг/кг, опухолевый ксенотрансплантат регрессировал у всех 10 животных и не рецидивировал до окончания исследования (Фигура 2 Эффективность Соединения 1 в комбинации с ИИ в 6-ти недельной схеме лечения на FaDu модели ксенотранспланта).
NCI-H460 выбирали в качестве модели, относительно нечувствительной к ИИ лечению. Опухоли, леченные только с применением ИИ, быстро прогрессировали во время лечения. Тем не менее, опухоли, леченные с применением ИИ и Соединения 1, регрессировали во время периода лечения и наблюдения приблизительно вплоть до дня 90 (Фигура 3 Эффективность Соединения 1 в комбинации с ИИ в 6-ти недельной схеме лечения на модели NCI-H460 ксенотрансплантата). Опухолевые ксенотрансплантаты у мышей, леченных с применением 50 мг/кг ингибитора ДНК-ПК, не превышали их начального объема до окончания эксперимента в день 110 (42 дней лечения плюс 68 дней наблюдения).
В обоих исследованиях, лечение в целом хорошо переносилось. Во время периода лечения, животные во всех леченных группах проявили умеренную потеря веса тела, вероятно, в связи с суточными процедурами лечения - пероральное зондовое питание, анестезия, и ИИ в течение периода 6 недель. Потеря веса тела была полностью обратимой.
Пример 2
Эффективность Соединения 1 в комбинации с этопозидом и цисплатином на модель ксенотранспланти NCI-H526 SCLC человека
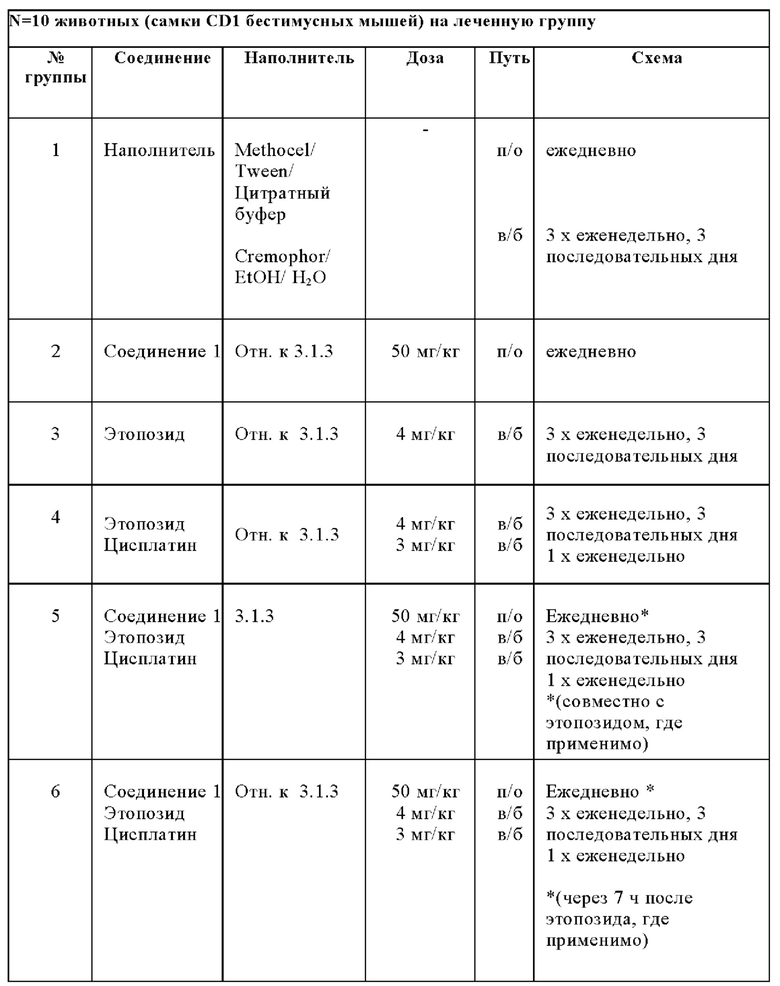
Для исследовании эффективности на ксенотрансплантате, использовали самок 1014-1-58/ BKU00105 CD1 безтимусных мышей [внутренняя партия ID 04108; Charles River Laboratories, Sulzfeld, Germany], в возрасте 6-8 недель. Для гематологических исследований, использовали самок 1015-1-3/ BKU00106 иммунокомпетентных CD1 мышей [внутренняя партия ID1406; Janvier Labs, Genest-Saint-Isle, France], в возрасте 12 недель. Мышей акклиматизировали в условиях содержания в течение 1 недели. Их содержали в группах из 10 животных в полисульфоновых клетках типа III (42,5 × 26,6 × 15,5 см; Techniplast, Hohenpeissenberg). Подстилка состояла из тополиных опилков (Е. Becker, Castrop-Rauxel). Комнатная температура составляла 24+/-2°С и относительная влажность была 50+/-10% с 15 обменами воздуха в час. Питьевую воду (обеспечиваемую ad libitum) дополняли 1 мг/мл хлора и доводили до рН 6,5 с применением HCl. Стерильное высокобелковое питания для иммунодефицитных мышей (Ssniff, Soest, №продукта V1244-72, γ-стерилизованное) также обеспечивали ad libitum. Цикл дня и ночи устанавливали на 12 часа света и 12 часа темноты. Более подробно протокол исследования описан ниже:
Для исследования эффективности на ксенотрансплантате клеток мелкоклеточного рака легких, 1014-1-58/ BKU00105 NCI-H526 клетки получали из Merck KGaA центрального клеточного банка (замороженный флакон NCI-Н526/5 17.03.2011). Клетки выращивали в суспензии и культивировали в RPMI 1640 ростовой среде (Gibco №31870), вкл. 10% FCS (Biochrome кат.: S0615, Lot0707W), 2 мМ L-глутамина (Gibco №25030), 1 мМ пирувата натрия (Gibco №11360) при 37°С, 5% CO2, для получения 2×108 клеток в целом. После этого клетки промывали 3х с помощью DPBS и ресуспендировали в DPBS (-Mg/-Ca) с Matrigel (BD, № кат.: 354234) (1:1/об.:об.) для получения 2×107 клеток/мл. Затем клеточную суспензию (100 мкл/животное) подкожно инокулировали в правую лапу иммунодефицитным CD1 мышам.
Растворы
Все реагенты и буферы хранили в соответствии с инструкциями производителей и использовали до окончания срока хранения партии.
Соединение 1 получали от Merck KGaA Darmstadt, Germany. Приготовление препарата: Соответствующее количество соединения взвешивали в "Precellys"-пробирку [PEQ-Lab, 91-PCS-CK28R], добавляли 1 мл наполнителя (0,5% Methocel (K4M Premium USP/ ЕР; Colorcon), 0,25% Tween20 (Merck, №заказа: 8170721000) в Na-цитратном буфере 300 мМ рН 2,5). Пробирку помещали в "precellys 24" гомогенизатор ткани [Bertin technologies, Montigny le Bretonneux (FR)] и измельчали дважды при 6500 встряхиваний в течение 30 секунд. После этого, смесь соединения переносили в соответствующий стеклянный флакон и добавляли наполнитель для доведения суспензии до ее конечного объема. В завершение, препарат (желтого цвета, тонкоизмельченная суспензия) перемешивали в течение 10 минут при 40°С.Свежий препарат приготавливали один раз в неделю.
Этопозид VP-16 получали от Selleck Chemicals LLC, № кат. SI225-07. Препарат этопозида готовили следующим образом: 2 мл Chremophor добавляли к 12 мг Этопозида и обрабатывали ультразвуком до растворения. Добавляли 2 мл 100% Этанола и смешивали. Затем добавляли 24 мл дистиллированной воды и обрабатывали ультразвуком. Конечная концентрация VP-16=0,4 мг/ мл. Свежий препарат приготавливали один раз в неделю.
Цисплатин получали от Metac GmbH, инфузии 50 мг/ 100 мл (0,5 мг/ мл); доставка 2015/02/12, №партии Μ130845 В. Цисплатин разводили до концентрации для конечного применения, используя 0,9% солевой раствор (Braun, Reg.-ID.:6726174.00.00). Свежий препарат приготавливали один раз в неделю.
Обобщенные сведения лечения представлены ниже:

Процедура исследования
Инокуляция опухолевых клеток: Суспензию клеток NCI-H526 человека подкожно инокулировали в правую лапу CD1 бестимусным мышам в объеме 100 мкл DPBS (-Mg/-Ca) с Matrigel (1:1/об.:об.) и концентрацией 2×107 клеток/мл.
Идентификация животных: Всех животных индивидуально идентифицировали, используя подкожно имплантированные электронные NONATEC передатчики (LUTRONIC, Luxemburg). Имплантацию осуществляли на спине с помощью гиподермальной иглы (калибр 18) после дезинфекции кожи с помощью 70% спирта. Электронный считыватель предоставлял возможность идентификации каждого индивидуального животного с соответствующим кодовым номером.
Измерения опухолей и расчет: Когда опухоли достигали объема 96-214 мм3, то животных рандомизировали на 7 леченных групп с 10 животным в каждой. Длину (L) и ширину (W) опухоли измеряли два раза в неделю с помощью штангенциркулей. Объем опухоли рассчитывали, используя формулу LxW2/2. Данные собирали в Study AdvantageTM (система сбора данных).
Вес тела: За весом тела наблюдали два /три раза в неделю.
Лечение: дозирования и схема, как изложено выше. Соединение 1 вводили в соответствии с 3 различными схемами:
1) Ежедневно во время исследования и совместно с SoC
2) Ежедневно во время исследования, в дни SoC комбинации, 7 ч - установленное время между лечением SoC и применением Соединения 1
3) Применение только в дни, когда нет лечения Этопозидом
Отбор образцов крови и обработка для гематологических анализов: Кровь собирали, используя Sarstedt Microvette 500 K3E (Tri-Kalium-EDTA) REF20.1341, Lot.4074501: Пробирки сразу помещали на роликовую мешалку (Stuart роликовая мешалка SRT9D) и перемешивали до анализов. Гематологические анализы осуществляли с использованием Analyser Sysmex xT-2000iV, локализованной в А32/113.
Обнаружение Соединения 1 и Этопозида в плазме мышей: Кровь собирали, как указано в 11.3 (BKU00113) и 11.5 (BKU00105), соответственно.
Количественное обнаружение Соединения 1 в плазме мышей осуществляли с использованием ВЭЖХ-МС/МС анализа, в целом в соответствии с процедурами, описанными в SO-ABC-6 Типовой рабочей инструкции 80.45.16.051 и ссылках, указанных в этом источнике.
Конечные точки
Т/С-значение: Способность лечения ингибировать рост опухоли оценивали в конце каждого исследования путем расчета % Т/С значения в соответствии со следующими формулами:
% Т/С дельта > 0 расчета (среднее): [(конечный объем леченной опухои - начальный объем леченной опухоли) / (конечный объем контрольной опухоли - начальный объем контрольной опухоли)] × 100]
% Т/С дельта ≤ 0 (регрессия) расчета (среднее): [(конечный объем леченной опухоли начальный объем леченной опухоли) / начальный объем леченной опухоли] × 100
Стаз: Стаз определял как опухоли, которые демонстрировали меньший или больший размер (≤ -50% и ≤ +25%) после окончания эксперимента относительно размера на начало лечения
Частичные Регрессии: Частичную регрессию определяли как опухоли, которые демонстрируют меньший размер (≤50%) после окончания эксперимента относительно размера на начало лечения.
Полные Регрессии: Полные ремиссии определяли как опухоли, которые больше же не пальпируемые.
Задержка роста опухоли: Отличие в днях для леченных относительно контрольных опухолей для достижения определенного объема, обычно 1 см3, но может быть меньше.
Токсичность: Изменение веса тела в % обозначает отличие веса в начале лечения и конце лечения. Изменения веса тела во время курса лечения является особенно важным, так как оно рассматривается как критерий наличия или отсутствия токсичности, связанной с лечением. Дозировка, продуцирующая изменение на 20% веса тела (средняя для группы) или ≥ 10% лекарственных смертей, рассматривается как чрезмерно токсичная дозировка. Вес тела животных включает вес опухоли.
Подсчет кровяных клеток
Статистический анализ
Данные эффективности анализировали с помощью RM-ANCOVA и попарного сравнения данных объемов опухолей соответствующих комбинированных групп с данными объемов опухолей группы, леченной только SoC.
Гематологические данные оценивали с помощью RM-ANOVA и Бонферрони тест после испытаний множественных сравнений для сравнения количества клеток крови соответствующих комбинированных групп с количеством клеток крови группы, леченной только SoC.
Терапевтический эффект Соединения 1 в комбинации со стандартной схемой лечения (SoC) с применением этопозида и цисплатина тестировали на модели ксенотрансплантата мелколеточного рака легких человека NCI-H526 у бестимусных мышей. Животных лечили с применением трех 1-недельных циклов химиотерапии, состоящей из цисплатина (3 мг/кг один раз в неделю) и Этопозида (4 мг/кг в течение трех последовательных дней в неделю). Комбинацию с Соединением 1 (50 мг/кг) использовал в трех различных схемах. 1) Соединение 1 применяли ежедневно во время исследования и совместно с этопозидом в соответствующие дни. 2) Соединение 1 применяли ежедневно во время исследования через 7 часов после лечением этопозидом в соответствующие дни. 3) Соединение 1 отделяли от лечения Этопозидом и применяли только в те дни, в которые Этопозид не вводили. В исследуемой группе с применением комбинации Соединение 1 вводили дополнительно к химиотерапии (50 мг/кг ежедневно во время периода исследования, распространяя на трехнедельную химиотерапию.
В комбинации с этопозидом и цисплатином, Соединение 1 проявило существенно увеличенную противоопухолевую активность на мышиной модели ксенотрансплантата SCLC NCI-H526 человека (Фигура 4а Эффективность Соединения 1 в комбинации с этопозидом/ цисплатином на NCI-H526 Модели ксенотранспланта (средний объем опухоли слева и индивидуальные объемы опухолей справа)) (обозначается как ONC1014-1-58AZ). Добавление Соединения 1 к SoC схеме этопозида и цисплатина приводит к дополнительной эффективности по сравнению с группой, леченной с применением SoC. После окончания периода лечения (день 21) средний объем опухоли в группе с применением комбинации (n=10) составил 50 мм3 - снижение приблизительно на 67% по сравнению с исходным объемом, в то время как средний объем опухоли SoC группы (n=10) повышался на 30% до приблизительно 200 мм3. В день 28, 9/10 животных в группе с применением комбинации были без прогрессирования заболевания, 4/10 показали полный ответ, из которых 3/10 стабилизацию заболевания и 1/10 регрессию. В группе SoC 8/10 животных продемонстрировали прогрессирование заболевания. На Фигуре 4b показано, что введение Соединение 1 ежедневно во время исследования приводит к лучшей эффективности, чем раздельное лечение с применением SoC и лечением Соединением 1 либо через 7 ч или дней.
SoC терапия индуцировала потерю веса тела у животных (Фигура 5 - Изменение веса тела при лечении с применением этопозида/ цисплатина и комбинации с Соединением 1 у мышей). Комбинирование SoC с Соединением 1 приводит к дополнительной потере веса тела. Всем животным обеспечивали достаточное питание (DietGel® Boost, смешанное в водой) в течение исследования для поддержания потери веса тела в умеренном интервале и стабилизации их общего состояния. После прекращения SoC лечения после окончания цикла 3 химиотерапии (d21) животные восстанавливались, несмотря на непрерывное введение Соединения 1.
Параллельно с противоопухолевым эффектом комбинации этопозид/цисплатин/Соединение 1, исследовали влияние на миелоидные и лимфоидные клетки в иммунокомпетентных мышей (обозначается как ONC1015-1-3AZ). Животных лечили с применением таких же доз и схем, что и противоопухолевом исследовании, но только в течение двух недель. Количество клеток крови определяли во время лечения (дней 5 и 11) и в период восстановления (дней 18 и 24). На Фигуре 6 - Количество ретикулоцитов и лимфоцитом после лечения с применением и восстановление от этопозида/цисплатина и комбинации с Соединением 1 показано, что ретикулоциты и лимфоциты существенно уменьшаются при лечении с применением этопозида и цисплатина. Добавление Соединения 1 не оказывает существенного влияния не на уменьшение клеток крови, не на фазу восстановления. Сходные эффекты наблюдаются для эозинофилов и не наблюдается существенного влияния на нейтрофилы и тромбоциты. Поскольку миелоидная и лимфоидная супрессия является одной из дозолимитирующих токсичностей схемы этопозид/цисплатин у пациентов, продемонстрированное отсутствие какой-либо существенной дополнительной токсичности является положительным исходом.
Пример 3
Лечение с применением отдельно взятого Соединения 1 ингибирует рост LoVo ксенотрансплантата
Недавно было описано, что опухолевые клетки с дисфункциональными компонентами путей репарации ДНК может зависеть от ДНК-ПК, свидетельствуя о том, что ДНК-ПК ингибиторы могут иметь отдельную активность на дефицитные по ДНК репарации опухоли (Riabinska и др., 2013, Dietlein и др., 2014). Мы тестировали эффект Соединения 1 на рост установленных ксенотрансплантатов LoVo карциномы ободочной кишки, которая, как известно, является дефектной по функционированию ATM пути вследствие мутации MRE11 белка. Трехнедельное введение ДНК-ПК ингибитора мышам, несущим опухоль, приводит к дозозависимому ингибированию роста опухоли с практически полной супрессией роста при 150 мг/кг (Фигура 7 - Эффективность отдельно взятого Соединения 1 на модели ксенотранспланта LoVo, дефицитного по ATM пути) (обозначается как ONCEFF-14-001AZ).
Пример 4
Фармакодинамические эффекты in vivo Соединения 1
После индуцирования разрывов двухцепочечных ДНК путем лучевой терапии или других агентов, повреждающих ДНК, каталитическая субъединица ДНК-ПК (ДНК-ПКк) аутофосфорилируется на некоторых остатках серина и треонина. Ser2056 является одним из наиболее значимых и наиболее изученных сайтов аутофосфорилирования. Поскольку фосфорилирование Ser2056 (р-Ser2056) хорошо коррелируется с состоянием активации ДНК-ПК, то он был выбран в качестве фармакодинамического (PD) биомаркера. Осуществляли два различных формата анализов для изменения p-Ser2056 в опухолевой ткани: ELISA и MSD формат.Для обнаружения надежного сигнала для последовательности, ИИ использовали в дозе 50 Гр для ELISA анализа и 10 Гр для более чувствительного MSD анализа. Дозозависимое ингибирование ИИ-индуцированного ДНК-ПК фосфорилирования (Ser2056) с помощью Соединения 1 было продемонстрировано на моделях ксенотрансплантата человека FaDu и НСТ116 с помощью ELISA (обозначается как ONC101305BCS) и WM164 путем MSD анализа. Мышам с привитыми WM164 опухолями вводили Соединение 1 за 10 минут до ИИ в дозе 10 Гр и уровни ДНК-ПК (p-Ser2056) в ткани опухоли (PD) измеряли в определенные моменты времени и коррелировали с концентрацией Соединения 1 в плазме (РК). ДНК-ПК аутофосфорилирование повышалось после ИИ, проявляя максимальную стимуляцию между 1 и 2 часами. Совместное введение ИИ и Соединения 1 (25 мг/кг) приводило к ингибированию ДНК-ПК аутофосфорилированию в ткани опухоли с наиболее сильными эффектами, соответствующими высокой экспозиции Соединения 1 в плазме. Ингибированный уровень был ниже, чем у животных, леченных наполнителем, вследствие ингибирования базального уровня ДНК-ПК фосфорилирования (р-Ser2056) (Фигура 8 - Соединение 1 Ингибирует ДНК-ПК Аутофосфорилирование (p-Ser2056) на ксенотрансплантате WM164 опухоли) (обозначается как ONC20140508CS).
Пример 5
Соединение 1 в комбинации с этопозидом или цисплатином тестировали на следующих раковых клеточных линиях для определения ингибирования опухолевых клеток: карцинома легких человека (NCI-H460), глиобластома человека (M059K и M059J), и плоскоклеточный рак глотки человека (FaDu). Подробности протокола исследования и используемых материалов представлены ниже.
Материалы и источники
Приборы

Концентрации тестируемых изделий
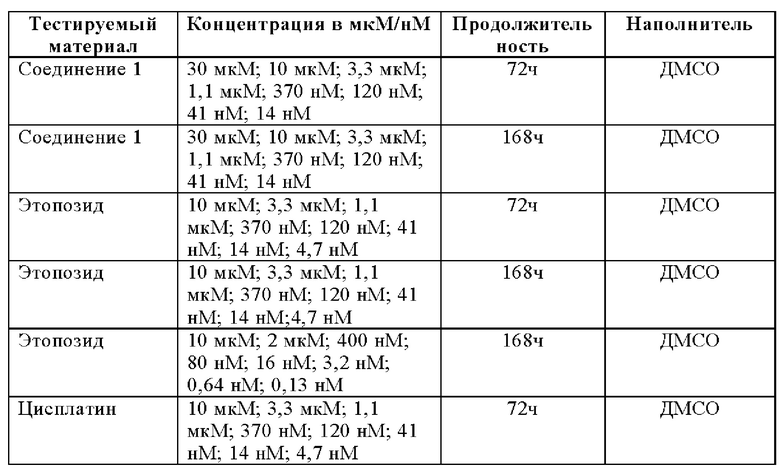
Клетки высевали в объеме 180 мкл/лунку в планшетах на 96 лунок: (FaDu: 1000 клеток/лунку (168 ч); NCI-H460 3000 клеток/лунку (72 ч) и 1000 клеток/лунку (168 ч); M059J: 5000 клеток/лунку (72 ч) и 2000 клеток/лунку (168 ч); М059K: 2000 к/лунку (72 ч) и 1000 клеток/лунку (168 ч)) и инкубировали при 37°С и релевантном CO2 в течение 24 часов. К культуральным планшетам добавляли 20 мкл на лунку, включая серийные разведения Соединения 1 и/или Этопозида или Цисплатина и инкубирование продолжали дополнительно в течение 3 дней (72 ч) или 7 дней (168 ч) при 37°С и релевантном CO2. Соединение 1 предварительно инкубировали в течение 30 минут перед добавлением этопозида или цисплатина.
Клетки высевали в объеме 200 мкл на лунку (FaDu: 1000 клеток/лунку (168 ч); NCI-H460 3000 клеток/лунку (72 ч) и 1000 клеток/лунку (168 ч); MOS9J: 5000 клеток/лунку (72 ч) и 2000 клеток/лунку (168 ч); M059K: 2000 к/лунку (72 ч) и 1000 клеток/лунку (168 ч)). После инкубирования в течение 24 часов при 37°С Соединение 1, Этопозид или Цисплатин диспергировали путем использования цифрового диспенсера HP D300 (и включая программное обеспечение для диспергирования). Планшеты дополнительно инкубировали в течение 3 дней (72 ч) или 7 дней (168 ч) при 37°С и релевантном CO2.
После окончания периода инкубация с соединением добавляли 20 мкл на лунку реагента аламарового синего и планшеты на 96 лунок инкубировали дополнительно в течение вплоть до семи часов. Абсорбцию определяли при 540 нм с помощью Reader Connect и Magelan 7.
0% влияния = клетки лечили с применением ДМСО; -100% влияния = без клеток
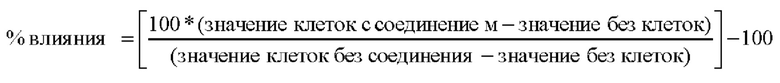
Результаты
Соединение 1 проявило увеличенное ингибирование жизнеспособности NCI-H460, FaDu и M059K (ДНК-ПК дикого типа) клеток в условиях in vitro путем применения комбинации с этопозидом (Фигуры 9, 11 и 12).
Соединение 1 выигрывает в сравнении с другим ДНК-ПК ингибитором, VX984, для которого необходимы более высокие концентрации этопозида для достижения такого же самого % влияния, как проиллюстрировано на Фигуре 17. VX-984 представляет собой Соединение 8-[(1S)-2-[[6-(4,6-дидейтерио-2-метилпиримидин-5-ил)пиримидин-4-ил]амино]-1-метилэтил]хинолин-4-карбоксиамид, как описано, например, в WO 2013/163190.
M059J клетки, которые являются ДНК-ПК дефицитными (1), не проявляют такого влияния комбинации Соединения 1 с этопозидом в сопоставимых условиях (Фигура 13). Не наблюдали достоверного влияния комбинации Соединения 1 совместно с цисплатином на жизнеспособность NCI-H460 (Фигуры 10).
Пример 6
Эффекты на рост клеток при лечении этопозидом в комбинации с Соединением 1 анализировали на панели следующих клеточных линий: A110L, А-427, A529L, А549, BEN, CACO2, CALU-1, Calu-3, CALU6, COLO205, COLO-677, COLO678, COLO-699, COR-L311, COR-L88, DLD1, DMS 114, DMS 153, DMS 454, DMS 53, DV-90, EBC-1, EPLC-272h, H-2171, H69V, HCC-15, HCC2935, HCC-366, HCC-44, HCC-827, HCT116, HCT15, HLC-1, HLF-a, H-MESO-1, HT29, IA-LM, IMR90, JU77, LC-2/ad, LK-2, LO68, LOVO, LS123, LS411N, LU65, Lu99B, LUDLU-1, LXF-289, MIAPACA2, MS-1, MSTO-211H, NCI-H1048, NCI-H1105, NCI-H1299, NCI-H146, NCI-H1563, NCI-H1568, NCI-H1573, NCI-H1581, NCI-H1651, NCI-H1694, NCI-H1734, NCI-H1755, NCI-H1792, NCI-H1838, NCI-H1869, NCI-H1876, NCI-H1882, NCI-H1915, NCI-H196, NCI-H1975, NCI-H2029, NCI-H2030, NCI-H2066, NCI-H2073, NCI-H2081, NCI-H2085, NCI-H211, NCI-H2110, NCI-H2122, NCI-H2126, NCI-H2141, NCI-H2170, NCI-H2172, NCI-H2196, NCI-H226, NCI-H2286, NCI-H2291, NCI-H23, NCI-H2342, NCI-H2347, NCI-H2405, NCI-H2444, NCIH292, NCIH358M, NCI-H446, NCIH460, NCI-H508, NCI-H520, NCI-H522, NCI-H524, NCI-H596, NCI-H647, NCI-H661, NCI-H69, NCI-H774, NCIH82, NCI-H841, NGP, PC-9, RKO, SCLC-21h, SHP-77, SK-CO-1, SK-MES-1, SNU-C1, SW1116, SW1417, SW1463, SW48, SW620, SW837, SW 900, SW948, Т3М-11, Т3М-12, T84, A110L, A-427, A529L, A549, BEN, CACO2, CALU-1, Calu-3, CALU6, COLO205, COLO-677, COL0678, COLO-699, COR-L311, COR-L88, DLD1, DMS 114, DMS 153, DMS 454, DMS 53, DV-90, EBC-1, EPLC-272h, H-2171, H69V, HCC-15, HCC2935, HCC-366, HCC-44, HCC-827, HCT116, HCT15, HLC-1, HLF-a, H-MESO-1, HT29, IA-LM, IMR90, JU77, LC-2/ad, LK-2, LO68, LOVO, LS123, LS411N, LU65, Lu99B, LUDLU-1, LXF-289, MIAPACA2, MS-1, MSTO-211H, NCI-H1048, NCI-H1105, NCI-H1299, NCI-H146, NCI-H1563, NCI-H1568, NCI-H1573, NCI-H1581, NCI-H1651, NCI-H1694, NCI-H1734, NCI-H1755, NCI-H1792, NCI-H1838, NCI-H1869, NCI-H1876, NCI-H1882, NCI-H1915, NCI-H196, NCI-H1975, NCI-H2029, NCI-H2030, NCI-H2066, NCI-H2073, NCI-H2081, NCI-H2085, NCI-H211, NCI-H2110, NCI-H2122, NCI-H2126, NCI-H2141, NCI-H2170, NCI-H2172, NCI-H2196, NCI-H226, NCI-H2286, NCI-H2291, NCI-H23, NCI-H2342, NCI-H2347, NCI-H2405, NCI-H2444, NCIH292, NCIH358M, NCI-H446, NCIH460, NCI-H508, NCI-H520, NCI-H522, NCI-H524, NCI-H596, NCI-H647, NCI-H661, NCI-H69, NCI-H774, NCIH82, NCI-H841, NGP, PC-9, RKO, SCLC-21h, SHP-77, SK-CO-1, SK-MES-1, SNU-C1, SW1116, SW1417, SW1463, SW48, SW620, SW837, SW 900, SW948, Т3М-11, Т3М-12, и T84.
Влияния лечения с применением комбинации и монотерапии сравнивали для двух основных тканей, имеющих происхождение из ободочной кишки и легких, но для некоторых аспектов также принимали во внимание четыре клеточные линии, имеющие происхождение из плевры.
В общем, комбинация этопозида с Соединением 1 продемонстрировали увеличение ингибирования роста для анализируемых клеточных линий. Влияния комбинации были синергическими для большинства клеточных линий в комбинации с Соединением 1.
Подробное описание протокола исследования представлено ниже.
128 клеточных линий подвергали скринингу с различными дозами этопозида (2.44Е-09М, 9.77Е-09М, 3,91Е-08М, 1,56Е-07М, 6,25Е-07М, 2,50Е-06М, 1,00Е-05М) и фиксированными дозами Соединения 1 (0,3 мкМ). Влияния на ингибирование роста лечения с применением отдельно взятых средств, а также комбинации измеряли с помощью ONCOLEAD.
Данные ингибирования роста относительно нелеченного контроля получали в виде индивидуальных измерений и моделировали в виде кривой дозовой зависимости по 4 м параметрам, используя DRC пакет в R (1). Получали концентрации ингибитора при 50% ингибировании роста (GI50), используя точку пересечения кривой дозовой зависимости с 50% уровнем ингибирования роста.
Относительные площади выше кривой дозовой зависимости (relAOC или АОС) получали в виде площади выше кривой дозовой зависимости в диапазоне доз между 1Е-3М и 1Е-10М.
Рассчитывали влияния комбинации этопозида с Соединением 1, приняв в качестве допущения независимые режимы действия партнеров комбинации. Синергизм лечебного влияния оценивали с использованием независимой модели BLISS (2) в виде среднего избытка выше линейной комбинации влияния монотерапевтических лечений в различных измеренных точках данных. Оценки синергизма обеспечивали с помощью ONCOLEAD.
Лечебные влияния обобщали в виде площади выше кривой дозовой зависимости (АОС) или в виде концентрации, необходимой для достижения 50% ингибирования роста относительно контрольных клеток (GI50). АОС значения получали для 122 клеточных линий трех основных тканей, имеющих происхождение из ободочной кишки, легких и плевры. Чувствительность к комбинированному лечению была более высокой практически во всех (120/122) случаях, на что указывает более длинные красные столбики на графике АОС соотношения на Фигуре 14 (Противоопухолевое влияние Соединения 1 в комбинации с этопозидом на панелях клеточных линий рака легких и ободочной кишки в условиях in vitro). На Фигуре 15 представлены противоопухолевое влияние Соединения 1 в комбинации с этопозидом на панелях клеточных линий рака легких и ободочной кишки в условиях in vitro.
Средняя концентрация этопозида, необходимая для достижения GI50, сдвинута в клеточных линиях рака легких с: 0,32 мкМ для монотерапии до 0,04 мкМ в комбинации с Соединением 1.
Средняя концентрация этопозида, необходимая для достижения GI50, сдвинута в клеточных линиях рака ободочной кишки с 0,7 мкМ для монотерапии до 0,12 мкМ в комбинации с Соединением 1.
Средняя концентрация этопозида, необходимая для достижения GI50, сдвинута в клеточных линиях мезотелиомы с 1 мкМ для монотерапии до 0,11 мкМ в комбинации с Соединением 1.
Сдвиг GI50 для основных четырех подтипов опухолей легких: мелкоклеточный рак, аденокарцинома, плоскоклеточный рак и крупноклеточный рак, в комбинации этопозида с Соединением 1, как сквамозные, так и крупноклеточные раки были в равной степени чувствительны к комбинированному лечению. Комбинация при этих двух показаниях приводит к 12,8-раз меньшей концентрации этопозида, необходимой для достижения при GI50, при введении в комбинации с Соединением 1.
Оценки синергизма обеспечивались с помощью ONCOLEAD в виде среднего избытка выше линейной комбинации влияний монотерапии выше индивидуальных измерений.
Распределения оценок синергизма для лечений с применением комбинаций для Соединения 1 представлены на Фигуре 16 в виде диаграмм рассеяния точек данных для индивидуальных клеточных линий. Уровни синергизма в пределах 10% выше или ниже влияний линейных комбинаций можно рассматривать как 'близкое к линейному' влияние.
Как показано на Фигуре 16, 15 из 20 клеточных линий ободочной кишки, 2 из 4 клеточных линий плевры (не показано), и 58 из 97 клеточных линий легких проявляют синергический эффект между этопозидом и Соединением 1. Другие клеточные линии продемонстрировали линейное или близкое к линейному влияние комбинации этих двух соединений.
Пример 7
Соединение 1 оценивали для определения сдвига активности этопозида на различных раковых клеточных линиях. Соединение 1 использовали в растворе ДМСО в следующих концентрациях: 150 нМ, 300 нМ и 1 пМ. Этопозид использовали в растворе ДМСО в следующих концентрациях: 10 пМ, 2,5 пМ, 630 нМ, 156 нМ, 39 нМ, 9,8 нМ и 2,4 нМ.
Клеточные линии получали непосредственно из коллекций клеточных линий АТСС, NCI, CLS и DSMZ. Приготавливали главный клеточный банк и рабочие аликвоты. Клетки, используемые для исследования в анализе потенцирования in vitro, используя панель 200+ клеточных линий, подвергали, меньше чем 20 пассажам. Для обеспечения отсутствия потенциального загрязнения или неправильного распределения, все клеточные линии тестировали с помощью STR анализа. Отсутствие микоплазматического и SMRV загрязнения подтверждали для всех клеточных линий, используемых в исследованиях.
Клеточные линии выращивали в средах, рекомендованных поставщиками, в присутствии 100 Ед/мл пенициллина G и 100 мкг/мл стрептомицина. Дополненной 10% FCS. RPMI 1640 и DMEM дополняли 2 мМ L-глутамина и 1 мМ Na-пирувата.
MEM среду Игла дополняли 1% ΝΕΑА. Для некоторых клеточных линий были необходимы дополнительные добавки, такие как 2,5% лошадиная сыворотка, гидрокортизон, трансферрин, бета-эстрадиол, се-ленит и 1 единиц/мл инсулина.
RPMI среду использовали для культивирования следующих клеточных линий: 5637, 22RV1, 7860, А2780, А431, А549, ACHN, ASPC1, ВТ20, ВХРС3, CAKI1, CLS439, COLO205, COLO678, DLD1, DU145, EFO21, EJ28, НСТ15, HS578T, IGROV1, JAR, LOVO, MCF7, MDAMB231, MDAMB435, MDAMB436, MDAMB468, MHHES1, МТ3, NCIH292, NCIH358M, NCIH460, NCIH82, OVCAR3, OVCAR4, PANC1005 (добавление инсулина), РВМС, РС3, RDES, SF268, SF295, SKBR3, SKMEL28, SKMEL5, SKOV3, SW620, U2OS, UMUC3, UO31, GRANTA-519, SU-DHL-6, SU-DHL-10, RAMOS, MINO, HL-60, K-562, ТНР-1, L-363, WSU-NHL, и MV4-11. Следующие раковые клеточные линии легких и толстой и прямой кишки культивировали в RPMI:
NCI-H23 NCI-H1838 NCI-H2347 LS411N Н-2171 NCI-H2122 NCI-H1915 NCI-H1299 COR-L88 COLO-677 DV-90 NCI-H69 MS-1 NCI-H211 NCI-H524 SCLC-21h COR-L311 Т3М-12 NCI-H146 NCI-H2030 NCI-H1792 HCC-44 H69V NCIH292 COL0678 NCI-H508 SNU-C1
DMEM среду использовали для культур А204, А375, А673, С33А, CASKI, НСТ116, HEPG2, HS729, НТ29, J82, MG63, MIAPACA2 (добавление лошадиной сыворотки), PANC1, PLCPRF5, RD, SAOS2, SKLMS1, SKNAS, SNB75, Т24, и ТЕ671.
MEM среду Игла использовали для CACO2, CALU6, HEK293, HELA, НТ1080, IMR90, JEG3, JIMT1, SKHEP1, SKNSH, и U87MG.
DMEM/F12 среду использовали для NCI-H2066, NCI-H2029, NCI-H2444, Н-MESO-1, NCI-H2085, LC-2/ad, DMS114, NCI-H2126, SW948, Т84, NCI-H2405, SW1463, SW1116, A110L, Т3М-11, JU77, NCI-H596, NCI-H1048, NCI-H226, NCI-Н2073, HLF-a, NCI-H2342, NCI-H1734, NCI-H2196, DMS454, NCI-H1882, NCI-Н1876, НСС2935, NCI-H2286, NCI-H2110, NCI-H2291, IA-LM, NCI-H1755, NCI-Н522, SW1417, SW837, SW48, NCI-H520, COLO-699, BEN, NCI-H1573, NCI-H1975, NCI-H2170, HCC-827, LO68, NCI-H841, SHP-77, SW900, LXF-289, NCI-H661, NCI-H1581, HCC-15, SK-MES-1, NCI-H647, LUDLU-1, HLC-1, EBC-1, LU65, CALU-1, PC-9, A-427, LK-2, MSTO-211H, Lu99B, NCI-H2141, NCI-H1105, NCI-H774, NCI-H1694, NCI-H2081, NCI-H1869, Calu-3, EPLC-272h, HCC-366,DMS 53, NCI-H1651, NCI-H2172, NCI-H1563, NCI-H1568, NCI-H446, A529L, NCI-H196, DMS 153, и NGP.
Клетки выращивали в 5% CO2 атмосфере в NB-203-XXL инкубаторе (N-Biotec, South Korea).
Выращивание клеток и лечение осуществляли в микротитровальных планшетах на 96 лунок CELLSTAR® (Greiner Bio-One, Germany). Клетки, собранные из культур в экспоненциальной фазе путем трипсинизации или путем разъединения (в случае роста клеток в суспензии), высевали в 90 мкл среды при оптимальных плотностях высевания. Определяли оптимальную плотность высевания для каждой клеточной линии для обеспечения экспоненциального роста во время эксперимента. Все клетки, выращиваемые без противораковых средств, были субконфлюэнтнми при окончании эксперимента, что определялось визуальным наблюдением.
Разведения соединений в ДМСО осуществляли в МТР планшетах на 96 лунок объемом 0,5 мл (Greiner Bio-One, Germany). После этого соединения разводили 1:100 в RPMI среде.
90 мкл клеток, после предварительного выращивания в течение 48-часового периода, обрабатывали путем смешивания 10 мкл питательной среды, содержащей соединение (что приводили к получению конечной концентрации ДМСО 0,1%). Клеткам позволяли расти при 37°С в течение 72 (или 120) часов.
Дополнительно, все эксперименты содержали несколько планшет с клетками, которые анализировали сразу после периода восстановления 48 часов. Эти планшеты содержали информацию о количестве клеток, Tz, в нулевое время (см. 3.5.1) то есть перед лечением, и служили для расчета цитотоксичности.
В случае комбинации, оба агента смешивали совместно в ДМСО в равных объемах таким образом, что конечная концентрация ДМСО составила 0,2%.
Измерения осуществляли, используя протокол окрашивания общего белка [Vichai и Kir-tikara, 2006]. Клетки фиксировали к поверхности путем добавления 10% ТСА (для сцепления растущих клеток) или 50% ТСА (для полусцепления растущих клеток или клеток, выращиваемых в суспензии). После инкубирования в течение часа при 4°С, планшеты промывали два раза с помощью 200 мкл деионизированной воды и высушивали. После этого клетки окрашивали с помощью 100 мкл 0,04% мас./об. SRB. Планшеты инкубировали при комнатной температуре по меньшей мере в течение 30 минут и промывали шесть раз 1% уксусной кислотой для удаления несвязанного красителя. Планшеты оставляли высушиваться при комнатной температуре и связанные SRB солюбилизировали с 100 мкл 10 мМ Трис основания. Оптическую плотность измеряли при 492, 520 и 560 нм, используя Deelux-LED96 планшет-ридер (Deelux Labortechnik GmbH, Germany).
Нелинейные расчеты подгонки кривых осуществляли, используя алгоритмы и средства визуализации собственной разработки. Алгоритмы были сходными с ранее описанными алгоритмами [DeLean и др., 1978] и были дополнены среднеквадратичной ошибкой или MSE моделью.
Это может сопоставимо с коммерческими применениями, например, XLfit (ID Business Solutions Ltd., Guildford, UK) алгоритм "205". Расчеты включали кривые дозовой зависимости с наилучшей приближенной линией, 95% доверительный интервал для 50% эффекта (см. ниже).
Одним из общепринятых путей выражения эффекта противоракового средства является измерение жизнеспособности клеток и выживания в присутствии тестируемого агента в виде % Т/С × 100. Взаимоотношение между жизнеспособностью и дозой называют кривой дозовой зависимости. Два основных значения используют для описания этого взаимоотношения без необходимости демонстрации кривой: концентрация тестируемых агентов, обеспечивая % Т/С значение 50%, или 50% ингибирования роста (IC50), и % Т/С значение 10%, или 90% ингибирования роста (IC90).
Используя эти измерения, можно рассчитать клеточные ответы для неполного ингибирования роста клеток (GI), полного ингибирования роста клеток (TGI) и чистой потери клеток (LC) вследствие активности соединения. Ингибирование роста на 50% (GI50) рассчитывали в виде 100 × [(Ti - Tz)/(C - Tz)]=50. Оно представляет собой концентрацию лекарственного средства, вызывающую уменьшению на 50% по сравнению с повышением чистого белка в контрольных клетках во время периода инкубирования с лекарственным средством. Другими словами, GI50 представляет собой IC50, скорректированное на нулевое время. Аналогично IC90, рассчитанные GI90 значения также представлены для всех тестируемых соединений. TGI рассчитывали согласно формуле Ti = Tz. LC50, представляет собой концентрацию лекарственного средства, вызывающую уменьшение на 50% измеряемого белка после окончания периода инкубирования с лекарственным средством по сравнению с таким значением изначально. Его рассчитывали в виде 100 × [(Ti - Tz)/Tz] = -50.
Активность Этопозида и Соединения 1 исследовали ранее на панели 81 раковых клеточных линии, представляющих собой 17 типов опухолевых тканей, плюс покоящиеся, непролиферирующие РВМС (всего 82 клеточные линии), которые используют для определения активности за пределами воздействий на пролиферацию клеток.
Этопозид проявляет широкую, более, чем 1000-кратную, активность в диапазоне от 30 нМ в JEG3 клеточных линиях до выше 10 мкМ, например JIMT1 и COLO678. Для 3 клеточных линий GI50 значения могут быть оценены выше 10 мкМ, и для 14 клеточных линий нет активности выше 10 мкМ, которая может быть записана (включая покоящиеся РВМС).
Соединение 1 проявляет узкую, но более чем 20-кратную активность в диапазоне, от 500 нМ в наборе клеточных линий до выше 10 мкМ. Для некоторых клеточных линий, GI50 значения могут быть оценены только выше 10 мкМ. Не может быть обнаружена активность в покоящихся РВМС.
Суммарное влияние комбинации Соединения 1 и этопозида оцениванию путем сравнения GI50 значения отдельно и в комбинации. Добавление Соединения 1 существенно повышает как диапазон активности, так и эффективность Этопозида в комбинации. В Таблице 3 обобщена активность этопозида отдельно и в комбинации Соединением 1. * или ** помечены наиболее низкая или наивысшая тестируемые концентрации. Этопозид-Соединение 1-150 нМ и Этопозид-Соединение 1-1 мкМ тестировали на панели 93 клеточных линий. Этопозид-Соединение 1-300 нМ тестировали на панели 127 клеточных линий, обогащенных клеточными линиями рака легких и толстой и прямой кишки и с лечением 120 часов. В скобках [] показаны результаты 120-ти часового лечения. мкМ указывает микромолярные концентрации.
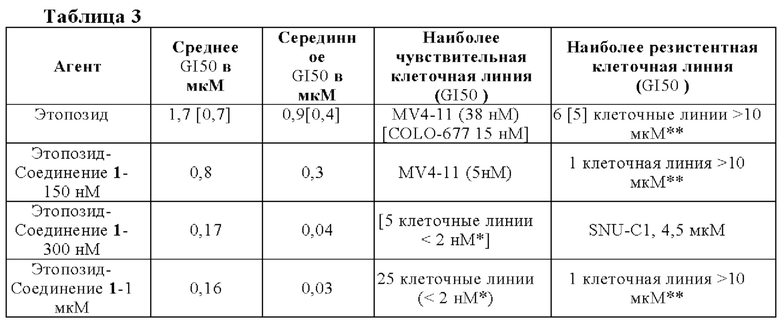
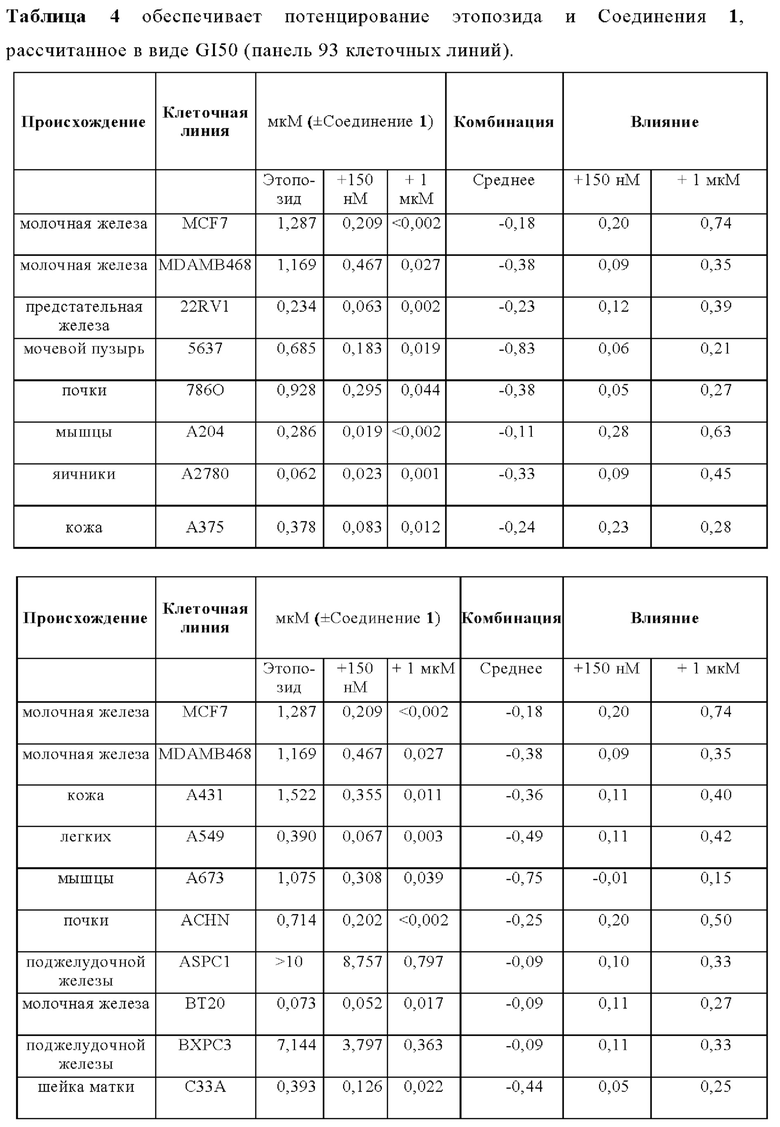
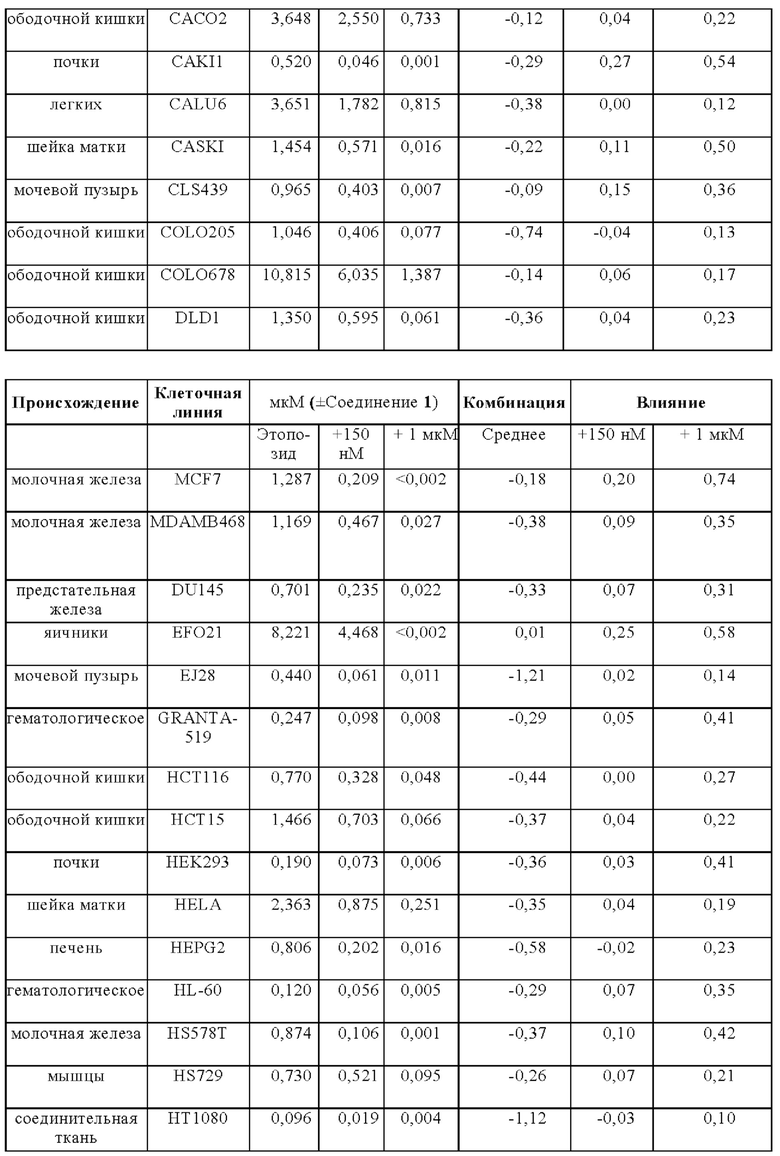
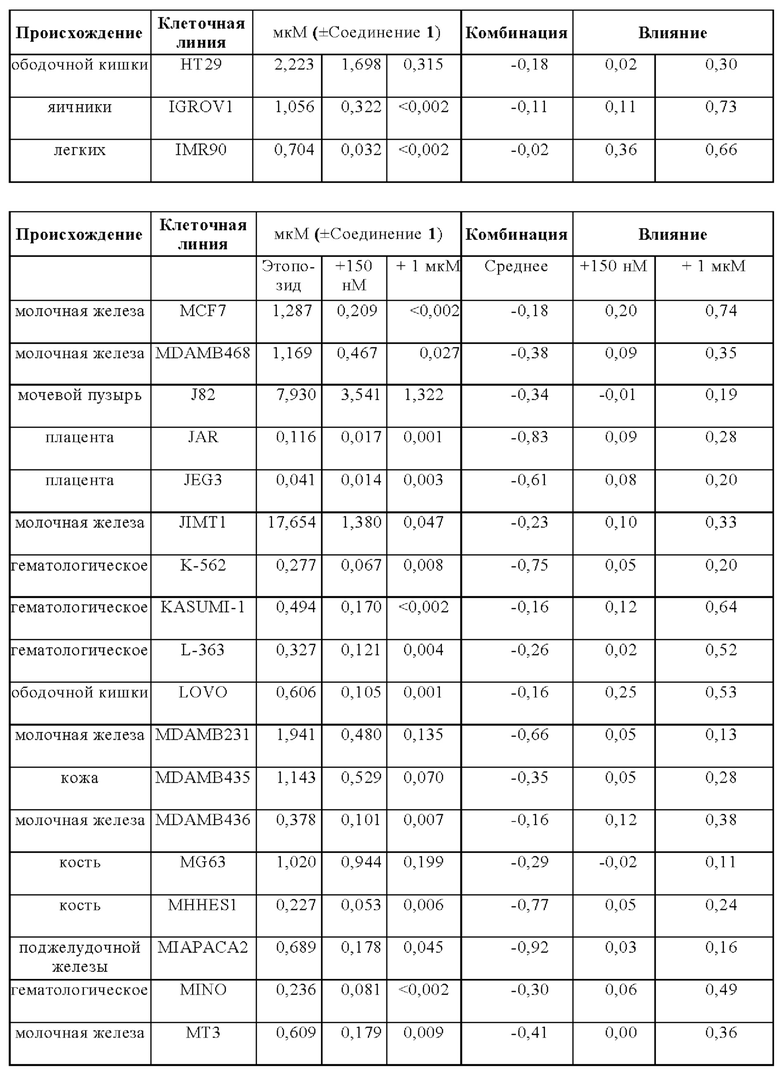
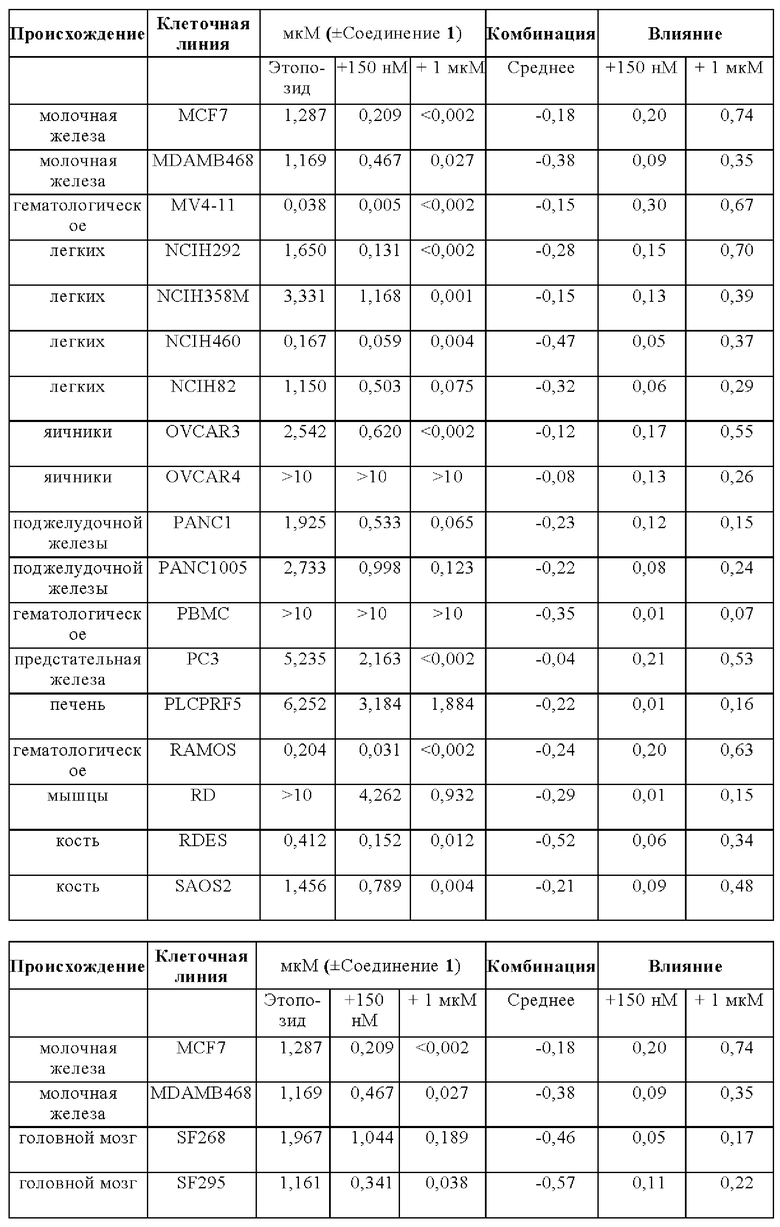
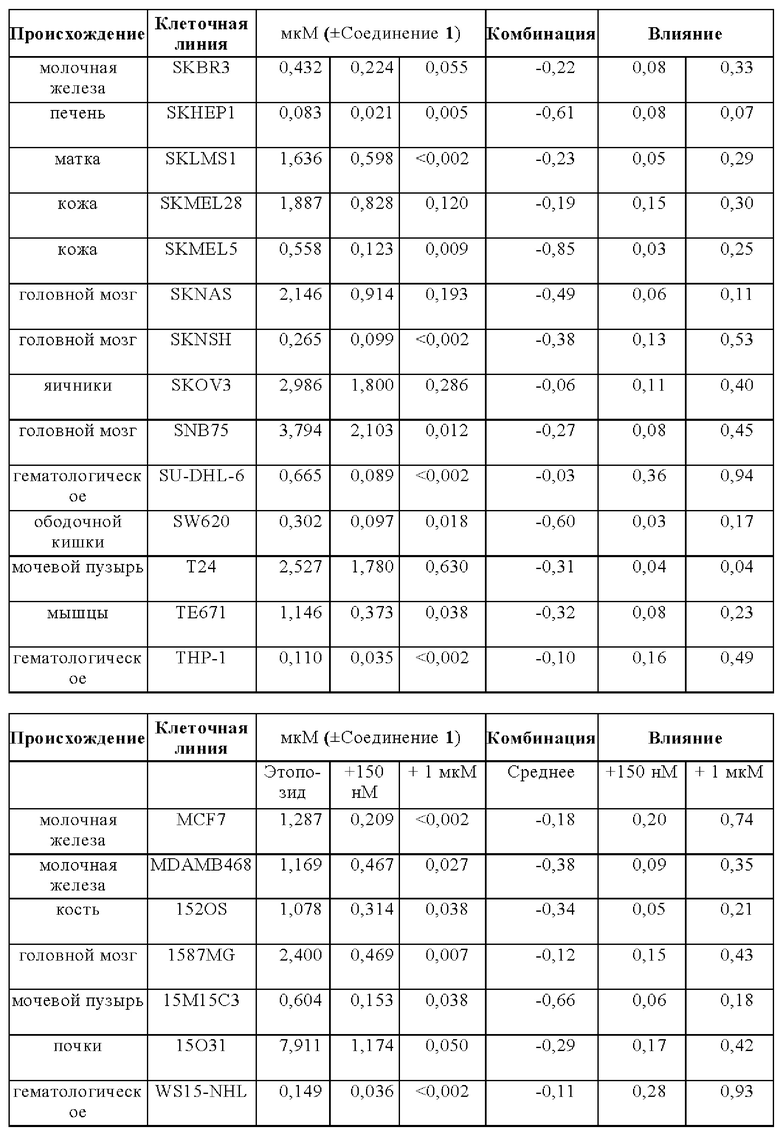
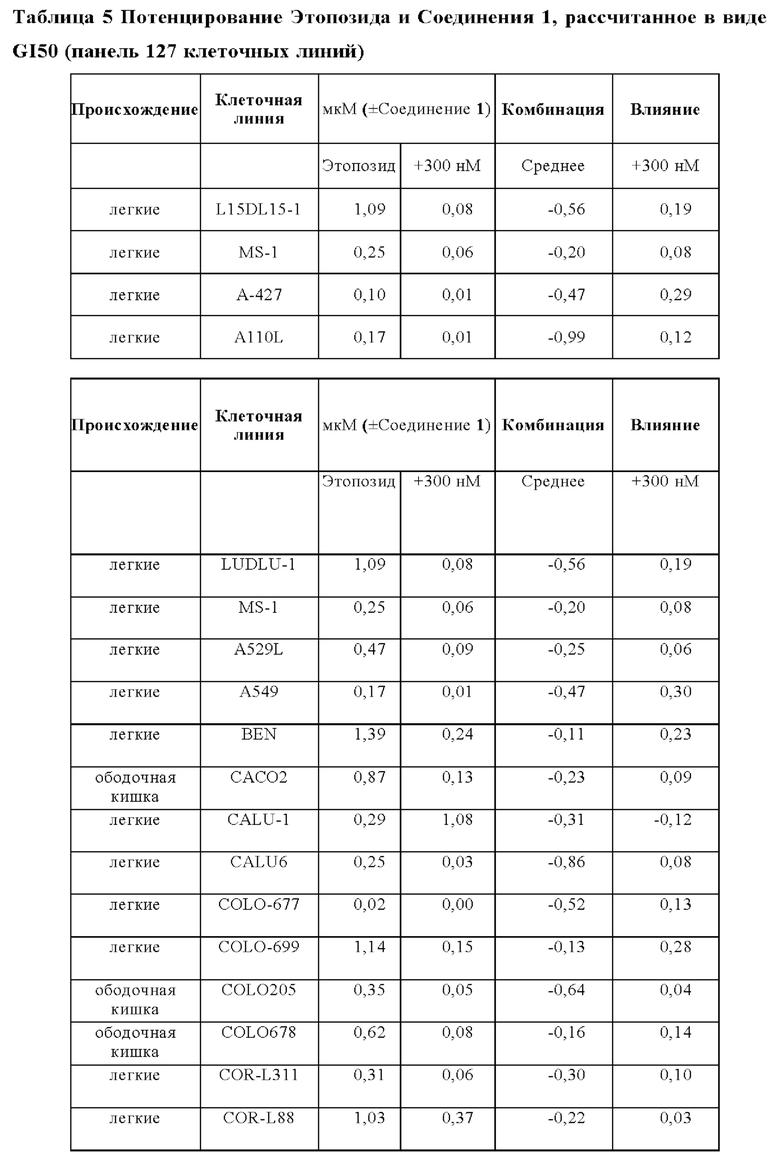
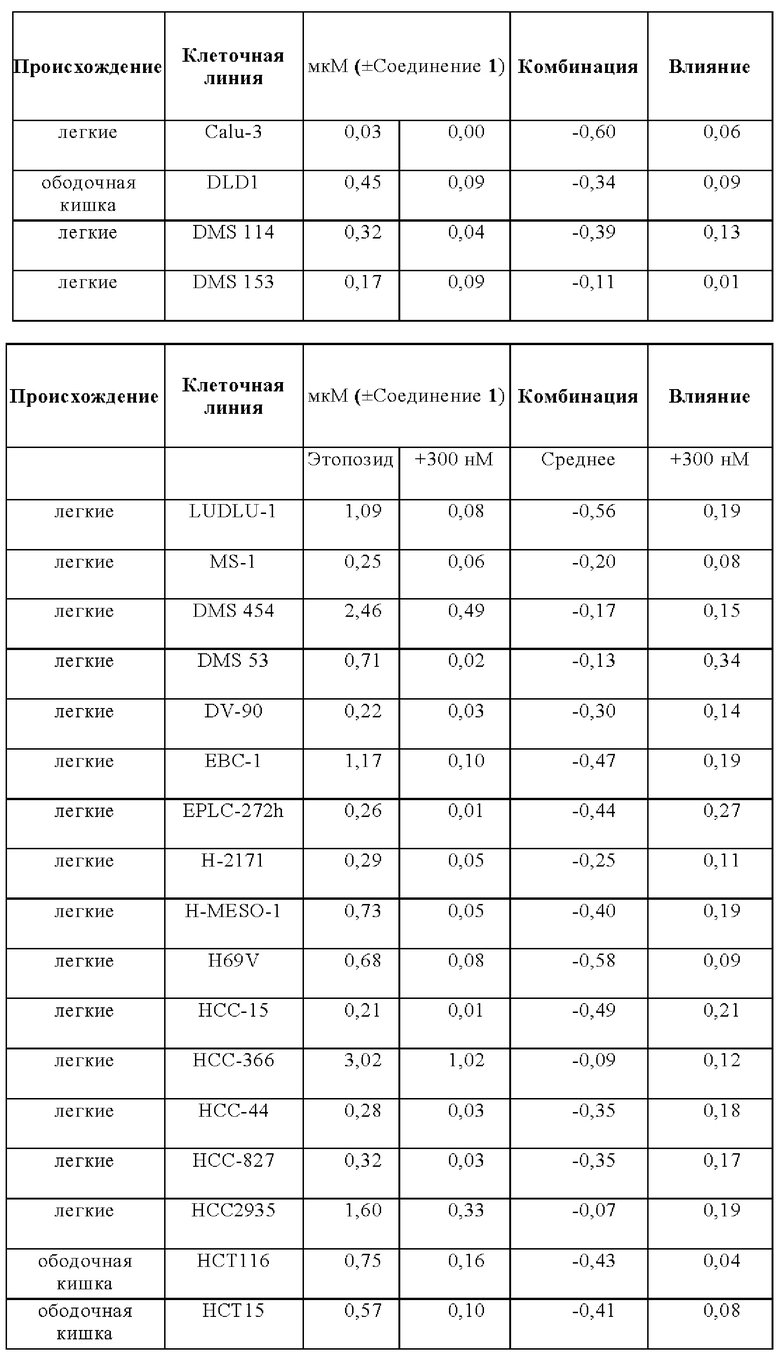
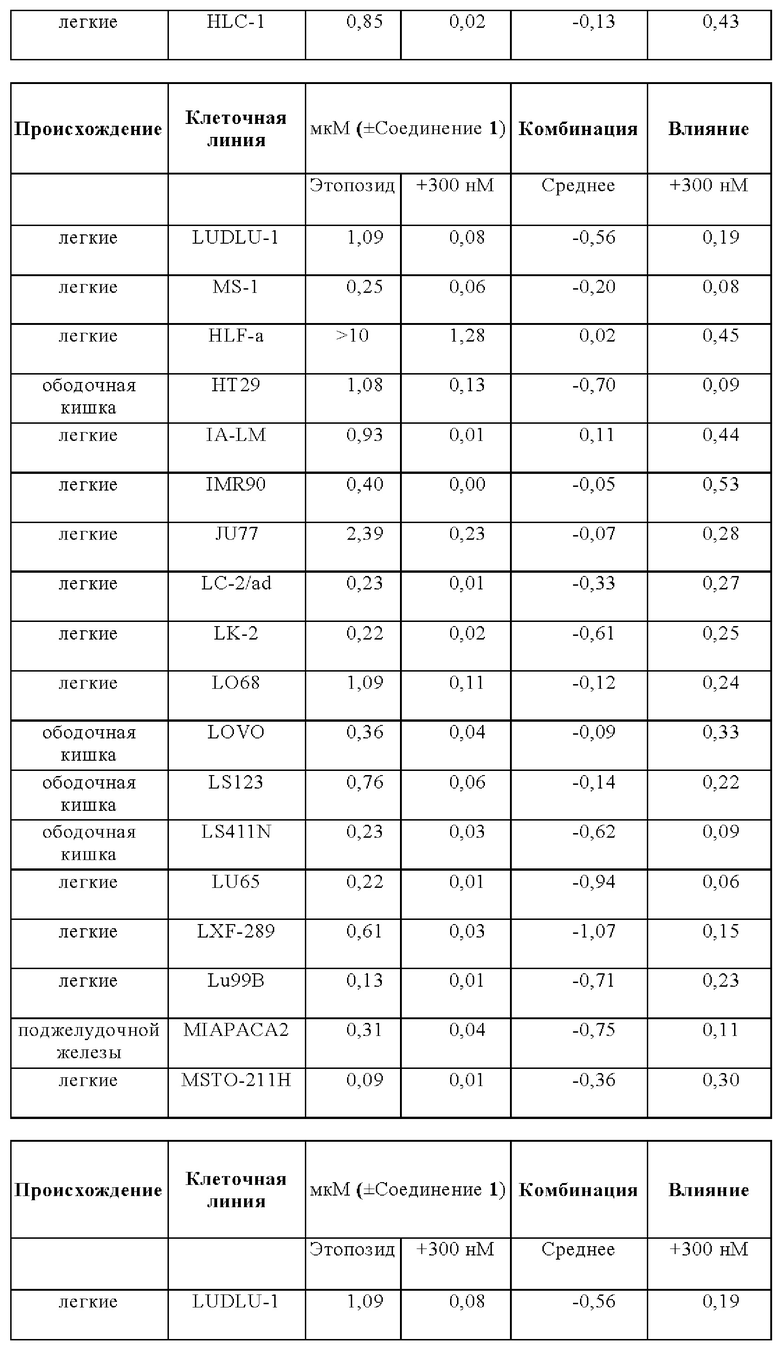
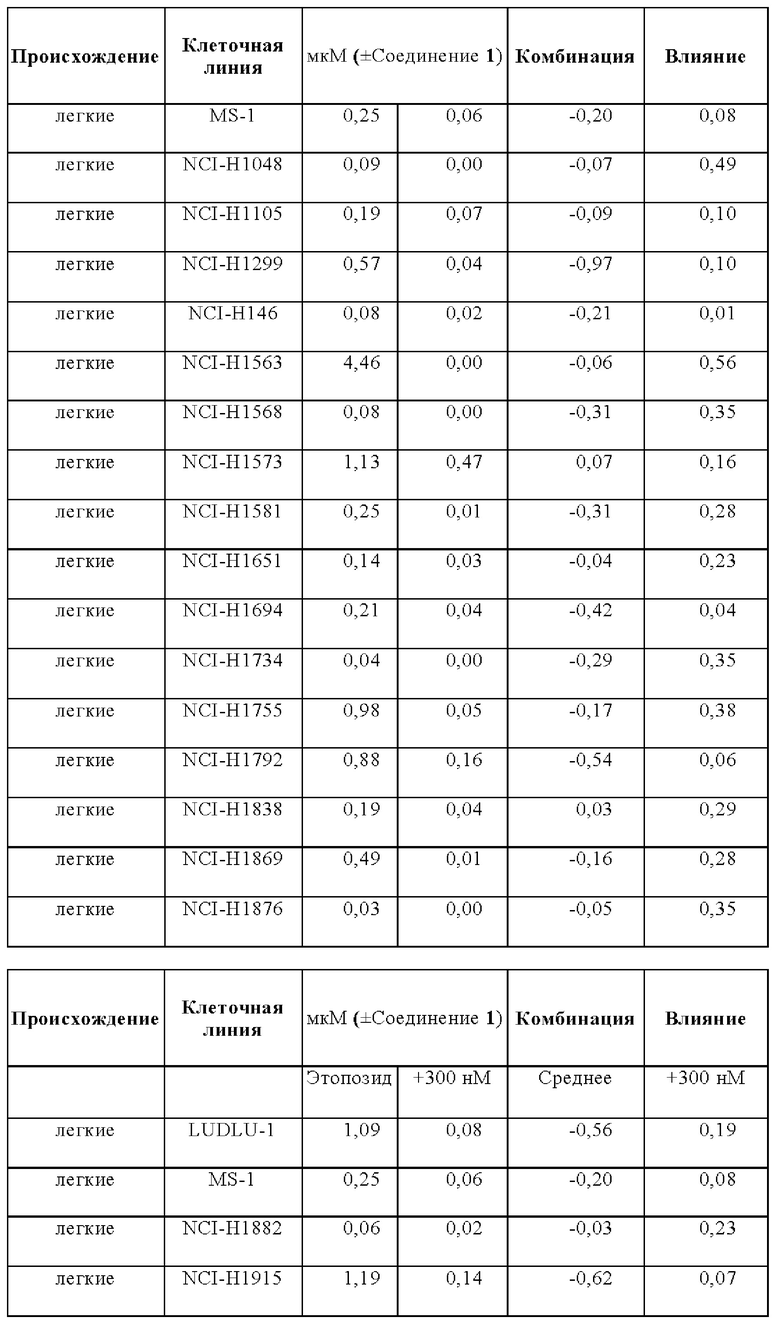
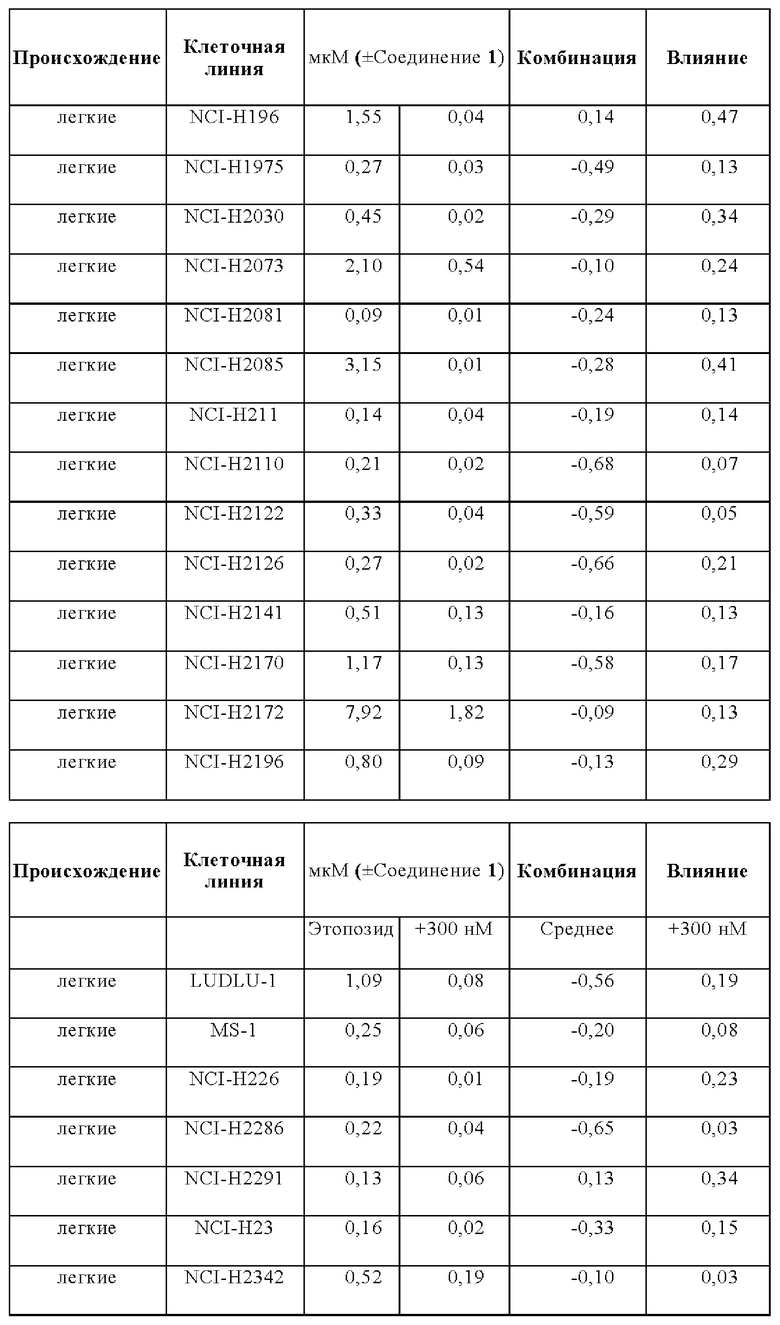
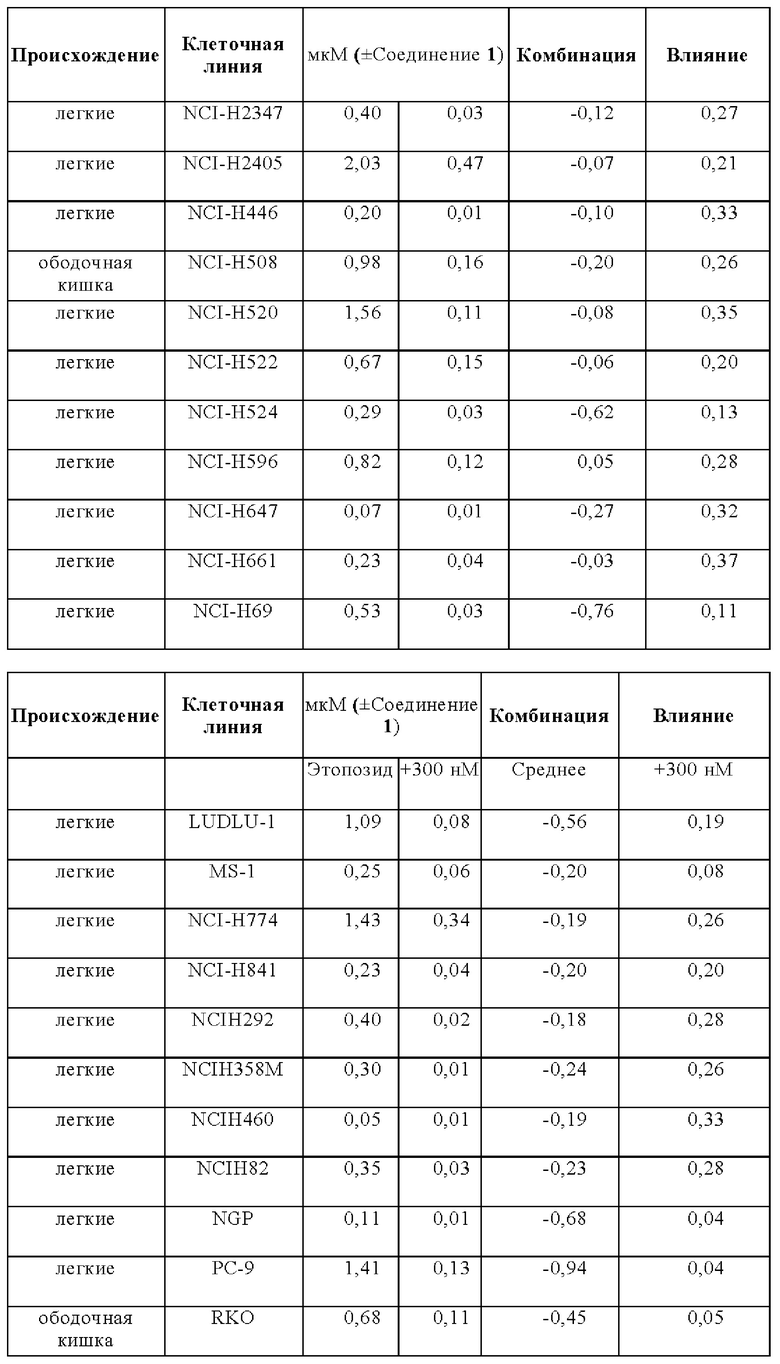
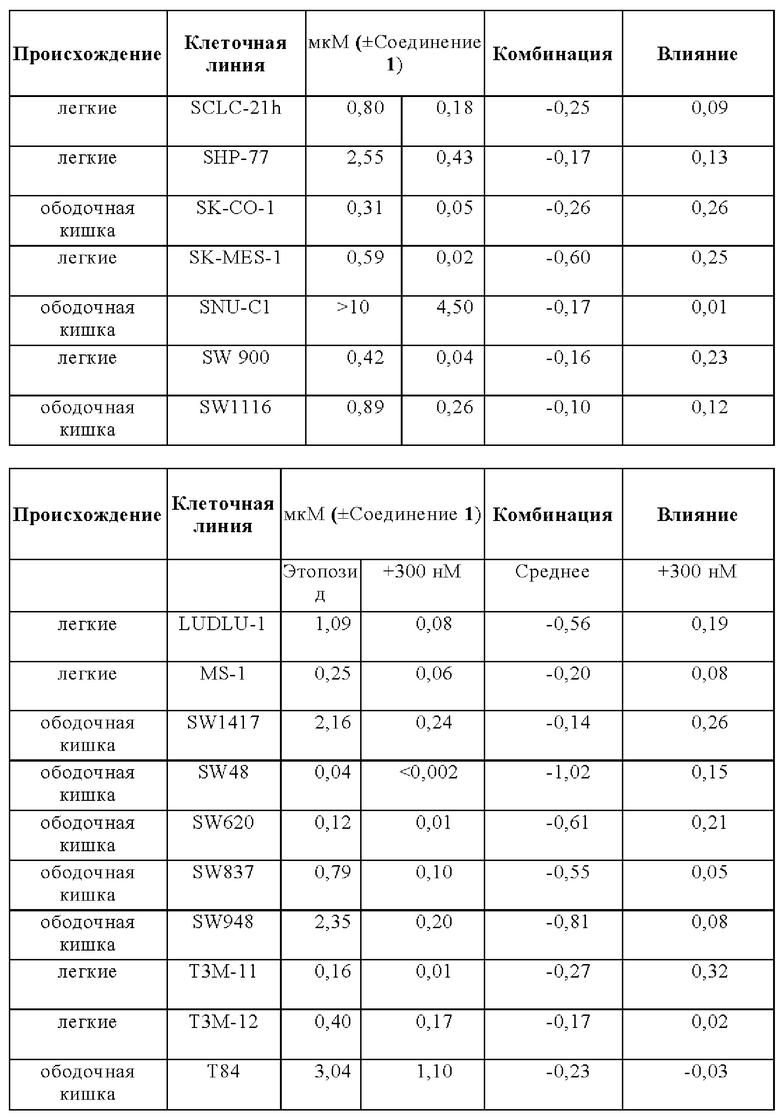
Пример 8
Фаза 1b: Субъекты получали Соединение 1 в предписанном дозовом уровне. В день 1 каждого цикла, после перорального приема Соединения 1, сначала вводили цисплатин, затем этопозид. Во всех случаях, Соединение 1 следует вводить приблизительно за 1,5 часа до химиотерапии. В дни 2 и 3 каждого цикла, Соединение 1 следует принимать перорально QD (1 раз в сутки) предпочтительно утром. Доза Соединения 1 может быть модифицирована в соответствии с правилами эскалации дозы, описанном в этом протоколе.
Цисплатин и этопозид будут вводить в соответствии с местными руководствами. Как правило, цисплатин вводят в дозе 75 мг/м2 в виде 60-минутной в/в инфузии в день 1, с последующим введением этопозида в дозе 100 мг/м2 в виде 60-минутной в/в инфузии. В дни 2 и 3 каждого цикла, этопозид можно вводить либо в виде в/в инфузии или перорально в соответствии с местными руководствами.
Фаза II: Субъектов будут рандомизировать для получения цисплатина и этопозида в комбинации с плацебо или Соединением 1 в RP2D идентифицированном в Фазе 1b части испытаний. В день 1 каждого цикла, после перорального приема Соединения 1/плацебо, сначала будут вводить цисплатин, после этого этопозид. Во всех случаях, Соединение 1 следует вводить приблизительно за 1,5 часа перед химиотерапией. В дни 2 и 3 каждого цикла, Соединение 1 следует принимать перорально QD предпочтительно утром. Цисплатин и этопозид будут вводить в соответствии с местными руководствами. Как правило, цисплатин вводят в дозе 75 мг/м2 в виде 60-минутной в/в инфузии в день 1 с последующим введением этопозида в дозе 100 мг/м2 в виде 60-минутной в/в инфузии. В дни 2 и 3 каждого цикла, этопозид можно вводить либо в виде внутривенной инфузии или перорально в соответствии с местными руководствами.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИЯ АНТИ-PD-L1 АНТИТЕЛА И ИНГИБИТОРА ДНК-ПК ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2018 |
|
RU2765997C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ИНГИБИТОРОМ EZH2 | 2018 |
|
RU2754131C1 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2011 |
|
RU2605335C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2011 |
|
RU2743643C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2757373C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ПРОТИВООПУХОЛЕВЫМ АЛКАЛОИДОМ | 2018 |
|
RU2767664C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2010 |
|
RU2587013C2 |
| КОМБИНИРОВАННАЯ ХИМИОТЕРАПИЯ | 2006 |
|
RU2429838C2 |
| СПОСОБЫ ПРИМЕНЕНИЯ (+)-1,4-ДИГИДРО-7-[(3S, 4S)-3-МЕТОКСИ-4-(МЕТИЛАМИНО)-1-ПИРРОЛИДИНИЛ]-4-ОКСО-1-(2-ТИАЗОЛИЛ)-1,8-НАФТИРИДИН-3-КАРБОНОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2006 |
|
RU2592231C2 |
| ПРИМЕНЕНИЕ МОДИФИЦИРУЮЩИХ ТРАНСКРИПТОМ АГЕНТОВ И ХИМИОТЕРАПИИ ИЛИ РАДИОТЕРАПИИ ПРОТИВ РАКА | 2005 |
|
RU2389484C2 |
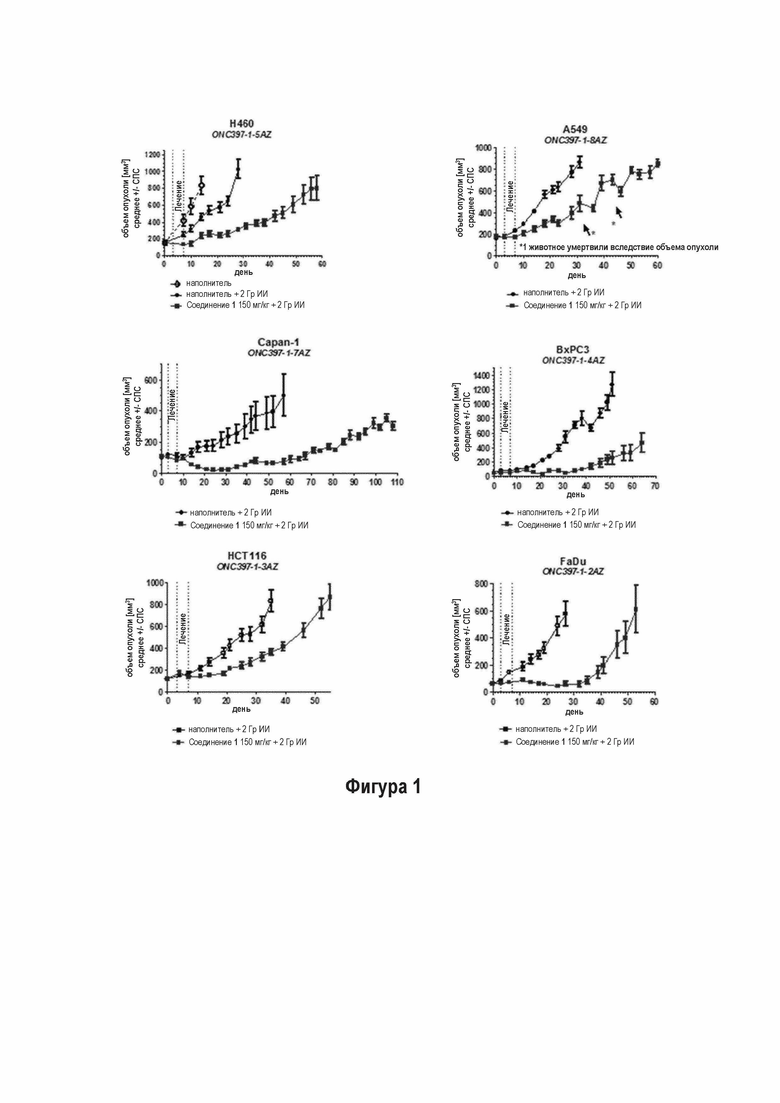
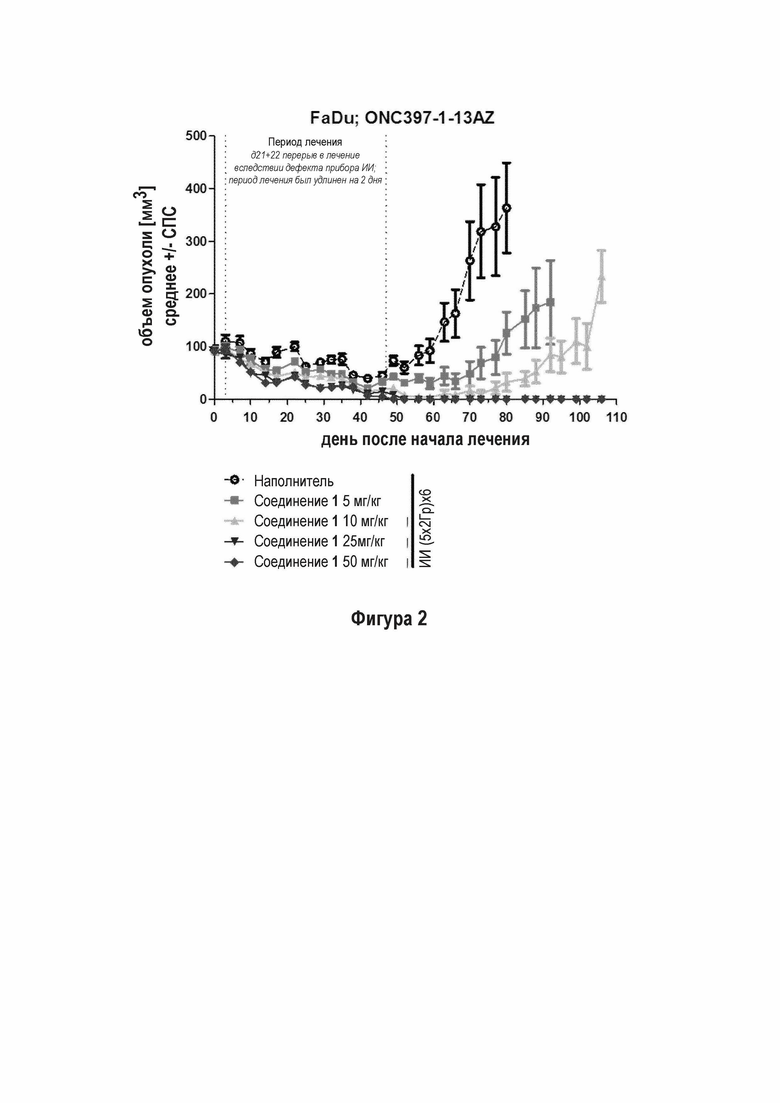
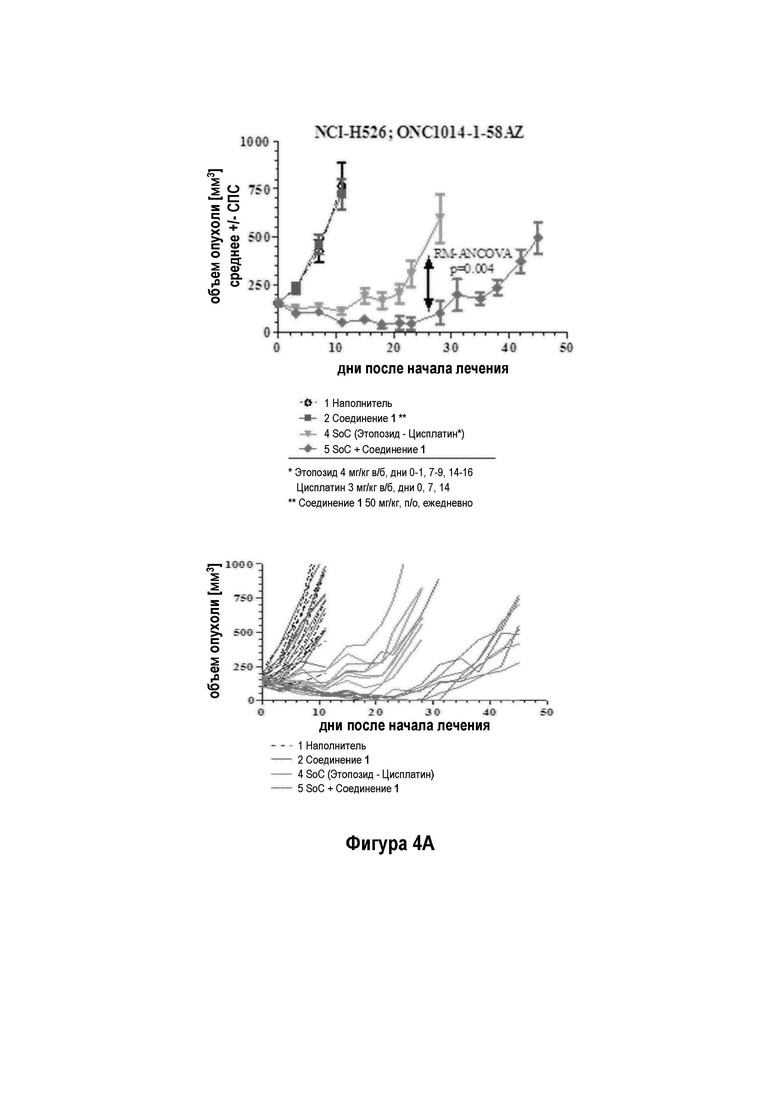
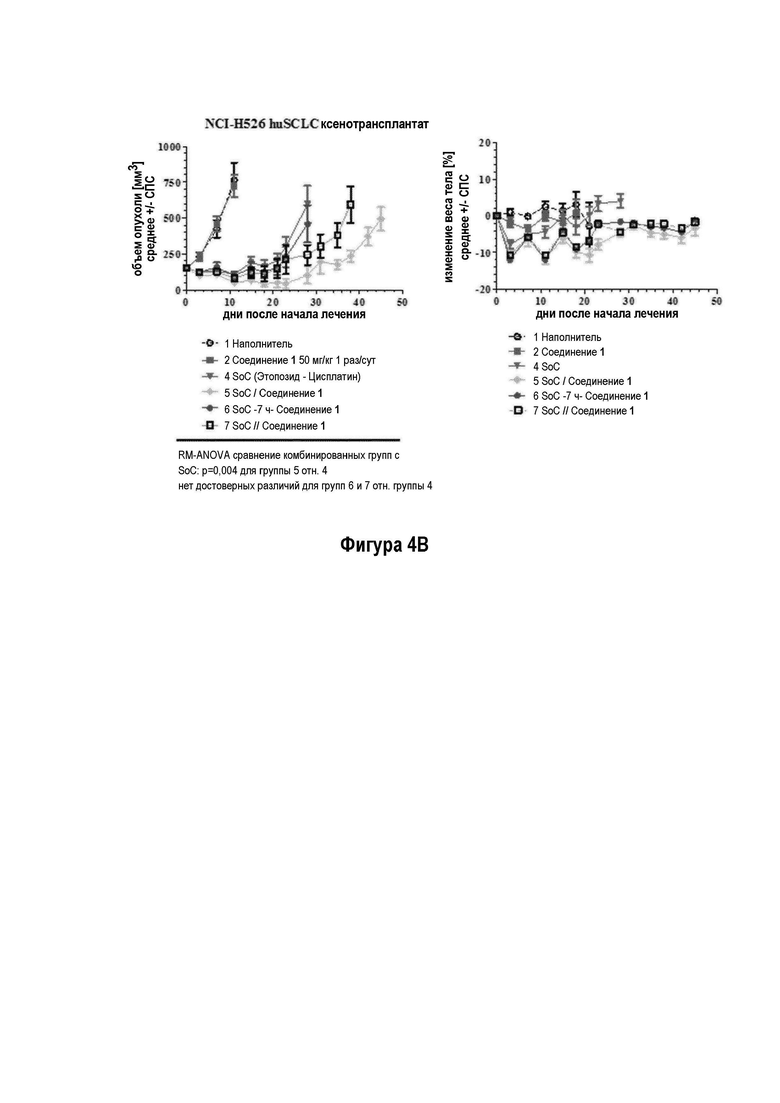
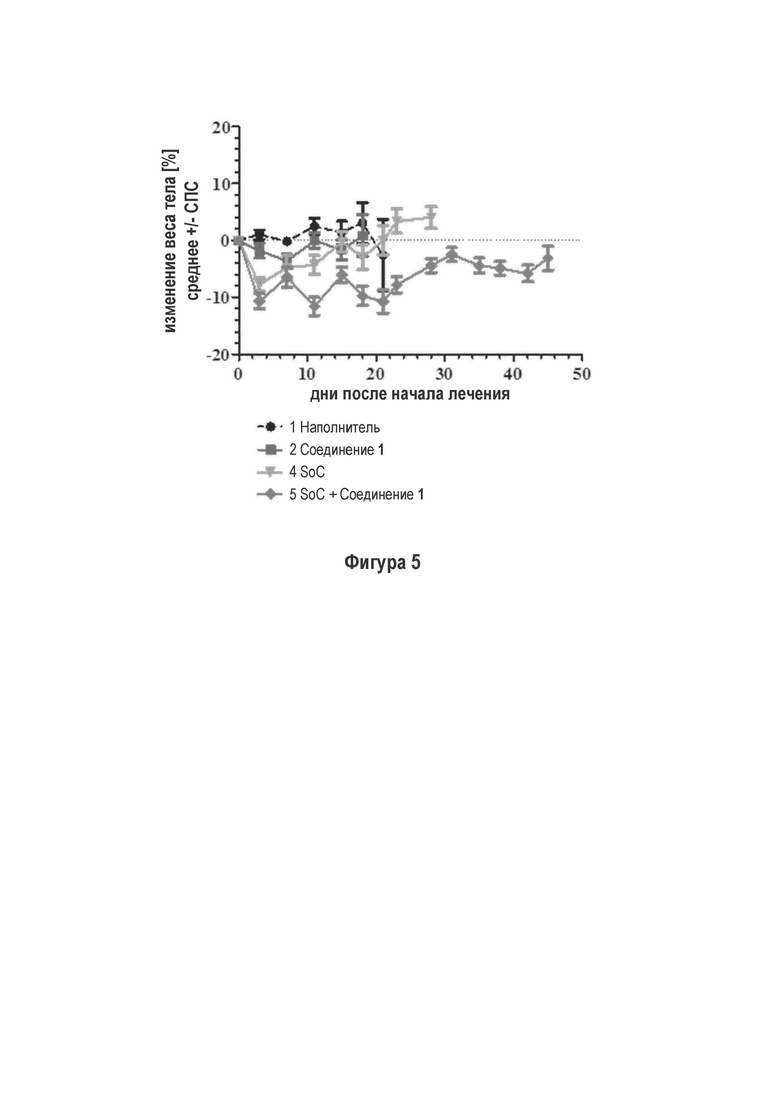
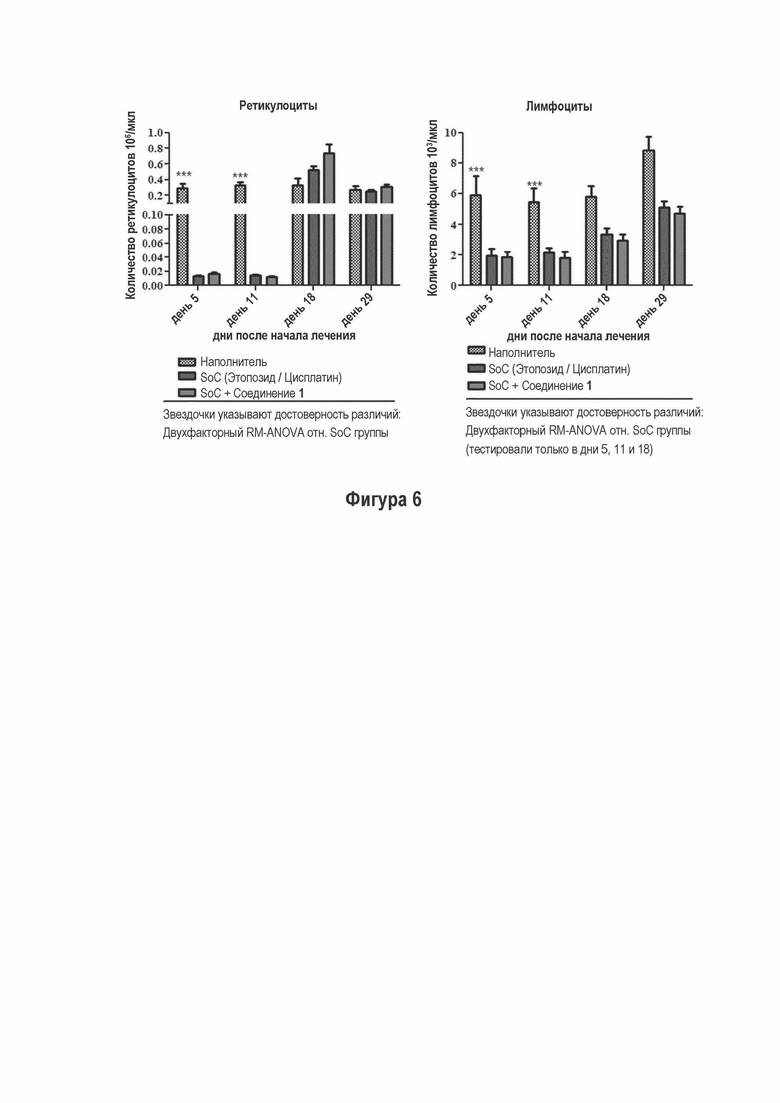
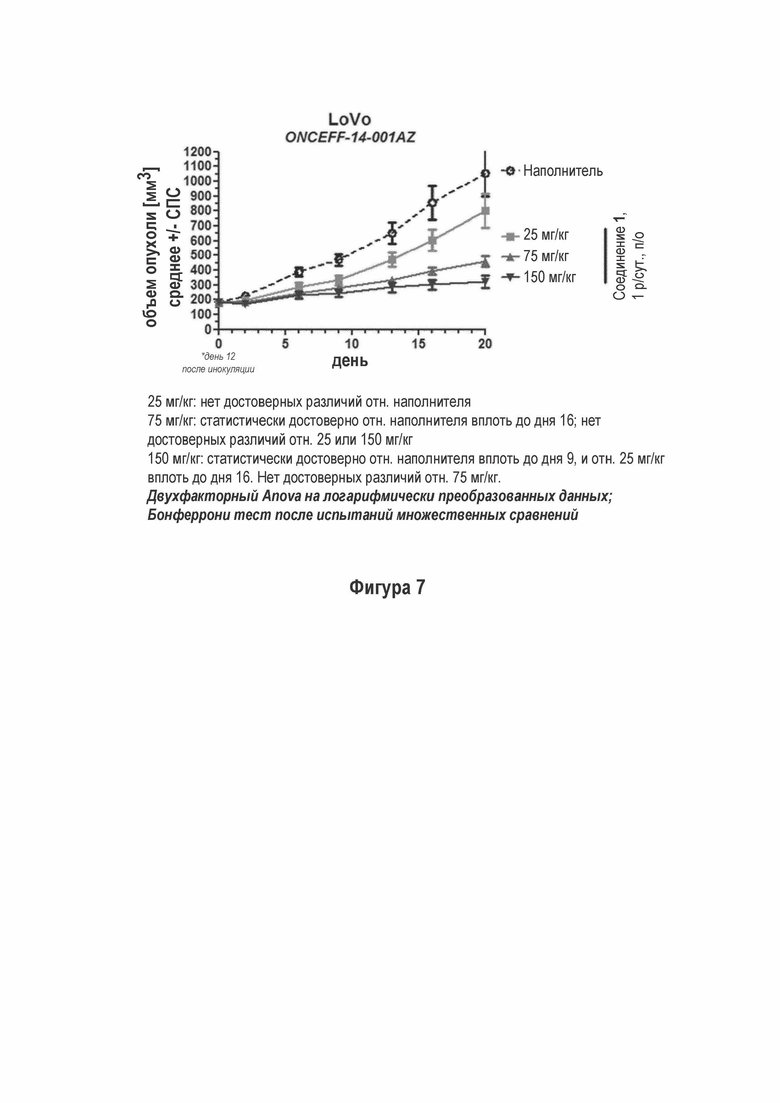
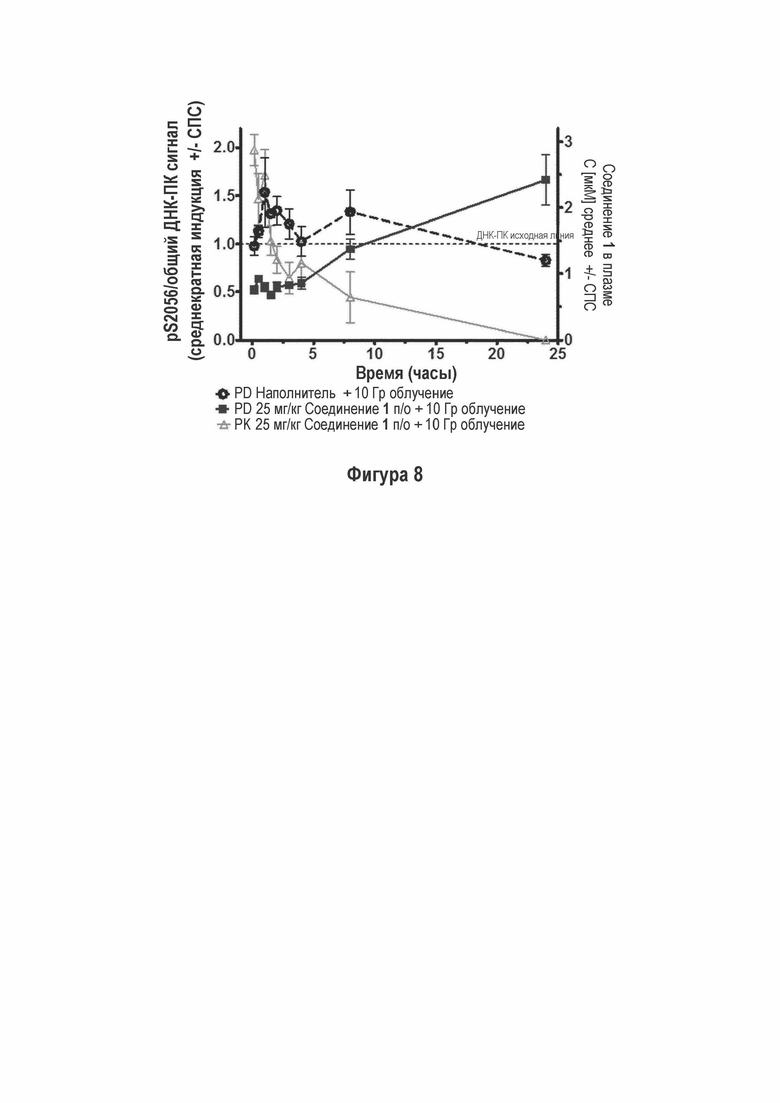
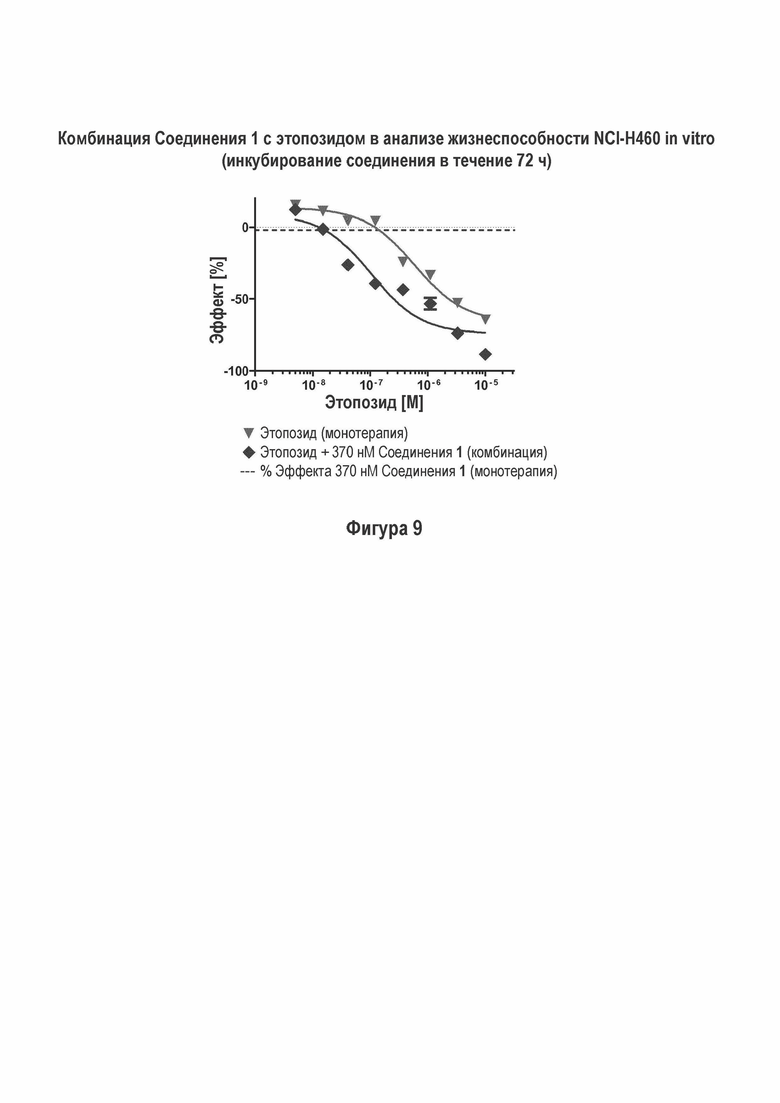
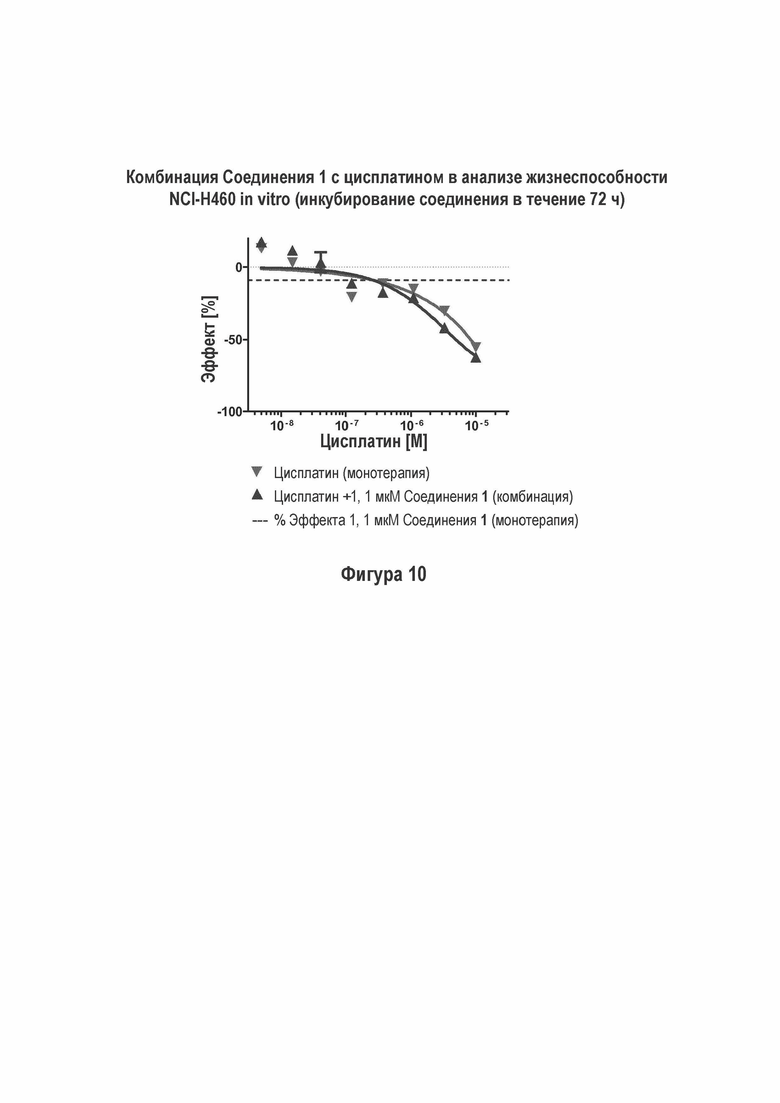
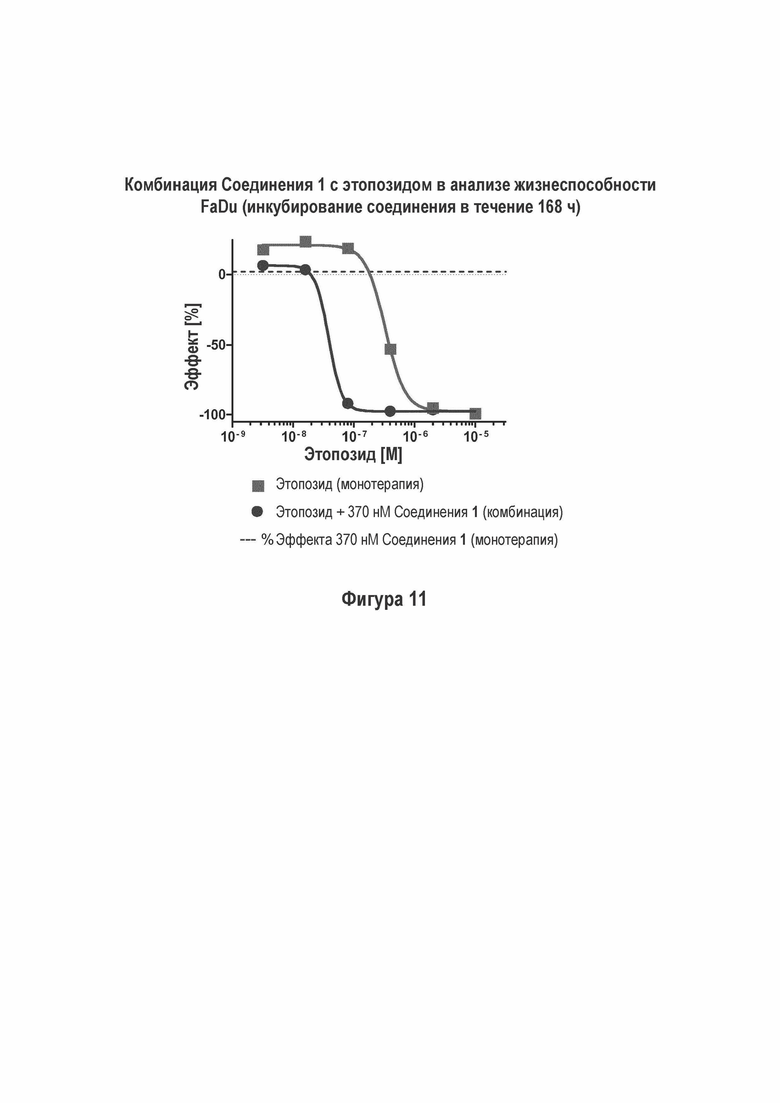
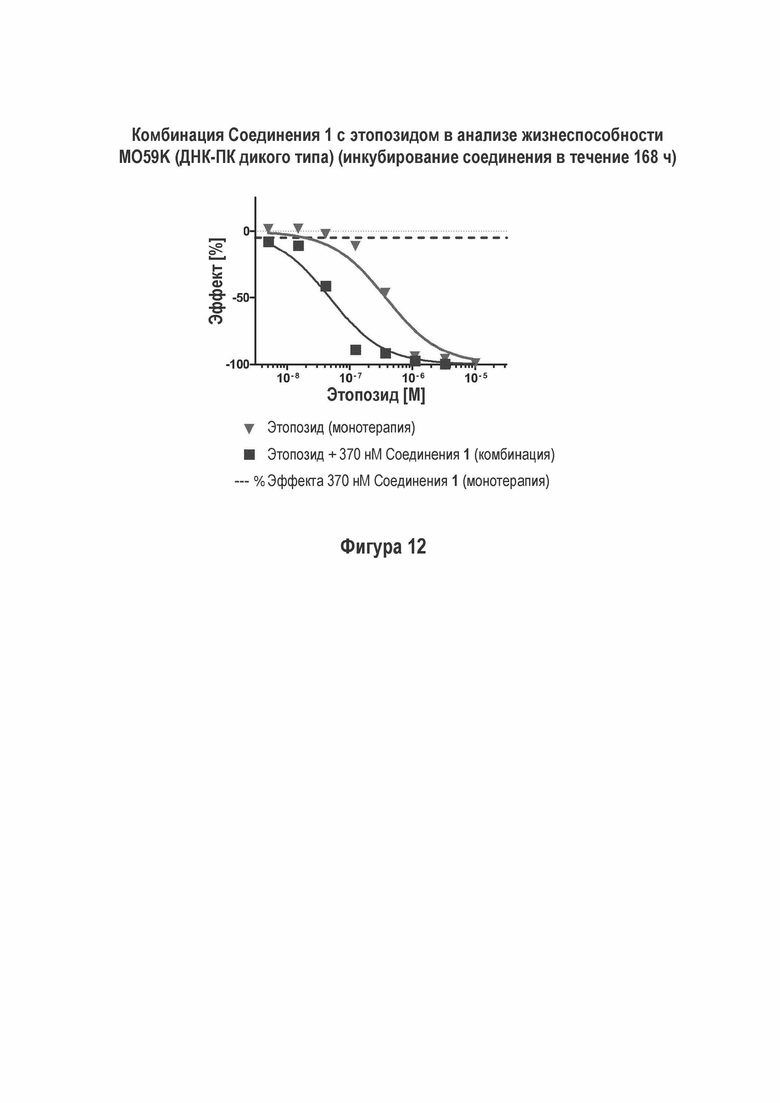
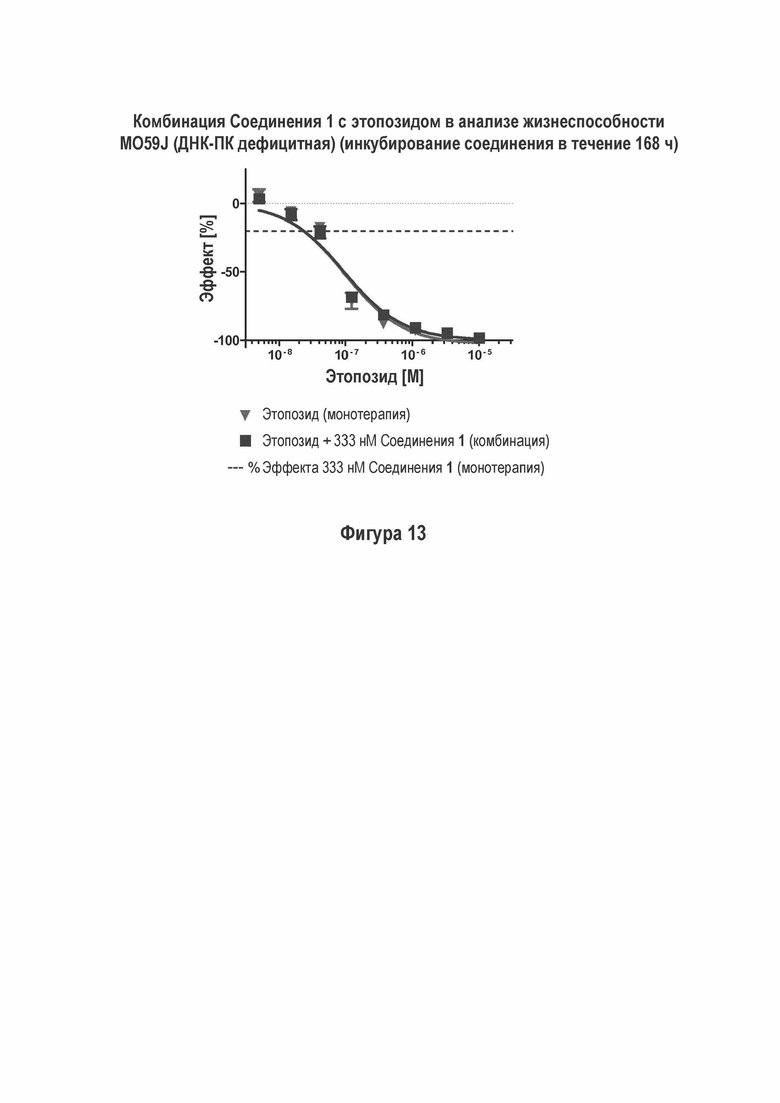
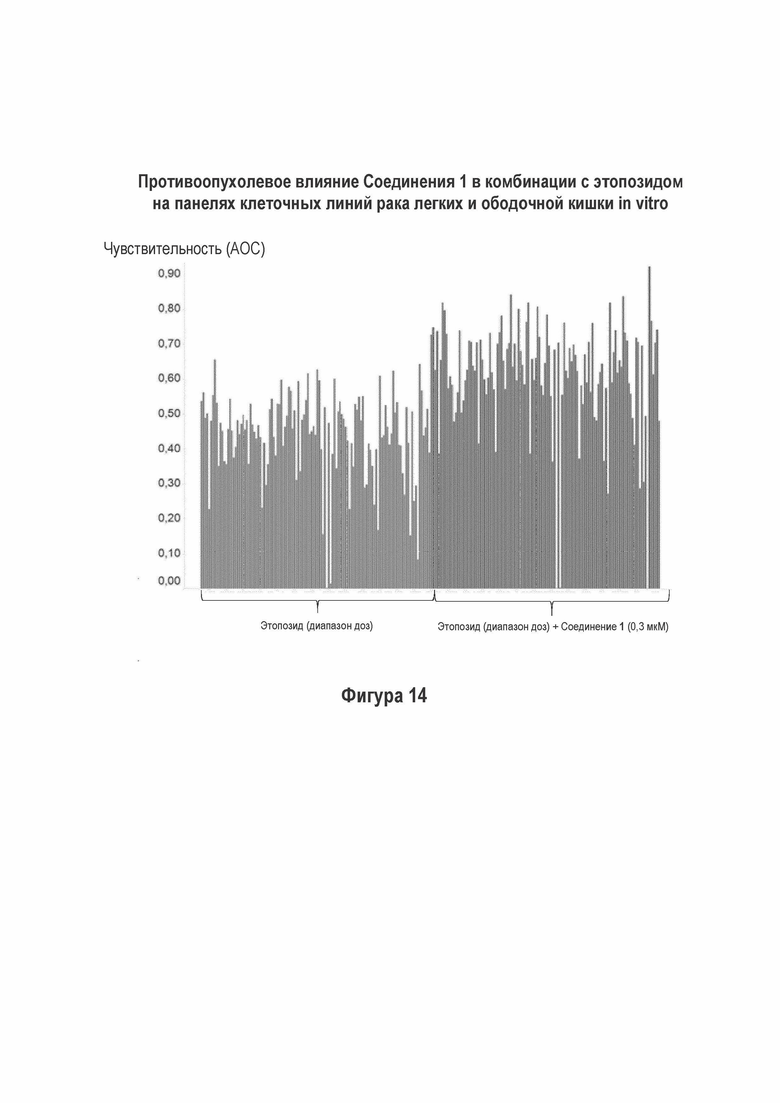

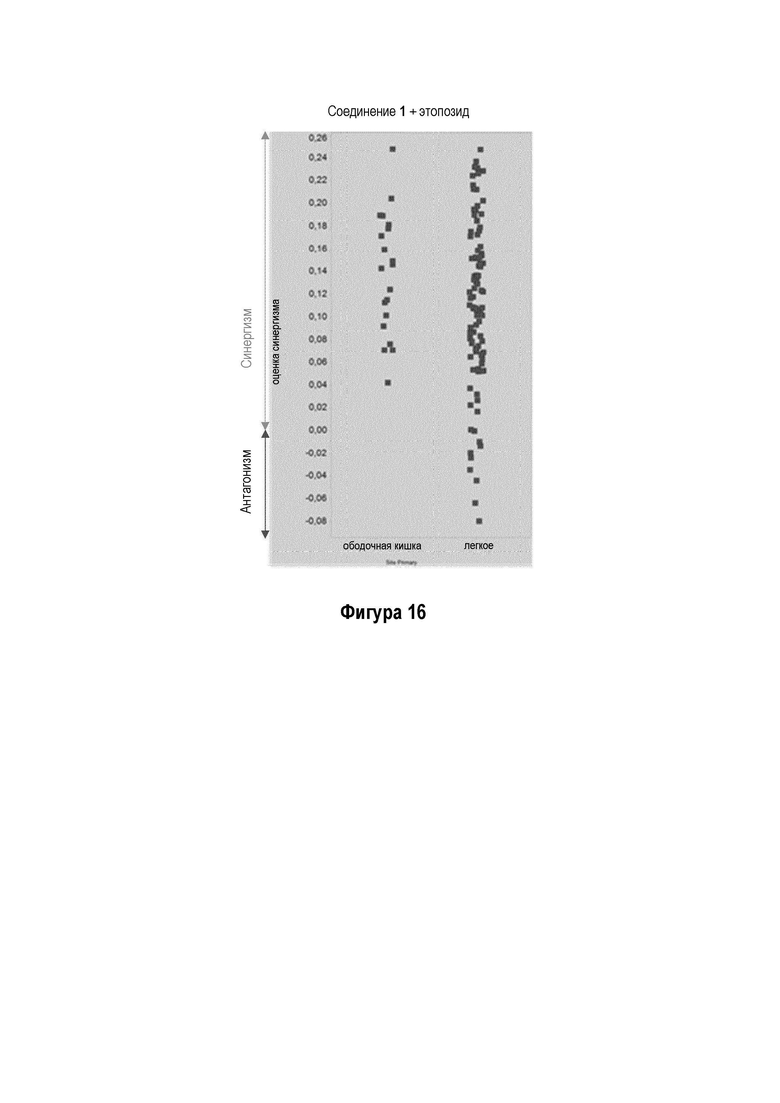
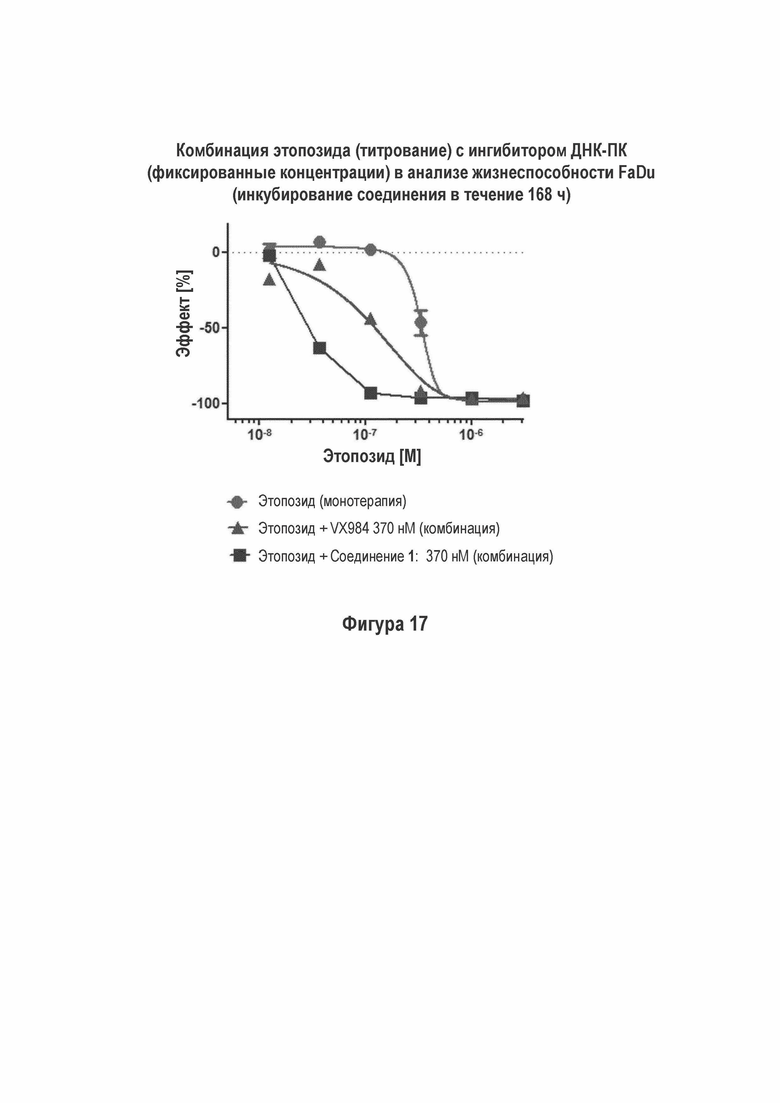
Изобретение относится к способу лечения злокачественного новообразования легкого, экспрессирующего ДНК-ПК, у пациента, который в этом нуждается, включающему введение указанному пациенту соединения 1:
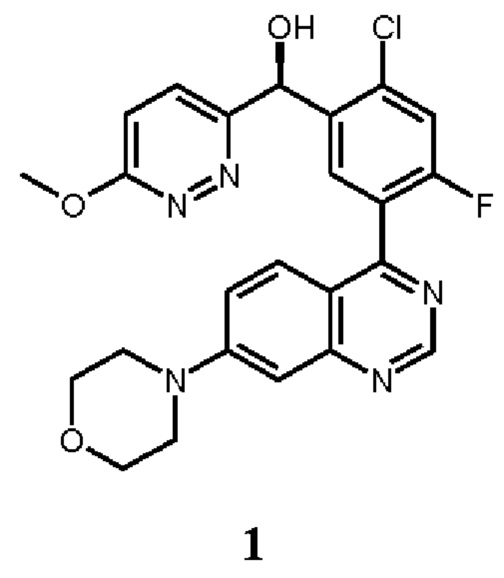 в комбинации с этопозидом и цисплатином, где соединение 1 вводят в количестве от 10 до 800 мг, где этопозид вводят внутривенно в количестве 100 мг/м2,
в комбинации с этопозидом и цисплатином, где соединение 1 вводят в количестве от 10 до 800 мг, где этопозид вводят внутривенно в количестве 100 мг/м2,
где цисплатин вводят внутривенно в количестве 75 мг/м2. Технический результат: разработан способ лечения злокачественного новообразования легкого, экспрессирующего ДНК-ПК, с помощью комбинированной терапии, которая демонстрирует синергизм соединения 1 в комбинации с этопозидом и цисплатином. 3 н. и 1 з.п. ф-лы, 17 ил., 7 табл., 8 пр.
1. Способ лечения злокачественного новообразования легкого, экспрессирующего ДНК-ПК, у пациента, который в этом нуждается, включающий введение указанному пациенту Соединения 1:
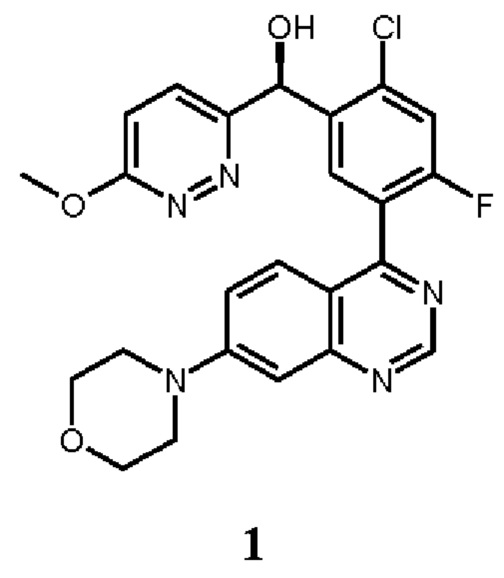
в комбинации с этопозидом и цисплатином,
где Соединение 1 вводят в количестве от 10 до 800 мг,
где этопозид вводят внутривенно в количестве 100 мг/м2,
где цисплатин вводят внутривенно в количестве 75 мг/м2.
2. Способ по п. 1, где Соединение 1
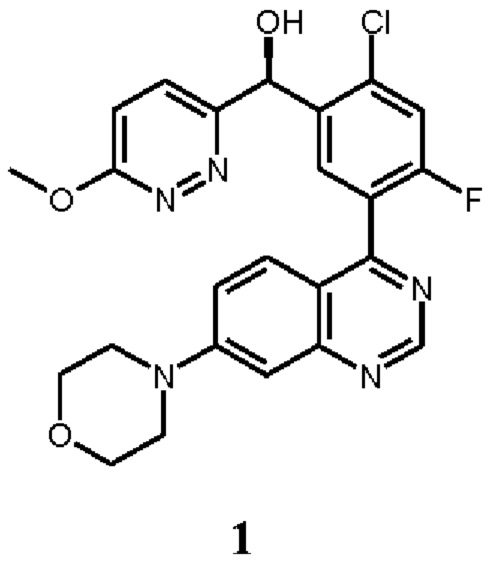
вводят одновременно или последовательно с этопозидом и цисплатином.
3. Применение Соединения 1:
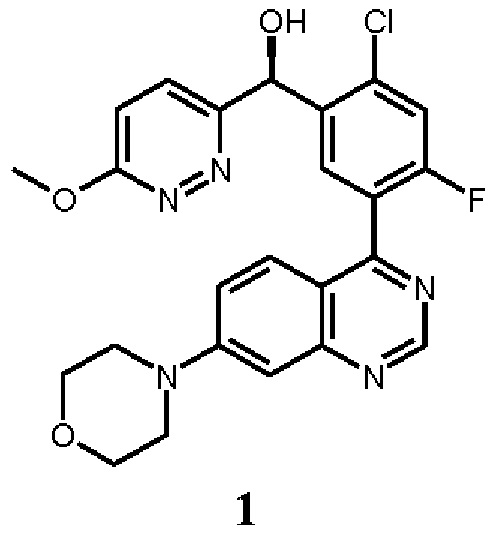
для лечения злокачественного новообразования легкого, экспрессирующего ДНК-ПК, в комбинации с этопозидом и цисплатином, где Соединение 1 вводят в количестве от 10 до 800 мг2, где этопозид вводят внутривенно в количестве 100 мг/м2, где цисплатин вводят внутривенно в количестве 75 мг/м2.
4. Применение Соединения 1:
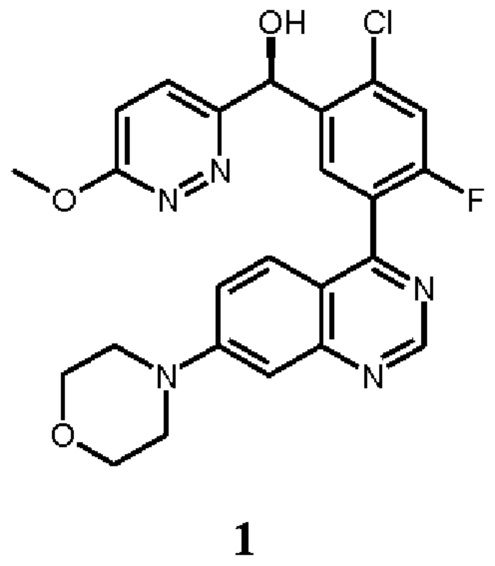
для приготовления лекарственного средства для лечения злокачественного новообразования легкого, экспрессирующего ДНК-ПК, в комбинации с этопозидом и цисплатином, где Соединение 1 вводят в количестве от 10 до 800 мг, где этопозид вводят внутривенно в количестве 100 мг/м2, где цисплатин вводят внутривенно в количестве 75 мг/м2.
| US 2016083401 A1, 24.03.2016 | |||
| US 2013281431 A1, 24.10.2013 | |||
| U YILMAZ ET AL., "Carboplatin plus etoposide for extensive stage small-cell lung cancer: An experience with AUC 6 doses of carboplatin", INDIAN JOURNAL OF CANCER, vol | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ELZBIETA PASTWA ET AL., "Wortmannin potentiates the combined effect of etoposide and | |||
Авторы
Даты
2022-12-15—Публикация
2017-12-18—Подача