Изобретение относится к области медицины, а именно к препаратам для парентерального применения для восстановления костных тканей.
В настоящее время проблема посттравматического восстановления костной ткани (репаративная регенерация) приобретает особое значение в связи с ростом локальных вооруженных конфликтов и техногенных катастроф, а также имеет социально-экономическую актуальность, связанную с необходимостью длительного и дорогостоящего лечения.
В настоящее время известны несколько наиболее распространенных способов стимуляции репаративной регенерации (Фон Верзен Р., 1993):
1. трансплантация детерминированных остеогенных продромальных клеток (ДОПК), обладающих собственной потенцией костеобразования, -остеобластический остеогенез (Фриденштейн А.Я., Лалыкина К.С, 1973; Matti Н., 1932);
2. способ пассивной стимуляции ДОПК с помощью аллогенных костных трансплантатов, синтетических или полусинтетических заменителей кости - остеокондуктивный остеогенез или остеокондукция (Gerbart T.N. et al, 1993; Mitteimeir H, Katthagen B.D., 1983). Имплантаты искусственного или биологического происхождения в этом случае являются остовом (кондуктором) для прорастания кровеносных сосудов, после чего происходит врастание клеток (остеобластов) из костного ложа;
3. воздействие специфическими субстанциями, к которым принадлежит костный морфогенетический белок (BMP-bone morphogenetic protein), точнее некоторые представители семейства морфогенетических белков, индуцирующих фенотипическое преобразование плюрипотентных стволовых соединительнотканных клеток или индуцибельных остеопродромальных клеток (Фон Верзен Р., 1993) в остеобласты, - остеоиндуктивный остеогенез или остеоиндукция (Urist M.R., 1965);
4. воздействие на остеогенез факторами, стимулируюнщми новообразование кости (TGF-p, IGF-I, IGF-II, PDGF, bFGF. aFGF, BMPs), - стимулированный остеогенез. Эти факторы постоянно присутствуют в нативной костной ткани, являясь медиаторами клеточной пролиферации и дифференцировки, ангиогенеза и минерализации, как при физиологической, так и при репаративной регенерации костной ткани (Solheim Е., 1998).
В настоящее время BMPs и факторы роста коммерчески доступны и применяются в некоторых странах в клинической практике. Однако малое количество их в костной ткани, трудность выделения и очистки, невозможность синтеза некоторых из них методами генной инженерии (например, BMPs ввиду не вполне ясной химической структуры) существенно ограничивают применение этих факторов в экспериментальной и клинической травматологии и ортопедии.
Другим способом воздействия на репаративную регенерацию является трансплантация детерминированных остеогенных продромальных клеток (ДОПК), обладающих собственной потенцией к остеогенезу (Фриденштейн А.Я., Лалыкина К.С., 1973).
Однако в силу сложности и дороговизны культивирования клеток-предшественников остеобластов, короткого времени жизни клеток вне питательной среды предложенный способ воздействия на остеогенез пока не получил широкого внедрения в экспериментальную и клиническую травматологию и ортопедию.
Известны экспериментальные и клинические данные о применении трансплантатов из деминерализованного костного матрикса, гидроксиапатита коралла, пористых полимерных материалов, насыщенных остеогенными клетками хозяина (Jean J.L., Wang S.J., Аи М.К., 1997; Bruder S.P., Kraus К.Н., Goldberg V.M., Kadiyala S., 1998, Rosenberg E., Rose L.E., 1998).
Перспективным в настоящее время, по данным проведенных исследований (Paralkar V.M., Hammonds R.G., Reddi А.Н., 1991; Solheim E., Pinholt E.M., Andersen R., Bang G., Sudmann E., 1992; Solheim E., Pinholt E.M., Bang G., Sud-mann E. 1992; Solheim E., Pinholt E.M., Bang G., Sudmann E. 1992; Sudmann В., Anfinsen O.G., Bang G. et al., 1993), является резорбируемый синтетический имплантат (система доставки факторов роста), изготовленный из полиортоэстера. Однако отдаленные результаты применения этого материала неизвестны, что пока ограничивает применение полиортоэстера в клинике.
Известен инъекционный раствор для регенерации костной ткани (патент РФ №2061402), содержащий 1-гидроксиэтилидендифосфоновую кислоту, хлорид кальция, нитрат гадолиния гексагидрат и воду при следующем соотношении ингредиентов, масс. %: 1-гидроксиэтилидендифосфоновая кислота 1,8-2,0; хлорид кальция безводный 1,4-2,2; нитрат гадолиния гексагидрат 0,3-0,4; вода до 1000, с рН 7,5-8,0. Известный раствор сокращает продолжительность процесса регенерации костной ткани в месте ее повреждения или дефекта, однако использование разных анионов в составе входящих в него солей (хлорид и нитрат ионов) не позволяет получить фармацевтически активный комплекс 1-гидроксиэтилидендифосфоновой кислоты постоянного состава, что делает препарат неэффективным.
Известен инъекционный раствор для регенерации костной ткани (патент РФ №2521344), содержащий 1-гидроксиэтилидендифосфоновую кислоту в количестве 1,80-2,06 г/л, хлорид кальция безводный в количестве 1,44-2,22 г/л, нитрат гадолиния(III) гексагидрат в количестве 0,30-0,40 г/л, хлорид диспро-зия(III) гексагидрат в количестве 0,038-0,076 г/л, с рН 7,3-7,8. Указанный раствор перед его введением в зону перелома доводят до температуры 30-100°С, выдерживают его при этой температуре в течение 1-48 час и вновь охлаждают до комнатной температуры. Известный раствор сокращает продолжительность процесса регенерации костной ткани в месте ее повреждения или дефекта и время восстановления нормальной физиологической функции травмированной кости, однако использование разных анионов в составе входящих в него солей (хлорид и нитрат ионов) не позволяет получить фармацевтически активный комплекс 1-гидроксиэтилидендифосфоновой кислоты постоянного состава. Кроме того, для использования известного состава требуется предварительная подготовка, что ограничивает его применение для оперативных действий.
Известна парентеральная композиция, включающая бисфосфоновую кислоту или ее фармацевтически приемлемую соль (бисфосфонат) в качестве активного компонента, фармацевтически приемлемый хелатирующий агент, а именно EDTA и DTPA и их фармацевтически приемлемые соли, и фармацевтически приемлемые наполнители (патент РФ №2238736). Известная композиция применяется в лечении и предотвращении заболеваний, включающих резорбцию костной ткани, особенно остеопороз, болезнь Педжета, гиперкальциемию при злокачественных опухолях и метаболическое нарушение костной ткани. Композиция особенно полезна для улучшения локальной толерантности активного компонента при парентеральном введении, особенно подкожным путем. Однако, известная композиция не влияет на посттравматическое восстановление костной ткани.
Известно применение N-бисфосфоната или его фармацевтически приемлемой соли или любого его гидрата для приготовления лекарственного средства, предназначенного для лечения состояний, характеризующихся аномально повышенным обновлением костной ткани, где лекарственное средство приспособлено для парентерального введения в виде стандартной дозируемой формы, содержащей от приблизительно 1 до приблизительно 10 мг N-бисфосфоната или его фармацевтически приемлемой соли или любого его гидрата (заявка РФ №2003100503). Известное средство применяется для профилактического лечения остеопороза, но не влияет на посттравматическое восстановление костной ткани.
Известен состав для парентерального введения для лечения остео-некроза и связанных с ним нарушений, таких как рассекающий остеохондрит, содержащий в качестве активного ингредиента фармацевтически приемлемую соль бифосфоната [патент РФ №2284821, опубл. 10.10.2006]. Однако, указанный препарат является не эффективным при посттравматическом восстановлении костной ткани.
Задача, решаемая предлагаемым изобретением - разработка фармацевтической парентеральной композиции для восстановления костных тканей, сочетающей восстановительное и бактериостатическое действие с высокими фармакокинетическими показателями и постоянным составом.
Заявленный технический результат достигается предлагаемой фармацевтической парентеральной композицией для восстановления костных тканей, содержащей 1-гидроксиэтилидендигидрофосфат кальция, серебро и воду, при следующем соотношении компонентов, масс. %:
Технический результат от использования изобретения заключается в повышении эффективности препарата за счет его стабильности и, как следствие, увеличении скорости диффузии активных субстанций в зону костных тканей, и расширение арсенала средств для восстановления костных тканей за счет применения бактериостатической составляющей в виде коллоидного серебра, которое в сочетании с 1-гидроксиэтилидендигидрофосфатом кальция проявляет синергический эффект.
За счет синергического взаимодействия компонентов предложенный состав оказывает комплексное воздействие в зоне костного дефекта. Входящий в предложенную композицию 1-гидроксиэтилидендигидрофосфат кальция представляет собой стабильный хелатный комплекс постоянного состава и ускоряет процесс регенерации, обогащая зону костного дефекта хелатным кальцием. Присутствующее коллоидное серебро, с одной стороны, воздействует на оболочку клеток, являясь проводником 1-гидроксиэти-лидендигидрофосфата кальция, а с другой оказывает бактериостатическое действие, из-за которого не наблюдается резистентности микроорганизмов, что усиливает положительное влияние на степень и динамику репаративных процессов.
Экспериментально было установлено, что указанные диапазоны концентраций активных ингредиентов являются оптимально приемлемыми, фармакологически значимыми и принятыми в лекарственной практике для аналогичных инъекционных растворов данной фармакологической группы.
Получение предлагаемой фармацевтической композиции осуществляется следующим способом.
В стеклянную емкость помещают необходимое количество дистиллированной воды и 1-гидроксиэтилидендифосфоновой кислоты. Перемешивают до полного растворения кислоты и помещают в раствор электроды из серебра произвольной формы. Через электроды пропускают постоянный ток в течение времени, рассчитанного для достижения необходимой концентрации серебра в соответствии с законом электролиза Фарадея. После этого в раствор добавляют расчетное количество гидроксида или оксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре, не превышающей 90°С. При перегреве делается технологическая пауза. Горячий раствор фасуется по ампулам 10 мл на стандартном фармацевтическом оборудовании. Готовый препарат не требует предварительной подготовки, стерилен и имеет срок хранения не менее года.
Контроль количественного содержания активных ингредиентов в композиции и определение стерильности полученного раствора проводят по известным методикам.
Примеры получения предлагаемой фармацевтической композиции.
Пример 1.
4,224 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 995 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 180 мА в течение 10 секунд. После этого в раствор добавляют 1,517 г гидроксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0, 5 масс. %, серебра 2×10-5 масс. %.
Пример 2.
0,845 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 999 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 180 мА в течение 25 секунд. После этого в раствор добавляют 0,23 г оксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0,1 масс. %, серебра 5×10-5 масс. %.
Пример 3.
0,535 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 998 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 180 мА в течение 15 секунд. После этого в раствор добавляют 0,689 г оксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0,3 масс. %, серебра 3×10-5 масс. %.
Пример 4.
0,34 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 1000 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 100 мА в течение 27 секунд. После этого в раствор добавляют 0,121 г гидроксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0,04 масс. %, серебра 3×10-5 масс. %.
Пример 5.
0,59 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 999 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 100 мА в течение 36 секунд. После этого в раствор добавляют 0,161 г оксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0,07 масс. %, серебра 4×10-5 масс. %.
Пример 6.
3,38 г 1-гидроксиэтилидендифосфоновой кислоты растворяют в 996 мл дистиллированной воды. В раствор погружают электроды из серебра и пропускают постоянный ток силой 250 мА в течение 18 секунд. После этого в раствор добавляют 0,95 г оксида кальция, перемешивают и гомогенизируют на погружном ультразвуковом лабораторном гомогенизаторе при мощности 180 ватт в течение 15 минут при температуре 80°С. Раствор прозрачный с небольшой опалесценцией.
Полученный раствор содержит 1-гидроксиэтилидендигидрофосфата кальция 0,4 масс. %, серебра 5×10-5 масс. %.
Фармацевтическая парентеральная композиция для восстановления костных тканей, полученная в соответствии с приведенными примерами, во всех случаях подтвердила достижение заявленного технического результата.
С целью определения общетоксического действия и доказательства эффективности предлагаемой композиции были проведены ее доклинические испытания на базе центральной научно-исследовательской лаборатории Приволжского исследовательского медицинского университета.
Эксперимент проведен на самцах кроликов линии «Советская Шиншила» весом 3,5-5 кг, которых разделили три группы: контрольную - отсутствие введения препарата в травме, опытную - введение предлагаемого состава в травме, сравнения - введение препарата сравнения «Биопласт-дент» в травме. Животным контрольной и опытных групп трепаном диаметром 3,0 мм производили дефект верхней челюсти и подвздошной кости на глубину 1-3 мм. У кроликов контрольной группы костный дефект оставляли свободным; кроликам первой экспериментальной группы дефекты костной ткани заполняли опытным препаратом. У кроликов второй экспериментальной группы дефекты костной ткани верхней челюсти и подвздопшой кости заполняли препаратом сравнения.
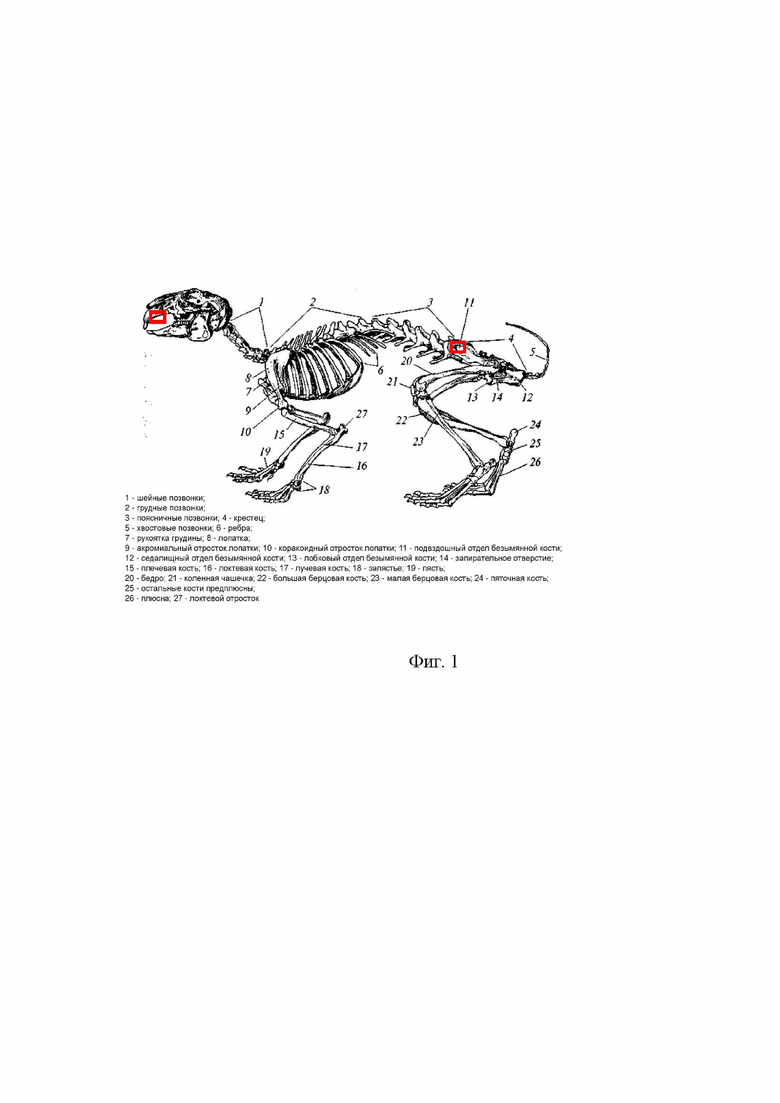
Операционное вмешательство осуществляли под 3-хкомпонентным наркозом включавшим в себя внутримышечное введение таких препаратов как Золетил 5 мг/кг мг в/м («Virbac» Франция), Ксиланит 0,1 мг в/м (ЗАО «НИТА-ФАРМ, Россия, г. Саратов) и ингаляционное - препаратом Изофлюран («Лаборатория Каризоо», Испания). Подача дыхательной смеси при ингаляционном наркозе осуществлялась с помощью кислородного концентратора АрМед 7F-1L и системы анестезии для мелких лабораторных животных, ингаляция изофлураном, Biosthesia («Vilber Lourmat», Франция). Мониторинг физиологическое состояния животных осуществлялся на всем протяжении операции и в течение послеоперационного периода. На фиг. 1 представлен скелет кролика с указанием зон, которые выделенны прямоугольниками, оперативного вмешательства и забора морфологического материала.
Все животные удовлетворительно перенесли оперативное вмешательство. Кроликов из каждой группы выводили из эксперимента на 3, 7, 14, 28 и 90-е сутки. Все манипуляции на животных осуществляли под сочетанным трехкомпонентным наркозом с соблюдением правил асептики и антисептики, а также в соответствии с международными принципами Хельсинской декларации о гуманном отношении к животным. Для проведения гематологического и биохимического анализа крови лабораторных животных забор крови осуществляли внутривенно из медиальной ушной вены кроликов.
Для проведения морфологического анализа у животных всех групп после их выведения из эксперимента эксплантировали фрагмент костной ткани верхней челюсти и подвздошной кости, включающий интактные участки и область регенерата.
Морфологическую оценку и фотофиксацию экспериментального материала выполняли с помощью светового микроскопа DMLS фирмы Leica и малоформатной цветной камеры (CCD) в интервале рабочих увеличений от 40 до 400. Всего было проанализировано 172 гистологических препарата подвздошной кости и 134 верхнечелюстной (табл. 1, 2).




Результаты и обсуждение
У кроликов всех групп через 3 сут. послеоперационного периода на светооптическом уровне отчетливо определялась область сформированного дефекта. В образцах костной ткани животных контрольной группы дефект заполнен тканевым детритом. По всему периметру раны фибрин отграничивал торцы спилов верхней челюсти и подвздошной кости от некротических масс и форменных элементов крови. В образцах костной ткани животных первой экспериментальной группы на 3-и сутки послеоперационного периода весь объем костного дефекта заполнен опытным препаратом. На препаратах видно, что материал плотно прилегает к обломкам кости. В данный период наблюдения поверхность костной раны верхней челюсти покрыта рыхлой волокнистой соединительной тканью, в которой заметно формирование кровеносных сосудов. Среди компонентов межклеточного вещества соединительной ткани идентифицируются многочисленные малодифференцированные клетки.
В образцах костной ткани животных второй экспериментальной группы, через 3 сут. после повреждения и заполнения раны препаратом сравнения, края кости по периметру отграничены от препарата лейкоцитарным валом. Между клетками крови заметны отложения фибрина и мелкие частицы препарата сравнения. Поверхность дефекта покрыта слоем фибрина, среди которого заметны клетки крови и некротические массы. Морфологические характеристики острой фазы воспаления в костной ране у кроликов всех групп через 3 сут. послеоперационного периода имеют ярко выраженные различия. Интенсивность воспалительной реакции в ткани при введении препарата сравнения ниже, чем у животных контрольной группы. Однако наименьший уровень воспалительной реакции отмечен при использовании опытного препарата. Очевидно, данный факт обусловлен различными механизмами действия входящих в состав препаратов веществ.
На 7е сутки различия в процессе репаративной регенерации в костях верхней челюсти и подвздошной кости становятся более выраженными. Во втором случае процесс заживления происходит интенсивнее.
Морфология регенерата на 14 сут. наблюдения имеет выраженные различия у животных экспериментальных групп. В образцах, полученных от кроликов первой экспериментальной группы, деградация опытного препарата сопряжена с его замещением интенсивно васкуляризированной грубоволокнистой костной тканью. У кроликов второй экспериментальной группы в тканях регенерата сохраняются признаки воспаления, а остеобласты имеют признаки низкой функциональной активности.
Через 28 суток в образцах костной ткани кроликов контрольной группы дефект полностью заполнен регенератом и с поверхности покрыт утолщенным периостом. В области ложа костного дефекта регенерат представлен молодой костной тканью. На поверхности формирующихся костных трабекул идентифицируются функционально активные остеобласты. В области торцов спилов регенерат выполнен волокнистой тканью с признаками интенсивной васкуляризации. На гистологических препаратах костной ткани животных первой экспериментальной группы к 28-м сут. наблюдения дефект представлен формирующейся пластинчатой костной тканью. На поверхности между периостом и регенератом локализованы небольшие участки, заполненные опытным препаратом, который имеет признаки резорбции и замещения костной тканью. Следует отметить, что по всему периметру дефекта регенерат интегрирован с костной тканью верхней челюсти и подвздошной кости. В аналогичных образцах костной ткани кроликов второй экспериментальной группы дефект по всему периметру краев спилов верхней челюсти и ложа выполнен формирующейся грубоволокнистой костной тканью.
Необходимо особо отметить, что на срезах подвздошной кости начиная с 3 по 28 сутки наблюдения у оперированных животных выявлены компоненты гиалиновой хрящевой ткани, хондробласты и хондроциты разной степени дифференцировки плотно прилегающие к костному дефекту (фиг. 2). Присутствие хондроцитов в ранние сроки наблюдения и сохранение их через 28 суток после операции в зоне костного дефекта служит плацдармом для развития энхондрального остеогенеза.
У животных контрольной группы через 3 месяца после повреждения кости дефект полностью заполнен регенератом, представленным грубоволокнистой костной тканью (фиг. 3). На фрагменте А черными стрелками обозначена граница между регенератом и костным дефектом; фрагмент Б представляет собой увеличенную часть фрагмента А (окраска по Ван-Гизону, ув. А×100; Б×200). В гистологических препаратах экспериментальных групп зона дефекта не определяется.
Проведенное морфологическое исследование показало, что регенерация костной ткани с использованием опытного препарата опережает таковую при применении препарата сравнения. Полученные данные свидетельствуют о целесообразности использования предлагаемого препарата для оптимизации остеогенеза при повреждении костной ткани. Вероятно, предлагаемый препарат опосредованно оказывает влияние на развитие воспаления в ране и стимулирует пролиферацию остеогенных клеток. Полученные результаты позволяют заключить, что предлагаемый препарат является перспективным материалом для дальнейших морфо-функциональных исследований в качестве стимулятора репаративной регенерации костной ткани.
Анализ гематологических показателей опытной группе через 3 месяца (количество эритроцитов, содержание лейкоцитов соотношение палочкоядерных нейтрофилов, базофилов, моноцитов в лейкоцитарной формуле) не выявил статистически значимых отличий относительно контроля. Было отмечено статистически значимое снижение содержания тромбоцитов, сегментоядерных нейтрофилов и эозинофилов в лейкоцитарной формуле, увеличение гемоглобина и лимфоцитов относительно контроля. В группе сравнения, как и в опытной группе, отмечалось статистически значимое увеличение уровня гемоглобина по сравнению с контролем. Регистрируемые статистически значимые изменения находились в пределах физиологической нормы данного вида животных.
Как показали проведенные исследования, предлагаемая фармацевтическая парентеральная композиция является эффективной для восстановления костных тканей, не вызывает асептического воспаления в зоне костного дефекта, увеличивает степень и динамику репаративных процессов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Комплексные соли ацексамовой кислоты, стимулирующие регенерацию костной ткани, ускоряющие процессы репаративного остеогенеза, стимулирующие минерализацию костной ткани при остеопорозе | 2018 |
|
RU2668966C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛЯЦИИ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ ЭПИТЕЛИАЛЬНОЙ, НЕРВНОЙ И КОСТНОЙ ТКАНЕЙ | 2018 |
|
RU2677327C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2008 |
|
RU2373883C1 |
| КОМПОЗИЦИЯ - ОСТЕОИНДУКТОР И ОСТЕОКОНДУКТОР, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ - ОСТЕОИНДУКТОРА И ОСТЕОКОНДУКТОРА, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ | 2008 |
|
RU2383564C1 |
| БИОСОВМЕСТИМАЯ КОМПОЗИЦИЯ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ И СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОЙ КОМПОЗИЦИИ ДЛЯ ВОСПОЛНЕНИЯ (ЛЕЧЕНИЯ) ЧАСТИЧНЫХ И ПОЛНЫХ ДЕФЕКТОВ ХРЯЩЕВОЙ И КОСТНОЙ ТКАНИ | 2008 |
|
RU2385727C1 |
| СПОСОБ ОПТИМИЗАЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА | 2006 |
|
RU2315580C2 |
| ПРЕПАРАТ ДЛЯ СТИМУЛИРОВАНИЯ ФИЗИОЛОГИЧЕСКОЙ И РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ "СТИМБОН-1" | 1991 |
|
RU2050158C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ КОСТЕЙ | 2000 |
|
RU2180534C2 |
| ТВЕРДАЯ ДОЗИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СПОСОБНОСТЬЮ УМЕНЬШАТЬ ЭКССУДАЦИЮ, УСКОРЯТЬ ОЧИЩЕНИЕ РАНЫ ОТ НЕКРОТИЧЕСКИХ МАСС, А ТАКЖЕ УСКОРЯТЬ ЭПИТЕЛИЗАЦИЮ И РЕГЕНЕРАЦИЮ | 2012 |
|
RU2488383C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ СТИМУЛЯЦИИ РЕПАРАТИВНОГО ОСТЕОГЕНЕЗА ЭКСТРАКТОМ КЛЕТОК ФЕТАЛЬНОЙ КОСТНОЙ ТКАНИ | 2010 |
|
RU2433794C2 |



Изобретение относится к области медицины, а именно к препаратам для парентерального применения для восстановления костных тканей. Фармацевтическую парентеральную композицию для восстановления костных тканей получают путем растворения 1-гидроксиэтилидендифосфоновой кислоты в дистиллированной воде, помещения в полученный раствор электродов из серебра и пропускания через них постоянного тока силой 180 мА в течение 10, 15 или 25 секунд, 100 мА в течение 27 или 36 секунд или 250 мА в течение 180 секунд, последующего добавления гидроксида или оксида кальция, перемешивания и гомогенизирования при мощности 180 ватт в течение 15 минут при температуре, не превышающей 90°С. Использование изобретения обеспечивает эффективное восстановление костных тканей, не вызывает асептического воспаления в зоне костного дефекта, увеличивает степень и динамику репаративных процессов. 3 ил., 2 табл., 6 пр.
Фармацевтическая парентеральная композиция для восстановления костных тканей, получаемая путем растворения 1-гидроксиэтилидендифосфоновой кислоты в дистиллированной воде, помещения в полученный раствор электродов из серебра и пропускания через них постоянного тока силой 180 мА в течение 10, 15 или 25 секунд, 100 мА в течение 27 или 36 секунд или 250 мА в течение 180 секунд, последующего добавления гидроксида или оксида кальция, перемешивания и гомогенизирования при мощности 180 ватт в течение 15 минут при температуре, не превышающей 90°С.
| СПОСОБ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ В ЭКСПЕРИМЕНТЕ | 1991 |
|
RU2061402C1 |
| СПОСОБ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ В ЭКСПЕРИМЕНТЕ | 2012 |
|
RU2521344C2 |
| ГЕЛЬ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2008 |
|
RU2360663C1 |
| CUKROWSKI I et al | |||
| Modeling and spectroscopic studies of bisphosphonate-bone interactions | |||
| The Raman, NMR and crystallographic investigations of Ca-HEDP complexes | |||
| Bone, 2007, 41(4):668-78, doi: 10.1016/j.bone.2007.05.008 | |||
| ВОЛОЖИН А | |||
| И | |||
| и др | |||
| Особенности тканевой | |||
Авторы
Даты
2022-12-19—Публикация
2022-03-18—Подача