Изобретение относится к области биотехнологии, молекулярной биологии, фитопатологии и сельского хозяйства и направлено на разработку эффективного средства биологической защиты растений от инфекции оомицетом Phytophthora infestans по механизму РНК интерференции (РНКи), приводящей к снижению/выключению экспрессии целевого гена. Интерференция основана на использовании дцРНК, комплементарных генам домашнего хозяйства и генам, ассоциированных с патогенезом (эффекторные гены) Phytophthora infestans. В соответствии с настоящим изобретением определены 12 генов домашнего хозяйства, существенных для жизненного цикла/жизнедеятельности фитофторы и 12 генов, кодирующих белки-эффекторы, ответственные за патогенность и вирулентность оомицета. Выбранные 24 фрагмента генов-мишеней, т.е. целевых генов, объединены в блоки, включающие по три сегмента в каждой кассете из восьми генетических конструкций, и могут быть использованы для синтеза дцРНК как in vitro, так и in vivo (Escherichia coli, Pseudomonas syringae, Saccharomyces cerevisiae) для последующей обработки растений картофеля и других сельскохозяйственных культур с целью их защиты от Phytophthora infestans.
Описание чертежей
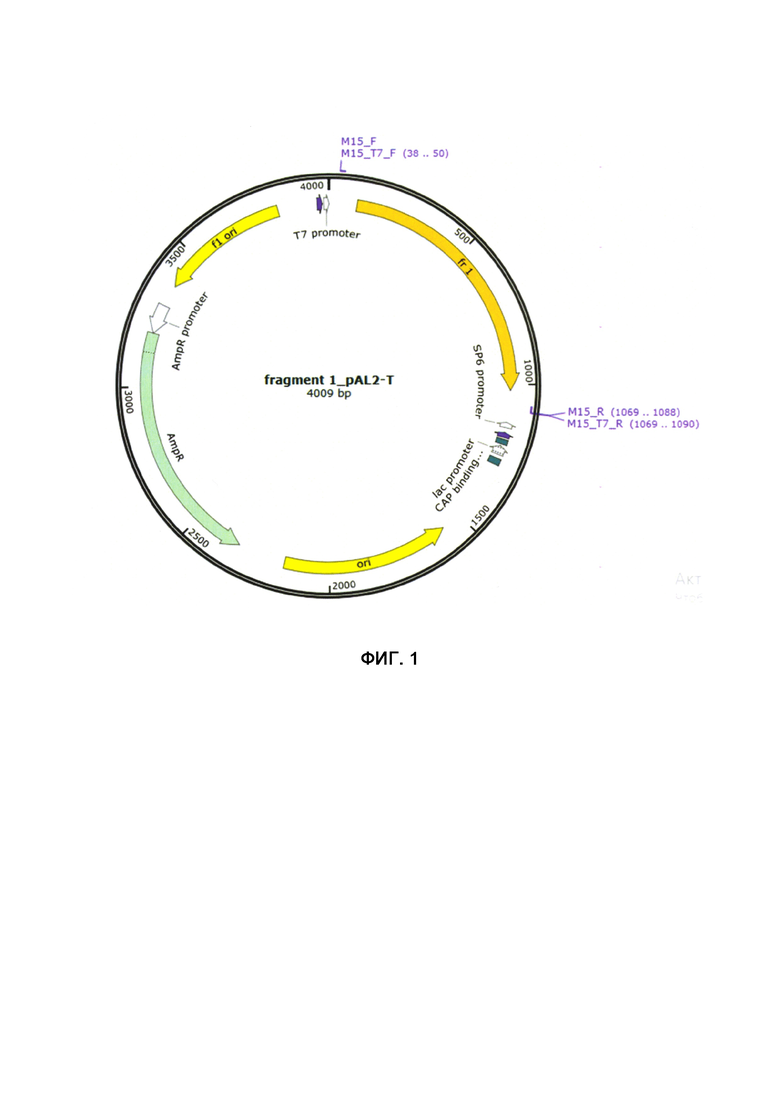
Фигура 1. Схема плазмиды, несущей последовательности генов alpha-tubulin, 60S ribosomal protein L4 и cytochrome L5 (конструкция Hr1) P. infestans (штамм T30-4). Конструкции Hr2-Нг8 отличаются только последовательностями генов, входящих в клонированный фрагмент, и перечислены в Табл. 1.
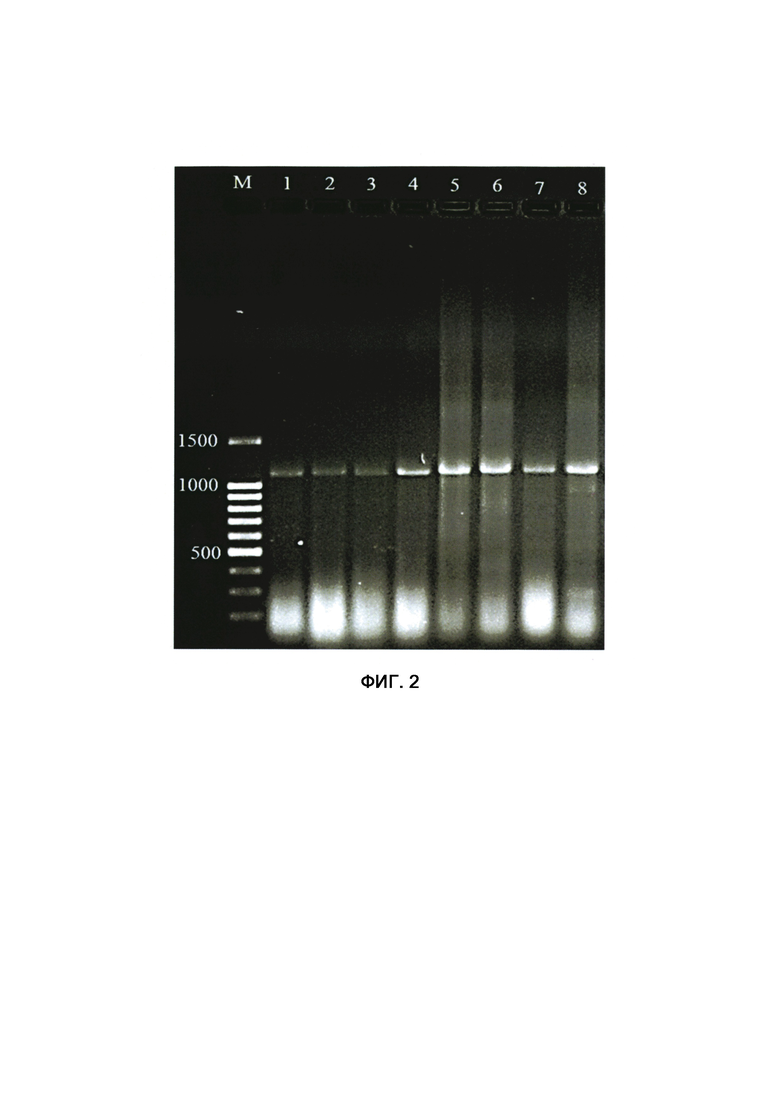
Фигура 2. Электрофорез дцРНК фитофторы, синтезированной in vitro в неденатурирующем геле агарозы.
1-8 - конструкции Hr1, Hr2, Hr3, Hr4, Hr5, Hr6, Hr7, Hr8, соответственно. Маркер мол. массы - 100 пн ladder (Evrogen).
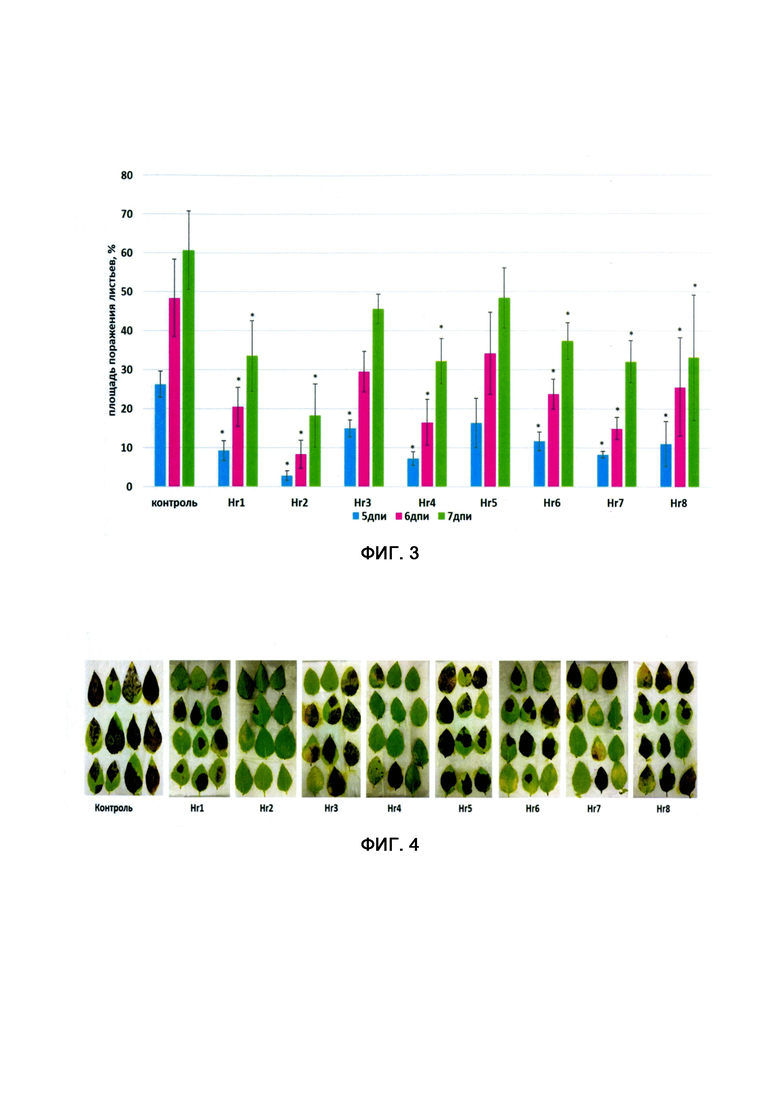
Фигура 3. Ингибирование фитофторы препаратами дцРНК конструкций Hr1, Hr2, Hr3, Hr4, Hr5, Hr6, Hr7, Hr8 на 5, 6 и 7 день после инфицирования (дпи) листьев восприимчивого к фитофторозу сортообразца 12-12-8 (селекция ООО «ДГТ»). Степень поражения листа патогеном (площадь некротических пятен) представлены в виде средних значений 3-х биологических повторностей (±SE). В каждом варианте каждого эксперимента тестировалось по 13-15 листьев. Значимые отличия (между контролем и вариантами обозначены «*» (р<0,05) (ANOVA with Tukey's HSD pos-hoc test).
Фигура 4. Развитие некротических пятен (на 7 дпи) после обработки зараженных фитофторой листьев картофеля препаратами дцРНК различных конструкций (Hr1, Hr2, Hr3, Hr4, Hr5, Hr6, Hr7, Hr8).
Фитофтороз, вызываемый оомицетом Phytophthora infestans (Mont.) de Вагу - самое вредоносное и экономически важное заболевание картофеля и томата в большинстве стран мира. Несмотря на то, что были обнаружены устойчивые к фитофторозу дикие мексиканские виды картофеля и разработаны методы их скрещивания с культурным картофелем, не удалось создать устойчивые сорта с постоянной устойчивостью к возбудителю, так как новые гены устойчивости из дикого мексиканского картофеля стали быстро терять эффективность. Кроме того, использование наиболее эффективных химических препаратов контактного действия содержащих фениламиды не позволил эффективно бороться с фитофторозом, так как их применение привело к накоплению резистентных к фениламидам штаммов. Возросший эпифитотиологический потенциал Р. infestans стал причиной снижения эффективности селекционных, химических и традиционных методов защиты картофеля. В связи с этим актуальной остается разработка экологически чистых средств защиты биологической растений, которые используют новые подходы для придания растениям устойчивости/резистентности против патогенов. Это может быть достигнуто как стимуляцией общих естественных механизмов иммунитета растений, так и посредством индукции специфического защитного ответа растения против индивидуального патогена или группы близкородственных патогенов.
Недавние исследования показали, что растения способны успешно экспрессировать искусственные гены, ответственные за синтез дцРНК и шпилечных двуспиральных РНК (шдцРНК), а также процессировать экзогенные дцРНК и шдцРНК для подавления экспрессии целевых генов патогенов (Морозов и др., 2019). Экзогенные дцРНК как и эндогенные дцРНК процессируются в растениях с образованием миРНК, которые распространяются по растению локально и системно и индуцируют резистентность растений к патогенам на основе механизма РНКи. Эта целенаправленная и экологически чистая стратегия защиты растений гораздо более приемлема, учитывая распространяемое давление общественного мнения, чем, например, химические обработки. Таким образом, механизм РНК-интерференции может быть использован в практическом плане для повышения устойчивости сельскохозяйственных растений к патогену P. Infestans, существенно расширяя арсенал узконаправленных и безопасных средств защиты растений.
Задача настоящего изобретения состояла в определении генов-мишеней P. infestans для получения серии специфических препаратов дцРНК для защиты растений от P. infestans на основе механизма РНК-интерференции.
Ключевые для потребителя характеристики, по которым у продукта/технологии есть преимущества над аналогами: возможность прямой защиты растений (картофеля, томатов) от заражения Р infestans при частичном отказе, или сокращении объемов, от трудозатратных профилактических мероприятий по фитопрочистке и выбраковке посадок.
Оомицет Phytophthora infestans поражает многие виды сельскохозяйственных культур Solanaceae, включая картофель (Solanum tuberosum) и томаты (Solanum lycopersicum). P. infestans - гемибиотроф, имеющий две стадии инфекционного процесса: начальную бессимптомную биотрофную и последующую некротрофическую. Во время биотрофной стадии P. infestans последовательно формирует аппрессории, первичные и вторичные гифы и, наконец, специализированные структуры, называемые гаусториями, через которые белки и небольшие молекулы, называемые эффекторами, доставляются в апопласт и клетки растения (Dou et al., 2008). Последующая некротрофическая стадия характеризуется разветвлением гиф и лизисом клеток-хозяина (van Кап, 2006). Особая опасность P. infestans как патогена обусловлена его эффективным размножением как бесполым, так и половым путем. В идеальных условиях жизненный цикл может быть завершен примерно за пять дней, причем одно поражение/заражение может генерировать до сотен тысяч новых спорангиев (Fry, 2008).
Разнообразие процессов, регулирующих каждую стадию инфекционного процесса, и молекулярные механизмы, запускающие переход от биотрофии к некротрофии (Lee and Rose, 2010), изучены недостаточно. Современные омиксные технологии (транскриптомный и протеомный анализы) позволили выявить гены патогенности и экспрессию эффекторов Р. infestans на разных стадиях развития инфекции (Zuluaga et al., 2016, Resjo et al., 2017).
Как и в случае с другими патогенами растений, патогенность и вирулентность определяются эффекторными генами (Lo Presti et al., 2015, Wang and Jiao, 2019). Считается, что белки-эффекторы позволяют патогенам регулировать метаболизм и подавлять защитные механизмы растения-хозяина (Abramovitch and Martin, 2004; Restrepo et al., 2005; Tian et al., 2007). Белки-эффекторы P. infestans принадлежат, в основном, к двум группам, которые нацелены на разные компартменты растения-хозяина. Апопластные эффекторы секретируются во внеклеточное пространство, тогда как цитоплазматические эффекторы перемещаются внутрь растительной клетки и взаимодействуют с различными субклеточными компартментами/структурами (Kamoun, 2006; Whisson et al., 2007).
Цитоплазматические эффекторы могут переходить в ядро, где они модулируют передачу сигналов и иммунные/защитные ответы растений (Dou et al., 2008; Schornack et al., 2010). Геном P. infestans является одним из крупнейших среди оомицетов (240 МБ) и содержит огромное количество мобильных элементов (ТЕ) (Haas et al., 2009, Vetukuri et al., 2013). Существуют сотни предсказанных генов, кодирующих белки-эффекторы, способствующие развитию инфекции, преимущественно локализованные в богатых ТЕ геномных областях, которые совместно управляют процессом диверсификации, что приводит к исключительно высокому потенциалу адаптации P. infestans к новым стратегиям защиты растений от этого патогена (Zuluaga et al., 2016).
Селекционная работа по созданию новых сортов с улучшенной устойчивостью к Р. infestans продолжается более 100 лет.Использование генов устойчивости диких видов Solanum началось с S. demissum и продолжается до сих пор (Vleeshouwers et al., 2011). Помимо пирамидирования доминантных генов устойчивости акцент был сделан на введении количественных признаков устойчивости. Тем не менее, поиск комбинаций генов устойчивости без негативного влияния признаков от видов-доноров, таких как, например, позднее созревание, остается сложно решаемой проблемой.
Впервые идея использования участков РНК, комплементарных определенной области мРНК целевого гена, для угнетения экспрессии этого гена была описана в 1984 году. Термин РНК-интерференция (РНКи) был введен в 1998 году, когда Tabara и соавт.(ТаЬага et al., 1998) показали, что процесс ингибирования экспрессии гена может быть инициирован инкубацией нематод в растворе ген-специфичных двуспиральных фрагментов РНК. Однако к тому времени на трансгенных растениях и грибах уже были получены явные указания на роль комплементарных РНК в регуляции экспрессии эндогенных эукариотических генов (Jorgensen, 1990; Grierson et al., 1991; Romano and Macino, 1992). В течение 1990-2000-х годов появилось множество работ, посвященных РНКи во многих эукариотических организмах, включая грибы, животные и растения. РНКи или РНК-сайленсинг, сиквенс-специфический механизм посттранскрипционного умолкания генов, опосредованный малыми интерферирующими РНК (миРНК) или микроРНК, выполняет важную роль в защите от вирусной инфекции, развитии и поддержании целостности генома (Ding, 2000; Vance and Vaucheret, 2001; Baulcombe, 2004; Chen, 2012). В растениях в процесс РНК-интерференции вовлечены несколько ключевых семейств белков, включая Dicer-подобные белки (DCL), Аргонавты (AGO) и РНК-зависимые РНК полимеразы (RDR). DCL белки являются РНКазами типа III, который процессируют дцРНК или РНК со шпилечными структурами с образованием миРНК или микроРНК, соответственно, длиной 20-24 нуклеотидов. AGO белки являются эндонуклеазами, которые формируют индуцированный РНК комплекс сайленсинга (RISC) с миРНК или микроРНК. RISC может связываться с целевой/таргетной мРНК или некодирующей РНК по принципу комплементарности через включенные в комплекс миРНК/микроРНК. Умолкание (выключение) экспрессии целевого гена осуществляется путем разрезания и деградации целевой мРНК (РНК-интерференция) или путем привлечения кофакторов и ингибирования трансляции этой мРНК или за счет модификации гистонов (метилирования) и ингибирования транскрипции целевого гена (траскрипционный сайленсинг). Белки RDR транскрибируют одноцепочечную РНК с образованием дцРНК, которая в дальнейшем процессируется с образованием миРНК при участии белков DCL. Поскольку образование дцРНК является общей особенностью механизмов сайленсинга, искусственно синтезированные дцРНК могут имитировать РНК сайленсинг в растениях, регулируя экспрессию генов и тем самым обеспечивая подход для улучшения свойств сельскохозяйственных культур (подавление функционирования клеточного гена), а также ингибируя размножение или вирулентность патогенов (Dalakouras et al., 2020). Существенно, что сигнал сайленсинга (дц миРНК) перемещается по растению в течение нескольких дней после инициации и, как правило, направлен от фотосинтетических источников (т.е. листьев) к корням и точкам роста (Lough and Lucas, 2006; Voinnet et al., 1998). Различают межклеточный транспорт миРНК через плазмодесмы и системный транспорт через проводящую ткань флоэмы (Wang and Dean, 2020).
С использованием трансгенных растений, экспрессирующих дцРНК против генов патогена, очевидный эффект показан у злаковых, зараженных возбудителем мучнистой росы Blumeria graminis (Nowara et al., 2010). Подавление генов метаболизма жирных кислот с помощью стратегии сайленсинга генов, индуцированной хозяином (host-induced gene silencing, HIGS) выявило эффективность этого метода для создания толерантности к болезням и у ряда других культурных растений. HIGS-опосредованное подавление гена OsSSI2 риса привело к повышению устойчивости к грибу Magnaporthe grisea и бактерии листовой гнили Xanthomonas oryzae (Jiang et al., 2009). Повышенная устойчивость растений риса к М. grisea была достигнута путем подавления двух генов, а именно OsFAD7 и OsFAD8, которые кодируют белки Ω-3-десатуразы жирных кислот (Yara et al., 2007). Более того, подавление генов, контролирующих производство лигнина, привело к повышению устойчивости растений сои к фитопатогену Sclerotinia sclerotiorum (Peltier et al., 2009). Обнаружено снижение симптомов мучнистой росы у растений ячменя или пшеницы при HIGS-опосредованном подавлении гена белка-эффектора Avra10 и уменьшение количества функциональных гаусторий внутри клеток эпидермиса.
В работах Whisson et al., 2005 и Grenville-Briggs et al., 2008 описывается первое применение синтезированной in vitro дцРНК для запуска сайленсинга генов P. infestans при ее доставке в протопласты патогена. В исследованиях были использованы дцРНК к генам infl и cdcl4 (Whisson et al., 2005) и CesA (Grenville-Briggs et al., 2008). INF1 представляет собой секретируемый предполагаемый белок-носитель стерола с мол массой 10 кДа. Белок Cdcl4 необходим для споруляции патогена P. infestans. После воздействия специфических дцРНК наблюдали снижение продукции INF1 и экспрессии гена cdcl4, что дало ожидаемое уменьшение количества спорангиев (Whisson et al., 2005; Grenville-Briggs et al., 2008). Гены CesA активируются во время прорастания цист и последующего образования аппрессорий. Сайлесинг генов CesA 1-4 значительно снижает количество целлюлозы в аппрессорной клеточной стенке, что приводит к уменьшению образования аппрессорий. Позднее проведенные исследования гомолога гена Cdcl4 P. infestans в возбудителе гнили корней сои P. sojae - PsCdcl4 - показали, что количество мРНК PsCdcl4 после обработки протопластов P. sojae синтезированной in vitro дцРНК PsCdcl4 резко снижается, что приводит к низкому уровню формирования спорангиев (Zhao et al., 2011). В отличие от приведенных данных, HIGS-опосредованный сайленсинг генов оомицета Pparasitica не инициировал развитие столь явной защитной реакции у трансгенных растений арабидопсиса, экспрессирующих дцРНК на основе последовательности гена PnPMAl (Zhang et al., 2011). Однако другие примеры указывают на возможность успешного применения HIGS и в случае оомицетов. Так, в одной из работ показано, что в трансгенных растениях табака, экспрессирующих дцРНК гена глутатион-8-трансферазы, развивается заметная устойчивость к табачному штамму фитофторы (Hernandez et al., 2009).
В других работах был исследован эффект ингибирования экспрессии различных эффекторных генов. Например, у P. infestans был описан супрессор РНКи PSR2 (Phytophthora супрессор сайленсинга РНК 2). PSR2 является консервативным белком-эффектором, одним из немногих присутствующих у большинства видов Phytophthora. Наибольший уровень экспрессии гена наблюдается в биотрофной фазе патогена, что позволяет предположить, что PSR2 важен на ранней стадии заражения. Показано, что PSR2 увеличивает вирулентность фитофторы, что делает его перспективной мишенью для борьбы с патогеном (Xiong et al., 2014; Sophie de Vries et al., 2017). Другие два эффектора PsAvhl8 и PsAvhl46, которые экспрессируются в P. sojae во время заражения сои, ингибируют биогенез малых РНК. Эктопическая экспрессия этих супрессоров салейсинга РНК увеличивает восприимчивость растений к фитофторе, показывая, что некоторые патогены содержат белки вирулентности, которые нацелены на процессы подавления биогенеза РНК растения-хозяина, чтобы способствовать развитию инфекции (Qiao et al., 2013).
В настоящее время очевидно, что РНК-интерференция может эффективно использоваться для достижения желаемой резистентности сельскохозяйственных культур к патогенам путем манипулирования экспрессией генов вирусов, бактерий, грибов, нематод и насекомых (Koch and Kogel, 2014; Kamthan et al., 2015; Морозов и др. 2019). Для синтеза искусственных дцРНК в растениях обычно используют трансгенные растения. Однако использование трансгенных растений попадает под правила, регулирующие работы с генно-модифицированными организмами (ГМО). Многообещающим методом применения дцРНК является опрыскивание растений - спрей-индуцированный сайленсинг генов (spray-induced gene silencing (SIGS)). дцРНК могут либо непосредственно поглощаться патогеном, либо сначала переноситься в растительные клетки, а затем переходить в клетки патогена (Dubrovina and Kiselev, 2019, Морозов и др., 2019).
Сведения по использованию дцРНК в качестве средства профилактики и лечения фитофтороза растений в литературе отсутствуют.
Среди известных препаратов нуклеиновых кислот в нашей стране близким аналогом к заявленному изобретнию, основанному на механизме действия дцРНК, является препарат для борьбы с личинками металловидки серой на основе нуклеиновой кислоты, с использованием короткого (18-ти членного) одноцепочечного антисмыслового фрагмента генома бакуловируса из консервативного домена RING гена IAP вируса ядерного полиэдроза металловидки серой 5'-CGACATGACCGCAAGGTA-3'. При наружной обработке личинок насекомого раствором данного фрагмента проявляется достоверное инсектицидное действие (Оберемок В.В. RU 2645258).
Аналогичным действием обладают дцРНК, комплементарные участкам отдельных генов патогена, в частности, участку гена HXTI ржавчинных грибов сои. ДцРНК, в данном случае, представляет собой нуклеотидную последовательность, идентичную последовательности мРНК длиной 18 нуклеотидов, транскрибируемой с гена HXTI. Для борьбы с ржавчиной сои дцРНК наносится на почву, где растут или способны расти растения, на листья и/или плоды/семена растений сои. (Байер Кю A., RU 2018106970). ДцРНК также используется для ингибирования экспрессии одного или более генов-мишеней у жесткокрылого паразита Diabrotica spp., что приводит к ингибированию его роста (Монсанто текнолоджи ЛЛС (US), RU2478710 С2).
Наиболее близким аналогом к раскрытому решению является изобретение по патенту ЕА 028662, где приводится группа изобретений, связанный с приданием растению устойчивости к оомицетам путем ингибирования гена сахаропиндегидрогинезы. Отличие раскрытого решения состоит в использовании иных генов в составе экспрессирующих кассет, соответственно продуцирующих дцРНК иной последовательности. В уровне техники практически отсутствуют какие-либо обобщенные сведения, позволяющие предсказать эффективные комбинации генов-мишеней, условия обработки и возможную величину эффекта. Применение дцРНК к комплексу генов, ответственных как за разные патогенетические свойства фитофторы, так и непосредственно к генам домашнего хозяйства, для защиты растений от P. Infestans, неизвестно из уровня техники и не применялось ранее для создания защитных композиций. Эффективность использованных в раскрытом решении комбинаций дцРНК различной направленности не публиковалась в открытых источниках. Эспериментальным путем были подобраны наиболее эффективные комбинации последовательностей интерферирующих дцРНК и показано защитное действие композиций на их основе, таким образом, подтвержден новый технический результат.Выбор длины вводимых в клетку дц РНК обусловлен тем фактом, что наиболее эффективными в индукции РНК интерференции являются специфические дцРНК длиной от 300 до 1000 пар нуклеотидов (п.н.) (Dubrovina, Kiselev, Int. J. Mol. Sci. 2019, 20, 2282; doi:10.3390/ijms20092282). Попадая в клетку, такие дцРНК узнаются компонентами системы РНК интерференции растения, в результате чего образуется набор разнообразных коротких миРНК, комплементарных РНК-мишени, что полностью воспроизводит процесс, происходящий в естественных условиях. Вероятность наличия в подобном наборе высокоэффективных миРНК существенно выше, чем при использовании искусственно синтезированных миРНК. D В целевой клетке растения процесс РНК-интерференции начинается с действия фермента Dicer-Like (DCL), который разрезает длинные молекулы вирусной или клеточной двуцепочечной РНК на короткие фрагменты порядка 21-25 нуклеотидов, которые традиционно называют также siRNA (small interfering RNA). Одну из двух цепочек каждого фрагмента называют «направляющей», т.к. эта одноцепочечная РНК далее включается в состав комплекса RISC. В результате активности этого белкового комплекса короткий одноцепочечный фрагмент РНК образует водородные связи с комплементарной последовательностью молекулы информационной РНК (геномной РНК вируса или клеточной мРНК) и вызывает разрезание последней белком комплекса RISC, который назван Argonaute (AGO). Таким образом, обеспечивается высокая специфичность разрезания. Таким образом, введение в растительную клетку синтезированной дцРНК по изобретению приводит к целому каскаду событий, результатом которых и является подавление (сайленсинг) работы соотвествующих генов P. Infestans. Авторы изобретения провели биоинформационный анализ генома P. Infestans. И проведели отбор генов P. infestans для создания эксперессирующих конструкций.
Критериями отбора были выбраны (1) наличие данных о необходимости кодируемого геном белка для жизненного цикла, инфекционности и патогенности P. infestans и (2) наличие экспериментальных данных о снижении инфекционности/патогенности Р. infestans при снижении уровня экспрессии данного гена. Отобраны консервативные гены патогена, необходимые для его роста или вирулентности, что снижает вероятность мутаций в этих важных генах, необходимых для сохранения жизненно важных функций патогена. На основании результатов анализа в качестве целевых мишеней выбраны 12 генов домашнего хозяйства, при нарушении работы которых фитофтора погибает или останавливается в развитии, и 12 генов, кодирующих эффекторы патогенности P. infestans, участвующие в различных стадиях развития гриба и угнетение экспрессии которых замедляет развитие фитофторы (Таблица 1).
В результате удачного выбора 12 генов домашнего хозяйства, существенных для жизненного цикла фитофторы, и 12 генов, кодирующих белки-эффекторы, ответственные за патогенность и вирулентность (эффекторные гены) P. Infestans, был получен основной технический результат, обеспечиваемый изобретением, а именно ингибирование развития патогена P. infestans на листьях растений картофеля в течение не менее 7 дней после обработки вводной композицией, содержащей одну из экспериируемых искусственными конструкциями коплексных дцРНК, где дцРНК выбран из группы транскриптов: SEQ ID 9 -SEQ ID 16.
Для осуществления способа по изобретению необходимо проделать следующие операции: получить генетические конструкции, представляющие собой объединенные группами по три 24 фрагмента генов-мишеней, в составе 8 экспрессирующих кассет; с использованием данных генетических конструкций синтезировать in vitro препараты восьми дцРНК, так называемых коктейлей, или комплексных дцРНК, которые будут введены в состав водных композиций для защиты растения от фитофтороза; поверхности листа растения и водного раствора дцРНК привести в контакт друг с другом посредством опрыскивания растения водной композицией, вследствие чего дцРНК будут поглощены непосредственно патогеном P. infestans или опосредованно через клетки растений, в которые доставляется дцРНК
Ингибирование развития патогена P. infestans на листьях растений достигнуто за счет подбора серии эффективных генов-мишеней двух типов, а именно генов домашнего хозяйства, существенных для жизненного цикла фитофторы, и генов, ответственных за патогенность и вирулентность (гены белков-эффекторов), клонирования фрагментов отобранных генов в составе единой последовательности/кассеты по три фрагмента для каждого типа генов, синтеза специфических дцРНК in vitro и опрыскивания полученными препаратами с подобранными концентрациями листьев растений, зараженных P. infestans.
Опрыскивание листьев растений картофеля линии 12-12-8 водным раствором дцРНК в количестве 100 мкл препарата с концентрацией 100 нг/мкл на 1 лист приводит к ингибированию развития патогена P. infestans, предварительно нанесенного на лист, которое оценивалось по площади поражения листьев в диапазоне от 2,0 до 10 раз по сравнению с контрольными листьями. Значение 100 нг/мкл является заведомо избыточным, минимально необходимая концентрация дцРНК в композиции может варьировать в зависимости от направленности дцРНК, при этом минимальное значение для сохранения эффективности может быть достигнуто путем простого титрования композиции с оценкой ее эффективности.
Методы осуществления.
1. Получение генетических конструкций, содержащих фрагменты генов P. infestans.
Всего было получено восемь конструкций, включающих кассеты, которые содержат слитые фрагменты ДНК трех различных генов-мишеней P. infestans (Таблица 1). Последовательности фрагментов трех генов P. infestans были синтезированы и клонированы в вектор pAL2-T (фиг. 1). Для подтверждения соответствия клонированной последовательности специфическая вставка в полученной конструкции была секвенирована.







2. Синтез дцРНК in vitro.
На первом этапе, используя вектор pAL2-T с целевой вставкой, проводили две отдельные полимеразные цепные реакции с праймерами несущими Т7 промотеры: M15_T7_F TAATACGACTCACTATAGGCATGGCGGCCGCG, M15_R TCGACCTGCAGGTCGAATTC и M15_F CATGGCGGCCGCG, M15_T7_R TAATACGACTCACTATAGGTCGACCTGCAGGTCGAATTC. Полученные ПЦР-продукты разделяли в агарозном геле методом электрофореза и очищали.
На следующем этапе проводили две отдельные реакции транскрипции на синтезированных ПЦР-продуктах в качестве матрицы с помощью набора производства New England Biolab - HiScribe™ T7 High Yield RNA Synthesis Kit в соответствии с протоколом производителя, в результате которых были получены две одноцепочечные РНК (оцРНК). Транскрипционную смесь, содержащую следующие компоненты: реакционный буфер, четыре рибонуклеотида в концентрациях по 10 мМ, Т7 РНК полимеразу и специфическую ДНК, инкубировали в течение 16 часов. После окончания реакции в реакционную смесь вносили ДНКазу I (DNase I, RNase-free 1000 Unit, Thermo Scientific) для того, чтобы избавиться от ДНК в реакционной смеси, инкубировали при 37°С в течение 15 мин. и инактивировали ДНКазу экстракцией фенолом/хлороформом (или нагреванием до 70°С в течение 10 мин). Полученные транскрипты (оцРНК) очищали путем переосаждения этанолом в присутствии ацетата натрия. После осаждения РНК, промывания и высушивания осадка РНК на воздухе, его растворяли в соответствующем объеме воды, свободной от нуклеаз.
Растворы соответствующих комплементарных оцРНК смешивали, нагревали до 95°С в течение 10 мин на водяной бане и охлаждали до комнатной температуры пассивным способом. Во время охлаждения происходит процесс "отжига" комплементарных оцРНК друг на друга с получением дцРНК. Концентрацию полученной дцРНК измеряли с помощью спектрофотометра Nanodrop 2000 (Thermo Scientific). Приготовлены 8 препаратов, содержащие дцРНК для салейсинга 24 генов фитофторы (фиг. 2).
Пример 1. Влияние дцРНК на развитие инфекции фитофторы на листьях восприимчивой линии картофеля.
Ингибирующее действие дцРНК испытывали на отделенных листьях восприимчивой к фитофторозу селекционной линии картофеля 12-12-8 (селекция ООО «ДГТ»). Стерильные пробирочные растения линии 12-12-8 высаживались в почву, где подращивались до стадии 6-8 настоящих листьев. Для проведения тестирования листья 3-4-го яруса отделялись от растения, помещались во влажный бокс в термостат при температуре 11°С, где они охлаждались в течение 2-3 часов, после чего их инокулировали суспензией фитофторы (на 1 лист растения наносили 100 мкл суспензии фитофторы концентрацией 104-5 зооспорангиев/мл). Зараженные фитофторой листья инкубировали во влажном боксе одни сутки при 11°С, после чего листья обрабатывали препаратами дцРНК (на 1 лист наносили 100 мкл препарата концентрацией 100 нг/мкл). Обработанные препаратами дцРНК листья картофеля инкубировались во влажном боксе при комнатной температуре до появления симптомов заражения. Ингибирующий эффект дцРНК оценивался визуально и с помощью количественного анализа цифровых изображения листьев программой Leaf Doctor https://apsiournals.apsnet.org/doi/pdfplus/10.1094/PDIS-03-15-0319-RE в динамике по площади некротических пятен, развивающихся на поверхности листьев картофеля на 5,6 и 7 день после инфицирования (дпи), выраженной в процентах от общей площади листьев. В каждом варианте было протестировано 13-15 листьев. Было проведено три независимых эксперимента (3 биологические повторности). На фигуре 3 показаны результаты эксперимента (средние значения 3-х биологических повторности). Статистически достоверное снижение площади поражения листьев фитофторозом по сравнению с контролем было выявлено во всех вариантах, где листья были обработаны конструкциями дцРНК. Фигура 4 иллюстрирует внешний вид листьев на 7-ой день эксперимента.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Общество с ограниченной ответственностью "международная лаборатория "Резистом"
<120> Интерферирующая дцРНК для защиты растений от фитофтороза
<140> RUPCT/2021/05044
<141> 2021-12-21
<150> PCT/RU2021/050444
<151> 2021-12-21
<150> RU2020143919
<151> 2020-12-30
<160> 16
<170> BiSSAP 1.3.6
<210> 1
<211> 919
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 1
tcgaggatta cgaggaggtg agtgcggaga ccgccgaggg cgagggtgag gaggaggagc 60
tgggcgagga gtactaggca tactcatttt ctcagtacag gcatccactc tttcaatgat 120
gctagctaaa agcttgtgtt ggaagaatga aacactgtag ttccatcttc tttctcaatg 180
aggtcgccta cctttgtcaa gcttctacta cctgtttacc gcccctcagt agccaaacgt 240
tgttgcaagt cagctaaaga agggaggcga tcaacttgtt caacatctcc aataacagac 300
aacggatcca agaagtcggc ctccaaggct ggctaccagc tgccgcgcca ccagatgaac 360
aacgccaacc tgggccgtct gattagctct gacgagatcc agtcggttgt gcgtgccggc 420
aagtaccaga agcaccgtcg cttccagaag aagaacccgc ttcgcaacct gggtgccatg 480
gtcaagctca acccgtacac gctggtggcc cgtcgcgctg agcttcgtgc tgaggccctt 540
cgtgccgaga agaaggcggc tgtggtcggc aagaaccgca agaacacgtg caagacggac 600
cccaagcaga tctggagtcc gcaaggtata tgacgtcact gccttcctgg acgaccaccc 660
gggcggcccg gagattatgg tggacgtggc tggtcaggac gccaccgacg agttcgaaga 720
catcggccac tcgaacgacg cacgtgcgca acttaagcag ttcgagatcg gcaagatcaa 780
gggcgatgcc aagaaggagg caaccgctac gaccagcgct ggtggctcta aggtctcggc 840
tagcgggcga caggatatta gcggtgacaa cggtccgctc tacgccgtac tggcggctgc 900
ggtggtcttc acctctaga 919
<210> 2
<211> 920
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 2
ctcgagtgtg aaggtcaaga ggctgcttcg cgcgctcacg acgataaaga cgctcgcgac 60
catgcacgtt ggtgctttca gcaagcgatc cgctgcttca gtatctgtct atccaacttt 120
ttcttggaga ggaagcacag acattcgctg tctgagaagg agttggagca gttcatttac 180
gacgtcgtgg ggctgttgaa ggagacggtg cctcgtggtc attacgatca gttgctgggc 240
ttcttgtgga ctgtggctac gcaggcattg agtcacttgg cgcatcatga cggcgggcaa 300
agcttcggat ccatcgcccc gcgtccggcc gctggtctac tgcgccccgc tgtgcactgc 360
cccacgatta agtacggctc gaaggtccgt gctggcaggg gtttcaccct ggaggagctg 420
aaggaggctg gcattaaccg caagcaggcc atcagcatcg gcattgccgt cgacttccgc 480
cgcaccaaca agtcggttga gtcgcttcag gccaacgtgc accgcctcaa ggcctacaag 540
gctaagcttg tggtgttccc gcgcaagagc aacaagccca agaacggcga tgcccccgct 600
gaggacgtga gatctaaatt accggtggcc cttggtacaa tgagcaggag ttcgatcacg 660
tatttattga cacactcagc acgttcgtgt acgaagtgat caaggcctcg ggaatgagca 720
cgttgaacgc gattacagac aaggtgcatg cctcgggtat ttccaaggtg gcgctgggtc 780
cagaagagat ccgttccatc atccagacgc tcatgtacga cggtcgcgtc gaggaagttc 840
gctctgtgcg tctcacgcct ggtgcatctc acgaggtcaa gtacaaagtt tcgcagcaga 900
tcacgacctt taactctaga 920
<210> 3
<211> 917
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 3
ctcgagctca ttctctcggc tgctcgcaag gctgaggctc gtggtcgtcc gcatgatgcg 60
ttcgctctat tgaagagcgc aggcgacatt gaaggcgtta ttttgctgct gaactcgcag 120
ctcagctcga cgttgtcagc cacacgacca gagcgtgagg aatggttccg tgaggccaag 180
gagtttgccg agaagtggat gcgcttccct tgggtccaga cgattgccaa ccgacatgcg 240
cgtacagctg cgattgcctt ccagacactc ctgaacatca gtatcttcct ggagattttc 300
gaggatccgc gtattgtgtc gctgtatgct gagaagaacg acctgcagtt cgctgtccct 360
ggtggactga tcggtgtagg aacgcacatt gaccccacat tgacgcgttc ggatcgtctg 420
gtgggtcagg tgctgggtct caagggcagt ctgccgcacg tgtttacgga gctggaaatc 480
aacttctacc tgcttaagcg tctgctcggt gtcaagactc aggaaggtag caaggcctcc 540
aaggtgcaga agctgtcgaa ggccgaggtg ctcatggtga acattggctc cacagccacc 600
ggtggcagat ctggcatcca cgtgcacgag ctcgaattcc ccgacggcga atcacccgac 660
ccggagatcc tggatcaatg gctcgatcta gtcgagacgt gctttaaaga caactctatt 720
gactccaaga acaataagtc gattgcggtg cattgtgtgg caggacttgg ccgagcccct 780
gttcttgtag ccatcgcgtt gatcgagtac ggactggacc ccatcaatgc cgtagagcat 840
atccgcaagt ttcgccgtgg ggccatcaac ctgcgccagc tcaagtatct ggagaagtac 900
caacctcggc gtctaga 917
<210> 4
<211> 923
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 4
ctcgagtgat cgacgtggag ggcgctggtc tgagtgacat ggtctttgac atgtgcatga 60
aggcagacat cgatctacgc acggagttct tcaagaacgt cgtgctgtct ggtggttcca 120
gcatgtaccc gggtctgccc agtcgtctgg agaaggatat taagcaaaga tacctcacgg 180
atgtgctcaa gggcgacaag agtcgactga gcaagttccg cttgcgcatt aacgacccac 240
ctcgtcgcaa acatctggtc ttccagggtg gcagtgtctt ggctgatgtc atgaaggaca 300
acgacggatc cattgccacg cccgatgtga tgcccttggt gggtcgcgtt gctcgaattc 360
ttggccctcg cggcttgatg cccaacccga agttggggac ggtgacgcag gaggttggtg 420
acgccatcgc ggcggcgcgt ggtggccagg tggagtttcg tgctgagaag aagggtatca 480
ttcacgccgg cgtgggcaag atgagcttct cggaggaggc actactggag aacgtgcgtg 540
ctttcatggt cgcactcagc gatgccaagc cggaaggcgc aaagggcaag tacattaagg 600
ctgctcacct gagatctgct ggacctttgt gtgatgaacc ggtatggggc gtcgcgttca 660
tcgttgaaga cgtcgttttc catgagaaaa gcgacgatgt gtcagatgaa gaggcgagca 720
agtacggacc gcttagcgga caggtaatct ccactatgcg gaccacttgc ctcatgtcct 780
ttgtgaagca gcctgtgcgg ttagtagagg ccgtgtatga gtgcacagtg cagtgtcaag 840
ccgagcagct cggcaagttg tacagtgtca tctcgaagcg acgaggcgat atctactcgg 900
aagagttgtc cgatgggtct aga 923
<210> 5
<211> 916
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 5
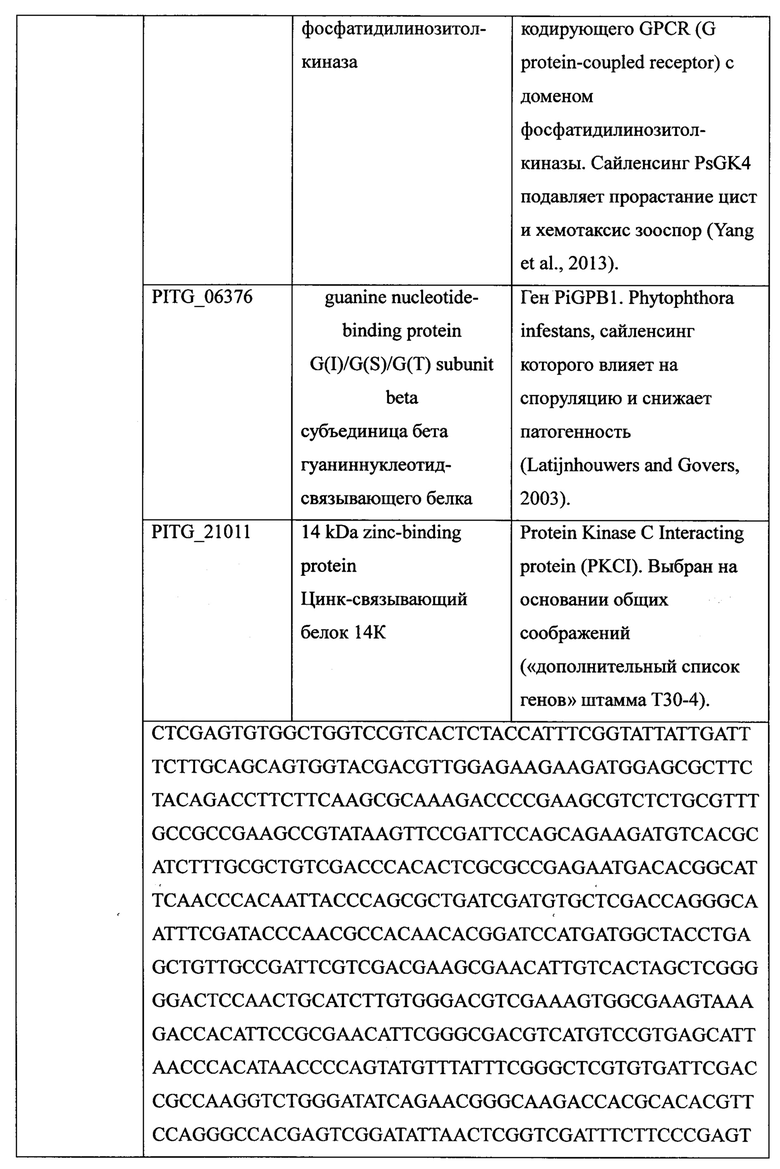
ctcgagtgtg gctggtccgt cactctacca tttcggtatt attgatttct tgcagcagtg 60
gtacgacgtt ggagaagaag atggagcgct tctacagacc ttcttcaagc gcaaagaccc 120
cgaagcgtct ctgcgtttgc cgccgaagcc gtataagttc cgattccagc agaagatgtc 180
acgcatcttt gcgctgtcga cccacactcg cgccgagaat gacacggcat tcaacccaca 240
attacccagc gctgatcgat gtgctcgacc agggcaattt cgatacccaa cgccacaaca 300
cggatccatg atggctacct gagctgttgc cgattcgtcg acgaagcgaa cattgtcact 360
agctcggggg actccaactg catcttgtgg gacgtcgaaa gtggcgaagt aaagaccaca 420
ttccgcgaac attcgggcga cgtcatgtcc gtgagcatta acccacataa ccccagtatg 480
tttatttcgg gctcgtgtga ttcgaccgcc aaggtctggg atatcagaac gggcaagacc 540
acgcacacgt tccagggcca cgagtcggat attaactcgg tcgatttctt cccgagtggc 600
aacgcagatc tccaagattg cgtatgagga cgagcagtgc ctcgcatttc acgacgtgaa 660
cccgcaagcg cccgtgcaca ttctgcttat ccccaagaag cgcgacggac ttacgcagct 720
cgcgcacgcc gaggagcgcc acgaatccat cctgggccat ctgctctaca ctgccaaaca 780
ggtcgctaac cagcagaact tagacaaggg tttccgtatc gttattaacg atggggcgga 840
cggctgccag tcggtattcc acctacattt gcaccttctt ggagggcgca agttgggctg 900
gccccctggg tctaga 916
<210> 6
<211> 920
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 6
ctcgagacaa gaagcgtgaa tcacttgcat ccaagatcga tgaggtagct cgcaaccaga 60
tttggcgcga gcagctcaag accgagtatg agatggaaag tgcactgaca ccgttccagc 120
tcaacccgaa gacactaagc tcgatcactc taaagccaac ccagactcac ccagaagact 180
ttggtaaagt acaagatgac cagggaacac gagatctcgc tgcaaagctg cgtgaagtga 240
ccaagagacc cacagaaaaa caagccctac cgatgacaga agctcagcgt gtcgggtggc 300
ttcaggatcc agtgaaggcg acaaggagct cgcccttgag gccacccacg acgtcgtgac 360
cgagttcccc tcgacctacg agttccatta tggtcttttg accctgtccg acgatggcag 420
tgaacccaag atgaatgcca aacaggacat cgtgtcctac aacggtgtgt cggtggaggc 480
tgactcctcg tccgatgttt ccacggagac tactgaggcc ccgaccacgc agaacgagac 540
ccctgccacc cagaacgaga ttcccgccac caagacgggc atcgtcaaga gctcagatgg 600
tggctgcgag atctggagtg ttacaccgtg acttgaagcc aagtaatcta ctcatcaatt 660
cagactgtca actcaagatt tgtgatcttg gactggcacg ttccaaggaa gcagacgacg 720
tggggatgac ggaatatgtg gtgacacgat ggtaccgtgc gcccgagctg ttgttaggta 780
gtgcgtatgg cgacggagtg gatctctggg ctgcaggatg cattttcgcc gagatgctgg 840
gacgcaaacc tttgtttccg ggtgagacgt atgtgcacca actgcaactc attatgaacg 900
tgttgggtgt accgtctaga 920
<210> 7
<211> 918
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 7
ctcgagaagt ggcatatcgg ctgtccggac tgctgggacg ctcagaaaat cgcctccgca 60
ctgaatgact ttgtcatctg cgtcgagatg ctgggctttg ccattgccca ccactacgcc 120
ttcgcgattg aagacttttt gtcgccgtca ggtacggcag gtgttagtgt gccgtcttcg 180
aacgtcaagg caccactgct ggccaatttt atggacgcta tcaacgtgac ggacgtgtcg 240
acagacctca agaactcccg gaacgagatt ctcaccaaga aacaggcgct ggctgccaag 300
ttcggatccc ggctacaacg gtgacacggg cgtcattaac atcggcgtgg acgcgaaagc 360
cattttcaag acgcaaaaca acttccgtcg ctccgagttg gtgcagaaca ttgcggccaa 420
caccaagggc accacatttt ttcgcaccag cgtcatgaag gaggaggcgt tcttgaaccc 480
ttatgcttgg cagatgatct tcccggagtc gcacatcttc gagatccgtg tggatgcctc 540
ggctagtccc gctaagatta tctacctgaa caacggcact tgggacgcca agtgggagac 600
tgagttcaga tctgacactc caaggactaa accgccctag gggtaactta acgacattcg 660
ctgcggacgc ttgtgtcgtg aacatgggta tcattgatat tttgaccccc tggtctttca 720
agaaaagcct tgaacgctgg gtgcgagtgc gactacagtg tcgtgacgcg aaggggattt 780
cgtgcatgaa acccattccg tatgcagacc gcttccgtcg taatgtgatt gatactgtca 840
tttttggtcg tcggctaggc tctaagagac gtcatccgga aaagcagcaa gaagagtcga 900
ttatggtgga tttctaga 918
<210> 8
<211> 911
<212> DNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 8
ctcgagaagc gcaacgtcac attggtagtg cgtctcaatg acaaacagta cgacgagaag 60
aagttcctgt cggcgggcat cgatcacatt gacttgatct acccggacgg cacaaatgcg 120
cctatgccga tcttaatgaa gttcattgaa gcttgcgaga agactcccgg agccgtggcg 180
gtgcactgca aagctgggct tggacgcaca ggtacctgta tcggcgcata catgatgaag 240
caccacttgt tctcggctca cgagctcatc gggtggctgc gtctgtgccg accgggtagt 300
gtcaggatcc gttcgagaaa atcgtcctgg cgccgaccga agacacggag gatgctgctg 360
ccgtgctggc tagtgatatt cgtgtggaca gtcacgacca gtggctggaa aagctggaga 420
aggccgccgg cgctggtctg gaagagctgc agaagcaaag tattgaagcc ggcaagaagg 480
cggagcaggc agcagtcgcg cgtcgcgctg ccgctgatcg ccgtaaacgt gaagagaagg 540
acgtgagctc caagcacctg cagaacttct tcaacaacct gctcagccgg cctgagaaga 600
ccagatctat gttcgcagat tcgcctccag acgctctgga tttactgcag aagatgctgg 660
tgattgaccc gaataagcgg attagtgtgg acgaggcgct ggcccatccg tacttggctg 720
cgatccggaa tgtggaggac gagacgaccg ccacttcgag cttcgatttt gactttgaga 780
acgagaaatt gacgaaaccc gtgctgcaga gactgatctg ggacgagatg aggcatttcc 840
accctgaagt gggcgacgag acagcgacgg agggagatga cagcagtgtc gctaccacgc 900
aggcttctag a 911
<210> 9
<211> 919
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 9
ucgaggauua cgaggaggug agugcggaga ccgccgaggg cgagggugag gaggaggagc 60
ugggcgagga guacuaggca uacucauuuu cucaguacag gcauccacuc uuucaaugau 120
gcuagcuaaa agcuuguguu ggaagaauga aacacuguag uuccaucuuc uuucucaaug 180
aggucgccua ccuuugucaa gcuucuacua ccuguuuacc gccccucagu agccaaacgu 240
uguugcaagu cagcuaaaga agggaggcga ucaacuuguu caacaucucc aauaacagac 300
aacggaucca agaagucggc cuccaaggcu ggcuaccagc ugccgcgcca ccagaugaac 360
aacgccaacc ugggccgucu gauuagcucu gacgagaucc agucgguugu gcgugccggc 420
aaguaccaga agcaccgucg cuuccagaag aagaacccgc uucgcaaccu gggugccaug 480
gucaagcuca acccguacac gcugguggcc cgucgcgcug agcuucgugc ugaggcccuu 540
cgugccgaga agaaggcggc uguggucggc aagaaccgca agaacacgug caagacggac 600
cccaagcaga ucuggagucc gcaagguaua ugacgucacu gccuuccugg acgaccaccc 660
gggcggcccg gagauuaugg uggacguggc uggucaggac gccaccgacg aguucgaaga 720
caucggccac ucgaacgacg cacgugcgca acuuaagcag uucgagaucg gcaagaucaa 780
gggcgaugcc aagaaggagg caaccgcuac gaccagcgcu gguggcucua aggucucggc 840
uagcgggcga caggauauua gcggugacaa cgguccgcuc uacgccguac uggcggcugc 900
gguggucuuc accucuaga 919
<210> 10
<211> 920
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 10
cucgagugug aaggucaaga ggcugcuucg cgcgcucacg acgauaaaga cgcucgcgac 60
caugcacguu ggugcuuuca gcaagcgauc cgcugcuuca guaucugucu auccaacuuu 120
uucuuggaga ggaagcacag acauucgcug ucugagaagg aguuggagca guucauuuac 180
gacgucgugg ggcuguugaa ggagacggug ccucgugguc auuacgauca guugcugggc 240
uucuugugga cuguggcuac gcaggcauug agucacuugg cgcaucauga cggcgggcaa 300
agcuucggau ccaucgcccc gcguccggcc gcuggucuac ugcgccccgc ugugcacugc 360
cccacgauua aguacggcuc gaagguccgu gcuggcaggg guuucacccu ggaggagcug 420
aaggaggcug gcauuaaccg caagcaggcc aucagcaucg gcauugccgu cgacuuccgc 480
cgcaccaaca agucgguuga gucgcuucag gccaacgugc accgccucaa ggccuacaag 540
gcuaagcuug ugguguuccc gcgcaagagc aacaagccca agaacggcga ugcccccgcu 600
gaggacguga gaucuaaauu accgguggcc cuugguacaa ugagcaggag uucgaucacg 660
uauuuauuga cacacucagc acguucgugu acgaagugau caaggccucg ggaaugagca 720
cguugaacgc gauuacagac aaggugcaug ccucggguau uuccaaggug gcgcuggguc 780
cagaagagau ccguuccauc auccagacgc ucauguacga cggucgcguc gaggaaguuc 840
gcucugugcg ucucacgccu ggugcaucuc acgaggucaa guacaaaguu ucgcagcaga 900
ucacgaccuu uaacucuaga 920
<210> 11
<211> 917
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 11
cucgagcuca uucucucggc ugcucgcaag gcugaggcuc guggucgucc gcaugaugcg 60
uucgcucuau ugaagagcgc aggcgacauu gaaggcguua uuuugcugcu gaacucgcag 120
cucagcucga cguugucagc cacacgacca gagcgugagg aaugguuccg ugaggccaag 180
gaguuugccg agaaguggau gcgcuucccu uggguccaga cgauugccaa ccgacaugcg 240
cguacagcug cgauugccuu ccagacacuc cugaacauca guaucuuccu ggagauuuuc 300
gaggauccgc guauuguguc gcuguaugcu gagaagaacg accugcaguu cgcugucccu 360
gguggacuga ucgguguagg aacgcacauu gaccccacau ugacgcguuc ggaucgucug 420
gugggucagg ugcugggucu caagggcagu cugccgcacg uguuuacgga gcuggaaauc 480
aacuucuacc ugcuuaagcg ucugcucggu gucaagacuc aggaagguag caaggccucc 540
aaggugcaga agcugucgaa ggccgaggug cucaugguga acauuggcuc cacagccacc 600
gguggcagau cuggcaucca cgugcacgag cucgaauucc ccgacggcga aucacccgac 660
ccggagaucc uggaucaaug gcucgaucua gucgagacgu gcuuuaaaga caacucuauu 720
gacuccaaga acaauaaguc gauugcggug cauugugugg caggacuugg ccgagccccu 780
guucuuguag ccaucgcguu gaucgaguac ggacuggacc ccaucaaugc cguagagcau 840
auccgcaagu uucgccgugg ggccaucaac cugcgccagc ucaaguaucu ggagaaguac 900
caaccucggc gucuaga 917
<210> 12
<211> 923
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 12
cucgagugau cgacguggag ggcgcugguc ugagugacau ggucuuugac augugcauga 60
aggcagacau cgaucuacgc acggaguucu ucaagaacgu cgugcugucu ggugguucca 120
gcauguaccc gggucugccc agucgucugg agaaggauau uaagcaaaga uaccucacgg 180
augugcucaa gggcgacaag agucgacuga gcaaguuccg cuugcgcauu aacgacccac 240
cucgucgcaa acaucugguc uuccagggug gcagugucuu ggcugauguc augaaggaca 300
acgacggauc cauugccacg cccgauguga ugcccuuggu gggucgcguu gcucgaauuc 360
uuggcccucg cggcuugaug cccaacccga aguuggggac ggugacgcag gagguuggug 420
acgccaucgc ggcggcgcgu gguggccagg uggaguuucg ugcugagaag aaggguauca 480
uucacgccgg cgugggcaag augagcuucu cggaggaggc acuacuggag aacgugcgug 540
cuuucauggu cgcacucagc gaugccaagc cggaaggcgc aaagggcaag uacauuaagg 600
cugcucaccu gagaucugcu ggaccuuugu gugaugaacc gguauggggc gucgcguuca 660
ucguugaaga cgucguuuuc caugagaaaa gcgacgaugu gucagaugaa gaggcgagca 720
aguacggacc gcuuagcgga cagguaaucu ccacuaugcg gaccacuugc cucauguccu 780
uugugaagca gccugugcgg uuaguagagg ccguguauga gugcacagug cagugucaag 840
ccgagcagcu cggcaaguug uacaguguca ucucgaagcg acgaggcgau aucuacucgg 900
aagaguuguc cgaugggucu aga 923
<210> 13
<211> 916
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 13
cucgagugug gcugguccgu cacucuacca uuucgguauu auugauuucu ugcagcagug 60
guacgacguu ggagaagaag auggagcgcu ucuacagacc uucuucaagc gcaaagaccc 120
cgaagcgucu cugcguuugc cgccgaagcc guauaaguuc cgauuccagc agaagauguc 180
acgcaucuuu gcgcugucga cccacacucg cgccgagaau gacacggcau ucaacccaca 240
auuacccagc gcugaucgau gugcucgacc agggcaauuu cgauacccaa cgccacaaca 300
cggauccaug auggcuaccu gagcuguugc cgauucgucg acgaagcgaa cauugucacu 360
agcucggggg acuccaacug caucuugugg gacgucgaaa guggcgaagu aaagaccaca 420
uuccgcgaac auucgggcga cgucaugucc gugagcauua acccacauaa ccccaguaug 480
uuuauuucgg gcucguguga uucgaccgcc aaggucuggg auaucagaac gggcaagacc 540
acgcacacgu uccagggcca cgagucggau auuaacucgg ucgauuucuu cccgaguggc 600
aacgcagauc uccaagauug cguaugagga cgagcagugc cucgcauuuc acgacgugaa 660
cccgcaagcg cccgugcaca uucugcuuau ccccaagaag cgcgacggac uuacgcagcu 720
cgcgcacgcc gaggagcgcc acgaauccau ccugggccau cugcucuaca cugccaaaca 780
ggucgcuaac cagcagaacu uagacaaggg uuuccguauc guuauuaacg auggggcgga 840
cggcugccag ucgguauucc accuacauuu gcaccuucuu ggagggcgca aguugggcug 900
gcccccuggg ucuaga 916
<210> 14
<211> 920
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 14
cucgagacaa gaagcgugaa ucacuugcau ccaagaucga ugagguagcu cgcaaccaga 60
uuuggcgcga gcagcucaag accgaguaug agauggaaag ugcacugaca ccguuccagc 120
ucaacccgaa gacacuaagc ucgaucacuc uaaagccaac ccagacucac ccagaagacu 180
uugguaaagu acaagaugac cagggaacac gagaucucgc ugcaaagcug cgugaaguga 240
ccaagagacc cacagaaaaa caagcccuac cgaugacaga agcucagcgu gucggguggc 300
uucaggaucc agugaaggcg acaaggagcu cgcccuugag gccacccacg acgucgugac 360
cgaguucccc ucgaccuacg aguuccauua uggucuuuug acccuguccg acgauggcag 420
ugaacccaag augaaugcca aacaggacau cguguccuac aacggugugu cgguggaggc 480
ugacuccucg uccgauguuu ccacggagac uacugaggcc ccgaccacgc agaacgagac 540
cccugccacc cagaacgaga uucccgccac caagacgggc aucgucaaga gcucagaugg 600
uggcugcgag aucuggagug uuacaccgug acuugaagcc aaguaaucua cucaucaauu 660
cagacuguca acucaagauu ugugaucuug gacuggcacg uuccaaggaa gcagacgacg 720
uggggaugac ggaauaugug gugacacgau gguaccgugc gcccgagcug uuguuaggua 780
gugcguaugg cgacggagug gaucucuggg cugcaggaug cauuuucgcc gagaugcugg 840
gacgcaaacc uuuguuuccg ggugagacgu augugcacca acugcaacuc auuaugaacg 900
uguugggugu accgucuaga 920
<210> 15
<211> 918
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 15
cucgagaagu ggcauaucgg cuguccggac ugcugggacg cucagaaaau cgccuccgca 60
cugaaugacu uugucaucug cgucgagaug cugggcuuug ccauugccca ccacuacgcc 120
uucgcgauug aagacuuuuu gucgccguca gguacggcag guguuagugu gccgucuucg 180
aacgucaagg caccacugcu ggccaauuuu auggacgcua ucaacgugac ggacgugucg 240
acagaccuca agaacucccg gaacgagauu cucaccaaga aacaggcgcu ggcugccaag 300
uucggauccc ggcuacaacg gugacacggg cgucauuaac aucggcgugg acgcgaaagc 360
cauuuucaag acgcaaaaca acuuccgucg cuccgaguug gugcagaaca uugcggccaa 420
caccaagggc accacauuuu uucgcaccag cgucaugaag gaggaggcgu ucuugaaccc 480
uuaugcuugg cagaugaucu ucccggaguc gcacaucuuc gagauccgug uggaugccuc 540
ggcuaguccc gcuaagauua ucuaccugaa caacggcacu ugggacgcca agugggagac 600
ugaguucaga ucugacacuc caaggacuaa accgcccuag ggguaacuua acgacauucg 660
cugcggacgc uugugucgug aacaugggua ucauugauau uuugaccccc uggucuuuca 720
agaaaagccu ugaacgcugg gugcgagugc gacuacagug ucgugacgcg aaggggauuu 780
cgugcaugaa acccauuccg uaugcagacc gcuuccgucg uaaugugauu gauacuguca 840
uuuuuggucg ucggcuaggc ucuaagagac gucauccgga aaagcagcaa gaagagucga 900
uuauggugga uuucuaga 918
<210> 16
<211> 911
<212> RNA
<213> Phytophthora infestans
<220>
<221> source
<222> 1..10
<400> 16
cucgagaagc gcaacgucac auugguagug cgucucaaug acaaacagua cgacgagaag 60
aaguuccugu cggcgggcau cgaucacauu gacuugaucu acccggacgg cacaaaugcg 120
ccuaugccga ucuuaaugaa guucauugaa gcuugcgaga agacucccgg agccguggcg 180
gugcacugca aagcugggcu uggacgcaca gguaccugua ucggcgcaua caugaugaag 240
caccacuugu ucucggcuca cgagcucauc ggguggcugc gucugugccg accggguagu 300
gucaggaucc guucgagaaa aucguccugg cgccgaccga agacacggag gaugcugcug 360
ccgugcuggc uagugauauu cguguggaca gucacgacca guggcuggaa aagcuggaga 420
aggccgccgg cgcuggucug gaagagcugc agaagcaaag uauugaagcc ggcaagaagg 480
cggagcaggc agcagucgcg cgucgcgcug ccgcugaucg ccguaaacgu gaagagaagg 540
acgugagcuc caagcaccug cagaacuucu ucaacaaccu gcucagccgg ccugagaaga 600
ccagaucuau guucgcagau ucgccuccag acgcucugga uuuacugcag aagaugcugg 660
ugauugaccc gaauaagcgg auuagugugg acgaggcgcu ggcccauccg uacuuggcug 720
cgauccggaa uguggaggac gagacgaccg ccacuucgag cuucgauuuu gacuuugaga 780
acgagaaauu gacgaaaccc gugcugcaga gacugaucug ggacgagaug aggcauuucc 840
acccugaagu gggcgacgag acagcgacgg agggagauga cagcaguguc gcuaccacgc 900
aggcuucuag a 911
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная плазмида L4440, обеспечивающая синтез двуцепочечной РНК, комплементарной фрагменту матричной РНК гена inf4 Phytophthora infestans | 2023 |
|
RU2813914C1 |
| МОЛЕКУЛЫ РНК, ВКЛЮЧАЮЩИЕ НЕКАНОНИЧЕСКИЕ ПАРЫ ОСНОВАНИЙ | 2019 |
|
RU2812710C2 |
| КОМПОЗИЦИЯ НА ОСНОВЕ ГИБРИДНОГО РЕКОМБИНАНТНОГО ПОЛИПЕПТИДА ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ООМИЦЕТАМИ | 2021 |
|
RU2786706C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С НУКЛЕОТИДНОЙ ДЕЛЕЦИЕЙ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2817376C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С НУКЛЕОТИДНОЙ ДЕЛЕЦИЕЙ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2814154C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С ТЕТРААЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2817384C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С ТЕТРААЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2817383C2 |
| ГЕН, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К PHYTOPHTHORA INFESTANS (ФИТОФТОРОЗУ) В СЕМЕЙСТВЕ SOLANACEAE | 2003 |
|
RU2361920C2 |
| КЛОНИРОВАНИЕ И ИСПОЛЬЗОВАНИЕ ФУНКЦИОНАЛЬНОГО R-ГЕНА ИЗ SOLANUM CHACOENSE | 2010 |
|
RU2586509C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАСТЕНИЯ КАРТОФЕЛЯ С БИАЛЛЕЛЬНЫМИ МУТАЦИЯМИ В КОДИРУЮЩЕЙ ОБЛАСТИ ГЕНА EDR1 ПРИ ПОМОЩИ ТЕХНОЛОГИИ РЕДАКТИРОВАНИЯ ГЕНОМА РАСТЕНИЙ CRISPR/CAS9 | 2022 |
|
RU2824558C2 |
Изобретение относится к области биотехнологии, молекулярной биологии, фитопатологии и сельского хозяйства и направлено на разработку эффективного средства биологической защиты растений от инфекции оомицетом Phytophthora infestans по механизму РНК интерференции (РНКи). В заявленном изобретении раскрыт комплекс 24 генов-мишеней: 12 генов домашнего хозяйства и 12 генов белков-эффекторов Phytophthora infestans, которые могут быть использованы в качестве мишеней для ингибирования экспрессии по механизму РНКи, на основе скомбинированных последовательностей которых in vitro синтезированы 8 вариантов дцРНК. Опрыскивание листьев растений картофеля водным раствором композиции, содержащей комплекс синтезированных дцРНК, приводит к ингибированию размножения Phytophthora infestans. 2 н. и 2 з.п. ф-лы, 4 ил., 1 табл., 1 пр.
1. Синтезированная молекула дцРНК для сайленсинга по меньшей мере одного гена Phytophtora infestans путем PHK-интерференции, отличающаяся тем, что является фрагментом длиной 300-1000 п.н. от полноразмерной дцРНК, последовательность которой выбрана из списка SEQ ID NO: 9 - SEQ ID NO: 16.
2. Способ защиты растений от Phytophtora infestans путем РНК-интерференции, включающий приведение поверхности листа растения и водного раствора дцРНК в контакт друг с другом посредством опрыскивания, отличающийся тем, что дцРНК имеет длину приблизительно 300-1000 п.н. и является фрагментом полноразмерной дцРНК, последовательность которой выбрана из списка SEQ ID NO: 9 - SEQ ID NO: 16.
3. Способ по п. 2, отличающийся тем, что включает следующие операции:
а) получение по меньшей мере одной экспрессирующей конструкции, в состав которой включена ДНК, кодирующая фрагменты последовательностей генов, выбранных из одной из следующих групп:
PITG_07996, PITG_06995, PITG_08082;
PITG_18244, PITG_04843, PITG_00051;
PITG_00262, PITG_11110, PITG_05251;
PITG_09284, PITG_12193, PITG_05058;
PITG_00460, PITG_06376, PITG_21011;
PITG_03162, PITG_01132, PITG_07274;
PITG_08393, PITG_01131, PITG_05519;
PITG_18578, PITG_01997, PITG_10447;
б) получение с использованием указанной конструкции in vitro препарата дцРНК;
в) приведение поверхности листа растения и водного раствора указанной дцРНК в контакт друг с другом посредством опрыскивания растения.
4. Способ по п. 2, отличающийся тем, что последовательность ДНК в составе экспрессирующей конструкции выбрана из списка SEQ ID NO: 1 - SEQ ID NO: 8.
| IN201811003339 A, 02.08.2019 | |||
| ZHANG M | |||
| et al., Production of dsRNA sequences in the host plant is not sufficient to initiate gene silencing in the colonizing oomycete pathogen Phytophthora parasitica, PLoS One, 2011, vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ВИКТОРОВ А | |||
| Г., Современные подходы к повышению устойчивости растений к вредителям с использованием методов | |||
Авторы
Даты
2023-11-27—Публикация
2020-12-30—Подача