Область техники
Изобретение относится к биохимии, конкретно к биологически активным полипептидам, которые обладают модулирующим действием на участвующие в генерации болевого сигнала клеточные рецепторы и могут найти применение в медицине и научных исследованиях, и способу их получения.
Уровень техники
Изучение и лечение боли являются существенными аспектами улучшения качества жизни пациентов. Лечение боли основывается главным образом на назначении противовоспалительных препаратов, которые могут быть нестероидными противовоспалительными препаратами (НПВП) или стероидными (кортикостероидными) препаратами, антидепрессантов, антиконвульсантов, а также сильных или слабых опиатов. Несмотря на большое количество существующих терапевтических средств, многие виды боли остаются малочувствительными к известным анальгетикам, поэтому разработка новых анальгетических средств с новым механизмом действия, а также разработка эффективных способов их получения являются важной и актуальной задачей.
Из уровня техники известен пептид PT6, модулирующий пуринергическую сигнализацию [RU2650780]. Наряду с этим известны способы получения близкого к PT6 по структуре (гомологичного) пептида PT1, состоящего из 35 аминокислотных остатков и модулирующего активность пуринергических рецепторов Р2Х3. PT1 может быть получен в бактериальной системе экспрессии в лабораторных условиях [Grishin E.V. et al. Novel peptide from spider venom inhibits P2X3 receptors and inflammatory pain // Ann. Neurol., 2010, Vol. 67, p. 680-683; RU2422459; RU2571942]. Известен опытно-промышленный способ получения PT1 [«Способ получения рекомбинантного анальгетического пептида», патент RU2571942]. Он заключается в наработке в штамме Еscherichia coli ER2566 химерного белка DnaB-PT1, который состоит из хитин-связывающего домена из Bacillus circulans, интеина DnaB из Synechocystis sp. и анальгетического пептида РТ1, очистке химерного белка DnaB-PT1 с помощью аффинной хроматографии на хитиновом сорбенте, автокаталитическом расщеплении химерного белка DnaB-PT1 и очистке пептида РТ1 с помощью обращенно-фазовой хроматографии. Недостатком этого способа является сравнительно низкий выход целевого продукта (14,3 мг с 1 л культуры).
Наиболее близким аналогом заявляемого изобретения служит лабораторный способ получения пептида PT6, описанный в RU2650780. Он заключается в наработке в штамме Е. coli BL21(DE3) химерного белка Trx-PT6, который состоит из белка-помощника тиоредоксина и пептида РТ6, очистке химерного белка Trx-PT6 с помощью аффинной хроматографии на сорбенте TALON Superflow Metal Affinity Resin (Clontech), расщеплении химерного белка Trx-PT6 с помощью энтеропептидазы и очистке пептида РТ6 с помощью обращенно-фазовой хроматографии. Недостатком этого способа является низкий выход целевого продукта (5 мг с 1 л культуры). Несмотря на то, что существуют способы получения соединений, модулирующих активность пуринергических рецепторов, эффективность этих способов является довольно низкой.
Раскрытие изобретения
Задачей настоящего изобретения является разработка нового эффективного способа получения пептида РТ6. Пептид PT6 состоит из 31 аминокислотного остатка и имеет аминокислотную последовательность SEQ ID NO 1.
Технический результат заключается в разработке нового эффективного способа получения пептида PT6, который позволяет получить пептид с высоким выходом целевого продукта 82,5 мг с 1 л культуры, причем указанный выход в несколько раз выше, чем при осуществлении уже известных способов получения такого пептида.
Кроме того, технический результат изобретения состоит в:
1) получении химерного белка Trx-РТ6 (SEQ ID NO 2), содержащего белок-помощник тиоредоксин и пептид РТ6, вследствие экспрессии химерного гена в составе векторной конструкции pET-32b-PT6, использованной для создания штамма-продуцента Е. coli BL21(DE3)/pET-32b-PT6;
2) получении рекомбинантного PT6 вследствие расщепления химерного белка Trx-PT1 энтеропептидазой.
Указанный технический результат достигается посредством разработки и осуществления способа получения пептида РТ6 с последовательностью SEQ ID NO 1, включающего:
- проведение контролируемой экспрессии гена химерного белка Trx-РТ6 с последовательностью SEQ ID NO 2 в составе векторной конструкции на основе вектора pET-32b (Novagen), причем указанная конструкция содержит ген химерного белка Trx-РТ6 и позволяет производить контролируемую экспрессию слитного гена, в штамме-продуценте Е. coli BL21(DE3) с внедренной векторной конструкцией, с использованием в качестве индуктора изопропил-β-D-1-тиогалактопиранозида,
- разрушение клеток штамма-продуцента с образованием лизата,
- отделение растворимых компонентов полученного лизата,
- очистку химерного белка Trx-РТ6 с помощью ионообменной хроматографии,
- расщепление химерного белка Trx-РТ6 энтеропептидазой,
- очистку пептида РТ6 с помощью ионообменной и обращенно-фазовой хроматографии.
Подробное раскрытие изобретения
Краткое описание чертежей
Фигура 1. Электрофоретический анализ тотального клеточного лизата, полученного после разрушения клеток E. coli BL21(DE3)/pET-32b-PT6. 1 - до индукции экспрессии гена слитного белка, 2 - через 2 часа после индукции, 3 - после окончания процесса ферментации, 4 - стандарты молекулярных масс (Thermo Scientific Unstained Protein Molecular Weight Marker), справа указана масса стандартных белков в кДа. На дорожки наносили по 10 мкг белка.
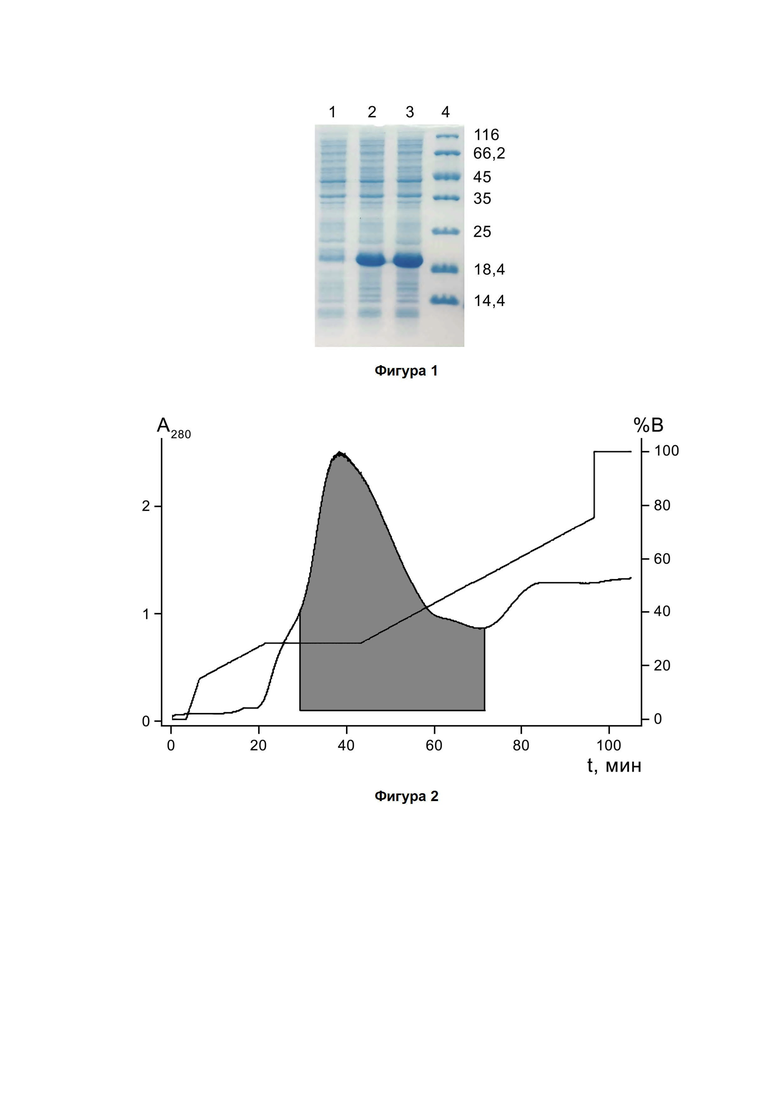
Фигура 2. Хроматографический профиль очистки гибридного белка Trx-PT6 на анионообменном сорбенте DEAE Sepharose Fast Flow. Фракции, содержащие свыше 60% целевого компонента, отмечены заливкой.
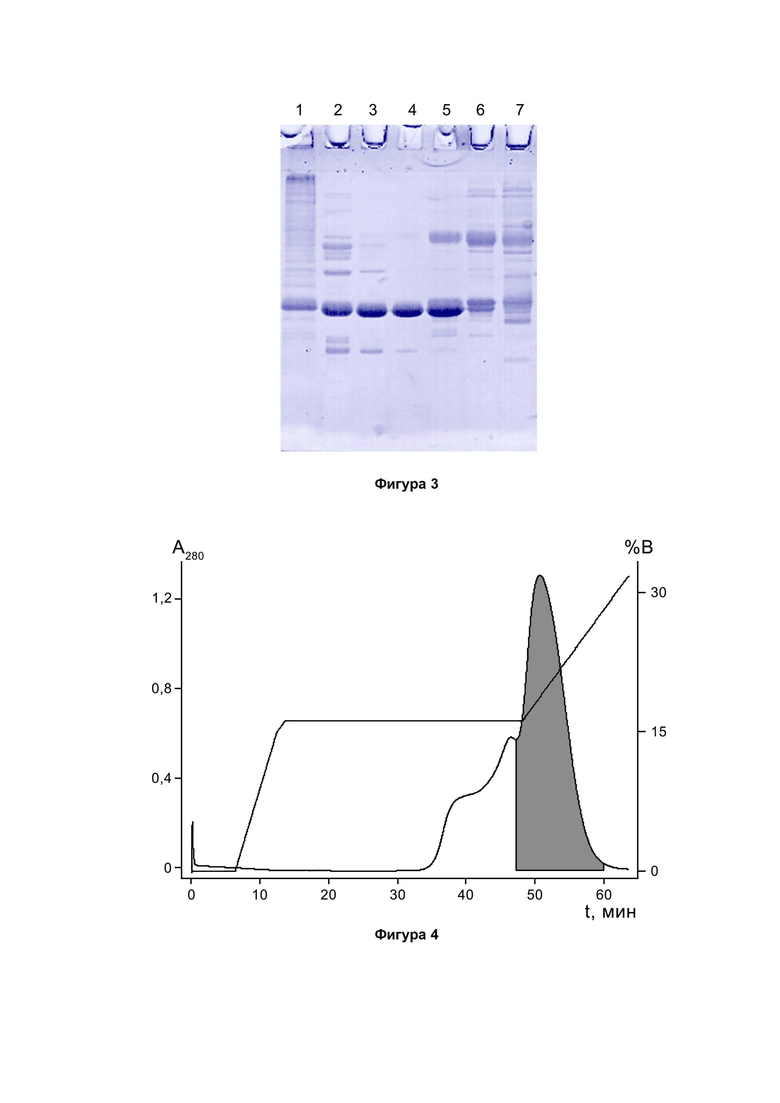
Фигура 3. Электрофоретический анализ фракций, полученных при очистке гибридного белка Trx-PT6 на анионообменном сорбенте DEAE Sepharose Fast Flow. Электрофорез проводили в 14%-ном полиакриламидном геле в денатурирующих условиях. 1 - образец перед разделением на сорбенте DEAE Sepharose Fast Flow, 32%; 2 - фракция 2 (фигура 2), 49%; 3 - фракция 3, 72%; 4 - фракция 4, 79%; 5 - фракция 5, 57%; 6 - фракция 6; 7 - фракция 7. На дорожки наносили по 10 мкг белка. Указанные проценты соответствуют содержанию гибридного белка Trx-PT6.
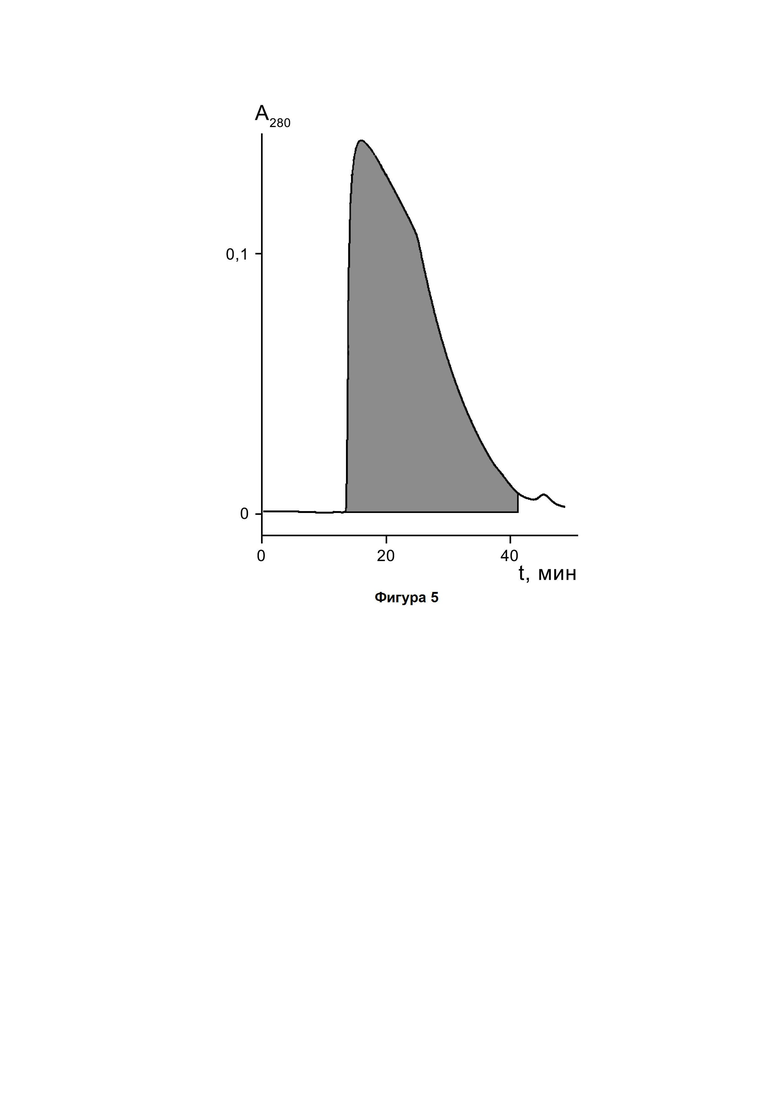
Фигура 4. Хроматографический профиль очистки пептида PT6 на анионообменном сорбенте SP Sepharose Fast Flow. Фракции, содержащие свыше 98% целевого компонента, отмечены заливкой.
Фигура 5. Хроматографический профиль очистки пептида PT6 на обращенно-фазовом сорбенте YMC Basic. Фракция, содержащая PT6 с чистотой не менее 98%, отмечена заливкой.
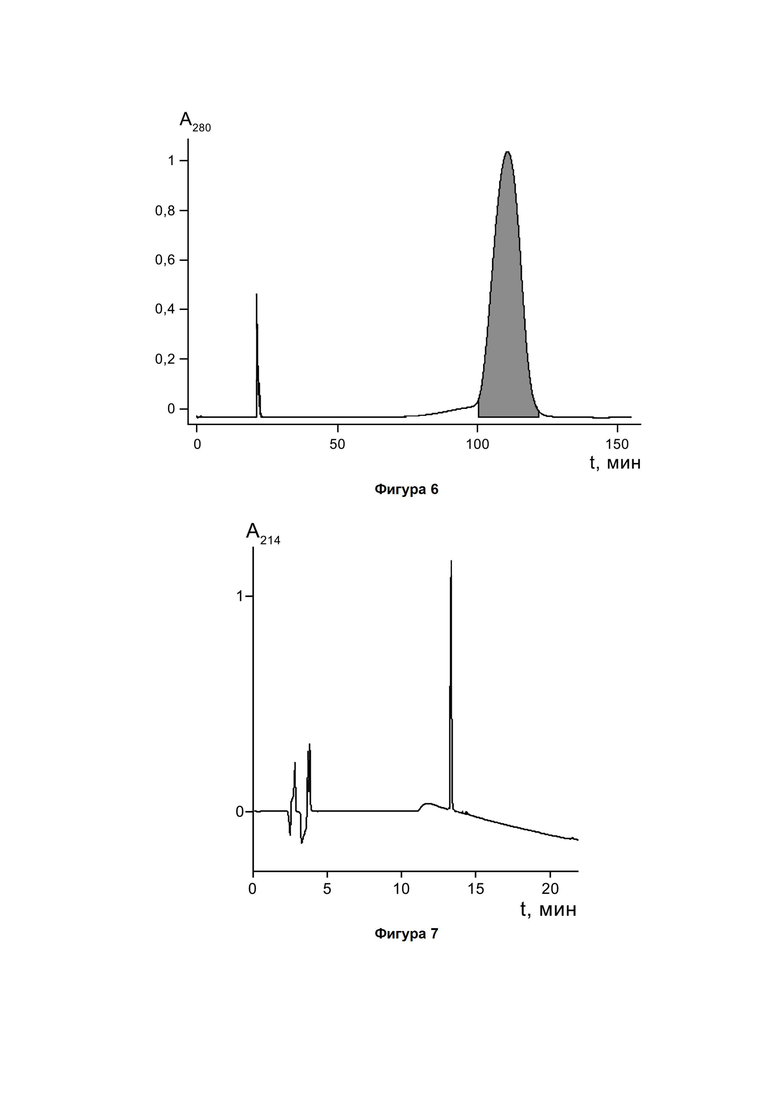
Фигура 6. Хроматографический профиль очистки пептида PT6 гель-фильтрацией на сорбенте Sephadex G-25 Superfine. Фракция, содержащая PT6 с чистотой не менее 98%, отмечена заливкой.
Фигура 7. Хроматографический анализ лиофилизата пептида РТ6 методом ОФ-ВЭЖХ. Колонка VDSpher PUR 100 C18-E (4,6×250 мм; размер частиц 5 мкм; VDS optilab Chromatographietechnik). Разделение в градиенте ацетонитрила (от 9,6 до 24% за 20 мин) в 0,1%-ной трифторуксусной кислоте со скоростью элюции 1 мл/мин.
Определения и термины
Различные термины, относящиеся к объектам настоящего изобретения, используются выше и также в описании и в формуле изобретения. Если иное не оговаривается, все технические и научные термины, используемые в данной заявке, имеют то же самое значение, которое понятно для специалистов в данной области. Ссылки на методики, используемые при описании данного изобретения, относятся к хорошо известным методам, включая изменения этих методов и замену их эквивалентными методами, известными специалистам.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Как используется в настоящем документе, термин «пептид РТ6» относится к пептиду, имеющему следующую аминокислотную последовательность:
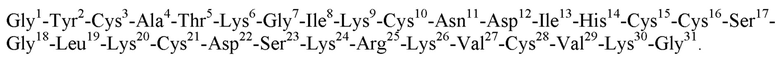
Термин «модулировать» в настоящем документе означает изменять функциональные характеристики пуринергических рецепторов Р2Х (в частности ингибировать, блокировать, снижать или предотвращать вызываемые связыванием агониста, в том числе эндогенного агониста, с рецептором физиологические эффекты), в частности Р2Х3 рецепторов.
Термин «модулятор» в настоящем документе означает вещество, способное модулировать, то есть изменять функциональные характеристики пуринергических рецепторов Р2Х (в частности, ингибировать, блокировать, снижать или предотвращать вызываемые связыванием агониста, в том числе эндогенного агониста, с рецептором физиологические эффекты), в частности Р2Х3 рецепторов.
Осуществление изобретения
Конструирование рекомбинантной плазмидной ДНК pET-32b-PT6, кодирующей пептид PT6, описано в RU2650780. Штамм-продуцент Е. coli BL21(DE3)/pET-32b-PT6 получают трансформацией компетентных клеток Е. coli BL21(DE3) плазмидой pET-32b-PT6 (RU2650780). Посевной материал в колбах получают путем культивирования штамма-продуцента Е. coli BL21(DE3)/pET-32b-PT6 в питательной среде, содержащей аминотон (10 г/л; A. Costantino & C. spa), дрожжевой экстракт (5 г/л; Biospringer), NaCl (10 г/л), MgSO4 (0,25 г/л) и глюкозу (5 г/л), pH 7,0, с добавлением ампициллина (50 мкг/мл). Для этого в 2 л питательной среды вносят 1 мл размороженной музейной культуры штамма-продуцента, инкубируют в течение 16 ч при температуре 37°С и скорости перемешивания 210 об./мин.
Затем проводят выращивание продуцента в ферментере. Для этого готовят 130 л питательной среды, содержащей аминотон (20 г/л), дрожжевой экстракт (10 г/л), K2HPO4×3H2O (5 г/л), NaCl (4 г/л), MgSO4 (0,4 г/л) и глюкозу (5 г/л), которую загружают в ферментер вместимостью 0,3 м3 (MBR), добавляют 35 г пеногасителя «Лапрол» (Нижнекамскнефтехим). Для ферментера устанавливают следующие технологические параметры: скорость вращения мешалки 30%, подача стерильного воздуха в количестве 0,1 м3/мин, избыточное давление 0,4 атм, температура 37°С, показания датчика растворенного кислорода (рО2) 100%. Перистальтическим насосом через линию передачи подпитки вносят в ферментер стерильный раствор ампициллина, итоговая концентрация которого составляет 100 мг/л. Посевной материал подсоединяют к ферментеру, с помощью перистальтического насоса производят засев культуры продуцента в питательную среду из расчета 2 л посевного материала на 130 л питательной среды.
Процесс выращивания клеток продуцента проводят, поддерживая автоматически следующие параметры: температура 37°С, давление 0,4 атм, расход воздуха 0,1 м3/мин, скорость перемешивания 90-270 об/мин для поддержания величины рО2 30-90%, концентрация растворенного кислорода рО2 50-100%, рН 7,0. Для корректировки рН в процессе выращивания биомассы перистальтическим насосом через линию передачи подпитки подают 50%-ный раствор глюкозы и 25%-ный раствор аммиака. Через 5 ч с момента засева культуры продуцента в ферментере при значении оптической плотности культуральной жидкости A600 нм= 7 проводят индукцию синтеза химерного белка в клетках культуры введением в асептических условиях в ферментер перистальтическим насосом через линию передачи подпитки раствора изопропил-β-D-тиогалактопиранозида, итоговая концентрация которого составляет 50 мг/л. Через 4 ч после введения индуктора биосинтеза химерного белка процесс ферментации останавливают. В результате получают 135 л культуральной жидкости клеток продуцента, которую подают на сепаратор CSA 19-06-476 (GEA Westfalia Separator), осуществляют две выгрузки суспензии клеток продуцента с общим объемом 11,2 л из сепаратора. На фигуре 1 показан электрофоретический анализ образцов тотального клеточного белка до индукции экспрессии химерного гена, а также спустя 2 ч после индукции и по окончании ферментации.
Полученную суспензию разбавляют до 57,8 л водой, добавляют Трис (итоговая концентрация 50 мМ) и ЭДТА (итоговая концентрация 10 мМ). Разрушение клеток биомассы проводят с использованием дезинтегратора MC15 (211, 10 TBSI; Gaulin) при температуре 13,5°С, скорости перемешивания 400 об./мин (40%) и давлении 590 атм в течение 20 мин. За три цикла получают 56,6 л суспензии разрушенных клеток.
Затем выполняют три последовательных цикла получения супернатанта дезинтеграта на проточной центрифуге CEPA Z81G (Carl Padberg Zentrifugenbau) из разрушенной биомассы (скорость потока 20 л/ч). Для каждого цикла берут 18,9 л разрушенной биомассы клеток продуцента. На каждой последовательной стадии получают 18 л супернатанта дезинтеграта (суммарно 54 л).
Выделение и очистку гибридного белка Trx-PT6 из клеточного лизата E. coli BL21(DE3)/pET-32b-PT6 проводят с помощью анионообменной хроматографии на анионите DEAE Sepharose Fast Flow (GE Healthcare). В супернатант дезинтеграта клеток продуцента (18 л; 50 мМ Трис-HCl, pH 8, 10 мМ ЭДТА) добавляют мочевину до 4 М, разбавляют в 2,5 раза буфером А (50 мМ Трис-HCl, pH 8,6), фильтруют, разбавляют еще в 4 раза буфером А и наносят на колонну BPG 200 (GE Healthcare) с анионитом (4 л), уравновешенную буфером А. Разделение проводят со скоростью 20 л/ч в градиентном режиме от 0 до 100% буфера Б (0,2 М NaCl, 50 мМ Трис-HCl, pH 8,6) за 32 л, фракции собирают по оптическому поглощению элюата при 280 нм. На фигуре 2 показан полученный профиль разделения, а на фигуре 3 - результат электрофоретического анализа полученных фракций. Объединяют фракции, содержащие свыше 60% целевого компонента, в результате получают раствор очищенного гибридного белка Trx-PT6 (15 л, 45 г). За три цикла очистки получают 45 л раствора, содержащего 135 г гибридного белка Trx-PT6.
Гибридный белок Trx-PT6 подвергают расщеплению энтеропептидазой. Для этого pH раствора, полученного при очистке гибридного белка, корректируют до 8,5 с помощью HCl, в раствор вносят энтеропептидазу (из расчета 1 ед. фермента на 1 мг белка), смесь инкубируют в течение 24 ч при комнатной температуре и перемешивании. В результате получают раствор, содержащий, по оценкам с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ), 20 г PT6.
Для разделения целевого пептида PT6 (pI ~10) и побочного продукта белка-помощника тиоредоксина (Trx; pI ~5,3) используют анионообменную хроматографию. Гидролизат гибридного белка Trx-PT6 разбавляют в 2 раза раствором 50 мМ Трис-HCl (pH 8,5) и наносят колонну BPG 200 с сорбентом DEAE Sepharose Fast Flow со скоростью 20 л/ч. Пептид PT6 не удерживается на сорбенте и содержится в проскоке в объеме 90 л.
Дальнейшую очистку пептида PT6 проводят с помощью катионообменной хроматографии. Для этого к проскоку с предыдущей стадии (анионообменной хроматографии) добавляют 18 л раствора 150 мМ СН3СООNa и доводят pH до 4,5 ледяной уксусной кислотой при перемешивании. Полученный раствор наносят на колонну BPG 200 с сорбентом SP Sepharose Fast Flow (2 л; GE Healthcare), уравновешенную буфером В (20 мМ СН3СООNa, pH 4,5). Разделение проводят со скоростью 20 л/ч в градиентном режиме от 0 до 100% буфера Г (0,5 М NaCl, 20 мМ СН3СООNa, pH 4,5) за 40 л, фракции собирают по оптическому поглощению элюата при 280 нм. На фигуре 4 показан полученный профиль разделения. Объединяют фракции, содержащие свыше 98% целевого компонента по данным ОФ-ВЭЖХ. В результате получают 32 л раствора, содержащего 18,4 г пептида PT6.
Для дополнительной очистки продукта от остаточного количества белка-помощника используют ОФ-ВЭЖХ. Хроматографическую очистку проводят на колонне DAU-100-700 (YMC), заполненной сорбентом YMC Basic (15 мкм, 20 нм; YMC Europe; 0,9 кг, 1,5 л). Раствор пептида PT6, полученный на предыдущей стадии (катионообменной хроматографии), наносят на колонну, уравновешенную раствором А (0,3 М NaCl, 0,8% уксусная кислота), со скоростью 200 мл/мин. После нанесения сорбент промывают 1,5 л раствора А. Целевой пептид элюируют раствором Б (0,8% уксусная кислота) в изократическом режиме, фракции собирают по оптическому поглощению элюата при 280 нм. На фигуре 5 показан полученный профиль разделения. В результате получают элюат в объеме 2,2 л, содержащий 17,5 г пептида PT6 с чистотой не менее 98% по данным аналитической ОФ-ВЭЖХ.
На заключительном этапе очистка целевого пептида PT6 производится методом гель-фильтрации на колонне BPG 200/950 (GE Healthcare) с использованием сорбента Sephadex G-25 Superfine (5 кг, 25 л; GE Healthcare). Раствор PT6, полученный на предыдущей стадии (ОФ-ВЭЖХ), наносят на колонну, уравновешенную раствором 10 мМ уксусной кислоты, со скоростью 10 л/ч. Элюцию проводят тем же раствором, фракции собирают по оптическому поглощению элюата при 280 нм. На фигуре 6 показан полученный профиль разделения. В результате получают элюат в объеме 3,1 л, содержащий 16,9 г PT6 с чистотой не менее 98% по данным аналитической ОФ-ВЭЖХ.
На завершающем этапе технологического процесса проводится лиофилизация очищенной субстанции пептида РТ6. Раствор, полученный в результате гель-фильтрации, пропускают через стерильный мембранный фильтр с порами диаметром 0,22 мкм (Millipore), наливают в стерильные лотки для сушки и лиофилизуют. В результате получают лиофилизат РТ6 в количестве 16,6 г с влажностью 7-8%, содержащий 15,4 г РТ6 по данным аналитической ОФ-ВЭЖХ. На фигуре 7 представлена хроматограмма лиофилизата субстанции РТ6.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ «АНАЛЬГЕТИКИ БУДУЩЕГО»
<120> СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА, МОДУЛИРУЮЩЕГО АКТИВНОСТЬ ПУРИНЕРГИЧЕСКИХ РЕЦЕПТОРОВ
<130> 415042
<160> 2
<210> 1
<211> 31
<212> PRT
<213> Искусственная последовательность
<400> 1
Gly Tyr Cys Ala Thr Lys Gly Ile Lys Cys Asn Asp Ile His Cys Cys
Ser Gly Leu Lys Cys Asp Ser Lys Arg Lys Val Cys Val Lys Gly
<210> 2
<211> 189
<212> PRT
<213> Искусственная последовательность
<400> 2
Met Ser Asp Lys Ile Ile His Leu Thr Asp Asp Ser Phe Asp Thr Asp
Val Leu Lys Ala Asp Gly Ala Ile Leu Val Asp Phe Trp Ala Glu Trp
Cys Gly Pro Cys Lys Met Ile Ala Pro Ile Leu Asp Glu Ile Ala Asp
Glu Tyr Gln Gly Lys Leu Thr Val Ala Lys Leu Asn Ile Asp Gln Asn
Pro Gly Thr Ala Pro Lys Tyr Gly Ile Arg Gly Ile Pro Thr Leu Leu
Leu Phe Lys Asn Gly Glu Val Ala Ala Thr Lys Val Gly Ala Leu Ser
Lys Gly Gln Leu Lys Glu Phe Leu Asp Ala Asn Leu Ala Gly Ser Gly
Ser Gly His Met His His His His His His Ser Ser Gly Leu Val Pro
Arg Gly Ser Gly Met Lys Glu Thr Ala Ala Ala Lys Phe Glu Gly Gln
His Met Asp Ser Pro Asp Leu Gly Thr Asp Asp Asp Asp Arg Gly Tyr
Cys Ala Thr Lys Gly Ile Lys Cys Asn Asp Ile His Cys Cys Ser Gly
Leu Lys Cys Asp Ser Lys Arg Lys Val Cys Val Lys Gly
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения Gd-связывающего белка | 2019 |
|
RU2713792C1 |
| Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида | 2017 |
|
RU2664199C1 |
| ШТАММ ESCHERICHIA COLI BL21(DE3)PLYSS/PET15B-HISCPF1 - ПРОДУЦЕНТ РНК-НАПРАВЛЯЕМОЙ ЭНДОНУКЛЕАЗЫ CRISPR/CPF1 | 2021 |
|
RU2774120C1 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| Плазмидный вектор pET-mChBac75Na, штамм бактерии Eschrichia coli BL21(DE3/ pET-mChBac75Na для экспрессии антимикробного пептида минибактенецина ChBac7.5 Nα и способ получения указанного пептида | 2016 |
|
RU2618850C2 |
| Штамм бактерий Escherichia Coli - продуцент рекомбинантного белка IL-29 | 2020 |
|
RU2760585C1 |
| Рекомбинантная плазмидная ДНК pET19b-Surv-OL, обеспечивающая синтез гибридного белка сурвивин-обелин (Surv-OL) и гибридный белок, связываемый анти-сурвивин антителами и обладающий биолюминесцентной активностью | 2021 |
|
RU2770490C1 |
| Рекомбинантный химерный белок, состоящий из большой экстраклеточной петли человеческого рецептора CD81 и стрептавидина | 2020 |
|
RU2778251C2 |
| Последовательность нуклеотидов, кодирующая β-N-ацетилгексозаминидазу Aggregatibacter actinomycetemcomitans, и генетические конструкции, её содержащие | 2021 |
|
RU2789544C1 |
| Рекомбинантный слитый белок | 2019 |
|
RU2732795C1 |
Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению биологически активных полипептидов, которые обладают модулирующим действием на участвующие в генерации болевого сигнала клеточные рецепторы, и может быть использовано для получения пептида РТ6 в системе экспрессии Е. coli. Изобретение обеспечивает высокоэффективную продукцию пептида РТ6, модулирующего активность пуринергических рецепторов, в клетках Е. coli BL21(DE3) с высоким выходом. 7 ил.
Способ получения пептида РТ6 с последовательностью SEQ ID NO: 1, включающий:
- проведение контролируемой экспрессии гена химерного белка Trx-РТ6 с последовательностью SEQ ID NO: 2 в составе векторной конструкции на основе вектора pET-32b, причем указанная конструкция содержит ген химерного белка Trx-РТ6 и позволяет производить контролируемую экспрессию слитного гена, в штамме-продуценте Е. coli BL21(DE3) с внедренной векторной конструкцией, с использованием в качестве индуктора изопропил-β-D-1-тиогалактопиранозида,
- разрушение клеток штамма-продуцента с образованием лизата,
- отделение растворимых компонентов полученного лизата,
- очистку химерного белка Trx-РТ6 с помощью ионообменной хроматографии,
- расщепление химерного белка Trx-РТ6 энтеропептидазой,
- очистку пептида РТ6 с помощью ионообменной и обращенно-фазовой хроматографии.
| ПЕПТИДНЫЙ МОДУЛЯТОР ПУРИНЕРГИЧЕСКИХ РЕЦЕПТОРОВ | 2016 |
|
RU2650780C1 |
| АНАЛЬГЕТИЧЕСКИЙ ПЕПТИД ИЗ МОРСКОЙ АНЕМОНЫ | 2016 |
|
RU2614759C1 |
| ПЕПТИДНЫЙ МОДУЛЯТОР ПУРИНЕРГИЧЕСКИХ РЕЦЕПТОРОВ | 2010 |
|
RU2422459C1 |
Авторы
Даты
2020-02-11—Публикация
2019-08-30—Подача