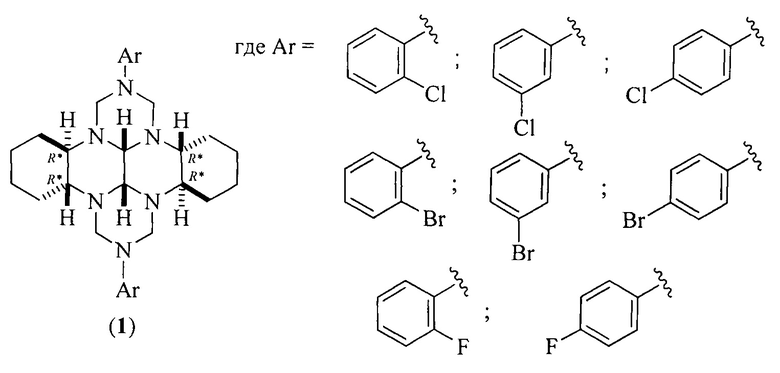
Предлагаемое изобретение относится к органической химии, конкретно, к (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а, 14b-гексаазадибензо[ƒg,ор]тетраценам общей формулы (1) и способу их получения:
Соединения, содержащие в своей структуре транс-1,2-диаминоциклогексановый фрагмент, обладают противоопухолевой активностью [Rakhimova, Е.; Kirsanov, V.; Tret'yakova, Е.; Khalilov, L.; Ibragimov, A.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039; Dragoun, M.;  Frias, C; Berkessel, A., Prokop, A.J. Cancer Res. & Clinic. Oncology 2018, 144, 685; Khokhar, A.R.; Al-Baker, S.; Shamsuddin, S.; Siddik, Z.H. J. Med. Chem. 1997, 40, 112; Morales, F.; Ramirez, A.; Morata-Tarifa, C.; Navarro, S.A.; Marchal, J.A.; Campos, J.M.; Conejo-Garcia, A. Future Med. Chem. 2017, 9, 293.; Omer, K.H.; Seliman, A.A.; Altaf, M.; Casagrande, N.; Aldinucci, D.; Altuwaijri, S.; Isab, A.A. Polyhedron 2015, 102, 773] и антипролиферативным действием [Iwanejko, J.;
Frias, C; Berkessel, A., Prokop, A.J. Cancer Res. & Clinic. Oncology 2018, 144, 685; Khokhar, A.R.; Al-Baker, S.; Shamsuddin, S.; Siddik, Z.H. J. Med. Chem. 1997, 40, 112; Morales, F.; Ramirez, A.; Morata-Tarifa, C.; Navarro, S.A.; Marchal, J.A.; Campos, J.M.; Conejo-Garcia, A. Future Med. Chem. 2017, 9, 293.; Omer, K.H.; Seliman, A.A.; Altaf, M.; Casagrande, N.; Aldinucci, D.; Altuwaijri, S.; Isab, A.A. Polyhedron 2015, 102, 773] и антипролиферативным действием [Iwanejko, J.;  Trynda, J.;
Trynda, J.;  Tetrahedron 2017, 73, 2276], представляют интерес в качестве N-содержащих хиральных лигандов [Dvornikova, I.A.; Buravlev, Е.V.; Frolova, L.L.; Nelyubina, Yu.V.; Chukicheva, I.Yu.; Kuchin, A.V. Russ. J. Org. Chem. 2011, 47, 1130], бифункциональных органокатализаторов
Tetrahedron 2017, 73, 2276], представляют интерес в качестве N-содержащих хиральных лигандов [Dvornikova, I.A.; Buravlev, Е.V.; Frolova, L.L.; Nelyubina, Yu.V.; Chukicheva, I.Yu.; Kuchin, A.V. Russ. J. Org. Chem. 2011, 47, 1130], бифункциональных органокатализаторов 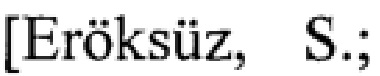 Neudorfl, J.M.; Berkessel, A. Synlett 2017, 28, 1278] и каталитических систем для энантиоселективных превращений [Evans, D.A.; Seidel, D.J. Am. Chem. Soc. 2005, 127, 9958; Evans, D.A.; Mito, S.; Seidel, D.J. Am. Chem. Soc. 2007, 129, 11583].
Neudorfl, J.M.; Berkessel, A. Synlett 2017, 28, 1278] и каталитических систем для энантиоселективных превращений [Evans, D.A.; Seidel, D.J. Am. Chem. Soc. 2005, 127, 9958; Evans, D.A.; Mito, S.; Seidel, D.J. Am. Chem. Soc. 2007, 129, 11583].
Известен способ получения [P. Neumann, A. Aumueller, H. Trauth. US Patent 4,904,779 (1990)] 2,9-дигетарилзамещенного гексаазапергидродибензотетрацена (2) без уточнения его стереоконфигурации циклоконденсацией 4-аминопиперидина, параформа и пергидротетраазатетрацена в среде этанола при кипячении в присутствии в качестве катализатора катионита Lewatit.
Известный способ не позволяет получать (3bR*,7aR*,10bR*,l4aR*-cis-14с,14b)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацены общей формулы (1).
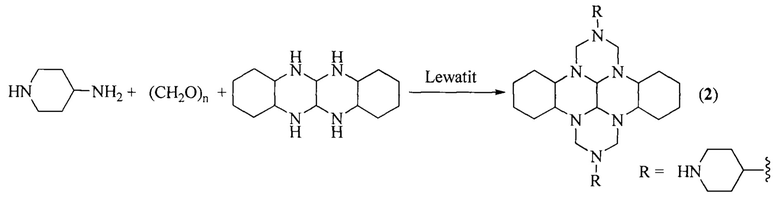
Известен способ получения [Rakhimova, Е.; Kirsanov, V.; Tret'yakova, Е.; Khalilov, L.; Ibragimov, A.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039] (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(алкил)октадекагидро-1H,8H-2,3а,7b,9,10a,14b-гексаазадибензо[ƒg,ор]тетраценов (3) взаимодействием N,N-бис(метоксиметил)-N-алкиламинов с транс-1,6,7,12-тетраазапергидротетраценом в присутствии катализатора на основе самария (III).
Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3a,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацены общей формулы (1).
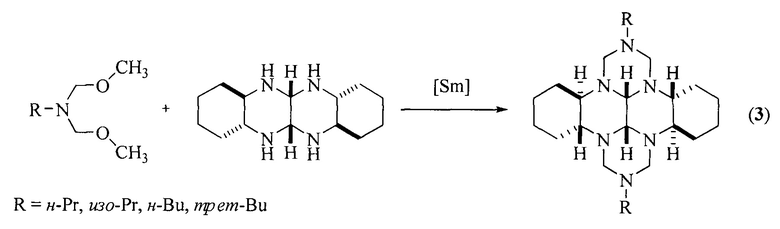
Известен способ получения [Rakhimova, Е.; Kirsanov, V.; Tret'yakova, Е.; Khalilov, L.; Ibragimov, A.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039] (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(циклоалкил)октадекагидро-1H,8H-2,3а,7b,9,10a, 14b-гексаазадибензо[ƒg,ор]тетраценов (4) взаимодействием 1,3,5-трициклоалкил-1,3,5-триазинанов с транс-1,6,7,12-тетраазапергидротетраценом с участием в качестве катализатора шестиводного хлорида никеля (II).
Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацены общей формулы (1).
Известен способ получения [Rakhimova, Е.; Kirsanov, V.; Tret'yakova, Е.; Khalilov, L.; Ibragimov, A.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039] (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(адамантил)октадекагидро-1H,8H-2,3a,7b,9,10a,14b-гексаазадибензо[ƒg,ор]тетраценов (5) циклоконденсацией транс-1,6,7,12-тетраазапергидротетрацена с формальдегидом и адамантиламинами в присутствии в качестве катализатора гранулированного цеолита Y в Н-форме.
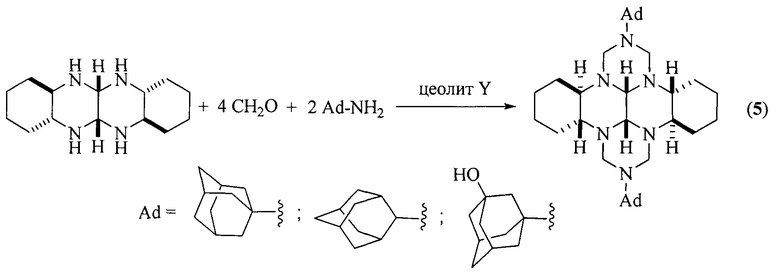
Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3a,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацены общей формулы (1).
Таким образом, в литературе отсутствуют сведения о (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3a,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетраценах общей формулы (1) и их получении.
Предлагается новый способ получения (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетраценов общей формулы (1).
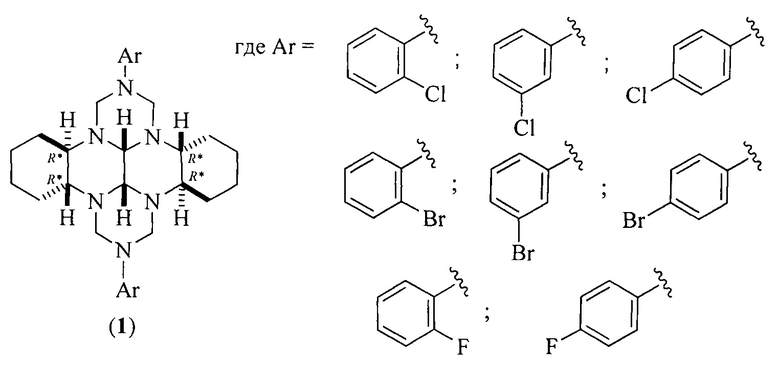
Сущность способа заключается во взаимодействии (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанола с галогенанилинами общей формулы ArNH2 (где Ar=2-ClC6H4, 3-ClC6H4, 4-ClC6H4, 2-BrC6H4, 3-BrC6H4, 4-BrC6H4, 2-FC6H4, 4-FC6H4) в присутствии катализатора YbCl3⋅6H2O, взятых в мольном соотношении (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанол : галогенанилин : YbCl3⋅6Н2О=1:2:(0.03-0.07), предпочтительно 1:2:0.05. Реакционную смесь перемешивают 2.5-3.5 ч при температуре ~ 20°С и атмосферном давлении в среде СН3ОН. Выход (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетраценов (1) составляет 40-77%. Реакция протекает по схеме:
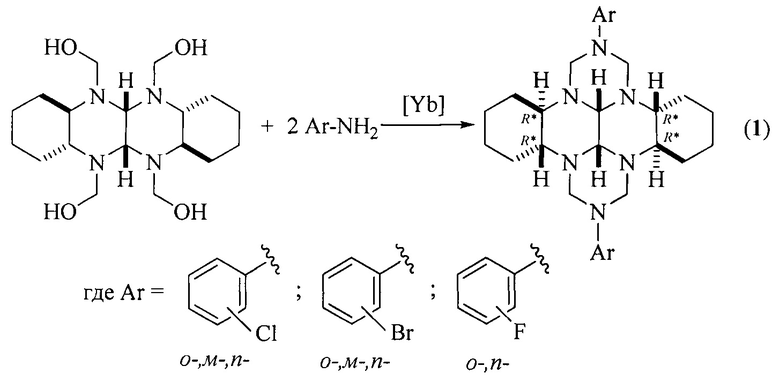
(Додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанол синтезируют способом, описанным в работе [Rakhimova Е.В., Kirsanov V.Yu., Mescheryakova E.S., Ibragimov A.G., Dzhemilev U.M. Mendeleev Communications, 2020, 30, 3, 308]. (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-Бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацены общей формулы (1) образуются только лишь с участием (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанола и галогенанилинов, взятых в мольном соотношении 1: 2 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора реакция идет с выходом не более 10%. Проведение указанной реакции в присутствии катализатора YbCl3⋅6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора YbCl3⋅6H2O менее 3 мол. % снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20°С. При температуре выше 20°С (например, 60°С) увеличиваются энергозатраты, а при температуре ниже 20°С (например, при 0°С) снижается скорость реакции. Опыты проводили в среде СН3ОН, т.к. в нем хорошо растворяются исходные соединения.
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходных реагентов транс-1,6,7,12-тетраазапергидротетрацена, формальдегида и адамантиламинов в присутствии в качестве катализатора гранулированного цеолита Y в Н-форме с получением 2,9-бис(адамантил)замещенных октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетраценов.
В предлагаемом способе реакция идет с участием в качестве исходных реагентов (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанола и галогенанилинов под действием катализатора YbCl3⋅6H2O.
Предлагаемый способ позволяет получать индивидуальные (3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацены общей формулы (1), синтез которых в литературе не описан.
Способ поясняется примерами:
Синтез (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5аН,11аН)-тетраил)тетраметанола: смесь (±)-транс-циклогексан-1,2-диамина (0.23 г, 2.00 ммоль) в 5 мл метанола и 40%-ный водный раствор глиоксаля (0.14 г, 1.00 ммоль) в 5 мл метанола перемешивают 3 ч при 70°С и охлаждают до комнатной температуры. Добавляют 37%-ный водный раствор формальдегида (0.45 мл, 4.00 ммоль) в 5 мл метанола, перемешивают 1 ч и получают in situ (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанол.
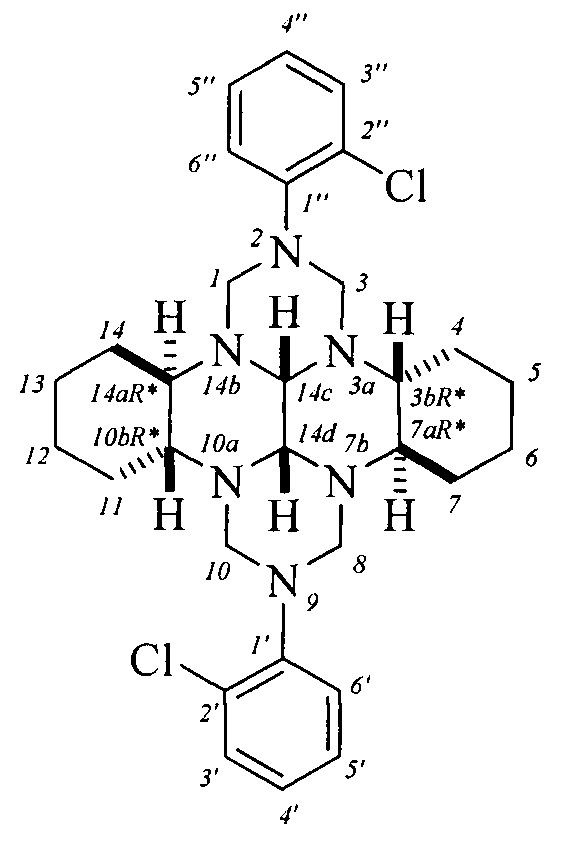
ПРИМЕР 1. В круглодонную колбу, установленную на магнитной мешалке, при комнатной температуре ~20°С помещают (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанол (1.00 ммоль) и 0.019 г (0.05 ммоль) YbCl3⋅6H2O, затем добавляют 2-хлоранилин (0.25 г, 2 ммоль) в 5 мл метанола. Реакционную смесь перемешивают 3 ч при комнатной температуре. Образующийся осадок отфильтровывают, дважды промывают метанолом (2×5 мл) и получают индивидуальный 3bR*,7aR*,10bR*,14aR*-cis-14с,14d)-2,9-бис(2-хлорфенил)октадекагидро-1H,8H-2,3a,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацен с выходом 62%.
Примеры 2-12, подтверждающие способ, выполнены аналогично пр. 1 и приведены в табл.

Все опыты проводили в среде СН3ОН при комнатной температуре (~20°С).
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(2-хлорфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена1(1Спектры ЯМР (1Н, 13С) сняты на спектрометре Bruker Avance 500 (125.78 МГц для ядер 13С и 500.17 МГц для ядер 1Н) или Bruker Avance 400 (100.62 МГц для ядер 13С и 400.13 МГц для ядер 1Н) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3.):
Спектр ЯМР 1Н (500.17 МГц, CDCl3), δ, м.д.: 0.71 уш.с (2Н, СН2, На-4,11), 0.87 д (2Н, СН2, На-7,14; 2Jab=10.5 Гц), 1.15-1.21 м (4Н, СН2, На-5,6,12,13), 1.52-1.74 м (6Н, СН2, Hb-4,5,7,11,12,14; 2Н, СН, Н-7а,14а), 2.08 уш.с (2Н, СН2, Hb-6,13), 3.31 уш.с (2Н, СН, H-3b,10b), 3.46 д (2Н, СН2, На-1,8; 2Jab=10.5 Гц), 3.59 уш.с (2Н, СН, H-14c,14d), 4.03 д (2Н, СН2, На-3,10; 2Jab=13.5 Гц), 4.78 д (2Н, СН2, Нь-1,8; 2Jba=9.5 Гц), 4.95 д (2Н, СН2, Hb-3,10; 2Jba=13 Гц), 6.94 уш.с (2Н, СН, Н-4',4''), 7.22-7.32 м (4Н, СН, Н-3',3'',5',5''), 7.71 уш.с (2Н, СН, Н-6',6'').
Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 24.3 (С-4,11), 24.5 (С-5,12), 27.3 (С-6,13), 28.0 (С- 7,14), 55.9 (C-3b,10b), 63.3 (С-7а,14а), 64.9 (С-3,10), 71.4 (С-1,8), 77.9 (C-14c,14d), 121.7 (С-6',6''), 123.3 (С-4',4''), 127.1 (С-2',2''), 127.6 (С-3',3''), 130.2 (С-5',5''), 147.7 (С- 1',1'').
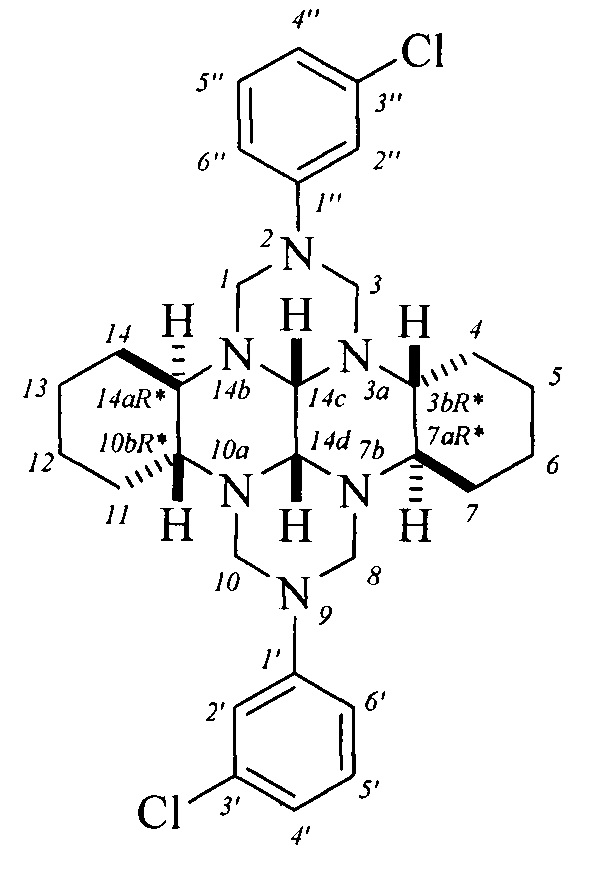
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(3-хлорфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (500.17 МГц, CDCl3), δ, м.д.: 0.91-0.98 м (4Н, СН2, На-4,7,11,14), 1.18-1.29 м (4Н, СН2, На-5,6,12,13), 1.63 д (2Н, СН2, Hb-4,11; 2Jba=12 Гц), 1.73 д (2Н, СН2, Hb-5,12; 2Jba=13 Гц), 1.80-1.84 м (2Н, СН, Н-7а,14а), 1.94 д (2Н, СН2, Hb-7,14; 2Jba=9.5 Гц), 2.11 д (2Н, СН2, Hb-6,13; 2Jba=10.5 Гц), 3.09-3.13 м (2Н, СН, H-3b,10b), 3.27 д (2Н, СН2, На-1,8; 2Jab=10 Гц), 3.52 уш.с (2Н, СН, H-14c,14d), 3.94 д (2Н, СН2, На-3,10; 2Jab=13 Гц), 4.86-4.91 д (4Н, СН2, Нь-1,3,8,10), 6.83 д (2Н, СН, Н-6',6''; 3J=8 Гц), 6.90 дд (2Н, СН, Н-5',5''; 3J=8 Гц; 3J=8 Гц), 6.97 уш.с (2Н, СН, Н-2',2''), 7.17 т (2Н, СН, Н-4',4''; 3J=8 Гц).
Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 24.1 (С-4,11), 24.5 (С-5,12), 27.1 (С-6,13), 28.6 (С- 7,14), 55.1 (C-3b,10b), 63.5 (С-7а,14а), 66.3 (С-3,10), 69.4 (С-1,8), 77.8 (C-14c,14d), 115.3 (С-5',5''), 117.0 (С-2',2''), 120.0 (С-6',6''), 130.0 (С-4',4''), 134.7 (С-3',3''), 150.8 (С- 1',1'').
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(4-хлорфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д.: 0.87-0.96 м (4Н, СН2, На-4,7,11,14), 1.17-1.26 м (4Н, СН2, На-5,6,12,13), 1.61 д (2Н, СН2, Hb-4,11; 2Jba=10.8 Гц), 1.72 д (2Н, СН2, Hb-5,12; 2Jba=11.6 Гц), 1.78-1.82 м (2Н, СН, Н-7а,14а), 1.90 д (2Н, СН2, Hb-7,14; 2Jba=9.2 Гц), 2.11 д (2Н, СН2, Hb-6,13; 2Jba=9.6 Гц), 3.09-3.13 м (2Н, СН, H-3b,10b), 3.28 д (2Н, СН2, На-1,8; 2Jab=10.8 Гц), 3.51 уш.с (2Н, СН, H-14c,14d), 3.93 д (2Н, СН2, На-3,10; 2Jab=13.6 Гц), 4.82-4.87 д (4Н, СН2, Hb-1,3,8,10), 6.95 д (4Н, СН, Н-2',2'',6',6''; 3J=8.4 Гц), 7.20 д (4Н, СН, Н-3',3'',5',5''; 3J=8.8 Гц).
Спектр ЯМР 13С (100.62 МГц, CDCl3), δ, м.д.: 24.2 (С-4,11), 24.5 (С-5,12), 27.1 (С-6,13), 28.5 (С- 7,14), 55.2 (C-3b,10b), 63.5 (С-7а,14а), 66.5 (С-3,10), 69.6 (С-1,8), 77.9 (C-14c,14d), 118.6 (С-2',2'',6',6''), 125.1 (С-4',4''), 128.9 (С-3',3'',5',5''), 148.4 (С-1',1'').

Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(2-бромфенил)октадекагидро-1H,8Н-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д.: 0.69-0.74 м (2Н, СН2, На-4,11), 0.84-0.89 м (2Н, СН2, На-7,14), 1.08-1.27 м (4Н, СН2, На-5,6,12,13), 1.49-1.58 м (4Н, СН2, Hb-4,7,11,14), 1.64 д (2Н, СН2, Hb-5,12; 2Jba=12.4 Гц), 1.71-1.76 м (2Н, СН, Н-7а,14а), 2.07 д (2Н, СН2, Hb-6,13; 2Jba=12.8 Гц), 3.32-3.37 м (2Н, СН, H-3b,10b), 3.45 д (2Н, СН2, На-1,8; 2Jab=10.8 Гц), 3.59 уш.с (2Н, СН, Н-14c,14d), 4.02 д (2Н, СН2, На-3,10; 2Jab=14 Гц), 4.76 д (2Н, СН2, Hb-1,8; 2Jba=10.8 Гц), 4.93 д (2Н, СН2, Hb-3,10; 2Jba=13.6 Гц), 6.88 т (2Н, СН, Н-5',5''; 3J=7.6 Гц), 7.26-7.29 м (2Н, СН, Н-4',4''), 7.51 д (2Н, СН, Н-3',3''; 3J=8 Гц), 7.73 д (2Н, СН, Н-6',6''; 3J=7.6 Гц).
Спектр ЯМР 13С (100.62 МГц, CDCl3), δ, м. д.: 24.3 (С-4,11), 24.4 (С-5,12), 27.3 (С-6,13), 28.0 (С- 7,14), 55.9 (C-3b,10b), 63.2 (С-7а,14а), 65.4 (С-3,10), 71.6 (С-1,8), 77.8 (C-14c,14d), 117.9 (С-2',2''), 122.2 (С-6',6''), 123.9 (С-5',5''), 128.2 (С-4',4''), 133.4 (С-3',3''), 149.1 (С- 1',1'').
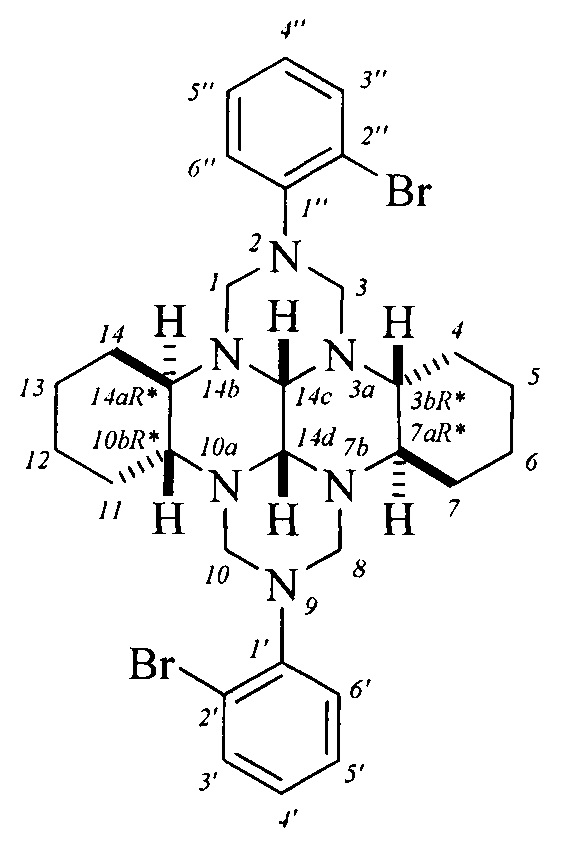
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(3-бромфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (500.17 МГц, CDCl3), δ, м.д.: 0.96 уш.с (4Н, СН2, На-4,7,11,14), 1.24-1.28 м (4Н, СН2, На-5,6,12,13), 1.64-1.93 м (6Н, СН2, Hb-4,5,7,11,12,14; 2Н, СН, Н-7а,14а), 2.11 уш.с (2Н, СН2, Hb-6,13), 3.12 уш.с (2Н, СН, H-3b,10b), 3.25-3.33 м (2Н, СН2, На-1,8), 3.51 уш.с (2Н, СН, H-14c,14d), 3.91-3.95 м (2Н, СН2, На-3,10), 4.87-4.90 м (4Н, СН2, Hb-1,3,8,10), 6.94-7.11 м (8Н, СН, Н-2',2'',4',4'',5',5'',6',6'').
Спектр ЯМР 13С (125.77 МГц, CDCl3), δ, м.д.: 24.1 (С-4,11), 24.5 (С-5,12), 27.1 (С-6,13), 28.6 (С- 7,14), 55.1 (C-3b,10b), 63.5 (С-7а,14а), 66.3 (С-3,10), 69.4 (С-1,8), 77.8 (C-14c,14d), 115.8 (С-6',6''), 120.0 (С-4',4''), 123.0 (С-2',2''), 130.3 (С-5',5'').
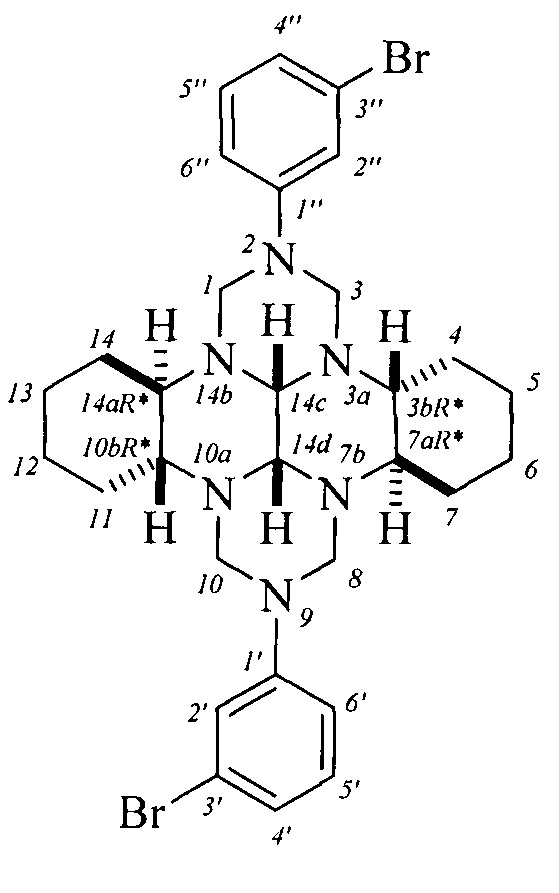
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(4-бромфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м.д.: 0.87-0.96 м (4Н, СН2, На-4,7,11,14), 1.17-1.26 м (4Н, СН2, На-5,6,12,13), 1.61 д (2Н, СН2, Hb-4,11; 2Jba=10.8 Гц), 1.72 д (2Н, СН2, Hb-5,12; 2Jba=11.2 Гц), 1.77-1.82 м (2Н, СН, Н-7а, 14а), 1.90 д (2Н, СН2, Hb-7,14; 2Jba=9.6 Гц), 2.10 д (2Н, СН2, Hb-6,13; 2Jba=10 Гц), 3.07-3.12 м (2Н, СН, H-3b,10b), 3.27 д (2Н, СН2, На-1,8; 2Jab=10.8 Гц), 3.51 уш.с (2Н, СН, H-14c,14d), 3.94 д (2Н, СН2, На-3,10; 2Jab=13.6 Гц), 4.82-4.88 м (4Н, СН2, Hb-1,3,8,10), 6.90 д (4Н, СН, Н-2',2'',6',6''; 3J=8.8 Гц), 7.33 д (4Н, СН, Н-3',3'',5',5''; 3J=8.4 Гц).
Спектр ЯМР 13С (100.62 МГц, CDCl3), δ, м.д.: 24.2 (С-4,11), 24.5 (С-5,12), 27.1 (С-6,13), 28.5 (С- 7,14), 55.2 (C-3b,10b), 63.5 (С-7а,14а), 66.4 (С-3,10), 69.5 (С-1,8), 77.9 (C-14c,14d), 112.4 (С-4',4''), 119.0 (С-2',2'',6',6''), 131.8 (С-3',3'',5',5''), 148.8 (С-1',1'').
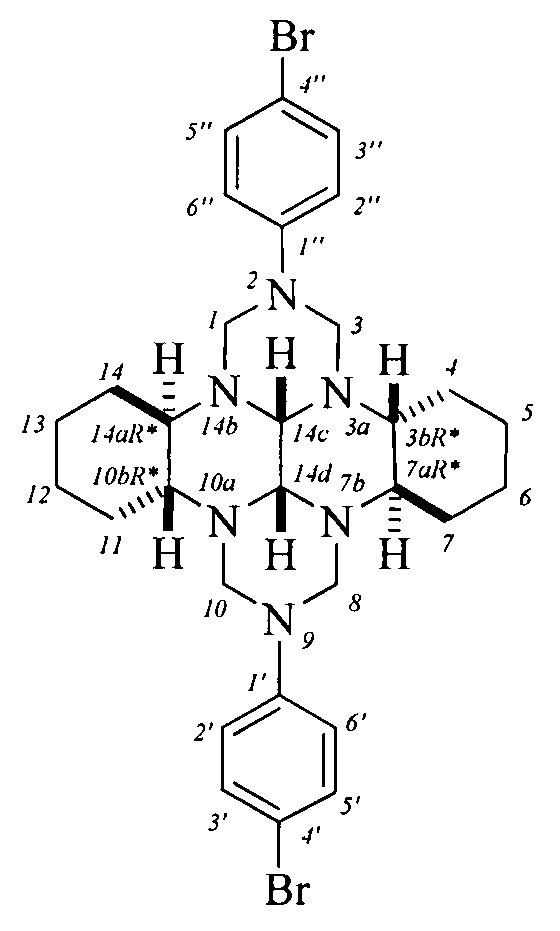
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(2-фторфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетрацена:
Спектр ЯМР 1Н (500.17 МГц, CDCl3), δ, м.д.: 0.79-0.82 м (2Н, СН2, На-4,11), 0.89-0.93 м (2Н, СН2, На-7,14), 1.16-1.26 м (4Н, СН2, На-5,6,12,13), 1.57 д (2Н, СН2, Hb-4,11; 2Jba=11.5 Гц), 1.68 д (2Н, СН2, Hb-5,12; 2Jba=11 Гц), 1.79 уш.с (2Н, СН, Н-7а,14а), 1.87 д (2Н, СН2, Hb-7,14; 2Jba=10.5 Гц), 2.11 д (2Н, СН2, Hb-6,13; 2Jba=10 Гц), 3.25 уш.с (2Н, СН, H-3b,10b), 3.39 д (2Н, СН2, На-1,8; 2Jab=10 Гц), 3.57 уш.с (2Н, СН, H-14c,14d), 3.98 д (2Н, СН2, На-3,10; 2Jab=13.5 Гц), 4.80 д (2Н, СН2, Hb-1,8; 2Jba=10 Гц), 4.89 д (2Н, СН2, Hb-3,10; 2Jba=13.5 Гц), 6.92 уш.с (2Н, СН, Н-4',4''), 6.99-7.06 м (4Н, СН, Н-3',3'',5',5''), 7.37 уш.с (2Н, СН, Н-6',6'').
Спектр ЯМР 13С (125.78 МГц, CDCl3), δ, м.д.: 24.3 (С-4,11), 24.5 (С-5,12), 27.3 (С-6,13), 28.1 (С- 7,14), 55.8 (C-3b,10b), 63.5 (С-7а,14а), 65.6 и 65.7 (С-3,10; J=12.5 Гц), 70.5 (С-1,8), 78.0 (C-14c,14d), 115.6 и 115.8 (С-3',3''; JC-C=25 Гц), 120.1 (С-6',6''), 122.2 и 122.3 (С-4',4''; JC-C=12.5 Гц), 124.6 (С-5',5''), 138.1 и 138.2 (С-1',1''; JC-C=12.5 Гц), 154.1 и 156.1 (С-2',2''; JC-F=250 Гц).
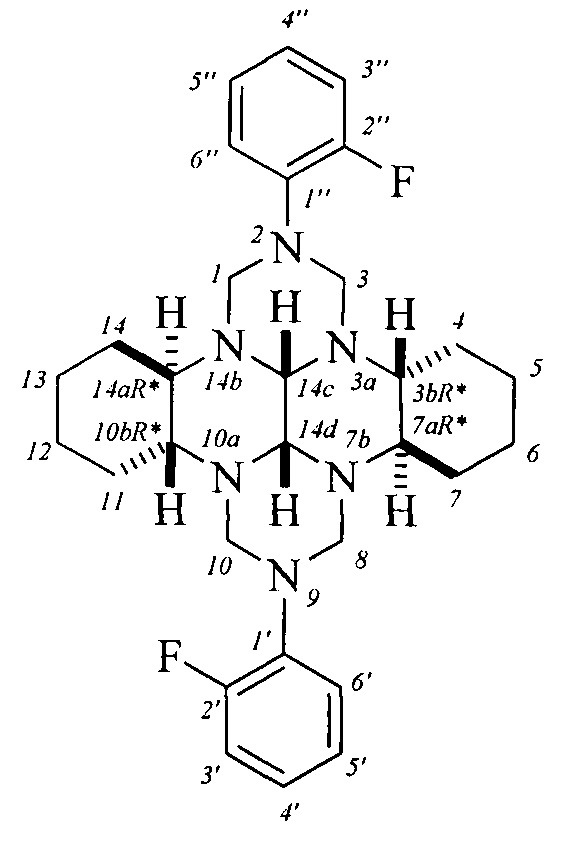
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(4-фторфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетрацена:
Спектр ЯМР 1Н (400.13 МГц, CDCl3), δ, м. д.: 0.93 уш.с (4Н, СН2, На-4,7,11,14), 1.21 уш.с (4Н, СН2, На-5,6,12,13), 1.61-1.88 м (6Н, СН2, Нь-4,5,7,11,12,14; 2Н, СН, Н-7а,14а), 2.09 уш.с (2Н, СН2, Нь-6,13), 3.18 уш.с (2Н, СН, H-3b,10b), 3.28 д (2Н, СН2, На-1,8; 2Jab=9.6 Гц), 3.52 уш.с (2Н, СН, Н-14c,14d), 3.92 д (2Н, СН2, На-3,10; 2Jab=12.4 Гц), 4.81 д (4Н, СН2, Hb-1,3,8,10; 2Jba=9.2 Гц), 6.95-7.01 м (8Н, СН, Н-2',2'',3',3'',5',5'',6',6'').
Спектр ЯМР 13С (100.62 МГц, CDCl3), δ, м. д.: 24.2 (С-4,11), 24.5 (С-5,12), 27.2 (С-6,13), 28.4 (С- 7,14), 55.3 (C-3b,10b), 63.5 (С-7а,14а), 67.2 (С-3,10), 70.4 (С-1,8), 77.9 (C-14c,14d), 115.4 и 115.6 (С-3',3''5',5''; JC-C=20 Гц), 119.3 (С-2',2'',6',6''), 146.3 (С-1',1''), 156.2 и 158.6 (С-4',4''; JC-F=240 Гц).
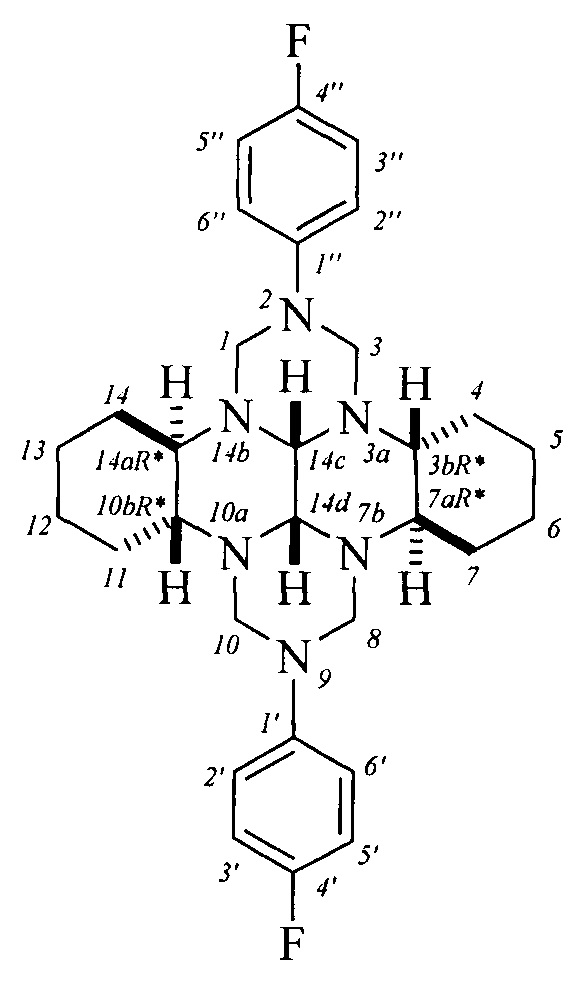
Изобретение относится к способу получения (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(галогенфенил)октадекагидро-1H,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,ор]тетраценов общей формулы (1). Технический результат: разработан способ получения гетероциклов с транс-1,2-диаминоциклогексановым фрагментом, которые могут найти применение в качестве соединений-кандидатов для разработки препаратов с противоопухолевой активностью и антипролиферативным действием, а также в качестве N-содержащих хиральных лигандов, бифункциональных и каталитических систем для энантиоселективных превращений. 1 табл., 1 пр.

Способ получения (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(галогенфенил)октадекагидро-1Н,8H-2,3а,7b,9,10а,14b-гексаазадибензо[ƒg,op]тетраценов общей формулы (1):
 ,
,
отличающийся тем, что галогенанилины формулы Ar-NH2, где Ar - указанные выше, подвергают взаимодействию с (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанолом в среде СН3ОН в присутствии катализатора YbCl3⋅6H2O при мольном соотношении (додекагидрохинаксолино[2,3-b]хинаксалин-5,6,11,12(5aH,11aH)-тетраил)тетраметанол : галогенанилин : YbCl3⋅6H2O=1:2:(0,03-0,07) при комнатной (~20°С) температуре и атмосферном давлении в течение 2,5-3,5 ч.
| СПОСОБ ПОЛУЧЕНИЯ 2,9-БИС-ЗАМЕЩЕННЫХ ТРАНС-2,3a,7b,9,10a,14b-ГЕКСААЗАПЕРГИДРОДИБЕНЗОТЕТРАЦЕНОВ НА ОСНОВЕ АМИНОПРОИЗВОДНЫХ МЕТИЛОВОГО ЭФИРА МАЛЕОПИМАРОВОЙ КИСЛОТЫ | 2019 |
|
RU2730493C1 |
| US4904779A, 27.02.1990 | |||
| Dzhemilev, Usein M.; Ibragimov, Askhat G.; Kirsanov, Victor Yu.; Mescheryakova, Ekaterina S.; Rakhimova, Elena B., Stereochemical outcome of perhydro hexaazadibenzotetracene formation from trans-1,2-diaminocyclohexane, Mendeleev Communications, vol | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Распределительный механизм для паровых машин | 1921 |
|
SU308A1 |
Авторы
Даты
2023-01-09—Публикация
2021-07-29—Подача