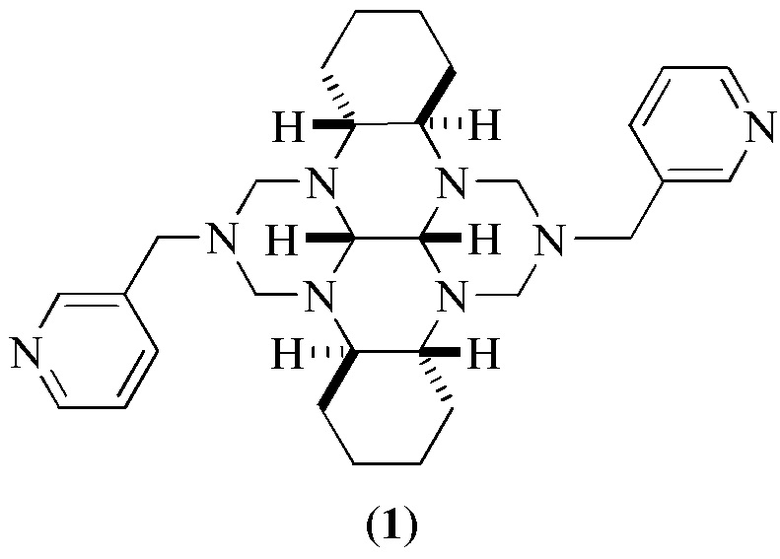
Предлагаемое изобретение относится к области синтеза соединений с биологической активностью, конкретно, к способу получения (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена (1) на основе каталитической реакции конденсации транс-1,6,7,12-тетраазапергидротетрацена с N,N,N',N'-тетраметилметандиамином и 3-метиламинопиридином. Соединение (1), in vitro проявляющее цитотоксический эффект в отношении клеточных линий гепатоцеллюлярной карциномы человека (HepG2), аденокарциномы толстого кишечника (HTC-116), моноцитарной лейкемии человека (THP-1), карциномы молочной железы (MCF-7), аденокарциномы легкого (A549), Т-клеточного лейкоза (Jurkat) и нейробластомы человека (SH-SY5Y), может быть использовано в качестве цитотоксического средства.
Известен способ получения [P. Neumann, A. Aumueller, H. Trauth. US Patent 4,904,779 (1990)] 2,9-дизамещенного гексаазапергидродибензотетрацена (2) без уточнения его стереоконфигурации циклоконденсацией 4-аминопиперидина, параформа и пергидротетраазатетрацена в среде этанола при кипячении в присутствии в качестве катализатора катионита Lewatit.

Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен (1).
Известен способ получения [Rakhimova, E.; Kirsanov, V.; Tret'yakova, E.; Khalilov, L.; Ibragimov, А.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039] (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(адамантил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетраценов (3) мультикомпонентной конденсацией адамантиламинов (адамантил-1-амин, адамантил-2-амин, 1-гидрокси-адамантил-3-амин) с формальдегидом и транс-1,6,7,12-тетраазапергидротетраценом с участием в качестве катализатора 10 масс. % цеолита Y.

Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен (1).
Известен способ получения [Rakhimova, E.; Kirsanov, V.; Mescheryakova, E.; Ibragimov, A.; Dzhemilev, U. Mendeleev Communications, 2020, 30, 3, 308] (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-дигет(арил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетраценов (4) циклоконденсацией транс-1,6,7,12-тетраазапергидротетрацена с формальдегидом и гет(арил)аминами в присутствии катализатора на основе Yb (III).

Известный способ не позволяет получать (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен (1).
Известна [Rakhimova, E.; Kirsanov, V.; Tret'yakova, E.; Khalilov, L.; Ibragimov, А.; Dzhemileva, L.; D'yakonov, V.; Dzhemilev, U. RSC Advances 2020, 10, 36, 21039] противоопухолевая активность in vitro соединения (3) в отношении клеточной линии гистиоцитарной лимфомы человека U937.

Известны противоопухолевые свойства соединения (5) [Dragoun, M.; Günther, T.; Frias, C.; Berkessel, A., Prokop, A. J. Cancer Res. & Clinic. Oncology 2018, 144, 685]. Указанное соединение избирательно ингибирует пролиферацию и индуцирует апоптоз в клеточных линиях лейкемии и лимфомы.

Известны [Omer, K. H.; Seliman, A. A.; Altaf, M.; Casagrande, N.; Aldinucci, D.; Altuwaijri, S.; Isab, A. A. Polyhedron 2015, 102, 773] цитотоксические свойства комплекса (6), который активен in vitro в отношении линий опухолевых клеток человека A2780, A2780cis и L-540.

Известны [Iwanejko, J.; Wojaczyńska, E.; Trynda, J.; Wojaczyński, J. Tetrahedron 2017, 73, 2276] антипролиферативные свойства соединений (7) и (8). Указанные эпимеры ингибируют рост раковых клеток сопоставимо с цисплатином, но более селективно.

Синтезы указанных соединений или многостадийны или базируются на использовании дорогостоящих исходных реагентов.
Таким образом, в литературе отсутствуют сведения о способе получения (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена (1) и его биологических свойствах.
Предлагается новый способ получения (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена (1) в одну препаративную стадию из доступных исходных реагентов. Соединение формулы (1) может быть использовано в качестве средства с цитотоксической активностью.
Сущность способа заключается во взаимодействии транс-1,6,7,12-тетраазапергидротетрацена с N,N,N',N'-тетраметилметандиамином и 3-метиламинопиридином в присутствии катализатора NiCl2·6H2O, взятых в мольном соотношении транс-1,6,7,12-тетраазапергидротетрацен : N,N,N',N'-тетраметилметандиамин : 3-метиламинопиридин : NiCl2·6H2O = 1 : 4 : 2 : (0.03-0.07), предпочтительно 1 : 4 : 2 : 0.05. Реакционную смесь перемешивают 2.5-3.5 ч при температуре ~ 20 °С и атмосферном давлении в среде CH3OH. Выход (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена (1) составляет 32-39%. Реакция протекает по схеме:

(3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-Бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен (1) образуется только лишь с участием транс-1,6,7,12-тетраазапергидротетрацена, N,N,N',N'-тетраметилметандиамина и 3-метиламинопиридина, взятых в мольном соотношении 1 : 4 : 2 (стехиометрические количества). При другом соотношении исходных реагентов снижается выход целевого продукта (1). Без катализатора реакция идет с выходом не более 10%. Проведение указанной реакции в присутствии катализатора NiCl2·6H2O больше 7 мол. % не приводит к существенному увеличению выхода целевого продукта (1). Использование катализатора NiCl2·6H2O менее 3 мол. % снижает выход (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Реакции проводили при температуре 20 °С. При температуре выше 20 °С (например, 60 °С) увеличиваются энергозатраты, а при температуре ниже 20 °С (например, при 0 оС) снижается скорость реакции. Опыты проводили в среде CH3OH, т.к. в нем хорошо растворяются исходные соединения.
Цитотоксичность соединения (1) оценивали на линиях раковых клеток (HepG2, HTC116, SH-SY5Y, MCF-7, A549, Jurkat, THP-1) и условно нормальных клетках человека (HEK293) методом МТТ теста (колориметрический тест для оценки метаболической активности клеток). Клетки инкубировали в присутствии соединения (1) в течение 48 ч. Контролем служил 5-фторурацил. Как видно из таблицы 1, соединение (1) ингибирует жизнеспособность раковых клеток при значениях IC50 от 25 до 52 мкМ в зависимости от тестируемой клеточной линии.
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
IC50/μM
Существенные отличия предлагаемого способа:
В известном способе реакция идет с участием в качестве исходных реагентов транс-1,6,7,12-тетраазапергидротетрацена, формальдегида и гет(арил)аминов в присутствии катализатора на основе Yb (III) с получением 2,9-дигет(арил)-октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетраценов.
В предлагаемом способе реакция идет с участием в качестве исходных реагентов транс-1,6,7,12-тетраазапергидротетрацена, N,N,N',N'-тетраметилметандиамина и 3-метиламинопиридина в присутствии катализатора NiCl2·6H2O. В отличие от известного, предлагаемый способ позволяет получить (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен (1) с цитотоксической активностью.
Способ поясняется примерами:
ПРИМЕР 1. В круглодонную колбу, установленную на магнитной мешалке, при комнатной температуре ~20°С помещают 0.25 г (1 ммоль) транс-1,6,7,12-тетраазапергидротетрацена в 10 мл MeOH, 0.41 г (4.00 ммоль) тетраметилметандиамина и 0.012 г (0.05 ммоль) катализатора NiCl2∙6H2O, затем добавляют 0.21 г (2.00 ммоль) 3-метиламинопиридина в 5 мл МеОН. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч и концентрируют. Образующийся осадок отфильтровывают, дважды промывают метанолом (2×10 мл) и получают индивидуальный (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен с выходом 37%.
Примеры 2-5, подтверждающие способ, выполнены аналогично пр. 1 и приведены в табл. 2.
п/п
транс-1,6,7,12-тетраазапергидротетрацен : тетраметилметандиамин : 3-метиламинопиридин : NiCl2∙6H2O, ммоль
час
Все опыты проводили в среде CH3OH при комнатной температуре (~20 оС).
Спектральные характеристики (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена:
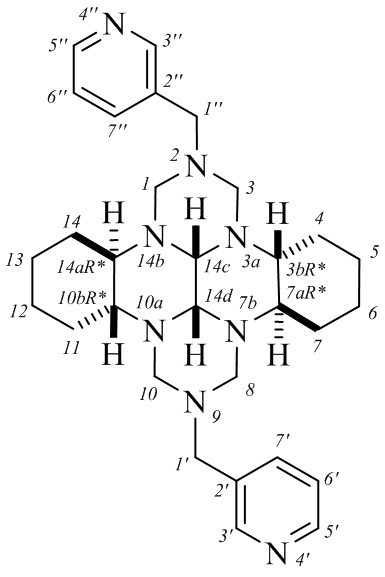
Спектр ЯМР 1H (400.13 МГц, CDCl3), δ, м. д.: 0.77-0.86 м (2Н, СН2, На-7,14), 1.15-1.18 м (2Н, СН2, На-4,11), 1.22-1.29 м (4Н, СН2, На-5,6,12,13), 1.63-1.77 м (2Н, СН, Н-7a,14a; 6Н, СН2, Нb-4,5,7,11,12,14), 1.87 д (2Н, СН2, Нb-6,13; 2Jba = 11.6 Гц), 2.48 д (2Н, СН2, На-1,8; 2Jab = 8 Гц), 3.07 д (2Н, СН2, На-3,10; 2Jab = 12 Гц), 3.34 уш.с (2Н, СН, Н-14c,14d), 3.36-3.39 м (2Н, СН, Н-3b,10b), 3.49 д (4Н, СН2, Н-1′,1′′; 2J = 13.6 Гц), 4.01 д (2Н, СН2, Нb-3,10; 2Jba = 11.6 Гц), 4.20 д (2Н, СН2, Нb-1,8; 2Jba = 7.6 Гц), 7.24-7.28 м (2Н, СН, Н-6′,6′′), 7.73 д (2Н, СН, Н-7′,7′′; J = 7.6 Гц), 8.52 д (4Н, СН, Н-3′,3′′,5′,5′′; J = 8 Гц).
Спектр ЯМР 13С (100.62 МГц, CDCl3), δ, м. д.: 24.2 (C-4,11), 24.6 (C-5,12), 26.9 (C-6,13), 28.2 (С-7,14), 54.4 (C-1′,1′′), 55.4 (C-3b,10b), 63.9 (C-7a,14a), 68.6 (C-3,10), 74.4 (C-1,8), 77.4 (C-14c,14d), 123.3 (C-6′,6′′), 133.6 (C-2′,2′′), 136.3 (C-7′,7′′), 148.9 (C-5′,5′′), 150.0 (C-3′,3′′). Спектры ЯМР (1Н, 13С) сняты на спектрометре Bruker Avance 400 по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDCl3.
| название | год | авторы | номер документа |
|---|---|---|---|
| (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9-бис(метилфенил или метоксифенил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацены и способ их получения | 2022 |
|
RU2788760C1 |
| (3bR*,7aR*,10bR*,14aR*-cis-14c,14d)-2,9 БИС(ГАЛОГЕНФЕНИЛ)ОКТАДЕКАГИДРО-1Н,8Н-2,3а,7b,9,10a,14b-ГЕКСААЗАДИБЕНЗО[fg,op]ТЕТРАЦЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2021 |
|
RU2787455C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,9-БИС-ЗАМЕЩЕННЫХ ТРАНС-2,3a,7b,9,10a,14b-ГЕКСААЗАПЕРГИДРОДИБЕНЗОТЕТРАЦЕНОВ НА ОСНОВЕ АМИНОПРОИЗВОДНЫХ МЕТИЛОВОГО ЭФИРА МАЛЕОПИМАРОВОЙ КИСЛОТЫ | 2019 |
|
RU2730493C1 |
| Способ получения терпеноидного димера с пергидротетраценовым спейсером и его применение в качестве средства с цитотоксической активностью | 2023 |
|
RU2794745C1 |
| Бис-аддукты имидо-амина метилового эфира малеопимаровой кислоты с азаполициклическими спейсерами и способ их получения | 2022 |
|
RU2792569C1 |
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛОМОЧЕВИНЫ, ИХ ПОЛУЧЕНИЕ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2004 |
|
RU2341523C2 |
| 1,3-ДИИОКСАНОНОВЫЕ ПРОИЗВОДНЫЕ АЛКЕНОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1989 |
|
RU2040525C1 |
| ПРОИЗВОДНОЕ ПИРРОЛИДИН-3-ИЛУКСУСНОЙ КИСЛОТЫ | 2012 |
|
RU2615135C2 |
| ФЕНОКСИЗАМЕЩЕННЫЕ ПИРИМИДИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ОПИОИДНЫХ РЕЦЕПТОРОВ | 2010 |
|
RU2554870C2 |
Изобретение относится к области биологически активных соединений, а именно к (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацену формулы (1), обладающему цитотоксической активностью в отношении клеточных линий гепатоцеллюлярной карциномы человека (HepG2), аденокарциномы толстого кишечника (HTC-116), моноцитарной лейкемии человека (THP-1), карциномы молочной железы (MCF-7), аденокарциномы легкого (A549), Т-клеточного лейкоза (Jurkat) и нейробластомы человека (SH-SY5Y). Изобретение относится также к способу получения тетрацена формулы (1). Способ заключается во взаимодействии транс-1,6,7,12-тетраазапергидротетрацена с N,N,N',N'-тетраметилметандиамином и 3-метиламинопиридином в присутствии катализатора NiCl2·6H2O при мольном соотношении транс-1,6,7,12-тетраазапергидротетрацен : N,N,N',N'-тетраметилметандиамин : 3-метиламинопиридин : NiCl2·6H2O = 1:4:2:(0,03-0,07). Реакцию проводят в среде CH3OH при комнатной (~20°С) температуре и атмосферном давлении в течение 2,5–3,5 ч. Данный способ позволяет получать тетрацен формулы (1) с выходом 32–39%. 2 н. и 1 з.п. ф-лы, 2 табл., 5 пр.

1. (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацен формулы (1):

2. Соединение по п.1, обладающее цитотоксической активностью в отношении клеточных линий гепатоцеллюлярной карциномы человека (HepG2), аденокарциномы толстого кишечника (HTC-116), моноцитарной лейкемии человека (THP-1), карциномы молочной железы (MCF-7), аденокарциномы легкого (A549), Т-клеточного лейкоза (Jurkat) и нейробластомы человека (SH-SY5Y).
3. Способ получения (3bR*,7aR*,10bR*,14aR*-цис-14c,14d)-2,9-бис(пиридин-3-илметил)октадекагидро-1Н,8Н-2,3а,7b,9,10a,14b-гексаазадибензо[fg,op]тетрацена формулы (1) по п.1, отличающийся тем, что транс-1,6,7,12-тетраазапергидротетрацен подвергают взаимодействию с N,N,N',N'-тетраметилметандиамином и 3-метиламинопиридином в среде CH3OH в присутствии катализатора NiCl2·6H2O при мольном соотношении транс-1,6,7,12-тетраазапергидротетрацен : N,N,N',N'-тетраметилметандиамин : 3-метиламинопиридин : NiCl2·6H2O = 1:4:2:(0,03-0,07) при комнатной (~20°С) температуре и атмосферном давлении в течение 2,5–3,5 ч.
| RAKHIMOVA E | |||
| ET AL, First Synthesis of 2,9-Disubstituted cis-2,3a,7b,9,10a,14b- Hexaazaperhydrodibenzotetracenes, SYNLETT, 2018, 29(14), рр | |||
| Способ получения ангидритового и гипсового цемента | 1923 |
|
SU1861A1 |
| RAKHIMOVA E | |||
| B | |||
| ET AL, Stereochemical outcome of perhydro hexaazadibenzotetracene formation from trans-1,2-diaminocyclohexane, MENDELEEV COMMUNICATIONS, 2020, 30(3), | |||
Авторы
Даты
2023-03-22—Публикация
2022-11-23—Подача