Изобретение относится к медицине, а именно к стоматологии, касается способа лечения воспалительных и воспалительно-деструктивных заболеваний пародонта и может быть использовано для лечения генерализованного пародонтита средней степени тяжести у пациентов с коморбидной патологией.
В структуре стоматологической заболеваемости патология пародонта занимает ведущее место и встречается в любой возрастной группе: в молодом возрасте в 40%, у людей среднего и пожилого возраста - в 90% и в 100% случаев соответственно [Гажва С.И. Хирургические методы лечения заболеваний пародонта. - Нижний Новгород, 2003. - 110 с]. Так, в Российской Федерации распространенность воспалительных заболеваний пародонта в возрастной группе 35-44 лет определяется на уровне 81%, в возрастной группе 65 лет и старше - на уровне 92% [Янушевич О.О., Кузьмина И.Н. Состояние тканей пародонта у населения в возрасте 35-44 лет в регионах России // Российский стоматологический журнал. - 2009. - №1. - С. 40-41.].
Воспалительный процесс в тканях характеризуется скрытым началом, хроническим течением, небольшими периодами ремиссии, частыми рецидивами, быстропрогрессирующим течением и сложностью терапии [Гажва С.И. Комплексное исследование слизистой оболочки дорсальной поверхности языка с целью диагностики ряда патологических состояний и идентификации личности: Автореф. дис. …докт. мед. наук. - Москва, 2000. - 26 с; Гажва С.И., Воронина А.И., Шкаредная О.В. Анализ клинико-иммунологического статуса полости рта у пациентов с хроническим генерализованным пародонтитом легкой и средней степеней тяжести при использовании антибактериальных средств // Стоматология. - 2010. Т. 89. №3. - С. 30-33.]. Самым тяжелым и распространенным заболеванием пародонта является пародонтит, который протекает годами с периодами ремиссий и обострений и часто приводит к значительному нарушению функции зубочелюстной системы из-за резорбции костной ткани, гибели удерживающего аппарата зубов и выпадения (или удаления) последних. По тяжести течения различают легкую (глубина десневых карманов менее 3,5 мл, костная резорбция - менее 1/3 высоты корня), среднюю (глубина десневых карманов - более 3,5 мл, но менее 5,0 мл, костная резорбция - менее 50% корня), тяжелую (глубина десневых карманов - более 5,0 мл, костная резорбция - более 50% корня) степень. Важнейшими возбудителями, вызывающими пародонтит, являются грамотрицательные микроорганизмы видов Porphyromonas gingivalis, Tannerella forsythia, Aggregatibacter actinomycetemcomitans. Эти бактерии характеризуются также как бактерии-маркеры пародонтита. Дисбиотические нарушения в виде угнетения нормальной микрофлоры на фоне роста удельного веса представителей условно-патогенной и патогенной микрофлоры являются одними из ведущих в патогенезе хронического воспаления тканей пародонта. Следствием хронических инфекций такого рода является медленная утрата соединительнотканного опорного аппарата зубов (так называемая утрата прикрепления), а в случае долговременного прогрессирования заболевания - утрата костного опорного аппарата зубов альвеолярных отростков челюстей. Обладающие инвазивным ростом пародонтопатогены красного (Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola) и оранжевого (Campylobacter rectus, Campylobacter showae, Eubacterium nodatum, Fusobacterium nucleatum, Prevotella intermedia, Prevotella nigrescens, Peptostreptococcus micros) комплексов находятся в сложных взаимоотношениях между собой внутри микробиома и иммунной системой организма человека, вызывая воспалительно-дегенеративные изменения на системном уровне [Волошина А.А. Значение микробного фактора в развитии и течении воспалительных заболеваний пародонта // Молодой ученый. - 2011. - №1 (24). - С. 248-251.]. Продолжительное развитие инфекции в ротовой полости является причиной формирования ревматоидной формы артроза, инфекционного эндокардита, атеросклероза, инсульта и инфаркта. В последние годы патология пародонта достаточно часто развивается на фоне коморбидной патологии, утяжеляя течение основного заболевания.
Многочисленные исследования выявили связь между патологией внутренних органов и заболеваниями тканей пародонта. Установлена прямая взаимосвязь между патологией желудочно-кишечного тракта (ЖКТ) и развитием воспалительных заболеваний пародонта (ВЗП). Так, при анализе анамнеза жизни пациентов часто выявляется возникновение заболеваний ЖКТ перед возникновением ВЗП. Удалось доказать связь повышенной распространенности Streptococcus mutans, Streptococcus oralis, Streptococcus sobrinus на 35,7%, 29,1%, 31,2% соответственно при обследовании соскобов пародонтального кармана у пациентов с заболеваниями ЖКТ - 61,2%, ССС - 34,1%, эндокринной системы - 28.2% [Горбачева И.А., Орехова Л.Ю., Шестакова Л.А., Михайлова О.В. Связь заболеваний внутренних органов с воспалительными поражениями полости рта // Пародонтология. - 2009. - №3 (52). - С. 3-7.; Цепов Л.М. Некоторые аспекты этиологии и патогенеза хронических воспалительных генерализованных заболеваний пародонта // Пародонтология. - 2005. - №2 - С. 23-26.]. Диагностированный плохой уровень гигиены у пациентов в период обострения ВЗП может привести к прогрессированию язвенной болезни желудка и 12-перстной кишки. Так, у 68-90% обследованных пациентов с патологией ЖКТ в анамнезе, преимущественно язвенной болезнью и колитом, выявили заболевания пародонта [Булкина Н.В. Патогенетическая взаимосвязь и взаимовлияние воспалительных заболеваний пародонта с патологией сердечно-сосудистой системы и желудочно-кишечного тракта // Клиническая стоматология. - 2010. - №2. - С. 28-29.; Цепов Л.М. Некоторые аспекты этиологии и патогенеза хронических воспалительных генерализованных заболеваний пародонта // Пародонтология. - 2005. - №2. - С. 23-26.; Abusleme L., Dupuy K., Dutsan N. et al. The subgingival microbiome in health and periodontitis and its relationship with community biomass and inflammation // ISME J. - 2013. Vol. 7. №5. Р. 1016-1025.]. Исследования, проведенные российскими и зарубежными авторами, установили наличие связи между функциональными и морфологическими изменениями пародонта при наличии сопутствующей патологии. Данные изменения связаны с нарушениями нейрорегуляции, гемодинамики, метаболизма, изменениями иммунологического статуса и микробиома макроорганизма. При этом отмечается наличие функциональной связи между тканями пародонта и пораженными органами, что приводит к утяжелению обоих заболеваний. Применяемое лечение сопутствующей патологии также влияет на ткани пародонта [Зорина О.А., Кулаков, А.А., Грудянов А.И. Микробиоценоз полости рта в норме и при воспалительных заболевания пародонта // Стоматология. - 2011. - №1. - С. 73-78.; Солдатова Е.С.Разработка схемы комплексного лечения воспалительных заболеваний пародонта: дис… докт. мед. наук. - Уфа, 2018 - 132 с; Еремин О.В., Лепилин А.В., Козлова И.В., Каргин Д.В. Коморбидность болезней пародонта и желудочно-кишечного тракта // Саратовский научно-медицинский журнал. - 2009. - Т. 5, - №3. - С. 393-398.; Наумова, В.Н., Туркина С.В., Маслак Е.Е. Взаимосвязь стоматологических и соматических заболеваний: обзор литературы // Волгоградский научно-медицинский журнал. - 2016. - №2. - С. 25-28.].
Известны различные способы лечения воспалительных и воспалительно-деструктивных заболеваний пародонта и применяемые при этом лекарственные средства, определяемые общим состоянием организма, формой и тяжестью воспалительного (воспалительно-деструктивного) процесса в пародонте.
Независимо от формы и стадии патологии воспалительных и воспалительно-деструктивных заболеваний пародонта местное лечение начинают с тщательного удаления зубных отложений с последующей антисептической обработкой десневого края. В схему лечения комплексной терапии заболеваний пародонта обязательно включают антибиотики [Митронин А.В. Дифференцированное применение противовоспалительных препаратов в комплексной терапии пародонтита // Стоматология. - 2005. - №6. - С. 32-39.; Клюшникова М.О. Проблемы лечения генерализованного пародонтита // Сборник научных статей по итогам международной научно-практической конференции. СПб, 2015. - С. 85-87.; Godson I.M. Antimicrobial strategies for treatment of periodontal diseases // Periodontal. - 2000. Vol. 1994. №5. - P. 142-168.], антисептики [Гусенов С.Г. Комплексное лечение хронического генерализованного пародонтита с применением мирамистина и ликопида. Методические рекомендации. -Махачкала, 2002. - 32 с; Herrera D. Chlorhexidine mouthwash reduces plaque and gingivitis // Evid. Based Dent - 2013. Vol. 14. №1. - P. 17-8.] и фитопрепараты, обладающие антибактериальными свойствами [Балин В.Н. Применение фитопрепаратов для лечения болезней пародонта // Terra Medika. - 2003. - №1. - С. 19-21.; Горбатова, Е.А. Отечественные препараты из растительного сырья в комплексном лечении заболеваний пародонта // Институт стоматологии. - 2000. - №1. - С. 32-33.]. Медикаментозные препараты позволяют получить хороший клинический результат, но при этом демонстрируют и отрицательные свойства, неоднозначно влияя на микрофлору полости рта, ткани пародонта и нередко приводя к негативным последствиям и побочным эффектам. Применение антисептиков может привести к снижению защитных механизмов тканей пародонта против бактерий. Так, на основании клинических и микробиологических данных установлено, что при традиционной противовоспалительной терапии 0,2% водным раствором хлоргексидина биглюконата анаэробная флора появлялась уже через 1 месяц у 50% пациентов, а нормальная флора сохранялась только у 40% пациентов [Рыба О.Б. Клинико-микробиологическая оценка эффективности различных видов противовоспалительной терапии хронического пародонтита // Саратовский научно-медицинский журнал. - 2008. - №3. - С. 88-90.]. Антимикробные препараты у части пациентов вызывают аллергические реакции, дисбиозы, синдром «иммунологической недостаточности», который приводит к персистенции возбудителя, рецидивам заболевания, а также к возникновению реинфекций агентами другой природы [Грудянов А.И. Антимикробная и противовоспалительная терапия в пародонтологии. - М.: МИА, 2004. - 80 с; Мелехов СВ. Состояние местного иммунитета и микробиоценоза полости рта у больных хроническим генерализованным пародонтитом // Пародонтология.- 2013. - №1(66) - С. 3-9.]. Считается, что на сегодняшний день ни один современный антибактериальный препарат, используемый при лечении хронического генерализованного пародонтита в терапевтических дозах как местно, так и системно, не может привести к полному удалению инфекции из полости рта, и тем более из пародонтальных карманов [Антимикробные препараты в стоматологической практике / редакторы: М. Ньюман, А. ван Винкельхофф; пер. с англ. М. Лариной. - М.: Азбука, 2004. - С 77 - 78.]. Кроме того, ни антисептики, ни антибиотики не оказывают избирательного действия на возбудителей, которые являются причиной заболеваний пародонта, а негативно влияют на микробиоценоз полости рта, что приводит к нарушению его равновесия (происходит усиленное размножение некоторых микроорганизмов, резистентных к антибиотику) и при долговременном применении антибиотиков - к развитию у микроорганизмов множественной антибиотикорезистентности.
Вследствие уничтожения бактерий антибиотиками высвобождаются бактериальные продукты, в частности продукты разложения (бактериальные токсины), которые в еще большей степени усиливают аутологичную иммунную реакцию и, следовательно, деструкцию тканей.
Одним из возможных путей коррекции микробиоценоза при воспалительных заболеваниях пародонта является бактериотерапия с применением пробиотических микроорганизмов. Пробиотики - это живые микроорганизмы, оказывающие позитивный эффект на физиологические, биохимические и иммунные реакции организма хозяина через стабилизацию и оптимизацию функции его нормальной микробиоты. Основное их назначение - восстановление эволюционно обусловленных микробиоценозов различных локусов макроорганизма. Механизмы позитивного воздействия на организм связаны с конкуренцией пробиотических бактерий за питательные вещества и рецепторы адгезии, с подавлением роста и развития патогенов за счет синтеза антибиотикоподобных веществ, органических кислот; с ингибированием транслокации микроорганизмов и их токсинов в лимфу и системный кровоток; с усилением функции врожденного иммунитета слизистых (адъювантный эффект, увеличение продукции IgA, стимуляция фагоцитоза, синтез цитокинов и др.).
В пародонтологии широко применяются различные пробиотические лекарственные средства как внутрь - перорально, так и местно - в виде аппликаций (таблица 1) [Митронин А.В., Вавилова Т.П., Перевощикова О.А., Островская И.Г. Применение пробиотиков в лечении патологии тканей ротовой полости //Российская стоматология. - 2013.-№2. - С. 17.].
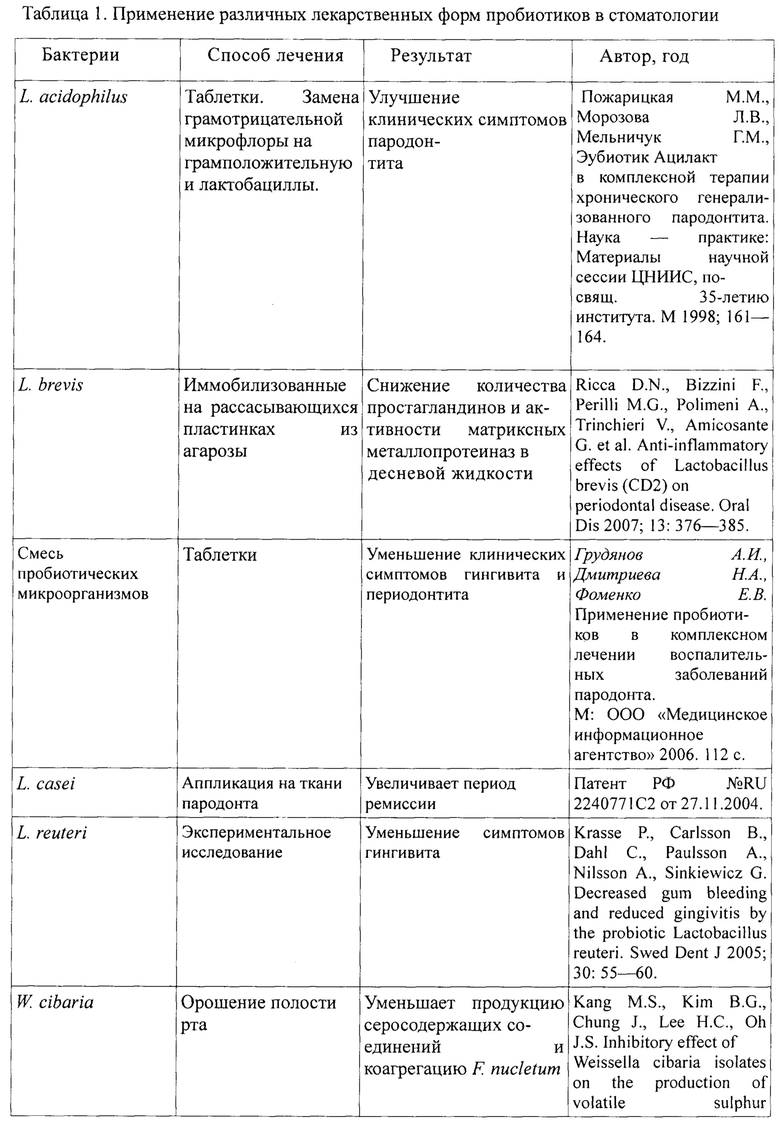
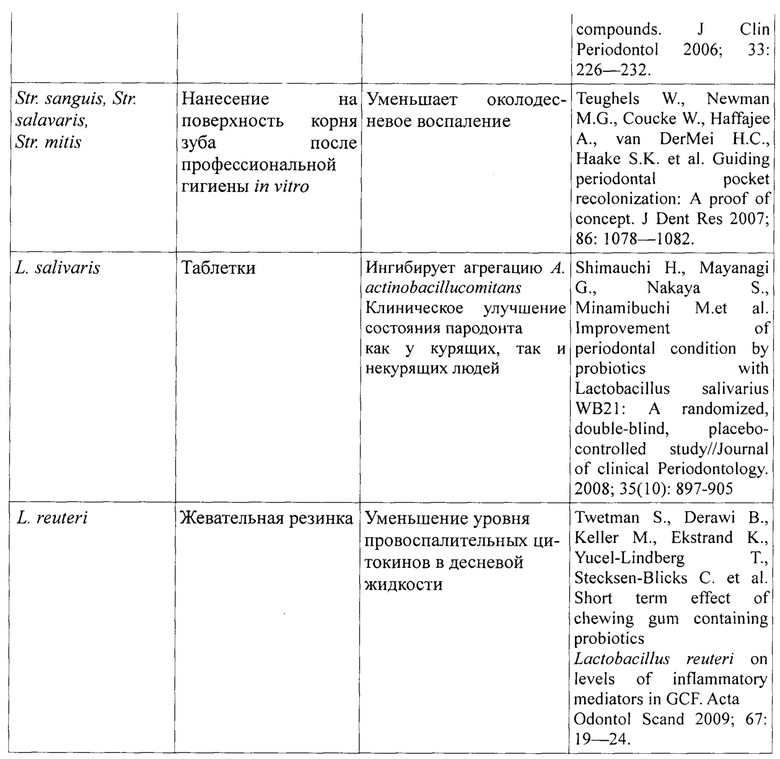
В настоящее время в терапии заболеваний пародонта применяются преимущественно сухие формы бактериальных препаратов, для активации которых в организме человека требуются 8-10 часов. В полости рта выдержать такое время экспозиции лекарства невозможно в силу физиологических особенностей, где постоянно циркулирует слюна, вымывая лекарственные препараты и снижая их концентрацию. [Биктимерова О.О. Повышение качества лечения и комплаентности пациентов с хроническим генерализованным пародонтитом на основе включения в лечебный комплекс синбиотика с живыми культурами лактобацилл: дисс.... канд. наук. - Ижевск, 2016. - 176 с].
Известны способы лечение пародонтита с использованием пробиотических штаммов в виде суспензии путем введения на тампонах в пародонтальные карманы [Амбардцумян А.Дз., Антонова С.А., Ерзинкян Л.А., Бжикян М.Г. Применение молочнокислых бактерий "Наринэ" для профилактики носительства золотистого стафилококка // Сб. "Проблемы клинической микробиологии в неинфекционной клинике. Москва, 1983. Тезисы докладов Всесоюзной научно-практической конференции, 18-19 мая, 1983 г. Винница; Грудянов А.И. Применение бактерийных препаратов в практике пародонтологии // Новое в стоматологии.- 2004. - №4. - С. 17-24.]. Наиболее предпочтительными являются синбиотики - например, Эуфлорин-L (свидетельство о гос. регистрации №RU.77.99.88.003.E.006019.04.15 от 28.04.2015), содержащий жидкий концентрат лактобактерий Lactobacillus acidophilus NK-1 в количестве не менее 108-1010 КОЕ/мл в физиологически-активном состоянии и их метаболиты. При хроническом генерализованном пародонтите легкой и средней степени тяжести предлагается включать в комплекс лечебных мероприятий курс инсталляций синбиотика «Эуфлорин-L» в пародонтальные карманы с наложением защитной повязки [Биктимерова О.О. Повышение качества лечения и комплаентности пациентов с хроническим генерализованным пародонтитом на основе включения в лечебный комплекс синбиотика с живыми культурами лактобацилл: дисс. …канд. наук. - Ижевск, 2016. - 176 с].
Общим недостатком известных способов лечения пародонтита с применением пробиотиков, включая синбиотики, является недостаточная эффективность, что обусловлено сохранением в очаге воспаления токсических бактериальных продуктов, усиливающих деструкцию тканей, и их диффузией от очага воспаления в примыкающие области.
Задача, на решение которой направлено заявленное изобретение, выражается в значительном обратном развитии воспалительно-деструктивного процесса тканей пародонта с исчезновением симптомов кровоточивости и отечности десен у больных с хроническим генерализованным пародонтитом средней степени тяжести у пациентов с коморбидной патологией.
Технический эффект, получаемый при решении поставленной задачи, выражается в разработке способа лечения хронического генерализованного пародонтита средней степени тяжести у пациентов с коморбидной патологией назначением в дополнение к комплексной базовой терапии пациентам с хроническим генерализованным пародонтитом средней степени тяжести с коморбидной патологией иммобилизованного на сорбенте - цеолите - синбиотика «LB-комплекс Л» [СГР RU.77.99.88.003.E.002522.06.18] местно (в пародонтальный карман) и перорально.
«LB-комплекс Л» - жидкий пробиотик четвертого поколения содержит три штамма лактобактерий и три штамма бифидобактерий, выращенных на гипоаллергенной основе, пребиотическую составляющую - фруктоолигосахарид - раффинозу, а консорциум живых антагонистически активных штаммов бифидо- и лактобактерий иммобилизован на энтеросорбенте - цеолите. Комплекс бифидобактерий и лактобацилл включает 6 штаммов, относящихся к видам Bifidobacterium bifidum, Bifidobacterium longum, Lactobacillus plantarum, Lactobacillus fermentum). Содержание бифидобактерий - 5,0×107 - 5,0×109 КОЕ/см3. Содержание лактобацилл - 5,0×106 - 5,0×108 КОЕ/см3. Шесть штаммов, входящих в состав пробиотика, не имеют генетически модифицированных аналогов, обладают высокой антагонистической активностью в отношении широкого спектра патогенных и условно-патогенных микроорганизмов, недетерминированной плазмидами антибиотикорезистентностью, достаточно устойчивы к действию желудочного сока и желчи.
Цеолит (матрица) не токсичен, атравматичен, обладает высокой сорбционной емкостью, эвакуируется из кишечника в течение 18-24 часов.
Раффиноза способствует селективной стимуляции роста и активизации метаболизма полезных представителей собственной микробиоты индивидуума.
В синбиотике «LB-комплекс Л» клетки микроорганизмов и частицы цеолита находятся в непосредственном контакте между собой, причем бактерии образуют биопленки - микроколонии на поверхности кристаллов. Пробиотические штаммы, иммобилизованные на цеолите, проходят кислую среду желудка, далее тонкий кишечник, и в толстом кишечнике происходит высвобождение микроорганизмов. Клетки микроорганизмов формируют достаточную для репродукциии дозу, за счет чего образуют микроколонии, интенсивно взаимодействующие с пристеночным слоем слизистой оболочки кишечника с помощью химических и электростатических сил и активно адгезируются на ней. Активное состояние лакто - и бифидобактерий, содержащихся в жидком пробиотике, усиливает скорость колонизации и обеспечивает выраженный антагонистический эффект. В то же время, по мере освобождения от бактерий, сорбент-носитель начинает осуществлять детоксицирующую функцию, адсорбируя и выводя токсины, продукты незавершенного метаболизма, патогенные и условно-патогенные бактерии, аллергены. Раффиноза, как пребиотическая составляющая, и содержащиеся в синбиотике бактериальные метаболиты способствуют росту и активизации полезных представителей собственной микробиоты индивидуума. Таким образом, применение иммобилизованного синбиотика обеспечивает обогощение микробиоты пробиотическими штаммами, угнетение патогенных и условно патогенных бактерий и активизацию нормального микробоценоза пациента, а также выведение токсинов из организма и насыщение его недостающими микроэлементами.
Способ осуществляется следующим образом.
Пациентам с хроническим генерализованным пародонтитом средней степени тяжести с коморбидной патологией проводят комплексную базовую терапию, включающую применение десенсибилизирующих, нестероидных противовоспалительных и общеукрепляющих лекарственных средств, а также обучение и контроль индивидуальной гигиены полости рта, удаление над- и поддесневых зубных отложений, проведение кюретажа пародонтальных карманов по показаниям, устранение травматической окклюзии, шинирование подвижных зубов, обработку антисептиком - 0,05% раствором хлоргексидина и заклеивание пародонтального кармана стоматологической самоклеящейся пленкой, и дополнительно назначают иммобилизованный синбиотик «LB-комплекс Л» местно - в пародонтальный карман при помощи шприца в объеме 0,1 - 0,2 мл курсом 14 дней и перорально по 10 мл в сутки на 1 - 2 приема курсом 25 дней.
Сущность заявленного изобретения поясняется чертежами, где:
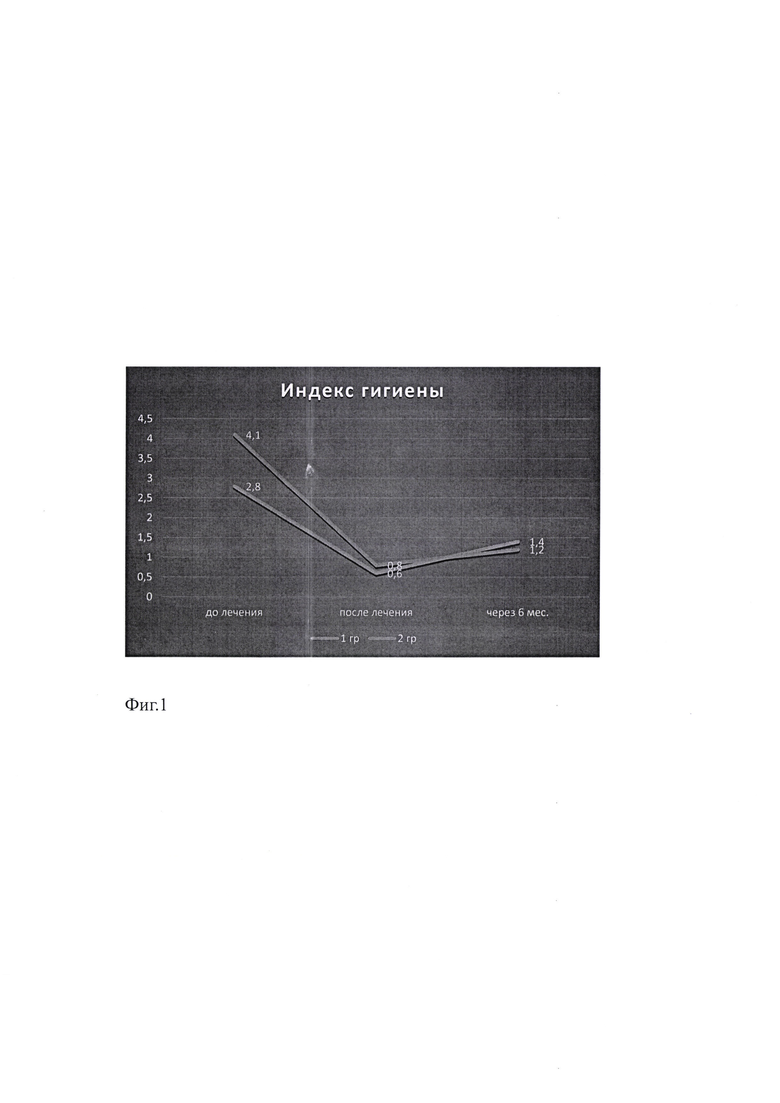
на Фиг. 1 показана сравнительная оценка индекса гигиены;
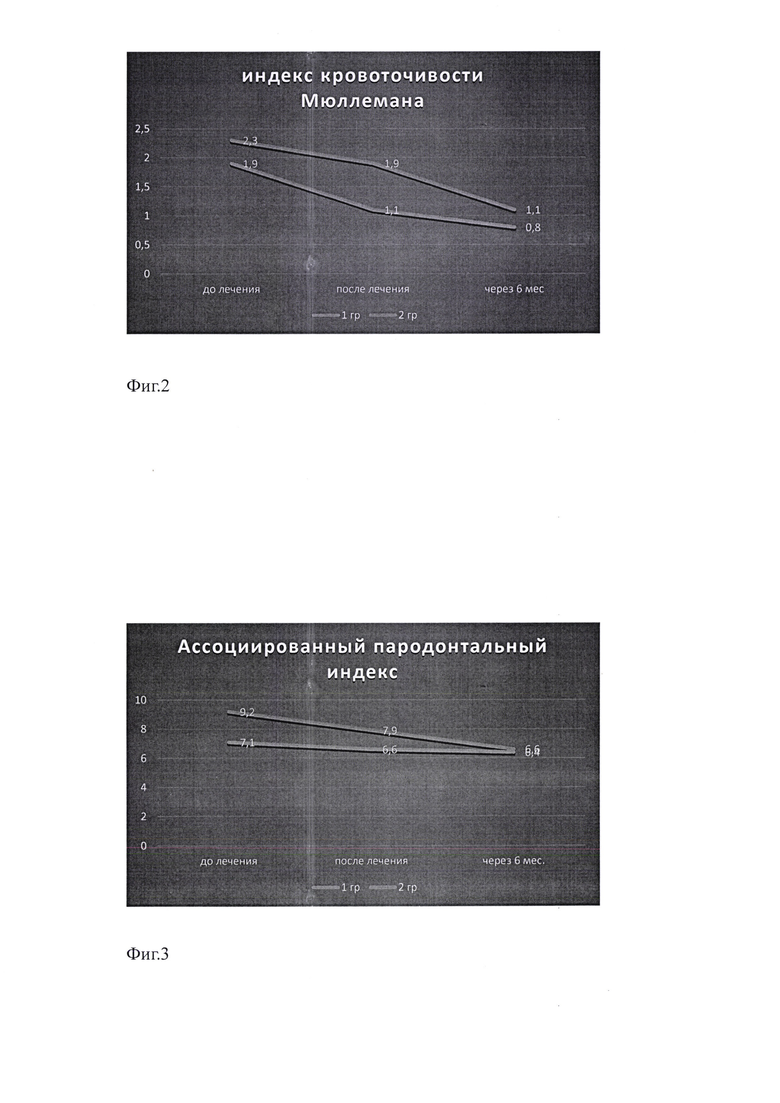
на Фиг. 2 показана сравнительная оценка индекса Мюллемана;
на Фиг. 3 показана сравнительная оценка ассоциированного пародонтального индекса;
на Фиг. 4 показана характеристика микробиоты кишечника и пародонтального кармана у двух групп больных ХГПССТ с коморбидной патологией после лечения.
Сущность способа поясняется примером.
Пример. Осуществимость способа
Для подтверждения осуществимости способа формировали две группы пациентов: основную и группу сравнения. Основная группа (группа 2) - 61 пациент обоего пола (25 женщин и 34 мужчины) в возрасте от 18 до 65 лет с хроническим генерализованным пародонтитом средней степени тяжести (ХГПССТ) и коморбидной хронической соматической патологией: заболевания желудочно-кишечного тракта, эндокринной, сердечно-сосудистой систем. Группа сравнения (группа 1) - 32 пациента, сопоставимая по возрасту, полу, основной и коморбидной патологии. Пациенты обеих групп получали базовую терапию, включавшую применение десенсибилизирующих, нестероидных противовоспалительных и общеукрепляющих лекарственных средств, а также обучение и контроль индивидуальной гигиены полости рта, удаление над- и поддесневых зубных отложений, проведение кюретажа пародонтальных карманов по показаниям, устранение травматической окклюзии, шинирование подвижных зубов, обработку антисептиком - 0,05% раствором хлоргексидина и заклеивание пародонтального кармана стоматологической самоклеящейся пленкой с хлоргексидином ДИПЛЕН-ДЕНТА X. Пациентам основной группы дополнительно назначали иммобилизованный синбиотик «LB-комплекс Л» местно - в пародонтальный карман при помощи шприца в объеме 0,2 мл, курсом 14 дней и перорально по 10 мл в сутки на 1 прием курсом 25 дней.
Обследование пародонтологических пациентов обеих групп (93 человека) до и после лечения проводили путем стандартного осмотра с использованием пародонтального зонда, определения пародонтальных индексов: упрощенного индекса гигиены Грина-Вермиллиона (ИГР-У), индекса кровоточивости Мюллемана, многофакторного индекса тяжести течения воспалительного процесса - ассоциированного пародонтального индекса (АПИ) [Гажва С.И., Воронина А.И., Шкаредная О.В. Анализ клинико-иммунологического статуса полости рта у пациентов с хроническим генерализованным пародонтитом легкой и средней степеней тяжести при использовании антибактериальных средств // Стоматология. - 2010. - Т. 89. - №3. - С 30-33.]. При заполнении медицинской карты стоматологического больного также отражали результаты бактериологического обследования микробиоценозов пародонтального кармана и просвета толстой кишки. Изучение и оценку качественного и количественного состава биоценоза пародонтального кармана проводили модифицированным методом [Правосудова Н.А., Мельников В.Л. Микробиология полости рта: учеб. метод. пособие для вузов. - 2013. - 89 с; Сахарук Н.А. Микробная флора полости рта в норме и патологии. Морфология грибов рода Candida // Вестник ВГМУ. - 2008. - Том 7. - №2. - С. 137 - 143.]. Качественный и количественный состав биоценоза ЖКТ изучали и оценивали с использованием унифицированной методики исследования и критериев оценки состояния микробиоты просвета толстой кишки [Точилина А.Г., Белова И.В., Соловьева И.В. [и др.] Критерии оценки состава биоценоза просвета толстой кишки // Справочник заведующего КДЛ. - 2016. - №8. - С. 54-78.; Отраслевой стандарт ОСТ 91500.11.0004 - 2003 «Протокол ведения больных. Дисбактериоз кишечника» (утв. Приказом Минздрава РФ от 9 июня 2003 г. №231/]. Выделенные культуры идентифицировали методом MALDI TOF масс-спектрометрии на масс-спектрометре Autoflex speed Bruker, программный комплекс Biotyper. Экспертную оценку состояния пародонта по клиническим и микробиологическим показателям у пациентов обеих групп проводили до лечения, сразу после проведенного клинического этапа терапии (через 14 дней) и в отдаленные сроки - спустя 6 месяцев. Состояние микробиоценоза толстой кишки оценивали до лечения и через 5-10 дней после проведенного в течение 25 дней курса лечения. Результаты индексной оценки в динамике представлены в таблице 2.

По результатам клинического обследования и оценки индексных показателей у 98% больных с ХГПССТ выявляли неудовлетворительную гигиену полости рта, а также высокие показатели индекса Мюллемана и АПИ.
Анализ полученных результатов гигиены полости рта пациентов с ХГПССТ до начала лечения визуализировал минерализированные и неминерализированные зубные отложения. Показатели индекса гигиены в группе сравнения находились в интервале 3,8±0,08, у пациентов основной группы - 4,1±0,06 баллов, что соответствовало плохой гигиене полости рта у всех пациентов. Сразу после лечения пародонтита, обучения и контроля индивидуальной гигиены полости рта наблюдали заметное улучшение гигиенического состояния полости рта пациентов обеих групп - 0,6±0,07 и 0,8±0,07 баллов, что соответствовало хорошей гигиене полости рта. При проведении контрольного осмотра спустя 6 месяцев после лечения отмечали небольшое ухудшение уровня индивидуальной гигиены. При этом в основной группе уровень гигиены оценивали как хороший - 1,2±0,04 балла, хоть и на нижней границе шкалы, а в группе сравнения - как удовлетворительный -1,6±0,03 балла.
Наблюдали положительную динамику клинического состояния тканей пародонта, в частности снижение кровоточивости, определяемой индексом Мюллемана. Так, до начала лечения у пациентов основной группы степень кровоточивости оценивали как плохую - 2,1±0,04 баллов, а в группе сравнения - как средней степени тяжести - 1,9±0,03 баллов. После проведенного пародонтологического лечения степень кровоточивости снижалась в обеих группах: до 1,1±0,04 баллов в группе 1 и 1,3±0,02 баллов в группе 2, что соответствовало средней степени тяжести течения процесса. Контрольный осмотр через 6 месяцев показал в основной группе хорошее состояние тканей (0,8±0,05 баллов), а в группе сравнения - средней степени тяжести (1,3±0,04 балла).
Ассоциированный пародонтальный индекс до начала лечения в группе 1 составил 8,7±0,09, в группе 2 - 9,2±0,12 баллов, что соответствовало средней степени тяжести течения патологического процесса в пародонте, но в группе 2 приближался к тяжелой степени тяжести. В результате проведенного лечения отмечали снижение индекса АЛИ до 7,6±0,08 баллов в группе 1 и 7,9±0,10 баллов в группе 2. Спустя 6 месяцев в обеих группах пациентов показатели индекса АПИ составили в группе сравнения 7,1±0,11, в основной группе - 6,6±0,09 баллов, что соответствовало пародонтиту средней степени тяжести, но при этом в основной группе нахождение параметра на нижней границе интервала можно расценивать как отсутствие или существенное снижение воспалительного компонента.
При бактериологическом исследовании отделяемого пародонтального кармана, проведенном до начала лечения, установили, что в обеих группах у 16,6% пациентов выделяли S. aureus в количестве 103-106 КОЕ/мл. Коагулазонегативные стафилококки идентифицировали у 66,6% пациентов. Чаще всего обнаруживали S. epidermidis (у 37,5% пациентов), в наибольшем количестве (105-106 КОЕ/мл) выделяли S. epidermidis, S. warneri, S. xylosus, S. felis. Нейссерии обнаруживали у 87,5% пациентов в количестве 103-106 КОЕ/мл. Из 12 идентифицированных видов нейссерий с наибольшей частотой выделяли N. mucosa (у 33,3% пациентов), N. flavescens и N. elongata (у 29,1% пациентов), N. macacae (у 25,0% пациентов). Наибольшей видовой представленностью характеризовался род Streptococcus - всего идентифицировали 21 вид. Чаще всего выделяли S. oralis (у 83,3% пациентов), S. sanguinis (у 66,6% пациентов), S. vestibularis (у 62,5% пациентов), S. pneumoniae (у 58,3% пациентов), S. anginosus (у 54,1% пациентов), S. salivarius (у 50,0% пациентов). В наибольшем количестве (107 КОЕ/мл) обнаруживали S. sanguinis, S. cristatus, S. pseudopneumoniae, S. gordonii. Представители семейства Lactobacillaceae (17 видов) выделяли преимущественно в количестве 103 КОЕ/мл. С большей частотой выделяли L. gasseri (у 25,0% пациентов), L. paracasei (у 16,6% пациентов), L. oris (у 12,5% пациентов). Гемофилы обнаруживали у 16,6% пациентов в количестве 104-107 КОЕ/мл. Дрожжеподобные грибы рода Candida выделяли у 25,0% обследованных. С равной частотой выявляли С.albicans, С.lambica, С.lusitaniae, С.kejyr в количестве 105-107 КОЕ/мл. Представители рода Veillonella обнаруживали у 95,8% пациентов. У 66,6%) пциентов выделяли V. parvula, в 29,2% - V. atypica. Две трети Veillonella spp. из отделяемого зубодесневого кармана выявляли в количестве 10-104 КОЕ/мл. Среди 12 выделенных видов превотелл P. nigrescens, P. oralis, P. denticola обнаруживали в количестве 105 КОЕ/мл. Количественная представленность других видов колебалась от 10 до 103 КОЕ/мл. Из микроорганизмов рода Actinomyces преимущественно выделяли A. naeslundii (у 37,5% пациентов), А. odontolyticus (у 29,2% пациентов) и A. oris (у 25,0% пациентов), количество которых у разных пациентов колебалось в широком диапазоне - от 10 до 107 КОЕ/мл. У 45,8% пациентов из отобранных образцов выделяли Fusobacterium nucleatum в количестве 103-105 КОЕ/мл. Кроме того, у 25,0% пациентов обнаруживали Selenomonas spp. с преобладанием S. noxia в количестве 105 КОЕ/мл; у 20,8%) паиентов - единичные клетки Clostridium spp.; у 16,6% пациентов - Rothia mucilaginosa в количестве от 103 до 105 КОЕ/мл, у 16,6% пациентов - Capnocytophaga spp.в количестве от 10 до 105 КОЕ/мл. Прочие бактерии (более 40 родов, включавших от одного до четырех видов) идентифицировали у отдельных пациентов в единичных случаях, формируя индивидуальные профили микробиоты.
При оценке общего состояния микробиоты пародонтального кармана до лечения дисбиотические нарушения I степени выявляли у 29,2% обследованных, II степени - у 45,8%), III степени - у 25%.
В группе сравнения после базовой терапии нормальные значения микробиоты обнаруживали у 15,7% пациентов, дисбиотические нарушения I степени - у 59,2%, II степени - у 25,0%, дисбиоза III степени не выявляли.
После проведенного лечения в основной группе снизилась частота выделения стафилококков. S. aureus обнаруживали у 10,5%) пациентов в количестве, не превышавшем 104 КОЕ/мл. Сократилось число видов коагулазонегативных стафилококков, из которых идентифицировали только S. capitis и S. epidermidis в количестве 103-104 КОЕ/мл. В видовой структуре нейссерий преобладавшими по частоте выделения стали N. flavescens (у 42,1% пациентов), N. mucosa (у 26,3% пациентов), N. elongata (у 26,3% пациентов). Частота выделения стрептококков незначительно уменьшилась: S. oralis выделяли у 73,6% пациентов, S. pneumoniae - у 68,4%, S. salivarius и S. vestibularis - у 63,1%, S. anginosus - у 47,3%, S. sanguinis - у 42,1%. Количество выделяемых стрептококков колебалось от 10 до 106 КОЕ/мл. В отделяемом пародонтального кармана возросла численность видов лактобацилл, выделяемых в количестве 105-106 КОЕ/мл. В таком титре обнаруживали L. gasseri, L. paracasei, L. rhamnosus, L. plantarum, L. oris, L. amylovorus, L. frumentii, L. fermentum. Снизилась частота (5,2%) и количество (103 КОЕ/мл) выделения Haemophylus parainfluenzae. После проведенного лечения только у 5,2% пациентов в исследуемом субстрате обнаруживали единичные клетка С.albicans. Других представителей рода Candida не выявляли. Частота, количество и видовая структура выделяемых вейлонелл и превотелл практически не изменились. Среди видов актиномицет после лечения чаще всего выделяли A. oris (у 36,8% пациентов), A. naeslundii обнаруживали только у 10,5% пациентов. Количество выделяемых актиномицет не превышало 106 КОЕ/мл. Selenomonas spp. после лечения обнаруживали у 42,1% пациентов в количестве 105-107 КОЕ/мл. После лечения снизились частота и количество выделения Capnocytophaga spp. При оценке общего состояния микробиоты пародонтального кармана в основной группе после лечения микробиоценоз нормализовался у 73,7% обследованных, у 26,3% обследованных состояние микробиоты улучшилось: дисбиоз I - II степени сменился компенсированным дисбиозом.
Сочетанный дисбиоз кишечника и пародонтального кармана до лечения выявляли у 83,3%) пациентов, у 16,6% пациентов обнаружен дисбиоз пародонтального кармана на фоне нормальной микробиоты кишечника. После лечения микробиоценоз кишечника и пародонтального кармана нормализовался в группе сравнения только у 15,7% обследованных, в то время как в основной группе - у 13,1% обследованных, кроме того, в основной группе у 26,3% пациентов отмечали положительную динамику восстановления микробиоценозов.
До обследования в микробиоте фекалий пациентов обеих групп бифидобактерий обнаруживали у 100,0% пациентов, у 37,5% пациентов - в сниженном количестве - 106-107 КОЕ/мл. С наибольшей частотой выделяли В. longum (у 75,0% пациентов), В. adolescentis (у 62,5% пациентов), В. bifidum (у 33,3% пациентов). В единичных случаях выделяли В. dentium, В. pseudocatenulatum, В. animalis, В. catenulatum, В. angulatum. Представители семейства Lactobacillaceae были обнаружены у 70,8% обследованных, причем у 29,1% обследованных в количествах менее 107 КОЕ/мл. У 21,0% пациентов лактобациллы в микробиоте просвета толстой кишки отсутствовали. Наиболее часто в фекалиях обнаруживали L. gasseri (у 45,8% пациентов), L. paracasei и L. vaginalis (у 29,1% пациентов) L. oris (у 25,0% пациентов), L. crispatus и L. salivarius (у 20,8% пациентов). Представители других родов и видов выделяли в единичных случаях. Bacteroides spp. выделяли в сниженных количествах у 91,6% пациентов, в количестве 108 КОЕ/мл - у 41,6% пациентов. С наибольшей частотой выделяли В. uniformis и В. ovatus (у 33,3% пациентов), В. vulgatus и В. thetaiotaomicron (у 25,0% пациентов). E.coli обнаруживали у всех обследованных пациентов, у 41,6% пациентов в сниженных количествах - 106 КОЕ/мл и менее. У 4,2% пациентов выявляли лактозонегативные кишечные палочки. Энтерококки обнаруживали у 50,0% пациентов (105-108 КОЕ/мл). Чаще всего из фекалий выделяли Е. faecalis (у 33,3% пациентов) и E.faecium (у 16,6% пациентов). У 52,6% обследованных пациентов выделяли различные виды клостридий, количество которых не превышало 10 КОЕ/мл, что соответствовало показателям нормы. В единичных случаях обнаруживали в повышенных количествах С. innocuum (106 КОЕ/мл) и С. perfringens (107 КОЕ/мл). У 12,5% пациентов обнаруживали S. aureus, у 41,2% пациентов - коагулазонегативные стафилококки, причем у 12,5% пациентов в значимых количествах - более 105 КОЕ/мл. Условно-патогенные микроорганизмы порядка Enterobacterales в значимых количествах (≥105 КОЕ/мл) обнаруживали у 45,8% пациентов, с наибольшей частотой выделяли Enterobacter cloaceae (у 16,6% пациентов) и Klebsiella pneumoniae (у 12,5% пациентов). В меньших количествах и с меньшей частотой выделяли Proteus mirabilis, М. morganii, Raoultella ornithinolytica, Citrobacter freundii. Дрожжеподобные грибы рода Candida идентифицировали в микробиоте просвета толстой кишки у 70,8% обследованных. В наибольших количествах (105-107 КОЕ/мл) выделяли С. kefyr, С. lusitaniae. С. albicans обнаруживали с большей частотой - у 54,2% пациентов, но в меньшем количестве - 102-104 КОЕ/мл. В единичных случаях выявляли С. crusei, С. tropicalis, С. guillermondii, С. parapsilosis, С. dublinensis, С. glabrata. Из грамотрицательных неферментирующих бактерий в значимых количествах (≥105 КОЕ/мл) в единичных случаях обнаруживали P. aeruginosa, Acinetobacter Iwoffii, Comamonas testosteroni. В значительном количестве (106-107 КОЕ/мл) идентифицировали стрептококки различных видов: S. lutetiensis, S. pleomorphus, S. salivarius, S. sanguinis, S. gallolyticus, S. vestibularis, S. parasanguinis, а также Collinsella aerofaciens, Eggerthella lenta, Streptomyces lavendulae. Следует отметить, что указанные виды стрептококков выделяли в единичных случаях, но при этом частота выделения бактерий рода Streptococcus в целом составила 45,8%). При оценке общего состояния микробиоты просвета толстой кишки до лечения дисбиотические нарушения I степени выявляли у 50,0% обследованных, II степени - у 33,3%, III степени - у 8,3%, нормальный микробиоценоз обнаруживали у 8,3% пациентов.
После проведенного лечения у пациентов группы сравнения положительной динамики восстановления нарушенного микробиоценоза кишечника не наблюдали.
В основной группе после комплексного лечения отмечали увеличение количества бифидобактерий и лактобацилл в микробиоте просвета толстой кишки до 108-109 КОЕ/мл у 94,7% и у 100,0% пациентов соответственно. Bacteroides spp. выделяли у 100,0% пациентов, у 73,6% пациентов - в количестве 108 КОЕ/мл. Оппортунистические микроорганизмы порядка Enterobacterales и семейства Staphylococcaceae в значимых количествах (≥105 КОЕ/мл) обнаруживали у 15,7% пациентов основной группы против 45,8% пациентов группы сравнения. Отмечено снижение частоты обнаружения дрожжеподобных грибов рода Candida в микробиоте просвета толстой кишки пациентов основной группы до 47,3%, тогда как в группе сравнения частота выделения этих микроорганизмов не изменилась (70,8%). В основной группе после лечения микробиоценоз нормализовался у 87,5% обследованных, у 12,5% обследованных состояние микробиоты кишечника улучшилось: резко и умеренно выраженные дисбиотические нарушения III и II степени изменились до слабовыраженных нарушений I степени.
Проведенные исследования показали, что назначение в дополнение к комплексной базовой терапии пациентам с хроническим генерализованным пародонтитом средней степени тяжести с коморбидной патологией синбиотика «LB-комплекс Л» (сочетанно - в виде аппликаций в пародонтальный канал и перорально) обеспечивает стойкую ремиссию патологического процесса в пародонте, нивелирует влияние воспалительного компонента на течение пародонтита, восстанавливает микробиоценоз десен и желудочно-кишечного тракта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ НЕОБХОДИМОСТИ ПРОВЕДЕНИЯ ЛАЗЕРНОЙ ДЕЭПИТЕЛИЗАЦИИ ПАРОДОНТАЛЬНОГО КАРМАНА ПРИ ЛЕЧЕНИИ ХРОНИЧЕСКОГО ГЕНЕРАЛИЗОВАННОГО ПАРОДОНТИТА | 2013 |
|
RU2569764C2 |
| Способ прогнозирования тяжести пародонтитов по составу условно-пародонтопатогенных видов микробиома корня языка | 2021 |
|
RU2773275C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ПАРОДОНТИТА | 2023 |
|
RU2808191C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2009 |
|
RU2400243C1 |
| Способ диагностики степени пародонтита по определению протеинолитической активности микроорганизмов ротовой жидкости | 2020 |
|
RU2768493C1 |
| ЗУБНЫЕ ПАСТЫ НА ОСНОВЕ МЕТАЛЛОКОМПЛЕКСА ЦИНКА С ПРОИЗВОДНЫМИ 1-АЛКЕНИЛИМИДАЗОЛА | 2010 |
|
RU2453300C2 |
| СПОСОБ ЛЕЧЕНИЯ БИОГЕЛЕМ ЛАМИФАРЭН ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ПАРОДОНТА У ЛИЦ МОЛОДОГО ВОЗРАСТА | 2013 |
|
RU2539191C1 |
| Способ лечения хронического генерализованного пародонтита | 2020 |
|
RU2752713C1 |
| СПОСОБ МЕСТНОГО ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2009 |
|
RU2400174C1 |
| СТОМАТОЛОГИЧЕСКИЙ ГЕЛЬ | 2022 |
|
RU2806865C1 |

Изобретение относится к медицине, а именно к стоматологии и может быть использовано для лечения генерализованного пародонтита средней степени тяжести у пациентов с коморбидной патологией. Дополнительно к комплексной базовой терапии назначают иммобилизованный синбиотик «LB-комплекс-Л» местно в пародонтальный карман, который вводят при помощи шприца в объеме 0,1-0,2 мл курсом 14 дней, и перорально по 10 мл в сутки на 1-2 приема курсом 25 дней. Способ обеспечивает стойкую ремиссию патологического процесса в пародонте, нивелирует влияние воспалительного компонента на течение пародонтита, восстанавливает микробиоценоз десен и желудочно-кишечного тракта за счет введения синбиотика. 4 ил., 2 табл., 1 пр.
Способ лечения хронического генерализованного пародонтита средней степени тяжести у пациентов с коморбидной патологией, включающий применение десенсибилизирующих, нестероидных противовоспалительных и общеукрепляющих лекарственных средств, обучение и контроль индивидуальной гигиены полости рта, удаление над- и поддесневых зубных отложений, проведение кюретажа пародонтальных карманов по показаниям, устранение травматической окклюзии, шинирование подвижных зубов, обработку антисептиком и заклеивание пародонтального кармана стоматологической самоклеящейся пленкой, отличающийся тем, что дополнительно назначают иммобилизованный синбиотик «LB-комплекс-Л» местно в пародонтальный карман, который вводят при помощи шприца в объеме 0,1-0,2 мл курсом 14 дней, и перорально по 10 мл в сутки на 1-2 приема курсом 25 дней.
| Биктимерова О.О | |||
| Повышение качества лечения и комплаентности пациентов с хроническим генерализованным пародонтитом на основе включения в лечебный комплекс синбиотика с живыми культурами лактобацилл: дисс | |||
| канд | |||
| наук | |||
| - Ижевск, 2016 | |||
| Приспособление для удаления таянием снега с железнодорожных путей | 1920 |
|
SU176A1 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО ПРЕПАРАТА ИЗ ЖИВЫХ ШТАММОВ МИКРООРГАНИЗМОВ ЛАКТО- И БИФИДОБАКТЕРИЙ "LB-КОМПЛЕКС Л" | 2010 |
|
RU2441907C1 |
| RU 2011133396 A, 09.08.2011 | |||
| СПОСОБ ЛЕЧЕНИЯ ПАРОДОНТИТА | 2009 |
|
RU2400243C1 |
| US 20060018843 A1, | |||
Авторы
Даты
2023-02-01—Публикация
2022-03-01—Подача