Изобретение относится к биотехнологии, а именно к медицинской и пищевой, и может быть использовано для приготовления лечебно-профилактических препаратов, биологически активных добавок и продуктов питания с использованием в качестве стартерных культур живых пробиотических штаммов микроорганизмов.
Широко известны препараты, направленные на восстановление нормального биоценоза кишечника, в частности эубиотики - бактерийные препараты из живых микроорганизмов - представителей облигатной микрофлоры кишечника - это колибактерин, лактобактерин, бифидумбактерин, бификол и т.п. сухие препараты (см. книгу под ред. В.А.Княжева. Дисбактериозы. Теория и практика. Нижний Новгород, 1999, с.70-73).
При всех положительных качествах этих препаратов при использовании их в сухом виде теряются многие свойства. При высушивании препарата снижается количество живых штаммов микроорганизмов, для активизации антагонистической активности штаммов необходимо длительное время экспозиции в кишечнике человека.
Известен препарат-пробиотик в сухой иммобилизованной форме (патент РФ №2164801, A61K 35/74, A23C 9/12, C12N 1/08, опубликован 10.04.2001), включающий носитель, представляющий собой сорбент и клетки эубиотиков, иммобилизованные на указанном носителе, причем клетки эубиотиков используют совместно с питательной средой, а в качестве сорбента используют материал с антацидными свойствами, развитой мезо- и макропористой структурой и объемом макропор не менее 0,01 см3/г в виде порошка с размером частиц не менее 0,1 мм или в виде гранул размером 0,1-5,0 мм или в виде таблеток, препарат дополнительно содержит защитную среду, а клетки эубиотиков с питательной средой представляют собой сухой концентрат бифидобактерий на молочной основе с титром 108-1010 КОЕ/г и с содержанием аминокислот (мг/100 г сухой биомассы):
Глутаминовая кислота - 15,0-68,0
Глутамин - 8,0-20,0
Лейцин - 10,0-50,0
Аргинин - 20,0-30,0
Цистеин - 50,0-80,0
При следующем соотношении компонентов препарата в сухом виде, мас.%:
Клетки эубиотиков с питательной средой и титром 108-1010 КОЕ/г - 0,1-10,0
Защитная среда - 0,1-10,0
Носитель-сорбент - остальное до 100%,
в качестве защитной среды используют желатин, сахарозу, аскорбиновую кислоту и хлористый натрий при следующем содержании компонентов, мас.%:
Желатин - 8,5-11,5
Аскорбиновая кислота - 0,8-1,2
Хлористый натрий - 1,7-3,0
Сахароза - остальное до 100%,
в качестве сорбента используют пористый материал на основе оксида алюминия с гидрофильно-гидрофобной топохимией поверхности, например энтеросорбент СУМС, модифицированный углеродом;
препарат в качестве бактерий-эубиотиков дополнительно содержит сухую закваску вязких штаммов ацидофильных бактерий Lactobacillus acidophilus типа AB, соотношение которых с сухим концентратом бифидобактерий составляет 1: (8-9) соответственно;
в качестве бифидобактерий в сухом концентрате используют Bifidobacterium bfidum N1 или N 791, или ЛВА-3, или Bifidobacterium longum 379, или Bifidobacterium adolescentis МС-42, или смесь указанных штаммов, взятых в равных весовых долях.
Недостатки данного препарата следующие.
1. Во-первых, в сухих препаратах клетки микроорганизмов находятся в глубоком анабиозе, причем процесс перехода из анабиоза в активное состояние занимает 8-10 часов (тогда как процесс пищеварения у детей - 4 часа); лиофилизация нарушает структуры поверхностных белков-адгезинов, что снижает колонизационную способность бактерий; в процессе сушки большая часть метаболитов разрушается, в частности, ценные органические кислоты: уксусная, молочная, витамины С и К.
2. Во-вторых, биомасса стартерных культур наращивается на молочной питательной среде до количества живых микробных клеток в биомассе 109-1011 КОЕ/мл, далее жидкая биомасса смешивается с сухим сорбентом СУМС, процесс иммобилизации проходит в течение 1,0-1,5 часа при температуре +4°C до полной иммобилизации клеток на носитель. Далее полученный продукт промывают в изотоническом растворе NaCl по МУК 4.2.577-96 п.7.1. п.7.10, проверяют количество живых микроорганизмов в единице объема, причем сорбция считается завершенной, если в отобранной пробе промывочного раствора остается не более 50% от исходного количества микроорганизмов что, безусловно, снизит количество живых до 2·108-2·1010 КОЕ/мл. Затем добавляют защитную среду и сушат в условиях низкотемпературного лиофильного высушивания. Известно, что при применении любого вакуум-сушильного оборудования при существующих технологиях высушивания препарата количество живых микробных клеток снижается на два порядка, то есть в результате в предлагаемом препарате количество живых КОЕ/мл в контроле готового препарата при закладке биомассы 2·108-2·1010 КОЕ/мл на выходе будет в лучшем случае 106-108 КОЕ/мл. То есть отличие иммобилизованных форм от сухих по выходу количества живых микробных клеток ожидать невозможно.
3. В-третьих, выращивание исходных штаммов на классической молочной среде не дает большой выход биомассы.
4. В-четвертых, СУМС-1 специально готовится искусственным способом из окиси алюминия, покрытой углеродной пленкой черного цвета
В качестве прототипа принят способ приготовления лечебно-профилактического препарата на основе живых штаммов микроорганизмов «LB-комплекс» (патент РФ №2192269, A61K 35/74, A23C 9/127, C12N 1/20, C12R 1:07, 1:225, 1:25, опубликован 10.11.02), включающий раздельное культивирование штаммов бифидо- и лактобактерий и смешивание их в соотношении 1:1 по окончании культивирования. Культивирование проводят на гидролизатно-молочной среде (ГМС). В качестве основы ГМС используют гидролизат обезжиренного молока и дополнительно вводят аскорбиновую кислоту в количестве 230-250 мг на 1000 мл гидролизата. Готовый препарат расфасовывают во флаконы с учетом необходимой суточной дозы. Способ позволяет получить готовый к употреблению препарат, воздействующий на бифидо- и лактокомпоненты микрофлоры человека, с длительным сроком годности.
Недостатки данного способа следующие.
1. Во-первых, исходное сырье для приготовления гидролизата - обрат молока, нестабильный продукт, его качество зависит от многих факторов. Панкреатин, используемый в качестве фермента для проведения гидролиза, не обеспечивает полный гидролиз белка из-за отсутствия минорных ферментативных составляющих. В связи с этим приготовленный гидролизат имеет низкий уровень аминного азота (150-250 мг%, табл.1), что обуславливает применение неразведенного гидролизата обрата молока по данному способу.
Из таблицы 1 видно, что панкреатин не обеспечивает полное расщепление белка. В качестве маркера полноты гидролиза принято использовать определение уровня триптофана в готовом полупродукте, т.е. чем выше содержание триптофана, тем более полно прошел гидролиз.
2. Во-вторых, данный способ предусматривает приготовление классического мультиштаммового пробиотического препарата без пребиотической составляющей, что снижает вероятность приживляемости микроорганизмов в толстом кишечнике и не обеспечивает дополнительный субстрат для их размножения.
3. В-третьих, отсутствие сорбента-носителя не обеспечивает иммобилизацию штаммов микроорганизмов, что снижает вероятность сохранности биомассы при прохождении через агрессивно-кислую среду желудка.
Эти недостатки устраняются предлагаемым решением.
Решаемая задача - совершенствование способа приготовления иммобилизованного пробиотика, обогащенного фруктоолигосахаридом (ФОС), в форме бактериального концентрата на основе живых штаммов микроорганизмов.
Технический результат - получение препарата синбиотика с высоким содержанием живых микробных клеток нескольких штаммов лакто- и бифидобактерий, обладающего повышенным защитным лечебным действием за счет введения в состав фруктоолигосахарида в качестве пребиотической составляющей и иммобилизации штаммов-пробиотиков на сорбенте.
Этот результат достигается тем, что в способе приготовления лечебно-профилактического препарата из живых штаммов микроорганизмов лакто- и бифидобактерий путем их культивирования на питательной среде, содержащей питательную основу - гидролизат казеина, разведенный дистиллированной водой, хлористый натрий, углеводную составляющую, агар-агар, кислую составляющую, расфасовку жидкого препарата с учетом необходимой для пациентов суточной дозы, в качестве гидролизата питательной основы используется гидролизат казеина, расщепленный поджелудочной железой крупного рогатого скота (табл.1), в качестве углеводной составляющей используют лактозу и раффинозу в соотношении 1:1 (табл.2), причем раффиноза является как углеводным компонентом, так и пребиотической составляющей, по окончании раздельного культивирования смесь штаммов добавляют к сорбирующему компоненту, расфасованному по флаконам, так что его доля составляет 1/2-1/4 часть общего объема созданной комплексной системы, которую затем выдерживают для иммобилизации на сорбенте при температуре +6±2°С в течение 18-24 часов; в качестве сорбирующего компонента используют БАД к пище «Литовит М», а в качестве штаммов-продуцентов используют L.plantarum, L.fermentum, B.bifidum, B.longum.
Таким образом, предложен оптимальный комплекс, позволяющий получить иммобилизованный препарат с высоким содержанием живых микробных клеток всех шести стартерных культур в единице объема с длительным сроком хранения и с пребиотической составляющей.
Способ осуществляется следующим образом: готовят основу жидкого иммобилизованного синбиотика гидролизатно-казеиновую среду (ГКС) по следующей схеме: разводят казеин в теплой питьевой воде, добавляют молотую поджелудочную железу, доводят температуру до 48 ±1°C, устанавливают pH 10-20% раствором NaOH, перемешивают, добавляют хлороформ и помещают в термостат на 72 часа, первый час постоянно перемешивают, затем фильтруют через бумажный фильтр. В готовом гидролизате контролируют аминный азот, разводят гидролизат дистиллированной водой до аминного азота 160-170 мг%, добавляют агар-агар, хлористый натрий, пептон, лактозу, раффинозу, аскорбиновую кислоту и стерилизуют.
Культивирование штаммов-продуцентов лакто- и бифидобактерий проводят по единому способу - каждый штамм отдельно в три этапа. По окончании культивирования биомассы отдельных штаммов смешивают, предпочтительнее в соотношении 1:1 и расфасовывают во флаконы с предварительно дозированным и стерилизованным сорбентом с учетом суточной дозы 5-10 мл, выдерживают в холодильной камере при t=6±2°C. Затем флаконы маркируют, фасуют в коробки по 25 штук (минимальный курс лечения). В качестве сорбента используют природный цеолит, относящийся к алюмосиликатам (клиноптилолит группы гейландита) Холинского месторождения в форме БАД к пище «Литовит М». Данный препарат применяется в качестве сорбента в медицинской практике с 80-х годов прошлого века, обладает уникальными свойствами селективного ионного обмена, поставляет в организм недостающие макро-, микро- и ультрамикроэлементы, нано- и пикоэлементы, если их не хватает и убирает их из организма, если они находятся в избытке [Бгатов В.И. Подходы к экогеологии», Новосибирск, НГУ, 1993]. Важным также является каталитическое свойство цеолита, что способствует нормализации всех биохимических процессов в организме. Доказано, что использование природного цеолита (БАД к пище «Литовит») дает целый ряд положительных эффектов, таких как антитоксический эффект, выведение из организма тяжелых металлов, иммуномодулирующий эффект, антианемический эффект, нормализация липидного, белкового и углеводного обмена, гепатопротекторный эффект, оптимизирует работу ферментов и т.п. [Агаджанян Н.А. с соавт. «Природные минералы на службе человека, Новосибирск, 2000].
Пример осуществления способа.
На первом этапе готовят впрок полупродукт - гидролизат казеина следующим образом: питьевую воду (ГОСТ 2874-82) нагревают до 48°C, засыпают казеин (казеин пищевой кислотный по ОСТ 4960-74) в количестве 60-70 г на литр, размешивают, доводят pH до 7,8-8,2 ЕД 20% раствором NaOH, ставят в термостат при 48°C на два часа для набухания, затем добавляют промолотую поджелудочную железу (ГОСТ 11285-93) в количестве 60-70 г/л и хлороформ в количестве 10 мл/л, доводят pH до 7,9-8,0 ЕД 10-20%) раствором NaOH и ставят в термостат при температуре 48°C. В течение первого часа содержимое несколько раз перемешивают (пробку после встряхивания прокалывают для удаления паров хлороформа) и оставляют для осуществления процесса гидролиза на 72 часа, после выдержки в термостате сливают надосадочную жидкость через бумажный фильтр. Готовый гидролизат должен содержать 450-500 мг% аминного азота. Хранят гидролизат впрок под хлороформом 1% к объему при температуре 4±1°C.
Из полученного полупродукта готовят питательную основу пробиотика (ГКС) по следующей рецептуре:
Для приготовления ГКС разводят цельный гидролизат дистиллированной водой до показателя аминного азота 160-170 мг%. Уменьшение аминного азота тормозит процесс размножения микроорганизмов, то есть замедляется интенсивность наращивания биомассы.
В гидролизат добавляют из расчета на 1 л 5 г хлористого натрия, 2 г пептона, 5 г лактозы, 5 г раффинозы, аскорбиновой кислоты 0,24±0,1 г и 0,75±0,1 г предварительно стандартно приготовленного агар-агара. Добавляют NaOH 20% раствор для установления pH 8,4-8,5 ЕД.
Готовую среду стерилизуют при 0,5 атм. 30 минут.
Аскорбиновая кислота используется как стимулятор роста для бифидо- и лактобактерий.
Пептон представляет собой смесь поли- и олигопептидов, аминокислот, солей и микроэлементов, соответственно является источником питательных веществ.
Агар увеличивает вязкость среды, что приводит к равномерному росту микроорганизмов по всей толще среды и равномерному потреблению факторов роста и питательных веществ.
Лактоза - энергетический субстрат и источник углерода.
Раффиноза (фруктроолигосахарид), кроме удовлетворения потребности клетки в углеводе, способствует селективной стимуляции роста и активизации метаболизма полезных представителей кишечной микрофлоры (лактобацилл и бифидобактерий)
Хлорид натрия поддерживает оптимальное осмотическое давление клеток.
В качестве штаммов-продуцентов используют L.plantarum 8RА3 и L.fermentum 90-ТС-4 и L.fermentum 39, B.bifidum 791, B.bifidum 1, B.longum 379.
Культивирование штаммов-продуцентов лакто- и бифидобактерий производится по единому способу.
I генерация - сухой штамм разводят в 10 мл ГКС и культивируют при 37±1°C в течение 18 часов.
II генерация - 10 мл I генерации вливают в 100 мл ГКС и культивируют 18 часов при 37±1°C.
III генерация - по 3 мл II генерации добавляют в 300 мл ГКС среды (т.е. из 100 мл II генерации получают 9,9 л III генерации) и культивируют 48 часов при температуре 37±1°C.
По окончании культивирования биомассы отдельных штаммов смешивают из расчета 1:1.
Параллельно с приготовлением генераций стартерных культур в пенициллиновые флаконы расфасовывают по 2±0,5 г сорбционного компонента БАД к пище «Литовит М» производства ЗАО НПФ «Новь» (ТУ 9197-001-16925875-05, регистрационное удостоверение №77.99.23.3.У.9488.11.07, дата выдачи 29.11.2007), что составляет суточную дозу, согласно рекомендациям производителя, и доля сорбента составляет 1/2-1/4 часть общего объема комплексной системы, стерилизуют в «воздушном стерилизаторе» при температуре 180±1°C 1 час. По окончании стерилизации флаконы остужают, разливают смесь биомассы стартерных культур лакто- и бифидобактерий по 5-10 мл с учетом суточной дозы пробиотика.
Герметично закрывают резиновой пробкой и алюминиевым колпачком, встряхивают. Далее процесс иммобилизации проходит при температуре +6±2°C в течение 18-24 ч ± 2 часа. Затем флаконы маркируют, фасуют в коробки по 25 штук (минимальный курс лечения). Хранится препарат при температуре +6±2°C до 60 суток с сохранностью живых микробных клеток в 1 мл жидкого препарата 1010-1012 КОЕ/мл.
Препарат может быть получен реакторным методом.
Препарат может использоваться перорально в 1 или 2 приема по 1 флакону в день перед едой с водой, компотом, морсом, соком и т.п. с температурой не выше 30°C. Перед употреблением флакон с препаратом тщательно встряхивают.
Для детей первых месяцев жизни «LB-комплекс Л» вводится в любые адаптированные искусственные смеси в количестве 2,5-5 мл в сутки (дробно на 3 кормления).
Показания к применению:
- заболевания, осложненные дисбактериозом кишечника: длительное лечение антибиотиками, химио- и гормональными препаратами; аллергическими заболеваниями (аллергодерматозы, экземы и т.п.); хронические заболевания ЖКТ, острые кишечные инфекции бактериальной и вирусной этиологии (дезинтерия, коли-энтерит, сальмонеллез, ОКИ невыясненной этиологии, рота- и энтеровирусная инфекция и др.), пищевые токсикоинфекции;
- интоксикации различного генеза, в том числе алкогольная;
- при острых и хронических заболеваниях печени;
- в качестве пробиотической и сорбционной составляющей диетотерапии послеоперационных больных;
- хронические заболевания, сопровождающиеся иммунодефицитом;
- лучевая и химиотерапия при онкологических заболеваниях.
Клиническая апробация пробиотика, приготовленного по способу, представленному в заявке, была проведена в следующих лечебно-профилактических учреждениях города Н. Новгорода: МЛПУ «Детская поликлиника №49» Приокского Райздравотдела, МЛПУ Детская Городская клиническая больница №27 «Айболит», ГУЗ «Нижегородский Областной клинический противотуберкулезный диспансер».
Указанные результаты подтвердились. Полученный предлагаемым способом препарат условно назван «LB-комплекс Л».
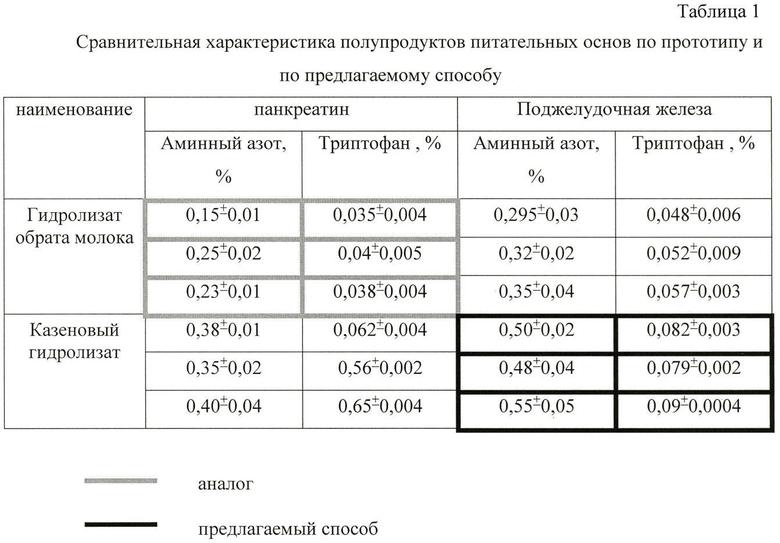
Из таблицы 1 видно, что максимальный уровень аминного азота и наиболее полное расщепление белка коровьего молока достигается при гидролизе казеина поджелудочной железой крупного рогатого скота (показатель полноты гидролиза - уровень триптофана).
Из таблицы 2 видно, что максимальный выход биомассы всех стартерных культур зарегистрирован при способе №3 приготовления питательной основы (1010-1012 КОЕ/мл), содержащей 5 г лактозы и 5 г раффинозы.
Способ включает раздельное культивирование штаммов лакто- и бифидобактерий на питательной среде, содержащей гидролизат казеина, полученный гидролизом с использованием поджелудочной железы крупного рогатого скота, углеводную составляющую, содержащую лактозу и раффинозу в соотношении 1:1. Раффиноза является как углеводным компонентом, так и пребиотической составляющей. Среда содержит пептон, агар-агар, аскорбиновую кислоту и воду дистиллированную. Смесь штаммов добавляют к сорбирующему компоненту, предварительно расфасованному во флаконы из расчета 1/2-1/4 часть общего объема созданной комплексной системы. Процесс иммобилизации на сорбенте - БАД к пище «Литовит М» происходит при температуре +6°±2°С в течение 18-24 ч. Способ позволяет получить иммобилизованный препарат-синбиотик с высоким содержанием живых микробных клеток нескольких штаммов лакто- и бифидобактерий, обладающий повышенным защитным лечебным действием. 2 з.п. ф-лы, 2 табл.
1. Способ приготовления лечебно-профилактического препарата из живых штаммов микроорганизмов лакто- и бифидобактерий путем их культивирования на питательной среде, содержащей питательную основу - гидролизат, разведенный дистиллированной водой, хлористый натрий, углеводную составляющую, агар-агар, кислую составляющую, расфасовку жидкого препарата с учетом необходимой для пациентов суточной дозы, отличающийся тем, что в качестве основы питательной среды используют гидролизат казеина, расщепленный поджелудочной железой крупного рогатого скота, и дистиллированную воду для разведения ферментированного гидролизата до заданного содержания аминного азота, в качестве углеводной составляющей используют лактозу и раффинозу в соотношении 1:1, причем раффиноза является как углеводным компонентом, так и пребиотической составляющей, по окончании раздельного культивирования смесь штаммов добавляют к сорбирующему компоненту, расфасованному по флаконам, так что его доля составляет 1/2-1/4 часть общего объема созданной комплексной системы, которую затем выдерживают для иммобилизации на сорбенте при температуре +6±2°С в течение 18-24 ч.
2. Способ по п.1, отличающийся тем, что в качестве сорбирующего компонента используют БАД к пище «Литовит М».
3. Способ по п.1, отличающийся тем, что в качестве штаммов-продуцентов используют L.plantarum 8RA-3 и L.fermentum 39, L.fermentum 90 TC-4, В.bifidum 1, В.bifidum 791, B.longum 379.
| СПОСОБ ПРИГОТОВЛЕНИЯ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОГО ПРЕПАРАТА НА ОСНОВЕ ЖИВЫХ ШТАММОВ МИКРООРГАНИЗМОВ "LB КОМПЛЕКС" | 2000 |
|
RU2192269C2 |
| ПРЕПАРАТ-ПРОБИОТИК В СУХОЙ ИММОБИЛИЗОВАННОЙ ФОРМЕ | 1999 |
|
RU2164801C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСТИМУЛИРУЮЩИХ СРЕДСТВ | 1996 |
|
RU2114625C1 |
| СПОСОБ ПРОИЗВОДСТВА МОЛОЧНОГО ЖЕЛЕ | 2003 |
|
RU2251864C2 |
| БГАТОВ В.И., БЛАГИТКО Е.М | |||
| И ДР | |||
| Литовит | |||
| - Новосибирск: Экор, 1999, с.58. | |||
Авторы
Даты
2012-02-10—Публикация
2010-07-29—Подача