Настоящее изобретение представляет собой мембрану для отделения целевых стволовых клеток от биологических образцов, более конкретно от суспензии отдельных клеток, полученной из биологического образца, что позволяет получать стерильные целевые стволовые клетки в физиологическом буфере, характеризующиеся известным размером популяции (количество выделенных клеток) и жизнеспособностью (соотношение живых/мертвых клеток) клеток. Полученные таким образом целевые стволовые клетки могут быть использованы либо для терапии, сразу после отделения, или в дальнейшем - для разработки тканевых наполнителей или новых решений в области регенеративной медицины, связанной с различными тканями в стоматологии, ортопедии, пластической хирургии и т.д., либо для исследований, например, для изучения биологии стволовых клеток или тестирования новых терапевтических агентов и т. д. Мембрана выполнена в виде трехмерной структуры-носителя, изготовленной из по меньшей мере одного слоя биосовместимого полимера с заданным размером пор в качестве материала-носителя, имеющей ковалентно связанные целевые молекулы, предпочтительно целевые антитела, или на ее поверхности, и/или в порах, где указанные молекулы распознают характеристические антигены, связанные с поверхностью целевых стволовых клеток, и, таким образом, связывают целевые стволовые клетки с мембраной. Целевые молекулы могут быть связаны непосредственно с поверхностью и/или присутствовать в связанном виде в порах структуры-носителя или они могут быть связаны или интегрированы в трехмерную структуру мембраны с помощью определенных функционализированных наночастиц.
Кроме того, настоящее изобретение включает способ получения мембраны, а также способ и устройство для отделения целевых стволовых клеток от биологического образца, которые включают указанную выше мембрану в качестве составной части.
Применение мембраны и способов по настоящему изобретению обеспечивает высокоспецифичное и эффективное активное отделение целевых стволовых клеток от смеси клеток в биологическом образце.
Уровень техники, технические проблемы и недостатки, решаемые настоящим изобретением.
Патент США № 794266 относится к выделению клеток путем связывания магнитных частиц с клетками. Решения из указанного выше патента несопоставимы с решениями, раскрытыми в настоящем изобретении, поскольку в указанном выше патенте используют технологию отделения клеток, основанную на магнитной силе притяжения в поле, в то время как настоящее изобретение вызывает отделение клеток, исключительно основываясь на реакции антитела с клеткой.
Патент США № 7592431 относится к выделению Treg-клеток (регуляторные Т-клетки) с помощью биосовместимых структур-носителей и активации маркеров клеточной поверхности. Релевантная литература не указывает на наличие каких-либо достаточно специфических маркеров в Treg-клетках; следовательно, способ согласно изобретению основан на другом подходе: дифференцировке стволовых клеток в Treg-клетки.
Заявка на патент WO 2017075389 включает описание получения клеток с использованием соответствующих маркеров; авторы не указали тип исходной ткани; способ осуществляется вручную (требует больше времени, затраты и выходы несопоставимы), и применяемые антитела несопоставимы с антителами, упомянутыми в настоящем изобретении (например, CD90).
Патент США № 7390484 включает описание нового оптимизированного коллекторного контейнера для липоаспирации, включающего систему фильтрации, позволяющую обогащать суспензию клеток. Речь идет о «концентрировании» клеток и их нанесении на планшеты для культуры клеток для дальнейшей очистки и размножения клеток, полученных из образца.
Заявка на патент США № 20130130371 описывает механическую очистку липоаспирата с применением сетчатых фильтров. Однако способ согласно настоящему изобретению определяет суспензию клеток как исходный материал, который можно получить несколькими способами, следовательно, способ согласно настоящему изобретению не ограничивается фильтрацией или очисткой с применением сетчатых фильтров. Более того, в указанной выше патентной заявке не упоминается какой-либо способ «отделения клеток на основе аффинности». В ней раскрывается предварительное получение липоаспирата для дальнейшего применения.
Заявка на патент США № 20130034524 описывает общеизвестный протокол выделения клеток с применением центрифугирования, ферментативного расщепления и т. д. Это не служит препятствием для настоящего изобретения, поскольку указанная выше заявка на патент относится к «обогащению или концентрированию клеток», а не к выделению или отделению клеток. Это также означает, что указанный выше патент не относится к способу отделения на основе аффинности; кроме того, выходы существенно ниже, чем выходы согласно настоящему изобретению, в особенности потому, что даже после центрифугирования все еще получают «смесь клеток».
Вышеупомянутые недостатки решений из уровня техники устраняются с помощью мембраны и способа отделения согласно настоящему изобретению.
В контексте данной заявки термин «стволовые клетки» определяет клетки с высокой (теоретически бесконечной) способностью к самообновлению популяции (что означает, что они могут делиться таким образом, что образуется больше клеток такого же типа), которые могут дифференцироваться в по меньшей мере один другой тип клеток, таким образом, имея способность к репопуляции или регенерации (различных) тканей после трансплантации. На молекулярном уровне эти клетки экспрессируют так называемые маркеры стволовых клеток, такие как поверхностные антигены, характерные для стволовых клеток. В зависимости от биологического образца содержащиеся в нем стволовые клетки экспрессируют характеристические поверхностные антигены. Например, гемопоэтические стволовые клетки, выделенные из периферической или пуповинной крови, экспрессируют среди прочего поверхностные антигены CD34, тогда как мезенхимальные стволовые клетки, выделенные из жировой ткани, экспрессируют поверхностные антигены CD90.
Термин «целевая стволовая клетка» означает стволовые клетки, экспрессирующие характеристические поверхностные антигены, которые связываются с выбранными целевыми молекулами.
Термин «целевая молекула» относится к молекуле, которая распознает характеристический антиген на поверхности целевой стволовой клетки и может связываться на этом характеристическом антигене. В процессе целевая молекула не должна влиять на саму целевую стволовую клетку, например, ее дифференцировку, или вынуждать ее делиться, и при применении не должна влиять на секрецию каких-либо веществ, которые могут вызвать краткосрочное (острое) или долгосрочное (хроническое) негативное воздействие на пациента или влияние на характеристики (генотип, эпигенетику или фенотип) целевых стволовых клеток. Предпочтительно, целевая молекула представляет собой целое антитело или часть антитела, которое распознает характеристический антиген на поверхности целевой стволовой клетки (например, область Fc, область Fab, аптамер) и обеспечивает специфическое связывание с характеристическим антигеном. Предпочтительно это антитела, распознающие следующие антигены: CD90, CD146, CD44, CD73, CD105, CD34, STRO-1, STRO-3 и т. д.
Биологический образец для отделения целевых стволовых клеток может представлять собой любые органы, ткани и жидкости человека и животных, которые включают такие клетки и взяты от живых или мертвых доноров. Он прежде всего представляет собой, но не ограничивается перечисленным: подкожную жировую ткань, полученную липоаспирацией или хирургическим удалением; костный мозг, полученный пункцией; немобилизованную периферическую кровь и периферическую кровь после мобилизации костного мозга, полученную венепункцией или аферезом; эндометрий, полученный при биопсии матки; менструальную кровь; пуповинную ткань, желе Уортона и пуповинную кровь, полученные после/во время родов; амниотическую жидкость, полученную амниоцентезом или во время родов путем кесарева сечения; амниотическую оболочку, полученную после родов; пульпу зуба, полученную из зубов.
Термин «функционализированная наночастица» относится к наночастице, имеющей поверхностные функциональные группы (например, NH2, OH, COOH, SH и т. д.) на своей поверхности, обеспечивающие связывание с трехмерной структурой-носителем мембраны и/или связывание целевых молекул на поверхности функционализированной наночастицы.
Термин «биофункционализированная наночастица» относится к функционализированной наночастице, имеющей уже связанные целевые молекулы или их части на своей поверхности, которые распознают характеристический антиген на поверхности целевой стволовой клетки и могут связываться с этим характеристическим антигеном.
Функционализированные наночастицы могут быть неорганическими, органическими, гибридными, композитными, магнитными или их комбинациями и состоят из металлов и/или их сплавов, и/или оксидов металлов, и/или полимеров, или любой комбинации указанных выше основных материалов с поверхностными функциональными группами (например, NH2, OH, COOH, SH и т. д.). В одном варианте осуществления функционализированные наночастицы представляют собой гибридные неоргано-органические наночастицы. Предпочтительно функционализированные наночастицы представляют собой, например, наночастицы из металлических сплавов (например, NiCu, представляющий собой никель/медь), заключенные в слой диоксида кремния (SiO2), имеющие поверхностные функциональные группы на поверхности. Функционализированные наночастицы также могут представлять собой оксиды металлов (например, Fe2O3 или Fe3O4), аналогично заключенные в слой диоксида кремния и имеющие поверхностные функциональные группы на поверхности. Предпочтительно толщина слоя диоксида кремния составляет от пары нанометров до нескольких десятков нанометров. В другом варианте осуществления функционализированные наночастицы представляют собой наночастицы на основе диоксида кремния (химически SiO2), полученные из различных предшественников на основе силоксана (например, (3-аминопропил)триэтоксисилан - APTES, винилтриэтоксисилан - VTES, (3-меркаптопропил)триэтоксисилан - MPTES), которые также могут обеспечивать присутствие желаемых функциональных групп на их поверхности уже в ходе синтеза этих наночастиц, т.е. in situ. В еще одном варианте осуществления функционализированные наночастицы представляют собой наночастицы на основе полисахаридов (например, хитозана, карбоксиметилцеллюлозы, альгината и т. д.). Их основная структура уже включает желаемые предпочтительные функциональные группы (например, NH2, OH, COOH и т.д.), обеспечивая функцию аналогичную другим примерам раскрытых функционализированных наночастиц. Другой вариант осуществления относится к синтезу наночастиц на основе других синтетических полимеров (например, дендримеров, производных метакрилатов, полиэтиленимина и т.д.), также содержащих желаемые функциональные группы (например, NH2, OH, COOH, SH и т.д.) в их основной структуре, таким образом, также удовлетворяющие начальному определению функционализированных наночастиц. Синтез наночастиц может быть осуществлен с использованием золь-гель метода, эмульсионных методов или любого другого способа синтеза, позволяющего получать наночастицы, которые удовлетворяют определению функционализированной наночастицы, состоящей из вышеупомянутых и других основных материалов.
Исходная суспензия отдельных клеток представляет собой суспензию отдельных клеток и небольших клеточных кластеров, полученную из биологического образца в физиологическом буфере, т.е. буфере, позволяющем сохранять клетки в физиологических условиях. Такие буферы представляют собой, например, физиологический раствор, культуральную среду, 1xPBS (забуференный фосфатом физиологический раствор) и другие подобные растворы. Таким образом, исходная суспензия клеток включает целевые стволовые клетки, а также другие нецелевые клетки, т.е. остальную часть клеток тканей, нецелевые стволовые клетки, продукты клеточного распада и другие компоненты (например, плазму крови, межклеточную жидкость, внеклеточный матрикс), которые могут присутствовать в биологическом образце.
Термин «активация мембраны» означает связывание целевых молекул, которые распознают и связывают характеристические антигены на поверхности целевых стволовых клеток, на/в трехмерной структуре-носителе мембраны. Активация мембраны может осуществляться путем включения целевых молекул с помощью любого химического, физико-химического или физического способа. Это включает, не ограничиваясь перечисленным, включение функционализированных наночастиц в структуру-носитель мембраны и последующее связывание целевых молекул с указанными наночастицами, интеграцию биофункционализированных наночастиц в структуру-носитель мембраны или прямое связывание целевых молекул со структурой-носителем мембраны.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение описано ниже, представлено с вариантами осуществления, и раскрыто на фигуре.
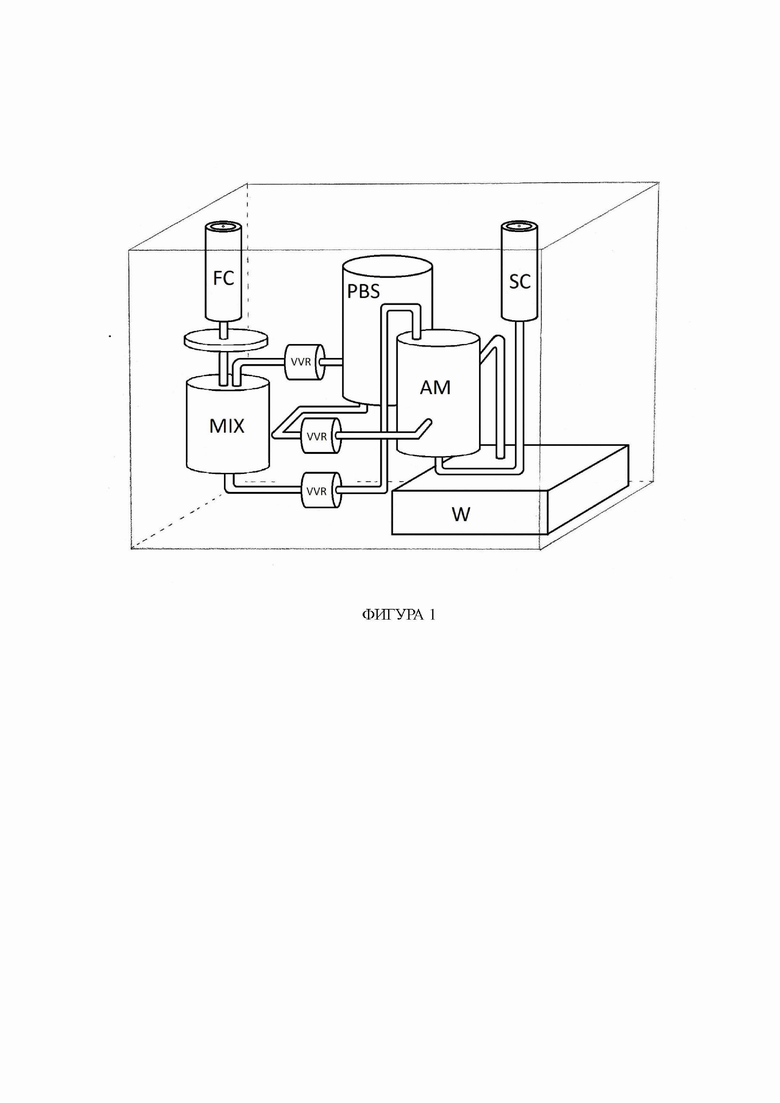
На фиг. 1 показана сменная кассета, составляющая часть устройства для отделения стволовых клеток от биологических образцов, которая включает мембрану согласно изобретению.
Мембрана согласно изобретению состоит из трехмерной структуры-носителя с включенными целевыми молекулами на поверхности и/или в порах указанной структуры-носителя. Указанная структура-носитель изготовлена из по меньшей мере одного слоя биосовместимого полимера, имеющего структурированную или неструктурированную геометрию, с порами диаметром от 50 до 500 мкм, имеющего на своей поверхности и/или в порах ковалентно связанные целевые молекулы, которые распознают и связывают характеристические антигены на поверхности целевых стволовых клеток. Таким образом, целевые стволовые клетки захватываются на мембране, тогда как нецелевые клетки проходят через мембрану или могут быть смыты с поверхности мембраны.
Структурированная геометрия отдельного слоя структуры-носителя означает, что в каждом отдельном слое форма, размер и распределение пор являются одинаковыми по всему слою. Слой как таковой можно охарактеризовать в ходе способа получения, который можно регулировать. Неструктурированная геометрия означает, что в каждом отдельном слое форма, размер и распределение пор являются произвольными и на них нельзя повлиять в ходе получения. Геометрия отдельного слоя структуры-носителя зависит от используемого способа получения мембраны. Например, при использовании 3D-печати геометрия отдельного слоя структуры-носителя будет структурированной, тогда как при использовании электроспиннинга геометрия отдельного слоя будет по большей части неструктурированной или произвольной, что является характерной особенностью этого способа.
Подходящий биосовместимый полимер может быть гидрофобным или гидрофильным. Предпочтительно он является гидрофобным; не должен связывать целевые стволовые клетки; должен быть инертным по отношению к целевым стволовым клеткам (что означает, что он не должен влиять на их основные характеристики, такие как статус и потенциал дифференцировки, статус и потенциал пролиферации, экспрессия поверхностных антигенов); во время применения не должен усиливать секрецию и/или возникновение каких-либо веществ, которые могут иметь краткосрочное или долгосрочное негативное воздействие на пациента, получающего лечение такими клетками; должен позволять осуществлять стерилизацию без изменения характеристик полимера; предпочтительно не должен связывать тромбоциты или эритроциты; должен обладать определенными физико-химическими и механическими характеристиками, важными для получения мембраны, такими как подходящая вязкость, значение pKa, пригодность для печати, поверхностное натяжение и т.д. Подходящие биосовместимые полимеры включают, но не ограничиваются перечисленным, различные тканые и нетканые натуральные материалы, например, производные полисахаридов, представляющие собой альгинат (ALG), карбоксиметилцеллюлозу (CMC), вискозу (VIS), шелк, коллаген, нанофибриллированную целлюлозу (NFC) и т.д. и их комбинации, полусинтетические материалы, такие как хитозан (CHI) и его производные, целлюлоза и другие производные, а также их комбинации; и синтетические материалы, например, поликапролактон (PCL), полиэтилентерефталат (PET), полибутилентерефталат (PBT), полипропилен (PP), полигидроксиэтилметакрилат (PHEMA), поли(N-(2-гидроксипропил)метакриламид) (PHPMA), поливиниловый спирт (PVA), полиэтиленоксид (PEOX), различные дендримеры, например, полиамидоамин (PAMAM), полиэтиленимин (PEI) и т.д. и их комбинации.
Предпочтительно биосовместимые полимеры выбраны из PCL, CMC, CHI, ALG, PET, PEOX и PHEMA/PHPMA. Это не исключает другие биосовместимые полимеры или их комбинации.
Выбор биосовместимого полимера для получения как таковой структуры-носителя может гарантировать, что структура-носитель будет иметь функциональные группы на поверхности и/или в порах (например, NH2, OH, COOH, SH и т.д.).
Если структура-носитель составлена из нескольких слоев, имеющих структурированную и/или неструктурированную геометрию, отдельные слои могут быть изготовлены из одинаковых или разных биосовместимых полимеров, и геометрия отдельных слоев, то есть форма, размер и распределение пор в отдельном слое, могут быть одинаковыми или разными.
Геометрию отдельного слоя определяют таким образом, чтобы пока целевые стволовые клетки связываются с поверхностью и/или в порах мембраны, через мембрану проходило как можно больше нецелевых клеток. Предпочтительно диаметр пор находится в диапазоне от 100 до 200 мкм.
Необязательно, функционализированные наночастицы могут быть ковалентно (или другим образом с применением любого химического, физико-химического или физического способа) связанными «in situ» на/в структуре-носителе, состоящей из биосовместимого полимера, то есть на поверхности или/и в порах указанной структуры-носителя. Функционализированные наночастицы могут быть интегрированы в/на структуру-носитель просто «механически», то есть без применения особых связей или взаимодействий со структурой-носителем (или просто захватываются на/в нее). С функционализированными наночастицами целевые молекулы ковалентно связаны через поверхностные функциональные группы, то есть через активные центры функционализированных наночастиц.
В ходе осуществления способа получения мембраны, то есть «in situ», биофункционализированные наночастицы, то есть функционализированные наночастицы со связанными целевыми молекулами, могут быть уже интегрированы в структуру-носитель.
В соответствии с изобретением для получения мембран могут использоваться различные биоинженерные способы, такие как 3D-печать (например, экструзия, лазер и т. д. и их комбинации), литье, электроспиннинг, плетение из обработанных или необработанных бесконечных волокон и другие методики, а также их комбинации. Также могут быть использованы другие методики, например смешение полимеров, при этом выбранная морфология обеспечивается путем селективного удаления желаемых полимерных компонентов (одного или нескольких) за счет использования их различных точек плавления. Среди других возможных методик получения мембран есть также спекание шариков (частиц круглой формы) различных размеров (например, шариков полистирола или микросфер диоксида кремния) с последующим покрытием их полимером; когда спеченная часть удаляется, остается мембранная структура желаемой пористости (на одном или нескольких уровнях), полностью состоящая из полимера. Однако другие методики или их комбинации, обеспечивающие указанные выше характеристики мембраны, также могут быть использованы для получения мембран.
Предпочтительно технологию 3D-печати используют для получения мембраны со структурированной или «расчетно» неструктурированной геометрией. Для этой цели лучше всего использовать 3D-принтер на основе экструзии, который экструдирует полимер или гидрогели путем нагрева/плавления и механической экструзии. Возможны комбинации всех методик. 3D-принтер может одновременно обеспечивать точное (до пиколитров) пипетирование раствора/суспензии выбранных активных молекул в заранее определенные места на структуре мембраны, что представляет собой еще один способ обеспечения желаемой активации мембраны. Кроме того, внутренняя структура отдельных экструдированных нитей может быть выполнена в виде туннелей или нитей с двумя/более слоями (например, печать ядра/оболочки), что позволяет дополнительно контролировать химические, физико-химические и механические характеристики мембраны, а также контролировать характеристики мембраны в ее активном или неактивном состоянии.
Второй предпочтительный способ представляет собой электроспиннинг, служащий для получения мембран с неструктурированной или частично структурированной геометрией (получаемые макроматериалы всегда могут быть схожими, при необходимости). При использовании этого способа, могут быть получены тонкие слои, состоящие из множества подслоев, которые могут быть собраны в мембрану произвольной толщины. В то же время электроспиннинг можно применять для изменения характеристик поверхности напечатанной трехмерной мембраны (например, увеличения ее удельной площади поверхности), микро- и нано-характеристик мембраны (например, локального добавления функциональных групп с электроспряденными волокнами и т.д.) или даже для активации мембраны (например, если композиция для электроспиннинга включает биофункционализированные наночастицы или иным образом интегрированные целевые молекулы).
Третий предпочтительный способ получения мембран представляет собой получение тканых материалов, имеющих структурированную микрогеометрию, а также структурированную или неструктурированную микро- и наногеометрию. Они изготовлены из бесконечных волокон или предварительно отобранных полимеров. Последние могут быть дополнительно обработаны способом на основе электроспиннинга, что обеспечивает дополнительные характеристики мембраны.
Вышеупомянутые способы позволяют получить структуру-носитель мембраны из биосовместимого полимера, с которой впоследствии связываются целевые молекулы. Вышеупомянутые способы также позволяют получить структуру-носитель мембраны из биосовместимого полимера с уже интегрированными функционализированными наночастицами, с которыми впоследствии связываются целевые молекулы. Указанные выше способы позволяют получить структуру-носитель мембраны из биосовместимого полимера с уже интегрированными биофункционализированными наночастицами, как более подробно описано ниже.
Активация мембраны или биофункционализация могут выполняться непосредственно на трехмерной структуре-носителе. В этом случае поверхность структуры-носителя химически обрабатывают с использованием известных методов, например, так называемого карбодиимидного метода (CDI) с использованием реагента 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC), который приводит к образованию амидных связей в «более мягких условиях», получая, таким образом, активные центры на поверхности и в порах структуры-носителя мембраны, т.е. ковалентно связанные поверхностные функциональные группы, с которыми целевые молекулы (например, антитела, их части, аптамеры) ковалентно связываются без влияния или с минимальным влиянием на их активность. EDC представляет собой водорастворимый карбодиимид, дополнительно способствующий ковалентному связыванию активных молекул на мембране.
Общая методика такой активации включает реакцию в водной среде, в которую, помимо реагента EDC, добавляют целевые молекулы, которые требуется связать (например, антитела), мембранную структуру и буфер. Приблизительно через 30 минут получают мембрану с все еще активными антителами, связанными со структурой-носителем, т.е. мембрану, способную осуществлять аффинное связывание целевых стволовых клеток, которые экспрессируют антигены, распознающие антитела (или целевые молекулы), связанные в/на мембране, в ходе описанного выше способа.
Активацию мембраны можно осуществлять с применением функционализированных наночастиц, которые могут быть либо связаны (например, ковалентно), либо не связаны (т.е. просто «захвачены») на/в структуре-носителе мембраны, что означает «in situ» в биосовместимом полимере, при этом поверхностные функциональные группы служат точками привязки или активными центрами для связывания целевых молекул, которые распознают и связывают характеристические антигены, связанные с поверхностью целевых стволовых клеток, на поверхности функционализированных наночастиц.
Если активацию мембраны выполняют с применением функционализированных наночастиц, функционализированные наночастицы (с соответствующими функциональными группами или активными центрами для связывания на структуре-носителе мембраны и для связывания целевых молекул, которые распознают и связывают характеристические антигены, связанные на поверхности стволовых клеток) получают предварительно с применением известных способов, например, CDI или способа сшивания с амином. Способ CDI в основном применяют для активации карбоксильных и фосфатных функциональных групп, другой упомянутый способ в основном применяют для активации функциональных аминогрупп. Указанные способы можно использовать одновременно.
Активацию мембраны можно осуществлять с применением функционализированных наночастиц, когда структура-носитель мембраны с интегрированными функционализированными наночастицами уже получена в соответствии с одним из описанных выше способов. В этом случае предварительно полученные функционализированные наночастицы, которые получают в соответствии с одним из описанных выше способов, сначала интегрируют в структуру-носитель мембраны в ходе получения структуры-носителя в соответствии с одним из описанных выше способов. Таким образом, функционализированные наночастицы либо интегрируются «in situ», либо химически связываются со структурой-носителем на ее поверхности или в порах. Функционализированные наночастицы, интегрированные в структуру-носитель, имеют на своей поверхности упомянутые выше функциональные группы (например, NH2, OH, COOH, SH и т.д.), которые в последствии служат для осуществления тех же способов химического связывания целевых молекул (например, способа CDI) с указанными функциональными группами и, следовательно, со структурой-носителем. Вслед за этим следует активация мембраны, т. е. связывание целевых молекул, которые распознают и связывают характеристические антигены, связанные с поверхностью стволовых клеток, на поверхности функционализированных наночастиц, например, следуя описанному выше способу активации мембраны.
Чтобы увеличить количество активных центров на поверхности и/или в порах структуры-носителя с интегрированными функционализированными наночастицами для связывания целевых молекул, поверхность структуры-носителя можно необязательно обработать механически (например, путем шлифовки, обрезки, удаления верхнего слоя структуры-носителя до толщины приблизительно мкм) или другим способом (например, травлением). Это позволяет экспонировать большее количество функционализированных наночастиц на поверхности или в порах структуры-носителя, что увеличивает эффективность связывания целевых молекул на структуре-носителе, что означает, что получают большее количество целевых молекул на единицу поверхности/объема мембраны.
Необязательно, необходимые активные центры на поверхности и/или в порах структуры-носителя мембраны для связывания целевых молекул, особенно в случае тканых или электроспряденных мембран, можно получать с использованием кислородной плазмы, обеспечивающей гидрофильность поверхности и присутствие групп OH-, COOH- на поверхности и/или в порах структуры-носителя; или с использованием азотной плазмы (или аммонийной плазмы), обеспечивающей гидрофильность поверхности и присутствие функциональных групп NH2 на поверхности и/или в порах структуры-носителя; или с использованием фторидной плазмы (или HF), оптимизирующей гидрофобность структуры-носителя. Поверхности, обработанные плазмой, позволяют осуществлять применение указанных выше способов активации, а также дальнейших стадий биофункционализации. При необходимости дополнительной обработки структуры-носителя мембраны отдельные способы плазменной обработки можно повторять или комбинировать.
Активацию мембраны с применением функционализированных наночастиц также можно осуществлять перед получением мембраны, а именно в случае, когда мембрану получают с помощью 3D-печати, при этом предварительно полученные биофункционализированные наночастицы, уже имеющие целевые молекулы, связанные с их поверхностными функциональными группами, добавляют в расплав выбранного биосовместимого полимера «in situ», после чего получают мембрану в соответствии с одним из описанных выше способов. Таким образом, биофункционализированные наночастицы с уже связанными целевыми молекулами интегрируют в трехмерную структуру мембраны в ходе способа ее получения.
В предпочтительном варианте осуществления мембрана выполнена в виде трехмерной структуры-носителя, состоящей из нескольких слоев со структурированной геометрией и размерами пор в диапазоне от 100 до 200 мкм. Отдельные слои структуры-носителя состоят из одного и того же биосовместимого полимера, и активацию мембраны осуществляют с помощью функционализированных наночастиц.
Предпочтительно мембрану согласно изобретению получают методом 3D-печати (биопечати). Выбранный биосовместимый полимер расплавляют, и в расплав добавляют «in situ» предварительно полученные функционализированные наночастицы с поверхностными функциональными группами; после этого трехмерную структуру мембраны со структурированной геометрией получают посредством 3D-печати, при этом функционализированные наночастицы интегрируют в трехмерную структуру-носитель мембраны. Полученную таким образом трехмерную структуру-носитель мембраны затем активируют с помощью функционализированных наночастиц с соответствующими целевыми молекулами, то есть выбранные целевые молекулы связываются с функциональными группами на наночастицах, которые находятся на структуре-носителе мембраны (таким образом, получают биофункционализированные наночастицы в мембране). Таким образом получают мембрану согласно изобретению.
Мембрану согласно изобретению применяют в способе отделения/выделения целевых стволовых клеток из биологического образца, при этом получают стерильные целевые стволовые клетки в физиологическом буфере с известным размером и жизнеспособностью клеточной популяции.
Перед введением в мембрану биологический образец предварительно получают соответствующим образом, т.е. получают исходную суспензию отдельных клеток, при этом обеспечивают подходящий размер отдельных клеток в суспензии и подходящую плотность суспензии.
Получение исходной суспензии отдельных клеток включает известные процессы разрушения биологического образца и механической фильтрации. Процессы разрушения биологических образцов включают, но не ограничиваются перечисленным, механическую обработку (например, мацерацию, разрезание, соскабливание, центрифугирование), химическую обработку (например, обработку буфером для лизиса эритроцитов, добавление антикоагулянтов), ферментативную обработку (например, применение коллагеназы, гиалуронидазы, трипсина или их комбинаций) и/или их комбинацию.
Необязательно, стадию удаления эритроцитов, например, с помощью буфера для лизиса эритроцитов, центрифугирования в градиенте плотности, меченых магнитных шариков, способа, называемого «плавучим» отделением, или других известных методик, можно добавить к получению исходной суспензии отдельных клеток, в частности, когда суспензию получают из крови и/или биологических образцов с высоким содержанием крови.
Следующей стадией в способе является механическая фильтрация как предварительный способ отделения частиц (клеток) от выбранного биологического образца, основанный не только на размере пор фильтра (частицы меньшего размера, чем поры фильтра, проходят через фильтр), но также и на химическом составе материала фильтра. Например, одни вещества прилипают к материалу, из которого изготовлен выбранный фильтр, больше других. Механическая фильтрация включает сетчатые фильтры различной пористости (например, от 10 до 100 мкм), которые применяют в виде отдельных звеньев или в каскаде последовательных фильтров с уменьшающимся размером пор. Химический состав фильтров может включать (но не ограничиваясь перечисленным) нейлон, ацетат целлюлозы, полимолочную кислоту, полигликолевую кислоту, полиэтилентерефталат, полипропилен, поликапролактон, при условии, что материал сетчатого фильтра не связывает целевые стволовые клетки.
Если используют каскадные фильтры, то отдельные фильтры в каскаде могут быть изготовлены из разных материалов. Фильтры для этой цели могут включать коммерчески доступные фильтры (например, Corning® Cell Strainer) и/или разработанные внутри предприятия фильтры, изготовленные на 3D-принтере, или фильтры, полученные с помощью других методик, и их комбинации.
Путем такого предварительного получения биологического образца получают исходную суспензию отдельных клеток, при этом размер отдельных клеток и/или любых возможных более мелких кластеров клеток в суспензии не превышает размер пор отдельной мембраны по меньшей мере в двух измерениях, и плотность исходной суспензии клеток поддерживают на уровне ниже 2×108 клеток/мл, предпочтительно от 1×106 до 1×107 клеток/мл.
Подходящую плотность исходной суспензии отдельных клеток получают путем добавления физиологического буфера (для осуществления разбавления) или увеличения количества клеток в суспензии (путем концентрирования), если это необходимо. Подачу исходной суспензии клеток к мембране регулируют автоматически. Устройство для подсчета клеток (в режиме биоимпеданса) определяет количество клеток, достигающих мембраны, и поддерживает плотность исходной суспензии клеток на уровне ниже 2×108 клеток/мл путем автоматической подачи или удаления физиологического буфера.
Размер клеток и/или любых более мелких кластеров клеток в суспензии не должен превышать размер пор мембраны. Предпочтительный размер отдельных клеток и/или любых более мелких кластеров клеток в суспензии по меньшей мере в двух измерениях не должен превышать 70 мкм.
Отделение целевых стволовых клеток от исходного материала, то есть биологического образца, осуществляют на основании прохождения свободного потока исходной суспензии отдельных клеток через по меньшей мере одну мембрану. В ходе этого процесса целевые стволовые клетки захватываются на поверхности мембраны и в порах мембраны за счет специфического распознавания и связывания между характеристическими антигенами на поверхности целевых стволовых клеток и целевыми молекулами, то есть антителами или фрагментами антител к указанным характеристическим антигенам, связанными с мембраной. Проход других нецелевых клеток через мембрану не затруднен (или затруднен лишь незначительно, например, из-за увеличения количества связанных целевых стволовых клеток, что приводит к снижению эффективной пористости мембраны).
Одну мембрану можно применять для отделения целевых стволовых клеток. Однако клетки можно также отделить, используя несколько мембран в каскаде, при этом каждая последующая мембрана в каскаде имеет такие же или меньшие размеры пор.
Способ отделения дополнительно позволяет многократно фильтровать суспензию клеток через мембрану/мембраны, тем самым повышая эффективность.
В зависимости от конечного назначения применения целевые стволовые клетки могут быть удалены с мембраны одним из описанных ниже способов или мембрана может быть использована вместе с целевыми стволовыми клетками. В последнем случае мембрану, например, можно использовать в качестве тканевого наполнителя для имплантации пациенту, переживающему серьезную травму. После помещения в естественную среду связанные с мембраной стволовые клетки дифференцируются в желаемые окружающие ткани и эффективно способствуют регенерации одной или более окружающих тканей. Мембрану со связанными целевыми стволовыми клетками также можно применять в качестве субстрата для роста для размножения этих клеток для их применения желаемым образом (например, в терапии и т.д.). Другой способ применения мембраны с захваченными целевыми стволовыми клетками представляет собой дифференцировку клеток в подходящую ткань с помощью внешних стимулов (например, путем добавления выбранных факторов роста в среду для роста или других стимулов). Однако выбор ткани ограничен типом захваченных целевых стволовых клеток. Таким образом, например, может быть получен костный сегмент для имплантации пациенту. Это всего лишь несколько примеров, но есть еще много других возможностей применения непосредственно мембраны с захваченными целевыми стволовыми клетками.
Способы удаления целевых стволовых клеток с мембраны включают, но не ограничиваются перечисленным: физико-механические способы (например, изменение давления; увеличение/уменьшение давления), физико-химические способы (например, изменение ионной силы путем добавления соли, буферов, ополаскивание сверхчистой водой и т. д.), биохимические способы (например, применение ферментов, таких как пептидазы, которые расщепляют связь между мембраной и антителами), химические способы (например, восстановление дисульфидных связей до тиоловых групп) и способы на основе аффинности (например, путем добавления соединений с большей аффинностью к выбранной активной функционализированной поверхности (например, антител), чем клетки (которые являются относительно «большими» частицами), и другие способы и их комбинации. Эти способы удаления целевых стволовых клеток с мембраны могут применяться: по отдельности, как комбинация вышеупомянутых способов, как каскадные системы одинаковых или разных способов с любым количеством дальнейших повторений. Предпочтительные способы отделения сводят к минимуму напряжение и уменьшают воздействие на отделенные целевые стволовые клетки, которые необходимо удалить с мембраны, как например, способ, в котором используют подходящие интервалы разницы давления. Выбранные способы удаления различаются в зависимости от свойств выбранной мембраны, функционализированных (или биофункционализированных) наночастиц, целевых молекул и целевых стволовых клеток. Следовательно, в различных выбранных способах/процессах выделения целевых стволовых клеток из биологических образцов могут применяться различные способы удаления или их комбинации.
Устройство для отделения целевых стволовых клеток от биологического образца, то есть от суспензии отдельных клеток, состоит из корпуса, в котором установлены электронные и механические компоненты с соответствующей регулировкой, и сменной кассеты. В электронную часть входят все электронные компоненты, необходимые для работы устройства, такие как система бесперебойного питания ИБП, датчики для измерения скорости потока и температуры, чтобы обеспечить и контролировать потоки и оптимальную температуру 37°C, пригодную для работы с биоматериалами (указанная температура может быть скорректирована, если необходимо), устройство для подсчета клеток, аналого-цифровые преобразователи, электрические преобразователи и т.д. В механическую часть устройства входят все механические компоненты, необходимые для работы устройства, такие как системы клапанов, насосы и/или компрессор, открывающие и закрывающие направляющие устройства для вставки сменной кассеты, фурнитура для прикрепления сменной кассеты к корпусу и соединение жидкостной системы для сменной кассеты на основе быстроразъемных зажимов для легкой замены кассеты. Регулирующая часть обеспечивает правильное регулирование устройства, тем самым обеспечивая оптимальные условия работы устройства, например, подходящее регулирование температуры, правильное регулирование потока для обеспечения желаемых концентраций исходной суспензии клеток.
Необязательно, в устройство может быть включена очищающая кассета для обеспечения самоочищения, особенно в том случае, когда незаменяемые части контактируют с биологическим материалом. Очистка устройства осуществляется автоматически согласно соответствующему протоколу.
Сменная кассета, представленная на фиг. 1, включает контейнер FC для исходной суспензии отдельных клеток, полученной из биологического образца, камеру смешивания MIX для обеспечения плотности исходной суспензии на уровне ниже 2×108 клеток/мл путем добавления, при необходимости, физиологического буфера из контейнера PBS, по меньшей мере одну мембрану AM согласно изобретению, контейнер для отходов W и коллектор SC для сбора суспензии целевых стволовых клеток. Регулирующие клапаны VVR, подключенные к одной насосно-компрессорной установке в устройстве, обеспечивают надлежащую подачу жидкостей или суспензий. Сменную кассету можно вставлять в устройство как сверху, так и спереди.
Необработанный исходный материал, то есть исходная суспензия отдельных клеток, можно вводить в сменную кассету, расположенную в контейнере FC, с помощью инъекционной иглы или любого другого метода асептического переноса и хранения. Подходящую плотность исходной суспензии отдельных клеток обеспечивают в камере смешивания MIX путем подачи, при необходимости, физиологического буфера из контейнера PBS.
Затем суспензию отдельных клеток доставляют к мембране AM, и отделение целевых стволовых клеток от исходной суспензии происходит на основании прохождения свободного потока исходной суспензии отдельных клеток через по меньшей мере одну мембрану AM. Целевые стволовые клетки связываются с мембраной AM, в то время как все нецелевые клетки проходят через мембрану AM или удаляются с поверхности мембраны путем промывки в виде остаточной суспензии в контейнер для отходов W. Целевые стволовые клетки удаляются с мембраны AM с помощью физиологического буфера под давлением, подаваемого из контейнера PBS, через контур обратной связи. Полученную в результате стерильную суспензию целевых стволовых клеток в физиологическом буфере собирают в коллекторе SC. Эта суспензия целевых стволовых клеток может быть сразу применена к пациенту или впоследствии использована для различных целей.
Доставка исходной суспензии отдельных клеток к мембране AM регулируется автоматически. Устройство для подсчета клеток определяет количество клеток, достигающих мембраны, и поддерживает плотность исходной суспензии отдельных клеток на уровне ниже 2×108 клеток/мл путем автоматической подачи физиологического буфера из контейнера PBS.
В предпочтительном варианте осуществления устройство для подсчета клеток основано на биоимпедансе, то есть на двух электродах из любого материала (серебро и т. д.), которые обнаруживают изменения электрического сопротивления. Устройство для подсчета клеток установлено в двух следующих различных положениях: на участке до того, как исходная суспензия отдельных клеток достигла мембраны AM, и до того, как стерильная суспензия целевых стволовых клеток в физиологическом буфере достигла коллекторного контейнера SC. Важной частью подсчета клеток является характеристика их соотношения живые/мертвые с помощью методики биоимпеданса для измерения проводимости мембраны AM (мертвые клетки имеют измененную проводимость из-за выделяемого цитозоля) или окрашивания для оценки жизнеспособности, при котором небольшой образец клеток из коллекторного контейнера SC отбирают онлайн и проверяют на наличие живых клеток.
Все датчики в устройстве подключены к главному компьютеру, оснащенному сенсорным экраном и пользовательским интерфейсом (UI). Устройство может быть подключено к Интернету через главный компьютер и порт LAN. Устройство можно установить в больнице, частной поликлинике или различных исследовательских институтах.
Конечным продуктом процесса отделения, которое достигается с помощью способа и устройства согласно изобретению, являются стерильные целевые стволовые клетки в физиологическом буфере (как определено в этой заявке) с известным размером клеточной популяции (количеством выделенных клеток) и известной жизнеспособностью клеток (соотношение живых/мертвых клеток).
Конечный продукт предназначен для применения в медицинских и/или исследовательских целях. В частности (но не исключая других возможных применений) возможно следующее применение: прямая трансплантация аутологичных и аллогенных клеток пациентам, подопытным или больным животным; культивирование, размножение и дифференцировка клеток в культурах in vitro; прямая криоконсервация клеток без культивирования для последующего применения; дальнейшее отделения (суб-)популяций клеток с помощью других маркеров.
Варианты осуществления изобретения
Получение мембраны
Мембрану получают согласно технологии 3D-печати. Для начала получают трехмерную структуру-носитель мембраны, которая состоит из десяти слоев поликапролактона с 100 мкм порами с интегрированными функционализированными наночастицами NiCu, заключенными в слой диоксида кремния, с функциональными группами NH2 на поверхности. Перед активацией (т. е. связыванием целевых молекул) эту структуру-носитель мембраны подвергают шлифовке. В результате больше наночастиц с функциональными группами становятся доступными. Отдельно получают раствор антител к CD90 и EDC, таким образом получают активированные антитела, которые будут связываться со структурой-носителем мембраны. Структуру-носитель погружают в раствор активированного антитела. Примерно через тридцать минут антитела связываются со структурой-носителем мембраны, то есть с функциональными группами NH2. После этого мембрану 3 раза промывают деионизированной водой. Теперь мембрана активирована и готова к отделению целевых стволовых клеток, в данном конкретном случае стволовых клеток с экспрессируемыми антигенами CD90.
Способ отделения целевых стволовых клеток от биологического образца
Пример 1
Препарат гемопоэтических стволовых клеток CD34+ из костного мозга здорового донора для трансплантации пациенту с лейкемией после химиотерапии
Биологический образец для получения клеток представляет собой периферическую кровь, собранную с помощью афереза после мобилизации костного мозга. Исходную суспензию отдельных клеток получают как «лейкоцитную пленку», представляющую собой фракцию образца крови, полученную центрифугированием в градиенте плотности для удаления эритроцитов и сыворотки крови путем дополнительной промывки в 1xPBS.
Конечную суспензию отдельных клеток получают в буфере 1xPBS для инъекции. С помощью инъекционной иглы исходную суспензию наносят на кассету с механическим фильтром 70 мкм для удаления любых крупных кластеров клеток и мембраной со связанными целевыми молекулами, которые распознают и связывают поверхностный антиген CD34, который экспрессируется на гемопоэтических стволовых клетках.
Регулятор потока на мембране обеспечивает оптимальную дозировку физиологической жидкости или буфера для предотвращения засорения системы. После того, как все нецелевые клетки собраны в контейнере для отходов, эффективность контура обратной связи гарантирует, что тот же раствор повторно фильтруется для захвата клеток, которые остались несвязанными с мембраной.
Следующая стадия включает смывку нецелевых или несвязанных клеток с мембраны. Это осуществляют в отдельном контуре обратной связи (не присоединенном к контейнеру для отходов) с помощью физиологического раствора или буфера под давлением (например, 1 бар или более). Целевые клетки промывают и собирают в отдельном контейнере в нижней части устройства. Промытые и отобранные клетки подходят для прямого применения.
Конечный продукт представляет собой стерильную суспензию гемопоэтических стволовых клеток CD34+, подходящую для применения у пациентов.
Пример 2
Препарат CD90+ (мезенхимальные стволовые клетки) для аутотрансплантации
Тумесцентный липоаспират подкожного жира применяют в качестве биологического образца для получения клеток. Исходную суспензию отдельных клеток получают в виде стромальной сосудистой фракции (SVF) в соответствии с известными способами в следующем порядке: промывание липоаспирата в 1xPBS (удаление эритроцитов и сыворотки крови), ферментативное расщепление с использованием коллагеназы Ia (разрушение межклеточных связей), градиентное центрифугирование и встряхивание (окончательное разделение клеток SVF и адипоцитов) и удаление адипоцитов пипетированием. Конечную суспензию отдельных клеток получают в буфере 1xPBS для инъекции.
С помощью инъекционной иглы исходную суспензию наносят на кассету с механическим фильтром 70 мкм для удаления крупных кластеров клеток и мембраной со связанными целевыми молекулами, которые распознают и связывают поверхностный антиген CD90, который экспрессируется на мезенхимальных стволовых клетках из подкожного жира.
Регулятор потока на мембране обеспечивает оптимальную дозировку физиологической жидкости или буфера для предотвращения засорения системы. После того, как все нецелевые клетки собраны в контейнере для отходов, эффективность контура обратной связи гарантирует, что тот же раствор повторно фильтруется для захвата клеток, которые остались несвязанными с мембраной.
Следующая стадия включает смывку нецелевых или несвязанных клеток с мембраны. Это осуществляют в отдельном контуре обратной связи (не присоединенном к контейнеру для отходов) с помощью физиологического раствора или буфера под давлением (например, 1 бар или более). Целевые клетки промывают и собирают в отдельный контейнер в нижней части устройства. Промытые и отобранные клетки подходят для прямого применения.
Конечный продукт представляет собой стерильную суспензию мезенхимальных стволовых клеток CD90+, подходящую для применения пациентами для лечения различных клинических состояний (в области ортопедии, кардиологии, пластической и реконструктивной хирургии, стоматологии, урологии, онкологии).
Пример применения суспензии отдельных клеток в ортопедии: полученную суспензию мезенхимальных стволовых клеток CD90+ наносят непосредственно в суставную щель (внутрисуставная инъекция) сустава с поверхностным повреждением хряща.
Пример применения суспензии отдельных клеток в стоматологии: после удаления зуба происходит обширная резорбция кости в челюсти. Часто это является препятствием для поиска подходящего с эстетической точки зрения протеза для пораженной челюсти и замены зуба. Оптимальное решение для восстановления недостающей части челюсти представляет собой применение мезенхимальных стволовых клеток. Чтобы обеспечить пространство для роста кости, существующая пустота должна быть защищена от зарастания надкостницы. Обычно используют титановую сетку; однако сетка из биосовместимого материала, напечатанная на 3D-принтере, еще лучше. Стволовые клетки теперь можно наносить на это предварительно подготовленное пространство. Благодаря активности факторов роста, полученных из тромбоцитов, стволовые клетки начинают дифференцироваться в остеобласты (молодые костные клетки) и, наконец, в остеоциты (взрослые костные клетки). Через несколько месяцев костный дефект перекрывается здоровой нативной тканью.
Изобретение относится к клеточной биологии, в частности к мембране для отделения целевых стволовых клеток от биологических образцов. В результате получают стерильные целевые стволовые клетки в физиологическом буфере. Указанная мембрана состоит из трехмерной структуры-носителя, изготовленной из по меньше мере одного слоя биосовместимого полимера с определенным размером пор, в качестве материала-носителя, и ковалентно связанных целевых молекул на ее поверхности и/или в порах. Эти целевые молекулы предпочтительно представляют собой целевые антитела, которые распознают характеристические антигены, которые связаны на поверхности целевых стволовых клеток и, таким образом, связывают целевые стволовые клетки с мембраной. Целевые молекулы могут быть либо непосредственно связаны с поверхностью и/или в порах структуры-носителя, либо связаны с поверхностью и/или в порах структуры носителя через специфические функционализированные наночастицы, которые связаны или встроены в трехмерную структуру-носитель мембраны. Кроме того, настоящее изобретение включает способ получения мембраны, а также способ и устройство для отделения целевых стволовых клеток от биологического образца, которые включают указанную выше мембрану в качестве составной части. Настоящее изобретение позволяет селективно отделять выбранные целевые стволовые клетки, т. е. связывать только определенные стволовые клетки-мишени из клеточной суспензии, которая содержит множество различных клеток, пропуская все остальные нежелательные клетки через мембрану. 5 н. и 38 з.п. ф-лы, 1 ил., 2 пр.
1. Мембрана для селективного отделения целевых стволовых клеток от суспензии отдельных клеток, содержащей стволовые клетки, причем указанная суспензия отдельных клеток получена из биологического образца, содержащего стволовые клетки, где мембрана состоит из трехмерной структуры-носителя, изготовленной из по меньшей мере одного слоя биосовместимого полимера с порами, причем указанный биосовместимый полимер инертен по отношению к целевым стволовым клеткам, что означает, что он не должен влиять на основные характеристики целевых стволовых клеток, и характеризуется тем, что указанные поры имеют диаметр в диапазоне от 200 до 500 мкм для обеспечения свободного потока исходной суспензии отдельных клеток через структуру-носитель, где указанная структура-носитель имеет на своей поверхности и/или в порах ковалентно связанные выбранные целевые молекулы для распознавания характеристических антигенов на поверхности подлежащих выделению целевых стволовых клеток и для специфического связывания с характеристическими антигенами на поверхности подлежащих выделению целевых стволовых клеток.
2. Мембрана по п. 1, где каждый отдельный слой структуры-носителя имеет либо структурированную геометрию с формой, размером и распределением пор, одинаковыми по всему слою, либо неструктурированную геометрию с формой, размером и распределением пор, произвольными по всему слою.
3. Мембрана по п. 1 или 2, где в случае, когда структура-носитель составлена из нескольких слоев, имеющих структурированную или неструктурированную геометрию, отдельные слои изготовлены из одинаковых или разных биосовместимых полимеров и геометрия отдельных слоев является одинаковой или разной.
4. Мембрана по любому из пп. 1-3, дополнительно включающая функционализированные наночастицы, интегрированные в/на структуру мембраны, при этом целевые молекулы ковалентно связаны с функционализированными наночастицами через их поверхностные функциональные группы.
5. Мембрана по любому из пп. 1-4, где биосовместимые полимеры выбраны из тканых и нетканых натуральных материалов, полусинтетических материалов и синтетических материалов.
6. Мембрана по п. 5, где тканые и нетканые натуральные материалы выбраны из производных полисахаридов.
7. Мембрана по п. 6, где производные полисахаридов выбраны из альгината (ALG), карбоксиметилцеллюлозы (CMC), вискозы (VIS), шелка, коллагена, нанофибриллированной целлюлозы (NFC) и их комбинаций.
8. Мембрана по п. 5, где полусинтетические материалы выбраны из хитозана (CHI) и его производных, целлюлозы и их комбинаций.
9. Мембрана по п. 5, где синтетические материалы выбраны из поликапролактона (PCL), полиэтилентерефталата (PET), полибутилентерефталата (PBT), полипропилена (PP), полигидроксиэтилметакрилата (PHEMA), поли(N-(2-гидроксипропил)метакриламида) (PHPMA), поливинилового спирта (PVA), полиэтиленоксида (PEOX), дендримеров и их комбинаций.
10. Мембрана по п. 9, где дендримеры выбраны из полиамидоамина (PAMAM), полиэтиленимина (PEI) и их комбинаций.
11. Мембрана по п. 5, где биосовместимые полимеры выбраны из PCL, CMC, HIT, ALG, PET, PEOX и PHEMA/PHPMA.
12. Мембрана по любому из пп. 1-11, где указанная целевая молекула представляет собой целое антитело или часть антитела, которое распознает характеристический антиген на поверхности целевой стволовой клетки и обеспечивает возможность специфичного связывания с характеристическим антигеном, предпочтительно это антитела, которые распознают следующие антигены: CD90, CD146, CD44, CD73, CD105, CD34, STRO-1, STRO-3 и другие.
13. Мембрана по любому из пп. 1-12, где функционализированные наночастицы представляют собой неорганические, органические, гибридные, композитные, магнитные наночастицы или их комбинации, и состоят из металлов или их сплавов, и/или оксидов металлов, и/или полимеров, или любой комбинации указанных выше основных материалов, и имеют на своей поверхности функциональные группы.
14. Мембрана по п. 13, где функциональные группы выбраны из NH2, OH, COOH, SH.
15. Способ получения активированной мембраны для отделения целевых стволовых клеток, включающий следующие стадии:
- предварительное получение функционализированных наночастиц, имеющих на своей поверхности функциональные группы для ковалентного связывания целевых молекул, которые распознают и связывают характеристические антигены, связанные с поверхностью стволовых клеток;
- интеграция предварительно полученных функционализированных наночастиц в/на структуру-носитель в ходе способа получения мембраны, причем указанная структура-носитель с порами, имеющими диаметр в диапазоне от 200 до 500 мкм, изготовлена из биосовместимого полимера, инертного по отношению к целевым стволовым клеткам, что означает, что он не должен влиять на основные характеристики целевых стволовых клеток, и получена с применением 3D-печати; при этом функционализированные наночастицы интегрируются «in situ» или химически связываются в объеме, на поверхности и/или в порах структуры-носителя;
- активация мембраны, при которой структуру-носитель с интегрированными функционализированными наночастицами погружают в раствор целевых молекул, или раствор целевых молекул пипетируют в заранее определенные места на структуре-носителе, при этом целевые молекулы связываются с указанными выше функциональными группами функционализированных наночастиц.
16. Способ по п. 15, где интеграция предварительно полученных функционализированных наночастиц в структуру-носитель включает плавление биосовместимого полимера, добавление предварительно полученных «in situ» функционализированных наночастиц с поверхностными функциональными группами в расплав, за которым следует получение структуры-носителя, во время которого функционализированные наночастицы интегрируются в структуру мембраны.
17. Способ по п. 15 или 16, необязательно включающий дополнительную обработку поверхности структуры-носителя с интегрированными функционализированными наночастицами для увеличения количества активных центров на поверхности и/или в порах структуры-носителя, причем указанная дополнительная обработка поверхности включает механическую, химическую или плазменную обработку.
18. Способ по любому из пп. 15-17, при котором активацию мембраны через функционализированные наночастицы можно также осуществлять до получения мембраны, при этом к расплаву выбранного биосовместимого полимера добавляют предварительно полученные «in situ» биофункционализированные наночастицы с целевыми молекулами, уже связанными с их поверхностными функциональными группами, с последующим получением мембраны с помощью 3D-печати, при этом биофункционализированные наночастицы со связанными целевыми молекулами интегрируют в структуру-носитель в ходе способа ее получения.
19. Способ получения активированной мембраны для отделения целевых стволовых клеток, включающий:
- получение структуры-носителя с порами, имеющими диаметр в диапазоне от 200 до 500 мкм, с применением 3D-печати из биосовместимого полимера(ов), инертного по отношению к целевым стволовым клеткам, что означает, что он не должен влиять на основные характеристики целевых стволовых клеток, с последующей химической обработкой поверхности носителя с получением, таким образом, ковалентно связанных поверхностных функциональных групп на поверхности, и/или в объеме, и/или в порах структуры-носителя, или
- получение структуры-носителя с порами, имеющими диаметр в диапазоне от 200 до 500 мкм, с применением 3D-печати из биосовместимого полимера(ов), инертного по отношению к целевым стволовым клеткам, что означает, что он не должен влиять на основные характеристики целевых стволовых клеток, причем выбор биосовместимого полимера как таковой гарантирует, что структура-носитель будет иметь поверхностные функциональные группы, выбранные из NH2, OH, COOH, SH, на поверхности, и/или в объеме, и/или в порах структуры-носителя;
- активацию мембраны, при этом целевые молекулы связываются с указанными выше поверхностными функциональными группами, причем активацию мембраны выполняют либо непосредственно на указанной структуре-носителе в процессе получения структуры-носителя путем пипетирования раствора целевых молекул в заранее определенные места на структуре-носителе либо путем последующего погружения указанной структуры-носителя в раствор целевых молекул; при этом целевые молекулы распознают и связывают характеристические антигены, связанные с поверхностью стволовых клеток.
20. Способ отделения целевых стволовых клеток от биологических образцов с помощью мембраны по любому из пп. 1-14, где указанный способ включает:
- получение исходной суспензии отдельных клеток, содержащей целевые стволовые клетки, а также другие нецелевые клетки, которые представляют собой клетки других тканей, нецелевые стволовые клетки, продукты клеточного распада и другие компоненты, присутствующие в биологическом образце, при этом размер отдельных клеток и/или возможных более мелких кластеров клеток в суспензии не превышает размер пор мембраны и плотность исходной суспензии отдельных клеток поддерживается на уровне ниже 2×108 клеток/мл;
- отделение целевых стволовых клеток от исходной суспензии, происходящее на основании прохождения свободного потока исходной суспензии отдельных клеток по меньшей мере через одну мембрану, при этом целевые стволовые клетки захватываются на поверхности мембраны и в порах из-за специфического распознавания и связывания между характеристическими антигенами на поверхности целевых стволовых клеток и целевыми молекулами, связанными с мембраной.
21. Способ по п. 20, где получение исходной суспензии отдельных клеток включает процессы разрушения биологических образцов.
22. Способ по п. 21, где процессы разрушения биологических образцов выбраны из механической обработки, химической обработки, ферментативной обработки и их комбинаций.
23. Способ по п. 22, где механическая обработка выбрана из мацерации, разрезания, соскабливания, центрифугирования.
24. Способ по п. 22, где химическая обработка выбрана из обработки буфером для лизиса эритроцитов и добавления антикоагулянтов.
25. Способ по п. 22, где ферментативная обработка выбрана из применения коллагеназы, гиалуронидазы, трипсина или их комбинаций.
26. Способ по любому из пп. 20-25, где получение исходной суспензии отдельных клеток включает механическую фильтрацию с применением сетчатых фильтров с пористостью от 10 до 100 мкм при условии, что материал сетчатого фильтра не связывает целевые стволовые клетки, и при этом сетчатые фильтры используются по отдельности или в виде каскада последовательных фильтров с уменьшающимся размером пор, и при этом отдельные фильтры в каскаде изготовлены из разных материалов.
27. Способ по любому из пп. 20-26, где получение исходной суспензии отдельных клеток необязательно включает стадию удаления эритроцитов до механической фильтрации.
28. Способ по любому из пп. 20-27, где размер отдельных клеток и/или возможных более мелких кластеров клеток в суспензии не превышает 70 мкм в по меньшей мере двух измерениях и плотность исходной суспензии отдельных клеток составляет от 1×106 до 1×107 клеток/мл.
29. Способ по любому из пп. 20-28, где подходящую плотность исходной суспензии отдельных клеток обеспечивают путем добавления физиологического буфера для осуществления разбавления или путем увеличения их количества в суспензии путем концентрирования, если необходимо.
30. Способ по любому из пп. 20-29, включающий отделение клеток с помощью нескольких мембран в каскаде, при этом каждая последующая мембрана, расположенная в каскаде, имеет такие же или меньшие размеры пор.
31. Способ по любому из пп. 20-29, необязательно включающий удаление целевых стволовых клеток с мембраны, причем способы удаления включают физические или механические способы; физико-химические способы; биохимические способы; химические способы; способы на основе аффинности; и их комбинации, причем указанные способы могут использоваться по отдельности, или в комбинации, или как каскадные системы одинаковых или разных способов с любым количеством повторений.
32. Способ по п. 31, где физические или механические способы выбраны из изменения давления.
33. Способ по п. 31, где физико-химические способы выбраны из изменения ионной силы путем добавления соли, буферов, ополаскивания сверхчистой водой.
34. Способ по п. 31, где биохимические способы выбраны из применения ферментов, расщепляющих связь между антигеном и мембраной.
35. Способ по п. 31, где химические способы выбраны из восстановления дисульфидных связей до тиоловых групп.
36. Способ по п. 31, где способы на основе аффинности выбраны из добавления соединений с большей аффинностью к выбранной активной функционализированной поверхности, чем клетки.
37. Устройство для отделения целевых стволовых клеток от биологического образца с помощью мембраны по любому из пп. 1-14, где указанное устройство состоит из корпуса, содержащего электронные и механические компоненты с соответствующей регулировкой, и сменной кассеты, причем сменная кассета содержит коллекторный контейнер (FC) для исходной суспензии отдельных клеток, камеру смешивания (MIX), где путем добавления физиологического буфера из контейнера (PBS) обеспечивается, при необходимости, плотность исходной суспензии отдельных клеток на уровне ниже 2×108 клеток/мл, по меньшей мере одну мембрану (AM) для отделения целевых стволовых клеток от суспензии отдельных клеток, контейнер для отходов (W) и коллектор (SC) для суспензии целевых стволовых клеток.
38. Устройство по п. 37, где электронный компонент включает источник питания ИБП (источник бесперебойного питания), датчики потока и температуры для обеспечения контроля потока и оптимальной температуры 37 °C, устройство для подсчета клеток, аналого-цифровые преобразователи (АЦП) и электрические преобразователи.
39. Устройство по п. 37 или 38, где механическая часть устройства включает системы клапанов, насосную систему и/или компрессор, направляющую систему для открытия/закрытия части, в которую вставляется сменная кассета, зажимы для фиксации кассеты в корпусе устройства, а также соединение жидкостной системы на основе быстроразъемных зажимов, чтобы упростить замену кассет.
40. Устройство по п. 38, где подача исходной суспензии отдельных клеток на мембрану (AM) регулируется автоматически, при этом устройство для подсчета клеток определяет количество клеток и поддерживает плотность исходной суспензии на уровне ниже 2×108 клеток/мл путем автоматического добавления физиологического буфера из контейнера (PBS).
41. Устройство по любому из пп. 38-40, где устройство для подсчета клеток работает основываясь на принципе биоимпеданса и состоит из двух электродов, определяющих изменение электрического сопротивления, причем устройство для подсчета клеток установлено в двух частях устройства, а именно на участке до того, как исходная суспензия отдельных клеток достигла мембраны (AM), и до того, как стерильная суспензия целевых стволовых клеток в физиологическом буфере достигла контейнера (SC).
42. Устройство по любому из пп. 37-41, необязательно содержащее очищающую кассету для самоочищения, осуществляемого автоматически и в соответствии с протоколом для автоматического самоочищения.
43. Устройство по любому из пп. 38-42, где датчики подключены к компьютеру-концентратору с сенсорным экраном с соответствующим интерфейсом, и устройство подключено к Интернету через порт LAN компьютера-концентратора.
| EP 1947170 A1, 23.07.2008 | |||
| NICODEMOU ANDREAS et al., Mesenchymal stromal/stem cell separation methods: concise review, Cell and Tissue Banking, 2017, vol | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| HADDEN WILLIAM J.et al., Stem cell migration and mechanotransduction on linear stiffness gradient hydrogels, PNAS, 15.05.2017, 114 (22), pp | |||
Авторы
Даты
2023-02-14—Публикация
2018-12-20—Подача